Спиропиперидиновые соединения в качестве антагонистов рецептора orl-1
Номер патента: 20848
Опубликовано: 27.02.2015
Авторы: Хименес-Агуадо Альма Мария, Бенито Колладо Ана Белен, Мартинес-Грау Мария Анхелес, Толедо Эскрибано Мигель Анхель, Лафуэнте Бланко Селия, Педрегал-Терсеро Консепсьон, Диас Буэсо Нурия
Формула / Реферат
1. Соединение формулы

где R1 представляет собой фтор или хлор;
каждый из R2a и R2b представляет собой водород или фтор;
R3 представляет собой водород, метил, гидроксиметил или (C1-С3) алкоксиметил;
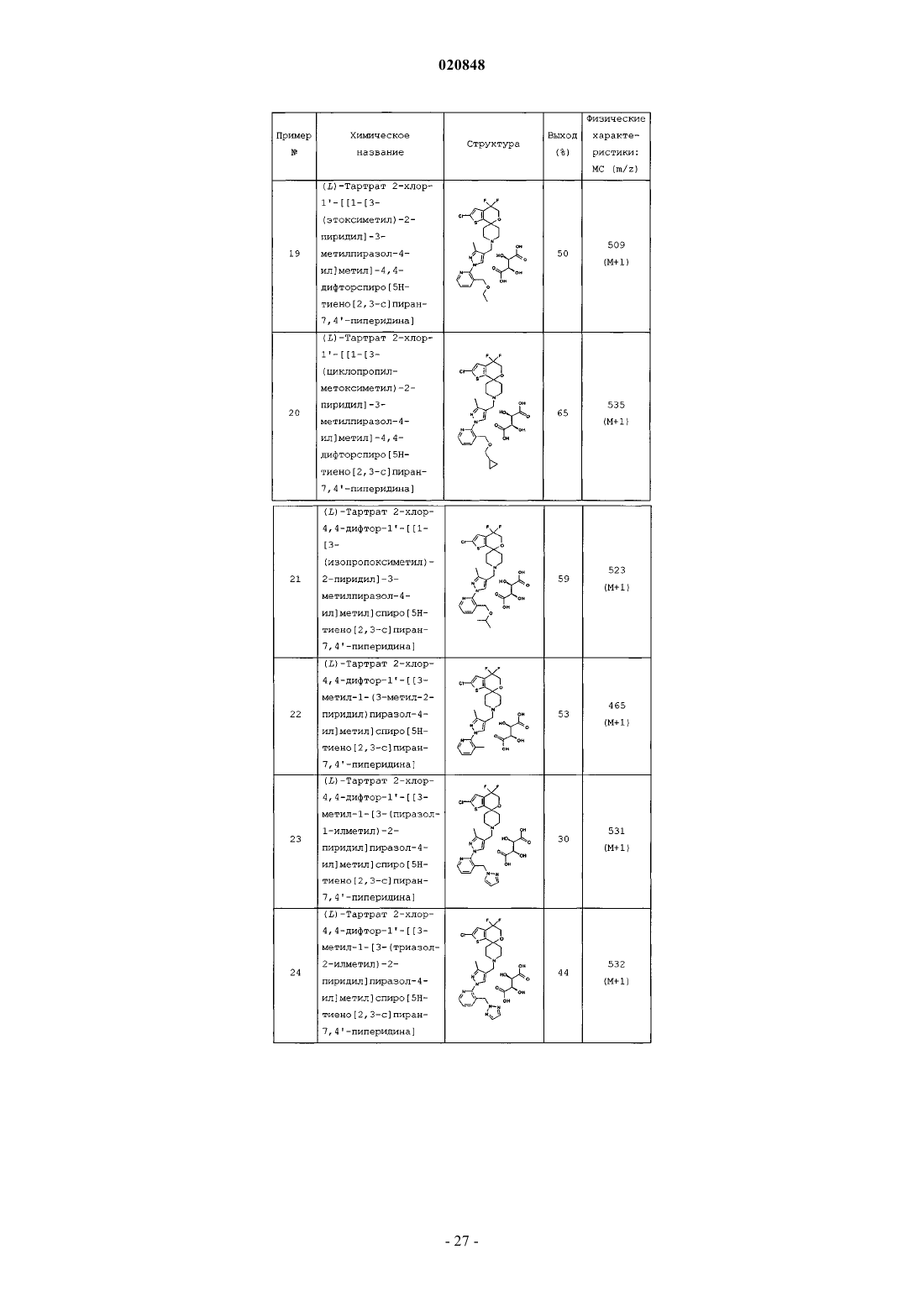
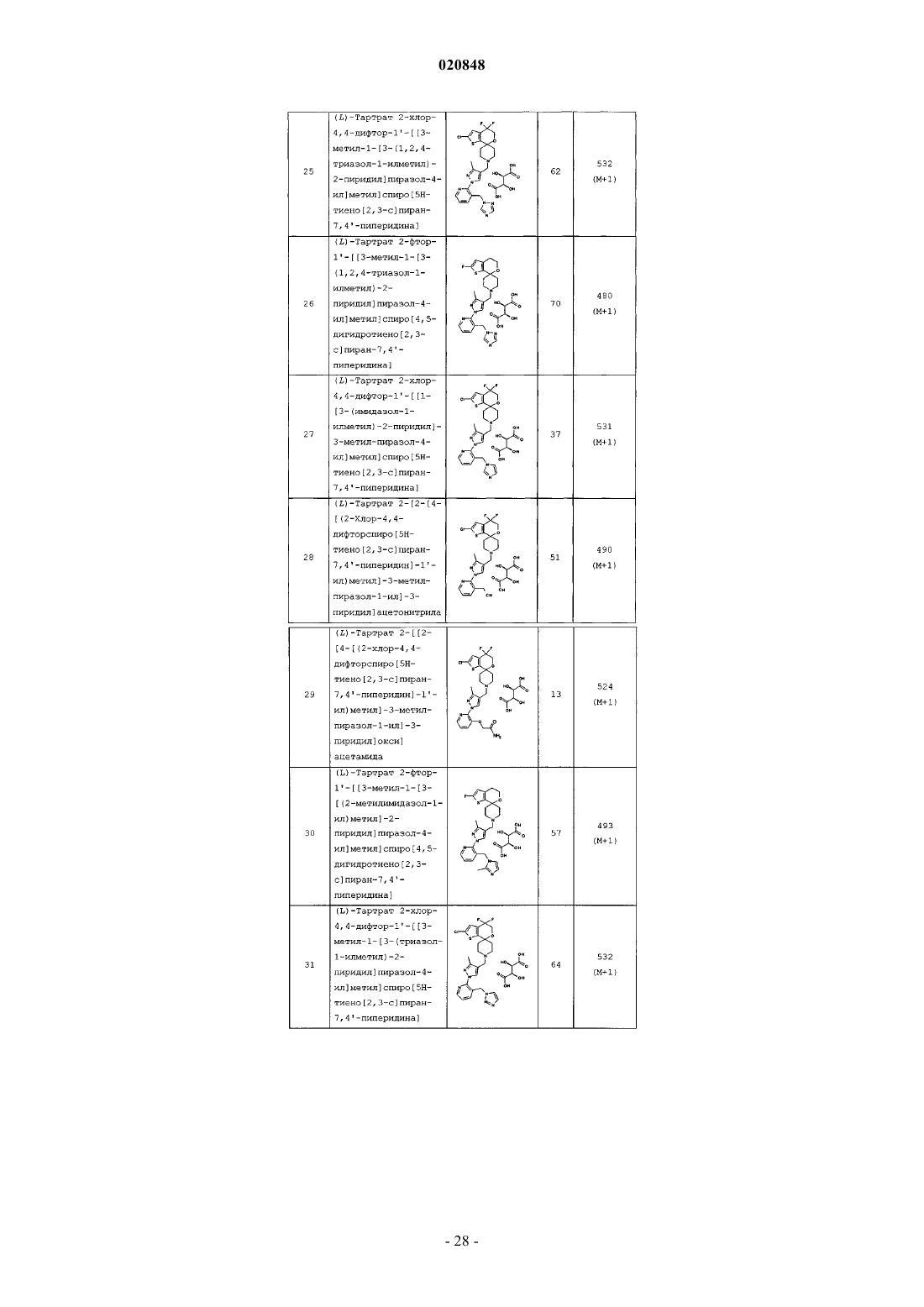
R4 выбран из группы, состоящей из фтора, хлора, циано, цианометила, (С1-С3) алкила, циклопропила, гидроксиметила, метокси, циклопропилметокси, аминокарбонилметокси, (C1-С3) алкоксиметила, циклопропилоксиметила, циклопропилметоксиметила, 1-гидрокси-1-метилэтила, аминокарбонилоксиметила, метиламинокарбонилоксиметила, диметиламинокарбонилоксиметила, аминокарбонила, аминокарбонилметила, -CH2-NR5R6, гидроксиимина, метоксиимина, морфолин-4-ила, морфолин-4-илметила, Ar1, -CH2Ar1, тетрагидрофуран-2-ила, 3-оксоморфолин-4-илметила, 2-оксопирролидин-1-илметила и 2-оксопиперидин-1-илметила;
R5 представляет собой водород, C1-C3 алкил, цианометил, -С(О)СН3 или аминокарбонилметил;
R6 представляет собой водород или метил; и
Ar1 представляет собой фрагмент, выбранный из группы, состоящей из имидизол-1-ила, имидизол-2-ила, 2-метилимидизол-1-ила, пиразол-1-ила, 1,2,3-триазол-1-ила, 1,2,3-триазол-2-ила, 1,2,4-триазол-1-ила, изоксазол-3-ила, оксазол-5-ила и 3-метил-1,2,4-оксадиазол-5-ила; или
его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой хлор, или его фармацевтически приемлемая соль.
3. Соединение по пп.1 или 2, где каждый из R2a и R2b представляет собой фтор, или его фармацевтически приемлемая соль.
4. Соединение по п.1, где R1 представляет собой фтор и каждый из R2a и R2b представляет собой водород, или его фармацевтически приемлемая соль.
5. Соединение по любому из пп.1-4, где R3 представляет собой метил, или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-5, где R4 представляет собой фтор, гидроксиметил, метоксиметил или пиразол-1-илметил, или его фармацевтически приемлемая соль.
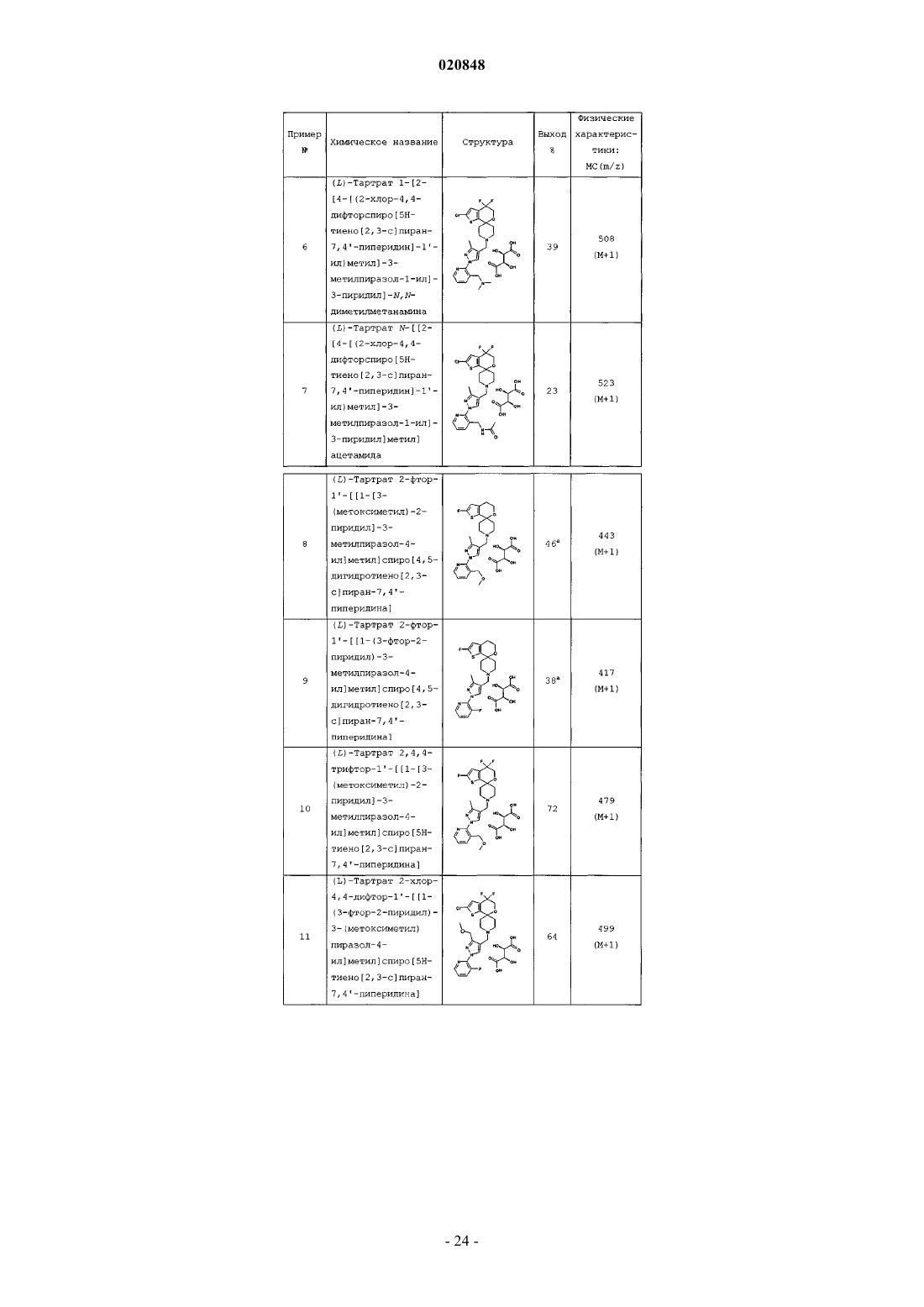
7. Соединение по п.1, представляющее собой [2-[4-[(2-хлор-4,4-дифторспиро[5Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1-ил]-3-пиридил]метанол; 2-хлор-4,4-дифтор-1'-[[3-метил-1-[3-(пиразол-1-илметил)-2-пиридил]пиразол-4-ил]метил]спиро[5Н-тиено[2,3-с]пиран-7,4'-пиперидин] или [4-[(2-хлор-4,4-дифторспиро[5Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-1-(3-фтор-2-пиридил)пиразол-3-ил] метанол; или его фармацевтически приемлемая соль.
8. Соединение по п.1, представляющее собой [2-[4-[(2-хлор-4,4-дифторспиро[5Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1-ил]-3-пиридил]метанол, или его фармацевтически приемлемая соль.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель, разбавитель или эксципиент.
10. Фармацевтическая композиция по п.9, дополнительно содержащая по меньшей мере один дополнительный терапевтический ингредиент.
11. Фармацевтическая композиция по п.10, где дополнительный терапевтический ингредиент представляет собой антидепрессант группы селективных ингибиторов обратного захвата серотонина (SSRI).
12. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения ожирения или избыточного веса у человека.
13. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения мигрени.
14. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения депрессии.
Текст
СПИРОПИПЕРИДИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ORL-1 Предложен антагонист рецептора ORL-1 формулы Бенито Колладо Ана Белен, Диас Буэсо Нурия, Хименес-Агуадо Альма Мария, Лафуэнте Бланко Селия,Мартинес-Грау Мария Анхелес,Педрегал-Терсеро Консепсьон, Толедо Эскрибано Мигель Анхель (ES) его применение и способы его получения. Антагонисты ORL-1, как полагают, пригодны для лечения избыточного веса, ожирения и/или поддержания веса после лечения избыточного веса или ожирения. Некоторые соединения также продемонстрировали на животных моделях, что соединения настоящего изробретения полезны для лечения мигрени.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Орфанин FQ (OFQ)/ноцицептин представляет собой пептид, состоящий из 17 аминокислот, который имеет высокую афинность к сопряженному с G-белком рецептору (GPCR) ORL-1. Рецептор ORL-1 представляет собой GPCR класса А, который экспрессируется в основном в центральной нервной системе и периферической нервной системе, а также в желудочно-кишечном тракте, гладких мышцах и иммунной системе. Несмотря на структурное родство с опиоидными пептидами/рецепторами, системаOFQ/ноцицептин не проявляет значительной перекрестной реактивности с классическими опиоидными пептидами/рецепторами и проявляет антиопиоидную активность in vivo (например, сообщалось, чтоORQ/ноцицептин проявляет антиноцицептивные свойства). В многочисленных исследованиях на животных моделях депрессии и пищевого поведения было показано, что антагонисты рецептора ноцицептина/орфанина FQ (NOC/OFQ), в частности антагонисты рецептора ORL-1, обладают антидепрессантной активностью и анорексигенной активностью. В связи с этим полагают, что антагонисты ORL-1 подходят для применения для лечения депрессии и/или избыточного веса и ожирения и/или для поддержания веса после лечения избыточного веса или ожирения. В WO 2003/095427 описаны некоторые спиропиперидинильные соединения в качестве антагонистов ORL-1 для применения в качестве анальгетиков. Йошизуми, Такаши и соавторы (Yoshizumi, Takashi et al. (2008), Design, synthesis, and structure-activity relationship study of a novel class of ORL-1 receptor antagonists based on N-biarylmethyl spiropiperidine, BioorganicMedicinal Chemistry Letters, vol. 18, p. 3778-3782) описали некоторые N-биарилметилспиропиперидиновые соединения в качестве селективных антагонистов ORL-1. Согласно настоящему изобретению предложено семейство 4',5'-дигидроспиро[пиперидин-4,7'тиено[2,3-с]пирановых] соединений, обладающих высокой антагонистической активностью в отношении рецептора ORL-1 и высокой способностью in vivo занимать рецепторы ORL-1 в ЦНС. Кроме того, конкретные соединения имеют благоприятный кардиотоксикологический профиль, определяемый их селективностью в отношении активности каналов hERG, а также высокой селективностью в отношении других физиологически важных рецепторов (например, мю-, каппа- и дельта-опиоидных, серотониновых и дофаминовых рецепторов). Кроме того, конкретные соединения согласно настоящему изобретению обладают хорошими биофармацевтическими и фармакокинетическими свойствами (такими как растворимость, воздействие при введении пероральным путем и поступление в ЦНС). Конкретные соединения согласно настоящему изобретению проявляют пониженный окислительный метаболизм, что обеспечивает хорошую биодоступность при пероральном введении. На животных моделях с использованием конкретных соединений было также показано, что соединения согласно настоящему изобретению подходят для лечения мигрени. Согласно настоящему изобретению предложены соединения формулы I где R1 представляет собой фтор или хлор; каждый из R2a и R2b представляет собой водород или фтор;R6 представляет собой водород или метил; иAr1 представляет собой фрагмент, выбранный из группы, состоящей из имидизол-1-ила, имидизол 2-ила, 2-метилимидизол-1-ила, пиразол-1-ила, 1,2,3-триазол-1-ила, 1,2,3-триазол-2-ила, 1,2,4-триазол-1 ила, изоксазол-3-ила, оксазол-5-ила и 3-метил-1,2,4-оксадиазол-5-ила; или их фармацевтически приемлемые соли. Согласно другому аспекту изобретения предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем, разбавителем или эксципиентом. Согласно одному варианту реализации указанного аспекта изобретения фармацевтическая композиция также содержит по меньшей мере один дополнительный терапевтический ингредиент, например, антидепрессант группы селективных ингибиторов обратного захвата серотонина (SSRI), например, флуоксетин. Кроме того, согласно указанному аспекту изобретения предложена фармацевтическая композиция, подходящая для лечения депрессии, содержащая соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Согласно другому варианту реализации указанного аспекта изобретения предложена фармацевтическая композиция, подходящая для лечения избыточного веса, ожирения и/или для поддержания веса, содержащая соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Согласно еще одному варианту реализации изобретения предложена фармацевтическая композиция, подходящая для лечения мигрени, содержащая соединение формулы I или его фармацевтически приемлемую соль в комбинации с одним или более фармацевтически приемлемыми эксципиентами, носителями или разбавителями. Согласно настоящему изобретению также предложен способ лечения депрессии у млекопитающего,включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Согласно другому варианту реализации изобретения предложен способ лечения депрессии у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулыI или его фармацевтически приемлемой соли и эффективного количества антидепрессанта группы SSRI или его фармацевтически приемлемой соли, например, флуоксетина. Согласно другим вариантам реализации изобретения предложены способы лечения избыточного веса и/или ожирения и/или способ поддержания веса, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Согласно конкретному варианту реализации указанных аспектов изобретения млекопитающее представляет собой человека. Согласно настоящему изобретению также предложено соединение формулы I или его фармацевтически приемлемая соль для применения в терапии. В пределах указанного аспекта изобретения предложено соединение формулы I или его фармацевтически приемлемая соль для применения для лечения депрессии у млекопитающих, в частности человека. Согласно изобретению также предложено соединение формулы I или его фармацевтически приемлемая соль в комбинации с антидепрессантом группыSSRI или его фармацевтически приемлемой солью, например, флуоксетином, для применения для лечения депрессии у млекопитающих, в частности человека. Также указанный аспект изобретения включает любое из следующего: соединение формулы I или его фармацевтически приемлемую соль для применения для лечения избыточного веса; соединение формулы I или его фармацевтически приемлемую соль для применения для лечения ожирения; соединение формулы I или его фармацевтически приемлемую соль для применения в поддержании веса (для поддержания веса), в частности, после лечения избыточного веса или ожирения; соединение формулы I или его фармацевтически приемлемую соль для применения для лечения мигрени. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы I или его фармацевтически приемлемой соли при получении лекарственного средства для лечения депрессии. Согласно другому варианту реализации изобретения предложено применение соединения формулыI или его фармацевтически приемлемой соли для получения лекарственного средства для лечения избыточного веса, ожирения и/или для поддержания веса. Согласно другому варианту реализации изобретения предложено применение соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения мигрени. Соединения согласно настоящему изобретению представляют собой основания и, соответственно,реагируют с рядом органических и неорганических кислот с образованием фармацевтически приемлемых солей. Фармацевтически приемлемые соли каждого из соединений согласно настоящему изобретению находятся в рамках настоящей заявки. Термин фармацевтически приемлемая соль при использовании в настоящей заявке относится к любой соли соединения формулы I, которая, по существу, не является токсичной для живых организмов. Указанные соли включают соли, перечисленные в источнике(Journal of Pharmaceutical Science, 66, 2-19 (1977, которые известны специалистам в данной области техники. Аббревиатуры, используемые в настоящей заявке, имеют следующие значения: БСА означает бычий сывороточный альбумин.mCPP означает метахлорфенилпиперазин, неселективный агонист рецептора серотонина. ЭДТА означает этилендиаминтетрауксусную кислоту. ЭГТА означает этиленгликольтетрауксусную кислоту. ГТФ означает гуанозинтрифосфат.HEPES означает 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту. ВЭЖХ означает высокоэффективную жидкостную хроматографию.IC50 означает концентрацию, при которой достигается 50% максимального ингибирования. ЖХ/МС означает жидкостную хроматографию с последующей масс-спектрометрией. ЖХ/МС/МС означает жидкостную хроматографию с последующей масс-спектрометрией и последующей повторной ионизационной масс-спектрометрией.mFST означает тест вынужденного плавания на мышах, животную модель для оценки активности антидепрессанта. МС означает масс-спектрометрию. МС (ИЭР) означает масс-спектрометрию с использованием ионизации электрораспылением. ЯМР означает ядерный магнитный резонанс. Индикатор RO означает 2-[(2-фторфенил)метил]-3-(2-фторспиро[4,5-дигидротиено[2,3-с]пиран 7,4'-пиперидин]-1'-ил)-N,N-диметилпропанамид.RO означает степень занятости рецепторов.SNAr означает нуклеофильное ароматическое замещение.SSRI означает селективный ингибитор обратного захвата серотонина.tBu означает трет-бутильный фрагмент. ТСХ означает тонкослойную хроматографию.XRD означает рентгеновскую дифракцию. Предпочтительные соединения согласно настоящему изобретению представляют собой соединения,где 1) R1 представляет собой хлор; 2) каждый из R2a и R2b представляет собой фтор; 3) R1 представляет собой хлор, и каждый из R2a и R2b представляет собой фтор; 4) R1 представляет собой фтор, и каждый из R2a и R2b представляет собой водород; 5) R3 представляет собой водород, метил, гидроксиметил или метоксиметил; 6) R3 представляет собой метил; 7) R3 представляет собой гидроксиметил; 8) R1 представляет собой хлор, каждый из R2a и R2b представляет собой фтор, и R3 представляет собой метил; 9) R1 представляет собой хлор, каждый из R2a и R2b представляет собой фтор, и R3 представляет собой гидроксиметил; 10) R4 представляет собой фтор, гидроксиметил, метоксиметил или пиразол-1-илметил; 11) R4 представляет собой фтор; 12) R4 представляет собой гидроксиметил; 13) R4 представляет собой метоксиметил; 14) R4 представляет собой пиразол-1-илметил; 15) любой из предпочтительных вариантов реализации изобретения 1)-9), где R4 представляет собой фтор; 16) любой из предпочтительных вариантов реализации изобретения 1)-9), где R4 представляет собой гидроксиметил; 17) любой из предпочтительных вариантов реализации изобретения 1)-9), где R4 представляет собой метоксиметил; 18) любой из предпочтительных вариантов реализации изобретения 1)-9), где R4 представляет собой пиразол-1-илметил. Конкретные предпочтительные соединения представляют собой [2-[4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-c]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1-ил]-3-пиридил]метанол; 2-хлор 4,4-дифтор-1'-3-метил-1-[3-(пиразол-1-илметил)-2-пиридил]пиразол-4-ил]метил]спиро[5 Н-тиено[2,3 с]пиран-7,4'-пиперидин] и [4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-1-(3-фтор-2-пиридил)пиразол-3-ил]метанол; или их фармацевтически приемлемую соль (т.е. примеры 1, 23, 53, 62 и 63). Конкретное предпочтительное соединение согласно настоящему изобретению представляет собой[2-[4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1 ил]-3-пиридил]метанол или его фармацевтически приемлемую соль, например, L-тартрат и/или соль HCl,как показано в примерах 1, 62 и 63. Соединения, в которых каждый из R2a и R2b представляет собой фтор, являются предпочтительными, так как указанные соединения имеют более благоприятный фармакокинетический профиль, являясь более устойчивыми к окислительному метаболизму, что приводит к общему улучшению биодоступности при пероральном введении указанных соединений. Общая химия Соединения согласно настоящему изобретению могут быть получены в соответствии со следующими схемами синтеза с помощью методов, хорошо известных и широко применяемых в данной области техники. Подходящие условия реакций для осуществления этапов указанных схем хорошо известны в данной области техники, и подходящие альтернативные растворители и реагенты известны специалистам в данной области техники. Аналогичным образом, специалистам в данной области техники очевидно, что промежуточные продукты синтеза при желании или необходимости могут быть выделены и/или очищены с помощью различных хорошо известных методов и что зачастую возможно использование различных промежуточных соединений непосредственно в последующих этапах синтеза с минимальной очисткой или без очистки. Более того, специалистам в данной области техники ясно, что в некоторых случаях порядок введения фрагментов не является определяющим. Конкретная очередность проведения стадий,необходимых для получения соединений формулы I, зависит от конкретного синтезируемого соединения, исходного соединения и относительной функциональной лабильности замещаемых фрагментов, что очевидно специалистам в области химии. Все заместители являются такими, как определено выше, если не указано иное, и все реагенты хорошо известны и применяются в данной области техники. Схема 1 При использовании условий реакции восстановительного аминирования соединение III подвергают взаимодействию с замещенным соответствующим образом пиразолкарбальдегидом и восстановителем,таким как триацетоксиборгидрид натрия, в подходящем растворителе, таком как тетрагидрофуран, при температуре окружающей среды с получением соединения II. В соответствующих условиях сочетания соединение II сочетают с соединением IV, в котором Hal представляет собой хлор, бром или йод, в присутствии подходящего катализатора, такого как йодид меди, с подходящим основанием, таким как карбонат калия, в растворителе, таком как толуол, при повышенной температуре с получением соединенияI', в котором R4' представляет собой R4 или предшественник R4. Когда Hal в соединении IV представляет собой F или Cl, нуклеофильное ароматическое замещение (SNAr) является альтернативным способом получения соединения I'. Более конкретно, соединение II может реагировать с соединением IV в подходящем растворителе, таком как диметилформамид, с подходящим основанием, таким как карбонат калия,при повышенной температуре с получением соединения I'. Соединение III также может реагировать с замещенным соответствующим образом соединением V, представляющим собой альдегид, в условиях восстановительного аминирования, как описано выше, с получением желаемого соединения I'. Когда R4' представляет собой предшественник R4, указанный R4' затем превращают в R4 с помощью известных способов. Схема 2 Соединения IIIa, IIIb и IIIc могут быть получены, как показано на схеме 2. Соединения XIV и XV подвергают взаимодействию в подходящем растворителе, таком как дихлорметан, в присутствии подходящей кислоты, такой как трифторуксусная кислота. Полученный трифторацетат подщелачивают вод-4 020848 ным раствором гидроксида натрия с получением соединения XIII в виде свободного основания. Соединение XIII в подходящем растворителе, таком как метил-трет-бутиловый эфир, обрабатывают раствором сульфурилхлорида в уксусной кислоте при комнатной температуре с получением соединения VIII в виде гидрохлорида. В соединение VIII затем вводят защитную группу для азота в условиях, хорошо известных специалистам в данной области техники, с получением соединения VII (см., например, Greene and Wuts,Protective Groups in Organic Synthesis, Third Edition, Chapters 2 and 7, John Wiley and Sons Inc. (1999. Как правило, защитная группа представляет собой группу Boc(трет-бутилоксикарбонил). Соединение VII подвергают взаимодействию с N-бромсукцинимидом в подходящем растворителе, таком как хлорбензол,при облучении с помощью источника света с получением бромсодержащего соединения, которое затем обрабатывают раствором основания, таким как водный раствор бикарбоната натрия, с получением гидроксильного соединения. Гидроксильное соединение, после его выделения или без выделения, затем может быть окислено в подходящих окислительных условиях, например, в присутствии бромида калия,тетраметилпиперидин-N-оксида и водного раствора гипохлорида натрия, с получением желаемого соединения VI, представляющего собой кетон. Соединение VI затем подвергают взаимодействию с трифторидом (бис(2-метилэтил)амино)серы в подходящем растворителе, таком как тетрагидрофуран, при повышенной температуре, из полученного продукта удаляют защитную группу с получением соединенияIIIa. В соединение формулы XIII вводят защитную группу с получением соединения XII таким же способом, как описано для получения соединения VII. Соединение XII в подходящем растворителе, таком как тетрагидрофуран, при пониженной температуре обрабатывают подходящим основанием, таким как тетраметилпиперидин лития, с последующим добавлением N-фторбензолсульфонимида с получением фторсодержащего соединения, из которого удаляют защитную группу с помощью водного раствора HCl и которое подщелачивают водным раствором NaOH с получением соединения IIIb. Соединение IX может быть получено из соединения XII таким же способом, как описано выше для получения соединения VI, путем синтеза в три стадии, такие как бромирование, гидроксилирование и окисление. Каждое промежуточное соединение может быть выделено в виде чистого соединения для дальнейшего взаимодействия или может подвергаться взаимодействию без выделения, как описано в синтезе соединения VI. Соединение IX затем обрабатывают подходящим металл-галогенным обменным реагентом, таким как бутиллитий, в подходящем растворителе, таком как тетрагидрофуран, при пониженной температуре с последующей обработкой фторирующим реагентом, таким как N-фтор-бензолсульфонимид, с получением желаемого фторсодержащего продукта, из которого затем соответствующим образом удаляют защитную группу с получением желаемого соединения IIIc. Схема 3 Соединения формулы V могут быть получены, как показано на схеме 3. Соединение XVI подвергают взаимодействию с соединением XVII с получением соединения формулы XV в условиях SNAr или условиях сочетания, описанных выше для превращения соединения II в соединение I'. Когда Z представляет собой группу сложного эфира, он может быть сначала восстановлен до спирта с помощью подходящего восстановителя, такого как алюмогидрид лития, в подходящем растворителе, таком как тетрагидрофуран. Затем спирт окисляют с получением альдегида с помощью соответствующего окислителя, такого как оксид марганца(IV), в растворителе, таком как дихлорметан. Когда R4' представляет собой предшественник R4, процесс превращения R4' в R4 включает, но не ограничивается указанными, такие реакции, как восстановительное аминирование с получением желаемого нового амина; восстановление сложного эфира, кетона или альдегида с получением спирта, который можно превращать в алкоксисоединение или карбамат; восстановление нитрила с получением амида или амина; превращение сложного эфира в гетероциклическое соединение, такое как оксадиазол, в подходящих условиях (др. примеры см. в источнике Richard С. Larock, Comprehensive Organic Transformations,Second Edition, Chapters 2 and 7, John Wiley and Sons Inc. (1999. Следующие примеры получения и примеры приведены для иллюстрации способов, подходящих для синтеза соединений согласно настоящему изобретению. Названия многих соединений, приведенных в примерах получения и примерах, даны на основании структур, полученных с помощью программы 3-Тиофенэтанол (123,03 мл, 1,11 моль) добавляли к раствору N-трет-бутоксикарбонил-4-пиперидона (185 г, 928,48 ммоль) в дихлорметане (1300 мл) и перемешивали при комнатной температуре. Затем добавляли по каплям (5 мин) трифторуксусную кислоту (280,82 мл, 3,71 моль) при охлаждении с помощью ледяной/водяной бани (при внутренней температуре = 14-30 С, предупрежение: выделение СО 2). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали при указанной температуре в течение 20 ч. Растворитель выпаривали с получением кристаллического твердого вещества бежевого цвета при охлаждении в вакууме. Указанное твердое вещество суспендировали в метилтрет-бутиловом эфире (200 мл), фильтровали, промывали метил-трет-бутиловым эфиром (21000 мл) и сушили в вакууме с получением трифторацетата 4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1 ия в виде твердого вещества белого цвета с выходом 95%. МС = (m/z): 210 (М+1). 10 М гидроксид натрия(220,36 мл, 2,20 моль) добавляли к перемешанной суспензии трифторацетата 4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-ия (285 г, 881,44 ммоль) в дихлорметане (1 л) при охлаждении (ледяная/водяная баня) и полученную смесь перемешивали до получения двухфазной смеси. Фазы разделяли и водный слой экстрагировали дихлорметаном (2200 мл). Объединенные органические слои концентрировали в вакууме с получением густого масла, которое растирали с водой с получением светло-желтого осадка. Указанный осадок фильтровали, промывали водой (300 мл) и гексаном (200 мл) и сушили в вакууме при 35 С в течение 20 ч с получением указанного в заголовке соединения в виде твердого вещества светло-желтого цвета с выходом 86%. МС (m/z): 210 (М+1). Пример получения 2. трет-Бутилспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилат(600 мл) перемешивали при 22 С в течение 10 мин. Затем добавляли по каплям трет-бутоксикарбонил-третбутил карбонат (65,6 г, 301 ммоль) в 2-метилтетрагидрофуране (300 мл). Через 12 ч добавляли водный раствор хлорида натрия (250 мл) и отделяли органический слой. Водный слой промывали два раза 2-метилтетрагидрофураном (250 мл) и органические слои объединяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения с выходом 99%. МС (m/z): 310 (М+1). Пример получения 3. 2-Фторспиро[4,5-дигидротиено[2,2-с]пиран-7,4'-пиперидин] 1. трет-Бутил-2-фторспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилат 2,2,6,6-Тетраметилпиперидин (18,7 мл, 110,5 ммоль) добавляли в тетрагидрофуран (200 мл) и раствор охлаждали в атмосфере азота при -78 С. Добавляли 2,5 М раствор бутиллития в гексане (37,2 мл, 93 ммоль) и смесь перемешивали в течение 30 мин при -78 С. К свежему раствору 2,2,6,6-тетраметилпиперидина лития добавляли раствор трет-бутилспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата (20 г, 58,2 ммоль) в тетрагидрофуране (90 мл) при поддержании температуры ниже -70 С. Через 20 мин добавляли через канюлю раствор N-фторбензолсульфонимида (30,26 г, 93,07 ммоль) в тетрагидрофуране (200 мл), предварительно охлажденный в атмосфере азота при -20 С. Через 1 ч перемешивания добавляли воду(20 мл) и водный раствор хлорида аммония (50 мл). Затем органический слой отделяли и водный слой промывали два раза метил-трет-бутиловым эфиром (225 мл). Органические слои объединяли и растворитель выпаривали при пониженном давлении. Неочищенный материал очищали с помощью ВЭЖХ с нормальными фазами с использованием смеси гексан/метил-трет-бутиловый эфир в качестве растворителя с получением трет-бутил-2-фторспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата с выходом 50%. МС (m/z): 328 (М+1). 2. 2-Фторспиро[4,5-дигидротиено[2,2-с]пиран-7,4'-пиперидин] 37% Соляную кислоту (11,75 мл, 125,22 ммоль) добавляли к раствору трет-бутил-2'-фтор-4',5'дигидро-1 Н-спиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилата (8,2 г, 25,04 ммоль) в изопропило-6 020848 вом спирте (57,4 мл) при 45 С. Полученный раствор перемешивали при 45 С в течение 6,5 ч. Растворитель концентрировали до образования желтой суспензии. Добавляли воду (50 мл) и смесь подщелачивали 5 н водным раствором гидроксида натрия. Водную фазу экстрагировали этилацетатом (3100 мл) и объединенные органические экстракты промывали солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения с выходом 96%. МС (m/z): 228 (М+1). Пример получения 4. Гидрохлорид 2'-хлор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пирана] Раствор 4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пирана] (50 г, 238,88 ммоль) в смеси уксусной кислоты (400 мл) и метил-трет-бутилового эфира (40 мл) охлаждали до 15 С. Затем раствор сульфурилхлорида (21,20 мл, 262,77 ммоль) в уксусной кислоте (100 мл) добавляли по каплям в течение 40 мин при указанной температуре (при внутренней температуре = 15-22 С) и смесь перемешивали при комнатной температуре в течение 20 ч. Затем добавляли по каплям раствор сульфурилхлорида (11,56 мл, 143,33 ммоль) в уксусной кислоте (50 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и затем добавляли по каплям (30 мин) к метил-трет-бутиловому эфиру (1 л) при охлаждении с помощью ледяной/водяной бани при перемешивании. Образовывалась белая суспензия и твердое вещество фильтровали. После получения второй порции материала фильтрат концентрировали (с помощью роторного вакуумного испарителя при повторном добавлении метил-третбутилового эфира). Полученное в результате твердое вещество суспендировали в метил-трет-бутиловом эфире (300 мл), суспензию перемешивали при кипячении с обратным холодильником (баня 100 С) и добавляли метанол (30 мл) до образования мутной суспензии. Затем суспензию охлаждали до комнатной температуры в течение ночи. Суспензию далее охлаждали на ледяной/водяной бане и фильтровали. Твердое вещество промывали метил-трет-бутиловым эфиром (50 мл) и объединяли с первой порцией с получением указанного в заголовке соединения с выходом 60%. МС (m/z): 244 (М+1). Пример получения 5. 2'-Хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран] 1. трет-Бутил-2-хлорспиро[4,5-дигидротиено[2,3-c]пиран-7,4'-пиперидин]-1'-карбоксилат К суспензии гидрохлорида 2-хлорспиро[4,5-дигидротиено[2,2-с]пиран-7,4'-пиперидина] (140 г, 0,49 моль) в дихлорметане (1,12 л) порциями добавляли триэтиламин (67,25 мл, 1,05 моль), 4-пиридинамин,N,N-диметил- (3,05 г, 0,025 моль) и ди-трет-бутилбикарбонат (111,22 г, 0,509 моль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали 1 н HCl (2) и водой. Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением трет-бутил-2-хлорспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]1'-карбоксилата с выходом 53%. МС (m/z): 244 (М+1-Вос). 2. трет-Бутил-4'-оксо-2'-хлор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилат В реактор на 5 л, снабженный рубашкой, добавляли N-бромсукцинимид (115,02 г, 639,77 ммоль) к раствору трет-бутил-2-хлорспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата (200 г,581,61 ммоль) в хлорбензоле (1,60 л) при комнатной температуре. Полученную суспензию облучали с помощью лампы накаливания (3100 Вт), почти соприкасающейся со внешней стенкой реактора, и устанавливали температуру реактора при 45 С. Через 4 ч добавляли N-бромсукцинимид (26,14 г, 145,40 ммоль) и температуру поддерживали при 40 С в течение 15 ч. Реакционную смесь охлаждали до температуры 0 С и добавляли метил-трет-бутиловый эфир (500 мл). Твердое вещество фильтровали и раствор концентрировали до получения примерно 1000 мл раствора в хлорбензоле. Затем добавляли метил-третбутиловый эфир (1000 мл), твердое вещество фильтровали и фильтрат концентрировали с получением 600 мл раствора хлорбензола. Добавляли диметилсульфоксид (806,47 мл, 11,35 моль) и бикарбонат натрия (95,38 г, 1,14 моль) при комнатной температуре. После перемешивания в течение 24 ч при комнатной температуре добавляли смесь вода/лед (1000 мл) и фазы разделяли. Органическую фазу промывали водой (21 л) и концентрировали с получением раствора в хлорбензоле. Затем добавляли дихлорметан(1,2 л) и смесь охлаждали до 5 С (ледяная/водяная баня). Добавляли бромид калия (20,27 г, 170,31 ммоль) и 2,2,6,6-тетраметилпиперидин-N-оксид (4,43 г, 28,38 ммоль). Затем к реакционной смеси добавляли при 5 С 6% раствор гипохлорита натрия в воде (644,40 мл, 567,68 ммоль), доведенный до рН 9 бикарбонатом натрия (насыщенным), и полученную смесь перемешивали в течение 1 ч при температуре от 5 С до комнатной температуры. Добавляли воду (1 л) и фазы разделяли. Органическую фазу промывали водой (20,5 л) и охлаждали с помощью ледяной/водяной бани. Затем к реакционной смеси добавляли при 5 С бромид калия (2,03 г, 17,03 ммоль), 2,2,6,6-тетраметилпиперидин-N-оксид (0,05 г, 0,32 ммоль) и 6% раствор гипохлорита натрия в воде (128,88 мл, 113,54 ммоль), доведенный до рН 9 твердым бикарбонатом натрия, и полученную смесь перемешивали в течение 1 ч при температуре от 5 С до комнатной температуры. Затем добавляли воду (1 л) и фазы разделяли. Органическую фазу промывали водой (21 л), сушили и концентрировали с получением твердого вещества темно-коричневого цвета. Твердое вещество растирали с гексаном (500 мл), смесью метил-трет-бутиловый эфир/гексан, 5%,(250 мл) и смесью метил-трет-бутиловый эфир/гексан, 10%, (250 мл) с получением трет-бутил-4'-оксо-2'хлор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилата в виде твердого вещества светло-коричневого цвета с выходом 66%. МС (m/z): 258 (М+1 (Boc. 3. трет-Бутил-2'-хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилат В колбу (перфторалкокси) на 500 мл, заполненную тетрагидрофураном (81 мл), добавляли трифторид(бис(2-метоксиэтил)амино)серы (183,62 г, 829,94 ммоль) и трет-бутил-4'-оксо-2'-хлор-4',5'-дигидроспиро[пиперидин-4,7'-тиено [2,3-с]пиран]-1-карбоксилат (135 г, 377,24 ммоль). Полученную суспензию перемешивали при 70 С в течение 24 ч. Затем указанную суспензию охлаждали до комнатной температуры и медленно выливали в смесь льда и насыщенного водного раствора бикарбоната натрия (4 л) при перемешивании (выделение газа). Метил-трет-бутиловый эфир использовали для сбора оставшегося в колбах материала. После завершения выделения газа добавляли твердый бикарбонат натрия при перемешивании до достижения рН 8. Полученную смесь экстрагировали метил-трет-бутиловым эфиром (3500 мл) до тех пор, пока продукт не переставал выявляться с помощью ТСХ в водной фазе. Объединенные органические слои промывали водой (3500 мл) и солевым раствором (500 мл), сушили над сульфатом магния и концентрировали с получением темного густого масла (250 г). Неочищенный материал растворяли в дихлорметане и фильтровали через пластину с силикагелем при использовании в качестве элюента смеси метил-трет-бутиловый эфир/гексан, 10%, (6 л) и смеси метил-трет-бутиловый эфир/гексан (4 л). Фракции собирали до тех пор, пока продукт не переставал выявляться с помощью ТСХ (20% метил-третбутиловой эфир/гексан, УФ, Rf=0,5). Фильтрат концентрировали с получением твердого вещества светло-коричневого цвета, которое сушили в вакууме при 40 С до достижения постоянной массы с получением трет-бутил-2'-хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилата с выходом 70%. МС (m/z): 324 (M+1-tBu). 4. 2'-Хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран] 37% Соляную кислоту (74,12 мл, 789,78 ммоль) добавляли к раствору трет-бутил-2'-хлор-4',4'дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилата (60 г, 157,96 ммоль) в изопропиловом спирте (420 мл) при 45 С. Полученный раствор перемешивали при 45 С в течение 15 ч. Затем смесь концентрировали до 1/4 объема с получением белой суспензии. Добавляли воду (100 мл) и суспензию подщелачивали 6 н водным раствором гидроксида натрия с получением двухслойной смеси,которую экстрагировали метил-трет-бутиловым эфиром (3100 мл). Объединенные органические слои промывали солевым раствором (50 мл), сушили над сульфатом магния и концентрировали с получением твердого вещества светло-коричневого цвета, которое сушили в вакууме до достижения постоянной массы с получением 97% указанного в заголовке соединения. МС (m/z): 280 (М+1). Пример получения 6. 2,4,4-Трифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]N-бромсукцинимид (2,2 экв.) добавляли к раствору трет-бутилспиро[4,5-дигидротиено[2,3-с]пиран 7,4'-пиперидин]-1'-карбоксилата (13,5 г) в хлорбензоле (108 мл). Полученную суспензию облучали с помощью лампы накаливания (260 Вт) в течение ночи. Дополнительную порцию N-бромсукцинимида (1,7 г) добавляли к смеси и указанную смесь облучали с помощью лампы накаливания (260 Вт) в течение 3 ч. Растворитель удаляли при пониженном давлении с получением осадка, который растворяли в ацетоне(650 мл), и добавляли раствор нитрата серебра (8,8 г) в воде (650 мл). Смесь перемешивали при комнатной температуре в темноте в течение ночи. Смесь отфильтровывали и ацетон выпаривали. Добавляли этилацетат и органический слой промывали насыщенным водным раствором бикарбоната натрия и солевым раствором. Органический слой сушили над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco (элюент: гексан/этилацетат 15-60%) с получением трет-бутил-2-бром-4-гидроксиспиро[4,5 дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата с выходом 38%. МС (m/z): 426/428(М+23/М+2+23). 2. трет-Бутил-2'-бром-4'-оксоспиро[пиперидин-4,7'-тиено[2, 3-c]пиран]-1-карбоксилат Бромид калия (535,67 мг, 4,50 ммоль) добавляли к раствору трет-бутил-2-бром-4-гидроксиспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-циклогексан]-1'-карбоксилата (7,28 г) и 2,2,6,6-тетраметилпиперидин-N-оксида (281,33 мг, 1,80 ммоль) в дихлорметане (70 мл) при 0 С. В другой сосуд добавляли бикарбонат натрия к 10% водному раствору гипохлорита натрия (22,34 мл, 36,01 ммоль) до достижения рН 9. Указанный раствор гипохлорита натрия-бикарбоната натрия добавляли по каплям при температуре 0 С и полученную темную суспензию перемешивали при температуре 0 С в течение 15 мин. Добавляли дихлорметан (20 мл) и воду (20 мл) и фазы разделяли. Органическую фазу промывали водой (20 мл) и сушили над сульфатом магния. Растворитель удаляли при пониженном давлении с получением третбутил-2'-бром-4'-оксоспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилата с выходом 99%. МС (m/z): 346/348 (М+1-tBu/M+3-tBu). 3. трет-Бутил-2-бром-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилат В колбу (перфторалкокси) на 100 мл добавляли трифторид (бис(2-метоксиэтил)амино)серы (5,16 мл, 27,96 ммоль) к безводному тетрагидрофурану (3,5 мл). Затем добавляли трет-бутил-2'-бром-4'оксоспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-карбоксилат (4,5 г, 11,19 ммоль). Раствор перемешивали при 70 С в течение ночи. Через указанное время добавляли метил-трет-бутиловый эфир (30 мл) и реакционную смесь осторожно выливали в раствор бикарбоната натрия (насыщенный водный раствор), охлажденный на ледяной бане. Наблюдали выделение СО 2 и добавляли бикарбонат натрия (насыщенный водный раствор) до достижения рН 8. Смесь экстрагировали метил-трет-бутиловым эфиром. Органический слой декантировали, промывали солевым раствором (2), сушили над сульфатом магния и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента смеси метил-третбутиловый эфир/гексан с получением 3,2 г трет-бутил-2-бром-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран 7,4'-пиперидин]-1'-карбоксилата. МС (m/z): 368/370 (M+1-tBu/M+3-tBu). 4. трет-Бутил-2,4,4-трифторспиро[5 Н-тиено[2,3-c]пиран-7,4'-пиперидин]-1'-карбоксилат 2,5 М бутиллитий в гексане (47 мл) добавляли к раствору трет-бутил-2-бром-4,4-дифторспиро[5 Нтиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата (1,99 г, 4,69 ммоль) в тетрагидрофуране (50 мл) в атмосфере азота при -78 С. Смесь перемешивали при -78 С в течение 1 ч и добавляли N-фторбензолсульфонимид в виде твердого вещества (3,69 г, 11,73 ммоль). Смеси позволяли нагреваться до комнатной температуры и перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и органическую фазу экстрагировали этилацетатом, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Неочищенный материал очищали с помощью хроматографии на нормально-фазовой колонке Isco (гексан/этилацетат 3-12%) с получением 1,3 г трет-бутил-2,4,4-трифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилата, который далее очищали с помощью ВЭЖХ с получением 0,818 г указанного соединения. МС (m/z): 308(M+1-tBu). 5. 2,4,4-Трифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин] трет-Бутил-2,4,4-трифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-карбоксилат (2,00 г, 5,50 ммоль) растворяли в соляной кислоте (4 н в диоксане) (10 мл, 40 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч и затем пропускали через картридж, заполненный 50 г SCX (сильным катионообменником), с получением 1,3 г указанного в заголовке соединения посредством выпаривания фракции 2 н аммония в метаноле. МС (m/z): 264 (M+1). Пример получения 7. 2-Хлор-4,4-дифтор-1'-[(3-метил-1 Н-пиразол-4-ил)метил]спиро[5 Н-тиено[2,3 с]пиран-7,4'-пиперидин] К раствору 2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина (105 г, 375 ммоль) в тетрагидрофуране (1,58 л) добавляли 3-метил-1 Н-пиразол-4-карбальдегид (43,40 г, 394,12 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавляли тремя порциями порошкообразный триацетоксиборгидрид натрия (95,46 г, 450,42 ммоль). Смесь перемешивали при комнатной температуре в течение 15 ч. Затем реакционную смесь выливали в ледяной насыщенный водный раствор бикарбоната натрия (400 мл). Фазы разделяли. Водную фазу экстрагировали этилацетатом (100 мл). Объединенные органические слои промывали 50% солевым раствором, и твердое вещество осаждалось в органическую фазу. Органическую фазу концентрировали с получением 170 г указанного в заголовке соединения. МС (m/z): 374 (М+1). Соединения согласно примерам получения 8-11 получали, по существу, так же, как описано для В колбу на 250 мл добавляли йодид меди(I) (1,91 г, 10,03 ммоль), 2-хлор-4,4-дифтор-1'-[(3-метил 1 Н-пиразол-4-ил)метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин] (25 г, 66,87 ммоль), карбонат калия(19,60 г, 140,43 ммоль), толуол (50 мл) и магнитную мешалку. Реакционную смесь дегазировали с помощью 5 циклов вакуумирования/наполнения. Затем добавляли 2-бром-3-формилпиридин (18,66 г, 100,31 ммоль) и транс-N,N'-диметилциклогексан-1,2-диамин (3,16 мл, 20,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Затем указанную смесь помещали на предварительно нагретую масляную баню при 115 С и перемешивали в течение 15 ч при указанной температуре. Реакционную смесь охлаждали до комнатной температуры, разводили 300 мл этилацетата и фильтровали через целит. Указанную смесь промывали этилацетатомом (100 мл) и водным раствором гидроксида аммония (3%) (4100 мл) для удаления остатков меди и затем промывали водой (50 мл) и солевым раствором (50 мл). Раствор сушили над сульфатом натрия. Растворитель выпаривали в вакууме с получением твердого вещества рыжеватого цвета. Указанное твердое вещество фильтровали через пластину с силикагелем с использованием в качестве элюента смеси 2-пропанол/дихлорметан (3-5% 2-пропанола) с получением указанного в заголовке соединения с выходом 69%. МС (m/z): 479 (М+1). Пример получения 13. 2-[4-[(2-Фторспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1-ил]пиридин-3-карбальдегид Соединение примера получения 13, по существу, получали так же, как описано в примере получе- 10020848 ния 12, путем использования 2-бромпиридин-3-карбальдегида и 2-фтор-1'-[(3-метил-1 Н-пиразол-4 ил)метил]спиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидина]. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с получением указанного в заголовке соединения с выходом 83%. МС (m/z): 427 (М+1). Пример получения 14. N-[(2-Хлор-3-пиридил)метил]ацетамид К раствору (2-хлор-3-пиридил)метанамина (300 мг, 2,10 ммоль) в дихлорметане (2 мл) при комнатной температуре добавляли уксусный ангидрид (198,88 мкл, 2,10 ммоль) и триэтиламин (293,26 мкл, 2,10 ммоль). Через 1 ч реакцию гасили насыщенным водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органический слой отделяли, сушили над сульфатом магния и растворитель выпаривали в вакууме с получением 184 мг N-[(2-хлор-3-пиридил)метил]ацетамида. МС (m/z): 185 (М+1). Пример получения 15. (2-Бром-3-пиридил)метилметансульфонат 1. (2-Бром-3-пиридил)метанол В круглодонную колбу на 2 л (оснащенную магнитной мешалкой, в атмосфере азота при 0 С), содержащую 2-бром-3-пиридин-карбоксальдегид (22,15 г, 119,08 ммоль) и метанол (200 мл), добавляли боргидрид натрия (1,35 г, 35,72 ммоль) тремя порциями. Через 1 ч при 0 С добавляли воду (200 мл) и реакционную смесь концентрировали при пониженном давлении для удаления метанола. Полученный осадок растворяли в этилацетате и промывали водой (200 мл). Органический экстракт промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали с получением 22 г (2 бром-3-пиридил)метанола в виде твердого вещества белого цвета. МС (m/z): 188 (М+1), 190 (М+3). 2. (2-Бром-3-пиридил)метилметансульфонат Триэтиламин (8,90 мл) добавляли в круглодонную колбу, содержащую раствор (2-бромпиридин-3 ил)метанола (8 г, 42,55 ммоль) в дихлорметане (212 мл), при 0 С, затем добавляли метансульфонилхлорид (3,95 мл) и смесь перемешивали при указанной температуре в течение 1,5 ч. Через указанное время смесь промывали водой и органический слой декантировали, сушили над сульфатом магния и растворитель выпаривали при пониженном давлении с получением 10,4 г указанного в заголовке соединения, которое использовали без дополнительной очистки. МС (m/z): 266, 268 (М+1; М+3). Пример получения 16. 2-(2-Бром-3-пиридил)пропан-2-ол Диизопропиламид лития (2 М, 12,5 мл, 25 ммоль) растворяли в тетрагидрофуране (40 мл) и охлаждали до -78 С. По каплям добавляли 2-бромпиридин (3,9 г, 25 ммоль) и реакционную смесь перемешивали в течение 3 ч перед добавлением 1 мл ацетона (который сушили над только что активированными молекулярными ситами) и позволяли нагреваться до комнатной температуры. Реакцию гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над сульфатом магния и выпаривали. Осадок очищали с помощью колоночной флэш-хроматографии на силикагеле при элюировании смесью 20% гексан/трет-бутилметиловый эфир с получением указанного в заголовке соединения (1,4 г, 26%). 1 Н-ЯМР (d6-диметилсульфоксид): 8,23 (дд, J=1,9, 4,5 Гц, 1 Н), 8,19 (дд, J=2,0, 7,8 Гц, 1 Н), 7,44 (дд, J=4,5, 7,7 Гц, 1 Н), 5,43 (с, 1 Н), 2,12 (с, 1 Н), 1,46 (с, 6 Н). Пример получения 17. Этил-3-метил-1 Н-пиразол-4-карбоксилат Серную кислоту (18 мл, 337,69 ммоль) добавляли к суспензии 1 Н-пиразол-4-карбоновой кислоты,3-метил- (10 г, 79,29 ммоль) в этаноле (90 мл) и смесь перемешивали при 85 С в течение 20 ч. Через указанное время растворитель частично удаляли. Осадок подщелачивали 1 М раствором гидроксида натрия до достижения рН 6-7 и экстрагировали дихлорметаном. Органический слой декантировали, сушили над сульфатом магния и растворитель выпаривали при пониженном давлении с получением 10,3 г указанного в заголовке соединения, которое использовали без дополнительной очистки. МС (m/z): 155 (М+1).(2 г, 20,5 ммоль) в тетрагидрофуране (90 мл) в атмосфере азота при -78 С. Через 4 ч при указанной температуре добавляли метилхлорформиат (1,9 мл, 24,6 ммоль) и смесь перемешивали в течение дополнительного ч при -78 С и позволяли достигнуть комнатной температуры в течение ночи. Реакционную смесь медленно выливали в воду и экстрагировали диэтиловым эфиром. Органический слой промывали солевым раствором, сушили над сульфатом натрия и растворитель выпаривали в вакууме. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco при элюировании смесью гексан/диэтиловый эфир (9/1) с получением 495,2 мг указанного в заголовке соединения. МС (m/z): 156 трет-Бутилат калия (29,25 г, 260,68 ммоль) добавляли к раствору 3-метил-1 Н-пиразол-4-карбальдегида (26,00 г, 236,12 ммоль) в диметилформамиде (250 мл), охлажденному на водяной бане. Смесь перемешивали при комнатной температуре в течение 10 мин. Затем добавляли 2,3-дифторпиридин (25 г,217,24 ммоль) и смесь перемешивали при комнатной температуре в течение 20 ч. Смесь выливали в смесь лед/вода и экстрагировали этилацетатом (320 мл). Органический экстракт сушили над сульфатом магния и растворитель выпаривали в вакууме. Осадок очищали с помощью хроматографии на силикагеле с использованием в качестве элюента смеси гексан/изопропиловый спирт с получением неочищенного материала с остаточным диметилформамидом. Материал затем растворяли в этилацетате (100 мл) и промывали водой (320 мл). Водную фазу экстрагировали этилацетатом (220 мл). Объединенные органические экстракты сушили над сульфатом натрия и концентрировали с получением 19 г указанного в заголовке соединения. МС (m/z): 206 (М+1). Пример получения 20. 2-(4-Формил-3-метилпиразол-1-ил)пиридин-3-карбонитрил Соединение примера получения 20, по существу, получали так же, как описано в примере получения 19, путем использования 3-метил-1 Н-пиразол-4-карбальдегида и 2-фторпиридин-3-карбонитрила. Указанное в заголовке соединение получали с выходом 23%. МС (m/z): 213 (М+1). Пример получения 21. Метил-2-(4-формил-3-метилпиразол-1-ил)пиридин-3-карбоксилат Смесь 3-метил-1 Н-пиразол-4-карбальдегида (300 мг, 2,72 ммоль), карбоната калия (565 мг, 4,08 ммоль), метил-2-фторпиридин-3-карбоксилата (507 мг, 3,27 ммоль) и диметилформамида (2 мл) перемешивали при 60 С в течение 16 ч. Добавляли воду и соединение экстрагировали в этилацетате. Органический слой промывали солевым раствором, сушили над сульфатом натрия и растворитель выпаривали. Неочищенную смесь очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием смеси гексан/этилацетат (2:1) в качестве элюента с получением 422 мг указанного в заголовке соединения. МС (m/z): 246 (М+1). Соединение примера получения 22-23 может быть получено, по существу, так же, как описано в примере получения 21, с использованием соответствующего 2-хлорпиридильного реагента. 1. Этил-1-[3-(диметиламинометил)-2-пиридил]-3-метилпиразол-4-карбоксилат Указанное соединение получали, по существу, так же, как описано в примере получения 7, путем использования этил-1-(3-формил-2-пиридил)-3-метилпиразол-4-карбоксилата и диметиламина, с выходом 95%, и использовали без дополнительной очистки после выделения. МС (m/z): 289 (М+1). 2. [1-[3-(Диметиламинометил)-2-пиридил]-3-метилпиразол-4-ил]метанол К раствору этил-1-[3-(диметиламинометил)-2-пиридил]-3-метилпиразол-4-карбоксилата (217,7 г,0,75 ммоль) в тетрагидрофуране (5 мл), охлажденному до 0 С, в атмосфере азота добавляли 1 М алюмогидрид лития в тетрагидрофуране (0,9 мл, 0,9 ммоль) и смесь перемешивали при указанной температуре в течение 5 мин. Реакцию гасили насыщенным водным раствором хлорида аммония и неочищенный продукт экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом натрия и растворитель выпаривали в вакууме. В конкретном указанном примере соединение не выделяли посредством органической экстракции, а окончательно выделяли из водного раствора с помощью картриджа,заполненного сильным катионообменником, с получением 146 мг (78%) [1-[3-(диметиламинометил)-2 пиридил]-3-метилпиразол-4-ил]метанола, который использовали без дополнительной очистки. МС (m/z): 247 (М+1). 3. 1-[3-(Диметиламинометил)-2-пиридил]-3-метилпиразол-4-карбальдегид 3,3,3-Триацетокси-3-йодфталид (0,553 г, 1,3 ммоль) добавляли к раствору [1-[3-(диметиламинометил)-2-пиридил]-3-метилпиразол-4-ил]метанола (0,146 г, 0,59 ммоль) в дихлорметане (4 мл) при комнатной температуре. Через 1 ч реакцию гасили путем добавления 2 н раствора карбоната натрия и соединение экстрагировали дихлорметаном. Органический слой отделяли, сушили над сульфатом магния и растворитель выпаривали в вакууме с получением 126 мг 1-[3-(диметиламинометил)-2-пиридил]-3 метилпиразол-4-карбальдегида, который использовали без дополнительной очистки. МС (m/z): 245 1. Этил-3-(бромметил)-1-(3-фтор-2-пиридил)пиразол-4-карбоксилат К раствору этил-1-(3-фтор-2-пиридил)-3-метилпиразол-4-карбоксилата (10,2 г, 40,9 ммоль) в хлорбензоле (205 мл) добавляли N-бромсукцинимид (8 г) при комнатной температуре. Реакционную смесь перемешивали и облучали лампой (100 Вт) при комнатной температуре в течение ночи. Затем добавляли дополнительную порцию N-бромсукцинимида (2 г), и через 2 ч исходный материал не выявлялся. Твердое вещество фильтровали и растворитель выпаривали. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента дихлорметана и метанола с получением 5,3 г этил-3-(бромметил)-1-(3-фтор-2-пиридил)пиразол-4-карбоксилата. МС(m/z): 328; 330 (М+1; М+3). 2. Изопропил-1-(3-фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-карбоксилат К раствору этил-3-(бромметил)-1-(3-фтор-2-пиридил)пиразол-4-карбоксилата (1,5 г, 4,57 ммоль) в пропан-2-оле (23 мл) добавляли изопропоксид лития (3,02 г) и смесь перемешивали в течение ночи при комнатной температуре. Через указанное время дополнительно добавляли изопропоксид лития (4,5 г) тремя порциями по 1,5 г каждые 16 ч. После последнего добавления реакционную смесь окончательно перемешивали при 40 С в течение 16 ч. Растворитель выпаривали и осадок растворяли в этилацетате и промывали солевым раствором. Органический слой декантировали и сушили над сульфатом натрия. Растворитель выпаривали и осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента дихлорметана и метанола с получением 317 мг изопропил-1-(3 фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-карбоксилата. МС (m/z): 322 (М+1). 3. [1-(3-Фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-ил]метанол К раствору изопропил-1-(3-фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-карбоксилата (316 мг,0,98 ммоль) в диэтиловом эфире (4,9 мл) в атмосфере азота, охлажденному до 0 С, добавляли 1 М раствор алюмогидрида лития в тетрагидрофуране (1,2 мл). Смесь перемешивали при 0 С в течение 1 ч. Добавляли воду (46 мкл) и смесь перемешивали в течение 5 мин, затем последовательно добавляли 15% водный раствор NaOH (46 мкл) и воду (138 мкл). Твердое вещество фильтровали и растворитель выпаривали с получением 241 мг [1-(3-фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-ил]метанола, который использовали без дополнительной очистки. МС (m/z): 266 (М+1). 4. 1-(3-Фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-карбальдегид Смесь [1-(3-фтор-2-пиридил)-3-(изопропоксиметил)пиразол-4-ил]метанола (241 мг, 0,91 ммоль) и оксида марганца(IV) (791 мг) перемешивали в дихлорметане (5 мл) при комнатной температуре в течение ночи. Через указанное время реакционную смесь фильтровали через целит и растворитель выпаривали с получением 197 мг указанного в заголовке соединения, которое использовали без дополнительной очистки. МС (m/z): 264 (М+1). Пример получения 26. 1-(3-Фтор-2-пиридил)-3-(метоксиметил)пиразол-4-карбальдегид 1. Этил-1-(3-фтор-2-пиридил)-3-(метоксиметил)пиразол-4-карбоксилат К раствору этилового эфира 3-бромметил-1-(3-фторпиридин-2-ил)-1 Н-пиразол-4-карбоновой кислоты (1,13 г, 3,44 ммоль) в ацетоне (23 мл) добавляли йодид калия (200,1 мг), карбонат калия (865,33 мг) и метанол (4,18 мл). Смесь перемешивали при комнатной температуре в течение 48 ч. Выявляли сложный метиловый и сложный этиловый эфир желаемого соединения. Растворители выпаривали. Осадок разводили дихлорметаном и промывали водой. Органический слой декантировали, сушили над сульфатом магния и растворитель выпаривали. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента этилацетата и гексана с получением 599 мг смеси сложного метилового эфира и сложного этилового эфира. МС (m/z): 266 (М+1) и 280 (М+1). 2. [1-(3-Фтор-2-пиридил)-3-(метоксиметил)пиразол-4-ил]метанол Указанное соединение, по существу, получали так же, как описано на 3-ей стадии примера получения 25 (стадия восстановления) с выходом 93%, с использованием в качестве исходного материала этил 1-(3-фтор-2-пиридил)-3-(метоксиметил)пиразол-4-карбоксилата (в смеси, содержащей также сложный метиловый эфир). [1-(3-Фтор-2-пиридил)-3-(метоксиметил)пиразол-4-ил]метанол использовали без дополнительной очистки. МС (m/z): 238 (М+1). 3. 1-(3-Фтор-2-пиридил)-3-(метоксиметил)пиразол-4-карбальдегид Указанное соединение, по существу, получали так же, как описано на 4-й стадии примера получения 25 (стадия окисления) с выходом 91%, с использованием в качестве исходного материала [1-(3 фторпиридин-2-ил)-3-метоксиметил-1 Н-пиразол-4-ил]-метанола. Указанное в заголовке соединение использовали без дополнительной очистки. МС (m/z): 236 (М+1). Пример получения 27. 3-Метил-1- (3-морфолино-2-пиридил)пиразол-4-карбальдегид Смесь 1-(3-фтор-2-пиридил)-3-метилпиразол-4-карбальдегида (230 мг, 1,12 ммоль) и морфолина (2 мл, 22,93 ммоль) нагревали с помощью микроволнового излучения (температура 160 С, время нарастания 2 мин, время выдерживания 10 мин, мощность 250 Вт). Избыток морфолина удаляли в вакууме и осадок разводили дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия. Органический слой отделяли, сушили над сульфатом магния и растворитель выпаривали в вакууме. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием смеси гексан/этилацетат в качестве элюента (от 50 до 100% в этилацетате) с получением указанного в заголовке соединения с выходом 72%. МС (m/z): 273 (М+1). К раствору (2-бромпиридин-3-ил)метанола (20 г, 106,37 ммоль) в 140 мл тетрагидрофурана добавляли 60% раствор гидрида натрия в минеральном масле (6,38 г, 155,5 ммоль) при 0 С в атмосфере азота. Раствор перемешивали при 0 С в течение 30 мин. К раствору добавляли метилйодид (7,95 мл, 127,6 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакцию гасили путем добавления воды и неочищенный продукт экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом магния и растворитель выпаривали в вакууме с получением 2-бром-3-(метоксиметил)пиридина с выходом 98%, который использовали без дополнительной очистки. МС (m/z): 202 (М+1), 204 (М+3). Соединения примеров получения 29-30 получали, по существу, так же, как описано в примере получения 28, с использованием соответствующих алкилйодидных реагентов. 1. 2-Бром-3-(бромметил)пиридин Сосуд Шленка на 25 мл наполняли 2-бром-3-пиридинбензиловым спиртом (1 г, 5,32 ммоль) и дихлорметаном (15 мл). Полученный раствор охлаждали до 0 С на соляной-водяной/ледяной бане при интенсивном перемешивании с помощью магнитной мешалки. Затем по каплям добавляли трехбромистый фосфор (0,55 мл, 5,80 ммоль) для контроля экзотермического эффекта ниже 10 С. Получали густую суспензию и после завершения добавления удаляли баню и суспензию нагревали до комнатной температуры. Затем смесь постепенно нагревали до температуры флегмы в течение 3 ч и затем доводили до комнатной температуры в течение ночи. К предварительно охлажденной смеси при 0 С добавляли смесь лед/вода и затем рН доводили до щелочного значения 2 М раствором карбоната натрия. Органический слой отделяли и водный раствор промывали дважды дихлорметаном (210 мл). Все органические слои объединяли, сушили над сульфатом магния, фильтровали и растворитель выпаривали при пониженном давлении с получением 1,2 г 2 бром-3-бромметилпиридина, который использовали без дополнительной очистки. 2. 2-Бром-3-(изопропоксиметил)пиридин К раствору изопропилового спирта (7,31 мл, 95,65 ммоль) в диметилформамиде (50 мл) при 0 С добавляли гидрид натрия (3,63 г, 90,87 ммоль) и смесь перемешивали при комнатной температуре в течение 30 мин (указанную реакцию проводили с использованием перегородки для специальной защиты). Затем добавляли с помощью шприца 2-бром-3-бромметилпиридин (6 г, 23,91 ммоль) в 10 мл диметилформамида и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и смесь экстрагировали этилацетатом, промывали солевым раствором и водой, сушили над сульфатом магния,фильтровали и растворитель выпаривали при пониженном давлении. Неочищенный материал очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием этилацетата и гексана в качестве элюента (градиент от 5 до 25% этилацетата) с получением 3,67 г указанного в заголовке соединения. МС (m/z): 230, 232 (М+1, М+3). Смесь 2-бром-3-бромметилпиридина (840 мг, 3,35 ммоль) и цианида натрия (187,99 мг, 3,68 ммоль) перемешивали и кипятили с обратным холодильником в течение 1 ч в смеси вода (10 мл)-этанол (2 мл). Реакционную смесь разводили дихлорметаном и промывали насыщенным водным раствором бикарбоната натрия. Органический слой отделяли, сушили над сульфатом магния и растворитель выпаривали в вакууме с получением указанного в заголовке соединения с выходом 83%, которое использовали без дополнительной очистки. МС (m/z): 197 (М+1), 199 (М+3). Пример получения 33. 1-[3-(Циклопропоксиметил)-2-пиридил]-3-метилпиразол-4-карбальдегид 1. Этил-1-[3-(гидроксиметил)-2-пиридил]-3-метилпиразол-4-карбоксилат К раствору сложного этилового эфира 1-(3-формилпиридин-2-ил)-3-метил-1 Н-пиразол-4-карбоновой кислоты (1 г, 3,9 ммоль) в метаноле (25 мл) добавляли боргидрид натрия (220,2 мг, 5,8 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли и неочищенный продукт растворяли в этилацетате и промывали насыщенным водным раствором хлорида аммония. Органический слой отделяли, сушили над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении с получением 1 г этил-1-[3-(гидроксиметил)-2-пиридил]-3-метилпиразол-4-карбоксилата. МС(m/z): 262 (М+1). 2. Этил-3-метил-1-[3-(винилоксиметил)-2-пиридил]пиразол-4-карбоксилат Трифторацетат палладия(II) (5,1 мг, 15,3 мкмоль) и 4,7-дифенил-фенантролин (5,1 мг, 15,3 мкмоль) растворяли в н-бутилвиниловом эфире (6,1 мл, 61,2 ммоль) и сложном этиловом эфире 1-(3-гидроксиметилпиридин-2-ил)-3-метил-1 Н-пиразол-4-карбоновой кислоты (800 мг, 3,1 ммоль) и добавляли несколько капель триэтиламина. Колбу запечатывали и содержимое перемешивали при 75 С в течение 24 ч. Затем смесь охлаждали до 24 С и фильтровали через пластину с целитом. Растворитель удаляли при пониженном давлении и осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием гексана и этилацетата в качестве элюентов (5-20% в этилацетате) с получением 605 мг этил-3-метил-1-[3-(винилоксиметил)-2-пиридил]пиразол-4-карбоксилата. МС (m/z): 288 (М+1). 3. Этил-1-[3-(циклопропоксиметил)-2-пиридил]-3-метилпиразол-4-карбоксилат 1,0 М диэтилцинк в гексане (365,7 мкл, 3,5 ммоль) добавляли в атмосфере азота к дихлорметану (0,9 мл). Раствор охлаждали до 0 С и очень медленно добавляли раствор трифторуксусной кислоты (268,4 мкл, 3,5 ммоль) в дихлорметане (0,9 мл). Через 20 мин добавляли раствор дийодметана (286,1 мкл, 3,5 ммоль) в дихлорметане (0,9 мл). Еще через 20 мин добавляли раствор сложного этилового эфира 3 метил-1-(3-винилоксиметилпиридин-2-ил)-1 Н-пиразол-4-карбоновой кислоты (510 мг, 1,8 ммоль) в дихлорметане (0,9 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли 5%HCl и водный слой экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом натрия и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием гексана и этилацетата в качестве элюентов (5-20% в этилацетате) с получением 310 мг этил-1-[3-(циклопропоксиметил)-2-пиридил]-3 метилпиразол-4-карбоксилата. МС (m/z): 302 (М+1). 4. 1-[3-(Циклопропоксиметил)-2-пиридил]-3-метилпиразол-4-карбальдегид К раствору сложного этилового эфира 1-(3-циклопропоксиметилпиридин-2-ил)-3-метил-1 Нпиразол-4-карбоновой кислоты (410 мг, 1,03 ммоль) в тетрагидрофуране (0,15 М) при 0 С в атмосфере азота добавляли 1,0 М алюмогидрид лития в тетрагидрофуране (1,2 экв.). Смесь перемешивали при комнатной температуре в течение 1 ч и добавляли насыщенный водный раствор хлорида аммония и водный слой экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом натрия и растворитель удаляли при пониженном давлении. Неочищенный материал растворяли в дихлорметане (14 мл) и добавляли оксид марганца(IV) (1,2 г, 13,9 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и затем фильтровали через пластину с целитом и растворитель выпаривали при пониженном давлении. Неочищенный продукт пропускали через пластину с силикагелем (элюент: этилацетат и дихлорметан). Растворитель удаляли при пониженном давлении с получением 90 мг указанного в заголовке продукта. МС (m/z): 258 (М+1). 1. Этил-1-[3-(метоксиметил)-2-пиридил]-3-метилпиразол-4-карбоксилат Указанное соединение получали, по существу, так же, как описано в примере получения 12, путем использования этил-3-метил-1 Н-пиразол-4-карбоксилата и 2-бром-3-(метоксиметил)пиридина, с выходом 83%. МС (m/z): 276 (М+1). 2. [1-[3-(Метоксиметил)-2-пиридил]-3-метилпиразол-4-ил]метанол Указанное соединение получали, по существу, так же, как описано в примере получения 24 (2 стадия), путем использования этил-1-[3-(метоксиметил)-2-пиридил]-3-метилпиразол-4-карбоксилата, с выходом 88%. МС (m/z): 234 (М+1). 3. 1-[3-(Метоксиметил)-2-пиридил]-3-метилпиразол-4-карбальдегид Смесь [1-[3-(метоксиметил)-2-пиридил]-3-метилпиразол-4-ил]метанола (2,2 г, 9,4 ммоль) и оксида марганца(IV) (19 г, 188,8 ммоль) перемешивали в дихлорметане (20 мл) при комнатной температуре в течение ночи. Реакционную смесь фильтровали через целит и растворитель выпаривали при пониженном давлении с получением 1,8 г указанного в заголовке соединения, которое использовали без дополнительной очистки. МС (m/z): 232 (М+1). Пример получения 35. 2-Бром-3-(имидазол-1-илметил)пиридин К раствору (2-бром-3-пиридил)метилметансульфоната (2,5 г, 9,39 ммоль) в этаноле (46,97 мл) при комнатной температуре добавляли карбонат калия (2,62 г) и 1 Н-имидазол (1,31 г). Смесь перемешивали при 50 С. Образовывалась густая эмульсия, добавляли 10 мл этанола и полученную почти эмульсию перемешивали при 50 С в течение ночи. Добавляли воду до тех пор, пока твердое вещество не растворялось полностью. Затем полученную смесь концентрировали при пониженном давлении и осадок разводили этилацетатом и промывали бикарбонатом натрия (насыщенным водным раствором). Органический слой декантировали, сушили над сульфатом магния и растворитель выпаривали в вакууме. Неочищенный материал очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента дихлорметана и метанола (98/2-90/10) с получением 1,42 г указанного в заголовке соединения. МС (m/z): 238, 240 (М+1, М+3). Соединения примеров получения 36-40 получали, по существу, так же, как описано в примере получения 35, из соответствующих азотсодержащих гетероколец. Оба соединения получали в ходе одной и той же реакции К раствору 2-бром-3-пиридинола (1,5 г, 8,49 ммоль) в тетрагидрофуране (15 мл) при 0 С добавляли 60% гидрид натрия в минеральном масле (509,44 мг, 12,74 ммоль) и смесь перемешивали при указанной температуре в течение 30 мин. Затем добавляли ацетамид, 2-хлор- (16,98 ммоль) и смесь оставляли перемешиваться при комнатной температуре на выходные. Реакцию гасили водой и смесь экстрагировали этилацетатом. Отделенный органический слой сушили над сульфатом магния и растворитель выпаривали в вакууме с получением указанного в заголовке соединения с выходом 75%. Соединение использовали без какой-либо дополнительной очистки. МС (m/z): 231 (М+1), 233 (М+3). Пример получения 42. 2-Бром-3-(циклопропилметокси)пиридин К раствору 2-бром-3-пиридинола (500 мг, 2,83 ммоль) в диметилформамиде (3 мл) добавляли при 0 С 60% гидрид натрия в минеральном масле (169,81 мг, 4,25 ммоль). Смесь перемешивали при указанной температуре в течение 15 мин и добавляли бромметилциклопропан (329,66 мкл, 3,40 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение 1 ч, реакцию гасили водой и указанную смесь экстрагировали этилацетатом. Органический слой отделяли, промывали солевым раствором, сушили над сульфатом магния и растворитель выпаривали в вакууме. Неочищенный продукт пропускали через короткую пластину с силикагелем и соединение элюировали дихлорметаном с получением 23% указанного в заголовке соединения. МС (m/z): 228 (М+1), 230 (М+3). Пример получения 43. Этил-1-(3-фтор-2-пиридил)-4-формилпиразол-3-карбоксилат 1. Этил-4-формил-1 Н-пиразол-3-карбоксилат Круглодонную колбу на 100 мл наполняли гидрохлоридом семикарбазида (2 г, 17,93 ммоль), этилпируватом (11,8 мл) и этаноатом натрия (2,97 г). Затем добавляли воду (9 мл). Смесь перемешивали при комнатной температуре в течение 90 мин, затем указанную смесь фильтровали и твердое вещество промывали дополнительной порцией воды. Твердое вещество белого цвета сушили в вакууме в термостате(40 С) в течение ночи. Получали 2,66 г чистого этил-2-(карбамоилгидразоно)пропаноата. К диметилформамиду (7,13 мл) добавляли по каплям фосфорилхлорид (3,28 мл) при 0 С. Охлаждающую баню удаляли для достижения комнатной температуры. Затем смесь нагревали до 40 С и добавляли несколькими порциями предварительно полученный этил-2-(карбомоилгидразоно)пропаноат (2,66 г, 15,36 ммоль) в течение 15-20 мин (выделение газа во время добавления). Когда внутренняя температура составляла 55 С,нагревающую баню удаляли, таким образом, внутреннюю температуру поддерживали в диапазоне 6070 С. Затем смесь нагревали до 80 С. При стабилизации температуры реакции при 80 С выделение газа практически больше не наблюдалось. Полученную суспензию перемешивали при 80 С в течение 2 ч. Реакционную смесь выливали в смесь лед/вода (30 мл) и перемешивали с получением суспензии. Добавляли по каплям 50% раствор гидроксида натрия до достижения рН 10. Раствор перемешивали при 50 С в течение 5 мин. Указанный раствор затем охлаждали с помощью ледяной/водяной бани и добавляли 35% водный раствор соляной кислоты до достижения рН 7. Смесь экстрагировали этилацетатом. Органический слой декантировали, сушили над сульфатом магния и растворитель выпаривали при пониженном давлении. Осадок растирали с гексаном и несколькими каплями дихлорметана с получением 1,6 г этил-4 формил-1 Н-пиразол-3-карбоксилата, который использовали на следующей стадии без дополнительной очистки. МС (m/z): 169 (М+1). 2. Этил-1-(3-фтор-2-пиридил)-4-формилпиразол-3-карбоксилат Смесь этил-4-формил-1 Н-пиразол-3-карбоксилата (1,6 г, 9,52 ммоль), 2,3-дифторпиридина (1,20 г) и карбоната калия (1,97 г) в диметилформамиде (8 мл) нагревали и перемешивали при 100 С в течение 1,5 ч. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и органическую фазу экстрагировали этилацетатом, декантировали, сушили над сульфатом магния и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием этилацетата и гексана, с получением 711 мг указанного в заголовке соединения. МС (m/z): 264 (М+1). 1. 3-(2,5-Дигидрофуран-2-ил)-2-фторпиридин В пробирку с завинчивающейся крышкой, содержащую ацетат калия (440 мг, 4,5 ммоль), бромид тетрабутиламмония (1,4 г, 4,5 ммоль) и молекулярные сита (4) в безводном диметилформамиде (1,8 мл), добавляли в атмосфере азота 2-фтор-3-йодпиридин (400 мг, 1,8 ммоль), 2,3-дигидрофуран (1,4 мл, 18 ммоль) и ацетат палладия (20 мг, 0,09 ммоль). Реакционную пробирку быстро запечатывали и содержимое перемешивали в течение ночи при комнатной температуре. Смесь разводили диэтиловым эфиром и полученную смесь фильтровали через целит. Фильтрат промывали водой, сушили над сульфатом магния,фильтровали и растворитель выпаривали в вакууме. Полученный осадок очищали с помощью силикагеля с использованием хроматографии на нормально-фазовой колонке Isco при элюировании смесью гексан/ацетон (градиент от 5 до 30% в ацетоне) с получением 170 мг 3-(2,5-дигидрофуран-2-ил)-2-фторпиридина. МС (m/z): 166 (М+1). 2. 2-Фтор-3-(тетрагидрофуран-2-ил)пиридин Круглодонную колбу, содержащую 3-(2,5-дигидрофуран-2-ил)-2-фторпиридин (170 мг, 1 ммоль) и 10% Pd/C в метаноле (3,1 мл), вакуумировали и наполняли водородом с помощью баллона. Реакционную смесь перемешивали в течение ночи при комнатной температуре и фильтровали через целит. Растворитель выпаривали в вакууме с получением 148 мг 2-фтор-3-(тетрагидрофуран-2-ил)пиридина. МС (m/z): 168 (М+1). 3. 3-Метил-1-(3-(тетрагидрофуран-2-ил)пиридин-2-ил)-1 Н-пиразол-4-карбальдегид В пробирку с завинчивающейся крышкой, содержащую 2-фтор-3-(тетрагидрофуран-2-ил)пиридин(148 мг, 0,88 ммоль) в диметилформамиде (2,2 мл), добавляли 3-метил-1 Н-пиразол-4-карбальдегид (81 мг, 0,74 ммоль) и карбонат калия (152 мг, 1,1 ммоль). Реакционную пробирку быстро запечатывали (предупреждение: возможно повышение давления; использовать защитную перегородку) и перемешивали на предварительно нагретой масляной бане при 110 С в течение 18 ч с помощью магнитной мешалки. Смесь разводили водой и экстрагировали этилацетатом. Органический слой отделяли, сушили над сульфатом магния, фильтровали и растворитель выпаривали в вакууме. Полученный осадок очищали с помощью силикагеля с использованием хроматографии на нормально-фазовой колонке Isco при элюировании смесью гексан/ацетон (градиент от 5 до 20% в ацетоне) с получением 116 мг указанного в заголовке соединения. МС (m/z): 258 (М+1). Пример получения 45. 3-(2-Бромпирид-3-ил)изоксазол 1. Оксим 2-бромпиридин-3-карбальдегида К раствору 2-бромпиридин-3-карбальдегида (2,04 г) в этаноле (25 мл) добавляли гидрохлорид гидроксиламина (948 мг, 13,16 ммоль) и этаноат натрия (1,09 г, 13,16 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали при пониженном давлении и осадок распределяли между дихлорметаном и водой. Органический слой отделяли, сушили над сульфатом натрия,фильтровали и растворитель выпаривали в вакууме с получением 2 г оксима 2-бромпиридин-3 карбальдегида. МС (m/z): 201/203 (М+1/М+3). 2. [3-(2-Бром-3-пиридил)изоксазол-5-ил]триметилсилан К перемешиваемой суспензии оксима 2-бромпиридин-3-карбальдегида (400 мг, 1,99 ммоль) в дихлорметане (3,98 мл) при 0 С добавляли порциями пиридин (201,13 мкл, 2,49 ммоль) с последующим добавлением N-хлорсукцинимида (337,19 мг, 2,49 ммоль). Затем добавляли триметилсилилацетилен(350,60 мкл, 2,49 ммоль) с последующим добавлением триэтиламина (346,68 мкл, 2,49 ммоль). Смесь перемешивали при температуре от 0 С до комнатной температуры. Через 2 ч добавляли дополнительную порцию пиридина (321,81 мкл, 3,98 ммоль) и N-хлорсукцинимида (539,51 мг, 3,98 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. Реакцию затем гасили насыщенным раствором хлорида аммония. Слои разделяли и органическую фазу сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением [3-(2-бром-3-пиридил)изоксазол-5-ил]триметилсилана с количественным выходом. МС (m/z): 297/299 (М+1/М+3). 3. 3-(2-Бром-3-пиридил)изоксазол К раствору [3-(2-бром-3-пиридил)изоксазол-5-ил]триметилсилана (620 мг, 2,09 ммоль) в метаноле(18 мл) добавляли одной порцией карбонат калия (29,12 мг, 208,59 мкмоль). Смесь перемешивали при комнатной температуре в течение 24 ч. Растворитель удаляли в вакууме. Неочищенный продукт распределяли между этилацетатом и насыщенным раствором хлорида аммония. Органическую фазу промывали водой и сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием в качестве элюента смеси гексан/этилацетат (от 66/33 до 50/50) с получением 140 мг указанного в заголовке соединения в виде твердого вещества белого цвета. МС (m/z): 225/227 (М+1/М+3). Пример получения 46. 1-(3-Хлор-2-пиридил)-3-метилпиразол-4-карбальдегид К раствору 3-метилпиразол-4-карбальдегида (0,5 г, 4,5 ммоль) в безводном диметилформамиде (15 мл) добавляли карбонат калия (2,5 г, 18 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 40 С в течение 30 мин и затем добавляли 1-фтор-2-хлорпиридин (0,77 г, 6 ммоль). Реакционную смесь нагревали при 70 С в течение 16 ч. После завершения нагревания реакционную смесь охлаждали до комнатной температуры, разводили водой и затем экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенную смесь очищали с помощью хроматографии на силикагеле при элюировании смесью гексан/этилацетат (75:25, 65:35) с получением 0,525 г (52%) указанного в заголовке соединения. МС (m/z): 222 (М+1). Пример получения 47. 1-(3-Циклопропил-2-пиридил)-3-метилпиразол-4-карбальдегид 1. Сложный этиловый эфир 1-(3-бромпиридин-2-ил)-3-метилпиразол-4-карбоновой кислоты К раствору сложного этилового эфира 3-метилпиразол-4-карбоновой кислоты (2,0 г, 13 ммоль) в безводном диметилформамиде (30 мл) добавляли карбонат калия (7,2 г, 52 ммоль) при комнатной температуре. Реакционную смесь перемешивали при 40 С в течение 30 мин и затем добавляли 1-фтор-2 бромпиридин (3,0 г, 17 ммоль). Реакционную смесь перемешивали при 70 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, разводили водой и затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенную смесь очищали с помощью хроматографии на силикагеле при элюировании смесью гексан/этилацетат (85:15, 80:20) с получением 3,2 г (79%) сложного этилового эфира 1(3-бромпиридин-2-ил)-3-метилпиразол-4-карбоновой кислоты. МС (m/z): 312 (М+3), 310 (М+1). 2. Сложный этиловый эфир 1-(3-циклопропилпиридин-2-ил)-3-метилпиразол-4-карбоновой кислоты Смесь сложного этилового эфира 1-(3-бромпиридин-2-ил)-3-метилпиразол-4-карбоновой кислоты(1,5 г, 5,5 ммоль), фосфата калия (4,0 г, 19,2 ммоль), циклопропилбороновой кислоты (0,7 г, 8,2 ммоль) и смеси толуол/вода (2:1, 15 мл) дегазировали с помощью азота и трициклогексилфосфина (0,153 г, 0,54 ммоль) и добавляли ацетат палладия (0,061 г, 0,27 ммоль). Смесь снова дегазировали с помощью азота и реакционный сосуд запечатывали и нагревали при 100 С в течение 16 ч. Реакционную смесь концентрировали, разводили водой и экстрагировали этилацетатом. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенную смесь очищали с помощью хроматографии на силикагеле при элюировании смесью гексан/этилацетат (85:15) с получением 1,6 г (93%) сложного этилового эфира 1-(3-циклопропилпиридин-2-ил)-3-метилпиразол-4-карбоновой кислоты. МС (m/z): 272 (М+1). 3. [1-(3-Циклопропилпиридин-2-ил)-3-метилпиразол-4-ил]метанол К перемешанной суспензии алюмогидрида лития (0,44 г, 11,7 ммоль) в безводном тетрагидрофуране (25 мл) добавляли раствор сложного этилового эфира 1-(3-бромпиридин-2-ил)-3-метилпиразол-4 карбоновой кислоты (1,6 г, 5,8 ммоль) в безводном тетрагидрофуране (5 мл) в атмосфере азота при -78 С. После завершения добавления реакционную смесь нагревали до комнатной температуры, затем перемешивали в течение ночи. Реакцию гасили 1 н раствором гидроксида натрия, затем реакционную смесь фильтровали через целит. Органический слой отделяли и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением 1,1 г (84%) [1-(3-циклопропилпиридин-2-ил)-3 метилпиразол-4-ил]метанола. МС (m/z): 230 (М+1). 4. 1-(3-Циклопропил-2-пиридил)-3-метилпиразол-4-карбальдегид К раствору [1-(3-циклопропилпиридин-2-ил)-3-метилпиразол-4-ил]метанола (1,1 г, 5,0 ммоль) в безводном дихлорметане (15 мл) добавляли хлорхромат пиридиния (1,2 г, 5,5 ммоль) в атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем фильтровали через целит. Фильтрат концентрировали при пониженном давлении. Неочищенную смесь очищали на силикагеле при элюировании смесью гексан/этилацетат (90:10, 80:20) с получением 0,2 г (20%) указанного в заголовке соединения. МС (m/z): 228 (М+1). Пример получения 48. 4-[(2-Бром-3-пиридил)метил]морфолин-3-он К раствору 2-бром-3-бромметилпиридина (0,68 г, 2,36 ммоль) в диметилформамиде (10 мл) добавляли гидрид натрия (0,11 г, 60% суспензия, 2,82 ммоль), морфолин-3-он (0,20 г, 1,97 ммоль) и йодид тетрабутиламмония (катализатор) при 0 С. Смесь перемешивали при комнатной температуре в течение 16 ч. После завершения перемешивания реакционную смесь распределяли между этилацетатом (25 мл) и водой (25 мл). Водный слой экстрагировали этилацетатом (225 мл) и объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный материал очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (55:45) с получением 0,35 г (66%) указанного в заголовке соединения. МС (m/z): 271/273 (М+1, М+3). Соединения примеров получения 49-50 получали, по существу, так же, как описано в примере получения 48, из соответствующего лактамного реагента.(1,99 г, 15,1 ммоль) в диметилформамиде (20 мл) добавляли карбонат калия (2,80 г, 20,2 ммоль) и смесь перемешивали при 100 С в течение 16 ч. После завершения перемешивания реакционную смесь распределяли между водой (25 мл) и этилацетатом (25 мл). Водный слой экстрагировали этилацетатом (325 мл) и объединенные органические экстракты сушили над сульфатом натрия, концентрировали в вакууме и очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (50:50) с получением 1,5 г (54%) указанного в заголовке соединения. МС (m/z): 280 Смесь этил-1-(3-хлор-2-пиридил)-4-формилпиразол-3-карбоксилата (1,0 г, 3,5 ммоль), триметилбороксина (0,44 г, 3,50 ммоль) и карбоната калия (1,4 г, 10,1 ммоль) в диоксане (18 мл) и воде (2 мл) дегазировали с помощью азота в течение 10 мин и затем добавляли трифенилфосфин палладия (0,40 г, 0,3 ммоль) и перемешивали при 110 С в течение 16 ч. После завершения перемешивания реакционную смесь распределяли между дихлорметаном (50 мл) и водой (25 мл). Водный слой экстрагировали дихлорметаном (225 мл) и объединенные органические экстракты сушили над сульфатом натрия и концентрировали в вакууме. Неочищенную смесь очищали с помощью колоночной хроматографии на силикагеле при элюировании смесью гексан/этилацетат (70:30) с получением 0,12 г (13%) указанного в заголовке соединения. МС (m/z): 260 (М+1). К раствору 2-[4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3 метилпиразол-1-ил]пиридин-3-карбальдегида (12,50 г, 26,10 ммоль) в дихлорметане (125 мл) при 0 С добавляли боргидрид натрия (0,395 г, 10,44 ммоль) и метанол (37,50 мл). Ледяную баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли воду (50 мл) и смесь концентрировали до половины объема с получением клейкого твердого осадка белого цвета. Добавляли дихлорметан (100 мл) и двухфазную смесь разделяли. Органический слой промывали водой (50 мл), сушили над сульфатом натрия и концентрировали до половины объема (около 100 мл). Добавляли метил-трет-бутиловый эфир (100 мл) и раствор концентрировали с получением осадка. Твердое вещество фильтровали и сушили в вакууме с получением 12 г [2-[4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3 с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1-ил]-3-пиридил]метанола. МС (m/z): 481 (М+1). Указанное в заголовке соединение в виде свободного основания (0,48 г, 1 ммоль) растворяли в 3 мл метанола и добавляли раствор (L)-винной кислоты (0,15 г, 1 ммоль) в метаноле. Смесь перемешивали в течение 10 мин. Растворитель выпаривали и осадок сушили в вакууме в течение ночи с получением (L)тартрата Раствор 40% глиоксала в воде (4,69 мл, 40,71 ммоль) и 2 н аммония в метаноле (54,29 мл, 108,57 ммоль) добавляли к суспензии 2-[4-[(2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин]-1'ил)метил]-3-метилпиразол-1-ил]пиридин-3-карбальдегида (6,50 г, 13,57 ммоль) в метаноле (10 мл). Реакционную смесь перемешивали в течение 5 мин при 0 С и затем при 40 С в течение 1 ч. К суспензии добавляли дихлорметан (10 мл) с почти полным растворением материала. Смесь перемешивали в течение 4 ч с получением светло-коричневого раствора. Раствор перемешивали в течение 8 ч при 40 С. Добавляли 40% глиоксал в воде (2,34 мл, 20,36 ммоль) и 2 н аммоний в метаноле (27,14 мл, 54,29 ммоль) и смесь перемешивали при 40 С в течение 15 ч. Реакционную смесь концентрировали до примерно 100 мл и выливали в смесь лед/вода (400 мл) и наблюдали образование твердого осадка бежевого цвета. Твердое вещество фильтровали, промывали водой и сушили в вакууме (7 г). Указанное твердое вещество объединяли с другим неочищенным материалом, полученным, по существу, таким же способом (10 г). Объединенное твердое вещество растворяли в дихлорметане и фильтровали через пластину с силикагелем при элюировании смесью дихлорметан/метанол (96/4). Фракции, содержащие продукт, объединяли и концентрировали с получением твердого вещества светло-желтого цвета (11 г). Твердое вещество экстрагировали смесью 10% гексан/дихлорметан при кипячении с обратным холодильником и фильтрат концентрировали. Твердое вещество далее очищали посредством хроматографии на силикагеле при элюировании смесью 2 н раствор гидроксида аммония в метаноле/дихлорметан с получением 6,5 г указанного в заголовке соединения. МС (m/z): 518 (М+1). Указанное соединение получали, по существу, так же, как описано в примере 2, путем использования 2-[4-[(2-фторспиро[4,5-дигидротиено[2,3-с]пиран-7,4'-пиперидин]-1'-ил)метил]-3-метилпиразол-1 ил]пиридин-3-карбальдегида. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с получением 32% указанного в заголовке соединения. МС (m/z): 465 (М+1). Пример 4. 5-(2-(4-2'-Хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-c]пиран]-1-ил) метил)-3-метил-1 Н-пиразол-1-ил)пиридин-3-ил)оксазол В пробирку с завичивающейся крышкой, содержащую 2-(4-2'-хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пиран]-1-ил)метил)-3-метил-1 Н-пиразол-1-ил)никотинальдегид (0,120 г,0,25 ммоль) в метаноле (2,5 мл), добавляли карбонат калия (0,104 г, 0,75 ммоль) и п-толуолсульфонилметилизоцианид (0,054 г, 0,28 ммоль) в атмосфере азота. Реакционную пробирку быстро запечатывали (предупреждение: возможно повышение давления; использовать защитную перегородку) и перемешивали на предварительно нагретой масляной бане при 65 С в течение 3 ч с помощью магнитной мешалки. Смесь разводили метанолом и очищали с использованием картриджа, заполненного сильным катионообменником (2 г). Растворитель выпаривали в вакууме. Полученный осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco при элюировании смесью гексан/этаноле (5-30%) с получением 0,093 г указанного в заголовке соединения. МС (m/z): 518 (М+1). Пример 5. (L)-Тартрат 2-хлор-4,4-дифтор-1'-1-(3-фтор-2-пиридил)-3-метилпиразол-4-ил]метил] спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина] К раствору 2-хлор-4,4-дифторспиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина] (19,99 г, 64,33 ммоль) в 1,2-дихлорэтане (120 мл) добавляли 1-(3-фтор-2-пиридил)-3-метилпиразол-4-карбальдегид (12 г, 58,48 ммоль) и смесь перемешивали при комнатной температуре в течение 15 мин. Затем добавляли порошкообразный триацетоксиборгидрид натрия (18,59 г, 87,72 ммоль) (внутренняя температура 25-35 С) и полученную суспензию перемешивали при комнатной температуре в течение 15 ч. Порциями добавляли насыщенный раствор бикарбоната натрия в ледяной смеси (200 мл) при перемешивании. Фазы разделяли. Водную фазу экстрагировали трет-бутилметиловым эфиром (30 мл). Объединенные органические слои промывали водой (50 мл) и 50% солевым раствором (50 мл), сушили над сульфатом натрия и концентрировали с получением вязкого масла, которое очищали посредством хроматографии на силикагеле с использованием смеси дихлорметан/метанол в качестве элюента с получением 18 г вязкого масла, которое растирали с гексаном и смесью 10% трет-бутилметиловый эфир/гексан с получением 16,5 г 2-хлор 4,4-дифтор-1'-1-(3-фтор-2-пиридил)-3-метилпиразол-4-ил]метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина]. МС (m/z): 469 (М+1). Тартрат, по существу, получали так же, как описано в примере 1. МС (m/z): 469 (М+1). Соединения примеров 6-15 получали, по существу, так же, как описано в примере 5, с использованием соответствующего альдегида. Реакции осуществляли с использованием тетрагидрофурана в качестве растворителя Пример 16. 2-Хлор-4,4-дифтор-1'-3-метил-1-(3-тетрагидрофуран-2-ил-2-пиридил)пиразол-4-ил] метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин] В пробирку с завинчивающейся крышкой, содержащую смесь 3-метил-1-(3-(тетрагидрофуран-2 ил)пиридин-2-ил)-1 Н-пиразол-4-карбальдегида (192 мг, 0,75 ммоль), 2'-хлор-4',4'-дифтор-4',5'-дигидроспиро[пиперидин-4,7'-тиено[2,3-с]пирана (209 мг, 0,75 ммоль) и уксусной кислоты (43 мкл, 0,75 ммоль) в 1,2-дихлорэтане (2,6 мл), добавляли триацетоксиборгидрид натрия (238 мг, 1,1 ммоль). Реакционную пробирку запечатывали и содержимое перемешивали при комнатной температуре в течение 18 ч с помощью магнитной мешалки. Смесь разводили метанолом и очищали с использованием картриджа,заполненного сильным катионообменником (10 г), и растворитель выпаривали в вакууме. Полученный осадок далее очищали с помощью хроматографии на нормально-фазовой колонке Isco при элюировании смесью гексан/ацетон (градиент от 5 до 30% в ацетоне) с получением 113 мг указанного в заголовке соединения в виде рацемической смеси. МС (m/z): 521 (М+1). Энантиомерное расщепление осуществляли в условиях СФХ (сверхкритической флюидной хроматографии) с использованием Chiralpak AD-H (Chiral Technologies, Inc., Уэст-Честер, Пенсильвания,США) в качестве неподвижной фазы и смеси диоксид углерода/метанол/диметилэтиламин (0,2%) в качестве подвижной фазы. Первый вымывающийся энантиомер представлял собой желаемый энантиомер.(192 мг). Смесь перемешивали 10 мин при комнатной температуре. Затем добавляли триацетоксиборгидрид натрия (268,3 мг) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разводили дихлорметаном и медленно гасили бикарбонатом натрия (насыщенным раствором). Органическую фазу затем экстрагировали дополнительной порцией дихлорметана, декантировали, сушили над сульфатом магния и растворитель выпаривали при пониженном давлении. Осадок очищали с помощью обращено-фазовой ВЭЖХ с получением 67,9 мг 2-хлор-4,4-дифтор-1'-1-(3-фтор-2-пиридил)3-(изопропоксиметил)пиразол-4-ил]метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина]. МС (m/z): 527 В пробирку с завинчивающейся крышкой добавляли йодид меди(I) (1,15 г, 6,02 ммоль), 2-хлор-4,4 дифтор-1'-[(3-метил-1 Н-пиразол-4-ил)метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидин] (15 г, 40,12 ммоль), карбонат калия (11,76 г, 84,26 ммоль), 15 мл толуола (через который предварительно барботировали азот в течение 20 мин) и магнитную мешалку. Через реакционную смесь барботировали азот в течение дополнительных 10 мин и затем добавляли 2-бром-3-метоксиметилпиридин (10,54 г, 52,16 ммоль) и транс-N,N'-диметилциклогексан-1,2-диамин (1,90 мл, 12,04 ммоль). Реакционную пробирку быстро запечатывали (предупреждение: возможно повышение давления; используйте защитную перегородку), перемешивали содержимое при комнатной температуре в течение 5 мин и помещали на предварительно нагретую масляную баню при 115 С на 24 ч. Образец охлаждали до комнатной температуры, разводили этилацетатом и фильтровали через целит. Растворитель выпаривали в вакууме. Осадок очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием смеси гексан/этилацетат (3070%). Желаемые фракции собирали и выпаривали. Некоторые неочищенные фракции (2 г) заново очищали с помощью хроматографии на нормально-фазовой колонке Isco с использованием смеси гексан/этилацетат (20-60% в этилацетате) в качестве элюента. Все фракции, содержащие конечное соединение, объединяли и выпаривали досуха в вакууме. Осадок растворяли в дихлорметане и промывали 10% водным раствором гидроксида аммония для удаления остатков меди. Органический растворитель выпаривали и соединение сушили в течение ночи с получением 13 г 2-хлор-4,4-дифтор-1'-1-[3-(метоксиметил)-2-пиридил]-3-метилпиразол-4-ил]метил]спиро[5 Н-тиено[2,3-с]пиран-7,4'-пиперидина]. МС В пробирку с завинчивающейся крышкой добавляли йодид меди(I) (23,74 мг, 0,125 ммоль), 2-хлор 4,4-дифтор-1'-[(3-метил-1 Н-пиразол-4-ил)метил]спиро[5 Н-тиено[2,3-c]пиран-7,4'-пиперидин] (233,00 мг,0,623 ммоль), карбонат калия (182,71 мг, 1,31 ммоль), толуол (2 мл) (через который предварительно барботировали азот в течение 20 мин) и магнитную мешалку. Через реакционную смесь барботировали азот в течение 20 мин и затем добавляли 2-йод-3-метоксипиридин (302,01 мг, 1,25 ммоль) и транс-N,N'диметилциклогексан-1,2-диамин (39,31 мкл, 0,25 ммоль). Реакционную пробирку быстро запечатывали(предупреждение: возможно повышение давления; используйте защитную перегородку) и перемешивали на предварительно нагретой масляной бане при 110 С в течение 24 ч с помощью магнитной мешалки. Затем смесь наносили на колонку, заполненную сильным катионообменником (25 г), и элюировали метанолом и затем 2 н раствором аммония в метаноле. Основную фракцию концентрировали и полученный осадок очищали с помощью основной ВЭЖХ с получением 162 мг указанного в заголовке соединения. МС (m/z): 481 (М+1).
МПК / Метки
МПК: A61P 25/00, A61K 31/444, C07D 495/20
Метки: соединения, антагонистов, качестве, orl-1, спиропиперидиновые, рецептора
Код ссылки
<a href="https://eas.patents.su/30-20848-spiropiperidinovye-soedineniya-v-kachestve-antagonistov-receptora-orl-1.html" rel="bookmark" title="База патентов Евразийского Союза">Спиропиперидиновые соединения в качестве антагонистов рецептора orl-1</a>