Ингибиторы вируса гепатита с
Номер патента: 20815
Опубликовано: 30.01.2015
Авторы: Чэнь Ци, Бендер Джон А., Су Бао-Нин, Сейнт Лорен Денис Р., Смит Майкл Дж., Истер Джон А., Ван Гань, Ромине Джефри Ли, Минвелл Николас А., Сюй Ниннин, Лопез Омар Д., Белема Маконен, Ян Чжун, Нгуен Ван Н., Хевавасам Пиясена
Формула / Реферат
1. Соединение формулы (I)
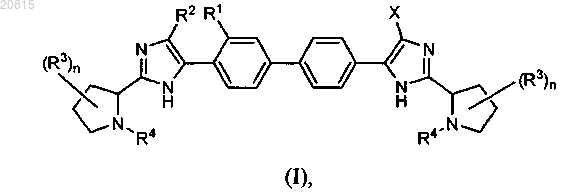
или его фармацевтически приемлемая соль, где
n равно 0,1 или 2;
X выбирают из водорода, циано, галогена циклопропила, циклопропилметила, 1-метилциклопропила, аллила, 1-метилпиразол-5-ила, 1-метилимидазол-5-ила и изоксазол-4-ила;
R1 представляет собой водород;
R2 выбирают из водорода, циклопропила и галогена; или
R1 и R2 вместе образуют -CH=CH- или -CH=CCl-;
при условии, что по меньшей мере один из X и R2 не обозначает водород;
каждый R3 представляет собой метил или два R3 в положениях 3 и 4 пиролидинового кольца вместе с атомами углерода пиролидинового кольца образуют циклопропановое кольцо;
каждый R4 независимо выбирают из третбутоксикарбонила, ацетила и N-(C1-С2)алкоксикарбониламино(С2-С5)алканоила, где (С2-С5)алканоильный фрагмент может быть замещен 1-2 группами метокси или радикалом, выбранным из группы, включающей гидрокси, циклопропан, циклобутил, 4,4-дифторциклогексил, тетрагидропиран-4-ил, 2,6-диметилтетрагидропиран-4-ил.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой галоген.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где R2 представляет собой галоген.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 и R2 вместе образуют -CH=CCl-.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой водород.
6. Соединение, выбранное из
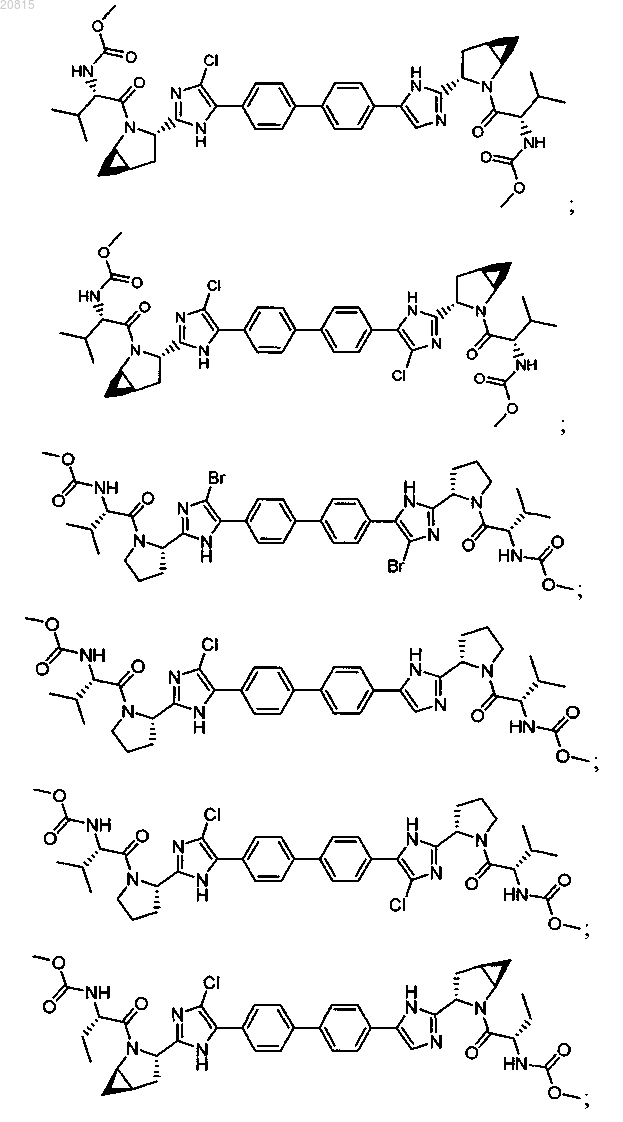

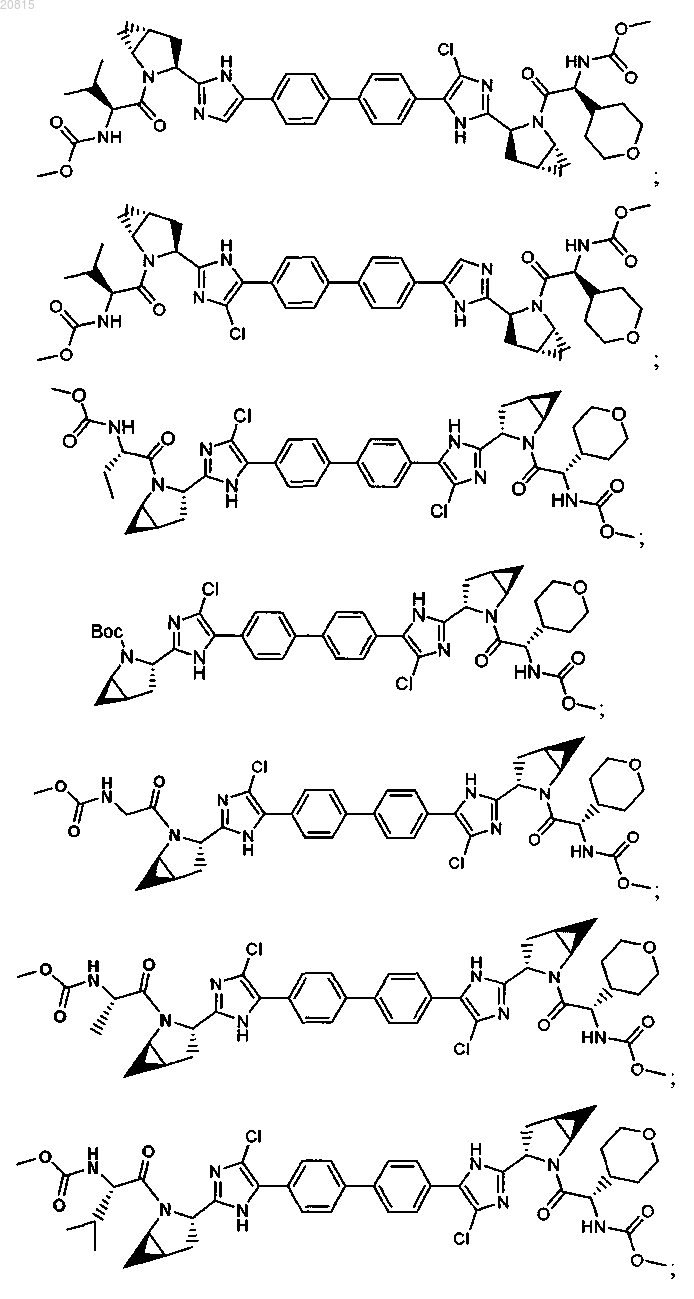
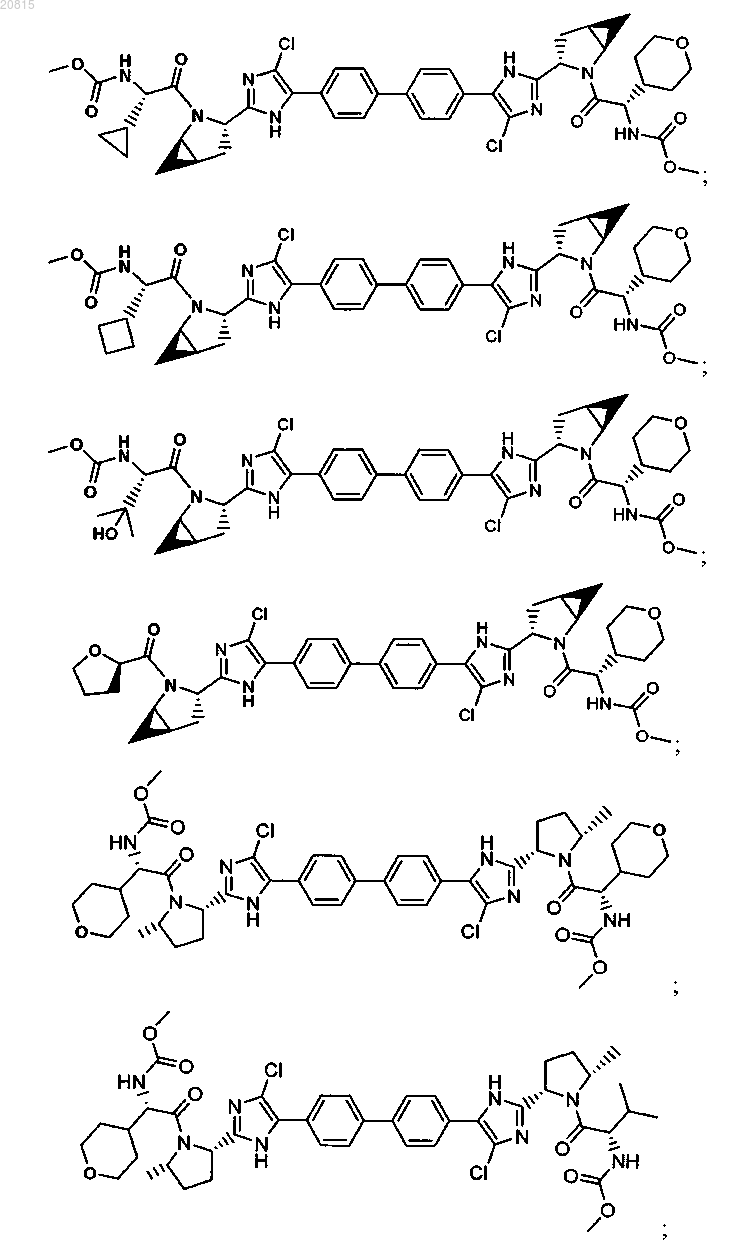
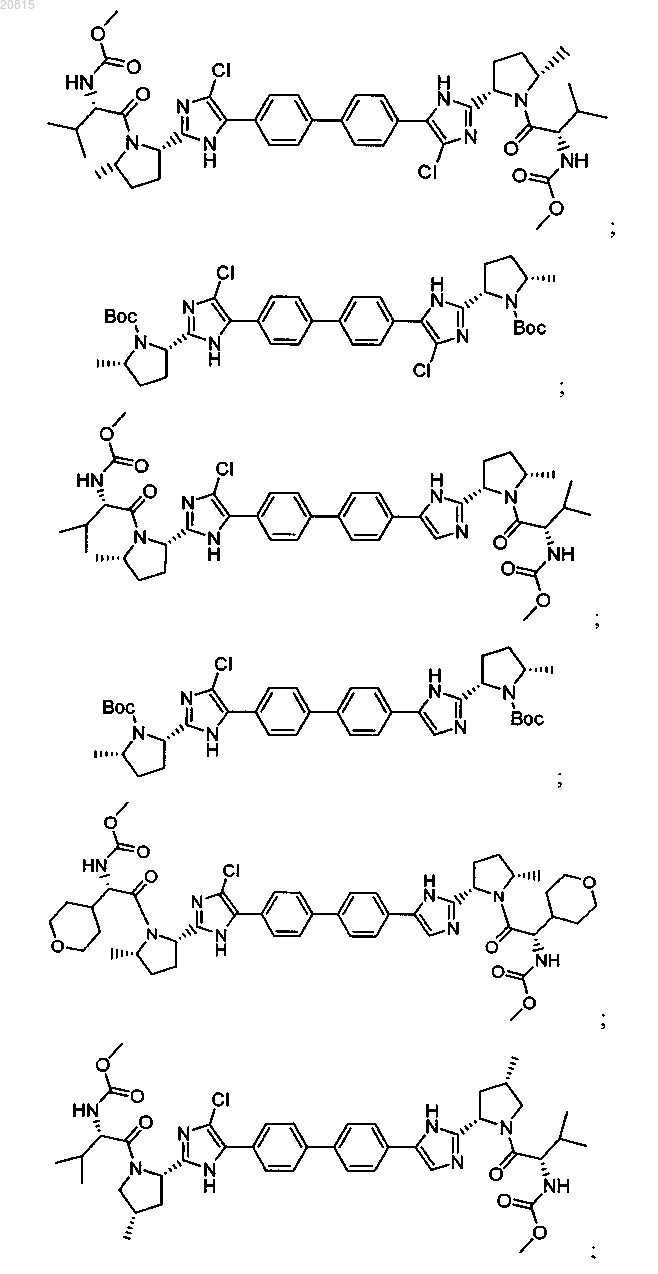
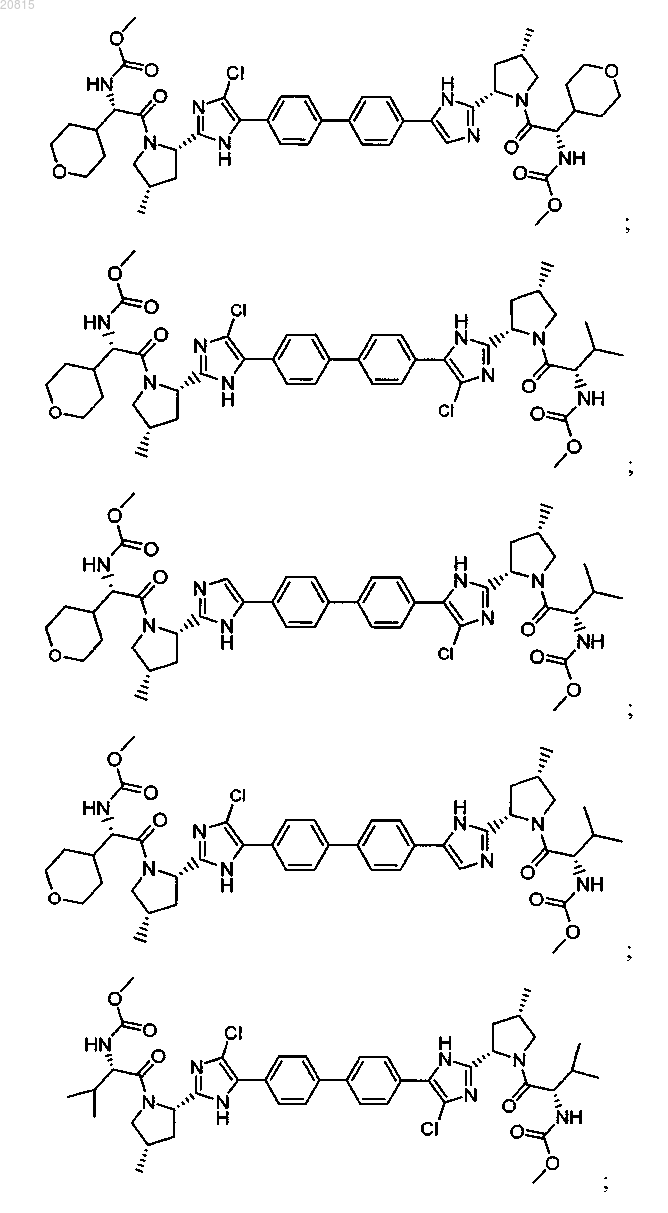
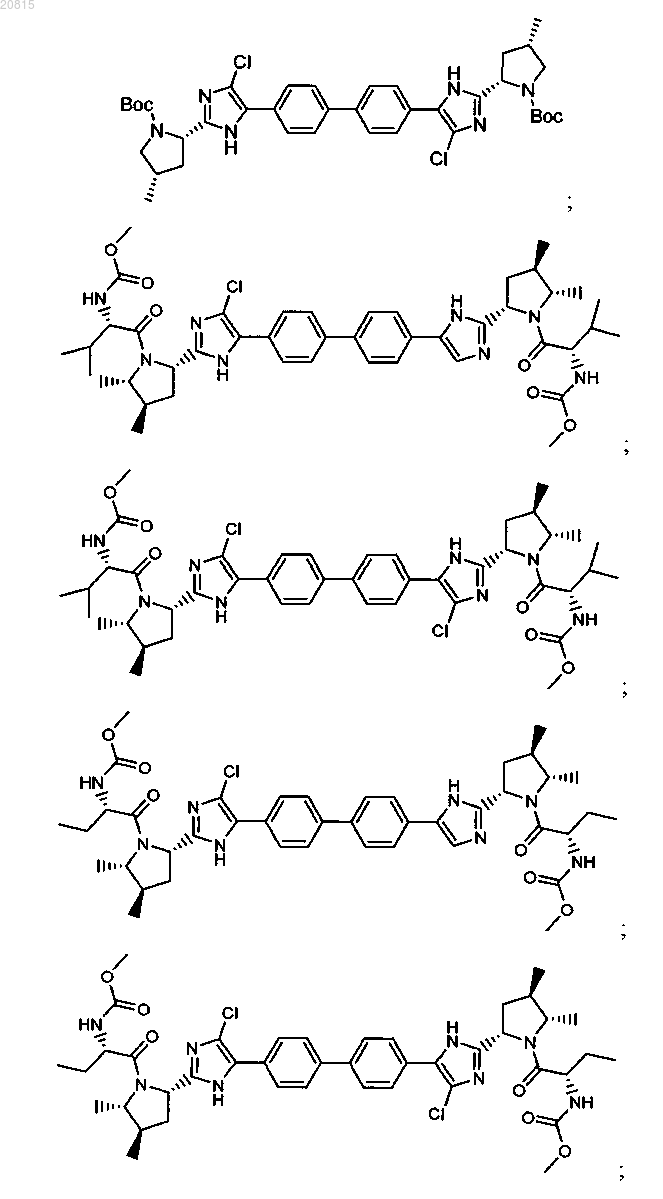
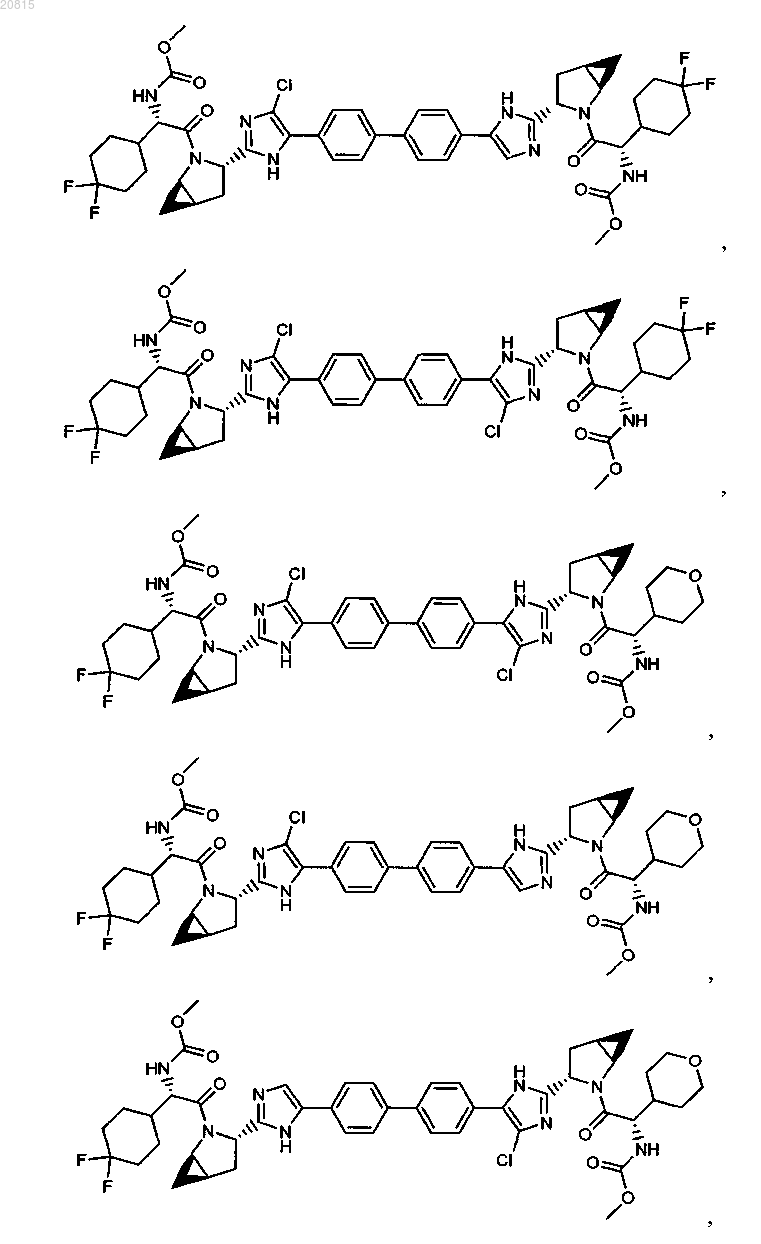

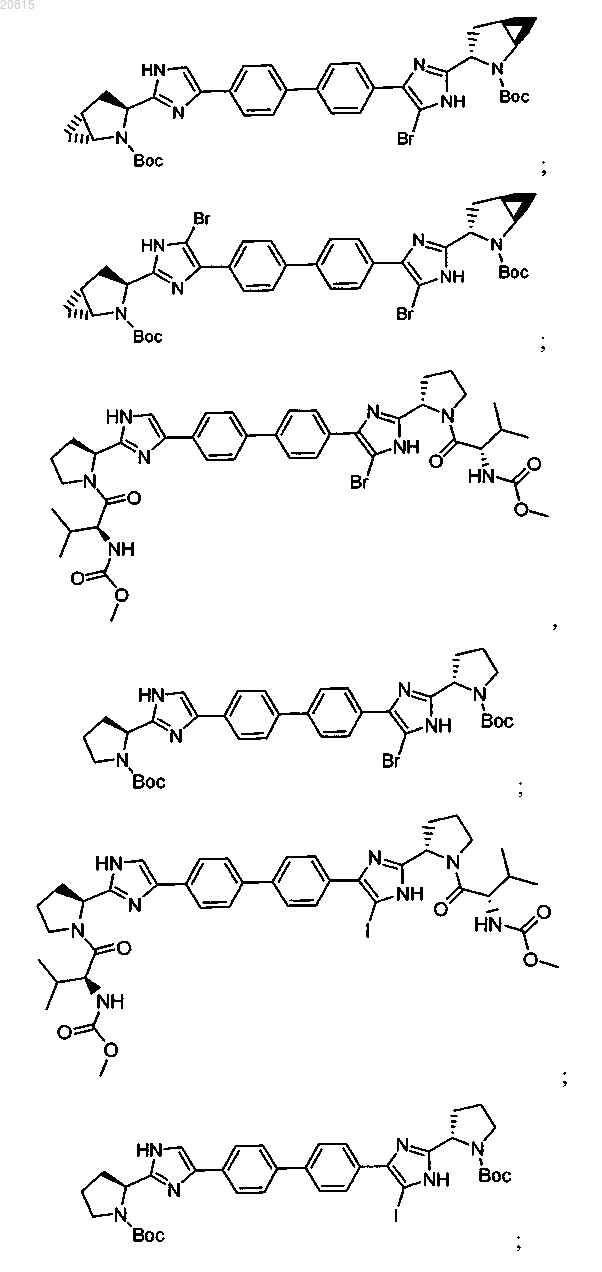
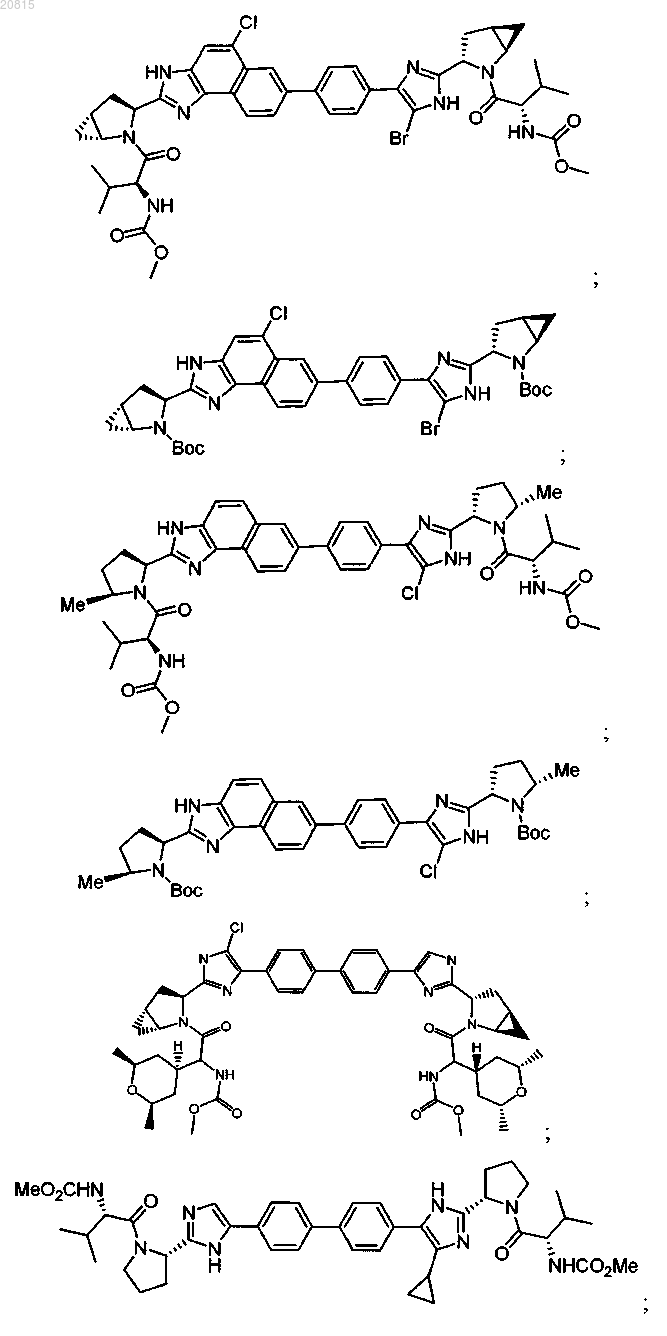
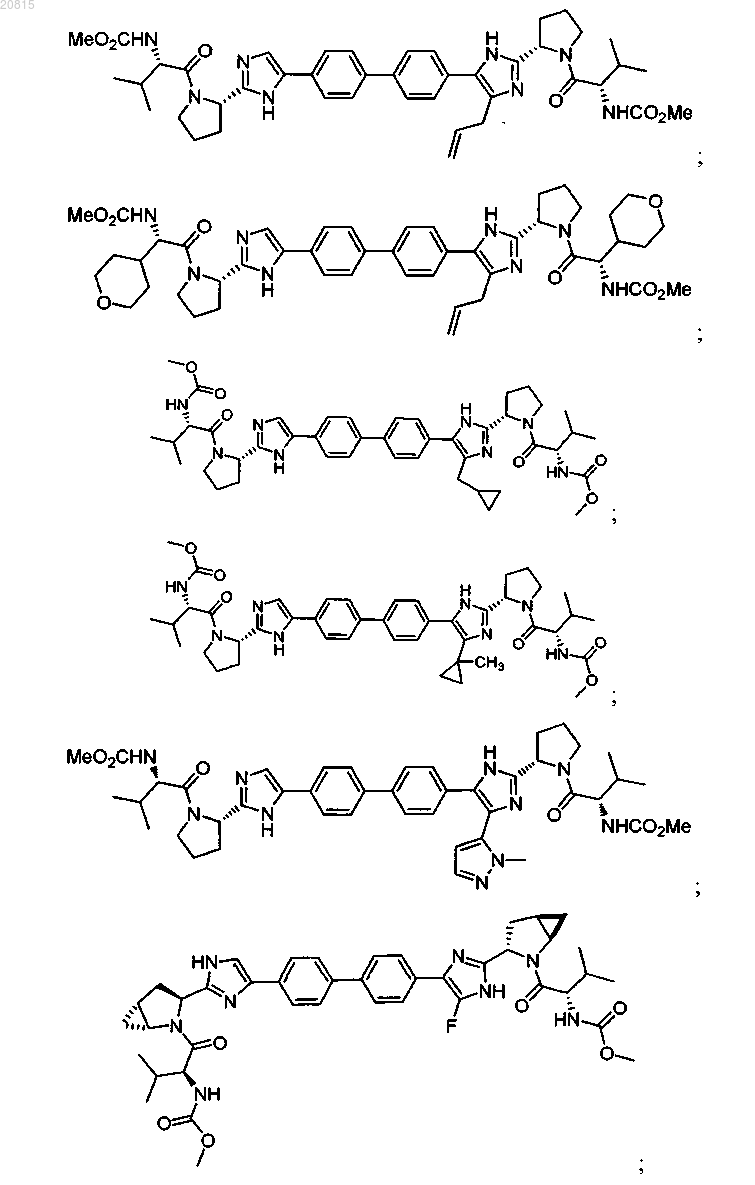
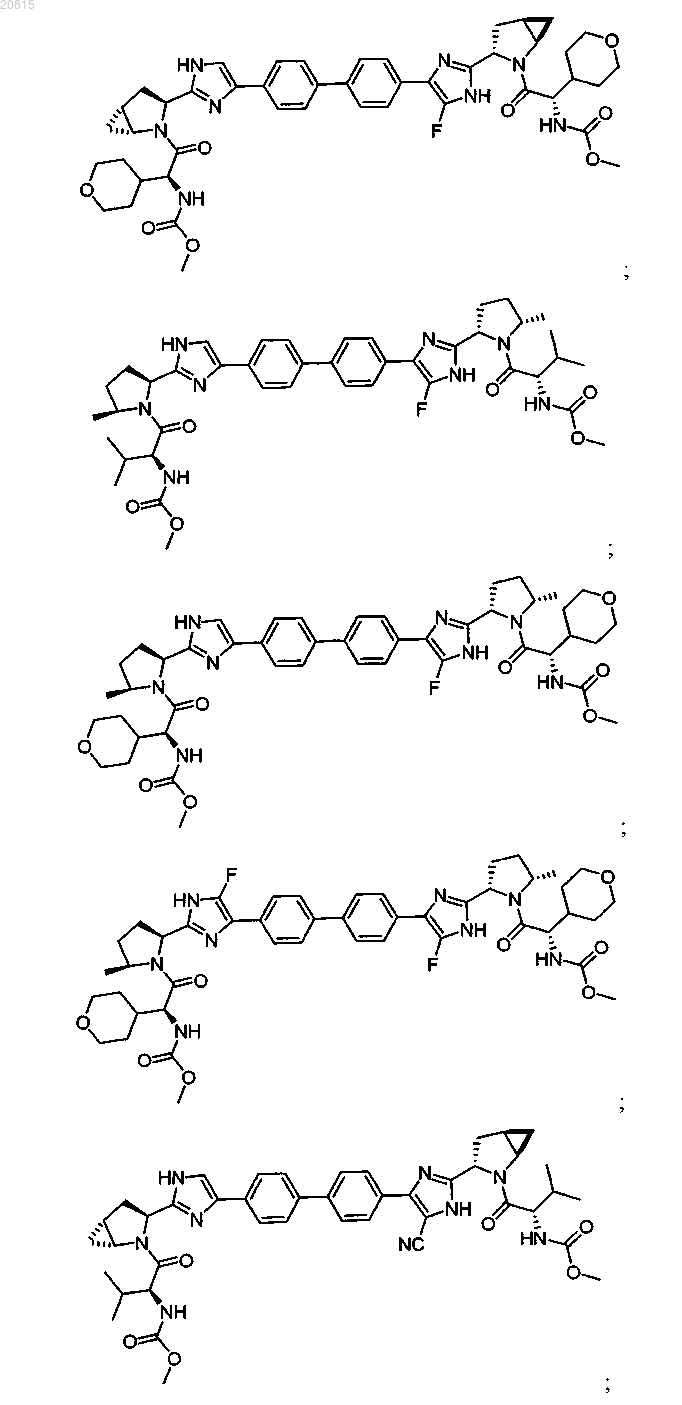
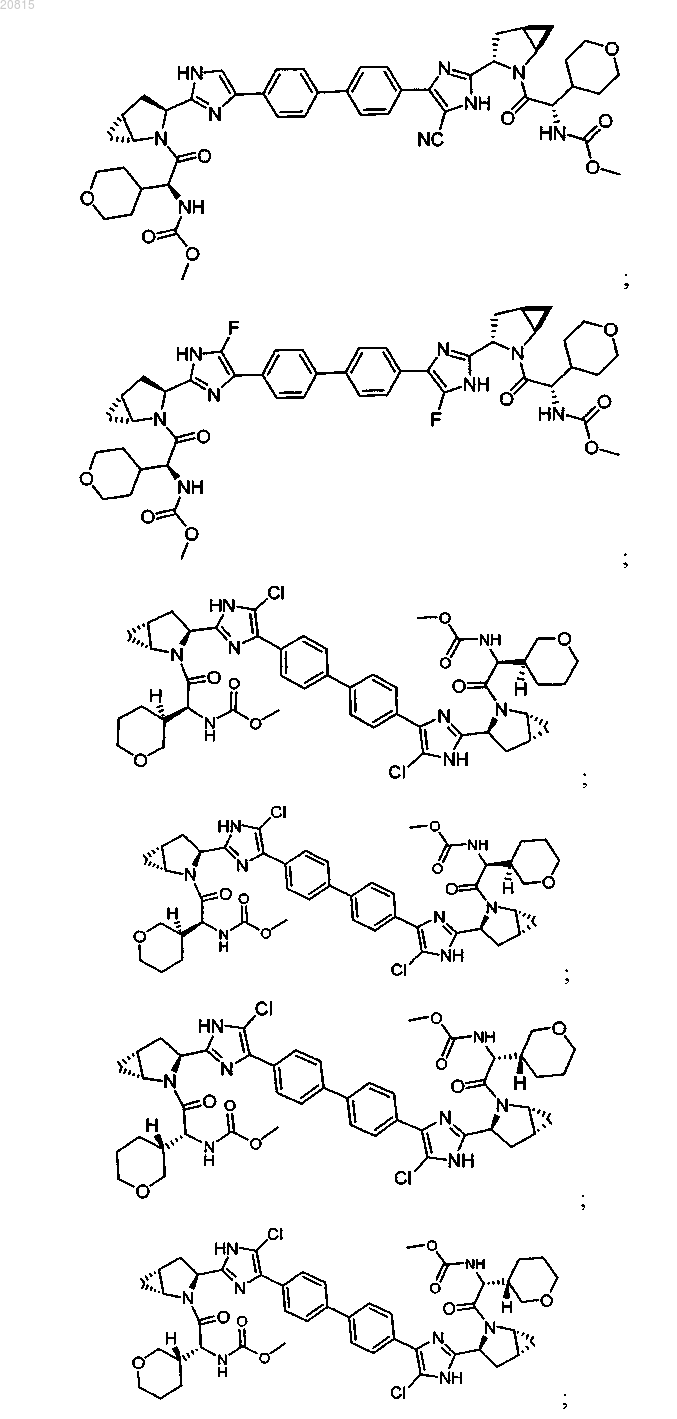
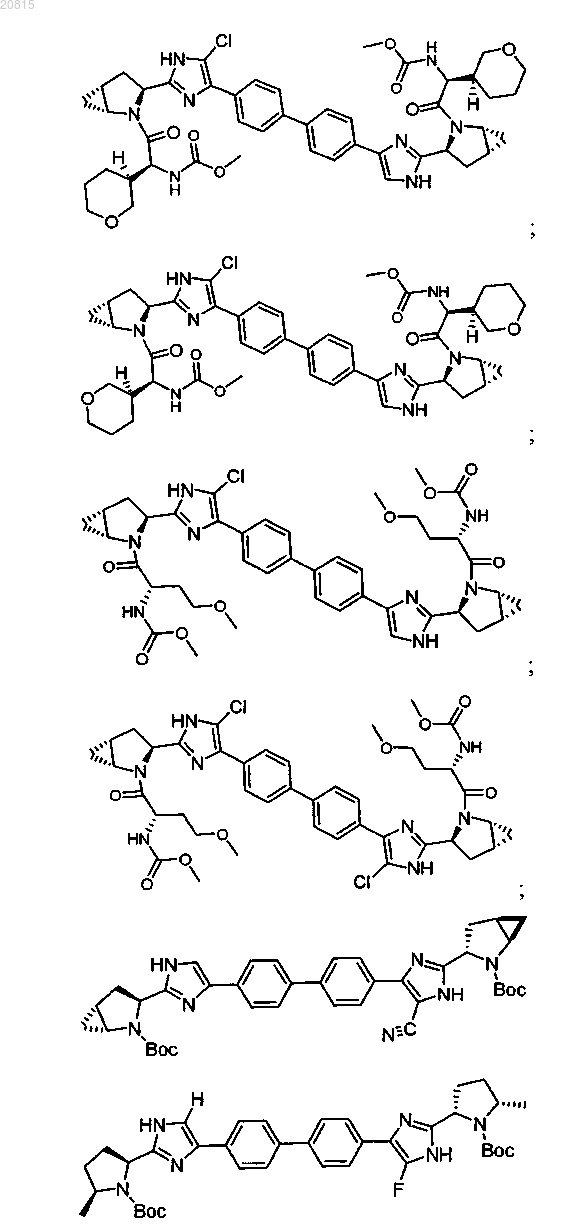
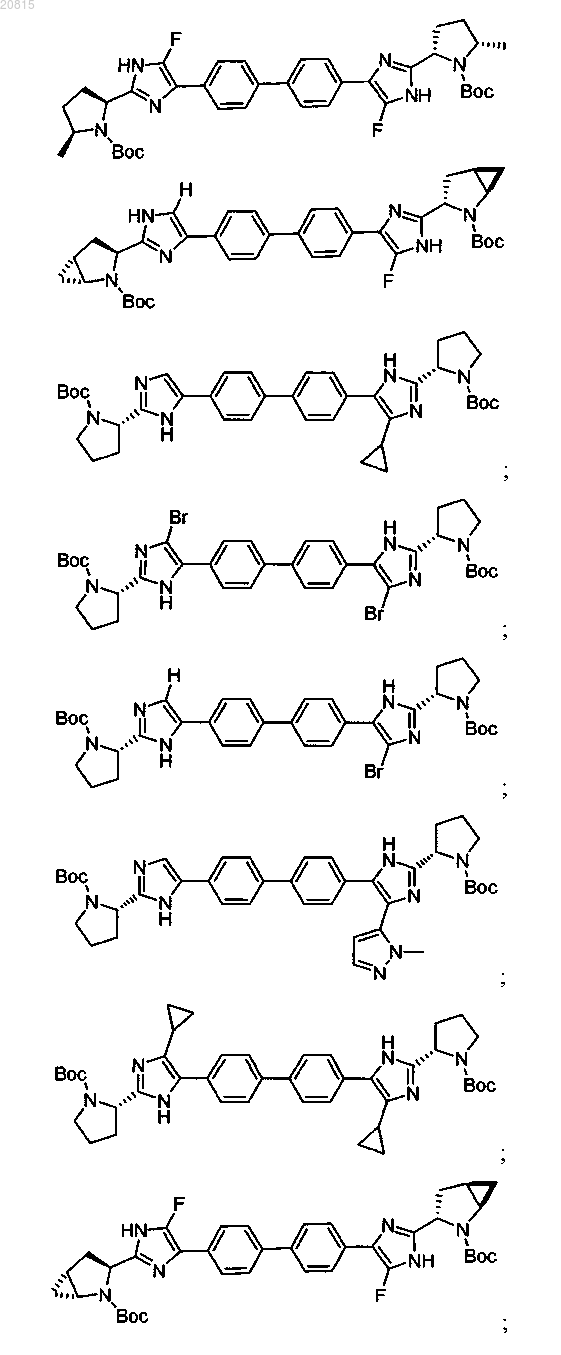
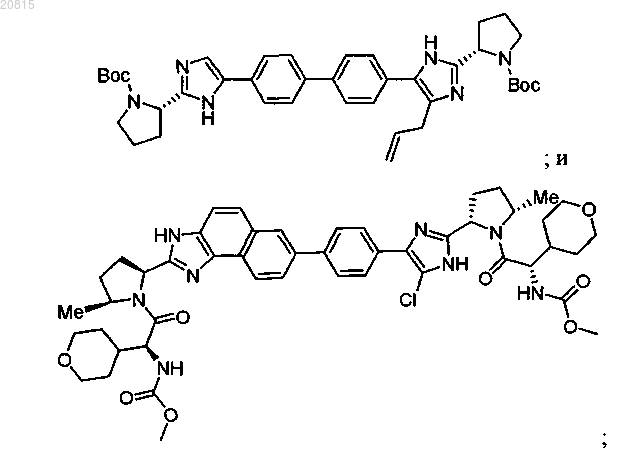
или его фармацевтически приемлемая соль.
7. Соединение, выбранное из
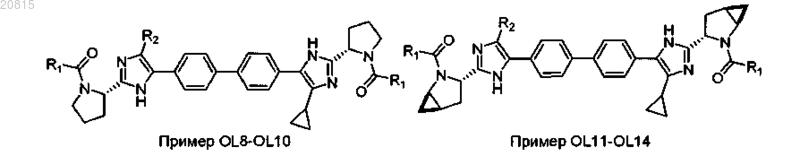
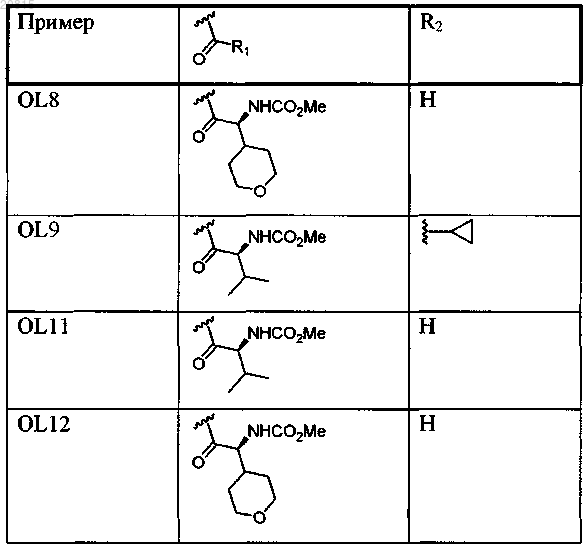
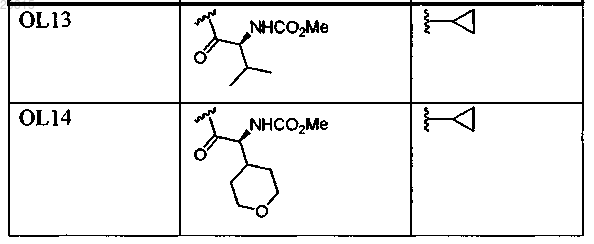

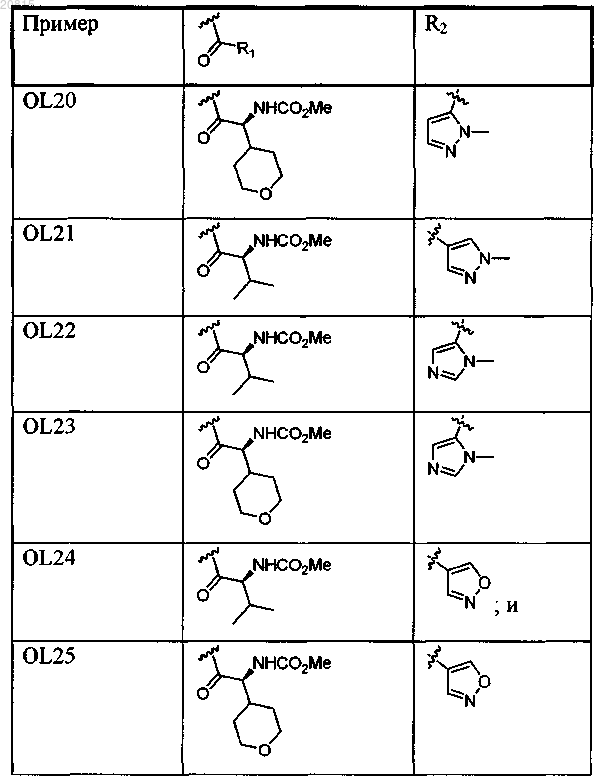
или его фармацевтически приемлемая соль.
8. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, дополнительно содержащая по меньшей мере одно дополнительное соединение, характеризующееся анти-HCV активностью.
10. Фармацевтическая композиция по п.9, в которой по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин.
11. Фармацевтическая композиция по п.10, в которой интерферон выбирают из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А и лимфобластоидного интерферона тау.
12. Фармацевтическая композиция по п.9, в которой по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа Т-хелперной клетки 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'-монофосфат-дегидрогеназы, амантадина и римантадина.
13. Фармацевтическая композиция по п.9, в которой по меньшей мере одно из дополнительных соединений эффективно ингибирует функции мишени, выбранной из металлопротеазы HCV, сериновой протеазы HCV, полимеразы HCV, геликазы HCV, белка NS4B HCV, входа HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH для лечения инфекции HCV.
14. Способ лечения инфекции HCV у пациента, предусматривающий введение пациенту терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
15. Способ по п.14, дополнительно предусматривающий введение по меньшей мере одного характеризующегося анти-HCV активностью дополнительного соединения перед введением, после введения или одновременно с введением соединения по п.1 или его фармацевтически приемлемой соли.
16. Способ по п.15, при котором по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин.
17. Способ по п.16, при котором интерферон выбирают из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А и лимфобластоидного интерферона тау.
18. Способ по п.15, при котором по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа Т-хелперной клетки 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'-монофосфатдегидрогеназы, амантадина и римантадина.
19. Способ по п.15, при котором по меньшей мере одно из дополнительных соединений эффективно для ингибирования функции мишени, выбранной из металлопротеазы HCV, сериновой протеазы HCV, полимеразы HCV, геликазы HCV, белка NS4B HCV, входа HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH для лечения инфекции HCV.
Текст
ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С Изобретение относится к соединениям, имеющим общую формулу (I), композициям и способам лечения инфекции вируса гепатита С (HCV). Изобретение также относится к фармацевтическим композициям, содержащим такие соединения, и способам применения этих соединений при лечении HCV инфекции. Белема Маконен, Ромине Джефри Ли,Нгуен Ван Н., Ван Гань, Лопез Омар Д., Сейнт Лорен Денис Р., Чэнь Ци,Бендер Джон А., Ян Чжун, Хевавасам Пиясена, Сюй Ниннин, Минвелл Николас А., Истер Джон А., Су БаоНин, Смит Майкл Дж. (US) Лыу Т.Н. (RU) Ссылка на родственные заявки Согласно настоящей заявке испрашивается приоритет на основании предварительной заявки США 61/286942, поданной 16 декабря 2009 г. Раскрытие в целом относится к противовирусным соединениям и более конкретно оно относится к соединениям, которые могут ингибировать функцию белка NS5A, кодируемого вирусом гепатита С(HCV), содержащим такие соединения композициям и способам ингибирования функции белка NS5A.HCV представляет собой один из основных человеческих патогенов, которым инфицировано приблизительно 170 миллионов человек в мире - примерно в пять раз больше, чем инфицированных вирусом иммунодефицита человека типа 1. У существенной части этих инфицированных HCV людей развивается серьезное прогрессирующее заболевание печени, включая цирроз и гепатоцеллюлярную карциному. Современный стандарт лечения HCV, при котором используют комбинацию пэгилированного интерферона и рибавирина, не характеризуется оптимальным процентом успешных попыток при достижении замедленного вирусного ответа и вызывает множество побочных эффектов. Таким образом, для решения этой актуальной медицинской проблемы существует четкая и давно назревшая потребность в разработке эффективных методов лечения.HCV представляет собой вирус, содержащий плюс-цепь РНК. На основе сравнения предсказанной аминокислотной последовательности и большого сходства в 5'-нетранслируемой области HCV классифицировали как отдельный род семейства Flaviviridae. Все члены семейства Flaviviridae характеризуются заключенными в оболочку вирионы, которые содержат геном в виде плюс-цепи РНК, кодирующий все известные вирусоспецифические белки посредством трансляции одной непрерывной открытой рамки считывания. Обнаружена значительная гетерогенность в пределах нуклеотидной и кодируемой аминокислотной последовательности по всему геному HCV из-за высокого коэффициента ошибок кодируемой не способной к коррекции РНК-зависимой РНК-полимеразы. По меньшей мере были охарактеризованы шесть основных генотипов и описано более 50 подтипов, распространенных в мире. Клиническая значимость геннной гетерогенности HCV показала склонность к появлению мутаций при монотерапевтическом лечении, следовательно, желаемыми являются дополнительные возможности выбора лечения. Возможный модулирующий эффект генотипов на патогенез и терапию остается невыясненным. Размер одноцепочечной РНК генома HCV приблизительно составляет 9500 нуклеотидов и содержит одну открытую рамку считывания (ORF), кодирующую один крупный полипротеин приблизительно из 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется по многим сайтам клеточными и вирусными протеазами с образованием структурных и неструктурных (NS) белков. В случаеHCV образование зрелых неструктурных белков (NS2, NS3, NS4A, NS4B, NS5A и NS5B) осуществляется двумя вирусными протеазами. Полагают, что первая представляет собой металлопротеазу и расщепляет соединение NS2-NS3; вторая представляет собой сериновую протеазу, которая содержится в N-концевой области NS3 (в настоящем документе также называемой NS3-протеазой) и опосредует все последующие расщепления ниже NS3, как в цис-положении в сайте расщепления NS3-NS4A и в трансположении в остальных сайтах NS4A-NS4B, NS4B-NS5A, NS5A-NS5B. Оказывается, что белок NS4A выполняет множество функций и действует как кофактор протеазы NS3, а также способствует размещению в мембранеNS3 и других вирусных репликазных компонентов. Образование комплекса NS3-NS4A необходимо для правильного функционирования протеазы, приводя к повышенной протеолитической эффективности процессов расщепления. Белок NS3 также проявляет нуклеозидтрифосфатазную и РНК-геликазную активности. NS5B (в настоящем документе также называемая полимераза HCV) представляет собой РНКзависимую РНК-полимеразу, которая участвует в репликации HCV наряду с другими белками HCV,включая NS5A, в составе репликазного комплекса. Желаемыми являются применимые для лечения инфицированных HCV пациентов соединения, которые селективно ингибируют вирусную репликацию HCV. В частности, желаемыми являются соединения, эффективно ингибирующие функцию белка NS5A. Белок NS5A HCV описан, например, в следующих ссылках: Tan, S.L. et al., Virology, 284:1-12 (2001); Park, K.-J. et al., J. Bid. Chem., 30711-30718 (2003);Biol. Chem., 281:9833 (2006); Huang, L., J. Biol. Chem., 280:36417 (2005); Rice, C. et al., WO 2006/093867. Согласно одному аспекту настоящее раскрытие относится к соединению формулы (I) или его фармацевтически приемлемой соли, гдеR1 и R2 вместе образуют -CH=CH- или -CH=CCl-; при условии, что по меньшей мере один из X и R2 не обозначает водород; каждый R3 представляет собой метил, или два R3 в положениях 3 и 4 пиролидинового кольца вместе с атомами углерода пиролидинового кольца образуют циклопропановое кольцо; каждый R4 независимо выбирают из третбутоксикарбонила, ацетила и N-(C1-С 2)алкоксикарбониламино(С 2-С 5)алканоил, где (С 2-С 5)алканоильный фрагмент может быть замещен 1-2 группами метокси или радикалом, выбранным из группы, включающей гидрокси, циклопропил, циклобутил, 4,4 дифторциклогексил, тетрагидропиран-4-ил, 2,6-диметилтетрагидропиран-4-ил. Согласно второму варианту осуществления первого аспекта настоящее раскрытие относится к соединению формулы (I) или его фармацевтически приемлемой соли, где X представляет собой галоген. Согласно третьему варианту осуществления первого аспекта R2 представляет собой галоген. Согласно четвертому варианту осуществления первого аспекта настоящее раскрытие относится к соединению формулы (I) или его фармацевтически приемлемой соли, где X представляет собой водород. Согласно второму аспекту настоящее раскрытие относится к композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Согласно первому варианту осуществления второго аспекта композиция дополнительно содержит по меньшей мере одно дополнительное соединение, характеризующееся анти-HCV активностью. Согласно второму варианту осуществления второго аспекта по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин. Согласно третьему варианту осуществления второго аспекта интерферон выбирают из интерферона альфа 2 В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона тау. Согласно четвертому варианту осуществления второго аспекта настоящее раскрытие относится к композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель и по меньшей мере одно дополнительное соединение, характеризующееся анти-HCV активностью, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа Тхелперной клетки 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'-монофосфатдегидрогеназы, амантадина и римантадина. Согласно пятому варианту осуществления второго аспекта настоящее раскрытие относится к композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, фармацевтически приемлемый носитель и по меньшей мере одно дополнительное соединение, характеризующееся анти-HCV активностью, где по меньшей мере одно из дополнительных соединений эффективно ингибирует функции мишени, выбранной из металлопротеазы HCV, сериновой протеазы HCV, полимеразыIMPDH для лечения инфекции HCV. Согласно третьему аспекту настоящее раскрытие относится к способу лечения инфекции HCV у пациента, предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно первому варианту осуществления третьего аспекта способ дополнительно предусматривает введение по меньшей мере одного дополнительного соединения, характеризующегося анти-HCV активностью перед введением, после введения или одновременно с введением соединения формулы (I) или его фармацевтически приемлемой солью. Согласно второму варианту осуществления третьего аспекта по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин. Согласно третьему варианту осуществления третьего аспекта интерферон выбирают из интерферона альфа 2 В, пэгилированного интерферона альфа,консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона тау. Согласно четвертому варианту осуществления третьего аспекта настоящее раскрытие относится к способу лечением инфекции HCV у пациента, предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного дополнительного соединения, характеризующегося анти-HCV активностью перед введением, после введения или одновременно с введением соединения формулы (I) или его фармацевтически приемлемой солью, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие ответа Тхелперной клетки 1 типа, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина, ингибитора инозин-5'-монофосфатдегидрогеназы, амантадина и римантадина. Согласно пятому варианту осуществления третьего аспекта настоящее раскрытие относится к способу лечения инфекции HCV у пациента, предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного дополнительного соединения, характеризующегося анти-HCV активностью перед введением, после введения или одновременно с введением соединения формулы (I) или его фармацевтиче-2 020815 ски приемлемой солью, где по меньшей мере одно из дополнительных соединений эффективно ингибирует функции мишени, выбранной из металлопротеазы HCV, сериновой протеазы HCV, полимеразыIMPDH для лечения инфекции HCV. Согласно другим аспектам настоящее описание может включать подходящие комбинации раскрытых здесь вариантов осуществления. Другие аспекты и варианты осуществления могут быть обнаружены в приведенном в настоящем документе описании. Здесь описание настоящего описания следует толковать в соответствии с правилами и принципами химического связывания. В некоторых случаях может быть необходимым удаление атома водорода для расположения заместителя в любом представленном положении. Следует понимать, что охватываемые настоящим раскрытием соединения являются подходяще стабильными для применения в качестве фармацевтического средства. Подразумевается, что определение любого заместителя или переменной в конкретном положении в молекуле будет зависеть от его определений в другом месте этой молекулы. Например, если оба R1 и R2 содержат R4 группу, две группы R4 могут быть одинаковыми или различными. Все патенты, заявки на выдачу патента и ссылки на литературу, цитируемые в описании, включены в настоящий документ посредством ссылки во всей полноте. В случае противоречий настоящее раскрытие, включая определения, будет иметь преимущество. Следующие используемые в настоящем описании термины характеризуются указанными значениями. Используемые в настоящем документе формы единственного числа подразумевают множественное,если в контексте четко не указано иное. Как описано в каждом из их соответствующего определения, если не указано иное, все арильные,циклоалкильные и гетероциклильные группы согласно настоящему описанию могут быть замещены. Например, описанная в определении термина "арил" арильная часть арилалкильной группы может быть замещена. Используемый в настоящем документе термин "алкенил" относится к группе из двух-шести атомов углерода с неразветвленной или разветвленной цепью, содержащей по меньшей мере одну углеродуглеродную двойную связь. Используемый в настоящем документе термин "алкенилокси" относится к алкенильной группе,присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "алкенилоксикарбонил" относится к алкенилоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "алкокси" относится к алкильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "алкоксиалкил" относится к алкильной группе, замещенной одной, двумя или тремя алкоксигруппами. Используемый в настоящем документе термин "алкоксиалкилкарбонил" относится к алкоксиалкильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "алкоксикарбонил" относится к алкоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "алкил" относится к группе, полученной из насыщенного углеводорода с неразветвленной или разветвленной цепью, содержащей от одного до шести атомов углерода. В соединениях согласно настоящему описанию, если R3 представляет собой алкил, алкил необязательно может образовывать конденсированное трех- или четырехчленное кольцо со смежным атомом углерода с получением показанной ниже структуры: где m выбирают из 1 и 2, где z равно 0, 1 или 2 и где Rs представляет собой алкил; или где алкил может необязательно образовывать спироциклическое трех- или четырехчленное кольцо с атомом углерода, к которому оно присоединено, с получением показанной ниже структуры: где m выбирают из 1 и 2; где z равно 0, 1 или 2 и где Rs представляет собой алкил. Используемый в настоящем документе термин "алкилкарбонил" относится к алкильной группе,-3 020815 присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "алкилкарбонилокси" относится к алкилкарбонильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "алкилсульфанил" относится к алкильной группе,присоединенной к исходному молекулярному фрагменту через атом серы. Используемый в настоящем документе термин "алкилсульфонил" относится к алкильной группе, присоединенной к исходному молекулярному фрагменту через сульфонильную группу. Используемый в настоящем документе термин "арил" относится к фенильной группе или бициклической конденсированной кольцевой системе, в которой одно или оба кольца представляют собой фенильную группу. Бициклические конденсированные кольцевые системы состоят из фенильной группы,конденсированной с четырех-шестичленным ароматическим или неароматическим карбоциклическим кольцом. Арильные группы согласно настоящему описанию могут быть присоединены к исходному молекулярному фрагменту через любой взаимозаменяемый атом углерода в группе. Типичные примеры арильных групп содержат без ограничения инданил, инденил, нафтил, фенил и тетрагидронафтил. Арильные группы согласно настоящему описанию необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкила, алкоксикарбонила, алкила, алкилкарбонила, второй арильной группы, арилалкокси, арилалкила, арилкарбонила, циано, галогена, галогеналкокси, галогеналкила, гетероциклила, гетероциклилалкила, гетероциклилкарбонила, гидрокси, гидроксиалкила, нитро, -NRxRy, (NRxRy)алкила, оксо и -P(O)OR2, где каждый R независимо выбирают из водорода и алкила; и где алкильная часть арилалкила и гетероциклилалкила является незамещенной и где вторая арильная группа, арильная часть арилалкила, арильная часть арилкарбонила, гетероциклил и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонила дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси, галогеналкила и нитро. Используемый в настоящем документе термин "арилалкокси" относится к арильной группе, присоединенной к исходному молекулярному фрагменту через алкоксигруппу. Используемый в настоящем документе термин "арилалкоксикарбонил" относится к арилалкоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "арилалкил" относится к алкильной группе, замещенной одной, двумя или тремя арильными группами. Кроме того, алкильная часть арилалкила необязательно замещена одной или двумя дополнительными группами, независимо выбранными из алкокси,алкилкарбонилокси, галогена, галогеналкокси, галогеналкила, гетероциклила, гидрокси и -NRcRd, где гетероциклил дополнительно необязательно замещен одним или двумя заместителями, независимо выбранными из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкоксикарбонила, галогена, галогеналкокси, галогеналкила, гидрокси, -NRxRy и оксо. Используемый в настоящем документе термин "арилалкилкарбонил" относится к арилалкильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "арилкарбонил" относится к арильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "арилокси" относится к арильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "арилоксикарбонил" относится к арилоксигруппе,присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "арилсульфонил" относится к арильной группе, присоединенной к исходному молекулярному фрагменту через сульфонильную группу. Используемый в настоящем документе термин "карбонил" относится к -C(O)-. Используемый в настоящем документе термин "карбокси" относится к -CO2H. Используемый в настоящем документе термин "циано" относится к -CN. Используемый в настоящем документе термин "циклоалкил" относится к насыщенной моноциклической, углеводородной кольцевой системе, содержащей от трех до семи атомов углерода, и которая не содержит гетероатомы. Типичные примеры циклоалкильных групп включают без ограничения циклопропил, циклобутил, циклопентил и циклогексил. Циклоалкильные группы согласно настоящему описанию необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси, алкила, арил, циано, галогена, галогеналкокси, галогеналкила,гетероциклила, гидрокси, гидроксиалкила, нитро и -NRxRy, где арил и гетероциклил дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси, галогеналкила, гидрокси и нитро. Используемый в настоящем документе термин "(циклоалкил)алкил" относится к алкильной группе,замещенной одной, двумя или тремя циклоалкильными группами. Используемый в настоящем документе термин "циклоалкилокси" относится к циклоалкильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "циклоалкилоксикарбонил" относится к циклоалкилоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу.-4 020815 Используемый в настоящем документе термин "циклоалкилсульфонил" относится к циклоалкильной группе, присоединенной к исходному молекулярному фрагменту через сульфонильную группу. Используемый в настоящем документе термин " формил" относится к -CHO. Используемый в настоящем документе термин "галоген" относится к Cl, Br, F или I. Используемый в настоящем документе термин "галогеналкокси" относится к галогеналкильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "галогеналкоксикарбонил" относится к галогеналкоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "галогеналкил" относится к алкильной группе, замещенной одним, двумя, тремя или четырьмя атомами галогена. Используемый в настоящем документе термин "гетероциклил" относится к четырех-, пяти-, шести- или семичленному кольцу, содержащему один, два, три или четыре гетероатома, независимо выбранных из азота, кислорода и серы. Четырехчленное кольцо не содержит двойные связи, пятичленное кольцо не содержит или содержит до двух двойных связей и шести- или семичленные кольца не содержат или содержат до трех двойных связей. Термин "гетероциклил" также подразумевает бициклические группы, в которых гетероциклильное кольцо конденсировано с другой моноциклической гетероциклильной группой, или четырех-шестичленное ароматическое или неароматическое карбоциклическое кольцо; а также такие разветвленные бициклические группы, как 7-азабицикло[2.2.1]гепт-7-ил, 2-азабицикло[2.2.2]окт-2-ил, 2,5-диазабицикло[2.2.1]гептан-2-ил и 2-азабицикло[2.2.2]окт-3-ил. Гетероциклильные группы согласно настоящему описанию могут быть присоединены к исходному молекулярному фрагменту через любой атом углерода или азот атом в группе. Примеры гетероциклильных групп включают без ограничения бензотиенил, фурил, имидазолил, индолинил, индолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, оксазолил, оксэтанил, пиперазинил, пиперидинил, пиразолил, пиридинил, пирролидинил, пирролопиридинил, пирролил, хинолинил,тетрагидрофуранил, тетрагидропиранил, тиазолил, тиенил и тиоморфолинил. Гетероциклильные группы согласно настоящему описанию необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкила, алкоксикарбонила, алкила,алкилкарбонила, арила, арилалкоксикарбонила, арилалкила, арилкарбонила, циано, галогена, галогеналкокси, галогеналкила, второй гетероциклильной группы, гетероциклилалкила, гетероциклилкарбонила,гидрокси, гидроксиалкила, нитро, -NRxRy, (NRxRy)алкила и оксо, где алкильная часть арилалкила и гетероциклилалкила являются незамещенными и где арил, арильная часть арилалкила, арильная часть арилкарбонила, вторая гетероциклильная группа и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонила дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси, галогеналкила и нитро. Используемый в настоящем документе термин "гетероциклилалкокси" относится к гетероциклильной группе, присоединенной к исходному молекулярному фрагменту через алкоксигруппу. Используемый в настоящем документе термин "гетероциклилалкоксикарбонил" относится к гетероциклилалкоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "гетероциклилалкил" относится к алкильной группе,замещенной одной, двумя или тремя гетероциклильными группами. Алкильная часть гетероциклилалкила дополнительно необязательно замещена одной или двумя дополнительными группами, независимо выбранными из алкокси, алкилкарбонилокси, арила, галогена,галогеналкокси, галогеналкила, гидрокси и -NRcRd, где арил дополнительно необязательно замещен одним или двумя заместителями, независимо выбранными из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкоксикарбонила, галогена, галогеналкокси, галогеналкила, гидрокси и -NRxRy. Используемый в настоящем документе термин "гетероциклилалкилкарбонил" относится к гетероциклилалкильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "гетероциклилкарбонил" относится к гетероциклильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "гетероциклилокси" относится к гетероциклильной группе, присоединенной к исходному молекулярному фрагменту через атом кислорода. Используемый в настоящем документе термин "гетероциклилоксикарбонил" относится к гетероциклилоксигруппе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "гидрокси" относится к -OH. Используемый в настоящем документе термин "гидроксиалкил" относится к алкильной группе, замещенной одной, двумя или тремя гидроксигруппами. Используемый в настоящем документе термин "гидроксиалкилкарбонил" относится к гидроксиалкильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "нитро" относится к -NO2. Используемый в настоя-5 020815 щем документе термин "-NRcRd" относится к двум группам, Rc и Rd, которые присоединены к исходному молекулярному фрагменту через атом азота. Rc и Rd независимо выбирают из водорода, алкенилоксикарбонила, алкоксиалкилкарбонила, алкоксикарбонила, алкила, алкилкарбонила, алкилсульфонила, арила,арилалкоксикарбонила, арилалкила, арилалкилкарбонила, арилкарбонила, арилоксикарбонила, арилсульфонила, циклоалкила, циклоалкилокси, циклоалкилоксикарбонила, циклоалкилсульфонила, формила, галогеналкоксикарбонила, гетероциклила, гетероциклилалкоксикарбонила, гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила, гетероциклилоксикарбонила, гидроксиалкилкарбонила, (NReRf)алкила, (NReRf)алкилкарбонила, (NReRf)карбонила, (NReRf)сульфонила, -C(NCN)OR' и-C(NCN)NRxRy, где R' выбирают из алкила и незамещенного фенила и где алкильная часть арилалкила,арилалкилкарбонила, гетероциклилалкила и гетероциклилалкилкарбонила дополнительно необязательно замещены одной -NReRf группой; и где арил, арильная часть арилалкоксикарбонила, арилалкила, арилалкилкарбонила, арилкарбонила, арилоксикарбонила и арилсульфонила, гетероциклила и гетероциклильная часть гетероциклилалкоксикарбонила, гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила и гетероциклилоксикарбонила дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси,галогеналкила и нитро. Используемый в настоящем документе термин "(NRcRd)алкенил" относится к где Rc и Rd определены в настоящем описании, и каждый Rq независимо представляет собой водород или C1-3 алкил. Используемый в настоящем документе термин "(NRcRd)алкил" относится к алкильной группе, замещенной одной, двумя или тремя -NRcRd группами. Алкильная часть (NRcRd)алкила дополнительно необязательно замещена одной или двумя дополнительными группами, выбранными из алкокси, алкоксиалкилкарбонила, алкоксикарбонила, алкилсульфанила, арилалкоксикарбонила, карбокси, циклоалкила,гетероциклила, гетероциклилкарбонила, гидрокси и (NReRf)карбонила; где гетероциклил дополнительно необязательно замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галогеналкокси, галогеналкила и нитро. Используемый в настоящем документе термин "-NReRf" относится к двум группам, Re и Rf, которые присоединены к исходному молекулярному фрагменту через атом азота. Re и Rf независимо выбирают из водорода, алкила, незамещенного арила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного (циклоалкил)алкила, незамещенного гетероциклила, незамещенного гетероциклилалкила,(NRxRy)алкила и (NRxRy)карбонила. Используемый в настоящем документе термин "(NReRf)алкил" относится к алкильной группе, замещенной одной, двумя или тремя -NReRf группами. Используемый в настоящем документе термин "(NReRf)алкилкарбонил" относится к (NReRf)алкильной группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "(NReRf)карбонил" относится к -NReRf группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "(NReRf)сульфонил" относится к -NReRf группе, присоединенной к исходному молекулярному фрагменту через сульфонильную группу. Используемый в настоящем документе термин "-NRxRy" относится к двум группам, Rx и Ry, которые присоединены к исходному молекулярному фрагменту через атом азота. Rx и Ry независимо выбирают из водорода, алкоксикарбонила, алкила, алкилкарбонила, незамещенного арила, незамещенного арилалкоксикарбонила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного гетероциклила и (NRx'Ry')карбонила, где Rx' и Ry' независимо выбирают из водорода и алкила. Используемый в настоящем документе термин "(NRxRy)алкил" относится к алкильной группе, замещенной одной, двумя или тремя -NRxRy группами. Используемый в настоящем документе термин "(NRxRy)карбонил" относится к -NRxRy группе, присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "-NRxRy", относится к двум группам, Rx и Ry, которые присоединены к исходному молекулярному фрагменту через атом азота. Rx и Ry независимо выбирают из водорода и алкила. Используемый в настоящем документе термин "(NRx'Ry')карбонил" относится к -NRx'Ry' группе,присоединенной к исходному молекулярному фрагменту через карбонильную группу. Используемый в настоящем документе термин "оксо" относится к =О. Используемый в настоящем документе термин "сульфонил" относится к -SO2-. В соединениях согласно настоящему изобретению существуют центры асимметрии. Эти центры обозначены символами "R" или "S" в зависимости от конфигурации заместителей вокруг хирального атома углерода. Следует понимать, что раскрытие охватывает все стереохимические изомерные формы-6 020815 или их смеси, которые обладают способностью ингибировать NS5A. Отдельные стереоизомеры соединений могут быть получены искусственно из коммерчески доступных исходных материалов, которые содержат хиральные центры, или получением смесей энантиомерных продуктов, с последующим разделением, таким как превращение в смесь диастереомеров, с последующим разделением или перекристаллизацией, хроматографическими методиками или посредством прямого разделения энантиомеров на хиральных хроматографических колонках. Исходные соединения конкретной стереохимии являются или коммерчески доступными, или могут быть получены и повторно растворены посредством известных из предшествующего уровня техники методик. Определенные соединения согласно настоящему описанию также могут существовать в различных стабильных конформационных формах, которые могут быть отделимыми. Асимметрия крутильных колебаний из-за ограниченного вращения вокруг асимметричной одинарной связи, например, из-за стерического затруднения или деформации кольца, может обеспечить возможность разделения различных конформационных изомеров. Настоящее раскрытие охватывает каждый конформационный изомер этих соединений и их смеси. Соединения согласно настоящему описанию также существуют в виде таутомеров; следовательно,настоящее раскрытие также охватывает все таутомерные формы. Подразумевается, что термин "соединения согласно настоящему описанию" и эквивалентные выражения охватывают соединения формулы (I) и их фармацевтически приемлемые энантиомеры, диастереомеры и соли. Подобным образом, если позволяет контекст, подразумевается, что ссылки на промежуточные соединения охватывают их соли. Подразумевается, что настоящее изобретение охватывает все изотопы атомов, которые встречаются в настоящих соединениях. Изотопы включают такие атомы, которые характеризуются одинаковым атомным числом, но разными массовыми числами. В качестве общего примера и без ограничения изотопы водорода включают дейтерий и тритий. Изотопы углерода включают 13 С и 14 С. Как правило, с применением соответствующего меченного изотопом реагента вместо использованного в ином случае немеченого реагента известными специалистам в данной области техники традиционными методиками или способами, аналогичными описанным в настоящем документе, могут быть получены меченные изотопами соединения согласно настоящему изобретению. Такие соединения могут характеризоваться разнообразными возможными использованиями, например, в качестве стандартов и реагентов при определении биологической активности. В случае стабильных изотопов такие соединения также могут характеризоваться возможностью благоприятно модифицировать биологические, фармакологические или фармакокинетические свойства. Соединения согласно настоящему описанию могут существовать в виде фармацевтически приемлемых солей. Используемый в настоящем документе термин "фармацевтически приемлемая соль" относится к солям или цвиттерионным формам соединений согласно настоящему описанию, которые растворимы в воде или в масле или являются диспергируемыми, которые в пределах результатов объема тщательной медицинской оценки подходят для применения при контакте с тканями пациентов без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или усложнения в соответствии с допустимым соотношением польза/риск, и они являются эффективными для их предполагаемого применения. Соли могут быть получены во время заключительного выделения и очистки соединений или отдельно путем осуществления взаимодействия подходящего атома азота с подходящей кислотой. Типичные кислотно-аддитивные соли включают ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфоросульфонат; диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, формиат, фумарат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталенсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат,пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, птолуолсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы с образованием фармацевтически приемлемых аддитивных солей, включают неорганические кислоты, такие как хлористо-водородная, бромисто-водородная, серная и фосфорная, и органические кислоты, такие как щавелевая, малеиновая, янтарная и лимонная. Основно-аддитивные соли могут быть получены во время заключительного выделения и очистки соединений путем осуществления взаимодействия карбоксигруппы с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла или с аммиаком или с органическим первичным,вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают литий, натрий, калий, кальций, магний и алюминий, а также нетоксичные катионы аминов, таких как аммоний,тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин,дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенэтиламин и N,N'-дибензилэтилендиамин. Другие типичные применимые для образования основно-аддитивных солей органические амины включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. При возможности для применения в терапии терапевтически эффективные количества соединения формулы (I), а также его фармацевтически приемлемые соли, могут быть введены в качестве неочищенных химических веществ, актив-7 020815 ный ингредиент может быть представлен в качестве фармацевтической композиции. Соответственно,раскрытие дополнительно относится к фармацевтическим композициям, которые содержат терапевтически эффективные количества соединений формулы (I) или его фармацевтически приемлемые соли и один или несколько фармацевтически приемлемых носителей, разбавителей или наполнителей. Используемый в настоящем документе термин "терапевтически эффективное количество" относится к общему количеству каждого активного компонента, которого достаточно, чтобы принести пациенту значительную пользу, например, долговременное снижение вирусной нагрузки. При применении к отдельному и введенному отдельно активному ингредиенту термин относится к одному ингредиенту. При применении к комбинации термин относится к комбинированным количествам активных ингредиентов, что приводит к терапевтическому эффекту независимо от того, будут ли они введены в комбинации, периодически или одновременно. Соединения формулы (I) и их фармацевтически приемлемые соли таковы, как описано выше. Носитель(и), разбавитель(и) или наполнитель(и) должны быть приемлемыми в смысле соответствия с другими ингредиентами состава и не должны быть вредными для пациента. В соответствии с другим аспектом настоящее описание также относится к способу получения фармацевтического состава,предусматривающему смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или наполнителями. Используемый в настоящем документе термин "фармацевтически приемлемый" относится к соединениям, материалам, композициям и/или лекарственным формам, которые по результатам тщательного медицинского обследования подходят для применения во взаимодействии с тканями пациентов без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения в соответствии с разумным соотношением польза/риск, и они являются эффективными для их предполагаемого применения. Фармацевтические составы могут присутствовать в стандартных формах дозировки, содержащих предопределенное количество активного ингредиента на стандартную дозу. Уровни дозировки от приблизительно 0,01 до приблизительно 250 мг/кг массы тела в сутки, предпочтительно от приблизительно 0,05 до приблизительно 100 мг/кг массы тела в сутки соединений согласно настоящему описанию являются типичными в монотерапии для профилактики и лечения опосредованного HCV заболевания. Типично, фармацевтические композиции согласно настоящему раскрытию будут введены от приблизительно 1 до приблизительно 5 раз в сутки или альтернативно способом непрерывного вливания. Такое введение может быть использовано в качестве хронической или острой терапии. Количество активного ингредиента, который может быть объединен с материалами носителя с получением разовой лекарственной формы, будет изменяться в зависимости от состояния, по поводу которого проводят лечение, тяжести состояния, времени введения, пути введения, скорости выведения используемого соединения, длительности лечения и возраста, пола, массы тела и состояния пациента. Как изложено в настоящем документе,предпочтительный стандартный лекарственный состав содержит ежедневную дозу или поддозу активного ингредиента или ее надлежащую часть. Как правило, лечение начинали небольшими дозами, значительно меньшими, чем оптимальная доза соединения. Далее, дозу увеличивали небольшими добавлениями до достижения при таких обстоятельствах оптимального эффекта. В основном, соединение наиболее желательно вводить до уровня концентрации, который, как правило, будет обеспечивать эффективные противовирусные результаты, не вызывая при этом каких-либо вредных или губительных побочных эффектов. Если композиции согласно настоящему раскрытию содержат комбинацию соединения согласно настоящему описанию и одно или несколько дополнительных терапевтических или профилактических средств, то и соединение, и дополнительное средство обычно присутствуют в дозировке от приблизительно 10 до 150% и более предпочтительно от приблизительно 10 до 80% дозы, которую обычно вводят при режиме монотерапии. Фармацевтические составы могут быть приспособлены для введения любым подходящим путем, например пероральным (включая буккальный или сублингвальный), ректальным,назальным, местным (включая буккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожный, внутрикожный, внутримышечный, внутриартикулярный, внутрисуставной, надчревный, подоболочечный, вводимый внутрь пораженных тканей, внутривенный или подкожной инъекцией или вливаниями) путем. Такие составы могут быть получены любым известным из уровня техники фармации способом, например, посредством связывания активного ингредиента с носителем(ями) или наполнителем(ями). Предпочтительным является пероральное введение или введение в виде инъекции. Приспособленные для перорального введения фармацевтические составы могут быть представлены в виде отдельных единиц, таких как капсулы или таблетки, порошки или гранулы, растворы или суспензии в водных или неводных жидкостях, пищевые пены или крем, или жидкие эмульсии масло-в-воде или эмульсии вода-в-масле. Например, для перорального введения в форме таблетки или капсулы компонент активного лекарственного средства может быть объединен с таким пероральным нетоксичным фармацевтически приемлемым инертным носителем, как этанол, глицерин, вода и т.п. Порошки готовят посредством измельчения соединения до подходящего мелкого размера и посредством смешивания с аналогично измельчен-8 020815 ным фармацевтическим носителем, таким как пищевой углевод, например крахмал или маннит. Также могут присутствовать ароматизаторы, консерванты, диспергаторы и красители. Капсулы готовят получением смеси порошка, как описано выше, и заполнением образованных желатиновых оболочек. Перед заполнением скользящие вещества и смазывающие вещества, такие как коллоидная окись кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, могут быть добавлены к смеси порошка. Для улучшения использования лекарственного препарата при проглатывании капсулы также могут быть добавлены разрыхлители или солюбилизаторы, такие как агар-агар,карбонат кальция или карбонат натрия. Более того, при желании или необходимости в смесь также могут быть включены подходящие связующие вещества, смазывающие вещества, разрыхлители и красители. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузные подсластители, природные и синтетические камеди, такие как гуммиарабик, трагакант или альгинат натрия,карбоксиметилцеллюлоза, полиэтиленгликоль и т.п. Используемые в этих лекарственных формах смазывающие вещества включают олеат натрия, хлорид натрия и т.п. Разрыхлители включают без ограничения крахмал, метилцеллюлозу, агар, бетонит, ксантановую камедь и т.п. Таблетки составляют, например,получением смеси порошка, гранулирования или комкования, добавлением смазывающего средства и разрыхлителя и прессованием в таблетки. Смесь порошка получали смешиванием подходяще измельченного соединения с разбавителем или основой, как описано выше, и необязательно со связующим веществом, таким как карбоксиметилцеллюлоза, альгинат, желирующее средство или поливинилпирролидон, ингибитором растворения, таким как парафин, усилителем всасывания, таким как четвертичная соль, и/или поглощающим веществом, таким как бентонит, каолин или двузамещенный фосфат кальция. Смесь порошка может быть гранулирована смачиванием связующим веществом, таким как сироп, паста крахмала, гуммиарабик, или растворами целлюлозных или полимерных материалов, и выдавливанием через сито. В качестве альтернативы гранулированию смесь порошка может быть пропущена через таблетировочную машину и результатом является неполностью сформированные массы, разделенные на гранулы. Гранулы могут быть смазаны для предупреждения прилипания к формам для формования таблеток посредством добавления стеариновой кислоты, стеарата соли, талька или минерального масла. Смазанную смесь затем спрессовывают в таблетки. Соединения согласно настоящему описанию также могут быть объединены с легкосыпучим инертным носителем и сжаты в таблетки сразу без стадий гранулирования или комкования. Может быть обеспечено прозрачное или матовое защитное покрытие, состоящее из герметизирующего покрытия из шеллака, покрытия из сахара или полимерного материала, и глянцевое покрытие из воска. К этим покрытиям могут быть добавлены красители для различения разных единиц дозировки. Пероральные жидкости, такие как раствор, сиропы и эликсиры, могут быть получены в разовой лекарственной форме, таким образом, данное количество содержит заданное количество соединения. Сиропы могут быть получены путем растворения соединения в подходяще ароматизированном водном растворе, тогда как эликсиры получают путем применения нетоксичных носителей. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленсорбитановые эфиры, консерванты, ароматизаторы, такие как масло мяты перечной, или природные подсластители или сахарин или другие искусственные подсластители и т.п. По необходимости составы разовой формы для перорального введения могут быть микроинкапсулированными. Состав также может быть получен для пролонгирования или способствования высвобождению, например, посредством покрытия или заключения материала частиц в полимеры, воск или подобное. Соединения формулы (I) их и фармацевтически приемлемые соли также могут быть введены в форме системы доставки липосомы, такой как небольшие моноламеллярные везикулы, большие моноламеллярные везикулы и многоламеллярные везикулы. Липосомы могут быть образованы из разнообразных фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть доставлены путем применения моноклональных антител в качестве индивидуальных носителей, с которыми соединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливаемых носителей лекарственного средства. Такие полимеры могут содержать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксидполилизин, замещенный остатками палитоила. Кроме того, соединения могут быть объединены в класс биоразлагаемых полимеров, применимый при достижении регулируемого высвобождения лекарственного средства, например, полимолочной кислоты, полиэпсилонкапролактона, полигидроксимасляной кислоты, сложных полиортоэфиров, полиацеталей, полидигидропиранов,полицианоакрилатов и сшитых или амфипатических блок-сополимеров гидрогелей. Приспособленные для трансдермального введения фармацевтические составы могут находиться в виде отдельных пластырей, которые предназначены оставаться в непосредственном контакте с эпидермисом пациента длительный период времени. Например, активный ингредиент может быть доставлен из пластыря посредством ионофореза, как в-9 020815 общем описано в Pharmaceutical Research, 3(6):318 (1986). Приспособленные для местного нанесения фармацевтические составы могут быть составлены в качестве мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или другой наружной ткани, например ротовой полости и кожи, составы предпочтительно наносят в качестве местно наносимой мази или крема. При составлении в виде мази активный ингредиент может быть использован или с парафиновой, или со смешиваемой с водой мазевой основой. Альтернативно, активный ингредиент может быть составлен в виде крема с кремовой основой масло-вводе или основанием вода-в-масле. Приспособленные для местных нанесений на глаз фармацевтические составы включают в себя глазные капли, где активный ингредиент растворяют или суспендируют в подходящем носителе, особенно в водном растворителе. Приспособленные для местного введения в ротовую полость фармацевтические составы включают в себя лепешки, пастилки и жидкости для полоскания рта. Приспособленные для ректального введения фармацевтические составы могут находиться в виде суппозиториев или в виде клизм. Приспособленные для назального введения фармацевтические составы, в которых твердый носитель, включают крупный порошок с размером частиц, например, в диапазоне от 20 до 500 мкм, которые вводят втягивания носом, т.е. путем быстрого вдыхания порошка через носовой ход из контейнера, который держат близко к носу. Подходящие составы для введения в виде назального спрея или капель для носа, в которых носитель жидкий, включают водные или масляные растворы активного ингредиента. Приспособленные для введения путем ингаляции фармацевтические составы включают пудру или аэрозоли, которые могут быть образованы при помощи различных типов измеренных, дозирующих ингаляторов под давлением, распылителей или инсуффляторов. Приспособленные для вагинального введения фармацевтические составы могут находиться в качестве составов для пессариев, тампонов, кремов, гелей, паст, пен или спрея. Приспособленные для парентерального введения фармацевтические составы включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и растворенные вещества, придающие составу изотоничность относительно крови предполагаемого пациента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие средства и загустители. Составы могут быть представлены в контейнерах для одноразовой дозы или для многократных доз, например, в герметизированных ампулах и флаконах, и могут сохраняться при условиях сушки сублимацией (лиофилизированных), при которых требуется только добавление стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Приготовленные для немедленного приема растворы для инъекций и суспензии могут быть получены из стерильных порошков, гранул и таблеток. Следует понимать, что при добавлении к упомянутым выше конкретным ингредиентам составы могут включать другие средства, общепринятые в настоящем уровне техники, которые имеют отношение к типу рассматриваемого состава, например, подходящие для перорального введения могут включать ароматизаторы. Термин "пациент" относится как к человеку, так и к другим млекопитающим. Термин "лечение" относится к (i) профилактике заболевания, нарушения или состояния, возникающего у пациента, когда он может быть предрасположен к заболеванию, нарушению и/или состоянию, но его наличие еще не диагностировано; (ii) ингибированию заболевания, нарушения или состояния, т.е. подавлению его развития; и (iii) ослаблению заболевания, нарушения или состояния, т.е. вызыванию регрессии заболевания, нарушения или состояния. Соединения согласно настоящему описанию также могут быть введены с циклоспорином, например циклоспорином А. При клинических испытаниях была показана активность циклоспорина А относительно HCV (Hepatology, 38:1282 (2003); Biochem. Biophys. Res. Commun., 313:42 (2004); J. Gastroenterol.,38:567 (2003. В табл. 1 ниже представлены некоторые типичные примеры соединений, которые могут быть введены с соединениями согласно настоящему раскрытию. Соединения согласно настоящему раскрытию могут быть введены с другими соединениями с анти-HCV активностью при комбинированной терапии или совместно, или отдельно, или посредством объединения соединений в композицию.- 12020815 Соединения согласно настоящему описанию также могут быть использованы в качестве лабораторных реагентов. Соединения могут способствовать обеспечению инструментов для исследования для планирования анализа вирусной репликации, проверки систем для анализа животных и структурных биологических исследований для дополнительного увеличения информации о механизмах заболевания HCV. Кроме того, соединения согласно настоящему описанию применимы в установлении или определении участка связывания других противовирусных соединений, например, посредством конкурентного ингибирования. Соединения согласно настоящему раскрытию также могут быть использованы для лечения или предупреждения вирусного инфицирования веществ и, следовательно, они снижают риск вирусной инфекции в лаборатории или у медперсонала, или у пациентов, у которых возникает контакт с таким веществами, например кровь, ткань, хирургические инструменты и одежда, лабораторные приборы и одежда,и аппараты и материалы для взятия или переливания крови. Предусматривается, что настоящее раскрытие охватывает соединения формулы (I), если они получены путем синтеза или метаболическим процессом, включая процессы, проходящие в человеческом или животном организме (in vivo) или процессы, проходящие in vitro. Используемые в настоящей заявке аббревиатуры, особенно те, которые включены в следующие типичные примеры, хорошо известны специалистам в данной области техники. Кроме того, используют следующие аббревиатуры: прибл. - приблизительно; мин - минуты; ч - часы; к.т. - комнатная температура, RT - время удержания; Rt - время удержания; TFA - трифторуксусная кислота; DMSO - диметилсульфоксид; Me - метил; THF - тетрагидрофуран; t-Bu - трет-бутил; EDCI - 1-(3-диметиламинопропил)-3 этилкарбодиимида гидрохлорид; DMAP - 4-диметиламинопиридин; DBU - 1,8-диазабициклоундек-7-ен;DME - 1,2-диметоксиэтан; и EEDQ - N-этоксикарбонил-2-этокси-1,2-дигидрохинолин. Настоящее раскрытие будет описано в связи с определенными вариантами осуществления, которые не предназначены ограничивать его объем. Напротив, настоящее раскрытие охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в объем формулы изобретения. Таким образом, в следующих примерах, которые включают конкретные варианты осуществления, будет показано одно осуществление на практике настоящего описания; было понятно, что примеры представлены с целью иллюстрации определенных вариантов осуществления и представлены для обеспечения предполагаемого наиболее применимого и легкопонятного описания их методик и принципиальных аспектов. Исходные материалы могут быть получены из коммерческих источников или получены традиционными способами из литературы, известными специалистам в данной области техники. Синтез общих Сар Условия анализа соединений Оценку чистоты и массовый анализ с низким разрешением проводили на системе Shimadzu LC вместе с системой Waters MICROMASS ZQ MS. Следует отметить, что время удерживания между приборами может слегка изменяться. Если не отмечено иное, к текущему разделу применимы дополнительные условия LC.(R)-2-(Диметиламино)-2-фенилуксусная кислота Суспензию 10% Pd/C (2,0 г) в метаноле (10 мл) добавляли в смесь (R)-2-фенилглицина (10 г, 66,2 ммоль), формальдегида (33 мл, 37 мас.%, в воде), 1 н. HCl (30 мл) и метанола (30 мл) и подвергали действию H2 (60 фунт/кв.дюйм) в течение 3 ч. Реакционную смесь фильтровали через диатомитовую землю(CELITE) и фильтрат концентрировали в вакууме. Полученное неочищенное вещество перекристаллизовывали из изопропанола с получением соли HCl Сар-1 в виде белых игл (4,0 г). Оптическое вращение:-117,1 [с = 9,95 мг/мл в Н 2 О; X = 589 нм]. 1H ЯМР (DMSO-d6,= 2,5 м.д., 500 МГц):7,43-7,34 (m, 5H),4,14 (s, 1H), 2,43 (s, 6H); LC (условие I): RT = 0,25; LC-MS: аналитически рассчитано для [M+H]+C10H14NO2 180.10; обнаружено 180,17; HRMS: аналитически рассчитано для [M+H]+ C10H14NO2 180,1025; обнаружено 180,1017. Сар-2NaBH3CN (6,22 г, 94 ммоль) добавляли порционно в течение нескольких минут в охлажденную(лед/вода) смесь (R)-2-фенилглицина (6,02 г, 39,8 ммоль) и метанола (100 мл), и перемешивали в течение 5 мин. В течение 10 мин по каплям добавляли ацетальдегид (10 мл) и перемешивание продолжали при той же температуре охлаждения в течение 45 мин и при температуре окружающей среды в течение 6,5 ч. Реакционную смесь снова охлаждали на бане с водой и льдом, обрабатывали водой (3 мл) и затем гасили добавлением по каплям концентрированной HCl в течение 45 мин до получения pH смеси 1,52,0. Охлаждающую баню удаляли и перемешивание продолжали при добавлении концентрированнойHCl с поддержанием pH смеси приблизительно 1,5-2,0. Реакционную смесь перемешивали в течение ночи, фильтровали с удалением белой суспензии и фильтрат концентрировали в вакууме. Неочищенное вещество перекристаллизовывали из этанола с получением соли HCl Сар-2 в виде двух партий блестящего белого твердого вещества (партия-1: 4,16 г; партия-2: 2,19 г). 1H ЯМР (DMSO-d6,= 2,5 м.д., 400 МГц): 10,44 (1,00, br s, 1H), 7,66 (m, 2H), 7,51 (m, 3H), 5,30 (s, 1H), 3,15 (br m, 2H), 2,98 (br m, 2H), 1,20 (арр brs, 6H). Партия-1: []25 -102,21 (с = 0,357, Н 2 О); партия-2: []25 -99,7 (с = 0,357, Н 2 О). LC (условие I): RT = 0,43 мин; LC-MS: аналитически рассчитано для [M+H]+ C12H18NO2: 208,13; обнаружено 208,26. Сар-3HCl (30 мл) и метанола (40 мл). Охлаждающую баню удаляли и реакционную смесь перемешивали с Н 2 из баллона в течение 17 ч. Добавляли дополнительное количество ацетальдегида (10 мл, 178,2 ммоль) и перемешивание продолжали в атмосфере Н 2 в течение 24 ч [Примечание: подачу Н 2 дополняли при потребности путем реакции]. Реакционную смесь фильтровали через диатомитовую землю (CELITE) и фильтрат концентрировали в вакууме. Полученное неочищенное вещество перекристаллизовывали из изопропанола с получением соли HCl (R)-2-(этиламино)-2-фенилуксусной кислоты в виде блестящего белого твердого вещества (2,846 г). 1H ЯМР (DMSO-d6,= 2,5 м.д., 400 МГц):14,15 (br s, 1H), 9,55 (brs, 2H), 7,55-7,48 (m, 5H), 2,88 (br m, 1H), 2,73 (br m, 1H), 1,20 (арр t, J = 7,2, 3H). LC (условие I): RT = 0,39 мин; индекс гомогенности 95 %; LC-MS: аналитически рассчитано для [M+H]+ C10H14NO2: 180,10; обнаружено 180,18. Суспензию 10% Pd/C (536 мг) в метаноле/H2O (3 мл/1 мл) добавляли в смесь (R)-2-(этиламино)-2 фенилуксусной кислоты/HCl (1,492 г, 6,918 ммоль), формальдегида (20 мл 37 мас.%, в воде), 1 н. HCl (20 мл) и метанола (23 мл). Реакционную смесь перемешивали с Н 2 из баллона в течение 72 ч, причем подачу H2 дополняли при потребности. Реакционную смесь фильтровали через диатомитовую землю(CELITE) и фильтрат концентрировали в вакууме. Полученное неочищенное вещество перекристаллизовывали из изопропанола (50 мл) с получением соли HCl Сар-3 в виде белого твердого вещества (985 мг). 1H ЯМР (DMSO-d6,= 2,5 м.д., 400 МГц):10,48 (br s, 1H), 7,59-7,51 (m, 5H), 5,26 (s, 1H), 3,08 (аррbr s, 2H), 2,65 (br s, 3H), 1,24 (br m, 3H). LC (условие I): RT = 0,39 мин; индекс гомогенности 95 %; LCMS: аналитически рассчитано для [M+H]+ C11H16NO2: 194,12; обнаружено 194,18; HRMS: аналитически рассчитано для [M+H]+ C11H16NO2: 194,1180; обнаружено 194,1181.ClCO2Me (3,2 мл, 41,4 ммоль) добавляли по каплям в охлажденный (лед/вода) полураствор THF(14,2 мл, 81,52 ммоль) в течение 6 мин, и перемешивали в течение подобной температуре в течение 5,5 ч. Летучий компонент удаляли в вакууме и остаток разделяли между водой (100 мл) и этилацетатом (200 мл). Органический слой промывали 1 н. HCl (25 мл) и насыщенным раствором NaHCO3 (30 мл), сушили(MgSO4), фильтровали и концентрировали в вакууме. Полученное бесцветное масло перетирали с гексанами, фильтровали и промывали гексанами (100 мл) с получением (R)-трет-бутил-2-(метоксикарбониламино)-2-фенилацетата в виде белого твердого вещества (7,7 г). 1H ЯМР (DMSO-d6,= 2,5 м.д., 400 МГц): 7,98 (d, J = 8,0, 1H), 7,37-7,29 (m, 5H), 5,09 (d, J = 8, 1H), 3,56 (s, 3H), 1,33 (s, 9H). LC (условие I):RT = 1,53 мин; индекс гомогенности 90%; LC-MS: аналитически рассчитано для [M+Na]+ C14H19NNaO4: 288,12; обнаружено 288,15.TFA (16 мл) добавляли по каплям в охлажденный (лед/вода) CH2Cl2 (160 мл) раствор вышеуказанного продукта в течение 7 мин, охлаждающую баню удаляли и реакционную смесь перемешивали в течение 20 ч. Поскольку снятие защиты не было завершено, добавляли дополнительное количество TFA(1,0 мл) и продолжали перемешивать дополнительно 2 ч. Летучий компонент удаляли в вакууме, и полученный масляный остаток обрабатывали диэтиловым эфиром (15 мл) и гексанами (12 мл) с получением осадка. Осадок фильтровали и промывали диэтиловым эфиром/гексанами (соотношение 1:3; 30 мл) и сушили в вакууме с получением Сар-4 в виде рыхлого белого твердого вещества (5,57 г). Оптическое вращение: -176,9 [с = 3,7 мг/мл в Н 2 О;= 589 нм]. 1H ЯМР (DMSO-d6, = 2,5 м.д., 400 МГц):12,84 (brs, 1H), 7,96 (d, J = 8,3, 1H), 7,41-7,29 (m, 5H), 5,14 (d, J = 8,3, 1H), 3,55 (s, 3H). LC (условие I): RT = 1,01 мин; индекс гомогенности 95 %; LC-MS: аналитически рассчитано для [M+H]+ C10H12NO4 210,08; обнаружено 210,17; HRMS: аналитически рассчитано для [M+H]+C10H12NO4 210,0766; обнаружено 210,0756. Сар-5 Смесь (R)-2-фенилглицина (1,0 г, 6,62 ммоль), 1,4-дибромбутана (1,57 г, 7,27 ммоль) и Na2CO3 (2,10 г, 19,8 ммоль) в этаноле (40 мл) нагревали при 100 С в течение 21 ч. Реакционную смесь охлаждали до температуры окружающей среды и фильтровали и фильтрат концентрировали в вакууме. Остаток растворяли в этаноле и подкисляли 1 н. HCl до pH 3-4, и летучий компонент удаляли в вакууме. Полученное неочищенное вещество очищали обращенно-фазовой ВЭЖХ (вода/метанол/TFA) с получением соли TFA Сар-5 в виде полувязкой белой пены (1,0 г). 1H ЯМР (DMSO-d6,= 2,5, 500 МГц)10,68 (br s, 1H), 7,51(m, 5H), 5,23 (s, 1H), 3,34 (арр br s, 2H), 3,05 (арр br s, 2H), 1,95 (арр br s, 4H); RT = 0,30 мин (условие I); индекс гомогенности 98%; LC-MS: аналитически рассчитано для [M+H]+ C12H16NO2: 206,12; обнаружено 206,25. Сар-6 Соли TFA Сар-6 синтезировали из (R)-2-фенилглицина и 1-бром-2-(2-бромэтокси)этана с применением способа получения Сар-5. 1H ЯМР (DMSO-d6,= 2,5, 500 МГц)12,20 (br s, 1H), 7,50 (m, 5H), 4,92(s, 1H), 3,78 (арр br s, 4H), 3,08 (арр br s, 2H), 2,81 (арр br s, 2H); RT = 0,32 мин (условие I); 98%; LC-MS: аналитически рассчитано для [M+H]+ C12H16NO3: 222,11; обнаружено 222,20; HRMS: аналитически рассчитано для [M+H]+ C12H16NO3: 222,1130; обнаружено 222,1121. Сар-7- 17020815 Раствор CH2Cl2 (200 мл) п-толуолсульфонилхлорида (8,65 г, 45,4 ммоль) добавляли по каплям в охлажденный (-5 С) CH2Cl2 (200 мл) раствор (S)-бензил-2-гидрокси-2-фенилацетата (10,0 г, 41,3 ммоль),триэтиламина (5,75 мл, 41,3 ммоль) и 4-диметиламинопиридина (0,504 г, 4,13 ммоль), при этом поддерживали температуру от -5 С до 0 С. Реакционную смесь перемешивали при 0 С в течение 9 ч и затем хранили в морозильной камере (-25 С) в течение 14 ч. Смесь оставляли оттаивать до температуры окружающей среды и промывали водой (200 мл), 1 н. HCl (100 мл) и насыщенным солевым раствором (100 мл), сушили (MgSO4), фильтровали и концентрировали в вакууме с получением бензил-2-фенил-2(тозилокси)ацетата в виде вязкого масла, которое отвердевало в результате отстаивания (16,5 г). Хиральную чистоту продукта не проверяли и этот продукт использовали на следующей стадии без дополнительной очистки. 1H ЯМР (DMSO-d6,= 2,5, 500 МГц)7,78 (d, J= 8,6, 2H), 7,43-7,29 (m, 10H), 7,20 (m,2H), 6,12 (s, 1H), 5,16 (d, J = 12,5, 1H), 5,10 (d, J = 12,5, 1H), 2,39 (s, 3H). RT = 3,00 (условие 1H); индекс гомогенности 90%; LC-MS: аналитически рассчитано для [M+H]+ C22H20NaO5S: 419,09; обнаружено 419,04. Раствор THF (75 мл) бензил-2-фенил-2-(тозилокси)ацетата (6,0 г, 15,1 ммоль), 1-метилпиперазина(3,36 мл, 30,3 ммоль) и N,N-диизопропилэтиламина (13,2 мл, 75,8 ммоль) нагревали при 65 С в течение 7 ч. Реакционную смесь оставляли охлаждаться до температуры окружающей среды и летучий компонент удаляли в вакууме. Остаток разделяли между этилацетатом и водой и органический слой промывали водой и насыщенным солевым раствором, сушили (MgSO4), фильтровали и концентрировали в вакууме. Полученное неочищенное вещество очищали посредством флеш-хроматографии (силикагель, этилацетат) с получением бензил-2-(4-метилпиперазин-1-ил)-2-фенилацетата в виде оранжевато-коричневого вязкого масла (4,56 г). Анализом при помощи хиральной ВЭЖХ (CHIRALCEL OD-H) было обнаружено, что образец представляет собой смесь стереоизомеров в соотношении от 38,2 до 58,7. Разделение стереоизомеров выполняли следующим образом: продукт растворяли в 120 мл этанола/гептана (1:1) и вводили (5 мл/введение) в колонку для хиральной ВЭЖХ (Chiracel OJ, 5 см ID50 см L, 20 мкм) с элюированием 85:15 гептаном/этанолом при 75 мл/мин и наблюдали при 220 нм. Стереоизомер-1 (1,474 г) и стереоизомер-2 (2,2149 г) восстанавливали в виде вязкого масла. 1H ЯМР (CDCl3,= 7,26, 500 МГц) 7,44-7,40 (m, 2H), 7,33-7,24 (m, 6H), 7,21-7,16 (m, 2H), 5,13 (d, J = 12,5, 1H), 5,08 (d, J = 12,5, 1H), 4,02 (s,1H), 2,65-2,38 (арр br s, 8H), 2,25 (s, 3H). RT = 2,10 (условие 1H); индекс гомогенности 98%; LC-MS: аналитически рассчитано для [M+H]+ C20H25N2O2: 325,19; обнаружено 325,20. Раствор метанола (10 мл) любого стереоизомера бензил-2-(4-метилпиперазин-1-ил)-2-фенилацетата(1,0 г, 3,1 ммоль) добавляли в суспензию 10% Pd/C (120 мг) в метаноле (5,0 мл). Реакционную смесь подвергали воздействию водорода в баллоне при тщательном наблюдении в течение 50 мин. Сразу после завершения взаимодействия катализатор отфильтровывали через диатомитовую землю (CELITE) и фильтрат концентрировали в вакууме с получением Сар-7, загрязненного фенилуксусной кислотой в виде желтовато-коричневой пены (867,6 мг; масса выше теоретического выхода). Продукт использовали для следующей стадии без дополнительной очистки. 1H ЯМР (DMSO-d6,= 2,5, 500 МГц)7,44-7,37 (m,2H), 7,37-7,24 (m, 3H), 3,92 (s, 1H), 2,63-2,48 (арр. br s, 2H), 2,48-2,32 (m, 6H), 2,19 (s, 3H); RT = 0,31 (условие II); индекс гомогенности 90%; LC-MS: аналитически рассчитано для [M+H]+ C13H19N2O2: 235,14; обнаружено 235,15; HRMS: аналитически рассчитано для [M+H]+ C13H19N2O2: 235,1447; обнаружено 235,1440. Синтез Сар-8 и Сар-9 проводили согласно синтезу Сар-7 с применением соответствующих аминов для стадии замещения SN2 (т.е., 4-гидроксипиперидин для Сар-8 и (S)-3-фторпирролидин для Сар-9) и модифицированных условий разделения соответствующих промежуточных стереоизомерных соединений, как описано ниже. Сар-8 Стереоизомерное разделение промежуточного соединения бензил-2-(4-гидроксипиперидин-1-ил)-2 фенилацетата выполняли с применением следующих условий: соединение (500 мг) растворяли в этаноле/гептане (5 мл/45 мл). Полученный раствор вводили (5 мл/введение) в колонку для хиральной ВЭЖХ(Chiracel OJ, 2 см ID 25 см L, 10 мкм) с элюированием 80:20 гептаном/этанолом при 10 мл/мин, наблюдали при 220 нм с получением 186,3 мг стереоизомера-1 и 209,1 мг стереоизомера-2 в виде светложелтого вязкого масла. Этот бензиловый сложный эфир гидрогенолизировали согласно методике получения Сар-7 с получением Сар-8: 1 Н ЯМР (DMSO-d6,= 2,5, 500 МГц) 7,40 (d, J = 7, 2H), 7,28-7,20 (m,3H), 3,78 (s, 1H), 3,46 (m, 1H), 2,93 (m, 1H), 2,62 (m, 1H), 2,20 (m, 2H), 1,70 (m, 2H), 1,42 (m, 2H). RT = 0,28 (условие II); индекс гомогенности 98%; LC-MS: аналитически рассчитано для [M+H]+ C11H18NO2: 236,13; обнаружено 236,07; HRMS: Рассчитано для [M+H]+ C13H18NO3: 236,1287; обнаружено 236,1283. Диастереомерное разделение промежуточного соединения бензил-2-S)-3-фторпирролидин-1-ил)2-фенилацетата выполняли с применением следующих условий: сложный эфир (220 мг) отделяли в колонку для хиральной ВЭЖХ (Chiracel OJ-H, 0,46 см ID25 см L, 5 мкм) с элюированием 95% CO2/5% метанолом с 0,1% TFA, при давлении 10 бар, скорости потока 70 мл/мин и температуре 35 С. Элюат ВЭЖХ для соответствующих стереоизомеров концентрировали и остаток растворяли в CH2Cl2 (20 мл) и промывали водной средой (10 мл воды + 1 мл насыщенного раствора NaHCO3). Органическую фазу сушили (MgSO4), фильтровали и концентрировали в вакууме с получением 92,5 мг фракции-1 и 59,6 мг фракции-2. Эти бензиловые сложные эфиры гидрогенолизировали согласно методике получения Сар-7 с получением Сар-9 а и Сар-9b. Cap-9a (диастереомер-1; образец представляет собой соль TFA в результате очистки обращенно-фазовой ВЭЖХ с применением H2O/метанола/TFA растворителя). 1H ЯМР (DMSOd6,= 2,5, 400 МГц) 7,55-7,48 (m, 5H), 5,38 (d m, J = 53,7, 1H), 5,09 (br s, 1H), 3,84-2,82 (br m, 4H), 2,312,09 (m, 2H). RT = 0,42 (Условие I); индекс гомогенности 95%; LC-MS: аналитически рассчитано для[M+H]+ C12H15FNO2: 224,11; обнаружено 224,14; Сар-9b (диастереомер-2): 1H ЯМР (DMSO-d6,= 2,5,400 МГц) 7,43-7,21 (m, 5H), 5,19 (d m, J = 55,9, 1H), 3,97 (s, 1H), 2,95-2,43 (m, 4H), 2,19-1,78 (m, 2H). RT = 0,44 (условие I); LC-MS: аналитически рассчитано для [M+H]+ C12H15FNO2: 224,11; обнаружено 224,14. Сар-10 В раствор D-пролина (2,0 г, 17 ммоль) и формальдегида (2,0 мл 37 мас.%, в H2O) в метаноле (15 мл) добавляли суспензию 10% Pd/C (500 мг) в метаноле (5 мл). Смесь перемешивали с водородом из баллона в течение 23 ч. Реакционную смесь фильтровали через диатомитовую землю (CELITE) и концентрировали в вакууме с получением Сар-10 в виде грязно-белого твердого вещества (2,15 г). 1H ЯМР (DMSO-d6, = 2,5, 500 МГц) 3,42 (m, 1H), 3,37 (dd, J = 9,4, 6,1, 1H), 2,85-2,78 (m, 1H), 2,66 (s, 3H), 2,21-2,13 (m, 1H),1,93-1,84 (m, 2H), 1,75-1,66 (m, 1H). RT = 0,28 (условие II); индекс гомогенности 98%; LC-MS. Аналитически рассчитано для [M+H]+ C6H12NO2: 130,09; обнаружено 129,96. Сар-11 Смесь (2S,4R)-4-фторпирролидин-2-карбоновой кислоты (0,50 г, 3,8 ммоль), формальдегида (0,5 мл 37 мас.%, в Н 2 О), 12 н. HCl (0,25 мл) и 10% Pd/C (50 мг) в метаноле (20 мл) перемешивали с водородом из баллона в течение 19 ч. Реакционную смесь фильтровали через диатомитовую землю (CELITE) и фильтрат концентрировали в вакууме. Остаток перекристаллизовывали из изопропанола с получением солиHCl Сар-11 в виде белого твердого вещества (337,7 мг). 1H ЯМР (DMSO-d6,= 2,5, 500 МГц) 5,39 (d m, J= 53,7, 1H), 4,30 (m, 1H), 3,90 (ddd, J = 31,5, 13,5, 4,5, 1H), 3,33 (dd, J = 25,6, 13,4, 1H), 2,85 (s, 3H), 2,602,51 (m, 1H), 2,39-2,26 (m, 1H). RT = 0,28 (условие II); индекс гомогенности 98%; LC-MS: аналитически рассчитано для [M+H]+ C6H11FNO2: 148,08; обнаружено 148,06. Сар-12 (так же, как и Сар-52)L-Алании (2,0 г, 22,5 ммоль) растворяли в 10% водном растворе карбоната натрия (50 мл) и к этому добавляли раствор THF (50 мл) метилхлорформиата (4,0 мл). Реакционную смесь перемешивали при условиях окружающей среды в течение 4,5 ч и концентрировали в вакууме. Полученное белое твердое вещество растворяли в воде и подкисляли 1 н. HCl до pH2-3. Полученные растворы экстрагировали этилацетатом (3100 мл) и объединенную органическую фазу сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением бесцветного масла (2,58 г). 500 мг этого вещества очищали обращеннофазовой ВЭЖХ (H2O/метанол/ТРА) с получением 150 мг Сар-12 в виде бесцветного масла. 1H ЯМР Смесь L-аланина (2,5 г, 28 ммоль), формальдегида (8,4 г, 37 мас.%), 1 н. HCl (30 мл) и 10% Pd/C (500 мг) в метаноле (30 мл) перемешивали в атмосфере водорода (50 фунт/кв.дюйм) в течение 5 ч. Реакционную смесь фильтровали через диатомитовую землю (CELITE) и фильтрат концентрировали в вакууме с получением соли HCl Сар-13 в виде масла, которое отвердевало в результате отстаивания в вакууме (4,4 г; масса выше теоретического выхода). Продукт использовали без дополнительной очистки. 1H ЯМР(R)-2-Фенил-2-(пиперидин-1-ил)уксусная кислота Стадия 1. Смесь (R)-(-)-D-фенилглицин-трет-бутилового сложного эфира (3,00 г, 12,3 ммоль),NaBH3CN (0,773 г, 12,3 ммоль), KOH (0,690 г, 12,3 ммоль) и уксусной кислоты (0,352 мл, 6,15 ммоль) перемешивали в метаноле при 0 С. К этой смеси в течение 5 мин добавляли по каплям глутаровый альдегид (2,23 мл, 12,3 ммоль). Реакционную смесь перемешивали и оставили нагреваться до температуры окружающей среды и продолжали перемешивать при той же температуре в течение 16 ч. Растворитель впоследствии удаляли и остаток разделяли 10% водным NaOH и этилацетатом. Органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали досуха с получением прозрачного масла. Это вещество очищали обращенно-фазовой препаративной ВЭЖХ (Primesphere C-18, 30100 мм; CH3CNH2O-0,l% TFA) с получением промежуточного сложного эфира (2,70 г, 56%) в виде прозрачного масла. 1H ЯМР (400 МГц, CDC13)7,53-7,44 (m, 3H), 7,40-7,37 (m, 2H), 3,87 (d, J = 10,9 Гц, 1H), 3,59 (d, J = 10,9 Гц, 1H), 2,99 (t, J = 11,2 Гц, 1H), 2,59 (t, J = 11,4 Гц, 1H), 2,07-2,02 (m, 2H), 1,82 (d, J = 1,82 Гц, 3H), 1,40 (s,9H). LC-MS: аналитически рассчитано для C17H25NO2: 275; обнаружено: 276 (М+H)+. Стадия 2. К перемешанному раствору промежуточного соединения сложного эфира (1,12 г, 2,88 ммоль) в дихлорметане (10 мл) добавляли TFA (3 мл). Реакционную смесь перемешивали при температуре окружающей среде в течение 4 ч и затем ее концентрировали досуха с получением светло-желтого масла. Масло очищали с применением обращенно-фазовой препаративной ВЭЖХ (Primesphere C-18,30100 мм; CH3CN-H2O-0,l% TFA). Соответствующие фракции объединяли и концентрировали досуха в вакууме. Затем остаток растворяли в минимальном количестве метанола и использовали относительно экстракционных картриджей МСХ LP (26 г). Картриджи промывали метанолом (40 мл) и затем необходимое соединение элюировали с применением 2 М аммиака в метаноле (50 мл). Содержащие продукт фракции объединяли и концентрировали и остаток поглощали водой. Посредством лиофилизации этого раствора получали указанное соединение (0,492 г, 78%) в виде светло-желтого твердого вещества. 1H ЯМР (DMSO-d6)7,50 (s, 5H), 5,13 (s, 1H), 3,09 (br s, 2H), 2,92-2,89 (m, 2H), 1,74 (m, 4H), 1,48 (br s, 2H).LC-MS: аналитически рассчитано для C13H17NO2: 219; обнаружено: 220 (M+H)+.(100 мл) добавляли весь сразу твердый EDCI (12,46 г, 0,065 моль). Полученный раствор перемешивали при комнатной температуре в атмосфере Ar в течение 18 ч и затем ее разбавляли этилацетатом, промывали (Н 2 О 2, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали с получением бледно-желтого масла. При помощи флеш-хроматографии (SiO2/ гексан-этилацетат, 4:1) этого масла получали указанное соединение (11,64 г, 73%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3)7,53-7,17 (m, 10H), 5,95 (q, J = 6,6 Гц, 0,5H), 5,94 (q, J = 6,6 Гц, 0,5H), 5,41 (s, 0,5H), 5,39 (s,0,5H), 1,58 (d, J = 6,6 Гц, 1,5H), 1,51 (d, J = 6,6 Гц, 1,5H). Стадия 2. (S)-1-Фенилэтил (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилацетат. В раствор(S)-1-фенилэтил-2-бром-2-фенилацетата (0,464 г, 1,45 ммоль) в THF (8 мл) добавляли триэтиламин (0,61 мл, 4,35 ммоль) с последующим добавлением йодида тетрабутиламмония (0,215 г, 0,58 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин и затем добавляли раствор 4 метил-4-гидроксипиперидина (0,251 г, 2,18 ммоль) в THF (2 мл). Смесь перемешивали в течение 1 ч при- 20020815 комнатной температуре и затем ее нагревали при 55-60C (температура масляной бани) в течение 4 ч. Затем охлажденную реакционную смесь разбавляли этилацетатом (30 мл), промывали (H2O2, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (0-60% этилацетат-гексан) с получением сначала (S,R)-изомера указанного соединения (0,306 г, 60%) в виде белого твердого вещества, а затем соответствующего (S,S)-изомера (0,120 г,23%), все в виде белого твердого вещества. (S,R)-изомер: 1H ЯМР (CD3OD)7,51-7,45 (m, 2H), 7,41-7,25(m, 8H), 5,85 (q, J = 6,6 Гц, 1H), 4,05 (s, 1H), 2,56-2,45 (m, 2H), 2,41-2,29 (m, 2H), 1,71-1,49 (m, 4H), 1,38 (d,J = 6,6 Гц, 3H), 1,18 (s, 3H). LC-MS: аналитически рассчитано для C22H27NO3: 353; обнаружено: 354C22H27NO3: 353; обнаружено: 354 (М+H)+. Стадия 3. (R)-2-(4-Гидрокси-4-метилпиперидин-1-ил)-2-фенилуксусная кислота. В раствор (S)-1 фенилэтил-(R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилацетата (0,185 г, 0,52 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества впоследствии удаляли в вакууме и остаток очищали обращеннофазовой препаративной ВЭЖХ (Primesphere С-18, 20100 мм; CH3CN-H2O-0,1% TFA) с получением указанного соединения (в виде соли TFA) в виде бледно-голубого твердого вещества (0,128 г, 98%). LC-MS: аналитически рассчитано для C14H19NO3: 249; обнаружено: 250 (М+H)+. Сар-16 Стадия 1. (S)-1-Фенилэтил-2-(2-фторфенил)ацетат. Смесь 2-фторфенилуксусной кислоты (5,45 г,35,4 ммоль), (S)-1-фенилэтанола (5,62 г, 46,0 ммоль), EDCI (8,82 г, 46,0 ммоль) и DMAP (0,561 г, 4,60 ммоль) в CH2Cl2 (100 мл) перемешивали при комнатной температуре в течение 12 ч. Растворитель затем концентрировали и остаток разделяли посредством H2O-этилацетата. Фазы разделяли и водный слой обратно экстрагировали этилацетатом (2). Объединенные органические фазы промывали (H2O, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (BIOTAGE/ 0-20% этилацетат-гексан) с получением указанного соединения в виде бесцветного масла (8,38 г, 92%). 1H ЯМР (400 МГц, CD3OD)7,32-7,23 (m, 7H), 7,10-7,04 (m, 2), 5,85 (q, J = 6,5 Гц, 1H), 3,71(s, 2H), 1,48 (d, J = 6,5 Гц, 3H). Стадия 2. (R)-S)-1-Фенилэтил)-2-(2-фторфенил)-2-(пиперидин-1-ил)ацетат. В раствор (S)-1 фенилэтил-2-(2-фторфенил)ацетата (5,00 г, 19,4 ммоль) в THF (1200 мл) при 0C добавляли DBU (6,19 г,40,7 ммоль) и раствор оставляли нагреваться до комнатной температуры при перемешивании в течение 30 мин. Раствор затем охлаждали до -78C добавляли в раствор CBr4 (13,5 г, 40,7 ммоль) в THF (100 мл),и смесь оставляли нагреваться до -10C и перемешивали при этой температуре в течение 2 ч. Реакционную смесь гасили насыщенным водн. NH4Cl и слои разделяли. Водный слой обратно экстрагировали этилацетатом (2) и объединенные органические фазы промывали (H2O, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме. К остатку добавляли пиперидин (5,73 мл, 58,1 ммоль) и раствор перемешивали при комнатной температуре в течение 24 ч. Летучие вещества затем концентрировали в вакууме и остаток очищали хроматографией на силикагеле (BIOTAGE/ 0-30% диэтиловый эфир-гексан) с получением чистой смеси диастереомеров (соотношение 2:1 посредством 1H ЯМР) в виде желтого масла (2,07 г, 31%) вместе с непрореагировавшим исходным веществом (2,53 г,51%). Посредством дополнительной хроматографии диастереомерной смеси (BIOTAGE/ 0-10% диэтиловый эфир-толуол) получали указанное соединение в виде бесцветного масла (0,737 г, 11%). 1H ЯМР(400 МГц, CD3OD)7,52 (ddd, J = 9,4, 7,6, 1,8 Гц, 1H), 7,33-7,40 (m, 1), 7,23-7,23 (m, 4H), 7,02-7,23 (m,4H), 5,86 (q, J = 6,6 Гц, 1H), 4,45 (s, 1H), 2,39 -2,45 (m, 4H), 1,52-1,58 (m, 4H), 1,40-1,42 (m, 1H), 1,38 (d, J = 6,6 Гц, 3H). LC-MS: аналитически рассчитано для C21H24FNO2: 341; обнаружено: 342 (М+H)+. Стадия 3. (R)-2-(2-Фторфенил)-2-(пиперидин-1-ил)уксусная кислота. Смесь (R)-S)-1-фенилэтил)2-(2-фторфенил)-2-(пиперидин-1-ил)ацетата (0,737 г, 2,16 ммоль) и 20% Pd(OH)2/C (0,070 г) в этаноле (30 мл) гидрировали при комнатной температуре и атмосферном давлении (H2 в баллоне) в течение 2 ч. Раствор затем продували Ar, фильтровали через диатомитовую землю (CELITE) и концентрировали в вакууме. Посредством этого получали указанное соединение в виде бесцветного твердого вещества (0,503 г, 98%). 1H ЯМР (400 МГц, CD3OD)7,65 (ddd, J = 9,1, 7,6, 1,5 Гц, 1H), 7,47-7,53 (m, 1H), 7,21-7,30 (m,2H), 3,07-3,13 (m, 4H), 1,84 (br s, 4H), 1,62 (br s, 2H). LC-MS: аналитически рассчитано для C13H16FNO2: 237; обнаружено: 238 (М+H)+.(S)-1-фенилэтил-2-бром-2-фенилацетата (1,50 г, 4,70 ммоль) в THF (25 мл) добавляли триэтиламин (1,31 мл, 9,42 ммоль), с последующим добавлением йодида тетрабутиламмония (0,347 г, 0,94 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин и затем добавляли раствор 4 фенил-4-гидроксипиперидина (1,00 г, 5,64 ммоль) в THF (5 мл). Смесь перемешивали в течение 16 ч и затем ее разбавляли этилацетатом (100 мл), промывали (Н 2 О 2, насыщенным солевым раствором), сушили (MgSO4), фильтровали и концентрировали. Остаток очищали на колонке с силикагелем (0-60% этилацетат-гексан) с получением приблизительно 2:1 смеси диастереомеров исходя из 1 Н ЯМР. Разделение этих изомеров выполняли с применением сверхкритической жидкостной хроматографии (CHIRALCEL OJ-H, 30250 мм; 20% этанол в СО 2 при 35C) с получением первого (R)-изомера указанного соединения (0,534 г, 27%) в виде желтого масла и затем соответствующего (S)-изомера (0,271 г, 14%) в виде желтого масла. (S,R)-изомер: 1H ЯМР (400 МГц, CD3OD)7,55-7,47 (m, 4H), 7,44-7,25 (m, 10H), 7,257,17 (m, 1H), 5,88 (q, J = 6,6 Гц, 1H), 4,12 (s, 1H), 2,82-2,72 (m, 1H), 2,64 (dt, J = 11,1, 2,5 Гц, 1H), 2,58-2,52(m, 2H), 1,53 (d, J = 6,5 Гц, 3H). LC-MS: аналитически рассчитано для C27H29NO3: 415; обнаружено: 416(М+H)+; (S,S)-изомер: 1 Н ЯМР (400 МГц, CD3OD)7,55-7,48 (m, 2H), 7,45-7,39 (m, 2H), 7,38-7,30 (m,5H), 7,25-7,13 (m, 4H), 7,08-7,00 (m, 2H), 5,88 (q, J = 6,6 Гц, 1H), 4,12 (s, 1H), 2,95-2,85 (m, 1H), 2,68 (dt, J = 11,1, 2,5 Гц, 1H), 2,57-2,52 (m, 1H), 2,42 (dt, J = 11,1, 2,5 Гц, 1H), 2,25 (dt, J = 12,1, 4,6 Гц, 1H), 2,12 (dt, J = 12,1, 4,6 Гц, 1H), 1,73 (dd, J = 13,6, 3,0 Гц, 1H), 1,64 (dd, J = 13,6, 3,0 Гц, 1H), 1,40 (d, J = 6,6 Гц, 3H). LCMS: аналитически рассчитано для C27H29NO3: 415; обнаружено: 416 (М+H)+. Следующие сложные эфиры получали подобным образом.- 22020815 Условия хиральной SFC для определения времени удержания:(S)-1-фенилэтил-(R)-2-(4-гидрокси-4-фенилпиперидин-1-ил)-2-фенилацетата (0,350 г, 0,84 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества впоследствии удаляли в вакууме и остаток очищали обращенно-фазовой препаративной ВЭЖХ (Primesphere С-18, 20100 мм; CH3CN-H2O-0,1% TFA) с получением указанного соединения (в виде соли TFA) в виде белого твердого вещества (0,230 г, 88%). LC-MS: аналитически рассчитано для C19H21NO3: 311,15; обнаружено: 312 (М+H)+. Следующие карбоновые кислоты готовили в оптически чистой форме подобным образом.- 23020815 Условия LC-MS для определения времени удержания: Стадия 1. (R,S)-Этил-2-(4-пиридил)-2-бромацетат. В раствор этил-4-пиридилацетата (1,00 г, 6,05 ммоль) в сухом THF (150 мл) при 0C в атмосфере аргона добавляли DBU (0,99 мл, 6,66 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры более 30 мин и затем ее охлаждали до 78C. К этой смеси добавляли CBr4 (2,21 г, 6,66 ммоль) и продолжали перемешивать при -78C в течение 2 ч. Реакционную смесь затем гасили насыщ. водн. NH4Cl и фазы разделяли. Органическую фазу промывали (насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме. Полученное желтое масло сразу же очищали посредством флеш-хроматографии (SiO2/ гексан-этилацетат,1:1) с получением указанного соединения (1,40 г, 95%) в виде несколько нестабильного желтого масла. 1H ЯМР (400 МГц, CDCl3)8,62 (dd, J = 4,6, 1,8 Гц, 2H), 7,45 (dd, J = 4,6, 1,8 Гц, 2H), 5,24 (s, 1H), 4,214,29 (m, 2H), 1,28 (t, J = 7,1 Гц, 3H). LC-MS: аналитически рассчитано для C9H10BrNO2: 242, 244; обнаружено: 243, 245 (М+H)+. Стадия 2. (R,S)-Этил-2-(4-пиридил)-2-(N,N-диметиламино)ацетат. В раствор (R,S)-этил-2-(4 пиридил)-2-бромацетата (1,40 г, 8,48 ммоль) в DMF (10 мл) при комнатной температуре добавляли диметиламин (2 М в THF, 8,5 мл, 17,0 ммоль). После завершения реакции (исходя из тонкослойной хроматографии) летучие вещества удаляли в вакууме и остаток очищали посредством флеш-хроматографии (BIOTAGE, 40+M SiO2 колонка; 50-100% этилацетат-гексан) с получением указанного соединения (0,539 г, 31%) в виде светло-желтого масла. 1H ЯМР (400 МГц, CDCl3)8,58 (d, J = 6,0 Гц, 2H), 7,36 (d, J = 6,0C11H16N2O2: 208; обнаружено: 209 (М+H)+. Стадия 3. (R,S)-2-(4-Пиридил)-2-(N,N-диметиламино)уксусная кислота. В раствор (R,S)-этил-2-(4 пиридил)-2-(N,N-диметиламино)ацетата (0,200 г, 0,960 ммоль) в смеси THF-метанол-H2O (1:1:1, 6 мл) при комнатной температуре добавляли порошкообразный LiOH (0,120 г, 4,99 ммоль). Раствор перемешивали в течение 3 ч и затем его подкисляли до pH 6 с применением 1 н HCl. Водную фазу промывали этилацетатом и затем ее лиофилизировали с получением дигидрохлорида указанного соединения в виде желтого твердого вещества (содержащего LiCl). Продукт использовали как таковой в последующих стадиях. 1H ЯМР (400 МГц, DMSO-d6)8,49 (d, J = 5,7 Гц, 2H), 7,34 (d, J = 5,7 Гц, 2H), 3,56 (s, 1H), 2,21 (s,6H). Следующие примеры получали подобным образом с применением способ описанный выше.(0,090 г, 0,176 ммоль), 3-бромхинолина и толуола (10 мл) дегазировали барботированием Ar в течение 15 мин. Реакционную смесь затем нагревали при 100C в течение 12 ч, после чего ее охлаждали до комнатной температуры и выливали в Н 2 О. Смесь экстрагировали этилацетатом (2) и объединенные органические фазы промывали (H2O, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали первый обращенно-фазовой препаративной ВЭЖХ (Primesphere С-18, 30100 мм; CH3CN-H2O-5 мм NH4OAc) и затем посредством флеш-хроматографии (SiO2/гексанэтилацетат, 1:1) с получением указанного соединения (0,128 г, 17%) в виде оранжевого масла. 1H ЯМРLC-MS: аналитически рассчитано для C15H18N2O2: 258; обнаружено: 259 (М+H)+. Стадия 2. (R,S)-2-(Хинолин-3-ил)-2-(N,N-диметиламино)уксусная кислота. Смесь (R,S)-этил-2-(хинолин-3-ил)-2-(N,N-диметиламино)ацетата (0,122 г, 0,472 ммоль) и 6 М HCl(3 мл) нагревали при 100C в течение 12 ч. Растворитель удаляли в вакууме с получением дигидрохлорида указанного соединения (0,169 г, 100%) в виде светло-желтой пены. Неочищенное вещество использовали в последующих стадиях без дополнительной очистки. LC-MS: аналитически рассчитано дляCH2Cl2 (40 мл) добавляли EDCI (3,29 г, 17,15 ммоль) и смесь оставляли перемешиваться при комнатной температуре в течение 12 ч. Растворитель затем удаляли в вакууме и остаток разделяли этилацетатомH2O. Слои разделяли, водный слой обратно экстрагировали этилацетатом (2) и объединенные органические фазы промывали (H2O, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле (BIOTAGE/ 0-50% диэтиловый эфир-гексан). Полученную чистую смесь диастереомеров затем разделяли обращенно-фазовой препаративной ВЭЖХ (Primesphere С-18, 30100 мм; CH3CN-H2O-0,1% TFA) с получением сначала (S)-1 фенэтил-(R)-2-(диметиламино)-2-(2-фторфенил)ацетата (0,501 г, 13%), а затем (S)-1-фенэтил-(S)-2- 26020815(диметиламино)-2-(2-фторфенил)ацетата (0,727 г, 18%), оба в виде их солей TFA. (S,R)-изомер: 1H ЯМР(m, 5H), 6,04 (q, J = 6,5 Гц, 1H), 5,60 (s, 1H), 2,84 (s, 6H), 1,43 (d, J = 6,5 Гц, 3H). LC-MS: аналитически рассчитано для C18H20FNO2: 301; обнаружено: 302 (M+H)+; (S,S)-изомер: 1H ЯМР (400 МГц, CD3OD)7,58-7,63 (m, 1H), 7,18-7,31 (m, 6H), 7,00 (dd, J = 8,5, 1,5 Гц, 2H), 6,02 (q, J = 6,5 Гц, 1H), 5,60 (s, 1H), 2,88(s, 6H), 1,54 (d, J = 6,5 Гц, 3H). LC-MS: аналитически рассчитано для C18H20FNO2: 301; обнаружено: 302(М+H)+. Стадия 2. (R)-2-(Диметиламино)-2-(2-фторфенил)уксусная кислота. Смесь соли TFA (R)-S)-1-фенилэтил)-2-(диметиламино)-2-(2-фторфенил)ацетата (1,25 г, 3,01 ммоль) и 20% Pd(OH)2/C (0,125 г) в этаноле (30 мл) гидрировали при комнатной температуре и атмосферном давлении (баллон H2) в течение 4 ч. Раствор затем продували Ar, фильтровали через диатомитовую землю (CELITE) и концентрировали в вакууме. Посредством этого получали указанное соединение в виде бесцветного твердого вещества (0,503 г, 98%). 1H ЯМР (400 МГц, CD3OD)7,53-7,63 (m, 2H),7,33-7,38 (m, 2H), 5,36 (s, 1H), 2,86 (s, 6H). LC-MS: аналитически рассчитано для C10H12FNO2: 197; обнаружено: 198 (М+H)+.S-изомер может быть получен подобным образом из соли TFA (S)-S)-1-фенилэтил)-2(диметиламино)-2-(2-фторфенил)ацетата. Сар-39 Смесь (R)-(2-хлорфенил)глицина (0,300 г, 1,62 ммоль), формальдегида (35% водный раствор, 0,80 мл, 3,23 ммоль) и 20% Pd(OH)2/C (0,050 г) гидрировали при комнатной температуре и атмосферном давлении (баллон H2) в течение 4 ч. Раствор затем продували Ar, фильтровали через диатомитовую землю(R)-2-(диметиламино)-2-(2-хлорфенил)уксусной кислоты в виде бесцветного масла (0,290 г, 55%). 1H ЯМР (400 МГц, CD3OD)7,59-7,65 (m, 2H), 7,45-7,53 (m, 2H), 5,40 (s, 1H), 2,87 (s, 6H). LC-MS: аналитически рассчитано для C10H12ClNO2: 213; обнаружено: 214 (М+H)+. Сар-40 В очень холодный раствор (R)-(2-хлорфенил)глицина (1,00 г, 5,38 ммоль) и NaOH (0,862 г, 21,6 ммоль) в Н 2 О (5,5 мл) добавляли по каплям метилхлорформиат (1,00 мл, 13,5 ммоль). Смесь оставляли перемешиваться при 0C в течение 1 ч и затем ее подкисляли добавлением конц. HCl (2,5 мл). Смесь экстрагировали этилацетатом (2) и объединенную органическую фазу промывали (Н 2 О, насыщенным солевым раствором), сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением указанного соединения (R)-2-(метоксикарбониламино)-2-(2-хлорфенил)уксусной кислоты в виде желто-оранжевой пены (1,31 г, 96%). 1H ЯМР (400 МГц, CD3OD)7,39-7,43 (m, 2H), 7,29-7,31 (m, 2H), 5,69 (s, 1H), 3,65 (s,3H). LC-MS: аналитически рассчитано для C10H10ClNO4: 243; обнаружено: 244 (М+H)+. Сар-41 К суспензии 2-(2-(хлорметил)фенил)уксусной кислоты (2,00 г, 10,8 ммоль) в THF (20 мл) добавляли морфолин (1,89 г, 21,7 ммоль) и раствор перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь затем разбавляли этилацетатом и экстрагировали H2O (2). Водную фазу лиофилизировали и остаток очищали хроматографией на силикагеле (BIOTAGE/ 0-10% метанола-CH2Cl2) с получением указанного соединения 2-(2-(морфолинометил)фенил)уксусной кислотой в виде бесцветного твердого вещества (2,22 г, 87%). 1H ЯМР (400 МГц, CD3OD)7,37-7,44 (m, 3H), 7,29-7,33 (m, 1H), 4,24 (s,2H), 3,83 (br s, 4H), 3,68 (s, 2H), 3,14 (br s, 4H). LC-MS: аналитически рассчитано для C13H17NO3: 235; обнаружено: 236 (М+H)+.- 27020815 Следующие примеры получали подобным образом с применением описанного для Сар-41 способа.HMDS (1,85 мл, 8,77 ммоль) добавляли в суспензию р-толуолсульфоната (R)-2-амино-2 фенилуксусной кислоты (2,83 г, 8,77 ммоль) в CH2Cl2 (10 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Добавляли 1 порцию метилизоцианата (0,5 г, 8,77 ммоль), перемешивание продолжали 30 мин. Реакцию гасили добавление H2O (5 мл) и полученный осадок фильтровали, промывали H2O и н-гексанами, и сушили в вакууме. (R)-2-(3-метилуреидо)-2-фенилуксусную кислоту (1,5 г; 82%) восстанавливали в виде белого твердого вещества и использовали ее без дополнительной очистки. 1 Необходимый продукт получали согласно способу, описанному для Сар-45 а. 1H ЯМР (500 МГц,DMSO-d6)м.д. 0,96 (t, J = 7,17 Гц, 3H) 2,94-3,05 (m, 2H) 5,17 (d, J = 7,93 Гц, 1H) 6,05 (t, J = 5,19 Гц, 1H) 6,60 (d, J = 7,63 Гц, 1H) 7,26-7,38 (m, 5H) 12,68 (s, 1H). LC-MS: аналитически рассчитано для C11H14N2O3 222,10 обнаружено 223,15 (М+H)+. ВЭЖХ XTERRA С-18 3,0506 мм, 0 -100% В в пределах 2 мин, время удержания 1 мин, А = 90% воды, 10% метанола, 0,2% Н 3 РО 4, В = 10% воды, 90% метанола, 0,2% Н 3 РО 4, RT = 0,87 мин, индекс гомогенности 90%. Сар-47 Стадия 1. (R)-трет-Бутил-2-(3,3-диметилуреидо)-2-фенилацетат. К перемешанному раствору (R)-трет-бутил-2-амино-2-фенилацетата (1,0 г, 4,10 ммоль) и основания Хунига (1,79 мл, 10,25 ммоль) в DMF (40 мл) по каплям в течение 10 мин добавляли диметилкарбамоил- 28020815 хлорид (0,38 мл, 4,18 ммоль). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь концентрировали при пониженном давлении, и полученный остаток растворяли в этилацетате. Органический слой промывали H2O, 1 н. водн. HCl и насыщенным солевым раствором, сушили (MgSO4),фильтровали и концентрировали при пониженном давлении. (R)-трет-бутил-2-(3,3-диметилуреидо)-2 фенилацетат получали в виде белого твердого вещества (0,86 г; 75%) и использовали без дополнительной очистки. 1H ЯМР (500 МГц, DMSO-d6)м.д. 1,33 (s, 9H) 2,82 (s, 6H) 5,17 (d, J = 7,63 Гц, 1H) 6,55 (d, J = 7,32 Гц, 1H) 7,24-7,41 (m, 5H). LC-MS: аналитически рассчитано для C15H22N2O3 278,16, обнаружено 279,23 (М+H)+; ВЭЖХ PHENOMENEX Luna C-18 4,650 мм, 0-100% В в пределах 4 мин, время удержания 1 мин, А = 90% воды, 10% метанола, 0,1% TFA, В = 10% воды, 90% метанола, 0,1% TFA, RT = 2,26 мин, индекс гомогенности 97%. Стадия 2. (R)-2-(3,3-Диметилуреидо)-2-фенилуксусная кислота. К перемешанному раствору R)-трет-бутил-2-(3,3-диметилурейдо)-2-фенилацетата (0,86 г, 3,10 ммоль) в CH2Cl2 (250 мл) добавляли по каплям TFA (15 мл) и полученный раствор перемешивали при к.т. в течение 3 ч. Необходимое соединение затем отделяли осаждением из раствора смесьюEtOAc:гексаны (5:20), фильтровали и сушили при пониженном давлении. (R)-2-(3,3-Диметилуреидо)-2 фенилуксусную кислоту выделяли в виде белого твердого вещества (0,59 г, 86%) и использовали без дополнительной очистки. 1H ЯМР (500 МГц, DMSO-d6)м.д. 2,82 (s, 6H) 5,22 (d, J = 7,32 Гц, 1H) 6,58 (d, J= 7,32 Гц, 1H) 7,28 (t, J = 7,17 Гц, 1H) 7,33 (t, J = 7,32 Гц, 2H) 7,38-7,43 (m, 2H) 12,65 (s, 1H). LC-MS: аналитически рассчитано для C11H14N2O3: 222,24; обнаружено: 223,21 (М+H)+ ВЭЖХ XTERRA С-18 3,050 мм, 0 - 100% В в пределах 2 мин, время удержания 1 мин, А = 90% воды, 10% метанола, 0,2% Н 3 РО 4, В = 10% воды, 90% метанола, 0,2% Н 3 РО 4, RT = 0,75 мин, индекс гомогенности 93%. Сар-48 Стадия 1. (R)-трет-Бутил-2-(3-циклопентилуреидо)-2-фенилацетат. К перемешанному раствору гидрохлорида (R)-2-амино-2-фенилуксусной кислоты (1,0 г, 4,10 ммоль) и основания Хунига (1,0 мл, 6,15 ммоль) в DMF (15 мл) добавляли по каплям циклопентилизоцианат (0,46 мл, 4,10 ммоль) и в течение 10 мин. После перемешивания при комнатной температуре в течение 3 ч реакционную смесь концентрировали при пониженном давлении и полученный остаток поглощали этилацетатом. Органический слой промывали Н 2 О и насыщенным солевым раствором, сушили(MgSO4), фильтровали и концентрировали при пониженном давлении. (R)-трет-Бутил-2-(3 циклопентилуреидо)-2-фенилацетат получали в виде мутного масла (1,32 г; 100 %) и использовали без дополнительной очистки. 1H ЯМР (500 МГц, CD3Cl-D)м.д. 1,50-1,57 (m, 2H) 1,58-1,66 (m, 2H) 1,87-1,97(m, 2H) 3,89-3,98 (m, 1H) 5,37 (s, 1H) 7,26-7,38 (m, 5H). LC-MS: аналитически рассчитано для C18H26N2O3 318,19, обнаружено 319,21 (М+H)+; ВЭЖХ XTERRA С-18 3,050 мм, 0 - 100% В в пределах 4 мин,время удержания 1 мин, А = 90% воды, 10% метанола, 0,1% TFA, В = 10% воды, 90% метанола, 0,1%TFA, RT = 2,82 мин, индекс гомогенности 96%. Стадия 2. (R)-2-(3-Циклопентилуреидо)-2-фенилуксусная кислота. К перемешанному раствору (R)трет-бутил-2-(3-циклопентилуреидо)-2-фенилацетата (1,31 г, 4,10 ммоль) в CH2Cl2 (25 мл) добавляли по каплям TFA (4 мл) и триэтилсилан (1,64 мл; 10,3 ммоль) и полученный раствор перемешивали при комнатной температуре в течение 6 ч. Летучие компоненты удаляли при пониженном давлении и неочищенный продукт перекристаллизовывали в этилацетате/пентанах с получением (R)-2-(3-циклопентилуреидо)-2-фенилуксусной кислоты в виде белого твердого вещества (0,69 г, 64%). 1H ЯМР (500 МГц,DMSO-d6)м.д. 1,17-1,35 (m, 2H) 1,42-1,52 (m, 2H) 1,53-1,64 (m, 2H) 1,67-1,80 (m, 2H) 3,75-3,89 (m, 1H) 5,17 (d, J = 7,93 Гц, 1H) 6,12 (d, J = 7,32 Гц, 1H) 6,48 (d, J = 7,93 Гц, 1H) 7,24-7,40 (m, 5H) 12,73 (s, 1H).LC-MS: аналитически рассчитано для C14H18N2O3: 262,31; обнаружено: 263,15 (М+H)+. ВЭЖХ XTERRA C-18 3,050 мм, 0 - 100% В в пределах 2 мин, время удержания 1 мин, А = 90% воды, 10% метанола, 0,2% Н 3 РО 4, В = 10% воды, 90% метанола, 0,2% Н 3 РО 4, RT = 1,24 мин, индекс гомогенности 100%. Сар-49 К перемешанному раствору 2-(бензиламино)уксусной кислоты (2,0 г, 12,1 ммоль) в муравьиной кислоте (91 мл) добавляли формальдегид (6,94 мл, 93,2 ммоль). Через пять часов при 70C, реакционную смесь концентрировали при пониженном давлении до 20 мл и осаждали белое твердое вещество. После- 29
МПК / Метки
МПК: C07D 405/14, C07D 403/14
Метки: гепатита, вируса, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-20815-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита с</a>
Предыдущий патент: Мягкая контактная линза
Следующий патент: Ингибиторы вирусов flaviviridae
Случайный патент: Способ получения металлических солей среднецепочечных жирных кислот