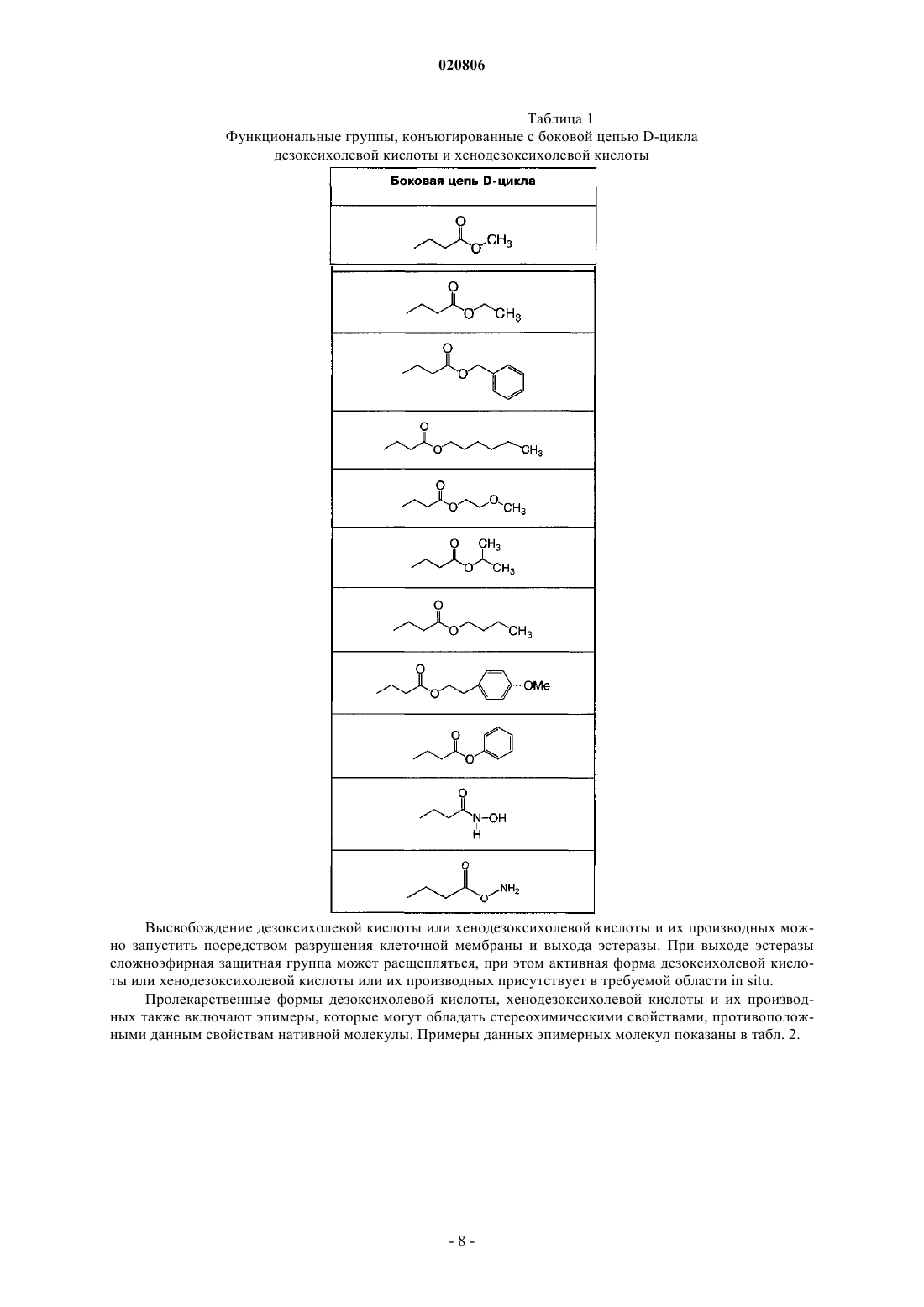
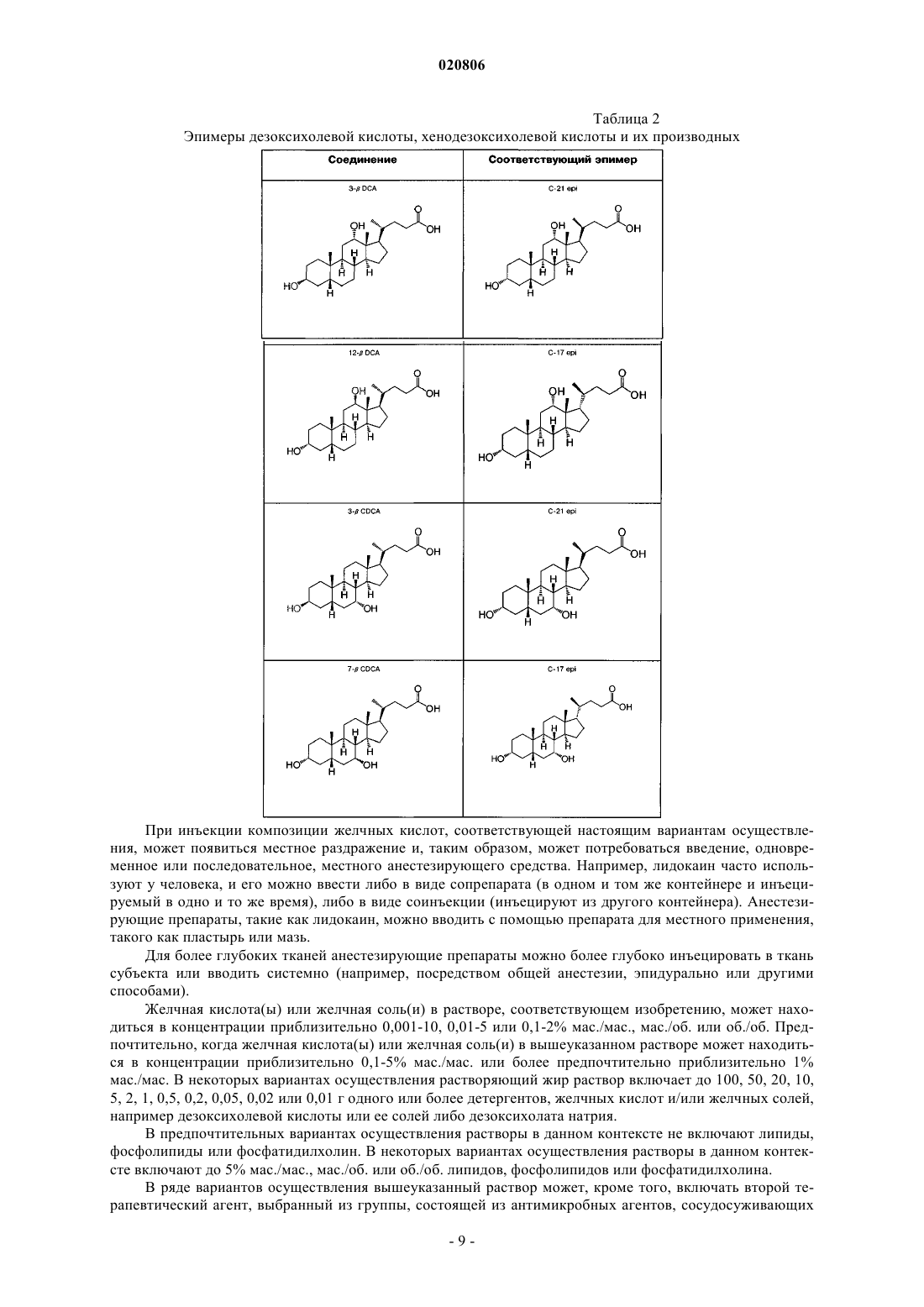
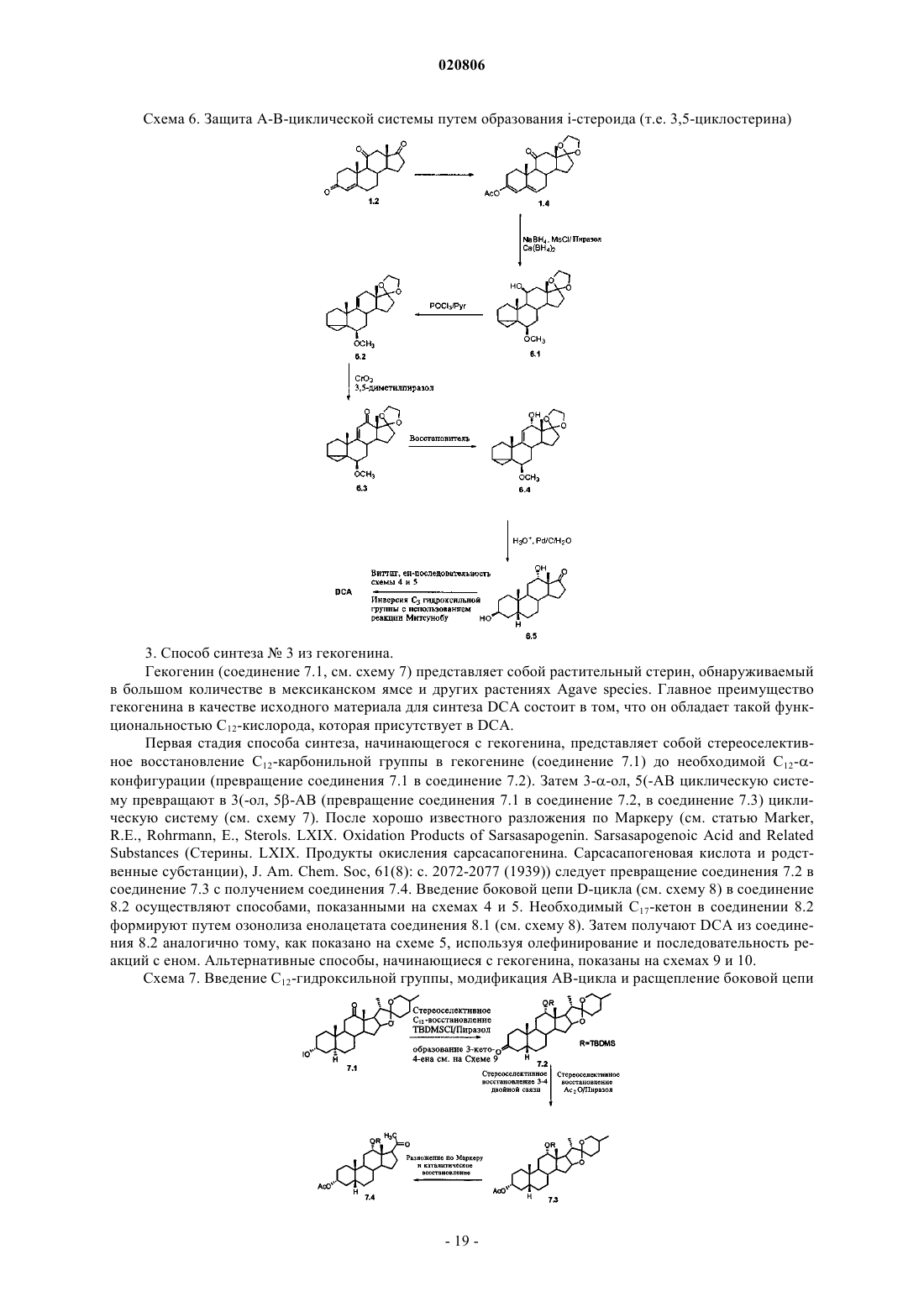
Способ получения дезоксихолевой кислоты (варианты), дезоксихолевая кислота, полученная указанным способом, фармацевтическая композиция, ее содержащая, способ удаления жировых отложений
Номер патента: 20806
Опубликовано: 30.01.2015
Авторы: Дэвид Натаниэл Е., Рейд Джон Грегори, Саху Акила Кумар, Прасад Ачампета Ратан, Махмуд Надир Ахмедуддин, Сваринген Рой А.Джей, Мориарти Роберт М.
Формула / Реферат
1. Способ получения дезоксихолевой кислоты или ее фармацевтически приемлемой соли, включающий проведение реакции 9α-гидроксиандрост-4-ен-3,17-диона формулы 1 с Н2 в условиях гидрирования с образованием соединения формулы 2
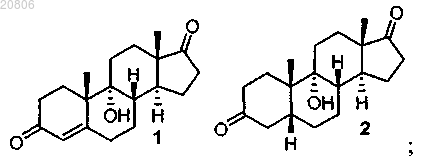
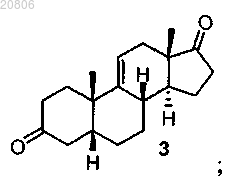
проведение реакции соединения формулы 2 с кислотой с образованием соединения формулы 3
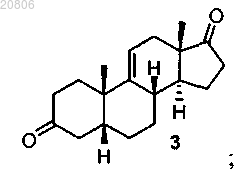
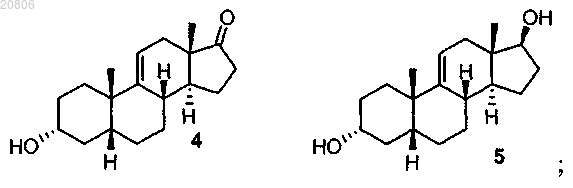
проведение реакции соединения формулы 3 с восстановителем с образованием соединения формулы 4 в виде смеси соединений формул 4 и 5
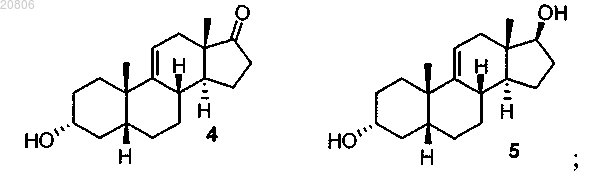
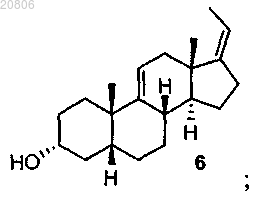
проведение реакции соединения формулы 4 с реагентом для олефинирования двух атомов углерода в условиях образования олефина с формированием соединения формулы 6
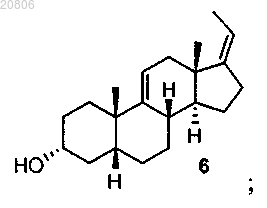
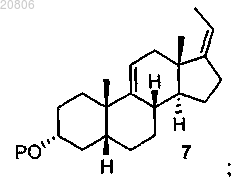
превращение соединения формулы 6 в соединение формулы 7
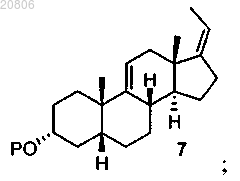
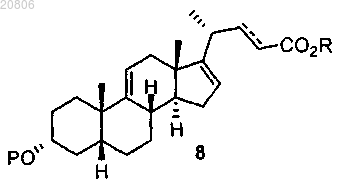
проведение реакции соединения формулы 7 с алкилпропиолатом CHºCC(O)OR или алкилакрилатом CH2=CHC(O)OR в присутствии кислоты Льюиса с образованием соединения формулы 8
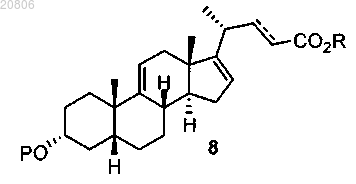
где пунктирная линия ![]() означает одинарную или двойную связь,
означает одинарную или двойную связь,
проведение реакции соединения формулы 8 с Н2 в условиях гидрирования с образованием соединения формулы 9
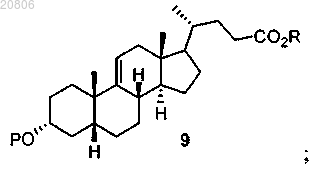
проведение реакции соединения формулы 9 с окислителем с образованием соединения формулы 10
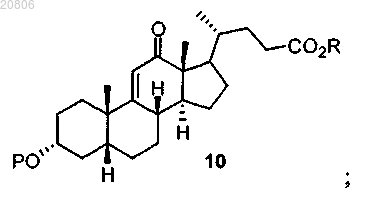
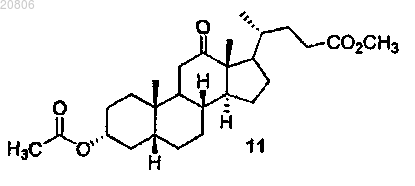
проведение реакции соединения формулы 10 с Н2 в условиях гидрирования с образованием соединения формулы 11
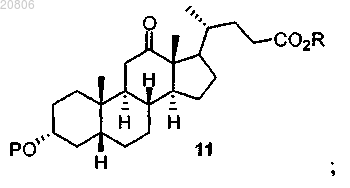
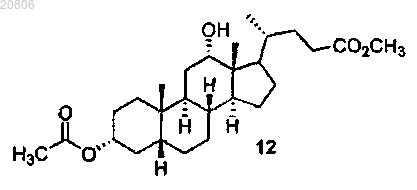
проведение реакции соединения формулы 11 с восстановителем с образованием соединения формулы 12
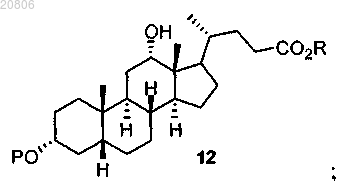
и воздействие на соединение формулы 12 условиями снятия защиты с образованием его сложного эфира и подходящими условиями гидролиза с образованием дезоксихолевой кислоты формулы

характеризующейся синтетической боковой цепью формулы
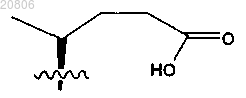
или ее фармацевтически приемлемой соли, причем в раскрытых выше соединениях Р представляет собой защитную группу, a R представляет собой С1-С6-алкил.
2. Способ по п.1, в котором при образовании соединения формулы 2 в условиях гидрирования используют катализатор Pd/C.
3. Способ по п.1, в котором в качестве кислоты, посредством которой образуют соединение формулы 3, берут минеральную кислоту.
4. Способ по п.3, в котором минеральная кислота представляет собой H2SO4.
5. Способ по п.1, в котором восстановитель, посредством которого образуют соединение формулы 4, представляет собой LiAl(OtBu)3H.
6. Способ по п.1, в котором реагент для олефинирования двух атомов углерода, посредством которого формируют соединение формулы 6, представляет собой Ph3PCH2CH3+Br-.
7. Способ по п.1, в котором защитная группа Р соединений 7-12 представляет собой -С(О)СН3.
8. Способ по п.1, в котором кислота Льюиса, посредством которой образуют соединение формулы 8, представляет собой EtAlCl2.
9. Способ по п.1, в котором алкилпропиолат или алкилакрилат представляет собой метилпропиолат или метилакрилат.
10. Способ по п.1, в котором при образовании соединения формулы 9 в условиях гидрирования используют катализатор PtO2.
11. Способ по п.1, в котором окислитель, посредством которого образуют соединение формулы 9, представляет собой CrO3.
12. Способ по п.1, в котором при образовании соединения формулы 11 в условиях гидрирования используют катализатор Pd/C.
13. Способ по п.1, в котором восстановитель, посредством которого образуют соединение формулы 12, представляет собой LiAl(OtBu)3H.
14. Способ по п.1, в котором при Р, представляющем собой -С(О)СН3, условия снятия защиты и гидролиза включают проведение реакции соединения 12 с гидроксидом щелочного металла, алкоксидом щелочно-земельного металла или смесью обоих.
15. Способ по п.1, в котором при Р, представляющем собой -С(О)СН3, условия снятия защиты и гидролиза включают проведение реакции соединения 12 с LiOH.
16. Способ получения дезоксихолевой кислоты или ее фармацевтически приемлемой соли, включающий проведение реакции соединения формулы 10
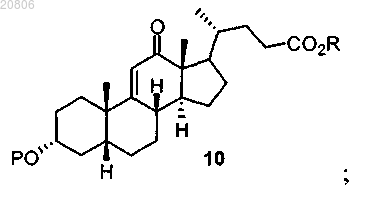
с Н2 в условиях гидрирования с образованием соединения формулы 11
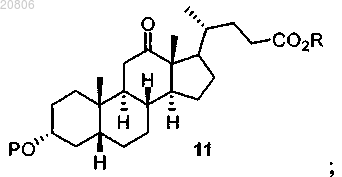
проведение реакции соединения формулы 11 с восстановителем с образованием соединения формулы 12

и воздействие на соединение формулы 12 условиями снятия защиты с образованием его сложного эфира и, необязательно, подходящими условиями гидролиза с образованием дезоксихолевой кислоты формулы
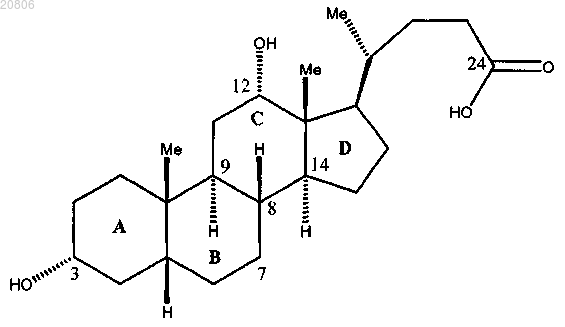
характеризующейся синтетической боковой цепью формулы

или ее фармацевтически приемлемой соли, причем в раскрытых выше соединениях Р представляет собой защитную группу, a R представляет собой С1-С6-алкил.
17. Способ получения дезоксихолевой кислоты или ее фармацевтически приемлемой соли, включающий проведение реакции 9α-гидроксиандрост-4-ен-3,17-диона 1 с Н2 в условиях гидрирования с катализатором Pd/C с образованием соединения формулы 2
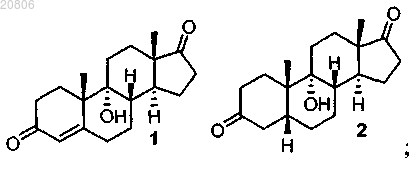
проведение реакции соединения формулы 2 с H2SO4 с образованием соединения формулы 3
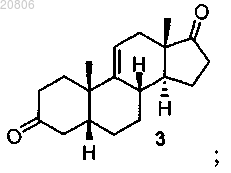
проведение реакции соединения формулы 3 с LiAl(OtBu)3 с образованием соединения формулы 4 в виде смеси соединений формул 4 и 5
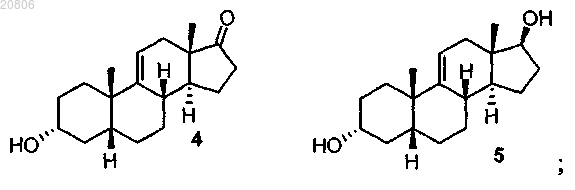
проведение реакции соединения формулы 4 с Ph3PCH2CH3+Br- для олефинирования двух атомов углерода в условиях образования олефина с формированием соединения формулы 6
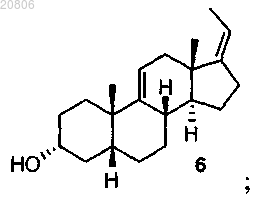
превращение соединения формулы 6 в соединение формулы 7
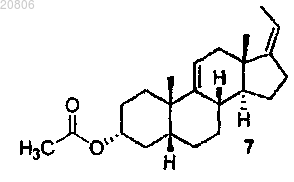
проведение реакции соединения формулы 7 с метилпропиолатом СНºСС(О)ОСН3 или метилакрилатом СН2=СНС(О)ОСН3 в присутствии EtAlCl2 с образованием соединения формулы 8
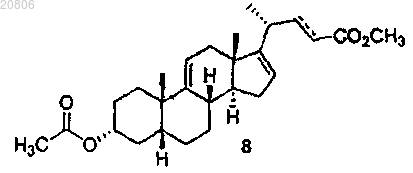
где пунктирная линия ![]() означает одинарную или двойную связь,
означает одинарную или двойную связь,
проведение реакции соединения формулы 8 с Н2 в условиях гидрирования с катализатором PtO2 с образованием соединения формулы 9
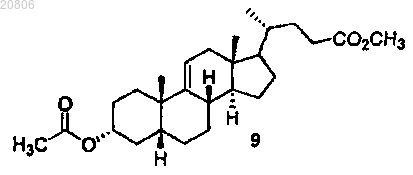
проведение реакции соединения формулы 9 с CrO3 с образованием соединения формулы 10
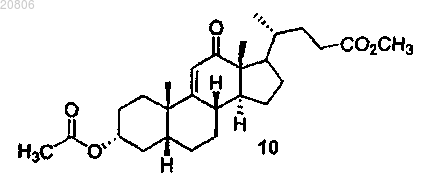
проведение реакции соединения формулы 10 с Н2 в условиях гидрирования с Pd/C катализатором с образованием соединения формулы 11
проведение реакции соединения 11 с LiAl(OtBu)3H с образованием соединения формулы 12
и воздействие на соединение формулы 12 условиями снятия защиты и условиями гидролиза с LiOH с образованием дезоксихолевой кислоты формулы
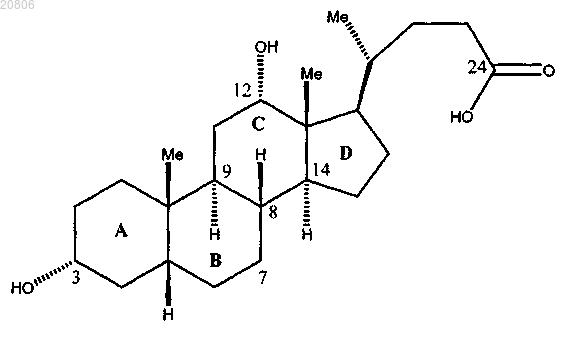
характеризующейся синтетической боковой цепью формулы
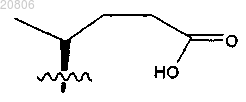
или ее фармацевтически приемлемой соли.
18. Дезоксихолевая кислота или ее фармацевтически приемлемая соль, полученные способом по любому из пп.1-17.
19. Фармацевтическая композиция, включающая дезоксихолевую кислоту или ее фармацевтически приемлемую соль по п.18 и фармацевтически приемлемый наполнитель.
20. Композиция по п.19, в которой фармацевтически приемлемая соль является солью натрия.
21. Композиция по п.19 или 20, в которой концентрация дезоксихолевой кислоты или фармацевтически приемлемой соли находится в диапазоне от 0,001 до 10% мас./мас., мас./об. или об./об., предпочтительно находится в диапазоне от 0,01 до 5%.
22. Композиция по любому из пп.19-21, которая дополнительно содержит липид, фосфолипид, фосфатидилхолин до 5% включительно мас./мас., мас./об. или об./об.
23. Композиция по любому из пп.19-22, которая дополнительно содержит по меньшей мере один активный ингредиент, выбранный из группы, включающей антимикробный агент, сосудосуживающий компонент, антитромботический агент, противосвертывающий агент, пеногаситель, противовоспалительный агент, анальгетик, диспергатор, антидиспергатор, усилитель проникновения, стероид, транквилизатор, мышечный релаксант и антидиарейный агент.
24. Композиция по любому из пп.19-23, которая содержит по меньшей мере один детергент.
25. Композиция по любому из пп.19-24, которая содержит по меньшей мере один дополнительный активный ингредиент, выбранный из группы, включающей антагонист рецептора нейропептида Y (NPY) и избирательный в отношении жира проапоптотический пептид.
26. Композиция по п.25, в которой указанный антагонист рецептора нейропептида Y (NPY) выбран из группы, включающей BIBP-3226, антагонист нейропептида Y5 (антагонисты рецептора NPY Amgen), BIBO-3304 (антагонист рецептора NPY Boehringer Ingelheim), BMS-192548 (антагонист рецептора NPY Bristol-Myers Squibb), AR-H040922 (антагонист рецептора NPY Bristol-Myers Squibb), LY-357897 (антагонист рецептора NPY Eli Lilly), антагонист рецептора NPY-Y5 Esteve, 1229U91 (антагонисты рецептора NPY GlaxoSmithKline), GW438014S (антагонисты рецептора NPY GlaxoSmithKline), JNJ-5207787 (антагонист рецептора NPY Johnson & Johnson), Lu-AA-44608 (антагонист рецептора NPY Lundbeck), MK-0557 (антагонист рецептора NPY Merck), NGD-95-1 (антагонист рецептора NPY Neurgogen), NLX-E201 (антагонист рецептора NPY Neurologix), CGP-71683 (антагонист рецептора NPY Novartis), PD-160170 (антагонисты рецептора NPY Pfizer), SR-120819A (антагонисты рецептора NPY Sanofi Aventis), BIIE0246 (антагонисты рецептора NPY Sanofi Aventis), S.A.0204 (антагонисты рецептора NPY Sanofi Aventis) и S-2367 (антагонист рецептора NPY Shiongli).
27. Композиция по п.25, в которой избирательный в отношении жира проапоптотический пептид представляет собой пептид CKGGRAKDC, который направлен на сосудистую сеть белой жировой ткани.
28. Применение композиция по любому из пп.19-27 для адиполитической терапии у млекопитающих.
29. Применение по п.28, в котором адиполитическая терапия направлена на патологически жировые отложения.
30. Применение по п.29, в котором жировые отложения связаны с условиями, выбранными из группы, включающей ожирение, синдром перераспределения жира, образование жировой грыжи века, липому, болезнь Деркама, липодистрофию, липодистрофию горба буйвола, дорсоцервикальный жир, висцеральное ожирение, увеличение молочных желез, гиперожирение, диффузные жировые тела вокруг туловища и рук и жировые отложения, связанные с целлюлитом.
31. Способ косметического безоперационного местного удаления жировых отложений из выбранных областей тела пациента, включающий введение в указанную область терапевтически эффективного количества композиции по любому из пп.19-27.
32. Способ по п.31, в котором введение представляет собой подкожное, субдермальное или чрескожное введение.
33. Способ по п.31 или 32, который дополнительно включает одновременное введение местного анестетика в указанную область.
34. Способ по любому из пп.31-33, в котором указанную область выбирают из группы областей, включающей область под глазом, под подбородком, подмышкой, на ягодице, щеке, брови, икре, спине, бедре, лодыжке или в брюшной области под подбородком.
35. Соединения, полученные по п.1 или 17 и выбранные из группы, включающей
9α-гидрокси-5β-андростан-3,17-дион (2),
5β-андрост-9(11)-ен-3,17-дион (3),
(Z)-3α-гидрокси-5β-прегна-9(11),17(20)-диен (6),
(Z)-3α-ацетокси-5β-прегна-9(11),17(20)-диен (7а),
(Е)-метил 3α-ацетокси-5β-хол-9(11),16,22-триен-24-оат (8а) и
метил 3α-ацетокси-5β-хол-9(11),16-диен-24-оат (8b).
36. Соединение по п.35, которое представляет собой 9α-гидрокси-5β-андростан-3,17-дион (2).
37. Соединение по п.35, которое представляет собой 5β-андрост-9(11)-ен-3,17-дион (3).
38. Соединение по п.35, которое представляет собой (Z)-3α-гидрокси-5β-прегна-9(11),17(20)-диен (6).
39. Соединение по п.35, которое представляет собой (Z)-3α-ацетокси-5β-прегна-9(11),17(20)-диен (7а).
40. Соединение по п.35, которое представляет собой (Е)-метил 3α-ацетокси-5β-хол-9(11),16,22-триен-24-оат (8а).
41. Соединение по п.35, которое представляет 3α-ацетокси-5β-хол-9(11),16-диен-24-оат (8b).
42. Способ получения соединения по формуле 10
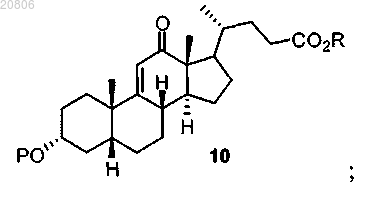
включающий проведение реакции 9α-гидроксиандрост-4-ен-3,17-диона 1 с Н2 в условиях гидрирования с образованием соединения формулы 2
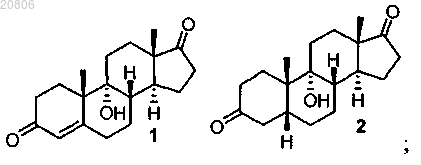
проведение реакции соединения формулы 2 с кислотой с образованием соединения формулы 3
проведение реакции соединения формулы 3 с восстановителем с образованием соединения формулы 4 в виде смеси соединений формул 4 и 5
проведение реакции соединения формулы 4 с реагентом для олефинирования двух атомов углерода в условиях образования олефина с формированием соединения формулы 6
превращение соединения формулы 6 в соединение формулы 7
проведение реакции соединения формулы 7 с алкилпропиолатом CHºCC(O)OR или алкилакрилатом CH2=CHC(O)OR в присутствии кислоты Льюиса с образованием соединения формулы 8
где пунктирная линия ![]() означает одинарную или двойную связь,
означает одинарную или двойную связь,
проведение реакции соединения формулы 8 с Н2 в условиях гидрирования с образованием соединения формулы 9
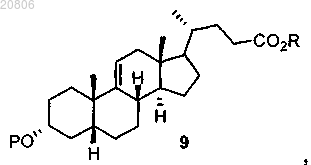
проведение реакции соединения формулы 9 с окислителем с образованием соединения формулы 10, причем в раскрытых выше соединениях Р представляет собой защитную группу, a R представляет собой С1-С6-алкил.
43. Способ получения соединения (Е)-метил 3α-ацетокси-5β-хол-9(11),16,22-триен-24-оат (8а) или метил 3α-ацетокси-5β-хол-9(11),16-диен-24-оат (8b), включающий проведение реакции (Z)-3α-ацетокси-5β-прегна-9(11),17(20)-диен (7а) с алкилпропилатом CHºCC(O)OR или алкилакрилатом CH2=CHC(O)OR, где R представляет собой С1-С6-алкил в присутствии кислоты Льюиса.
Текст
СПОСОБ ПОЛУЧЕНИЯ ДЕЗОКСИХОЛЕВОЙ КИСЛОТЫ (ВАРИАНТЫ),ДЕЗОКСИХОЛЕВАЯ КИСЛОТА, ПОЛУЧЕННАЯ УКАЗАННЫМ СПОСОБОМ,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ЕЕ СОДЕРЖАЩАЯ, СПОСОБ УДАЛЕНИЯ ЖИРОВЫХ ОТЛОЖЕНИЙ(CA), Прасад Ачампета Ратан (IN),Сваринген Рой А. Джей, Рейд Джон Грегори (US), Саху Акила Кумар (IN) Попеленский Н.К. (RU) В изобретении описаны желчные кислоты и родственные композиции, а также способы синтеза и применение. В частности, предложены дезоксихолевая кислота и родственные композиции, причем указанные композиции свободны от всех примесей животной природы и свободны от пирогенных примесей. Область техники, к которой относится изобретение Настоящее изобретение относится в широком смысле к желчным кислотам и родственным композициям и способам. В одном аспекте настоящее изобретение относится к дезоксихолевой кислоте и родственным композициям, полезным промежуточным продуктам и способам их синтеза. В другом аспекте настоящее изобретение относится к применению заявленных композиций и способов в качестве фармацевтических композиций, а также способов их получения. Важно, что желчные кислоты по настоящему изобретению не выделены у млекопитающих или из микробных организмов, продуцирующих данные кислоты в естественных условиях, и, таким образом, они свободны от любых токсинов и примесей, связанных с данными организмами. В другом аспекте настоящее изобретение относится к синтезу дезоксихолевой кислоты и ее фармацевтически приемлемых солей и промежуточных продуктов. Сведения о предшествующем уровне техники Холанология, изучение желчных кислот и особенно химии желчных кислот, представляла интерес в течение большей части столетия. Хотя многое известно, химия желчных кислот включает широкий круг химических структур, многие из которых обладают неожиданными свойствами. В плане обзора см., например, статью Mukhopadhyay, S. и U. Maitra, Current Science 87:1666-1683 (2004) ("Chemistry and biologyof bile acids" ("Химия и биология желчных кислот"), включенную в данном контексте в виде ссылки. Желчные кислоты характеризуются двумя связанными структурами, жестким стероидным ядром и короткой алифатической боковой цепью (см. фиг. 1 настоящей заявки); см. статью Hofmann, A.F., et al. В плане предлагаемой номенклатуры желчных кислот см. J. Lipid Res. 33:599-604 (1992). Как ядро, так и боковая цепь имеют большое число возможных стерических положений. Ядро может быть изменено путем увеличения или сокращения отдельных циклов, и боковая цепь может быть укорочена или удлинена. Кроме того, обе части молекулы желчной кислоты имеют большое количество возможных полярных заместителей. На ядре или боковой цепи могут присутствовать ионизирующие группы. Наконец, конъюгирующие группы могут находиться на ядре (например, сульфат, глюкуронат, фосфат) или на боковой цепи(глицин либо таурин или другие аминокислоты либо даже сахара). Структура боковой цепи определяет класс соединения (желчные кислоты или желчные соли). Желчные кислоты являются амфифильными веществами, имеющими как амфифильную, так и амфипатическую "поверхность": Hofman, A.F., News Physiol. Sci. 14: 24-29 (1999) "Bile Acids: The good, the По договоренности гидрофобную поверхность называют "-сторона" и гидрофильную поверхность называют "-сторона". В общем, -сторона растворима в липидах и -сторона относительно полярна. Существуют желчные кислоты, например, имеющие полярные группы (гидроксильные группы в природных желчных кислотах) на гидрофобной стороне, а также на гидрофильной стороне, например урсодезоксихолевая кислота. Амфипатическая природа молекулы отвечает за формирование ею смешанных мицелл с амфипатическими, но нерастворимыми в воде липидами, такими как фосфатидилхолин. Желчные кислоты не будут солюбилизировать входящие в состав пищи липиды в форме смешанных мицелл до тех пор, пока содержание желчных кислот превышает критическую концентрацию, называемую критической концентрацией мицеллизации. Желчные кислоты, обнаруженные в максимальном соотношении у человека, представляют собой хенодезоксихолевую кислоту и дезоксихолевую кислоту. Дезоксихолевая кислота известна также как дезоксихолат, холаноевая кислота и 3,12-дигидрокси-5-холанат. В организме человека дезоксихолевая кислота используется в эмульгировании жиров для всасывания в кишечнике. В исследования дезоксихолевую кислоту используют в качестве мягкого детергента для выделения мембранаассоциированных белков. Будучи в существенной степени очищенной, дезоксихолевая кислота находится в форме кристаллического порошка от белого до не совсем белого цвета. Дезоксихолевая кислота представляет собой одну из четырех основных кислот, образуемых печенью. Она растворима в спирте и уксусной кислоте. Номер CAS (Реферативной службы по химии) дезоксихолевой кислоты [83-44-3]. Быстрое удаление жиров организма издавна является мечтой, и заявлено множество субстанций,предназначенных для достижения данных результатов, хотя немногие дали результаты. "Мезотерапия" или использование инъекционных препаратов для удаления жира не является широко распространенной среди практикующих врачей из соображений безопасности и эффективности, хотя гомеопатические и косметические заявки делают с 1950 г. Мезотерапия изначально возникла в Европе как способ использования кожных инъекций, содержащих смесь соединений, предназначенную для лечения местных медицинских и косметических состояний. Хотя мезотерапию традиционно использовали для облегчения боли,-1 020806 ее косметическое применение, в частности, при удалении жира и целлюлита недавно привлекло внимание в Соединенных Штатах Америки. Один из данных описанных вариантов лечения с целью местного уменьшения жира, который был распространен в Бразилии и в котором используют инъекции фосфатидилхолина, ошибочно считали синонимом мезотерапии. Несмотря на его привлекательность как предполагаемой "жирорастворяющей" инъекции, безопасность и эффективность данных косметических видов лечения остаются неясными для большинства пациентов и врачей; см. статью Rotunda, A.M. and M. Kolodney, Dermatologic Surgery 32:465-480 (2006) ("Mesotherapy and Phosphatidylcholine Injections: HistoricalClarification and Review" (Мезотерапия и инъекции фосфатидилхолина, исторический аспект и обзор). Заявка WO 2006/133160 (включенная в данном контексте в своей полноте, включая чертежи) описывает способы липомоделирования, например уменьшения отложения жира, путем введения антагониста рецептора нейропептида Y в область отложения жира. В статье Kolonin M.G. et al., Nat. Med. June 10(6):625-32 (2004) описывают избирательные в отношении жира проапоптотические пептиды, обладающие сильными эффектами уничтожения жировых клеток. Для проявления эффекта уничтожения описанным проапоптотическим пептидам необходима избыточная сосудистая сеть. В недавно опубликованной литературе показано, что дезоксихолевая кислота обладает свойствами удаления жира при инъекции в жировые отложения in vivo; см. WO 2005/117900 и WO 2005/112942, а также US2005/0261258; US2005/0267080; US2006/127468 и US2006/154906, все из которых включены в данном контексте в виде ссылки в своей полноте, включая чертежи. Дезоксихолат, введенный в жировую ткань, обладает двумя эффектами: 1) он уничтожает жировые клетки посредством цитолитического механизма и 2) он вызывает сжатие кожи. Оба данных эффекта необходимы для опосредования требуемых эстетических исправлений (т.е. формирования контура тела). Поскольку дезоксихолат, инъецированный в жир, быстро инактивируется под воздействием белка и затем быстро возвращается в содержимое кишечника, его эффекты пространственно ограничены. В результате данного эффекта ослабления, который обусловливает клиническую безопасность, лечение, направленное на удаление жира, как правило, требует проведения 4-6 курсов. Данное местное удаление жира без необходимости хирургического вмешательства благоприятно не только в плане терапии, относящейся к патологически локализованным жировым отложениям (например, случаям дислипидемии, характерным для медицинских вмешательств при лечении ВИЧ), но также в плане косметического удаления жира без сопутствующего риска, присущего хирургическому вмешательству (например, липосакции); см. статью Rotunda et al., Dermatol. Surgery 30: 1001-1008 (2004) ("Detergent effects of sodium deoxycholate are a major feature of an injectable phosphatidylcholine formulation used for localized fat dissolution" (Эффекты детергента у дезоксихолата натрия являются основным свойством инъекционного препарата фосфатидилхолина, используемого для местного растворения жира) и статью Rotunda et al., J. Am. Acad. Dermatol. 2005: 973-978 ("Lipomas treated with subcutaneous deoxycholate injections" (Липомы, леченные подкожными инъекциями дезоксихолата, обе из которых включены в данном контексте в виде ссылки. Препараты желчных кислот фармацевтического качества коммерчески доступны при относительно низкой стоимости. Данная низкая стоимость обусловлена тем фактом, что желчные кислоты получают из туш животных, особенно крупных животных, таких как коровы и овцы. Важно, что как в случае всех лекарственных средств из животных источников существует проблема того, что выделенные у животных продукты желчных кислот могут содержать патогены животных и другие вредные агенты, такие как метаболиты и токсины животных или микробов, в том числе бактериальные токсины, такие как пирогены. Данные патогены животных могут включать прионы, которые, как считают, представляют собой тип инфекционного патогенного белка, который может вызывать прионовые заболевания. Прионовые заболевания представляют собой дегенеративные нарушения нервной системы. Одно из данных заболеваний, болезнь "коровье бешенство" (считают, что оно является вариантом болезни Крейтцфельда-Якоба(CJD, как полагают, вызывается прионом, находящимся в съедобном мясе больных коров. Большинство случаев являются спорадическими с неизвестным способом передачи; некоторые случаи являются наследственными и небольшое число передается при медицинских процедурах. Распространение человеческих прионовых заболеваний посредством употребления инфицированного материала ранее подразумевали при куру и с недавнего времени при варианте CJD. Все другие прионовые болезни животных (скрепи овец, трансмиссивная энцефалопатия норок, вызывающая истощение болезнь оленей и губчатая энцефалопатия крупного рогатого скота), по-видимому, горизонтально передаются при контакте с инфицированными животными или путем потребления инфицированной пищи. Оценку риска и предсказания будущих событий, относящихся к прионовым болезням, трудно провести вследствие различных путей передачи, непредсказуемых видовых барьеров, различного распределения инфекционного начала в тканях и штаммовых вариациях, обнаруживаемых при ряде заболеваний. Как правило, продукты животной природы могут подвергаться воздействию микробных организмов, которые продуцируют пирогены (субстанции, вызывающие лихорадочное состояние). Бактериальные заражения пищевых и/или фармацевтических продуктов также представляют собой серьезную проблему, как подтверждается заражением продуктов питания энтерогеморагической Е. coli. Продукты, такие как различные сорта говядины, а также такие продукты, как яблоки, шпинат и т.п., подвержены данному заражению. В данных случаях токсин, продуцируемый бактериями (а не сами бактерии), является тем, что дает вредные эффекты для человека. Данные вредные эффекты включают тяжелую диарею, почечную недостаточность и в чрезвычайных случаях смерть. Бактериальные эндотоксины, тип пирогена,должны быть исключены из всех фармацевтических композиций. Продукты животной природы, как правило, очищают способом исключения, т.е., а не выделения конечного продукта из смеси, причем конечный продукт представляет собой материал, остающийся после исключения примесей. И в дополнение к потенциальным молекулам животной природы, таким как патогены, другим артефактом очистки из источников животной природы является то, что конечный продукт представляет собой смесь одной или более желчных кислот. Например, коммерческие препараты дезоксихолевой кислоты включают некоторое количество хенодоксихолевой кислоты, а также холевой кислоты, которая является предшественником обеих, дезоксихолевой и хедодезоксихолевой кислоты при синтезе желчных кислот у млекопитающих. Поскольку точное соотношение дезокси/хено/холевой кислот предварительно не выбирают, это может привести в результате к варьированию от партии к партии,когда предполагают изготовление больших количеств желчных кислот. Данное варьирование от партии к партии может быть проблематичным и может приводить к дополнительным стадиям в сборе регулирующих утверждений или контроле качества, особенно в попытках получить фармацевтическую композицию. Ясно, что изготовители хотели бы предсказуемости результатов от партии к партии при изготовлении фармацевтических композиций желчных кислот. В настоящее время проблемы, касающиеся продуктов животной природы, содержащих патогены животных и другие вредные агенты, решают путем получения из изолированных и обследованных животных. Например, дезоксихолевая кислота из животных в Новой Зеландии является источником желчных кислот для использования у человека согласно регуляторным схемам США до тех пор, пока животные продолжают оставаться изолированными и иным образом свободными от исследуемых патогенов. Неявным образом необходимость данной контролируемой правительством регуляторной схемы является признанием действительного риска передачи патогенов животных при инъекции лекарственных средств животной природы. Когда альтернативные лекарственные средства неживотной природы становятся доступными, правительственная регуляторная схема больше не требуется. Примером данной альтернативы (лекарственного средства неживотной природы, заменяющей лекарственное средство животной природы) и связанных с ним преимуществ является инсулин, предназначенный для применения у человека. Производство коровьего инсулина в Соединенных Штатах Америки прекращено в 1998 г. и свиного инсулина, предназначенного для применения у человека, прекращено в январе 2006 г. Хотя инсулин животной природы можно получить в стадах, о которых неизвестно, чтобы они подвергались воздействию вызывающих BSE или других патогенных агентов, производственное оборудование или процессы могут подвергнуть ингредиенты животной природы воздействию животных, на которых воздействовали патогены. Риск передачи патогенных агентов человеку можно исключить путем использования инсулина, который получают рекомбинантно или синтетически. Для потребителей ситуация с инсулином наглядна: когда синтетический материал имеется в свободном доступе, риск передачи патогенов животных теоретически исключен. Для изготовителей возможность производить чистое химическое вещество,которое в существенной степени свободно от материала патогенов животной природы, дает преимущество в плане безопасности, качества и регуляторных целей. Кроме того, способ синтеза, как правило, дает в большей степени воспроизводимый продукт, чем выделяемый из биологических источников. В настоящее время вследствие относительного преобладания желчных кислот, полученных из туш животных, промышленность не предпринимает шаги ни для полного химического синтеза желчных кислот, ни для получения желчных кислот с использованием фитостерина или микробных исходных материалов. И хотя синтезированы производные желчных кислот, данная работа снова в основном включает желчные кислоты животной природы в качестве исходных материалов для химии стероидов вследствие низкой стоимости и легкой доступности материалов животной природы. Несмотря на предшествующие активные попытки, предпринимаемые в исследованиях фитостеринов, отсутствуют легкодоступные коммерческие композиции, полученные из фитостеринов желчных кислот фармацевтического качества; см., например, статью Mukhopadhyay, S. and U. Maitra., Current Science 87: 1666-1683, 1670 (2004) (отмечая, что полный синтез любой желчной кислоты не проводили с учетом ссылки на статью 1981 г. Kametani et al. J. Am. Chem. Soc. 103: 2890 (1981) ("First Total Synthesis of (+)-Chenodeoxycholic acid" (Первый полный синтез (+)-хенодезоксихолевой кислоты). Микробные, такие как бактериально продуцируемые желчные кислоты, использовали in situ как бактериальные продукты, например, для очистки разливов нефти в море; см. статью Maneerat et al., Appl. Microbiol. Biotechnol. 76: 679-683 (2004) ("Bile acids arenew products of a mariene bacterium, Myroides sp. Strain SM1" (Желчные кислоты являются новыми продуктами морской бактерии Myroides sp. штамм SM1). Для того чтобы полностью реализовать потенциал дезоксихолевой кислоты в плане удаления жира,обязательно, чтобы беспокойство относительно использования продуктов животной природы было более направленным. Ясно, что существует необходимость в соответствующих количествах эффективных жирных кислот и родственных композиций, таких как дезоксихолевые кислоты, которые, как известно изначально, свободны от веществ животной природы (или патогенных веществ, способных воздействовать на животных, особенно млекопитающих, и при применении у человека обладающих вредным эф-3 020806 фектом на человека) и других вредных агентов, таких как метаболиты животной или микробной природы, токсины, включая бактериальные токсины, такие как пирогены, для использования в качестве лекарственных препаратов для человека. Настоящее изобретение направлено на данную проблему, предусматривая синтетически полученные композиции желчных кислот, свободных от потенциального риска присутствия патогенов животной природы и других вредных агентов. Раскрытые композиции желчных кислот могут быть использованы в адиполитической терапии и будут служить для последующего перспективного исследования и экспериментальных попыток в области местного удаления жира. Сущность изобретения В данном контексте предусматривают адекватные количества подходящей желчной кислоты в виде определенной фармацевтической композиции, а также способы ее синтеза. Композиции желчных кислот и предусматриваемые таким образом способы не основаны на млекопитающих или микробных организмах, которые в естественных условиях продуцируют желчные кислоты. В одном аспекте предусматривают определенные композиции дезоксихолевой кислоты, которые свободны от всех веществ животной природы и пирогенов млекопитающих и/или бактериальных пирогенов, и соответствующие способы получения и применения. В другом аспекте предусматривают адекватные количества подходящих дезоксихолевых кислот в виде определенных фармацевтических композиций, которые можно использовать как инъекционную фармацевтическую композицию для местного удаления жира, наряду с родственными композициями, способами получения и способами применения. Определенные инъекционные препараты дезоксихолата, соответствующие настоящему изобретению, можно комбинировать с молекулой, которая вызывает уничтожение жира посредством ортогонального механизма, например, с антагонистами NPY и/или избирательными в отношении жира проапоптотическими пептидами, с получением агентов, предназначенных для использования при создании более сильных средств для опосредования формирования контуров тела в течение уменьшенного количества терапевтических сеансов. В другом аспекте настоящее изобретение предусматривает способы и промежуточные продукты, относящиеся к синтезу дезоксихолевой кислоты и ее фармацевтически приемлемых солей. Полученную синтетическим путем дезоксихолевую кислоту можно использовать в адиполитической терапии для удаления жира. Все публикации и патентные заявки, упомянутые в данном описании, включены в данном контексте в виде ссылки в той же самой степени, как если бы для каждой отдельной публикации или патентной заявки было специально и отдельно указано, что она включена посредством ссылки. На протяжении данного описания на различные публикации, патенты и опубликованные патентные описания ссылаются посредством идентифицирующей ссылки. Описания данных публикаций, патентов и опубликованных патентных описаний в данном контексте включены в виде ссылки в настоящее описание, чтобы более полно описать состояние области техники, к которой относится изобретение. Как используют в данном контексте, некоторые термины имеют следующие определенные значения. Как используют в описании и формуле изобретения формы единственного числа включают ссылки на единственное и множественное число, пока из контекста ясно не следует иное. До тех пор пока не указано иначе, все числа, выражающие количества ингредиентов, условия реакции и т.п., используемые в описании и формуле изобретения, следует понимать как корректируемые во всех случаях термином "приблизительно". Соответственно, пока не указано противоположное, численные параметры, приведенные в следующем описании и прилагаемой формуле изобретения, являются приближенными значениями. Каждый численный параметр должен быть, по меньшей мере, ограничен в свете числа представленных значащих цифр и путем использования обычных методов округления. Термин "ацетилирующий реагент" относится к реагенту, в котором можно ввести ацетильную группу СН 3 С(О)- в молекулу. Термин "кислота" относится к донору протона и включает как органические, так и неорганические кислоты. Термин "алкил" относится к одновалентным насыщенным алифатическим углеводородным группам, имеющим от 1 до 10 атомов углерода и предпочтительно 1-6 атомов углерода. Данный термин включает, например, неразветвленные и разветвленные углеводородные группы, такие как метил (СН 3-),этил (СН 3 СН 2-), н-пропил (СН 3 СН 2 СН 2-), изопропил СН 3)2 СН-), н-бутил (СН 3 СН 2 СН 2 СН 2-), изобутил СН 3)2 СНСН 2-), втор-бутил СН 3)(СН 3 СН 2)СН-), трет-бутил СН 3)3 С-), н-пентил (СН 3 СН 2 СН 2 СН 2 СН 2-) и неопентил СН 3)3 ССН 2-). Термин "арил" относится к одновалентной ароматической карбоциклической группе из 6-12 атомов углерода, имеющей один цикл (например, фенил) или множество конденсированных циклов (например,нафтил). Термин "животной природы" относится к происходящему от любого представителя царства (Animalia) живых организмов, включая многоклеточные организмы и одноклеточные организмы. Термин "дегидрирующий реагент" относится к реагенту, который может реагировать с водой. В одном аспекте дегидрирующий реагент может реагировать с водой, которую удаляют из молекулы. Термин "десульфуризирующий реагент" относится к реагенту, который может реагировать с сульфидом. В одном аспекте десульфуризирующий реагент может реагировать с сульфидсодержащей молекулой с целью удаления из молекулы сульфидной группы. Термин "этандитиол или предшественник дитиана" относится к реагенту, который при реакции с карбонильной группой будет образовывать этандитиоловую или дитиановую группу. Термин "электрофильная ацетильная группа" относится к ацетильной группе как к электрофилу,группе, которая притягивается к электронам и имеет тенденцию акцептировать электроны. Термин "гидрирующий реагент" относится к реагенту, который отдает молекуле атом водорода. Термин "кислота Льюиса" относится к акцептору электронной пары. Кислоты Льюиса включают металлоорганические реагенты, такие как галиды алкилалюминия (например, Et2AlCl и MeAlCl2). Термин "происходящий от млекопитающих" относится к происходящему из любого млекопитающего животного. Термин "млекопитающее животное" относится к классу (Mammalia) теплокровных высших позвоночных (например, плацентарных, сумчатых или однопроходных яйцекладущих), которые выкармливают своих детенышей молоком, секретируемым молочными железами, имеют кожу, как правило, больше или меньше покрытую шерстью, и включают человека. Термин "микробной природы" относится к происходящему из любого микробного организма. Термин "микробный организм" относится к домену (Bacteria) прокариотических круглых, спиральных или палочковидных одноклеточных микроорганизмов, у которых могут отсутствовать клеточные стенки или которые являются грамположительными или грамотрицательными, если они имеют клеточные стенки,которые часто объединяются в колонии или передвигаются с помощью жгутиков, которые, как правило,обитают в почве, воде, органическом материале или организмах растений и животных, которые обычно являются автотрофными, сапрофитными или паразитическими по типу питания и которых замечают по их биохимическим эффектам и патогенности. Термин "олефинирующий реагент" относится к реагентам, которые реагируют с кетонами с образованием соответствующих олефинов. Термин "условия образования олефинов" относится к подходящим условиям для проведения данных трансформаций. Примеры данных реагентов включают реагенты Виттига и условия олефинирования Виттига. Термин "окислитель" относится к реагенту, который может акцептировать электроны с окислительно-восстановительной реакции. В данном случае галоген или кислород могут быть введены в молекулу либо водород может быть удален из молекулы. Термин "патоген" относится к специфическому возбудителю заболевания."Фармацевтически приемлемая соль" относится к фармацевтически приемлемым солям, полученным из ряда органических и неорганических противоионов, хорошо известных в области техники, и включают только в качестве примера натрий, калий, литий, кальций, магний, аммоний и тетраалкиламмоний. Подходящие соли включают описанные в справочнике под ред. P. Heinrich Stahl, Camille G. Wermuth, Handbook of Pharmaceutical Salts Properties, Selection, and Use (Справочник по свойствам, выбору и применению фармацевтических солей), 2002. Данные фармацевтически приемлемые соли можно получить путем реакции DCA (дезоксихолевой кислоты) с подходящим основанием. Для иллюстративных целей примеры данных оснований включают гидроксид натрия, гидроксид калия или гидроксид лития. Альтернативно, соли можно получить путем гидролиза сложных эфиров DCA с помощью основания и исключения любой обработки кислой, которая могла бы привести к образованию DCA. Термин "восстановитель" относится к реагенту, который может быть донором электронов в окислительно-восстановительной реакции. В данном случае галоген или кислород можно удалить из молекулы или можно ввести в молекулу водород. Композиции и способы применения В различных аспектах, описанных в данном контексте, настоящее изобретение предусматривает композиции (и эффективные промежуточные продукты), предназначенные для фармацевтического применения, способы их синтеза и способы использования настоящих фармацевтических композиций. Важно, что настоящие композиции желчных кислот свободны от риска, присущего материалу, полученному из исходных материалов животной природы, и вследствие этого не требуют детальных проверок и регуляций, необходимых для материалов, полученных от животных. В одном аспекте данное изобретение направлено, таким образом, на фармацевтические композиции желчных кислот, свободные от материала животной природы, такого как патогены млекопитающих, а также в существенной степени свободно от токсинов бактериальной природы, таких как пирогены. Дезоксихолат натрия представляет собой образующуюся в естественных условиях желчную соль,которая солюбилизирует пищевые липиды в пищеварительном тракте. Он образуется in vivo сложным биосинтетическим путем с использованием холестерина в качестве исходного материала и с участием как человеческих, так и бактериальных ферментов. Основной функцией дезоксихолата является способствовать процессу переваривания путем солюбилизирования пищевых липидов для облегчения всасывания. В организме биосинтез дезоксихолата начинается в ферментативного окисления, изомеризации и восстановления холестерина в печени с образованием холевой кислоты, желчной кислоты, структурно близкой к исходному холестерину (см. раздел Stryer L., глава 27: Biosynthesis of Membrane Lipids andSteroids (Биосинтез мембранных липидов и стероидов) в монографии Biochemistry (Биохимия), 1995,W.H. Freeman and Company: New York. с. 691-707). Затем в печени холевая кислота химически связывается с одной или двумя аминокислотами (таурином или глицином) с образованием "конъюгированных" холевых кислот (т.е. L-гликохолата и таурохолата). Затем данные конъюгированные холевые кислоты находятся в желчном пузыре до приема пищи. После приема пищи раствор желчи высвобождается из желчного пузыря в кишку, причем молекулы конъюгированных желчных кислот являются объектом двух дополнительных химических модификаций, опосредованных ферментами, образуемыми кишечной микрофлорой (см. статью Ridlon J.M., Kang D.J. и Hylemon P.В., Bile salt biotransformations by human intestinal bacteria (Биотрансформации желчных кислот кишечными бактериями человека), J. Lipid Res.,47(2): с. 241-59 (2006. Сначала конъюгированная холевая кислота дегидроксилируется с образованием конъюгированного дезоксихолата. Затем конъюгированный дезоксихолат деконъюгируют с образованием свободного дезоксихолата, который наряду с другими желчными кислотами принимает участие в солюбилизации пищевых жиров. Поскольку дезоксихолат находится ниже холевой кислоты по ходу синтеза, холевая кислота может являться примесью, присутствующей в природных источниках дезоксихолата. Дезоксихолат растворим до концентрации 333 мг/мл в воде, малорастворим в спирте и даже меньше растворим в ацетоне и ледяной уксусной кислоте. Обратимое образование мицелл может происходить при концентрациях дезоксихолата натрия выше критической концентрации мицелл приблизительно 2,4 мг/мл и нейтральном рН (см. статью Matsuoka K., M.Y., Micelle formation of sodium deoxycholate and sodium ursodeoxycholate (Образование мицелл дезоксихолата натрия и урсодезоксихолата натрия) (ч. 1),Biochim. Biophys. Acta., 1580(2-3): с. 189-99 (2002. В концентрациях, превышающих критическую концентрацию мицелл 2,4 мг/мл, дезоксихолат будет образовывать мицеллы и обладает способностью солюбилизировать клетки, липиды и белки. При более низких концентрациях, таких как 0,4 мг/мл (сравнимых с состоянием голодания), дезоксихолат на 98% связан с альбумином (см. статью Roda A. et al., Quantitative aspects of the interaction of bile acids with human serum albumin (Количественные аспекты взаимодействия желчных кислот с человеческим сывороточным альбумином), J. Lipid Res., 23(3): с. 490-5 (1982 в присутствии 26 мг/мл альбумина (что близко к сывороточной физиологической концентрации 35-50 мг/мл). Предпочтительные варианты осуществления направлены на дезоксихолевую кислоту (DCA) или ее пролекарственную форму либо фармацевтически приемлемую соль соединения или пролекарственной формы и родственные композиции и способы, где дезоксихолевая кислота (DCA) представляет собой Причем указанное соединение не является выделенным из организма млекопитающего или микробного организма, образующего DCA в естественных условиях. Другие предпочтительные варианты осуществления также направлены на стереоизомеры DCA и их фармацевтически приемлемые соли и на промежуточные продукты в синтезе DCA и ее стереоизомеров и солей, а также на родственные композиции и способы. Настоящие фармацевтические композиции желчных кислот, необязательно, находятся в солевой форме и, кроме того, необязательно содержат фармацевтически приемлемый разбавитель, наполнитель или носитель. В одном аспекте данное изобретение направлено на соединение, которое представляет собой дезоксихолевую кислоту (DCA) или ее пролекарственную форму либо фармацевтически приемлемую соль соединения или пролекарственной формы Причем указанное соединение не является выделенным из организма млекопитающего или микробного организма, образующего DCA в естественных условиях, и фармацевтически приемлемый наполнитель. Предпочтительные катионы для получения солей можно выбрать из группы, состоящей из натрия(NH4+). Соли можно также получить из щелочного металла или щелочно-земельного металла. Щелочной металл можно выбрать из натрия (Na+), калия (K+) и лития (Li+). Щелочно-земельный металл можно выбрать из группы, состоящей из магния (Mg2+), кальция (Са 2+), бария (Ва 2+) и стронция(Sr2+). Для применения в качестве фармацевтической композиции для местного удаления жира предпочтительно, когда желчная соль представляет собой дезоксихолат натрия. Предусматривают также пролекарственные формы, соответствующие вариантам осуществления. Пролекарственная форма является активным или неактивным соединением, которое химически модифицируется путем физиологического воздействия in vivo, таким как гидролиз, метаболизм и т.п., с образованием соединения, соответствующего вариантам осуществления, после введения пролекарственной формы пациенту. Например, можно получить С 1-С 10-сложный эфир или амид настоящей дезоксихолевой кислоты или ее производных, так что высвобождение дезоксихолевой кислоты или ее производных запускается посредством разрушения клеточной мембраны и выхода эстеразы. При выходе эстеразы сложноэфирная защитная группа расщепляется, при этом активная форма дезоксихолевой кислоты или ее производных присутствует в требуемой области in situ. Данные С 1-С 10-сложные эфиры могут, необязательно, включать 1-4 гетероатома, выбранных из кислорода, серы или азота; алкильные группы, такие как метил, этил, изопропил, бутил, гексил и т.п., необязательно имеющие 1-4 гетероатома, выбранных из кислорода, серы или азота; алкилфенильные группы, имеющие в целом до 10 атомов углерода, такие как бензильная или этилфенильная группы, необязательно имеющие 1-4 гетероатома в любой приемлемой точке замещения; и арильную группу, такую как фенильная группа. Пример амида включает, но без ограничения перечисленным, гидроксамат, в плане общего обсуждения пролекарственных форм, включающих сложные эфиры, см. монографии Svensson and Tunek Drug Metabolism Reviews (Обзоры по метаболизму лекарственных препаратов), 165 (1988) и Bundgaard Design of Prodrugs (Создание пролекарственных форм), Elsevier (1985), полностью включенные в данном контексте в виде ссылки. Синтез С 1-С 10 сложного эфира или амида дезоксихолевой кислоты хорошо известен в области техники. Например,сложный эфир можно синтезировать путем реакции дезоксихолевой кислоты со спиртом в присутствии минеральной кислоты в реакции эстерификации. Нативные структуры дезоксихолевой кислоты и хенодезоксихолевой кислоты показаны ниже. Показаны четыре цикла (А, В, С, D), а также боковая цепь карбоновой кислоты, которая идет от D-цикла. Без ограничения перечисленного некоторые примеры сложных эфиров, гидроксаматов и гидроксиамидов дезоксихолевой кислоты, а также хенодезоксихолевая кислота (CDCA) или ее производные описаны ниже. Различные функциональные группы можно присоединить к дезоксихолевой кислоте или хенодезоксихолевой кислоте посредством эстерификации карбоксильной группы боковой цепи D-цикла с целью генерации пролекарственных форм. Без ограничения перечисленного некоторые примеры данных сложных эфиров боковой цепи D-цикла показаны в табл. 1. Высвобождение дезоксихолевой кислоты или хенодезоксихолевой кислоты и их производных можно запустить посредством разрушения клеточной мембраны и выхода эстеразы. При выходе эстеразы сложноэфирная защитная группа может расщепляться, при этом активная форма дезоксихолевой кислоты или хенодезоксихолевой кислоты или их производных присутствует в требуемой области in situ. Пролекарственные формы дезоксихолевой кислоты, хенодезоксихолевой кислоты и их производных также включают эпимеры, которые могут обладать стереохимическими свойствами, противоположными данным свойствам нативной молекулы. Примеры данных эпимерных молекул показаны в табл. 2. При инъекции композиции желчных кислот, соответствующей настоящим вариантам осуществления, может появиться местное раздражение и, таким образом, может потребоваться введение, одновременное или последовательное, местного анестезирующего средства. Например, лидокаин часто используют у человека, и его можно ввести либо в виде сопрепарата (в одном и том же контейнере и инъецируемый в одно и то же время), либо в виде соинъекции (инъецируют из другого контейнера). Анестезирующие препараты, такие как лидокаин, можно вводить с помощью препарата для местного применения,такого как пластырь или мазь. Для более глубоких тканей анестезирующие препараты можно более глубоко инъецировать в ткань субъекта или вводить системно (например, посредством общей анестезии, эпидурально или другими способами). Желчная кислота(ы) или желчная соль(и) в растворе, соответствующем изобретению, может находиться в концентрации приблизительно 0,001-10, 0,01-5 или 0,1-2% мас./мас., мас./об. или об./об. Предпочтительно, когда желчная кислота(ы) или желчная соль(и) в вышеуказанном растворе может находиться в концентрации приблизительно 0,1-5% мас./мас. или более предпочтительно приблизительно 1% мас./мас. В некоторых вариантах осуществления растворяющий жир раствор включает до 100, 50, 20, 10,5, 2, 1, 0,5, 0,2, 0,05, 0,02 или 0,01 г одного или более детергентов, желчных кислот и/или желчных солей,например дезоксихолевой кислоты или ее солей либо дезоксихолата натрия. В предпочтительных вариантах осуществления растворы в данном контексте не включают липиды,фосфолипиды или фосфатидилхолин. В некоторых вариантах осуществления растворы в данном контексте включают до 5% мас./мас., мас./об. или об./об. липидов, фосфолипидов или фосфатидилхолина. В ряде вариантов осуществления вышеуказанный раствор может, кроме того, включать второй терапевтический агент, выбранный из группы, состоящей из антимикробных агентов, сосудосуживающих компонентов, антитромботических агентов, противосвертывающих агентов, пеногасителей, противовоспалительных агентов, анальгетиков, диспергаторов, антидиспергаторов, усилителей проникновения, стероидов, транквилизаторов, мышечных релаксантов и антидиарейных агентов. В ряде вариантов осуществления раствор находится в контейнере, который содержит до 500 мл раствора. Данный контейнер может представлять собой шприц или контейнер, загружаемый шприцем. В ряде вариантов осуществления композиции и способы, кроме того, включают молекулу, которая,как известно, вызывает уничтожение жира ортогональным механизмом. Данные молекулы включают антагонисты рецептора нейропептида Y (NPY), в том числе, но без ограничения перечисленного, антагонисты рецептора NPY, такие как BIBP-3226 (Amgen), BIBO-3304 (Boehringer Ingleheim), BMS-192548 и(Sanofi Aventis), S-2367 (Shiongli), дигидропиридин и производные дигидропиридина, которые являются антагонистами рецептора NPY, бициклические соединения, которые являются антагонистами рецептораNPY, карбазольные антагонисты рецептора NPY и трициклические соединения, которые представляют собой антагонисты рецептора NPY; см., например, WO 2006/133160 и U.S. 6313128 (включенные в данном контексте путем ссылки в своей полноте, включая чертежи). Кроме того, предусматривают избирательные в отношении жира проапоптотические пептиды, такие как пептид CKGGRAKDC, который направлен на сосудистую сеть белого жира; см., статью Kolonin M.G. et al., Nat. Med. June 10(6):625-32(2004). В одном аспекте настоящее изобретение относится к способам уменьшения подкожного отложения жира у пациента. Данные способы включают стадию местного введения в отложение подкожного жира пациента композиции, включающей (i) растворяющее жир эффективное количество одного или более фармакологически активных детергентов или желчной кислоты (кислот) и/или желчной соли(ей), либо дезоксихолевой кислоты или ее соли или дезоксихолата натрия; (ii) фармацевтический, ветеринарный или косметический наполнитель и (iii), необязательно липид, причем соотношение липида или желчной соли составляет до 1% мас./мас., и причем композиция не включает липазу или колипазу. В ряде вариантов осуществления отложение жира ассоциировано с состоянием, выбранным из группы, состоящей из ожирения, синдрома перераспределения жира, образования жировой грыжи века, липом, болезни Деркама, липодистрофии, липодистрофии горба буйвола, дорсоцервикального жира, висцерального ожирения,увеличения молочных желез, гиперожирения, диффузных жировых тел вокруг туловища и рук и жировых отложений, связанных с целлюлитом. В предпочтительных вариантах осуществления вышеуказанный способ не включает осуществление хирургического вмешательства у пациента. В одном аспекте данное изобретение направлено на способ удаления жировых отложений из выбранных областей тела млекопитающего, включающий введение нуждающемуся в этом млекопитающему терапевтически эффективного количества DCA или ее пролекарственной формы либо фармацевтически приемлемой соли DCA или пролекарственной формы причем указанное соединение не является выделенным из организма млекопитающего или микробного организма, образующего DCA в естественных условиях. В одном варианте осуществления способы, соответствующие данному изобретению, могут далее включать введение млекопитающему по меньшей мере одного дополнительного активного ингредиента,выбранного из группы, состоящей из антагониста рецептора нейропептида Y(NPY) и избирательного в отношении жира проапототического пептида. В одном варианте осуществления антагонист рецептора нейропептида Y (NPY) выбран из группы, состоящей из BIBP-3226, антагониста нейропептида Y5 (антагонисты рецептора NPY Amgen), BIBO-3304 (антагонист рецептора NPY Boehringer Ingleheim), BMS192548 (антагонист рецептора NPY Bristol-Myers Squibb), AR-H040922 (антагонист рецептора NPY Bristol-Myers Squibb), LY-357897 (антагонист рецептора NPY Eli Lilly), антагониста рецептора NPY-Y5 Esteve, 1229U91 (антагонисты рецептора NPY GlaxoSmithKline), GW438014S (антагонисты рецептора NPY цептора NPY Sanofi Aventis), S-2367 (антагонист рецептора NPY Shiongli), дигидропиридиновых антагонистов рецептора NPY, производных дигидропиридиновых антагонистов рецептора NPY, бициклических соединений, которые представляют собой антагонисты рецептора NPY, карбазольного антагониста рецептора NPY и трициклических соединений, которые представляют собой антагонисты рецептора NPY; см., например, WO 2006/133160 и U.S. 6313128 (включенные в данном контексте в виде ссылки в своей полноте, включая чертежи). В одном варианте осуществления избирательный в отношении жира проапоптотический пептид представляет собой пептид CKGGRAKDC, который направлен на сосудистую сеть белой жировой ткани; см. статью Kolonin M.G. et al., Nat. Med. June 10(6):625-32 (2004). В одном аспекте настоящее изобретение относится к способам уменьшения внешних проявлений кожного состояния на участке кожи пациента. Данные способы включают стадию местного введения в указанный участок кожи композиции, включающей (i) подтягивающее кожу эффективное количество одного или более фармакологически активных детергентов или желчной кислоты (кислот) и/или желчной соли(ей) либо дезоксихолевой кислоты или ее соли или дезоксихолата натрия; (ii) фармацевтический, ветеринарный или косметический наполнитель и (iii) необязательно липид. В ряде вариантов осуществления стадия введения включает доставку композиций, описанных в данном контексте, посредством подкожной или чрескожной инъекции. В ряде вариантов осуществления кожное состояние, которое лечат или облегчают, выбрано из группы, состоящей из дряблой кожи, старения кожи, неровностей кожи и морщин. В ряде вариантов осуществления участок кожи, который лечат, находится под глазом, под подбородком, подмышкой, на ягодице, щеке, брови, икре, спине, бедре, лодыжке или в области желудка. В ряде вариантов осуществления композиции, используемые для восстановления внешнего вида кожного состояния на участке кожи, представляют собой состав для введения в раствор, подтягивающий кожу. Данный подтягивающий кожу раствор может далее включать второй терапевтический агент, выбранный из группы, состоящей из антимикробных агентов, сосудосуживающих компонентов, антитромботических агентов, противосвертывающих агентов, пеногасителей, противовоспалительных агентов,анальгетиков, диспергаторов, антидиспергаторов, усилителей проникновения, стероидов, транквилизаторов, мышечных релаксантов и антидиарейных агентов. В предпочтительных вариантах осуществления детергент включает желчную кислоту, выбранную из группы, состоящей из дезоксихолевой кислоты, холевой кислоты, хенодезоксихолевой кислоты, 7-дегидроксилатхенодезоксихолевой кислоты, литохолевой кислоты, урсодезоксихолевой кислоты, дигидрокситауриновой кислоты, тригидрокситауриновой кислоты и конъюгатов с глицином любого из вышеуказанных соединений. В ряде вариантов осуществления детергент содержит желчную соль, которая включает катион, выбранный из группы, состоящей из натрия (Na+), калия (K+), лития (Li+), магния(Mg2+), кальция (Са 2+), бария (Ва 2+), стронция (Sr2+) и аммония (NH4+). В ряде вариантов осуществления детергент включает желчную соль с катионом, который представляет собой щелочной металл или щелочно-земельный металл. Предпочтительно, когда щелочной металл представляет собой натрий (Na+),калий (K+) или литий (Li+) и щелочно-земельный металл представляет собой магний (Mg2+), кальций(Са 2+), барий (Ва 2+) или стронций (Sr2+). Более предпочтительно, когда желчная соль является дезоксихолатом натрия. Другой вариант осуществления предусматривает способ эмульгирования жира в организме млекопитающего, включающий введение нуждающегося в этом млекопитающего терапевтически эффективного количества соединения, которое представляет собой DCA или его пролекарственную форму либо фармацевтически приемлемую соль DCA или пролекарственную форму причем указанное соединение не является выделенным из организма млекопитающего или микробного организма, образующего DCA в естественных условиях. Другой вариант осуществления предусматривает способ солюбилизации фосфатидилхолина, включающий смешивание фосфатидилхолина и эффективного количества соединения, которое представляет собой DCA или ее пролекарственную форму либо фармацевтически приемлемую соль DCA или пролекарственную форму Причем указанное соединение не является выделенным из организма млекопитающего или микробного организма, образующего DCA в естественных условиях. Другой аспект изобретения относится к смешиванию адипо-абляционных (разрушающих) желчных кислот, таких как дезоксихолевая кислота (DCA) агентами, которые уничтожают жировые клетки. В одном аспекте данное изобретение предусматривает средства для усиления эстетических эффектов инъекций дезоксихолата путем введения в инъекционный препарат дезоксихолата молекулы, которая вызывает уничтожение жира ортогональным механизмом. Примеры данных потенциальных молекул включают, но без ограничения перечисленного, антагонисты нейропептида Y (NPY) и избирательные в отношении жира проапоптотические пептиды, как описано в данном контексте. Поскольку как уничтожение жировых клеток, так и подтягивание кожи могут потребоваться для опосредования необходимых эффектов, данные эффекты агента, обладающего способностью уничтожать жир и сильными эффектами подтягивания кожи (такого как дезоксихолат) можно усилить путем добавления молекулы с сильными эффектами уничтожения жировых клеток. Кроме того, молекулы, избыток которых необходим в сосудистой сети для проявления эффекта уничтожения (такие как некоторые проапоптотические пептиды, которые связываются с белками, экспрессирующимися в капиллярах со стороны просвета), могут увеличить избыток относительно данных белков, поскольку дезоксихолат может вызывать подтекание сосудов. Таким образом, данные агенты могут быть синергическими с дезоксихолатом, потенциально создавая более сильные средства для опосредования формирования контура тела в течение меньшего количества терапевтических сеансов. Способ синтеза В других вариантах осуществления настоящее изобретение предусматривает способы синтеза соединений, солей и пролекарственных форм DCA и родственных им промежуточных продуктов. Нумерация стероидной основы, как используют в данном контексте, соответствует общему соглашению, как показано на фиг. 1. Соответственно предусматривают способ получения дезоксихолевой кислоты (DCA) или ее сложного эфира либо ее фармацевтически приемлемой соли(b) проведение реакции соединения 2 с кислотой с образованием соединения 3(с) проведение реакции соединения 3 с восстановителем с образованием соединения 4 в виде смеси 4 и 5(d) проведение реакции соединения 4 с реагентом для олефинирования двух атомов углерода в условиях образования олефина с формированием соединения 6(е) превращение соединения 6 в соединение формулы 7, где Р представляет собой защитную группу(f) проведение реакции соединения формулы 7 с алкилпропиолатом CHCC(O)OR или алкилакрилатом CH2=CHC(O)OR, где R представляет собой алкил, в присутствии кислоты Льюиса с образованием соединения формулы 8, где Р представляет собой защитную группу, R представляет собой алкил и пунктирная линия означает одинарную или двойную связь;(g) проведение реакции соединения формулы 8 с Н 2 в условиях гидрирования с образованием соединения формулы 9, где Р представляет собой защитную группу и R представляет собой алкил(h) проведение реакции соединения формулы 9 с окислителем с образованием соединения формулы 10, где Р представляет собой защитную группу и R представляет собой алкил(i) проведение реакции соединения формулы 10 с Н 2 в условиях гидрирования с образованием соединения формулы 11, где Р представляет собой защитную группу и R представляет собой алкил(j) проведение реакции соединения формулы 11 с восстановителем с образованием соединения формулы 12, где Р представляет собой защитную группу и R представляет собой алкил(k) воздействие на соединение формулы 12 условиями снятия защиты с образованием его сложного эфира и, необязательно, подходящими условиями гидролиза с образованием дезоксихолевой кислоты или ее фармацевтически приемлемой соли. Настоящее изобретение также предусматривает следующие промежуточные соединения, показанные на схеме 1 ниже, где Р и R такие, как определено выше. Схема 1. Синтез дезоксихолевой кислоты (DCA) В одном варианте осуществления условия гидрирования, соответствующие части (а), включают катализатор Pd/C. В одном варианте осуществления кислота, соответствующая части (b), представляет собой минеральную кислоту. В ряде аспектов минеральная кислота представляет собой H2SO4. В одном варианте осуществления восстановитель, соответствующий части (с), представляет собойLiAl(OtBu)3H. В одном варианте осуществления реагент для олефинирования двух атомов углерода, соответствующий части (d), представляет собой агент Виттига, такой как Ph3PCH2CH3+Br-. В одном варианте осуществления защитная группа Р соединения 7-12 представляет собой-С(О)СН 3. В ряде аспектов соединение 6 подвергают воздействию ацилирующих условий с образованием соединения 7 а, например, путем обработки соединения 6 уксусным ангидридом и органическим основанием, таким как Et3N, пиридин и/или диметиламинопиридин. В одном варианте осуществления кислота Льюиса, соответствующая части (f), представляет собойEtAlCl2. В одном варианте осуществления алкилпропиолат, соответствующий части (f), представляет собой метилпропиолат. В одном варианте осуществления алкилакрилат, соответствующий части (f), представляет собой метилакрилат. В одном варианте осуществления условия гидрирования, соответствующие части (g) включают катализатор PtO2 или Pd/C. В одном варианте осуществления окислитель, соответствующий части (h), представляет собойCrO3. В одном варианте осуществления условия гидрирования, соответствующие части (i), включают катализатор Pd/C. В одном варианте осуществления восстановитель, соответствующий части (j), представляет собой В одном варианте осуществления условия снятия защиты и гидролиза, соответствующие части (k),где Р представляет собой -С(О)СН 3, включают проведение реакции соединения 12 с гидроксидом щелочно-земельного металла, алкоксидом щелочно-земельного металла или смесью обоих. В ряде аспектов условия гидролиза включают кислотную обработку для получения дезоксихолевой кислоты. В других аспектах кислотную обработку исключают с получением соответствующей соли. В одном варианте осуществления алкоксид щелочно-земельного металла представляет собой LiOH. В одном варианте осуществления соли дезоксихолевой кислоты получают путем реакции с алкоксидом или гидроксидом щелочно-земельного металла. Соли дезоксихолоевой кислоты включают соли натрия (Na+), калия (K+) и лития (Li+). В одном варианте осуществления предусматривают промежуточное соединение, выбранное из группы, состоящей из 9-гидрокси-5-андростан-3,17-диона (2),5-антрост-9(11)-ен-3,17-диона (3),(Z)-3 а-гидрокси-5-прегна-9(11),17(20)-диена (6),(Z)-3-ацетокси-5-прегна-9(11),17(20)-диена (7 а),(Е)-метил 3-ацетокси-5-хол-9(11),16,22-триен-24-оата (8 а),метил 3-ацетокси-5-хол-9(11),16-диен-24-оат (8b),метил 3-ацетокси-5-хол-9(11)-ен-12-он-24-оата (10 а),метил 3-ацетокси-5-холан-12-он-24-оата (11 а). Фармацевтические композиции и способы введения Композиции могут состоять из описанного соединения в комбинации по меньшей мере с одним фармацевтически приемлемым наполнителем. Приемлемые наполнители нетоксичны, способствуют введению и не оказывают вредного воздействия на терапевтический положительный эффект описанного соединения. Данный наполнитель может представлять собой любой твердый, жидкий, полутвердый или в случае аэрозольной композиции газообразной наполнитель, который, как правило, доступен специалисту в области техники. Твердые фармацевтические наполнители включают крахмал, целлюлозу, тальк, глюкозу, лактозу,сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, глицеролмоностеарат, хлорид натрия, сухое обезжиренное молоко и т.п. Жидкие и полутвердые наполнители могут быть выбраны из глицерина, пропиленгликоля, воды, этанола и различных масел, включая масла из нефти,растительной или синтетической природы, например арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Предпочтительные жидкие носители, в частности, предназначенные для инъекционных растворов, включают воду, солевой раствор, водную декстрозу и гликоли. В общем, соединения, соответствующие предпочтительным вариантам осуществления, будут вводить в терапевтически эффективном количестве любым из принятых способов введения, используемых для агентов, которые служат для аналогичного применения. Действительное количество соединения,соответствующего предпочтительным вариантам осуществления, т.е. активного ингредиента, будет зависеть от множества факторов, таких как тяжесть заболевания, которое лечат, возраст и относительное состояние здоровья пациента, активности используемого соединения, пути и формы введения и других факторов. Лекарственный препарат можно вводить больше чем один раз в день, предпочтительно один или два раза в день. Все из данных факторов входят в компетенцию лечащего врача. Количество соединения в препарате может варьировать в полном диапазоне, используемом компетентными специалистами в области техники. Могут быть получены настоящие композиции в различных аспектах, как описано в данном контексте, в которых часть дезоксихолевой кислоты лежит в диапазоне приблизительно 0,5-10% в пересчете на массу/основу водного объема или на мас./мас. основу, принимая плотность воды (т.е. соответствие 1:1 между массой и объемом). В другом аспекте настоящие варианты осуществления относятся к описываемым в настоящее время фармацевтическим композициям в концентрациях до точки насыщения разбавителя. Специалист может выбрать степень тиксотропной вязкости на основе условий, таких как концентрация и рН; см., например, статью Mukhopadhyay, S. and U. Maitra,Current Science 87: 1666-1683 (2004), с. 1680. В ряде вариантов осуществления стадия введения включает доставку композиций в данном контексте посредством кожного пластыря, насоса или подкожной депо-формы. В ряде вариантов осуществления стадия введения включает доставку композиций в данном контексте местно или подкожно. В специфических вариантах осуществления стадия введения включает введение местно (например, подкожно или субдермально) в область под глазом, под подбородком, подмышкой, на ягодице, икре, спине, бедре или в области желудка указанного пациента. Введение можно осуществить путем подкожной или чрескожной инъекции. Схемы синтеза Другие примеры полного химического синтеза фармацевтических композиций желчной кислоты и полезных промежуточных соединений представлены ниже. Данные следующие описания и примеры предусматривают альтернативу экстракции DCA из организмов млекопитающих или микробных организмов, которые образуют данное соединение в естественных условиях. Способы синтеза 1-6 предназначены для использования в настоящем изобретении для синтеза дезоксихолевой кислоты (DCA). Способ синтеза 1 В и примеры 1-11 показывают синтез DCA из гидрокортизона. 1. Способ синтеза 1 А из адреностерона через 9(11)-ен или 11,12-ен. Кортизон (соединение 1.1) на схеме 1 А (см. ниже) широко доступен как полностью синтетический материал. Его можно эффективно расщепить с образованием С 17-кетонового соединения при использовании хлорхромата пиридиния (РСС). Данное расщепление до адреностерона (соединение 1.2) может быть также достигнуто при использовании HIO4 или висмутата натрия (NaBiO3). Реакция, которая превращает соединение 1.2 в соединение 1.3, представляет собой известный химический процесс. Превращение соединения 1.3 в соединение 1.4 включает монокетализацию. Последующие стадии представляют собой регенерацию 3-кето-4-ена, избирательное восстановление 4,5-ена (H2/Pt/ДМФ (диметилформамид с получением С 5 конфигурации и избирательное восстановление С 3-карбонильной группы до требуемой 3-конфигурации с получением соединения 1.5. Введение защитной группы в превращение соединения 1.5 в соединение 1.6 и последующее восстановление продукта дает С 11 ол (аксиальная конфигурация), т.е. соединение 1.7, которое подходит для региоселективной элиминации до ключевого 9(11)-ена (т.е. превращения соединения 1.7 в соединение 1.8). Схема синтеза на данной стадии разветвляется, поскольку соединение 1.7 можно использовать в качестве исходного материала для превращения либо в соединение 1.8, либо в соединение 1.9. Реакция элиминации, используемая для превращения соединения 1.7 в соединение 1.8, является региоселективной вследствие транс-диаксиальной связи С 11-гидроксильной группы с С 9-атомом водорода. Альтернативный способ элиминации для получения изомерного С 11-С 12-олефина соединения 1.9 является аналогично региоселективным, включая цис-термическую элиминацию (т.е. превращение соединения 1.7 в соединение 1.9). Схема 1 А. Синтез двух С-циклических предшественников С 12-гидроксильной группы DCA Аллильное окисление соединения 1.8 (путем обработки CrO3 и 3,5-диметилпиразолом) дает енонсодержащее соединение 1.10. Перкислотное окисление соединения 1.9 происходит стереоселективно на ные химические превращения дают два ключевых предшественника функциональности С 12 гидроксильной группы, а именно соединение 1.10 и соединение 2.1 (см. схемы 1 А и 2). Компетентный специалист в области техники будет иметь в виду, что вышеописанный способ с использованием кортизона можно модифицировать, чтобы альтернативно начинать с гидрокортизона, который имеет такой же углеродный скелет и такое же относительное положение атомов кислорода, причем гидрокортизон отличается от кортизона только статусом окисления С-11 несущего кислород атома углерода. Гидрокортизон коммерчески доступен и известны различные способы синтеза данного соединения (см. статью Szczebara et al. Nature Biotechnology 21:143-149 (февраль 2003, включая полный химический синтез (см. статью Woodward R.В. et al. J. Am. Chem. Soc. 74: 4223 (1952. Кетон 1.13 синтезируют, исходя из гидрокортизона 1.12 (схема 1 В), посредством гидрогенолиза ,-ненасыщенной двойной связи с последующим общим восстановлением кетона с использованием борогидрида натрия, чтобы обеспечить возможность расщепления 1,2-диола при использовании NaIO4 с образованием, таким образом, С 17-кетона на D-цикле стероидной циклической системы. Последующее окисления хлорхроматом пиридиния (РСС) дает соединение 1.13. Обработка соединения 1.13 K-селектридом с последующим ацетилированием уксусным ангидридом/пиридином дает защищенный спирт 1.15. Последующее олефинирование соединения 1.15 реагентом Виттига дает алкен 1.16, который затем обрабатывают метилпропиолатом и дихлоридом этилалюминия с образованием диена 1.17. После гидрирования обеих двойных связей кетон 1.18 восстанавливают и полученный спиртовой промежуточный продукт элиминируют при обработке SOCl2 в пиридине с образованием алкена 1.19. Аллильное окисление алкена 1.19 с помощьюCrO3 и восстановление двойной связи в условиях гидрирования дает кетон 1.21. Удаление защитной группы ацетата и окисление полученного в результате спирта дает дикетон 1.22. Восстановление соединения 1.22 с помощью LiAlH(OtBu)3 и гидролиз сложного метилового эфира дает DCA. Схема 1 В. Синтез DCA из гидрокортизона Дальнейшие превращения соединений 1.10 и 2.1 показаны на схеме 2. Сначала соединение 1.10 модифицируют так, чтобы оно включало надлежащим образом функционализированную С-циклическую систему, идентичную системе DCA (схема 2). Стереоселективное восстановление С 12-карбонильной группы дает соединение 2.1 и каталитическое гидрирование 9(11)-двойной связи, присутствующей в соединении 2.1, дает соединение 2.2. Схема 2. Введение С 12-гидроксильной группы с использованием способа аллильного окисления На схеме 3 представлено превращение эпоксид-содержащего соединения 1.11 в аналогично С 12 гидроксистероидного соединения 2.2, представленного на схеме 2. Схема 3. Стереоселективное восстановление С 11-С 12-эпоксида Как отмечено выше, в обоих из данных способов образуется одинаковое промежуточное соединение 2.2. Следующей стадией синтеза DCA является модификация D-цикла, присутствующего в соединении 2.2, так чтобы он включал D-цикл DCA с замещенной боковой цепью (см. схемы 4 и 5). Схема 4. Снятие защиты и реакция Виттига Сначала группы С 17-кеталя и С 3-силилового эфира соединения 2.2 гидролизуют. Затем проводят реакцию Виттига для получения соединения 4.2. Превращение соединения 4.2 в соединение 5.1 осуществляют посредством реакции ена. Последующее каталитическое восстановление соединения 5.1 и гидролиз сложного эфира дает DCA (см. схему 5). Схема 5. Реакция ена и каталитическое восстановление для введения боковой цепи DCA 2. Способ синтеза 2 из кортизона через адреностерон (способ с использованием i-стероида, 3,5 циклостерина). Избирательная кетализация адреностерона (соединение 1.2, схема 6) по С 17, восстановление борогидридом, мезилирование и гидролиз в буфере дают i-стероид (3,5-цилостерин), содержащий соединение 6.1. Соединение 6.1 претерпевает образование 9(11)-ена (превращение соединения 6.1 в соединение 6.2,см. схему 6) и аллильное окисление (превращение соединения 6.2 в соединение 6.3, см. схему 6) с последующим восстановлением карбонильной группы с образованием соединения 6.4. Гидролиз i-стерина и гидрирование дают соединение 6.5, которое можно превратить в DCA способами синтеза, представленными выше в способе синтеза 1. Схема 6. Защита А-В-циклической системы путем образования i-стероида (т.е. 3,5-циклостерина) 3. Способ синтеза 3 из гекогенина. Гекогенин (соединение 7.1, см. схему 7) представляет собой растительный стерин, обнаруживаемый в большом количестве в мексиканском ямсе и других растениях Agave species. Главное преимущество гекогенина в качестве исходного материала для синтеза DCA состоит в том, что он обладает такой функциональностью С 12-кислорода, которая присутствует в DCA. Первая стадия способа синтеза, начинающегося с гекогенина, представляет собой стереоселективное восстановление С 12-карбонильной группы в гекогенине (соединение 7.1) до необходимой С 12-конфигурации (превращение соединения 7.1 в соединение 7.2). Затем 3 ол, 5(-АВ циклическую систему превращают в 3(-ол, 5-АВ (превращение соединения 7.1 в соединение 7.2, в соединение 7.3) циклическую систему (см. схему 7). После хорошо известного разложения по Маркеру (см. статью Marker,R.E., Rohrmann, E., Sterols. LXIX. Oxidation Products of Sarsasapogenin. Sarsasapogenoic Acid and RelatedSubstances (Стерины. LXIX. Продукты окисления сарсасапогенина. Сарсасапогеновая кислота и родственные субстанции), J. Am. Chem. Soc, 61(8): с. 2072-2077 (1939 следует превращение соединения 7.2 в соединение 7.3 с получением соединения 7.4. Введение боковой цепи D-цикла (см. схему 8) в соединение 8.2 осуществляют способами, показанными на схемах 4 и 5. Необходимый С 17-кетон в соединении 8.2 формируют путем озонолиза енолацетата соединения 8.1 (см. схему 8). Затем получают DCA из соединения 8.2 аналогично тому, как показано на схеме 5, используя олефинирование и последовательность реакций с еном. Альтернативные способы, начинающиеся с гекогенина, показаны на схемах 9 и 10. Схема 7. Введение С 12-гидроксильной группы, модификация АВ-цикла и расщепление боковой цепи Схема 9. Дитиоэтановый способ получения 3-кето-4-ена 4. Способ синтеза 4 из сапогенинов. Сапогенины получают при гидролизе сахаридов и дисахаридов, присоединенных к С 3 гидроксильной группе сапонинов (т.е. гликозидов стероидов). Они являются широко распространенными продуктами растительной природы. Сапонин существует в естественных условиях в виде спироскелетной структуры, как показано ниже. Кроме того, соединение 10.3 может быть образовано из тигогенина,диосгенина, хлорогенина, смилагенина и гекогенина (соединение 7.1). Авторы считают, что DCA можно было бы синтезировать из каждого из указанных веществ, а именно из тигогенина, диосгенина, хлорогенина, смилагенина и гекогенина (соединение 7.1). (см. статью Y. Mazur, N. Danieli and Franz Sondheimer,J. Am. Chem. Soc; 82, 5809 (1960. Хотя авторы смогли синтезировать DCA из гекогенина, они признают, что любой из вышеуказанных сапогенинов мог бы аналогичным образом служить исходным материалом для синтеза DCA. Схема 10 В. Способ синтеза из сапонина 5. Способ синтеза 5 из стигмастерина. Стигмастерин (соединение 11.1) представляет собой широкодоступный растительный стерин. В качестве исходного материала для синтеза DCA он имеет преимущество в том, что он содержит функционализированную систему АВ-цикла и легко отщепляемую группу боковой цепи. Его недостатком является отсутствие необходимой функциональности в С-цикле, важном для синтеза DCA. В данном способе синтеза стигмастерин (соединение 11.1) АВ-цикл защищают образованием iстероида с последующим озонолизом с целью получения боковой цепи на С 17-введенном и восстановленном до С 24-оле в качестве замаскированной формы карбоксильной группы (см. схему 11). На последующих стадиях генерируют аллильное положение на С 12 (см. схему 12). Образование диена В-цикла и окисление ацетатом ртути являются известными способами, и каталитическое восстановление системы В-цикла дает промежуточное соединение, общее с предшествующими способами, описанными выше. Однако в противоположность другим способам боковая цепь уже имеется. Аллильное окисление (превращение соединения 12.4 в соединение 1.20) и стереоселективное восстановление (превращение соединения 1.20 в соединение 1.21) с последующими ранее обсужденными стадиями дает продукт, который превращают в DCA. Схема 11. Озонолиз i-стероида и восстановление боковой цепи В варианте способа с использованием стигмастерина применяют защиту Дайелса-Алдера диена Вцикла. Это эффективно, поскольку изолирует 9(11)-двойную связь, что предупреждает возможное препятствие на стадиях аллильного окисления (см. схему 13). Эргостерин (соединение 14.1) представляет собой широкодоступный исходный материал и может быть использован для получения DCA путем адаптации способов, приведенных в данной заявке. Аллильное окисление представляет легкий способ, ведущий к получению функциональности С 12-кислорода(см. схему 14). Преимущество данного способа состоит в том, что его начинают с диена В-цикла. Он сходится со способом с использованием стигмастерина. Схема 14. Образование триена из эргостерина Соединения, соответствующие предпочтительным вариантам осуществления, можно получить из легкодоступных исходных материалов при использовании общих способов и процедур. Следует иметь в виду, что когда приводят типичные или предпочтительные условиях осуществления способов (т.е. температуры реакции, время, молярные соотношения реагентов, растворители, давления и т.п.), можно также использовать другие условия осуществления способа, пока не указано иначе. Оптимальные условия реакции могут варьировать в зависимости от конкретных используемых реагентов или растворителя, но данные условия могут быть определены компетентным специалистом в области техники путем рутинных способов оптимизации. Кроме того, для компетентных специалистов в области техники будет очевидно, что принятые защитные группы могут быть необходимы для того, чтобы препятствовать ряду функциональных групп вступать в нежелательные реакции. Подходящие защитные группы для различных функциональных групп, а также подходящие условия для защиты и снятия защиты с определенных функциональных групп хорошо известны в области техники. Например, множество защитных групп описано в монографии Т.W. Greene and G.M. Wuts, Protecting Groups in Organic Synthesis (Защитные группы в органическом синтезе), 3-е изд., Wiley, New York, 1999 и приведенных в ней ссылках. Исходные материалы и реагенты для реакций, описанных в данном контексте, представляют собой,- 22020806 как правило, известные соединения или могут быть получены известными способами или их очевидными модификациями. Например, многие из исходных материалов и реагентов доступны у коммерческих производителей, таких как Aldrich Chemical Co. (Milwaukee, Wisconsin, USA), Bachem (Torrance, California, USA), Emka-Chem или Sigma (St. Louis, Missouri, USA). Другие можно получить с помощью способов или их очевидных модификаций, описанных в стандартной справочной литературе, такой как монографии Fieser and Fieser's Reagents for Organic Synthesis (Реагенты для органического синтеза), т. 1-15(John Wiley and Sons, 1991), March's Advanced Organic Chemistry (Перспективы органической химии),(John Wiley and Sons, 4 изд.) и Larock's Comprehensive Organic Transformations (Полные превращения органических соединений) (VCH Publishers Inc., 1989). Перечень фигур, чертежей и иных материалов На фиг. 1 приведен чертеж, представляющий структуру желчных кислот, включающий систему нумерации атомов углерода скелета желчных кислот; на фиг. 2 показывают близость дозозависимого снижения выживаемости клеток первичных человеческих адипоцитов при обработке синтетической натрий дезоксихолевой кислотой, соответствующей настоящему изобретению, по сравнению с дезоксихолатом натрия, полученного из крупного рогатого скота (Sigma). Сведения, подтверждающие возможность осуществления изобретения Различные исходные материалы, промежуточные соединения и соединения, соответствующие предпочтительным вариантам осуществления, можно выделить и очистить при необходимости, используя принятые способы, такие как осаждение, фильтрование, кристаллизация, упаривание, отгонка и хроматография. Характеризацию данных соединений можно провести, используя принятые способы, такие как по температуре плавления, масс-спектру, данным ядерного магнитного резонанса и различных других спектроскопических анализов. Примеры вариантов осуществления стадий для проведения синтеза продуктов способом синтеза 1, см. схему 1 В, описаны более подробно ниже. В табл. 3 описывают сокращения, используемые для представления различных соединений/групп/устройства/способа/свойства в иллюстративных схемах реакций и способах синтеза, описанных в следующих примерах и на протяжении описания. Таблица 3 Общие положения. Манипуляции с чувствительными к кислороду и влаге материалами проводят с использованием двугорлых высушенных на огне колбах в атмосфере аргона. Колоночную хроматографию проводят, используя силикагель SE-Make (60-120 меш), силикагель Spectrochem (230-400 меш) или оксид алюминия 90-neutral (SD-Fine Chem. Ltd., India). Аналитическую тонкослойную хроматографию (ТСХ) проводят на пластинках Merck Kieselgel 60 F254 (0,25 мм) (MerckCo., Whitehouse Station, NJ). Визуализацию пятен детектируют либо с помощью лампы УФ-света (254 нм), либо путем обработки раствором серной кислоты (5%) и п-анисового альдегида (3%) в этаноле. Прибор. Анализ соединений и продуктов реакции, полученных согласно схемам реакции и способам синтеза, описанных в данном контексте, можно осуществить на приборе и оборудовании, описанных ниже. Ядерный магнитный резонанс (ЯМР). Спектры протонного и углеродного ядерного магнитного резонанса (данные 1 Н ЯМРспектроскопии и данные 13 С ЯМР-спектроскопии) регистрируют на спектрометре Varian Mercury-Gemini 200 (данные 1 Н ЯМР-спектроскопии, 200 МГц; данные 13 С ЯМР-спектроскопии, 50 МГц) или Varian(Varian, Inc., Palo Alto, CA) с использованием резонансов растворителей в качестве внутренних стандартов (данные 1 Н ЯМР-спектроскопии, CHCl3 при 7,26 промиль или ДМСО при 2,5 промиль и ДМСО-Н 2 О при 3,33 промиль; данные 13 С ЯМР-спектроскопии, CDCl3 при 77,0 промиль или ДМСО при 39,5 промиль). Данные 1 Н ЯМР-спектроскопии представляют следующим образом: химический сдвиг (, промиль), мультиплетность (s=синглет, d=дублет, t=триплет, q=квартет, br=широкий, m=мультиплет), константы связывания (Гц) и интеграция. Инфракрасная спектроскопия. Инфракрасные спектры (ПФ-ИК-спектр (преобразование Фурье-инфракрасный спектр получают на приборе модели JASCO-460+ (Jasco, Inc., Easton, MD). Масс-спектры получают с помощью спектрометра Perkin Elmer, API-2000 spectrometer (Perkin Elmer, Inc., Waltham, MA), используя вариант ES+(электроспрей). Температура плавления. Температуры плавления определяют, используя прибор для измерения температуры плавленияLAB-INDIA (Labindia Instruments Pvt. Ltd., India) и не корректируют. Высокоэффективная жидкостная хроматография. ВЭЖХ-хроматограммы регистрируют, используя прибор модели SHIMADZU-2010 с детекторомPDA (Shimadza Corp., Japan). Оптическая активность. Специфические оптические вращения ([]D) определяют, используя прибор JASCO-1020 при длине волны 589 нм (Jasco, Inc., Easton, MD) и не корректируют. Химические реактивы. Пока не указано иначе, коммерчески доступные реагенты используют без очистки. Диэтиловый эфир и ТГФ перегоняют из натрий/бензофенонкетила. Безводные ДМФ, DCM, пентан и гексан получают перегонкой из СаН 2. Пример 1. Получение андростан-3,11,17-триона (1.13). 10% Pd/C (2,5 г, 5 мас.%) добавляют к раствору гидрокортизона (соединение 1.12) (50,0 г, 138,12 ммоль) в ДМФ (250 мл). Полученную в результате суспензию гидрируют в аппарате Парра (50 psi (3600 г/см 2 в течение 12 ч. После полного исчезновения исходного материала, как удостоверяются с помощью ТСХ, неочищенную реакционную смесь фильтруют через маленький слой целита и удаляют растворитель под вакуумом. Неочищенный продукт (48,0 г) получают в виде бесцветного твердого вещества.NaBH4 (2,1 г, 55,3 ммоль) добавляют к раствору вышеописанного неочищенного продукта (48,0 г,131,86 ммоль) в EtOH (500 мл) и CH2Cl2 (500 мл). Через 1 ч добавляют ацетон (50 мл) и воду (150 мл),затем NaIO4 (70,5 г, 329,6 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют дистиллированную воду (500 мл) и экстрагируют смесь этилацетатом (3250 мл). Слой этилацетата пропускают через слой силикагеля и упаривают раствор с получением 38 г продукта в виде бесцветного твердого соединения. Неочищенный продукт подвергают дальнейшему окислению без очистки. РСС (40,4 г, 187,5 ммоль) добавляют к раствору вышеописанного неочищенного продукта в CH2Cl2(400 мл) в 3 равных порциях в течение 30 мин. Полученную в результате реакционную смесь перемешивают при комнатной температуре в течение приблизительно 3-4 ч. После завершения реакции, которую мониторируют с помощью ТСХ, неочищенную реакционную смесь последовательно фильтруют через слои целита и силикагеля и неочищенный материал очищают колоночной хроматографией[59(Д)700(Дл) мм, силикагель 60-120 меш, 150 г], элюируя системой этилацетат/гексан (3:10) [фракции по 50 мл, элюция 10 мл/мин, мониторируют с помощью ТСХ с обработкой п-анисовым альдегидом; Rf для соединения 1.13=0,37 и Rf для соединения 1.12=0,05 в EtOAc/гексан (1:1)] с получением диастереомерного соединения 1.13 (33,0 г, выход 79%) в виде бесцветного твердого соединения. Полученный неочищенный материал очищают препаративной ВЭЖХ, используя колонку Phenomenex Lunov C18 (25030,0 мм, 10 мк) и изократную элюцию CH3CN:H2O (12:13) при скорости потока 25 мл/мин во фракциях по 15 мл. Препаративную ВЭЖХ используют только для очистки, но не для анализа. В табл. 4 описывают измеряемые свойства продукта. Таблица 4(33,0 г, 109,27 ммоль) в ТГФ (330 мл) в течение 15 мин в инертной атмосфере при -78 С и перемешивают в течение приблизительно 3-4 ч при -78 С. Реакционную смесь гасят водным раствором NaOH (2 M, 70 мл). Неочищенную реакционную смесь разводят этилацетатом (500 мл) и органический слой промывают водой (375 мл), насыщенным солевым раствором (100 мл) и сушат над MgSO4 (75 г). Растворитель удаляют под вакуумом с получением 33 г неочищенного материала. Неочищенный продукт подвергают ацетилированию без очистки. Очистка неочищенного материала. Неочищенный материал очищают колоночной хроматографией [29(Д(диаметр 600(Дл(длина мм, силикагель 230-400 меш, 200 г], элюируя системой этилацетат/гексан (1:4) [фракции по 25 мл, элюция 5 мл/мин, мониторируют по ТСХ с обработкой п-анисовым альдегидом; Rf для соединения 1.14=0,3 и Rf для соединения 1.13=0,37 в EtOAc/гексане (1:1)] с получением соединения 1.14. В табл. 5 описывают измеряемые свойства продукта. Таблица 5 Пример 3. 3-гидроксиандростан-11,17-дион ацетат (1.15). Уксусный ангидрид (16,6 г, 162,8 ммоль) добавляют к раствору соединения 1.14 (33,0 г, 108,55 ммоль) в пиридине (150 мл) при 0 С в инертной атмосфере. Полученную в результате реакционную смесь перемешивают в течение ночи при температуре окружающей среды. После завершения реакции,как подтверждают с помощью ТСХ, пиридин и оставшийся уксусный ангидрид удаляют под вакуумом. Неочищенный остаток разводят этилацетатом (500 мл) и промывают водой (3150 мл), насыщенным солевым раствором (100 мл) и сушат над MgSO4 (75 г). Растворитель упаривают под вакуумом и неочищенный материал очищают колоночной хроматографией [59(Д)800(Дл) мм, силикагель 60-120 меш, 150 г], элюируя системой этилацетат/гексан (1:10) [фракции по 25 мл, элюция 10 мл/мин, мониторируют с помощью ТСХ с обработкой п-анисовым альдегидом; Rf для соединения 1.15=0,38 и Rf для соединения 1.14=0,1 в системе EtOAc/гексан (3:7)] с получением соединения 1.15 (19,0 г, выход 66,4%) в виде бесцветного твердого соединения. В табл. 6 описывают измеряемые свойства продукта. Таблица 6 Пример 4. (Z)-3-Гидрокси-5-прег-17(20)-ен-11-он ацетат (1.16). трет-Бутоксид калия (159,28 мл, 159,2 ммоль, 1 М раствор в ТГФ) по каплям добавляют к раствору бромида этилтрифенилфосфония (61,16 г, 164,8 ммоль) в ТГФ (150 мл) в течение 1 ч в инертной атмосфере при -5 С. Полученную в результате окрашенную в темно-розовый цвет реакционную смесь нагревают до 10-15 С и перемешивают в течение дополнительного 1 ч при той же температуре. Раствор соединения 55 (19,0 г, 54,9 ммоль) в ТГФ (50 мл) медленно вводят в вышеуказанную суспензию Виттига при -5 С. Раствор перемешивают в течение дополнительных 10-20 мин и дают реакционной смеси медленно нагреться до температуры окружающей среды. Перемешивание продолжают в течение приблизительно 3-4 ч. После полного исчезновения исходного материала, что подтверждают с помощью ТСХ, реакционную смесь гасят насыщенным водным раствором NH4Cl (75 мл). Водный слой экстрагируют EtOAc (2150 мл), объединенные органические экстракты промывают насыщенным солевым раствором (100 мл) и сушат над MgSO4 (75 г). Растворитель удаляют под вакуумом и неочищенный материал очищают колоночной хроматографией [49(Д)600(Дл) мм, силикагель 60-120 меш, 300 г], элюируя системой этилацетат/гексан (1:20) [фракции по 25 мл, элюция 10 мл/мин, мониторируют с помощью ТСХ с обработкой п-анисовым альдегидом; Rf для соединения 1.16=0,54 и Rf для соединения 1.15=0,06 в EtOAc/гексане (1:6)] с получением соединения 1.16 (15,5 г,выход 78,8%) в виде густой бесцветной жидкости, которая медленно затвердевает через 1-2 дня при 0 С. В табл. 7 описывают измеряемые свойства продукта.
МПК / Метки
МПК: A61Q 19/06, C07J 13/00, A61K 31/575, A61P 3/04, C07J 1/00, C07J 9/00
Метки: кислоты, полученная, дезоксихолевая, дезоксихолевой, удаления, жировых, кислота, композиция, отложений, фармацевтическая, содержащая, указанным, получения, способом, способ, варианты
Код ссылки
<a href="https://eas.patents.su/30-20806-sposob-polucheniya-dezoksiholevojj-kisloty-varianty-dezoksiholevaya-kislota-poluchennaya-ukazannym-sposobom-farmacevticheskaya-kompoziciya-ee-soderzhashhaya-sposob-udaleniya-zhirov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения дезоксихолевой кислоты (варианты), дезоксихолевая кислота, полученная указанным способом, фармацевтическая композиция, ее содержащая, способ удаления жировых отложений</a>