Пиразолопиримидиноны, которые ингибируют циклический гуанозин-3′, 5′-монофосфат-фосфодиэстеразу типа 5 (cgmp pde5), для лечения сексуального расстройства
Номер патента: 2057
Опубликовано: 24.12.2001
Авторы: Мэтиас Джон Пол, Баннедж Марк Эдвард, Стрит Стивен Дирек Альберт, Вуд Энтони
Формула / Реферат
1. Соединение формулы (IA) или (IB)
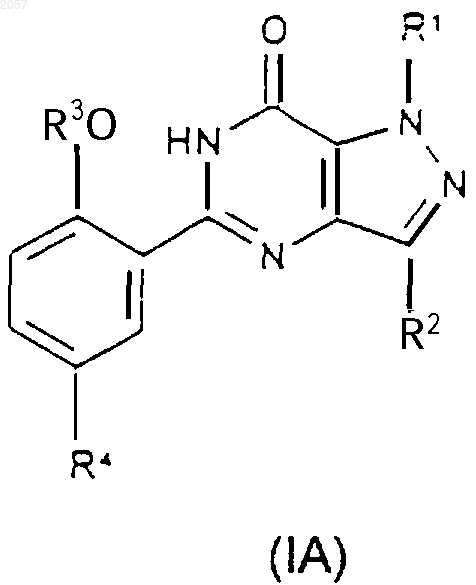
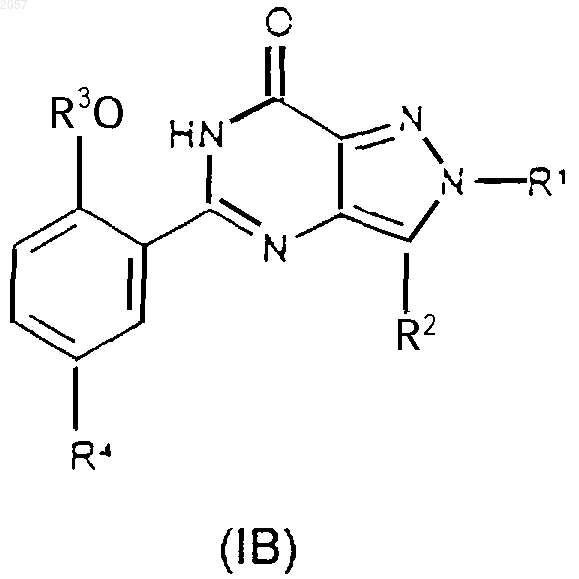
либо его фармацевтически или ветеринарно приемлемая соль, либо фармацевтически или ветеринарно приемлемый сольват любого из них,
где R1 представляет собой C1-С3алкил, замещенный С3-С6циклоалкилом, CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, имидазолила, триазолила, пирролидинила, пиперидинила, морфолинила и 4-R9-пипepaзинилa; (CH2)nHet или (СН2)nАr;
R2 представляет собой C1-С6алкил;
R3 представляет собой C1-С6алкил, возможно замещенный С1-С4алкоксигруппой;
R4 представляет собой SO2NR7R8;
R5 и R6, каждый независимо, выбраны из Н и С1-С4алкила, возможно замещенного С1-С4алкоксигруппой, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную, морфолинильную или 4-R9-пипepaзинильнyю группу;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют 4-R10-пипepaзинильнyю группу;
R9 представляет собой С1-С4алкил;
R10 представляет собой Н или С1-С4алкил, возможно замещенный ОН, С1-С4алкоксигруппой или CONH2;
Het представляет собой С-связанную 6-членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, либо С-связанную 5-членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из С1-С4алкила, возможно замещенного С1-С4алкоксигруппой, С1-С4алкоксигруппы, галогено и NH2;
Аr представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из С1-C4алкила, С1-С4алкоксигруппы, галогено, CN, CONH2, NO2, NH2, NНSO2(С1-C4алкил) и SO2NH2; и
n равняется 0 или 1.
2. Соединение по п.1, где R1 представляет собой С1-С2алкил, замещенный С3-С5циклоалкилом, CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, триазолила, морфолинила и 4-R9-пипepaзинилa; (CH2)nHet или (СН2)nАr; R5 представляет собой Н, а R6 представляет собой С1-С4алкил, возможно замещенный С1-С4алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолинильную группу; Het выбран из пиридинила, 1-оксидопиридинила, пиридазинила, пиримидинила, пиразинила, имидазолила, изоксазолила, тиазолила, триазолила и оксадиазолила, каждый из которых возможно замещен одним или двумя заместителями, выбранными из СН3, СН2СН2OСН3, ОСН3 и NH2; и R2, R3, R4 R9, Аr и n такие, как определено ранее в п.1.
3. Соединение по п.2, где R1 представляет собой С1-С2алкил, замещенный циклобутилом, CONR5R6, пиразол-1-илом, 1,2,3-триазол-1-илом, 1,2,4-триазол-1-илом, морфолин-4-илом или 4-метилпиперазин-1-илом; пиримидин-2-ил; СН2Неt или (CH2)nAr; R2 представляет собой C1-С3алкил; R3 представляет собой C1-С3алкил, возможно замещенный С1-С2алкоксигруппой; R5 представляет собой Н, а R6 представляет собой С1-С2алкил, возможно замещенный С1-С2алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолин-4-ильную группу; R10 представляет собой С1-С2алкил, возможно однозамещенный ОН, ОСН3 либо CONH2; Het выбран из пиридин-2-ила, 1-оксидопиридин-2-ила, пиридин-3-ила, пиридазин-3-ила, пиридазин-4-ила, пиримидин-4-ила, пиримидин-5-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1- метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 2-метилтиазол-4-ила, 1-метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол-5-ила, 4-метил-1,2,4-триазол-3-ила, 3-метил-1,2,4-триазол-5-ила, 1,2,4-оксадиазол-3-ила и 5-метил-1,2,4-оксадиазол-3-ила; Аr выбран из фенила, 4-хлорфенила, 4-бромфенила, 2-цианофенила, 2-карбамоилфенила, 4-карбамоилфенила, 2-нитрофенила, 4-нитрофенила, 2-аминофенила, 4-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила, 4-(проп-2-илсульфонамидо)фенила и 4-сульфамоилфенила; и n такой, как определено ранее в п.2.
4. Соединение по п.3, где R1 представляет собой циклобутилметил, морфолин-4-илкарбонилметил, 2-(морфолин-4-ил)этил, пиримидин-2-ил, CH2Het или (CH2)nAr; R2 представляет собой СН2СН3 или СН2СН2СН3; R3 представляет собой СН2СН3, СН2СН2СН3 или СН2СH2ОСН3; R10 представляет собой СН3, СН2СН3 или СН2СH2ОН; Het выбран из пиридин-2-ила, пиридазин-3-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 1-метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол-5-ила и 5-метил-1,2,4-оксадиазол-3-ила; Аr выбран из фенила, 2-аминофенила, 2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила и 4-(проп-2-илсульфонамидо)фенила; и n такой, как определено ранее в п.3.
5. Соединение по п.4, где соединение формулы (IA) или (IB) выбрано из
5-{5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил}-3-н-пропил-1-(пиридин-2-ил)метил-1,6-дигидро-7Н-пиразоло[4,3-d]-пиримидин-7-она;
1-(1-метилимидазол-2-ил)метил-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-1,6-дигидро-7Н-пиразоло[4,3-d]-пиримидин-7-она;
5-{5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил}-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]-пиримидин-7-она;
5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]-пиримидин-7-она;
3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она;
5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2-(пиридазин-3-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она;
5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2-(пиразин-2-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]-пиримидин-7-она; и
5-[2-этокси-5-(4-этилпиперазин-1-илсульфонил)фенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7Н-пиразоло[4,3-d]пиримидин-7-она.
6. Фармацевтическая композиция, содержащая соединение формулы (IA) или (IB), либо его фармацевтически приемлемую соль, либо фармацевтически приемлемый сольват любого из них, по любому из пп.1-5 вместе с фармацевтически приемлемым разбавителем или носителем.
7. Ветеринарный препарат, содержащий соединение формулы (IA) или (IB), либо его ветеринарно приемлемую соль, либо ветеринаЁэю приемлемый сольват любого из них, по любому из пп.1-5 вместе с ветеринарно приемлемым разбавителем или носителем.
8. Применение соединения формулы (IA) или (IB), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата любого из них по любому из пп.1-5 в качестве лекарства для людей.
9. Применение фармацевтической композиции по п.6 в качестве лекарства для людей.
10. Применение соединения формулы (IA) или (IB), либо его ветеринарно приемлемой соли, либо ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 в качестве лекарства для животных.
11. Применение ветеринарного препарата п.7 в качестве лекарства для животных.
12. Применение соединения формулы (IA) или (IB), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата любого из них по любому из пп.1-5 для производства лекарства для людей для исцеляющего или профилактического лечения терапевтического состояния, для которого показан ингибитор cGMP PDE5.
13. Применение соединения формулы (IA) или (IB), либо его ветеринарно приемлемой соли, либо ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 для производства лекарства для животных, для которых показан ингибитор cGMP PDE5.
14. Применение соединения формулы (IA) или (IB), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата, содержащего любое из них, по любому из пп.1-5 для производства лекарства для людей для исцеляющего или профилактического лечения нарушения эрекции у мужчин, сексуального расстройства у женщин, преждевременных родов, дисменореи, доброкачественной гиперплазии предстательной железы (ВРН), синдрома инфравезикальной обструкции, недержания, стабильной, нестабильной и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы, аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики.
15. Применение соединения формулы (IA) или (IB), либо его ветеринарно приемлемой соли, либо ветеринарно приемлемого сольвата любого из них по любому из пп.1-5 для производства лекарства для животных для исцеляющего или профилактического лечения нарушения эрекции у мужских особей, сексуального расстройства у женских особей, преждевременных родов, дисменореи, доброкачественной гиперплазии предстательной железы (ВРН), синдрома инфравезикальной обструкции, недержания, стабильной, нестабильной и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы, аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики.
16. Способ лечения или профилактики терапевтического состояния, для которого показан ингибитор cGMP PDE5, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (IА) или (IВ), либо его фармацевтически или ветеринарно приемлемой соли, либо фармацевтически или ветеринарно приемлемого сольвата любого из них по любому из пп.1-5, либо фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеперечисленного, по п.6 или 7.
17. Способ лечения или профилактики нарушения эрекции у мужских особей, сексуального расстройства у женских особей, преждевременных родов, дисменореи, доброкачественной гиперплазии предстательной железы (ВРН), синдрома инфравезикальной обструкции, недержания, стабильной, нестабильной и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы, аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы (IA) или (IB), либо его фармацевтически или ветеринарно приемлемой соли, либо фармацевтически или ветеринарно приемлемого сольвата любого из них, по любому из пп.1-5, либо фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеперечисленного, по п.6 или 7.
18. Соединение формулы (IIА) или (IIВ)
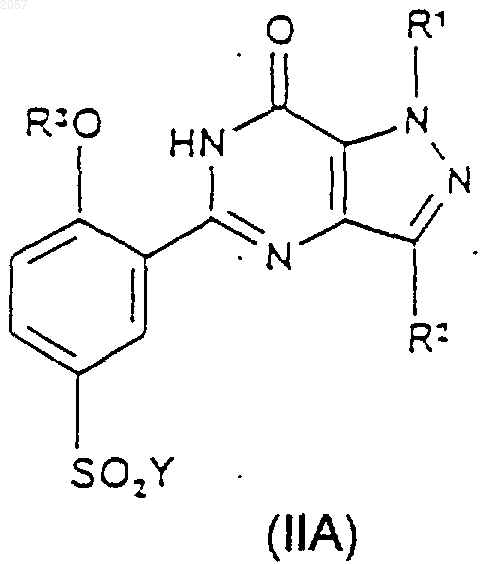
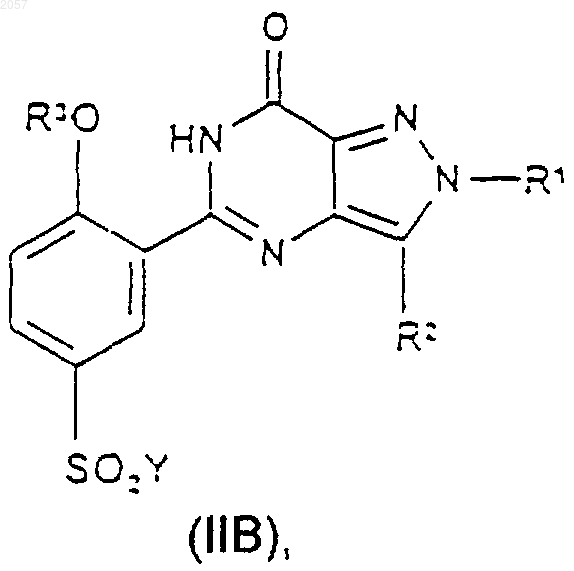
где Y представляет собой галогено, a R1, R2 и R3 такие, как определено ранее в п.1.
19. Соединение по п.18, где Y представляет собой хлор.
20. Соединение формулы (IVA) или (IVB)
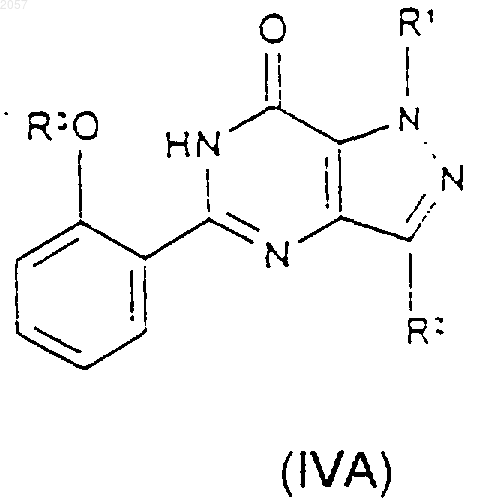
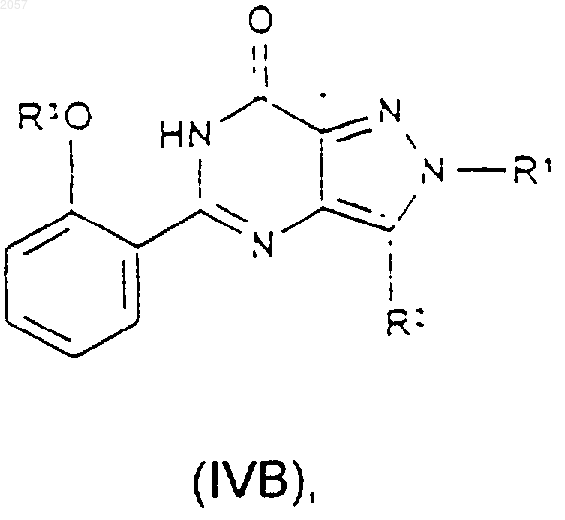
где R1, R2 и R3 такие, как определено ранее в п.1.
21. Соединение формулы (IXA) или (IXB)
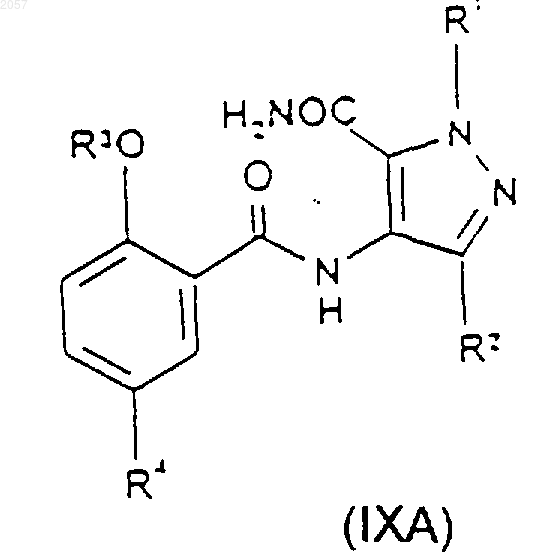
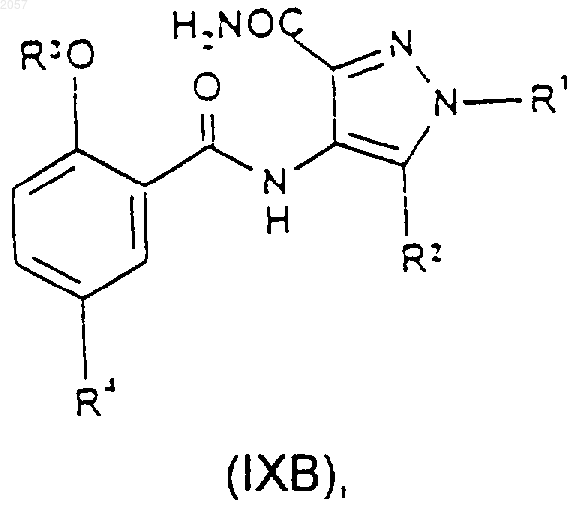
где R1, R2, R3 и R4 такие, как определено ранее в п.1.
22. Способ получения соединения формулы (IA) или (IВ)
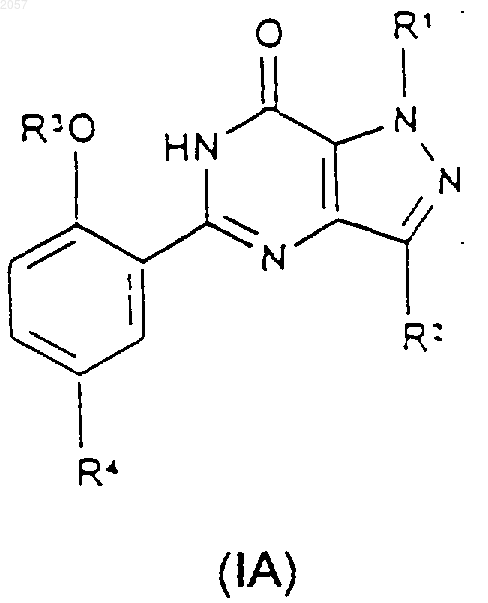
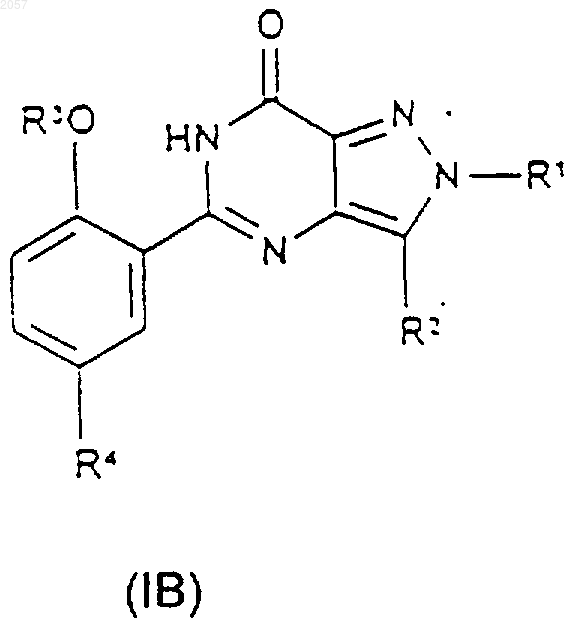
либо его фармацевтически или ветеринарно приемлемой соли, либо фармацевтически или ветеринарно приемлемого сольвата любого из них,
где R1 представляет собой C1-С3алкил, замещенный С3-С6циклоалкилом, CONR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, имидазолила, триазолила, пирролидинила, пиперидинила, морфолинила и 4-R9-пипepaзинилa; (CH2)nHet или (СН2)nАr;
R2 представляет собой С1-С6алкил;
R3 представляет собой C1-С6алкил, возможно замещенный С1-С4алкоксигруппой;
R4 представляет собой SO2NR7R8;
R5 и R6, каждый независимо, выбраны из Н и С1-С4алкила, возможно замещенного С1-С4алкоксигруппой, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную, морфолинильную или 4-R9-пипepaзинильнyю группу;
R7 и R8 вместе с атомом азота, к которому они присоединены, образуют 4-R10-пипepaзинильнyю группу;
R9 представляет собой С1-С4алкил;
R10 представляет собой Н или С1-С4алкил, возможно замещенный ОН, С1-С4алкоксигруппой либо CONH2;
Het представляет собой С-связанную 6-членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, или С-связанную 5-членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из С1-С4алкила, возможно замещенного С1-С4алкоксигруппой, С1-C4алкоксигруппы, галогено и NH2;
Аr представляет собой фенил, возможно замещенный одним или двумя заместителями, выбранными из С1-С4алкила, С1-С4алкоксигрупяы, галогено, CN, CONH2, NO2, NH2, NHSO2 (С1-С4алкил) и SO2NH2; и n равняется 0 или 1; при котором соединение формулы (IIА) или (IIB) соответственно
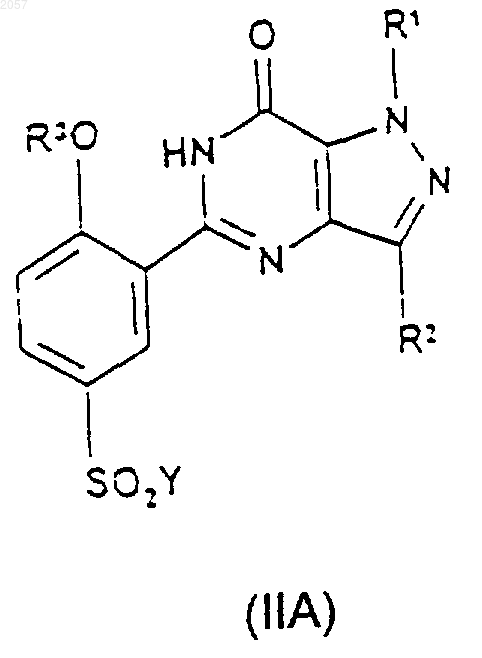
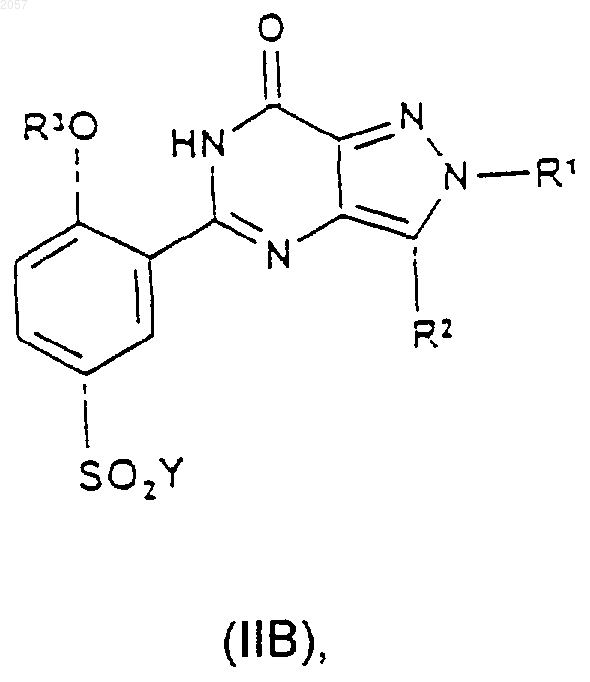
где Y представляет собой галогено, a R1, R2 и R3 такие, как определено ранее в этом пункте, подвергают взаимодействию с соединением формулы (III)
R7R8NH (III),
где R7 и R8 такие, как определено ранее в этом пункте, с последующим возможным образованием фармацевтически или ветеринарно приемлемой соли целевого продукта, либо фармацевтически или ветеринарно приемлемого сольвата любого из них.
23. Способ получения соединения формулы (IA) или (IB), либо его фармацевтически или ветеринарно приемлемой соли, либо фармацевтически или ветеринарно приемлемого сольвата любого из них, при котором соединение формулы (IXA) или (IXB) соответственно
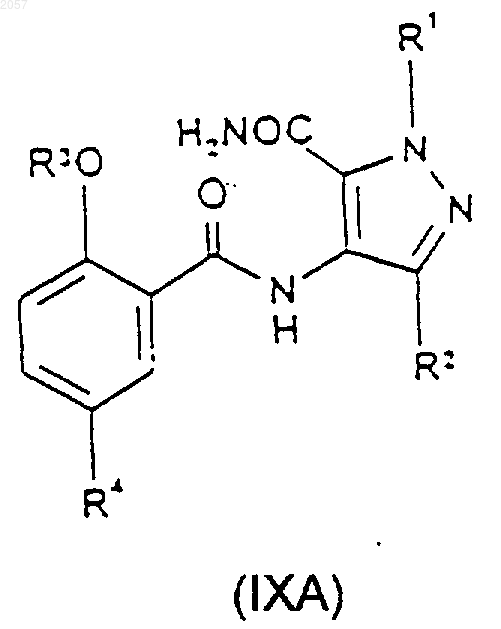
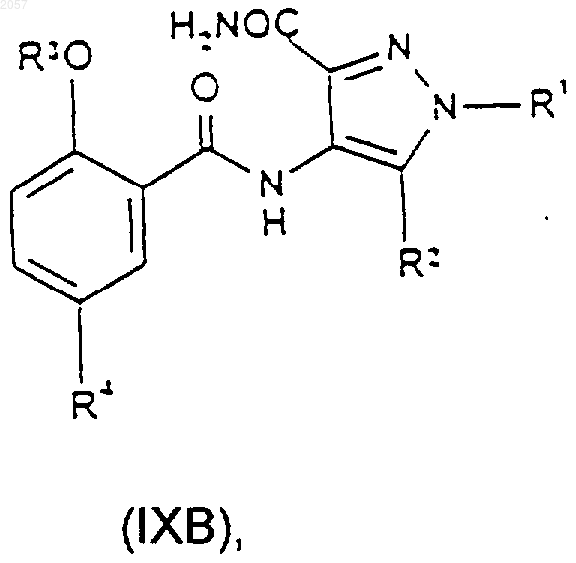
где R1, R2, R3 и R4 такие, как определено ранее для формул (IA) и (IB) в п.22, подвергают циклизации с последующим возможным образованием фармацевтически или ветеринарно приемлемой соли целевого продукта, либо фармацевтически или ветеринарно приемлемого сольвата любого из них.
Текст
1 Это изобретение относится к группе пиразоло[4,3-d]пиримидин-7-онов, которые ингибируют циклический гуанозин-3',5'-монофосфатфосфодиэстеразу (cGMP PDE). В особенности,соединения по изобретению представляют собой сильнодействующие и селективные ингибиторы циклический гуанозин-3',5'-монофосфатфосфодиэстеразы типа 5 (cGMP PDE5) и поэтому полезны в различных терапевтических областях. В частности, данные соединения имеют значение при лечении нарушения эрекции у мужчин (MED) и сексуального расстройства у женщин (FSD), но ясно, что они также будут полезны для лечения других терапевтических состояний, для которых показан сильнодействующий и селективный ингибитор cGMP PDE5. Такие состояния включают в себя преждевременные роды, дисменорею, доброкачественную гиперплазию предстательной железы (ВРН),синдром инфравезикальной обструкции, недержание, стабильную, нестабильную и вариантную (Prinzmetal) стенокардию, гипертензию,легочную гипертензию, застойную сердечную недостаточность, атеросклероз, состояния пониженной проходимости кровеносных сосудов,например после чрескожной чресполостной пластической операции на коронарных сосудах(post-PTCA), заболевание периферических сосудов, удар, бронхит, аллергическую астму, хроническую астму, аллергический ринит, глаукому и заболевания, характеризующиеся расстройством кишечной перистальтики, например слизистый колит (IBS).WO-A-94/28902 и WO-A-96/16644 относятся к применению различных групп ингибиторов cGMP PDE5 для лечения MED, включая, в пределах WO-A-96/16644, соединения, раскрытые в ЕР-А-020188, которые представляют собой также антагонисты аденозинового рецептора и описаны как пригодные при лечении сердечно-сосудистых заболеваний, равно как и раскрытые в ЕР-А-0352960 соединения, обладающие бронхолитическими, сосудорасширяющими и противоаллергическими свойствами. Таким образом, согласно данному изобретению предложены соединения формул (IА) и или их фармацевтически или ветеринарно приемлемая соль, или фармацевтически или ветеринарно приемлемый сольват любого из них,гдеR5 и R6 каждый независимо выбраны из Н и С 1-С 4 алкила, возможно замещенного С 1 С 4 алкоксигруппой, или вместе с атомом азота, к которому они присоединены, образуют пирролидинильную, пиперидинильную, морфолинильную либо 4-R9-пипepaзинильнyю группу;Het представляет собой С-связанную 6 членную гетероциклическую группу, содержащую один или два атома азота, возможно в форме его моно-N-оксида, либо С-связанную 5 членную гетероциклическую группу, содержащую от одного до четырех гетероатомов, выбранных из азота, кислорода и серы, причем любая из указанных гетероциклических групп возможно замещена одним или двумя заместителями, выбранными из С 1-С 4 алкила, возможно замещенного С 1-С 4 алкоксигруппой, С 1-С 4 алкоксигруппы, галогено и NH2; Аr представляет собой фенил, возможно замещенный одним или двумя заместителями,выбранными из С 1-С 4 алкила, С 1-С 4 алкоксигруппы, галогено, CN, CONH2, NO2, NH2,NНSО 2(C1-C4 алкил) и SO2NH2; и n равняется 0 или 1. Если не оговорено особо, в приведенном выше определении алкильные или алкоксигруппы, имеющие три или более чем три атома углерода, могут быть прямоцепочечными или разветвленными. Галогено означает фтор-, хлор-,бром- или иод-. Соединения формул (IА) и (IВ) могут содержать один или более чем один хиральный центр и поэтому могут существовать в виде стереоизомеров, т.е. в виде энантиомеров или диастереоизомеров, равно как и в виде их смесей. Изобретение охватывает как индивидуальные стереоизомеры соединений формул (IА) и (IВ),так и любую их смесь. Разделение диастереоизомеров может быть достигнуто традиционными способами, например фракционной кристаллизацией или хроматографией (включая ВЭЖХ) диастереоизомерной смеси соединения формулы (IА) или (IВ) либо его подходящей соли или производного. Индивидуальный энантиомер соединения формулы (IА) или (IВ) может быть получен из соответствующего оптически чистого промежуточного соединения или путем раз 3 деления либо с помощью ВЭЖХ рацемата с использованием подходящей хиральной стационарной фазы, либо, где целесообразно, путем фракционной кристаллизации диастереоизомерных солей, образованных в результате взаимодействия рацемата с подходящими оптически активными кислотой или основанием. Соединения формул (IА) и (IB) могут также существовать в таутомерных формах, и данное изобретение охватывает как их смеси, так и индивидуальные таутомеры. Кроме того, охватываемыми данным изобретением являются меченные радиоактивным изотопом производные соединений формул (IА) и (IB), которые пригодны для биологических исследований. Фармацевтически или ветеринарно приемлемые соли соединений формул (IА) и (IB), которые содержат основной центр, представляют собой, например, нетоксичные соли присоединения кислоты, образованные с неорганическими кислотами, такими как соляная, бромистоводородная, серная и фосфорная кислота, с органическими карбоновыми кислотами или с органическими сульфоновыми кислотами. Кроме того, соединения формул (IА) и (IB) охватывают фармацевтически или ветеринарно приемлемые соли металлов, в частности нетоксичные соли щелочных металлов, образованные с основаниями. Примеры включают в себя натриевые и калиевые соли. Предпочтительной солью является цитрат. Предпочтительной группой соединений формул (IА) и (IВ) является такая, где R1 представляет собой С 1-С 2 алкил, замещенный С 3 С 5 циклоалкилом, СОNR5R6 или N-связанной гетероциклической группой, выбранной из пиразолила, триазолила, морфолинила и 4-R9 пипepaзинилa; (CH2)nHet или (СН 2)nАr; R5 представляет собой Н, а R6 представляет собой С 1 С 4 алкил, возможно замещенный С 1-С 4 алкоксигруппой, или R5 и R6 вместе с атомом азота, к которому они присоединены, образуют морфолинильную группу; Het выбран из пиридинила,1-оксидопиридинила, пиридазинила, пиримидинила, пиразинила, имидазолила, изоксазолила,тиазолила, триазолила и оксадиазолила, каждый из которых возможно замещен одним или двумя заместителями,выбранными из СН 3,СН 2 СН 2OСН 3, ОСН 3 и NH2; и R2, R3, R4, R9, Аr иn такие, как определено ранее. Более предпочтительной группой соединений формул (IA) и (IB) является такая, где R1 представляет собой С 1-С 2 алкил, замещенный циклобутилом, CONR5R6, пиразол-1-илом, 1,2,3 триазол-1-илом, 1,2,4-триазол-1-илом, морфолин-4-илом или 4-метилпиперазин-1-илом; пиримидин-2-ил; CH2Het или (СН 2)nАr; R2 представляет собой С 1-С 3 алкил; R3 представляет собой C1-С 3 алкил, возможно замещенный С 1 С 2 алкоксигруппой; R5 представляет собой Н, аR10 представляет собой С 1-С 2 алкил, возможно однозамещенный ОН, ОСН 3 либо CONH2; Het выбран из пиридин-2-ила, 1-оксидопиридин-2 ила, пиридин-3-ила, пиридазин-3-ила, пиридазин-4-ила, пиримидин-4-ила, пиримидин-5-ила,пиразин-2-ила, 3-метоксипиридин-2-ила, 6 аминопиридин-2-ила, 1-метилимидазол-2-ила,3,5-диметилизоксазол-4-ила, 2-метилтиазол-4 ила, 1-метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)-1,2,4-триазол-5-ила,4-метил-1,2,4-триазол-3-ила, 3-метил-1,2,4-триазол-5-ила, 1,2,4 оксадиазол-3-ила и 5-метил-1,2,4-оксадиазол-3 ила; Аr выбран из фенила, 4-хлорфенила, 4 бромфенила, 2-цианофенила,2-карбамоилфенила, 4-карбамоилфенила, 2-нитрофенила, 4 нитрофенила, 2-аминофенила, 4-аминофенила,2-метансульфонамидофенила, 4-метансульфонамидофенила, 4-этансульфонамидофенила, 4(проп-2-илсульфонамидо)фенила и 4-сульфамоилфенила; и n такой, как определен ранее. Предпочтительной группой соединений формул (IA) и (IB), в частности, является такая,где R1 представляет собой циклобутилметил,морфолин-4-илкарбонилметил, 2-(морфолин-4 ил)этил, пиримидин-2-ил, CH2Het или (СН 2)nАr;R3 представляет собой СН 2 СН 3,CH2 СH2 СН 3 или СН 2 СH2 ОСН 3;R10 представляет собой СН 3, СН 2 СН 3 или СН 2 СН 2OН; Het выбран из пиридин-2-ила, пиридазин-3-ила, пиразин-2-ила, 3-метоксипиридин-2-ила, 6-аминопиридин-2-ила, 1-метилимидазол-2-ила, 3,5-диметилизоксазол-4-ила, 1 метил-1,2,4-триазол-5-ила, 1-(2-метоксиэтил)1,2,4-триазол-5-ила и 5-метил-1,2,4-оксадиазол 3-ила; Аr выбран из фенила, 2-аминофенила, 2 метансульфонамидофенила,4-метансульфонамидофенила, 4-этансульфонамидофенила и 4(проп-2-илсульфонамидо)фенила; и n такой, как определено ранее. Особенно предпочтительные индивидуальные соединения по изобретению включают: 5-5-[4-(2-гидроксиэтил)пиперазин-1 илсульфонил]-2-н-пропоксифенил-3-н-пропил 1-(пиридин-2-ил)метил-1,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он; 1-(1-метилимидазол-2-ил)метил-5-[5-(4 метилпиперазин-1-илсульфонил)-2-нпропоксифенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он; 5-5-[4-(2-гидроксиэтил)пиперазин-1 илсульфонил]-2-н-пропоксифенил-3-н-пропил 2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он; 5-[5-(4-этилпиперазин-1-илсульфонил)-2 н-пропоксифенил]-3-н-пропил-2-(пиридин-2 ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он; 5 3-этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-2-(пиридин-2 ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он; 5-[5-(4-этилпиперазин-1-илсульфонил)-2 н-пропоксифенил]-3-н-пропил-2-(пиридазин-3 ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он; 5-[5-(4-этилпиперазин-1-илсульфонил)-2 н-пропоксифенил]-3-н-пропил-2-(пиразин-2-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он; и 5-[2-этокси-5-(4-этилпиперазин-1 илсульфонил)фенил]-3-н-пропил-2-(пиридин-2 ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Согласно еще одному аспекту настоящего изобретения предложены способы получения соединений формул (IА) и (IB), их фармацевтически и ветеринарно приемлемых солей и фармацевтически и ветеринарно приемлемых сольватов любого из них, как проиллюстрировано ниже. Специалистам ясно, что порядок используемых в синтезе стадий, в пределах некоторых описанных способов, может изменяться, и будет зависеть inter alia от таких факторов, как природа остальных функциональных групп, имеющихся в конкретном субстрате, наличие ключевых промежуточных соединений и стратегия защитных групп, которую (если таковые имеются) следует выбрать. Ясно, что такие факторы также будут оказывать влияние на выбор реагента для использования на указанных стадиях синтеза. Иллюстрацией стратегий защитных групп являются способы синтеза из примера 56, в котором защита спиртовой группы с использованием трет-бутилдиметилсилильной группы предшествует требуемой стадии N-мезилирования, из примера 63, в котором пиперазин по 4 положению защищают Воc(третбутоксикарбонилом) с целью предотвращения бис-сульфонилирования пиперазина, и из примеров 23 и 68, в которых защита амина с использованием пивалоильной группы предшествует предпоследней стадии хлорсульфонилирования. Очевидно также, что в результате взаимопревращений и трансформаций различных стандартных заместителей или функциональных групп у некоторых соединений формул (IА) и(IВ) будут получены другие соединения формул(IА) и (IВ). Примеры включают в себя алкоксидный обмен по 2 положению 5-фенильного заместителя (см. превращение соединения примера 41 в соединение примера 42), гидролиз цианогруппы до карбамоила (см. превращение соединения примера 46 в соединение примера 47), восстановление нитрогруппы до аминогруппы (см. превращения соединений примеров 49, 50, 51, 91, 115, 118 и 121 в соединения при 002057 6 меров 52, 53, 54, 93, 116, 119 и 122 соответственно), сульфонилирование аминогруппы (см. превращения соединений примеров 52, 54, 116,119 и 122 в соединения примеров 55, 57, 117,120 и 123 и 124 соответственно), гидрогенолиз галогено (см. превращение соединения примера 88 в соединение примера 87) и N-окисление пиридинила (см. превращения соединений примеров 6 и 12 в соединения примеров 128 и 129 соответственно). Более того, некоторые соединения формул(IA) и (IB) могут быть получены непосредственно из соответствующих незамещенных по 4 положению пиперазиновых аналогов, т.е. соединений формул (IA) и (IB), где R10 является водородом, с использованием стандартных методик алкилирования. Следующие способы представляют собой иллюстрацию общих процедур синтеза, которые могут быть выбраны для получения соединений по данному изобретению. 1. Соединение формулы (IA) или (IB) может быть получено из соединения формулы где Y представляет собой галогено, предпочтительно хлор-, a R1, R2 и R3 такие, как определено ранее для формул (IA) и (IB), путем взаимодействия с соединением формулы (III)(III),7 где R и R8 такие, как определено ранее для формул (IA) и (IB). Данное взаимодействие обычно осуществляют при комнатной температуре, предпочтительно в присутствии соответствующего растворителя, такого как C1-С 3 алканол, используя избыток (III) или другого подходящего основания, чтобы удалить кислый побочный продукт(HY). Соединение формулы (IIА) или (IIВ) может быть получено из соединения формулы где R1, R2 и R3 такие, как определено ранее для формул (IIА) и (IIВ), путем применения известных методов введения SO2Y-группы, где Y также определен ранее для формул (IIА) и (IIВ), в систему ароматического кольца. Например, в том случае, когда Y представляет собой хлор-,путем действия избытка хлорсульфоновые кислоты, с возможным последующим действием избытка тионилхлорида при температуре от приблизительно 0 С до приблизительно комнатной. Соединение формулы (IVA) или (IVB) может быть получено путем алкилирования соединения формулы (V) где R2 и R3 такие, как определено ранее для формул (IVA) и (IVB), с использованием одного или более чем одного способа из большого числа хорошо известных способов, таких как(i) взаимодействие (V) с соединением формулы R1X, где R1 такой, как определено ранее для формул (IVA) и (IVB), a X представляет собой подходящую уходящую группу, например галогено (предпочтительно хлор-, бром- или иод-), С 1-С 4 алкансульфонилокси-, трифторметансульфонилокси- или арилсульфонилоксигруппу (такую как бензолсульфонилокси или птолуолсульфонилокси-), в присутствии соответствующего основания, возможно в присутствии иодида натрия или иодида калия, при температуре от приблизительно -70 С до приблизительно 100 С. Данное алкилирование предпочтительно проводят при температуре от приблизительно комнатной до приблизительно 80 С. Подходящие комбинации основаниерастворитель могут быть выбраны из(a) карбоната натрия, калия или цезия, бикарбоната натрия или калия, или третичного амина, такого как триэтиламин или пиридин, 002057(b) гидроксида натрия или калия, или С 1 С 4 алкоксида натрия или калия вместе с С 1 С 4 алканолом, водой или их смесями;(c) гидрида лития, натрия или калия,бис(триметилсилил)амида лития, натрия или калия, диизопропиламида лития или бутиллития вместе с толуолом, эфиром, 1,2-диметоксиэтаном, тетрагидрофураном или 1,4-диоксаном; или(d) в условиях катализа фазового переноса,галогенида или гидроксида тетраалкиламмония вместе со смесью водного раствора гидроксида натрия или калия и дихлорметана, 1,2 дихлорэтана или хлороформа;(ii) взаимодействие (V) с соединением формулы R1OH, где R1 такой, как определено ранее для формул (IVA) и (IVB), с использованием классической методологии Мицунобу. Типичные условия реакции включают в себя обработку (V) алканолом в присутствии триарилфосфина и ди(С 1-С 4)алкилазодикарбоксилата в подходящем растворителе, таком как тетрагидрофуран или 1,4-диоксан, при температуре от приблизительно -5 С до приблизительно комнатной. Некоторые соединения формул (IVA) и(IVB) могут быть получены, в меньшей степени,непосредственно из родственных аналогов, когда эти аналоги легче доступны, используя ранее описанные способы алкилирования: см.,например, гидролитическое превращение соединения подготовительного примера 33, где R1 представляет собой 2,4-дихлорпиримидин-5 илметил, в соединение подготовительного примера 34, где R1 представляет собой пиримидин 5-илметил. Подобным же образом, амиды подготовительных примеров 102, 103 и 104 и подготовительных примеров 105, 106 и 107 получают из соответствующих карбоновых кислот подготовительных примеров 101 и 69 соответственно. Другие соединения формул (IVA) и (IVB),где R1 представляет собой CH2Het, могут быть получены путем построения гетероциклического кольца после стадии пиразолопиримидиноналкилирования. Этот подход особенно удобен,когда требуемый HetCH2X относительно недоступен. Например, когда Het представляет собой либо 3-метил-1,2,4-триазол-5-ил, либо 5-метил 1,2,4-оксадиазол-3-ил, гетероциклические кольца могут быть составлены из карбоксиметильного предшественника и цианометильного предшественника, соответственно, т.е. соединения формулы (IVA) и (IVB), где R1 представляет собой СН 2 СO2 Н или СН 2 СN, с помощью серии стандартных стадий. Каждый вариант проиллюстрирован посредством превращения соединения подготовительного примера 69 в соедине 9 ние подготовительного примера 72 и превращения соединений подготовительных примеров 73 и 77 в соединения подготовительных примеров 76 и 79. Еще одним вариантом получения соединения формулы (IVA) или (IVB) является введение группы R1 на значительно более ранней стадии в схему синтеза, например путем соответствующего генерирования N1- или N2-алкилированного пиразольного производного, которое затем преобразовывают в (IVA) или (IVB) по аналогии с далее описанным превращением(VII) в (V). Соединение формулы (V) может быть получено из соединения формулы (VI) где R2 и R3 такие, как определено ранее для формулы (V), применением известных для образования пиримидинонового кольца методов циклизации. Так например, циклизация может быть осуществлена путем обработки (V) основанием, таким как гидроксид натрия или калия либо карбонат натрия или калия, возможно в присутствии перекиси водорода в среде С 1 С 4 алканол-вода при температуре реакционной смеси от приблизительно 60 С до температуры дефлегмации. Кроме того, циклизация может быть опосредована C1-С 5 алкилатом натрия или калия в С 1-С 5 алканоле как растворителе при температуре реакционной смеси от приблизительно 60 С до температуры дефлегмации. Другие способы циклизации включают в себя обработку (V) либо полифосфорной кислотой при температуре от приблизительно 130 С до приблизительно 150 С, либо кислотой Льюиса, например безводным хлоридом цинка, при температуре от приблизительно 200 С до приблизительно 220 С. Соединение формулы (VI) может быть получено путем селективного N-ацилирования соединения формулы (VII) где R2 такой, как определено ранее для формулы где Y представляет собой подходящую уходящую группу, а R3 такой, как определено ранее для формулы (VI). Например, когда Y представляет собой хлор-, данное взаимодействие может быть осуществлено с использованием соответствующего ароилхлорида в присутствии избытка третичного амина, такого как триэтиламин или пиридин, действующего как акцептор для побочной кислоты (HY), возможно в присутствии катализатора, такого как 4-диметиламинопиридин, в подходящем растворителе,таком как дихлорметан, при температуре от приблизительно 0 С до приблизительно комнатной. Для удобства в качестве растворителя может быть использован также пиридин. 2. Другой обычно применяемый путь синтеза соединений формул (IА) и (IВ) включает в себя введение заместителя R4 на ранней стадии синтеза. Так, соединение формулы (IА) или (IВ) может быть получено путем циклизации соединения формулы (IХА) или (IХВ) соответственно где R1, R2, R3 и R4 такие, как определено ранее для формул (IA) и (IB). Циклизация может быть осуществлена в щелочных, нейтральных и кислых условиях. В нейтральных условиях соединение формулы (IXA) или (IXB) может быть нагрето, возможно, в присутствии растворителя, и/или, возможно, в присутствии дегидратирующего агента, и/или системы механического удаления воды, например аппарата Дина-Старка. Подходящим растворителем является 1,2-дихлорбензол,сульфолан или N-метилпирролидин-2-он, подходящим дегидратирующим агентом являются молекулярные сита, и реакцию предпочтительно проводят при 180-220 С. В кислотных условиях циклизация может быть проведена путем взаимодействия соединения формулы (IXA) или (IXB) с протонной кислотой или кислотой Льюиса, возможно в при 11 сутствии растворителя. Подходящей протонной кислотой является концентрированная серная кислота,фосфорная кислота или птолуолсульфоновая кислота, подходящей кислотой Льюиса является трифторид бора, хлорид алюминия, тетрахлорид кремния, хлорид олова, тетрахлорид титана, хлорид железа или хлорид цинка, подходящий растворитель представляет собой ледяную уксусную кислоту, тетрагидрофуран, 1,4-диоксан или хлорбензол, и реакцию предпочтительно проводят при 65210 С. Однако предпочтительным способом циклизации соединения формулы (IXA) или (IXB) является циклизация в щелочных условиях,предпочтительно в растворителе, возможно в присутствии перекиси водорода или перекисной соли, с последующей, где необходимо, нейтрализацией реакционной смеси. Подходящее основание выбрано из группы, состоящей из С 1 С 12 алкилатных и гидридных солей лития, натрия и калия, амида натрия, циклогексиламида натрия и карбоната цезия, количество используемого основания находится в интервале от 1,1 до 2,0 молярных эквивалентов, подходящий растворитель выбран из группы, состоящей из этанола, н-пропанола, трет-бутанола, третамилового спирта, 1-метилциклогексанола, тетрагидрофурана и 1,4-диоксана, и реакцию проводят при 60-105 С. Предпочтительно, если основание выбрано из группы, состоящей из этилата натрия, третбутилата натрия, трет-бутилата калия и гидрида натрия; а растворитель выбран из группы, состоящей из этанола, н-пропанола, третбутанола, трет-амилового спирта и тетрагидрофурана. Соединение формулы (IXA) или (IXB) может быть получено путем взаимодействия соединения формулы (ХА) или (ХВ), соответственно где R1 и R2 такие, как определено ранее для формул (IXA) и (IXB), с соединением формулы где R3 и R4 также такие, как определено ранее для формул (IXA) и (IXB). Реакция сочетания может быть осуществлена с использованием общепринятых методик образования амидной связи, например через ацилхлоридное производное соединения (XI),по аналогии с получением соединения формулы(VI), гарантируя, что любой потенциально уязвимый заместитель (например, когда R10 представляет собой С 1-С 4 алкил, замещенный ОН илиCONH2). В частности, может быть использован любой из множества вариантов сочетания аминокислот. Например кислоту формулы (XI) можно активировать, используя карбодиимид, такой как 1,3-дициклогексилкарбодимид или 1-этил-3(3-диметиламинопроп-1-ил)карбодиимид, возможно в присутствии 1-гидроксибензотриазола и/или катализатора,такого как 4 диметиламинопиридин, либо используя соль галогенотрисаминофосфония, такую как бромтрис(пирролидино)фосфония гексафторфосфат. Тот и другой тип связывания проводят в подходящем растворителе, таком как дихлорметан,возможно в присутствии третичного амина, такого как N-метилморфолин или N-этилдиизопропиламин (например, когда либо соединение формулы (ХА) или (ХВ), либо активирующий реагент представлены в форме соли присоединения кислоты), при температуре приблизительно 0 С. Предпочтительно используют 1,12,0 молярных эквивалентов активирующего реагента и 2,0-3,0 молярных эквивалента любого третичного амина. Смесь (XI) и либо (ХА), либо (ХВ) обрабатывают приблизительно одним молярным эквивалентом сочетающего реагента (бензотриазол 1-илокси)трипирролидинофосфония гексафторфосфата (РуВОР) в подходящем растворителе,таком как диметилформамид, при приблизительно комнатной температуре. Еще в одном варианте карбоксильную группу (XI) сначала можно активировать с использованием приблизительно до 5%-ного избытка такого реагента,какN,N'карбонилдимидазол, в подходящем растворителе, например этилацетате или бутан-2-оне, при температуре от приблизительно комнатной до приблизительно 80 С с последующим взаимодействием промежуточного имидазолида с либо(ХА), либо (ХВ) при температуре от приблизительно 20 до приблизительно 90 С. Амины формулы (III), 4-аминопиразол-5 карбоксамиды формул (VII), (ХА) и (ХВ), производные карбоновых кислот формулы (VIII) и 13 карбоновые кислоты формулы (XI), в том случае, если их нет в продаже или они не описаны впоследствии, могут быть получены либо по аналогии со способами, описанными в разделе подготовительные примеры, либо с помощью общепринятых методик синтеза в соответствии со стандартными руководствами по органической химии или в соответствии с литературным прецедентом из легко доступных исходных материалов с использованием соответствующих реагентов и условий реакции. Более того, специалисты осведомлены о вариантах способов и альтернативах способам,описанным здесь далее в разделах примеры и подготовительные примеры, которые позволяют получать соединения, которые определены формулами (IА) и (IВ). Фармацевтически приемлемые соли присоединения кислот соединений формул (IА) и(IВ), которые содержат, основный центр, также могут быть получены традиционным образом. Например, раствор свободного основания обрабатывают соответствующей кислотой, либо чистой, либо в подходящем растворителе, и полученную соль выделяют либо фильтрацией, либо выпариванием реакционного растворителя под вакуумом. Фармацевтически приемлемые соли присоединения оснований могут быть получены аналогичным образом путем обработки соединения формулы (IА) или (IВ) соответствующим основанием. Оба типа соли могут образовываться или взаимопревращаться при использовании методик ионного обмена на смолах. Биологические активности соединений по настоящему изобретению определяли с помощью следующих методов испытаний. Ингибиторная активность в отношении фосфодиэстеразы (PDE)PDE-ингибиторные активности in vitro в отношении циклический гуанозин-3',5'монофосфат-(cGMP) и циклический аденозин 3',5'-монофосфат-(сАМР)-фосфодиэстераз определяли измерением значений IС 50 (концентраций соединения, необходимых для 50%-ного ингибирования ферментативной активности). Необходимые PDE-ферменты выделяли из целого ряда источников, включая пещеристое тело человека, тромбоциты человека и кролика,желудочек сердца человека, скелетная мышца человека и сетчатка быка, по существу по методу W.J.Thompson и M.M.Appleman. (Biochem.,1971, 10, 311). В частности, cGMP-специфичную PDE (PDE5) и cGMP-ингибируемую cAMPPDE (PDE3) получали из ткани пещеристого тела человека, человеческих тромбоцитов или кроличьих тромбоцитов; cGMP-стимулируемуюPDE (PDE2) получали из пещеристого тела человека; кальций/кальмодулин-(Са/САМ)-зависимую PDE (PDE1) - из желудочка сердца человека; сАМР-специфичную PDE (PDE4) - из скелетной мышцы человека; а фоторецепторную 14 Анализы выполняли, используя модификацию группового метода Томпсона и др.(W.J. Thompson et al. Biochem., 1979, 18. 5228). Результаты этих тестов показывают, что соединения по настоящему изобретению являются сильнодействующими и селективными ингибиторами cGMP-специфичной PDE5. Функциональная активность Ее оценивали in vitro путем определения способности соединения по изобретению усиливать индуцированное нитропруссидом натрия расслабление предварительно сокращенных полосок из ткани пещеристого тела кроликов,как описано в работе S.A. Ballard et al. (Brit. J.Pharmacol., 1996, 118 (suppl.), abstract 153P). Активность in vivo На анестезированных собаках проводили проверку соединений на предмет определения их способности после внутривенного введения усиливать нарастание давления в пещеристых телах пениса, индуцированное с помощью внутрикавернозной инъекции нитропруссида натрия,используя метод, оcнованный на известном методе (Trigo-Rocha et al., Neurourol. and Urodyn.,1994, 13, 71). При лечении людей соединения формул(IA) и (IB), их фармацевтически приемлемые соли и фармацевтически приемлемые сольваты любого из них могут быть введены в чистом виде, но обычно их вводят в смеси с фармацевтическим носителем, выбранным с точки зрения предполагаемого пути введения и обычной фармацевтической практики. Предпочтительно их вводят перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактозу; или в капсулах или овулях, либо в чистом виде, либо в смеси с эксципиентами; или в форме эликсиров, растворов или суспензий, содержащих корригенты или красители. Кроме того, их можно вводить парентерально, например внутрикавернозно, внутривенно, внутримышечно или подкожно. Для парентерального введения их лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или моносахаридов для того, чтобы раствор сделать изотоничным крови. Для трансбуккального или подъязычного введения их можно назначать в форме таблеток или лепешек, которые могут быть приготовлены традиционным способом. Уровень суточной дозы соединений формул (IА) и (IВ) и их фармацевтически приемлемых солей и сольватов для перорального, парентерального, трансбуккального и подъязычного введения пациентам может быть в интервале от 10 до 500 мг (в разовой или разделенных дозах). Так, например, таблетки или капсулы могут содержать от 5 до 100 мг активного соединения для введения по одной, или по две,или более одновременно, как подходит. В любом случае врач определит фактическую дозу, 15 которая будет наиболее подходящей для конкретного пациента и будет меняться в зависимости от возраста, веса и чувствительности данного пациента. Вышеупомянутые дозы являются типичными для обычного больного; конечно,могут быть конкретные случаи, которые заслуживают более высоких или более низких интервалов доз, и таковые находятся в пределах объема данного изобретения. Обычно предпочтительным способом введения людям соединений по данному изобретению является пероральное введение, как наиболее удобное и, например при MED, обходящее хорошо известные неудобства, связанные с внутрикавернозным (в.к.) введением. Предпочтительная схема перорального приема лекарства при MED для обычного мужчины составляет,когда необходимо, от 25 до 100 мг соединения. В случаях, когда реципиент страдает от нарушения глотательной функции или испытывает ухудшение всасывания лекарств при пероральном введении, лекарство может быть введено парентерально, например подъязычно или трансбуккально. В случае использования в ветеринарии соединение формулы (IA) или (IB), либо его ветеринарно-приемлемая соль, либо ветеринарноприемлемый сольват любого из них, вводят в виде подходящего приемлемого препарата согласно обычной ветеринарной практике, и схему приема лекарства и путь введения, которые будут наиболее целесообразны для данного животного, будет определять хирург-ветеринар. Таким образом, согласно данному изобретению предложена фармацевтическая композиция, содержащая соединение формулы (IА) или(IВ), либо его фармацевтически приемлемую соль, либо фармацевтически приемлемый сольват любого из них вместе с фармацевтически приемлемым разбавителем или носителем. Кроме того, предложен ветеринарный препарат, содержащий соединение формулы (IА) или (IВ), либо его ветеринарно-приемлемую соль, либо ветеринарно-приемлемый сольват любого из них вместе с ветеринарно-приемлемым разбавителем или носителем. Согласно данному изобретению также предложены соединение формулы (IА) или (IВ),либо его фармацевтически приемлемая соль,либо фармацевтически приемлемый сольват любого из них, либо фармацевтическая композиция, содержащая любое из вышеперечисленного, для использования в качестве лекарства для людей. Вдобавок предложены соединение формулы (IА) или (IВ), либо его ветеринарноприемлемая соль,либо ветеринарноприемлемый сольват любого из них, либо ветеринарный препарат, содержащий любое из вышеперечисленного, для использования в качестве лекарства для животных. 16 Согласно еще одному аспекту данного изобретения предложено применение соединения формулы (IА) или (IВ), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата любого из них для производства лекарства для людей для исцеляющего или профилактического лечения терапевтического состояния, для которого показан ингибитор cGMP PDE5. Кроме того, предложено применение соединения формулы (IА) или (IВ), либо его ветеринарно-приемлемой соли, либо ветеринарно приемлемого сольвата любого из них для производства лекарства для животных для исцеляющего или профилактического лечения терапевтического состояния, для которого показан ингибитор cGMP PDE5. Более того, согласно данному изобретению предложено применение соединения формулы(IА) или (IВ), либо его фармацевтически приемлемой соли, либо фармацевтически приемлемого сольвата, содержащего любое из них, для производства лекарства для людей для исцеляющего или профилактического лечения нарушения эрекции у мужчин, сексуального расстройства у женщин, преждевременных родов,дисменореи, доброкачественной гиперплазии предстательной железы (ВРН), синдрома инфравезикальной обструкции, недержания, стабильной,нестабильной и вариантной(Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы,аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики. Также предложено применение соединения формулы (IА) или (IВ), либо его ветеринарно-приемлемой соли, либо ветеринарноприемлемого сольвата, содержащего любое из них, для производства лекарства для животных для исцеляющего или профилактического лечения нарушения эрекции у мужских особей, сексуального расстройства у женских особей,преждевременных родов, дисменореи, доброкачественной гиперплазии предстательной железы(ВРН), синдрома инфравезикальной обструкции, недержания, стабильной, нестабильной и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы, аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики. Кроме того, согласно данному изобретению предложен способ лечения или профилак 17 тики терапевтического состояния, для которого показан ингибитор cGMP PDE5, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы(IА) или (IВ), либо его фармацевтически или ветеринарно-приемлемой соли, либо фармацевтически или ветеринарно приемлемого сольвата любого из них, либо фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеперечисленного. Кроме того, согласно данному изобретению предложен способ лечения или профилактики нарушения эрекции у мужских особей,сексуального расстройства у женских особей,преждевременных родов, дисменореи, доброкачественной гиперплазии предстательной железы(ВРН), синдрома инфравезикальной обструкции, недержания, стабильной, нестабильной и вариантной (Prinzmetal) стенокардии, гипертензии, легочной гипертензии, застойной сердечной недостаточности, атеросклероза, удара, заболевания периферических сосудов, состояния пониженной проходимости кровеносных сосудов, хронической астмы, бронхита, аллергической астмы, аллергического ринита, глаукомы или заболеваний, характеризующихся расстройством кишечной перистальтики, у млекопитающего (включая человека), при котором указанному млекопитающему вводят терапевтически эффективное количество соединения формулы(IА) или (IВ), либо его фармацевтически или ветеринарно-приемлемой соли, либо фармацевтически или ветеринарно-приемлемого сольвата любого из них, либо фармацевтической композиции или ветеринарного препарата, содержащих любое из вышеперечисленного. Данное изобретение также охватывает любые новые промежуточные соединения, описанные здесь, например соединения формул (IIА),(IIВ), (IVA), (IVB), (IXA) и (IХВ). Синтезы соединений по изобретению и промежуточных соединений, используемых здесь, проиллюстрированы следующими примерами и подготовительными примерами. Спектры 1H-ядерного магнитного резонанса (ЯМР) регистрировали, используя спектрометры либо Varian Unity 300, либо Varian Inova 400, и во всех случаях полученные спектры соответствуют предполагаемым структурам. Характеристические химические сдвигиданы в миллионных долях по нисходящей от тетраметилсилана с использованием общепринятых сокращений для обозначения основных пиков: например s - синглет; d - дублет; t - триплет; q квартет; m - мультиплет; b - широкий. Масс-спектры (m/z) регистрировали на масс-спектрометре Fisions Instruments Trio с использованием метода термораспылительной ионизации. Под комнатной температурой подразумевается температура 20-25 С. 18 Пример 1. Аминосульфонилирование 1/2 алкилированных 5-(2-алкоксифенил)-3-алкил 1/2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 онов. Хлорсульфоновую кислоту (30 ммоль) медленно добавляют к охлажденному во льду образцу либо N1-, либо N2-алкилированного субстрата (3 ммоль) с последующим добавлением тионилхлорида (4,5 ммоль), затем полученную смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 24 ч. Реакционную смесь охлаждают во льду и осторожно вливают в перемешиваемую смесь воды со льдом, далее осадок собирают и высушивают вакуум-отсосом, получая неочищенный сульфонилхлорид достаточной чистоты для того, чтобы использовать его непосредственно на последующей стадии N-сульфонилирования. Избыток (как правило от 2 до 5 мол. экв.) 1-замещенного пиперазина добавляют порциями к перемешиваемой смеси сульфонилхлорида и этанола. Реакционную смесь перемешивают в течение 20 ч при комнатной температуре, а затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия, далее органическую фазу отделяют и объединяют с тремя этилацетатными экстрактами водной фазы. Объединенные органические растворы высушивают (Na2SO4) и упаривают при пониженном давлении, получая неочищенный сульфонамид, который очищают колоночной хроматографией на силикагеле. В тех случаях, когда сульфонилхлорид не выпадает в осадок при прекращении реакции хлорсульфирования ледяной водой, полученный водный раствор разбавляют равным объемом этанола, охлаждают во льду и обрабатывают соответствующим пиперазиновым производным, как описано выше. Пример 2. 3-Этил-5-[5-(4-этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(пиридин 2-ил)метил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (40%) из соединения, указанного в заголовке подготовительного примера 16, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 59,06; Н, 6,19; N, 17,00. 19 Получают в виде твердого вещества белого цвета (62%) из соединения, указанного в заголовке подготовительного примера 17, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 59,51; Н, 6,42; N, 16,67.MCHP: m/z 566 (M+1)+. Пример 4. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-3-нпропил-1-(пиридин-2-ил)метил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (12%) из соединения, указанного в заголовке подготовительного примера 17, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 58,18; Н, 6,25; N, 15,81.a) Получают в виде твердого вещества белого цвета (30%) из соединения, указанного в заголовке подготовительного примера 18, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 58,92; Н, 6,34; N, 17,03.(b) Перемешиваемую смесь соединения,указанного в заголовке подготовительного примера 136 (385,1 г; 0,66 моль), и н-пропанола(1932 мл) перегоняют при пониженном давлении до тех пор, пока не будет удалена приблизительно половина объема (990 мл) нпропанола, затем охлаждают приблизительно до 37 С в атмосфере азота. Порциями через 15 мин добавляют трет-бутилат калия (222,2 г; 1,98 моль), и реакционную смесь кипятят с обратным холодильником в течение 26 ч, оставляют охладиться, обрабатывают водой (1932 мл) и фильтруют. Значение рН фильтрата доводят до 7,5, используя 1 М соляную кислоту (1840 мл),затем твердый осадок гранулируют в течение 30 мин, собирают, промывают водой и высушивают, получая указанное в заголовке соединение(275,2 г; 73,7%) в виде твердого вещества белого цвета.(ДMCOd6): 0.92 (6 Н, m), 1.19 (3H, t),1.72 (2H, m), 2.25 (2 Н, q), 2.39 (4 Н, m), 2.88 (4 Н,m), 2.96 (2 Н, q), 4.11 (2 Н, t), 5.68 (2 Н, s), 7.21(M+1)+. Пример 5 В. 3-Этил-5-[5-(4-этилпиперазин 1-илсульфонил)-2-н-пропоксифенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-она цитрат. Перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 5 А (15,0 г; 26,5 ммоль), и ацетона (150 мл) кипятят с обратным холодильником, затем фильтруют. К перемешиваемому фильтрату добавляют профильтрованный раствор лимонной кислоты (5,10 г; 26,5 ммоль) в смеси ацетона (75 мл) и воды (7,5 мл), затем реакционную смесь кипятят с обратным холодильником в течение 75 мин и оставляют охладиться. Полученную суспензию гранулируют в течение 1 ч и фильтруют, полученное таким образом твердое вещество затем промывают ацетоном (20 мл) и высушивают при 45 С, что позволяет получить указанное в заголовке соединение (18,33 г; 91%) в виде твердого вещества белого цвета, т. пл. 185 С. Обнаружено: С, 53,84; Н, 5,71; N, 12,89. С 28 Н 35N7O4S; С 6 Н 8 О 7 соответствует: С, 53,89; Н,5,72; N, 12,94.(ДМСОd6): 0.95 (6 Н, m), 1.20(2 Н, m), 7.82 (3H, m), 8.51 (1 Н, d), 11.72 (1 Н, s). Пример 6. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (53%) из соединения, указанного в заголовке подготовительного примера 20, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 58,96; Н, 6,23; N, 17,03. С 28 Н 35N7O4S соответствует: С, 59,45; Н, 6,24; N,17,33%.(CDCl3): 0.96 (3H, t), 1.16 (3H, t), 1.76(1 Н, m), 7.83 (1 Н, d), 8.58 (1 Н, d), 8.78 (1 Н, s),10.60 (1 Н, s). MCHP: m/z 566 (M+1)+. Пример 7. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-3-нпропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (30%) из соединения, указанного в заголовке подготовительного примера 20, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 57,84; Н, 6,44; N, 15,99.(1H, s). MCHP: m/z 596 (М+1)+. Пример 8. 3-Этил-5-[5-(4-метилпиперазин 1-илсульфонил)-2-н-пропоксифенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (35%) из соединения, указанного в заголовке подготовительного примера 18, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 58,24; Н, 6,06; N, 17,53.MCHP: m/z 552 (M+1)+. Пример 9. 3-Этил-5-5-[4-(2-гидроксиэтил) пиперазин-1-илсульфонил]-2-н-пропоксифенил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (30%) из соединения, указанного в заголовке подготовительного примера 18, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 56,11; Н, 6,10; N,16,15. C28H35N7O5S; H2O соответствует: С, 56,08; Н, 6,22; N, 16,35%.(CDCl3): 1.12 (3H, t), 1.30(М+1)+. Пример 10. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде пены белого цвета (32%) из соединения, указанного в заголовке подготовительного примера 19,и 1-метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,82; Н, 6,08; N, 17,19%.(2H, s), 7.08 (1H, d), 7.15 (1H, d), 7.23 (1H, m),7.64 (1H, m), 7.84 (1H, d), 8.58 (1H, d), 8.80 (1H,s), 10.62 (1H, s). MCHP: m/z 552 (M+1)+. Пример 11. 5-[2-Этокси-5-(4-этилпиперазин-1-илсульфонил)фенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (35%) из соединения, указанного в заголовке подготовительного примера 19, и 1 002057 22 этилпиперазина, используя методику из примера 1. Обнаружено: С, 58,93; Н, 6,24; N, 17,09.(1 Н, m), 7.80 (1 Н, d), 8.54 (1 Н, d), 8.76 (1 Н, s),10.58 (1 Н, s). MCHP: m/z 566 (M+1)+. Пример 12. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (42%) из соединения, указанного в заголовке подготовительного примера 20, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 59,46; Н, 6,44; N, 16,53. С 29 Н 37N7O4S; 0,35 Н 2O соответствует: С, 59,44; Н, 6,48; N, 16,73%.(CDCl3): 0.94 (3H, t), 1.03 (3H, t), 1.18 (3H, t),1.76 (2H, m), 2.04 (2 Н, m), 2.41 (2 Н, q), 2.53 (4H,m), 3.00 (2 Н, t), 3.12 (4H, m), 4.25 (2 Н, t), 5.67(2 Н, s), 7.08 (1 Н, d), 7.15 (1H, d), 7.23 (1 Н, m),7.63 (1H, m), 7.83 (1 Н, d), 8.58 (1 Н, d), 8.79 (1 Н,s), 10.60 (1 Н, s). MCHP: m/z 580 (M+1)+. Пример 13. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиридин-3-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (39%) из соединения, указанного в заголовке подготовительного примера 21, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 59,25; Н, 6,47; N, 16,73. C29H37N7O4S; 0,25 СН 2 Сl2 соответствует: С, 59,65; Н, 6,40; N,16,79%.(CDCl3): 0.92 (3H, t), 0.98 (3H, t), 1.14(1 Н, d), 7.79 (1 Н, d), 8.54 (2 Н, m), 8.74 (1 Н, s),10.58 (1 Н, s). MCHP: m/z 580 (M+1)+. Пример 14. 3-Этил-5-[5-(4-этилпиперазин 1-илсульфонил)-2-н-пропоксифенил]-2-(пиридазин-3-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3d]пиримидин-7-он. Получают в виде твердого вещества (40%) из соединения, указанного в заголовке подготовительного примера 29, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 55,73; Н, 6,07; N, 18,93. C27H34N8O4S; 0,75 Н 2O соответствует: С, 55,89; Н, 6,17; N, 19,31%.(CDCl3): 1.10 (3H, t), 1.15 (3H, t), 1.34 (3H, t),2.04 (2 Н, m), 2.40 (2 Н, q), 2.50 (4 Н, m), 3.08 (6 Н,m), 4.24 (2 Н, t), 5.88 (2 Н, s), 7.15 (1 Н, d), 7.46 23 Получают в виде твердого вещества белого цвета (32%) из соединения, указанного в заголовке подготовительного примера 30, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 57,61; H, 6,11; N, 19,10. С 28 Н 36N8O4S соответствует: С, 57,91; Н, 6,25; N,19,30%.(CDCl3): 0.92 (3H, t), 0.98 (3H, t), 1.12(1 Н, d), 7.80 (1 Н, d), 8.74 (1 Н, s), 9.12 (1 Н, d),10.62 (1 Н, s). MCHP: m/z 581 (М+1)+. Пример 16. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиридазин-4-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]-пиримидин-7-он. Получают в виде твердого вещества бледно-коричневой окраски (20%) из соединения,указанного в заголовке подготовительного примера 31, и 1-этилпиперазина, используя методику из примера 1.(CDCl3): 1.01 (6 Н, m), 1.18(1 Н, d), 8.85 (1 Н, s), 9.14 (1H, d), 9.20 (1 Н, s),10.99 (1H, s). MCHP: m/z 581 (М+1)+. Пример 17. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиримидин-4-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]-пиримидин-7-он. Получают в виде пены (58%) из соединения, указанного в заголовке подготовительного примера 32, и 1-этилпиперазина, используя методику из примера 1. Обнаружено: С, 57,31; Н,6,21; N, 18,98. С 28 Н 36N8O4S соответствует: С,57,91; Н, 6,25; N, 19,30%.(CDCl3): 0.92 (3H, t),0.97 (3H, t), 1.12 (3H, t), 1.73 (2H, m), 2.00 (2 Н,m), 2.38 (2 Н, q), 2.59 (4 Н, m), 2.92 (2 Н, t), 3.04(4 Н, m), 4.20 (2 Н, t), 5,60 (2 Н, s), 6.96 (1 Н, d),7.12 (1 Н, d), 7.80 (1 Н, d), 8.64 (1 Н, d), 8.75 (1H,s), 10.63 (1 H, s). MCHP: m/z 581 (M+1)+. Пример 18. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(пиримидин-5-ил)метил-2,6-дигидро-7 Нпиразоло[4.3-d]-пиримидин-7-он. Получают в виде пены кремовой окраски(44%) из соединения, указанного в заголовке подготовительного примера 34, и 1-этилпиперазина, используя методику из примера 1. Обнаружено: С, 57,00; Н, 6,20; N, 18,42. С 28 Н 36N8O4S; 0,15 СН 2 Сl2 соответствует: С,56,98; Н, 6,17; N, 18,88%.(CDCl3): 0.99 (6 Н,m), 1.11 (3H, t), 1.78 (2H, m), 2.00 (2 Н, m), 2.37 24 Получают в виде пены беловатой окраски(47%) из соединения, указанного в заголовке подготовительного примера 35,и 1 этилпиперазина, используя методику из примера 1.(CDCl3): 1.01 (3H, t), 1.15 (3H, t), 1.37(1H, s). MCHP: m/z 567 (M+1)+. Пример 20. 5-[5-(4-Этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2(пиразин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (37%) из соединения, указанного в заголовке подготовительного примера 36, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 56,80; Н, 6,11; N, 18,84. С 28 Н 36N8O4S; 0,80 Н 2O соответствует: С, 56,51; Н, 6,37; N, 18,83%.(CDCl3): 0.99 (6H, m), 1.10[4,3-d]пиримидин-7-он. Получают в виде твердого кристаллического вещества белого цвета (15%) из соединения, указанного в заголовке подготовительного примера 41, и 1-метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,93; Н, 5,75; N, 18,00. С 26 Н 31N7O4S соответствует: С,58,10; Н, 5,77; N, 18,25%.(CDCl3): 1.00 (3H, t),1.87 (2 Н, m), 2.30 (3H, s), 2.50 (4 Н, m), 2.98 (2 Н,m), 3.12 (4 Н, m), 4.12 (3H, s), 5.96 (2 Н, s), 7.00m/z 538 (M+1)+. Пример 22. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(3-метоксипиридин-2-ил)метил-3-н-пропил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (27%) из соединения, указанного в заголовке подготовительного примера 47, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 58,83; Н, 6,48; N, 15,76. С 30 Н 39N7 О 5S соответствует: С, 59,09; Н, 6,45; N,16,08%.(CDCl3): 1.00 (6 Н, m), 1.18 (3H, t), 1.87 25 Получают в виде твердого вещества белого цвета (44%) из соединения, указанного в заголовке подготовительного примера 50, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 58,31; Н, 6,45; N, 18,52. С 29 Н 38N8O4S соответствует: С, 58,57; Н, 6,44; N,18,84%.(CDCl3): 1.02 (6 Н, m), 1.17 (3H, t), 1.88(1 Н, d), 7.34 (1 Н, d), 7.85 (1 Н, d), 8.88 (1 Н, s),10.88 (1 Н, s). MCHP: m/z 595 (M+1)+. Пример 24. 1-(1-Метилимидазол-2-ил)метил-5-[5-(4-метилпиперазин-1-илсульфонил)-2 н-пропоксифенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (36%) из соединения, указанного в заголовке подготовительного примера 51, и 1-метилпиперазина,используя методику из примера 1.(CDCl3): 0.98 (3H, t), 1.18 (3H, t), 1.84 (2 Н, m), 2.04 (2 Н,m), 2.27 (3H, s), 2.50 (4 Н, m), 2.82 (2 Н, t), 3.10(4 Н, m), 3.76 (3H, s), 4.24 (2 Н, t), 5.90 (2 Н, s),6.84 (1 Н, s), 6.99 (1 Н, s), 7.16 (1H, d), 7.84 (1 Н,d), 8.84 (1 Н, s), 10.94 (1H, s). MCHP: m/z 569(M+1)+. Пример 25. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(1-метилимидазол-2-ил)метил-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (55%) из соединения, указанного в заголовке подготовительного примера 51, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.18 (3H, t),1.66 (1 Н, s), 1.84 (2 Н, m), 2.06 (2 Н, m), 2.55 (2 Н,t), 2.62 (4 Н, m), 2.92 (2 Н, t), 3.12 (4 Н, m), 3.58(2 Н, m), 3.77 (3H, s), 4.88 (2 Н, t), 5.90 (2 Н, s),6.85 (1 Н, s), 7.00 (1 Н, s), 7.18 (1 Н, d), 7.85 (1 Н,d), 8.80 (1 Н, s). MCHP: m/z 599 (M+1)+. Пример 26. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(1-метилимидазол-2-ил)метил-3-н-пропил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (66%) из соединения, указанного в заголовке подготовительного примера 51, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 57,48; Н, 6,60: N, 18,70. C28H38N8O4S соответствует: С, 57,71; Н, 6,57; N, 19,23%.(CDCl3): 1.00 (6 Н, m), 1.20 (3H, t), 1.84 (2H, m), 2.05 (2 Н,m), 2.40 (2 Н, q), 2.54 (4 Н, m), 2.92 (2 Н, t), 3.10 26 Получают в виде твердого вещества белого цвета (83%) из соединения, указанного в заголовке подготовительного примера 53, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,02; Н, 6,30; N, 16,28.(1H, d), 8.84 (1H, s), 10.86 (1H, s). MCHP: m/z 584 (М+1)+. Пример 28. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(3,5-диметилизоксазол-4-ил)метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде пены белого цвета (57%) из соединения, указанного в заголовке подготовительного примера 53, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 56,33; Н, 6,42; N, 15,69. С 29 Н 39N7 О 6S соответствует: С, 56,75; Н, 6,41; N,15,98%.(CDCl3): 1.01 (3H, t), 1.20 (3H, t), 1.86(2 Н, s), 7.18 (1 Н, d), 7.86 (1 Н, d), 8.85 (1 Н, s),10.88 (1 Н, s). MCHP: m/z 614 (М+1)+. Пример 29. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-3-метил-1-(3,5 диметилизоксазол-4-ил)метил-1.6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (88%) из соединения, указанного в заголовке подготовительного примера 54, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,33; Н, 5,72; N, 17,74.(1 Н, d), 8.88 (1 Н, s), 10.85 (1 Н, s). MCHP: m/z 542 (M+1)+. Пример 30. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]1-(2-метилтиазол-4-ил)метил-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (61%) из соединения, указанного в заголовке подготовительного примера 56, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 55,51; Н, 6,12; N, 16,28. C27H35N7O4S2 соответствует: С, 55,36; Н, 6,02; N, 16,74%. 27 Пример 31. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(1-метил 1,2,4-триазол-5-ил)метил-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (49%) из соединения, указанного в заголовке подготовительного примера 59, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,96; Н, 6,38; N, 21,17.(M+1)+. Пример 32. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(1-метил-1,2,4-триазол-5-ил)метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде пены белого цвета (62%) из соединения, указанного в заголовке подготовительного примера 59, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 52,96; Н, 6,40; N, 20,14.(M+1)+. Пример 33. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1(1-метил 1,2,4-триазол-5-ил)метил-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (40%) из соединения, указанного в заголовке подготовительного примера 59, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 55,31; Н, 6,60; N, 21,09.(M+1)+. Пример 34. 5-5-[4-(2-Метоксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(1-метил-1,2,4-триазол-5-ил)метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7oн. Получают в виде твердого вещества белого цвета (43%) из соединения, указанного в заголовке подготовительного примера 59, и 1-(2 метоксиэтил)пиперазина, используя методику из примера 1.(СDСl3): 1.00 (3H, t), 1.20 (3H, t),1.86 (2H, m), 2.06 (2 Н, m), 2.57 (6 Н, m), 2.92 (2 Н, 002057MCHP: m/z 614 (M+1)+. Пример 35. 1-[1-(2-Метоксиэтил)-1,2,4 триазол-5-ил]метил-5-[5-(4-метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде пены белого цвета (77%) из соединения, указанного в заголовке подготовительного примера 64, и 1-метилпиперазина,используя методику из примера 1.(CDCl3): 0.97 (3H, t), 1.16 (3H, t), 1.82 (2 Н, m), 2.00 (2 Н,m), 2.24 (3H, s), 2.46 (4 Н, m), 2.86 (2 Н, t), 3.25(2 Н, s), 7.12 (1 Н, d), 7.80 (2 Н, m), 8.82 (1 Н, s),10.86 (1 Н, s). MCHP: m/z 614 (М+1)+. Пример 36. 5-[5-(4-Этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-1[1-(2-метоксиэтил)-1,2,4-триазол-5-ил]метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде пены белого цвета (66%) из соединения, указанного в заголовке подготовительного примера 64, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 55,10; Н, 6,62; N, 19,71. С 29 Н 41N9O5S соответствует: С, 55,49; Н, 6,58; N, 20,08%.(СDСl3): 0.98 (6 Н, m), 1.15 (3H, t), 1.80 (2H, m), 2.00 (2 Н,m), 2.37 (2 Н, q), 2.50 (4 Н, m), 2.90 (2H, t), 3.08(M+1)+. Пример 37. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1(4-метил 1,2,4-триазол-3-ил)метил-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (43%) из соединения, указанного в заголовке подготовительного примера 66, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 54,46; Н, 6,31; N, 21,08. С 27 Н 37N9O4S; 0,60 Н 2 О соответствует: С, 54,54; Н, 6,47; N, 21,20%.(CDCl3): 1.00 (6H, m), 1.20m/z 584 (M+1)+. Пример 38. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]1-(4-метил 1,2,4-триазол-3-ил)метил-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (51%) из соединения, указанного в заголовке подготовительного примера 66, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 53,07; Н, 6,14; N, 20,48. С 26 Н 35N9O4S; 0,80 Н 2O; 0,10 CH2Cl2; 0,05 СН 3 ОН(M+1)+. Пример 39. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(4-метил-1,2,4-триазол-3-ил)метил-3-н-пропил 1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого вещества белого цвета (37%) из соединения, указанного в заголовке подготовительного примера 66, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 53,49; Н, 6,04; N,21,50. С 27 Н 37N9O5S; 0,10 Н 2O соответствует: С,53,91; Н, 6,23; N, 20,96%.(CDCl3): 1.00 (3H, t),1.20 (3H, t), 1.84 (2H, m), 2,06 (2H, m), 2.28 (1 Н,s), 2.56 (2H, t), 2.64 (4H, m), 2.92 (2H, t), 3.14(М+1)+. Пример 40. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]1-(1,2,4 оксадиазол-3-ил)метил-3-н-пропил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества (33%) из соединения, указанного в заголовке подготовительного примера 67, и 1-метилпиперазина,используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.18 (3H, t), 1.87 (2 Н, m), 2.04 (2 Н,m), 2.28 (3H, s), 2.50 (4 Н, m), 2.94 (2 Н, t), 3.12(4 Н, m), 4.26 (2 Н, t), 6.02 (2 Н, s), 7.17 (1 Н, d),7.85 (1 Н, d), 8.67 (1 Н, s), 8.88 (1H, s), 10.96 (1 Н,s). MCHP: m/z 557 (M+1)+. Пример 41. 1-Бензил-5-[2-этокси-5-(4 метилпиперазин-1-илсульфонил)фенил]-3-нпропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Соединение, указанное в заголовке подготовительного примера 86 (5,0 г; 8,8 ммоль), добавляют к перемешиваемому раствору третбутилата калия (1,2 г; 10 ммоль) в трет-бутаноле(75 мл), и полученную смесь кипятят с обратным холодильником в течение 20 ч, оставляют охлаждаться и упаривают при пониженном давлении. Остаток распределяют между этилацетатом(300 мл) и водой (300 мл), затем отделенную водную фазу экстрагируют этилацетатом (3150 мл). Объединенные органические растворы промывают последовательно водой (150 мл) и солевым раствором (150 мл), высушивают(МgSO4) и упаривают при пониженном давлении, получая твердое вещество белого цвета,растирание которого с эфиром с последующим высушиванием под вакуумом дает указанное в заголовке соединение (4,29 г) в виде мелких белых кристаллов. Обнаружено: С, 60,84; Н, 002057m/z 551 (M+1)+. Пример 42. 1-Бензил-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-нпропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. 60 мас.%-ную дисперсию гидрида натрия в минеральном масле (160 мг, 4 ммоль) порциями добавляют к перемешиваемому, охлажденному во льду пропан-1-олу (20 мл). После прекращения выделения пузырьков газа добавляют соединение, указанное в заголовке примера 41(550 мг, 1 ммоль), и полученную смесь кипятят с обратным холодильником в течение 96 ч, затем оставляют охлаждаться и упаривают при пониженном давлении. Остаток распределяют между этилацетатом (50 мл) и водой (50 мл),затем отделенную водную фазу экстрагируют этилацетатом (общий объем 100 мл). Объединенные органические растворы высушивают(Na2SO4) и упаривают при пониженном давлении, затем остаток очищают колоночной хроматографией на силикагеле, используя смесь этилацетат:метанол:0,880 водный аммиак (95:5:0,5) в качестве элюента и получая указанное в заголовке соединение (230 мг) в виде бесцветной пены. Обнаружено: С, 61,65; Н, 6,48; N, 14,53. С 29 Н 36N6O4S соответствует: С, 61,68; Н, 6,48; N,14,88%.(CDCl3): 0.98 (3H, t), 1.15 (3H, t), 1.83[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (75%) из соединения, указанного в заголовке подготовительного примера 87, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,99; Н, 5,94; N, 13,76. С 29 Н 35 СlN6O4S соответствует: С, 58,14; Н, 5,89;m/z 599 (М+1)+. Пример 44. 1-(4-Хлорбензил)-5-[2-этокси 5-(4-метилпиперазин-1-илсульфонил)фенил]-3 н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого кристаллического вещества белого цвета (27%) из соедине 31 ния, указанного в заголовке подготовительного примера 88, и 1-метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,43; Н, 5,67; N, 14,30. С 28 Н 33 СlN6O4S соответствует: С, 57,47; Н, 5,68; N, 14,36%.(CDCl3): 1.00 (3H,t), 1.66 (3H, t), 1.84 (2 Н, m), 2.36 (3H, s), 2.60m/z 585 (М+1)+. Пример 45. 1-(4-Хлорбензил)-5-2-этокси 5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]фенил-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого кристаллического вещества белого цвета (68%) из соединения, указанного в заголовке подготовительного примера 88, и 1-(2-гидроксиэтил)пиперазина,используя методику из примера 1. Обнаружено: С, 56,60; Н, 5,71; N, 13,47. C29H35ClN6O5S соответствует: С, 56,62; Н, 5,73; N, 13,66%.(М+1)+. Пример 46. 1-(4-Цианобензил)-5-[2-этокси 5-(4-метилпиперазин-1-илсульфонил)фенил]-3 н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин 7-он. Получают в виде порошка белого цвета(60%) из соединения, указанного в заголовке подготовительного примера 90,и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 60,42; Н, 5,79; N, 16,85.[4,3-d]пиримидин-7-он. 2 М водный раствор гидроксида натрия (5 мл) добавляют к перемешиваемому раствору соединения, указанного в заголовке примера 1(200 мг; 0,35 ммоль), в этаноле (5 мл), и смесь перемешивают при комнатной температуре в течение 3 ч, затем упаривают при пониженном давлении. Остаток растворяют в воде (10 мл) и раствор экстрагируют этилацетатом (общий объем 50 мл), затем объединенные органические экстракты высушивают (Na2SO4) и упаривают при пониженном давлении. Очистка остатка обращенно-фазовой колоночной хроматографией на полистирольной смоле (MCl-гель), используя градиентное элюирование смесью аце 002057(72 мг) в виде порошка белого цвета. Обнаружено: С, 56,67; Н, 5,79; N, 16,00. C29H35N7O5S;[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (93%) из соединения, указанного в заголовке подготовительного примера 91, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 58,17; Н, 5,88; N, 16,28. С 29 Н 35N7 О 5S соответствует: С, 58,67; Н, 5,94; N,16,51%.(ДМСOd6): 0.94 (3H, t), 1.35 (3H, t),1.76 (2H, m), 2.15 (3H, s), 2.37 (4H, m), 2.80 (2H,t), 2.92 (4H, m), 4.21 (2H, q), 5.79 (2H, s), 7.30(3H, m), 7.39 (1H, d), 7.84 (5 Н, m), 12.29 (1H, s). МСНР: m/z 594 (M+1)+. Пример 49. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-(2-нитробензил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде порошка белого цвета(88%) из соединения, указанного в заголовке подготовительного примера 93,и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 56,37; Н, 6,14; N, 14,03. С 28 Н 33N7O6S; СН 3 СO2 СН(СН 3)2 соответствует: С, 56,80; Н, 6,21; N, 14,05%.(CDCl3): 1.00 (3H,t), 1.60 (3H, t), 1.88 (2H, m), 2.28 (3H, s), 2.52(1H, s). MCHP: m/z 596 (M+1)+. Пример 50. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(2-нитробензил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого кристаллического вещества белого цвета (76%) из соединения, указанного в заголовке подготовительного примера 94, и 1-(2-гидроксиэтил)пиперазина,используя методику из примера 1. Обнаружено: С, 56,15; Н, 5,83: N, 15,06. С 30 Н 37N7 О 7S соответствует: С, 56,33; Н, 5,83; N, 15,33%.(CDCl3): 1.04 (3H, t), 1.17 (3H, t), 1.90 (2H, m), 2.04 (2H,m), 2.30 (1 Н, t), 2.57 (2H, t), 2.62 (4H, m), 2.98(1H, s). MCHP: m/z 640 (М+1)+. Пример 51. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-(4-нитробен 33 зил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества беловатой окраски (64%) из соединения, указанного в заголовке подготовительного примера 95, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 56,10; Н, 5,55, N, 16,01.(240 мг; 0,4 ммоль), в метаноле (40 мл), и смесь гидрируют при 345 кПа (50 фунт/кв. дюйм.) и 50 С в течение 20 ч, затем оставляют охлаждаться и фильтруют. Фильтр промывают метанолом (50 мл) и объединенные метанольные растворы упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан: метанол (95:5) в качестве элюента, с последующей кристаллизацией из этилацетата, что позволяет получить указанное в заголовке соединение(190 мг) в виде порошка белого цвета. Обнаружено: С, 58,98; Н, 6,20; N, 17,25. C28H35N7O4S соответствует: С, 59,45; Н, 6,24; N, 17,33%.(2 Н, m), 7.12 (2H, m), 7.58 (1 Н, d), 7.82 (1 Н, а),8.80 (1 Н, s), 10.85 (1 Н, s). Пример 53. 1-(2-Аминобензил)-5-5-[4-(2 гидроксиэтил)пиперазин-1-илсульфонил]-2-нпропоксифенил-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого кристаллического вещества белого цвета (54%) из соединения, указанного в заголовке примера 50, используя методику из примера 52 за исключением того, что в качестве элюента в хроматографии используют смесь этилацетат: метанол (95:5) и в качестве растворителя при кристаллизации используют этанол.(CDCl3): 1.01 (3H, t), 1.20 34 Получают в виде твердого вещества белого цвета (88%) из соединения, указанного в заголовке примера 51, используя методику из примера 52. Обнаружено: С, 59,38; Н, 6,28; N, 17,00. С 28 Н 35N7O4S соответствует: С, 59,45; Н, 6,24; N,17,33%.(CDCl3): 1.00 (3H, t), 1.65 (3H, t), 1.87(1 Н, d), 8.82 (1 Н, s), 10.83 (1 Н, s). МСНР: m/z 566 (M+1)+. Пример 55. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-(2-метансульфонамидобензил)-3-н-пропил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Метансульфонилхлорид (31 мкл; 0,40 ммоль) добавляют к перемешиваемому, охлажденному во льду раствору соединения, указанного в заголовке примера 52 (150 мг; 0,27 ммоль), в пиридине (3 мл), и смесь перемешивают при комнатной температуре в течение 2 ч,затем упаривают при пониженном давлении. Остаток обрабатывают водой (10 мл), и полученную суспензию экстрагируют дихлорметаном (общий объем 40 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пониженном давлении, получая масло оранжевого цвета, которое очищают хроматографией на силикагеле, используя смесь этилацетат: метанол: 0,880 водный аммиак (94:5:1) в качестве элюента и получая указанное в заголовке соединение (62 мг) в виде пены белого цвета. Обнаружено: С, 54,03; Н, 5,87; N, 14,70. C29H37N7O6S2 соответствует: С, 54,10; Н, 5,79; N, 15,23%.m/z 644 (М+1)+. Пример 56. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(2-метансульфонамидобензил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. 1M раствор фторида тетра-н-бутиламмония в тетрагидрофуране (0,27 мл; 0,27 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 98 (145 мг; 0,18 ммоль), в тетрагидрофуране (3 мл). Через последующие 20 ч при комнатной температуре добавляют воду (5 мл), и полученную смесь экстрагируют этилацетатом (общий объем 20 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пониженном давлении, получая масло желтого цвета, которое очищают колоночной хроматографией на силикагеле, используя смесь этилацетат:метанол:0,880 водный аммиак (94:5:1) в качестве элюента, с последующей кристаллизацией из этилацетата, что позволяет получить указанное в заголовке соединение (83 мг) в виде 35 твердого вещества белого цвета. Обнаружено: С, 53,89; Н, 6,00; N, 14,09. C31H41N7O7S2 соответствует: С, 54,13; Н, 6,01; N, 14,25%.(2H, t), 5.79 (2H, s), 7.18 (2H, m), 7.36 (1 Н, m),7.60 (1 Н, d), 7.70 (1 H, d), 7.84 (1H, d), 8.82 (1H,s), 9.68 (1H, s), 10.99 (1H, s). Пример 57. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-1-(4-метансульфонамидобензил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (64%) из соединения, указанного в заголовке примера 54, используя методику из примера 55. Обнаружено: С, 51,10; Н, 6,01; N, 13,85. С 29 Н 37N7O6S2; 2H2O соответствует: С, 51,23; Н,6,08; N, 14,42%.(CDCl3): 1.00 (3H, t), 1.62 (3H,t), 1.86 (2H, m), 2.28 (3H, s), 2.50 (4 Н, m), 2.94[4,3-d]пиримидин-7-он. Получают в виде мелкозернистого твердого вещества белого цвета (39%) из соединения,указанного в заголовке подготовительного примера 99, и 1-метилпиперазина, используя методику из примера 1. Обнаружено: С, 51,72; Н,5,42; N, 14,85. С 28 Н 35N7O6S2; Н 2O соответствует: С, 51,92; Н, 5,76; N, 15,14%.(CDCl3): 1.00 (3H,t), 1.64 (3H, t), 2.28 (3H, m), 2.50 (4H, m), 2.95(2H, t), 3.10 (4H, m), 4.37 (2H, q), 4.75 (2H, s),5.80 (2H, s), 7.16 (2H, d), 7.52 (2H, d), 7.84 (3H,m), 8.84 (1H, s), 10.90 (1 Н, s). Пример 59. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-3-метил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества рыжевато-коричневой окраски (57%) из соединения,указанного в заголовке подготовительного примера 42, и 1-метилпиперазина, используя методику из примера 1.(ДМСОd6): 1.30 (3H, t), 2.20(1 Н, d), 11.58 (1H, s). MCHP: m/z 542 (M+18)+. Пример 60. 5-2-Этокси-5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]фенил-3-метил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены рыжеватокоричневой окраски (47%) из соединения, указанного в заголовке подготовительного примера 42, и 1-(2-гидроксиэтил)пиперазина, используя методику из примера 1.(CDCl3): 1.52 (3H, t),2.50 (3H, s), 2.55 (2 Н, t), 2.76 (4 Н, m), 3.24 (4 Н, 002057[4,3-d]пиримидин-7-он. Получают в виде бесцветного масла (19%) из соединения, указанного в заголовке подготовительного примера 43, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 56,44; Н, 5,76; N, 17,86. С 26 Н 31N7O4S; Н 2O соответствует: С, 56,16; Н, 5,94; N, 17,64%.(1H, m), 7.86 (1 Н, d), 8.58 (1 Н, d), 8.78 (1 Н, s),10.52 (1H, s). MCHP: m/z 538 (М+1)+. Пример 62. 3-Этил-5-[5-(пиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(пиридин 2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде твердого вещества белого цвета (33%) из соединения, указанного в заголовке подготовительного примера 18, и пиперазина, используя методику из примера 1. Обнаружено: С, 57,40; Н, 5,81; N, 17,91. С 26 Н 31N7O4S; 0,50 H2O соответствует: С, 57,13; Н, 5,90; N,17,94%.(CDCl3): 1.14 (3H, t), 1.30 (3H, t), 2.01(1H, s), 10.60 (1H, s). MCHP: m/z 538 (М+1)+. Пример 63. 5-[5-(Пиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-она трифторацетат. Трифторуксусную кислоту (4 мл) добавляют к перемешиваемому раствору соединения,указанного в заголовке подготовительного примера 44 (388 мг; 0,6 ммоль), в дихлорметане (4 мл), и смесь перемешивают в течение 18 ч при комнатной температуре, затем упаривают при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле, используя смесь дихлорметан: метанол: 0,880 водный аммиак (97:3:1) в качестве элюента, что позволяет получить указанное в заголовке соединение (65%) в виде твердого вещества. Обнаружено: С, 51,93; Н, 5,14; N, 14,42. С 27 Н 33N7O4S; CF3CO2H соответствует: С, 52,32; Н, 5,14; N, 14,73%.(ДМСОd6): 0.86 (3H, t), 1.14 37 Получают в виде пены кремовой окраски(58%) из соединения, указанного в заголовке подготовительного примера 20, и 1-(2 метоксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 58,45; Н, 6,45; N,16,08. C30H39N7O5S; 0,35 H2O соответствует: С,58,49; Н, 6,50; N, 15,92%.(CDCl3): 0.96 (3H, t),1.19 (3H, t), 1.76 (2H, m), 2.04 (2H, m), 2.59 (6 Н,m), 2.98 (2 Н, m), 3.12 (4 Н, m), 3.30 (3H, s), 3.42m/z 610 (M+1)+. Пример 65. 5-[5-(4-Карбамоилметилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-нпропил-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он. Получают в виде пены бледно-желтой окраски (16%) из соединения, указанного в заголовке подготовительного примера 20, и 1 карбамоилметилпиперазина (Indian J. Chem.,1984, 23 В, 650), используя методику из примера 1.(CDCl3): 0.95 (3H, t), 1.17 (3H, t), 1.73 (2 Н,m), 2.05 (2 Н, m), 2.64 (4 Н, m), 3.00 (2 Н, t), 3.02(1H, s), 10.62 (1H, s). MCHP: m/z 609 (М+1)+. Пример 66. 2-(3-Метоксипиридин-2-ил) метил-5-[5-(4-метилпиперазин-1 илсульфонил)2-н-пропоксифенил]-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (82%) из соединения, указанного в заголовке подготовительного примера 48, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 57,60; H, 6,23; N, 15,92.(1 Н, s). MCHP: m/z 595 (M)+. Пример 67. 5-[5-(4-Этилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-2-(3-метоксипиридин-2-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (85%) из соединения, указанного в заголовке подготовительного примера 48, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 58,19; H, 6,49; N, 15,62. 38 Пример 68. 2-(6-Аминопиридин-2-ил) метил-5-[5-(4-этилпиперазин-1-илсульфонил)-2 н-пропоксифенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (30%) из соединения, указанного в заголовке подготовительного примера 49, используя методику из примера 1. Обнаружено: С, 58,20; Н, 6,61; N, 17,77. C29H38N8O4S; 0,60 СН 3 ОН соответствует: С, 57,91; Н, 6,63; N, 18,25%.(2 Н, s), 6.30 (1 Н, d), 7.15 (1 Н, d), 7.35 (1 Н, m),7.83 (1H, d), 7.79 (1H, s), 8.50 (1H, s), 10.58 (1H,s). MCHP: m/z 595 (М+1)+. Пример 69. 2-(1-Метилимидазол-2-ил) метил-5-[5-(4-метилпиперазин-1-илсульфонил)2-н-пропоксифенил]-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (52%) из соединения, указанного в заголовке подготовительного примера 52, и 1-метилпиперазина,используя методику из примера 1.(CDCl3): 0.96 (3H, t), 1.14 (3H, t), 1.75 (2 Н, m), 2.02 (2 Н,m), 2.26 (3H, s), 2.50 (4 Н, m), 3.10 (6 Н, m), 3.75(1H, s), 7.14 (1H, d), 7.82 (1H, d), 8.76 (1H, s),10.60 (1 Н, s). MCHP: m/z 569 (M+1)+. Пример 70. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-метилимидазол-2-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (70%) из соединения, указанного в заголовке подготовительного примера 52, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 56,67; Н, 6,65; N, 18,54. С 28 Н 38N8O4S; 0,60 Н 2O соответствует: С, 56,66; Н, 6,66; N, 18,88%.(CDCl3): 1.00 (6H, m), 1.16m/z 583 (M+1)+. Пример 71. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-2(1-метилимидазол-2-ил)метил-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (31%) из соединения, указанного в заголовке подготовительного примера 52, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1.(CDCl3): 0.98 (3H, t), 1.14 (3H, t),2.74 (2H, m), 2.04 (2H, m), 2.32 (1H, s), 2.54 (2H,t), 2.60 (4H, m), 3.12 (6H, m), 3.56 (2H, m), 3.76(1-метилимидазол-2-ил)метил-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]-пиримидин-7-он. Получают в виде твердого вещества белого цвета (17%) из соединения, указанного в заголовке подготовительного примера 51, и 1 карбамоилметилпиперазина (Indian J. Chem.,1984, 23 В, 650), используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.18 (3H, t), 1.86 (2H,m), 2.00 (2H, m), 2.68 (4H, m), 2.92 (2H, t), 3.04(2H, s), 3.14 (4H, m), 3.78 (3H, s), 4.28 (2H, t),5.37 (1H, s), 5.90 (2H, s), 6.66 (1H, s), 6.86 (1H, s),7.00 (1H, s), 7.18 (1H, d), 7.87 (1H, d), 8.84 (1H,s), 10.90 (1H, s). MCHP: m/z 612 (M+1)+. Пример 73. 2-(3,5-Диметилизоксазол-4 ил)метил-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (34%) из соединения, указанного в заголовке подготовительного примера 55, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 57,19; Н, 6,37; N, 16,19. С 28H37N7O5S; 0,35 Н 2O соответствует: С, 56,82; Н, 6,42; N, 16,66%.(CDCl3): 0.98 (3H, t), 1.14 (3H, t), 1.78 (2H, m),2.02 (2 Н, m), 2.16 (3H, s), 2.24 (3H, s), 2.35 (3H,s), 2.46 (4 Н, m), 2.90 (2 Н, t), 3.57 (4 Н, m), 4.23(М+1)+. Пример 74. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-2(3,5-диметилизоксазол-4-ил)метил-3-н-пропил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7oн. Получают в виде твердого вещества белого цвета (31%) из соединения, указанного в заголовке подготовительного примера 55, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 55,98; Н, 6,44; N,15,50. C29H39N7O6S соответствует: С, 56,75; Н,6,41; N, 15,98%.(CDCl3): 1.00 (3H, t), 1.15 (3H,t), 1.78 (2 Н, m), 2.04 (2 Н, m), 2.18 (3H, s), 2.32[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (80%) из соединения, указанного в заголовке подготовительного примера 57, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 52,52; Н, 5,40; N, 17,54. 40 Пример 76. 5-[5-(4-Метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]2-(2-метилтиазол-4-ил)метил-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (43%) из соединения, указанного в заголовке подготовительного примера 58, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 55,42; Н, 6,13; N, 16,24. С 27 Н 35N7O4S2 соответствует: С, 55,36; Н, 6,02; N, 16,74%.(М+1)+. Пример 77. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-метил 1,2,4-триазол-5-ил)метил-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (44%) из соединения, указанного в заголовке подготовительного примера 60, и 1 метилпиперазина, используя методику из примера 1.(СDСl3): 1.00 (3H, t), 1.16 (3H, t), 1.82(1 Н, s). MCHP: m/z 570 (M+1)+. Пример 78. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-метил 1,2,4-триазол-5-ил)метил-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (83%) из соединения, указанного в заголовке подготовительного примера 60, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 54,76; Н, 6,36; N, 21,05. С 27 Н 37N9O4S; 0,50 H2O соответствует: С, 54,71; Н, 6,46; N, 21,27%.(CDCl3): 1.00 (6H, m), 1.15(1H, s), 8.74 (1H, s), 10.62 (1H, s). MCHP: m/z 584 (М+1)+. Пример 79. 5-5-[4-(2-Метоксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-2(1-метил-1,2,4-триазол-5-ил)метил-3-н-пропил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого вещества белого цвета (89%) из соединения, указанного в заголовке подготовительного примера 60, и 1-(2 метоксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 54,36; Н, 6,38; N,20,15. С 28 Н 39N9O5S соответствует: С, 54,80; Н,6,41; N, 20,54%.(СDСl3): 1.00 (3H, t), 1.17 (3H,t), 1.80 (2H, m), 2.04 (2 Н, m), 2.58 (6 Н, m), 3.10(M+1)+. Пример 80. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-[1-(2 метоксиэтил)-1,2,4-триазол-5-ил]метил-3-нпропил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде пены белого цвета (68%) из соединения, указанного в заголовке подготовительного примера 65, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 54,96; Н, 6,59; N, 19,67. C29H41N9O5S соответствует: С, 55,49; Н, 6,58; N, 20,08.(CDCl3): 1.00 (6 Н, m), 1.14 (3H, t), 1.80 (2H, m), 1.98 (2H,m), 2.37 (2 Н, q), 2.50 (4 Н, m), 3.05 (6 Н, m), 3.26(2 Н, s), 7.10 (1 Н, d), 7.80 (2 Н, m), 8.73 (1 Н, s),10.54 (1 Н, s). MCHP: m/z 628 (M+1)+. Пример 81. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(3-метил 1,2,4-триазол-5-ил)метил-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (49%) из соединения, указанного в заголовке подготовительного примера 72, и 1 метилпиперазина, используя методику из примера 1.(CDCl3): 1.02 (3H, t), 1.15 (3H, t), 1.86m/z 570 (M+1)+. Пример 82. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-2-(5-метил-1,2,4 оксадиазол-3-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (47%) из соединения, указанного в заголовке подготовительного примера 79, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 52,44; Н, 5,63; N, 19,48. С 25 Н 32N8O5S; Н 2 О соответствует: С, 52,25; Н,5,96; N, 19,50%.(ДМСОd6): 0.93 (3H, t), 1.34(1H, s), 11.80 (1H, s). MCHP: m/z 557 (М+1)+. Пример 83. 5-2-Этокси-5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]фенил-2-(5 метил-1,2,4-оксадиазол-3-ил)метил-3-н-пропил 2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7 он. Получают в виде твердого вещества (56%) из соединения, указанного в заголовке подготовительного примера 79, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 53,15; Н, 6,14; N, 17,98. С 26 Н 34N8O6S соответствует: С, 53,23; Н, 5,84; N,19,10%.(CDCl3): 1.03 (3H, t), 1.63 (3H, t), 1.88(1H, s). MCHP: m/z 587 (M+1)+. Пример 84. 2-(5-Метил-1,2,4-оксадиазол-3 ил)метил-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (91%) из соединения, указанного в заголовке подготовительного примера 76, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,43; Н, 6,06; N, 19.46.MCHP: m/z 571 (М+1)+. Пример 85. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(5-метил 1,2,4-оксидиазол-3-ил)метил-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (70%) из соединения, указанного в заголовке подготовительного примера 76, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 54,85; Н, 6,16; N, 18,69.(1 Н, d), 8.72 (1 Н, s), 10.53 (1 Н, s). MCHP: m/z 584 (M)+. Пример 86. 5-5-[4-(2-Гидроксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-2(5-метил-1,2,4-оксидиазол-3-ил)метил-3-нпропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (86%) из соединения, указанного в заголовке подготовительного примера 76, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: C, 53,22; Н, 6,00; N,18,06. 43 смеси ацетонитрила (1,5 мл) и диметилсульфоксида (1,5 мл), и полученную смесь кипятят с обратным холодильником в течение 20 ч, затем упаривают при пониженном давлении. Остаток суспендируют в солевом растворе (10 мл) и суспензию экстрагируют этилацетатом (общий объем 30 мл). Объединенные экстракты высушивают (Na2SO4) и упаривают при пониженном давлении, затем остаток очищают колоночной хроматографией на силикагеле, используя смесь этилацетат:метанол:0,880 водный аммиак(94:5:1) в качестве элюента, что позволяет получить указанное в заголовке соединение (84 мг) в виде бесцветной смолы.(CDCl3): 0.95 (3H, t),1.62 (3H, t), 1.74 (2 Н, m), 2.30 (3H, s), 2.57 (4 Н,m), 2.90 (2 Н, t), 3.16 (4 Н, m), 4.39 (2 Н, q), 5.58(2 Н, s), 7.10-7.36 (6 Н, m), 7.82 (1 Н, d), 8.78 (1 Н,s), 10.60 (1 Н, s). MCHP: m/z 551 (М+1)+. Пример 88. 2-(4-Бромбензил)-5-[2-этокси 5-(4-метилпиперазин-1-илсульфонил)фенил]-3 н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (57%) из соединения, указанного в заголовке подготовительного примера 89, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 52,80; Н, 5,38; N, 12,83. С 28 Н 33 ВrN6O4S; 0,50(1 Н, d), 7.44 (2H, d), 7.80 (1H, d), 8.76 (1H, s),10.62 (1H, s). Пример 89. 2-(4-Бромбензил)-5-2-этокси 5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]фенил-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (66%) из соединения, указанного в заголовке подготовительного примера 89, и 1-(2-гидроксиэтил) пиперазина, используя методику из примера 1. Обнаружено: С, 52,13; Н, 5,37; N, 12,42. С 29 Н 35 ВrN6 О 5S; 0,50 Н 2O соответствует: С,52,05; Н, 5,43; N, 12,57%.(CDCl3): 0.97 (3H, t),1.63 (3H, t), 1.76 (2H, m), 2.68 (3H, m), 2.78 (4H,m), 2.86 (2H, t), 3.20 (4H, m), 3.66 (2H, m), 4.39[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (28%) из соединения, указанного в заголовке подготовительного примера 92, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 55,76; Н, 6,04; N, 15,56. C29H35N7O5S; 0,50(1 H, s). MCHP: m/z 594 (М+1)+. Пример 91. 5-[2-Этокси-5-(4-метилпиперазин-1-илсульфонил)фенил]-2-(4-нитробензил)-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d] пиримидин-7-он. Получают в виде пены желтого цвета(82%) из соединения, указанного в заголовке подготовительного примера 96, и 1-метилпиперазина, используя методику из примера 1. Обнаружено: С, 55,96; Н, 5,54; N, 16,27. С 28 Н 33N7O6S соответствует: С, 56,46; Н, 5,58; N,16,46%.(CDCl3): 0.94 (3H, t), 1.65 (3H; t), 1.74(1 Н, s), 10.68 (1H, s). MCHP: m/z 596 (M+1)+. Пример 92. 5-2-Этокси-5-[4-(2-гидроксиэтил)пиперазин-1-илсульфонил]фенил-2-(4 нитробензил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде масла желтого цвета(90%) из соединения, указанного в заголовке подготовительного примера 96, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 54,83; Н, 5,61; N,15,46. C29H35N7O7S; 0,50 Н 2 О соответствует: С,54,88; Н, 5,72; N, 15,45%.(CDCl3): 0.96 (3H, t),1.62 (3H, t), 1.74 (2H, m), 2.30 (1H, s), 2.55 (2H,t), 2.60 (4H, m), 2.90 (2H, t), 3.10 (4H, m), 3.58[4,3-d]пиримидин-7-он. Получают в виде бесцветной пены (77%) из соединения, указанного в заголовке примера 91, используя методику из примера 52. Обнаружено: С, 58,51; Н, 6,18; N, 16,76. C28H35N7O4S; 0,50 H2O соответствует: С, 58,52; Н, 6,31; N,17,06%.(CDCl3): 0.83 (3H, t), 1.64 (3H, t), 1.72(1 Н, d), 8.76 (1 Н, s), 10.58 (1 Н, s) млн-1. Пример 94. 1-(N-Этилкарбамоилметил)-5[5-(4-метилпиперазин-1-илсульфонил)-2-нпропоксифенил]-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества коричневой окраски (40%) из соединения, указанного в заголовке подготовительного примера 102, и 1-метилпиперазина, используя методику из примера 1.(CDCl3): 1.01 (3H, t), 1.08 (3H, t),1.18 (3H, t), 1.89 (2 Н, m), 2.04 (2 Н, m), 2.28 (3H,s), 2.49 (4 Н, m), 2.97 (2H, t), 3.10 (4H, m), 3.29 7,18 (1H, d), 7.86 (1H, d), 8.87 (1H, s), 10.95 (1H,s). MCHP: m/z 560 (M+1)+. Пример 95. 1-[N-(2-Метоксиэтил)карбамоилметил]-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (63%) из соединения, указанного в заголовке подготовительного примера 103, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 54,60; Н, 6,87; N, 16,02. С 27 Н 39N7O6S соответствует: С, 54,98; Н, 6,67; N, 16,03%.(CDCl3): 1.05 (3H, t), 1.20 (3H, t), 1.89 (2H, m), 2.04 (2H,m), 2.29 (3H, s), 2.50 (4H, m), 2.98 (2H, t), 3.10(М+1)+. Пример 96. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(морфолин-4-илкарбонилметил)-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества бежевой окраски (59%) из соединения, указанного в заголовке подготовительного примера 104, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,25; Н, 6,50; N, 14,72. С 28 Н 39N7O6S; H2O соответствует: С, 54,27; Н,6,67; N, 15,82%.(CDCl3): 1.02 (3H, t), 1.19 (3H,t), 1.88 (2 Н, m), 2.02 (2 Н, m), 2.27 (3H, s), 2.50(1 Н, s). МСНР: m/z 602 (M+1)+. Пример 97. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]1-[1S-(морфолин-4-илкарбонил)этил]-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (61%) из соединения, указанного в заголовке подготовительного примера 109, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 55,16; Н, 6,58; N, 15,39.(4 Н, m), 3.48 (2 Н, m), 3.64 (6 Н. m), 4.27 (2 Н, t),6.16 (1 Н, q), 7.18 (1H,d), 7.84 (1 Н, d), 8.86 (1 Н,s), 10.91 (1 Н, s). MCHP: m/z 616 (M+1)+. Пример 98. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-[1R-(морфолин-4-илкарбонил)этил]-3-н-пропил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(54%) из соединения, указанного в заголовке подготовительного примера 112,и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 56,26; Н, 6,91; N, 15,20.MCHP: m/z 616 (М+1)+. Пример 99. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(2-морфолин-4-илэтил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (41%) из соединения, указанного в заголовке подготовительного примера 114, и 1 метилпиперазина, используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.20 (3H, t), 1.86(2 Н, m), 2.06 (2 Н, m), 2.28 (3H, s), 2.50 (8 Н, m),2.92 (4 Н, m), 3.10 (4 Н, m), 3.60 (4 Н, m), 4.24 (2 Н,t), 4.68 (2 Н, t), 7.17 (1 Н, d), 7.82 (1H,d), 8.88 (1 Н,s), 10.84 (1 Н, s). MCHP: m/z 589 (M+1)+. Пример 100. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-1-(2-морфолин-4-илэтил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества (36%) из соединения, указанного в заголовке подготовительного примера 114, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 57,44; Н, 7,22; N, 15,86. C29H43N7O5S соответствует: С, 57,88; Н, 7,20; N, 16,29%.(CDCl3): 1.00 (6H, m), 1.18 (3H, t), 1.86 (2H, m), 2.04 (2H,m), 2.40 (2H, q), 2.52 (8H, m), 2.86 (2H, t), 2.90(2H, t), 3.10 (4H, m), 3.60 (4H, m), 4.24 (2H, t),4.70 (2H, t), 7.16 (1H, d), 7.84 (1 Н, d), 8.86 (1 Н,s), 10.84 (1H, s). MCHP: m/z 603 (M+1)+. Пример 101. 5-5-[4-(2-Метоксиэтил)пиперазин-1-илсульфонил]-2-н-пропоксифенил-1(2-морфолин-4-илэтил)-3-н-пропил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде твердого вещества белого цвета (35%) из соединения, указанного в заголовке подготовительного примера 114, и 1-(2 метоксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 56,41; Н, 7,11; N,15,07. C30H45N7O6S; 0,30 Н 2O соответствует: С,56,55; Н, 7,21; N, 15,39%,(CDCl3): 1.00 (3H, t),1.20 (3H, t), 1.86 (2H, m), 2.06 (2H, m), 2.50 (4H,m), 2.58 (4H, m), 2.86 (2H, t), 2.94 (2H, t), 3.10(M+1)+. Пример 102. 2-(N-Этилкарбамоилметил)-5[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(61%) из соединения, указанного в заголовке подготовительного примера 105,и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,59; Н, 6,62; N, 16,32.(1H, s), 7.17 (1H, d), 7.86 (1H, d), 8.82 (1H, s),10.72 (1H, s). MCHP: m/z 560 (M+1)+. Пример 103. 2-[N-(2-Метоксиэтил)карбамоилметил]-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены кремовой окраски(54%) из соединения, указанного в заголовке подготовительного примера 106,и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,67; Н, 6,69; N, 15,89. С 27 Н 39N7O6S соответствует: С, 54,98; Н, 6,67; N,16,03%.(CDCl3): 1.01 (3H, t), 1.17 (3H, t), 1.85MCHP: m/z 590 (M+1)+. Пример 104. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(морфолин-4-илкарбонилметил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде пены белого цвета (52%) из соединения, указанного в заголовке подготовительного примера 107, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 54,74; Н, 6,46; N, 15,72. С 28 Н 39N7O6S; 0,20(1H, d), 8.81 (1H, s), 10.58 (1 Н, s). MCHP: m/z 602 (M+1)+. Пример 105. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-[1S-(морфолин-4-илкарбонил)этил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (52%) из соединения, указанного в заголовке подготовительного примера 110, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 54,57; Н, 6,52; N, 15,15. C29H41N7O6S; 0,36(1H, q), 7.16 (1H, d), 7.83 (1H, d), 8.79 (1H, s),10.64 (1H, s). MCHP: m/z 616 (M+1)+. Пример 106. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-[1R(морфолин-4-илкарбонил)этил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Получают в виде пены желтого цвета(54%) из соединения, указанного в заголовке подготовительного примера 113,и 1 метилпиперазина, используя методику из при 002057(М+1)+. Пример 107. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(2-морфолин-4-илэтил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (52%) из соединения, указанного в заголовке подготовительного примера 115, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 56,44; Н, 7,16; N, 16,07.(1 Н, d), 8.80 (1 Н, s), 10.56 (1 Н, s). MCHP: m/z 589 (М+1)+. Пример 108. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(2-морфин-4-илэтил)-3-н-пропил-2,6-дигидро-7 Нпиразоло[4,3-d]пиpимидин-7-oн. Получают в виде масла желтого цвета(24%) из соединения, указанного в заголовке подготовительного примера 115,и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 57,04; Н, 7,28; N, 15,46.(1H, d), 8.80 (1H, s), 10.56 (1H, s). MCHP: m/z 603 (M+1)+. Пример 109. 5-5-[4-(2-Гидроксиэтил) пиперазин-1-илсульфонил]-2-н-пропоксифенил-2-(2-морфолин-4-илэтил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (36%) из соединения, указанного в заголовке подготовительного примера 115, и 1-(2 гидроксиэтил)пиперазина, используя методику из примера 1. Обнаружено: С, 56,05; Н, 7,02; N,15,31. C29H43N7O6S соответствует: С, 56,38; Н,7,02; N, 15,87%.(CDCl3): 1.04 (3H, t), 1.14 (3H,t), 1.88 (2H, m), 2.04 (2H, m), 2.30 (1H, s), 2.48 49 Получают в виде пены белого цвета (43%) из соединения, указанного в заголовке подготовительного примера 116, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 56,20; Н, 7,43; N, 17,78. C29H44N8O4S; 0,20(1H, d), 8.80 (1H, s), 10.55 (1H, s). MCHP: m/z 602 (M+1)+. Пример 111. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-(2-пиразол-1-илэтил)-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (45%) из соединения, указанного в заголовке подготовительного примера 118, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 57,62; Н, 6,59; N, 19,05. С 28H38N8O4S соответствует: С, 57,71; Н, 6,57; N, 19,23%.(CDCl3): 0.82 (3H, t), 0.98 (3H, t), 1.11 (3H, t), 1.44 (2 Н,m), 1.98 (2H, m), 2.38 (2 Н, m), 2.44 (2 Н, m), 2.48(4 Н, m), 3.00 (4 Н, m), 4.20 (2 Н, t), 4.64 (2 Н, t),4.76 (2 Н, t), 6.02 (1 Н, s), 6.86 (1 Н, s), 7.08 (1 Н, d),7.54 (1 Н, s), 7.79 (1 Н, m), 8.70 (1 Н, s), 10.69 (1H,s). MCHP: m/z 583 (M+1)+. Пример 112. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-[2-(1,2,3-триазол-1-ил)этил]-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (57%) из соединения, указанного в заголовке подготовительного примера 120, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 55,13; Н, 6,44; N, 21,41. C27H37N9O4S соответствует: С, 55,56; Н, 6,39; N, 21,60%.(CDCl3): 0.82 (3H, t), 0.96 (3H, t), 1.14 (3H, t), 1.51 (2 Н,m), 2.00 (2 Н, m), 2.38 (2 Н, m), 2.50 (4 Н, m), 2.58(M+1)+. Пример 113. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-[2-(1,2,4-триазол-1-ил)этил]-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (33%) из соединения, указанного в заголовке подготовительного примера 122, и 1 метилпиперазина, используя методику из примера 1. Обнаружено: С, 54,58; Н, 6,24; N, 21,57. С 26 Н 35N9O4S соответствует: С, 54,82; Н, 6,19; N,22,13%.(CDCl3): 0.86 (3H, t), 1.13 (3H, t), 1.55 50 Пример 114. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-[2-(1,2,4-триазол-1-ил)этил]-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (37%) из соединения, указанного в заголовке подготовительного примера 122, и 1 этилпиперазина, используя методику из примера 1. Обнаружено: С, 55,14; Н, 6,37; N, 21,14.[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(36%) из соединения, указанного в заголовке подготовительного примера 123,и 1 этилпиперазина, используя методику из примера 1.(CDCl3): 0.90 (3H, t), 0.99 (3H, m), 1.11[4,3-d]пиримидин-7-он. Перемешиваемую смесь соединения, указанного в заголовке примера 115 (622 мг; 1,02 ммоль), 10%-ного палладия на угле (100 мг),этанола (10 мл) и этилацетата (30 мл) гидрируют при 345 кПа (50 ф/кв дюйм) и 50 С в течение 3 ч и затем при комнатной температуре в течение 18 ч. Полученную смесь фильтруют, затем фильтрат объединяют с этилацетатной промывкой фильтра и упаривают при пониженном давлении, что позволяет получить указанное в заголовке соединение (100%) в виде порошка белого цвета.(СDСl3): 0.87 (3H, t), 0.98 (3H, m),1.12 (3H, t), 1.70 (2 Н, m), 2.01 (2 Н, q), 2.38 (2 Н,m), 2.48 (4 Н, m), 2.90 (2 Н, t), 3.08 (4 Н, m), 3.92(2 Н, s), 4.23 (2 Н, t), 6.86 (2 Н, d), 7.13 (2 Н, d),7.27 (1 Н, d), 7.81 (1 Н, d), 8.80 (1 Н. s), 10.62 (1 Н,s). MCHP: m/z 580 (M+1)+. Пример 117. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(2 метансульфонамидофенил)-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиpимидин-7-oн. Метансульфонилхлорид (0,156 мл; 2,0 ммоль) добавляют к перемешиваемому раствору соединения, указанного в заголовке примера 116 (583 мг; 1,0 ммоль), в пиридине (8 мл) в атмосфере азота и полученный раствор перемешивают при 50 С в течение 18 ч, затем упари 51 вают при пониженном давлении. Остаток распределяют между этилацетатом и водой, затем отделенную органическую фазу промывают солевым раствором, высушивают (МgSO4) и упаривают при пониженном давлении. Полученную пену коричневой окраски очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан:метанол (от 100:0 до 99:1, до 98:2, до 97:3), получая указанное в заголовке соединение(32%) в виде пены кремовой окраски. Обнаружено: С, 53,96; Н, 6,01; N, 14,38. С 30 Н 39N7O6S2; 0,60 Н 2O соответствует: С, 53,89; Н, 6,06; N,14,67%.(CDCl3): 0.91 (3H, t), 1.01 (3H, t), 1.19[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(63%) из соединения, указанного в заголовке подготовительного примера 124,и 1 метилпиперазина, используя методику из примера 1.(CDCl3): 0.96 (3H, t), 1.16 (3H, t), 1.80[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(71%) из соединения, указанного в заголовке примера 118, используя методику из примера 116.(CDCl3): 0.89 (3H, t), 1.16 (3H, t), 1.78 (2H,m), 2.04 (2 Н, m), 2.27 (3H, s), 2.49 (4 Н, m), 2.96(2 Н, t), 3.10 (4 Н, m), 4.22 (2 Н, t), 6.76 (2 Н, d),7.18 (1 Н, d), 7.29 (2 Н, d), 7.83 (1H, d), 8.82 (1H,s), 10.59 (1H, s). MCHP: m/z 566 (М+1)+. Пример 120. 2-(4-Метансульфонамидофенил)-5-[5-(4-метилпиперазин-1-илсульфонил)-2-н-пропоксифенил]-3-н-пропил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(55%) из соединения, указанного в заголовке примера 119, и метансульфонилхлорида, используя методику из примера 117. Обнаружено: С, 53,05; Н, 5,72; N, 14,94. С 30 Н 39N7 О 6S2 0,20 Н 2O соответствует: С, 53,08; Н, 5,71; N, 14,84%.(CDCl3): 0.97 (3H, t), 1.19 (3H, t), 1.80 (2 Н, m),2.07 (2 Н, m), 2.30 (3H, s), 2.52 (4 Н, m), 3.02 (2 Н,t), 3.16 (7 Н, m), 4.28 (2 Н, t), 6.90 (1 Н, d), 7.19[4,3-d]пиримидин-7-он. Получают в виде твердого вещества желтого цвета (82%) из соединения, указанного в заголовке подготовительного примера 124, и 1 этилпиперазина, используя методику из примера 1.(CDCl3): 0.96 (3H, t), 1.16 (3H, t), 1.42[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (64%) из соединения, указанного в заголовке примера 121, используя методику из примера 116.(CDCl3): 0.91 (3H, t), 1.16 (3H, t),1.40 (3H, t), 1.83 (2H, m), 2.05 (2H, m), 2.25 (2H,m), 2.49 (4 Н, m), 2.96 (2H, t), 3.10 (4 Н, m), 4.28m/z 580 (М+1)+. Пример 123. 2-(4-Этансульфонамидофенил)-5-[5-(4-этилпиперазин-1-илсульфонил)2-н-пропоксифенил]-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества розовой окраски (52%) из соединения, указанного в заголовке примера 122, и этансульфонилхлорида, используя методику из примера 117. Обнаружено: С, 55,07; H, 6,18; N, 14,39. C31H41N7O6S2 соответствует: С, 55,42; H, 6,15; N, 14,59%.(М+1)+. Пример 124. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-3-н-пропил 2-[4-(проп-2-илсульфонамидо)фенил]-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества (28%) из соединения, указанного в заголовке примера 122, и 2-пропансульфонилхлорида, используя методику из примера 117. Обнаружено: С,53,59; Н, 6,15; N, 13,34. С 32 Н 43N7O6S2; 0,17 Н 2O соответствует: С, 53,64; Н, 6,53; N, 13,68%.[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (40%) из соединения, указанного в заголовке подготовительного примера 125, и 1-метилпиперазина,используя методику из примера 1.(CDCl3): 1.00 (3H, t), 1.18 (3H, t), 1.80 (2 Н, m), 2.06 (2 Н,m), 2.28 (3H, s), 2.50 (4 Н, m), 3.13 (4 Н, m), 3.46[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (84%) из соединения, указанного в заголовке подготовительного примера 126, и 1 метилпиперазина, используя методику из примера 1.(CDCl3): 1.01 (3H, t), 1.60 (3H, t), 1.88[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (56%) из соединения, указанного в заголовке подготовительного примера 127, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 59,24; Н, 7,01; N, 15,24. С 27 Н 38N6O4S соответствует: С, 59,76; Н, 7,06; N, 15,44%.(CDCl3): 1.04 (3H, t), 1.12 (3H, t), 1.90 (6H, m), 2.06 (4 Н,m), 2.30 (3H, s), 2.50 (4 Н, m), 2.98 (3H, m), 3.12m/z 543 (M+1)+. Пример 128. 5-[5-(4-Метилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-оксидопиридин-2-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиpимидин-7-oн. 3-Хлорпероксибензойную кислоту (5055%-ную; 152 мг; 0,44 ммоль) в атмосфере азота добавляют к перемешиваемому раствору соединения, указанного в заголовке примера 6 (108 мг; 0,19 ммоль), в дихлорметане (5 мл), и перемешивание продолжают в течение 18 ч. Реакционную смесь разбавляют дихлорметаном (20 мл), последовательно промывают 5%-ным водным раствором метабисульфита натрия (20 мл),10%-ным водным раствором карбоната калия(20 мл) и солевым раствором (15 мл), затем высушивают (МgSO4) и упаривают при пониженном давлении. Полученную пену желтого цвета очищают колоночной хроматографией на силикагеле, используя градиентное элюирование смесью дихлорметан:метанол:0,880 водный аммиак (от 100:1:1 до 100:3:1), получая указанное в заголовке соединение (36 мг) в виде твердого(1H, s). MCHP: m/z 582 (М+1)+. Пример 129. 5-[5-(4-Этилпиперазин-1 илсульфонил)-2-н-пропоксифенил]-2-(1-оксидопиридин-2-ил)метил-3-н-пропил-2,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены желтого цвета(63%) из соединения, указанного в заголовке примера 12, используя методику из примера 128. Обнаружено: С, 57,04; Н, 6,14; N, 15,80.(1H, s). MCHP: m/z 596 (M+1)+. Пример 130. 3-Этил-5-[2-(2-метоксиэтокси)-5-(4-метилпиперазин-1-илсульфонил)фенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]-пиримидин-7-он. Получают в виде пены белого цвета (85%) из соединения, указанного в заголовке подготовительного примера 133, и 1-метилпиперазина,используя методику из примера 1. Обнаружено: С, 55,82; Н, 5,84; N, 16,54. С 27 Н 33N7O5S; 0,75(1H, d), 8.70 (1H, s), 10.86 (1H, s). MCHP: m/z 569 (M+2)+. Пример 131. 3-Этил-5-[5-(4-этилпиперазин-1-илсульфонил)-2-(2-метоксиэтокси)фенил]-2-(пиридин-2-ил)метил-2,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (73%) из соединения, указанного в заголовке подготовительного примера 133, и 1-этилпиперазина,используя методику из примера 1. Обнаружено: С, 57,08; Н, 6,04; N, 16,51. C28H35N7O5S; 0,50 Н 2O соответствует: С, 56,93; Н, 6,14; N, 16,60%.(CDCl3): 1.01 (3H, t), 1.30 (3H, t), 2.39 (2 Н, q),2.53 (4 Н, m), 3.01 (2 Н, q), 3.10 (4 Н, m), 3.59 (3H,s), 3.87 (2 Н, t), 4.41 (2 Н, t), 5.68 (2 Н, s), 7.08 (1 Н,d), 7.15 (1 Н, d), 7.20 (1 Н, m), 7.61 (1 Н, m), 7.82MCHP: m/z 582 (M+1)+. Подготовительный пример 1. Этиловый эфир 3-этил-1 Н-пиразол-5-карбоновой кислоты. Этанольный раствор этилата натрия (21 мас.%; 143 мл; 0,39 моль) в атмосфере азота добавляют по каплям к перемешиваемому охлажденному во льду раствору диэтилоксалата(59,8 мл; 0,44 моль) в абсолютном этаноле (200 мл) и полученный раствор перемешивают в те 55 чение 15 мин. Затем по каплям добавляют бутан-2-он (39 мл; 0,44 моль), охлаждение убирают, реакционную смесь перемешивают в течение 18 ч при комнатной температуре и затем в течение 6 ч при 40 С, после чего вновь применяют охлаждающую баню. Далее по каплям добавляют ледяную уксусную кислоту (25 мл; 0,44 моль), полученный раствор перемешивают в течение 30 мин при 0 С, по каплям добавляют гидразингидрат (20 мл; 0,44 моль), затем реакционную смесь оставляют нагреваться до комнатной температуры и поддерживают ее в течение 18 ч перед тем, как упарить при пониженном давлении. Остаток распределяют между дихлорметаном (300 мл) и водой (100 мл), далее отделяют органическую фазу, промывают водой(2100 мл), высушивают (Na2SO4) и концентрируют при пониженном давлении, получая указанное в заголовке соединение (66,0 г).(CDCl3): 1.04 (3H, t), 1.16 (3H, t), 2,70 (2 Н, q),4.36 (2 Н, q), 6.60 (1 Н, s). MCHP: m/z 169 (М+1)+. Подготовительный пример 2. 3-Этил-1 Нпиразол-5-карбоновая кислота. Водный раствор гидроксида натрия (10 М; 100 мл; 1,0 моль) добавляют по каплям к перемешиваемой суспензии соединения, указанного в заголовке подготовительного примера 1 (66,0 г; 0,39 моль), в метаноле, и полученный раствор кипятят с обратным холодильником в течение 4 ч. Охлажденную реакционную смесь концентрируют при пониженном давлении до объема приблизительно 200 мл, разбавляют водой (200 мл) и эту смесь промывают толуолом (3100 мл). Полученную водную фазу подкисляют концентрированной соляной кислотой до рН 4,осадок собирают и высушивают вакуумотсосом, получая указанное в заголовке соединение (34,1 г).(ДМСОd6): 1.13 (3H, t), 2.56 (2 Н,q), 6.42 (1 Н, s). Подготовительный пример 3. 4-Нитро-3-нпропил-1 Н-пиразол-5-карбоновая кислота. Дымящую серную кислоту (17,8 мл) добавляют по каплям к перемешиваемой охлажденной во льду дымящей азотной кислоте (16,0 мл), полученный раствор нагревают до 50 С,затем порциями в течение 30 мин добавляют 3 н-пропил-1 Н-пиразол-5-карбоновую кислоту(Chem. Pharm. Bull., 1984, 32, 1568; 16,4 г; 0,106 моль), поддерживая температуру реакционной смеси ниже 60 С. Полученный раствор нагревают в течение 18 ч при 60 С, оставляют охлаждаться, затем выливают на лед. Собирают белый осадок, промывают водой и высушивают вакуум-отсосом, получая указанное в заголовке соединение (15,4 г), т. пл. 170-172 С. Обнаружено: С, 42,35; Н, 4,56; N, 21,07. С 7 Н 9N3O4 соответствует: С, 42,21; Н, 4,55; N, 21,10%.(ДМСОd6): 0.90 (3H, t), 1.64 (2 Н, m), 2.83 (2 Н, m), 14.00 (1 Н,s). Подготовительный пример 4. 3-Этил-4 нитро-1 Н-пиразол-5-карбоновая кислота. 56 Получают из соединения, указанного в заголовке подготовительного примера 2, аналогично подготовительному примеру 3 в виде твердого вещества коричневой окраски (64%).(ДМСОd6): 1.18 (3H, t), 2.84 (2 Н, m), 13.72 (1 Н,s). Подготовительный пример 5. 4-Нитро-3-нпропил-1 Н-пиразол-5-карбоксамид. Раствор соединения, указанного в заголовке подготовительного примера 3 (15,4 г; 0,077 моль), в тионилхлориде (75 мл) кипятят с обратным холодильником в течение 3 ч, и затем охлажденную реакционную смесь упаривают при пониженном давлении. Остаток азеотропно отгоняют с тетрагидрофураном (250 мл), затем суспендируют в тетрагидрофуране (50 мл),далее перемешиваемую суспензию охлаждают во льду и обрабатывают в течение 1 ч газообразным аммиаком. Добавляют воду (50 мл) и полученную смесь упаривают при пониженном давлении, получая твердое вещество, которое после растирания с водой и высушивания вакуум-отсосом, дает указанное в заголовке соединение (14,3 г), т. пл. 197-199 С. Обнаружено: С,42,35; Н, 5,07; N, 28,38. С 7 Н 10N4 О 3 соответствует: С, 42,42; Н, 5,09; N, 28,27%.(ДМСОd6): 0.90 (3H, t), 1.68 (2 Н, m), 2.86 (2 Н, t), 7.68 (1 Н,s), 8.00 (1H, s). Подготовительный пример 6. 3-Этил-4 нитро-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 4, аналогично подготовительному примеру 5 в виде твердого вещества белого цвета (90%).(ДМСОd6): 1.17 (3H, t), 2.87 (2 Н, m), 7.40 (1 Н, s),7.60 (1 Н, s), 7.90 (1 Н, s). MCHP: m/z 185 (М+1)+. Подготовительный пример 7. 4-Амино-3-нпропил-1 Н-пиразол-5-карбоксамид. Перемешиваемую смесь соединения, указанного в заголовке подготовительного примера 5 (10,0 г; 0,050 моль), 10%-ного палладия на угле (1,5 г) и этанола (400 мл) гидрируют в течение 18 ч при 345 кПа (50 фунт/кв. дюйм) и 50 С, затем фильтруют. Фильтрат объединяют с этанольной промывкой (200 мл) фильтра и далее упаривают при пониженном давлении, получая твердое вещество оранжевого цвета, которое в результате кристаллизации из смеси этилацетат: метанол дает указанное в заголовке соединение(6,8 г) в виде твердого вещества белого цвета,т. пл. 196-201 С. Обнаружено: С, 48,96; Н, 6,98;(1 Н, s), 7.12 (1 Н, s), 12.20 (1 Н, s). Подготовительный пример 8. 4-Амино-3 этил-1 Н-пиразол-5-карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 6, аналогично подготовительному примеру 7, в виде твердого вещества коричневой окраски (80%).(ДМСОd6): 1.08 (3H, t), 2.45 (2 Н, q), 4.50 (1 Н, s),6.88 (1 Н, s), 7.10 (1 Н, s), 7.26 (2 Н, s). MCHP: m/z 155 (M+1)+. Подготовительный пример 9. 4-(2-нПропоксибензамидо)-3-н-пропил-1 Н-пиразол-5 карбоксамид. Раствор 2-н-пропоксибензоилхлорида (57,6 г; 0,291 моль) в дихлорметане (50 мл) добавляют по каплям к перемешиваемой охлажденной во льду суспензии соединения, указанного в заголовке подготовительного примера 7 (35,0 г; 0,208 моль), в безводном пиридине (350 мл), и полученную смесь перемешивают в течение 18 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток азеотропно отгоняют с толуолом (2100 мл) и полученное твердое вещество коричневой окраски растирают с эфиром (100 мл), получая указанное в заголовке соединение (83,0 г) в виде твердого вещества бежевой окраски.(СН 3 ОНd4): 0.92 (3H, t),1.14 (3H, t), 1.65 (2H, m), 1.94 (2H, m), 2.80 (2 Н,t), 4.20 (2 Н, t), 7.08 (1 Н, m), 7.18 (1 Н, d), 7.52(1 Н, m), 8.04 (1 Н, d). МСНР: m/z 131 (М+1)+. Подготовительный пример 10. 3-Этил-4-(2 н-пропоксибензамидо)-1 Н-пиразол-5 карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 8, аналогично подготовительному примеру 9, в виде твердого вещества бежевой окраски (68%).(1H, d), 10.20 (1H, s). MCHP: m/z 317 (М+1)+. Подготовительный пример 11. 4-(2 Этоксибензамидо)-3-н-пропил-1 Н-пиразол-5 карбоксамид. Получают из соединения, указанного в заголовке подготовительного примера 7, и 2 этоксибензоилхлорида аналогично подготовительному примеру 9, в виде твердого вещества белого цвета (64%), т. пл. 209-211 С. Обнаружено: С, 60,73; H, 6,41; N, 17,80. С 16H20N4O3 соответствует: С, 60,74; H, 6,37; N, 17,71%.(1 Н, s). Подготовительный пример 12. 5-(2-нПропоксифенил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиpимидин-7-oн. трет-Бутилат калия (93,0 г; 0,832 моль) в атмосфере азота добавляют порциями к перемешиваемому раствору соединения, указанного в заголовке подготовительного примера 9 (83,0 г; 0,25 моль), в пропан-2-оле (800 мл), и смесь кипятят с обратным холодильником в течение 18 ч, затем оставляют охлаждаться. Добавляют воду (100 мл), получая гомогенный раствор,который подкисляют до рН 6 2M соляной кислотой. Полученный белый осадок собирают и[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 10, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (85%).(1 H, s). MCHP: m/z 299 (М+1)+. Подготовительный пример 14. 5-(2 Этоксифенил)-3-н-пропил-1,6-дигидро-7 Нпиразоло[4,3-d]пиримидин-7-он. Получают из соединения, указанного в заголовке подготовительного примера 11, аналогично подготовительному примеру 12, в виде твердого вещества белого цвета (88%), т. пл. 199-201 С. Обнаружено: С, 64,44; H, 6,19; N,18,44. C16H18N4O2 соответствует: С, 64,41; H,6,08; N, 18,78%.(CDCl3): 1.08 (3H, t), 1.65 (3H,t), 1.98 (2H, m), 3.04 (2 Н, t), 4.36 (2 Н, q), 7.10(1 Н, d), 7.20 (1H, m), 7.50 (1H, m), 8.57 (1H, d),11.36 (1H, s), 11.88 (1H, s). Подготовительный пример 15. Алкилирование 5-(2-алкоксифенил)-3-алкил-1,6-дигидро 7 Н-пиразоло[4,3-d]пиримидин-7-онов. Для N-алкилирования соединений, указанных в способах получения 12, 13 и 14, применяют пять общих методик, способы А-Е. В некоторых случаях в результате одной и той же реакции могут быть получены оба N1- и N2 изомера. Способ А. Алкилгалогенид (2,75 ммоль) добавляют в атмосфере азота к перемешиваемой суспензии пиразоло[4,3-d]пиримидинонового субстрата(2,5 ммоль) в 1 М водном растворе гидроксида натрия (7,25 ммоль) и реакционную смесь обрабатывают в течение 72 ч при 50 С, затем оставляют охлаждаться. Полученную смесь экстрагируют этилацетатом (225 мл) и объединенные экстракты высушивают (MgSО 4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ В. 60%-ную (мас./мас.) дисперсию гидрида натрия в минеральном масле (0,39 ммоль) добавляют в атмосфере азота к перемешиваемому охлажденному во льду раствору субстрата (0,39 ммоль) в безводном тетрагидрофуране (8 мл). Через 1 ч при 0 С добавляют алкилгалогенид(0,43 ммоль) и реакционную смесь нагревают в течение 24 ч при 45 С, затем оставляют охлаждаться. Полученную смесь упаривают при пониженном давлении, и остаток распределяют между этилацетатом (40 мл) и солевым раствором (30 мл). Органическую фазу отделяют, высушивают (MgSO4) и упаривают при пониженном давлении, что позволяет получить неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ С. 2 М раствор бис(триметилсилил)амида натрия в тетрагидрофуране (2,2 ммоль) в атмосфере азота добавляют по каплям к перемешиваемому охлажденному во льду раствору субстрата(2 ммоль) в безводном тетрагидрофуране (8 мл) и раствор перемешивают в течение 1 ч при 0 С,перед тем как охладить до -70 С. Затем добавляют алкилгалогенид (2 ммоль), охлаждение убирают и полученный раствор перемешивают в течение 24 ч при комнатной температуре, затем упаривают при пониженном давлении. Остаток распределяют между этилацетатом (40 мл) и водным раствором бикарбоната натрия (30 мл),органическую фазу отделяют, высушивают(MgSО 4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. С другой стороны, может быть применен 0,5 М раствор бис(триметилсилил)амида калия в толуоле с безводным толуолом в качестве растворителя, и в этом случае алкилирование осуществляют при температуре приблизительно 40 С в течение 20 ч. Способ D. Раствор субстрата (4,8 ммоль), алкилгалогенида (4,8 ммоль) и Aliquat (ТМ) 336 (150 мг) в дихлорметане (80 мл) в атмосфере азота добавляют к перемешиваемому 1 М водному раствору гидроксида натрия (15 ммоль). Двухфазную смесь энергично перемешивают в течение 72 ч при комнатной температуре, затем водную фазу отделяют и экстрагируют этилацетатом (225 мл). Экстракты объединяют с органической фазой и этот раствор высушивают (МgSO4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Способ Е. Трифенилфосфин (1,77 ммоль) и алканол(1,77 ммоль) добавляют к перемешиваемому раствору субстрата (1,60 ммоль) в безводном тетрагидрофуране (10 мл). Полученный раствор охлаждают до -5 С и по каплям добавляют диэтилазодикарбоксилат (1,77 ммоль), затем реакционную смесь оставляют нагреваться до комнатной температуры, перемешивают в течение 18 ч и упаривают при пониженном давлении. Остаток распределяют между этилацетатом (30 мл) и водой (30 мл), далее органическую фазу отделяют, объединяют с этилацетатным экс 002057(Na2SO4) и упаривают при пониженном давлении, получая неочищенный продукт, который очищают колоночной хроматографией на силикагеле. Подготовительный пример 16. 3-Этил-5-(2 н-пропоксифенил)-1-(пиридин-2-ил)метил-1,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (15%) из соединения, указанного в заголовке подготовительного примера 13, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В.(CDCl3): 1.18 (3H, t),1.43 (3H, t), 2.00 (2 Н, m), 3.02 (2 Н, q), 4.18 (2 Н,t), 5.95 (2 Н, s), 7.03 (2 Н, m), 7.16 (2 Н, m), 7.46(1 Н, m), 7.60 (1 Н, m), 8,52 (1 Н, d), 8.58 (1 Н, d),11.20 (1H, s). MCHP: m/z 390 (М+1)+. Подготовительный пример 17. 5-(2-нПропоксифенил)-3-н-пропил-1-(пиридин-2-ил) метил-1,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (22%) из соединения, указанного в заголовке подготовительного примера 12, и 2-хлорметилпиридина, используя методику из подготовительного примера 15D.(CDCl3): 1.01 (3H, t), 1.17(1H, d), 8.59 (1 Н, d), 11.20 (1H, s). MCHP: m/z 404 (М+1)+. Подготовительный пример 18. 3-Этил-5-(2 н-пропоксифенил)-2-(пиридин-2-ил)метил-2,6 дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде твердого вещества белого цвета (22%) из соединения, указанного в заголовке подготовительного примера 13, и 2 хлорметилпиридина, используя методику из подготовительного примера 15 В. Выход в 43% может быть достигнут с использованием методики из подготовительного примера 15 С.(CDCl3): 1.12 (3H, t), 1.30 (3H, t),1.99 (2 Н, m), 3.00 (2 Н, q), 4.17 (2 Н, t), 5.68 (2 Н,s), 7.00-7.14 (3H, m), 7.20 (1 Н, m), 7.42 (1 Н, m),7.60 (1 Н, m), 8.40 (1 Н, d), 8,58 (1 Н, d), 10.87 (1 Н,s). MCHP: m/z 390 (М+1)+. Подготовительный пример 19. 5-(2 Этоксифенил)-3-н-пропил-2-(пиридин-2-ил) метил-2,6-дигидро-7 Н-пиразоло[4,3-d]пиримидин-7-он. Получают в виде пены белого цвета (59%) из соединения, указанного в заголовке подготовительного примера 14, и 2-хлорметилпиридина, используя методику из подготовительного примера 15 В.(CDCl3): 0.98 (3H, t),1.60 (3H, t), 1.76 (2 Н, m), 2.98 (2 Н, t), 4.30 (2 Н,q), 5.70 (2 Н, s), 7.06 (2 Н, m), 7.15 (1 Н, m), 7.22
МПК / Метки
МПК: A61K 31/519, A61P 9/00, C07D 487/04
Метки: pde5, 5'-монофосфат-фосфодиэстеразу, расстройства, лечения, сексуального, циклический, которые, типа, cgmp, гуанозин-3, ингибируют, пиразолопиримидиноны
Код ссылки
<a href="https://eas.patents.su/30-2057-pirazolopirimidinony-kotorye-ingibiruyut-ciklicheskijj-guanozin-3-5-monofosfat-fosfodiesterazu-tipa-5-cgmp-pde5-dlya-lecheniya-seksualnogo-rasstrojjstva.html" rel="bookmark" title="База патентов Евразийского Союза">Пиразолопиримидиноны, которые ингибируют циклический гуанозин-3′, 5′-монофосфат-фосфодиэстеразу типа 5 (cgmp pde5), для лечения сексуального расстройства</a>
Предыдущий патент: Получение промежуточных соединений эндотелина реакцией ассиметрического сопряженного присоединения с использованием хиральной добавки.
Следующий патент: Новые соли врс-пептидов с органопротективной активностью, способ их получения и их использование в терапии
Случайный патент: Машина и метод захватывания щебеночного балласта рельсового пути












