Получение промежуточных соединений эндотелина реакцией ассиметрического сопряженного присоединения с использованием хиральной добавки.
Формула / Реферат
1. Способ получения соединения формулы I
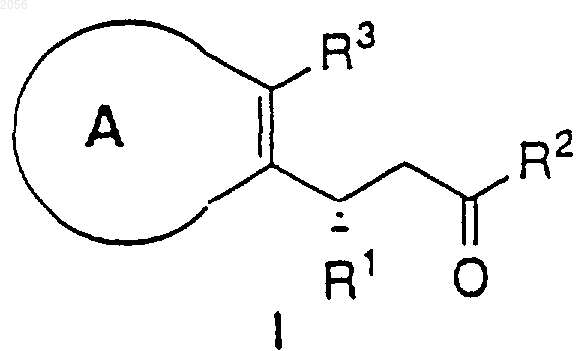
где

представляет
а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2,
в) 5- или 6-членный карбоциклил, содержащий одну или две двойные связи, по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2,
с) арил, где арил определен ниже,
C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил или C3-C8 циклоалкил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила, СО(СН2)nСН3 и CO(CH2)nCH2N(R5)2, арил представляет собой фенил или нафтил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2 и, если два заместителя находятся у соседних углеродов, они соединяются с образованием 5- или 6-членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N и S, назамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из Н, ОН, CO2R6, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(CH2)nCH2N(R5)2;
R1 представляет
а) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,
в) арил или
с) гетероарил;
гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Сl, F, I, СF3, N(R5)2, C1-С8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nСН2N(R5)2;
R2 означает OR4 или N(R5)2;
R3 представляет
а) Н,
в) C1-C8 алкил,
c) С2-С8 алкенил,
d) С2-C8 алкинил,
e) C1-C8 алкоксил,
f) С3-С7 циклоалкил,
g) S(O)tR5,
h) Br, Cl, F, I,
i) арил,
j) гетероарил,
k) N(R5)2,
l) NН2,
m) CHO,
n) -CO-C1-C8 алкил,
о) -СО-арил,
р) -СО-гетероарил,
q) -CO2R4 или
r) защищенный альдегид;
Х и Y независимо означают О, S или NR5;
n равно 0-5;
t равно 0, 1 или 2;
R4 представляет C1-C8 алкил;
R5 представляет C1-C8 алкил или арил;
R6 представляет H, C1-C8 алкил и арил; и
R7 независимо представляют H, C1-C8 алкил и арил, когда имеются два заместителя R7 у азота, они могут соединяться с образованием 3- - 6-членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2; включающему взаимодействие a,b-ненасыщенного эфира или амида
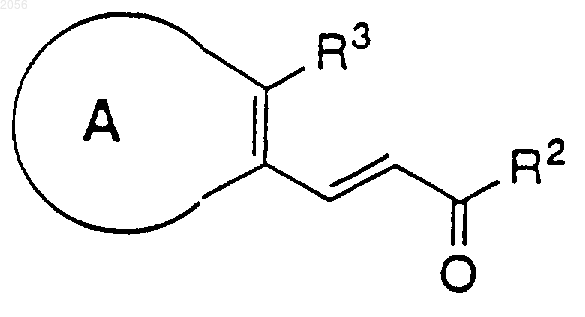
с литий-органическим соединением R1Li в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы, состоящей из
а) (-)-спартеин,
в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2-диаминоциклогексан или
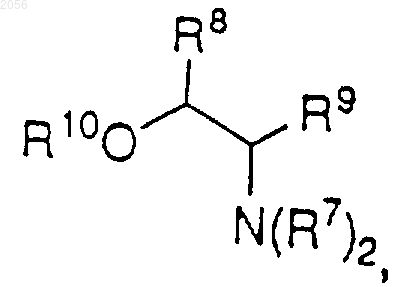
с)
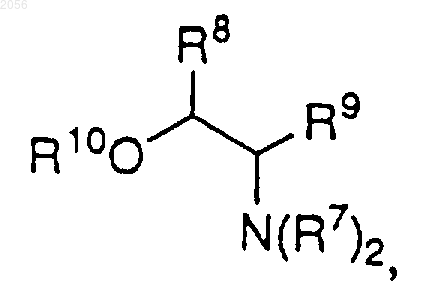
где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и
R10 представляет Н, C1-C6 алкил или арил,
и апротонного растворителя, где указанный апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира, бензола, толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78шС до приблизительно 0шС.
2. Способ по п.1, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4.
3. Способ по п.2, в котором область температур находится от приблизительно -78шС до приблизительно -20шС.
4. Способ получения соединения формулы I
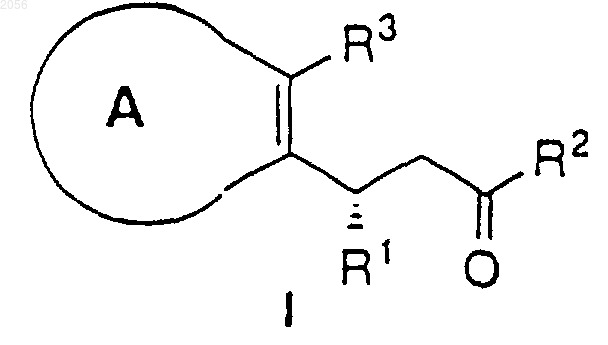
где
представляет собой
а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из O, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(CH2)nCH2N(R5)2,
в) 5- или 6-членный карбоциклил, содержащий одну иди две двойные связи, по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, СО2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(CH2)nCH2N(R5)2,
с) арил, где арил определен ниже,
C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил или C3-C8 циклоалкил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила, СО(СН2)nСН3 и СО(CН2)nСН2N(R5)2,
арил представляет собой фенил или нафтил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2; и когда два заместителя находятся у соседних углеродов, они могут соединяться с образованием 5- или 6-членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N и S, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из Н, ОН, CO2R6, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2;
R1 представляет:
a) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,
в) арил или
с) гетероарил;
гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(CH2)nCH2N(R5)2;
R2 представляет OR4 или N(R5)2;
R3 представляет
а) СНО,
в) CH(OR4)2;
n равно 0-5,
t равно 0, 1 или 2;
Х и Y независимо представляют О, S или NR5;
R4 представляет C1-C8 алкил;
R5 представляет C1-C8 алкил или арил;
R6 представляет Н, C1-C8 алкил и арил;
R7 независимо представляют Н, C1-C8 алкил и арил, когда имеются два заместителя R7 у азота, они могут соединяться с образованием 3- - 6-членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН2)nСН3 и СО(СН2)nCH2N(R5)2;
включающий стадии
1) взаимодействия a,b-ненасыщенного эфира или амида

где R3 означает CH(OR4)2,
с литий-органическим соединением R1Li в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы, состоящей из
а) (-)-спартеин,
в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2-диаминоциклогексан или
с)
где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет Н, C1-C6 алкил или арил, и апротонного растворителя, где указанный апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира, бензола, толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78шС до приблизительно 0шС, чтобы получить сопряженный продукт; и
2) удаления кислотой защищающей группы для получения соединения формулы I, где R3 является СНО.
5. Способ по п.4, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4.
6. Способ по п.5, в котором область температур составляет от приблизительно -78шС до приблизительно -20шС.
7. Способ получения
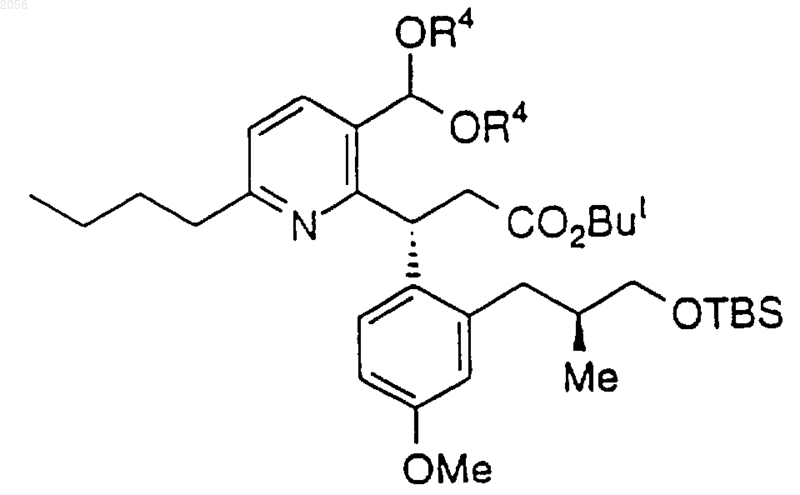
включающий взаимодействие a,b-ненасыщенного эфира или амида
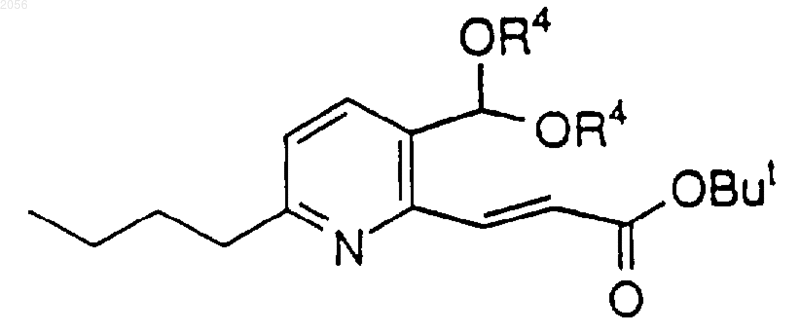
c литий-оpганическим соединением
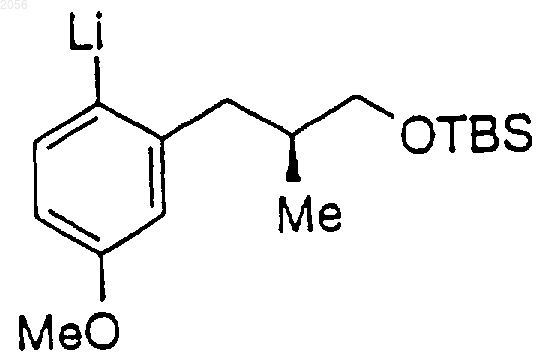
в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы, состоящей из
а) (-)-спартеин,
в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2-диаминоциклогексан или
c)
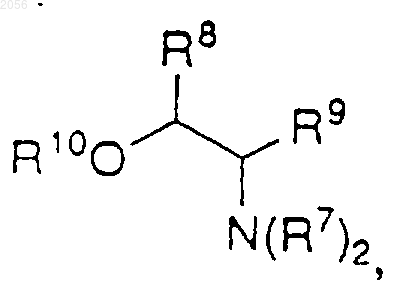
где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет Н, C1-C6 алкил или арил,
и апротонного растворителя, где указанный апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира, бензола, толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78шС до приблизительно -20шС.
8. Способ по п.7, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4.
9. Способ по п.8, в котором область температур находится ют приблизительно -78шС до приблизительно -50шС.
10. Способ по п.9, в котором число эквивалентов литий-органического соединения R1Li составляет 1,5 до приблизительно 2,5.
11. Способ по п.10, в котором апротонный растворитель представляет собой толуол или смесь толуол-гексан-(каталитический)тетрагидрофуран.
12. Способ по п.11, в котором область температур составляет от приблизительно -78шС до приблизительно -70шС.
Текст
1 Предпосылки к созданию изобретения Данное изобретение относится к новым ключевым промежуточным соединениям в синтезе антагониста эндотелина и способу получения этих ключевых промежуточных соединений формулы I. Соединение, характеризующееся высоким сродством, по крайней мере, к одному из двух подтипов рецепторов, обусловливающих дилатацию гладких мышц, таких как кровеносные сосуды или трахея. Соединения эндотелиновых антагонистов представляют, возможно, новые лекарственные средства особенно для лечения артериальной гипертензии, легочной гипертензии (гипертензии малого круга кровообращения), болезни Рейно, острой почечной недостаточности, инфаркта миокарда, стенокардии, инфаркта головного мозга, сужения кровеносных сосудов головного мозга, артериосклероза, астмы, язвы желудка, диабета, рестеноза, гипертрофии предстательной железы, эндотоксинового шока, вызванных эндотоксином множественных органных нарушений или дисеминированного внутрисосудистого свертывания (коагуляции) и/или индуцированной циклоспорином почечной недостаточности или гипертензии. Эндотелин является полипептидом, состоящим из аминокислот, его продуцируют эндотелиальные клетки сосудов человека или свиньи. Эндотелин оказывает мощное вазоконстрикторное действие и устойчивое и мощное прессорное действие (повышающее кровяное давление) (Nature, 332, 411-415, (1988. Три изопептида эндотелина (эндотелин-1,эндотелин-2 и эндотелин-3), которые похожи по структуре, существуют в организме животных,включая человека, и эти пептиды проявляют вазоконстрикторное и прессорное действие(Proc.Natl.Acad.Sci, USA, 86.2863-2867, (1989. Показано, что уровни эндотелин четко повышаются в крови пациентов при первичной артериальной гипертензии, остром инфаркте миокарда, легочной гипертензии, болезни Рейно, диабете или атеросклерозе, или в промывных жидкостях из дыхательных путей или в крови пациентов с астмой по сравнению с нормальными уровнями (Japan, J. Hypertension, 12,79, (1989), J. Vascular medicine Biology, 2, 207,(1990), Diabetologia, 33, 306-310, (1990), J. Am.Med. Association, 264, 2868 (1990), и The Lancet,ii, 747-748 (1989) и ii, 1144-1147 (1990. Кроме того, сообщалось о повышенной чувствительности кровеносных сосудов головного мозга к эндотелину в экспериментальной модели ангиоспазма головного мозга (Japan.Soc. Cereb. Blood FlowMetabol., 1, 73 (1989,улучшений функции почек при использовании антител к эндотелину в модели острой почечной недостаточности (J. Clin. invest. 83, 1762-1767(1989) и ингибировании развития язвы желудка антителами к эндотелину на модели язвы желудка (Extract of Japanese Society of ExperimentalGastric Ulcer. 50 (1991. Поэтому предполагают,что эндотелин является одним из медиаторов,вызывающих острую почечную недостаточность или ангиоспазм головного мозга с последующим субарахноидальным кровоизлиянием. Эндотелин секретируют не только эндотелиальные клетки, а также эпителиальные клетки трахеи или клетки почек (FEBS Letters, 255, 129132 (1989) и FEBS Letters, 249, 42-46 (1989. Также обнаружено, что эндотелин контролирует высвобождение физиологически активных эндогенных веществ таких как ренин, предсердный натрийуретический пептид, эндотелиальный фактор релаксации (EDRF), тромбоксан А 2, простациклин, норадреналин, ангиотензин П и субстанция Р (Biochem. Biophys, Res. Commun., 157, 1164-1168 (1988); Biochem. Biophys,Res. Commun., 155, 20 167-172 (1989); Proc. Natl.Acad. Sci. USA, 85 1 9797-9800 (1989); J. Cardiovasc. Pharmacol., 13, S89-92 (1989); Japan. J. Hypertension, 12, 76 (1989) и Neuroscience Letters,102, 179-184 (1989. Кроме того, эндотелин вызывает сокращение гладких мышц жедудочнокишечного тракта и гладкой мышцы матки(FEBS Letters, 247, 337-340 (1989); Eur. J. Pharmacol., 154, 227-228 (1988); и Biochem. Biophys,Res. Commun., 159, 317-323 (1989. Показано,что эндотелин стимулирует пролиферацию гладкомышечных клеток сосудов крысы, что позволяет предположить возможное участие в артериальной гипертрофии (Atherosclerosis, 78,225-228 (1989. К тому же, так как рецепторы эндотелина присутствуют с высокой плотностью не только в периферических тканях, но также в центральной нервной системе, а введение эндотелина в головной мозг вызывает изменение поведения животных, вероятно, эндотелин играет важную роль в контроле функций нервной системы (Neuroscience Letters, 97, 276279 (1989. В частности полагают, что эндотелин является одним из медиаторов боли (LifeSciences, 49, PL61-PL65 (1991. Внутреннюю гиперпластическую реакцию вызывают баллонной денудацией (снятием поверхностного слоя) эндотелия сонной артерии крысы. Эндотелин вызывает значительное усиление внутренней гиперплазии (J. Cardiovasc.Pharmacol., 22, 355-359 и 371-373 (1993. Эти данные подтверждают роль эндотелина в патогенезе рестеноза сосудов. Недавно было показано, что как ЕТА, так и ЕТВ рецепторы имеются в простате человека и эндотелин вызывает мощное сокращение их. Эти результаты позволяют предположить вероятность того, что эндотелин вовлечен в патофизиологию доброкачественной гиперплазии простаты (J. Urology, 151, 763-766(1994. С другой стороны, эндотоксин является одним из возможных стимуляторов высвобождения эндотелина. Наблюдают значительное повышение уровней эндотелина в крови или в 3 супернатанте культуры эндотелиальных клеток при введении эндотоксина экзогенно животным или добавлении его в культуру эндотелиальных клеток, соответственно. Эти данные позволяют предположить, что эндотелин является важным медиатором заболеваний, вызванных эндотоксином (Biochem. Biophys Res. Commun., 161,1220-1227 (1989); и Acta Physiol. Scand., 137,317-318 (1989. Кроме того, было описано, что циклоспорин значительно увеличивает секрецию эндотелина в культуре клеток почек (LLC-PKL клеток)(Eur. J. Pharmacol., 180, 191-192 (1990. К тому же, введение циклоспорина крысам снижает скорость гломерулярной фильтрации и повышает кровяное давление в сочетании со значительным увеличением уровня циркулирующего эндотелина. Эту индуцированную циклоспорином почечную недостаточность подавляют введением антител к эндотелину (Kidney Int., 37, 14871491 (1990. Таким образом предполагают, что эндотелин существенно вовлечен в патогенез заболеваний, вызванных циклоспорином. Такие разнообразные воздействия эндотелина обусловлены связыванием эндотелина с эндотелиновыми рецепторами, широко распространенными во многих тканях (Am. J. Physiol.,256, R856-R866 (1989. Известно, что эндотелины вызывают сужение кровеносных сосудов через, по крайней мере, два подтипа рецепторов эндотелина (J.(1991. Одним из рецепторов эндотелина является рецептор ЕТA, скорее селективный к ЕТ-1,чем к ЕТ-3, а другим является рецептор ЕТB одинаково активный с ЕТ-1 и ЕТ-3. Эти рецепторные белки отличаются друг от друга (Nature,348, 730-735 (1990. Эти два подтипа рецепторов эндотелина характеризуются различным распространением в тканях. Известно, что рецептор ЕТA присутствует, главным образом, в тканях сердечнососудистой системы, тогда как рецептор ЕТB имеет широкое распространение в различных тканях таких как ткани мозга, почек, легких,сердца и сосудов. Полагают, что вещества, которые специфически ингибируют связывание эндотелина с рецепторами эндотелина, являются антагонистами различных фармакологических активностей эндотелина и успешно используются в качестве лекарственных средств в oбширной области. Так как действие эндотелинов осуществляется не только через рецептор ЕТA, но также через рецептор ЕТB, необходимы новые непептидные вещества с активностью антагонистов рецептора ЕТ к любому подтипу рецепторов,чтобы эффективно блокировать активность эндотелинов при различных заболеваниях. Эндотелин является эндогенным веществом, которое прямо или косвенно (посредством контролирования освобождения различных эн 002056 4 догенных веществ) вызывает устойчивое сокращение или релаксацию сосудистых и несосудистых гладких мышц, и, как полагают, избыток образования его или избыток секреции является одним из факторов патогенеза гипертензии, легочной гипертензии, болезни Рейно,бронхиальной астмы, язвы желудка, диабета,артериосклероза, рестеноза, острой почечной недостаточности, инфаркта миокарда, стенокардии, спазма сосудов головного мозга и инфаркта головного мозга. Кроме того предполагают, что эндотелин служит в качестве важного медиатора, вовлеченного в заболевания такие как рестеноз, гипертрофия простаты, эндотоксиновый шок, вызванные эндотоксином множественные повреждения органов или генерализованный тромбогеморрагический синдром (диссеминированное внутрисосудистое свертывание) и индуцированная циклоспорином недостаточность почек или гипертензия. В настоящее время известны два эндотелиновых рецептора -ЕТA и ЕТB, и показано, что антагонисты этих рецепторов представляют собой возможные лекарственные средства. ЕР 0526708 А 1 и WO 93/08799 А 1 являются характерными примерами патентных заявок, описывающих непептидные соединения с заявленной активностью в качестве антагонистов эндотелиновых рецепторов. Данное изобретение описывает асимметрическое сопряженное присоединение для получения соединения формулы I основного промежуточного соединения в синтезе антагонистов эндотелина следующей структуры:R3B представляет арил или гетероарил;R5 представляет C1-C8 алкил или арил. Краткое описание изобретения Настоящее изобретение относится к способу получения соединения формулы I представляет а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, но по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, С 2-С 8 алкенила, С 2-С 8 алкинила или С 3-С 8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2,в) 5- или 6-членный карбоциклил, содержащий одну или две двойные связи, но по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, С 2-С 8 алкенила, С 2-С 8 алкинила или С 3-С 8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2,с) арил, где арил определен ниже, C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил, С 2-С 8 алкинил или С 3-С 8 циклоалкил, незамещенные или замещенные одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН,CO2R4, Br, Cl, F, I, CF3, N(R5)2, C1-C8 алкокси,С 3-С 8 циклоалкила,СО(СН 2)nСН 3 иCO(CH2)nCH2N(R5)2,арил обозначает фенил или нафтил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, С 2-С 8 алкенила, С 2-С 8 алкинила или С 3-С 8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2, и если два заместителя располагаются на соседних углеродах, они могут соединяться с образованием 5 или 6-членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N, S, незамещенного или замещенного одним, двумя или тремя замеcтителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2;a) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,в) арил или с) гетероарил; гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1,2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из: ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2 002056R7 представляет Н, C1-C8 алкил, арил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, CF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СO(СН 2)nСН 2N(R5)2; или когда два заместителя R7 расположены у того же самого азота, они могут соединяться с образованием кольца из 3 до 6 атомов; включающему взаимодействие ,-ненасыщенного эфира или амида с литий-органическим соединением R1Li в присутствии хиральной добавки и апротонного растворителя в диапазоне температур от приблизительно -78 С до приблизительно 0 С. Подробное описание изобретения Настоящее изобретение относится к способу получения соединения формулы I представляет а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, но по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из O, N и S, незаме 7 щенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2,в) 5- или 6-членный карбоциклил, содержащий одну или две двойные связи, но по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(CH2)nCH2 N(R5)2,с) арил, который определен ниже:C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил,C2-C8 алкинил, или C3-C8 циклоалкил, незамещенные или замещенные одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила,СО(СН 2)nСН 3 и CO(CH2)nCH2N(R5)2,арил представляет собой фенил или нафтил, незамещенный или замещенный одним,двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I,СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)n СН 3 и СО(CH2)nCH2N(R5)2, и если два заместителя располагаются на соседних углеродах, они могут соединяться с образованием 5- или 6-членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N, S,которое может быть незамещенным или замещенным одним, двумя или тремя заместителями, выбранными из группы, состоящей из Н,ОН, CO2R6, Br, Cl, F, I, СF3, N(R7)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2;a) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,в) арил или с) гетероарил; гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2C8 алкинила или C3-C8 циклоалкила, СО(СН 2)n СН 3 и CO(CH2)nCH2N(R5)2,R2 представляет OR4 или N(R5)2;R7 независимо представляют Н, C1-C8 алкил, арил, когда два заместителя R7 располагаются у азота, они могут соединяться с образованием 3- - 6- членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(CН 2)nCH2N(R5)2; включающему взаимодействие с литий-органическим соединением R1Li в присутствии хиральной добавки и апротонного растворителя в диапазоне температур от приблизительно -78 С до приблизительно 0 С. В вышепредставленном способе число эквивалентов литий-органического соединенияR1Li, составляет 1 до приблизительно 4 и предпочтительно от приблизительно 1,5 до приблизительно 2,5. В вышезаявленном способе хиральная добавка представляет собой хиральное соединение, способное к координации (установлению координационной связи) с хиральными добавками, такими как а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диамино-циклогексан или с) где R8 и R9 независимо представляют собой Н,C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; иR10 представляет собой C1-C6 алкил или арил, и эффективна в этом способе. Понятно, 9 что аминоспирт, изображенный посредством вышеупомянутой структуры, имеет, по крайней мере, один и, возможно, два хиральных центра. В вышезаявленном способе апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, МТВЕ(метил трет-бутиловый эфир), толуола, бензола,гексана, пентана и диоксана, или смеси названных растворителей. В вышезаявленном способе предпочтительным апротонным растворителем является толуол. Эффективные в этом способе смеси растворителей представляют собой гексан и толуол с каталитическим количеством тетрагидрофурана, и пентан и толуол с каталитическим количеством тетрагидрофурана, предпочтительно гексан и толуол с каталитическим количеством тетрагидрофурана. В вышепредставленном способе диапазон температур составляет от приблизительно -78 С до приблизительно -20 С, и предпочтительно от приблизительно -78 С до приблизительно -50 С. Воплощением данного изобретения является способ получения соединения формулы I представляет а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, но по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2,в) 5- или 6-членный карбоциклил, содержащий одну или две двойные связи, но, по крайней мере, одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила,C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2,с) арил, где арил является таким, как определено ниже, C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил или C3-C8 циклоалкил,незамещенные или замещенные одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила,СО(СН 2)nСН 3 и CO(CH2)nCH2N(R5)2,арил представляет фенил или нафтил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, 002056 10 состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2, и когда два заместителя располагаются на соседних углеродах, они могут соединяться с образованием 5 или 6-членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N, S, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из Н, ОН, CO2R6, Br, Cl, F, I, СF3,N(R7)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2;a) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,в) арил или с) гетероарил; гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2C8 алкинила или C3-C8 циклоалкила, СО(СН 2)n СН 3 и СО(CH2)nCH2N(R5)2;R7 независимо представляет Н, C1-C8 алкил и арил, когда два заместителя R7 располагается у азота, они могут соединяться с образованием 3- до -6-членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2; включающему стадии 1) взаимодействия ,-ненасыщенного эфира или амида где R3 является CH(OR4)2; с литий-органическим соединением, R1Li,в присутствии хиральной добавки и апротонного растворителя в диапазоне температур от приблизительно -78 С до приблизительно 0 С, чтобы получить сопряженный аддукт; и 11 2) удаления группы, защищающей альдегид, кислотой, чтобы получить соединение формулы I, где R3 является СНО. В вышезаявленном способе число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4, и предпочтительно от приблизительно 1,5 до приблизительно 2,5. В вышеприведенном способе хиральная добавка представляет собой хиральное соединение, способное к координации с хиральными добавками такими как а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диаминоциклогексан или с) где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет C1-C6 алкил или арил, и эффективны в этом способе. В вышезаявленном способе апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, МТВЕ(метил трет-бутиловый эфир), толуола, бензола,гексана, пентана и диоксана, или смеси названных растворителей. В способе, который описан выше, предпочтительным апротонным растворителем является толуол. Полезные в этом способе смеси растворителей представляют собой гексан и толуол с каталитическим количеством тетрагидрофурана,и пентан и толуол с каталитическим количеством тетрагидрофурана, предпочтительно гексан и толуол с каталитическим количеством тетрагидрофурана. В вышеописанном способе область температур составляет от приблизительно -78 С до приблизительно -20 С и предпочтительно от приблизительно -78 С до приблизительно -50 С. Воплощением данного изобретения является способ получения защищенного альдегида 12 в присутствии хиральной добавки и апротонного растворителя в области температур от приблизительно -78 С до приблизительно -20 С. В вышезаявленном способе число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4, и предпочтительно от приблизительно 1,5 до приблизительно 2,5. В вышепредставленном способе хиральная добавка представляет собой хиральное соединение, поддающееся координации с хиральными добавками, такими как а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диаминоциклогексан или с) где R8 и R9 независимо представляют собой Н,C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет собой C1-C6 алкил или арил, которые эффективны в этом способе. В вышеописанном способе апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, МТВЕ(метил трет-бутиловый эфир), толуола, бензола,гексана, пентана и диоксана или смеси названных растворителей. В вышепредставленном способе предпочтительным апротонным растворителем является тетрагидрофуран. Эффективные в данном способе смеси растворителей представляют собой гексан и толуол с каталитическим количеством тетрагидрофурана, пентан и толуол с каталитическим количеством тетрагидрофурана, предпочтительно гексан и толуол с каталитическим количеством тетрагидрофурана. В вышеописанном способе область температур составляет от приблизительно -78 С до приблизительно -20 С, предпочтительно от приблизительно -78 С до приблизительно -50 С и наиболее предпочтительно от -78 С до приблизительно -70 С. Кроме того понятно, что вышеназванные заместители включают обозначения, перечисленные ниже. Вышеназванные алкильные заместители означают углеводороды с нормальной и разветвленной цепью с длиной, соответствующей таким как метил, этил, изопропил, изобутил,трет-бутил, неопентил, изопентил и так далее. Алкенильные заместители означают вышеописанные алкильные группы, которые модифицируют так, что каждая содержит двойную связь углерод-углерод, такую как винил, аллил и 2-бутенил. Циклоалкил обозначает кольца, составленные из 3 до 8 метиленовых групп, каждая из которых не замещена или замещена другими 13 углеводородными заместителями, и включает,например, циклопропил, циклопентил, циклогексил и 4-метилциклогексил. Алкокси заместитель представляет собой вышеописанную алкильную группу, присоединенную через кислородный мостик. Гетероарильный заместитель представляет собой карбазолил, фуранил, тиенил, пирролил,изотиазолил, имидазолил, изоксазолил, тиазолил, оксазолил, пиразолил, пиразинил, пиридил,пиримидил, пуринил. Гетероциклильный заместитель представляет собой пиридил, пиримидил, тиенил, фуранил, оксазолидинил, оксазолил, тиазолил, изотиазолил, пиразолил, триазолил, имидазолил,имидазолдинил, тиазолидинил, изоксазолил,оксадиазолил, тиадиазолил, морфолинил, пиперидинил, пиперазинил, пирролил или пирролидинил. Защищенный альдегид представляет собой ацеталь, такой как -CH(OC1-C8 алкил), 002056 Коммерчески доступную кислоту 10 восстанавливают ВН 3SМе 2 до спирта 11, который затем переводят в бромид 13 через мезилат 12,используя хлористый мезил, триэтиламин с последующим добавлением NaBr и диметилацетамида (ДМАС). Схема 2,-Ненасыщенный эфир или амид обычно получают в две стадии: 1) реакцией сочетания в положении один кольца А где R3 означает СНО, Z является удаляемой группой, такой как Br, Сl, I, Отрифил, Отозил или Омезил, и R2 означает OR4 или N(R5)2; и 2) превращением альдегида (R3 означает СНО) в требуемый защищенный альдегид (R3 означает СH(OR4)2, a R4 означает C1-C8 алкил). Коммерчески доступный пиридон 1 алкилируют через его дианион бромистым пропилом и продукт затем переводят в бромпиридин 3 а,используя бромирующий реагент, такой как РВr3. Нитрил 3 а затем восстанавливают до альдегида 3, используя диизобутилалюминий гидрид (DIBAL). Альдегид затем подвергают реакции Хекка (Heck) с трет-бутилакрилатом, используя NaOAc, (аллил) 2PdCl2, три-о-толилфосфин, толуол, нагревают с обратным холодильником для получения ненасыщенного эфира 4 а с высоким выходом. Затем ненасыщенный эфир 4 а обрабатывают спиртом (R4 ОН) и водной кислотой, чтобы получить ацеталь-акцептор 5 а. Комерчески доступный 1,2-амининданол ацилируют (пропионилхлорид, К 2 СО 3) для получения амида 8, который затем превращают в ацетонид 9 (2-метоксипропен, пиридиний птолуолсульфонат (PPTS. Затем ацетонид 9 алкилируют бромидом 13, (LiHMDS), чтобы получить 14, последний затем гидролизуют (Н+,МеОН) для получения смеси кислоты и метилового эфира 15. Восстановление (LAH) смеси эфир-кислота дает оптически чистый спирт 16 с высоким выходом. Защита спирта 16 (TBSCl),имидазол) дает бромид 17, предшественник литий-органического соединения 17 а. Схема 3 15 Соединение 17 а и хиральную добавку, такую как спартеин добавляют к ,-ненасыщенному эфиру 5 а при (-78)-(-50 С). Обработка водой дает соединения 6 а и 6b. Смеси соединений 6 а и 6b обрабатывают TBAF или водной кислотой для снятия защиты у силилированного спирта или ацеталя и силилированного спирта. Схема 4 Настоящее изобретение иллюстрируется далее следующими примерами, которые не предназначает для ограничения изобретения. Далее в примерах используют следующие обозначения в данных ЯМР: Получение соединения 1 Соединение 1 является коммерчески доступным исходным материалом, например, см. Получение соединения 2 Диизопропиламин (М.в. 101,19; плотность 0,772; 2,1 экв., 20,54 мл) в 200 мл ТГФ. Охлаждают до -50 С и добавляют н-BuLi (1,6 М в гексане, 2,05 экв., 96 мл), допуская нагревание раствора до -20 С. Выдерживают при 0-3 С в течение 15 мин, затем охлаждают до -30 С и добавляют 1 (М.в. 134,14; 75 ммоль, 10,0 г). Выдерживают при от 0 до 43 С в течение 2 ч. Охлаждают до -50 С и добавляют бромпропан (М.в. 123,00; плотность 1,354, 1,0 экв., 6,8 мл). Нагре 002056 16 вают до 25 С в течение 30 мин и выдерживают 30 мин. Добавляют NH4Cl и CH2Cl2. Высушивают органический слой (сульфат магния), затем выпаривают в вакууме для получения 61% соединения 2. Пример 3 Получение соединения 3 Смешивают 2 (М.в. 176,22, 46 ммоль) и РВr3 (М.в. 270,70, плотность 2,880, 2,5 экв., 10,8 мл) и выдерживают при 160 С, через 2 ч охлаждают до 25 С и добавляют некоторое количество СН 2 Сl2. Медленно гасят добавлением воды. Разделяют слои и водный слой два раза промывают CH2Cl2. Объединяют органические слои и высушивают, (сульфат магния). Концентрируют и выделяют твердое вещество хроматографией на силикагеле (90:10 гексаны:этилацетат) с 61% выходом (М.в. 239,12, 6,60 г). Продукт реакции бромирования (М.в. 239,12, 27,6 ммоль, 6,60 г) растворяют в 66 мл толуола и охлаждают до -42 С. Медленно добавляют DIBAL (1,5 М в толуоле, 2 экв., 37 мл) и выдерживают 1 ч при -42 С. Добавляют НСl(2N, 10 экв., 134 мл) и энергично перемешивают в течение 30 мин. Разбавляют этилацетатом,разделяют слои и водный слой промывают этилацетатом. Объединяют органические слои,высушивают (сульфат магния) и концентрируют в вакууме, чтобы получить 90% соединения 3(М.в. 128,17, плотность 0,875, 2,5 экв., 9,08 мл),Р(о-толил)3 (М.в. 304,38, 10 моль%, 755 мг) и димер аллилпалладий хлорида (М.в. 365,85, 5 моль%, 455 мг). Нагревают с обратным холодильником в течение 24 ч. Охлаждают, фильтруют и выпаривают в вакууме. Выделяют 4 а(М.в. 262,29, 10 моль%, 653 мг) и димер аллилпалладий хлорида (М.в. 365,85, 5 моль%, 455 17 мг). Выдерживают при 140 С в закрытой пробирке в течение 24 ч. Охлаждают, фильтруют и выпаривают в вакууме. Хроматографией на силикагеле (80:20 - гексаны:этилацетат) выделяют 4 в (М.в. 260,34) с выходом 70% (4,52 г). Пример 5 а Получение соединения 5 а Раствор 16,0 г (55,36 ммоль) альдегида 4 а и 1,4 г (5,54 ммоль) PPTS (пиридиний птолуолсульфонат) в 280 мл МеОН кипятят с обратным холодильником в течение 2,5 ч. После охлаждения до комнатной температуры, растворитель выпаривают в вакууме. Остаток растворяют в EtOAc и промывают насыщенным раствором бикарбоната натрия. Концентрирование органического слоя дает 18,2 г требуемого продукта 5 а. Выход 98%. 1 Стадия А. Получение 6 а и 6 в. К раствору 17 (2,23 г, 5,97 ммоль), (-)спартеина (1,37 мл, 5,97 ммоль) и ТГФ (73 мкл,0,896 ммоль) в 20 мл толуола при -78 С добавляют по каплям t-BuLi (1,7 М в гексане, 7,0 мл,11,94 ммоль). Раствор выдерживают при -78 С в течение 30 мин. В течение 10 мин при -78 С по каплям добавляют раствор ненасыщенного тбутилового эфира 5 а (1,0 г, 2,98 ммоль) в 5 мл толуола. После 20-минутного выдерживания при -78 С реакцию гасят водой. Отделяют органическую фазу и высушивают над безводным сульфатом натрия. Очистка сырого продукта хроматографией на силикагеле (EtOAc-гексан,2:98) дает 1,52 г требуемых продуктов 6 а и 6b. Выход 81%. Для основного диастереомера 6b: 1(s, 3H) ppm. Для определения соотношения двух диастереоизомеров 6 а и 6b, удаляют защиту вышеупомянутых соединений обработкой TBAF в ТГФ или либо НСl, либо pTSA в водном ацетоне. Стадия В. Получение 6 с и 6d (Способ А). Раствор 500 мг (0,8 ммоль) вышеупомянутых соединений 6 а и 6b и 0,96 мл TBAF (1,0 М в ТГФ) в 6 мл ТГФ оставляют для перемешивания в течение 4 ч при комнатной температуре. Затем реакционный раствор промывают водой и высушивают над сульфатом натрия. Продукт анализируют методом 1 Н ЯМР. Интегрирование синглетных пиков при 5,42 ppm (основной диастереомер) и 5,38 ppm (минорный диастереомер) используют для определения соотношения двух диастереомеров. Стадия С. Получение 6 е и 6f (Способ В). Раствор 100 мг (0,16 ммоль) вышеупомянутых соединений 6 а и 6b в 3 мл ацетона и 1 мл 5% НСl или 45 мг рТSА в 3 мл ацетона и 1 мл воды оставляют для перемешивания в течение 5 ч при комнатной температуре. Растворители выпаривают в вакууме. Остаток растворяют вEtOAc и промывают 10% карбонатом натрия. Продукт концентрируют и анализируют методом 1 Н ЯМР. Интеграцию синглетных пиков при 10,35 ppm (основной диастереомер) и 10,20ppm (минорный диастереомер) используют для определения соотношения двух диастереомеров. Пример 7 Получение соединения 7 Соединение 7 представляет собой коммерчески доступный исходный материал, например,см., DSM Andeno, Grubbenvorsterweg 8, P.O. Box 81, 5900 АB Venio, The Netherlands. Пример 8Nа 2 СО 3 (М.в. 105,99. 1,5 экв., 8,8 г) растворяют в 82 мл воды. Добавляют раствор (1R, 2S) аминоинданола 7 (М.в. 149,19, 55,0 моль. 8,2 г) в 160 мл СН 2 Сl2. Охлаждают до -5 С и добавляют пропионилхлорид (М.в. 92,53, плотность 1,065,1,3 экв., 6,2 мл). Нагревают до 25 С и выдерживают 1 ч. Разделяют слои и органический слой высушивают (сульфат магния). Концентрируют в вакууме, чтобы получить 8 (М.в. 205,26, 10 г) с выходом 89%. Получение соединения 9 К раствору 8 (М.в. 205,26, 49,3 ммоль, 10 г) в 200 мл ТГФ добавляют пиридиний птолуолсульфонат (PPTS) (М.в. 251,31, 0,16 экв.,2 г), затем метоксипропен (М.в. 72,11, плотность 0,753, 2,2 экв., 10,4 мл). Выдерживают 2 ч при 38 С, затем добавляют водный раствор бикарбоната натрия и этилацетат, органический слой высушивают (сульфат магния). После концентрирования в вакууме образуется 9 (М.в. 245,32, 12,09 г) с количественным выходом. Пример 10 Получение соединения 10 Соединение 10 представляет собой коммерчески доступный исходный материал, например, см., Lancaster Synthesis, P.O. Box 1000,Windham, NH 03087-9977 или Ryan Scientific,Inc., P.O. Box 845, Isle of Palms, SC 29451-0845. Пример 11(сульфат магния) и концентрируют в вакууме для получения соединения 11 (М.в. 217,06, 25,5 г) с выходом 94%. Пример 12-5 С до 0 С, затем вливают в 55 мл воды. Экстрагируют СН 2 Сl2, промывают 1N H2SO4 (40 мл),потом насыщенным солевым раствором. Органические слои высушивают (сульфат магния) и концентрируют в вакууме до получения 12 (М.в. 295,15, 13,23 г) с 95% выходом. Получение соединения 13 12 (М.в. 295,15, 44,8 ммоль, 13,23 г) растворяют в 44 мл диметилацетамида (DMAC). Добавляют NaBr (М.в. 102,90, 2 экв., 9,22 г) и выдерживают в течение 1 ч. Добавляют 88 мл воды и фильтрацией собирают твердое вещество. Кейк (отжатый осадок на фильтре) промывают водой и высушивают отсасыванием. Получают 13 (М.в. 279,96, 12,54 г) с количественным выходом. Пример 14LiHMDS (1,0 М в ТГФ, 1,5 экв., 545 мл) и выдерживают 1,5 ч, нагревая до -50 С. Добавляют 13 (М.в. 279,96, 327 ммоль, 91,3 г) в 300 мл ТГФ и выдерживают при -35 С в течение 1 ч. Нагревают до -10 С в пределах 1 ч, затем выливают в водный NH4Cl. Разделяют слои и экстрагируют этилацетатом. Органический слой высушивают и концентрируют в вакууме для получения сырого 14 (М.в. 444,37). Пример 15 Получение соединения 15 14 в 1 л МеОН, охлаждают до 10 С. Барбoтируют газ НСl в течение 1 ч до тех пор, пока не завершится реакция. Добавляют 2 л H2O и фильтруют продукт. Кейк промывают Н 2O и высушивают, чтобы получить гидроксиамид,который затем растворяют в 1 л МеОН и 1,5 л 6N НСl и нагревают с обратным холодильником в течение ночи. Смесь охлаждают до 25 С и экстрагируют CH2Cl2, чтобы после концентрирования получить соединение 15 (60 г, 64% из бромида 13). Пример 16 Получение соединения 16 15 (смесь кислоты и эфира, 26,88 ммоль) в 150 мл ТГФ при -78 С. Добавляют литийалюминийгидрид (LiAlH4) (1 М в ТГФ, 2 экв., 53,76 мл) в течение 30 мин. Нагревают до 25 С в те 21 чение 1 ч, затем выливают в водный NH4Cl. Добавляют этилацетат, экстрагируют этилацетатом. Органические слои промывают рассолом,высушивают (сульфат магния) и концентрируют в вакууме до получения соединения 16 (М.в. 259,14, 6,62 г) с выходом 95%. Пример 17(М.в. 150,73, 1 экв., 3,85 г). Выдерживают 1 ч при 25C, затем частями заливают водным NаНСО 3 и добавляют этилацетат. Экстрагируют этилацетатом, высушивают органический слой (сульфат магния) и концентрируют в вакууме, до получения с количественным выходом соединения 17 (М.в. 373,41,9,54 г). 1(s, 3H), 3.50 (d, J=5.75, 2H), 2.89 (dd, J=13.31,6.15, 1H), 2.45 (dd, J=13.30, 8.26, 1 Н), 2.03 (m,1 Н), 0.94 (s, 9 Н), 0.92 (d, J=5.01, 3 Н), 0.07 (s,6 Н). 13 С ЯМР (СDСl3): 159.1, 141.6, 133.2, 117.0,115.4, 113.2, 67.4, 55.4, 39.7, 36.3, 26.0 (3 С), 18.4,16.5, -5.3 (2 С). Примеры 18-22 Вслед за способом, описанным в примере 6, перечисленные хиральные добавки дают в результате указанные диастереомерные соотношения соединений 6 а к 6b. 22 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы где представляет а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2,в) 5- или 6-членный карбоциклил, содержащий одну или две двойные связи, по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2,с) арил, где арил определен ниже,C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил,C2-C8 алкинил или C3-C8 циклоалкил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила,СО(СН 2)nСН 3 и CO(CH2)nCH2N(R5)2, арил представляет собой фенил или нафтил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2 алкинила илиC3-C8 циклоалкила,C8 СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2 и, если два заместителя находятся у соседних углеродов,они соединяются с образованием 5- или 6 членного кольца с одним, двумя или тремя гетероатомами, выбранными из О, N и S, назамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы,состоящей из Н, ОН, CO2R6, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2; 23 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Сl, F, I, СF3, N(R5)2,C1-С 8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2C8 алкинила илиR7 независимо представляют H, C1-C8 алкил и арил, когда имеются два заместителя R7 у азота, они могут соединяться с образованием 3- 6-членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН,CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси,C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2; включающему взаимодействие ,-ненасыщенного эфира или амида с литий-органическим соединением R1Li в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы, состоящей из а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диаминоциклогексан или с) где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; иR10 представляет Н, C1-C6 алкил или арил,и апротонного растворителя, где указанный апротонный растворитель выбирают из группы,состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира, бензола,толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78 С до приблизительно 0 С. 2. Способ по п.1, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4. 3. Способ по п.2, в котором область температур находится от приблизительно -78 С до приблизительно -20 С. 4. Способ получения соединения формулы представляет собой а) 5- или 6-членный гетероциклил, содержащий одну, две или три двойные связи, по крайней мере одну двойную связь, и 1, 2 или 3 гетероатома, выбранных из O, N и S, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2,в) 5- или 6-членный карбоциклил, содержащий одну иди две двойные связи, по крайней мере одну двойную связь, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, СО 2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(CH2)nCH2N(R5)2,с) арил, где арил определен ниже,C1-C8 алкокси, C1-C8 алкил, C2-C8 алкенил,C2-C8 алкинил или C3-C8 циклоалкил, незамещенный или замещенный одним, двумя или тремя заместителями, выбранными из группы,состоящей из ОН, CO2R4, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(CН 2)nСН 2N(R5)2,арил представляет собой фенил или нафтил, незамещенный или замещенный одним,двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I,СF3, N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2; и когда два заместителя находятся у соседних углеродов, они могут соединяться с образованием 5 или 6-членного кольца с одним, двумя или тре 25 мя гетероатомами, выбранными из О, N и S,незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из Н, ОН, CO2R6, Br, Cl, F, I, СF3,N(R5)2, C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила,СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2;a) C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил,в) арил или с) гетероарил; гетероарил представляет 5- или 6-членное ароматическое кольцо, содержащее 1, 2 или 3 гетероатома, выбранных из О, N и S, незамещенное или замещенное одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН, CO2R4, Br, Cl, F, I, СF3, N(R5)2,C1-C8 алкокси, C1-C8 алкила, C2-C8 алкенила, C2 алкинила илиR7 независимо представляют Н, C1-C8 алкил и арил, когда имеются два заместителя R7 у азота, они могут соединяться с образованием 3- 6-членного кольца, незамещенного или замещенного одним, двумя или тремя заместителями, выбранными из группы, состоящей из ОН,CO2R4, Br, Cl, F, I, СF3, N(R5)2, C1-C8 алкокси,C1-C8 алкила, C2-C8 алкенила, C2-C8 алкинила или C3-C8 циклоалкила, СО(СН 2)nСН 3 и СО(СН 2)nCH2N(R5)2; включающий стадии 1) взаимодействия ,-ненасыщенного эфира или амида где R3 означает CH(OR4)2,с литий-органическим соединением, R1Li,в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы,состоящей из а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диаминоциклогексан или с) 26 где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет Н, C1-C6 алкил или арил, и апротонного растворителя, где указанный апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира,бензола, толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78 С до приблизительно 0 С, чтобы получить сопряженный продукт; и 2) удаления кислотой защищающей группы для получения соединения формулы I, где R3 является СНО. 5. Способ по п.4, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4. 6. Способ по п.5, в котором область температур составляет от приблизительно -78 С до приблизительно -20 С. 7. Способ получения в присутствии хиральной добавки, где указанную хиральную добавку выбирают из группы,состоящей из а) (-)-спартеин,в) N,N,N',N'-тетра(C1-C6)-алкилтранс-1,2 диаминоциклогексан или где R8 и R9 независимо представляют Н, C1-C6 алкил, C3-C7 циклоалкил или арил, за исключением того, что R8 и R9 одновременно не могут быть Н; и R10 представляет Н, C1-C6 алкил или арил,и апротонного растворителя, где указанный апротонный растворитель выбирают из группы, состоящей из тетрагидрофурана, диэтилового эфира, метил трет-бутилового эфира,бензола, толуола, гексана, пентана и диоксана или смеси названных растворителей, в диапазоне температур от приблизительно -78 С до приблизительно -20 С. 8. Способ по п.7, в котором число эквивалентов литий-органического соединения R1Li составляет от 1 до приблизительно 4. 9. Способ по п.8, в котором область температур находится от приблизительно -78 С до приблизительно -50 С. 10. Способ по п.9, в котором число эквивалентов литий-органического соединения R1Li составляет 1,5 до приблизительно 2,5. 28 11. Способ по п.10, в котором апротонный растворитель представляет собой толуол или смесь толуол-гексан-(каталитический)тетрагидрофуран. 12. Способ по п.11, в котором область температур составляет от приблизительно -78 С до приблизительно -70 С.
МПК / Метки
МПК: A61K 31/44, C07D 213/55, C07B 37/02
Метки: реакцией, ассиметрического, использованием, эндотелина, соединений, присоединения, добавки, промежуточных, получение, сопряженного, хиральной
Код ссылки
<a href="https://eas.patents.su/15-2056-poluchenie-promezhutochnyh-soedinenijj-endotelina-reakciejj-assimetricheskogo-sopryazhennogo-prisoedineniya-s-ispolzovaniem-hiralnojj-dobavki.html" rel="bookmark" title="База патентов Евразийского Союза">Получение промежуточных соединений эндотелина реакцией ассиметрического сопряженного присоединения с использованием хиральной добавки.</a>
Предыдущий патент: Стабильные порошковые препараты, находящиеся в стекловидном состоянии
Следующий патент: Пиразолопиримидиноны, которые ингибируют циклический гуанозин-3′, 5′-монофосфат-фосфодиэстеразу типа 5 (cgmp pde5), для лечения сексуального расстройства
Случайный патент: Рнк с комбинацией из немодифицированных и модифицированных нуклеотидов для экспрессии белков












