Триазины как ингибиторы киназы pi3 и mtor
Номер патента: 20317
Опубликовано: 30.10.2014
Авторы: Дос Сантос Освальдо, Гопалсами Ариамала, Заск Ари, Верхейен Ерун К., Делос Сантос Эфрен Гийермо, Венкатесан Аранапакам М., Аирал-Калоустиан Семирамис, Денхардт Кристоф М., Ричард Дэвид Дж., Каррэн Кевин Дж., Мансур Тарек С., Чэнь Чзэчэн, Ши Мэнсяо, Каплан Джошуа Аарон
Формула / Реферат
1. Соединение формулы I
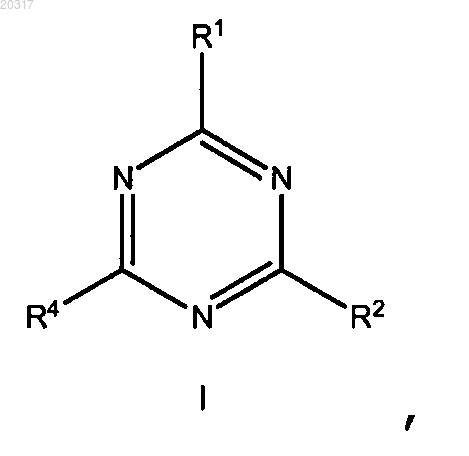
где R1 представляет собой
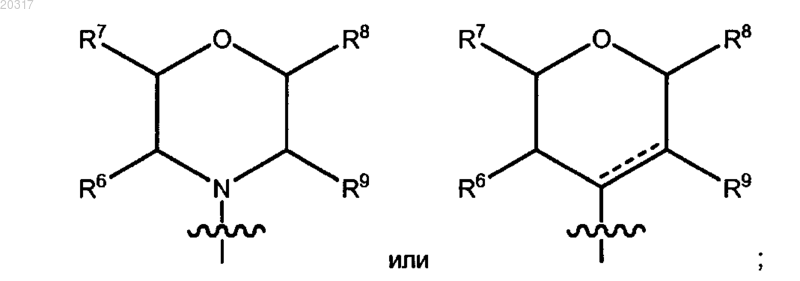
где R6, R7, R8, R9, каждый независимо, представляют собой водород и C1-C6-алкил или
R6 и R9 или R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный 5-6-членный насыщенный цикл, содержащий 0 или 1 атом О;
R2 представляет собой необязательно замещенный C6-C10-арил-NH-CO-R3;
R3 представляет собой OR5, NR5R5, NHR5;
R5 независимо выбирают из C1-C6-алкила; C1-C6-гидроксиалкила; C1-C6-галогеналкила; амино-C1-C6-алкила, насыщенного незамещенного моно-C3-C6-циклоалкила, C4-C9-гетероарила, выбранного из пиридина, тиофена, пиридазина, пиразола, которые могут быть необязательно замещены C1-C6-алкилом, галоген-C1-C6-алкилом, галогеном, пиридином, 4-метилпиперазин-1-илом; C4-C9-гетероциклила, выбранного из пиперазина и пиперидина, которые могут быть необязательно замещены C1-C6-алкилом; фенила, который может быть необязательно замещен C1-C6-алкилом, галогеном, C1-C6-алкокси, C1-C6-гидроксиалкилом, гидрокси, OC1-C6-гидроксиалкилом, С(О)C1-C6-алкилом, галоген-C1-C6-алкилом, (галоген)(гидрокси)C1-C6-алкилом, N(C1-C6-алкил)2, CN, C2-C6-алкенилом, C1-C6-алкил-NH-(C1-C6-алкил)-N(C1-C6-алкил)2, СНО, NO2, NH2, -O-C1-C6-алкил-N(R'R")2, где R' и R", взятые вместе с атомом азота, к которому они присоединены, образуют C3-C6-гетероцикл, выбранный из пиперазина, пирролидина, пиперидина, необязательно замещенных C1-C6-алкилом; -N(R'R")2, где R' и R", взятые вместе с атомом азота, к которому они присоединены, образуют C3-C9-гетероциклил, выбранный из пиперазина, пирролидина, необязательно замещенных C1-C6-алкилом, C3-C6-циклоалкилом, N(C1-C6-алкил)2, NC(О)C1-C6-алкилом; группы фенил-C(O)-NRfRg, где Rf и Rg независимо представляют собой водород, C1-C6-алкил, C1-C6-алкил-N(C1-C6-алкил)2, N(C1-C6-алкил)2 или Rf и Rg, взятые вместе с атомом азота, к которому они присоединены, образуют C3-C9-гетероциклил, выбранный из пиперазина, пиперидина, пирролидина, морфолина, тиоморфолина, 4,4-диоксотиоморфолина, причем упомянутый C3-C9-гетероциклил может быть необязательно замещен C1-C6-алкилом, морфолин-1-илом, пирролидин-1-илом, пиперидин-1-илом, N(C1-C6-алкил)2, пиридином, C1-C6-алкил-N(C1-C6-алкил)2, бензилом, фенилом, C3-C6-циклоалкилом, 3-оксо-8-азабицикло[3.2.1]окт-8-илом;
R4 представляет собой:
а) C1-C6-алкил, необязательно замещенный группой, выбранной из гидрокси, СНО, 1,3-диоксана, пиридина, N(C1-C6-алкил)2; пирролидина, 4-метилпиперазина, пиридин-4-иламина, -амино-(C1-C6-алкил)(N(C1-C6-алкил)2);
b) насыщенный моноциклический C3-C6-циклоалкил;
с) -O-C1-C6-алкил, необязательно замещенный -О-C1-C6-алкилом, NH2, -перидинилом;
d) -O-C1-C6-алкенил;
е) C6-C10-арил, представляющий собой фенил, необязательно замещенный NH2, C1-C6-алкилом,
-NHC(O)NHC1-C6-алкилом, -NHC(О)OC1-C6-алкилом, (пиридин-3-илкарбамоил)амином, (метилкарбамоил)амином, 4-(4-метилпиперидин-1-ил)фенил-NHC(O)NH-, 4-(4-метилпиперазин-1-ил)фенил-NHC(О)NH-;
f) насыщенный или частично ненасыщенный моноциклический C4-C9-гетероциклил, присоединенный к триазиновому фрагменту через атом углерода, выбранный из 3,6-дигидро-2Н-пиран-4-ила и тетрагидро-2Н-пиран-4-ила;
g) насыщенный моноциклический или бициклический C4-C9-гетероциклил, содержащий от 1 до 3 гетероатомов, выбранных из N и О, присоединенный к триазиновому фрагменту через атом азота, которые необязательно замещены C1-C6-алкилом, -C(O)OC1-C6-алкилом, C1-C6-гидроксиалкилом, -S(О)2C1-C6-алкилом, 4-трицикло[3.3.1.13,7]дец-1-илом, -NHC(О)(C1-C6-алкил), бензилокси, пиридин-3-илметилом, С(О)C1-C6-алкилом, -NRaRb, где Ra и Rb независимо представляют собой водород, C1-C6-алкил, бензил, -C1-C6-алкил (N(C1-C6-алкил)2), C1-C6-гидроксиалкил, C1-C6-алкилморфолин, -C(O)OC1-C6-алкил, -C1-C6-алкил(О)NH2, -C1-C6-алкил(О)ОН, -C1-C6-алкил (О)OC1-C6-алкил или Ra и Rb, взятые вместе с атомом азота, к которому они присоединены, образуют 6-членный гетероциклил, выбранный из пиперазина или морфолина;
h) -О-(моно- или бициклический)C5-C9-гетероциклил, включающий от 1 до 3 гетероатомов, выбранных из О и N, необязательно замещенный C1-C6-алкилом, -С(О)OC1-C6-алкилом, -С(О)NC1-C6-алкилом, -S(O)2NH2;
j) -NHRc, где Rc представляет собой C1-C6-алкил, -C1-C6-алкил-C1-C6-алкокси, -C1-C6-алкил(NH2), C1-C6-гидроксиалкил, фенилсульфонил, азетидин, C1-C6-морфолин, C1-C6-пиперидин-4-ил, C3-C6-циклопропилпиперазин-1-ил, 4-метилпиперазин-1-ил, пиперидин-4-ил, 4-(4-метилпиперазин-1-ил)фенил, 4-(пиперазин-1-ил)фенил, (4-(C1-C6-циклоалкил)пиперазин-1-ил;
k) NRdRe, где Rd и Re, оба, представляют собой C1-C6-алкил, C1-C6-гидроксиалкил;
или его фармацевтически приемлемая соль.
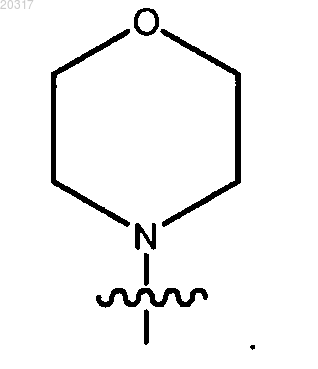
2. Соединение по п.1, в котором R1 представляет собой
3. Соединение по п.1 или 2, в котором R2 представляет собой необязательно замещенный C6-C14-арил-NH-COR3.
4. Соединение по п.3, в котором R2 представляет собой необязательно замещенный фенил-NH-COR3.
5. Соединение по п.4, в котором R3 представляет собой NHR5.
6. Соединение по п.5, в котором R5 представляет собой необязательно замещенный фенил или C1-C9-гетероарил.
7. Соединение по п.6, в котором R5 представляет собой фенил, замещенный -Y-Q.
8. Соединение по п.7, в котором -Y- представляет собой С(O).
9. Соединение по п.8, в котором Q представляет собой 3-10-членный C1-C9-гетероарил, замещенный ди(C1-C6-алкил)амино-.
10. Соединение по любому из пп.1-9, в котором R4 представляет собой
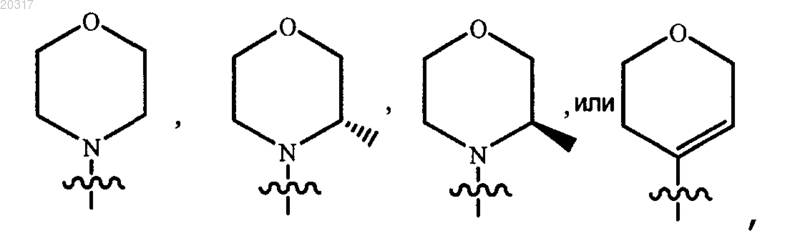
или его фармацевтически приемлемая соль.
11. Соединение по п.10, в котором R4 представляет собой
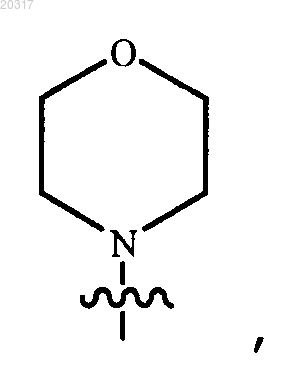
и его фармацевтически приемлемые соли.
12. Соединение, представляющее собой 1-(4-{[4-(диметиламино)пиперидин-1-ил]карбонил}фенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]мочевину, или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция, ингибирующая киназу PI3 и mTOR, включающая соединение по любому из пп.1-12 и фармацевтически приемлемый носитель.
14. Фармацевтическая композиция по п.13, в которой фармацевтически приемлемый носитель подходит для перорального введения и композиция составляет пероральную лекарственную форму.
15. Способ лечения расстройства, связанного с PI3K, или расстройства, связанного с mTOR, включающий введение млекопитающему, нуждающемуся в этом, соединения по любому из пп.1-12 в эффективном количестве, где расстройство, связанное с PI3K, или расстройство, связанное с mTOR, выбирают из множественной миеломы (частный случай лейкемии), рака молочной железы, рака яичников, рака предстательной железы, рака легких, рака толстой кишки, рака головного мозга, рака почек, острого лимфобластного лейкоза, почечно-клеточной карциномы.
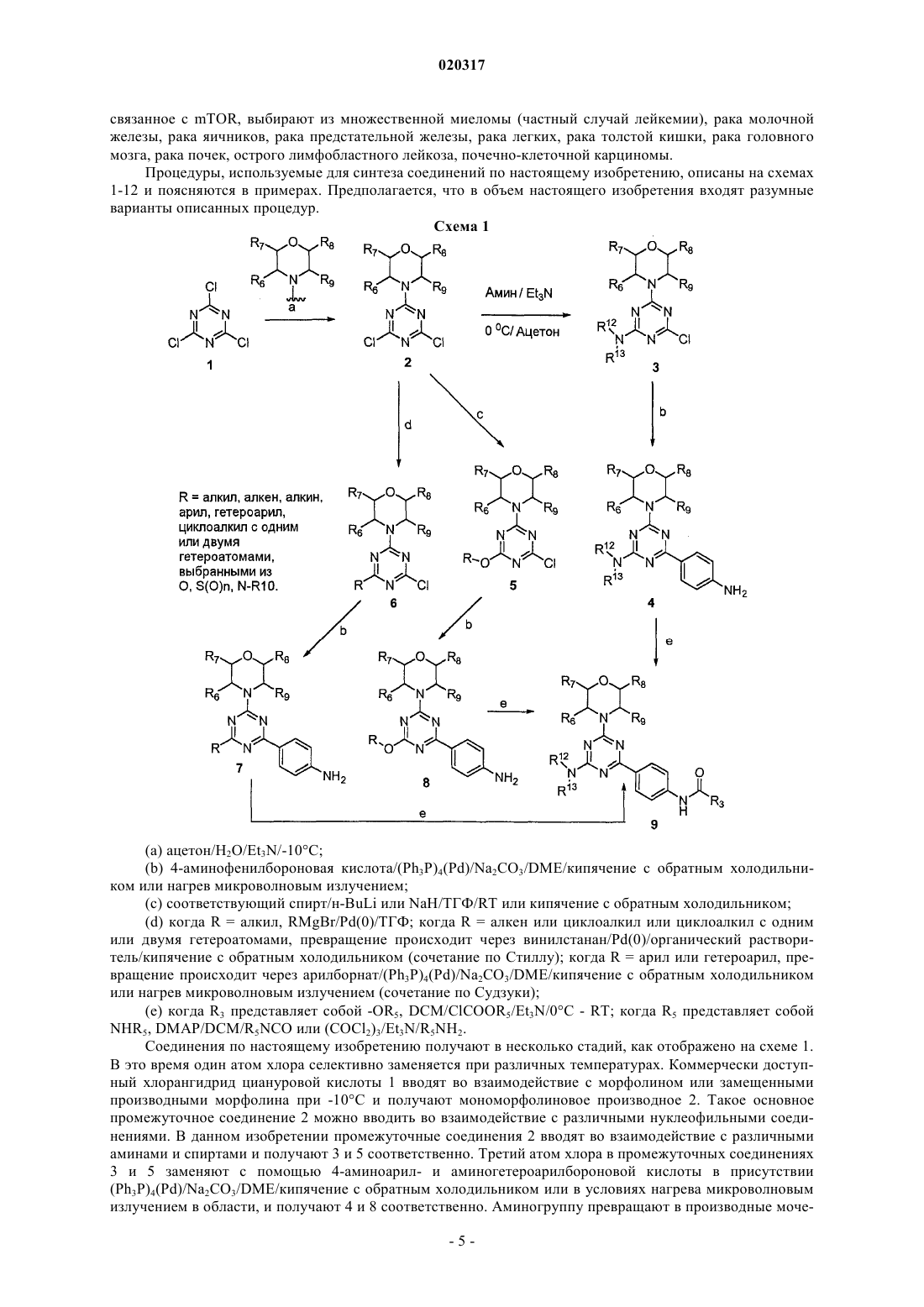
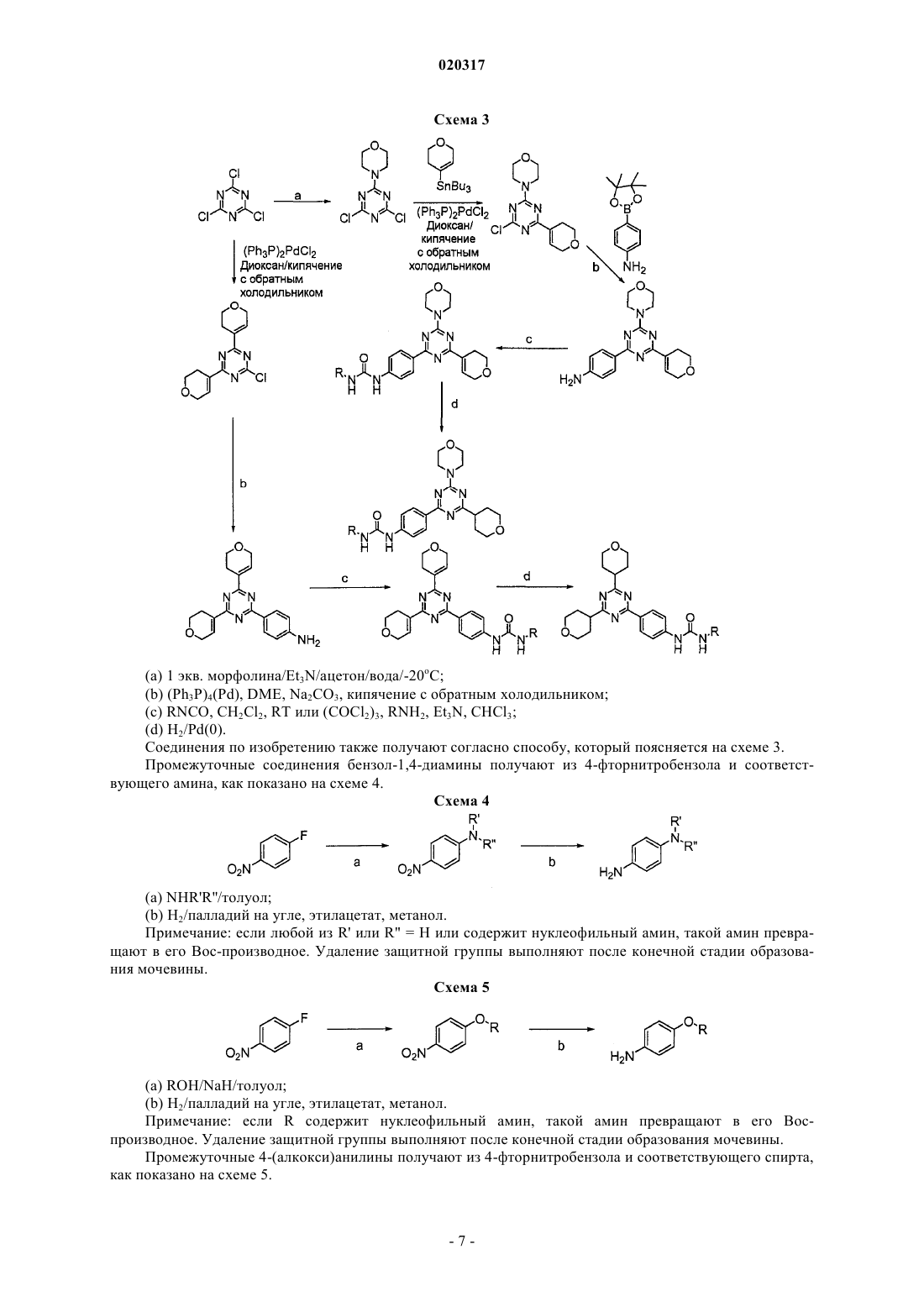
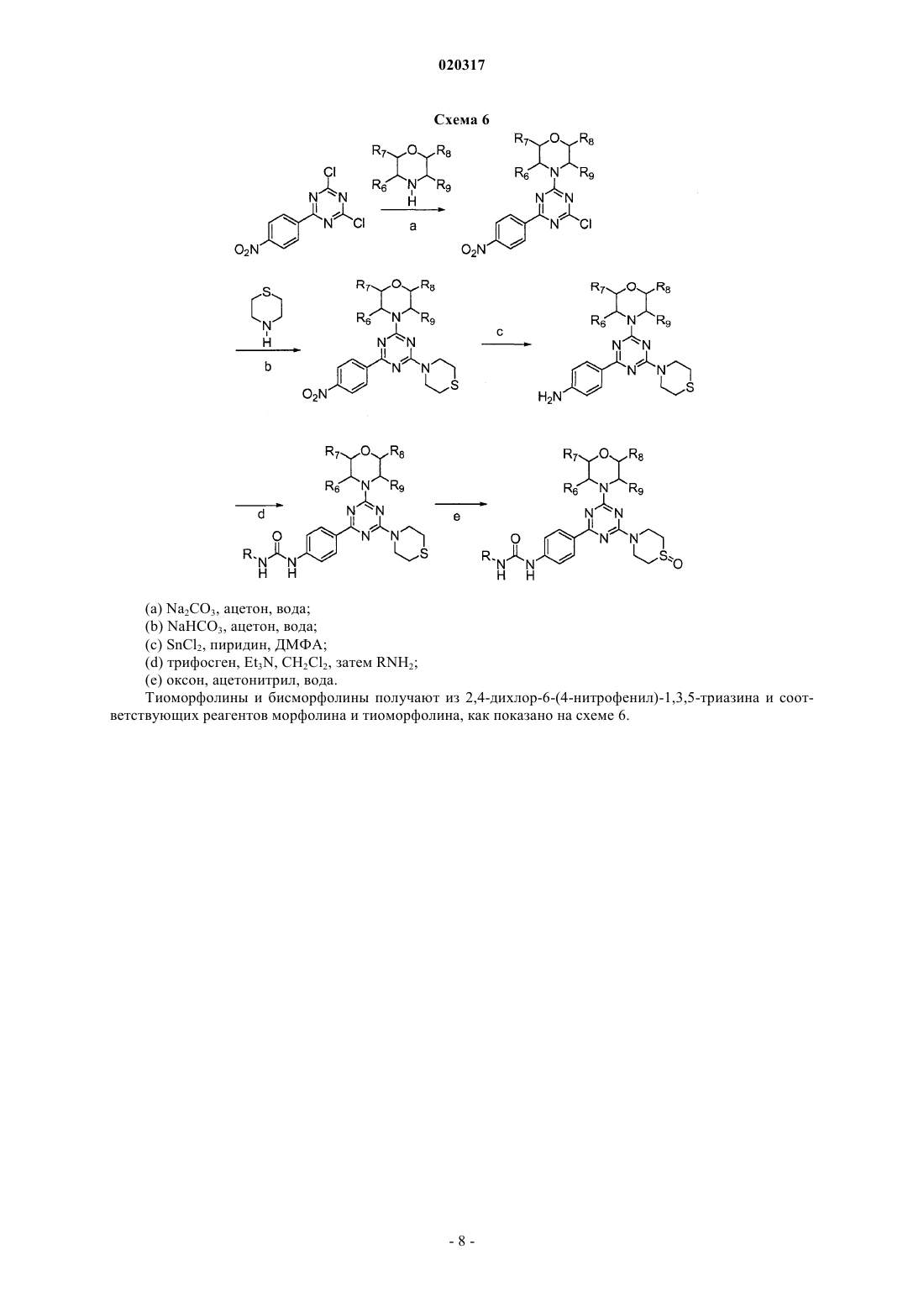
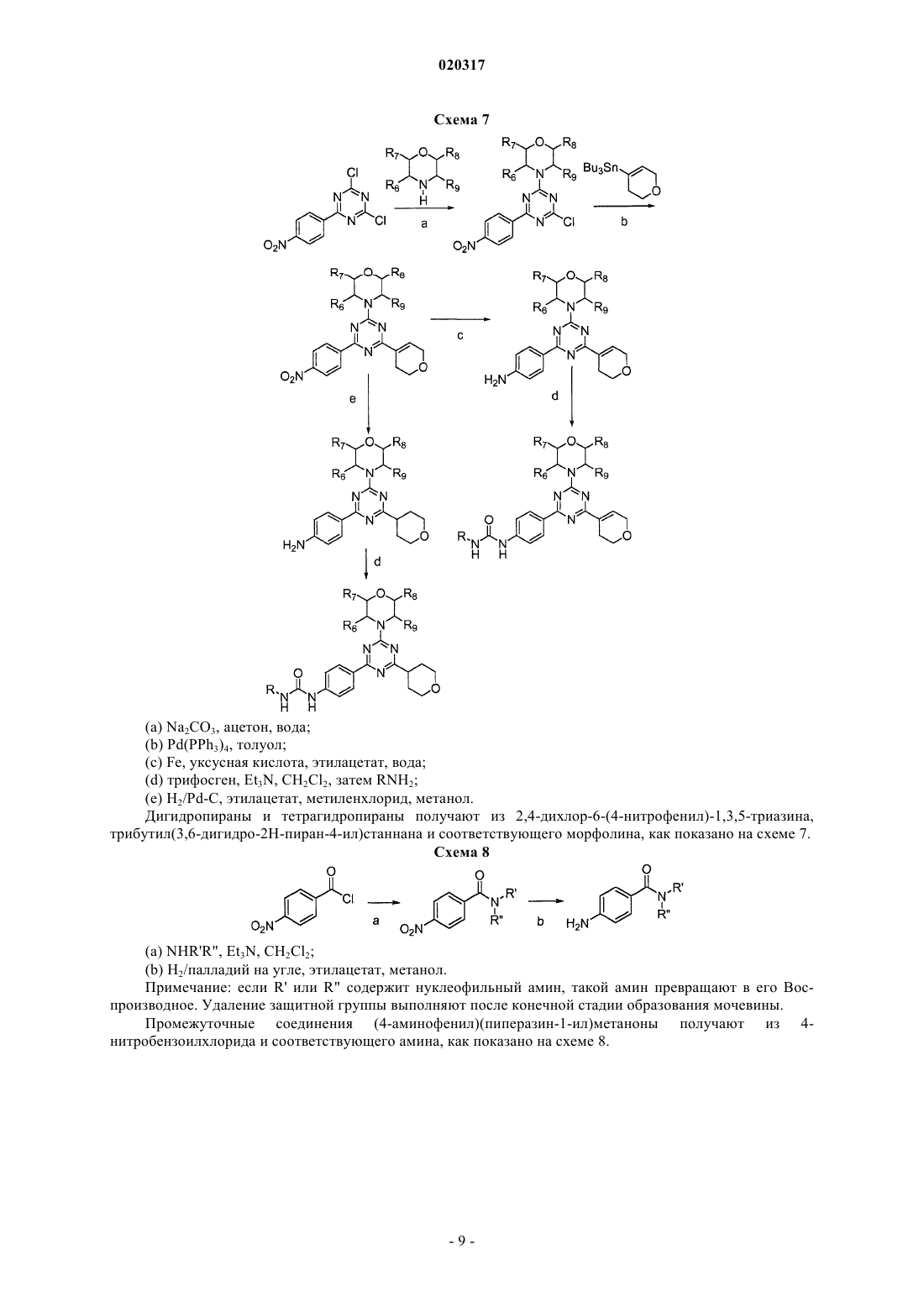
Текст
ТРИАЗИНЫ КАК ИНГИБИТОРЫ КИНАЗЫ PI3 И mTOR Изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям Венкатесан Аранапакам М., Чэнь Чзэчэн, Денхардт Кристоф М., Дос Сантос Освальдо, Делос Сантос Эфрен Гийермо, Заск Ари, Верхейен Ерун К., Каплан Джошуа Аарон,Ричард Дэвид Дж., Аирал-Калоустиан Семирамис, Мансур Тарек С.,Гопалсами Ариамала, Каррэн Кевин Дж., Ши Мэнсяо (US) где значения радикалов R1, R2 и R4 раскрыты в формуле изобретения. Заявленные соединения ингибируют киназу PI3 и mTOR и используются для лечения заболеваний, опосредуемых киназой PI3 и mTOR, таких как различные онкозаболевания. Изобретение также относится к фармацевтическим композициям, включающим соединения формулы I, в том числе для перорального введения. Область техники, к которой относится изобретение Данное изобретение относится к 2,4,6-замещенным [1,3,5]триазинам, в которых один заместитель необязательно замещен морфолино, тетрагидропиранильной или дигидропиранильной группой, которые ингибируют киназу PI3 и mTOR, к способам их получения, к способам лечения с использованием указанных соединений и к содержащим их фармацевтическим композициям. Предпосылки создания изобретения Фосфатидилинозит (далее в данном описании сокращенно "PI") является одним из фосфолипидов в клеточных мембранах. В последние годы стало ясно, что PI играет важную роль во внутриклеточной сигнальной трансдукции. В технике хорошо известно, что (4,5)бифосфат PI (PI(4,5)Р 2 или PIP2) разлагается фосфолипазой С на диацилглицерин и (1,4,5)трифосфат инозита с индуцированием активации протеинкиназы С и мобилизацией внутриклеточного кальция соответственно [M.J. Berridge et al., Nature,312, 315 (1984); Y. Nishizuka, Science, 225, 1365 (1984)]. Фосфатидилинозит-3-киназа (PI3K) представляет собой фермент, который фосфорилирует положение 3 инозитного цикла фосфатидилинозита [D. Whitman et al., Nature, 332, 664 (1988)]. Существует множество подтипов PI3K. В настоящее время идентифицированы три основных подтипа PI3K на основании их субстратной специфичности in vitro, и такие три подтипа обозначаются как класс I (а и b), классII и класс III [В. Vanhaesebroeck, Trend in Biol. Sci., 22, 267 (1997)]. Класс Ia подтипа PI3K на сегодняшний день исследован наиболее полно. В указанном подтипе класа Ia существуют три изоформы (,и ), которые существуют в гетеродимерах каталитической субъединицы в 110 кДа и регуляторных субъединицах в 50-85 кДа. Регуляторные субъединицы содержат домены SH2, которые связываются с фосфорилированными тирозиновыми остатками в рецепторах фактора роста или адаптерных молекулах и посредством этого локализуют PI3K на внутренней клеточной мембране. На внутренней клеточной мембране PI3K превращает PIP2 в PIP3 (фосфатидилинозит-3,4,5 трифосфат), который служит для локализации нижних эффекторов PDK1 и Akt на внутренней клеточной мембране, где происходит активация Akt. Активированный Akt опосредует разнотипный порядок действия, включая ингибирование апоптоза, развитие клеточного цикла, реакцию на передачу сигнала инсулина и клеточную пролиферацию. Подтипы PI3K класса Ia также содержат Ras-связывающие домены(RBD), которые допускают ассоциацию с активированным Ras, обеспечивая другой механизм для локализации PI3K на мембране. Показано, что активированные онкогенные формы рецепторов фактора роста, Ras и даже киназа PI3K аберрантно возбуждают передачу сигнала на пути PI3K/Akt/mTOR, приводящего к трансформации клетки. Как центральный компонент пути передачи сигнала PI3K/Akt/mTOR,PI3K (в особенности, изоформа класса Ia) становится главной терапевтической мишенью при разрабтке противораковых лекарственных средств. Субстратами для PI3K класса I являются PI, PI(4)Р, PI(4,5)Р 2, причем PI(4,5)Р 2 является наиболее благоприятным. PI3K класса I дополнительно разделяют на две группы класса Ia и Ib из-за механизма их активации и ассоциированных регуляторных субъединиц. PI3K класса Ib является р 110, который активируется взаимодействием с рецепторами, соединенными с белком G. Взаимодействие между p110 и рецепторами, соединенными с белком G, опосредуется регуляторными субъединицами в 110, 87 и 84 кДа.PI и PI(4)Р являются известными субстратами для PI3K класса II; PI(4,5)Р 2 не является субстратом для ферментов указанного класса. PI3K класса II включают изоформы PI3K С 2, С 2 и С 2, которые содержат домены С 2 на С-конце, что означает, что их активность регулируется ионами кальция. Субстратом для PI3K класса III является только PI. Механизм активации PI3K класса III не выяснен. Поскольку каждый подтип имеет собственный механизм регуляции активности, возможно, что механизм(ы) активации зависит(ят) от стимулов, специфических для каждого соответствующего класса PI3K. Соединение PI103 (3-(4-(4-морфолинил)пиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил)фенол) ингибирует ферменты PI3Ka и PI3Kg, а также mTOR с величинами IC50 2, 3 и 50-80 нМ соответственно. Введение I.P. дозы указанного соединения мышам моделям рака с ксенотрансплантатами опухолей человека показало активность против ряда моделей опухолей человека, включая глиобластому (PTEN nullU87MG), карциному предстательной железы (РС 3), молочной железы (MDA-MB-468 и MDA-MB-435),толстой кишки (НСТ 116) и карциному яичников (SKOV3 и IGROV-1) (Raynaud et al., Pharmacologickinase isoforms, Cancer Science, 2007, 98: 10, 1638-1642). Длительное пероральное введение ZSTK474 мышиным моделям с ксенотрансплантами рака человека полностью ингибировало рост, который происходит от немелкоклеточного рака легких (А 549), рака предстательной железы (РС-3) и рака толстой кишки (WiDr) при дозе 400 мг/кг (Yaguchi et al., Antitumor Activity of ZSTK474, a New Phosphatidylinositol 3-Kinase Inhibitor, J. Natl. Cancer Inst., 98: 545-556).(2-метил-2-(4-(3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1 Нимидазо[4,5-с]хинолин-1-ил)фенил)пропаннитрил) ингибирует ферменты как PI3Ka и PI3Kg, так иmTOR с величинами IC50 4, 5 и "наномолярными". Испытания на моделях с ксенотрансплантами опухолей человека показали активность против моделей опухолей предстательной железы (РС-3) и глиобластомы (U-87) человека. Клинические испытания проходили в декабре 2006 г. (Verheijen J.С. and Zask A.,Phosphatidylinositol 3-kinase (PI3K) inhibitors as anticancer drugs, Drugs Fut., 2007, 32(6): 537-547). Соединение SF-1126 (пролекарственная форма LY-294002, которое представляет собой 2-(4 морфолинил)-8-фенил-4 Н-1-бензопиран-4-он) является "ингибитором pan-PI3K". Соединение активно на преклинических мышиных моделях рака предстательной железы, молочной железы, яичников, легких,множественной миеломы и рака головного мозга (Verheijen J.С. and Zask A., Phosphatidylinositol 3-kinase(PI3K) inhibitors as anticancer drugs, Drugs Fut., 2007, 32(6): 537-547). Хотя кажется ясным, что ингибирование изоформысущественно для противоопухолевой активности ингибиторов PI3K, неясно, может ли более селективный ингибитор определенной изоформы PI3K привести к меньшим нежелательным биологическим действиям. В последнее время появились сообщения, что изоформы не класса I PI3K (PI3K,и ) имеют способность вызывать онкогенную трансформацию клеток, причем предполагается, что изоформонеспецифические ингибиторы могут представлять усиленный терапевтический потенциал по сравнению со специфическими ингибиторами. Селективность против других родственных киназ также является важным соображением для разработки ингибиторов PI3K. Хотя селективные ингибиторы могут быть предпочтительными с целью избежания нежелательного побочного действия, имеются сообщения, что ингибирование нескольких мишеней на пути PI3K/Akt (например, PI3K и mTOR [мишень рапамицина у млекопитающего]) может привести к большей эффективности. Возможно, что ингибиторы липидкиназ могут соответствовать ингибиторам протеинкиназ, и неселективные ингибиторы также могут быть привнесены в клинику. Мишень рапамицина у млекопитающего mTOR представляет собой белок передачи сигнала клетке,который регулирует реакцию опухолевых клеток на питательные вещества и факторы роста, а также регулирующий кровоснабжение опухоли через действие сосудистого эндотелиального фактора ростаVEGF. Ингибиторы mTOR лишают питания опухолевые клетки и сокращают опухоли путем ингибирования действия mTOR. Все ингибиторы mTOR связываются с mTOR-киназой. Это оказывает по меньшей мере два важных действия. Во-первых, mTOR является нижним медиатором пути PI3K/Akt. Полагают,что путь PI3K/Akt сверхактивируется при многих онкозаболеваниях и может отвечать за превалирующую реакцию различных онкозаболеваний на ингибиторы mTOR. Сверхактивация верхнего пути могла бы естественно вызвать также сверхактивацию mTOR-киназы. Однако в присутствии ингибиторовmTOR такой процесс блокируется. Блокирующее действие предотвращает передачу сигнала mTOR в нижний путь, который контролирует рост клеток. Сверхактивация пути PI3K/Act-киназа часто ассоциируется с мутациями в гене PTEN, который является общим при многих онкозаболеваниях и может помочь предсказать, какие опухоли будут реагировать на ингибиторы mTOR. Вторым основным эффектом ингибирования mTOR является ангиогенез через понижение уровней VEGF. При лабораторных испытаниях обнаружено, что некоторые химиотерапевтические средства более эффективны в присутствии ингибиторов mTOR (George J.N. et al., Cancer Research, 61, 1527-1532, 2001). Другие лабораторные результаты показали, что некоторые клетки рабдомиосаркомы гибнут в присутствии ингибиторов mTOR. Существует три ингибитора mTOR, которые дошли до клинических испытаний. Такими соединениями являются Wyeth's Torisel, также известный как 2-метилпропаноат 42-(3-гидрокси-2(гидроксиметилрапамицина, CCI-779 или Temsirolimus; Novartis' Everolimus, также известный как 42-O(2-гидроксиэтил)рапамицин или RAD 001; и Ariad's AP23573, также известный как 42(диметилфопсиноил)рапамицин. FDA одобрил Torisel для лечения запущенной почечно-клеточной карциномы. Кроме того, Torisel активен на мышиной модели с ксенотрансплатом NOS/SCID острого лимфобластного лейкоза [Teachey et al., Blood, 107(3), 1149-1155, 2006]. Управление США по пищевым продуктам и лекарственным средствам (FAD) 30 марта 2009 г. одобрило Everolimus (афинитор, AFINITOR) для лечения пациентов с запущенной почечно-клеточной карциномой. АР 23573 получил от FDA статус лекарств для лечения редких заболеваний и для ускоренного лечения сарком мягких тканей и костной ткани. Три ингибитора mTOR имеют нелинейные, хотя и воспроизводимые, фармакокинетические профили. Средние величины площади под кривой (AUC) для таких лекарственных средств возрастают меньше,чем в зависимости от дозы. Указанные три соединения являются полусинтетическими производными природного макролидного антибиотика рапамицина. Было бы желательно найти полностью синтетические соединения, которые ингибируют mTOR, которые являются более сильными и проявляют улучшенное фармакокинетическое поведение. Сущность изобретения Изобретение относится к соединениям формулы I где R6, R7, R8, R9, каждый независимо, представляют собой водород и C1-C6-алкил, или R6 и R9 илиR и R8 вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный 5-6-членный насыщенный цикл, содержащий 0 или 1 атом О;R2 представляет собой необязательно замещенный С 6-С 10-арил-NH-CO-R3;R5 независимо выбирают из С 1-С 6-алкила; С 1-С 6-гидроксиалкила; С 1-С 6-галогеналкила; амино-С 1 С 6-алкила, насыщенного незамещенного моно С 3-С 6-циклоалкила, С 4-С 9-гетероарила, выбранного из пиридина, тиофена, пиридазина, пиразола, которые могут быть необязательно замещены С 1-С 6-алкилом,галоген-С 1-С 6-алкилом, галогеном, пиридином, 4-метилпиперазин-1-илом; С 4-С 9-гетероциклила, выбранного из пиперазина и пиперидина, которые могут быть необязательно замещены С 1-С 6-алкилом; фенила,который может быть необязательно замещен С 1-С 6-алкилом, галогеном, С 1-С 6-алкокси, С 1-С 6 гидроксиалкилом, гидрокси, OC1-С 6-гидроксиалкилом, С(О)С 1-С 6-алкилом, галоген-С 1-С 6-алкилом, (галоген)(гидрокси)С 1-С 6-алкилом, N(С 1-С 6-алкил)2, CN, С 2-С 6-алкенилом, С 1-С 6-алкил-NH-(С 1-С 6-алкил)N(С 1-С 6-алкил)2, СНО, NO2, NH2, -O-С 1-С 6-алкил-N(R'R")2, где R' и R", взятые вместе с атомом азота, к которому они присоединены, образуют С 3-С 6-гетероцикл, выбранный из пиперазина, пирролидина, пиперидина, необязательно замещенных С 1-С 6-алкилом; -N(R'R")2, где R' и R", взятые вместе с атомом азота, к которому они присоединены, образуют С 3-С 9-гетероциклил, выбранный из пиперазина, пирролидина, необязательно замещенных C1-С 6-алкилом, С 3-С 6-бициклоалкилом, N(С 1-С 6-алкил)2, NC(О)С 1-С 6 алкилом; группы фенил-С(О)-NRfRg, где Rf и Rg независимо представляют собой водород, С 1-С 6-алкил,С 1-С 6-алкил-N(С 1-С 6-алкил)2, N(С 1-С 6-алкил)2 или Rf и Rg, взятые вместе с атомом азота, к которому они присоединены, образуют С 3-С 9-гетероциклил, выбранный из пиперазина, пиперидина, пирролидина,морфолина, тиоморфолина, 4,4-диоксо-тиоморфолина, причем упомянутый С 3-С 9-гетероциклил может быть необязательно замещен C1-С 6-алкилом, морфолин-1-илом, пирролидин-1-илом, пиперидин-1-илом,N(С 1-С 6-алкил)2, пиридином, С 1-С 6-алкил-N(С 1-С 6-алкил)2, бензилом, фенилом, С 3-С 6-циклоалкилом, 3 оксо-8-азабицикло[3.2.1]окт-8-илом;f) насыщенный или частично ненасыщенный моноциклический С 4-С 9-гетероциклил, присоединенный к триазиновому фрагменту через атом углерода, выбранный из 3,6-дигидро-2 Н-пиран-4-ила и тетрагидро-2 Н-пиран-4-ила;g) насыщенный моноциклический или бициклический С 4-С 9-гетероциклил, содержащий от 1 до 3 гетероатомов, выбранных из N и О, присоединенный к триазиновому фрагменту через атом азота, которые необязательно замещены С 1-С 6-алкилом, -C(O)OC1-C6-алкилом, С 1-С 6-гидроксиалкилом, -S(О)2 С 1 С 6-алкилом, 4-трицикло[3.3.1.13,7]дец-1-илом, -NHC(O)(С 1-С 6-алкил), бензилокси, пиридин-3 илметилом, С(О)С 1-С 6-алкилом, -NRaRb, где Ra и Rb независимо представляют собой водород, С 1-С 67 алкил, бензил, -С 1-С 6-алкил(N(С 1-С 6-алкил)2), С 1-С 6-гидроксиалкил, С 1-С 6-алкилморфолин, -C(O)OC1-C6 алкил, -С 1-С 6-алкил(О)NH2, -С 1-С 6-алкил(O)ОН, -С 1-С 6-алкил(O)OC1-C6-алкил или Ra и Rb, взятые вместе с атомом азота, к которому они присоединены, образуют 6-членный гетероциклил, выбранный из пиперазина или морфолина;k) NRdRe, где Rd и Re, оба, представляют собой С 1-С 6-алкил, С 1-С 6-гидроксиалкил,и их фармацевтически приемлемым солям. В предпочтительном варианте изобретение относится к соединениям формулы I, в которых R1 представляет собой В более предпочтительном варианте изобретение относится к соединениям формулы I, в которыхR2 представляет собой необязательно замещенный C6-C14-арил-NH-COR3. В еще более предпочтительном варианте изобретение относится к соединениям формулы I, в которых R2 представляет собой необязательно замещенный фенил-NH-COR3. В еще более предпочтительном варианте изобретение относится к соединениям формулы I, в которых R3 представляет собой NHR5. В наиболее предпочтительном варианте изобретение относится к соединениям формулы I, в которых R5 представляет собой необязательно замещенный фенил или C1-C9-гетероарил или R5 представляет собой фенил, замещенный -Y-Q. В предпочтительном варианте изобретение относится к соединениям формулы I, в которых -Yпредставляет собой С(О). В более предпочтительном варианте изобретение относится к соединениям формулы I, в которых Q представляет собой 3-10-членный C1-C9-гетероарил, замещенный ди(C1-C6-алкил)амино-. В еще более предпочтительном варианте изобретение относится к соединениям формулы I, в которых в котором R4 представляет собой В отдельном частном варианте изобретение относится к соединениям формулы I, в которых R4 представляет собой Настоящее изобретение также раскрывает соединение, представляющее собой 1-(4-[4(диметиламино)пиперидин-1-ил]карбонилфенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]мочевину и его фармацевтически приемлемую соль. Кроме того, настоящее изобретение относится к фармацевтической композиции, ингибирующей киназу PI3 и mTOR, включающей соединение формулы I и фармацевтически приемлемый носитель. В частном варианте изобретение относится к фармацевтической композиции, в которой фармацевтически приемлемый носитель подходит для перорального введения, и композиция составляет пероральную лекарственную форму. Настоящее изобретение также относится к способу лечения расстройства, связанного с PI3K, или расстройства, связанного с mTOR, включающему введение млекопитающему, нуждающемуся в этом,соединения формулы I в эффективном количестве, где расстройство, связанное с PI3K, или расстройство,-4 020317 связанное с mTOR, выбирают из множественной миеломы (частный случай лейкемии), рака молочной железы, рака яичников, рака предстательной железы, рака легких, рака толстой кишки, рака головного мозга, рака почек, острого лимфобластного лейкоза, почечно-клеточной карциномы. Процедуры, используемые для синтеза соединений по настоящему изобретению, описаны на схемах 1-12 и поясняются в примерах. Предполагается, что в объем настоящего изобретения входят разумные варианты описанных процедур. Схема 1(b) 4-аминофенилбороновая кислота/(Ph3P)4(Pd)/Na2CO3/DME/кипячение с обратным холодильником или нагрев микроволновым излучением;(d) когда R = алкил, RMgBr/Pd(0)/ТГФ; когда R = алкен или циклоалкил или циклоалкил с одним или двумя гетероатомами, превращение происходит через винилстанан/Pd(0)/органический растворитель/кипячение с обратным холодильником (сочетание по Стиллу); когда R = арил или гетероарил, превращение происходит через арилборнат/(Ph3P)4(Pd)/Na2CO3/DME/кипячение с обратным холодильником или нагрев микроволновым излучением (сочетание по Судзуки);NHR5, DMAP/DCM/R5NCO или (COCl2)3/Et3N/R5NH2. Соединения по настоящему изобретению получают в несколько стадий, как отображено на схеме 1. В это время один атом хлора селективно заменяется при различных температурах. Коммерчески доступный хлорангидрид циануровой кислоты 1 вводят во взаимодействие с морфолином или замещенными производными морфолина при -10 С и получают мономорфолиновое производное 2. Такое основное промежуточное соединение 2 можно вводить во взаимодействие с различными нуклеофильными соединениями. В данном изобретении промежуточные соединения 2 вводят во взаимодействие с различными аминами и спиртами и получают 3 и 5 соответственно. Третий атом хлора в промежуточных соединениях 3 и 5 заменяют с помощью 4-аминоарил- и аминогетероарилбороновой кислоты в присутствии(Ph3P)4(Pd)/Na2CO3/DME/кипячение с обратным холодильником или в условиях нагрева микроволновым излучением в области, и получают 4 и 8 соответственно. Аминогруппу превращают в производные моче-5 020317 вины двумя различными процедурами, в зависимости от доступности исходного материала. Некоторые соединения, приведенные в качестве примеров в данном описании, превращают в производные мочевины взаимодействием 4 или 8 с соответствующим образом замещенными изоцианатами. Многие из производных мочевины, указанные в данном описании, получают взаимодействием промежуточных соединений 4 или 8 с трифосгеном/Et3N и соответствующим образом замещенными первичными аминами. Соответствующие производные карбаматы получают взаимодействием промежуточных соединений 4 или 8 с соответствующим образом замещенными хлорформиатами. Промежуточные соединения 2 также используют для получения производных 6, где R представляет собой алкил, алкен, алкин, арил или гетероарил. Взаимодействие 6 с соответствующим образом замещенным алкилом вводит алкильную или циклоалкильную группы в промежуточное соединение 6 или циклоалкилмагнийбромид или соответствующий соответствующим образом замещенный цинкоорганический реагент. Алкены можно ввести в соединение 6 соответствующим образом замещенными производными винилолова с Pd-катализатором. Подобным образом, арильные или гетероарильные заместители можно ввести взаимодействием или с соответствующей бороновой кислотой (сочетание по Судзуки) или с арил- или гетероарилмагнийбромидом. Алкины можно ввести взаимодействием соединения 6 с соответствующим образом замещенным алкином иPd(0). Введенные алкин и алкен также можно функционально превратить в другие производные, такие как с алкильными, спиртовыми или аминогруппами. Подробные процедуры описаны в экспериментальном разделе для каждого получаемого производного. Схема 2(a) ацетон/H2O/Et3N/ от -10 С до комнатной температуры. Некоторые соединения по изобретению получают способами, отображенными на схеме 2.(d) H2/Pd(0). Соединения по изобретению также получают согласно способу, который поясняется на схеме 3. Промежуточные соединения бензол-1,4-диамины получают из 4-фторнитробензола и соответствующего амина, как показано на схеме 4. Схема 4(b) Н 2/палладий на угле, этилацетат, метанол. Примечание: если любой из R' или R" = Н или содержит нуклеофильный амин, такой амин превращают в его Вос-производное. Удаление защитной группы выполняют после конечной стадии образования мочевины. Схема 5(b) Н 2/палладий на угле, этилацетат, метанол. Примечание: если R содержит нуклеофильный амин, такой амин превращают в его Воспроизводное. Удаление защитной группы выполняют после конечной стадии образования мочевины. Промежуточные 4-(алкокси)анилины получают из 4-фторнитробензола и соответствующего спирта,как показано на схеме 5.(e) оксон, ацетонитрил, вода. Тиоморфолины и бисморфолины получают из 2,4-дихлор-6-(4-нитрофенил)-1,3,5-триазина и соответствующих реагентов морфолина и тиоморфолина, как показано на схеме 6.(e) H2/Pd-C, этилацетат, метиленхлорид, метанол. Дигидропираны и тетрагидропираны получают из 2,4-дихлор-6-(4-нитрофенил)-1,3,5-триазина,трибутил(3,6-дигидро-2 Н-пиран-4-ил)станнана и соответствующего морфолина, как показано на схеме 7. Схема 8(b) Н 2/палладий на угле, этилацетат, метанол. Примечание: если R' или R" содержит нуклеофильный амин, такой амин превращают в его Воспроизводное. Удаление защитной группы выполняют после конечной стадии образования мочевины. Промежуточные соединения (4-аминофенил)(пиперазин-1-ил)метаноны получают из 4 нитробензоилхлорида и соответствующего амина, как показано на схеме 8.(d) трифосген, Et3N, CH2Cl2, затем RNH2. Соединения 1-(4-(4-(3-окса-8-азабицикло[3.2.1]октан-8-ил)-6-R)-3-метилморфолино)-1,3,5 триазин-2-ил)фенил)-3-мочевины получают из 2,4-дихлор-6-(4-нитрофенил)-1,3,5-триазина, (R)-3 метилморфолина, гидрохлорида 3-окса-8-азабицикло[3.2.1]октана и соответствующего амина, как показано на схеме 9. Получение как (6S'), так и (6R') изомеров трет-бутил-6-гидрокси-3-окса-8-азабицикло[3.2.1]октан-8 карбоксилата из трет-бутил-1 Н-пиррол-1-карбоксилата показано на схеме 10.R = алкил, арил или гетероарил. Соединения (6S')-трет-бутил-6-амино-3-окса-8-азабицикло[3.2.1]октан-8-карбоксилат и (6R')-третбутил-6-фтор-6-(алкил, арил или гетероарил)-3-окса-8-азабицикло[3.2.1]октан-8-карбоксилат можно получить из трет-бутил-6-оксо-3-окса-8-азабицикло[3.2.1]октан-8-карбоксилата (схема 10) и соответствующего амина или реактива Гриньяра, как показано на схеме 11. Схема 12. Соединения формулы I можно получить из хлорангидрида циануровой кислоты, как показано на схеме 12. Определения. Приведенные далее определения используют в связи с соединениями по настоящему изобретению,если контекст не указывает на иное. Вообще, число атомов углерода, присутствующих в данной группе,определяется "Сх-Су", где х и у являются нижним и верхним пределами соответственно. Например, группа, определяемая как "C1-C6", содержит от 1 до 6 атомов углерода. Число атомов углерода, используемое в определениях в данном описании, относится к углеродной цепи и углеродным ответвлениям, но не включает атомы углерода заместителей, таких как заместители алкокси и т.п. Если не указано иное, номенклатура заместителей, которые не определены в данном описании точно, представляется названием слева направо конечной части функциональной группы, за которой следует соседняя к точке присоединения функциональная группа. Например, название заместителя "арилалкилоксикарбонил" относится к группе (C6-C14-арил)-(C1-C6-алкил)-O-С(О)-. Термины, которые не определены в данном описании, имеют значения, которые им обычно придают специалисты в данной области техники."Ацил-" относится к группе, имеющей прямую, разветвленную или циклическую конфигурацию или их сочетание, присоединенную к остальной структуре через карбонильную функциональную группу. Такие группы могут быть насыщенными или ненасыщенными, алифатическими или ароматическими и карбоциклическими или гетероциклическими. Примеры группы C1-C6-ацил- включают ацетил-, бензоил-,никотиноил-, пропионил-, изобутирил-, оксалил- и т.п. Термин "низший ацил" относится к ацильным группам, содержащим один-четыре атома углерода. Ацильная группа может быть незамещенной или замещенной одной или несколькими следующими группами: галоген, H2N-, (C1-C6-алкил)амино-, ди(C1C6-алкил)амино-, (C1-C6-алкил)С(О)N(C1-C3-алкил)-, C1-C6)алкил)карбоксамидо-, HC(O)NH-, H2NC(O)-,(C1-C6-алкил)NHC(O)-, ди(C1-C6-алкил)NHC(O)-, -CN, гидроксил, C1-C6-алкокси-, C1-C6-алкил-, HO2C-,(C1-C6-алкокси)карбонил-, (C1-C6-алкил)С(О)-, C6-C14-арил-, C1-C9-гетероарил- или C3-C8-циклоалкил-."Алкил-" относится к углеводородной цепи, которая может быть линейной цепью или разветвленной цепью, содержащей указанное число атомов углерода, например, C1-C12-алкильная группа может иметь от 1 до 12 (включительно) атомов углерода. Примеры C1-C6-алкильных групп включают метил,этил, пропил, бутил, пентил, гексил, изопропил, изобутил, втор-бутил, трет-бутил, изопентил, неопентил и изогексил и другие группы. Примеры C1-C8-алкильных групп включают, но не ограничиваются пере- 12020317 численным, метил, пропил, пентил, гексил, гептил, 3-метилгекс-1-ил, 2,3-диметилпент-2-ил, 3-этилпент 1-ил, октил, 2-метилгепт-2-ил, 2,3-диметилгекс-1-ил и 2,3,3-триметилпент-1-ил. Алкильная группа может быть незамещенной или замещенной одной или несколькими группами, включая галоген, -NH2, (C1-C6 алкил)NH, (C1-C6-алкил)(C1-C6-алкил)N-, -N(C1-C3-алкил)С(О)(C1-C6-алкил), -NHC(O)(C1-C6-алкил),-NHC(O)H, -C(O)NH2, -C(O)NH(C1-C6-алкил), -С(О)N(C1-C6-алкил)(C1-C6-алкил), -CN, гидроксил, C1-C6 алкокси, C1-С 6-алкил, -С(О)ОН, -С(О)О(C1-C6-алкил), -C(O)(C1-C6-алкил), C6-C14-арил, C1-C9-гетероарил,C3-C8-циклоалкил,C1-C6-галогеналкил,C1-C6-аминоалкил,-ОС(О)(C1-C6-алкил),C1-C6 карбоксиамидоалкил и -NO2. Термин "алкадиенил" относится к линейной или разветвленной цепи ненасыщенного углеводорода,которая содержит по меньшей мере две двойных связи и может существовать в Е- или Z-конформации. Примеры C4-C6-алкадиенильной группы включают, но не ограничиваются перечисленным, бута-1,3 диенил, бута-2,3-диенил, изопренил, пента-1,3-диенил и пента-2,4-диен-2-ил. Термин "алкадиинил" относится к линейной или разветвленной цепи ненасыщенного углеводорода,содержащей по меньшей мере две тройных связи. Примеры C4-C6-алкадиинильной группы включают, но не ограничиваются перечисленным, бута-1,3-диинил, бута-2,3-диинил, пента-1,3-диинил и пента-2,4 диинил. Термин "алкенил" относится к линейной или разветвленной цепи ненасыщенного углеводорода, которая содержит по меньшей мере одну двойную связь и может существовать в Е- или Z-конформации. Примеры C2-C8-алкенильной группы включают, но не ограничиваются перечисленным, этилен, пропилен, 1-бутилен, 2-бутилен, изобутилен, втор-бутилен, 1-пентен, 2-пентен, изопентен, 1-гексен, 2-гексен,3-гексен, изогексен, 1-гептен, 2-гептен, 3-гептен, 1-октен, 2-октен, 3-октен и 4-октен. Примеры C2-C6 алкенильной группы включают, но не ограничиваются перечисленным, этилен, пропилен, 1-бутилен, 2 бутилен, изобутилен, втор-бутилен, 1-пентен, 2-пентен, изопентен, 1-гексен, 2-гексен, 3-гексен и изогексен. Примеры C3-C8-алкенильной группы включают, но не ограничиваются перечисленным, пропилен, 1 бутилен, 2-бутилен, изобутилен, втор-бутилен, 1-пентен, 2-пентен, изопентен, 1-гексен, 2-гексен, 3 гексен, изогексен, 1-гептен, 2-гептен, 3-гептен, 1-октен, 2-октен, 3-октен и 4-октен. Примеры C3-C6 алкенильной группы включают, но не ограничиваются перечисленным, проп-2-енил, бут-3-енил, бут-2 енил, 2-метилаллил, пент-4-енил и гекс-5-енил. Алкенильная группа может быть незамещенной или замещенной одной или несколькими группами, включая галоген, -NH2, (C1-C6-алкил)NH-, (C1-C6 алкил)(C1-C6-алкил)N-, -N(C1-С 3-алкил)С(О)(C1-C6-алкил), NHC(O)(C1-C6-алкил), -NHC(O)H, -C(O)NH2,-С(O)NH(C1-C6-алкил), -С(О)N(C1-C6-алкил)(C1-C6-алкил), -CN, гидроксил, C1-C6-алкокси, C1-C6-алкил,-С(О)ОН, -С(О)О(C1-C6-алкил), -С(О)(C1-C6-алкил), C6-C14-арил, C1-C9-гетероарил и C3-C8-циклоалкил. Термин "алкинил" относится к линейной или разветвленной цепи ненасыщенного углеводорода,содержащей по меньшей мере одну тройную связь. Примеры C2-C6-алкинильной группы включают, но не ограничиваются перечисленным, ацетилен, пропин, 1-бутин, 2-бутин, изобутин, втор-бутин, 1-пентин,2-пентин, изопентин, 1-гексин, 2-гексин, 3-гексин и изогексин. Примеры C3-C6-алкинильной группы включают, но не ограничиваются перечисленным, проп-2-инил, бут-3-инил, бут-2-инил, пент-4-инил и гекс-5-инил. Примеры C3-C8-алкинильной группы включают, но не ограничиваются перечисленным,проп-2-инил, бут-3-инил, бут-2-инил, пент-4-инил, гекс-5-инил, гепт-3-инил, 2-метилгекс-3-инил, окт-4 инил и 2-метилгепт-3-инил. Алкинильная группа может быть незамещенной или замещенной одной или несколькими группами, включая галоген, -NH2, (C1-C6-алкил)NH, (C1-C6-алкил)(C1-C6-алкил)N-, -N(C1C3-алкил)С(O)(C1-C6-алкил), -NHC(О)(C1-C6-алкил), -NHC(O)H, -C(O)NH2, -С(O)NH(C1-C6-алкил),-С(О)N(C1-C6-алкил)(C1-C6-алкил), -CN, гидроксил, C1-C6-алкокси, C1-C6-алкил, -С(О)ОН, -C(O)O(C1-C6 алкил), -С(О)(C1-C6-алкил), C6-C14-арил, C1-C9-гетероарил и C3-C8-циклоалкил."Алкокси-" относится к группе R-O-, где R представляет собой алкильную группу, имеющую значения, указанные выше. Примеры C1-C6-алкоксигрупп включают, но не ограничиваются перечисленным,метокси, этокси, н-пропокси, 1-пропокси, н-бутокси и трет-бутокси. Алкоксигруппа может быть незамещенной или замещенной одной или несколькими группами из следующих: галоген, гидроксил, C1-C6 алкокси-, -NH2, (C1-C6-алкил)амино-, ди(C1-C6-алкил)амино-, (C1-C6-алкил)С(О)N(C1-C3-алкил)-, (C1-C6 алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(O)-, ди(C1-C6-алкил)NC(О)-, NC-,HO2C-, (C1-C6-алкокси)карбонил-, (C1-C6-алкил)СО-, C6-C14-арил, C1-C9-гетероарил, C3-C8-циклоалкил,C1-C6-галогеналкил, амино (C1-C6-алкил)-, (C1-C6-алкил)карбоксил-, C1-C6-карбоксиамидоалкил- или"(Алкокси)карбонил-" относится к группе алкил-О-С(О)-. Примеры (C1-C6-алкокси)карбонильных групп включают, но не ограничиваются перечисленным, метоксикарбонил, этоксикарбонил, нпропоксикарбонил, 1-пропоксикарбонил, н-бутоксикарбонил и трет-бутоксикарбонил. (Алкокси)карбонильная группа может быть незамещенной или замещенной одной или несколькими группами из следующих: галоген, гидроксил, -NH2, (C1-C6-алкил)амино-, ди(С 1-С 6-алкил)амино-, (C1-C6 алкил)С(О)N(C1-C3-алкил)-, (С 1-С 6-алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(O)-,ди(C1-C6-алкил)NC(О)-, NC-, C1-C6-алкокси-, HO2C-, (С 1-С 6-алкокси)карбонил-, (C1-C6-алкил)СО-, C6-C14 арил, C1-C9-гетероарил, C3-C8-циклоалкил, C1-C6-галогеналкил, амино (C1-C6-алкил)-, (C1-C6 алкил)карбоксил-, C1-C6-карбоксиамидоалкил- или O2N-."(Алкил)амидо-" относится к группе -C(O)NH-, когда атом азота указанной группы присоединяется к C1-C6-алкильной группе, имеющей значения, указанные выше. Характерные примеры (C1-C6 алкил)амидогруппы включают, но не ограничиваются перечисленным, -C(O)NHCH3, -C(O)NHCH2CH3,-C(O)NHCH2CH2CH3, -C(O)NHCH2CH2CH2CH3, -C(O)NHCH2CH2CH2CH2CH3, -C(O)NHCH(CH3)2,-C(O)NHCH2CH(CH3)2, -C(O)NHCH(CH3)CH2CH3, -C(O)NH-C(CH3)3 и -C(O)NHCH2C(CH3)3."(Алкил)амино-" относится к группе -NH, причем атом азота указанной группы присоединен к алкильной группе, имеющей значения, указанные выше. Характерные примеры (C1-С 6-алкил)аминогруппы включают, но не ограничиваются перечисленным, CH3NH-, CH3CH2NH-, CH3CH2CH2NH-,CH3CH2CH2CH2NH-, (CH3)2CHNH-, (CH3)2CHCH2NH-, CH3CH2CH(CH3)NH- и (CH3)3CNH-. (Алкил)аминогруппа может быть незамещенной или замещенной одной или несколькими группами из следующих: галоген, H2N-, (C1-C6-алкил)амино-, ди(C1-C6-алкил)амино-, (C1-C6-алкил) С(О)N(C1-C3-алкил)-,(C1-C6-алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(О)-, ди(С 1-С 6-алкил)NC(O)-,NC-, гидроксил, C1-C6-алкокси-, C1-C6-алкил-, HO2C-, (C1-C6-алкокси)карбонил-, (C1-C6-алкил)СО-, C6C14-арил, C1-C9-гетероарил, C3-C8-циклоалкил, C1-C6-галогеналкил, амино(C1-C6-алкил)-, (C1-C6 алкил)карбоксил-, C1-C6-карбоксиамидоалкил- или O2N-."Аминоалкил-" относится к алкильной группе, имеющей значения, указанные выше, в которой один или несколько атомов водорода заменены -NH2; один или оба Н в NH2 могут быть заменены заместителями."Алкилкарбоксил-" относится к алкильной группе, имеющей значения, указанные выше, которая присоединена к основной структуре через атом кислорода карбоксильной функциональной группы"(Алкил)карбоксиамидо-" относится к группе -NHC(O)-, где карбонильный атом углерода указанной группы присоединен к С 1-С 6-алкильной группе, имеющей значения, указанные выше. Характерные примеры (C1-C6-алкил)карбоксиамидогруппы включают, но не ограничиваются перечисленным,-NHC(O)CH3,-NHC(O)СН 2 СН 3,NHC(O)CH2CH2CH3,-NHC(O)CH2CH2CH2CH3,-NHC(O)CH2CH2CH2CH2CH3, NHC(O)CH(CH3)2, -NHC(O)CH2CH(CH3)2, -NHC(O)CH(CH3)CH2CH3,-NHC(O)-C(CH3)3 и -NHC(O)CH2C(CH3)3. Термины "алкилен", "алкенилен" и "алкинилен" относятся к алкильной, алкенильной и алкинильной группам, имеющим значения, указанные выше, и две точки присоединения в химической структуре. Примеры C1-C6-алкилена включают этилен, пропилен и диметилпропилен. Подобным образом, примерыC2-C6-алкенилена включают этенилен и пропенилен. Примеры C2-C6-алкинилена включают этинилен и пропинилен. Термин "арил" относится к ароматической углеводородной группе. Примеры C6-C14-арильной группы включают, но не ограничиваются перечисленным, фенил, -нафтил, -нафтил, бифенил, антрил, тетрагидронафтил, флуоренил, инданил, бифениленил и аценафтил. Примеры C6-C10-арильной группы включают, но не ограничиваются перечисленным, фенил, -нафтил, -нафтил, бифенил и тетрагидронафтил. Арильная группа может быть незамещенной или замещенной одной или несколькими группами,включающими C1-C6-алкил, галоген, галогеналкил-, гидроксил, гидроксил (C1-C6-алкил)-, -NH2, аминоалкил-, диалкиламино-, -СООН, -С(O)O-(C1-C6-алкил), -ОС(О)(C1-C6-алкил), N-алкиламидо-,-С(O)NH2, (C1-C6-алкил)амидо- или -NO2. Термин "(арил)алкил" относится к алкильной группе, имеющей значения, указанные выше, в которой один или несколько атомов водорода заменены арильной группой, имеющей значения, указанные выше. Группы (C6-C14-арил)алкил- включают бензил, бензгидрил, 1-фенилэтил, 2-фенилэтил, 3 фенилпропил, 2-фенилпропил, 1-нафтилметил, 2-нафтилметил и т.п. (Арил)алкильная группа может быть незамещенной или замещенной одной или несколькими группами из следующих: галоген, H2N-, гидроксил,(C1-C6-алкил)амино-,ди(C1-C6-алкил)амино-,(C1-C6-алкил)С(О)N(C1-C3-алкил)-,(C1-C6 алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(O)-, ди(C1-C6-алкил)NC(О)-, NC-, C1-C6 алкокси-, C1-C6-алкил-, HO2C-, (C1-C6-алкокси)карбонил-, (C1-C6-алкил)С(О)-, C6-C14-арил-, C1-C9 гетероарил-, C3-C8-циклоалкил-, C1-C6-галогеналкил-, амино(C1-C6-алкил)-, (C1-C6-алкил)карбоксил-, C1C6-карбоксиамидоалкил- или O2N-. Термин "(арил)амино" относится к радикалу формулы (арил)-NH-, где арил имеет значения, указанные выше. Термин "(арил)окси" относится к группе Ar-O-, где Ar представляет собой арильную группу,имеющую значения, указанные выше. Термин "циклоалкил" относится к неароматической насыщенной моноциклической, бициклической или полициклической углеводородной циклической системе. Характерные примеры C3-C12-циклоалкила включают, но не ограничиваются перечисленным, циклопропил, циклопентил, циклогептил, циклооктил,декагидронафталин-1-ил, октагидро-1 Н-инден-2-ил, декагидро-1 Н-бензо[7]аннулен-2-ил и додекагидроиндацен-4-ил. Характерные примеры C3-C10-циклоалкила включают, но не ограничиваются перечисленным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, декагидронафталин-1-ил и октагидро-1 Н-инден-2-ил. Характерные примеры C3-C8-циклоалкила включают, но не огра- 14020317 ничиваются перечисленным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и октагидропентален-2-ил. Циклоалкил может быть незамещенным или замещенным одной или несколькими группами, включающими галоген, -NH2, (C1-C6-алкил)NH, (C1-C6-алкил)(C1-C6-алкил)N-,N(C1-C3-алкил)С(O)(C1-C6-алкил), -NHC(O)(C1-C6-алкил), -NHC(O)H, C(O)NH2, -С(O)NH(C1-C6-алкил),-C(O)N(C1-C6-алкил)(C1-C6-алкил), -CN, гидроксил, C1-C6-алкокси, C1-C6-алкил, -С(О)ОН, -C(O)O(C1-C6 алкил), -С(О)(C1-C6-алкил), C6-C14-арил, C1-C9-гетероарил, C3-C8-циклоалкил, C1-C6-галогеналкил-, C1-C6 аминоалкил-, -OC(O)(C1-C6-алкил), C1-C6-карбоксиамидоалкил- и -NO2. Кроме того, каждые любые два атома водорода у одного и того же атома углерода карбоцикла могут быть заменены атомом кислорода с образованием заместителя оксо (=O). Термин "циклоалкенил" относится к неароматической ненасыщенной моноциклической, бициклической или полициклической углеводородной циклической системе, содержащей по меньшей мере одну двойную связь, соединяющую два циклических атома углерода. Характерные примеры C5-C8 циклоалкенила включают, но не ограничиваются перечисленным, циклопентенил, циклогексенил, 4,4 аокталин-3-ил и циклооктенил. Циклоалкенил может быть незамещенным или замещенным одной или несколькими группами, включающими галоген, -NH2, (C1-C6-алкил)NH, (C1-C6-алкил)(C1-C6-алкил)N-,N(C1-С 3-алкил)С(О)(C1-C6-алкил), -NHC(О)(C1-C6-алкил), -NHC(O)H, -C(O)NH2, -С(O)NH(C1-C6-алкил),-С(О)N(C1-C6-алкил)(C1-C6-алкил), -CN, гидроксил, C1-C6-алкокси, C1-C6-алкил, -С(О)ОН, -С(О)О(C1-C6 алкил), -С(О)(C1-C6-алкил), C6-C14-арил, C1-C9-гетероарил и C3-C8-циклоалкил. Кроме того, каждые любые два атома водорода у одного и того же атома углерода карбоцикла могут быть заменены атомом кислорода с образованием заместителя оксо (=O)."Ди(алкил)амино-" относится к атому азота, присоединенному к двум алкильным группам, имеющим значения, указанные выше. Каждую алкильную группу можно выбрать независимо. Характерные примеры группы ди(C1-C6-алкил)амино- включают, но не ограничиваются перечисленным, -N(CH3)2,-N(СН 2 СН 3)(СН 3),-N(CH2CH3)2,-N(CH2CH2CH3)2,-N(СН 2 СН 2 СН 2 СН 3)2,-N(СН(СН 3)2)2,-N(CH(CH3)2)(СН 3), -N(CH2CH(CH3)2)2, -NH(СН(СН 3)СН 2 СН 3)2, N(C(CH3)3)2, -N(C(CH3)3)(СН 3) и-N(СН 3)(СН 2 СН 3). Две алкильные группы у атома азота, когда взяты вместе с атомом азота, к которому они присоединены, могут образовывать 3-7-членный азотсодержащий гетероцикл, где до двух атомов углерода гетероцикла могут быть замещены -N(H)-, -N(C1-C6-алкил)-, -N(C3-C8-циклоалкил)-, -N(C6-C14 арил)-, -N(C1-С 9-гетероарил)-, -N(амино(C1-C6-алкил-, -N(C6-C14-ариламино)-, -O-, -S-, -S(О)- или"C1-C6-галогеналкил-" относится к C1-C6-алкильной группе, имеющей значения, указанные выше,где один или несколько атомов водорода C1-C6-алкильной группы замещены -F, -Cl, -Br или -I. Каждое замещение можно независимо выбрать из -F, -Cl, -Br или -I. Характерные примеры C1-C6 галогеналкильной группы включают, но не ограничиваются перечисленным, -CH2F, -CCl3, -CF3, CH2CF3,-CH2Cl, -CH2CH2Br, -CH2CH2I, -CH2CH2CH2F, -CH2CH2CH2Cl, CH2CH2CH2CH2Br, -CH2CH2CH2CH2I,-CH2CH2CH2CH2CH2Br, -CH2CH2CH2CH2CH2I, -CH2CH(Br)CH3, -CH2CH(Cl)CH2CH3, -CH(F)CH2CH3 и-C(CH3)2(CH2Cl). Термин "гетероарил" относится к моноциклической, бициклической или полициклической ароматической циклической системе, содержащей по меньшей мере один атом в цикле, выбранный из гетероатомов кислорода, серы и азота. Примеры C1-C9-гетероарильных групп включают фуран, тиофен, индол,азаиндол, оксазол, тиазол, изоксазол, изотиазол, имидазол, N-метилимидазол, пиридин, пиримидин, пиразин, пиррол, N-метилпиррол, пиразол, N-метилпиразол, 1,3,4-оксадиазол, 1,2,4-триазол, 1-метил-1,2,4 триазол, 1 Н-тетразол, 1-метилтетразол, бензоксазол, бензотиазол, бензофуран, бензизоксазол, бензимидазол, N-метилбензимидазол, азабензимидазол, индазол, хиназолин, хинолин и изохинолин. Бициклические C3-C9-гетероарильные группы включают группы, в которых фениловый, пиридиновый, пиримидиновый или пиридазиновый цикл конденсирован с 5- или 6-членным моноциклическим гетероарильным циклом с одним или двумя атомами азота в цикле, одним атомом азота вместе с одним атомом кислорода или одним атомом серы в цикле, или одним атомом О или S в цикле. Примеры моноциклических C1-C4 гетероарильных групп включают 1 Н-тетразол, 3 Н-1,2,4-триазол, фуран, тиофен, оксазол, тиазол, изоксазол, изотиазол, имидазол и пиррол. Гетероарильная группа может быть незамещенной или замещенной одной или несколькими группами, включающими C1-C6-алкил, галоген, галогеналкил, гидроксил, гидроксил(C1-C6-алкил)-, -NH2, аминоалкил-, диалкиламино-, -СООН, -С(O)O-(C1-C6-алкил), -ОС(О)(C1-C6 алкил), N-алкиламино-, -C(O)NH2, (С 1-С 6-алкил)амидо- или -NO2."(Гетероарил)алкил-" относится к алкильной группе, имеющей значения, указанные выше, в которой один или несколько атомов водорода замещены гетероарильной группой, имеющей значения, указанные выше. Примеры (C1-C9-гетероарил)алкильных групп включают 2-пиридилметил, 2-тиофенилэтил,3-пиридилпропил, 2-хинолинилметил, 2-индолилметил и подобные группы. (Гетероарил)алкильная группа может быть незамещенной или замещенной одной или несколькими группами из следующих групп: галоген, H2N-, гидроксил, (C1-C6-алкил)амино-, ди(C1-C6-алкил)амино-, (C1-C6-алкил) С(О)N(C1 Сзалкил)-, (C1-C6-алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(O)-, ди(C1-C6 алкил)NC(О)-, NC-, C1-C6-алкокси-, C1-C6-алкил-, HO2C-, (C1-C6-алкокси)карбонил-, (C1-C6-алкил)С(О)-,- 15020317C6-C14-арил-, C1-C9-гетероарил-, C3-C8-циклоалкил-, C1-C6-галогеналкил-, амино(C1-C6-алкил)-, (C1-C6 алкил)карбоксил-, C1-C6-карбоксиамидоалкил- или O2N-. Термин "гетероатом" относится к атому серы, азота или кислорода. Термины "гетероцикл" или "гетероциклил" относятся к моноциклическим, бициклическим или полициклическим группам, в которых по меньшей мере один атом в цикле является гетероатомом. Гетероцикл может быть насыщенным или частично насыщенным. Примеры C1-C9-гетероциклильных групп включают, но не ограничиваются перечисленным, азиридин, оксиран, оксирен, тииран, пирролин, пирролидин, дигидрофуран, тетрагидрофуран, дигидротиофен, тетрагидротиофен, дитиолан, пиперидин,1,2,3,6-тетрагидропиридин-1-ил, тетрагидропиран, пиран, тиан, тиин, пиперазин, оксазин, 5,6-дигидро 4 Н-1,3-оксазин-2-ил,2,5-диазабицикло[2.2.1]гептан,2,5-диазабицикло[2.2.2]октан,3,6 диазабицикло[3.1.1]гептан, 3,8-диазабицикло[3.2.1]октан, 6-окса-3,8-диазабицикло[3.2.1]октан, 7-окса 2,5-диазабицикло[2.2.2]октан, 2,7-диокса-5-азабицикло[2.2.2]октан, 2-окса-5-азабицикло[2.2.1]гептан-5 ил,2-окса-5-азабицикло[2.2.2]октан,3,6-диокса-8-азабицикло[3.2.1]октан,3-окса-6 азабицикло[3.1.1]гептан, 3-окса-8-азабицикло[3.2.1]октан-8-ил, 5,7-диокса-2-азабицикло[2.2.2]октан, 6,8 диокса-3-азабицикло[3.2.1]октан, 6-окса-3-азабицикло[3.1.1]гептан, 8-окса-3-азабицикло[3.2.1]октан-3 ил, 2-метил-2,5-диазабицикло[2.2.1]гептан-5-ил, 1,3,3-триметил-6-азабицикло[3.2.1]окт-6-ил, 3-гидрокси 8-азабицикло[3.2.1]октан-8-ил,7-метил-3-окса-7,9-диазабицикло[3.3.1]нонан-9-ил,9-окса-3 азабицикло[3.3.1]нонан-3-ил,3-окса-9-азабицикло[3.3.1]нонан-9-ил,3,7-диокса-9 азабицикло[3.3.1]нонан-9-ил, 4-метил-3,4-дигидро-2 Н-1,4-бензоксазин-7-ил, тиазин, дитиан и диоксан. Рассматриваемые гетероциклические циклы или циклические системы имеют минимум 3 члена. Поэтому, например, C1-гетероциклильные радикалы могут включать, но не ограничиваться перечисленным,оксазиранил, диазиридинил и диазиринил, С 2-гетероциклильные радикалы включают, но не ограничиваются перечисленным, азиридинил, оксиранил и диазетидинил, С 9-гетероциклильные радикалы включают, но не ограничиваются перечисленным, азеканил, тетрагидрохинолинил и пергидроизохинолинил. Гетероциклильная группа может быть незамещенной или замещенной одной или несколькими группами, включающими C1-C6-алкил, галоген, галогеналкил-, гидроксил, гидроксил (C1-C6-алкил)-,-NH2, аминоалкил-, диалкиламино-, -СООН, -С(О)О-(C1-C6-алкил), -ОС(О)(С 1-С 6-алкил), N-алкиламидо-,-С(O)NH2, (C1-C6-алкил)амидо или -NO2."Гетероциклил(алкил)-" относится к алкильной группе, имеющей значения, указанные выше, в которой один или несколько атомов водорода замещены гетероциклильной группой, имеющей значения,указанные выше. Гетероциклил(C1-C6-алкильные) группы включают 2-пиридилметил, 1 пиперазинилэтил, 4-морфолинилпропил, 6-пиперазинилгексил и подобные группы. Гетероциклилалкильная группа может быть незамещенной или замещенной одной или несколькими группами из следующих групп: галоген, H2N-, (C1-C6-алкил)амино-, ди(C1-C6-алкил)амино-, (C1-C6-алкил) С(О)N(C1-C3 алкил)-, (C1-C6-алкил)карбоксиамидо-, HC(O)NH-, H2NC(O)-, (C1-C6-алкил)NHC(О)-, ди(C1-C6 алкил)NC(O)-, NC-, гидроксил, C1-C6-алкокси-, C1-C6-алкил-, HO2C-, (C1-C6-алкокси)карбонил-, (C1-C6 алкил)С(О)-, 4-7-членный моноциклический гетероцикл, C6-C14-арил-, C1-C9-гетероарил- или C3-C8 циклоалкил-."Гидроксиалкил-" относится к алкильной группе, имеющей значения, указанные выше, в которой один или несколько атомов водорода замещены гидроксильными группами. Примеры C1-C6 гидроксиалкила включают, например, -CH2OH, -СН 2 СН 2 ОН, -СН 2 СН 2 СН 2 ОН, -СН 2 СН(ОН)СН 2 ОН,-СН 2 СН(ОН)СН 3, -СН(СН 3)СН 2 ОН и более высокие гомологи. Термин "моноциклический гетероциклил" относится к моноциклическим группам, в которых по меньшей мере один атом цикла представляет собой гетероатом. Гетероцикл может быть насыщенным или частично насыщенным. Примеры моноциклических C1-C9-гетероциклильных групп включают, но не ограничиваются перечисленным, азиридин, оксиран, оксирен, тииран, пирролин, пирролидин, дигидрофуран, тетрагидрофуран, дигидротиофен, тетрагидротиофен, дитиолан, пиперидин, 1,2,3,6 тетрагидропиридин-1-ил, тетрагидропиран, пиран, тиан, тиин, пиперазин, оксазин, 5,6-дигидро-4 Н-1,3 оксазин-2-ил, 4-метил-3,4-дигидро-2 Н-1,4-бензоксазин-7-ил, тиазин, дитиан и диоксан. Рассматриваемые гетероциклические системы имеют минимум 3 члена. Поэтому, например, C1-гетероциклильные радикалы могут включать, но не ограничиваться перечисленным, оксазиранил, диазиридинил и диазиринил, С 2 гетероциклильные радикалы включают, но не ограничиваются перечисленным, азиридинил, оксиранил и диазетидинил, С 9-гетероциклильные радикалы включают, но не ограничиваются перечисленным, азеканил. Гетероциклильная группа может быть незамещенной или замещенной одной или несколькими группами, включающими C1-C6-алкил, галоген, галогеналкил-, гидроксил, гидроксил (C1-C6-алкил)-,-NH2, аминоалкил-, диалкиламино-, -СООН, -С(О)О-(C1-C6-алкил), ОС(О)(C1-C6-алкил), N-алкиламидо-,-C(O)NH2, (C1-C6-алкил) амидо-или -NO2."Перфторалкил-" относится к алкильной группе, имеющей значения, указанные выше, с двумя или большим числом атомов фтора. Примеры C1-C6-перфторалкильной группы включают CF3, CH2CF3,CF2CF3 и CH(CF3)2. шимпанзе, бабуин или горилла. Термин "необязательно замещенный", используемый в данном описании, означает, что по меньшей мере один атом водорода необязательно замещенной группы замещен галогеном, -NH2, -NH(C1-C6 алкилом), -N(C1-C6-алкил)(C1-C6-алкилом), -N(C1-С 3-алкил)С(О)(C1-C6-алкилом), -NHC(O)(C1-C6 алкилом), -NHC(O)H, -C(O)NH2, -C(O)NH(C1-C6-алкилом), -С(О)N(C1-C6-алкил)(C1-C6-алкилом), -CN,гидроксилом, C1-C6-алкокси, C1-C6-алкилом, -С(О)ОН, -C(O)O(С 1-С 6-алкилом), -С(О)(C1-C6-алкилом), C6C14-арилом, C1-C9-гетероарилом или C3-C8-циклоалкилом. Характерные "фармацевтически приемлемые соли" включают, но не ограничиваются перечисленным, например, водорастворимые и водонерастворимые соли, такие как ацетат, соли алюминия, амсонат"Эффективное количество", когда употребляется в связи с соединением по данному изобретению,является количеством, эффективным для ингибирования mTOR или PI3K у субъекта. Некоторые соединения по данному изобретению обладают одним или нескольими хиральными центрами, и настоящее изобретение включает каждый отдельный энантиомер таких соединений, а также смеси энантиомеров. Когда в соединениях по настоящему изобретению существует несколько хиральных центров, изобретение включает каждую комбинацию, а также их сочетание. Имеются в виду все хиральные диастереомерные и рацемические формы структуры, если специально не указывается определенная стереохимия или изомерная форма. В технике хорошо известно как получать оптически активные формы, например, путем расщепления рацемических форм или путем синтеза из оптически активных исходных материалов. Соединения по настоящему изобретению обнаруживают ингибирующую активность в отношенииmTOR и поэтому могут использоваться для того, чтобы ингибировать анормальный рост клеток, в котором mTOR играет некую роль. Таким образом, соединения по настоящему изобретению являются эффективными при лечении расстройств, с которыми ассоциируются действия mTOR в связи с анормальным ростом клеток, таких как рестеноз, атеросклероз, костные расстройства, артрит, диабетическая ретинопатия, псориаз, доброкачественная гипертрофия предстательной железы, воспаление, ангиогенез, иммунологические расстройства, панкреатит, болезнь почек, рак и т.д. В частности, соединения по настоящему изобретению обладают превосходным ингибирующим действием на рост раковых клеток и эффективны при лечении онкозаболеваний, предпочтительно всех типов солидных онкозаболеваний и злокачественных лимфом, и в особенности лейкоза, рака кожи, рака мочевого пузыря, рака молочной железы, рака матки, рака яичников, рака предстательной железы, рака легких, рака толстой кишки, рака поджелудочной железы, рака почек, рака желудка, рака головного мозга, запущенной почечно-клеточной карциномы, острого лейкобластного лейкоза, злокачественной меланомы, саркомы мягких тканей или костной ткани и т.д. Соединения по настоящему изобретению обнаруживают ингибирующую активность в отношении киназ PI3 и поэтому могут использоваться для того, чтобы ингибировать анормальный рост клеток, в котором киназы PI3 играет некую роль. Таким образом, соединения по настоящему изобретению являются эффективными при лечении расстройств, с которыми ассоциируются действия киназ PI3 в связи с анормальным ростом клеток, таких как рестеноз, атеросклероз, костные расстройства, артрит, диабетическая ретинопатия, псориаз, доброкачественная гипертрофия предстательной железы, воспаление, ангиогенез, иммунологические расстройства, панкреатит, болезнь почек, рак и т.д. В частности, соединения по настоящему изобретению обладают превосходным ингибирующим действием на рост раковых клеток и эффективны при "лечении онкозаболеваний, предпочтительно всех типов солидных онкозаболеваний и злокачественных лимфом, и в особенности лейкоза, рака кожи, рака мочевого пузыря, рака молочной железы, рака матки, рака яичников, рака предстательной железы, рака легких, рака толстой кишки, рака поджелудочной железы, рака почек, рака желудка, рака головного мозга, запущенной почечно-клеточной карциномы, острого лейкобластного лейкоза, злокачественной меланомы, саркомы мягких тканей или головного мозга и т.д. В случае терапевтических применений фармакологически активные соединения формулы I будут обычно вводиться в виде фармацевтической композиции, включающей в качестве необходимого активного ингредиента по меньшей мере одно такое соединение в сочетании с твердым или жидким фармацевтически приемлемым носителем и, необязательно, с фармацевтически приемлемыми адъювантами и эксципентами, с использованием стандартных и распространенных методов. Фармацевтические композиции по данному изобретению включают подходящие лекарственные формы для перорального, парентерального (в том числе подкожного, внутримышечного, интрадермального и внутривенного), бронхиального или назального введения. Так, если используют твердый носитель, препарат может быть таблетирован, помещен в твердую желатиновую капсулу в форме порошка или гранул или находиться в форме пастилок или лепешек. Твердый носитель может содержать обычные эксципиенты, такие как связующие вещества, наполнители, таблетирующие смазывающие вещества, вещества, способствующие рассыпанию, смачивающие вещества и т.п. На таблетку при необходимости может быть нанесено покрытие обычными методами. Если используют жидкий носитель, препарат может находиться в форме сиропа, эмульсии, мягкой желатиновой капсулы, стерильной среды для инъекции, водной или неводной жидкой суспензии, или может представлять собой сухой продукт для восстановления водой или другим подходящим носителем перед применением. Жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, смачивающие вещества,неводный носитель (включая съедобные масла), консерванты, а также корригенты и/или красители. Для парентерального введения среда обычно будет включать стерильную воду, по меньшей мере, в большей части, хотя могут использоваться солевые растворы, растворы глюкозы и подобные растворы. Также можно использовать суспензии для инъекций, и в таком случае могут использоваться обычные суспендирующие вещества. В парентеральные лекарственные формы также можно добавлять обычные консерванты, буферирующие вещества и подобные вещества. Особенно применимым является введение соединения формулы I непосредственно в парентеральных препаратах. Фармацевтические композиции получают обычными методами, соответствующими нужному препарату, содержащему соответствующие количества активного ингредиента, т.е. соединения формулы I по изобретению. См., например, Remington:The Science and Practice of Pharmacy, 20th Edition, Baltimore, MD: Lippincott WillamsWilkins, 2000. Дозировка соединений формулы I для достижения терапевтического действия будет зависеть не только от таких факторов, как возраст, масса и пол пациента и способ введения, но также от степени нужной активирующей активности калиевых каналов и силы соединения, используемого в случае определенного расстройства, связанного с заболеванием. Также предполагается, что при лечении дозировка определенного соединения может вводиться в стандартной лекарственной форме и что специалист в данной области техники может установить соответственно стандартную лекарственную форму, отражающую относительный уровень активности. Решение, какую определенную дозировку использовать, и решение о кратности введения в сутки остается за лечащим врачом и может изменяться путем титрования дозировки к определенным обстоятельствам данного изобретения для получения нужного терапевтического действия. Подходящей дозой соединения формулы I или его фармацевтической композиции для млекопитающего, включая человека, страдающего от или вероятно страдающего от любого состояния, описанного в данном описании, является количество активного ингредиента от примерно 0,01 до 10 мг/кг массы тела. Для парентерального введения доза может находиться в интервале от 0,1 до 1 мг/кг массы тела в случае внутривенного введения. В случае перорального введения доза может находиться в интервале от примерно 0,1 до 5 мг/кг массы тела. Активный ингредиент будет предпочтительно вводиться в равных дозах от одного до четырех раз в сутки. Однако обычно вводят небольшую дозировку и постепенно дозировку увеличивают до тех пор, пока не определят оптимальную дозировку для реципиента, находящегося на лечении. Однако следует понимать, что количество фактически вводимого соединения будет определяться лечащим врачом с учетом релевантных обстоятельств, включая состояние, от которого лечат, выбор вводимого соединения, выбранный способ введения, возраст, массу тела и реакцию отдельного пациента и тяжесть симптомов у пациента. Количество соединения по настоящему изобретению или его фармацевтически приемлемой соли,которое эффективно для ингибирования mTOR или PI3K у субъекта. Кроме того, в помощь идентификации оптимальных интервалов дозировки необязательно можно использовать анализы in vitro или in vivo. Точная используемая доза также может зависеть от способа введения, состояния, тяжести состояния, от которого лечат, а также от раличных физических факторов, связанных с индивидуумом, которого лечат,и может устанавливаться согласно решению практикующего врача. Эквивалентные дозировки можно вводить на протяжении различных периодов времени, включая, но не ограничиваясь ими, примерно каждые 2 ч, примерно каждые 6 ч, примерно каждые 8 ч, примерно каждые 12 ч, примерно каждые 24 ч,примерно каждые 36 ч, примерно каждые 48 ч, примерно каждые 72 ч, примерно каждую неделю, примерно каждые две недели, примерно каждые три недели, примерно каждый месяц и примерно каждые два месяца. Число и частота введения дозировок, соответствующих полному курсу лечения, будут определяться согласно решению практикующего врача. Количества эффективных дозировок, описанные в данном описании, относятся к общим вводимым количествам; иными словами, если вводят более одного соединения по настоящему изобретению или его фармацевтически приемлемой соли, эффективные дозировочные количества соответствуют общему вводимому количеству. В одном воплощении соединение по настоящему изобретению или его фармацевтически приемлемую соль вводят одновременно с другим терапевтическим средством. В одном воплощении могут быть введены композиция, включающая эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли, и эффективное количество другого терапевтического средства в той же композиции. Эффективные количества другого терапевтического средства хорошо известны специалистам в данной области техники. Однако в компетенции специалистов в данной области техники также определение оптимального интервала эффективного количества другого терапевтического средства. Соединение по настоящему изобретению или его фармацевтически приемлемая соль и другое терапевтическое средство могут действовать аддитивно или, в одном воплощении, синергично. В одном воплощении изобретения, где животному вводят другое терапевтическое средство, эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли меньше, чем могли бы быть их эффективные количества, когда другое терапевтическое средство не вводят. В таком случае, без связи с какой-либо теорией, полагают, что соединение по настоящему изобретению или его фармацевтически приемлемая соль и другое терапевтическое средство действуют синергично. Способы, применимые для получения соединений формулы I, приводятся в примерах ниже и обобщены на схемах 1-3. Схема 1. Специалисту в данной области техники будет понятно, что схемы 1-3 можно адаптировать для получения других соединений формулы I и фармацевтически приемлемых солей соединений формулы I по настоящему изобретению. В данном описании используются приведенные далее аббревиатуры, которые имеют указанные определения: ACN обозначает ацетонитрил, АсОН обозначает уксусную кислоту, АТФ обозначает аденозинтрифосфат, CHAPS обозначает 3-[(3-холамидопропил)диметиламмонио]пропансульфоновую кислоту,DEAD обозначает диэтилазодикарбоксилат, DIAD обозначает диизопропилазодикарбоксилат, DMAP обозначает диметиламинопиридин, ДМФА обозначает N,N-диметилформамид, ДМФА-DMA обозначает диметилацеталь диметилформамида, ДМСО обозначает диметилсульфоксид, Dowtherm представляет собой эвтектическую смесь бифенила (C12H10) и дифенилоксида (С 12 Н 10 О). Dowtherm является зарегистрированным товарным знаком Dow Corning Corporation. DPBS обозначает физиологический раствор,забуференный фосфатом по Дульбекко, ЭДТК обозначает этилендиаминтетрауксусную кислоту, ESI указывает на ионизацию электронным распылением, EtOAc обозначает этилацетат, EtOH обозначает этанол,HEPES обозначает 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, GMF обозначает стекло,основание Хюнига представляет собой диизопропилэтиламин, ВЭЖХ обозначает высокоэффективную жидкостную хроматографию, LPS обозначает липополисахарид, MeCN обозначает ацетонитрил, МеОН обозначает метанол, МС обозначает масс-спектрометрию, NEt3 обозначает триэтиламин, ЯМР обозначает ядерный магнитный резонанс, PBS обозначает забуференный фосфатом физиологический раствор (рН 7,4), RPMI 1640 обозначает буфер (Sigma-Aldrich Corp., St. Louis, MO, USA), SDS обозначает додецилсульфат (натриевую соль), SRB обозначает сульфородамин В, TBSCl обозначает третбутилдиметилсилилхлорид, ТСА обозначает трихлоруксусную кислоту, ТФК обозначает трифторуксусную кислоту, ТГФ обозначает тетрагидрофуран, ТСХ обозначает тонкослойную хроматографию, и TRIS обозначает трис(гидроксиметил)аминометан. Способы. Далее описываются способы синтеза соединений формулы I. Приведенные далее примеры представлены для пояснения некоторых воплощений настоящего изобретения, но не должны истолковываться как ограничивающие объем данного изобретения. Пример 1. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-пиридин-4 илмочевины. Стадия 1. Получение 2-хлор-4,6-диморфолин-4-ил[1,3,5]триазина. К раствору хлорангидрида циануровой кислоты (18,4 г, 10 ммоль) в ацетоне (100 мл) и измельченному льду (500 г) при перемешивании при -10 С добавляют смесь триэтиламина (30,0 г, избыток) и морфолина (17,4 г, 20 ммоль). По окончании добавления реакционную смесь перемешивают при комнатной температуре в течение 1 ч и разбавляют 50 мл воды. Отделившееся твердое вещество белого цвета отфильтровывают и промывают водой. Твердое вещество белого цвета сушат и отфильтровывают. Находят, что сырой продукт реакции является чистым, и его передают на следующую стадию без очистки. Выход 25 г, 87%; (M+H) 286,7. Стадия 2. Получение 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина. Смесь 2-хлор-4,6-диморфолин-4-ил-[1,3,5]триазина (1,4 г, 4,9 ммоль), каталитического количества тетракис-(трифенилфосфин)палладия(0) (70 мг, 0,061 ммоль), 2 М раствора карбоната натрия (3 мл), пи- 19020317 наколового эфира 4-аминофенилбороновой кислоты (1,6 г, 7,3 ммоль) и DME (100 мл) кипятят с обратным холодильником в течение 24 ч. Растворитель выпаривают, остаток растворяют в метиленхлориде и фильтруют через целит. Фильтрат промывают водой (200 мл) и органический слой сушат над сульфатом магния. Органический слой фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле, элюируют смесью этилацетат/гексан (1:1) и получают 1,40 г (выход 83%) 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина в виде аморфного твердого вещества.(80 мл) при 0 С добавляют трифосген (0,25 мг, 0,84 ммоль) и триэтиламин (3 мл). Смесь перемешивают в течение 20 мин при 0 С, к реакционной смеси добавляют 4-аминопиридин (0,10 г, 0,83 ммоль) и перемешивают еще в течение 2 ч при комнатной температуре. Растворитель выпаривают, остаток подвергают ВЭЖХ с использованием смеси ацетонитрил/ТФК в качестве подвижной фазы и получают 98,2 мг (выход 36%) 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-пиридин-4-илмочевины.(M+H) 463,3. Процедура А получения мочевин с использованием арилизоцианатов. К смеси 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (140 мг, 0,40 ммоль) и каталитического количества диметиламинопиридина (DMAP) в метиленхлориде (100 мл) при перемешивании добавляют небольшой избыток арилизоцианата (0,61 ммоль). Смесь перемешивают при комнатной температуре в течение 48 ч. Реакционную смесь концентрируют до половины ее начального объема, выделившееся выпавшее в осадок вещество собирают фильтрацией и промывают метанолом (15 мл) и затем диэтиловым эфиром. В некоторых случаях полученный сырой продукт очищают колоночной хроматографией на силикагеле с элюированием его соответствующими растворителями, в зависимости от полярности продуктов. Следующие соединения получают согласно процедуре А. Пример 2. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-пиридин-3 илмочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,08 г, 0,23 ммоль) и 3 пиридилизоцианата (30 мг, 0,25 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Продукт реакции очищают колоночной хроматографией на силикагеле с элюированием его смесью 10% МеОН:этилацетат. Выход 60 мг (56%).(M+H) 463,5. Пример 3. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-фенилмочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (140 мг, 0,40 ммоль) и фенилизоцианата (72 мг, 0,61 ммоль) названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Продукт реакции очищают колоночной хроматографией на силикагеле с элюированием его этилацетатом. Выход 0,128 г (68%).(M+H) 462,3. Пример 4. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]тиофен-2-илмочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (60 мг, 0,17 ммоль) и 2 тиенилизоцианата (18 мг, 0,14 ммоль) названное в заголовке соединение извлекают в виде твердого вещества серого цвета после колоночной хроматографии на силикагеле с элюированием смесью 5% этилацетата:метанол. Выход 12 мг (14%).(M+H) 470. Пример 5. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(4 метилфенил)мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 метилфенилизоцианата (74 мг, 0,56 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 65 мг (33%).(M+H) 476,4. Пример 6. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(4 фторфенил)мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 фторфенилизоцианата (83 мг, 0,61 ммоль), извлекают 65 мг (выход 33%) названного в заголовке соединения в виде твердого вещества белого цвета. Пример 7. Получение 1-(2,4-диметоксифенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 2,4 диметоксифенилизоцианата (131 мг, 0,73 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 76 мг (36%).(M+H) 522,4. Пример 8. Получение 1-(4-хлорфенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 хлорфенилизоцианата (94 мг, 0,61 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 60 мг (30%).(M+H) 496,3. Пример 9. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(4 метоксифенил)мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 метоксифенилизоцианата (91 мг, 0,63 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 48 мг (24%).(4-хлорфенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 хлорфенилизоцианата (94 мг, 0,61 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 60 мг (30%).(2,4-дифторфенил)-3-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,105 г, 0,30 ммоль) и 2,4 дифторфенилизоцианата (71 мг, 0,45 ммоль), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 40 мг (27%).(M+H) 498,6. Пример 12. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-этилмочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,130 г, 0,38 ммоль) и этилизоцианата (260 мг, 10-кратный избыток), названное в заголовке соединение извлекают в виде твердого вещества белого цвета. Выход 38 мг (25%).(M+H) 414,4. Пример 18. Получение 1-4-[4-(азетидин-3-иламино)-6-морфолин-4-ил-1,3,5-триазин-2-ил]фенил 3-пиридин-3-илмочевины. К раствору трет-бутил-3-[(4-морфолин-4-ил-6-4-[(пиридин-3-илкарбамоил)амино]фенил-1,3,5 триазин-2-ил)амино]азетидин-1-карбоксилата (30 мг, 0,055 ммоль) в DCM (20 мл) при перемешивании при комнатной температуре добавляют ТФК (1,5 мл) и перемешивают в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Выход 21 мг (83%); (M+H) 448,5. Пример 19. Получение 1-4-[4-(азетидин-3-иламино)-6-морфолин-4-ил-1,3,5-триазин-2-ил]фенил 3-(4-фторфенил)мочевины. К раствору трет-бутил-3-[(4-морфолин-4-ил-6-4-[(4-фторфенилкарбамоил)амино]фенил-1,3,5 триазин-2-ил)амино]азетидин-1-карбоксилата (30 мг, 0,053 ммоль) в DCM (20 мл) при перемешивании при комнатной температуре добавляют ТФК (1,5 мл) и перемешивают в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Выход 20 мг (83%); (M+H) 465,5. Пример 20. Получение 1-4-[4-(азетидин-3-иламино)-6-морфолин-4-ил-1,3,5-триазин-2-ил]фенил 3-(4-метилфенил)мочевины. К раствору трет-бутил-3-[(4-морфолин-4-ил-6-4-[(4-метилфенилкарбамоил)амино]фенил-1,3,5 триазин-2-ил)амино]азетидин-1-карбоксилата (130 мг, 0,23 ммоль) в DCM (20 мл) при перемешивании при комнатной температуре добавляют ТФК (1,5 мл) и перемешивают в течение 24 ч. По окончании пе- 21020317 ремешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Выход 40 мг (37%); (M+H) 461,5. Пример 22. Получение 1-4-[4-(азетидин-3-иламино)-6-морфолин-4-ил-1,3,5-триазин-2-ил]фенил 3-пиридин-4-илмочевины. К раствору трет-бутил-3-[(4-морфолин-4-ил-6-4-[(пиридин-4-илкарбамоил)амино]фенил-1,3,5 триазин-2-ил)амино]азетидин-1-карбоксилата (40 мг, 0,073 ммоль) в DCM (20 мл) при перемешивании при комнатной температуре добавляют ТФК (1,5 мл) и перемешивают в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Выход 26 мг (81%); (M+H) 448,5. Пример 23. Получение 1-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-1,3,5 триазин-2-ил]фенил-3-фенилмочевины. Стадия 1. Получение 3-(4-хлор-6-морфолин-4-ил-1,3,5-триазин-2-ил)-8-окса-3 азабицикло[3.2.1]октана. К суспензии 2,4-дихлор-6-морфолин-4-ил-[1,3,5]триазина (1,5 г, 6,5 ммоль) в смеси измельченный лед/ацетон при перемешивании добавляют 8-окса-3-азабицикло[3.2.1]октан (980 мг, 6,5 ммоль) и триэтиламин (3 мл) и перемешивают при комнатной температуре в течение 6 ч. По окончании перемешивания выделившееся твердое вещество отфильтровывают и промывают водой. Находят, что сырой продукт реакции является достаточно чистым для дальнейших превращений. Выход 2,0 г (99%). Т.пл. 118 С; (M+H) 313,1. Стадия 2. Получение 4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-1,3,5-триазин-2 ил]анилина. Смесь 3-(4-хлор-6-морфолин-4-ил-1,3,5-триазин-2-ил)-8-окса-3-азабицикло[3.2.1]октана (2,0 г, 6,4 ммоль), тетракис-(трифенилфосфин)палладия(0) в каталитическом количестве (100 мг), 2 М раствора карбоната натрия (5 мл), пинаколового эфира 4-аминофенилбороновой кислоты (1,5 г, 6,43 ммоль) иDME (200 мл) кипятят с обратным холодильником в течение 24 ч. Растворитель выпаривают, остаток растворяют в метиленхлориде и фильтруют через целит. Органический слой промывают водой (200 мл) и сушат над сульфатом магния. Органический слой фильтруют и растворитель выпаривают. Остаток хроматографируют на колонке с силикагелем с использованием в качестве элюента смеси этилацетат/гексан (1:1), и получают 1,4 г (выход 59%) названного в заголовке продукта. Т.пл. 154 С; (M+H) 369,4. Стадия 3. Получение 1-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-1,3,5-триазин 2-ил]фенил-3-фенилмочевины. Названное в заголовке соединение получают, начиная с того, что 4-[4-морфолин-4-ил-6-(8-окса-3 азабицикло[3.2.1]окт-3-ил)-1,3,5-триазин-2-ил]анилин (120 мг, 0,32 ммоль), фенилизоцианат (80 мг, 0,67 ммоль) и DMAP (5 мг) перемешивают при комнатной температуре в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Твердое веществобелого цвета. Т.пл. 242 С; выход 35 мг (28%); (M+H) 488,56. Пример 24. Получение 1-(4-фторфенил)-3-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3 ил)-1,3,5-триазин-2-ил]фенилмочевины. Названное в заголовке соединение получают, начиная с того, что 4-[4-морфолин-4-ил-6-(8-окса-3 азабицикло[3.2.1]окт-3-ил)-1,3,5-триазин-2-ил]анилин (100 мг, 0,27 ммоль), 4-фторфенилизоцианат (50 мг, 0,36 ммоль) и DMAP (5 мг) перемешивают при комнатной температуре в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смесиACN/вода и ТФК. Твердое веществобелого цвета. Т.пл. 248 С; выход 86 мг (86%); (M+H) 506,4. Пример 25. Получение 1-(4-метилфенил)-3-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт 3-ил)-1,3,5-триазин-2-ил]фенилмочевины. Названное в заголовке соединение получают, начиная с того, что 4-[4-морфолин-4-ил-6-(8-окса-3 азабицикло[3.2.1]окт-3-ил)-1,3,5-триазин-2-ил]анилин (100 мг, 0,27 ммоль), 4-толилизоцианат (60 мг,0,45 ммоль) и DMAP (5 мг) перемешивают при комнатной температуре в течение 24 ч. По окончании перемешивания реакционную смесь концентрируют и очищают ВЭЖХ Gilson с использованием смеси(22 мг, 0,06 ммоль) в CHCl3 (1 мл) добавляют Et3N (25 мл, 0,18 ммоль) и трифосген (18 мг, 0,06 ммоль). Смесь перемешивают при комнатной температуре в течение 15 мин, и добавляют 4-аминопиридин (17 мг, 0,18 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Растворитель удаляют, остаток подвергают разделению ВЭЖХ и получают названное в заголовке соединение в виде твердого вещества не совсем белого цвета (1 соль ТФК, 8,8 мг, выход 24%). МС (ESI) m/z 489,2. Пример 35. Получение 4-[(4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5 триазин-2-ил]фенилкарбамоил)амино]бензамида. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-аминобензамида (25 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (10,6 мг, выход 33%). МС (ESI) m/z 531,2. Пример 36. Получение 1-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5 триазин-2-ил]фенил-3-пиридин-3-илмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 3-аминопиридина (17 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (1 соль ТФК, 14,8 мг, выход 41%). МС (ESI) m/z 489,5. Пример 37. Получение 1-(4-фторфенил)-3-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8 ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-фторанилина (20 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (14,8 мг, выход 49%). МС (ESI) m/z 506,5. Пример 38. Получение 1-[4-(гидроксиметил)фенил]-3-4-[4-морфолин-4-ил-6-(3-окса-8 азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-аминобензилового спирта (22 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (9,6 мг, выход 31%). МС (ESI) m/z 518,5. Пример 39. Получение 1-[4-(2-гидроксиэтил)фенил]-3-4-[4-морфолин-4-ил-6-(3-окса-8 азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-аминофенетилового спирта (24 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (10,6 мг, выход 33%). МС (ESI) m/z 532,5. Пример 40. Получение 2-(диэтиламино)этил-4-[(4-[4-морфолин-4-ил-6-(3-окса-8 азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]фенилкарбамоил)амино]бензоата. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и гидрохлорида прокаина (50 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (1 соль ТФК, 14,6 мг, выход 33%). МС (ESI) m/z 613,6. Пример 41. Получение 1-(4-метилфенил)-3-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт 8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и п-толуидина (20 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (9,2 мг, выход 31%). МС (ESI) m/z 502,5. Пример 42. Получение 1-(4-цианофенил)-3-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт 8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-аминобензонитрила (21 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (14,3 мг, выход 46%). МС (ESI) m/z 513,5. Пример 43. Получение 1-[4-(4-метилпиперазин-1-ил)фенил]-3-4-[4-морфолин-4-ил-6-(3-окса-8 азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и 4-(4-метилпиперазин-1-ил)анилина (54 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (2 соль ТФК, 3,2мг, выход 7%). МС (ESI) m/z 586,6. Пример 44. Получение 1-изопропил-3-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт-8-ил)1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и изопропиламина (11 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (13,6 мг, выход 50%). МС (ESI) m/z 454,5. Пример 45. Получение 1-(2-гидроксиэтил)-3-4-[4-морфолин-4-ил-6-(3-окса-8-азабицикло[3.2.1]окт 8-ил)-1,3,5-триазин-2-ил]фенилмочевины. При следовании процедуре, описанной в примере 34, взаимодействие 4-[4-морфолин-4-ил-6-(3 окса-8-азабицикло[3.2.1]окт-8-ил)-1,3,5-триазин-2-ил]анилина (22 мг, 0,06 ммоль), трифосгена (18 мг,0,06 ммоль) и этаноламина (11 мг, 0,18 ммоль) дает названное в заголовке соединение в виде твердого вещества не совсем белого цвета (14,4 мг, выход 53%). МС (ESI) m/z 456,5. Пример 46. Получение 1-[2-(диметиламино)этил]-3-4-[4-(1,4-диокса-8-азаспиро[4.5]дец-8-ил)-6 морфолин-4-ил-1,3,5-триазин-2-ил]фенилмочевины. МС (ES+) 513,62 (M+H)+. Пример 47. Получение 1-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-1,3,5 триазин-2-ил]фенил-3-пиридин-3-илмочевины. МС (ESI) m/z 489,3. Пример 48. Получение 1-4-[4-морфолин-4-ил-6-(8-окса-3-азабицикло[3.2.1]окт-3-ил)-1,3,5 триазин-2-ил]фенил-3-пиридин-4-илмочевины, т.пл. 258 С. МС (ESI) m/z 489,3. Следуя процедуре, изложенной в примере 1, стадия 3, получают следующие соединения. Пример 49. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(2-метилпиридин-4 ил)мочевина. МС (ESI) m/z 477,3. Пример 50. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4-(2 гидроксиэтил)фенил]мочевина. МС (ESI) m/z 506,4. Пример 52. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4-(1 гидроксиэтил)фенил]мочевина. МС (ESI) m/z 506,4. Пример 53. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4(трифторметил)фенил]мочевина. МС (ESI) m/z 530,2. Пример 54. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(4-гидроксифенил)мочевина. МС (ESI) m/z 478,2. Пример 55. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[5-(трифторметил)пиридин-2 ил]мочевина. МС (ESI) m/z 530,5. Пример 56. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-4-[2,2,2-трифтор-1-гидрокси 1-(трифторметил)этил]фенилмочевина. МС (ESI) m/z 621,54. Пример 57. 1-[4-(4,6-Диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[3-(1 гидроксиэтил)фенил]мочевина. МС (ESI) m/z 506,3. Пример 58. Метил-4-([4-(4,6-диморфолин-4-ил-1,3,5-триазин-2 ил)фенил]карбамоиламино)бензоат. МС (ESI) m/z 520,3. Пример 59. Получение 1-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенил-3-пиридин-4-илмочевины. Стадия 1. К раствору NaH (50%, 460 мг) в сухом ТГФ при перемешивании при комнатной температуре постепенно добавляют тетрагидро-2 Н-пиран-4-ол (1,02 г, 10 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и постепенно добавляют 2,4-дихлор-6-морфолин-4 ил[1,3,5]триазин (2,35 г, 10 ммоль) в ТГФ (50 мл). Реакционную смесь перемешивают при комнатной температуре в течение 48 ч и реакцию медленно гасят смесью воды со льдом. Смесь экстрагируютCHCl3, экстракт хорошо промывают водой и сушат над безводным MgSO4. Экстракт фильтруют, концентрируют и 2-хлор-4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин очищают колоночной хроматографией на силикагеле с элюированием его смесью 40% этилацетата:гексан. Выход 1,5 г, 50%; твердое вещество белого цвета. Т.пл. 91 С. МС (ESI) m/z 301,52. Стадия 2. Получают 4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]анилин процедурой, описанной в примере 1, стадия 2. Исходя из 2-хлор-4-морфолин-4-ил-6(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазина (1,5 г, 4,9 ммоль), извлекают 980 мг (выход 56%) продукта после очистки с использованием колоночной хроматографией на силикагеле с элюированием продукта этилацетатом. Т.пл. 188 С. МС (ESI) m/z 358,2. Стадия 3. Получают 1-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенил-3-пиридин-4-илмочевину процедурой, описанной в примере 1, стадия 3. Исходя из 4-[4 морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2-ил]анилина (212 мг, 0,59 ммоль), извлекают 190 мг (выход 67%) конечного продукта в виде твердого вещества белого цвета. Т.пл. 238 С. МС (ESI) m/z 478,3. Пример 60. Получение 1-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенил-3-фенилмочевины. 1-4-[4-Морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2-ил]фенил-3 фенилмочевину получают взаимодействием 4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)1,3,5-триазин-2-ил]анилина и соответствующего фенилизоцианата. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 476,5. Пример 61. Получение 1-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенил-3-пиридин-3-илмочевины. 1-4-[4-Морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2-ил]фенил-3-пиридин-3 илмочевину получают взаимодействием 4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5 триазин-2-ил]анилина и соответствующего 3-пиридилизоцианата. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 477,53. Пример 62. Получение 1-[4-(гидроксиметил)фенил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Нпиран-4-илокси)-1,3,5-триазин-2-ил]фенилмочевины. 1-[4-(Гидроксиметил)фенил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5 триазин-2-ил]фенилмочевину получают процедурой с трифосгеном, описанной в примере 1, стадия 3. Продукт очищают ВЭЖХ Gilson. Пример 63. Получение 1-(2-метилпиридин-4-ил)-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4 илокси)-1,3,5-триазин-2-ил]фенилмочевины. 1-(2-Метилпиридин-4-ил)-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин 2-ил]фенилмочевину получают процедурой с трифосгеном, описанной в примере 1, стадия 3. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 491,5. Пример 64. Получение 1-[2-(метиламино)этил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4 илокси)-1,3,5-триазин-2-ил]фенилмочевины. 1-[2-(Метиламино)этил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенилмочевину получают процедурой с трифосгеном, описанной в примере 1, стадия 3. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 457,54. Пример 65. Получение 1-(3-ацетилфенил)-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4 илокси)-1,3,5-триазин-2-ил]фенилмочевины. 1-(3-Ацетилфенил)-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5-триазин-2 ил]фенилмочевину получают взаимодействием 4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)1,3,5-триазин-2-ил]анилина и соответствующего 3-ацетилизоцианата. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 518,58. Пример 66. Получение 1-[4-(диметиламино)фенил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Нпиран-4-илокси)-1,3,5-триазин-2-ил]фенилмочевины. 1-[4-(Диметиламино)фенил]-3-4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран-4-илокси)-1,3,5 триазин-2-ил]фенилмочевину получают взаимодействием 4-[4-морфолин-4-ил-6-(тетрагидро-2 Н-пиран 4-илокси)-1,3,5-триазин-2-ил]анилина и соответствующего 4-(N,N-диметиламино)фенилизоцианата. Продукт очищают ВЭЖХ Gilson.MC (ESI) m/z 519,61. Пример 67. Получение 4-[3-4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенилуреидо]бензойной кислоты. К смеси метил-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензоата (1,4 г, 2,69 ммоль), ТГФ (10 мл), МеОН (5 мл) и H2O (2,5 мл) при перемешивании добавляют LiOHH2O (339 мг, 8,07 ммоль) с последующим кипячением с обратным холодильником в течение 8 ч. Смесь концентрируют,добавляют H2O (5 мл) и затем подкисляют 2 н. HCl. Твердое вещество отфильтровывают, промываютH2O, сушат и получают продукт в виде твердого вещества желтовато-коричневого цвета (1,3 г, выход 96%).MC (ESI) m/z = 506,3. Пример 68. Получение N-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2 ил)фенил)уреидо)бензамида. Раствор 4-[3-4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенилуреидо]бензойной кислоты (150 мг; 0,297 ммоль), основания Хюнига (303 мкл, 1,782 ммоль) и HBTU (563 мг, 1,485 ммоль) в 2 мл NMP перемешивают в течение 1 ч при комнатной температуре, добавляют N',N'-диметилэтан-1,2-диамин (130 мкл, 1,188 ммоль) и затем перемешивают в течение ночи. Добавляют CH2Cl2 (40 мл) и смесь промывают насыщ. раствором NaHCO3 и H2O. Смесь концентрируют, остаток очищают хроматографией на силикагеле, CH2Cl2:МеОН:7 н. NH3 в МеОН (10:1:0,22) и получают продукт в виде твердого вещества белого цвета (98 мг, выход 57%). МС (ESI) m/z = 576,4. Пример 68. Получение N-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2 ил)фенил)уреидо)бензамида в виде соли HCl. К N-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензамиду(72 мг, 0,125 ммоль) и МеОН (1 мл) добавляют 4 н. раствор HCl в диоксане (1 мл) и перемешивают в течение 3 ч. Твердое вещество отфильтровывают, промывают эфиром и получают продукт в виде твердого вещества белого цвета (73 мг, выход = 95%). МС (ESI) m/z = 576,4. Пример 69. Получение гидрохлорида 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(4 метилпиперазин-1-карбонил)фенил)мочевины. При перемешивании раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (150 мг; 0,297 ммоль), основания Хюнига (303 мкл, 1,782 ммоль) и HBTU (563 мг, 1,485 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с 1-метилпиперазином (132 мкл, 1,188 ммоль) и получают 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(4-метилпиперазин-1 карбонил)фенил)мочевину в виде твердого вещества белого цвета (95 мг, выход 54%). МС (ESI) m/z = 588,4. К 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(4-метилпиперазин-1 карбонил)фенил)мочевине (70 мг, 0,119 ммоль) и МеОН (1 мл) добавляют 4 н. раствор HCl в диоксане (1 мл) и перемешивают в течение 3 ч. Твердое вещество отфильтровывают, промывают эфиром и получают продукт в виде твердого вещества белого цвета (74 мг, выход = 100%). Пример 70. Получение 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)-Nметилбензамида. При перемешивании раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (150 мг; 0,297 ммоль), основания Хюнига (303 мкл, 1,782 ммоль) и HBTU (563 мг, 1,485 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с метиламином (594 мкл, 2 М раствор в ТГФ) и получают продукт реакции в виде твердого вещества белого цвета (118 мг, выход 77%). МС (ESI) m/z = 519,3. Пример 71. Получение гидрохлорида N-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5 триазин-2-ил)фенил)уреидо)-N-метилбензамида. При перемешивании раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (150 мг; 0,297 ммоль), основания Хюнига (303 мкл, 1,782 ммоль) и HBTU (563 мг, 1,485 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с N1,N1,N2-триметилэтан-1,2-диамином (154 мкл, 1,188 ммоль) и получают N-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2 ил)фенил)уреидо)-N-метилбензамид в виде твердого вещества белого цвета (88 мг, выход 50%). МС (ESI) m/z = 590,2. КN-(2-(диметиламино)этил)-4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)-Nметилбензамиду (55 мг, 0,127 ммоль) и МеОН (1 мл) добавляют 4 н. раствор HCl в диоксане (1 мл) и перемешивают в течение 3 ч. Твердое вещество отфильтровывают, промывают эфиром и получают продукт в виде твердого вещества белого цвета (70 мг, выход = 88%). Пример 72. Получение 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(4 морфолинопиперидин-1-карбонил)фенил)мочевины. При перемешивании раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 1 мл NMP вводят во взаимодействие согласно примеру 68 с 4-(пиперидин-4-ил)морфолином (67 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт (40,1 мг, выход 62%). МС (ESI) m/z = 658,7. Пример 73. Получение 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)-N(хинуклидин-3-ил)бензамида. Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с хинуклидин-3-амином (79 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт (24,3 мг, выход 40%). МС (ESI) m/z = 614,7. Пример 74. Получение 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(4-(пирролидин-1 ил)пиперидин-1-карбонил)фенил)мочевины. Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с 4-[1-пирролидинил]пиперидином (61 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт в виде твердого вещества белого цвета (37 мг, выход 58%). МС (ESI) m/z = 642,7. Пример 75. Получение 1-(4-(1,4'-бипиперидин-1'-карбонил)фенил)-3-(4-(4,6-диморфолино-1,3,5 триазин-2-ил)фенил)мочевины. Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с 1,4'-бипиперидином (67 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт в виде твердого вещества белого цвета (39 мг,выход 60%). МС (ESI) m/z = 656,8. Пример 76. Получение 1-(4-(4-(диметиламино)пиперидин-1-карбонил)фенил)-3-(4-(4,6 диморфолино-1,3,5-триазин-2-ил)фенил)мочевины Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с N,N-диметилпиперидин-4-амином (51 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт в виде твердого вещества белого цвета (30,6 мг, выход 52%). МС (ESI) m/z = 616,7. Пример 77. Получение 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(пиперазин-1 карбонил)фенил)мочевины. Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вво- 27020317 дят во взаимодействие согласно примеру 68 с пиперазином (34 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт (17,2 мг, выход 30%). МС (ESI) m/z = 573,6. Пример 78. Получение 1-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)-3-(4-(2-(пиридин-2 ил)ацетил)фенил)мочевины. Раствор 4-(3-(4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил)уреидо)бензойной кислоты (50 мг; 0,099 ммоль), основания Хюнига (103 мкл, 0,594 ммоль) и HBTU (188 мг, 0,495 ммоль) в 2 мл NMP вводят во взаимодействие согласно примеру 68 с пиридин-2-илметанамином (43 мг, 0,396 ммоль). Растворитель выпаривают, остаток очищают ВЭЖХ и получают продукт (9 мг, выход 15%). МС (ESI) m/z = 596,6. Получение 3-(4,6-дихлор-1,3,5-триазин-2-ил)-8-окса-3-азабицикло[3.2.1]октана. К раствору хлорангидрида циануровой кислоты (2,00 г, 10,85 ммоль) в ацетоне (20 мл) и воде (10 мл) при 0 С из капельной воронки в течение 15 мин добавляют раствор гидрохлорида 8-окса-3 азабицикло[3.2.1]октана (1,46 г, 9,76 ммоль) в насыщенном водном растворе NaHCO3 (25 мл) и ацетоне(25 мл). Реакционную смесь перемешивают при 0 С в течение 2 ч и затем фильтруют и собирают выпавшее в осадок вещество белого цвета. Осадок промывают водой (25 мл) и сушат. Сырой продукт реакции очищают колоночной хроматографией (этилацетат в гексане, 30:70) и получают 3-(4,6-дихлор-1,3,5 триазин-2-ил)-8-окса-3-азабицикло[3.2.1]октан (1,55 г) в виде твердого вещества белого цвета. Процедура получения 3-(4-хлор-6-(замещенный амино)-1,3,5-триазин-2-ил)-8-окса-3 азабицикло[3.2.1]октана. К раствору 3-(4,6-дихлор-1,3,5-триазин-2-ил)-8-окса-3-азабицикло[3.2.1] октана (0,085 г, 0,33 ммоль) и Na2CO3 (0,041 г, 0,39 ммоль) в ацетоне (1 мл) и воде (1 мл) добавляют нужный амин (0,36 ммоль). Раствор нагревают при 55 С и перемешивают в течение 2 ч, затем концентрируют и получают сырой аминотриазин, который используют непосредственно без очистки. Следуя такой процедуре, получают следующие соединения: 3-(4-хлор-6-(пиперидин-1-ил)-1,3,5-триазин-2-ил)-8-окса-3-азабицикло[3.2.1]октан (310,3, М+Н); 3-(4-хлор-6-(пирролидин-1-ил)-1,3,5-триазин-2-ил)-8-окса-3-азабицикло[3.2.1]октан (296,3, М+Н); трет-бутил-2-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-хлор-1,3,5-триазин-2 иламино)этил)карбамат (385,3, М+Н); 2-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-хлор-1,3,5-триазин-2-иламино)этанол (286,3, М+Н); 4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-хлор-N-фенил-1,3,5-триазин-2-амин (318,3, М+Н); 4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-хлор-N-циклогексил-1,3,5-триазин-2-амин (324,3, М+Н); трет-бутил-3-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-хлор-1,3,5-триазин-2-иламино)азетидин-1 карбоксилат (397,3, М+Н). Способ получения 4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-(замещенный амино)-1,3,5 триазин-2-ил)анилина. Суспензию хлорида бисаминотриазина (0,33 ммоль) в толуоле (2 мл), этаноле (2 мл) и 2 М водном растворе Na2CO3 (0,700 мл) в склянке для обработки микроволновым излучением продувают N2 в течение 5 мин. Добавляют Pd(PPh3)4 (0,021 мг, 0,018 ммоль) и пинаколовый эфир 4-аминофенилбороновой кислоты (0,94 мг, 0,43 ммоль), склянку плотно закрывают и нагревают при 110 С в течение 1 ч. Смесь охлаждают и фильтруют через целит. Остаток на фильтре промывают этилацетатом, фильтрат промывают рассолом, сушат и концентрируют. Сырой материал очищают ВЭЖХ (система Waters, 5-70%(381,4, М+Н); трет-бутил-3-(4-(4-аминофенил)-6-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-1,3,5-триазин-2 иламино)азетидин-1-карбоксилат (454,4, М+Н). Процедура получения 1-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-(замещенный амино)-1,3,5 триазин-2-ил)фенил)-3-(пиридин-4-ил)мочевины. Получают раствор трифосгена (0,034 мг, 0,114 ммоль) в CH2Cl2 (1 мл). Добавляют раствор нужного производного триазинанилина (0,23 ммоль) в CH2Cl2 (1 мл) и триэтиламин (0,095 мл, 0,68 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 15 мин. Затем добавляют раствор 4-аминопиридина (0,043 мг, 0,46 ммоль) в ТГФ (1 мл) и раствор перемешивают при комнатной темпера- 28020317 туре в течение 3 ч, затем концентрируют и остаток очищают ВЭЖХ (система Waters, 5-70% CH3CN вH2O, мас./0,05% NH4OH) и получают 1-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-(замещенный амино)-1,3,5-триазин-2-ил)фенил)-3-(пиридин-4-ил)мочевины. Перечисленные далее соединения получают с помощью такой процедуры. Пример 79. Получение 1-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-(пиперидин-1-ил)-1,3,5 триазин-2-ил)фенил)-3-(пиридин-4-ил)мочевины; 487,2, М+Н. Пример 80. Получение 1-(4-(4-(8-окса-3-азабицикло[3.2.1]октан-3-ил)-6-(пирролидин-1-ил)-1,3,5 триазин-2-ил)фенил)-3-(пиридин-4-ил)мочевины; 474,2, М+Н. Пример 81. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4-(1 гидроксиэтил)фенил]мочевины. К смеси 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и метиленхлорида при перемешивании при 0 С добавляют трифосген (0,25 г, 0,84 ммоль) и Et3N (3 мл). Реакционную смесь перемешивают в течение 20 мин при 0 С. Затем к смеси добавляют 1-(4-аминофенил)этанол (0,10 г, 0,73 ммоль). Реакционную смесь перемешивают в течение примерно 16 ч при комнатной температуре. Растворитель выпаривают. Остаток растворяют в ДМСО и передают на ВЭЖХ с использованием ацетонитрильного буфера ТФК и получают 48 мг (24%) 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]3-[4-(1-гидроксиэтил)фенил]мочевины. М+Н 506,4. Пример 82. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(2-метилпиридин-4 ил)мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 2-метил-4 аминопиридина (80 мг, 0,73 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-(2-метилпиридин-4-ил)мочевину. Выход 60 мг, 27%. МС (ESI) m/z = 477,3. Пример 83. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4(гидроксиметил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 аминофенилметанола (100 мг, 0,81 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4(гидроксиметил)фенил]мочевину. Выход 58 мг, 26%. МС (ESI) m/z = 492,3. Пример 84. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4 гидроксифенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил) анилина (0,140 г, 0,40 ммоль) и 4 аминофенола (89 мг, 0,81 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4-гидроксифенил]мочевину. Выход 62 мг, 16%. МС (ESI) m/z = 478,2. Пример 85. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4(трифторметил)фенил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 трифторметиланилина (100 мг, 0,81 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[4(трифторметил)фенил]мочевину. Выход 25 мг, 13%. МС (ESI) m/z = 430,2. Пример 86. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-4-[2,2,2-трифтор-1 гидрокси-1-(трифторметил)этил]фенилмочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,140 г, 0,40 ммоль) и 4 трифторметиланилина (140 мг, 0,40 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-4-[2,2,2-трифтор-1-гидрокси 1-(трифторметил)этил]фенилмочевину. Выход 40 мг, 16%. МС (ESI) m/z = 628,3. Пример 87. Получение 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[5(трифторметил)пиридин-2-ил]мочевины. Исходя из 4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)анилина (0,160 г, 0,47 ммоль) и 2-амино-5 трифторфенилпиридина (100 мг, 0,61 ммоль) и следуя процедуре, изложенной в примере 81, очисткой ВЭЖХ извлекают 1-[4-(4,6-диморфолин-4-ил-1,3,5-триазин-2-ил)фенил]-3-[5-(трифторметил)пиридин-2 ил]мочевину.
МПК / Метки
МПК: A61P 35/00, A61K 31/53, C07D 498/08
Метки: киназы, ингибиторы, триазины
Код ссылки
<a href="https://eas.patents.su/30-20317-triaziny-kak-ingibitory-kinazy-pi3-i-mtor.html" rel="bookmark" title="База патентов Евразийского Союза">Триазины как ингибиторы киназы pi3 и mtor</a>
Предыдущий патент: Материалы на основе полиолефинов, подвергнутые вытяжке, изделия, полученные из них
Следующий патент: Иминные соединения для борьбы с беспозвоночными вредителями
Случайный патент: Защищенная система, использующая в качестве ключа непрерывно изменяющиеся признаки части тела пользователя