Модуляторы рецептора tgr5 и их применение
Формула / Реферат
1. Соединение формулы (D)

или его соль или сольват, где
R1 представляет собой водород, гидрокси, незамещенный С1-С6алкил или галоген;
R2 представляет собой водород или α-гидрокси;
R4 представляет собой этил;
R7 представляет собой водород, незамещенный С1-С6алкил или гидрокси;
R11 представляет собой гидроксил, OSO3H, OSO3-, OCOCH3, ОРО3Н, ОРО32- или водород и
R12 представляет собой гидроксил, OSO3H, OSO3-, ОСОСН3, ОРО3Н, ОРО32- или водород.
2. Соединение формулы Е
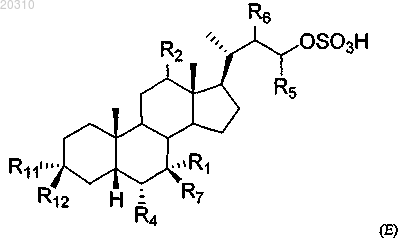
или его соль или сольват конъюгата, где
R1 представляет собой водород, гидрокси, незамещенный С1-С6алкил или галоген;
R2 представляет собой водород или α-гидроксил;
R4 представляет собой этил;
R5 представляет собой водород или незамещенный С1-С6алкил;
R6 представляет собой водород;
R7 представляет собой водород, незамещенный С1-С6алкил или гидрокси;
R11 представляет собой гидроксил, OSO3H, OSO3-, OCOCH3, ОРО3Н, ОРО32- или водород и
R12 представляет собой гидроксил, OSO3H, OSO3-, OCOCH3, ОРО3Н, ОРО32- или водород.
3. Соединение по п.1 или 2, или его соль, или сольват, где R11 представляет собой гидроксил и R12 представляет собой водород.
4. Соединение по любому из пп.1-3, или его соль, или сольват, где R1 представляет собой группу ОН.
5. Соединение по любому из пп.1-4, или его соль, или сольват, где R7 представляет собой Н.
6. Соединение по любому из пп.1-5, или его соль, или сольват, где R2 представляет собой Н.
7. Соединение, выбранное из
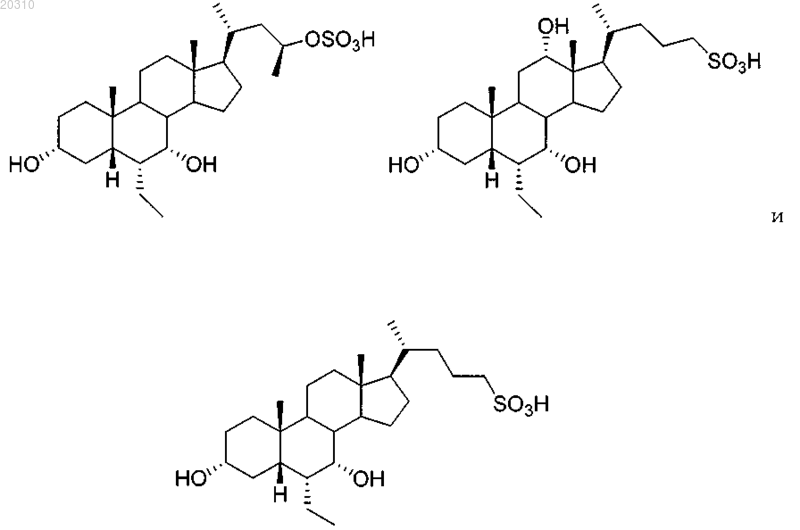
или его соль или сольват.
8. Соединение по любому из пп.1-7, где указанное соединение представляет собой фармацевтически приемлемую соль.
9. Соединение по п.8, где фармацевтически приемлемая соль представляет собой
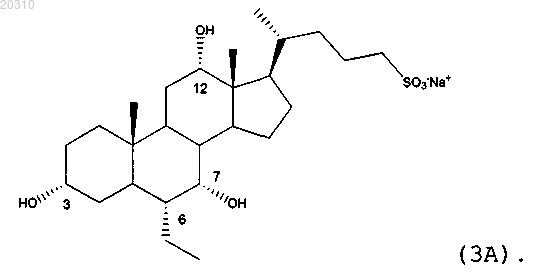
10. Соединение по п.8, где фармацевтически приемлемая соль представляет собой
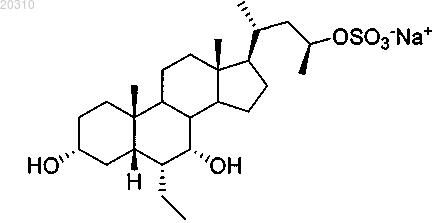
11. Фармацевтическая композиция, включающая соединение по любому из пп.1-10, или его соль, или сольват и по меньшей мере один фармацевтически приемлемый наполнитель.
12. Способ лечения или предупреждения заболевания, связанного с модулированием рецептора TGR5 у субъекта, включающий введение соединения по любому из пп.1-9, или его соли, или сольвата.
13. Способ по п.12, где заболевание выбрано из метаболического заболевания, воспалительного заболевания, заболевания печени, аутоиммунного заболевания, сердечного заболевания, заболевания почек, рака и заболевания желудочно-кишечного тракта.
14. Способ по п.13, где заболевание выбрано из воспалительного заболевания и рака.
15. Способ по любому из пп.12-14, где соединение, или его соль, или сольват вводят субъекту перорально, парентерально, внутривенно или местно.
16. Способ по любому из пп.12-15, где субъект является человеком.
Текст
где значения радикалов определены в описании изобретения. Изобретение также относится к фармацевтической композиции, включающей вышеуказанное соединение, или его соль, или сольват и фармацевтически приемлемый носитель, и к способу лечения или предупреждения заболевания, связанного с модулированием рецептора TGR5 у субъекта, включающему введение вышеуказанного соединения, или его соли, или сольвата. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, содержащим фрагмент серной или сульфоновой кислоты, которые модулируют рецептор TGR5, а также к фармацевтическим композициям, содержащим такие соединения, применимым в способах лечения и профилактики ряда заболеваний. Предпосылки изобретенияTGR5 представляет собой рецептор, сопряженный с G-белком, который был идентифицирован, как рецептор, находящийся на поверхности клетки, который реагирует на желчные кислоты (ВА). Было обнаружено, что первичная структура TGR5 и его способность реагировать на желчные кислоты, обладают высокой степенью консервативности в ряду рецепторов TGR5, принадлежащих человеку, коровам, кроликам, крысам и мышам, и это позволяет предположить, что TGR5 обладает важными физиологическими функциями. Было установлено, что рецептор TGR5 широко распространен не только в лимфоидных, но также и в других тканях. Высокие уровни мРНК TGR5 были найдены в плаценте, селезенке и моноцитах/макрофагах. Было показано, что желчные кислоты вызывают интернализацию слитого белка TGR5 из клеточной оболочки в цитоплазму. Kawamata et al., 2003, J. Bio. Chem., 278, 9435. Было установлено,что TGR5 идентичен hGPCR19, о котором сообщалось Takeda и соавторами 2002, EFBS Lett. 520, 97-101.TGR5 связан с внутриклеточным накоплением сАМР, который в значительных количествах вырабатывается в клетках различных типов. Хотя активация обсуждаемого мембранного рецептора в макрофагах снижает выработку провоспалительных цитокинов (Kawamata, Y.; Fujii, R.; Hosoya, M.; Harada, M.;TGR5 действием ВА в адипоцитах и миоцитах увеличивает расход энергии (Watanabe M.; Houten S. M.;Schoonjans K.; Bianco A. C.; Auwerx J., Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation. Nature. 2006, 439, 484-489). Этот последний эффект включает сАМР-зависимую индукцию йодтиронин дейодиназы 2 типа (D2), которая за счет локального превращения Т 4 в Т 3 вызывает увеличение активности тиреоидного гормона. В соответствии с ролью TGR5 в регулировании энергетического метаболизма, самки TGR-5-нокаутированных мышей продемонстрировали значительное накопление жира и прирост массы тела, когда их провоцировали кормом с высоким содержанием жира,показывая, что отсутствие TGR5 понижает расход энергии и вызывает ожирение (Maruyama Т.; Tanaka,K.; Suzuk J.; Miyoshi H.; Harada N.; Nakamura Т.; Miyamoto Y.; Kanatani A.; Tamai Y., Targeted disruptionof G protein-coupled bile acid receptor 1 (Gpbarl/MBar) in mice. J. Endocrinol. 2006, 191, 197-205). Помимо этого и в соответствии с участием TGR5 в энергетическом гомеостазе, сообщалось, что активация мембранного рецептора под действием жирных кислот способствует выработке глюкагон-подобного пептида 1 (GLP-1) в линиях энтероэндокринных клеток мышей (Katsuma, S. ; Hirasawa, A.; Tsujimoto, G., Bile acids promote glucagon-like peptide-1 secretion through TGR5 in a murine enteroendocrine cell line STC-1. Biochem. Biophys. Res. Commun. 2005, 329, 386-390). Исходя из всех приведенных выше данных, TGR5 является привлекательной мишенью для лечения ряда заболеваний. До настоящего времени в литературе было описано несколько примеров агонистов рецепторов В частности, метилирование C23-(S) положения природных ВА придает им заметную селективность в отношении способности активировать TGR5 по сравнению с активацией FXR (рецептора X фарнезоидов), в то время как замещение алкилом положения 6 увеличивает силу действия на оба рецептора. Другие агонисты TGR5 включают бензиловый эфир 6-метил-2-оксо-4-тиофен-2-ил-1,2,3,4 тетрагидропиримидин-5-карбоновой кислоты (WO 004067008, Takeda Chemical Industries LTD, Japan,2004) и олеанолевую кислоту (Sato H.; Genet С.; Strehle A.; Thomas С.; Lobstein A.; Wagner A.; Mioskowski С.; Auwerx J.; Saladin R., Antihyperglycemic activity of a TGR5 agonist isolated from Olea europaea. Biochem. and Biophys. Res. Commun. 2007, 362, 793-798; Ito F.; Hinuma K.; Kanzaki N.; Miki Т.; Kawamata, Y.;receptor agonists. PN: WO 2004067008, 2004. Позднее, первый синтез энантиомерной хенодезоксихолевой кислоты (CDCA) и литохолевой кислоты (LCA) дал возможность установить специфичность действия природных ВА на TGR5 (Katona В. W.; Cummins С. L.; Ferguson A. D.; Li Т.; Schmidt D. R.; Mangelsdorf,D. J.; Covey D. F., Synthesis, Characterization and Receptor Interaction Profiles of Enantiomeric Bile Acids. J.Med. Chem. 2007, 50, 6048-6058). Хотя указанные химические средства исследования впервые обеспечили фармакологическую дифференциацию геномных и негеномных действий ВА, некоторые из них позволили также провести первые исследования взаимосвязи между структурой и активностью, где наличие дополнительных связывающих карманов в молекуле TGR5 играет ключевую роль в определении селективности по отношению к лигандам (Pellicciari R.; Sato H.; Gioiello A.; Costantino G.; Macchiarulo A.; Sadeghpour B. M.; Giorgi G.; Schoonjans K.; Auwerx J., Nongenomic actions of bile acids. Synthesis and preliminary characterization of 23-and 6,23-alkyl-substituted bile acid derivatives as selective modulators for the g-protein coupled receptor TGR5. J.Med. Chem. 2007, 50, 4265-4268). В этом контексте возможность использования более мощных и селективных модуляторов TGR5 необходима для дальнейшего выявления дополнительных особенностей, влияющих на активацию рецептора, и описания физиологического и фармакологического действия этого рецептора. Существует потребность в разработке модуляторов рецептора TGR5 для лечения и профилактики ряда заболеваний. В настоящем изобретении разработаны соединения, содержащие фрагмент серной или сульфоновой кислоты, которые модулируют TGR5, а также способы применения этих соединений для лечения заболеваний. Сущность изобретения Настоящее изобретение относится к модуляторам рецептора TGR5, содержащим фрагмент серной или сульфоновой кислоты, и к их применению для лечения и профилактики заболеваний, при которых происходит модулирование рецептора TGR5, например, метаболических заболеваний, воспалительных заболеваний, заболеваний печени, аутоиммунных заболеваний, сердечных заболеваний, заболеваний почек, рака и заболеваний желудочно-кишечного тракта. Изобретение включает соединение, имеющее формулу А: или его соль, сольват или гидрат, где R1 означает водород, гидрокси, или незамещенный С 1-С 6 алкил или галоген; R2 означает водород или -гидрокси; R4 означает водород, -гидрокси; R5 означает водород или незамещенный C1-С 6 алкил; R6 означает водород; R7 означает водород, замещенный или незамещенный алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, OCOCH3, ОРО 3 Н, ОРО 32- или водород;(1) если m+n+o=3 или 4, р означает ноль, и R5 является атомом водорода, то R4 не является атомом водорода, если R7 не является ОН; (2) если m+n+o=3, p означает 1 и каждый из заместителей R5 и R6 является атомом водорода, то по меньшей мере один из заместителей R2 и R4 не является атомом водорода; и (3) если m+n+o=2, то по меньшей мере один из заместителей R5 и R6 не является атомом водорода. В одном из аспектов настоящее изобретение включает соединение, имеющее формулу D или его соль, сольват или гидрат, где R1 означает водород, гидрокси, или незамещенный C1-С 6 алкил или галоген; R2 означает водород или -гидрокси; R4 означает этил; R7 означает водород, незамещенный С 1-С 6 алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, OCOCH3, ОРО 3 Н, ОРО 32- или водород; и R12 означает гидроксил, OSO3H, OSO3-, ОСОСН 3, ОРО 3 Н, ОРО 32- или водород. В одном из аспектов настоящее изобретение включает соединение, имеющее формулу E: или его соль, сольват или гидрат, где R1 означает водород, гидрокси, незамещенный С 1-С 6 алкил или галоген; R2 означает водород или -гидрокси; R4 означает этил; R5 означает водород или незамещенный С 1-С 6 алкил; R6 означает водород; R7 означает водород, незамещенный С 1-С 6 алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, OCOCH3, OPO3H, ОРО 32- или водород и R12 означает гидроксил,OSO3H, OSO3-, ОСОСН 3, ОРО 3 Н, ОРО 32- или водород. В одном из аспектов, настоящее изобретение включает соединение или его соль, сольват или гидрат, где R1 представляет собой ОН. В одном из аспектов настоящее изобретение включает соединение или его соль, сольват или гидрат, где R7 представляет собой Н. В одном из аспектов, настоящее изобретение включает соединение или его соль, сольват или гидрат, где R2 представляет собой Н. В одном из аспектов, настоящее изобретение включает соединение или его соль, сольват или гидрат, где R4 является незамещенным алкилом. В одном из аспектов изобретение включает соединение, выбранное из или его соль, сольват или гидрат. В одном из аспектов настоящее изобретение включает соединение, которое представляет собой фармацевтически приемлемую соль. В одном из аспектов изобретение включает фармацевтическую композицию, содержащую соединение или его соль, сольват или гидрат, а также по меньшей мере один фармацевтически приемлемый наполнитель. В другом аспекте изобретение относится к способу лечения заболеваний, при которых имеет место модулирование рецептора TGR5, включающему введение соединения, имеющего формулу А, или его соли, сольвата или гидрата, или фармацевтической композиции, включающей соединение формулы А или его соль, сольват или гидратR1 означает водород, гидрокси или незамещенный С 1-С 6 алкил или галоген; R2 означает водород или гидрокси; R4 означает этил; R5 означает водород или незамещенный С 1-С 6 алкил; R6 означает водород; R7 означает водород или незамещенный С 1-С 6 алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, OCOCH3,ОРО 3 Н, ОРО 32- или водород; R12 означает гидроксил, OSO3H, OSO3-, ОСОСН 3, ОРО 3 Н, ОРО 32- или водород; профилактики заболевания у субъекта, при котором имеет место модулирование рецептора TGR5. В одном из аспектов настоящее изобретение включает указанный способ, где заболевание выбрано из метаболического заболевания, воспалительного заболевания, заболевания печени, аутоиммунного заболевания, сердечного заболевания, заболевания почек, рака и заболевания желудочно-кишечного тракта. В одном из аспектов изобретение включает указанное применение, где заболевание выбрано из воспалительного заболевания и рака. В одном из аспектов изобретение включает указанный способ, где соединение или фармацевтическую композицию вводят субъекту перорально, парентерально, внутривенно или местно. В одном из аспектов изобретение включает указанный способ, где субъект является человеком. В приведенном выше описании наиболее важные особенности настоящего изобретения изложены до некоторой степени обобщенно, для того, чтобы можно было понять приведенное ниже подробное описание изобретения и чтобы можно было лучше оценить вклад настоящего изобретения в технику. Другие цели и отличительные особенности настоящего изобретения станут ясны из рассмотрения приведенного ниже подробного описания в сочетании с примерами. Краткое описание иллюстративного материала Фиг. 1 представляет собой график, на котором изображена зависимость поверхностного натяжения от логарифма концентрации соединения 3 А (мМ) в 0,15 М NaCl. Фиг. 2 представляет собой график, на котором изображена метаболическая устойчивость соединения 2 А в искусственной панкреатической жидкости. Фиг. 3 представляет собой график, на котором изображено выделение желчи в эксперименте по дуоденальной инфузии соединения 3 А. Фиг. 4 представляет собой график, на котором изображено выделение желчи в эксперименте по феморальной инфузии соединения 3 А. Фиг. 5 представляет собой график, на котором изображена зависимость скоростей секреции от времени в экспериментах по феморальной и дуоденальной инфузии соединения 3 А. Фиг. 6 и 7 представляют собой графики, на которых показано содержание соединения 3 А и его основного метаболита в желчи, определенное с использованием масс-спектрометрии в эксперименте по дуоденальной инфузии. Данные приведены в виде абсолютных значений площади. Фиг. 7 представляет собой увеличенный фрагмент фиг. 6. Фиг. 8 представляет собой график, на котором показан прирост массы (%) в зависимости от времени после введения препарата (пример 11). Фиг. 9 представляет собой группу гистограмм, отображающих изменение со временем массы различных составных частей организма (в %) в результате введения препаратов через 5 недель с начала введения (пример 11). На фиг. 10 показаны результаты оценки гомеостаза глюкозы для соединения 3 А. На фиг. 10 А показана гликемия через 3 недели после начала введения. На фиг. 10 В показано содержание фруктозаминов через 3 недели после начала введения. На фиг. 10 С показаны результаты теста на переносимость глюкозы через 9 недель после начала введения. Описание изобретения В приведенном ниже описании изложены детали одного или нескольких вариантов осуществления настоящего изобретения. В данном разделе описаны способы и материалы, хотя при практическом воплощении или тестировании по настоящему изобретению могут применяться любые способы и материалы, аналогичные или эквивалентные описанным в настоящей заявке. Другие отличительные особенности, цели и преимущества настоящего изобретения будут ясны из приведенного описания. В тексте описания формы единственного числа включают также формы множественного числа, если контекст явно не указывает на иное. Если не определено по-другому, все технические и научные термины, использованные в описании, имеют значение, в котором их обычно понимает рядовой специалист в той области техники, к которой относится настоящее изобретение. В случае возникновения противоречий, настоящее описание будет иметь преимущественную силу. В одном из аспектов, изобретение относится к соединению, имеющему формулу А или его соли, сольвату или гидрату, где R1 означает водород, гидрокси, замещенный или незамещенный алкил или галоген; R2 означает водород или -гидрокси; R4 означает водород, замещенный или незамещенный алкил или галоген; R5 означает водород, незамещенный алкил или арил; R6 означает водород, незамещенный или замещенный алкил, или R5 и R6 совместно с атомами углерода, к которым они присоединены, образуют цикл, состоящий из 3, 4, 5 или 6 атомов; R7 означает водород, замещенный или-4 020310 незамещенный алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, ОСОСН 3, ОРО 3 Н, OPO32- или водород; R12 означает гидроксил, OSO3H, OSO3-, OCOCH3, ОРО 3 Н, ОРО 32- или водород, или R11 и R12 совместно образуют карбонил; m означает 0, 1 или 2; n означает 0 или 1; о означает 0 или 1 и р означает 0 или 1. В одном из аспектов изобретения, если m+n+o=3 или 4, р означает ноль и R5 является атомом водорода, то R4 не является атомом водорода, если R7 не является группой OH. В другом аспекте изобретения, если m+n+o=3 или 4, р означает ноль, и R5 не является незамещенным алкилом или арилом, то R4 не является атомом водорода, если R7 не является группой ОН. В одном из аспектов настоящего изобретения, если m+n+o=3, р означает 1 и каждый из заместителей R5 и R6 является атомом водорода, то, по меньшей мере, один из заместителей R2 и R4 не является атомом водорода. В одном из аспектов настоящего изобретения, если m+n+o=2, то по меньшей мере один из заместителей R5 и R6 не является атомом водорода. В одном из аспектов настоящее изобретение не включает соединения А, В и С или их соли, сольваты или гидраты. В другом аспекте, изобретение не включает соединение 6 А или его соль, сольват или гидрат. В другом аспекте, изобретение не включает соединение 7 А или его соль,сольват или гидрат. В одном из аспектов, изобретение относится к соединению, имеющему формулу В или его соли, сольвату или гидрату, где R2, R4 и R6, m, n, о и р соответствуют данным выше определениям. В одном из аспектов изобретения, если m+n+o=3 или 4, р означает ноль, R5 является атомом водорода, то R4 не является атомом водорода. В одном из аспектов настоящего изобретения, если m+n+o=3,p означает 1, и каждый из заместителей R5 и R6 является атомом водорода, то по меньшей мере один из заместителей R2 и R4 не является атомом водорода. В другом аспекте настоящего изобретения, еслиm+n+о=2, то по меньшей мере один из заместителей R5 и R6 не является атомом водорода. В одном из аспектов, изобретение относится к соединению, имеющему формулу C или его соли, сольвату или гидрату, где R2, R5, R6, m, n, о и р соответствуют данным выше определениям. В одном из аспектов изобретения, если m+n+o=2, то по меньшей мере один из заместителей R5 иR6 не является атомом водорода. В одном из аспектов, изобретение относится к соединению, имеющему формулу D или его соли, сольвату или гидрату, где R1, R2, R4, R7, R11 и R12 соответствуют данному выше определению. В одном из аспектов, R4 не является атомом водорода. В одном из аспектов изобретение относится к соединению, имеющему формулу Е или его соли, сольвату или гидрату, где R1 означает водород, гидрокси, замещенный или незамещенный алкил или галоген; R2 означает водород или -гидроксил; R4 означает водород, замещенный или незамещенный алкил или галоген; R5 означает водород, незамещенный алкил или арил; R6 означает водород, незамещенный или замещенный алкил, или R5 и R6 совместно с атомами углерода, к которым они присоединены, образуют цикл, состоящий из 3, 4, 5 или 6 атомов; R7 означает водород, замещенный или незамещенный алкил или гидрокси; R11 означает гидроксил, OSO3H, OSO3-, ОСОСН 3, ОРО 3 Н, ОРО 32- или водород; и R12 означает гидроксил, OSO3H, OSO3-, OCOCH3, ОРО 3 Н, ОРО 32- или водород, или R11 и R12 совместно образуют карбонил. В одном из аспектов изобретения по меньшей мере один из заместителейR5 или R6 не является атомом водорода. В одном из аспектов изобретение относится к соединению, имеющему формулу F или его соли, сольвату или гидрату, где R5 означает незамещенный или замещенный алкил или арил; и R1, R2, R4, R7, R11 и R12 соответствуют данным выше определениям. В одном из аспектов изобретение относится к соединению, имеющему формулу G или его соли, сольвату или гидрату, где R1, R2, R4, R7, R11 и R12 соответствуют данным выше определениям. В одном из аспектов изобретение относится к соединению, имеющему формулу H или его соли, сольвату или гидрату, где R2, R5 и R6 соответствуют данным выше определениям. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR1 означает OH. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR7 означает Н. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR1 означает ОН, и R7 означает Н. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR2 означает Н. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R2 означает альфа-ОН. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R2 означает бета-ОН. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR4 представляет собой незамещенный алкил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R4 представляет собой этил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R4 представляет собой метил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR5 не является атомом водорода. В одном из аспектов изобретение относится к соединению или его соли,сольвату или гидрату, где R5 представляет собой незамещенный алкил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R5 представляет собой метил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR6 является водородом. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где оба заместителя R5 и R6 являются атомами водорода. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR11 представляет собой гидроксил. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R12 представляет собой водород. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R11 представляет собой гидроксил и R12 является атомом водорода. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеm равно 1. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где m равно 2. В одном из аспектов, изобретение относится к соединению или его соли, сольвату или гидрату, где n равно 1. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где о равно 0. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату,где о равно 1. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где р равно 1. В одном из аспектов, изобретение относится к соединению или его соли, сольвату или гидрату,где р равно 0. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, гдеR4 представляет собой этил и р равно 1. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату, где R4 представляет собой этил, и соединение содержит сульфонатный фрагмент. В одном из аспектов изобретение относится к соединению или его соли, сольвату или гидрату,где R4 представляет собой водород или замещенный или незамещенный алкил, и р равно 0. В одном из аспектов изобретение относится к соединению, выбранному из или его соли, сольвату или гидрату. В одном из аспектов изобретение относится к соединению, где соединение представляет собой фармацевтически приемлемую соль. В одном из аспектов изобретение относится к фармацевтически приемлемой соли, выбранной из В одном из аспектов изобретение относится к фармацевтической композиции, включающей соединение по настоящему изобретению и по меньшей мере один фармацевтически приемлемый наполнитель. В одном из аспектов изобретение относится к применению соединения или фармацевтической композиции по настоящему изобретению для изготовления лекарственных средств, для лечения или профилактики заболевания у субъекта. В другом аспекте изобретение относится к способу лечения или профилактики заболевания у субъекта путем введения соединения или фармацевтической композиции по настоящему изобретению. В одном из аспектов изобретение предусматривает введение субъекту терапевтически эффективного количества соединения или фармацевтической композиции по настоящему изобретению. В одном из аспектов изобретение предусматривает введение субъекту профилактически эффективного количества соединения или фармацевтической композиции по настоящему изобретению. В одном из аспектов изобретение относится к применению соединения или фармацевтической композиции по настоящему изобретению для изготовления лекарственного средства для лечения или профилактики заболевания, при котором имеет место модулирование рецептора TGR5, у субъекта. Настоящее изобретение включает способ лечения или профилактики заболевания, при котором имеет место модулирование рецептора TGR5, у субъекта, путем введения соединения или фармацевтической композиции по настоящему изобретению. В одном из аспектов изобретение относится к указанному применению, где заболевание выбрано из метаболического заболевания, воспалительного заболевания, заболевания печени, аутоиммунного заболевания, сердечного заболевания, заболевания почек, рака и заболевания желудочно-кишечного тракта,причем применяемое соединение имеет формулу А, В, С, D, E, F или G. Изобретение охватывает способ лечения или профилактики заболевания, выбранного из метаболического заболевания, воспалительного заболевания, заболевания печени, аутоиммунного заболевания, сердечного заболевания, заболевания почек, рака и заболевания желудочно-кишечного тракта, с применением соединений формул А, В, С, D,E, F или G. Изобретение охватывает способ лечения или профилактики воспалительного заболевания или рака с применением соединений формул А, В, С, D, E, F или G. В одном из аспектов изобретение относится к указанному применению, где заболевание представляет собой метаболическое заболевание, выбранное из ожирения, диабета, метаболического синдрома,невосприимчивости к инсулину, гипертонии и дислипидемии. Изобретение включает способ лечения или профилактики метаболического заболевания, выбранного из ожирения, диабета, метаболического синдрома, невосприимчивости к инсулину, гипертонии и дислипидемии. В одном из аспектов изобретение относится к указанному применению, где заболевание представляет собой воспалительное заболевание, выбранное из аллергии, остеоартрита, аппендицита, бронхиальной астмы, панкреатита, аллергической сыпи и псориаза. Изобретение включает способ лечения или профилактики воспалительного заболевания, выбранного из аллергии, остеоартрита, аппендицита, бронхиальной астмы, панкреатита, аллергической сыпи и псориаза. В одном из аспектов изобретение относится к указанному применению, где заболевание представляет собой аутоиммунное заболевание, выбранное из ревматоидного артрита, рассеянного склероза и диабета I типа. Изобретение включает способ лечения или профилактики аутоиммунного заболевания,выбранного из ревматоидного артрита, рассеянного склероза и диабета I типа. В одном из аспектов, изобретение относится к указанному применению, где заболевание представляет собой заболевание желудочно-кишечного тракта, выбранное из воспалительного заболевания кишечника (болезни Крона, язвенного колита), синдрома короткого кишечника (радиационного колита),микроскопического колита, синдрома раздраженного кишечника (расстройства всасывания в кишечнике) и чрезмерного развития микрофлоры. Изобретение включает способ лечения или профилактики желудочно-кишечного заболевания, выбранного из воспалительного заболевания кишечника (болезни Крона,язвенного колита), синдрома короткого кишечника (радиационного колита), микроскопического колита,синдрома раздраженного кишечника (расстройства всасывания в кишечнике) и чрезмерного развития микрофлоры. В одном из аспектов, изобретение относится к указанному применению, где заболевание представляет собой почечное заболевание, выбранное из диабетической нефропатии, хронической почечной недостаточности, гипертонического нефросклероза, хронического гломерулонефрита, хронической трансплантационной гломерулопатии, хронического интерстициального нефрита и поликистозной болезни почек. Изобретение включает способ лечения или профилактики почечного заболевания, выбранного из диабетической нефропатии, хронической почечной недостаточности, гипертонического нефросклероза,хронического гломерулонефрита, хронической трансплантационной гломерулопатии, хронического интерстициального нефрита и поликистозной болезни почек. В одном из аспектов, изобретение относится к указанному применению, где заболевание представляет собой раковое заболевание, выбранное из колоректального рака, рака печени, гепатоклеточной карциномы, холангиокарциномы, рака почек, рака желудка, рака поджелудочной железы, рака простаты и инсуланомы. Изобретение включает способ лечения или профилактики ракового заболевания, выбранного из колоректального рака, рака печени, гепатоклеточной карциномы, холангиокарциномы, рака почек,рака желудка, рака поджелудочной железы, рака простаты и инсуланомы. В одном из аспектов, изобретение относится к указанному применению, где заболевание представляет собой заболевание печени, выбранное из неалкогольного стеатогепатита, неалкогольного жирового перерождения печени, хронического вирусного гепатита, алкогольных заболеваний печени, лекарственного гепатита, гемохроматоза, первичного билиарного цирроза, первичного склерозирующего холангита,портальной гипертензии, десатурации желчи, болезни Гоше, болезни Вилсона, недостаточности 1 антитрипсина, полного парентерального питания (TPN), холелитиаза, холелитиаза, связанного с TPN, и сепсиса. Изобретение включает способ лечения или профилактики заболевания печени, выбранного из неалкогольного стеатогепатита, неалкогольного жирового перерождения печени, хронического вирусного гепатита, алкогольных заболеваний печени, лекарственного гепатита, гемохроматоза, первичного билиарного цирроза, первичного склерозирующего холангита, портальной гипертензии, десатурации желчи, болезни Гоше, болезни Вилсона, недостаточности 1-антитрипсина, полного парентерального питания (TPN), холелитиаза, холелитиаза, связанного с TPN и сепсиса. В одном из аспектов изобретение относится к указанному применению, где заболевание представляет собой сердечное заболевание, выбранное из застойной сердечной недостаточности, инфаркта миокарда, атеросклероза, стенокардии, артериосклероза и цереброваскулярных заболеваний (кровоизлияния,инсульта, цереброваскулярного инфаркта). Изобретение включает способ лечения или профилактики сердечного заболевания, выбранного из застойной сердечной недостаточности, инфаркта миокарда, атеросклероза, стенокардии, артериосклероза и цереброваскулярных заболеваний (кровоизлияния, инсульта,цереброваскулярного инфаркта). В одном из аспектов, при заболевании имеет место модулирование активности рецептора TGR5. В одном из аспектов соединение по настоящему изобретению является агонистом рецептора TGR5. В одном из аспектов, соединение является селективным агонистом TGR5, по сравнению с его способностью к активации FXR. В одном из аспектов, соединение является частичным модулятором FXR. В одном из аспектов соединение является частичным агонистом FXR. В одном из аспектов, соединение или фармацевтическую композицию по настоящему изобретению вводят субъекту перорально, парентерально, внутривенно или местно. В одном из аспектов указанный субъект является человеком. Определения В целях удобства, в настоящем разделе собраны некоторые термины, применяемые в настоящем описании, примерах и приложенной формуле изобретения. Термин лечение в настоящем описании означает облегчение, уменьшение, ослабление, устранение, модулирование или улучшение, т.е. относится к действиям, вызывающим регрессию заболевания или болезненного состояния. Кроме того, лечение может включать подавление, т.е. остановку развития существующей болезни или болезненного состояния, и облегчение или улучшение, т.е. регрессию существующего болезненного состояния или заболевания, например, если уже имеется болезненное состояние или заболевание. Термин профилактика в настоящем описании означает полное или почти полное предотвращение появления у пациента заболевания или болезненного состояния, особенно если пациент или субъект предрасположен к этому заболеванию или имеется опасность появления такого заболевания или болезненного состояния. Термин алкил охватывает насыщенные алифатические группы, в т.ч. алкильные группы с линейной цепью (например, метил, этил, пропил, бутил, фенил, гексил, гептил, окстил, нонил, децил) и алкильные группы с разветвленной цепью (например, изопропил, трет-бутил, изобутил). В некоторых вариантах осуществления, в углеродном скелете алкильных групп с линейными или разветвленными цепями содержится не более шести атомов углерода (т.е. C1-C6 для линейных цепей, С 3-С 6 для разветвленных цепей). В некоторых примерах, скелет линейных или разветвленных алкильных групп содержит не более четырех атомов углерода. В настоящем описании подразумевается, что термин циклоалкил охватывает насыщенные циклические группы, например, циклопропил, циклобутил или циклопентил. Имеется в виду, что термин С 3-8 циклоалкил включает С 3, С 4, С 5, С 6, С 7 и С 8 циклоалкильные группы. Термин замещенный алкил относится к алкильным фрагментам, в которых у одного или нескольких атомов углерода углеродного скелета имеется заместитель, присутствующий вместо одного или нескольких атомов водорода. В число таких заместителей могут входить, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонат, фосфинат, циано,амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино(включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфат, алкилсульфинил, сульфонат, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил, или ароматические или гетероароматические фрагменты. Термин арил включает группы, обладающие ароматичностью, в т.ч. 5- и 6-членные несопряженные или моноциклические ароматические группы, которые могут включать от нуля до четырех гетероатомов, а также сопряженные или мультициклические системы, по меньшей мере, с одним ароматическим циклом. Примеры арильных групп включают бензол, фенил, пиррол, фуран, тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изоксазол, пиридин, пиразин, пиридазин,пиримидин и т.п. Кроме того, термин арил включает мультициклические арильные группы, например,трициклические, бициклические, например, нафталин, бензоксазол, бензодиоксазол, бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенил, хинолин, изохинолин, нафтиридин, индол, бензофуран,пурин, бензофуран, деазапурин или индолизин. Арильные группы, в циклических структурах которых имеются гетероатомы, могут также именоваться арильными гетероциклами, гетероциклами,гетероарилами или гетероароматическими. Ароматический цикл может быть замещен по меньшей мере по одному положению цикла, перечисленными выше заместителями, как, например, галогеном,гидроксилом, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилатом, алкилкарбонилом, алкиламинокарбонилом, аралкиламинокарбонилом, алкениламинокарбонилом, алкилкарбонилом, арилкарбонилом, аралкилкарбонилом, алкенилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом, фосфонатом, фосфинатом, циано,амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино(включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрилом, алкилтио, арилтио, тиокарбоксилатом, сульфатом, алкилсульфинилом, сульфонатом, сульфамоилом,сульфонамидо, нитро, трифторметилом, циано, азидо, гетероциклилом, алкиларилом или ароматическими или гетероароматическими фрагментами. Кроме того, арильные группы могут быть конденсированными или связанными мостиковой связью с алициклическими или гетероциклическими фрагментами,которые не являются ароматическими, с образованием мультициклической системы (например, тетралина, метилендиоксифенила). Если число атомов углерода не определено иным образом, низшие алкилы включают определенные выше алкильные группы, содержащие от одного до десяти, например, от одного до шести атомов углерода в углеродном скелете. Термин сложный эфир охватывает соединения и фрагменты, которые включают атом углерода или гетроатом, связанный с атомом кислорода, который, в свою очередь, связан с углеродом карбонильной группы. Термин сложный эфир охватывает алкоксикарбоксигруппы, например, метоксикарбонил,этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентоксикарбонил и т.д. Алкильные, алкенильные или алкинильные группы соответствуют данным выше определениям. Термин гидрокси или гидроксил включает такие группы, как -ОН или -O-. Термин галоген включает фтор, бром, хлор, йод и т.д. Термин пергалогензамещенный обычно относится к фрагменту, в котором все атомы водорода заменены атомами галогена. Термин анионная группа в настоящем описании относится к группе, которая несет отрицательный заряд при физиологических значениях рН. Анионные группы включают карбоксилат, сульфат, сульфо- 10020310 нат, сульфинат, сульфамат, тетразолил, фосфат, фосфонат, фосфинат или фосфоротиоат или их функциональные эквиваленты. Имеется в виду, что функциональные эквиваленты анионных групп включают биоизостеры, например, биоизостеры карбоксильной группы. Биоизостеры охватывают как классические биоизостерические эквиваленты, так и неклассические биоизостерические эквиваленты. Классические и неклассические биоизостеры известны в технике (см., например, Silverman, R.B. The OrganicChemistry of Drug Design and Drug Action, Academic Press, Inc.: San Diego, Calif., 1992, pp.19-23). Другой анионной группой является карбоксилат. Термин неустойчивая функциональная группа относится к замещающему фрагменту, который содержит лабильную связь, например, функциональный фрагмент или связь, которые чувствительны к гидролизу или расщеплению в физиологических условиях (например, в водных растворах в нейтральном диапазоне рН). Примеры неустойчивых функциональных групп включают ацетали и кетали. Кроме того, соединения по настоящему изобретению, например, соли этих соединений, могут существовать либо в гидратированной, либо в негидратированной (безводной) форме, либо в виде сольватов с молекулами других растворителей. Не ограничивающие примеры гидратов включают моногидраты,дигидраты и т.д. Не ограничивающие примеры сольватов включают сольваты с этанолом, сольваты с ацетоном и т.д. Термин сольваты относится к продуктам присоединения растворителя, которые содержат как стехиометрические, так и нестехиометрические количества растворителя. Некоторые соединения в твердом кристаллическом состоянии имеют тенденцию захватывать молекулы растворителя в определенной мольной пропорции, образуя при этом сольваты. Если растворитель является водой, то образовавшийся сольват представляет собой гидрат, если растворитель является спиртом, то образовавшийся сольват представляет собой алкоголят. Гидраты образуются при соединении одной или нескольких молекул воды с одним из веществ по настоящему изобретению, где вода сохраняет свое молекулярное состояние в видеH2O, причем в результате такого соединения возможно образование одного или нескольких гидратов. Следует отметить, что структура некоторых соединений по настоящему изобретению включает асимметрические атомы углерода. Соответственно, необходимо понимать, что появляющиеся в результате этой асимметрии изомеры (например, все энантиомеры и диастереомеры) включены в объем настоящего изобретения, если не указано иное. Эти изомеры можно получать в практически чистом виде с помощью классических методик разделения, а также с помощью стереохимически управляемого синтеза. Энантиомеры (R- и S-конфигурации) именуют по системе правил, разработанных R.S.Cahn, C.Ingold иV.Prelog (Каном, Ингольдом и Прелогом). Далее, структуры и соединения, описанные в настоящей заявке, включают все атропические изомерные формы. Атропические изомеры представляют собой один из типов стереоизомеров, в которых атомы двух изомеров по-разному расположены в пространстве. Существование атропических изомеров возможно вследствие ограниченного вращения, вызванного затруднением вращения объемных групп вокруг центральной связи. Такие атропические изомеры, как правило, существуют в форме смеси, однако в результате современных достижений в области хроматографии, в некоторых случаях появилась возможность разделять смеси двух атропических изомеров. Имеется в виду, что термины устойчивое соединение и устойчивая структура указывают на соединение, которое достаточно устойчиво для того, чтобы не разрушаться при выделении из реакционной смеси и очистке до приемлемой степени чистоты, а также при включении в состав эффективного лекарственного препарата. В настоящем описании термин аналог относится к химическому соединению, которое структурно подобно другому соединению, но незначительно отличается от него по составу и строению (например,заменой одного атома атомом другого элемента, или заменой одной функциональной группы другой функциональной группой). Так, например, аналог представляет собой соединение, которое подобно или сопоставимо с исходным соединением по своему действию и свойствам. В настоящем описании термин производное, например, в термине производные желчной кислоты относится к соединениям, которые включают общее ядро, состоящее из 4 циклов, и замещены различными группами, описанными в настоящей заявке. Химические соединения, описанные в настоящей заявке, могут иметь асимметрические центры. Соединения по настоящему изобретению, содержащие асимметрически замещенный атом, могут быть выделены в оптически активных или рацемических формах. В технике хорошо известны способы получения оптически активных форм, например, путем разделения рацемических форм или путем синтеза из оптически активных исходных веществ. Для соединений, описанных в настоящей заявке, может существовать большое число геометрических изомеров за счет наличия олефиновых связей, двойных связейC=N и т.п., и все устойчивые изомеры этого типа рассматриваются в настоящем изобретении. Описаны цис- и транс геометрические изомеры соединений по настоящему изобретению и их можно выделить в виде смеси изомеров или в виде отдельных изомерных форм. Имеется в виду, что в изобретение включены все хиральные, диастереомерные, рацемические и геометрические изомерные формы соединений,если нет указания на конкретную стереохимию или изомерную форму. Все способы, применяемые для получения соединений по настоящему изобретению, и интермедиаты, получаемые в этих способах, там,где это уместно, рассматриваются в качестве составной части настоящего изобретения. Все таутомеры показанных или описанных соединений, в случаях, когда это уместно, также рассматриваются в качестве составной части настоящего изобретения. Термин биоизостер относится к соединению, которое образуется при замене атома или группы атомов другими, аналогичными в широком смысле, атомом или группой атомов. Биоизостерическая замена может быть обоснована физико-химически или топологически. Примеры биоизостеров карбоновых кислот включают ацил сульфонимиды, тетразолы, сульфонаты и фосфонаты. См., например, Patani andLa Voie, Chem. Rev. 96, 3147-3176 (1996). Фраза фармацевтически приемлемый признана в технике. В некоторых аспектах этот термин включает композиции, полимеры и другие материалы и/или дозированные формы, которые, согласно обоснованному суждению медицины, подходят для применения в контакте с тканями людей и животных,не вызывая избыточного токсического действия, раздражения, аллергической реакции, или других проблем или осложнений, и соответствуют разумному соотношению польза/риск. Фраза фармацевтически приемлемый носитель признана в технике и включает, например, фармацевтически приемлемые материалы, композиции или носители, например, жидкие или твердые наполнители, разбавители, растворители или инкапсулирующие вещества, которые принимают участие в переносе или транспортировке любой композиции по настоящему изобретению из одного органа или части тела в другой орган или часть тела. Каждый носитель должен являться приемлемым в смысле совместимости с другими ингредиентами композиции по настоящему изобретению и отсутствия вреда для пациента. В некоторых вариантах осуществления фармацевтически приемлемый носитель является апирогенным. Некоторые примеры веществ, которые могут применяться в качестве фармацевтически приемлемых носителей, включают:(1) сахара, например лактозу, глюкозу и сахарозу; (2) крахмалы, например кукурузный крахмал или картофельный крахмал; (3) целлюлозу и ее производные, например натрийкарбоксиметилцеллюлозу,этилцеллюлозу и ацетат целлюлозы; (4) порошкообразную камедь трагаканта; (5) солод; (6) желатин; (7) тальк; (8) наполнители, например масло какао и воски для суппозиториев; (9) масла, например масло арахиса, масло хлопчатника, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, например пропиленгликоль; (11) полиолы, например глицерин, сорбит,маннит и полиэтиленгликоль; (12) сложные эфиры, например этилолеат и этиллаурат; (13) агар; (14) буферные средства, например гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах. Комбинированная терапия (или котерапия) включает введение соединения по настоящему изобретению и по меньшей мере одного второго агента в качестве составных частей конкретной схемы лечения, предназначенной для обеспечения благоприятного эффекта от совместного действия этих терапевтических агентов (т.е. соединения по настоящему изобретению и по меньшей мере еще одного второго агента). Благоприятный эффект от применения комбинации включает, не ограничиваясь этим, совместное фармакокинетическое или фармакодинамическое действие, возникающее в результате комбинирования терапевтических агентов. Введение упомянутых терапевтических агентов в составе комбинации,как правило, осуществляют в течение определенного периода времени (обычно измеряемого минутами,часами, днями или неделями, в зависимости от выбранной комбинации). Термин комбинированная терапия может предназначаться, но, как правило, не предназначается, для указания на введение двух или нескольких из этих терапевтических агентов, как частей отдельных схем монотерапии, что случайно и произвольно приводит к комбинациям по настоящему изобретению. Термин комбинированная терапия предназначен для обозначения введения этих терапевтических агентов в определенной последовательности, т.е. когда каждый из терапевтических агентов вводят в отдельный момент времени, а также когда введение этих терапевтических агентов, или по меньшей мере двух из них, осуществляется практически одновременно. Практически одновременное введение можно осуществлять, например, путем введения субъекту одной капсулы, содержащей терапевтические агенты в фиксированном соотношении, или нескольких капсул, по одной для каждого из терапевтических агентов. Последовательное или практически одновременное введение каждого из терапевтических агентов можно выполнять подходящим путем,включая, но, не ограничиваясь этим, пероральное введение, внутривенное введение, внутримышечное введение и прямую абсорбцию через ткань слизистых оболочек. Терапевтические агенты могут вводиться одним и тем же путем или разными путями. Например, первый терапевтический агент выбранной комбинации может вводиться с помощью внутривенной инъекции, тогда как другой терапевтический агент комбинации может вводиться перорально. С другой стороны, например, все терапевтические агенты можно вводить перорально или все терапевтические агенты можно вводить с помощью внутривенной инъекции. Последовательность, в которой осуществляется введение терапевтических агентов, не имеет решающего значения. Термин комбинированная терапия охватывает также введение описанных выше терапевтических агентов в дополнительной комбинации с другими биологически активными ингредиентами и нелекарственными видами лечения (например, хирургией или механическим воздействием). Если комбинированная терапия дополнительно включает нелекарственную форму лечения, это нелекарственное лечение можно проводить в любое подходящее время и так долго, пока не будет достигнут положительный эффект от совместного действия терапевтических агентов и нелекарственного лечения. Например, в соответствующих случаях, положительного эффекта удается добиться при временном исключении применения нелекарственного лечения из схемы введения терапевтического агента, возможно, на несколько дней или даже недель. Термины парентеральное введение и введенный парентерально в настоящем описании относятся к способам введения, отличающимся от энтерального и местного введения, обычно с помощью инъекции, и эти термины включают, не ограничиваясь перечисленным, внутривенные, внутримышечные,внутриартериальные, интратекальные, внутрикапсулярные, интраорбитальные, внутрисердечные, внутрикожные, интраперитонеальные, транстрахеальные, подкожные, подкапсулярные, субарахноидальные,интраспинальные и интрастернальные инъекции и инфузии. Терапевтически эффективное количество соединения или комбинации соединений по настоящему изобретению представляет собой количество (количество в абсолютном выражении или концентрацию) соединения или соединений. В одном из вариантов осуществления, если терапевтически эффективное количество соединения вводят субъекту при необходимости лечения симптомов заболевания, то облегчение симптомов происходит немедленно, либо после введения соединения еще один или несколько раз. Количество соединения, которое следует вводить субъекту, будет зависеть от конкретного расстройства,способа введения, совместно вводимых соединений, при наличии таковых, а также особенностей субъекта, например, общего состояния здоровья, наличия других заболеваний, возраста, пола, генотипа, массы тела и переносимости лекарственных средств. Специалист в данной области будет способен определить подходящие дозировки в зависимости от этих и других факторов. Термин профилактически эффективное количество означает количество (абсолютное количество или концентрацию) соединения или комбинации соединений по настоящему изобретению, которое вводят для предупреждения или уменьшения опасности возникновения заболевания - другими словами, количество, необходимое для обеспечения предупредительного или профилактического эффекта. Количество соединения по настоящему изобретению, которое следует ввести субъекту, будет зависеть от конкретного расстройства, способа введения, совместно вводимых соединений, при наличии таковых, а также особенностей субъекта, например, общего состояния здоровья, наличия других заболеваний, возраста,пола, генотипа, массы тела и переносимости лекарственных средств. Термин уменьшение опасности в настоящем описании означает понижение возможности или вероятности появления заболевания у пациента, в особенности, если субъект или пациент предрасположен к появлению этого заболевания. Соль соединения по настоящему изобретению представляет собой производное соединения, которое содержит ионную связь, и, как правило, образуется при взаимодействии соединения с кислотой или основанием. Фармацевтически приемлемая соль является солью, которая подходит для введения субъекту. В настоящем описании термин фармацевтически приемлемая соль относится к производному раскрытого соединения, в котором исходное соединение модифицировано путем получения его соли с кислотой или основанием. Примеры фармацевтически приемлемых солей включают, не ограничиваясь этим, соли основных групп, например, аминов, с минеральными и органическими кислотами; соли кислотных групп, например, карбоксильных групп со щелочами или органическими основаниями; и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли исходных соединений, образованные, например, нетоксичными неорганическими или органическими кислотами. Такие обычные нетоксичные соли включают, не ограничиваясь этим, например, соли, полученные из неорганических и органических кислот, выбранных из 2-ацетоксибензойной, 2 гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой,угольной, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой,глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолиларсаниловой, гексилрезорциновой,гидрабаминовой, бромисто-водородной, хлористо-водородной, йодисто-водородной, гидроксималеиновой, гидроксинафтойной, изетионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, себациновой,янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной и толуолсульфоновой кислот. Фармацевтически приемлемые соли по настоящему изобретению можно получить из исходных соединений, которые содержат основной или кислотный фрагмент, с помощью обычных химических методик. Как правило, эти соли можно получить взаимодействием соединений в форме свободных кислот и оснований со стехиометрическим количеством подходящего основания или кислоты в воде или органи- 13020310 ческом растворителе или их смеси; как правило, предпочтительной является неводная среда, например,эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечень подходящих солей приведен в Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA, USA, p.1445 (1990). Фармацевтическая композиция представляет собой состав, содержащий соединение по настоящему изобретению в форме, подходящей для введения субъекту. В другом варианте осуществления фармацевтическая композиция может находиться в виде нерасфасованной массы или в виде дозированной лекарственной формы. Дозированная лекарственная форма представляет собой любую из целого ряда известных форм, включая, например, капсулу, пакет для внутривенного вливания, таблетку, единичную дозу аэрозольного ингалятора или пузырек. Количество действующего ингредиента (например, состава соединения по настоящему изобретению или его соли) в единице дозированной формы фармацевтической композиции представляет собой эффективное количество, и оно меняется в соответствии с конкретным лечением, в котором применяется эта дозированная форма. Специалист в данной области должен понимать, что иногда необходимо вносить стандартные изменения в дозировку, в зависимости от возраста и состояния пациента. Кроме того, дозировка будет зависеть от пути введения. В изобретении предусмотрен целый ряд путей введения, в т.ч. пероральный, легочный, ректальный, парентеральный, трансдермальный, подкожный, внутривенный, внутримышечный, интраперитонеальный, интраназальный и т.п. Дозированные формы для местного или трансдермального введения соединений по настоящему изобретению, включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляторы. В другом варианте осуществления, действующее соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем, а также с любыми необходимыми консервантами, буферами или пропеллентами. Термин флэш-доза (доза моментального действия) относится к составам соединений, которые представляют собой дозированные формы, способные к быстрому диспергированию. Термин немедленное высвобождение определяется как высвобождение соединения из дозированной формы за относительно короткий период времени, как правило, примерно до 60 мин. Термин модифицированное высвобождение определяется как включающий отсроченное высвобождение, продолжительное высвобождение и импульсное высвобождение. Термин импульсное высвобождение подразумевает последовательность импульсов высвобождения лекарственного средства из дозированной формы. Термин устойчивое высвобождение или продолжительное высвобождение служит для описания непрерывного высвобождения соединения из дозированной формы на протяжении длительного времени. Термин субъект включает млекопитающих, например людей, животных-компаньонов (например,собак, кошек, птиц и т.п.), сельскохозяйственных животных (например, коров, овец, свиней, лошадей,домашнюю птицу и т.п.), а также лабораторных животных (например, крыс, мышей, морских свинок,птиц и т.п.). Как правило, субъект представляет собой человека. Соединения по настоящему изобретению также включают пролекарства или физиологически эквивалентные производные. Термины пролекарство или физиологически эквивалентное производное относятся к предшественнику лекарственного средства, который претерпевает метаболическое превращение in vivo с образованием действующего лекарственного средства. Кроме того, в изобретении рассматривается применение пролекарств, которые in vivo претерпевают превращение в модулирующиеTGR5 соединения, применяемые в способах по настоящему изобретению (см., например, R.B.Silverman,1992, "The Organic Chemistry of Drug Design and Drug Action", Academic Press, Chp.8). Такие пролекарства могут применяться для изменения биораспределения (например, чтобы дать возможность преодолеть барьер кровь-мозг тем соединениям, которые не могли бы преодолеть его в исходном состоянии) или фармакокинетики TGR5-модулирующих соединений. Например, анионные группы, такие как карбоксилат, сульфат или сульфонат, могут быть этерифицированы, например, алкильной группой (например,метильной группой) или фенильной группой с получением сложного эфира. При введении субъекту сложного эфира, он претерпевает ферментное или неферментное, восстановительное или гидролитическое расщепление с образованием анионной группы. Этот сложный эфир может быть циклическим, например, циклическим сульфатом или сульфоном, или два или несколько анионных фрагментов могут быть этерифицированы связующей группой. Анионная группа может быть этерифицирована фрагментами (например, ацилоксиметиловыми эфирами), которые отщепляются с образованием интермедиатовTGR5-модулирующих соединений, которые затем разрушаются с образованием активных TGR5 модулирующих соединений. В одном из вариантов осуществления пролекарство является восстановленной формой карбоксилата, сульфата или сульфоната, например, спиртом или тиолом, которая in vivo претерпевает окисление до TGR5-модулирующего соединения. Кроме того, анионный фрагмент может быть этерифицирован с образованием группы, которая способствует активному переносу полученного производного in vivo или селективному поглощению его целевыми органами. Термин модулятор TGR5 относится к любому соединению, которое взаимодействует с рецептором TGR5. Это взаимодействие не ограничено действием соединения в качестве антагониста, агониста,частичного агониста или обратного агониста рецептора TGR5. В одном из аспектов соединения по на- 14020310 стоящему изобретению действуют как антагонисты рецептора TGR5. В другом аспекте, соединения по настоящему изобретению действуют как агонисты рецептора TGR5. В следующем аспекте, соединения по настоящему изобретению действуют как частичные агонисты рецептора TGR5. В еще одном аспекте,соединения по настоящему изобретению действуют как обратные агонисты рецептора TGR5. Профиль лиганда, обычно эндогенного или синтетического, характеризуется его собственной эффективностью 'е',первоначально описанной Ферчготтом в 1966 г. Этот параметр используется для выражения степени изменения биологических реакций, которую вызывают те или иные лиганды при связывании с одинаковым количеством рецепторов. Термин "агонист" в основном относится к соединению, которое усиливает активность другой молекулы или сайта рецептора. По классическому определению, агонист, независимо от того, является ли он ортостерическим, аллостерическим, обратным или коагонистом, обладает способностью связываться с рецептором, изменять состояние рецептора и вызывать биологическое действие. Следовательно, агонизм определяется как способность агониста или лиганда вызывать биологическое действие. В противоположность этому, "антагонист", по существу, является агонистом с высоким сродством к той же макромолекуле рецептора, но с очень небольшой или пренебрежимо малой собственной эффективностью, за счет чего он стерически препятствует биологическому действию агониста. Если говорить об антагонизме, как о свойстве, то он может быть функциональным или физиологическим, где антагонист участвует в непосредственной конкуренции за сайт рецептора в первом случае, и осуществляет противодействие через другую систему рецептор-мессенджер во втором случае. Более конкретно, агонистTGR5 является лигандом рецептора или соединением, которое связывается с TGR5, и увеличивает концентрацию циклического аденозина монофосфата (сАМР) в клетках, экспрессирующих этот рецептор по меньшей мере на 20%. Напротив, антагонист TGR5 мог бы представлять собой соединение, которое противодействует активности агониста или блокирует ее, вызывая тем самым уменьшение концентрации сАМР. Настоящее изобретение относится к соединениям, обладающим модулирующим действием на рецептор TGR5, и к их применению для лечения и профилактики заболеваний, например, метаболических,воспалительных, заболеваний печени, аутоиммунных, сердечных, почечных, раковых и заболеваний желудочно-кишечного тракта. Некоторые типовые примеры соединений по настоящему изобретению показаны ниже. Все публикации и патентные документы, упомянутые в настоящей заявке, включены в заявку с помощью ссылок, как если бы в отношении каждой из этих публикаций или документов было конкретно и индивидуально указано, что она включена в заявку с помощью ссылки. Ссылки на публикации и патентные документы не подразумевают признание того, что любой из них принадлежит к известному уровню техники, и не являются каким-либо допущением в отношении содержания или даты указанных публикаций и документов. Поскольку в настоящей заявке изобретение раскрывается в форме письменного описания, специалист в данной области техники должен понять, что изобретение может быть воплощено на практике в виде многочисленных вариантов осуществления, и что предшествующее описание и приведенные далее примеры служат иллюстративным целям, а не ограничивают изложенную ниже по тексту формулу изобретения. Пример 1. Синтез модуляторов TGR5 Соединения по настоящему изобретению и связанные с ними производные можно синтезировать с использованием методик, известных специалисту в данной области техники.e) NaOH 5% в Н 2 О, 93%. Общий выход 17%. 3,7,12-триацетокси-6-этил-5-холан-24-овая кислота (2). К охлажденной до 0 С суспензии соединения 1 (250 мг, 0,572 ммоль) в перегнанном CH2Cl2 (5 мл) в присутствии 4-пирролидин-пиридина (9 мг, 0,057 ммоль) при перемешивании добавляли перегнанныйEt3N (0,78 мл, 5,430 ммоль). Затем по каплям в атмосфере азота добавляли уксусный ангидрид (0,49 мл,5,140 ммоль). Через 20 мин температуру раствора повышали до комнатной и перемешивали в течение ночи. Смесь концентрировали при пониженном давлении и полученный остаток подкисляли 3 н HCl и экстрагировали AcOEt (315 мл). Органический слой промывали насыщенным раствором соли (15 мл),высушивали над безводным Na2SO4 и концентрировали при пониженном давлении, получая 290 мг смеси соединения 2 (70%) и 3,7-триацетокси-7-гидрокси-6-этил-5-холан-24-овой кислоты (2 а, 30%) по данным спектроскопии 1 Н ЯМР. Полученную смесь использовали в следующей стадии без дополнительной очистки. 1(1 Н, м, 7-СНОАс соед.2). 3,7,12-триацетокси-6-этил-24-гидрокси-5-холан (3). К раствору соединения 2 (290 мг неочищенного продукта предыдущей стадии) в перегнанном ТГФ(0,44 мл, 4,576 ммоль) (примечание: образование белого осадка). Наблюдая за ходом реакции с помощью ТСХ (петролейный эфир/AcOEt 6:4), перемешивали полученную смесь в течение 2 ч, пока исходное соединение полностью не вступало в реакцию. Затем к смеси по каплям добавляли NaBH4 (326 мг, 8,580 ммоль), растворенный в Н 2 О (3 мл), и перемешивали реакционную смесь в течение ночи. Добавляли H2O(30 мл) и 3 н HCl (10 мл) и экстрагировали смесь EtOAc (320 мл). Органический слой промывали насыщенным раствором соли (15 мл), высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на BiotageTM (колонка: 12+М, градиент AcOEt в петролейном эфире от 5% до 55%), получая 130 мг (41%, исходя из соединения 1) смеси соединения 3 (70%) и 3,12-триацетокси-7,24-дигидрокси-6-этил-5-холана (3a, 30%) по данным спектроскопии 1 Н ЯМР. Полученную смесь использовали в следующей стадии без дополнительной очистки. 1 Н ЯМР (200 МГц, CDCl3) : 0,66 (3 Н, м, 18-СН 3 соед. 3 и соед. 3 а), 0,75-0,85 (м, 9H, м, 19-СН 3 + 21 СН 3 + СН 2 СН 3 соед.3 и соед. 3 а), 3,55 (2H, м, 24-СН 2 ОН соед. 3 и соед. 3 а), 3,67 (м, 1H, 7-СН-ОН соед. 3 а), 4,52 (м, 3-СНОАс соед. 3 и соед. 3 а), 4,99-5,06 (2H, м, 12-СНОАс соед.3 и 3 а и 7-СНОАс соед.3). 3,7,12-тригидрокси-6-этил-5-холан-24-сульфонат натрия (3 А). К раствору трифенилфосфина (270 мг) в перегнанном CH2Cl2 (4 мл) в атмосфере N2 добавляли бром(0,02 мл, 0,426 ммоль) и имидазол (0,02 мл, 0,426 ммоль), и перемешивали смесь в течение 10 мин. Затем по каплям добавляли соединение 3 (130 мг, 0,237 ммоль), смешанное с перегнанным CH2Cl2 (4 мл), и смесь перемешивали до тех пор, пока исходное соединение полностью не вступало в реакцию. Затем добавляли CH2Cl2 (20 мл) и промывали реакционную смесь H2O (320 мл), насыщенным раствором соли(15 мл), высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на BiotageTM (колонка: 12+М, градиент AcOEt в петролейном эфире от 5 до 55%), получая 65 мг (45%) смеси соединения 4 (70%) и 3,12-триацетокси-7,24- 17020310 дигидрокси-6-этил-5-холана (4 а, 30%). После этого растворяли полученную смесь в EtOH (10 мл), по каплям добавляли 5% раствор Na2SO3 в Н 2 О (9 мл) и перемешивали реакционную смесь при 90 С в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь концентрировали при пониженном давлении и полученный остаток разбавляли Н 2 О (15 мл), подкисляли 3 н HCl и экстрагировали CH2Cl2 (315 мл). Органический слой промывали насыщенным раствором соли (15 мл), высушивали над безводнымNa2SO4 и концентрировали при пониженном давлении. Затем полученный остаток обрабатывали 5% раствором NaOH в H2O (15 мл) и кипятили с обратным холодильником в течение 24 ч. Смесь концентрировали при пониженном давлении и остаток разбавляли H2O (15 мл), промывали CH2Cl2 (215 мл), подкисляли 3 н HCl и экстрагировали смесью AcOEt/MeOH 8:2 (325 мл). Органический слой высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали с помощью хроматографии среднего давления (колонка: "RP-1 8 Lobar В", МеОН/Н 2 О 6:4 50 фунтов/кв.дюйм), получая 3,7,12-тригидрокси-6-этил-5-холан-24-сульфонат натрия, 3 А (47 мг, 93%). Т.пл.: 280 С 1h) 5% NaOH в МеОН, 43%; Общий выход: 9%. Метил 3,7-дигидрокси-23-метил-6-этил-5-холан-24-оат (2). К раствору соединения 1 (2,0 г, 4,6 ммоль) в метаноле (150 мл) добавляли п-толуолсульфоновую кислоту (0,2 г, 1,05 ммоль) и смесь обрабатывали ультразвуком в течение 90 мин. Растворитель выпаривали при пониженном давлении, остаток растворяли в CHCl3 (200 мл), промывали насыщенным водным раствором бикарбоната натрия (2100 мл), водой (100 мл) и насыщенным раствором соли (100 мл). Органический слой высушивали над безводным сульфатом натрия и упаривали досуха, получая метиловый эфир 2 (2,0 г, 97%) в виде твердого вещества белого цвета. 3,7-дигидрокси-23-метил-6-этил-5-биснорхоланилдифенилэтилен (4). К раствору метилового эфира 2 (1,35 г, 3,01 ммоль) в свежеперегнанном ТГФ (15 мл) добавляли фенилмагнийбромид (24,1 мл, 1 М в ТГФ) и полученную смесь кипятили с обратным холодильником в течение ночи. Раствору давали остыть до комнатной температуры, по каплям добавляли 3 н хлористоводородную кислоту (30 мл) и перемешивали полученную смесь в течение 30 мин. Отделяли органическую фазу и водную фазу экстрагировали EtOAc (350 мл). Объединенные органические соли промывали насыщенным раствором соли (1100 мл), высушивали над безводным сульфатом натрия и упаривали досуха при пониженном давлении, получая интермедиат 3, который использовали в следующей стадии без дополнительной очистки. Полученный коричневый продукт растворяли в смеси этанола (35 мл) и 12 нHCl (1 мл) и кипятили эту смесь в течение ночи. Затем растворитель выпаривали в вакууме, остаток растворяли в CH2Cl2 (100 мл), промывали насыщенным раствором бикарбоната натрия (260 мл), водой (60 мл), насыщенным раствором соли (60 мл), высушивали над безводным сульфатом натрия и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией, элюируя смесью CHCl3/MeOH и получая желаемое производное 4 в виде белого твердого вещества (1,40 г, 84%, исходя из соединения 2). 1H ЯМР (CDCl3) : 0,7 (3 Н, с, 18-СН 3), 0,85 (3 Н, д, J=6,5 Гц, 21-СН 3), 0,88-0,92 (6 Н, м, 19-СН 3 + СН 2 СН 3), 0,97-1,22 (6 Н, м), 1,23-1,52 (9 Н, м), 1,57-1,70 (5 Н, м), 1,78-1,85 (4 Н, м), 1,92-1,95 (1 Н, м), 3,403,42 (1 Н, м, 3-СН), 3,69 (1 Н, ушир.с, 7-СН), 7,25-7,29 (4 Н, м, ArH), 7,127,23 (6 Н, м, ArH). 13 С ЯМР (CDCl3) : 11,6, 11,7, 17,8, 20,0, 20,6, 22,2, 23,1, 23,6, 28,4, 30,5, 33,12, 33,8, 34,8, 35,4(2 х),39,4, 39,9, 41,1, 41,6, 42,8, 45,1, 50,4, 56,8, 70,8, 72,3, 125,8, 127,8(4 х), 128,6(4 х), 129,8(2 х), 138,8, 143,4. 3-ацетокси-7-гидрокси-23-метил-6-этил-5-биснорхоланилдифенилэтилен (5) К раствору соединения 4 (1,85 г, 3,33 ммоль) в свежеперегнанном ТГФ (15 мл) добавляли уксусный ангидрид (0,35 мл, 3,66 ммоль), пиридин (0,05 мл, 0,66 ммоль), 4-ди(метиламино)пиридин (28 мг, 0,23 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь перегоняли с водой (70 мл) и экстрагировали EtOAc (350 мл). Объединенные органические слои промывали водой (250 мл), насыщенным раствором соли (50 мл), высушивали над безводным сульфатом натрия и упаривали досуха при пониженном давлении, получая желаемое ацетилированное соединение 5 (1,57 г,79%) в виде твердого вещества белого цвета, которое использовали в следующей стадии без дополнительной очистки. 1(6 Н, м, ArH), 7,25-7,29 (4 Н, м, ArH). 13 С ЯМР (CDCl3) : 11,6, 11,8, 17,9, 20,1, 20,7, 21,4, 22,2, 23,1, 23,7, 26,6, 28,4, 29,6, 33,1, 34,9, 35,2,35,5, 39,5, 40,0, 41,2, 41,6, 42,9, 45,1, 50,4, 56,9, 70,7, 74,7, 125,8, 127,8(4 х), 129,5(4 х), 129,8(2 х), 134,0,138,9, 143,5. 3-ацетокси-7-гидрокси-6-этил-5-холан-23-он (6) Раствор соединения 5 (1,35 г, 2,26 ммоль) в смеси сухого МеОН (15 мл) и сухого CH2Cl2 (20 мл) при-78 С подвергали озонированию до тех пор, пока темно-синий цвет раствора не сохранялся в течение 30 мин. Затем озонирование прекращали и темно-синий раствор продували азотом для удаления растворенного озона. Когда реакционная смесь потеряла синий цвет, добавляли Me2S (0,55 мл, 7,55 ммоль) и давали раствору нагреться до комнатной температуры. Затем удаляли растворитель при пониженном давлении и остаток очищали флэш-хроматографией, элюируя градиентом EtOAc в петролейном эфире от 2 до 15%, и получая желаемый кетон 6 в виде белого твердого вещества (0,7 г, 70%). 1H ЯМР (CDCl3) : 0,7 (3 Н, с, 18-СН 3), 0,85-0,9 (9 Н, м, 19-СН 3 + 21-СН 3 + СН 2 СН 3), 1,04-1,23 (7 Н,м), 1,29-1,46 (8 Н, м), 1,58-1,72 (4 Н, м), 1,78-1,97 (5 Н, м), 2,00 (3 Н, с, 3-СНОС(О)СН 3), 2,11 (1 Н, с, 24 СН 3), 2,43-2,53 (1 Н, м), 3,70 (1 Н, ушир.с, 7-СН), 4,48-4,59 (1 Н, м, 3-СН). 13 С ЯМР (CDCl3) : 11,6, 11,8, 19,7, 20,7, 21,5, 22,1, 23,1, 23,7, 26,6, 28,4, 29,6, 30,6, 32,6, 33,1, 35,1,35,5, 39,5, 39,9, 41,1, 42,8, 45,0, 50,5, 50,9, 56,0, 70,7, 74,7, 170,7, 209,3. 3-ацетокси-7, 23 (S) -дигидрокси-6-этил-5-холан (7) К перемешиваемому раствору кетона 6 (0,5 г, 1,12 ммоль) в ТГФ при 0 С одной порцией добавлялиNaBH4 (0,27 г, 7,17 ммоль) и затем по каплям добавляли МеОН (0,27 мл, 6,7 ммоль). По окончании добавления реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Затем выпаривали растворитель досуха, растворяли остаток в CH2Cl2 и 3 н HCl и перемешивали в течение 1 ч. Разделяли две фазы, органический слой промывали водой, насыщенным раствором соли, высушивали над безводным сульфатом натрия и упаривали досуха при пониженном давлении. Маслянистый остаток,который по данным ТСХ состоял из двух компонентов, очищали флэш-хроматографией (петролейный эфир/EtOAc 7:3), получая в качестве первой фракции 3-ацетокси-7,23(S)-дигидрокси-6-этил-5 холан 7 (0,225 г, 48%) и затем более полярный 3-ацетокси-7,23(R)-дигидрокси-6-этил-5-холанH ЯМР (CDCl3) : 0,7 (3 Н, с, 18-СН 3), 0,88-0,91 (6 Н, м, 19-СН 3 + СН 2 СН 3), 0,97 (3 Н, д, J=6,4 Гц, 21 СН 3), 1,04-1,08 (4 Н, м,), 1,19 (3 Н, д, J=6,1 Гц, 24-СН 3), 1,26-1,56 (12 Н, м), 1,53-1,71 (5 Н, м), 1,76-1,96 (4 Н,м), 2,0 (3 Н, с, 3-СНОС (О) СН 3), 3,72 (1 Н, ушир.с, 7-СН), 3,79-3,95 (1 Н, м, 23-СН), 4,51-4,59 (1 Н, м, 3 СН). 13 С ЯМР (CDCl3) : 11,8, 18,5, 20,7, 21,5, 22,1, 23,1, 23,7, 24,8, 26,6, 28,4, 29,6, 32,6, 33,1, 35,1, 35,5,39,6, 39,9, 41,1, 42,8, 45,0, 45,8, 50,5, 56,7, 65,1, 70,7, 74,7, 170,7. 6-этил-23(S) метил-3,7,23-тригидрокси-24-нор-5-холан-23-сульфат натрия (2 А) К суспензии комплекса триоксида серы и пиридина (0,1 г, 0,49 ммоль) в сухом пиридине (5 мл) добавляли спирт 7 (0,2 г, 0,49 ммоль) и полученную смесь перемешивали при комнатной температуре в атмосфере азота в течение 48 ч, после чего выпаривали растворитель при пониженном давлении. Остаток растворяли в 5% растворе NaOH в МеОН (2 мл) и перемешивали при комнатной температуре в течение ночи. Растворитель упаривали при пониженном давлении, полученное твердое вещество смешивали с Н 2 О/СН 3 ОН (1:1) и очищали хроматографией на обращенной фазе (колонка RP-18 lobar В), используя в качестве подвижной фазы смесь СН 3 ОН/Н 2 О (от 5:5 до 8:2) и получая желаемый сульфат, а именно 3,7, 23-тригидрокси-6-этил-23 (S) -метил-24-нор-5-холан-23-сульфат натрия 2 А (0,11 г, 43%). 1H ЯМР (CD3OD) : 0,7 (3 Н, с,18-СН 3), 0,89-0,94 (6 Н, м, СН 3-19, СН 2 СН 3), 1,01 (3 Н, д, J=6,4 Гц, 21 СН 3), 1,09-1,29 (4 Н, м), 1,32 (3 Н, д, J=6,1, 24-СН 3), 1,36-1,41 (5 Н, м), 1,47-1,61 (6 Н, м), 1,71-1,89 (9 Н, м),2,02-2,05 (1 Н, м), 3,28-3,35 (1 Н, м, 3-СН), 3,66 (1 Н, ушир.с, 7-СН), 4,54-4,58 (1 Н, м, 23-СН). 13 С ЯМР (CD3OD) : 12,0, 12,3, 19,4, 21,9, 22,4, 23,5, 23,7, 24,6, 29,4, 31,3, 33,5, 34,4, 34,5, 36,6, 36,7,41,1, 41,5, 43,1, 43,8, 45,5, 46,9, 51,7, 58,1, 71,2, 73,2, 74,8. Пример 2. Исследование активности соединений по настоящему изобретению в отношении рецепторов TGR5 и FXR in vitro Оценивали силу и эффективность действия соединений по настоящему изобретению на рецепторTGR5 с использованием анализов in vitro. Данные табл. 1 показывают, что соединения по настоящему изобретению являются мощными и селективными модуляторами рецептора TGR5. В некоторых аспектах настоящего изобретения, соединения являются двойными агонистами рецепторов FXR и TGR5. Таблица 1. Сила и эффективность действия соединений по настоящему изобретению на рецепторы Для ознакомления с описанием анализа связывания рецептора TGR5 in vitro см., например, Kawamata, J. Biol. Chem 2003, Vol.27811, pp.9435-9440. Действие соединений на рецептор FXR исследовали по флуоресцентному резонансному переносу энергии (FRET) при связывании пептида SRC-1 с человеческим FXR, применяя бесклеточный анализ ELISA. См., Blanchard et al., WO 00/37077. Активность люциферазы определяли в клетках СНО, устойчиво экспрессирующих hTGR5, или транзиторно котрансфецированных вектором экспрессии hTGR5 и репортерным геном люциферазы, активируемым сАМРреспонсивным элементом (CRE). Некоторые соединения подвергали анализу с использованием репортерной люциферазы, для определения их способности активировать ядерный рецептор желчных кислотFXR. Для получения данных, приведенных в табл. 1, использовались, например, следующие материалы и методики. Плазмиды Клон NIH Mammalian Gene Collection (коллекции генов млекопитающих национального института здоровья) MGC:40597 (именуемый также pCMVSPORT6/hTGR5 или pTGR5) и pcDNA3.1(+) получали отpCMX-mRXR были любезно представлены доктором David J.Mangelsdorf (Howard Hughes Medical Insti- 20020310tute, University of Texas Southwesteern Medical Center). Плазмида pEcREx7 была любезно предоставлена доктором Richard A. Heyman (X-ceptor Therapeutics, CA). Клеточные культуры Клетки яичников китайского хомячка (СНО), клетки NCI-H716, клетки Нер 3 В и клетки COS1 получали от American Type Culture Collection (Американской коллекции типовых культур) (Manassas, VA). Среды для клеточных культур, сыворотки и добавки приобретали у Invitrogen или Sigma-Aldrich. Все клетки СНО содержали в минимальной эссенциальной среде(-МЕМ) с добавкой 10% (объем/объем) сыворотки телят (FBS) и 100 мкМ заменимых аминокислот (NEAA). Клетки NCI-H716 содержали в виде суспензии в среде RPMI-1640 с добавкой 10% (объем/объем) FBS, 10 мМ HEPES и 1 мМ пирувата натрия. Клетки Нер 3 В содержали в среде Игла, с добавкой 10% (объем/объем) FBS и 100 мкМ NEAA. Клетки COS1 содержали в среде Игла, модифицированной Дульбекко (DMEM), с добавкой 10% (объем/объем) FBS. Во все среды для клеточных культур вводили добавки 100 ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата. Клетки выращивали при 37 С в атмосфере с 5% СО 2, которую меняли каждые 2-6 дней, и для каждого эксперимента в планшеты помещали свежие порции клеток. Транзиторные трансфекции Клетки СНО помещали в 96-луночные планшеты при плотности размещения 3,5104 клеток/лунка,культивировали в течение 24 ч и затем трансфецировали каждую лунку 150 нг человеческой (h) экспрессионной плазмиды (pCMVSPORT6/hTGR5) и 100 нг репортерной плазмиды люциферазы, активируемой сАМР-респонсивным элементом (CRE), с использованием реагента Lipofectamine 2000 (Invitrogen), согласно инструкциям производителя. После 6 ч инкубирования, клетки один раз промывали фосфатносолевым буфером (PBS) и заменяли среду на DMEM, содержащую 0,1% (мас./об.) альбумина бычьей сыворотки (BSA). После инкубирования в течение еще 18 ч, клетки в течение 5 ч обрабатывали каждым из тестируемых соединений в различных концентрациях в свежей среде DMEM, содержащей 0,1%(мас./об.) BSA. После этой обработки проводили лизис клеток в 50 мкл буфера для лизиса (25 мМ Tris-Cl(pH 7,6), 2 мМ EDTA, 1 мМ дитиотрейтол (DTT), 10% (об./об.) глицерина и 1% (об./об.) triton X-100) при помощи цикла замораживание-оттаивание, и полученный продукт исследовали на содержание люциферазы, как описано ниже. Клетки COS1 помещали в 96-луночные планшеты при плотности размещения 2,5104 клеток/лунка в среду DMEM с добавлением 10% (об./об.) FBS, очищенной на активированном угле, культивировали в течение 24 ч и затем содержимое каждой ячейки трансфецировали 25 нг экспрессионной плазмиды hFXR(pCMX-hFXR), 25 нг экспрессионной плазмиды мышиного (m)рецептора ретиноидов X (PXR)(pCMX-mRXR), 50 нг репортерной плазмиды (pEcRE7-Luc) и 50 нг pCMV в качестве внутреннего контроля, используя реагент Lipofectamine 2000. Через 24 ч клетки дважды промывали PBS и обрабатывали тестируемыми соединениями в различных концентрациях в свежей среде DMEM с добавкой 10%(объем/объем) FBS, очищенной на активированном угле, в течение 24 ч. После обработки клетки подвергали лизису в 50 мкл буфера для лизиса осуществляя цикл замораживания-оттаивания, и подвергали анализам на люциферазу и -галактозидазу, как описано ниже. Нормализованные значения концентрации люциферазы вычисляли делением активности люциферазы на активность -галактозидазы. Определение содержания люциферазы и -галактозидазы Для определения содержания люциферазы, 20 мкл клеточного лизата смешивали со 100 мкл буфера для анализа люциферазы [235 мкМ люциферина, 265 мкМ АТР и 135 мкМ кофермент А (СоА)] и измеряли люминесценцию с помощью прибора CentroXS LB960 (Berthold Technologies, Bad Widbad, Germany). Для определения содержания -галактозидазы, 10 мкл клеточного лизата смешивали со 100 мклBuffer Z [60 мМ Na2HPO4, 10 мМ KCl, 1 мм MgSO4, 50 мМ -меркаптоэтанол и 0,75 мг/мл о-нитрофенил-D-галактопиранозид (ONPG)] и инкубировали при 37 С в течение 0,5-3 ч. Реакции прерывали добавлением 50 мкл стоп-буфера (1M Na2CO3) и определяли оптическую плотность при 420 нм. Получение клеток СНО, устойчиво экспрессирующих человеческий TGR5 (клеток CHO-TGR5) Клетки СНО трансфецировали 3,8 мкг экспрессионной плазмиды hTGR5 (pCMVSPORT6/hTGR5),3,8 мкг CRE-активируемой репортерной плазмиды люциферазы (pCRE-Luc) и 0,4 мкг экспрессионной плазмиды гена устойчивости к неомицину [pcDNA3.1(+)] с использованием Lipofectamine 2000. Трансфецированные клетки отбирали с помощью 400 мкг/мл сульфата G418 и отдельные клоны независимо выращивали в 96-луночном планшете. Отбирали линии клеток СНО, экспрессирующие TGR5, обрабатывая клетки LCA (литохолевой кислотой), с последующим анализом люциферазы. Исследование продуцирования сАМР Клетки NCI-H716 помещали в 96-луночные планшеты, непосредственно перед использованием покрытые 0,75 мг/мл Matrigel (BD Biosciences) согласно инструкции производителя, при плотности 6104 клеток/лунка в среде DMEM с добавками 10% (об./об.) FBS, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина сульфата, и культивировали в течение 24 ч, что привело к адгезии клеток к дну планшета. Клетки CHO-TGR5 помещали в 96-луночный планшет при плотности 3,5104 клеток/лунка в среде МЕМ с добавками 10% (об./об.) FBS, 100 мкМ NEAA, 100 ед/мл пенициллина и 100 мкг стрептомицина сульфата и культивировали в течение 24 ч. Клетки дважды промывали PBS и заменяли среду на среду для анализа сАМР [DMEM, содержащую 0,1% (мас./об.) BSA и 0,5 мМ 3-изобутил-1-метилксантин(IBMX)]. После инкубирования в течение 30 мин при 37 С обрабатывали клетки каждым из тестируемых соединений в свежей среде для анализа сАМР в течение 30 мин. После обработки среду удаляли и определяли количество сАМР с использованием cAMP-Screen kit (Applied Biosystems, Foster City, CA), согласно инструкциям производителя. Определение 50% эффективных концентраций (ЕС 50) и эффективности Для каждых условий анализы проводили в трех или четырех экземплярах. Значения ЕС 50 определяли с помощью пробит-анализа. Эффективность определяли путем вычисления процентного отношения полученных значений к значениям для 10 мкМ LCA при исследовании агонистов TGR5, к значениям для 10 мкМ 6-Et-CDCA при исследовании агонистов FXR, соответственно. После вычитания средних значений для базовых условий (при обработке носителем), полученные значения применяли для определения ЕС 50 и/или эффективности. Вычисления средних значений ЕС 50 и сравнение значений ЕС 50 для различных соединений выполняли после преобразования в логарифмическую форму. Статистический анализ Статистический анализ проводили с использованием t-критерия Стьюдента и рассматривали значения р 0,05 в качестве статистически значимых. Пример 3. Метаболическая активность соединений по настоящему изобретению в мышиной модели ожирения, вызванного рационом питания Цель настоящего исследования заключается в определении того, могут ли агонисты TGR5 (олеанолевая кислота (ОА) или соединения по настоящему изобретению (например, тестируемые соединения корректировать развитие ожирения и связанную с ним невосприимчивость к инсулину in vivo. Для исследования этого вопроса ОА/Тестируемое соединение вводили вместе с пищей в течение 16 недель самцам мышей C57BL6J, которых до этого в течение 10 недель содержали на корме с большим количеством жиров.II. Протокол эксперимента В предшествующих исследованиях было установлено, что ОА является селективным агонистомTGR5, не вызывающим отвращения к пище. Однако животные, которым вводили ОА в дозировке 100 мг/кг/день, продемонстрировали некоторые признаки токсического действия, в то время как более низкие дозировки переносились хорошо. Поэтому в настоящем исследовании вводили ОА в дозировке 50 мг/кг/день. Исследования in vitro показали, что соединения по настоящему изобретению являются мощными и селективными лигандами TGR5. Не ожидалось никаких проблем с токсичностью при введении соединений по настоящему изобретению в концентрации, которая примерно в 50 раз ниже, чем в указанных исследованиях. Для проведения первого исследования 48 самцов мышей C57BL6J (в возрасте 5 недель) разбивали на две группы: одна группа из 24 животных (группы 1, 2 и 3) получала обычный корм, тогда как другая группа из 24 животных получала корм с высоким содержанием жиров в течение 10 недель (группы 4, 5 и 6). После этого животные в течение 16 недель принимали участие в исследовании. Животным, разбитым на пять групп по десять особей, назначали следующие рационы питания: 1: обычная пища; 2: обычная пища + ОА 50 мг/кг/день; 3: обычная пища + тестируемое соединение, например, 30 мг/кг/день; 4: пища с высоким содержание жира; 5: пища с высоким содержание жира + ОА 50 мг/кг/день; 6: пища с высоким содержание жира + тестируемое соединение, например, 30 мг/кг/день; На протяжении всего исследования дважды в неделю определяли массу тела и количество принятой пищи. Неделя 2: Во всех группах определяли соотношение массовый состав организма с помощью двухэнергетической рентгеновской абсорбциометрии (Dexascan). Неделя 1: Во всех группах после голодания в течение 12 ч проводили измерение уровней трансаминаз, глюкозы, триглицеридов, холестерина, HDL-C, LDL-C и инсулина в сыворотке, после чего начинали давать мышам описанный выше корм (день 0). Неделя 2: Во всех группах после голодания в течение 12 ч проводили измерение уровней трансаминаз, глюкозы, триглицеридов, холестерина, HDL-C, LDL-C и инсулина в сыворотке (день 14). Неделя 4: Определяли переносимость глюкозы, подвергая всех животных интраперитонеальному тесту на переносимость глюкозы (IPGTT). Перед тестом животных заставляли голодать в течение 12 ч. С помощью непрямой калориметрии определяли ночной расход энергии животных в группах 1, 4, 5 и 6(обычная пища, пища с высоким содержанием жиров и пища с высоким содержанием жиров ОА/тестируемое соединение). Неделя 8 : Повторно определяли массовый состав организма животных во всех группах с помощьюDexascan. Во всех группах после голодания в течение 12 ч проводили измерение уровней трансаминаз,глюкозы, триглицеридов, холестерина, HDL-C, LDL-C и инсулина в сыворотке (день 56). Неделя 9: В течение 30 ч исследовали циркадную активность животных в группах 4, 5 и 6 (мыши,получавшие пищу с высоким содержанием жиров). Неделя 10: Осуществляли измерение кровяного давления и частоты сердечных сокращений у животных групп 4, 5 и 6. Неделя 11: У всех животных измеряли ректальную температуру в 10:00 утра. Проводили исследование циркадной активности животных в группах 1, 2, 3 и 4. Неделя 12: Определяли переносимость глюкозы в группах 4, 5 и 6, подвергая животных интраперитонеальному тесту на переносимость глюкозы (IPGTT). Во время IPGTT также отбирали кровь для определения уровней инсулина. Перед этими тестами животных заставляли голодать в течение 12 ч. Собирали кал животных во всех группах в течение 24 ч и определяли в нем содержание липидов. Неделя 16: Проводили испытание всех животных холодом, измеряя температуру тела животных при внешней температуре 4 С. Через три дня животных умерщвляли. При умерщвлении собирали кровь и анализировали на: содержание липидов в плазме (ТС, TG, HDL-C, FFA); функции печени (ALAT, ASAT, щелочная фаза, GT); глюкозу и инсулин; профили липопротеинов плазмы отдельных групп (эксклюзионная хроматография). Печень, тонкий кишечник, жировые ткани (WAT и ВАТ), поджелудочную железу, сердце и мышцы извлекали из организма, взвешивали и сохраняли для проведения дополнительных анализов, которые включали: стандартную гистологию (окрашивание НЕ, окрашивание сукцинат дегидрогеназой, окрашивание масляным красным-O и клеточную морфологию); определение содержания липидов в тканях; электронную микроскопию ВАТ и мышечной ткани для исследования митохондрий; выделение РНК для исследования экспрессии отдельных генов, принимающих участие в метаболизме и энергетическом гомеостазе с помощью количественной RT-PCR; выделение белка для исследования пост-трансляционных модификаций, например ацетилирования определенных белков (например, PGC-1).III. Подробное описание методик А-Содержание и питание животных Размещение и содержание животных Мышей размещали в виварии в группах (5 животных в клетке) в условиях отсутствия патогенных микроорганизмов, при цикле свет-темнота 12 ч: 12 ч (включение света в 7:00 утра), при контролируемой температуре (20-22 С) и влажности, согласно правилам Евросоюза. Животным обеспечивали неограниченный доступ к воде и пище. Питьевая вода Химический состав водопроводной воды регулярно анализировали в Institut d'Hydrologie, UPL,Strasbourg с целью проверки отсутствия потенциально токсичных веществ. Питьевую воду обрабатывалиHCl и HClO4 для поддержания рН в диапазоне 5-5,5 и концентрации хлора 5-6 ч./млн. Рацион питания Стандартный корм для грызунов получали от UAR и корм с высоким содержанием жиров получали от Research Diet. Мышам давали либо обычный корм (16% белка, 3% жира, 5% клетчатки, 5% минеральных веществ), либо корм с высоким содержанием жиров (20% белка, 20% углеводородов, 60% жира). Олеанолевую кислоту и тестируемые соединения смешивали либо с обычным кормом в форме порошка,либо с порошкообразным кормом с высоким содержанием жиров в следующих соотношениях: 0,5 г ОА/кг корма для введения 50 мг/кг/день и 0,08 г тестируемого соединения/кг корма для введения 10 мг/кг/день. Затем порошкообразный корм вновь превращали в гранулы. Животным контрольной группы давали гранулированный корм без добавления тестируемого соединения или ОА. Благодаря консистенции корма с высоким содержанием жиров, при его смешивании с ОА воду не добавляли. В случае обычного корма, которые труднее превращался в гранулы, к порошку добавляли минимальное количество воды для повторного получения гранул, которые затем высушивали на воздухе. Новые порции корма готовили еженедельно. Отбор образцов крови Кровь отбирали под анестезией из ретроорбитального синуса или из хвостовой вены. Анестезия Для экспериментов по двухэнергетической рентгеновской абсорбциометрии животных подвергали анестезии смесью кетамин (200 мг/кг)/ксилазин (10 мг/кг), которую вводили с помощью интраперитонеальной инъекции. Для осуществления пункций вен, животных анестезировали вдыханием смеси изофлуран-О 2. В-Биохимия Тесты проводили на автоматизированной лабораторной рабочей станции Olympus AU-400 с использованием коммерческих реагентов (Olympus). Анализ липидов и липопротеинов Содержание триглицеридов в сыворотке, общее и содержание HDL холестерина (высокой плотности), определяли с применением ферментных анализов. Содержание HDL холестерина в сыворотке определяли после осаждения апо В-содержащих липопротеинов фосфовольфрамовой кислотой/Mg (например, Roche Diagnostics, Mannheim, Germany). Содержание свободных жирных кислот определяли с применением набора от Wako (например, Neuss, Germany) согласно указаниям производителя. Метаболические и эндокринные исследования Концентрацию глюкозы в крови измеряли анализатором Precision Q.I.D. (например, Medisense system), используя электроды Medisense Precis (например, Abbot Laboratories, Medisense products, Bedford,USA). Достоверность методики подтверждали путем сравнения значений, полученных с помощью анализатора Precision Q.I.D., с результатами измерения глюкозы по классической методике. Применяли методику Precision Q.I.D, поскольку для нее требуется минимальное количество крови и, следовательно, ее можно использовать для многократных измерений, например, во время IPGTT. Уровни инсулина в плазме (например, Mercodia, Uppsala, Sweden) определяли с помощью ELISA, согласно указаниям производителя. С - Исследование метаболизма Профили липопротеинов Профили липопротеинов получали с помощью жидкостной экспресс-хроматографии белков, разделяя липопротеины на три основных класса VLDL, LDL и HDL. Интраперитонеальный тест на переносимость глюкозы (IPGTT) - пероральный тест на переносимость глюкозыIPGTT проводили у мышей, голодавших в течение ночи (12 ч). Мышам осуществляли интраперитонеальную инъекцию (IPGTT) 20% раствора глюкозы в стерильном физиологическом растворе (0,9%NaCl) в дозировке 2 г глюкозы/кг массы тела. Отбирали кровь из хвостовой вены для определения содержания глюкозы и инсулина, до введения раствора глюкозы, а также через 15, 30, 45, 75, 90, 120, 150,180 мин после введения. Вычисляли приращения площади под кривой содержания глюкозы, как показатель чувствительности к инсулину, в то время, как соответствующие уровни инсулина указывали на резервы секреции инсулина. Расход энергии Расход энергии оценивали с помощью непрямой калориметрии, измеряя потребление кислорода устройством Oxymax (например, Columbia Instruments, Columbus, ОН) в течение 12 ч. Система состояла из открытого контура с воздухом, входящим в пластиковую клетку и выходящим из нее (в клетке находилась одна мышь). Животным разрешали свободный доступ к пище и воде. Высокоточные сенсоры СО 2 и О 2 измеряли разницу концентраций СО 2 и О 2 во входящих и выходящих объемах воздуха, что позволяло определить количество потребленного кислорода за определенный период времени, при условии, что поток воздуха, входящего в клетку, остается постоянным. Поступающие из устройства данные обрабатывались в присоединенном компьютере, анализировались и представлялись в виде экспортируемого файла Excel. Значения были выражены в единицах млкг-1 ч-1, которые хорошо известны как VO2. Определение содержания жиров в организме с помощью Dexa сканирования Анализ Dexa выполняли на денситометре с ультравысоким разрешением PIXIMUS Series (пиксели 0,180,18 мм, GE Medical Systems, Madison, WI, USA). Минеральную плотность кости (BMD в г/см 2) и состав организма определяли с применением программного обеспечения PIXIMUS (версия 1,4, GE Medical Systems).D - Неинвазивное измерение кровяного давления и пульса Система анализа Visitech BP-2000 Blood Pressure Analysis System является компьютеризированной системой, которая позволяет одновременно измерять различные параметры жизнедеятельности 4 бодрствующих мышей без вмешательства оператора с помощью специальной манжеты, надетой на хвост. Мышей помещали в индивидуальные темные камеры на подогреваемую платформу и хвосты животных продевали через хвостовую манжету. Система измеряла кровяное давление путем определения давления манжеты, при котором прекращался кровоток в хвосте. Фотоэлектрический сенсор определял пульс особи. Было показано, что результаты, которые выдавала описываемая система, хорошо соответствовали данным по среднему внутриартериальному давлению, которое одновременно измеряли в сонной артерии. Это позволяло получать воспроизводимые значения систолического кровяного давления и частоты сердцебиения. Для получения результатов была необходима тренировка животных в системе в течение одной недели. Е - Циркадная активность Измеряли спонтанную двигательную активность, используя индивидуальные боксы, каждый из которых состоял из выдвижного пола, съемной клетки и был снабжен инфракрасными датчиками захвата,которые позволяли измерять активность передвижений животного и количество вставаний на задние лапы. Боксы связывали с компьютером с использованием электронного интерфейса (например, Imetronic,Pessac, France). Мышей тестировали в течение 32 ч для того, чтобы измерить адаптацию к аппаратуре, а также дневную и ночную активность. Количество воды, выпитой за время тестирования, измеряли с использованием автоматизированного ликометра. Пример 4. Физико-химические свойства Растворимость в воде Твердые соединения (ВА желчные кислоты) суспендировали в 5 мл 0,1M HCl. После инкубирования в течение 1 недели, полученные насыщенные растворы фильтровали через фильтр Millipore (0,22 мкм) и измеряли концентрацию ВА с помощью ВЭЖХ-ESI-MC/MC, используя колонку С 18 (150 мм 2 мм i.d., 4 мкм) и, в качестве подвижной фазы, воду, содержащую 15 мМ уксусную кислоту с рН 5 и ацетонитрил. Скорость потока составляла 150 мкл/мин. Регистрацию данных масс-спектрометрии проводили в режиме мониторинга множественных реакций, используя источник ESI в режиме отрицательной ионизации. Растворимость в воде выражали в мкмоль/л. Растворимость в воде измеряли для малорастворимых протонированных частиц карбоксилированных желчных кислот при рН 1. Сульфаты и сульфонаты, такие как 3 А и 2 А, ионизированы даже при низких значениях рН, и в физиологических условиях всегда растворимы во всех биологических жидких средах. Таблица 2. Физико-химические свойства исследованных природных желчных кислот и их аналоговWS: данные по растворимости в воде относятся к ВА в форме протонированных частиц и, следовательно, эти данные не получали для 3 А, 2 А, TCDCA и TUDCA, которые имеют высокую растворимость (высокая).STCMC: поверхностное натяжение при CMC в 0,15 М водном растворе NaCl.LogPA: коэффициент распределения 1-октанол-вода исследованных желчных кислот в форме ионизированных частиц.: значения, взятые из литературы. Критическая концентрация мицеллообразования (CMC) Оценивали поверхностно-активные свойства, т.е. склонность к образованию мицелл, для заряженных молекул, которые растворимы в воде в виде натриевых солей (повышение pKa на 2 единицы). Критическую концентрацию мицеллообразования (CMC) определяли путем измерения поверхностного натяжения (ST), используя методику максимального давления в пузырьке, позволяющую получить значения поверхностного натяжения, на которые, в отличие от статических методик, лишь незначительно влияют возможные примеси. Использовали тензиометр Sensadyne 6000 (Chem-Dyne Research Corp., Milwaukee, WI), снабженный двумя стеклянными датчиками диаметром 0,5 и 4 мм, соединенными с источником азота. Частота образования пузырьков в дистиллированной воде при 26 С составляла 1 пузырек в секунду (Р=2,7 атм) и калибровку проводили с использованием дважды дистиллированной воды и метанола. Поверхностное натяжение растворов натриевых солей ВА в 0,15 М NaCl измеряли при различных концентрациях в диапазоне 0,13-50 мМ. Наносили на график зависимость значения поверхностного натяжения от логарифма концентрации соли желчной кислоты; регрессионные линии, соответствующие двум частям кривой (мономерной и мицеллярной фазам), рассчитывали с применением метода наименьших квадратов и точку пересечения этих линий принимали за значение CMC. Кроме того, из кривых зависимости ST от концентрации вычисляли значение поверхностного натяжения при CMC (равновесии между мономерными и мицеллярными частицами), получая информацию о поверхностной активности,которая связана с размером мицелл в сочетании со способностью понижать поверхностное натяжение.CMC определяли путем измерения поверхностного натяжения в неравновесных условиях, т.е. в условиях, при которых загрязнения незначительно влияют на полученные результаты (фиг. 1). Соединение 3 А демонстрирует высокую способность уменьшать поверхностное натяжение, при CMC 2,8 мМ. Вид зависимости ST от концентрации позволяет сделать предположение об образовании относительно крупных агрегатов с соответствующей поверхностной активностью. Коэффициент распределения октанол/вода Поскольку сульфатные и сульфонатные производные всегда ионизированы при всех значениях рН,коэффициент распределения октанол/вода для всех молекул измеряли в ионизированной форме. Коэффициент распределения 1-октанол/вода (LogP) измеряли с использованием обычной методики со встряхиваемой колбой. Эксперимент проводили для 0,1 мМ растворов солей желчных кислот при рН 8 с добавкой 0,1 М фосфатного буфера для гарантии полной ионизации ВА; значения log P соответствовали ВА в ионизированной форме, а не протонированным частицам, и исходные концентрации каждой ВА были ниже ее собственного значения CMC. Водный буфер предварительно насыщали 1-октанолом, 5 мл 1 октанола предварительно насыщали водой, затем добавляли к буферу и оставляли образцы для достижения равновесия на 2 недели при постоянном перемешивании при комнатной температуре. После центрифугирования осторожно разделяли фазы. Концентрацию ВА в водной фазе измеряли ВЭЖХ-ESIMC/MC, используя колонку С 18 (150 мм 2 мм i.d., 4 мкМ) и воду, содержащую 15 мкМ уксусную кислоту, с рН 5 и ацетонитрил, в качестве подвижной фазы. Расход потока составлял 150 мкл/мин и температуру колонки поддерживали на уровне 45 С. Регистрацию данных масс-спектрометрии проводили в режиме мониторинга множественных реакций, используя источник ESI в режиме отрицательной ионизации. Коэффициент распределения 1-октанол/вода вычисляли для ионизированных частиц, чтобы облегчить сравнение карбоксил- и сульфатзамещенных желчных кислот, поскольку последние не протонируются даже при очень низких значениях рН. Связывание альбумина Степень связывания альбумина оценивали с помощью равновесного диализа при фиксированном соотношении ВА-альбумин. ВА растворяли в концентрации 100 мкМ в физиологическом растворе (рН 7,2), содержащем 5% альбумина бычьей сыворотки, и оставляли стоять в течение 24 ч при 25 С. Два миллилитра этого раствора подвергали диализу в мешочках из целлюлозы, которые имели отсечку по молекулярной массе 12-14000, помещенных в 25 мл физиологического раствора. Систему приводили в равновесие осторожным механическим встряхиванием в течение 72 ч при 25 С. Концентрации ВА в диализированном растворе (соответствующие свободной несвязанной фракции) и в исходном растворе определяли с помощью ВЭЖХ-ESI-MC/MC, в тех же условиях, что и в предыдущем исследовании. Рассчитывали связывание альбумина в процентах, исходя из исходной концентрации ВА и концентрации несвязанной ВА в диализированной фракции. Данные приведены в табл. 2. Ни одно из соединений не демонстрирует связывания с альбумином, достаточного для относительно быстрого поглощения печенью, подобно природным ВА. Соответственно, ожидается другая (более медленная) кинетика их поглощения печенью. Пример 5. Исследование метаболической устойчивости при действии бактериальных культур человеческого стула Устойчивость к действию кишечных бактерий. 7a-дегидроксилирование Гомогенизированные образцы свежего человеческого стула (500 мг) помещали в стерильные флаконы, в которые добавляли 5 мл стерилизованной среды на основе измельченного мяса и глюкозы (ScottLab., Fiskville, RI). Затем добавляли ВА до конечной концентрации 0,05 мМ. После этого флаконы инкубировали при 37 С; затем через 0, 1, 2, 4, 8 и 24 ч после добавления ВА, реакции прекращали добавлением 150 мкл 30% KOH. Образцы центрифугировали при 3500 об/мин в течение 10 мин; из супернатанта выделяли ВА с помощью С-18 твердофазной экстракции, и анализировали их с помощью ТСХ и ВЭЖХES-MC/MC. В качестве первого скринингового теста применяли тонкослойную хроматографию (ТСХ), в которой использовали пластины с силикагелем толщиной 0,25 мм (Merck, Darmstat, Germany). Система растворителей, которую использовали для разделения конъюгированных ВА, состояла из пропионовой кислоты/изоамилацетата/воды/н-пропанола (3:4:1:2, все соотношения объемные; растворитель I), и система для неконъюгированных ВА состояла из уксусной кислоты/четыреххлористого углерода/изопропилового эфира/изоамилацетата/воды/н-пропанола/бензола (1:4:6:8:2:2, все соотношения объемные; растворительII). Пятна разделенных ВА проявляли 5% раствором фосфомолибденовой кислоты в этаноле. Все исследованные аналоги желчных кислот проявляли высокую устойчивость при инкубировании с бактериальными культурами человеческого стула, и даже через 24 ч более 85% соединений удалось выделить в неизменном виде, как показано на фиг. 2. В противоположность этому контрольный природный аналог CDCA продемонстрировал время полужизни лишь один час, и после восьми часов инкубирования был почти полностью метаболизирован (претерпел 7-дегидроксилирование) с образованием литохолевой кислоты. В случае всех 6-этилзамещенных аналогов после столь же продолжительного периода инкубирования, 7-дегидроксилирование и промежуточное образование 7-оксопроизводного практически отсутствовало. Устойчивость боковых цепей Согласно результатам первого эксперимента, боковые цепи не подвергаются изменениям при действии ферментов кишечных бактерий. Эти данные дают основание предположить, что наличие этильной группы в 6-м положении защищает гидроксильную группу в положении 7 от окисления или элиминирования за счет пространственных препятствий. Кроме того, все изученные аналоги проявляют значительную устойчивость к метаболизму боковых цепей. Сложноэфирная связь боковой цепи сульфатного аналога 2 А полностью стабильна в культурах человеческого стула. Сульфонатный аналог 3 А также очень стабилен. При исследовании способом ВЭЖХ-ES-MC/MC было обнаружено отсутствие второстепенных метаболитов. Эти данные дают возможность предположить, что в среде нижнего отдела кишечника в присутствии анаэробных бактерий, аналоги желчных кислот по настоящему изобретению являются стабильными. Пример 6. Метаболическая устойчивость в искусственной дуоденальной/панкреатической жидкости(по спецификации USP) in vitro Это исследование выполняли для соединения 2 А, поскольку в боковой цепи его молекулы содержится сложноэфирная связь, и цель исследования заключалась в подтверждении устойчивости в присутствии ферментов эстераз, которые находятся в соке двенадцатиперстной кишки и поджелудочной железы. Искусственную панкреатическую жидкость готовили растворением 10 г/л Pancreatin (Sigma P8096: панкреатин свиных поджелудочных желез, активность 1 по спецификации USP) в 0,05 М фосфатном буфере, рН 7,20,1. Затем к 4-мл аликвотам искусственной панкреатической жидкости добавляли 50 пМ исследуемой ВА и инкубировали в течение различных периодов времени (0, 30, 60, 90, 120, 180 и 240 мин) при 37 С. После инкубирования к 2-мл аликвоте каждого раствора добавляли 2 мл 0,1M NaOH,желчные кислоты экстрагировали SPE и анализировали с помощью тонкослойной хроматографии и масс-спектрометрии, как описано выше. На фиг. 2 показана устойчивость соединения 2 А к метаболизму в искусственной панкреатической жидкости. Согласно указаниям протокола USP в качестве контроля использовали оливковое масло. Соединение оказалось очень устойчивым (см. фиг. 2) и сложноэфирная связь (сульфата) в соединении 2 А не подвергалась гидролизу панкреатическими эстеразами, что позволяет сделать вывод о высокой устойчивости в среде содержимого двенадцатиперстной кишки и верхнего отдела кишечника человека. Пример 7. Секреция с желчью и метаболизм соединения 3 А в организме крысы с желчной фистулой после дуоденального (id) и феморального (iv) введения Цель и обоснование эксперимента Структурная модификация новых аналогов желчных кислот могла бы повлиять на их поглощение печенью, печеночный транспорт и секрецию, и абсорбцию в кишечнике. Следовательно, сведения о секреции с желчью после iv и id введения, а также о метаболизме, являются ключевым моментом в отборе кандидатов для дальнейших исследований. Для оценки пути и эффективности кишечной абсорбции, аналоги желчных кислот по настоящему изобретению вводили как внутривенно (феморальная инфузия), так и перорально (дуоденальная инфузия) в одинаковых дозах и определяли скорость их секреции с желчью в модели крысы с желчной фистулой. Разница в площадях под кривыми зависимости секреции с желчью от времени для iv и id введения является мерой кишечной абсорбции и дает информацию о биодоступности. Желчегонный эффект Дуоденальная инфузия Модель крысы с желчной фистулой была разработана в отделе содействия лабораторным исследованиям University of Bologna (университета г. Болоньи). Соединение 3 А вводили крысам в дозировке 1 мкмоль/кг/мин (1-часовая инфузия) путем дуоденальной инфузии (id). У крыс имелась желчная фистула для отбора образцов желчи в различные моменты времени до и во время инфузии. В экспериментах по дуоденальной инфузии были задействованы три крысы (25010 г). Образцы желчи отбирали каждые 15 мин в течение четырех часов. Помимо этого 3 контрольным животным вводили физиологический раствор при тех же временных параметрах и условиях отбора образцов (контрольные крысы в эксперименте по дуоденальной инфузии). На фиг. 3 показаны объемы желчи, выделяющейся во время отбора образцов (для одного животного). Дуоденальную инфузию начинали через 30 мин после первого отбора желчи и проводили ее в течение одного часа. Соединение 3 А продемонстрировало умеренный желчегонный эффект. Внутривенная инфузия В эксперименте по феморальной инфузии были задействованы 3 крысы. На фиг. 4 показаны объемы желчи, выделявшейся во время исследования. Феморальную инфузию начинали через 75 мин после достижения равновесного состояния и продолжали в течение 60 мин. Образцы желчи отбирали каждые 15 мин в течение четырех часов. Помимо этого трем крысам вводили физиологический раствор при тех же временных параметрах и условиях отбора образцов (контрольные крысы в эксперименте по феморальной инфузии). Соединение 3 А продемонстрировало умеренный желчегонный эффект, подобный тому, который был получен в id эксперименте. Секреция введенных аналогов желчных кислот с желчью Образцы желчи, собранные во время iv и id экспериментов, анализировали для определения секреции с желчью введенных аналогов желчных кислот и их метаболитов. Анализ ВЭЖХ-ES-MC/MC. Готовили концентрированные растворы каждого из соединений в метаноле в концентрации 1 ммоль/л (за исключением UPF 1212 в концентрации 350 мкмоль/л) и затем готовили рабочие растворы, разбавляя соответствующие количества исходного раствора. Метанол и ацетонитрил имели степень чистоты для ВЭЖХ. Использовали раствор аммиака с концентрацией 30 и 99,8% уксусную кислоту. Все реагенты получали от Carlo Erba Reagents. Воду с чистотой, достаточной для ВЭЖХ, получали с помощью системы Milli-Q. Приготовление образцов Температуру образцов крысиной желчи доводили до комнатной, быстро перемешивали и разбавляли в объемном отношении 1:100 (образцы желчи из экспериментов по дуоденальной инфузии), и 1:100 или 1:200 (образцы желчи из эксперимента по феморальной инфузии), смесью 15 мМ буферный раствор ацетата аммония (рН 5,0):ацетонитрил=70:30 (об./об.). Конечный раствор переносили во флаконы автозагрузчика образцов и вводили в хроматографическую колонку 10 мкл раствора. Методика ВЭЖХ-ESI-MC/MC Образцы крысиной желчи анализировали при помощи жидкостной хроматографии с последующим масс-спектрометрическим анализом (ВЭЖХ-МС/МС) в котором использовалась ионизация электрораспылением (ESI) в режиме отрицательной ионизации. Для жидкостной хроматографии использовали разделительный модуль Waters Alliance 2695 совместно с автозагрузчиком образцов. Температуру в автозагрузчике поддерживали на уровне 7 С. Разделение проводили на колонке Synergi Hydro-RP C18 (1502,0 мм i. d., размер частиц 4 мкм), защищенной предколонкой Security Guard ODS 42,0 мм i.d., обе колонки фирмы Phenomenex. Анализируемые образцы элюировали с использованием 15 мМ буферного раствора ацетата аммония (рН=5,00) в качестве подвижной фазы А и ацетонитрила в качестве подвижной фазы В. Долю подвижной фазы В повышали с 30 до 64% в течение 10 мин, затем до 100% течение 10 мин и оставляли на этом уровне в течение еще 10 мин. Скорость потока составляла 150 мкл/мин и температуру колонки поддерживали на уровне 45 С. Выходящий из колонки поток вводили в ESI источник ионов,соединенный с тройным квадрупольным масс-спектрометром (Quattro-LC, Micromass), работающим в режиме мониторинга множественных реакций (MRM). Азот использовали в качестве распыляющего газа при скорости потока 90 л/ч и для удаления растворителя при скорости потока 930 л/ч. Температуры блока источника ионов и блока удаления растворителя были установлены на уровне 80 и 180 С соответственно. Напряжение на капилляре составляло 3,0 кВ. Для сбора и обработки данных использовали программу MassLynx версии 4,0. Кроме того, для идентификации метаболитов эксперименты по массспектрометрии проводили как в одиночной конфигурации МС, так и в тандемной конфигурации МС/МС. Получение количественных данных Ежедневно строили калибровочную кривую по 5 точкам, причем данные для каждой точки получали в результате двукратного введения образца. Образцы для калибровки готовили в диапазоне концентраций 0,1-25 мкмоль/л, используя в качестве растворителя подвижную фазу. Параметры линейной калибровочной кривой получали из графика зависимости площади под кривой анализируемого вещества от его концентрации с использованием регрессионного анализа по методу наименьших квадратов (взвешивание по 1/х 2). Коэффициенты корреляции составляли 0,989. Фармакокинетика (секреция с желчью) введенных аналогов желчных кислот: сравнениеiv и id введения Приведенные ниже данные относятся к скорости секреции аналогов желчных кислот в неизменном состоянии выходимых вместе с желчью после дуоденальной и феморальной инфузии в дозировке 1 мкмоль/кг/мин. Позже будут приведены данные по основным и второстепенным метаболитам. В табл. 3 показаны концентрации соединения 3 А и величины секреции, полученные для образцов крысиной желчи, отобранных во время дуоденальной инфузии (1 ч с 75-й до 135 мин). В табл. 4 показаны концентрации соединения 3 А и величины секреции, полученные для образцов крысиной желчи, отобранных во время феморальной инфузии (1 ч с 75-й до 135 мин).b: n.d.; не обнаружена. Секреция соединения 3 А (сульфонированного аналога желчной кислоты) с желчью после iv введения происходит очень эффективно, и соединение почти полностью поступает в желчь в неизменном виде. Кинетический профиль показывает, что данный аналог эффективно поглощается печенью и секретируется в желчь почти в исходном состоянии, не претерпевая метаболизма в печени (фиг. 5). В противоположность этому, после id введения выделение соединения с желчью оказывается значительно меньшим, чем после iv введения, и это дает основание предположить, что соединение плохо абсорбируется в кишечнике (фиг. 5). В соответствии со своими физико-химическим свойствами, это соединение плохо абсорбируется при действии механизма пассивной диффузии (низкое значение logP=0,71), и активный механизм, по-видимому, не задействован в данном случае. Наличие в молекуле трех гидроксильных групп приводит к тому, что молекула с одной стороны эффективно поглощается печенью и секретируется в желчь, но с другой стороны плохо абсорбируется кишечником. Пример 8. Метаболизм в печени Для предварительного скрининга осуществляли поиск возможных метаболитов, исходя из соединений, образование которых ожидалось согласно предыдущим экспериментам и данным, и в соответствии со структурой и физико-химическим свойствами изученных аналогов. Соединение 3 А не претерпевало метаболизма в печени или в кишечнике, и при поглощении печенью секретировалось в желчь в неизменном виде и с высокой скоростью, что приводило к незначительному времени пребывания в печени. При введении с помощью id, соединение плохо абсорбировалось кишечником, и в этом случае также не подвергалось метаболическим превращениям. Вследствие относительно высокой гидрофильности (низкого значения LogP) и присутствия сульфонатной группы и трех гидроксильных групп, соединение 3 А достаточно полярно для того, чтобы претерпевать секрецию в желчь в неизменном виде, но слишком полярно для поглощения кишечником при действии пассивных механизмов. На фиг. 6 показано содержание в желчи соединения 3 А и его основного метаболита по данным масс-спектрометрии в эксперименте с дуоденальной инфузией. Приведенные данные представляют собой абсолютные значения площадей под кривыми. На фиг. 7 показан увеличенный фрагмент фиг. 6. Пример 9. In vitro исследование токсического действия соединений на клетки HepG2 Цитотоксичность соединений по настоящему изобретению оценивали с использованием стандартных методик, известных в технике. Конкретно, цитотоксичность оценивали с использованием клетокHepG2, наблюдали за уменьшением содержания АТР и определяли значения ЕС 50. Оба соединения 3 А и 2 А продемонстрировали значения ЕС 501000 мМ.
МПК / Метки
МПК: A61P 37/00, C07J 31/00, A61K 31/575, A61P 13/12, A61P 1/16
Метки: применение, рецептора, модуляторы
Код ссылки
<a href="https://eas.patents.su/30-20310-modulyatory-receptora-tgr5-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы рецептора tgr5 и их применение</a>
Предыдущий патент: Автоматический инъектор и способ приведения его в готовность
Следующий патент: Вектор на основе искусственной хромосомы
Случайный патент: Долото ударного действия для роторного бурения грунта и способ его работы