{5-[4-(3,3-диметилазетидин-1-карбонил)фенил]-[1,2,4]триазол[1,5-a]пиридин-2-ил}амид циклопропанкарбоновой кислоты
Формула / Реферат
1. Соединение формулы I
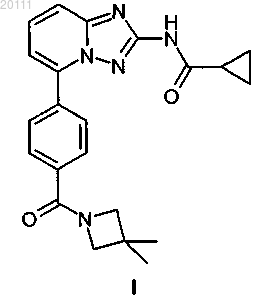
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения или его фармацевтически приемлемой соли по п.1.
3. Фармацевтическая композиция по п.2, содержащая дополнительный терапевтический агент, где дополнительный терапевтический агент представляет собой агент для лечения, предупреждения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани, и/или заболеваний, связанных с гиперсекрецией IL6.
4. Применение соединения или его фармацевтически приемлемой соли по п.1 для получения лекарственного средства.
5. Применение соединения или его фармацевтически приемлемой соли по п.1 в качестве лекарственного средства.
6. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения, предупреждения и/или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани, и/или заболеваний, связанных с гиперсекрецией IL6.
7. Применение соединения или его фармацевтически приемлемой соли по п.1 для получения лекарственного средства для лечения, предупреждения и/или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани, и/или заболеваний, связанных с гиперсекрецией IL6.
8. Способ лечения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани, и/или заболеваний, связанных с гиперсекрецией IL6, при этом указанный способ включает в себя введение эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1, 4 или 5 или фармацевтической композиции по п.2.
9. Способ по п.8, в котором воспалительное состояние представляет собой ревматоидный артрит.
10. Способ по п.8, в котором состояние или заболевание включает в себя воспаление.
11. Способ по п.8, где соединение по п.1 вводят в сочетании с дополнительным терапевтическим агентом, где дополнительный терапевтический агент представляет собой агент для лечения, предупреждения или профилактики воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжения трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани, и/или заболеваний, связанных с гиперсекрецией IL6.
Текст
(I). Данное соединение можно получить в виде фармацевтической композиции, которая может быть использована для предупреждения и лечения ряда состояний у млекопитающих,включая людей, включая путем неограничивающего примера воспалительные состояния,аутоиммунные заболевания, пролиферативные заболевания, отторжения трансплантата,заболевания, включающие в себя ухудшение обновления хрящевой ткани, врожденные пороки развития хрящевой ткани и/или заболевания, связанные с гиперсекрецией IL6. Мене Кристель Жанн Мари, Блан Хавьер (BE) Медведев В.Н. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к соединению, которое является ингибитором JAK, семейству тирозинкиназ, участвующих в воспалительных состояниях, аутоиммунных заболеваниях, пролиферативных заболеваниях, отторжении трансплантата, заболеваниях, включающих в себя ухудшение обновления хрящевой ткани, врожденные пороки развития хрящевой ткани и/или заболевания, связанные с гиперсекрецией IL6. В настоящем изобретении также предоставлены способы получения данного соединения,фармацевтические композиции, содержащие данное соединение, и способы предупреждения и/или лечения воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжений трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани и/или заболеваний, связанных с гиперсекрецией IL6, путем введения соединения данного изобретения. Янус-киназы (JAK) представляют собой цитоплазматические тирозинкиназы, передающие цитокиновый сигнал от мембранных рецепторов к факторам транскрипции STAT. Описано четыре члена семейства JAK: JAK1, JAK2, JAK3 и TYK2. При связывании цитокина со своим рецептором члены семействаJAK ауто- и/или трансфосфорилируют друг друга с последующим фосфорилированием STAT, которые затем мигрируют в ядро для модулирования транскрипции. Внутриклеточная передача сигнала JAKSTAT обеспечивается интерферонами, большинством интерлейкинов, а также множеством цитокинов и эндокринных факторов, таких как ЕРО, ТРО, GH, OSM, LIF, CNTF, GM-CSF и PRL (Vainchenker W. et al.(2008. Генетические модели в сочетании и исследованием малых молекул ингибиторов JAK выявили терапевтический потенциал нескольких JAK. При помощи генетики мышей и людей подтверждено, чтоJAK3 является иммуносуппрессорной мишенью (О'Shea J. et al. (2004. Ингибиторы JAK3 были успешно приняты в клиническую разработку, первоначально для случаев отторжения трансплантата органов, но впоследствии также и для других иммуновоспалительных показаний, таких как ревматоидный артритTYK2 представляет собой возможную мишень в случае иммуновоспалительных заболеваний, что подтверждено методом генетики человека и исследованиями нокаутных мышей (Levy D. And Loomis С.JAK1 представляет собой новую мишень в области иммуновоспалительных заболеваний. JAK1 гетеродимеризуется с другими JAK для передачи сигнала от провоспалительных цитокинов. Следовательно, ожидается, что ингибирование JAK1 и/или других JAK окажет благоприятное терапевтическое воздействие в случае ряда воспалительных состояний, а также других заболеваний, передающихся путемJAK-опосредованной передачи сигнала. Предпосылки к созданию изобретения Дегенерация хряща является признаком различных заболеваний, среди которых наиболее известными являются ревматоидный артрит и остеоартрит. Ревматоидный артрит (RA) представляет собой хроническое дегенеративное поражение сустава, характеризуемое воспалением и разрушением структур сустава. Если не лечить данное заболевание, это приводит к значительной недееспособности и боли вследствие потери функций сустава и даже к преждевременной смерти. Таким образом, целью терапииRA является не только замедлить развитие болезни, но добиться ремиссии, чтобы остановить разрушение сустава. Вследствие тяжести последствий данного заболевания широкое распространение RA (приблизительно 0,8% взрослых поражены по всему миру) означает большое социоэкономическое воздействие (в отношении обзоров по RA авторы изобретения ссылаются на Smolen and Steiner (2003); Lee andWeinblatt (2001); Choy and Panayi (2001); O'Dell (2004) и Firestein (2003. Остеоартрит (называемый также ОА, или артрит, обусловленный изнашиванием) представляет собой наиболее распространенную форму артрита и характеризуется потерей суставного хряща, зачастую связанную с гипертрофией кости и болью. В отношении исчерпывающего обзора по остеоартриту авторы изобретения обращаются к Wieland et al. (2005). Остеоартрит с трудом поддается лечению. В настоящее время отсутствуют надежные методы лечения и лечение направлено на облегчение боли и предупреждение деформации пораженного сустава. Общепринятые методы лечения включают в себя использование нестероидных и противовоспалительных лекарственных препаратов (NSAID). Несмотря на то что для лечения остеоартрита рекомендуют пищевые добавки, такие как хондроитин и сульфат глюкозамина, в ходе недавнего клинического исследования было выяснено, что оба метода лечения не уменьшают боль, связанную с остеоартритом (Clegg et al.,2006). В целом, доступные лекарственные средства, корректирующие заболевание остеоартритом, отсутствуют. Стимуляция анаболических процессов, блокирование катаболических процессов или сочетание двух этих процессов может привести к стабилизации сустава и, возможно, даже реверсии поражения и,следовательно, предупреждает дальнейшее развитие данного заболевания. Анаболическая стимуляция хондроцитов может стимулироваться различными спусковыми механизмами. Инсулиноподобный фактор роста-I (IGF-I) является доминирующим анаболическим фактором роста в синовиальной жидкости и стимулирует синтез как протеогликанов, так и коллагена. Кроме того, было показано, что члены семей-1 020111 ства морфогенетических белков костей (BMP), а именно ВМР 2, ВМР 4, ВМРб и ВМР 7, и члены семейства трансформирующих факторов роста человека- (TGF-) способны вызывать анаболическую стимуляцию хондроцитов (Chubinskaya and Kuettner, 2003). Недавно было идентифицировано соединение, вызывающее анаболическую стимуляцию хондроцитов (патент США 6500854; ЕР 1391211). Однако для большинства из этих соединений проявляются серьезные побочные эффекты и, следовательно, существует значительная необходимость в соединениях, стимулирующих дифференциацию хондроцитов без этих побочных эффектов.Vandeghinste et al. (WO 2005/124342) обнаружили, что JAK1 представляет собой мишень, ингибирование которой может иметь терапевтическое значение в случае нескольких заболеваний, включая ОА.JAK1 принадлежит к семейству Янус-киназ (JAK) цитоплазматических тирозинкиназ, участвующих в опосредованной цитокиновыми рецепторами внутриклеточной передаче сигнала. Семейство JAK состоит из 4 членов: JAK1, JAK2, JAK3 и TYK2. JAK вовлекаются в цитокиновые рецепторы при связывании с цитокином с последующей гетеродимеризацией цитокинового рецептора и совместно используемой рецепторной субъединицы (общая цепь гамма-с, gp130). Затем JAK активируются путем ауто- и/или трансфосфорилирования другой JAK, что приводит к фосфорилированию рецепторов и рекрутингу и фосфорилированию членов передатчиков сигнала и активатора транскрипции (STAT). Фосфорилированные STAT димеризуются и перемещаются в ядро, где они связываются с энхансерными областями цитокин-респонсивных генов. Нокаут гена JAK1 у мышей показал, что JAK1 играет существенные и неизбыточные роли в процессе развития: JAK1-/-мышей умерли в течение 24 ч после рождения и развитие лимфоцитов было сильно нарушено. Более того, клетки JAK1-/- не были или были менее реакционноспособны по отношению к цитокинам, чем в случае использования цитокиновых рецепторов II класса, цитокиновых рецепторов, использующих субъединицу гамма-с для передачи сигнала, и семейства цитокиновых рецепторов, использующих субъединицу gp130 для передачи сигнала (Rodig et al., 1998.) Различные группы подразумевали передачу сигнала JAK-STAT в биологии хондроцитов. Li et al.(2001) показали, что онкостатин М вызывает экспрессию генов ММР и TIMP3 в первичных хондроцитах за счет активации путей передачи сигнала JAK/STAT и MAPK. Osaki et al. (2003) показали, что опосредованное интерфероном-гамма ингибирование коллагена II в хондроцитах включает в себя передачу сигнала JAK-STAT. IL1- вызывает катаболизм хряща за счет снижения экспрессии компонентов матрикса и за счет экспрессии коллагеназ и индуцируемой синтазы оксида азота (NOS2), которая опосредует образование оксида азота (NO). Otero et al., (2005) показали, что лептин и IL1- синергитически вызывают образование NO или экспрессию NOS2 мРНК в хондроцитах и что она блокируется ингибитором JAK.Legendre et al. (2003) показали, что рецептор IL6/IL6 вызывает даунрегуляцию хрящ-специфичных матриксных генов коллагена II, ядра аггрекана и связывающего белка в суставных хондроцитах быка и что это опосредуется передачей сигнала JAK/STAT. Следовательно, данные наблюдения предполагают роль активности JAK-киназы в гомеостазе хряща и терапевтические возможности для ингибиторов JAKкиназ. Члены семейства JAK участвовали в дополнительных состояниях, включающих в себя миелопролиферативные нарушения (O'Sullivan et al., 2007, Mol. Immunol. 44(10):2497-506), для которых были определены мутации в JAK2. Это указывает на то, что ингибиторы JAK, в частности JAK2, также могут быть использованы при лечении миелопролиферативных нарушений. Кроме того, семейство JAK, в частности JAK1, связано с различными видами рака, в частности различными видами лейкоза, например острым миелоидным лейкозом (O'Sullivan et al., 2007, Mol. Immunol. 44 (10) :2497-506; Xiang et al., 2008,"Identification of somatic JAK1 mutations in patients with acute myeloid leukemia" Blood First Edition Paper,prepublished online December 26, 2007; DOI 10.1182/blood-2007-05-090308) и острым лимфобластическим лейкозом (Mullighan et al., 2009), или солидными опухолями, например лейомиосаркомой матки (Constantinescu et al., 2007, Trends in Biochemical Sciences 33(3): 122-131), раком предстательной железы (Tamet al., 2007, British Journal of Cancer, 97, 378-383). Эти результаты указывают на то, что ингибиторы JAK,в частности JAK1 и/или JAK2, могут также быть использованы при лечении различных видов рака (лейкозов и солидных опухолей, например лейомиосаркомы матки, рака предстательной железы). Кроме того, болезнь Кастлмана, множественная миелома, мезангиальный пролиферативный гломерулонефрит, псориаз и саркома Капоши, по-видимому, происходят вследствие гиперсекреции цитокинаIL-6, биологические эффекты которого опосредуются внутриклеточной передачей сигнала JAK-STAT(Tetsuji Naka, Norihiro Nishimoto and Tadamitsu Kishimoto, Arthritis Res 2002, 4 (suppl 3): S233-S242). Эти результаты указывают на то, что ингибиторы JAK могут также быть использованы при лечении указанных заболеваний. Для JAK3 и Tyk2 была установлена связь с аутоиммунными заболеваниями. Мутации в JAK3, а также в верхних компонентах передачи сигнала цепи гамма-с рецептора и IL7 составляют в сумме приблизительно 70% случаев тяжелого комбинированного иммунодефицита. Следует отметить, что JAK1 сотрудничает с JAK3 в передаче сигналов от цепи гамма-с рецептора. Полиморфизм Тук 2 заметен в системной красной волчанке (SLE) (О'Sullivan et al., 2007, Mol. Immunol. 44(10):2497-506). Поэтому избрание мишенью семейства JAK может предоставить терапевтическую возможность в области иммуновос-2 020111 палительных заболеваний. Существующие в настоящее время терапевтические методы лечения не являются удовлетворительными и, следовательно, сохраняется необходимость в получении других соединений, которые могут быть полезны при лечении воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжений трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани и/или заболеваний, связанных с гиперсекрецией IL6. Таким образом, в настоящем изобретении предоставлено соединение, способы его получения и фармацевтические композиции, содержащие соединение настоящего изобретения совместно с подходящим фармацевтическим носителем. В частности, данное соединение проявляет высокую эффективность и селективность в отношении JAK1 по сравнению с другими членами семейства JAK, помимо 385 киназы и некиназных мишеней. Кроме того, данные указывают на то, что данное соединение обладает хорошими пределами безопасности. Поэтому сделан вывод о том, что в настоящем изобретении предложена новая возможность лечения заболеваний, опосредованных JAK1, в частности воспалительных заболеваний, таких как SLE (системная красная волчанка) и RA. Кроме того, в настоящем изобретении предоставлено использование соединения изобретения для получения лекарственного средства для лечения данных заболеваний и состояний. Краткое описание сущности изобретения Настоящее изобретение основано на открытии того факта, что ингибиторы JAK, в частности JAK1,применимы для лечения воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжений трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков развития хрящевой ткани и/или заболеваний, связанных с гиперсекрецией IL6. В настоящем изобретении также предоставлены способы получения данных соединений, фармацевтические композиции, содержащие данные соединения, и способы лечения воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжений трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков хрящевой ткани и/или заболеваний, связанных с гиперсекрецией IL6, при введении соединения данного изобретения. Соответственно в первом аспекте изобретения описано соединение данного изобретения, имеющее формулу I Соединение изобретения представляет собой новый ингибитор JAK, проявляющий высокую эффективность и селективность в отношении JAK1 по сравнению с другими членами семейства JAK, помимо 385 киназы и некиназных мишеней, а также обладает хорошими пределами безопасности. Использование соединения с таким профилем может привести к преимуществам при лечении воспалительных заболеваний, в частности SLE и RA, благодаря низкому проценту неспецифичных эффектов. В следующем аспекте в настоящем изобретении предоставлены фармацевтические композиции, содержащие соединение данного изобретения, и фармацевтический носитель, эксципиент или разбавитель. Кроме того, соединение данного изобретения, применимое в фармацевтических композициях и описанных в данном описании способах лечения, является фармацевтически приемлемым согласно получению и использованию. В данном аспекте изобретения фармацевтическая композиция может также содержать дополнительные активные ингредиенты, подходящие для использования в сочетании с соединением данного изобретения. В следующем аспекте изобретения в данном изобретении предоставлен способ лечения млекопитающего, восприимчивого или пораженного состоянием из числа перечисленных в настоящем описании и, в частности, таким состоянием, которое может быть связано с аберрантной активностью JAK, например воспалительными состояниями, аутоиммунными заболеваниями, пролиферативными заболеваниями,отторжениями трансплантата, заболеваниями, включающими в себя ухудшение обновления хрящевой ткани, врожденными пороками развития хрящевой ткани и/или заболеваниями, связанными с гиперсекрецией IL6, при этом данный способ включает в себя введение терапевтически эффективного количества соединения данного изобретения или одной или более раскрытых в описании фармацевтических композиций. В конкретном аспекте в данном изобретении предоставлен способ лечения млекопитающего, восприимчивого или пораженного состоянием, которое может быть связано с аберрантной активностьюJAK, в частности воспалительными состояниями, пролиферативными заболеваниями и заболеваниями,включающими в себя ухудшение обновления хрящевой ткани. В следующем аспекте в настоящем изобретении предоставлено соединение данного изобретения,-3 020111 предназначенное для лечения или предупреждения состояния из числа перечисленных в настоящем описании, в частности таких состояний, которые могут быть связаны с аберрантной активностью JAK, такие как воспалительные состояния, аутоиммунные заболевания, пролиферативные заболевания, отторжения трансплантата, заболевания, включающие в себя ухудшение обновления хрящевой ткани, врожденные пороки развития хрящевой ткани и/или заболевания, связанные с гиперсекрецией IL6. В конкретном аспекте в настоящем изобретении предоставлено соединение данного изобретения, предназначенное для лечения или предупреждения состояния, связанного с аберрантной активностью JAK1, в частности воспалительных состояний, пролиферативных заболеваний и заболеваний, включающих в себя ухудшение обновления хрящевой ткани. В еще одном аспекте, связанном со способом лечения, в данном изобретении предоставлен способ лечения млекопитающего, восприимчивого или пораженного состоянием, причинно связанным с описанной в данном описании аномальной активностью JAK, при этом данный способ включает в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций, или соединения данного изобретения. В конкретном варианте осуществления аномальная активность JAK представляет собой аномальную активность JAK1. В следующем аспекте в настоящем изобретении предоставлено соединение данного изобретения,предназначенное для лечения или предупреждения состояния, причинно связанного с аномальной активностью JAK. В конкретном варианте осуществления аномальная активность JAK представляет собой аномальную активность JAK1. В дополнительных аспектах в данном изобретении предоставлены способы синтеза соединения изобретения, при этом репрезентативные методики и пути синтеза описаны в данном описании далее. Соответственно главной целью данного изобретения является предоставление соединения, способного модифицировать активность JAK и, таким образом, предупреждать или излечивать любые состояния, которые могут быть причинно связаны с ней. В частности, любые состояния, которые могут быть причинно связаны с активностью JAK1. Следующей целью настоящего изобретения является предоставление соединения, способного лечить или облегчать состояния или заболевания либо их симптомы, такие как воспалительные состояния,аутоиммунные заболевания, пролиферативные заболевания, отторжения трансплантата, заболевания,включающие в себя ухудшение обновления хрящевой ткани, врожденные пороки развития хрящевой ткани и/или заболевания, связанные с гиперсекрецией IL6, которые могут быть причинно связаны с активностью JAK. В частности, любое заболевание или состояние, которое может быть причинно связано с активностью JAK1. Еще одной целью данного изобретения является предоставление фармацевтических композиций,которые могут быть использованы для лечения или предупреждения множества болезненных состояний,включая заболевания, связанные с активностью JAK, такие как воспалительные состояния, аутоиммунные заболевания, пролиферативные заболевания, отторжения трансплантата, заболевания, включающие в себя ухудшение обновления хрящевой ткани, врожденные пороки развития хрящевой ткани и/или заболевания, связанные с гиперсекрецией IL6. В частности, состояния, связанные с активностью JAK1. Другие цели и преимущества будут очевидны специалистам в данной области из рассмотрения последующего подробного описания. Подробное описание изобретения Определения. Подразумевается, что следующие термины имеют приведенные ниже значения и полезны для понимания описания и предусмотренных рамок настоящего изобретения. При описании данного изобретения, которое может включать в себя соединения, фармацевтические композиции, содержащие подобные соединения и способы применения подобных соединений и композиций, следующие термины, в случае их наличия, имеют следующие значения, если не указано иначе. Следует также понимать, что при описании в настоящем описании любая из определенных ниже групп может быть замещена рядом заместителей и что подразумевается, что соответствующие определения включают в себя подобные замещенные группы в свои рамки, установленные ниже. Если не указано иначе, термин "замещенный" следует определять, как установлено далее. Кроме того, следует понимать,что при использовании в настоящем описании термины "группы" и "радикалы" можно считать взаимозаменяемыми."Фармацевтически приемлемый" означает принятый или могущий быть принятым регулирующим ведомством федерального или государственного правительства либо соответствующим ведомством в странах, отличных от Соединенных Штатов, или тот, который перечислен в фармакопее США или других общепринятых фармакопеях для использования для животных, а более конкретно, для людей."Фармацевтически приемлемая соль" относится к соли соединения данного изобретения, которая является фармацевтически приемлемой и которая обладает требуемой фармакологической активностью исходного соединения. В частности, подобные соли не являются токсичными, могут представлять собой соли присоединения неорганических или органических кислот и соли присоединения оснований. Конкретно, подобные соли включают в себя (1) соли присоединения кислоты, полученные с неорганически-4 020111 ми кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота,азотная кислота, фосфорная кислота и т.д.; или полученные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, капроевая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота,3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота,бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4 толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третбутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и так далее; или (2) соли, образованные в том случае, когда кислый протон, имеющийся в исходном соединении, либо замещен ионом металла, например ионом щелочного металла, ионом щелочно-земельного металла, или ионом алюминия; или координирован с органическим основанием, таким как этаноламин, диэтаноламин,триэтаноламин, N-метилглюкамин и т.д. Кроме того, соли включают в себя, только в качестве примера,соли натрия, калия, кальция, магния, аммония, тетраалкиламмония и так далее; а в случае, когда соединение содержит основную функциональную группу, соли нетоксичных органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.д. Термин "фармацевтически приемлемый катион" относится к приемлемому катионному противоиону кислотной функциональной группы. Примерами подобных катионов являются катионы натрия, калия,кальция, магния, аммония, тетраалкиламмония и т.д."Фармацевтически приемлемый разбавитель" относится к разбавителю, адъюванту, эксципиенту или носителю, с которым вводят соединение данного изобретения."Пролекарства" относятся к соединениям, включая производные соединений данного изобретения,которые содержат отщепляемые группы и в результате сольволиза или в физиологических условиях превращаются в соединения данного изобретения, которые фармацевтически активны in vivo. Подобные примеры включают в себя, но не ограничиваются производными холинового эфира и т.д., Nалкилмормолинового эфира и т.д."Сольват" относится к формам соединения, которые ассоциированы с растворителем, обычно по реакции сольволиза. Данная физическая ассоциация включает в себя связывание за счет водородных связей. Обычные растворители включают в себя воду, этанол, уксусную кислоту и т.д. Соединения данного изобретения могут быть получены, например, в кристаллической форме и могут быть сольватированы или гидратированы. Подходящие сольваты включают в себя фармацевтически приемлемые сольваты, такие как гидраты, а также включают в себя как стехиометрические сольваты, так и нестехиометрические сольваты. В некоторых случаях сольват может быть выделен, например, когда одна или более молекул растворителя входят в кристаллическую решетку кристаллического твердого вещества. "Сольват" включает в себя как фазу в растворе, так и выделяемые сольваты. Представительные сольваты включают в себя гидраты, этаноляты и метаноляты."Терапевтически эффективное количество" означает количество соединения, которого при введении субъекту для лечения заболевания достаточно для осуществления подобного лечения данного заболевания. "Терапевтически эффективное количество" может изменяться в зависимости от соединения,заболевания и его тяжести и возраста, массы и т.д., подлежащего лечению субъекта."Предупреждающий" или "предупреждение" относится к снижению риска получения или развития заболевания или нарушения (то есть приведение к тому, что по меньшей мере один из клинических симптомов заболевания не развивается у субъекта, который может подвергаться действию вызывающего заболевание агента или предрасположен к заболеванию до начала заболевания). Термин "профилактика" относится к "предупреждению" и относится к мере или процедуре, целью которой является предупреждение, а не лечение или излечение от заболевания. Неограничивающие примеры профилактических мер могут включать в себя введение вакцин, введение низкомолекулярного гепарина находящимся в стационаре пациентам, подвергающимся риску получить тромбоз, например,вследствие обездвиживания, и введение противомалярийного агента, такого как хлорохин, перед визитом в географический регион, в котором малярия является эндемической, или где высок риск контакта с малярией."Лечащий" или "лечение" любого заболевания или нарушения относится в одном из вариантов осуществления к облегчения данного заболевания или нарушения (то есть остановке заболевания или проявления, степени или тяжести по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечащий" или "лечение" относится к облегчению по меньшей мере одного физического параметра, который может быть незаметен для субъекта. В еще одном варианте осуществле-5 020111 ния "лечащий" или "лечение" относится к модулированию заболевания или нарушения, либо физически(например, стабилизация заметного симптома), физиологически (например, стабилизация физического параметра), или и того, и другого. В следующем варианте осуществления "лечащий" или "лечение" относится к замедлению развития заболевания. Используемый в настоящем описании термин "воспалительное состояние(состояния)" относится к группе состояний, включающих в себя ревматоидный артрит, остеоартрит, юношеский идиопатический артрит, псориаз, аллергическое заболевание дыхательных путей (например, астма, ринит), воспалительные заболевания кишечника (например, болезнь Крона, колит), вызванные эндотоксинами болезненные состояния (например, осложнения после аортокоронарного шунтирования или хронические эндотоксические состояния, приводящие, например, к хронической сердечной недостаточности) и родственные заболевания с участием хрящей, такие как заболевания суставов. В частности, данный термин относится к ревматоидному артриту, остеоартриту, аллергическому заболеванию дыхательных путей (например,астме) и воспалительным заболеваниям кишечника. Используемый в настоящем описании термин "аутоиммунное заболевание(заболевания)" относится к группе заболеваний, включающих в себя обструктивное заболевание дыхательных путей, включая такие состояния, как COPD, астму (например, наследственную бронхиальную астму, пылевую астму, детскую астму), в особенности хроническую или застарелую астму (например, позднюю астму, или гиперреактивность дыхательных путей), бронхит, включая бронхиальную астму, системную красную волчанку(атопический дерматит), контактный дерматит и другие экзематозные дерматиты, воспалительное заболевание кишечника (например, болезнь Крона и неспецифический язвенный колит), атеросклероз и боковой амиотрофический склероз. В частности, данный термин относится к COPD, астме, системной красной волчанке, сахарному диабету I типа и воспалительному заболеванию кишечника. Используемый в настоящем описании термин "пролиферативное заболевание(заболевания)" относится к таким состояниям, как рак (например, лейомиосаркома матки или рак предстательной железы),миелопролиферативные нарушения (например, истинная полицитемия, эссенциальный тромбоцитоз и миелофиброз), лейкоз (например, острый миелоидный лейкоз и острый лимфобластический лейкоз),множественная миелома, псориаз, рестеноз, склеродермит или фиброз. В особенности данный термин относится к раку, лейкозу, множественной миеломе и псориазу. Используемый в настоящем описании термин "рак" относится к злокачественному или доброкачественному разрастанию клеток на коже или в органах тела, например, но без ограничения, груди, предстательной железы, легких, почке, поджелудочной железы, желудка или кишечника. Рак имеет тенденцию к проникновению в соседнюю ткань и распространению (метастазированию) в отдаленные органы,например кости, печень, легкие или мозг. Используемый в настоящем описании термин рак включает в себя как метастатические типы опухолевых клеток, такие как меланома, лимфома, лейкемия, фибросаркома, рабдомиосаркома и мастоцитома, и типы тканевой карциномы, такие как, но не ограниченные, колоректальным раком, раком предстательной железы, мелкоклеточным раком легких и немелкоклеточным раком легких, раком груди, раком поджелудочной железы, раком мочевого пузыря, раком почки, раком желудка, глиобластомой, первичным раком печени, раком яичника, раком предстательной железы и лейомиосаркомой матки. Используемый в настоящем описании термин "лейкоз" относится к неопластическим заболеваниям крови и кроветворных органов. Подобные заболевания могут привести к дисфункции костного мозга и иммунной системы, что сделает реципиента крайне восприимчивым к инфекции и кровотечению. В особенности термин лейкоз относится к острому миелоидному лейкозу (AML) и острому лимфобластическому лейкозу (ALL). Используемый в настоящем описании термин "отторжение трансплантата" относится к острому или хроническому отторжению алло- или ксенотрансплантатов, или клеток, ткани или солидных органов,например панкреатических островков, стволовых клеток, костного мозга, кожи, мышцы, корнеальной ткани, нейронной ткани, сердца, легких, объединенных сердца-легких, почки, печени, кишечника, поджелудочной железы, трахеи или пищевода, или заболеваний трансплантат против хозяина. Используемый в настоящем описании термин "заболевания, включающие в себя ухудшение обновления хрящевой ткани" включает в себя такие состояния, как остеоартрит, псориатический артрит, юношеский ревматоидный артрит, подагрический артрит, септический, или инфекционный артрит, реактивный артрит, рефлекторная симпатическая дистрофия, альгодистрофия, синдром Титце, или реберный хондрит, фибромиалгия, остеохондрит, нейрогенный, или нейропатический артрит, артропатия, эндемические формы артрита типа деформирующего эндемического остеоартроза, болезнь Мселени и болезнь Хандигоду; дегенерация, возникающая вследствие фибромиалгии, системной красной волчанки, склеродермии и анкилозирующего спондилоартрита. Используемый в настоящем описании термин "врожденный порок(и) хряща" включает в себя такие состояния, как наследственный хондролиз, хондродисплазия и псевдохондродисплазия, в частности, но без ограничения, микротию, анотию, метафизарную хондродисплазию и родственные нарушения. Используемый в настоящем описании термин "заболевание(я), связанные с гиперсекрецией IL6" включает в себя такие состояния, как болезнь Кастлмана, множественная миелома, псориаз, саркома Капоши и/или мезангиальный пролиферативный гломерулонефрит. Используемый в настоящем описании термин "JAK" относится к семейству янус-киназ (JAK), которые представляют собой цитоплазматические тирозинкиназы, передающие цитокиновый сигнал от мембранных рецепторов к факторам транскрипции STAT. Описаны четыре члена семейства JAK: JAK1,JAK2, JAK3 и TYK2, и термин JAK может относиться ко всем членам семейства JAK вместе или к одному или более членам семейства JAK, как указано в контексте. Подразумевается, что "соединение(я) изобретения" и эквивалентные выражения включают в себя соединение описанной в данном описании формулы, при этом данное выражение включает в себя фармацевтически приемлемые соли и сольваты, например гидраты и сольваты фармацевтически приемлемых солей, где это позволяет контекст. Аналогичным образом, подразумевается, что ссылка на промежуточные соединения, вне зависимости от того, заявлены ли они сами, включает в себя их соли и сольваты,где это позволяет контекст. Когда в настоящем описании ссылаются на интервалы, например, но без ограничения, C1-C8 алкил,цитирование интервала следует считать представлением каждого члена указанного интервала. Другие производные соединений данного изобретения обладают активностью как в форме своих кислот, так и формах производных кислот, но в форме кислотной чувствительной формы часто проявляют преимущества растворимости, совместимости с тканями или замедленного высвобождения в организме млекопитающего (смотрите Bundgard, H., Design of Prodrugs, p. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают в себя производные кислот, которые хорошо известны практикующим специалистам в данной области, например, такие как сложные эфиры, полученные реакцией исходной кислоты с подходящим спиртом, или амиды, полученные реакцией соединения исходной кислоты с замещенным или незамещенным амином, или ангидриды кислот, или смешанные ангидриды. Особенно полезными пролекарствами являются простые алифатические или ароматические сложные эфиры, амиды и ангидриды, полученные из кислотных групп, являющихся боковыми в соединениях данного изобретения. В некоторых случаях желательно получить пролекарства типа двойных сложных эфиров, такие как(ацилокси)алкиловые сложные эфиры или алкоксикарбонил)окси)алкиловые сложные эфиры. В частности, подобные пролекарства представляют собой C1-C8 алкил, С 2-С 8 алкенил, арил, C7-C12 замещенный арил и C7-C12 арилалкиловые сложные эфиры соединений данного изобретения. Используемый в настоящем описании термин "изотопный вариант" относится к соединению, содержащему искусственные процентные доли изотопов одного или более атомов, которые составляют подобное соединение. Например, "изотопный вариант" соединения может содержать один или более нерадиоактивных изотопов, например, таких как дейтерий (2 Н или D), углерода-13 (13 С), азота-15 (15N) или т.п. Будет понятно, что в соединении, в котором осуществлено подобное изотопное замещение, следующие атомы, в случае, когда они присутствуют, могут изменяться так, что, например, любой атом водорода может представлять собой 2H/D, любой атом углерода может представлять собой 13 С или любой атом азота может представлять собой 15N, и что наличие и расположение подобных атомов можно определить в пределах квалификации в данной области техники. Аналогичным образом, изобретение может включать в себя получение изотопных вариантов с радиоизотопами, например, в случае, когда полученные соединения могут быть использованы для исследований распределения лекарственного средства и/или субстрата в тканях. Для данной цели особенно полезны радиоактивные изотопы тритий, то есть 3 Н, и углерод-14, то есть 14 С, ввиду простоты их введения и простых способов определения. Кроме того, можно получить соединения, которые замещены изотопами, излучающими позитроны, такими как 11C, 18F,15O и 13N, и применимы в исследованиях методом позитрон-эмиссионной томографии (PET) для изучения занятости рецепторов субстрата. Подразумевается, что все изотопные варианты предоставленных в настоящем описании соединений, вне зависимости от того, являются ли они радиоактивными или нет, входят в объем данного изобретения. Стереоизомеры, которые не являются зеркальными отображениями друг друга, называются "диастереомерами", а стереоизомеры, являющиеся взаимно несовмещающимися зеркальными отображениями друг друга, называются "энантиомерами". Если в соединении имеется асимметрический центр, например он связан с четырьмя различными группами, возможно наличие пары энантиомеров. Энантиомер можно охарактеризовать абсолютной конфигурацией его асимметрического центра и описать при помощи правил R- и S-последовательности Канна и Прелога или характера вращения данной молекулой плоскости поляризованного света и обозначить ее как правовращающую или левовращающую (то есть как(+)- или (-)-изомеры соответственно). Хиральное соединение может существовать либо в виде индивидуального энантиомера, либо в виде их смеси. Смесь, содержащая равные количества энантиомеров, называют "рацемической смесью"."Таутомеры" относятся к соединениям, которые представляют собой взаимопревращающиеся формы структуры конкретного соединения и которые отличаются расположением атомов водорода и электронов. Так, в результате перемещения электронов и какого-либо атома (обычно Н) в равновесии могут находиться две структуры. Например, енолы и кетоны являются таутомерами, поскольку они быстро превращаются друг в друга при обработке их либо кислотой, либо основанием. Другим примером таутомерии являются аци- и нитро-формы фенилнитрометана, которые получаются аналогичным образом при обработке кислотой или основанием. Таутомерные формы могут иметь отношение к достижению оптимальной химической реакционноспособности и биологической активности рассматриваемого соединения. Соединение данного изобретения может содержать один или более асимметрических центров; поэтому подобные соединения можно получить в виде индивидуальных (R)- или (S)-стереоизомеров либо в виде их смесей. Если не указано иначе, подразумевается, что описание или название конкретного соединения в описании и формуле изобретения включает в себя индивидуальные энантиомеры и смеси, рацемические или другие. Методы определения стереохимической структуры и разделения стереоизомеров хорошо известны в данной области техники. Соединение. Настоящее изобретение основано на том факте, что ингибиторы JAK применимы для лечения воспалительных состояний, аутоиммунных заболеваний, пролиферативных заболеваний, отторжении трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков хрящевой ткани и заболеваний, связанных с гиперсекрецией IL6. Кроме того, в настоящем изобретении предоставлены способы получения данного соединения, фармацевтические композиции, содержащие данное соединение, и способы лечения заболеваний, включающих в себя разрушение хряща, разрушение костей и/или суставов, и/или воспаление, путем введения соединения данного изобретения. Настоящее соединение является ингибитором членов семейства JAK, конкретно, оно ингибирует активность JAK1, JAK2, JAK3 и TYK2. В частности, оно ингибирует активность JAK1. Соответственно в первом аспекте данного изобретения описано соединение изобретения, имеющее формулу I Соединение данного изобретения представляет собой 5-[4-(3,3-диметилазетидин-1 карбонил)фенил]-[1,2,4]триазол[1,5-а]пиридин-2-иламид циклопропанкарбоновой кислоты. В одном из вариантов осуществления соединение данного изобретения не является изотопным вариантом. В одном из аспектов соединение данного изобретения находится в форме свободного основания. В одном из аспектов соединение данного изобретения представляет собой фармацевтически приемлемую соль. В одном из аспектов соединение данного изобретения представляет собой сольват данного соединения. В одном из аспектов соединение данного изобретения представляет собой сольват фармацевтически приемлемой соли данного соединения. В некоторых аспектах в настоящем изобретении предоставлены пролекарства и производные соединения согласно приведенной выше формуле. Пролекарства представляют собой производные соединений данного изобретения, которые содержат метаболически отщепляемые группы, и в результате сольволиза или в физиологических условиях превращаются в соединения данного изобретения, которые фармацевтически активны in vivo. Подобные примеры включают в себя, но не ограничиваются сложноэфирными производными холина, сложными эфирами N-алкилморфолина и т.д. Другие производные соединения данного изобретения обладают активностью как в форме их кислот, так и производных кислот, но форма быстро реагирующей кислоты часто проявляет преимущества в отношении растворимости, совместимости с тканями или замедленного высвобождения в организме млекопитающего (см. Bundgard, H., Design of Prodrugs, p. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают в себя производные кислот, которые хорошо известны специалистам, практикующим в данной области, например, такие как сложные эфиры, полученные реакцией исходной кислоты с подходящим спиртом, или амиды, полученные реакцией соединения исходной кислоты с замещенным или незамещенным амином, или ангидриды кислот, или смешанные ангидриды. Предпочтительными пролекарствами являются простые алифатические или ароматические сложные эфиры, амиды и ангидриды,полученные из кислотных групп, являющихся боковыми в соединениях данного изобретения. В некоторых случаях желательно получить пролекарства типа двойных сложных эфиров, такие как (ацилокси)алкиловые сложные эфиры или алкоксикарбонил)окси)алкиловые сложные эфиры. В особенности полезны C1 до С 8 алкил, С 2-С 8 алкенил, арил, C7-C12 замещенный арил и С 7-С 12 арилалкиловые сложные эфиры соединений данного изобретения. Фармацевтические композиции. При использовании в качестве фармацевтического средства соединение данного изобретения обычно вводят в виде фармацевтической композиции. Подобные композиции можно получить способом, который хорошо известен в области фармацевтики и содержит по меньшей мере одно активное соединение. Как правило, соединение данного изобретения вводят в фармацевтически эффективном количестве. Реально вводимое количество соединения обычно будет определяться врачом, принимая во внимание относящиеся к делу обстоятельства, включая подлежащее лечению состояние, выбранный способ введения, реальное вводимое соединение, возраст, вес и реакцию индивидуального пациента, тяжесть симптомов пациента и т.д. Фармацевтические композиции данного изобретения можно вводить рядом способов, включая пероральный, ректальный, чрескожный, подкожный, внутрисуставной, внутривенный, внутримышечный и интраназальный. В зависимости от предназначенного способа доставки из соединения данного изобретения предпочтительно составляют препарат либо в виде инъекции, либо пероральных композиций, либо в виде мазей, в виде лосьонов, либо в виде пластырей, все из которых предназначены для чрескожного введения. Композиции для перорального введения могут принимать форму нефасованных жидких растворов или суспензий ,или нефасованных порошков. Однако более общепринятым является предоставление композиций в виде разовых дозированных форм для облегчения точной дозировки. Термин "разовая дозированная форма" относится к физически дискретным единицам, которые подходят в качестве единичных доз для субъектов, являющихся людьми, и других млекопитающих, при этом каждая единица содержит заранее определенное количество активного вещества, рассчитанное для оказания требуемого терапевтического эффекта, в сочетании с подходящим фармацевтическим эксципиентом, разбавителем или носителем. Типичные разовые дозированные формы включают в себя предварительно заполненные,предварительно отмеренные ампулы или шприцы с жидкими композициями, или пилюли, таблетки, капсулы или т.п. в случае твердых композиций. В подобных композициях соединение данного изобретения обычно является минорным компонентом (от около 0,1 до около 50 мас.% или предпочтительно от около 1 до около 40 мас.%), при этом остаток представляет собой различные разбавители или носители или технологические вспомогательные вещества, полезные для получения требуемой дозированной формы. Жидкие формы, подходящие для перорального введения, могут включать в себя подходящий водный или неводный разбавитель с буферными веществами, суспендирующими и диспергирующими агентами, красителями, вкусовыми веществами и т.д. Твердые формы могут включать в себя, например, любой из следующих ингредиентов или соединений, имеющих аналогичную природу: связывающее вещество, такое как микрокристаллическая целлюлоза, трагакантовая смола или желатин, эксципиент, такой как крахмал или лактоза, разрыхляющий агент, такой как альгиновая кислота, примогель или кукурузный крахмал, смазывающее вещество, такое как стеарат магния, глидант, такой как коллоидная двуокись кремния, подслащивающее вещество, такое как сахароза или сахарин, или вкусовой агент, такой как перечная мята, метилсалицилат или апельсиновое вкусовое вещество. Основу композиций для инъекций обычно составляет инъецируемый стерильный физиологический раствор, или физиологический раствор с фосфатным буфером, или другие инъецируемые носители, известные в данной области. Как и раньше, активное соединение в подобных композициях обычно представляет собой минорный компонент, часто составляющий от около 0,05 до 10 мас.%, при этом остаток является инъецируемым носителем и т.д. Чрескожные композиции обычно составляют в виде местной мази или крема, содержащего активный ингредиент(ы), обычно в количестве, изменяющемся в интервале от около 0,01 до около 20 мас.%,предпочтительно от около 0,1 до около 20 мас.%, предпочтительно от около 0,1 до около 10 мас.% и более предпочтительно от около 0,5 до около 15 мас.%. При составлении препарата в виде мази активные ингредиенты будут обычно соединены либо с парафиновой, либо несмешивающейся с водой основой мази. Альтернативным образом, из активных ингредиентов можно составить препарат в виде крема, например с кремовой основой масло-в-воде. Такие чрескожные препараты хорошо известны в данной области и, как правило, содержат дополнительные ингредиенты для повышения кожного проникновения или устойчивости активных ингредиентов препарата. Все подобные известные чрескожные препараты и ингредиенты включены в объем данного изобретения. Соединение данного изобретения можно также вводить путем чрескожного приспособления. Соответственно чрескожное введение можно осуществить с использованием пластыря либо типа резервуара,либо пористой мембраны, или ряда твердых матриц. Описанные выше компоненты для вводимых перорально, путем инъекций или вводимых местно композиций являются лишь репрезентативными. Другие вещества, а также методики обработки и т.п. изложены в 8 части Remington's Pharmaceutical Sciences, 17th edition, 1985, Mack Publishing Company,Easton, Pennsylvania, которая включена в настоящее описание в виде ссылки. Соединение данного изобретения можно также вводить в виде форм замедленного высвобождения или систем доставки лекарственных препаратов с замедленным высвобождением. Описание репрезентативных веществ для замедленного высвобождения можно найти в Remington's Pharmaceutical Sciences. Следующие примеры препаратов иллюстрируют репрезентативные фармацевтические композиции,которые можно получить согласно данному изобретению. Однако настоящее изобретение не ограничено следующими фармацевтическими композициями. Препарат 1. Таблетки. Соединение данного изобретения можно смешивать в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества можно добавить минорное количество стеарата магния. Из данной смеси можно сформовать таблетки по 240-270 мг (80-90 мг активного амидного соединения на таблетку) при помощи таблеточного пресса. Препарат 2. Капсулы. Соединение данного изобретения можно смешивать в виде сухого порошка с разбавителем из крахмала в массовом соотношении приблизительно 1:1. Данной смесью можно заполнить капсулы по 250 мг (125 мг активного амидного соединения на капсулу). Препарат 3. Жидкость. Соединение данного изобретения (125 мг) можно смешать с сахарозой (1,75 г) и ксантановой смолой (4 мг) и полученную смесь можно перемешать, пропустить через сито 10 меш США, а затем смешать с предварительно приготовленным раствором микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия (11:89, 50 мг) в воде. Бензоат натрия (10 мг), вкусовое вещество и краситель можно разбавить водой и прибавить при перемешивании. После этого при перемешивании можно добавить достаточное количество воды. Затем можно добавить достаточное количество воды для получения общего объема 5 мл. Препарат 4. Таблетки. Соединение данного изобретения можно смешивать в виде сухого порошка со связывающим веществом из сухого желатина в массовом соотношении приблизительно 1:2. В качестве смазывающего вещества можно добавить минорное количество стеарата магния. Данную смесь формуют в таблетки по 450900 мг (150-300 мг активного амидного соединения) при помощи таблеточного пресса. Препарат 5. Инъекция. Соединение данного изобретения можно растворить или суспендировать в забуференной стерильной солевой водной среде для инъекций в концентрации приблизительно 5 мг/мл. Препарат 6. Местно. Стеариловый спирт (250 г) и белый петролатум (250 г) можно расплавить примерно при 75 С, а затем можно прибавить смесь соединения данного изобретения (50 г), метилпарабен (0,25 г), пропилпарабен (0,15 г), лаурилсульфат натрия (10 г) и пропиленгликоль (120 г), растворенные в воде (около 370 г), и можно перемешивать полученную смесь, пока она не затвердеет. Способы лечения. Соединение данного изобретения можно использовать в качестве терапевтического агента для лечения состояний у млекопитающих, которые причинно связаны, или относятся к аберрантной активностиJAK. В частности, состояния относятся к аберрантной активности JAK1. Соответственно соединение и фармацевтические композиции данного изобретения находят применение в качестве терапевтических средств для предупреждения и/или лечения воспалительных состояний, аутоиммунных заболеваний,пролиферативных заболеваний, отторжений трансплантата, заболеваний, включающих в себя ухудшение обновления хрящевой ткани, врожденных пороков хрящевой ткани и заболеваний, связанных с гиперсекрецией IL6, у млекопитающих, включая людей. В дополнительных аспектах способа лечения в данном изобретении предоставлены способы лечения млекопитающего, восприимчивого или пораженного воспалительным состоянием. Данный способ включает в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В конкретном варианте осуществления воспалительное состояние выбирают из ревматоидного артрита, остеоартрита, аллергического заболевания дыхательных путей (например, астмы) и воспалительных заболеваний кишечника. В следующем аспекте в настоящем изобретении предоставлено соединение данного изобретения,предназначенное для лечения, предупреждения или профилактики воспалительного состояния. В конкретном варианте осуществления воспалительное состояние выбирают из ревматоидного артрита, остеоартрита, аллергического заболевания дыхательных путей (например, астмы) и воспалительных заболеваний кишечника. В дополнительных аспектах способа лечения в данном изобретении предоставлены способы лечения млекопитающего, восприимчивого или пораженного аутоиммунным заболеванием. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В конкретном способе осуществления аутоиммунное заболевание выбирают из COPD, астмы, сис- 10020111 темной красной волчанки, сахарного диабета I типа и воспалительного заболевания кишечника. В следующем аспекте в настоящем изобретении предоставлено соединение данного изобретения,предназначенное для лечения, предупреждения или профилактики аутоиммунного заболевания. В конкретном способе осуществления аутоиммунное заболевание выбирают из COPD, астмы, системной красной волчанки, сахарного диабета I типа и воспалительного заболевания кишечника. В следующих аспектах способа лечения в данном изобретении предоставлены способы лечения млекопитающего, восприимчивого или пораженного пролиферативным заболеванием, в частности раком(например, солидными опухолями, такими как лейомиосаркома матки или рак предстательной железы),лейкозом (например, AML или ALL), множественной миеломой и/или псориазом. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В следующем аспекте в настоящем изобретении предоставлено соединение данного изобретения,предназначенное для лечения, предупреждения или профилактики пролиферативного заболевания, в частности рака (например, солидных опухолей, таких как лейомиосаркома матки или рак предстательной железы), лейкоза (например, AML или ALL), множественной миеломы и/или псориаза. В следующих аспектах способа лечения в данном изобретении предоставлены способы лечения млекопитающего, восприимчивого или пораженного отторжением трансплантата. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В конкретном варианте осуществления в данном изобретении предоставлены способы лечения отторжения трансплантата органа. В аспекте способа лечения в данном изобретении предоставлен способ лечения, предупреждения или профилактики млекопитающего, восприимчивого или пораженного заболеванием, включающим в себя ухудшение обновления хрящевой ткани. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В другом аспекте в данном изобретении предоставлено соединение данного изобретения, предназначенное для лечения, предупреждения или профилактики заболеваний, включающих в себя ухудшение обновления хрящевой ткани. Кроме того, в настоящем изобретении предоставлен способ лечения врожденных пороков развития хрящевой ткани. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В другом аспекте в данном изобретении предоставлено соединение данного изобретения, предназначенное для лечения, предупреждения или профилактики врожденных пороков развития хрящевой ткани. В следующем аспекте способов лечения в данном изобретении предоставлены способы лечения млекопитающего, восприимчивого или пораженного заболеваниями, связанными с гиперсекрецией IL6, в частности болезнью Кастлмана или мезангиальным пролиферативным гломерулонефритом. Данные способы включают в себя введение эффективного для лечения состояния или предупреждения состояния количества одной или более описанных здесь фармацевтических композиций или соединений данного изобретения. В следующем аспекте в данном изобретении предоставлено соединение данного изобретения, предназначенное для лечения, предупреждения или профилактики заболеваний, связанных с гиперсекрециейIL6, в частности болезни Кастлмана или мезангиального пролиферативного гломерулонефрита. В качестве следующего аспекта изобретения предоставлено соединение данного изобретения для использования в качестве фармацевтического средства, в особенности при лечении или предупреждении вышеупомянутых состояний и заболеваний. Кроме того, в настоящем описании предоставлено использование соединения для получения лекарственного средства для лечения или предупреждения одного из упомянутых выше состояний и заболеваний. Особый режим настоящего способа включает в себя введение субъекту, страдающему воспалительным состоянием, эффективного количества соединения данного изобретения в течение периода времени,достаточного для снижения степени воспаления у субъекта и предпочтительно прекращения процессов,ответственных за указанное воспаление. Особый вариант осуществления данного способа включает в себя введение эффективного количества соединения данного изобретения рассматриваемому пациенту,страдающему или восприимчивому к развитию ревматоидного артрита, в течение периода времени, которого достаточно соответственно для снижения или предупреждения воспаления в суставах указанного пациента, а предпочтительно для прекращения процессов, ответственных за указанное воспаление. Следующий особый режим настоящего способа включает в себя введение субъекту, страдающему заболеваниями, включающими в себя ухудшение обновления хрящевой ткани (например, остеоартрит),эффективного количества соединения данного изобретения в течение периода времени, достаточного для снижения, а предпочтительно прекращения самоподдерживающихся процессов, ответственных за указанное разрушение. Конкретный вариант осуществления данного способа включает в себя введение эффективного количества соединения данного изобретения субъекту пациенту, страдающему или восприимчивому к развитию остеоартрита, в течение периода времени, которого достаточно соответственно для снижения или предупреждения разрушения суставов указанного пациента, а предпочтительно для прекращения самоподдерживающихся процессов, ответственных за указанное разрушение. В конкретном варианте осуществления указанное соединение может проявлять анаболические и/или антианаболические свойства в отношении хрящевой ткани. Концентрация дозы для инъекции изменяется в интервале от около 0,1 по меньшей мере до 10 мг/кг/ч, значительно в пользу интервала от около 1 до около 120 ч и особенно от 24 до 96 ч. Для достижения соответствующих концентраций стационарного состояния можно также вводить предварительно наполненный болюс, содержащий от около 0,1 до около 10 мг/кг или более. Ожидается, что максимальная общая доза не превысит примерно 2 г/день для пациентов массой от 40 до 80 кг, являющихся людьми. Для предупреждения и/или лечения продолжительных состояний, таких как дегенеративные состояния, режим лечения обычно продолжается в течение многих месяцев или лет, так что в целях удобства и переносимости пациента предпочтительной является пероральная доза. В случае перорального дозирования репрезентативными режимами являются от одной до пяти, а в особенности от двух до четырех, и обычно три пероральные дозы в день. При использовании данных схем дозирования каждая доза предоставляет от около 0,01 до около 20 мг/кг соединения данного изобретения, при этом каждая из конкретных доз предоставляет от около 0,1 до около 10 мг/кг, а в особенности от около 1 до около 5 мг/кг. Чрескожные дозы обычно выбирают для получения похожей или более низкой концентрации в крови, чем концентрации, которые достигаются при использовании инъецируемых доз. В случае использования для предупреждения начала воспалительного состояния соединение данного изобретения будут вводить пациенту, имеющему риск развития данного состояния, обычно по совету и под наблюдением врача в описанных выше концентрациях дозировок. Как правило, в число пациентов,имеющих риск развития конкретного состояния, входят пациенты, в семейном анамнезе которых имеется данное состояние, или пациенты, для которых по данным генетического тестирования или скрининга была установлена особая восприимчивость к развитию данного состояния. Соединение данного изобретения можно вводить в виде единственного активного агента или его можно вводить в сочетании с другими терапевтическими агентами, включая другие соединения, которые проявляют аналогичную или похожую терапевтическую активность и для которых установлена безопасность и эффективность в случае подобного комбинированного введения. В конкретном варианте осуществления совместное введении двух (или более) агентов допускает использование значительно более малых доз каждого из них, что снижает, таким образом, наблюдаемые подобные эффекты. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения воспалительного состояния; конкретные агенты включают в себя, но не ограничиваются иммунорегуляторными агентами, например азатиоприном, кортикостероидами (например, преднизолоном, или дексаметазоном), циклофосфамидом, циклоспорином А, такролимусом, микофенолятмофетилом, муромонабом-СБ 3 (ОКТ 3, например,Orthocolone), ATG, аспирином, ацетаминопрофеном, ибупрофеном, напроксеном и пироксикамом. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения артрита (например, ревматоидного артрита); конкретные агенты включают в себя, но не ограничиваются анальгетиками, нестероидными противовоспалительными лекарственными средствами (NSAIDS), стероидами, синтетическими DMARDS (например, но без ограничения, метотрексатом, лефлуномидом, сульфазалазином, ауранофином, ауротиомалатом натрия, пеницилламином, хлоррохином, гилроксихлорохином, азатиоприном и циклоспорином) и биологическими DMARDS (например, но без ограничения, инфликсимабом, этанерсептом, адалиммабом,ритуксимабом и абатасептом). В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения пролиферативных нарушений; конкретные агенты включают в себя, но не ограничиваются метотрексатом, лейковорином, адриамицином, пренизоном, блеомицином, циклофосфамидом, 5-фторурацилом, паклитакселом, доцетакселем, винкристином,винбластином, винорельбином, доксорубицином, тамоксифеном, торемифеном, мегестролацетатом, анастрозолом, госерелином, анти-HER2 моноклональным антителом (например, Herceptin), капецитабином, гидрохлоридом рабоксифена, ингибиторами EGFR (например, Iressa, Tarceva, Erbitux), ингибиторами VEGF (например, Avastin), ингибиторами протеасом (например, Velcade), Glivec и ингибиторами hsp90 (например, 17-AAG). Кроме того, соединение данного изобретения вводят совместно с другими терапевтическими средствами, включающими в себя, но не ограниченными, лучевую терапию или хирургию. В конкретном варианте осуществления пролиферативное нарушение выбирают из рака,миелопролиферативного заболевания или лейкоза. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения аутоиммунных заболеваний; конкретные агенты включают в себя, но не ограничиваются глюкокортикоидами, цитостатическими агентами (например, аналогами пурина), алкилирующими агентами (например, азотистыми ипритами (циклофосфамид), нитрозомочевинами, соединениями платины и другими), антиметаболитами (например, метотрексатом, азатиоприном и меркаптопурином), цитотоксическими антибиотиками (например, дактиномицином, антрациклинами, митомицином С, блеомицином и митрамицином), антителами (например, антиCD20, анти-CD25, или анти-CD3 (OTK3) моноклональными антителами, Atgam и Thymoglobuline),циклоспорином, такролимусом, рапамицином (сиролимусом), интерферонами (например, IFN-), TNFсвязывающими белками (например, инфликсимабом (Remicade), этанерсептом (Enbrel) или адалимумабом (Himura, микофенолятом, финголимодом и мириоцином. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения отторжения трансплантата; конкретные агенты включают в себя, но не ограничиваются ингибиторами кальцинеурина (например, циклоспорином или такролимусом (FK506, ингибиторами mTOR (например, сиролимусом, эверолимусом), антипролиферативными кортикостероидами (например, преднизолоном, гидрокортизоном), антителами (например,моноклональными антителами к анти-IL-2R рецептору, базиликсимабом, даклизумабом), поликлональными анти-Т-клеточными антителами (например, анти-тимоцитарным глобулином (ATG), антилимфоцитарным глобулином (ALG. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения астмы и/или ринита и/или COPD; конкретные агенты включают в себя, но не ограничиваются: агонистами 2-адренорецепторов (например, салбутамолом, левалбутеролом, тербуталином и битолтеролом), эпинефрином (в виде ингаляции или таблеток), антихолинергическими средствами (например, ипратропиумбромидом), глюкокортикоидами (пероральными или вводимыми путем ингаляциями), 2-антагонистами длительного действия (например, салметеролом, формотеролом, бамбутеролом и пероральным альбутеролом замедленного высвобождения),сочетанием вводимых путем ингаляции стероидов и бронходилататорами длительного действия (например, флутиказоном/салметеролом, бутезонидом/формотеролом), антагонистами и ингибиторами синтеза лейкотриена (например, монтелукастом, зафирлукастом и зилейтоном), ингибиторами высвобождения медиаторов (например, кромогликатом и кетонифеном), биологическими регуляторами отклика IgE (например, омализумабом), антигистаминными препаратами (например, цетеризином, циннаризином, фексофенадином) и вазоконстрикторами (например, оксиметазолином, ксилометазолином, нафазолином и трамазолином). Кроме того, соединение данного изобретения можно вводить в сочетании с неотложными терапевтическими средствами в случае астмы и/или COPD, при этом подобные виды терапии включают в себя введение кислорода или кислородно-гелиевой смеси, распыленный сальбутамол или тербуталин (необязательно в сочетании с антихолинергическими препаратами (например, ипратропием, системные стероиды (пероральные, или внутривенные, например преднизон, преднизолон, метилпреднизолон, дексаметазон или гидрокортизон), внутривенный сальбутамол, непрецифические -агонисты, вводимые путем инъекции или ингаляции (например, эпинефрин, изоэтарин, изопротеренол, метапротеренол), антихолинергические средства (внутривенно или распыленные, например гликопирролат, атропин, ипратропий),метилксантины (теофиллин, аминофиллин, бамифиллин), ингаляционные анестетики, обладающие бронходилатирующим эффектов (например, изофлуран, галотан, энфлуран), кетамин и внутривенный сульфат магния. В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения воспалительной болезни кишечника (IBD); конкретные агенты включают в себя, но не ограничиваются глюкокортикоидами (например, преднизоном, будезонидом), синтетическими модифицирующими заболевание иммуномодулирующими агентами(например, метотрексатом, лефлуномидом, сульфазалазином, мезалазином, азатиоприном, 6 меркаптопурином и циклоспорином) и биологическими модифицирующими заболевание иммуномодулирующими агентами (например, адалимумабом, ритуксимабом и абатасептом). В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтически агентом для лечения и/или предупреждения системной красной волчанки; конкретные агенты включают в себя, но не ограничиваются модифицирующими заболевание противоревматическими лекарственными средствами (DMARD), такими как антималярийные препараты (например, плаквенил, гидроксихлорохин), иммунодепрессантами (например, метотрексат и азатиоприн), циклофосфамидом и микофеноловой кислотой; иммуносуппрессивными лекарственными средствами и анальгетиками,такими как нестероидные противовоспалительные лекарственными препаратами, опиаты (например,декстропропоксифен и ко-кодамол), опиоиды (например, гидрокодон, оксикодон, MS Contin или метадон) и содержащим фентанил чрескожным пластырем "Дюрогезик". В одном из вариантов осуществления соединение данного изобретения вводят совместно с другим терапевтическим агентом для лечения и/или предупреждения псориаза; конкретные агенты включают в себя, но не ограничиваются местными видами лечения, такими как растворы для погружения, увлажняющие кремы, лечебные кремы и мази, содержащие каменноугольный деготь, дитранол (антралин),кортикостероиды типа дезоксиметазона (Topicort), флуоцинонид, аналоги витамина D3 (например,кальципотриол), ретиноиды арганового масла (этретинат, ацитретин, тазаротен), системные курсы лечения, такие как метотрексат, циклоспорин, ретиноиды, тиогуанин, гидроксимочевина, сульфалазин, микофенолятмофетил, азатиоприн, такролимус, эфиры фумаровой кислоты или биопрепараты, такие какAmetive, Huraira, Remicade, Raptiva и устекинумаб (блокатор IL-12 и IL-23). Кроме того, соединение данного изобретения можно вводить в сочетании с другими видами терапии, включающими в себя, но не ограниченными фототерапией или фотохимиотерапией (например, псорален и фототерапия ультрафиолетовыми лучами диапазона А (PUVA. В совместное введение входят любые способы доставки пациенту двух или более терапевтических агентов как части одного и того же режима лечения, как будет очевидно специалисту в данной области. Несмотря на то что два или более агентов можно вводить одновременно в виде одного препарата, это не существенно. Данные агенты можно вводить в составе различных препаратов и в разное время. Общие методики синтеза Общее. Соединение данного изобретения можно получить из легко доступных исходных веществ с использованием следующих общих способов и методик. Понятно, что в случае, когда приведены типичные или предпочтительные условия способа (например, температура реакции, продолжительность, молярные соотношения реагентов, растворители, давление т.д.), можно также использовать другие условия способа,если не установлено иначе. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов или растворителя, но специалист в данной области может определить такие условия путем стандартных способов оптимизации. Кроме того, для специалистов в данной области будет очевидно, что могут потребоваться стандартные защитные группы, чтобы предотвратить протекание нежелательных реакций с участием некоторых функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы,а также подходящих условий для защиты и снятия защиты хорошо известен в данной области. Например,многочисленные защитные группы и их введение и удаление описаны у T.W. Green and P.G.M. Wuts,Protective Groups in Organic Synthesis, Wiley, New York, 1991 и в приведенных там ссылках. Следующие способы представлены подробно в отношении получения репрезентативных бициклогетероарилов, которые были перечислены в настоящем описании ранее. Специалист в области органического синтеза может получить соединение данного изобретения из известных или коммерчески доступных исходных веществ и реагентов. Все реагенты были технического качества и использовались без дополнительной очистки, если не установлено иначе. В реакциях, проводимых в атмосфере инертного газа, использовали коммерчески доступные безводные растворители. Во всех остальных случаях использовали растворители, чистые для анализа, если не указано иначе. Колоночную хроматографию осуществляли на силикагеле 60 (35-70 мкм). Тонкослойную хроматографию проводили на пластинах с предварительно нанесенным силикагелем F-254 (толщина 0,25 мм). Спектры 1 Н-ЯМР регистрировали на спектрометре Bruker DPX 400 (400 МГц). Химические сдвигив спектрах 1 Н-ЯМР приведены в миллионных долях (м.д.) относительно тетраметилсилана ( 0,00) или пика остаточного протона соответствующего растворителя, то есть CHCl3( 7,27) в качестве внутреннего стандарта. Мультиплетность приведена в виде синглета (с), дублета (д),триплета (т), квадруплета (кв), мультиплета (м) и уширенного сигнала (уш). Константы спин-спинового взаимодействия (J) приведены в Гц. Масс-спектры с электроспреевой ионизацией регистрировали на спектрометре Micromass platform LC/MS. Колонка, используемая для всех анализов методом ВЭЖХ: Waters Acquity UPLC ВЕН С 18 1,7 мкм, 2,1 мм ID50 мм L ( партии 186002350). Препаративная ВЭЖХ: Waters XBridge Prep C18 5 мкм ODB 19 мм ID100 мм L ( партии 186002978). Все методы проводили с использованием градиентов MeCN/H2O. В Н 2 О содержалась либо 0,1% ТФА, либо 0,1% NH3. Следующее представляет собой список сокращений, используемых в экспериментальной части: Синтез соединения изобретения Соединение согласно данному изобретению можно получить согласно следующей схеме. Общий способ синтеза. Схема в которой Ar представляет собой фенил-L1-гетероциклоалкил, L1 является -СО- и гетероциклоалкильная группа необязательно замещена. Общее. 1.1.1. 1-(6-Бромпиридин-2-ил)-3-карбэтокситиомочевина (2) К раствору 2-амино-6-бромпиридина (1) (253,8 г, 1,467 моль) в DCM (2,5 л), охлажденного до 5 С,прибавляют по каплям этоксикарбонилизотиоцианат (173,0 мл, 1,467 моль) в течение 15 мин. Затем реакционную смесь оставляют нагреваться до комнатной температуры (20 С) и перемешивают в течение 16 ч. В результате упаривания в вакууме получают твердое вещество, которое можно выделить фильтрованием, тщательно промывают петролейным эфиром (3600 мл) и сушат на воздухе, получая (2). Данную тиомочевину можно использовать на следующей стадии как таковую без какой-либо очистки. 1H (400 МГц, CDCl3)12,03 (1 Н, уш.с, NH), 8,81 (1 Н, д, J=7,8 Гц, Н-3), 8,15 (1 Н, уш.с, NH), 7,60 (1 Н, т, J=8,0 Гц,Н-4), 7,32 (1 Н, дд, J=7,7 и 0,6 Гц, Н-5), 4,31 (2 Н, кв, J=7,1 Гц, СН 2), 1,35 (3 Н, т, J=7,1 Гц, СН 3). 1.1.2. 5-Бром-[1,2,4]триазол[1,5-а]пиридин-2-иламин (3) К суспензии гидрохлорида гидроксиламина (101,8 г, 1,465 моль) в смеси EtOH/MeOH (1:1, 900 мл) прибавляют N,N-диизопропилэтиламин (145,3 мл, 0,879 моль) и перемешивают смесь при комнатной температуре (20 С) в течение 1 ч. После этого прибавляют 1-(6-бромпиридин-2-ил)-3 карбэтокситиомочевину (2) (89,0 г, 0,293 моль) и смесь медленно нагревают до кипения с обратным холодильником (примечание: для гашения выделяющегося H2S необходима поглотительная трубка с хлорной известью). После 3 ч при кипении с обратным холодильником смесь оставляют охлаждаться и фильтруют, выделяя выпавший осадок. Дополнительное количество продукта выделяют в результате упаривания фильтрата в вакууме, добавления Н 2 О (250 мл) и фильтрования. Объединенные осадки последовательно промывают H2O (250 мл), EtOH/MeOH (1:1, 250 мл) и Et2O (250 мл), затем сушат в вакууме, получая производное триазолпиридина (3) в виде твердого вещества. Данное соединение можно использовать на следующей стадии как таковое без какой-либо очистки. 1 Н (400 МГц, ДМСО-d6)7,43-7,34 (2 Н, м, 2 ароматический Н), 7,24 К раствору 2-аминотриазолпиридина (3) (7,10 г, 33,3 ммоль) в сухом CH3CN (150 мл) при 5 С добавляют Et3N (11,6 мл, 83,3 ммоль), после чего добавляют циклопропанкарбонилхлорид (83,3 ммоль). Затем реакционную смесь оставляют нагреваться до температуры окружающей среды и перемешивают до тех пор, пока не израсходуется все исходное вещество (3). При необходимости, для гарантии полного протекания реакции добавляют еще Et3N (4,64 мл, 33,3 ммоль) и циклопропанкарбонилхлорид (33,3 ммоль). После выпаривания растворителя в вакууме полученный остаток обрабатывают 7 н. раствором аммиака в метаноле (50 мл) и перемешивают при температуре окружающей среды (в течение 1-16 ч) для гидролиза какого-либо продукта бис-ацилирования. Выделение продукта проводят, удаляя летучие ве- 16020111 щества в вакууме с последующим растиранием в Et2O (50 мл). Осадки выделяют фильтрованием, промывают Н 2 О (250 мл), ацетоном (50 мл) и Et2O (50 мл), затем сушат в вакууме, получая требуемое бромпромежуточное соединение (4). Методика синтеза для получения соединения данного изобретения. Соединение 1. Стадия 1. Сочетание по СузукиPdCl2dppf (5%). После этого полученную смесь нагревали традиционным нагреванием на масляной бане при 90 С в течение 16 ч. Добавляли 1 М раствор HCl, и в кислом растворе образовывался осадок. Данный осадок отфильтровывали, сушили в вакууме, получая указанное в заголовке соединение, которое использовали на следующей стадии без дополнительной очистки. Стадия 2. 5-[4-(3,3-Диметилазетидин-1-карбонил)фенил]-[1,2,4]триазол[1,5-а]пиридин-2-иламид циклопропанкарбоновой кислоты (соединение 1) К раствору 4-[2-(циклопропанкарбониламино)-[1,2,4]триазол[1,5-а]пиридин-5-ил]бензойной кислоты (4 г, 0,012 моль) в DCM (150 мл) добавляли EDCI (3,59 г, 0,019 моль), HOBt (2,53 г, 0,019 моль) и DIPEA (4,48 мл) при комнатной температуре. Полученную смесь перемешивали в течение 10 мин при комнатной температуре. К раствору добавляли гидрохлоридную соль диметилазетидина (1,64 г, 0,013 моль) и перемешивали смесь в течение 16 ч. К реакционной смеси добавляли воду. Органический слой отделяли и промывали 2 н. раствором NaOH, 2 н. раствором HCl и водой. Органическую фазу сушили надMgSO4, фильтровали и упаривали в вакууме. В результате очистки методом флэш-хроматографии (элюент: от смеси 1:1 петролейный эфир/EtOAc до чистого EtOAc) получали 5-[4-(3,3-диметилазетидин-1 карбонил)фенил]-[1,2,4]триазол[1,5-а]пиридин-2-иламид циклопропанкарбоновой кислоты. Соединение данного изобретения, которое было получено или которое можно получить согласно описанному здесь способу синтеза, приведено ниже в табл. I. Спектральные данные ЯМР соединения изобретения представлены в табл. II. Таблица I Данные масс-спектрометрии соединения изобретения Таблица II Данные ЯМР соединения изобретения Биологические примеры. Пример 1. Анализ in vitro. Пример 1.1. Анализ ингибироваиия JAK1. Рекомбинантную JAK1 человека (каталитический домен, аминокислоты 866-1154; номер по каталогу PV4774) получали от Invitrogen. Инкубировали 1 нг JAK1 с 20 нМ белка Ulight-JAK1(tyr1023) (номер по каталогу Perkin Elmer TRF0121) в киназном реакционном буфере (25 мМ MOPS pH 6,8, 0,016% Brij35, 8,33 мМ MgCl2, 3,33 мМ DTT, 7 мкМ АТФ) в присутствии или в отсутствие 4 мкл, содержащих тестируемое соединение или разбавитель (ДМСО, 1% конечная концентрация) в общем объеме 20 мкл на белом планшете 384 Luminotrac (Greiner, номер по каталогу 781075). Через 60 мин при комнатной температуре реакции останавливали добавлением 20 мкл/лунку детекторной смеси (1 детекторный буфер(Perkin Elmer, номер по каталогу CR97-100C), 0,5 нМ европий-анти-фосфотирозина (РТ 66) (Perkin Elmer,номер по каталогу AD0068), 10 мМ ЭДТА). Считывание осуществляли с использованием Envision при возбуждении при 320 нм и определяя излучение при 615 нм (Perkin Elmer). Киназную активность рассчитывали, вычитая относительные единицы флуоресценции (RFU), полученные в присутствии положительного контрольного ингибитора (10 мкМ стауроспорин) из RFU, полученных в присутствии разбавителя. Способность тестируемого соединения ингибировать данную активность определяли как процент ингибирования=RFU, определенные для образца в присутствии тестируемого соединения- RFU, определенные для образца с положительным контрольным ингибитором), деленное на (RFU, определенные в присутствии разбавителя - RFU, определенные для образца с положительным контрольным ингибитором 100. Получали серийные разбавления дозы для соединений, что позволяет тестировать влияние дозаотклик в анализе JAK1 и вычислить IC50 для данного соединения. Каждое соединение тестировали стандартным образом при концентрации 20 мкМ с последующим серийным разбавлением 1/5, 8 точек (20 мкМ-4 мкМ-800 нМ-160 нМ-32 нМ-6,4 нМ-1,28 нМ-0,26 нМ) при конечной концентрации 1% ДМСО. При повышении эффективности серий соединения готовят дополнительные разбавления и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Данные представлены в виде средней IC50 из анализовсредняя квадратическая ошибка среднего значения. Таблица III Значения IC50 соединения для JAK1 Пример 1.2. Анализ на определение Ki JAK1. Для определения Ki с ферментом смешивали различные количества ингибитора и следили за ферментной реакцией как функцией концентрации АТФ. Ki определяли при помощи двойного взаимного графического отображения Km относительно концентрации соединения (график Lineweaver-Burk). JAK1(Invitrogen, PV4774) использовали при конечной концентрации 500 нг/мл. Субстрат представлял собой натриевую соль Poly(Glu,Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцию проводили в 25 мМ HepespH 7,5; 0,01% Tween 20, 10 мМ MgCl2 при различных концентрациях АТФ и соединения и останавливали добавлением 150 мМ фосфорной кислоты. Определение включенного фосфата в PolyGT субстрата осуществляли, помещая образцы на фильтрующий планшет (с использованием харвестера, Perkin Elmer) с последующим промыванием. Включенный 33 Р в PolyGT определяют на сцинцилляционном счетчикеTopcount после добавления сцинцилляционной жидкости в фильтрующие планшеты (Perkin Elmer). При тестировании в данном анализе соединения 1 получали значение Ki, равное 6,9 нМ. Альтернативным образом, для определения Ki с ферментом смешивали различные количества ингибитора и следили за ферментной реакцией как функцией концентрации АТФ. Ki определяли при помощи двойного взаимного графического отображения Km относительно концентрации соединения (график Lineweaver-Burk). В данном анализе использовали 1 нг JAK1 (Invitrogen, PV4774). Субстрат представлял собой 50 нМ пептида Ulight-JAK-1 (Tyr1023) (Perkin Elmer, TRF0121). Реакцию проводили в 25 мМ MOPS pH 6,8, 0,01%, 2 мМ DTT, 5 мМ MgCl2 Brij-35 при различных концентрациях АТФ и соединения. Фосфорилированный субстрат определяли с использованием Eu-меченного антифосфотирозинового антитела РТ 66 (Perkin Elmer, AD0068). Считывание осуществляли при помощи Envision (Perkin Elmer) при возбуждении при 320 нм и последующем излучении при 615 и 665 нм. При тестировании в данном анализе соединения 1 получали значение Ki, равное 5,6 нМ. Пример 1.3. Анализ ингибирования JAK2. Рекомбинантную JAK2 человека (каталитический домен, аминокислоты 866-1154; номер по каталогу PV4210) получали от Invitrogen. Инкубировали 0,0125 mU JAK2 с 25 нМ пептида Ulight-JAK1(tyr1023)(номер по каталогу Perkin Elmer TRF0121) в киназном реакционном буфере (41,66 мМ HEPES рН 7,0,0,016% Triton Х-100, 12,5 мМ MgCl2, 3,33 мМ DTT, 7,5 мкМ АТФ) в присутствии или в отсутствие 4 мкл,содержащих тестируемое соединение или разбавитель (ДМСО, 1% конечная концентрация) в общем объеме 20 мкл на белом планшете 384 Luminotrac (Greiner, номер по каталогу 781075). Через 60 мин при комнатной температуре реакции останавливали добавлением 20 мкл/лунку детекторной смеси(1 детекторный буфер (Perkin Elmer, номер по каталогу CR97-100C), 0,5 нМ европий-антифосфотирозина (РТ 66) (Perkin Elmer, номер по каталогу AD0068), 10 мМ ЭДТА. Считывание осуществляли с использованием Envision при возбуждении при 320 нм и определяя излучение при 615 нм (PerkinElmer). Киназную активность рассчитывали, вычитая относительные единицы флуоресценции (RFU),полученные в присутствии положительного контрольного ингибитора (10 мкМ стауроспорин) из RFU,полученных в присутствии разбавителя. Способность тестируемого соединения ингибировать данную активность определяли как процент ингибирования=RFU, определенные для образца в присутствии тестируемого соединения- RFU, определенные для образца с положительным контрольным ингибитором), деленное на (RFU, определенные в присутствии разбавителя - RFU, определенные для образца с положительным контрольным ингибитором 100. Получали серийные разбавления дозы для соединений, что позволяет тестировать влияние дозаотклик в анализе JAK2 и вычислить IC50 для данного соединения. Каждое соединение тестировали стандартным образом при концентрации 20 мкМ с последующим серийным разбавлением 1/5, 8 точек (20 мкМ-4 мкМ-800 нМ-160 нМ-32 нМ-6,4 нМ-1,28 нМ-0,26 нМ) при конечной концентрации 1% ДМСО. При повышении эффективности серий соединения готовят дополнительные разбавления и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Данные представлены в виде средней IC50 из анализовсредняя квадратическая ошибка среднего значения. Таблица IV Значения IC50 соединения для JAK2 Пример 1.4. Анализ на определение Ki JAK2. Для определения Ki с ферментом смешивали различные количества ингибитора и следили за ферментной реакцией как функцией концентрации АТФ. Ki определяли при помощи двойного взаимного графического отображения Km относительно концентрации соединения (график Lineweaver-Burk). В данном анализе использовали 0,025 mU JAK2 (Invitrogen, PV4210). Субстрат представлял собой натриевую соль Poly(Glu,Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцию проводили в 10 мМ MOPS pH 7,5, 0,5 мМ ЭДТА, 0,01% Brij-35, 1 мМ DTT, 15 мМ MgAc при различных концентрациях АТФ и соединения и останавливали добавлением 150 мМ фосфорной кислоты. Определение включенного фосфата вPolyGT субстрата осуществляли, помещая образцы на фильтрующий планшет (с использованием харвестера, Perkin Elmer) с последующим промыванием. Включенный 33 Р в PolyGT определяют на сцинцилляционном счетчике Topcount после добавления сцинцилляционной жидкости в фильтрующие планшеты(Perkin Elmer). При тестировании в данном анализе соединения 1 получали значение Ki, равное 126 нМ. Альтернативным образом, для определения Ki с ферментом смешивали различные количества ингибитора и следили за ферментной реакцией как функцией концентрации АТФ. Ki определяли при помощи двойного взаимного графического отображения Km относительно концентрации соединения (график Lineweaver-Burk). В данном анализе использовали 0,0125 mU JAK2 (Invitrogen, PV4210). Субстрат представлял собой 50 нМ пептида Ulight-JAK-1 (Tyr1023) (Perkin Elmer, TRF0121). Реакцию проводили в 25 мМ HEPES рН 7,0, 0,01% Triton X-100, 2 мМ DTT, 7,5 мМ MgCl2 при различных концентрациях АТФ и соединения. Фосфорилированный субстрат определяли с использованием Eu-меченного антифосфотирозинового антитела РТ 66 (Perkin Elmer, AD0068). Считывание осуществляли при помощи Envision (Perkin Elmer) при возбуждении при 320 нм и последующем излучении при 615 и 665 нм. При тестировании в данном анализе соединения 1 получали значение Ki, равное 35 нМ. Пример 1.5. Анализ ингибирования JAK3. Каталитический домен рекомбинантной JAK3 человека (аминокислоты 781-1124; номер по каталогу PV3855) получали от Invitrogen. Инкубировали 0,025 MU JAK3 с 2,5 мкг субстрата polyGT (номер по каталогу Sigma P0275) в киназном реакционном буфере (25 мМ Tris рН 7,5, 0,5 мМ EGTA, 0,5 мМNa3VO4, 5 мМ b-глицеринфосфата, 0,01% Triton X-100, 1 мкМ нерадиоактивного АТФ, 0,25 мкКи 33 Ргамма-АТФ (GE Healthcare, номер по каталогу АН 9968) конечные концентрации в присутствии или в отсутствие 5 мкл, содержащих тестируемое соединение или разбавитель (ДМСО, 1% конечная концен- 19020111 трация) в общем объеме 25 мкл в полипропиленовом 96-луночном планшете (Greiner, V-образное дно). Через 105 мин при 30 С реакции останавливали добавлением 25 мкл/лунку 150 мМ фосфорной кислоты. Все остановленные киназные реакционные смеси переносили в предварительно промытые (75 мМ фосфорной кислотой) 96-луночные фильтрующие планшеты (Perkin Elmer, номер по каталогу 6005177) с использованием клеточного харвестера (Perkin Elmer). Планшеты 6 раз промывали раствором 75 мМ фосфорной кислоты в количестве 300 мкл на лунку и плотно закрывали дно планшетов. Добавляли 40 мкл/лунку Microscint-20, плотно закрывали верх планшетов и осуществляли считывание данных с использованием Topcount (Perkin Elmer). Активность киназы рассчитывали, вычитая количество подсчетов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорина), из cpm, полученных в присутствии разбавителя. Способность тестируемого соединения ингибировать данную активность определяли как процент ингибирования=cpm, определенные для образца в присутствии тестируемого соединения- cpm, определенные для образца с положительным контрольным ингибитором), деленное на (cpm, определенные в присутствии разбавителя - cpm, определенные для образца с положительным контрольным ингибитором 100. Получали серийные разбавления дозы для соединения, что позволяет тестировать влияние дозаотклик в анализе JAK3 и вычислить IC50 для данного соединения. Каждое соединение тестировали стандартным образом при концентрации 20 мкМ с последующим серийным разбавлением 1/3, 8 точек (20 мкМ-6,67 мкМ-2,22 мкМ-740 нМ-247 нМ-82 нМ-27 нМ-9 нМ) при конечной концентрации 1% ДМСО. При повышении эффективности серий соединения готовят дополнительные разбавления и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Данные представлены в виде средней IC50 из анализовсредняя квадратическая ошибка среднего значения. Таблица V Значения IC50 соединения для JAK3 Пример 1.6. Анализ на определение Ki JAK3. Для определения Ki с ферментом смешивали различные количества ингибитора и следили за ферментной реакцией как функцией концентрации АТФ. Ki определяли при помощи двойного взаимного графического отображения Km относительно концентрации соединения (график Lineweaver-Burk). JAK3(Carna Biosciences, 09CBS-0625 В) использовали при конечной концентрации 10 мг/мл. Субстрат представлял собой натриевую соль Poly(Glu,Tyr) (4:1), М.м. 20000-50000 (Sigma, P0275). Реакцию проводили в 25 мМ Tris рН 7,5, 0,01% Triton Х-100, 0,5 мМ EGTA, 2,5 мМ DTT, 0,5 мМ Na3VO4, 5 мМ bглицеринфосфота, 10 мМ MgCl2 при различных концентрациях АТФ и соединения и останавливали добавлением 150 мМ фосфорной кислоты. Определение включенного фосфата в PolyGT субстрата осуществляли, помещая образцы на фильтрующий планшет (с использованием харвестера, Perkin Elmer) с последующим промыванием. Включенный 33 Р в PolyGT определяют на сцинцилляционном счетчике Topcount после добавления сцинцилляционной жидкости в фильтрующие планшеты (Perkin Elmer). При тестировании в данном анализе соединения 1 получали значение Ki, равное 188 нМ. Пример 1.7. Анализ ингибирования TYK2. Каталитический домен рекомбинантной TYK2 человека (аминокислоты 871-1187; номер по каталогу 08-147) получали от Carna Biosciences. Инкубировали 5 нг TYK2 с 12,5 мкг субстрата polyGT (номер по каталогу Sigma P0275) в киназном реакционном буфере (25 мМ HEPES рН 7,5, 100 мМ NaCl, 0,2 мМNa3VO4, 0,1% NP-40, 0,1 мкМ нерадиоактивного АТФ, 0,125 мкКи 33 Р-гамма-АТФ (GE Healthcare, номер по каталогу АН 9968) конечные концентрации в присутствии или в отсутствие 5 мкл, содержащих тестируемое соединение или разбавитель (ДМСО, 1% конечная концентрация) в общем объеме 25 мкл в полипропиленовом 96-луночном планшете (Greiner, V-образное дно). Через 90 мин при 30 С реакции останавливали добавлением 25 мкл/лунку 150 мМ фосфорной кислоты. Все остановленные киназные реакционные смеси переносили в предварительно промытые (75 мМ фосфорной кислотой) 96-луночные фильтрующие планшеты (Perkin Elmer, номер по каталогу 6005177) с использованием клеточного харвестера (Perkin Elmer). Планшеты 6 раз промывали раствором 75 мМ фосфорной кислоты в количестве 300 мкл на лунку и плотно закрывали дно планшетов. Добавляли 40 мкл/лунку Microscint-20, плотно закрывали верх планшетов и осуществляли считывание данных с использованием Topcount (Perkin Elmer). Активность киназы рассчитывали, вычитая количество подсчетов в 1 мин (cpm), полученных в присутствии положительного контрольного ингибитора (10 мкМ стауроспорина), из cpm, полученных в присутствии разбавителя. Способность тестируемого соединения ингибировать данную активность определяли как процент ингибирования=cpm, определенные для образца в присутствии тестируемого соединения- cpm, определенные для образца с положительным контрольным ингибитором), деленное на (cpm, определенные в присутствии разбавителя - cpm, определенные для образца с положительным контрольным ингибитором 100. Получали серийные разбавления дозы для соединения, что позволяет тестировать влияние доза- 20020111 отклик в анализе TYK2 и вычислить IC50 для данного соединения. Каждое соединение тестировали стандартным образом при концентрации 20 мкМ с последующим серийным разбавлением 1/3, 8 точек (20 мкМ-6,67 мкМ-2,22 мкМ-740 нМ-247 нМ-82 нМ-27 нМ-9 нМ) при конечной концентрации 1% ДМСО. При повышении эффективности серий соединения готовят дополнительные разбавления и/или снижают верхнюю концентрацию (например, 5, 1 мкМ). Данные представлены в виде средней IC50 из анализовсредняя квадратическая ошибка среднего значения. Таблица VI Значения TYK2 IC50 для соединения Пример 2. Клеточные анализы. Пример 2.1. Анализ передачи сигнала JAK-STAT. Клетки HeLa выдерживали в минимальной питательной среде Игла, модифицированной Далбекко(DMEM), содержащей 10% инактивированной нагреванием плодной телячьей сыворотки, 100 U/мл пенициллина и 100 мкг/мл стрептомицина. Клетки HeLa использовали при 70% слиянии для трансфекции. 20000 клеток в 87 мкл среды клеточной культуры быстро трансфицировали 40 нг репортера pSTAT1(2)люциферазы, 8 нг репортера LacZ в качестве внутреннего контрольного репортера и 52 нг pBSK с использованием 0,32 мкл Jet-PEI (Polyplus) в качестве реагента трансфекции на лунку в формате 96 луночного планшета. После инкубации в течение ночи при 37 С в присутствии 10% CO2 трансфекционную среду удаляли. Добавляли 75 мкл DMEM и 1,5% инактивированной нагреванием плодной телячьей сыворотки. В течение 60 мин добавляли 15 мкл соединения в концентрации 6,7, а затем 10 мкл OSM человека (Peprotech) в конечной концентрации 33 нг/мл. Все соединения тестировали по два раза, начиная с 20 мкМ с последующим серийным разбавлением 1/3, в целом 8 доз (20 мкМ-6,6 мкМ-2,2 мкМ-740 нМ-250 нМ-82 нМ-27 нМ-9 нМ) при конечной концентрации 0,2% ДМСО. После инкубации в течение ночи при 37 С в присутствии 10% CO2 клетки лизировали в 100 мкл лизисного буфера/лунку (PBS, 0,9 мМ CaCl2, 0,5 мМ MgCl2, 5% трегалозы, 0,025% тергитола NP9, 0,15%BSA). 40 мкл клеточного лизата использовали для считывания активности -галактозидазы при добавлении 180 мкл раствора Gal (30 мкл ONPG 4 мг/мл и 150 мкл -галактозидазного буфера (0,06 МNa2HPO4, 0,04 М NaH2PO4, 1 мМ MgCl2 в течение 20 мин. Реакцию останавливали добавлением 50 мкл 1 M Na2CO3. Поглощение считывали при 405 нм. Активность люциферазы определяли при использовании 40 мкл клеточного лизата и 40 мкл Steadylite, как описано производителем (Perkin Elmer), при помощи Envision (Perkin Elmer). 10 мкМ ингибитора pan-JAK использовали в качестве положительного контроля (100% ингибирования). В качестве отрицательного контроля использовали 0,5% ДМСО (0% ингибирования). Положительный и отрицательный контроль использовали для расчета значений z' и процента ингибирования"(PIN). Процент ингибирования=флуоресценция, определенная в присутствии разбавителя - флуоресценция, определенная для образца в присутствии тестируемого соединения), поделить на (флуоресценцию,определенную в присутствии разбавителя флуоресценция, определенную для образца в отсутствие триггера 100. Значения PIN наносили на график для тестированных соединений в виде зависимости доза-отклик и получали значения ЕС 50. Таблица VII Значения ЕС 50 соединения при передаче сигнала STAT Пример 2.2. Анализ передачи сигнала OSM/IL-1. Было показано, что OSM и IL-1 проявляют синергетическую апрегуляцию уровня ММР 13 в клеточной линии хондросаркомы человека SW11353. Клетки высевали в 96-луночные планшеты в количестве 15000 клеток/лунку в объеме 120 мкл DMEM (Invitrogen), содержащей 10% (об./об.) FBS и 1% смеси пенициллин/стрептомицин (Invitrogen), инкубируемой при 37 С и 5% СО 2. Клетки предварительно инкубировали в присутствии 15 мкл соединения в среде М 199, содержащей 2% ДМСО в течение 1 ч перед запуском при помощи 15 мкл OSM и IL-1, достигая 25 нг/мл OSM и 1 нг/мл IL-1, и определяли концентрацию ММР 13 в кондиционированной среде в течение 48 ч после запуска. Активность ММР 13 определяли с использованием анализа активности захвата антитела. Для этого на 384-луночные планшеты(NUNC, 460518 MaxiSorb черный) наносили покрытие 35 мкл 1,5 мкг/мл раствора анти-человеческого антитела ММР 13 (RD Systems, МАВ 511) в течение 24 ч при 4 С. После промывания лунок 2 раза смесью PBS и 0,05% Tween оставшиеся сайты связывания блокировали 100 мкл 5% нежирного сухого моло- 21020111 ка (Santa Cruz, sc-2325, Blotto) в PBS в течение 24 ч при 4 С. Затем лунки промывали 2 раза смесью PBS и 0,05% Tween и добавляли 35 мкл супернатанта культуры в разбавлении 1/10, содержащего ММР 13 в блокирующем буфере со 100-кратным разбавлением, и инкубировали в течение 4 ч при комнатной температуре. Затем лунки дважды промывали смесью PBS и 0,05% Tween с последующей активацией ММР 13 при добавлении 35 мкл 1,5 мМ ацетата 4-аминофенилртути (АРМА) (Sigma, A9563) и инкубировании при 37 С в течение 1 ч. Лунки вновь промывали смесью PBS и 0,05% Tween и добавляли 35 мкл субстрата ММР 13 (Biomol, P-126, флуорогенный субстрат OmniMMP). После инкубирования в течение 24 ч при 37 С определяли флуоресценцию трансформированного субстрата при помощи приборасчетчика Perkin Elmer Wallac Envision 2102 Multilabel Reader (длина волны возбуждающего света: 320 нм,длина волны излучаемого света: 405 нм). Процент ингибирования=флуоресценция, определенная в присутствии разбавителя - флуоресценция, определенная для образца в присутствии тестируемого соединения), поделить на (флуоресценцию,определенную в присутствии разбавителя флуоресценция, определенную для образца в отсутствие триггера 100. Данные выражены в виде среднего ЕС 50 из анализовсредняя квадратическая ошибка среднего значения. Таблица VIII Значения ЕС 50 MMP13 соединения Пример 2.3. Анализ пролиферации PBL. Лимфоциты периферической крови человека (PBL) стимулировали IL-2 и определяли пролиферацию с использованием анализа на встраивание BrdU. Сначала PBL стимулировали в течение 72 ч РНА для индуцирования рецептора IL-2, выдерживали без питания в течение 24 ч, чтобы остановить пролиферацию клеток, затем стимулировали IL-2 еще в течение 72 ч (включая 24-часовое введение метки вBrdU). Клетки преинкубировали с тестируемыми соединениями в течение 1 ч перед добавлением IL-2. Клетки выращивали в RPMI 1640, содержащей 10% (об./об.) FBS. Пример 2.4. Анализ цельной крови (WBA). 2.4.1. Протокол стимуляции IFN. Для прогноза селективности тестируемых соединений в отношении ингибирования JAK1- по сравнению с JAK2-зависимыми путями передачи сигнала in vivo была создана физиологически релевантная модель in vitro с использованием цельной крови человека. В анализе WBA кровь, взятую у людейдобровольцев, давших информированное согласие, обрабатывали ex vivo соединением (1h), а затем стимулировали либо в течение 30 мин интерфероном (IFN, JAK1-зависимый путь передачи сигнала), либо в течение 2 ч гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF, JAK2 зависимый путь передачи сигнала). 2.4.1.1. Анализ фосфо-STAT1. При стимуляции IFN увеличение фосфорилирования передатчиков сигнала и активаторов транскрипции 1 (pSTAT1) под действием IFN в экстрактах белых кровяных клеток определяли при помощи анализа pSTAT1 ELISA. Фосфорилирование передатчика сигнала и активаторов транскрипции 1 (STAT1) после инициирования интерфероном альфа (IFN) представляет собой JAK1-опосредованное событие. Анализ фосфо-STAT1, который использовали для определения уровня фосфо-STAT1 в экстрактах клеток, разрабатывали для того, чтобы оценить способность соединения ингибировать JAK1-зависимые пути передачи сигнала. Цельную человеческую кровь, взятую у людей-добровольцев, давших информированное согласие,обрабатывали ex vivo соединением (1h), а затем стимулировали в течение 30 мин IFN. Увеличение фосфорилирования STAT1 под действием IFN в экстрактах белых кровяных клеток определяли при помощи анализа фосфо-STAT1 ELISA. АСК-лизисный буфер включал в себя 0,15 М NH4Cl, 10 мМ KHCO3, 0,1 мМ ЭДТА. рН буфера составлял 7,3. 10-кратный концентрат клеточного лизисного буфера (часть набора для иммуноферментного анализELISA сэндвич-типа PathScan Phospho-STAT1 (Tyr701) от Cell Signaling) разбавляли в 10 раз Н 2 О. Перед использованием в буфер добавляли ингибиторы протеиназы. 20 мкг IFN растворяли в 40 мкл H2O, получая 500 мкг/мл исходного раствора. Данный исходный раствор хранили при -20 С. Готовили 3-кратные серийные разбавления соединения в ДМСО (максимальная концентрация: 10 мМ). Затем данное соединение дополнительно разбавляли средой (фактор разбавления зависит от требуемой конечной концентрации соединения). 2.4.1.1.1. Инкубирование крови с соединением и стимуляция IFN. Человеческую кровь собирали в гепаринизированные пробирки. Данную кровь делили на аликвоты по 392 мкл. Затем к каждой аликвоте добавляли 4 мкл разбавления соединения и инкубировали пробы крови в течение 1 ч при 37 С. Исходный раствор IFN разбавляли в 1000 раз средой RPMI, получая 500 нг/мл рабочего раствора. К пробам крови добавляли 4 мкл 500 нг/мл рабочего раствора (конечная концентрация IFNa: 5 нг/мл). Пробы инкубировали при 37 С в течение 30 мин. 2.4.1.1.2. Получение экстрактов клеток. В конце периода стимуляции к пробам крови добавляли 7,6 мл буфера АСК для лизирования красных кровяных клеток. Пробы перемешивали, переворачивая пробирки пять раз, и инкубировали реакционную смесь на льду в течение 5 мин. В процессе данного инкубирования лизис RBC должен был быть очевидным. Клетки осаждали центрифугированием при 300 g, 4 С в течение 7 мин и удаляли супернатант. В каждую пробирку добавляли 10 мл 1PBS и повторно суспендировали осадок после центрифугирования. Пробы вновь центрифугировали при 300 g, 4 С. Супернатант удаляли и вновь суспендировали осадок после центрифугирования в 500 мкл 1PBS. Затем клеточную суспензию переносили в чистую пробирку для микроцентрифугирования на 1,5 мл. Клетки осаждали центрифугированием при 700 g в течение 5 мин при 4 С. Супернатант удаляли и растворяли осадок в 150 мкл клеточного лизисного буфера. Пробы инкубировали на льду в течение 15 мин. После этого пробы хранили при -80 С до дальнейшей обработки. 2.4.1.1.3. Определение фосфорилирования STAT1 методом ELISA. Для определения уровня фосфо-STAT1 использовали набор для иммуноферментного анализ ELISA сэндвич-типа PathScan Phospho-STAT1 (Tyr701) от Cell Signaling (по каталогу 7234). Экстракты клеток размораживали на льду. Пробирки цетрифугировали в течение 5 мин при 16000 g,4 С и получали просветленные лизаты. В то же время микролуночные полоски из набора приводили в равновесие при комнатной температуре и готовили промывной буфер, разбавляя промывной буфер 20 Н 2 О. Пробы разбавляли в 2 раза разбавителем проб и добавляли 100 мкл в микролуночные полоски. Полоски инкубировали в течение ночи при 4 С. На следующий день лунки 3 раза промывали промывным буфером. В лунки добавляли 100 мкл детекторного антитела. Полоски инкубировали при 37 С в течение 1 ч. Затем лунки снова 3 раза промывали промывным буфером. В каждую лунку добавляли 100 мкл HRP-связанного вторичного антитела и инкубировали пробы при 37 С. Через 30 мин лунки снова промывали 3 раза и во все лунки добавляли 100 мкл субстрата ТМВ. Когда цвет проб изменялся на синий, для остановки реакции добавляли 100 мклSTOP-раствора. Поглощение измеряли при 450 нм. 2.4.1.2. ELISA IL-8. При стимуляции GM-CSF повышение концентрации интерлейкина-8 (IL-8) в плазме крови определяли при помощи анализа IL-8 методом ELISA. Индуцированная экспрессия IL-8 гранулоцитарномакрофагальным колониестимулирующим фактором (GM-CSF) представляет собой JAK2 опосредованное событие. ELISA IL-8, который можно использовать для определения концентрации IL-8 в образцах плазмы, разрабатывали для того, чтобы оценить способность соединения ингибировать JAK2 зависимые пути передачи сигнала. Цельную человеческую кровь, взятую у людей-добровольцев, давших информированное согласие,обрабатывали ex vivo соединением (In), а затем стимулировали в течение 2 ч GM-CSF. Увеличение концентрации IL-8 в плазме крови определяли методом ELISA IL-8. 10 мкг GM-CSF растворяли в 100 мкл Н 2 О, получая 100 мкг/мл исходного раствора. Данный исходный раствор хранили при -20 С. Готовили 3-кратные серийные разбавления тестируемого соединения в ДМСО (максимальная концентрация: 10 мМ). Затем данное соединение дополнительно разбавляли средой (фактор разбавления зависит от требуемой конечной концентрации соединения). 2.4.1.2.1. Инкубирование крови с соединением и стимуляция GM-CSF. Человеческую кровь собирали в гепаринизированные пробирки. Данную кровь делили на аликвоты по 245 мкл. Затем к каждой аликвоте добавляли 2,5 мкл разбавления соединения и инкубировали пробы крови в течение 1 ч при 37 С. Исходный раствор GM-CSF разбавляли в 100 раз средой RPMI, получая 1 мкг/мл рабочего раствора. К пробам крови добавляли 2,5 мкл 1 мкг/мл рабочего раствора (конечная концентрация GM-CSF: 10 нг/мл). Пробы инкубировали при 37 С в течение 2 ч. 2.4.1.2.2. Получение образцов плазмы. Пробы центрифугировали в течение 15 мин при 1000 g, 4 С. Получали 100 мкл плазмы и хранили при -80 С до дальнейшего использования. 2.4.1.2.3. Определение концентрации IL-8 методом ELISA. Для определения концентрации IL-8 использовали набор для хемилюминесцентного иммуноферментного анализа IL-8 человека от RD Systems (по каталогуQ8000B). Промывной буфер готовили, разбавляя промывной буфер 10 Н 2 О. Рабочий Glo-реагент получали,добавляя 1 часть Glo-реагента 1 к 2 частям Glo-реагента В в течение от 15 мин до 4 ч перед использованием. В каждую лунку добавляли 100 мкл разбавителя анализа RDI-86. После этого добавляли 50 мкл об- 23020111 разца (плазмы). ELISA-планшет инкубировали в течение 2 ч при комнатной температуре, 500 об/мин. Все лунки 4 раза промывали промывным буфером и в каждую лунку добавляли 200 мкл конъюгата IL-8. После инкубирования в течение 3 ч при комнатной температуре лунки 4 раза промывали промывным буфером и добавляли в каждую лунку 100 мкл рабочего Glo-реагента. ELISA-планшет инкубировали в течение 5 мин при комнатной температуре (защищали от света). Измеряли люминесценцию (время считывания 0,5 с/лунку). 2.4.1.4. Результаты.pIC50 соединения 1 при ингибировании INF-вызванного повышения концентрации pSTAT1 составило 6,320,07 (SEM), тогда как pIC50 при ингибировании GM-CSF-вызванного повышения IL-8 составило 4,870,13 (SEM) (результаты получены при использовании 6 доноров крови). Это показывает, что соединение 1 в 28 раз более селективно в отношении JAK1-пути, чем в отношении JAK2-пути. Следовательно, в клеточном окружении понятно, что соединение 1 проявляет селективность в отношении JAK1 по сравнению с JAK2. По-видимому, соединение 1 проявляет большую селективность в отношенииJAK1, чем в отношении JAK2, по сравнению с известными структурно родственными соединениями или другими известными ингибиторами JAK. 2.4.1.3. Обработка данных лечения и результаты. С целью дальнейшего уточнения результатов данные ингибирования индукции фосфо-STAT1 под действием INF в экстрактах клеток или ингибирования индукции IL-8 под действием GM-CSF в плазме наносили на график относительно концентрации соединения и получали значения IC50 при использовании программного обеспечения Graphpad. Данные сохранялись, если R2 превышал 0,8 и наклон горба был меньше 3, и сохраняли только тех доноров, для которых в обоих анализах получали достоверные данные. Например, при представлении в данный дополнительный протокол анализа данных определеннаяpIC50 соединения 1 в случае ингибирования вызванного INF повышения концентрации pSTAT1 составляла 6,210,09 (SEM), тогда как pIC50 в случае ингибирования GM-CSF-вызванного повышения IL-8 составило 4,970,14 (SEM) (результаты получены при использовании 6 доноров крови). Это подтверждает то, что соединение 1 в 17,6 раз более селективно в отношении JAK1-пути, чем в отношении JAK2-пути. Следовательно, в клеточном окружении понятно, что соединение 1 проявляет селективность в отношении JAK1 по сравнению с JAK2. По-видимому, соединение 1 проявляет большую селективность в отношении JAK1, чем в отношении JAK2, по сравнению с известными структурно родственными соединениями или другими известными ингибиторами JAK. 2.4.2. Протокол стимуляции IL-6. Для установления селективности соединения в отношении JAK1 по сравнению с JAK2 был также проведен проточный цитометрический анализ ex vivo с использованием человеческой цельной крови. Таким образом, кровь брали у людей-добровольцев, давших информированное согласие. После этого кровь приводили в равновесие в течение 30 мин при 37 С при осторожном качании, затем отбирали аликвоты в пробирки Эппендорфа. Добавляли соединение в различной концентрации и инкубировали при 37 С в течение 30 мин, а затем стимулировали в течение 20 мин при 37 С при осторожном качании интерлейкином 6 (IL-6) для стимуляции JAK1-зависимого пути или GM-CSF для стимуляции JAK2 зависимого пути. После этого проводили оценку фосфо-STAT1 и фосфо-STAT5 при использовании анализа FACS. 2.4.2.1. Анализы фосфо-STAT1. В случае IL-6-стимулированного увеличения фосфорилирования переносчиков сигнала и активаторов транскрипции 1 (pSTAT1) в белой кровяной клетке человеческую цельную кровь, полученную у людей-добровольцев, которые дали информированное согласие, обрабатывали ex vivo соединением в течение 30 мин, а затем стимулировали в течение 20 мин IL-6. Увеличение фосфорилирования STAT1 под действием IL-6 в лимфоцитах определяли с использованием анти-фосфо-STAT1 антитела при помощиFACS. 5-кратный буфер Lyse/Fix (BD PhosFlow, по каталогу 558049) разбавляли в 5 раз дистиллированной водой и предварительно нагревали при 37 С. Оставшийся разбавленный Lyse/Fix буфер отбрасывали. 10 мкг rhIL-6 (RD Systems, по каталогу 206-IL) растворяли в 1 мл PBS 0,1% BSA, получая 10 мкг/мл исходного раствора. Данный исходный раствор хранили в виде аликвот при -80 С. Готовили 3-кратное серийное разбавление соединения в ДМСО (10 мМ исходного раствора). В образцы, обработанные контрольным веществом, добавляли ДМСО вместо соединения. Все образцы инкубировали при 1% конечной концентрации ДМСО. 2.4.2.1.1. Инкубирование крови с соединением и стимуляция действием IL-6. Человеческую кровь собирали в гепаринизированные пробирки. Данную кровь делили на аликвоты по 148,5 мкл. Затем к каждой аликвоте добавляли 1,5 мкл разбавления соединения и инкубировали пробы крови в течение 30 мин при 37 С при осторожном качании. К пробам крови добавляли исходный раствор IL-6 (1,5 мкл) (конечная концентрация 10 нг/мл) и инкубировали пробы при 37 С в течение 20 мин при осторожном качании. 2.4.2.1.2. Препарат белых кровяных клеток и введение метки CD4. В конце периода стимулирования 3 мл 1-кратного предварительно нагретого буфера Lyse-Fix мгновенно добавляли в пробы крови, недолгое время перемешивали вращением и инкубировали в течение 15 мин при 37 С на водяной бане, чтобы лизировать красные кровяные клетки и фиксировать лейкоциты,затем замораживали при -80 С до дальнейшего использования. Для следующих стадий пробирки размораживали при 37 С в течение приблизительно 20 мин и центрифугировали в течение 5 мин при 400 g при 4 С. Осадок после центрифугирования промывали 3 мл холодного 1PBS и после центрифугирования клеточный осадок повторно суспендировали в 100 мклFITC-конъюгированное изотопное антитело и инкубировали в течение 20 мин при комнатной температуре, в темноте. 2.4.2.1.3. Пермеабилизация клеток и введение метки анти-фосфо-STAT1 антителом. После промывания клеток 1PBS клеточный осадок повторно суспендировали в 100 мкл ледяного 1PBS и добавляли 900 мкл ледяного 100%-ного метанола. Затем клетки инкубировали при 4 С в течение 30 мин для пермеабилизации. После этого пермеабилизованные клетки промывали 1PBS, содержащим 3% BSA и, наконец, повторно суспендировали в 80 мкл 1PBS, содержащем 3% BSA. Добавляли и перемешивали 20 мкл РЕ мышиного анти-STAT1 (pY701) или РЕ мышиного IgG2aK изотопного контрольного антитела (BD Biosciences, по каталогу 612564 и 559319 соответственно),затем инкубировали в течение 30 мин при 4 С в темноте. После этого клетки однократно промывали 1PBS и анализировали на проточном цитометре FACSCanto II (BD Biosciences). 2.4.2.1.4. Флуоресцентный анализ на FACSCanto II. Подсчитывали в целом 50000 событий и определяли фосфо-STAT1 положительные клетки после стробирования на CD4+ клетках в лимфоцитарном гейте. Данные анализировали при помощи программного обеспечения FACSDiva, и они соответствовали проценту ингибирования стимуляции IL-6, рассчитанному на процентную долю положительных клеток для фосфо-STAT1 на CD4+ клетках. 2.4.2.2. Анализ фосфо-STAT5. В случае GM-CSF-стимулированного увеличения фосфорилирования переносчиков сигнала и активаторов транскрипции 5 (pSTAT5) в белой кровяной клетке человеческую цельную кровь, полученную у людей-добровольцев, которые дали информированное согласие, обрабатывали ex vivo соединением в течение 30 мин, а затем стимулировали в течение 20 мин GM-CSF. Увеличение фосфорилированияSTAT5 под действием GM-CSF в моноцитах определяли с использованием анти-фосфо-STAT5 антитела при помощи FACS. 5-кратный буфер Lyse/Fix (BD PhosFlow, по каталогу 558049) разбавляли в 5 раз дистиллированной водой и предварительно нагревали при 37 С. Оставшийся разбавленный Lyse/Fix буфер отбрасывали. 10 мкг rhGM-CSF (AbCys S. А., по каталогуР 300-03) растворяли в 100 мкл PBS 0,1% BSA, получая 100 мкг/мл исходного раствора. Данный исходный раствор хранили в виде аликвот при -80 С. Готовили 3-кратное серийное разбавление соединения в ДМСО (10 мМ исходного раствора). В образцы, обработанные контрольным веществом, добавляли ДМСО вместо какого-либо тестируемого соединения. Все образцы инкубировали при 1% конечной концентрации ДМСО. 2.4.2.2.1. Инкубирование крови с соединением и стимуляция действием GM-CSF. Человеческую кровь собирали в гепаринизированные пробирки. Данную кровь делили на аликвоты по 148,5 мкл. Затем к каждой аликвоте добавляли 1,5 мкл разбавления соединения и инкубировали пробы крови в течение 30 мин при 37 С при осторожном качании. К пробам крови добавляли исходный раствор GM-CSF (1,5 мкл) (конечная концентрация 20 пг/мл) и инкубировали пробы при 37 С в течение 20 мин при осторожном качании. 2.4.2.2.2. Препарат белых кровяных клеток и введение метки CD14. В конце периода стимулирования 3 мл 1-кратного предварительно нагретого буфера Lyse-Fix мгновенно добавляли в пробы крови, недолгое время перемешивали вращением и инкубировали в течение 15 мин при 37 С на водяной бане, чтобы лизировать красные кровяные клетки и фиксировать лейкоциты,затем замораживали при -80 С до дальнейшего использования. Для следующих стадий пробирки размораживали при 37 С приблизительно в течение 20 мин и центрифугировали в течение 5 мин при 400 g при 4 С. Клеточный осадок промывали 3 мл холодного 1PBS и после центрифугирования клеточный осадок повторно суспендировали в 100 мкл PBS, содержащем 3%BSA. Добавляли FITC мышиное анти-CD14 антитело (BD Biosciences, по каталогу 345784) или контрольное FITC мышиное IgG2bK изотопное антитело (BD Biosciences, по каталогу 555057) и инкубировали в течение 20 мин при комнатной температуре, в темноте. 2.4.2.2.3. Пермеабилизация клеток и введение метки анти-фосфо-STAT5 антителом. После промывания клеток 1PBS клеточный осадок повторно суспендировали в 100 мкл ледяного 1PBS и добавляли 900 мкл ледяного 100%-ного метанола. Затем клетки инкубировали при 4 С в течение 30 мин для пермеабилизации. После этого пермеабилизованные клетки промывали 1PBS, содержащим 3% BSA, и, наконец, повторно суспендировали в 80 мкл 1PBS, содержащем 3% BSA. Добавляли и перемешивали 20 мкл РЕ мышиного анти-STAT5 (pY694) или РЕ мышиного IgG1K изотопного контрольного антитела (BD Biosciences, по каталогу 612567 и 554680 соответственно),затем инкубировали в течение 30 мин при 4 С в темноте. После этого клетки однократно промывали 1PBS и анализировали на проточном цитометре FACSCanto II (BD Biosciences). 2.4.2.2.4. Флуоресцентный анализ на FACSCanto II. Подсчитывали в целом 50000 событий и определяли фосфо-STAT5 положительные клетки после стробирования на CD14+ клетках. Данные анализировали при помощи программного обеспеченияFACSDiva, и они соответствовали проценту ингибирования стимуляции GM-CSF, рассчитанному на процентную долю положительных клеток для фосфо-STAT5 на CD14+ клетках. 2.4.2.3. Результаты. При представлении в данный протокол для соединения данного изобретения определяли процент ингибирования (PIN), полученный из среднего значения 3 здоровых добровольцев. Например, тестировали соединение 1 и возвращались к pIC50=6,61 при ингибировании STAT1 фосфорилирования и pIC50=5,37 при ингибировании STAT5 фосфорилирования. При сравнении влияния соединения 1 на STAT1 (JAK1-зависимый путь) и STAT5 (JAK2-зависимый путь) определяли 17,6-кратную селективность для JAK1 относительно JAK2. Пример 3. Модели in vivo. Пример 3.1. Модель CIA. 3.1.1. Материалы. Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) приобретали у Difco. Коллаген коровы II типа (CII), липополисахарид (LPS) и энбрель приобретали у Chondrex (Isle d'Abeau,Франция); Sigma (Isle d'Abeau, Франция), Whyett (25 мг шприц для инъекций, Франция) Acros Organics(Palo Alto, CA) соответственно. Все остальные используемые реагенты были химически чистыми, и все растворители были аналитически чистыми. 3.1.2. Животные. Крыс темного окраса агути (самцы, возраст 7-8 недель) получали из Harlan Laboratories (MaisonAlfort, Франция). Мышей DBA/1J (самцы, возраст 7 недель) получали из Centre d'Elevage et de Reproduction JANVIER (CERJ) (Лаваль, Франция). Крыс и мышей выдерживали в 12-часовом цикле смены свет/темнота (0700-1900). Температуру поддерживали при 22 С, пищу и воду предоставляли свободно. 3.1.3. Вызванный коллагеном артрит (CIA). За один день до опыта готовили раствор CII (2 мг/мл) с содержанием 0,05 М уксусной кислоты и хранили при 4 С. Непосредственно перед иммунизацией смешивали равные объемы адъюванта (IFA) иCII при помощи гомогенизатора в предварительно охлажденной стеклянной бутылке на водной бане со льдом. Лишний адъювант и продолжительная гомогенизация могут потребоваться, если не образуется эмульсии. Мыши: делали инъекцию 0,1 мл эмульсии чрескожно в основание хвоста каждой мыши на 1 день,вторую бустер-дозу чрескожной инъекции (CII раствор при 1 мг/мл в CFA 0,1 мл физиологического раствора) осуществляли на 21 день. Способ иммунизации модифицировали исходя из опубликованных способов (David D. Brand, Kary A. LathamEdward F. Rosloniec. Collagen-induced arthritis. Nature methods 2(5):1269-1275, 2007). Крысы: делали инъекцию 0,2 мл эмульсии чрескожно в основание хвоста каждой крысе на 1 день,вторую бустер-дозу чрескожной инъекции (CII раствор при 2 мг/мл в CFA 0,1 мл физиологического раствора) осуществляли на 9 день. Способ иммунизации модифицировали исходя из опубликованных способов (Sims NA et ah, (2004) Targeting osteoclasts with zoledronic acid prevents bone destruction in collageninduced arthritis, Arthritis Rheum. 50 2338-2346; Jou et al., 2005). 3.1.4. Организация исследования. Терапевтические эффекты тестируемых соединений исследовали на модели крысы или мыши CIA. Животных разделяли случайным образом на равные группы, и в каждой группе содержалось 10 животных. Всех крыс вакцинировали на 1 день и повторно вакцинировали на 9 день. Всех мышей вакцинировали на 1 день и повторно вакцинировали на 21 день. Терапевтическое дозирование длилось с 16 по 30 день. Отрицательная контрольная группа получала разбавитель (МС 0,5%) и положительная контрольная группа - энбрель (10 мг/кг, 3 недели, s.c.). Рассматриваемое соединение обычно тестировали в виде 3 доз,например 3, 10, 30 мг/кг, р.о. 3.1.5. Клиническая оценка артрита. Проводили оценку артрита согласно способу Khachigian 2006, Lin et al. 2007 и Nishida et al. 2004. Опухание каждой из четырех лап расценивали по артритической оценке следующим образом: 0 - нет симптомов, 1 - слабая, но четко выраженная краснота одного типа суставов, такого как лодыжка, или запястье, или явная краснота и опухлость, ограниченные отдельными пальцами, вне зависимости от числа пораженных пальцев, 2 - умеренная краснота и опухлость двух или более типов суставов, 3 - сильная краснота и опухлость целой лапы, включая пальцы, 4 - максимально воспаленная конечность с вовлечением многочисленных суставов (максимальная совокупная клиническая артритическая оценка 16 на животное) (Nishida et al., 2004). Чтобы допустить мета-анализ многочисленных исследований, значения клинической оценке нормировали следующим образом:AUC клинической оценки (AUC оценки): площадь под кривой (AUC) с 1 по 14 день вычисляли для каждой отдельной крысы. AUC для каждого животного делили на среднюю AUC, полученную для разбавителя в исследовании, из которого получали данные относительно данного животного, и умножали на 100 (то есть AUC выражали в виде процентной доли средней AUC разбавителя на исследование). Возрастание клинической оценки с 1 по 14 день (счет конечной точки): разницу в клинической оценке для каждого животного делили на среднюю разницу в клинической оценке, полученную для разбавителя в исследовании, из которого получали данные относительно данного животного, и умножали на 100 (то есть AUC выражали в виде процентной доли средней клинической оценки разбавителя на исследование). 3.1.6. Изменение массы тела (%) после начала артрита. Клинически потеря массы тела связана с артритом (Shelton et al., 2005; Argiles et al., 1998; Rall,2004; Walsmith et al., 2004). Следовательно, изменение массы тела после начала артрита можно использовать в качестве неспецифической конечной точки для оценки влияния терапевтических средств на модель крысы. Изменение массы тела (%) после начала артрита можно вычислить следующим образом: Мыши Крысы 3.1.7. Оценка по Ларсену. После смерти оценку по Ларсену выводили для обеих задних лапок всех крыс по меньшей мере 2 ученых. Вычисляли среднее значение данных оценок, получая одну оценку по Ларсену на крысу. Чтобы было можно провести сравнение оценок по Ларсену между исследованиями, оценку по Ларсену для каждой крысы делили на среднюю оценку по Ларсену, полученную для разбавителя в исследовании, к которому относится крыса, и умножить на 100 (то есть выражая оценку по Ларсену в виде процентной доли средней клинической оценки разбавителя на исследование). Рассчитывали и сравнивали среднюю оценку по Ларсену для различных групп, получавших лечение. 3.1.8. Рентгенологическое исследование. Делали рентгеновские снимки задних лап каждого отдельного животного. Каждой из фотографий давали случайный слепой идентификационный номер, а тяжесть эрозии кости ранжировали при помощи двух независимых оценок системы радиологической оценки Ларсена следующим образом: 0 - нормальная с незатронутыми контурами костей и нормальным суставным пространством; 1 - легкая аномалия с одной или двумя внешними плюсневыми костями, в которых проявляется небольшая эрозия костей; 2 определенная ранняя аномалия с проявлением эрозии костей для трех-пяти внешних плюсневых костей; 3 - средняя деструктивная аномалия, при которой для всех внешних плюсневых костей, а также для любой одной или двух внутренних плюсневых костей проявляется определенная эрозия костей; 4 - тяжелая деструктивная аномалия, при которой для всех внешних плюсневых костей проявляется определенная эрозия костей и по меньшей мере один из внутренних плюсневых суставов полностью эродирован с частично сохранившимися контурами костей сустава; 5 - уродующая аномалия без контуров костей. Данная система оценок представляет собой модификацию от Salvemini et al., 2001; Bush et al., 2002; Sims et al.,2004; Jou et al., 2005. 3.1.9. Гистологический анализ. После рентгенологического анализа задние лапки мышей фиксировали в 10% формалине с фосфатным буфером (рН 7,4), декальцинировали при помощи быстрого декальцификатора костей для высококачественного гистологического анализа (Laboratories Eurobio) и заливали парафином. Чтобы гарантировать исчерпывающую оценку артритических суставов, делали по меньшей мере четыре серийных среза(толщиной 5 мкм) и между каждой серией срезов делали промежутки по 100 мкм. Срезы окрашивали гематоксилином и эозином (НЕ). Гистологические исследования синовиального воспаления и повреждения костей и хрящевой ткани проводили двойным слепым методом. Для каждой лапки оценивали четыре параметра с использованием четырехточечной шкалы. Данные параметры представляли собой клеточную инфильтрацию, серьезность паннуса, эрозию хрящевой ткани и эрозию костей. Оценку проводили следующим образом: 1 - нормальная, 2 - легкая, 3 - умеренная, 4 - выраженная. Четыре данных оценки суммировали и представляли в виде дополнительной оценки, а именно "общей оценки RA". Чтобы дать возможность сравнить гистологические отсчеты для разных исследований, общую гистологическую оценку для каждой крысы делили на среднюю общую гистологическую оценку, полученную для разбавителя в исследовании, к которому относится крыса, и умножали на 100 (то есть общую гистологическую оценку выражали в виде процентной доли средней общей гистологической оценки разбавителя на исследование). Проводили расчет и сопоставление средней общей гистологической оценки для различных групп, получавших лечение. 3.1.10. Микрокомпьютерный томографический (СТ) анализ калканеуса (пяточной кости). Разрушение кости, наблюдаемое при RA, происходит, главным образом, в кортикальном слое кости и может быть обнаружено методом СТ анализа (Sims N.A. et al., 2004; Oste L. et al., ECTC Montreal 2007). После сканирования и 3D-объемной реконструкции пяточной кости разрушение кости определяют как число дискретных объектов, присутствующих на слайде, выделенных in silico перпендикулярно продольной оси кости. Чем больше разрушенная кость, тем больше дискретных объектов выделено. Анализируют 1000 срезов, равномерно распределенных вдоль пяточной кости (с промежутком около 10,8 мкм). 3.1.11. Результаты. Соединение 1 тестировали в исследовании CIA на мышах в количестве 30 мг/кг и в исследованииCIA на крысах в количестве 30, 10, 3 и 1 мг/кг. Соединение 1 оказалось эффективным при всех отсчетах,осуществленных в исследовании CIA на крысах, при статистической достоверности в нескольких отсчетах, в частности значительные улучшения наблюдались для AUC клинической оценки (от 10 мг/кг), конечной клинической оценки (от 1 мг/кг), оценки по Ларсену (от 30 мг/кг) и опухания лапки (от 1 мг/кг). Пример 3.2. Модель септического шока. Инъекция липополисахарида (LPS) вызывает быстрое высвобождение растворимых рецепторов фактора некроза опухоли (TNF) в периферию. Данную модель используют для анализа предполагаемых блокаторов высвобождения TNF in vivo. Шесть самок мышей BALB/cJ (20 г) на группу лечат однократно заданными дозами, р.о. Через 30 мин делают i.p. инъекцию LPS (15 мкг/кг, серотип Е. Coli 0111:B4). Через 90 мин мышей подвергают эвтаназии и собирают кровь. Концентрации циркулирующего TNF определяют при помощи коммерчески доступных наборов ELISA. В качестве контрольного противовоспалительного соединения используют дексаметазон (5 мкг/кг). Выбранные соединения тестируют при одной или многократных дозах, например 3, и/или 10, и/или 30 мг/кг, р.о. Соединение 1 проявляло статистически достоверное снижение высвобождения TNF (50%) при 30 мг/кг р.о. Пример 3.3. Модель МАВ (модель с моноклональным антителом). Модель МАВ дает возможность провести быструю оценку модулирования RA-подобной воспалительной реакции терапевтическими средствами (Kachigian L.M. Nature Protocols (2006) 2512-2516: Collagen antibody-induced arthritis). Мышам DBA/J делают инъекцию i.v. смесью mAb, направленных против коллагена II. Через день начинают лечение соединением (разбавитель: 10% об./об. HPCD). Через три дня мыши получают i.p. инъекцию LPS (50 мкг/мышь), приводящую к быстрому началу воспаления. Лечение соединением продолжают в течение 10 дней после инъекции mAb. Воспаление определяют по измерению опухания лапки и регистрации клинической оценки каждой лапки. Представляют общие клинические оценки артрита четырех конечностей для демонстрации тяжести воспаления. Систему оценки применяют к каждой конечности с использованием шкалы 0-4, при этом 4 представляет собой наиболее тяжелое воспаление. 0 - Симптомы отсутствуют. 1 - Слабое, но отчетливое покраснение и опухание одного типа сустава, такого как лодыжка или запястье, или явное покраснение и опухание, ограниченное отдельными пальцами, вне зависимости от числа пораженных пальцев. 2 - Умеренное покраснение и опухание двух или более типов суставов. 3 - Сильное покраснение и опухание целой лапки, включая пальцы. 4 - Максимально воспаленная конечность с участием многочисленных суставов. Пример 3.4. Онкологические модели. Модели in vivo для подтверждения эффективности малых молекул по отношению к JAK2 управляемым миелопролиферативным заболеваниям описаны Wernig et al. Cancer Cell 13, 311, 2008 иGeron et al. Cancer Cell 13, 321, 2008. Пример 3.5. Модель IBD на мышах. Модели in vitro и in vivo для подтверждения эффективности малых молекул по отношению к IBD описаны Wirtz et al. 2007. Пример 3.6. Модель астмы на мышах. Модели in vitro и in vivo для подтверждения эффективности малых молекул по отношению к астме описаны Nials et al., 2008; Ip et al. 2006; Pernis et al., 2002; Kudlacz et al., 2008. Пример 4. Модели токсичности, DMPK и безопасности. Пример 4.1. Термодинамическая растворимость. Готовят раствор 1 мг/мл тестируемого соединения в 0,2 М фосфатном буфере с рН 7,4 или 0,1 М цитратном буфере с рН 3,0 при комнатной температуре в стеклянном сосуде. Образцы вращают на диске ротатора STR 4 (Stuart Scientific, Bibby) со скоростью 3,0 при комнатной температуре в течение 24 ч. Через 24 ч 800 мкл образца переносят в пробирку Эппендорфа и центрифугируют в течение 5 мин при 14000 об/мин. Затем 200 мкл супернатанта образца переносят на планшет Multiscreen Solubility Plate(Millipore, MSSLBPC50) и фильтруют супернатант (10-12 мм рт. ст.) при помощи вакуумной гребенки в чистый полипропиленовый 96-луночный планшет с V-образным дном Greiner (по каталогу 651201). 5 мкл фильтрата разбавляют 95 мкл (F20) того же буфера, который использовали для инкубирования в планшете, содержащем калибровочную кривую (Greiner, по каталогу 651201). Калибровочную кривую для данного соединения делают свежеприготовленной в ДМСО, начиная от 10 мМ исходного раствора в ДМСО, разбавленного фактором 2 в ДМСО (5000 мкМ), а затем еще разбавляют ДМСО до 19,5 мкМ. Затем 3 мкл серийного разбавления, начиная с 5000 мкМ, переносят в 97 мкл смеси ацетонитрил-буфер (50/50). Конечный интервал концентрации составляет от 2,5 до 150 мкМ. Планшет герметизируют при помощи герметизирующих пленок (MA96RD-04S, www.kinesis.co.uk) и измеряют образцы при комнатной температуре методом ЖХ-МС (ZQ 1525 от Waters) в оптимизированных условиях с использованием Quanoptimize для определения соответствующей массы молекулы. Образцы анализируют на ЖХ-МС при скорости потока 1 мл/мин. Растворитель А представляет собой 15 мМ аммиак и растворитель В представляет собой ацетонитрил. Образец проходит в условиях положительного ионного спрея на колонку XBridge C18 3,5 мкМ (2,130 мм) от Waters. Градиент растворителя имеет общее время прохода 2 мин и изменяется от 5 до 95% В. Анализ площади пиков проводят при помощи пакета программ Masslynx и площади пиков образцов наносят на график относительно калибровочной кривой, получая растворимость соединения. Значения растворимости приведены в мкМ или мкг/мл. Пример 4.2. Растворимость в воде. Начиная от 10 мМ исходного раствора в ДМСО, готовят серийное разбавление соединения в ДМСО. Серийные разбавления переносят в 96-луночный планшет с F-образным дном NUNC Maxisorb(по каталогу 442404) и добавляют 0,2 М фосфатного буфера с рН 7,4 или 0,1 М цитратного буфера с рН 3,0 при комнатной температуре. Конечная концентрация изменяется в интервале от 200 до 2,5 мкМ за 5 одинаковых стадий разбавления. Конечная концентрация ДМСО не превышала 2%. В угловые точки каждого 96-луночного планшета прибавляют 200 мкМ пирена, и он служит контрольной точкой для калибровки Z-оси в микроскопе. Планшеты для анализа герметизируют и инкубируют в течение 1 ч при 37 С при встряхивании при 230 об/мин. После этого планшеты сканируют под микроскопом с освещением белым светом, получая отдельные картинки осадка по концентрации. Осадок анализируют и переводят в число, которое наносят на график. Первая концентрация, при которой соединение оказывается полностью растворенным, представляет собой сообщенную концентрацию, однако истинная концентрация находится где-то между данной концентрацией и концентрацией одного шага разбавления в большую сторону. Значения растворимости приведены в мкг/мл. Пример 4.3. Связывание с белком плазмы (равновесный диализ). 10 мМ исходный раствор соединения в ДМСО разбавляют фактором 5 в ДМСО. Данный раствор дополнительно разбавляют в свежеразмороженной плазме крови человека, крысы, мыши или собаки(BioReclamation INC) при конечной концентрации 10 мкМ и конечной концентрации ДМСО 0,5% (5,5 мкл в 1094,5 мкл плазмы в 96-луночном планшете PP-Masterblock (Greiner, по каталогу 780285. Готовят планшет с вкладышами Pierce Red Device (ThermoScientific, по каталогу 89809) и заполняют 750 мкл PBS буферный резервуар и 500 мкл спайковой плазмы в резервуар для плазмы. Планшет инкубируют в течение 4 ч при 37 С при встряхивании при 230 об/мин. После инкубации 120 мкл содержимого обоих резервуаров переносят в 360 мкл ацетонитрила в 96-луночных круглодонных, РР планшетах с глубокими лунками (Nunc, по каталогу 278743) и герметизируют крышкой из алюминиевой фольги. Образцы перемешивают и помещают на лед на 30 мин. После этого данный планшет центрифугируют в течение 30 мин при 1200 rcf при 4 С и переносят супернатант в 96-луночный РР планшет с Vобразным дном (Greiner, 651201) для анализа методом ЖХ-МС. Данный планшет герметизируют герметизирующими пленкамиwww.kinesis.co.uk и измеряют образцы при комнатной температуре методом ЖХ-МС (ZQ 1525 от Waters) в оптимизированных условиях с использованием Quanoptimize для определения соответствующей массы молекулы. Образцы анализируют методом ЖХ-МС при скорости потока 1 мл/мин. Растворитель А представляет собой 15 мМ аммиак и растворитель В представляет собой ацетонитрил. Образец проходит в условиях положительного ионного спрея на колонку XBridge C18 3,5 мкМ (2,130 мм) от Waters. Градиент растворителя имеет общее время прохода 2 мин и изменяется от 5 до 95% В.
МПК / Метки
МПК: A61P 29/00, A61P 35/00, A61K 31/437, A61P 37/00, C07D 471/04
Метки: кислоты, 5-[4-(3,3-диметилазетидин-1-карбонил)фенил]-[1,2,4]триазол[1,5-a]пиридин-2-ил}амид, циклопропанкарбоновой
Код ссылки
<a href="https://eas.patents.su/30-20111-5-4-33-dimetilazetidin-1-karbonilfenil-124triazol15-apiridin-2-ilamid-ciklopropankarbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">{5-[4-(3,3-диметилазетидин-1-карбонил)фенил]-[1,2,4]триазол[1,5-a]пиридин-2-ил}амид циклопропанкарбоновой кислоты</a>
Предыдущий патент: Твердая лекарственная форма, обладающая анорексигенным действием (варианты)
Следующий патент: Паропроницаемый ботинок
Случайный патент: Конструкция соединителей сигналов данных с линией электропитания высокого напряжения


































