Антибактериальные композиции
Номер патента: 19748
Опубликовано: 30.06.2014
Авторы: Хэйдон Дэвид Джон, Чаплевски Ллойд Джордж, Лэдувахетти Тамара, Митчелл Дейл Роберт, Палмер Николас Джон, Эзералл Джон Фредерик, Стил Кристофер Ричард
Формула / Реферат
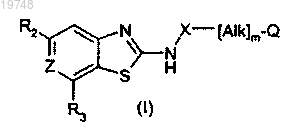
1. Применение соединения формулы (I) или его соли, гидрата, сольвата или N-окиси для приготовления антибактериальной композиции

где m равен 1;
Q обозначает водород;
Alk обозначает -СН2СН2-;
X обозначает -C(=O)NH-;
Z обозначает СН или CF;
R2 обозначает группу Q1-[Alk1]q-Q2, где
q равен 0 или 1;
Alk1 обозначает С1-С6алкилен, который может содержать аминогруппу -N(H)- или заканчиваться ей и который может быть оксозамещенным;
Q2 является необязательно замещенным и выбран из фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-10-членного бициклического гетероциклического радикала, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН3-, СН3О-, CN и NH2;
Q1 обозначает водород или заместитель, выбранный из C1-С3алкила, гидроксила, гидроксиС1-3-алкила, галогена, полностью или частично фторированного C1-С3алкила, С1-С3алкокси, С1-С3алкоксиС1-С3алкила, нитро, нитрила (-CN), оксо (=O), фенила, необязательно замещенного N(С1-С3алкил)2, 5-6-членного моноциклического гетероциклического радикала, необязательно замещенного (С1-С3)алкилом и содержащего 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы, циклоалкила, содержащего 3-6 атомов углерода в кольце, -COORA, -CORA, -CONRARB и -NRBCORA, где RA и RB независимо выбраны из водорода, C1-3-алкила, или Q1 представляет собой группу -NRARB, где RA и RB независимо выбраны из водорода, C1-С6алкила, гидроксиС1-С6алкила или (С1-С3)алкокси(С1-С3)алкила, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С1-С6алкил)пиперазинильного кольца;
R3 обозначает группу Q4-[Alk2]p[Q3]q, отличную от водорода, где
р и q независимо равны 0 или 1;
Alk2 обозначает С1-С6алкилен;
Q3 является необязательно замещенным и выбран из циклопропила, фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-членного бициклического гетероарила, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН3О-, -NH2,
-CN, Cl, СН3- и CF3;
Q4 обозначает водород или заместитель, выбранный из С1-С3алкила, гидроксила, гидроксиС1-С3алкила, галогена, полностью или частично фторированного C1-С3алкила, С1-С3алкокси, нитрила (-CN), COORA, CONRARB, CONHNH2, NRBCORA, NRACONRARB, где RA и RB независимо обозначают водород или C1-С3алкил, или Q4 представляет собой группу NRARB, в которой RA и RB независимо обозначают водород, С1-С6алкил, гидроксиС1-С6алкил или С1-С3алкоксиС1-С3алкил, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С1-С6алкил)пиперазинильного кольца.
2. Применение по п.1, отличающееся тем, что Z обозначает СН.
3. Применение по п.1 или 2, отличающееся тем, что в заместителе R2 Q2 обозначает необязательно замещенное пиридиновое, пиримидиновое, пиразиновое или пиридин-2-оновое кольцо.
4. Применение по любому из пп.1-3, отличающееся тем, что в заместителе R2 Q2 обозначает необязательно замещенное пиридин-3-иловое кольцо, необязательно замещенное пиримидин-5-иловое кольцо, необязательно замещенное пиразин-2-иловое кольцо или необязательно замещенное пиридин-2-он-4-иловое кольцо.
5. Применение по любому из пп.1-4, отличающееся тем, что в заместителе R2 содержится Alk1, который представляет собой С1-С3алкиленовый радикал.
6. Применение по любому из пп.1-4, отличающееся тем, что в заместителе R2 содержится Alk1, который представляет собой С1-С3алкиленовый радикал, который включает группу -NH- или необязательно заканчивается группой -NH-, соединенной с Q2.
7. Применение по п.6, отличающееся тем, что Alk1 представляет собой С2-С3алкиленовый радикал, который заканчивается группой -NH-, соединенной с Q2, и который является оксозамещенным у атома С, смежного с указанной группой -NH-, так что Alk1 имеет формулу -(СН2)0-2C(=O)NH-.
8. Применение по п.6, отличающееся тем, что Alk1 имеет формулу -(CH2)1-2NHC(=O)-, причем (С=О) присоединен к Q2.
9. Применение по любому из пп.5-8, отличающееся тем, что в заместителе R2 Q1 обозначает группу формулы -NRARB, где RA и RB независимо обозначают водород или (С1-С6)алкил, гидрокси(С1-С6)алкил или (С1-С3)алкокси(С1-С3)алкил.
10. Применение по любому из пп.5-8, отличающееся тем, что в заместителе R2 Q1 обозначает группу формулы NRARB, где RA и RB, взятые вместе с атомом азота, образуют циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С1-С6алкил)пиперазинильного кольца.
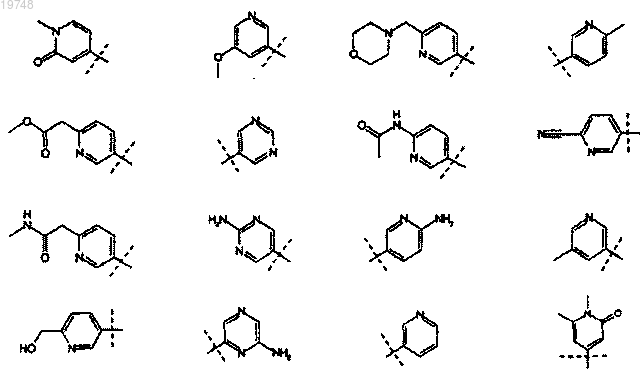
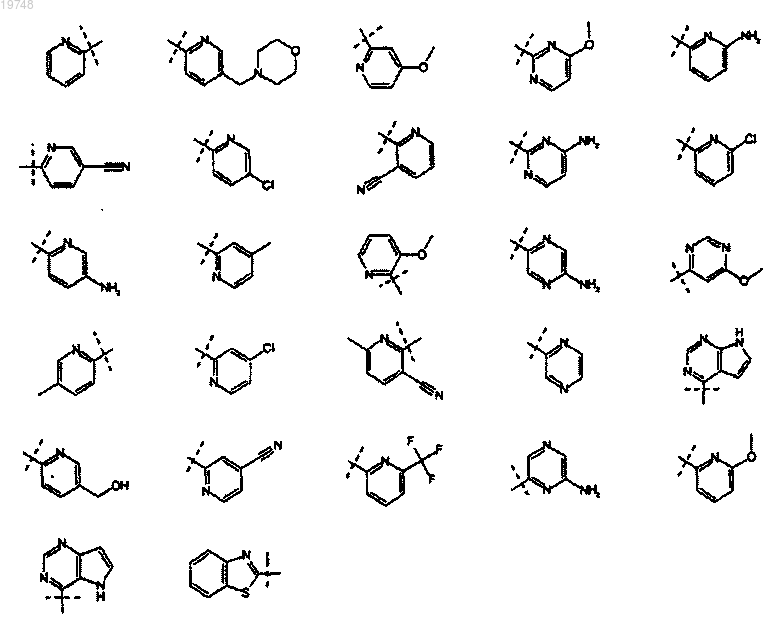
11. Применение по п.1 или 2, отличающееся тем, что заместитель R2 выбран из следующих радикалов:
12. Применение по любому из предыдущих пунктов, отличающееся тем, что в заместителе R3 q равен 1.
13. Применение по п.12, отличающееся тем, что в заместителе R3 p равен 1.
14. Применение по п.13, отличающееся тем, что в заместителе R3 Alk2 обозначает C1-С3алкиленовый радикал.
15. Применение по п.12, отличающееся тем, что в заместителе R3 Q4 обозначает водород и р равен 0.
16. Применение по любому из пп.12-15, отличающееся тем, что в заместителе R3 Q3 обозначает необязательно замещенное пиридиновое кольцо, необязательно замещенное пиримидиновое кольцо или необязательно замещенное пиразиновое кольцо.
17. Применение по любому из пп.12-15, отличающееся тем, что в заместителе R3 Q3 обозначает необязательно замещенное пиридин-2-иловое кольцо, необязательно замещенное пиримидин-2-иловое кольцо или необязательно замещенное пиразин-2-иловое кольцо.
18. Применение по любому из пп.1-11, отличающееся тем, что в заместителе R3 p и q равны 0 и Q4 выбран из галогена, -CONHRA, -NHCONHRB, где RA и RB обозначают водород или (С1-С6)алкил, гидрокси(С1-С6)алкил или (С1-С3)алкокси(С1-С3)алкильную группу.
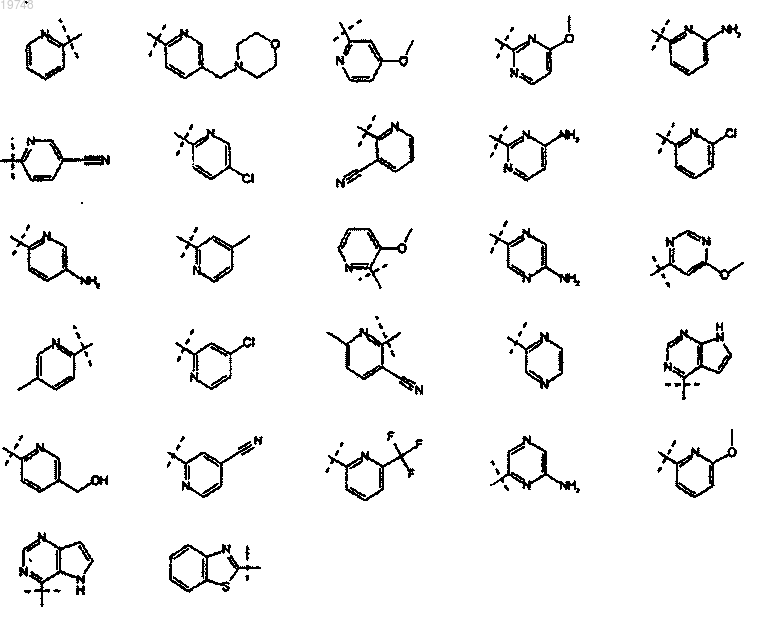
19. Применение по любому из пп.1-11, отличающееся тем, что заместитель R3 выбран из следующих радикалов:
20. Способ обработки или профилактики бактериального загрязнения субстрата, включающий нанесение на участок такого загрязнения или возможного загрязнения соединения (I) по любому из пп.1-19 в количестве, которое достаточно для ингибирования роста бактерий.
21. Способ лечения субъекта, страдающего от бактериальной инфекции, или профилактики бактериальной инфекции у субъекта, включающий введение указанному субъекту антибактериально эффективного количества соединения по любому из пп.1-19.
22. Соединение формулы (I), его соль, гидрат, сольват или N-окись
где m равен 1;
Q обозначает водород;
Alk обозначает -СН2СН2-;
X обозначает -С(=О)NH;
Z обозначает СН или CF;
R2 обозначает группу Q1-[Alk1]q-Q2, где
q равен 0 или 1;
Alk1 обозначает C1-С6алкилен, который может содержать аминогруппу -N(H)- или заканчиваться ей и который может быть оксозамещенным;
Q2 является необязательно замещенным и выбран из фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-10-членного бициклического гетероциклического радикала, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН3-, СН3О-, CN и NH2;
Q1 обозначает водород или заместитель, выбранный из С1-С3алкила, гидроксила или гидроксиС1-С3алкила, галогена, полностью или частично фторированного С1-С3алкила, C1-С3алкокси, С1-С3алкоксиС1-С3алкила, нитро, нитрила (-CN), оксо (=O), фенила, необязательно замещенного N(С1-С3алкил)2, 5-6-членного моноциклического гетероциклического радикала, необязательно замещенного (C1-С3)алкилом и содержащего 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы, циклоалкила, содержащего 3-6 атомов углерода в кольце, -COORA, -CORA, -CONRARB и -NRBCORA, где RA и RB независимо выбраны из водорода и С1-С3алкила, или Q1 представляет собой группу -NRARB, где RA и RB независимо выбраны из водорода, C1-С6алкила или (С1-С3)алкокси(С1-С3)алкила, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С1-С6алкил)пиперазинильного кольца;
R3 обозначает группу Q4-[Alk2]p-[Q3]q, где
р независимо равен 0 или 1;
q равен 1;
Alk2 обозначает C1-С6алкилен;
Q3 необязательно замещен и выбран из циклопропила, фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-членного бициклического гетероарила, содержащего 2-3 гетероатома, выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН3О-, -NH2, -CN, Cl, СН3- и CF3;
Q4 обозначает водород или заместитель, выбранный из С1-С3алкила, гидроксила, гидроксиС1-С3алкила, галогена, полностью или частично фторированного C1-С3алкила, C1-С3алкокси, нитрила (-CN), COORA, CONRARB, CONHNH2, NRBCORA, NRACONRARB, где RA и RB независимо обозначают водород или C1-С3алкил, или Q4 представляет собой группу формулы NRARB, в которой RA и RB, каждый независимо, представляют собой водород, С1-С6алкил, гидроксиС1-С3алкил или С1-С3алкоксиС1-С3алкил, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С1-С6алкил)пиперазинильного кольца.
23. Соединение по п.22, отличающееся тем, что Z обозначает СН.
24. Соединение по п.22 или 23, отличающееся тем, что Q2 обозначает необязательно замещенное пиридиновое, пиримидиновое кольцо или пиразиновое кольцо либо необязательно замещенное пиридин-2-оновое кольцо.
25. Соединение по любому из пп.22-24, отличающееся тем, что Q2 обозначает необязательно замещенное пиридин-3-иловое кольцо, необязательно замещенное пиримидин-5-иловое кольцо, необязательно замещенное пиразин-2-иловое кольцо или необязательно замещенное пиридин-2-он-4-иловое кольцо.
26. Соединение по любому из пп.22-25, отличающееся тем, что оно содержит Alk1, который обозначает C1-С3алкиленовый радикал.
27. Соединение по любому из пп.22-25, отличающееся тем, что оно содержит Alk1, который обозначает C1-С3алкиленовый радикал, включающий группу -NH- или необязательно заканчивающийся группой -NH-, присоединенной к Q2.
28. Соединение по п.27, отличающееся тем, что Alk1 обозначает С2-С3алкиленовый радикал, который заканчивается группой -NH-, присоединенной к Q2, и который является оксозамещенным у атома С, смежного с указанной группой -NH-, так что Alk1 имеет формулу -(СН2)0-2C(=O)NH-.
29. Соединение по п.27, отличающееся тем, что Alk1 имеет формулу -(CH2)1-2NHC(=O), причем (С=О) присоединена к Q2.
30. Соединение по любому из пп.26-29, отличающееся тем, что Q1 обозначает группу формулы -NRARB, где RA и RB независимо обозначают водород или (С1-С6)алкил, гидрокси(С1-С6)алкил или (С1-С3)алкокси(С1-С3)алкил.
31. Соединение по любому из пп.26-29, отличающееся тем, что Q1 обозначает группу формулы -NRARB, где RA и RB, взятые вместе в атомом азота, образуют циклическое аминосодержащее кольцо, выбранное из морфолинилового, пиперидинилового, пиперазинилового или 4-(С1-С6)алкилпиперазинилового кольца.
32. Соединение по п.22 или 23, отличающееся тем, что заместитель R2 выбран из следующих радикалов:

33. Соединение по любому из пп.22-32, отличающееся тем, что р равен 1.
34. Соединение по п.33, отличающееся тем, что Alk2 обозначает C1-С3алкиленовый радикал.
35. Соединение по любому из пп.22-32, отличающееся тем, что Q4 обозначает водород и р равен 0.
36. Соединение по любому из пп.33-35, отличающееся тем, что Q3 обозначает необязательно замещенное пиридиновое кольцо, необязательно замещенное пиримидиновое кольцо или необязательно замещенное пиразиновое кольцо.
37. Соединение по любому из пп.33-35, отличающееся тем, что Q обозначает необязательно замещенное пиридин-2-иловое кольцо, необязательно замещенное пиримидин-2-иловое кольцо или необязательно замещенное пиразин-2-иловое кольцо.
38. Соединение по любому из пп.22-32, отличающееся тем, что R3 выбран из следующих радикалов:
39. Соединение по п.22 или 23, отличающееся тем, что m равен 1, Q обозначает водород, Alk обозначает -СН2-СН2-, X обозначает -C(O)NH-, R2 обозначает радикал, выбранный из указанных в п.32, и R3 обозначает радикал, выбранный из указанных в п.38.
40. Антибактериальная композиция, содержащая соединение по любому из пп.22-39 вместе с фармацевтически приемлемым носителем.
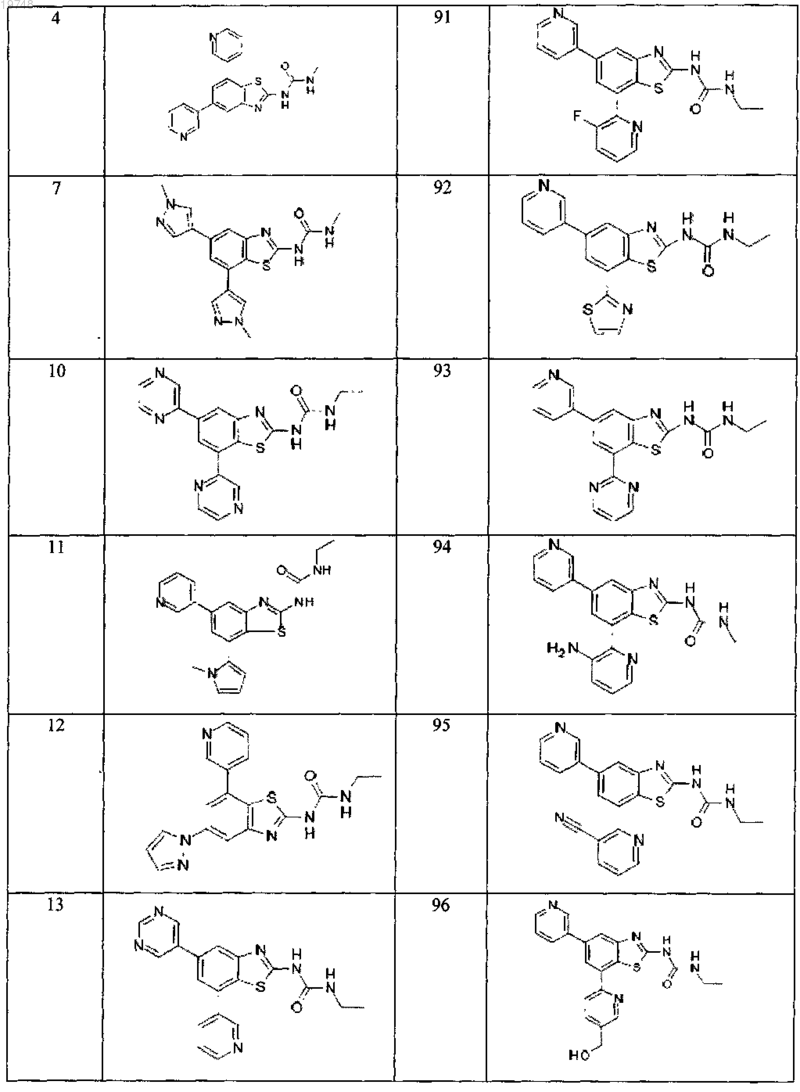
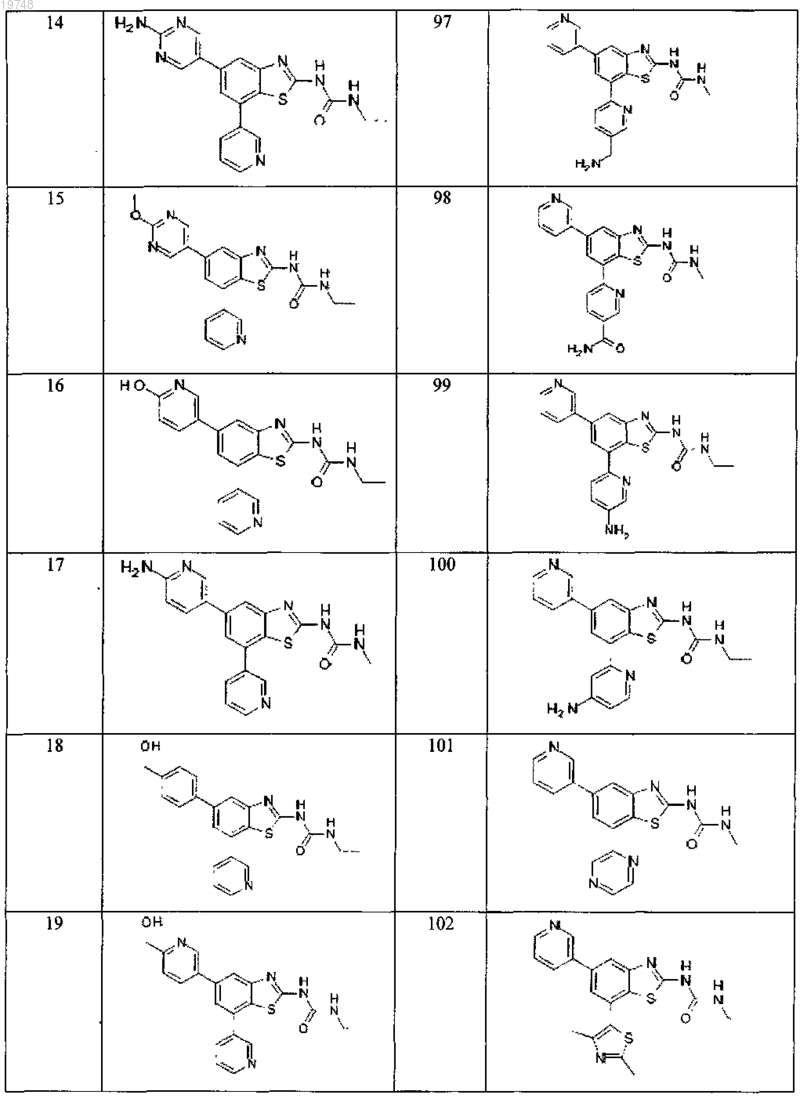
41. Соединение, выбранное из группы, состоящей из

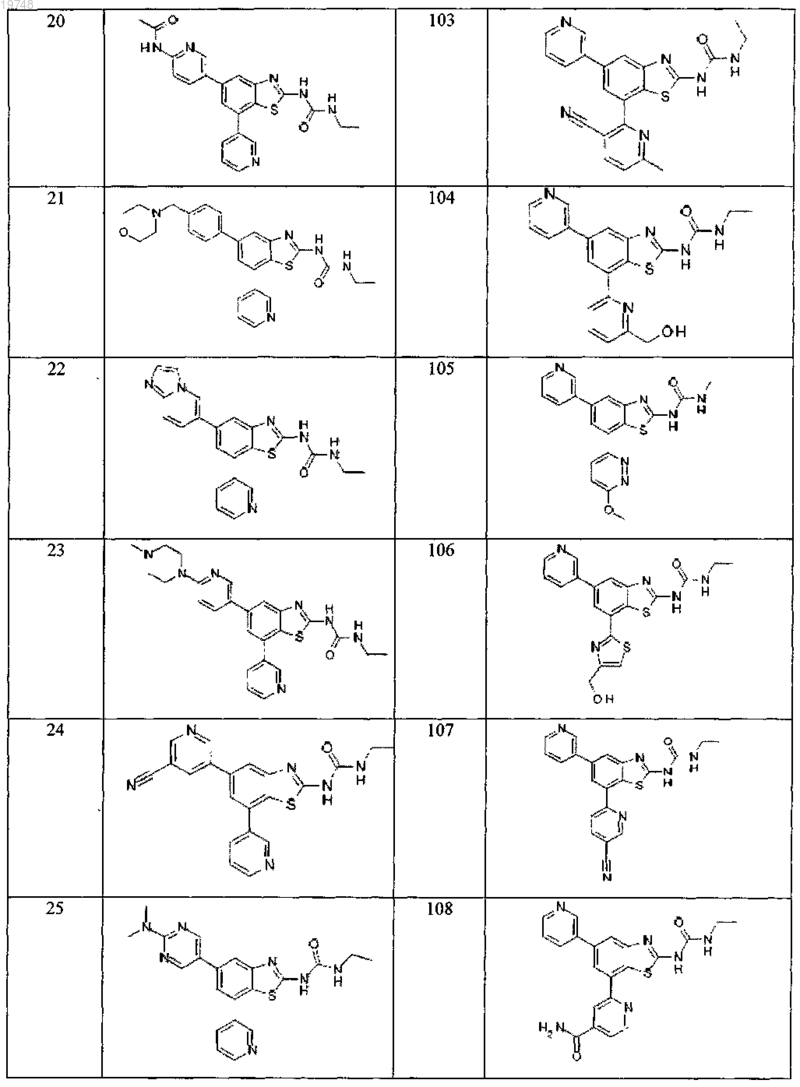
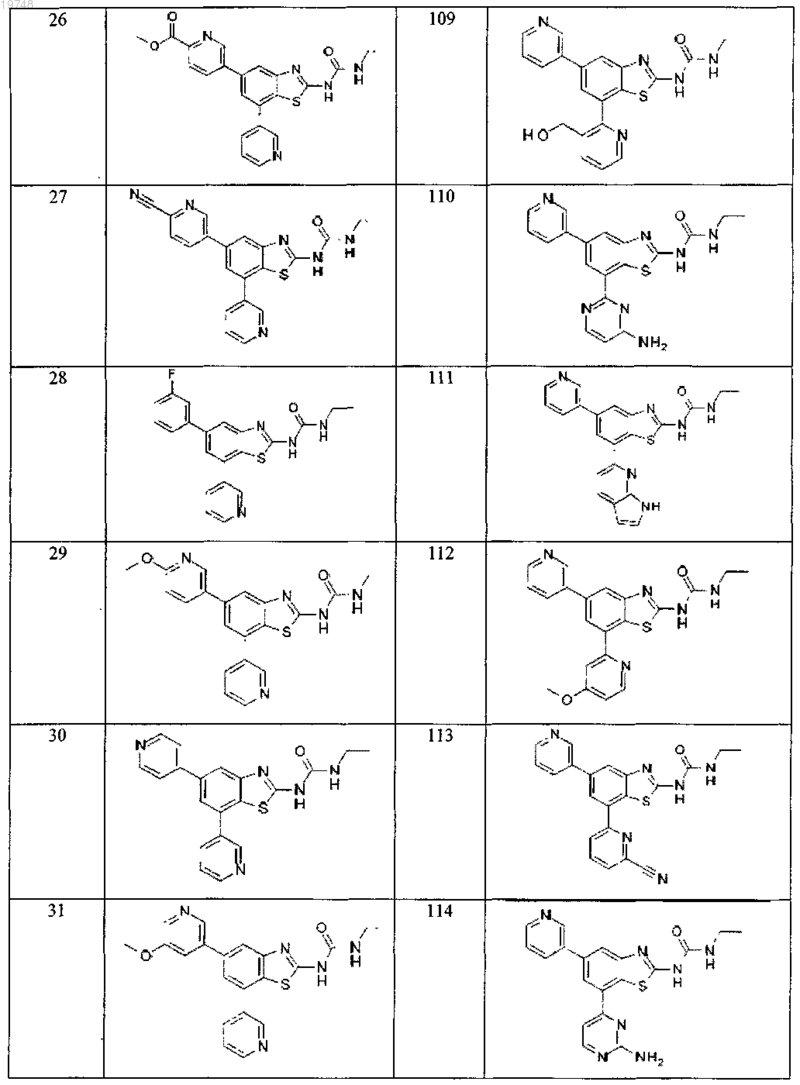
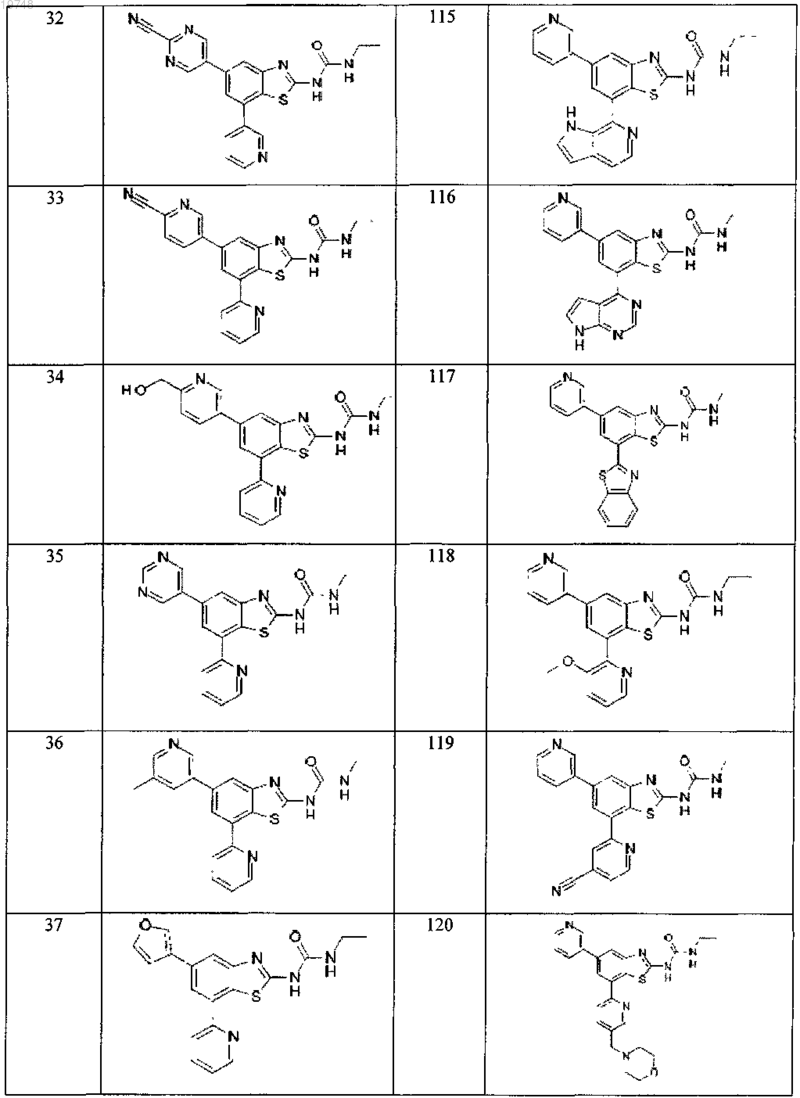
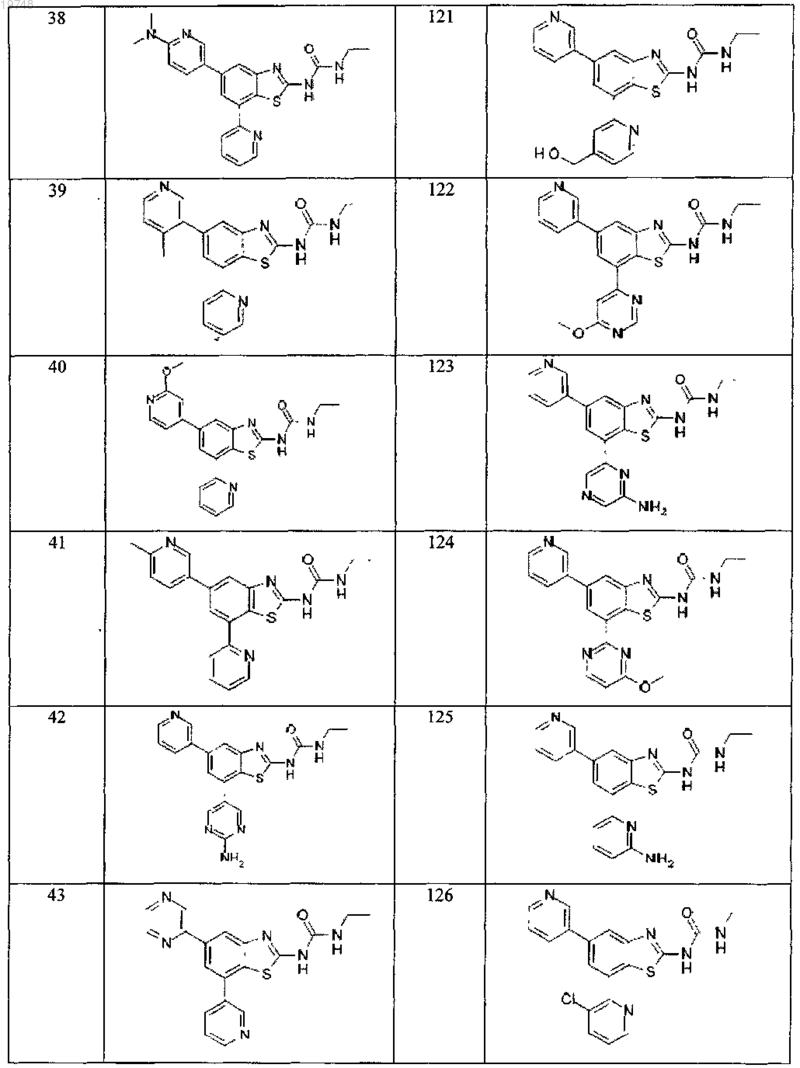
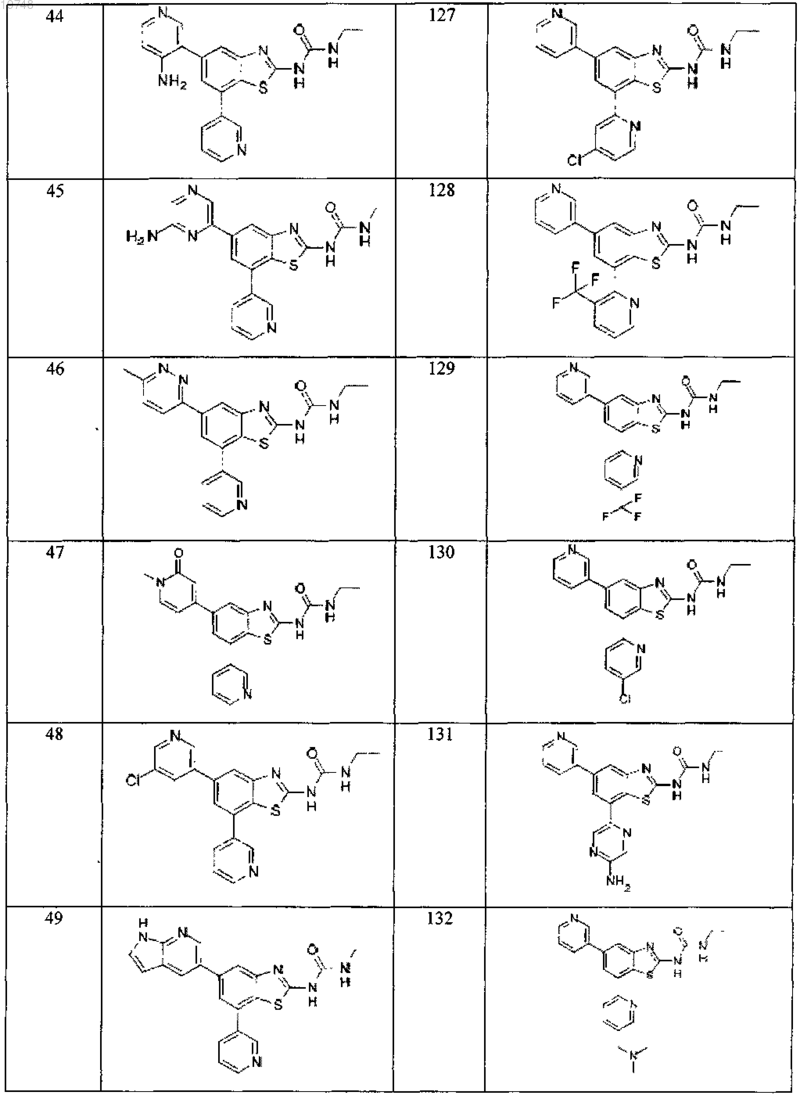
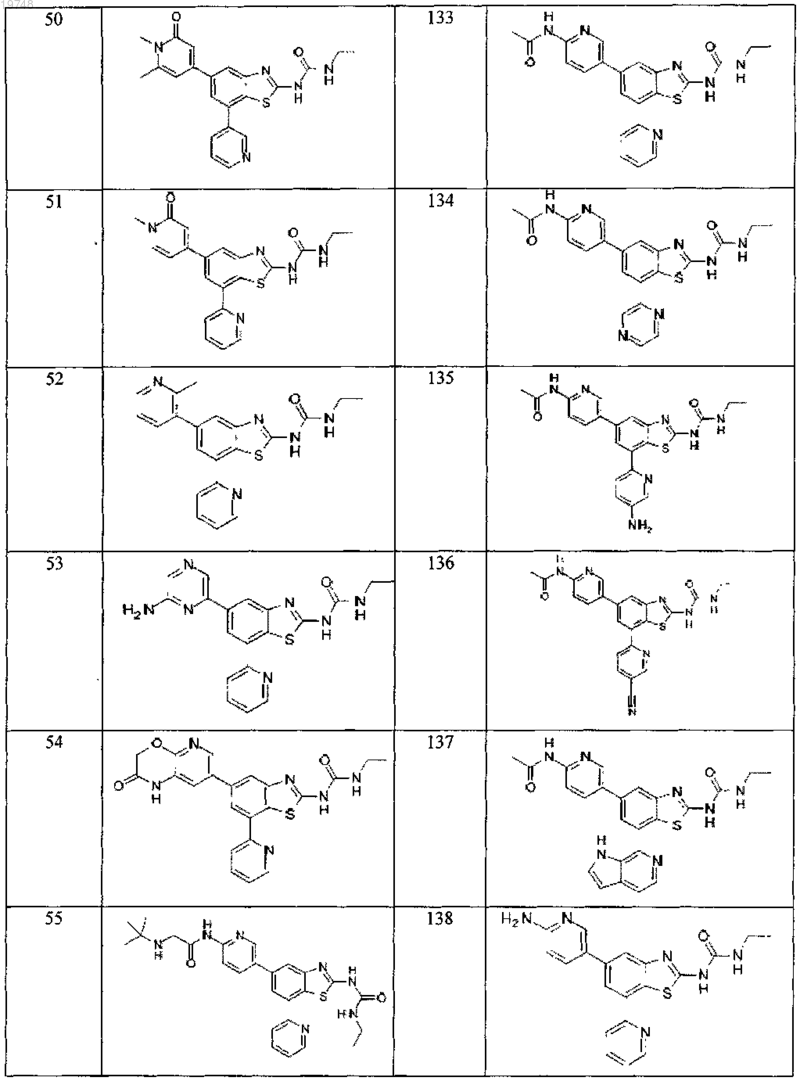
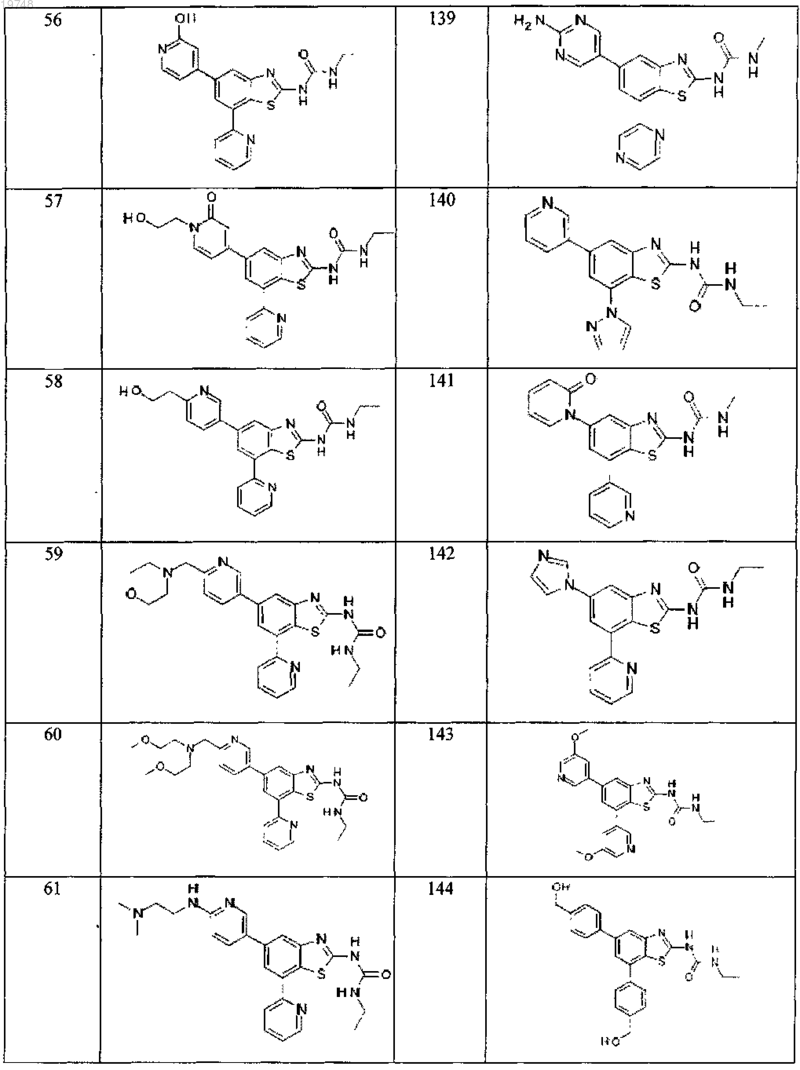
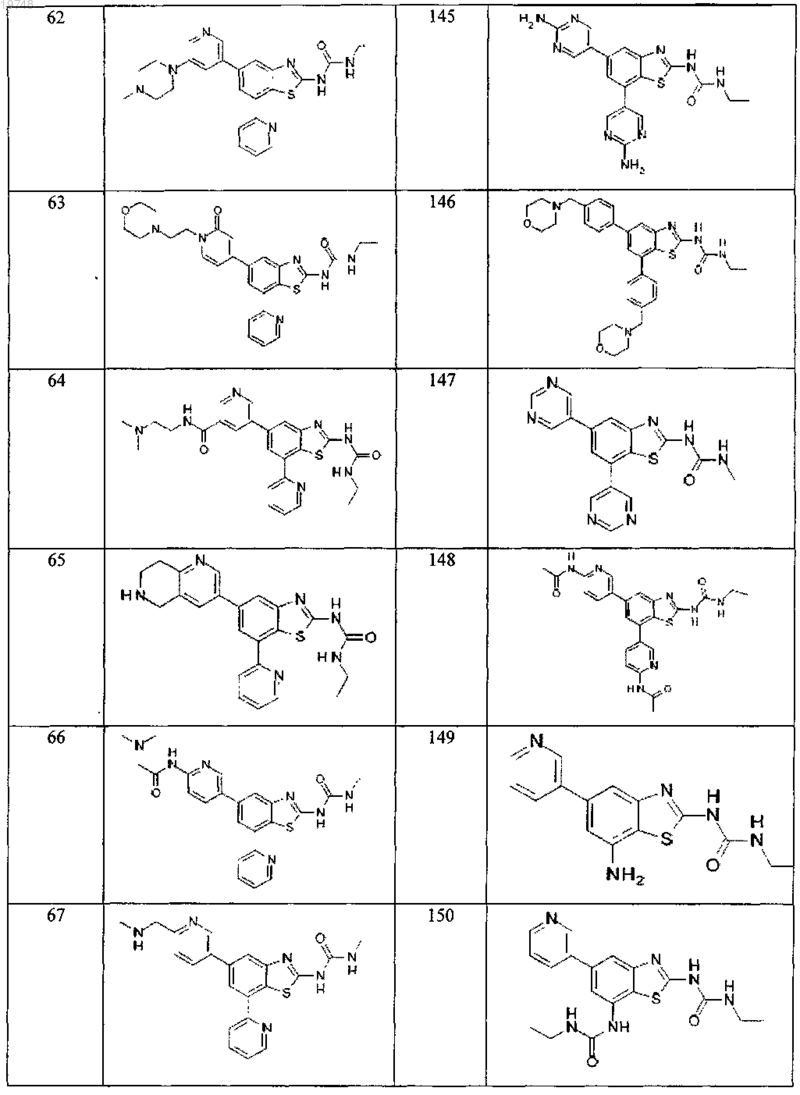

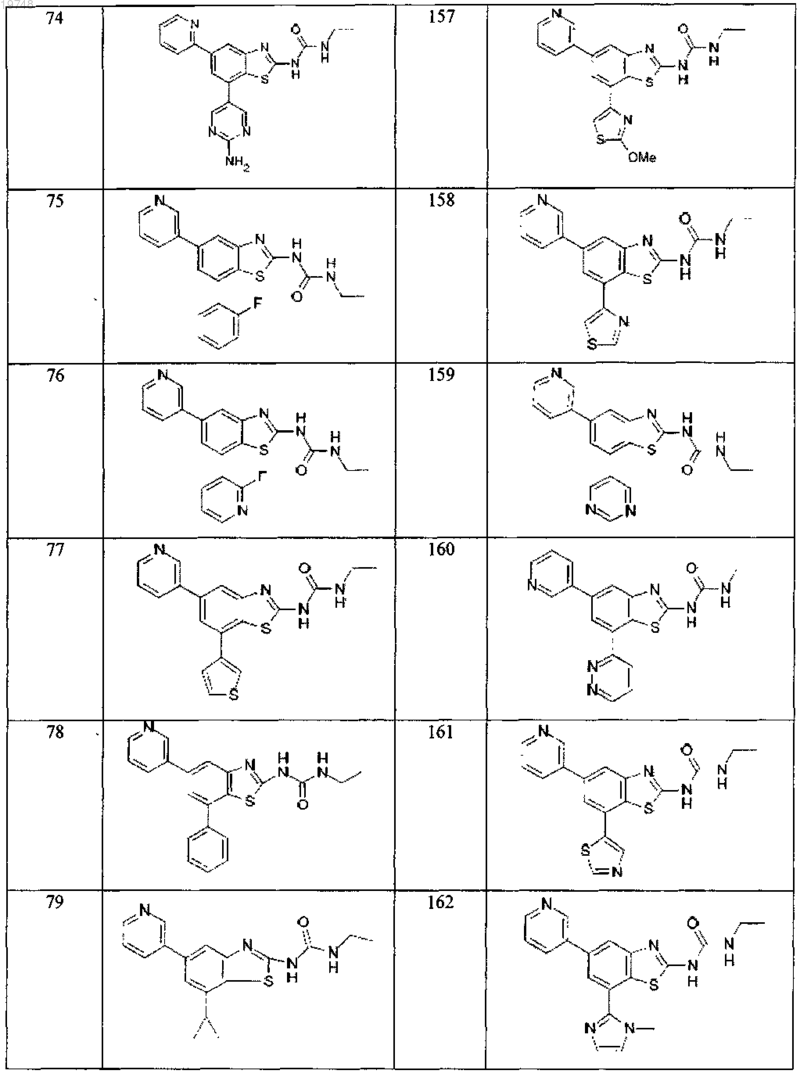
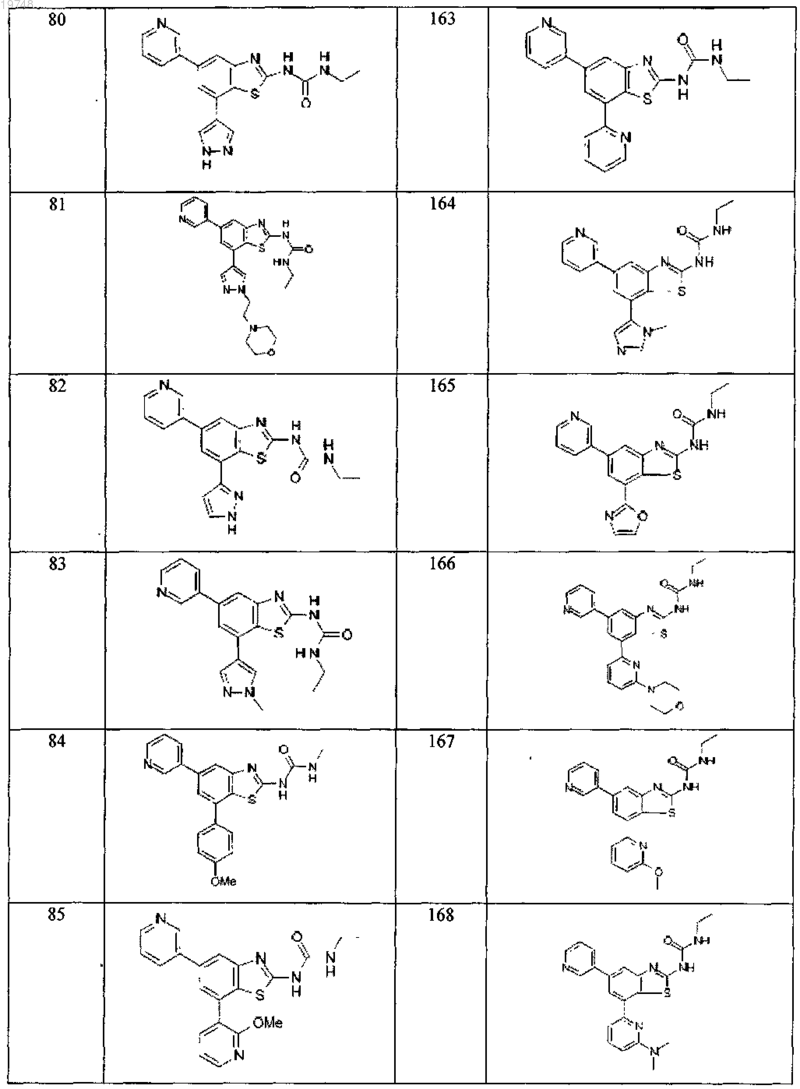
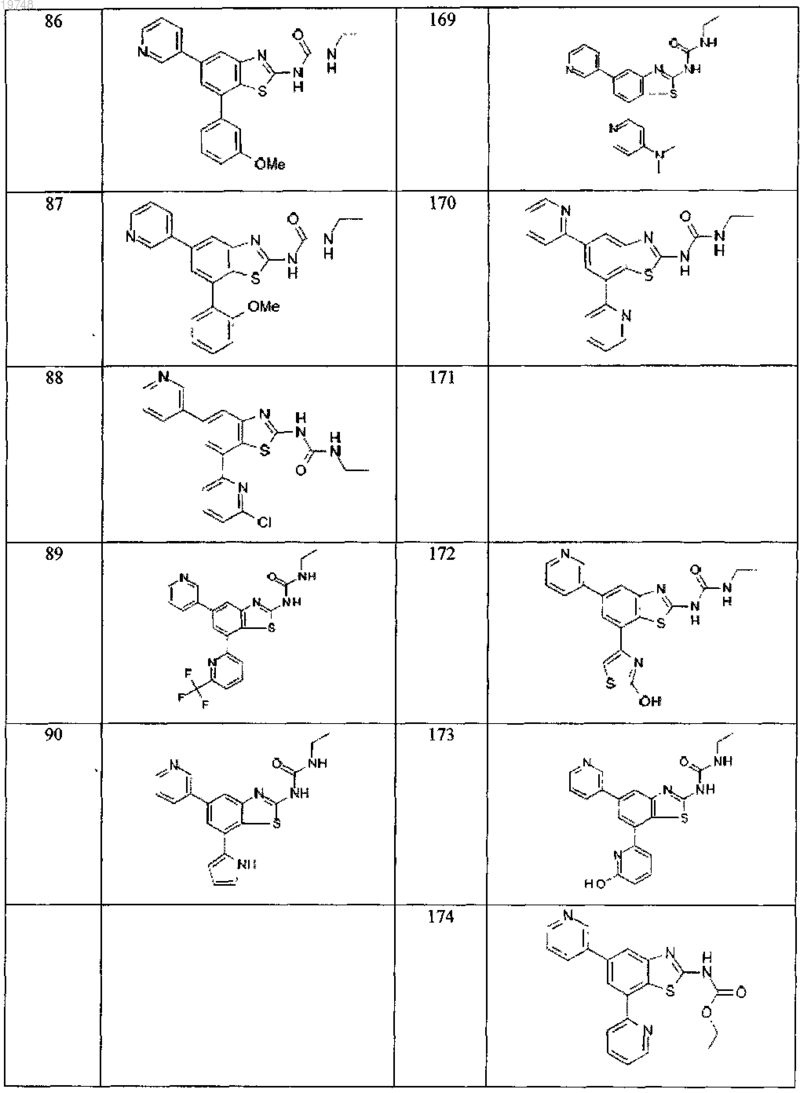
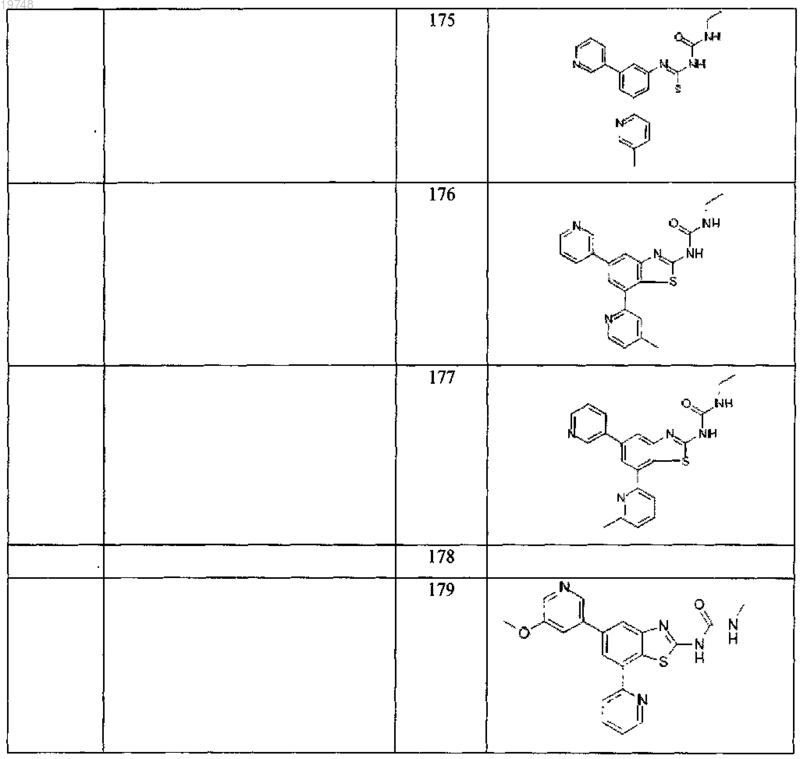
Текст
(71)(73) Заявитель и патентовладелец: БИОТА ЮРОП ЛИМИТЕД (GB) Область техники, к которой относится изобретение Данное изобретение относится к замещенным бензотиазолам, которые могут применяться в качестве антибактериальных агентов. Сведения о предшествующем уровне техники Топоизомеразы типа II катализируют взаимное превращение топоизомеров ДНК путем транспорта одного сегмента ДНК через другой. Бактерии кодируют два вида ферментов топоизомеразы II, ДНКгиразу и ДНК топоизомеразу IV. Гираза контролирует сверхскручивание ДНК и облегчает топологический стресс. Топоизомераза декатенирует последующую репликацию дочерних хромосом и может ослаблять сверхскручивание ДНК. Топоизомеразы типа II бактериального типа образуют гетеротетромерный комплекс, который состоит из двух подъединиц. Гираза образует комплекс А 2 В 2, состоящий из Gyr А и Gyr В, в то время как топоизомераза образует комплекс С 2 Е 2, состоящий из Par С и Par E. В противоположность этому топоизомеразы II эукариотного происхождения являются гомодимерами. В идеале,антибиотик, действие которого основано на ингибировании топоизомераз бактериального типа, будет селективным в отношении бактериальных ферментов, а также будет сравнительно неактивным в отношении изомераз типа II эукариотного происхождения. Топоизомеразы типа II являются высококонсервативными ферментами, что позволяет создать ингибиторы широкого спектра действия. Далее, подъединицы Gyr В и Par Е являются функционально подобными, имея домен АТР-азы в N-концевом участке и С-концевом участке, который взаимодействует с другой подъединицей (Gyr А и Par С соответственно) и ДНК. Консервативность активных сайтов гиразы и топоизомеразы IV позволяет предположить, что ингибиторы этих сайтов могут быть одновременно нацелены (таргетированы) на обе топоизомеразы типа II. Такие ингибиторы двойной направленности представляют интерес, так как они обладают возможностью уменьшать развитие резистентности, основанной на таргетировании. Топоизомеразы типа II являются мишенью для ряда антибактериальных агентов. Наиболее эффективными из этих агентов являются хинолоны. Первоначальные хинолоновые антибиотики включали налидиксовую кислоту, циноксацин и оксолиновую кислоту. Введение фтора привело к созданию нового класса лекарств, фторхинолонов, которые обладают более широким спектром антимикробного действия и улучшенными фармакокинетическими свойствами. Фторхинолоны включают норфлокацин, ципрофлоксацин и хинолоны четвертого поколения, гатифлоксацин и моксифлоксацин. Кумарины и циклотиалидины являются дальнейшими классами антибиотиков, которые ингибируют топоизомеразы типа II,однако они не нашли широкого применения из-за плохой проницаемости в бактерии, эукариотной токсичности и низкой растворимости в воде. Примеры таких антибиотиков включают новобиоцин и кумермицин А 1, циклотиалидин, цинодин и клероцидин. Постоянное возникновение резистентности к антибиотикам требует, чтобы разрабатывались новые классы антибиотиков. В заявках WO 02/060879, WO 03/105846 и WO 2005/012292 описаны бензимидазольные и пиридоимидазольные соединения, которые ингибируют активность бактериальной гиразы. Однако потребность в альтернативных соединениях, которые ингибируют бактериальные топоизомеразы, остается. Сущность изобретения Данное изобретение основано на том, что, как было обнаружено, класс замещенных бензотиазолов обладает антибактериальной активностью, о чем свидетельствует ингибирование бактериального роста членами этого класса. Соединения обладают активностью в отношении штаммов грамм-положительных,грамм-отрицательных и атипичных бактерий, таких как стафилококки, энтерококки, стрептококки, гемофиллы, моракселлы, хламидофиллы, легионеллы и микоплазмы, например Staphylococcus aureus,Staphylococcus epidermidis, Enterococcus faecalis, Enterococcus faecium, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae, Moraxella catarrhalis, Chlamydophila pneumonia, Legionella pneumonia и Mycoplasma pneumonia. Соединения, которых касается данное изобретение, являются, следовательно, пригодными для лечения бактериальной инфекции или загрязнения, например, для лечения, наряду с прочими, грамм-положительных инфекций и приобретенной пневмонии. Хотя изобретение не ограничено какой-либо конкретной гипотезой, касающейся механизма действия соединений, в настоящее время считают, что такая активность обусловлена, по меньшей мере частично, соединениями, ингибирующими бактериальные топоизомеразы типа II. Таким образом, изобретение охватывает антибактериальное применение класса замещенных бензотиазольных соединений, описанных в данном изобретении, и новые члены этого класса соединений. Международная заявка WO 2001/057008 относится к бензотиазолам, пригодным для лечения рака и состояний, при которых важным механизмом является ангиогенез. Это изобретение не описывает и не подразумевает, что соединения, которых она касается, обладают антибактериальной активностью и не раскрывает замещенные бензотиазолы, заявленные в данном изобретении. Сведения, подтверждающие возможность осуществления изобретения Согласно данному изобретению предусмотрено применение соединения формулы (I) или его соли,гидрата, сольвата или N-окиси для приготовления антибактериальной композиции:Z обозначает СН или CF;Alk1 обозначает С 1-С 6 алкилен, который может содержать аминогруппу -N(H)- или заканчиваться ей и который может быть оксозамещенным;Q2 является необязательно замещенным и выбран из фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-10 членного бициклического гетероциклического радикала, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН 3-, СН 3 О-, CN и NH2;Q1 обозначает водород или заместитель, выбранный из C1-С 3 алкила, гидроксила, гидроксиС 1-3-алкила, галогена, полностью или частично фторированного С 1-С 3 алкила, С 1-С 3 алкокси, C1-С 3 алкоксиС 1 С 3 алкила, нитро, нитрила (-CN), оксо (=O), фенила, необязательно замещенного N(С 1-С 3 алкил)2, 5-6 членного моноциклического гетероциклического радикала, необязательно замещенного (C1-С 3)алкилом и содержащего 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы, циклоалкила,содержащего 3-6 атомов углерода в кольце, -COORA, -CORA, -CONRARB и -NRBCORA, где RA и RB независимо выбраны из водорода, C1-6 алкилазалкила, или Q1 представляет собой группу -NRARB, где RA и RB независимо выбраны из водорода, C1-С 6 алкила, гидроксиС 1-С 6 алкила или (C1-С 3)алкокси(С 1-С 3)алкила,или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С 1-С 6 алкил)пиперазинильного кольца;Q3 является необязательно замещенным и выбран из циклопропила, фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-членного бициклического гетероарила, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН 3 О-, -NH2, -CN, Cl,СН 3- и CF3;Q4 обозначает водород или заместитель, выбранный из C1-С 3 алкила, гидроксила, гидроксиС 1 С 3 алкила, галогена, полностью или частично фторированного С 1-С 3 алкила, C1-С 3 алкокси, нитрила (-CN),COORA, CONRARB, CONHNH2, NRBCORA, NRACONRARB, где RA и RB независимо обозначают водород или С 1-С 3 алкил, или Q4 представляет собой группу NRARB, в которой RA и RB независимо обозначают водород, C1-С 6 алкил, гидроксиС 1-С 6 алкил или С 1-С 3 алкоксиС 1-С 3 алкил, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С 1-С 6 алкил)пиперазинильного кольца. Согласно другим аспектам данное изобретение включает:(i) способ лечения субъекта, страдающего от бактериальной инфекции, или способ профилактики бактериальной инфекции у субъекта, включающие введение субъекту количества соединения (I), определенного выше, достаточного для ингибирования роста бактерий;(ii) способ обработки или профилактики бактериального загрязнения субстрата, включающий нанесение на участок такого загрязнения или возможного загрязнения количества соединения (I), определенного выше, достаточного для ингибирования роста бактерий;(iv) соединение (I), определенное выше, для применения в способе лечения или профилактики бактериальной инфекции. Соединения формулы (I), описанные выше, но при q равном 1 в заместителе R3, и их соли, гидраты,сольваты или N-окиси считаются новыми per se и образуют другой аспект настоящего изобретения. Конкретно, такие соединения, где Q2 обозначает возможно замещенное пиридиновое, пиримидиновое или пиразиновое или возможно замещенное пиридин-2-оновое кольцо, также образуют один из объектов данного изобретения. Терминология. Используемый в данном изобретении термин "(Са-Cb)алкил", где а и b являются целыми числами,относится к линейному или разветвленному алкильному радикалу, содержащему от "а" до "b" атомов углерода. Так, например, когда "а" равен 1 и "b" равен 6, этот термин включает метил, этил, н-пропил,изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Применяемый в данном изобретении термин "двухвалентный (Са-Cb)алкиленовый радикал", где а иb являются целыми числами, относится к насыщенной углеводородной цепи, содержащей от "а" до "b" атомов углерода и две ненасыщенные валентности. Этот термин включает, например, метилен, этилен, нпропилен и н-бутилен. Термин "карбоциклический" относится к моно-, ди- или трициклическому радикалу, содержащему до 16 атомов в кольце, все из которых являются атомами углерода, и охватывает арил и циклоалкил. Используемый термин "циклоалкил" относится к моноциклическому насыщенному карбоциклическому радикалу, содержащему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил,циклопентил, циклогексил, циклогептил, циклооктил и бицикло[2.2.1]-гепт-1-ил. Используемый в данном изобретении не узаконенный термин "арил" относится к моно-, ди- или трициклическому карбоциклическому ароматическому радикалу и охватывает радикалы, содержащие два моноциклических карбоциклических ароматических кольца, которые непосредственно связаны ковалентной связью. Примерами таких радикалов являются фенил, дифенил и нафтил. Применяемый также не узаконенный термин "гетероарил" относится к моно-, ди- или трициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N или О,и включает радикалы, содержащие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно связаны ковалентной связью. Примерами таких радикалов являются тиенил, бензотиенил, фурил, бензофурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил,бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил,оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Используемый также не узаконенный термин "гетероциклил" или "гетероциклический" включает"гетероарил", определение которого дано выше, и в его неароматическом значении относится к моно-,ди- или трициклическому неароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N или О, и к группам, состоящим из моноциклического неароматического радикала, содержащего один или более таких гетероатомов, который ковалентно связан с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Примерами таких радикалов являются азетидинил, пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензофуранил, пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидная и сукцинимидная группы. Если иное не оговорено в контексте описания, термин "замещенный", относящийся к любому заместителю, означает группу, замещенную совместимыми заместителями в количестве до четырех, каждый из которых независимо может представлять собой, например, (С 1-С 6)алкил, (С 2-С 6)алкенил, (C2 С 6)алкинил, (C1-С 6)алкокси, гидрокси, гидрокси(С 1-С 6)алкил, (C1-С 3)алкокси(C1-C3)алкил, меркапто,меркапто(С 1-С 6)алкил, (C1-С 6)алкилтио, галоид (включая фтор, бром и хлор), полностью или частично фторированный (С 1-С 3)алкил, (С 1-С 3)алкокси или (C1-С 3)алкилтио, такие как трифторметил, трифторметокси и трифторметилтио, нитро, нитрил (CN), оксо (=O), фенил, фенил(С 1-С 3)алкил, фенокси, моноциклический гетероарил, гетероарил(С 1-С 3)алкил или гетероарилкоси с 5 или 6 атомами в кольце, циклоалкил, содержащий в кольце 3-6 атомов углерода, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB,-CONHNH2, -SO2NRARB, NRARB, -NHNH2, -OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или-NRACONRARB, где RA и RB независимо обозначают водород или (С 1-С 6)алкил, гидрокси(C1-С 6)алкил или(C1-С 3)алкокси(С 1-С 3)алкил, или в случае, когда RA и RB присоединены к одному и тому же атому N, RA иRB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, такое как морфолинил, пиперидинил, пиперазинил, или 4-(С 1-С 6)алкилпиперазинил, такой как 4 метилпиперазинил. Когда заместитель представляет собой фенил, фенил(C1-С 3)алкил, фенокси или моноциклический гетероарил, гетероарил(С 1-С 3)алкил или гетероарилокси с 5 или 6 атомами в кольце, этот фенил или гетероарильное кольцо сами по себе могут быть замещены любым из указанных выше заместителей, за исключением фенила, фенил(C1-С 3)алкила, фенокси, гетероарила, гетероарил(С 1-С 3)алкила или гетероарилокси. "Возможный заместитель" или "заместитель" могут быть одной из указанных выше конкретных групп. Применяемый в данном изобретении термин "соль" включает соли присоединения оснований, соли присоединения кислот и четвертичные соли. Соединения по изобретению, которые являются кислыми,могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроокиси щелочных металлов, например гидроокиси натрия и калия, гидроокиси щелочно-земельных металлов, например гидроокиси кальция, бария и магния; с органическими основаниями, например Nметил-D-глюкамином, холином, трис-(гидроксиметил)аминометаном, L-аргинином, L-лизином, Nэтилпиперидином, дибензиламином и т.п. Те соединения формулы (I), которые являются основными,могут образовать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например с галоидводородными кислотами, такими как соляная или бромисто-водородная кислоты, серная кислота, азотная кислота или фосфорная кислота и т.п., и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфокислотой, п-толуолсульфокислотой, бензойной, бензосульфокислотой, глутаминовой, молочной и миндальной кислотами и т.п. Обзор подходящих солей см. в Handbook of Pharmaceutical Salts: Properties, Selection andUse by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Термин "сольват" применяется для описания молекулярного комплекса, содержащего соединение по изобретению и стехиометрическое количество одного или более фармацевтически приемлемых растворителей, например этанола. Термин "гидрат" применяется, когда указанным растворителем является вода. Соединения по изобретению, которые содержат один или более действительных или возможных хиральных центров вследствие наличия асимметричных атомов углерода, могут существовать в виде ряда диастереоизомеров с R- или S-стереохимией у каждого хирального центра. Данное изобретение охватывает все такие диастереоизомеры и их смеси. Структурные признаки. Соединения, которых касается данное изобретение, имеют, например, следующие признаки в любой совместимой комбинации.Z обозначает СН или CF. Предпочтительно, чтобы Z обозначал СН, тогда соединения формулы (I) являются замещенными бензотиазолами.R3 обозначает группу Q4-[Alk2]p-[Q3]q, но не водород. По некоторым вариантам q равен 1 и р равен 0 или 1. Согласно другим вариантам q равен 0 и р равен 0 или 1. Если Alk2 имеется (то есть "р" равен 1), он обозначает двухвалентный С 1-С 6 алкилен, например -СН 2, -СН 2 СН 2-, -CH2CH2CH2-. Предпочтительно,чтобы он обозначал двухвалентные С 1-С 3 алкиленовые радикалы. Если содержится Q3, он является необязательно замещенным и выбран из циклопропила, фенила, 56-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 9-членного бициклического гетероарила, содержащего 2-3 гетероатома,независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН 3 О-, -NH2, -CN, Cl, СН 3- и CF3 Примеры таких радикалов включают возможно замещенные тиенил,бензотиенил, фурил, бензфурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил,пиразинил, триазинил, индолил, индазолил, азетидинил, пирролил, фуранил, тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, пиперидинил, пиперазинил, индолил, морфолинил, бензфуранил, пиранил, изоксазолил, бензимидазолил, циклопропил, циклобутил, циклопентил, циклогексил, фенил и нафтил.Q4 обозначает водород или необязательный заместитель, выбранный из C1-С 3 алкила, гидроксила,гидроксиС 1-С 3 алкила, галогена, полностью или частично фторированного С 1-С 3 алкила, C1-С 3 алкокси,нитрила (-CN), COORA, CONRARB, CONHNH2, NRBCORA, NRACONRARB, где RA и RB независимо обозначают водород или С 1-С 3 алкил, или Q4 представляет собой группу NRARB, в которой RA и RB независимо обозначают водород, C1-С 6 алкил, гидроксиС 1-С 6 алкил или С 1-С 3 алкоксиС 1-С 3 алкил, или RA и RB,взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С 1-С 6 алкил)пиперазинильного кольца. Предпочтительно, чтобы в соединении содержался Q3 (то есть q был равен 1), в таких случаях Q3 может обозначать, например, возможно замещенное пиридиновое кольцо, возможно замещенное пиримидиновое кольцо или возможно замещенное пиразиновое кольцо, например возможно замещенный пиридин-2-ил, возможно замещенный пиримидин-2-ил или возможно замещенный пиразин-2-ил. Возможные заместители в Q3 включают СН 3 О-, -NH2, -CN, Cl, СН 3- и -CF3. По вариантам, где р и q, каждый, равны 0, Q4 может быть одним из возможных заместителей, указанных выше, например галоидом, таким как хлор или бром, -CONHRA, -NHCONHRB, где RA и RB обозначают водород или (C1-C6)алкил, гидрокси(С 1-С 6)алкил или (C1-С 3)алкокси(С 1-С 3)алкил.R2 обозначает группу Q1-[Alk1]q-Q2. Если Alk1 содержится, он обозначает C1-С 6 алкилен, который может содержать аминогруппу -N(H)или заканчиваться ей и который может быть оксозамещенным. Примеры таких радикалов включаютQ2 необязательно может быть замещенным и выбран из фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 910-членного бициклического гетероциклического радикала, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН 3-, СН 3 О-,CN и NH2. Примеры таких радикалов включают указанные выше при описании значений радикала Q3.Q1 обозначает водород или необязательный заместитель, выбранный из C1-С 3 алкила, гидроксила,гидроксиС 1-3-алкила, галогена, полностью или частично фторированного С 1-С 3 алкила, C1-С 3 алкокси, С 1 С 3 алкоксиС 1-С 3 алкила, нитро, нитрила (-CN), оксо (=O), фенила, необязательно замещенного N(С 1 С 3 алкил)2, 5-6-членного моноциклического гетероциклического радикала, необязательно замещенного(C1-С 3)алкилом и содержащего 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы, циклоалкила, содержащего 3-6 атомов углерода в кольце, -COORA, -CORA, -CONRARB и-NRBCORA, где RA и RB независимо выбраны из водорода, С 1-3-алкила, или Q1 представляет собой группу-NRARB, где RA и RB независимо выбраны из водорода, C1-С 6 алкила, гидроксиС 1-С 6 алкила или (С 1 С 3)алкокси(С 1-С 3)алкила, или RA и RB, взятые вместе с этим атомом азота, могут образовать циклическое аминосодержащее кольцо, выбранное из морфолинила, пиперидинила, пиперазинила или 4-(С 1 С 6 алкил)пиперазинильного кольца. Примеры таких радикалов включают указанные выше при описании значений радикала Q4. В группе R2 Q2 является необязательно замещенным и выбран из фенила, 5-6-членного моноциклического гетероарила, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы,или 9-10-членного бициклического гетероциклического радикала, содержащего 2-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем необязательные заместители выбраны из СН 3-,СН 3 О-, CN и NH2. Предпочтительные кольца Q2 включают возможно замещенные пиридин, пиримидин,пиразин или пиридин-2-он, такой как возможно замещенное пиридин-3-ильное кольцо, пиримидин-5 ильное кольцо, возможно замещенное пиразин-2-ильное кольцо или возможно замещенное пиридин-2 он-4-ильное кольцо. В группе R2 q равен 0 или 1. Когда q равен 1, Alk1 содержится в соединении и может быть двухвалентным C1-С 6-алкиленовым радикалом, который может включать группу NH, или возможно заканчиваться группой -NH-, соединенной с Q2. В конкретном случае Alk1 является двухвалентным С 2 С 3 алкиленовым радикалом, который заканчивается группой -NH-, присоединенной к Q2, и который является оксозамещенным у атома С, смежного с этой группой -NH-, при этом Alk1 имеет формулу-(СН 2)0-2C(=O)NH-. В других случаях Alk1 имеет формулу -(CH2)1-2NHC(=O)- с группой (С=О), связанной с Q2. В группе R2 Q1 может быть, например, водородом или необязательным заместителем, выбранным из C1-С 3 алкила, гидроксила, гидроксиС 1-3-алкила, галогена, полностью или частично фторированного C1 С 3 алкила, C1-С 3 алкокси, С 1-С 3 алкоксиС 1-С 3 алкила, нитро, нитрила (-CN), оксо (=O), фенила, необязательно замещенного N(C1-С 3 алкил)2, 5-6-членного моноциклического гетероциклического радикала, необязательно замещенного (С 1-С 3)алкилом и содержащего 1, 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы, циклоалкила, содержащего 3-6 атомов углерода в кольце, -COORA, -CORA,-CONRARB и -NRBCORA, где RA и RB независимо выбраны из водорода, C1-3-алкила, или Q1 представляет собой группу -NRARB, где RA и RB независимо выбраны из водорода, C1-С 6 алкила, гидроксиС 1-С 6 алкила или (Q-С 3)алкокси(С 1-С 3)алкила, или RA и RB, взятые вместе с этим атомом азота, могут образовать цик-5 019748 Применение и композиции. Как упомянуто выше, соединения, которых касается данное изобретение, являются антимикробными агентами и поэтому могут применяться как топические антибактериальные дезинфектанты или при лечении микробной инфекции у людей и животных, например других млекопитающих, птиц и рыб. Поскольку целевая топоизомеразы типа II, являющаяся мишенью соединений по изобретению, представляет собой универсальный бактериальный фермент, соединения по изобретению ингибируют рост различных видов бактерий, являющихся грамм-положительными и грамм-отрицательными и атипичными бактериями, такими как стафилококки, энтерококки, стрептококки, гемофиллы, моракселлы, хламидофиллы,легионеллы и микоплазмы, например Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis, Enterococcus faecium, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae,Moraxella catarrhalis, Chlamydophila pneumonia, Legionella pneumonia и Mycoplasma pneumonia. Соединения, которых касается данное изобретение, являются, следовательно, пригодными для лечения бактериальной инфекции или бактериального загрязнения, например, на ряду с прочим, для лечения инфекций,вызванных грамм-положительными инфекциями и приобретенных пневмоний. Следует иметь в виду, что конкретный уровень доз для каждого конкретного пациента будет зависеть от ряда факторов, включая активность используемого конкретного соединения, возраст, вес, общее состояние здоровья, пол, режим питания, время введения, путь введения, скорость выделения, комбинацию лекарств и степень серьезности конкретной болезни, подвергающейся лечению. Оптимальные величины доз и частота приема определяются в ходе клинических испытаний, как это требуется. Соединения, которых касается данное изобретение, могут быть приготовлены для введения любым образом в соответствии с их фармакокинетическими свойствами. Композиции для перорального применения могут быть в виде таблеток, капсул, порошков, гранул, лепешек, жидких препаратов или гелей,таких как оральные, топические или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для орального введения могут быть в виде унифицированных доз и могут содержать обычные эксципиенты, такие как связующие агенты, например сироп, смола акации, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактоза, сахар, маисовый крахмал, фосфат кальция,сорбит или глицин; смазывающий агент для таблетирования, например стеарат магния, тальк, полиэтиленгликоль или двуокись кремния; дезинтегранты, например картофельный крахмал, или приемлемые смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут иметь покрытия, полученные способами, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть в виде сухого продукта для восстановления в водном или другом подходящем носителе перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, сироп на основе глюкозы, желатин,гидрированные съедобные жиры; эмульгаторы, например лецитин, моноолеат сорбитана или смола акации; неводные носители (которые могут включать съедобные масла), например миндальное масло, фракционированное кокосовое масло, маслянистые сложные эфиры, такие как на основе глицерина, пропиленгликоля или этиловый спирт; консерванты, например метил- или пропил-п-гидроксибензоат или сорбиновая кислота, и, если желательно, обычные ароматизаторы или красители. Для топического нанесения на кожу лекарство может быть в виде крема, лосьона или мази. Крем или мазь, в которые вводят лекарство, имеют обычный состав, хорошо известный из уровня техники,например, как описано в обычных книгах по фармацевтике, таких как British Pharmacopoeia. В случае топического применения в глазах, лекарство может быть в виде раствора или суспензии в подходящем стерильном водном или неводном носителе. Могут быть также добавлены добавки, например буферы, такие как метабисульфит натрия или эдеата динатриевая соль, консерванты, включая бактерицидные и фунгицидные агенты, такие как фенилртутьацетат или нитрат, бензалконий-хлорид или хлоргексидин, и загущающие агенты, такие как гипромеллоза. Активный ингредиент может быть также введен парентерально в стерильной среде. В зависимости от используемого носителя и концентрации лекарство может быть или суспендировано либо растворено в носителе. Предпочтительно, чтобы в носителе были растворены адъюванты, такие как местный анестетик, консервант и буферные агенты. Синтез и примеры соединений. Существуют многочисленные подходы к синтезу соединений формулы (I), которых касается данное изобретение, все они основаны на известных химических способах, с которыми знаком химик-органик. Так, соединения формулы (I) могут быть получены способами, описанными в обычной литературе и хорошо известными специалистам. Типичными литературными источниками являются "Advanced organicLarock "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katrizky, обзорные статьи, помещенные, например, в "Synthesis", "Асе. Chem. Res.", "Chem. Rev." или в первичных литературных источниках, которые можно найти путем поиска on line или из вторичных источников, таких как "ChemicalAbstracts " или "Beilstein". Примеры таких способов и схем получения соединений формулы (I) приведены ниже в примерах. Далее изобретение будет проиллюстрировано следующими примерами. Сокращения. Стадия 1. 4-Бром-2-йод-6-нитроанилин. 4-Бром-2-нитроанилин (14,3 г, 0,0659 моль) добавляли одной порцией к йоду (17,6 г, 0,0692 моль),растворенному в этаноле (300 мл), с последующим введением сульфата серебра(I) (20,4 г, 0,0659 моль). После перемешивания при комнатной температуре в течение 18 ч реакционную массу отфильтровывали и полученное твердое вещество промывали дихлорметаном до тех пор, пока не растворится весь оранжевый продукт. Объединенные фильтраты выпаривали под вакуумом и полученный твердый продукт промывали смесью диэтиловый эфир/40-60 петролейный эфир (1:1) и отфильтровывали с получением 4 бром-2-йод-6-нитроанилина в виде оранжевого твердого продукта (19,8 г, 88%), который использовали без последующей очистки. 1 Н NMR (400 МГц, CDCl3):6,15 (2 Н, br s), 8,00 (1H, s), 8,42 (1H, s). Стадия 2. 3-Бром-5-йоднитробензол. 4-Бром-2-йод-6-нитроанилин (5 г, 0,0145 моль) частями добавляли к перемешиваемой серной кислоте (60 мл), поддерживая температуру, равную 0-5 С. После перемешивания на холоде в течение 1 ч добавляли нитрит натрия (2,3 г, 0,0326 моль) и перемешивали реакционную смесь на холоде еще 2 ч. Затем реакционную смесь выливали в лед (250 мл). Полученную смесь частями добавляли к кипящему раствору сульфата меди(II) (0,36 г, 0,00145 моль) в этаноле (150 мл) и кипятили еще 2 ч. Реакционную смесь охлаждали до комнатной температуры и экстрагировали этилацетатом (300 мл), который промывали насыщенным раствором кислого углекислого натрия (250 мл) и высушивали (MgSO4). Растворитель удаляли под вакуумом с получением 3-бром-5-йоднитробензола в виде твердого продукта желтого цвета (4,21 г, 88%), который использовали без последующей очистки. 1 Н NMR (400 МГц, CDCl3):8,18 (Н, s), 8,34(1 Н, s), 8,50 (1H, s). Стадия 3. 3-Бром-5-йоданилин. Смесь 3-бром-5-йоднитробензола (4,21 г, 0,0128 моль) и порошка железа (3,6 г, 0,0642 моль) в ледяной уксусной кислоте (50 мл) перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь фильтровали через слой целита и промывали этилацетатом. Фильтрат выпаривали под вакуумом, получая коричневое масло. Его растворяли в этилацетате, переносили на фильтр из целита и элюировали этилацетатом. Фильтрат выпаривали под вакуумом, получая 3-бром-5-йоданилин в виде твердого продукта коричневого цвета (3,67 г, 96%), который использовали без последующей очистки. 1 НNMR (400 МГц, CDCl3):3,72 (2 Н, br s), 6,77 (1 Н, s), 6,95 (1H, s), 7,21 (1H, s). Стадия 4. 1-Бензоил-3-(3-бром-5-йодфенил)тиомочевина. Раствор тиоцианата аммония (4,45 г, 0,0585 моль) в безводном ацетоне (48 мл) по каплям обрабатывали бензоилхлоридом (6,47 мл, 0,05583 моль) и перемешивали при комнатной температуре в течение 1 ч. Затем одной порцией добавляли раствор 3-бром-5-йоданилина (15,85 г, 0,05319 моль) в безводном ацетоне (48 мл) и перемешивали смесь при комнатной температуре в течение 16 ч. Полученную суспензию выливали в воду (300 мл) и перемешивали в течение 0,5 ч. Осадок продукта собирали путем фильтрования, промывали водой и затем петролейным эфиром с температурой 40-60 С, высушивали под вакуумом,получая 1-бензоил-3-(3-бром-5-йодфенил)тиомочевину (20,70 г, 84%). 1 Н NMR (400 МГц, CDCl3):7,56(2 Н, m), 7,67(1 Н, m), 7,76 (1 Н, s), 7,90 (2 Н, d), 7,99 (1 Н, s), 8,05 (1H, s), 9,17 (1H, br s), 12,70 (1H, br s). Стадия 5. (3-Бром-5-йодфенил)тиомочевина. Перемешиваемую суспензию 1-бензоил-3-(3-бром-5-йодфенил)тиомочевины (20,70 г, 0,0449 ммоль) в метаноле (303 мл) обрабатывали метоксидом натрия (2,42 г, 0,049 моль) и перемешивали при комнатной температуре в течение 4 ч. Полученную суспензию выпаривали досуха при пониженном давлении. Остаток смешивали с водой (500 мл) и экстрагировали этилацетатом (3200 мл), который высушивали(MgSO4), растворитель удаляли под вакуумом с получением остатка, который растирали в порошок со смесью петролейный эфир/диэтиловый эфир (1:1) при температуре 40-60 С, получали (3-бром-5 йодфенил)тиомочевину в виде твердого продукта грязно-белого цвета (14,35 г, 89%). 1H NMR (400 МГц,DMSO-d6):7,67 (1H, s), 7,83 (1H, s), 7,89 (1H, s), 9,87 (1 Н, brs). Стадия 6. 7-Бром-5-йодбензотиазол-2-иламин и 5-бром-7-йодбензотиазол-2-иламин. Перемешиваемую суспензию (3-бром-5-йодфенил)тиомочевины (2,83 г, 0,00723 моль) в хлороформе (65 мл) обрабатывали бромом (1,16 г, 0,4 мл, 0,00723 моль) и кипятили с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры смесь разбавляли эфиром (200 мл). Твердый продукт собирали на фильтре, промывали водным раствором кислого углекислого натрия (200 мл), затем водой (200 мл) и сушили под вакуумом, получая 1:1 смесь 7-бром-5-йодбензотиазол-2-иламина и 5-бром 7-йодбензотиазол-2-иламина (2,87 г, 100%), которую применяли далее без очистки. 1 Н NMR (400 МГц,DMSO-d6):3,40 (2 Н, br s), 7,50-7,95 (2 Н, m). Стадия 7. 1-(7-Бром-5-йодбензотиазол-2-ил)-3-этилмочевина и 1-(5-бром-7-йодбензотиазол-2-ил)-3 этилмочевина. Перемешиваемую смесь продукта со стадии 6 (2,87 г, 0,00808 моль), безводного 1,4-диоксана (95 мл), этилизоцианата (2,87 г, 3,2 мл, 0,0404 моль) и дибутилолово-диацетата (0,2 мл) нагревали при 100 С в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь выпаривали досуха и растирали остаток с диэтиловым эфиром (250 мл). Твердый продукт собирали на фильтре и сушили под вакуумом, получая 1:1 смесь 1-(7-бром-5-йодбензотиазол-2-ил)-3-этилмочевины и 1-(5-бром-7 йодбензотиазол-2-ил)-3-этилмочевины в виде белого твердого продукта (2,17 г, 63%), который применяли без последующей очистки. 1 Н NMR (400 МГц, DMSO-d6):1,12 (3 Н, m), 3,23 (2 Н, m), 6,77 (1 Н, br t),7,72-8,00 (2H, m). Стадия 8. 1-(5-Бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина (пример 2) и 1-(7-бром-5 пиридин-3-илбензотиазол-2-ил)-3-этилмочевина (пример 3). Перемешиваемую смесь продукта со стадии 7 (3,66 г, 0,00859 моль), 3-пиридин-бороновой кислоты(1,06 г, 0,00859 моль), порошкообразного трехосновного фосфата калия (2,18 г, 0,0103 моль), безводного 1,4-диоксана (58 мл) и безводного метанола (117 мл) продували азотом в течение 15 мин. Добавляли комплекс 1,1'-бис-(дифенилфосфин)ферроцена и хлорида палладия(II) (0,70 г, 0,000859 моль) и нагревали смесь при температуре 80 С в течение 16 ч в атмосфере азота. После охлаждения до комнатной температуры смесь фильтровали через целит и промывали метанолом. Фильтрат выпаривали под вакуумом и полученный остаток очищали методом флэш-хроматографии на силикагеле, используя этилацетат для элюирования 1-(5-бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (1,0 г, 30%) и 5% метанола в этилацетате для элюирования 1-(7-бром-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (0,857 г,26%). 1-(5-Бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина: 1 Н NMR (400 МГц, DMSO-d6):1,10(1H, s). LC-MS m/z 377 [M+H]+ Rt=2,63 мин. Подобным образом получали следующие соединения: Стадия 1. 1,3-Дибром-5-нитробензол. К ледяному раствору 2,6-дибром-4-нитроанилина (100 г, 0,34 моль) в 1,50 л этанола до каплям добавляли конц. H2SO4 (116 мл, 2,15 моль) в течение 30-45 мин при постоянном перемешивании. Реакционную смесь нагревали до 60 С и порциями добавляли к реакционной смеси нитрит натрия (72 г, 1,09 моль). Полученную реакционную смесь желтого цвета медленно нагревали до 90 С и нагревали с обратным холодильником 2-2,5 ч. После охлаждения до комнатной температуры смесь выливали в ледяную воду. Полученный таким образом твердый продукт красноватого цвета отфильтровывали, промывали водой и сушили с получением нужного соединения в виде твердого продукта коричневого цвета (85,0 г,90%). 1 Н NMR (400 МГц, DMSO-d6):8,38 (d, J=1,20 Гц, 1 Н и 8,40 Гц br s, 2H). Стадия 2. 3,5-Диброманилин. К раствору 1,3-дибром-5-нитробензола (85,0 г, 0,30 моль) в 1 л этанола порциями добавляли SnCl22 Н 2 О (341,0 г, 1,50 моль) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 1,5 ч при температуре 80 С. После охлаждения до комнатной температуры растворитель выпаривали при пониженном давлении и сырой продукт белого цвета подщелачивали 4 N раствором NaOH до рН 12. Смесь экстрагировали этилацетатом (3) и объединенные органические слои промывали рассолом и сушили над Na2SO4. Растворитель удаляли при пониженном давлении с получением нужного соединения коричневого цвета (65,0 г, 86%). 1 Н NMR (400 МГц, DMSO-d6):5,71 (br s, 2 Н),6,71 (s, 2 Н) и 6,77 (s, 1 Н). Стадия 3. 1-Бензоил-3-(3,5-дибромфенил)тиомочевина. К раствору 3,5-диброманилина (65,0 г, 0,26 моль) в безводном ацетате (1,6 л) добавляли бензоилизотиоцианат (46,4 г, 0,28 моль) и перемешивали реакционную смесь при комнатной температуре в течение 30 мин. Ацетон отгоняли и сырой остаток промывали гексаном, получая желаемое соединение желтого цвета (96,5 г, 90%). 1 Н NMR (400 МГц, DMSO-d6):7,56 (t, J=7,60 Гц, 2 Н), 7,67 (t, J=7,20 Гц, 1 Н),7,75 (s, 1H), 7,96-7,98 (m, 4H), 11,76 (br s, 1H) и 12,54 (br s, 1H). Стадия 4. (3,5-Дибромфенил)тиомочевина. Раствор NaOH (46,30 г, 1,16 моль) в 480 мл Н 2 О добавляли к раствору 1-бензоил-3-(3,5 дибромфенил)тиомочевины (96,0 г, 0,23 моль) в 1,2 л THF. Полученную реакционную смесь перемешивали при 70 С в течение 12 ч. THF отгоняли и экстрагировали этилацетатом (3). Объединенные органические слои сушили над Na2SO4, отфильтровывали и отгоняли с получением сырого остатка, который промывали гексаном, получая желательное соединение в виде твердого продукта серого цвета (68 г,-9 019748 95%). 1 Н NMR (400 МГц, DMSO-d6):7,49 (s, 1 Н), 7,84 (s, 2H), 7,98 (br s, 2H) и 10,48 (br s, 1H). MS: 310,88 [M+H]+. Стадия 5. 5,7-Дибромбензотиазол-2-иламин. К раствору (3,5-дибромфенил)тиомочевины (35 г, 0,11 моль) в CHCl3 (600 мл) при температуре -5560 С по каплям добавляли раствор Br2 (40,40 г, 0,25 моль, в 100 мл СНСЬ) в течение 1 ч. Реакционную смесь перемешивали при -55-60 С в течение 15 мин с последующим нагреванием с обратным холодильником в течение 3 ч при 70-75 С. Реакционную смесь охлаждали до комнатной температуры и фильтровали, получали сырой остаток, который промывали гексаном и диэтиловым эфиром. Полученный таким образом твердый продукт растворяли в Н 2 О, подщелачивали водным раствором аммиака до рН 10-12 и перемешивали в течение 30 мин. Полученный твердый продукт отфильтровывали и промывали водой с получением желательного продукта (34,0 г, 98%). 1 Н NMR (400 МГц, DMSO-d6):7,39 (s, 1H), 7,48 (s,1 Н) и 7,95 (br s, 2H). MS: 308,96 [M+H]+. Стадия 6. 1-(5,7-Дибромбензотиазол-2-ил)-3-этилмочевина. К раствору 5,7-дибромбензотиазол-2-иламина (20,0 г, 0,65 моль) в диоксане (400 мл) добавляли этилизоцианат (27,83 г, 0,39 моль) и перемешивали реакционную смесь в течение 15 ч при температуре 75-80 С. После завершения реакции (мониторинг методом TLC) растворитель выпаривали, остаток отбирали при помощи H2O и перемешивали в течение 15 ч при 70-75 С. Твердый продукт отфильтровывали,промывали горячей водой и сушили в условиях высокого вакуума, получая желаемый продукт (19,65 г,80%). 1 Н NMR (400 МГц, DMSO-d6):1,08 (t, J=6,80 Гц, 3 Н), 3,18 (m, 2H), 6,76 (br s, 1H), 7,62 (s, 1H),7,82 (s, 1H) и 11,10 (br s, 1H). MS: 379,90 [M+H]+. Стадия 7. 1-(5-Бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина (пример 2). 1-(7-Бром-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина (пример 3) 1-(5,7-дипиридин-3 илбензотиазол-2-ил-3-этилмочевина (пример 4). К раствору 1-(5,7-дибромбензотиазол-2-ил)-3-этилмочевины (1,60 г, 0,40 ммоль) в DMF - Н 2 О (2:1,48 мл) добавляли пиридин-3-бороновую кислоту (0,51 г, 0,42 ммоль) и K3PO4 (0,90 г, 0,42 ммоль) в атмосфере азота при комнатной температуре. Затем реакционную смесь дегазировали в течение 30 мин с последующим добавлением комплекса [1,1'-бис-(дифенилфосфин)ферроцена]дихлорпалладий (II) вместе сCH2Cl2 (0,35 г, 0,042 ммоль). Реакционную смесь затем снова дегазировали в течение 30 мин и нагревали при 120 С в течение 1 ч в атмосфере азота. Отгоняли DMF, добавляли в реакционную смесь воду и экстрагировали этилацетатом (3). Объединенные органические слои сушили над безводным Na2SO4 и выпаривали досуха при пониженном давлении. Соединение очищали на силикагеле (230-400 М), применяя этилацетат/гексан (градиент) с получением указанных в заголовке соединений. 1-(5-бром-7-пиридин-3 илбензотиазол-2-ил)-3-этилмочевина 60% EtOAc-гексан (14% выход). 1 Н NMR (400 МГц, DMSO-d6):1,07 (t, J=7,20 Гц, 3 Н), 3,14 (m, 2H), 6,73 (br s, 1H), 7,52-7,60 (m, 2H), 7,87 (s, 1H), 8,11-8,13 (m, 1H), 8,678,69 (m, 1H), 8,89 (m, 1H) и 10,99 (br s, 1H). MS: 378,99 [M+H]+. 1-(7-Бром-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина 80% EtOAc-гексан (17% выход), m.p. 345C. 1H NMR (DMSO-d6, 400 МГц):1,11 (t, J=7,20 Гц, 3 Н), 3,20 (m, 2H), 6,75 (br s, 1H), 7,48-7,51 (m,1H), 7,63 (s, 1H), 7,79 (s, 1H), 8,18 (m, 1H), 8,60 (m, 1H), 8,97 (s, 1H) и 11,01 (br s, 1H). MS: 377,17 [M+H+]. 1-(5,7-Дипиридин-3-илбензотиазол-2-ил)-3-этилмочевина 95% EtOAc- MeOH (25% выход). 1H NMR Похожим способом были получены следующие соединения: Стадия 1. 1,3-Дийод-5-нитробензол. К ледяному раствору 2,6-дийод-4-нитроанилина (25,0 г, 0,06 моль) в этаноле (625 мл) по каплям добавляли конц. H2SO4 (50,0 мл, 0,90 моль) в течение 30-45 мин при постоянном перемешивании. Реакционную смесь нагревали до 60 С и порциями добавляли к реакционной смеси нитрит натрия (9,70 г, 0,14 моль). Полученную реакционную смесь, окрашенную в желтый цвет, медленно нагревали до 90 С и нагревали с обратным холодильником в течение 2-2,5 ч. После охлаждения до комнатной температуры смесь выливали в ледяную воду. Полученный таким образом твердый продукт красноватого цвета отфильтровывали, промывали водой и сушили с получением желаемого соединения желтого цвета (17,0 г,72%). 1 Н NMR (DMSO-d6, 400 МГц):8,48 (s, 2 Н) и 8,56 (s, 1H). Стадия 2. 3,5-Дийоданилин. К раствору 1,3-дийод-5-нитробензола (15,80 г, 0,042 моль) в этаноле (200 мл) добавляли SnCl22 Н 2 О(28,50 г, 0,13 моль) порциями при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 1,5 ч при 80 С. После охлаждения до комнатной температуры растворитель выпаривали при пониженном давлении, полученный сырой продукт подщелачивали 4 N растворомNaOH до рН 12. Смесь экстрагировали этилацетатом (3), объединенные органические слои промывали рассолом и сушили над Na2SO4. Растворитель удаляли при пониженном давлении, получая желательный продукт в виде твердого вещества желтого цвета (11,0 г, 75%). Стадия 3. 1-Бензоил-3-(3,5-дийодфенил)тиомочевина. К раствору 3,5-дийоданилина (5,0 г, 0,01 моль) в безводном ацетоне (150 мл) добавляли бензоилизотиоцианат (2,81 г, 0,012 моль) и перемешивали реакционную смесь при комнатной температуре в течение 30 мин. Отгоняли ацетон и сырой остаток промывали гексаном, получая желаемое соединение в виде твердого продукта желтого цвета (6,35 г, 91%). Стадия 4. (3,5-Дийодфенил)тиомочевина. Раствор NaOH (1,30 г, 0,033 моль) в 35 мл Н 2 О добавляли к раствору 1-бензоил-3-(3,5 дийодфенил)тиомочевины (6,30 г, 0,013 моль) в 75 мл THF. Полученную реакционную смесь перемешивали в течение 12 ч при 70 С. Отгоняли THF и экстрагировали этилацетатом (3). Объединенные органические слои сушили над Na2SO4, фильтровали и отгоняли, получая сырой остаток, который промывали гексаном, получая желаемое соединение (4,0 г, 75%). MS: 405,06 [М+H+]. Стадия 5. 5,7-Дийодбензотиазол-2-иламин. К раствору (3,5-дийодфенил)тиомочевины (4,0 г, 0,01 моль) в CHCl3 (160 мл) по каплям при температуре -55-60 С добавляли раствор Br2 (4,72 г, 0,02 моль, в 25 мл CHCl3) в течение 15 мин. Реакционную смесь перемешивали при температуре -55-60 С в течение 15 мин с последующим нагреванием с обратным холодильником при 70-75 С в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали, получая сырой остаток, который промывали гексаном и диэтиловым эфиром. Полученный твердый продукт растворяли в Н 2 О, подщелачивали водным раствором аммиака до рН 10-12 и перемешивали в течение 30 мин. Полученный твердый продукт отфильтровывали и промывали водой с получением желаемого продукта (3,50 г, 88%). 1 Н NMR (DMSO-d6, 400 МГц):7,59 (d, J=1,0 Гц, 1H),7,62 (d, J=1,0 Гц, 1 Н) и 7,85 (br s, 2H). MS: 403,06 [М+Н+]. Стадия 6. 1-(5,7-Дийодбензотиазол-2-ил)-3-этилмочевина. К раствору 5,7-дийодбензотиазол-2-иламина (8,0 г, 0,02 моль) в диоксане (160 мл) добавляли этилизоцианат (10,70 г, 0,15 моль) и перемешивали реакционную смесь в течение 15 ч при температуре 7580 С. После завершения реакции (мониторинг методом TLC) растворитель выпаривали, остаток обрабатывали Н 2 О и перемешивали в течение 15 ч при 70-75 С. Твердый продукт фильтровали, промывали горячей водой и сушили в глубоком вакууме, получая желаемый продукт (5,0 г, 53%). 1 Н NMR (DMSO-d6,400 МГц):1,08 (t, J=7,20 Гц, 3 Н), 3,16-3,19 (m, 2H), 6,73 (br s, 1H), 7,82 (s, 1H), 7,94 (s, 1H) и 10,97 (br s,1 Н). MS: 474,12 [M+H+]. Стадия 7. 1-Этил-3-(5-йод-7-пиридин-3-илбензотиазол-2-ил)мочевина (пример 8) и 1-этил-3-(7-йод 5-пиридин-3-илбензотиазол-2-ил)мочевина (пример 9). К раствору 1-(5,7-дийодбензотиазол-2-ил)-3-этилмочевины (0,20 г, 0,42 ммоль) в DMF (5 мл) добавляли пиридин-3-бороновую кислоту (0,0,76 г, 0,63 ммоль) и K3PO4 (0,133 г, 0,63 ммоль) при комнатной температуре в атмосфере азота. Затем дегазировали реакционную смесь в течение 30 мин с последующим добавлением комплекса бис-(трифенилфосфин)дихлорид палладия(II) (0,0044 г, 0,063 ммоль). Реакционную смесь снова дегазировали в течение 30 мин и затем нагревали при 120 С в течение 1 ч в атмосфере азота. Отгоняли DMF, добавляли воду и экстрагировали этилацетатом (3). Объединенные органические слои высушивали над безводным Na2SO4 и выпаривали досуха при пониженном давлении. Остаток очищали методом хроматографии на двуокиси кремния (230-400 М), используя DCM/метанол(99:1), получая 1-этил-3-(5-йод-7-пиридин-3-илбензотиазол-2-ил)мочевину в виде твердого продукта неправильного белого цвета (0,025 г, 14%), и DCM/метанол (98:2), получая 1-этил-3-(7-йод-5-пиридин-3 илбензотиазол-2-ил)мочевину в виде твердого продукта неправильного белого цвета (0,025 г, 14%). 1-Этил-3-(5-йод-7-пиридин-3-илбензотиазол-2-ил)мочевина. 1 Н NMR (DMSO-d6, 400 МГц):1,07(t, J=7,20 Гц, 3 Н), 3,19 (m, 2H), 6,77 (br s, 1H), 7,47-7,56 (m, 1H), 7,88 (s, 1H), 7,94 (s, 1H), 8,12-8,15 (m,1H), 8,58 (br s, 1H), 8,93 (s, 1H) и 10,96 (br s, 1H). MS: 425,0 [M+H+]. Стадия 8. 1-(5,7-Дипиразин-2-илбензотиазол-2-ил)-3-этилмочевина (пример 10). К раствору 1-(5,7-дийодбензотиазол-2-ил)-3-этилмочевины (0,50 г, 1,0 ммоль) в DMF (5,0 мл) добавляли 2-трибутилстаннилпиразин (0,78 г, 2,0 ммоль) в атмосфере азота при комнатной температуре. Реакционную смесь дегазировали в течение 30 мин с последующим добавлением тетракис(трифенилфосфин)палладия(0) (0,18 г, 0,10 ммоль). Реакционную смесь снова дегазировали в течение 30 мин и затем нагревали при температуре 120 С в течение 2 ч в атмосфере азота. После завершения реакции (мониторинг методом TLC) отгоняли DMF, добавляли воду и экстрагировали этилацетатом (3). Объединенные органические слои сушили над безводным Na2SO4 и выпаривали досуха при пониженном давлении. Полученное соединение очищали методом хроматографии (двуокись кремния, 230-400 М),используя этилацетат/метанол (95:5), и получали соединение, указанное в заголовке (0,025 г, 6,5%). 1 Н(2,0 мл) добавляли N-метил-2-трибутилстаннил-1H-пиррол (0,18 г, 0,47 ммоль) в атмосфере азота при комнатной температуре. Реакционную смесь дегазировали в течение 30 мин, затем добавляли тетра- 12019748 кис(трифенилфосфин)палладий(0) (0,027 г, 0,024 ммоль). Реакционную смесь снова дегазировали в течение 30 мин и затем нагревали при температуре 120 С в течение 20 ч в атмосфере азота. После завершения реакции (мониторинг методом TLC) отгоняли DMF, добавляли воду и экстрагировали этилацетатом(3). Соединенные органические слои сушили над безводным Na2SO4 и выпаривали досуха при пониженном давлении. Сырой продукт очищали методом препаративной ВЭЖХ, получали желаемое соединение в виде твердого продукта неправильного белого цвета (0,005 г, 6,0%). 1 Н NMR (DMSO-d6, 400 МГц):1,08 (t, J=6,80 Гц, 3 Н), 3,17 (q, J=6,0 Гц, 2 Н), 3,68 (s, 3 Н), 6,19 (s, 1H), 6,41 (m, 1H), 6,77 (br s, 1H),6,96 (s, 1H), 7,48-7,53 (m, 2 Н), 7,89 (s, 1H), 8,19 (d, J=8,0 Гц, 1H), 8,59 (m, 1H), 9,00 (s, 1H) и 10,80 (br s,1H). MS: 378,15 [М-Н+]. Чистота (HPLC) (Xbridge С 18, 2504,6 мм, 275 нм): 98,22% (Rt=14,25 мин). Схема 1 С Стадия 1. 3-Бром-5-пиразол-1-илфениламин. К раствору 3,5-диброманилина (0,50 г, 1,99 ммоль) в DMSO (2 мл) последовательно добавляли Lпролин (0,41 г, 0,36 ммоль), Cs2CO3 (1,16 г, 3,58 ммоль), CuI (0,038 г, 0,20 ммоль) и пиразол (0,12 г, 1,80 ммоль). Реакционную смесь дегазировали в течение 10 мин и затем нагревали до 110 С в течение 48 ч. После завершения реакции (мониторинг методом TLC) реакционную смесь охлаждали до комнатной температуры, добавляли воду и экстрагировали этилацетатом (3). Объединенные органические слои промывали водой, сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали в колонке с двуокисью кремния (230-400 М, 15% EtOAc-гексан) с получением желаемого соединения (0,18 г, 37%). Стадия 2. 1-Бензоил-3-(3-бром-5-пиразол-1-илфенил)тиомочевина. К раствору 3-бром-5-пиразол-1-илфениламина (0,18 г, 0,76 ммоль) в безводном ацетоне (5,0 мл) добавляли бензоилизотиоцианат (0,14 г, 0,83 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Отгоняли ацетон и промывали остаток гексаном для получения целевого соединения (0,27 г, 89%). Стадия 3. (3-Бром-5-пиразол-1-илфенил)тиомочевина. Раствор NaOH (0,13 г, 3,35 ммоль) в 1,0 мл Н 2 О добавляли к раствору 1-бензоил-3-(3-бром-5 пиразол-1-илфенил)тиомочевины 3 (0,27 г, 0,67 ммоль) в 5,0 мл THF. Полученную реакционную смесь перемешивали при 70 С в течение 12 ч. Отгоняли THF и экстрагировали этилацетатом (3). Объединенные органические фазы сушили над Na2SO4, фильтровали и перегоняли с целью получения сырого остатка, который промывали 2% этилацетат/гексаном с получением желаемого соединения (0,17 г, 85%). Стадия 4. 7-Бром-5-пиразол-1-илбензотиазол-2-иламин. К раствору (3-бром-5-пиразол-1-илфенил)тиомочевины (1,0 г, 3,0 ммоль) в DCM (17,0 мл) при температуре 0 С добавляли по каплям в течение 15 мин раствор Br2 (1,07 г, 6,0 ммоль, в 3,0 мл DCM). Реакционную смесь перемешивали при температуре 0 С в течение 15 мин с последующим нагреванием с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали, получали сырой остаток, который промывали гексаном и диэтиловым эфиром. Полученный таким образом твердый продукт растворяли в Н 2 О, подщелачивали водным раствором аммиака до рН 10-12 и экстрагировали этилацетатом (3). Объединенные органические слои промывали водой,сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали над силикагелем (230-400 М, 25%EtOAc-гексан) с получением целевого продукта (0,30 г, 30%). Стадия 5. 1-(7-Бром-5-пиразол-1-илбензотиазол-2-ил)-3-этилмочевина. К раствору 7-бром-5-пиразол-1-илбензотиазол-2-иламина (0,10 г, 0,34 ммоль) в диоксане (5,0 мл) добавляли этилизоцианат (0,24 г, 3,34 ммоль) и перемешивали реакционную смесь при температуре 55 С в течение 15 ч. После завершения реакции (мониторинг методом TLC) растворитель выпаривали и остаток промывали гексаном, получая целевой продукт (0,11 г, 88%). Стадия 6. 1-Этил-3-(5-пиразол-1-ил-7-пиридин-3-илбензотиазол-2-ил)мочевина (пример 12). К раствору 1-(7-бром-5-пиразол-1-илбензотиазол-2-ил)-3-этилмочевины (0,27 г, 0,74 ммоль) вDMF:Н 2 О (2:1, 15 мл) добавляли 3-пиридилбороновую кислоту (0,11 г, 0,88 ммоль) и K3PO4 (0,17 г, 0,81 ммоль) в атмосфере азота при комнатной температуре. Затем дегазировали реакционную смесь в течение 30 мин с последующим добавлением комплекса бис-(трифенилфосфин)дихлорид палладия(II) (0,077 г,0,11 ммоль). Реакционную смесь затем дегазировали в течение 30 мин и нагревали при 120 С в течение 2 ч в атмосфере азота. После завершения реакции (мониторинг методом TLC) DMF отгоняли, к реакционной смеси добавляли воду и экстрагировали этилацетатом. Объединенные органические фазы сушили над безводным Na2SO4 и затем выпаривали досуха при пониженном давлении. Сырой остаток очищали на силикагеле (230-400 М), применяя EtOAc-гексан (70:30), получая целевое соединение (0,066 г, 22%). 1-Этил-3-(7-пиридин-3-ил-5-пиримидин-5-илбензотиазол-2-ил)мочевина (пример 13). Перемешиваемую смесь 1-(5-бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (250 мг, 0,663 ммоль), пиримидин-5-бороновой кислоты (86 мг, 0,696 ммоль), порошка трехосновного фосфата калия(167 мг, 0796 ммоль) и комплекса 1,1'-бис-(дифенилфосфин)ферроцен-хлорид палладия(II) (81 мг, 0,0995 ммоль) в безводном 1,4-диоксане (5 мл) и безводном метаноле (10 мл) промывали азотом в течение 5 мин и нагревали в герметичном сосуде в течение 16 ч при температуре 80 С. После охлаждения до комнатной температуры смесь фильтровали через кизельгур. Кизельгур тщательно промывали метанолом и объединенные фильтраты выпаривали досуха под вакуумом, получая техническую 1-этил-3-(7-пиридин-3-ил-5 пиримидин-5-илбензотиазол-2-ил)мочевину, которую очищали флэш-хроматографией на силикагеле,элюируя 0-5% метанола в этилацетате. Получали 57 мг (22%) твердого вещества неправильного белого цвета. 1 Н NMR (400 МГц, DMSO-d6):1,13 (3 Н, t), 3,22 (2 Н, m), 6,79 (1H, br t), 7,66 (1H, m), 7,85 (1H, s),8,18 (1 Н, s), 8,28 (1H, d), 8,74 (1H, d), 9,07 (1H, s), 9,25 (1H, s), 9,36 (2 Н, s), 10,95 (1H, br s). LC-MS m/z 377[M+H]+. Rt=2,59 мин. Похожим способом получали следующие соединения:(схема 10) были получены следующие соединения: Следующие соединения были приготовлены похожим образом с применением 1-[7-(2-аминопиримидин-5-ил)-5-бромбензотиазол-2-ил]-3-этилмочевины (схема 1) Стадия 1. 1-[5-(5,5-Диметил[1,2,3]диоксаборинан-2-ил)-7-пиридин-3-илбензотиазол-2-ил]-3 этилмочевина. Смесь 1-(5-бром-7-(пиридин-3-ил)бензо[d]тиазол-2-ил)-3-этилмочевины (100 мг, 0,265 ммоль), бис(неопентил)гликолят-диборона (120 мг, 0,530 ммоль) и ацетата калия (78 мг, 0,796 ммоль) в диметилсульфоксиде (4 мл) промывали азотом в течение 5 мин. Добавляли комплекс бис(дифенилфосфин)ферроцена с хлоридом палладия(II) (22 мг, 0,0265 ммоль). Сосуд герметизировали и нагревали при температуре 80 С в течение 16 ч. Стадия 2. 1-Этил-3-(5-пиразин-2-ил-7-пиридин-3-илбензотиазол-2-ил)мочевина (пример 43). Реакционную смесь со стадии 1 охлаждали до комнатной температуры. Добавляли 2-хлорпиразин(46 мг, 0,405 ммоль) с последующим введением водного раствора карбоната цезия (3,7 М, 0,1 мл, 0,405 ммоль). Реакционную смесь промывали в течение 5 мин азотом, обрабатывали тетракистрифенилфосфином палладия(0) (21 мг, 0,0265 ммоль), герметизировали и нагревали при температуре 80 С в течение 8 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли дихлорметаном (50 мл), промывали водой (310 мл), затем рассолом (25 мл) и высушивали (MgSO4). Растворитель удаляли под вакуумом и очищали остаток методом флэш-хроматографии на двуокиси кремния, элюируя 5% метанола в этилацетате, получали 1-этил-3-(5-пиразин-2-ил-7-пиридин-3-илбензотиазол-2-ил)мочевину в виде твердого продукта бледно-коричневого цвета (15 мг, 15% после двух стадий). 1H NMR (400 МГц,CDCl3=CD3OD):1,26 (3 Н, t), 3,37 (2 Н, m), 7,51(1H, m), 7,99 (1H, s), 8,14 (1H, d), 8,30 (1H, s), 8,56 (1H, s),8,66 (1H, d), 8,70 (1H, s), 8,93 (1H, s), 9,14 (1H, s). LC-MS m/z 377 [M+H]+. Rt=2,36 мин. Похожим способом получали следующие соединения: С применением 1-(5-бром-7-пиридин-2-илбензотиазол-2-ил)-3-этилмочевины получали подобным образом следующие соединения (схема 10): С применением 1-[7-(2-аминопиримидин-5-ил)-5-бромбензотиазол-2-ил]-3-этилмочевины (схема 1) получали похожим способом следующие соединения: 1-Этил-3-[7-(2-фторфенил)-5-пиридин-3-илбензотиазол-2-ил]мочевина (пример 75). Перемешиваемую смесь 1-(7-бром-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (50 мг, 0,133 ммоль), 2-фторбензолбороновой кислоты (19 мг, 0,139 ммоль), порошкообразного трехосновного фосфата калия (34 мг, 0,160 ммоль) и комплекса 1,1'-бис-(дифенилфосфин)ферроцена и хлорида палладия(II)(16 мг, 0,01995 ммоль) в безводном 1,4-диоксане (1 мл) и безводном метаноле (2 мл) промывали азотом в течение 5 мин и нагревали в герметичном сосуде в течение 16 ч при температуре 80 С. После охлаждения до комнатной температуры смесь фильтровали через кизельгур. Затем кизельгур тщательно промывали метанолом и объединенные фильтраты выпаривали досуха под вакуумом, получали сырую 1-этил 3-[7-(2-фторфенил)-5-пиридин-3-илбензотиазол-2-ил]мочевину, которую очищали флэш-хроматографией на двуокиси кремния, элюируя 0-30% метанола в этилацетате. Получали 12 мг твердого вещества бледно-коричневого цвета. 1H NMR (400 МГц, DMSO-d6):1,12 (3 Н, t), 3,21 (2 Н, m), 6,77 (1 Н, br t), 7,46 (2H,m), 7,55 (2H, m), 7,62 (1H, s), 7,74 (1H, t), 8,05 (1H, s), 8,24 (1H, d), 8,63 (1H, d), 9,05 (1H, s), 10,88 (1H,brs).LC-MS m/z 393 [M+H]+ Rt=2,79 мин. Похожим способом получали следующие соединения: Были получены следующие соединения, но с применением альтернативных условий, показанных ниже. де (2 мл) промывали азотом в течение 5 мин. Добавляли комплекс бис-(дифенилфосфин)ферроцен - хлорид палладия(II) (10 мг, 0,011 ммоль) и реакционную смесь после герметизации сосуда нагревали в течение 16 ч при температуре 80 С. Стадия 2. 1-Этил-3-[7-(3-фторпиридин-2-ил)-5-пиридин-3-илбензотиазол-2-ил]мочевина (пример 91). Реакционную смесь со стадии 1 охлаждали до комнатной температуры и обрабатывали 2-хлор-3 фторпиридином (15 мг, 0,11 ммоль) и карбонатом цезия (53 мг, 0,165 ммоль). Реакционную смесь промывали в течение 5 мин азотом, обрабатывали тетракис-трифенилфосфином палладия(0) (13 мг, 0,011 ммоль), герметизировали и нагревали в течение 8 ч при температуре 80 С. Реакционную смесь охлаждали до комнатной температуры, разбавляли дихлорметаном (50 мл), промывали водой (310 мл), затем рассолом (25 мл) и высушивали (MgSO4). Растворитель удаляли под вакуумом и очищали остаток методом флэш-хроматографии, элюируя 5% метанола в этилацетате, получали 1-этил-3-[7-(3-фторпиридин-2 ил)-5-пиридин-3-илбензотиазол-2-ил]мочевину в виде твердого вещества белого цвета (7,5 мг, 17%). 1 НRt=2,47 мин. По аналогичному способу получали следующие соединения: Аналогичным способом с применением N-5-[7-бром-2-(3-этилуреидо)бензотиазол-5-ил]пиридин-2 илацетамида получали следующие соединения: Аналогичным способом с применением 1-[5-(6-аминопиридин-3-ил)-7-бромбензотиазол-2-ил]-3 этилмочевины (схема 1 А) было получено следующее соединение: С применением 1-[5-(2-аминопиримидин-5-ил)-7-бромбензотиазол-2-ил]-3-этилмочевины (схема 1) аналогичным способом было получено следующее соединение: 1-[7-(5,5-Диметил[1,3,2]диоксаборинан-2-ил)-5-пиридин-3-илбензотиазол-2-ил]-3-этилмочевина. Перемешиваемую смесь 1-[7-бром-5-(пиридин-3-ил)бензо[d]тиазол-2-ил]-3-этилмочевины (100 мг,0,2652 ммоль), бис-(неопентил)гликолятдибора (120 мг, 0,5303 ммоль) и ацетата калия (78 мг, 0,7957 ммоль) в диметилсульфоксиде (4 мл) в течение 5 мин промывали азотом, обрабатывали комплексом 1,1'бис-(дифенилфосфин)ферроцен-хлорид палладия(II) (22 мг, 0,02653 ммоль) и нагревали в течение 16 ч при температуре 80 С. После охлаждения до комнатной температуры смесь разбавляли дихлорметаном(50 мл), промывали водой (310 мл), высушивали над MgSO4 и удаляли растворитель под вакуумом, получали сырую 1-[7-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-5-пиридин-3-илбензотиазол-2-ил]-3 этилмочевину, которую применяли на следующей стадии без очистки. Стадия 2. 1-Этил-3-(7-пиразол-1-ил-5-пиридин-3-илбензотиазол-2-ил)мочевина (пример 140). Смесь 1-[7-(5,5-Диметил[1,3,2]диоксаборинан-2-ил)-5-пиридин-3-илбензотиазол-2-ил]-3-этилмочевины (116 мг, 0,339 ммоль), пиразола (25 мг, 0,373 ммоль), ацетата меди(II) (71 мг, 0,39 ммоль), безводного триэтиламина (188 мг, 1,865 ммоль) и порошкообразного молекулярного сита 4 (8 гранул) в безводном дихлорметане перемешивали в открытом сосуде при комнатной температуре в течение 2 дней. Полученную смесь отфильтровывали, удаляли под вакуумом растворитель и получали 1-этил-3-(7 пиразол-1-ил-5-пиридин-3-илбензотиазол-2-ил)мочевину, которую очищали методом препаративной ВЭЖХ (HPLC). Получали твердое вещество неправильного белого цвета (8 мг). 1H NMR (400 МГц,DMSO-d6):1,13 (3 Н, t), 3,23 (2 Н, m), 6,71 (1 Н, s), 7,06 (1 Н, br s), 7,58 (1H, br t), 7,93 (1H, s), 7,96 (1H, s),8,08 (1H, s), 8,33 (1H, d), 8,66 (1H, br s), 8,98 (1H, s), 9,15 (1H, brs), 10,80 (1H, brs). LC-MS m/z 365 [M+H]+. Стадия 1. 1-[5-(5,5-Диметил[1,3,2]диоксаборинан-2-ил)-7-пиридин-3-илбензотиазол-2-ил]-3 этилмочевина. Перемешиваемую смесь 1-(5-бром-7-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (100 мг,0,2652 ммоль), бис-(неопентил)гликолятдибора (120 мг, 0,5303 ммоль) и ацетата калия (78 мг, 0,7957 ммоль) в диметилсульфоксиде (4 мл) промывали азотом в течение 5 мин, обрабатывали комплексом 1,1'бис-(дифенилфосфин)ферроцен-хлорид палладия(II) (22 мг, 0,02653 ммоль) и нагревали в течение 16 ч при температуре 80 С. После охлаждения до комнатной температуры смесь разбавляли дихлорметаном(50 мл), промывали водой (310 мл), сушили над MgSO4, удаляли растворитель под вакуумом, получали сырую 1-[5-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-7-пиридин-3-илбензотиазол-2-ил]-3-этилмочевину,которую применяли на следующей стадии без очистки. Стадия 2. 1-Этил-3-[5-(2-оксо-2 Н-пиридин-1-ил)-7-пиридин-3-илбензотиазол-2-ил]мочевина [пример 141]. Смесь сырого 1-[5-(5,5-диметил[1,3,2]диоксаборинан-2-ил)-7-пиридин-3-илбензотиазол-2-ил]-3 этилмочевины, 2-гидроксипиридина (88 мг, 0,292 ммоль), ацетата меди(II) (56 мг, 0,305 ммоль), безвод- 24019748 ного триэтиламина (147 мг, 1,458 ммоль) и порошкообразного молекулярного сита 4 (6 гранул) в безводном дихлорметане (21 мл) перемешивали в открытом сосуде в течение 5 дней при комнатной температуре. Полученную смесь отфильтровывали, удаляли под вакуумом растворитель, получали сырую 1 этил-3-[5-(2-оксо-2 Н-пиридин-1-ил)-7-пиридин-3-илбензотиазол-2-ил]мочевину, которую очищали методом препаративной HPLC. Получали твердое вещество коричневого цвета (17 мг). LC-MS m/z 392 Стадия 1. 1-[5,7-бис-(5-Метоксипиридин-3-ил)бензотиазол-2-ил]-3-этилмочевина [пример 143]. Перемешиваемую смесь 1-(5,7-дибромбензотиазол-2-ил)-3-этилмочевины (100 мг, 0,264 ммоль),порошкообразного трехосновного фосфата калия (67 мг, 0,317 ммоль), комплекса 1,1'-бис(дифенилфосфин)ферроцен-хлорид палладия(II) (32 мг, 0,0386 ммоль), 3-метокси-5-пиридинбороновой кислоты пинаколового эфира (248 мг, 1,056 ммоль) в безводном 1,4-диоксане (1,8 мл) и безводном метаноле (3,6 мл) промывали азотом в течение 5 мин и нагревали в течение 16 ч при 80 С. Реакционную смесь отфильтровывали через целит и промывали этилацетатом. Фильтрат выпаривали под вакуумом,получали сырую 1-[5,7-бис-(5-метоксипиридин-3-ил)бензотиазол-2-ил]-3-этилмочевину, которую очищали методом препаративной HPLC, получая твердое вещество коричневого цвета (20 мг, 17%). 1 Н NMR[M+H]+. Rt=2.52 мин. Аналогичным способом получали следующие соединения: Стадия 1. 4-Бром-2,6-динитроанилин. Перемешиваемую суспензию 2,6-динитроанилина (5 г, 27,3 ммоль) в ледяной уксусной кислоте (50 мл) по каплям обрабатывали бромом (1,5 мл, 30 ммоль) и нагревали в течение 2 ч при температуре 120 С. После охлаждения до комнатной температуры полученную смесь выливали в воду (500 мл). Осадившийся твердый продукт отфильтровывали, промывали водой и сушили под вакуумом, получали 4 бром-2,6-динитроанилин в виде твердого вещества желтого цвета (6,5 г, 91%). 1 Н NMR (400 МГц,CDCl3):8.45 (2 Н, br s), 8.65 (2 Н, s). Стадия 2. 2,6-Динитро-4-пиридн-3-иланилин. Раствор 4-бром-2,6-динитроанилина (3 г, 11,45 ммоль) в 1,2-динитроанилина (3 г, 11,45 ммоль) в 1,2-диметоксиэтана (83 мл) при перемешивании промывали азотом в течение 15 мин и обрабатывали водным раствором кислого карбоната натрия (1 М, 22,8 мл), затем добавляли пиридин-3-бороновую кислоту (2,1 г, 17,17 ммоль) и комплекс 1,1-бис-(дифенилфосфин)ферроцен-хлорид палладия(II) (0,94 г,1,15 ммоль). Полученную смесь кипятили с обратным холодильником в атмосфере азота в течение 18 ч. После охлаждения до комнатной температуры смесь темного цвета разбавляли насыщенным водным раствором кислого карбоната натрия (300 мл) и экстрагировали этилацетатом (3250 мл). Экстракт высушивали (MgSO4), удаляли растворитель под вакуумом, получая остаток, который очищали методом флэш-хроматографии (двуокись кремния), элюируя 30-100% этилацетата в 40-60 петролейного эфира. Получали 2,6-динитро-4-пиридин-3-иланилин желтого цвета (1,46 г, 49%). 1 Н NMR (400 МГц, CDCl3):7.44 (1H, m), 7.90 (1H, m), 8.56 (2 Н, br s), 8.68 (1H, m), 8.80 (2 Н, s), 8.87 (1H, d). Стадия 3. 3-(3,5-Динитро-4-тиоцианатфенил)пиридин. Суспензию 2,6-динитро-4-пиридин-3-иланилина (1,24 г, 4,76 ммоль) в водной серной кислоте (50% об./об., 12 мл) перемешивали при комнатной температуре в течение 1 ч перед охлаждением на ледяной бане и в течение 5 мин обрабатывали водным раствором нитрита натрия (20% вес./об., 2,0 мл). Смесь перемешивали в течение 1,5 ч на холоде, затем обрабатывали раствором тиоцианата калия (0,6 г) в воде(1,4 мл), добавляемым одной порцией. Полученную смесь перемешивали в течение 15 мин на холоде и затем добавляли к суспензии тиоцианата меди(I) (1,0 г) в воде, охлаждая смесь на ледяной бане. Смесь перемешивали на холоде 2 ч и затем нагревали в течение 20 мин при 70 С. После охлаждения до комнатной температуры смесь выливали в насыщенный водный раствор кислого карбоната натрия (200 мл) и экстрагировали этилацетатом (3100 мл), экстракт промывали рассолом (200 мл) и сушили (MgSO4). Растворитель удаляли под вакуумом с получением остатка, который очищали флэш-хроматографией (двуокись кремния), элюируя 80-100% этилацетата в 40-60 петролейного эфира. Получали 3-(3,5-Динитро-4-тиоцианатфенил)пиридин (1,07 г, 74%). 1H NMR(400 МГц, CDCl3):7.54 (1H, m), 7.99 (1H, m), 8.49 (2H, s), 8.82 (1H, m), 8.95 (1H,d). Стадия 4. 7-Нитро-5-пиридин-3-илбензотиазол-2-иламин. Раствор 3-(3,5-динитро-4-тиоцианатфенил)пиридина (0,66 г, 2,19 ммоль) в ледяной уксусной кислоте (15 мл) обрабатывали порошком железа (0,61 г, 11,0 ммоль) и перемешивали в течение 16 ч при комнатной температуре. Полученную смесь разбавляли водой (200 мл) и подщелачивали путем добавления концентрированного раствора аммиака. Твердый продукт собирали на фильтре, промывали водой и затем этилацетатом. Отфильтрованное твердое вещество обрабатывали кипящим этанолом (3200 мл), который удаляли под вакуумом, получая 7-нитро-5-пиридин-3-илбензотиазол-2-иламин в виде бледножелтого твердого продукта (0,57 г, 95%). LC-MS m/z 273 [М+Н]+. Rt=2.24 мин. Стадия 5. 1-Этил-3-(7-нитро-5-пиридин-3-илбензотиазол-2-ил)мочевина. Смесь 7-нитро-5-пиридин-3-илбензотиазол-2-иламина (100 мг, 0,3676 ммоль), этилизоцианата (0,18 мл, 1,831 ммоль) и дибутилоловодиацетата (10 кап) в безводном 1,4-диоксане (10 мл) при перемешивании в герметичном сосуде нагревали при 100 С в течение 16 ч. После охлаждения до комнатной темпе- 26019748 ратуры осадок собирали на фильтре, промывали 1,4-диоксаном и сушили под вакуумом, получая 1-этил 3-(7-нитро-5-пиридин-3-илбензотиазол-2-ил)мочевину в виде твердого продукта желтого цвета (30 мг,24%). LC-MS m/z 344 [М+Н]+. Rt=2.59 мин. Стадия 6. 1-(7-Амино-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевина [пример 149]. Перемешиваемую суспензию 1-этил-3-(7-нитро-5-пиридин-3-илбензотиазол-2-ил)мочевина (25 мг,0,0728 ммоль) в этаноле (0,5 мл) и концентрированную соляную кислоту (0,5 мл) обрабатывали хлоридом олова(II) (69 мг, 0,364 ммоль) и нагревали в течение 5 ч при температуре 80 С. После охлаждения до комнатной температуры смесь разбавляли водой (50 мл) и подщелачивали (до рН 11) путем добавления концентрированного аммиака. 1-(7-Амино-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевину экстрагировали этилацетатом (350 мл), экстракт сушили (MgSO4), растворитель удаляли под вакуумом, получая твердый продукт неправильного белого цвета (37 мг), который применяли без очистки. 1 Н NMR (400 МГц, DMSO-d6):1.14 (3 Н, t), 3.24 (2 Н, m), 5.63 (2 Н, br s), 6.79 (1 Н, br t), 6.80 (1 Н, s), 7.22 (1 Н, br s), 7.50(1H, m), 8.03 (1H, d), 8.58 (1H, d), 8.86 (1H, s), 10.62 (1H, brs). Стадия 7. 1-Этил-3-[2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7-ил]мочевина [пример 150]. Перемешиваемую смесь 1-(7-амино-5-пиридин-3-илбензотиазол-2-ил)-3-этилмочевины (15 мг, 0,048 ммоль), этилизоцианата (0,03 мл) и дибутилоловодиацетата (2 капли) в безводном 1,4-диоксане (2 мл) нагревали в герметичном сосуде при 100 С в течение 16 ч. После охлаждения до комнатной температуры методом препаративной HPLC выделяли 1-этил-3-[2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7 ил]мочевину в виде твердого вещества белого цвета (5,4 мг, 29%). 1 Н NMR (400 МГц, CD3OD):1.23 Стадия 1. 5-Бром-3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты метиловый эфир. Трифторуксусный ангидрид (120 мл) при перемешивании охлаждали на бане со смесью льда и соли и в течение 5 мин обрабатывали метил-2-амино-5-бромбензоатом (10 г, 43,5 ммоль), поддерживая температуру ниже 6 С. После завершения добавления полученную суспензию перемешивали на холоде еще в течение 15 мин и добавляли одной порцией нитрат калия (5,27 г, 52,2 ммоль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Полученную смесь концентрировали выпариванием, остаток разбавляли насыщенным водным раствором кислого карбоната натрия (300 мл) и обрабатывали этилацетатом (3250 мл), экстракты промывали рассолом (300 мл) и высушивали(MgSO4). Растворитель удаляли под вакуумом, получали сырой продукт, который очищали методом флэш-хроматографии (двуокись кремния), элюируя 10-90% этилацетата в 40-60 петролейного эфира. Побочный продукт (5-бром-2-(2,2,2-трифторацетиламино)бензойной кислоты метиловый эфир) элюировали до 5-бром-3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты метилового эфира, который представлял собой твердое вещество желтого цвета (11,1 г, 69%). 1 Н NMR (400 МГц, CDCl3):4.03 (3 Н, s),7.26 (1H, s), 8.33 (1 Н, d), 8.44 (1H, d), 11.23 (1H, brs). Стадия 2. 2-Амино-5-бром-3-нитробензойной кислоты метиловый эфир. Перемешиваемую суспензию 5-бром-3-нитро-2-(2,2,2-трифторацетиламино)бензойной кислоты метилового эфира (8 г, 21,56 ммоль) в метаноле (150 мл) обрабатывали соляной кислотой (6 М, 75 мл) и нагревали в течение 16 ч при 80 С. После охлаждения до комнатной температуры твердый продукт желтого цвета отфильтровывали и промывали холодной водой, сушили под вакуумом, получали 2-амино-5 бром-3-нитробензойной кислоты метиловый эфир (5,0 г, 84%). 1 Н NMR (400 МГц, CDCl3):3.99 (3 Н, s),8.33 (1H, d), 8.40 (2 Н, br s), 8.51 (1H, d). Стадия 3. 2-Амино-3-нитро-5-пиридин-3-илбензойной кислоты метиловый эфир. Перемешиваемый раствор 2-амино-5-бром-3-нитробензойной кислоты метилового эфира (2 г, 7,27 ммоль) в 1,2-диметоксиэтане (53 мл) промывали азотом в течение 15 мин и обрабатывали водным раствором кислого карбоната натрия (1 М, 14,5 мл), затем пиридин-3-бороновой кислотой (1,33 г, 10,9 ммоль) и комплексом 1,1-бис-(дифенилфосфин)ферроцен-хлорид палладия(II) (0,6 г, 0,733 ммоль). Полу- 27019748 ченную смесь кипятили с обратным холодильником в атмосфере азота в течение 18 ч. После охлаждения до комнатной температуры смесь темного цвета разбавляли насыщенным водным раствором кислого карбоната натрия (300 мл) и экстрагировали этилацетатом (3250 мл). Экстракты промывали рассолом(200 мл), сушили (MgSO4), растворитель удаляли под вакуумом, получая остаток, который очищали методом флэш-хроматографии (двуокись кремния), элюируя 30-100% этилацетата в 40-60 петролейного эфира. 2-Амино-3-нитро-5-пиридин-3-илбензойной кислоты метиловый эфир получали в виде твердого продукта желтого цвета (1,1 г, 56%). 1 Н NMR (400 МГц, CDCl3):3.97 (3 Н, s), 7.39 (1H, m), 7.87 (1H, m),8.52 (1H, d), 8.55 (2H, br s), 8.62 (1H, m), 8.65 (1H, d), 8.84 (1H, m). Стадия 4. 3-Нитро-5-пиридин-3-ил-2-тиоцианатбензойной кислоты метиловый эфир. Суспензию 2-амино-3-нитро-5-пиридин-3-илбензойной кислоты метилового эфира (0,92 г, 3,37 ммоль) в водной серной кислоте (50% об./об., 9 мл) перемешивали при комнатной температуре в течение 1 ч, затем охлаждали на ледяной бане и обрабатывали в течение 5 мин водным раствором нитрита натрия(20% вес./об., 1,4 мл). Смесь перемешивали на холоде в течение 1,5 ч, затем обрабатывали раствором тиоцианата калия (0,42 г) в воде (1,0 мл), добавляя его одной порцией. Полученную смесь перемешивали 15 мин на холоде и затем добавляли к суспензии тиоцианата меди(I) в воде (2,8 мл) при охлаждении на ледяной бане. Смесь перемешивали на холоде в течение 2 ч и затем нагревали в течение 20 мин до 70 С. После охлаждения до комнатной температуры смесь выливали в насыщенный водный раствор кислого карбоната натрия (200 мл) и обрабатывали этилацетатом (3100 мл), экстракты промывали рассолом (200 мл) и высушивали (MgSO4). Растворитель удаляли под вакуумом, остаток очищали методом флэшхроматографии (двуокись кремния), элюируя 80-100% этилацетата в 40-60 петролейного эфира. 3-Нитро 5-пиридин-3-ил-2-тиоцианатбензойной кислоты метиловый эфир получали в виде твердого продукта бледно-желтого цвета (0,78 г, 74%). 1 Н NMR (400 МГц, CDCl3):4.12 (3 Н, s), 7.49 (1 Н, m), 7.96 (1H, m),8.34 (1H, d), 8.40 (1H, d), 8.76 (1H, m), 8.92 (1H, d). Стадия 5. 2-Амино-5-пиридин-3-илбензотиазол-7-карбоновой кислоты метиловый эфир. Раствор 3-нитро-5-пиридин-3-ил-2-тиоцианатбензойной кислоты метилового эфира (1,1 г, 3,49 ммоль) в ледяной уксусной кислоте (23 мл) обрабатывали порошкообразным железом (0,97 г, 17,5 ммоль) и перемешивали при комнатной температуре в течение 16 ч. Полученную смесь разбавляли водой(200 мл) и подщелачивали путем добавления концентрированного раствора аммиака. Смесь отфильтровывали, фильтрат экстрагировали этилацетатом (3200 мл). Отфильтрованный твердый продукт обрабатывали кипящим этанолом (3250 мл) и объединенные органические фракции выпаривали досуха, получали 2-амино-5-пиридин-3-илбензотиазол-7-карбоновой кислоты метиловый эфир в виде продукта неправильного белого цвета (0,46 г, 46%). 1 Н NMR (400 МГц, DMSO-d6):3.98 (3 Н, s), 7.55 (1H, m), 7.81[пример 151]. Перемешиваемую смесь 2-амино-5-пиридин-3-илбензотиазол-7-карбоновой кислоты метилового эфира (20 мг, 0,07 ммоль), этилизоцианата (0,03 мл, 0,35 ммоль) и дибутилоловодиацетата (2 капли) в безводном 1,4-диоксане (1,5 мл) нагревали, используя микроволновое излучение в реакторе СЕМ Discover при температуре 125 С в течение 1 ч. После охлаждения до комнатной температуры выделяли 2-(3 этилуреидо)-5-пиридин-3-илбензотиазол-7-карбоновой кислоты метиловый эфир методом препаративнойHPLC, получали твердый продукт белого цвета (7,4 мг, 30%). 1 Н NMR (400 МГц, CDCl3+CD3OD):1.26(1H, d). LC-MS m/z 357 [М+Н]+. Rt=2.25 мин. Стадия 7. 2-(3-Этилуреидо)-5-пиридин-3-илбензотиазол-7-карбоновой кислоты этиламид [пример 152] и 2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7-карбоновая кислота. Смесь 2-амино-5-пиридин-3-илбензотиазол-7 карбоновой кислоты метилового эфира (125 мг, 0,439 ммоль), этилизоцианата (0,21 мл, 2,187 ммоль) и дибутилоловодиацетата (12 капель) в безводном 1,4 диоксане (10 мл) нагревали в герметичном сосуде при температуре 100 С в течение 16 ч. После охлаждения до комнатной температуры растворитель удаляли под вакуумом, получая 2-(3-этилуреидо)-5 пиридин-3-илбензотиазол-7-карбоновой кислоты метиловый эфир, который применяли без очистки. Перемешиваемую смесь 2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7-карбоновой кислоты метилового эфира (78 мг, 0,22 ммоль) и водного раствора этиламина (70% вес./об., 3 мл) нагревали при помощи микроволнового излучения в реакторе СЕМ Discover при температуре 100 С в течение 1 ч. Реакционную смесь очищали методом препаративной HPLC, получали 2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7 карбоновой кислоты этиламид в виде твердого продукта белого цвета (8,7 мг, 5%). 1 Н NMR (400 МГц,CDCl3+CD3OD):1.28 (6 Н, m), 3.40 (2 Н, m), 3.53 (2 Н, m), 7.51 (1H, m), 7.99 (2 Н, d), 8.12 (1H, d), 8.35 (1H,br d), 8.57 (1H, br s), 8.91 (1H, s). LC-MS m/z 370 [М+Н]+. Rt=2.05 мин. Была также выделена 2-(3-этилуреидо)-5-пиридин-3-илбензотиазол-7-карбоновая кислота в виде твердого продукта белого цвета (2,5 мг, 2%). LC-MS m/z 343 [М+Н]+. Rt=1.91 мин.(319 мг, 0,895 ммоль) в метаноле (10 мл) обрабатывали гидразингидратом (2 мл) и перемешивали при комнатной температуре в течение 16 ч. HPLC показала, что реакционная смесь все еще содержала значительное количество исходного вещества, поэтому добавляли еще 1 мл гидразингидрата и продолжали перемешивание в течение 24 ч. Полученную смесь разбавляли водой (25 мл), затем этанолом (25 мл) и сушили под вакуумом, получали 1-этил-3-(7-гидразинкарбонил-5-пиридин-3-илбензотиазол-2 ил)мочевину в виде твердого продукта неправильного белого цвета (312 мг, 98%). 1H NMR (400 МГц,DMSO-d6):1.15 (3H, t), 3.26 (2H, m), 4.69 (2H, br s), 6.86 (1H, br t), 7.57 (1H, m), 8.15 (1H, s), 8.22 (1H, s),8.29 (1H, d), 8.65 (1H, d), 9.12 (1H, s), 10.24 (1H, br s), 10.71 (1H,brs). LC-MS m/z 357 [M+H]+. Rt=2.22 мин. Схема 9(45 мг, 0,05 ммоль), 3-метокси-5-пиридин-бороновой кислоты пинаколового эфира (186 мг, 0,79 ммоль) в диметилформамиде (8 мл) и воды (2 мл) промывали азотом в течение 5 мин и нагревали при температуре 100 С в течение 1 ч. Реакционную смесь концентрировали под вакуумом, затем распределяли между этилацетатом и водой. Органическую фазу высушивали (MgSO4), отфильтровывали и концентрировали под вакуумом. Сырой продукт очищали методом хроматографии на силикагеле, элюируя 0-5% метанола в этилацетате, получали 1-[7-бром-5-(5-метоксипиридин-3-ил)бензотиазол-2-ил]-3-этилмочевину 1 в виде твердого продукта белого цвета (49 мг, 15%). 1 Н NMR (400 МГц, CDCl3):1.25 (3 Н, t), 3.39 (2 Н, q), 3.98THF). Смесь продували азотом, затем нагревали при температуре 60 С в течение 16 ч. Полученную реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и затем рассолом. Органическую фазу высушивали (MgSO4) и концентрировали под вакуумом. Сырой продукт очищали методом препаративной HPLC, получали 1-этил-3-[5-(5-метоксипиридин-3-ил)-7 пиридин-2-илбензотиазол-2-ил]мочевину в виде продукта белого цвета (25 мг, 27%). 1 Н NMR (400 МГц,CDCl3):1.31 (3 Н, t), 3.48 (2 Н, q), 3.90 (3 Н, s), 7.21 (1H, m), 7.50 (1H, s), 7.80 (1H, m), 8.32 (1H, s), 8.57
МПК / Метки
МПК: C07D 277/00, C07D 277/62, A61K 31/4406, A61K 31/4402, A61K 31/497, A61K 31/428, A61P 31/04
Метки: антибактериальные, композиции
Код ссылки
<a href="https://eas.patents.su/30-19748-antibakterialnye-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Антибактериальные композиции</a>
Предыдущий патент: Лактамные соединения и их применение в качестве фармацевтических препаратов
Следующий патент: Противовирусные соединения
Случайный патент: Устройство для инъекции одноразового пользования