Атропизомеры 3-арил-4(3н)-хиназолинонов и их использование в качестве антагонистов амра-рецепторов
Формула / Реферат
1. Атропизомер формулы
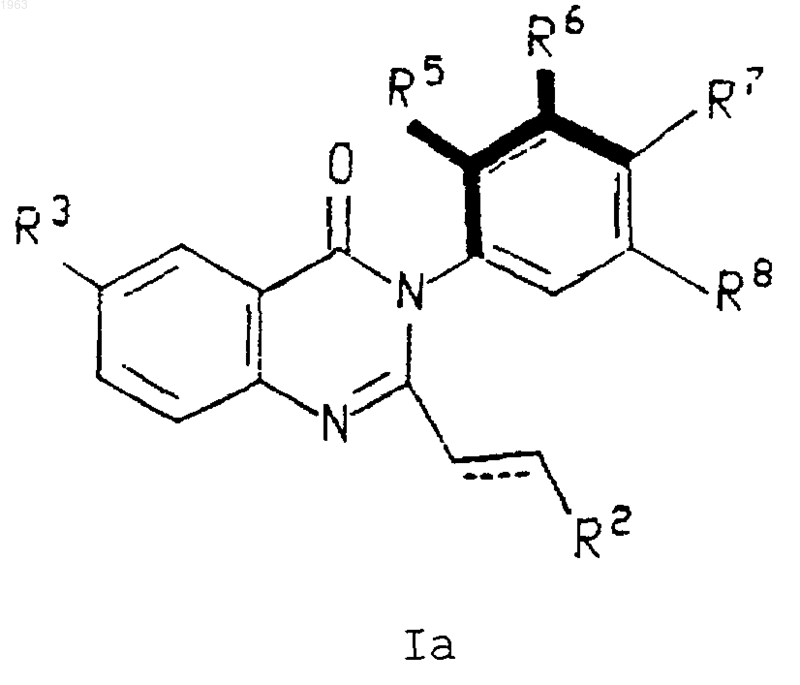
где R2 представляет фенильную группу формулы Ph2 или пяти- или шестичленный гетероцикл;
где указанный 6-членный гетероцикл имеет формулу
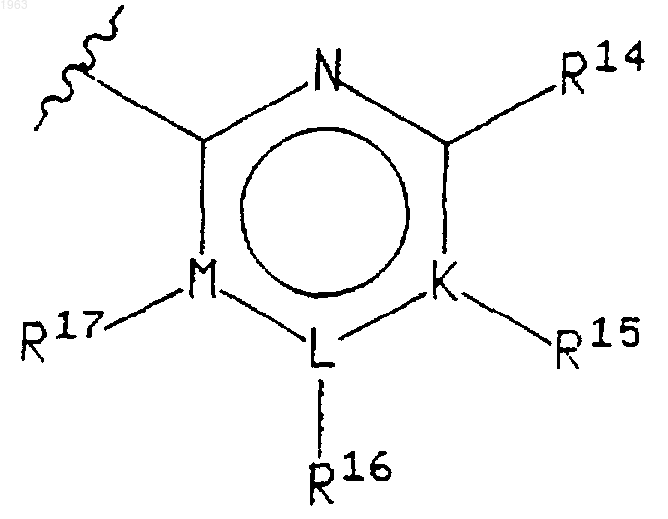
где N представляет азот; где атомы указанных положений кольца K, L и М могут быть независимо выбраны из углерода и азота, при условии, что i) только один из K, L и М может быть азотом и ii) когда K, L или М представляет азот, то соответствующий ему заместитель R15, R16 или R17 отсутствует;
где указанный пятичленный гетероцикл имеет формулу
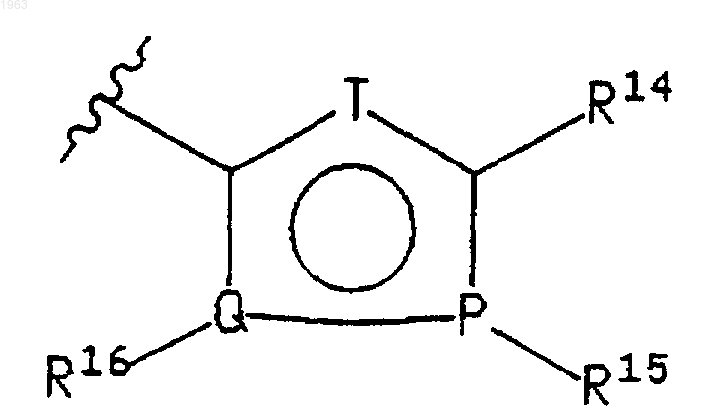
где указанный Т представляет -СН-, N, NH, О или S, где атомы указанных положений кольца Р и Q могут быть независимо выбраны из углерода, азота, кислорода или серы; при условии, что (i) только один из Р, Q или Т может быть кислородом, NH или серой; (ii) по крайней мере, один из Р, Q или Т должен быть гетероатомом; и (iii) когда Р или Q представляет кислород или серу, то соответствующий ему заместитель R15 или R16 отсутствует;
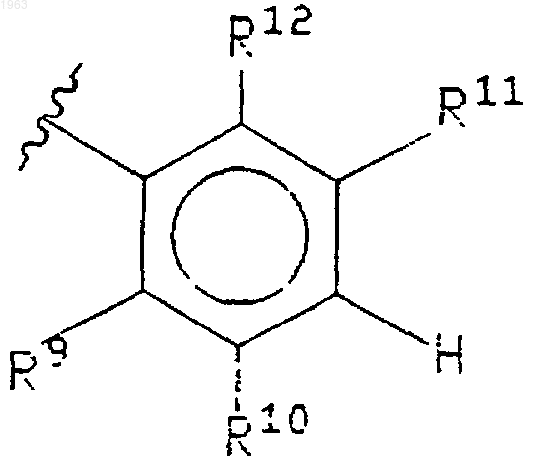
где указанный Ph2 представляет группу формулы
R3 представляет водород, галоген, -CN, -NO2, CF3, (С1-С6)алкил или (С1-С6)алкокси;
R5 представляет водород, (С1-С6)алкил, галоген, СF3, (С1-С6)алкокси или (С1-С6)алкилтиол;
R6 представляет водород или галоген;
R7 представляет водород или галоген;
R8 представляет водород или галоген;
R9 представляет водород, галоген, СF3, (С1-С6)алкил, необязательно замещенный от одного до трех атомами галогена, (С1-С6)алкокси, необязательно замещенный от одного до трех атомами галогена, (С1-С6)алкилтиол, амино-(СН2)s-, (С1-С6)алкил-NH-(CH2)s-, ди(С1-С6)алкил-N-(CH2)s-, (С3-С7)циклоалкил-NH-(СН2)s-, H2N-(C=O)-(СН2)s-, (С1-С6)алкил-HN-(C=O)-(СН2)s-, ди(С1-С6-алкил)-N-(С=O)-(СН2)s-, (С3-С7)циклоалкил-NH-(С=O)-(СН2)s-, R13O-(СН2)s-, R13O-(С=O)-(СН2)s-, Н(O=С)-NH-(СН2)s-, (С1-С6)алкил-(O=С)-NH-(СН2)s-,
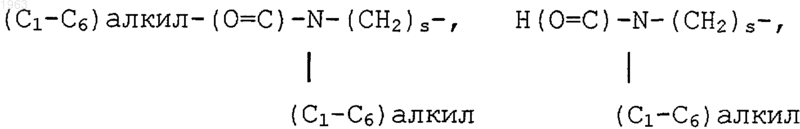
Н-(С=O)-(СН2)s-, С1-С6(алкил)-(С=O)-, гидрокси, гидрокси-(С1-С6)алкил-, (С1-С6)алкил-O-(С1-С6)алкил-, и -CN;
R10 представляет водород или галоген;
R11 и R14 выбирают, независимо, из водорода, галогена, СF3, (С1-С6)алкила, необязательно замещенного от одного до трех атомами галогена, (С1-С6)алкокси, необязательно замещенного от одного до трех атомами галогена, (С1-С6)алкилтиол, амино-(СН2)р-, (С1-С6)алкил-NН-(СН2)р-, ди(С1-С6)алкил-N-(СН2)р-, (С3-С7)циклоалкил-NH-(СН2)р-, амино-(С1-С6)алкил-NH-(СН2)р-, (С1-С6)алкил-NH-(С1-С6)алкил-NН-(СН2)р-, ди(С1-С6)алкил-N-(С1-С6)алкил-NH-(СН2)p-,
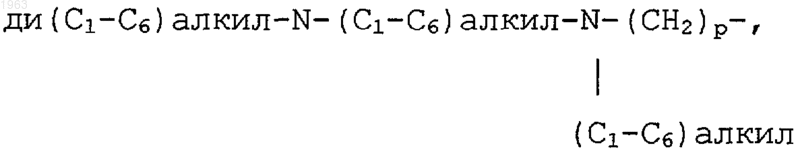
Н2N-(С=O)-(СН2)р-, (С1-С6)алкил-HN-(СО)-(СН2)р-, ди(С1-С6)алкил-N-(С=O)-(СН2)р-, (С3-С7)циклоалкил-NH-(С=O)-(СН2)р-, R13O-(СН2)р-, R13O-(C=O)-(СН2)р-, Н(O=С)-O-, Н(O=С)-O-(С1-С6)алкил-, Н(O=С)-NH-(СН2)р-, (С1-С6)алкил-(O=C)-NH-(СН2)р-, -СНО, Н-(С=O)-(СН2)р-, (С1-С6)алкил-(С=O)-(СН2)р-,
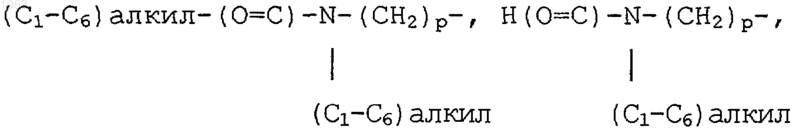
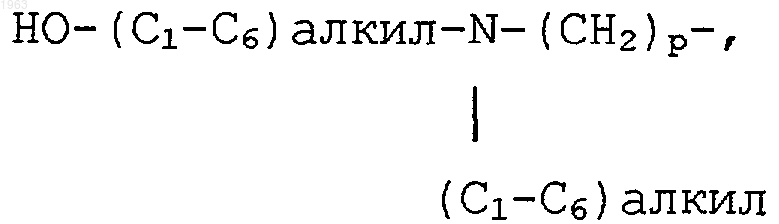
(С1-С6)алкил-(С=O)-О-(СН2)р-, амино-(С1-С6)алкил-(С=O)-О-(СН2)р-, (С1-С6)алкил-NH-(С1-С6)алкил-(С=O)-О-(СН2)р-, ди(С1-С6)алкил-N-(С1-С6)алкил-(С=O)-О-(СН2)р-, амино-(С1-С6) алкил-O-(С=O)-(СН2)р-, (С1-С6)алкил-NH-(С1-С6) алкил-O-(С=O)-(СН2)р-, ди(С1-С6)алкил-N-(С1-С6)алкил-O-(С=O)-О-(СН2)р-, гидрокси, гидрокси-(С1-С6)алкил-, гидрокси-(С1-С6)алкил-NH-(СН2)р-, (С1-С6)алкил-O-(С1-С6)алкил-, -CN, пиперидин-(СН2)р-, пирролидин-(СН2)p- и 3-пирролин-(СН2)p-, где указанные пиперидин, пирролидин и 3-пирролин в упомянутых частей пиперидин-(СН2)p-, пирролидин-(СН2)p- и 3-пирролин-(СН2)p- могут быть необязательно замещены на любом из атомов углерода кольца, способных иметь дополнительную связь, предпочтительно от нуля до двух заместителей, заместителем, независимо выбранным из галогена, СF3, (C1-С6)алкила, необязательно замещенного от одного до трех атомами галогена, (C1-C6)алкокси, необязательно замещенного от одного до трех атомами галогена, (C1-C6)алкилтиол, амино-(СН2)p-, (C1-C6)алкил-NH-(СН2)p-, ди(C1-C6)алкил-N-(СН2)p-, (C3-C7)циклоалкил-NH-(СН2)p-, амино-(C1-C6)алкил-NH-(СН2)p-, (C1-C6)алкил-NH-(C1-C6)алкил-NH-(СН2)p-, ди (C1-C6)алкил-N-(C1-C6)алкил-NH-(СН2)p-, (C1-C6)алкил-O-(C1-C6)алкил-, ди(C1-C6)алкил-N- (C1-C6)алкил-N-(CH2)p-,
½
(C1-C6)алкил
H2N-(C=O)-(СН2)p-, (C1-C6)алкил-НN=(С=O)-(СН2)p-, ди(C1-C6)алкил-N-(С=O)-(СН2)p-, (С3-С7)циклоалкил-NН-(C=O)-(СН2)p-, R13O-(C=O)-(СН2)p-, Н(O=С)-O-, Н(O=С)-O-(C1-C6)-алкил-, H(O=C)-NH-(СН2)p-, (C1-C6)алкил-(O=C)-NH-(СН2)p-, -CHO, Н-(С=O)-(СН2)p-, (C1-C6)алкил-(C=O)-,
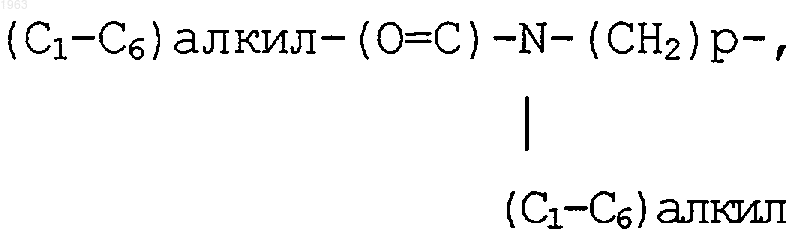

(C1-C6)алкил-(C=O)-O-NH-(СН2)p-, амино-(C1-C6)алкил-(С=O)-О-(СН2)p-, (C1-C6)алкил-NH-(C1-C6)алкил-(С=O)-О-(СН2)p-, ди(C1-C6)алкил-N-(C1-C6)алкил-(С=O)-О-(СН2)p-, гидрокси, гидрокси-(C1-C6)алкил-, гидрокси-(C1-C6)алкил-NH-(СН2)p- и -CN;
R12 представляет водород, -CN или галоген;
R13 представляет водород, (C1-C6)алкил, (C1-C6)алкил-(С=O)-; (C1-C6)алкил-O-(С=O)-; (C1-C6)алкил-NH-(C1-C6)алкил; ди(C1-C6)-алкил-N-(C1-C6)алкил-; (C1-C6)алкил-NH-(С=O)- или ди(C1-C6)-алкил-N-(СО)-;
R15 представляет водород, -CN, (C1-C6)алкил, галоген, СF3, -СНО или (C1-C6)алкокси;
R16 представляет водород, -CN, (C1-C6)алкил, галоген, СF3, -СНО или (C1-C6)алкокси;
R17 представляет водород, -CN, (C1-C6)алкил, амино-(C1-C6)алкил-, (C1-C6)алкил-NH-(C1-C6)алкил-, ди(C1-C6)алкил-N-(C1-C6)алкил-, галоген, СF3, -СНО или (C1-C6)алкокси;
n равно целому числу от нуля до 3;
каждый р независимо равен целому числу от нуля до 4;
s равно целому числу от нуля до 4;
где пунктирная линия представляет необязательную двойную связь;
и фармацевтически приемлемые соли таких соединений.
2. Соединение по п.1, где R3 представляет водород, галоген или (C1-C6)алкил.
3. Соединение по п.1, где один из R5, R6, R7 или R8 представляет фтор, бром, хлор, метил или трифторметил.
4. Соединение по п.1, где R5 представляет фтор, бром, хлор, метил или трифторметил.
5. Соединение по п.2, где R5 представляет фтор, бром, хлор, метил или трифторметил.
6. Соединение по п.1, где R2 представляет Ph2 и либо R9 представляет фтор, хлор, -CN или гидрокси; либо R11 представляет -СНО, хлор, фтор, метил, (C1-C6)алкил-NH-(CH2)p-, ди(C1-C6)алкил-N-(CH2)p- или циано.
7. Соединение по п.2, где R2 представляет Ph2 и либо R9 представляет фтор, хлор, -CN или гидрокси; либо R11 представляет -СНО, хлор, фтор, метил, (C1-C6)алкил-NH-(CH2)p-, ди(C1-C6)алкил-N-(CH2)p- или циано.
8. Соединение по п.1, где R2 представляет гетероарил, где указанный гетероарил представляет либо необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод или К и L представляют углерод и М представляет азот (т.е. пиримидин-2-ил), либо указанный гетероарил представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот, Р представляет серу и Q представляет углерод или Т представляет азот или серу, Q представляет азот или серу и Р представляет углерод, или Т представляет кислород и Р и Q, каждый, представляют углерод.
9. Соединение по п.1, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод и где R14 представляет водород, -СНО, хлор, фтор, метил, (C1-C6)алкил-NH-(CH2)p-, ди(C1-C6) алкил-N-(CH2)p- или циано; R17 представляет водород, -СНО, хлор, фтор, метил, (C1-C6)алкил-NH-(C1-C6)алкил, ди(C1-C6)алкил-N-(C1-C6)алкил или циано или R15 или R16 независимо представляют водород, -СНО, хлор, фтор, метил или циано.
10. Соединение по п.1, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод и R14 представляет водород, -СНО, метил, (C1-C6)алкил-NH-(CH2)p-, ди(C1-C6)алкил-N-(CH2)p- или циано.
11. Соединение по п.1, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот, Р представляет серу и Q представляет углерод и R14, R15 или R16, каждый независимо представляет водород, хлор, фтор, метил или циано.
12. Соединение по п.1, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот или серу, Q представляет серу или азот и Р представляет углерод, и R14 или R15 независимо выбирают из водорода, хлора, фтора, метила или циано.
13. Соединение по п.1, где упомянутое соединение выбирают из группы, состоящей из
(S)-3-(2-хлорфенил)-2-[2-(5-диэтиламинометил-2-фторфенил)винил]-6-фтор-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)-винил]-6-фтор-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-2-[2-(4-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-2-[2-(6-этиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-она;
(S)-3-(2-бромфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил]-6-фтор-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-6-фтор-2-[2-(6-метоксиметилпиридин-2-ил)винил]-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-6-фтор-2-[2-(4-метилпиримидин-2-ил)винил]-3Н-хиназолин-4-она;
(S)-3-(2-хлорфенил)-6-фтор-2-{2-[6-(изопропиламинометил)пиридин-2-ил]этил}-3Н-хиназолин-4-она и
(S)-6-фтор-2-[2-(2-метилтиазол-4-ил)винил]-3-(2-метилфенил)-3Н-хиназолин-4-она.
14. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии (например, состояний, вызванных странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащая количество соединения по п.1, эффективное для лечения или профилактики такого состояния, и фармацевтически приемлемый носитель.
15. Способ лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсшш, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой или чрезмерной дозой лекарственного сердца или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм, и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1, эффективного для лечения или профилактики такого состояния.
16. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащая количество соединения по п.1, эффективное для создания антагонизма АМРА-рецептору, и фармацевтически приемлемый носитель.
17. Способ лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического нейронного повреждения, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1, эффективного для создания антагонизма АМРА-рецептору.
Текст
1 Предпосылки создания изобретения Данное изобретение относится к атропизомерам 3-арил-4(3 Н)-хиназолинонов формулыI, описанной ниже, и их фармацевтически приемлемым солям и фармацевтическим композициям и способам лечения нейродегенеративных и связанных с травмами ЦНС состояний. Атропизомеры являются изомерными соединениями, которые хиральны, т.е. каждый изомер не способен накладываться на его зеркальное изображение, и изомеры, после того,как они разделены, вращают поляризованный свет в равной степени, но в противоположных направлениях. Атропизомеры отличаются от энантиомеров тем, что атропизомеры не имеют один асимметричный атом. Атропизомеры представляют собой конформационные изомеры, которые имеют место, когда вращение вокруг одинарной связи в молекуле предотвращается или значительно замедляется в результате стерических взаимодействий с другими частями молекулы и заместители на обоих концах одинарной связи несимметричны. Подробное описание атропизомеров можно найти у Jerry(1983). Соединения данного изобретения представляют первое доказательство того, что атропизомеры хиназолинонов разделимы и что разделенные изомеры обладают разной антагонистической активностью в отношении АМРАрецепторов. (АМРА-рецепторы: представляют собой подвиды рецепторов глутаматов, идентифицированных благодаря их способности связывать -амино-3-гидрокси-5-метил-4-изоксазолпропионовую кислоту (АМРА), которые являются рецепторами постсинаптических нейромедиаторов для возбуждающих аминокислот).Colebrook et al., Can. J. Chem., 53, 3431-4 (1975),наблюдали затрудненное вращение вокруг арильных C-N-связей в хиназолинонах, но не разделили или предположили, что ротационные изомеры не могут быть разделены. Заявка на патент Соединенных Штатов 60/017738, зарегистрированная 15 мая 1996 и озаглавленная "Новые 2,3-дизамещенные 4(3 Н)-хиназолиноны", и заявка на патент Соединенных Штатов 60/017737, зарегистрированная 15 мая 1996 и озаглавленная "Новые 2,3-дизамещенные (5,6)гетероарилконденсированные пиримидин-4 оны, причем обе заявки включены здесь в качестве ссылки во всей их полноте, относятся к рацемическим хиназолинонам и пиримидинонам. Неожиданным образом, авторы данного изобретения обнаружили, что один изомер хиназолинона, определяемый пространственными расположениями заместителей, возникающими из-за стерических взаимодействий, обладает всей активностью антагониста АМРАрецептора. 2 Роль возбуждающих аминокислот, таких как глутаминовая кислота и аспарагиновая кислота, в качестве доминирующих медиаторов синаптической передачи возбуждения в центральной нервной системе была вполне доказана. Watkins and Evans, Ann. Rev. Pharmacol.(1989); Watkins, Krogsgaard-Larsen, and Honore,Trans. Pharm. Sci, 11, 25 (1990). Эти аминокислоты функционируют в синаптической передаче в основном через рецепторы возбуждающих аминокислот. Эти аминокислоты принимают участие также в различных других физиологических процессах, таких как моторная регуляция, дыхание, сердечно-сосудистая регуляция,сенсорное восприятие и познание. Рецепторы возбуждающих аминокислот классифицируют на два основных типа. Рецепторы, которые непосредственно ассоциируются с открытием катионных каналов в клеточной мембране нейронов, называют "ионотропными". Этот тип рецептора был подразделен, по меньшей мере, на три подтипа, которые определяются деполяризующими действиями селективных агонистов N-метил-D-аспартата (NMDA), амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты (AМРА) и каиновой кислоты(КА). Вторым общим типом является G-белок или второй, связанный с медиатором "метаботропный" рецептор возбуждающих аминокислот. Этот второй тип при активации агонистами квискуалатом,иботенатом или транс-1 аминоцикло-пентан-1,3-дикарбоновой кислотой вызывает повышенный гидролиз фосфоинозоитида в постсинаптической клетке. Оба типа рецепторов, по-видимому, не только опосредуют нормальную синаптическую передачу по пути возбуждения, но также участвуют в модификации синаптической связи в процессе развития и изменений в эффективности синаптической передачи на всем протяжении жизненного цикла.Schoepp Bockaert and Sladeczek, Trends in Pharmacol. Sci., 11, 508 (1990); McDonald and Johnson, Brain Research Reviews, 15, 41 (1990). Чрезмерная или нежелательная стимуляция рецепторов возбуждающих аминокислот ведет к повреждению или потере нервных клеток путем механизма, известного как токсичность при возбуждении. Предполагается, что этот процесс опосредует дегенерацию нейронов при различных состояниях. Медицинские последствия такой дегенерации нейронов приводят к тому, что снижение этих дегенеративных нейрологических процессов является важной терапевтической целью. Токсичность при возбуждении возбуждающими аминокислотами принимает участие в патофизиологии ряда нейрологических нарушений. Эта токсичность при возбуждении принимает участие в патофизиологии острых и хронических нейродегенеративных состояний, 3 включая церебральный дефицит после операции на сердце с шунтированием и трансплантации,удар, церебральную ишемию, травму спинного мозга, травму головы, болезнь Альцгеймера,хорею Гентингтона, боковой амиотрофический склероз, эпилепсию, СПИД-индуцированную деменцию, перинатальную гипоксию, гипоксию(например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма,асфиксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой или передозировкой лекарственного средства или алкоголя), остановку сердца, гипогликемическое нейронное повреждение, глазное повреждение и ретинопатию и идиопатическую или индуцированную лекарственным средством болезнь Паркинсона. Другие нейрологические состояния, которые вызываются глутаматной дисфункцией, требуют нейромодуляцию. Эти другие нейрологические состояния включают мышечные спазмы, мигреневые головные боли,недержание мочи, психоз, синдром отмены (например алкоголизм и привыкание к чрезмерному употреблению лекарственных средств,включая привыкание к опиатам, кокаину и никотину), толерантность к опиатам, тревожное состояние, рвоту, отек мозга, хроническую боль,судороги, почечную нейропатию, шум в ушах и позднюю дискинезию. Полагают, что использование нейрозащитного агента, такого как антагонист АМРА-рецептора полезно при лечении этих нарушений и/или снижения степени нейрологического повреждения, связанного с этими нарушениями. Антагонисты рецепторов возбуждающих аминокислот (ЕАА) можно использовать также в качестве аналгезирующих агентов. Несколькими исследованиями на моделях локальной и обширной ишемии было показано,что антагонисты АМРА-рецепторов являются нейрозащитными средствами. Было описано,что, являющийся конкурирующим антагонистом АМРА-рецептора NBQX (2,3-дигидрокси 6-нитро-7-сульфамоилбензо[f]хиноксалин), эффективен при профилактике обширного и локального ишемического повреждения. Sheardown et al., Science, 247, 571 (1900); Buchan etal., Neuroreport, 2, 473 (1991); LePeillet et al.,Brain Research, 571, 115 (1992). Было показано,что являющийся неконкурирующим антагонистом АМРА-рецептора GKYI 52466, является эффективным нейрозащитным агентом на моделях обширной ишемии у крыс. LaPeillet et al.,Brain Research, 571, 115 (1992). Эти исследования твердо свидетельствуют о том, что замедленная нейрональная дегенерация при мозговой ишемии включает в себя токсичность при глутаматном возбуждении, опосредованную, по меньшей мере частично, активацией АМРАрецептора. Таким образом, антагонисты АМРАрецептора могут оказаться полезными в качестве нейро защитных агентов и могут улучшить 4 нейрологическое последствие церебральной ишемии у людей. Краткое изложение сущности изобретения Данное изобретение относится к атропизомеру формулы где R2 представляет фенильную группу формулы Ph2 или пяти- или шестичленный гетероцикл; где указанный 6-членный гетероцикл имеет формулу где N представляет азот; где атомы указанных положений кольца К, L и М могут быть независимо выбраны из углерода и азота, при условии,что i) только один из К, L и М может быть азотом и ii) когда К, L или М представляет азот, то его соответствующий заместитель R15, R16 илиR17 отсутствует; где указанный пятичленный гетероцикл имеет формулу где указанный Т представляет -СН-, N, NH, О или S, где атомы указанных положений кольца Р и Q могут быть независимо выбраны из углерода, азота, кислорода и серы; при условии, что(i) только один из Р, Q или Т может быть кислородом, NH или серой; (ii) по меньшей мере один из Р, Q или Т должен быть гетероатомом; и (iii) когда Р или Q представляет кислород или серу,то соответствующий ему заместитель R15 илиR6 представляет водород или галоген;R7 представляет водород или галоген;R8 представляет водород или галоген;R9 представляет водород, галоген, СF3, (С 1 С 6)алкил, необязательно замещенный от одного до трех атомами галогена, (С 1-С 6)алкокси, необязательно замещенный от одного до трех атомами галогена, (С 1-С 6)алкилтиол, амино-(СН 2)s-,(С 1-С 6)алкил-NH-(СН 2)s-, ди(С 1-С 6)алкил-N-(СН 2)s-,(С 3-С 7)циклоалкил-NH-(СН 2)s-, H2N-(С=O)-(СН 2)s-,(С 1-С 6)алкил-HN-(С=O)-(СН 2)s-, ди(С 1-С 6 алкил)-N(C=O)-(СН 2)s-, (С 3-С 7)циклоалкил-NH-(C=O)-(СН 2)s-,R13O-(СН 2)s-, R13O-(С=O)-(СН 2)s-, Н(O=С)-NH(СН 2)s-, (С 1-С 6)алкил-(O=С)-NH-(СН 2)s-, до трех атомами галогена, (C1-С 6)алкокси, необязательно замещенного от одного до трех атомами галогена, (C1-С 6)алкилтиол, амино(СН 2)p-, (C1-С 6)алкил-NH-(СН 2)p-, ди(C1-С 6) алкил-N-(СН 2)p-, (С 3-С 7)-циклоалкил-NH-(СН 2)p-,амино-(C1-С 6)алкил-NH-(СН 2)p-, (C1-С 6)алкилNH-(C1-С 6)алкил-NH-(СН 2)p-, ди(C1-С 6)алкил-N(C1-С 6)алкил-O-(C1(C1-С 6)алкил-NH-(СН 2)p-,С 6)алкил-, ди(C1-С 6)алкил-NR10 представляет водород или галоген;R11 и R14 выбирают, независимо, из водорода, галогена, СF3, (С 1-С 6)алкила, необязательно замещенного от одного до трех атомами галогена, (С 1-С 6)алкокси, необязательно замещенного от одного до трех атомами галогена, (С 1 С 6)алкилтиол, амино-(СН 2)p-, (С 1-С 6)алкил-NH(СН 2)p-, ди(С 1-С 6)алкил-N-(СН 2)p-, (С 3-С 7)циклоалкил-NH-(СН 2)p-,амино-(С 1-С 6)алкил-NH(СН 2)p-, (С 1-С 6)алкил-NH-(С 1-С 6)алкил-NH-(СН 2)p-,ди(С 1-С 6)алкил-N-(С 1-С 6)алкил-NH-(СН 2)p-,(С 1-С 6)алкил-(С=O)-О-(СН 2)p-,амино-(С 1-С 6) алкил-(С=O)-О-(СН 2)p-, (С 1-С 6)алкил-NH-(С 1-С 6) алкил-(С=O)-О-(СН 2)Hp-, ди(С 1-С 6)алкил-N-(С 1 С 6)алкил-(С=O)-О-(СН 2)p-, амино-(С 1-С 6)алкилO-(С=O)-(СН 2)p-, (С 1-С 6)алкил-NH-(С 1-С 6)алкилO-(С=O)-(СН 2)p-,ди(С 1-С 6)алкил-N-(С 1-С 6)алкил-O-(С=O)-(СН 2)p-, гидрокси, гидрокси-(С 1 С 6)алкил-, гидрокси-(С 1-С 6)алкил-NH-(СН 2)p-,(С 1-С 6)алкил-O-(С 1-С 6)алкил-, -CN, пиперидин(СН 2)p-, пирролидин-(СН 2)p- и 3-пирролин(СН 2)p-, где указанные пиперидин, пирролидин и 3-пирролин в упомянутых частей пиперидин(СН 2)p-, пирролидин-(СН 2)p- и 3-пирролин(СН 2)p- могут быть необязательно замещены на любом из атомов углерода кольца, способных иметь дополнительную связь, предпочтительно от нуля до двух заместителей, заместителем,независимо выбранным из галогена, СF3, (C1-С 6) алкила, необязательно замещенного от одногоn равно целому числу от нуля до 3; каждый р независимо равен целому числу от нуля до 4;s равно целому числу от нуля до 4; где пунктирная линия представляет необязательную двойную связь; и фармацевтически приемлемые соли таких соединений. Данное изобретение относится также к фармацевтически приемлемым кислотноаддитивным солям соединений формулы Iа. Кислоты, которые используют для получения фармацевтически приемлемых кислотно-аддитивных солей вышеуказанных основных соединений данного изобретения, являются кислотами,которые образуют нетоксичные кислотноаддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройо 7 дидные, нитратные, сульфатные, бисульфатные,фосфатные, кислые фосфатные, ацетатные, лактатные, цитратные, кислые цитратные, тартратные, битартратные, сукцинатные, малеатные,фумаратные, глюконатные, сахаратные, бензоатные, метансульфонатные, этансульфонатные,бензолсульфонатные, п-толуолсульфонатные и памоатные [т.е. 1,1'-метилен-бис-(2-гидрокси-3 нафтоатные)] соли. Данное изобретение относится также к основно-аддитивным солям формулы Iа. Химические основания, которые можно использовать в качестве реагентов для получения фармацевтически приемлемых солей с основаниями тех соединений формулы Iа, которые являются кислотными по природе, являются основаниями,которые образуют нетоксичные соли с такими соединений. Такие нетоксичные соли оснований включают, но не ограничиваются ими, соли,полученные из таких фармакологически приемлемых катионов, как например, катионы щелочных металлов (например, калия и натрия) и катионы щелочно-земельных металлов (например,кальция и магния), аммония, или водорастворимые аддитивные соли аминов, таких как Nметилглюкамина (меглумина), и низший алканоламмониевые соли и другие основные соли фармацевтически приемлемых органических аминов. Предпочтительными соединениями формулы Iа являются соединения, где R3 представляет водород, галоген или (C1-C6)алкил. Предпочтительными соединениями формулы Iа являются соединения, где один из R5,R6, R7 или R8 представляют фтор, бром, хлор,метил или трифторметил, предпочтительно, когда R5 представляет фтор, бром, хлор, метил или трифторметил. Очень предпочтительными соединениями формулы Iа являются соединения,где R5 представляет хлор или метил. Предпочтительными соединениями формулы Iа, где R2 представляет Ph2, являются соединения, где R9 представляет фтор, хлор, -CN или гидрокси; или R11 представляет -СНО, хлор,фтор, метил, (C1-С 6)алкил-NH-(СН 2)p-, ди(C1 С 6)алкил-N-(СН 2)p- или циано. Очень предпочтительными соединениями формулы Iа, где R2 представляет Ph2, являются соединения, где R9 представляет фтор или -CN, или R11 представляет метил, (C1-С 6)алкил-NH-(СН 2)p-, ди(C1 С 6)алкил-N-(СН 2)p- или циано. Предпочтительными соединениями формулы Iа, где R2 представляет гетероарил, являются соединения, где указанный гетероарил представляет либо необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод (т.е. пиридин-2-ил) или К и L представляют углерод и М представляет азот(т.е. пиримидин-2-ил) либо указанный гетероарил представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот, Р представляет серу и Q представляет уг 001963 8 лерод (т.е. 1,3-тиазол-4-ил) или Т представляет азот или серу, Q представляет азот или серу и Р представляет углерод (т.е. 1,3-тиазол-2-ил), или Т представляет кислород и Р и Q, каждый, представляет углерод (т.е. фур-2-ил). Предпочтительными соединениями формулы Iа, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод (т.е. пиридин-2-ил),являются соединения, где R14 представляет водород, -СНО, хлор, фтор, метил, (C1-С 6)алкилNH-(СН 2)p-, ди(C1-С 6)алкил-N-(СН 2)p- или циано; R17 представляет водород, -СНО, хлор, фтор,метил, (C1-С 6)-алкил-NH-(C1-С 6)алкил-, ди(C1 С 6)алкил-N-(C1-С 6)алкил- или циано или R15 илиR16, независимо, представляет водород, -СНО,хлор, фтор, метил или циано. Очень предпочтительными соединениями формулы Ia, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод (т.е. пиридин-2-ил), являются соединения, где R14 представляет водород, -СНО,метил,(C1-С 6)алкил-NH-(СН 2)p-,ди(C1 С 6)алкил-N-(СН 2)p- или циано. Предпочтительными соединениями формулы Iа, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот, Р представляет серу и Q представляет углерод (т.е. 1,3-тиазол-4-ил), являются соединения, где R14, R15 или R16, каждый независимо, представляет водород, хлор, фтор,метил или циано. Предпочтительными соединениями формулы Iа, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот или серу, Q представляет серу или азот и Р представляет углерод (т.е. 1,3 тиазол-2-ил), являются соединения, где R14 илиR15, независимо, представляет водород, хлор,фтор, метил или циано. Конкретные предпочтительные соединения изобретения включают:(S)-6-фтор-2-[2-(2-метилтиазол-4-ил)винил]-3-(2-метилфенил)-3 Н-хиназолин-4-он. Другие конкретные соединения изобретения включают:(S)-3-(2-хлорфенил)-6-фтор-2-[2-(6 пирролидин-1-илметилпиридин-2-ил)винил]3 Н-хиназолин-4-он. Данное изобретение относится к фармацевтической композиции для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга,травмы головы, болезни Aльцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии(например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма,асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой,или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени,недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения,ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащей количество соединения формулы Iа, эффективное для лечения или профилактики такого состояния, и фармацевтически приемлемый носитель. Это изобретение относится также к способу лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотро 001963 12 фического склероза,эпилепсии,СПИДиндуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой или чрезмерной дозой лекарственного сердца или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи,психоза, судорог, хронической или острой боли,глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающего введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения формулы Iа, эффективного для лечения или профилактики такого состояния. Данное изобретение относится также к фармацевтической композиции для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга,травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии(например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма,асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой,или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени,недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения,ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащей количество соединения формулы Iа, эффективное для создания антагонизма АМРА-рецептору, и фармацевтически приемлемый носитель. Данное изобретение относится также к способу лечения или профилактики состояния,выбранного из церебрального дефицита после операции на сердце с шунтированием и транс 13 плантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИДиндуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического нейронного повреждения, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи,психоза, судорог, хронической или острой боли,глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения формулы Iа, эффективного для создания антагонизма АМРА-рецептору. Соединения этого изобретения включают в себя все стереоизомеры и все оптические изомеры соединений формулы Iа (например, R- и Sэнантиомеры), а также рацемические, диастереомерные и другие смеси таких изомеров. Соединения этого изобретения могут содержать олефин-подобные двойные связи. Когда такие связи присутствуют, соединения изобретения существуют в виде цис- и трансконфигураций и в виде их смесей. Если не оговорено особо, алкильные группы, указываемые здесь, а также алкильные части других групп, указываемых здесь (например,алкокси) могут быть неразветвленными или разветвленными и могут быть также циклическими (например, циклопропил, циклобутил,циклопентил или циклогексил) или могут быть неразветвленными или разветвленными и содержат циклические части. Если не оговорено особо, гало и галоген относится к фтору, брому, хлору или йоду. Жирные линии в формулах Iа и Ib, изображенной ниже, указывают, что атомы, соединенные этими жирными линиями, и присоединенные к ним группы, стерически затруднены,так что существуют либо ортогонально выше плоскости кольца хиназолинона, либо ортогонально ниже плоскости кольца хиназолинона. Это стерическое затруднение обуславливается барьером энергии вращения, создаваемым заместителем R5, препятствующим свободному вращению вокруг одинарной связи, связывающей кольцо хиназолинона с кольцом фенила 14 В соединениях формулы Iа группы R5 и R6 стерически затруднены, так что существуют ортогонально выше плоскости кольца хиназолинона, когда винильная группа расположена справа от кольца хиназолинона. Соединения формулы Iа обозначают (S)-стереохимией. В соединениях формулы Ib, представляющих зеркальное изображение соединений формулы Iа и показанных ниже, группы R5 и R6 стерически затруднены, так что существуют ортогонально выше плоскости кольца хиназолинона, когда винильная группа находится слева от кольца хиназолинона. Соединения формулы Ib обозначают (R)-стереохимией. Соединения формулы Iа обладают по существу всей активностью антагониста АМРА-рецептора, тогда как соединения формулы Ib по существу лишены активности антагониста АМРА-рецептора. Подробное описание изобретения Соединения формулы Iа можно получить по способам схемы 1. В схеме реакций и в обсуждении, которое приводится ниже, К, L, М, Р,Q, Т, R2, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14,R15, R16, R17, Ph2, n, m и р, если не оговорено особо, такие как определено выше для формулы Схема 1 относится к получению соединений формулы Iа или Ib из соединений формулы 16 тупны или их можно получить способами, хорошо известными средним специалистам в данной области. Соединение формулы V можно превратить в ацетамид формулы IV реакцией с ацетилхлоридом или уксусным ангидридом в присутствии основания в инертном в реакции растворителе. Подходящие растворители включают метиленхлорид, дихлорэтан, тетрагидрофуран и диоксан, предпочтительно, метиленхлорид. Подходящие основания включают триалкиламины,такие как триэтиламин и трибутиламин, диметиламинопиридин и карбонат калия, предпочтительно, триэтиламин. Температура вышеупомянутой реакции находится в диапазоне от около 0 С до около 35 С, время реакции - от около 1 ч до около 10 ч, предпочтительно, ее проводят приблизительно при 25 С в течение около 3 ч. Ацетамид формулы IV циклизуют в соединение формулы III реакцией с дегидратирующим агентом в присутствии катализатора в сухом, инертном в реакции растворителе. Подходящие дегидратирующие агенты включают уксусный ангидрид, пентоксид фосфора, дициклогексилкарбодиимид и ацетилхлорид, предпочтительно, уксусный ангидрид. Подходящие катализаторы включают ацетат натрия или калия,уксусную кислоту, п-толуолсульфоновую кислоту или эфират трифторида бора, предпочтительно, ацетат натрия. Подходящие растворители включают диоксан, толуол, диглим (диметиловый эфир диэтиленгликоля) или дихлорэтан,предпочтительно, диоксан. Температура вышеупомянутой реакции находится в диапазоне от около 80 С до около 110 С, время реакции - от около 1 ч до около 24 ч, предпочтительно ее проводят приблизительно при 100 С в течение около от 3 до 10 ч. Альтернативно, соединение формулы V можно непосредственно превратить в соединение формулы III реакцией с уксусным ангидридом в присутствии кислотного катализатора в растворителе. Подходящие кислотные катализаторы включают уксусную кислоту, серную кислоту или п-толуолсульфоновую кислоту, предпочтительно, уксусную кислоту. Подходящие растворители включают уксусную кислоту, толуол или ксилол, предпочтительно уксусную кислоту. Температура вышеупомянутой реакции составляет от около 20C до около 150 С, время реакции - от около 10 мин до около 10 ч, предпочтительно, ее проводят приблизительно при 120 С в течение около от 2 до 5 ч. Соединение формулы III, полученное любым из вышеуказанных способов, подвергают реакции с амином формулы 17 в полярном протонном растворителе в присутствии кислотного катализатора, получая соединение формулы II. Подходящие кислотные катализаторы включают уксусную кислоту, птолуолсульфоновую кислоту или серную кислоту, предпочтительно, уксусную кислоту. Подходящие полярные протонные растворители включают уксусную кислоту, метанол, этанол или изопропанол, предпочтительно, уксусную кислоту. Температура вышеупомянутой реакции составляет от около 20 С до около 117 С, время реакции - от около 1 ч до около 24 ч, предпочтительно, ее проводят приблизительно при 117 С в течение около 6 ч. Альтернативно, соединение формулы IV можно непосредственно превратить в соединение формулы II реакцией с дегидратирующим агентом, амином формулы VIII, и основанием в инертном в реакции растворителе. Подходящие дегидратирующие агенты включают трихлорид фосфора, оксихлорид фосфора, пентахлорид фосфора или тионилхлорид, предпочтительно,трихлорид фосфора. Подходящие основания включают пиридин, лутидин, диметиламинопиридин, триэтиламин или N-метилморфолин,предпочтительно, пиридин. Подходящие растворители включают толуол, циклогексан, бензол или ксилол, предпочтительно, толуол. В некоторых случаях, когда объединенные реагенты представляют собой жидкость, реакцию можно проводить без разбавления. Температура вышеупомянутой реакции составляет от около 50 С до около 150 С, время реакции - от около 1 ч до около 24 ч, предпочтительно ее проводят приблизительно при 110 С в течение около 4 ч. Соединение формулы II подвергают реакции с альдегидом формулы R2CHO в присутствии катализатора и дегидратирующего агента в подходящем растворителе, получая соединение формулы I, где пунктирная линия представляет двойную связь. Подходящие катализаторы включают хлорид цинка, ацетат натрия, хлорид алюминия, хлорид олова или эфират трифторида бора, предпочтительно, хлорид цинка или ацетат натрия. Подходящие дегидратирующие агенты включают уксусный ангидрид, метансульфоновый ангидрид, трифторуксусный ангидрид или пропионовый ангидрид, предпочтительно, уксусный ангидрид. Подходящие полярные растворители включают уксусную кислоту, диоксан, диметоксиэтан или пропионовую кислоту. Температура вышеупомянутой реакции составляет от около 60 С до около 100 С, время реакции - от около 30 мин до около 24 ч, предпочтительно, ее проводят приблизительно при 100 С в течение около 3 ч. Соединения формулы I, где пунктирная линия представляет одинарную углеродуглеродную связь, можно получить гидрированием соответствующих соединений, где пунктирная линия представляет двойную углеродуглеродную связь, с использованием стандарт 001963 18 ных методик, которые хорошо известны специалистам в данной области. Например, восстановление двойной связи можно осуществить газообразным водородом (Н 2) с использованием катализаторов, таких как палладий на угле(Pd/C), палладий на сульфате бария (Pd/BaSO4),платина на угле (Pt/C) или трис(трифенилфосфин)родийхлорид (катализатор Вилькинсона) в подходящем растворителе, таком как метанол,этанол, ТГФ, диоксан или этилацетат при давлении от около 1 до около 5 атмосфер и температуре от около 10 С до около 60 С, как описано в Catalytic Hydrogenation in Organic Synthesis,Paul Rylander, Academic Press Inc., San Diego,1979, pp. 31-63. Предпочтительны следующие условия: Pd на угле, этилацетат, 25 С и давлении газообразного водорода 1,055-4,219 атм (1560 пси). Этот способ обеспечивает также введение изотопов водорода (например, дейтерия,трития) путем замены 1H2 на 2H2 или 3H2 в вышеуказанной методике. Соединения формулы I можно разделить на соединения формул Iа и Ib высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием хиральной колонки ВЭЖХ и элюированием подходящим растворителем. Средний специалист в данной области должен понимать, что для разделения индивидуальных атропизомеров можно использовать много типов инструментов, колонок и элюентов. Подходящие инструменты для ВЭЖХ включают LCSpiderLing, Waters 4000, Hewlett Packard 1050 и продукты терморазделения ВЭЖХ аналитической чистоты. Подходящие ВЭЖХ конструируют по способам, хорошо известным средним специалистам в данной области. Такая конструкция неизменно включает в себя насос,отверстие для ввода пробы и детектор. Подходящие хиральные колонки могут быть куплены предварительно заполненными или их может заполнить средний специалист в данной области. Подходящие хиральные колонки включают хиральные колонки ОА, OD, OG, AD и AS, которые можно купить у Chiral Technologies Inc.,730 Spingdale Drive, PO Box 564, Exton, PA 19341. Средний специалист в данной области должен понимать, что для разделения изомеров изобретения могут быть пригодны многие другие хиральные колонки, купленные у других продавцов. Материал для заполнения колонок можно также купить в виде гранул различного размера. Для препаративных разделений пригодны гранулы с размером около 20 микрон в диаметре. Для аналитического разделения пригодны гранулы с размером около 10 микрон в диаметре. Соединения формулы Iа, где присутствует основная группа, можно также разделить обработкой энантимерно чистой кислотой в подходящем растворителе для образования разделяемых диастереомерных солей. Подходящие энантимерно чистые кислоты включают камфора 19 сульфоновую кислоту, винную кислоту (и ее производные), миндальную кислоту и молочную кислоту. Подходящие растворители включают спирты, такие как этанол, метанол и бутанол, толуол, циклогексан, простой эфир и ацетон. Альтернативно, соединение формулы V можно превратить в соединение формулы II по способам, описанным в схеме 2. Образованное таким образом соединение формулы II можно превратить в соединение формулы I по способам схемы 1. Исходя из схемы 2, соединение формулы V подвергают реакции с сочетающим реагентом, амином формулы VIII, описанном выше, и основанием в инертном в реакции растворителе с образованием соединения формулыVI. Примеры подходящих сочетающих реагентов, которые активируют карбоксильную функциональную группу, представляют дициклогексилкарбодиимид, N-3-диметиламинопропил-Nэтилкарбодиимид, 2-этокси-1-этоксикарбонил 1,2-дигидрохинолин (ЭЭДХ), карбонилдиимидазол (КДИ) и диэтилфосфорилцианид. Подходящие основания включают в себя диметиламинопиридин (ДМАП), гидроксибензотриазол(ГБТ) или триэтиламин, предпочтительно, диметиламинопиридин. Сочетание проводят в инертном растворителе, предпочтительно, апротонном растворителе. Подходящие растворители включают ацетонитрил, дихлорметан, дихлорэтан и диметилформамид. Предпочтительным растворителем является дихлорметан. Температура вышеуказанной реакции обычно составляет от около -30 до около 80 С, предпочтительно, от около 0 до около 25 С. Соединение формулы VI превращают в соединение формулы VII реакцией с ацетилхлоридом или уксусным ангидридом в присутствии основания в инертном в реакции растворителе. Подходящие растворители включают метиленхлорид, тетрагидрофуран и хлороформ, предпочтительно, метиленхлорид. Подходящие основания включают триалкиламины, такие как триэтиламин и трибутиламин, диметиламинопиридин и карбонат калия, предпочтительно,триэтиламин. Температура вышеупомянутой реакции составляет от около 0 С до около 35 С,время реакции - от около 1 ч до около 10 ч,предпочтительно, ее проводят приблизительно при 30 С в течение около 3 ч. Соединение формулы VII циклизуют в соединение формулы II реакцией с трифенилфосфином, основанием и диалкилазодикарбоксилатом в инертном в реакции растворителе. Подходящие основания включают пиридин, триэтиламин и 4-диметиламинопиридин, предпочтительно, 4-диметиламинопиридин. Подходящие растворители включают диметилформамид, тетрагидрофуран и диоксан, предпочтительно, диоксан. Температура вышеупомянутой реакции находится в диапазоне от около 25 С до около 125 С, время реакции - от около 1 ч до около 24 20 ч, предпочтительно, ее проводят приблизительно при 100 С в течение около от 8 до 15 ч. Соединение формулы II можно превратить в соединение формулы Iа по способу, описанному в схеме 1. Соединения формулы II можно также получить по способам, описанным Miyashlta, et al.,Heterocycles, 42, 2, 691-699 (1996). В схеме 3 соединение формулы II превращают в соответствующее соединение формулыVIII реакцией II с основанием, как, например,диизопропиламидом лития, в полярном апротонном растворителе, таком как тетрагидрофуран. Раствор перемешивают при температуре между около -100 С и около 0 С, предпочтительно, около -78 С, в течение периода времени между около 15 мин и около 1 ч, предпочтительно, около 30 мин. Образованный, таким образом, анионный продукт подвергают реакции с раствором в тетрагидрофуране альдегида формулы R2CHO. Раствор альдегида можно добавить к раствору аниона (нормальное добавление) или раствор аниона можно добавить к раствору альдегида (обратное добавление). Хотя для получения соединений формулы VIII можно использовать оба способа, обратное добавление предпочтительно. Получаемую реакционную смесь перемешивают в течение периода времени между около 15 мин и около 1 ч, предпочтительно, около 30 мин, при температуре около-100 С, предпочтительно, около -78 С, и затем оставляют для нагревания до температуры окружающей среды. В реакции 2 схемы 3 соединение формулы VIII превращают в соответствующее соединение формулы I реакцией VIII с дегидратирующим агентом, таким как трифторуксусный ангидрид, в сухом, инертном в реакции растворителе, таком как диоксан, толуол,диглим или дихлорэтан, предпочтительно диоксан. Реакционную смесь перемешивают при температуре между около 0 С и около 50 С,предпочтительно, при комнатной температуре, в течение периода времени между около 1 ч и около 14 ч, предпочтительно, около 12 ч. Соединения формулы I, где пунктирная линия представляет одинарную углеродуглеродную связь, можно получить гидрированием соответствующих соединений, где пунктирная линия представляет двойную углеродуглеродную связь, с использованием стандартных методик, которые хорошо известны специалистам в данной области. Например, восстановление двойной связи можно осуществить газообразным водородом (H2) с использованием катализаторов, таких как палладий на угле(Pd/C), палладий на сульфате бария (Pd/BaSO4),платина на угле (Pt/C) или трис (трифенилфосфин)родийхлорид (катализатор Вилькинсона) в подходящем растворителе, таком как метанол,этанол, ТГФ, диоксан или этилацетат, при давлении от около 1 до около 5 атмосфер и температуре от около 10 С до около 60 С, как описа 21 но в Catalytic Hydrogenation in Organic Synthesis,Paul Rylander, Academic Press Inc., San Diego,1979, pp. 31-63. Предпочтительны следующие условия: Pd на угле, этилацетат, 25 С и давление газообразного водорода 1,055-1,406 атм (1520 пси). Этот способ обеспечивает также введение изотопов водорода (например, дейтерия,трития) путем замены 1H2 на 2H2 или 3H2 в вышеуказанной методике. Если не оговорено особо, давление вышеуказанных реакций некритическое. Обычно реакции проводят при давлении от около одной до около трех атмосфер, предпочтительно, при давлении окружающей среды (около одной атмосферы). Когда R2 представляет гетероарил, средний специалист в данной области должен понимать,что гетероарил выбирают из группы, состоящей из пиридин-2-ила, 1,3-пиразин-4-ила, 1,4-пиразин-3-ила, 1,3-пиразин-2-ила, пиррол-2-ила, 1,3 имидазол-4-ила, 1,3-имидазол-2-ила, 1,3,4-триазол-2-ила, 1,3-оксазол-4-ила, 1,3-оксазол-2-ила,1,3-тиазол-4-ила, 1,3-тиазол-2-ила, 1,2,4-оксадиазол-3-ила, 1,2,4-оксадиазол-5-ила, фур-2-ила,1,3-оксазол-5-ила и 1,3,4-оксадиазол-2-ила, где упомянутый гетероарил может необязательно быть замещен на любом атоме, способном образовать дополнительную связь, заместителями вплоть до трех. Соединения формулы Iа, которые основные по природе, способны образовать большое число различных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемы для введения животным, часто на практике сначала желательно выделить соединение формулыI из реакционной смеси в виде фармацевтически приемлемой соли и затем просто превратить последнюю снова в свободное основание путем обработки щелочным реагентом, и затем превратить свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений данного изобретения легко получить обработкой основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в водном растворителе-среде или в подходящем органическом растворителе, таком как метанол или этанол. Целевую твердую соль получают при осторожном выпаривании растворителя. Кислоты, которые используют для получения фармацевтически приемлемых кислотноаддитивных солей основных соединений этого изобретения, представляют собой кислоты, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлоридные, гидробромидные, гидройодидные,нитратные, сульфатные или бисульфатные,фосфатные или кислые фосфатные, ацетатные,лактатные, цитратные или кислые нитратные, 001963[т.е. 1,1'-метилен-бис-(2-гидрокси-3 нафтоатные)]соли. Те соединения формулы Iа, которые являются кислотными по природе, способны образовать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов и, особенно,соли натрия и калия. Все эти соли получают общепринятыми методиками. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых солей с основаниями этого изобретения,представляют собой основания, которые образуют нетоксичные соли с описанными здесь кислотными соединениями формулы Iа. Эти нетоксичные соли с основаниями включают соли, полученные из таких фармакологически приемлемых катионов, как, например, натрия,калия, кальция и магния и так далее. Эти соли можно легко получить обработкой соответствующих кислотных соединений водным раствором, содержащим целевые фармакологически приемлемые катионы, и затем выпариванием получаемого раствора досуха, предпочтительно,при пониженном давлении. Альтернативно, их можно также получить смешиванием растворов в низших алканолах кислотных соединений и целевого алкоксида щелочного металла и затем выпариванием получаемого раствора досуха таким же образом, как до этого. В любом случае, для обеспечения полноты реакции и получения максимального выхода целевого конечного продукта, предпочтительно, применяют стехиометрические количества реагентов. Соединения формулы Iа и их фармацевтически приемлемые соли (далее называемые также как "активные соединения изобретения") полезны для лечения нейродегенеративных и связанных с травмами ЦНС состояний и являются сильнодействующими антагонистами АМРА-рецептора. Активные соединения изобретения можно, следовательно, использовать для лечения или профилактики церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона,бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии (например, состояний, вызванных странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя),остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привы 23 кание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах,страха, рвоты и поздней дискинезии. Активность соединений изобретения in vitro и in vivo для антагонизма АМРА-рецептору можно определить методами, доступными среднему специалисту в данной области. Один метод определения активности соединений изобретения представляет собой ингибирование приступов, индуцированных пентилентетразолом (ПТЗ). Другой метод определения активности соединений изобретения представляет собой блокирование поглощения 45Ca2+, индуцированного активацией АМРА-рецептора. Один специфический метод определения ингибирования индуцированных пентилентетразолом (ПТЗ) приступов следующий. Активность соединений изобретения для ингибирования индуцированных пентилентетразолом (ПТЗ) приступов у мышей можно определить по следующей методике. Этот анализ определяет способность соединений блокировать припадки и гибель, вызванные ПТЗ. Полученные показатели представляют латентные состояния до клонических и тонических приступов и смерти. ID50 определяют на основании защиты в процентах. Самцы мышей CD-1 от Charles River, весящие 14-16 г при доставке и 25-35 г во время испытания, служат в качестве субъектов для этих экспериментов. Мышей поселяют по 13 штук на клетку при стандартных лабораторных условиях в режиме "дня и ночи" L(свет):D(темнота)/7 утра:7 вечера на срок, по меньшей мере, 7 дней до экспериментирования. До времени испытания корм и вода доступны мышам по потребности. Все соединения вводят в объеме 10 мл/кг. Выбор наполнителей для лекарственных средств будет зависеть от растворимости соединения, но тестирование обычно выполняют с использованием солевого раствора, дистиллированной воды или E:D:S/5:5:90 (5% эмульфора,5% ДМСО и 90% солевого раствора) в качестве наполнителя для инъекции. Мышам вводят испытуемые соединения или наполнитель (внутрибрюшинно, подкожно или перорально) и помещают в клетки из плексигласа по группам из пяти мышей. В предварительно определенное время после этих инъекций мышам вводят инъекцию ПТЗ (внутрибрюшинно, 120 мг/кг) и помещают в индивидуальные клетки из плексигласа. Показатели, полученные в процессе этого пятиминутного периода испытания, представляют собой: (1) латентое состояние до клонических припадков, (2) ла 001963 24 тентное состояние до тонических припадков и(3) латентое состояние до гибели. Группы обработки лекарственным средством сравнивают с группой, обработанной наполнителем, посредством тестов Kruskal-Wallis Anova и MannWhitney U (Statview). Защиту в процентах вычисляют для каждой группы (число субъектов,не обнаруживающих приступ или гибель, как показано оценкой в течение 300 с) при каждом измерении. ID50 определяют анализом единицы вероятности (Biostat). Другой способ определения активности соединений состоит в определении влияния соединений на двигательную координацию у мышей. Эту активность можно определить по следующей методике. Самцы мышей CD-1 от Charles River, весящие 14-16 г при доставке и 23-35 г во время испытания, служат в качестве субъектов для этих экспериментов. Мышей поселяют по 13 штук на клетку при стандартных лабораторных условиях в режиме "дня и ночи" L(свет):D (темнота)/7 утра:7 вечера на срок, по меньшей мере,7 дней до экспериментирования. До времени испытания корм и вода доступны мышам по потребности. Все соединения вводят в объеме 10 мл/кг. Выбор наполнителей для лекарственных средств будет зависеть от растворимости соединения, но тестирование обычно выполняют с использованием солевого раствора, дистиллированной воды или E:D:S/5:5:90 (5% эмульфора,5% ДМСО и 90% солевого раствора) в качестве наполнителя для инъекции. Аппаратура, используемая в этих исследованиях, состоит из группы из пяти квадратов из проволочной сетки размером 13,34 х 13,34 см,подвешенных на стальных столбиках высотой 11,43 см, соединенных со столбом высотой 165,1 см, который возвышается над лабораторным столбом на высоте 38,1 см. Эти квадраты из проволочной сетки можно переворачивать на другую сторону. Мышам вводят испытуемые соединения или наполнитель (внутрибрюшинно, чрескожно или перорально) и помещают в клетки из плексигласа по группам из пяти особей. В предварительно определенное время после этих инъекций мышей помещают на верх квадратов из проволочной сетки и слегка ударяют, так чтобы они подвешивались вверх ногами. Во время одноминутного испытания мышей оценивают как 0, если они падают с сетки, как 1, если они подвешиваются с другой стороны, или 2, если они взбираются на верх сетки. Группы обработки лекарственным средством сравнивают с группой обработки наполнителем посредством тестов Kruskal-Wallis Anova и Mann-Whitney U(Statview). Один специфический метод определения блокирования поглощения 45 Са 2+, индуцирован 25 ного активацией АМРА-рецептора, описывается ниже. Первичные культуры нейронов Первичные культуры нейронов мозжечковых гранул получают, как описано Parks, T.N.,Artman, L.D., Alasti, N., and Nemeth, E.F., Modulation of N-Metil-D-Aspartate Receptor-Mediated(1991). По этому методу мозжечок удаляют у крыс CD возраста 8 дней, крошат на кусочки 1 мм и инкубируют в течение 15 мин при 37 С в растворе Тироде без кальция и магния, содержащем 0,1% трипсин. Ткань затем гомогенизируют с использованием тонкой пастеровской пипетки. Суспензию клеток помещают на культуральный планшет с 96 лунками, покрытыми поли-D-лизином в количестве 105 клеток на лунку. Среда состоит из минимальной поддерживающей среды (MEM) с солями Эрла, 10% термоинактивированной фетальной бычьей сывороткой, 2 мМ L-глутамином, 21 мМ глюкозой,пенициллин-стрептомицином (100 единиц на мл) и 25 мМ КСl. Через 24 ч среду заменяют на свежую среду, содержащую 10 мкМ цитозинарабинозида, для ингибирования деления клеток. Культуры следует использовать при 6-8 DIV. Поглощение 45 Са 2+, индуцированное активацией АМРА-рецептора Влияние лекарственных средств на поглощение 45 Са 2+, индуцированное активацией АМРА-рецептора, можно исследовать в культурах клеток мозжечковых гранул. Культуры в планшетах на 96 лунок предварительно инкубируют в течение приблизительно 3 ч в среде, не содержащей сыворотку, и затем в течение 10 мин в сбалансированном солевом растворе, не содержащем Мg2+ (состав в мМ: 120 NaCl, 5 KCl, 0,33NaH2PO4, 1,8 CaCl2, 22,0 глюкозы и 10,0 HEPES при рН 7,4), содержащем 0,5 мМ ДТТ (дитиотрейтола), 10 мкМ глицина и лекарственные средства при конечной концентрации 2 Х. Реакцию начинают быстрым добавлением равного объема сбалансированного солевого раствора,содержащего 100 мкМ агониста АМРАрецептора, каиновой кислоты, и 45 Са 2+ (конечная специфическая активность 250 Ки/ммоль). Через 10 мин при 25 С реакцию останавливают аспирацией содержащего 45Ca2+ раствора и промыванием клеток 5 Х в охлажденном льдом сбалансированном солевом растворе, не содержащем добавленный кальций и содержащем 0,5 мМ ЭДТУ. Клетки затем лизируют инкубацией в течение ночи в 0,1% тритоне-Х 100 и затем определяют радиоактивность в лизате. Все соединения изобретения, которые были испытаны,имеют IC50 ниже, чем 500 нМ. Композиции данного изобретения можно получить общепринятым способом с использованием одного или нескольких фармацевтически приемлемых носителей. Так, активные соединения изобретения можно изготовить в фор 001963(например, внутривенного, внутримышечного или подкожного) или ректального введения, или в форме, подходящей для введения ингаляцией или инсуффляцией. Для перорального введения фармацевтические композиции могут быть в форме, например, таблеток или капсул, приготовленных общепринятыми способами с фармацевтически приемлемыми средами для лекарства, такими как связывающие агенты (например, предварительно клейстеризованный маисовый крахмал,поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния), дезинтеграторы (например, картофельный крахмал или натриевая соль гликоллята крахмала) или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки можно покрыть оболочками способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для смешивания с водой или другим подходящим наполнителем перед использованием. Такие жидкие препараты можно приготовить общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгирующие агенты (например,лецитин или аравийская камедь); неводные наполнители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил-пгидроксибензоаты или сорбиновая кислота). Для трансбуккального введения композиция может быть в форме таблеток или лепешек,изготовленных общепринятым способом. Активные соединения изобретения можно изготовить в форме, подходящей для парентерального введения инъекцией, включая использование общепринятых методик катетеризации или инфузии. Готовые препаративные формы для инъекции могут присутствовать в унифицированной лекарственной форме, например, в ампулах или контейнерах для многократного приема, с добавленным консервантом. Композиции могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или водных наполнителях и могут содержать образующие форму агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в форме порошка для пересоздания перед использованием подходящим наполнителем, например стерильной водой без пирогенов. 27 Активные соединения изобретения можно также изготовить в форме ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы суппозиторий, такие как какаомасло или другие глицериды. Для интраназального введения или введения ингаляцией активные соединения изобретения обычно поставляются в форме раствора или суспензии из контейнера с пульверизатором,который сжимается или накачивается пациентом, или в виде аэрозольного спрея из находящегося под давлением контейнера или распылителя с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля дозированную единицу можно определить при помощи клапана для поставки измеренного количества. Находящийся под давлением контейнер или распылитель может содержать раствор или суспензию активного соединения. Для использования в ингаляторе или инсуффляторе могут быть изготовлены (например, из желатины) капсулы или картриджи, содержащие порошкообразную смесь соединения изобретения и подходящей порошкообразной основы, такой как лактоза или крахмал. Предполагаемая доза активных соединений изобретения для перорального, парентерального или трансбуккального введения среднему взрослому человеку для лечения состояний, указанных выше (например, удара) составляет от 0,01 до 20 мг/кг активного ингредиента на унифицированную дозу, которая могла быть введена, например, от 1 до 4 раз в день. Аэрозольные готовые препаративные формы для лечения состояний, указанных выше(например, удара), у среднего взрослого человека, предпочтительно, приспосабливают так,чтобы каждая измеренная доза или "пуф" аэрозоля содержал от 20 до 1000 мкг соединения изобретения. Общая суточная доза с аэрозолем будет в диапазоне от 100 до 10 мг. Введение можно проводить несколько раз в день, например, 2, 3, 4 или 8 раз, давая, например, 1, 2 или 3 дозы каждый раз. Следующие примеры иллюстрируют получение соединений данного изобретения. Коммерческие реагенты использовали без дополнительной очистки. Точки плавления некорректированы. Все данные ЯМР регистрировали при 250, 300 или 400 МГц в дейтерохлороформе,если не оговорено особо, и представляли в частях на миллион (5) и относили к затворному сигналу дейтерия из растворителя образца. Для удобства и для достижения максимальных выходов все неводные реакции проводили в сухой стеклянной посуде с сухими растворителями в инертной атмосфере. Все реакционные смеси перемешивали магнитным перемешивающим 28 бруском, если не оговорено особо. Если не оговорено особо, все масс-спектры регистрировали с использованием режима химической ионизации. Температура окружающей среды или комнатная температуры относится к 20-25 С. Пример 1. (S)-2-[3-(2-Хлорфенил)-6-фтор 4-оксо-3,4-дигидрохиназолин-2-ил]винилникотинонитрил и (R)-2-2-[3-(2-хлорфенил)-6-фтор 4-оксо-3,4-дигидрохиназолин-2-ил]винилникотинонитрил. Указанное в заголовке соединение из получения 80 (1 мг) растворяли в 1 мл метанола и разбавляли 1:10 смесью гексан/изопропанол,90/10 с 0,1% диэтиламина. 10 мкл аликвоту этого раствора вводили инъекцией в колонку хиралпак AD размером 250 х внутренний диаметр 4,6 мм (Chiral Technologies, Exton, PA, Part.19042) для высокоэффективной жидкостной хроматографии. Обнаружение можно осуществлять детектором Hewlett-Packard 1050 diode array при 2500 нанометрах. Полные спектры при сканировании регистрировали в диапазоне от 190 до 600 нм для каждого пика на хроматограмме. Проведенное разделение давало два пика, элюированных со временем 42,167 и 49,906 мин, соответственно. Спектры для каждого пика-компонента были идентичны друг с другом и идентичны с рацематом, подтверждая,что компоненты представляют собой энантиомеры. Пример 2. (S)-3-(2-Хлорфенил)-2-[2-(6 диэтиламинометилпиридин-2-ил)-винил-6-фтор 3 Н-хиназолин-4-он и (-)-3-(2-хлорфенил)-2-[2(6-диэтиламинометилпиридин-2-ил)винил-6 фтор-3 Н-хиназолин-4-он. Рацемический продукт из получения 1 (120 мг) растворяли в 12,4 мл этанола и вводили инъекцией в препаративную колонку ВЭЖХ (хирацел OD 5 см х 50 см). Чистые энантиомеры элюировали с использованием 10% этанола в гексане при скорости потока 100 мл в минуту. Элюат контролировали ультрафиолетовым обнаружением у 250 нм. Собирали две фракции,первый компонент центрировался около времени элюирования 10,7 мин и второй компонент центрировался около времени элюирования 15,0 мин. Общее время цикла для этого опыта было 40 мин. Спектры каждого из компонентов-пиков были идентичны друг с другом, и идентичны с рацематом, подтверждая, что компоненты представляют собой энантиомеры.= 1, СН 3 ОН). Пример 3. (S)-3-(2-Хлорфенил)-2-[2-(6 этиламинометилпиридин-2-ил)-винил-6-фтор 3 Н-хиназолин-4-он и (-)-3-(2-хлорфенил)-2-[2(6-этиламинометилпиридин-2-ил)винил-6-фтор 3 Н-хиназолин-4-он. Рацемический продукт из получения 24(150 мг) растворяли в 5 мл изопропанола с 0,1% диэтиламина. Раствор затем вводили в колонку ВЭЖХ (хирацел OD 5 см х 50 см) и элюирова 29 ли смесью изопропанол/гексан, 30/70 с 0,1% диэтиламина при скорости потока 100 мл в минуту. Элюат контролировали ультрафиолетовым обнаружением у 265 нм. Собирали две фракции,первый компонент центрировался около времени элюирования 13,8 мин и второй компонент центрировался около времени элюирования 20,1 мин. Спектры каждого из компонентов были идентичны друг с другом и идентичны с рацеПриНазвание мер 4 2-2-[3-(2-Хлор-4-йодфенил)-6-фтор-4-оксо-3,4 дигидрохиназолин-2-ил]винилникотинонитрил 5 2-2-[3-(2-Хлор-4-йодфенил)-6-фтор-4-оксо-3,4 дигидрохиназолин-2-ил]винилникотинонитрил 6 3-(2-Хлорфенил)-6-фтор-2-[2-(6-метилпиридин 2-ил)винил]-3 Н-хиназолин-4-он 7 3-(2-Хлорфенил)-6-фтор-2-[2-(6-метилпиридин 2-ил)винил]-3 Н-хиназолин-4-он 8 3-(2-Хлорфенил)-6-фтор-2-(2-пиридин-2 илвинил)-3 Н-хиназолин-4-он 9 3-(2-Хлорфенил)-6-фтор-2-(2-пиридин-2 илвинил)-3 Н-хиназолин-4-он 10 3-(2-Хлорфенил)-6-фтор-2-(2-пиримидин-2 илвинил)-3 Н-хиназолин-4-он 11 3-(2-Хлорфенил)-6-фтор-2-(2-пиримидин-2 илвинил)-3 Н-хиназолин-4-он 12 3-(2-Хлорфенил)-6-фтор-2-[2-(2-метилтиазол-4 ил)винил]-3 Н-хиназолин-4-он 13 3-(2-Хлорфенил)-6-фтор-2-[2-(2-метилтиазол-4 ил)винил]-3 Н-хиназолин-4-он 14 3-(2-Хлорфенил)-6-фтор-2-[2-(4-метилпиримидин-2-ил)винил]-3 Н-хиназолин-4-он 15 3-(2-Хлорфенил)-6-фтор-2-[2-(4 метилпиримидин-2-ил)винил]-3 Н-хиназолин-4 он Получение 1. 3-(2-Хлорфенил)-2-[2-(6 диэтиламинометилпиридин-2-ил)винил-6-фтор 3 Н-хиназолин-4-он Способ А. 6-Фтор-2-метилхиноксалин-4 он. Раствор 12,95 г (70,0 ммоль) 2-нитро-5 фторбензойной кислоты в 200 мл ледяной уксусной кислоты и 20 мл уксусного ангидрида обрабатывали 0,625 г 10% палладия на угле и восстанавливали при начальном давлении 3,832 атм (54,5 пси). Поглощение водорода завершалось через два часа. Катализатор удаляли фильтрованием и фильтрат нагревали при кипячении с обратным холодильником в течение двух часов, после чего ТСХ (гексан/этилацетат,1:1) показывала, что реакция завершилась. Реакционную смесь выпаривали до полукристаллической массы, которую диспергировали в минимальном количестве 2-пропанола и перемешивали на ледяной бане в течение одного часа. Кристаллический твердый продукт отделяли фильтрованием, промывали минимальным ко 30 матом, подтверждая, что компоненты представляют собой энантиомеры.([]D = -47,6, с = 0,25, СН 3 ОН). Примеры 4-15. Соединения примеров 4-15 получали по способам, аналогичным способам примера 1. Таблица 1 УФ Время удерживания Подвижная фаза личеством холодного 2-пропанола и сушили на воздухе, получая 5,79 г (46%) целевого продукта в виде коричневого твердого материала, т.пл. 127,5-128,5 С. Синтез 5-фтор-2-нитробензойной кислоты описывается Slothouwer, J.H., Recl. Trav. Chim.Pays-Bas. 33, 336 (1914). Способ В. 3-(2-Хлорфенил)-6-фтор-2-метил-4-(3 Н)-хиназолинон. Раствор 2,50 г (14,0 ммоль) 6-фтор-2 метилхиноксалин-4-она и 1,96 г (15,4 ммоль) 2 хлоранилина приблизительно в 20 мл ледяной уксусной кислоты нагревали при кипячении с обратным холодильником в атмосфере азота в течение 6 ч. Большую часть растворителя выпаривали из охлажденной реакционной смеси и остаток растворили в этаноле и охлаждали. После хранения 6 дней в холодильнике образованные кристаллы отделяли фильтрованием, промывали минимальным количеством холодного этанола и сушили на воздухе, получая 1,79 г 31 Способ С. 6-(2-[3-(2-Хлорфенил)-6-фтор-4 оксо-3,4-дигидрохиназолин-2-илвинил)пиридин-2-карбальдегид. Каталитическое количество (около 100 мг) безводного хлорида цинка добавляли к раствору 576 мг (2,0 ммоль) 3-(2-хлор-фенил)-6-фтор-2 метил-4(3 Н)-хиназолинона и 270 мг (2,0 ммоль) 2,6-пиридиндикарбоксальдегида в 20-25 мл диоксана и 1,0 мл уксусного ангидрида. Реакционную смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение 3 ч до тех пор, пока ТСХ не показала, что исходные материалы были израсходованы. Охлажденную реакционную смесь выливали в воду, и смесь экстрагировали этилацетатом. Объединенные экстракты обрабатывали солевым раствором и сушили сульфатом магния, обрабатывали обесцвечивающим углем и фильтровали и растворитель удаляли, получая целевой продукт. Его растворяли в смеси простой эфир/пентан, 2:1, и кристаллы выделяли фильтрованием, получая 266 мг продукта, 33%, т.пл. 247-248 С. Синтез пиридин-2,6-дикарбоксальдегида описывается Papadopoulos, et al., J. Org. Chem. 31, 615 (1966). Способ D. 3-(2-Хлорфенил)-2-[2-(6-диэтиламинометилпиридин-2-ил)винил-6-фтор-3 Нхиназолин-4-он. Раствор 65 мг (0,16 ммоль) 6-2-[3-(2 хлорфенил)-6-фтор-4-оксо-3,4-дигидрохиназолин-2-ил]винилпиридин-2-карбальдегида в 10 мл метиленхлорида при комнатной температуре в атмосфере азота обрабатывали 3 каплями диэтиламина и 73 мг (0,34 ммоль) триацетоксиборогидрида натрия. После перемешивания в течение 2 1/2 ч при комнатной температуре, растворитель выпаривали и остаток распределяли между разбавленной хлористоводородной кислотой и простым эфиром и перемешивали в течение 30 мин. Эфирный слой отделяли и водный слой снова экстрагировали простым эфиром и эфирные экстракты выгружали. рН водного кислотного раствора устанавливали приблизительно до 14 10% гидроксидом натрия (при охлаждении ледяной баней) и затем экстрагировали два раза простым эфиром. Объединенные эфирные экстракты экстрагировали соляным раствором и сушили сульфатом магния и растворитель выпаривали. После одной попытки образовать мезилатную соль повторно обработанное свободное основание в этилацетате обрабатывали 7,5 мг (0,06 ммоль) малеиновой кислоты, растворенной в небольшом количестве этилацетата. Кристаллы, образованные из получаемых растворов, фильтровали и промывали этилацетатом, получая 22 мг мономалеатной соли (24%), т.пл. 170,5-171,5 С. Получения 2-50. Получения 2-50 проводили по способам,аналогичным способам получения 1.(4 Н, м), 7,88-7,96 (1H, м), 8,56 (1H, м). Получение 51. 6-Фтор-2-[2-(2-метилтиазол-4-ил)винил]-3-(2-метилфенил)-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,136 г, 1,0 ммоль) сплавляли при продувании азота в круглодонной колбе открытым пламенем. Реакционный сосуд оставляли для возвращения к температуре окружающей среды, затем добавляли диоксан (10 мл). К этой смеси добавляли 6 фтор-2-метил-3-(2-метилфенил)-3 Н-хиназолин 4-он (0,134 г, 0,5 ммоль), уксусный ангидрид(0,141 мл, 1,5 ммоль) и 2-метилтиазол-4 карбоксальдегид (0,191 г, 1,5 ммоль). Реакционную смеси кипятили с обратным холодильником в течение 3,5 ч, после этого времени охлаждали до комнатной температуры. После того,как реакционная смесь охлаждалась до комнатной температуры, ее разбавляли водой. Получаемую смесь повторно экстрагировали хлороформом. Экстракты в хлороформе объединяли и получаемый слой хлороформа промывали водой и солевым раствором, сушили над сульфатом натрия и концентрировали, получая темный остаток. Этот остаток растирали с простым эфиром,фильтровали и сушили, получая 0,04 г (21%) 6 фтор-2-[2-(2-метилтиазол-4-ил)винил]-3-(2 метилфенил)-3 Н-хиназолин-4-она в виде рыжевато-коричневого твердого материала. Точка плавления 211-212 С. ЯМР 7,91(дд, J = 3, 8,3 Гц, 1 Н), 7,87 (д, J = 15 Гц, 1 Н),7,75 (дд, J = 5, 9 Гц, 1 Н), 7,49 (дт, J = 3, 9 Гц,1 Н), 7,42 (сим. м, 3 Н), 6,61 (д, J = 15 Гц, 1 Н),2,60 (с, 3 Н), 2,09 (с, 3 Н). Получение 52. 3-(2-Хлорфенил)-6-фтор-2[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4 он. Безводный хлорид цинка (0,133 г, 0,98 ммоль) сплавляли при продувании азота в круглодонной колбе открытым пламенем. Реакционный сосуд оставляли для возвращения к температуре окружающей среды, после этого времени добавляли диоксан (7 мл). К этой смеси добавляли 3-(2-хлорфенил)-6-фтор-2-метил-3 Н-хиназолин-4-он (0,14 г, 0,49 ммоль), уксусный ангидрид (0,138 мл, 1,46 ммоль) и 2-метилтиазол 4-карбоксальдегид (0,185 г, 1,46 ммоль в 4 мл диоксана). Реакционную смеси кипятили с обратным холодильником в течение 4 ч, после этого времени оставляли для охлаждения до 40 комнатной температуры. После того, как реакционная смесь охлаждалась до комнатной температуры, ее разбавляли водой. Смесь повторно экстрагировали хлороформом. Экстракты в хлороформе объединяли с образованием слоя хлороформа, который промывали водой и солевым раствором, сушили над сульфатом натрия и концентрировали, получая темный остаток. Этот остаток растирали с простым эфиром,фильтровали и сушили, получая 0,16 г (57%) 3(2-хлорфенил)-6-фтор-2-[2-(2-метилтиазол-4 ил)винил]-3 Н-хиназолин-4-она в виде рыжевато-коричневого твердого материала. Точка плавления 231-232 С. ЯМР 7,877,84 (м, 2 Н), 7,80 (дд, J = 4,8, 9 Гц, 1 Н), 7,63-7,61(с, 1 Н), 6,60 (д, J = 15 Гц, 1 Н), 2,60 (с, 3 Н). Анализ. Вычислено для С 20 Н 13 СlFN3 ОS: С 60,45; Н 3,27; N 10,58. Найдено: С 59,68; Н 3,17; N 10,44. Получение 53. 2-[2-(2-Диметиламинометилтиазол-4-ил)винил]-6-фтор-3-(2-фторфенил)-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,106 г, 0,78 ммоль) сплавляли при продувании азота в круглодонной колбе открытым пламенем. Реакционный сосуд оставляли для возвращения к температуре окружающей среды, после этого времени добавляли диоксан (6 мл). К этой смеси добавляли 6-фтор-3-(2-фторфенил)-2-метил-3 Н-хиназолин-4-он (0,108 г, 0,39 ммоль), уксусный ангидрид (0,111 мл, 1,18 ммоль) и 2-диметиламинометилтиазол-4-карбоксальдегид (0,280 г,1,18 ммоль в 4 мл диоксана). Реакционную смесь кипятили с обратным холодильником в течение 4 дней, после этого времени оставляли для охлаждения до комнатной температуры и разбавляли водой. До тех пор, пока смесь не становилась основной, добавляли карбонат натрия. Смесь повторно экстрагировали хлороформом. Экстракты в хлороформе объединяли с образованием слоя хлороформа, который промывали водным бисульфитом, водой и солевым раствором и, наконец, сушили над сульфатом натрия и концентрировали, получая темный остаток. Этот остаток растирали с простым эфиром, фильтровали и сушили, получая 0,051 г 41 Получение 54. 3-(2-Бромфенил)-6-фтор-2[2-(2-метилтиазол-4-ил)винил]-3 Н-хиназолин-4 он. Безводный хлорид цинка (0,150 г, 1,1 ммоль) сплавляли при продувании азота в круглодонной колбе открытым пламенем. Реакционный сосуд оставляли для возвращения к температуре окружающей среды, после этого времени добавляли диоксан (5 мл). К этой смеси добавляли 3-(2-бромфенил)-6-фтор-2-метил-3 Н-хиназолин-4-он (0,182 г, 0,55 ммоль), уксусный ангидрид (0,156 мл, 1,65 ммоль) и 2-метилтиазол 4-карбоксальдегид (0,209 г, 1,65 ммоль в 3 мл диоксана). Реакционную смесь кипятили с обратным холодильником в течение 3 ч и затем охлаждали до комнатной температуры. После того, как реакционная смесь охлаждалась до комнатной температуры, ее разбавляли водой. Получаемую смесь повторно экстрагировали хлороформом. Объединенные слои хлороформа промывали водой и солевым раствором, затем сушили над сульфатом магния и затем концентрировали, получая темный остаток. Этот остаток растирали с простым эфиром, фильтровали и сушили, получая 0,116 г (52%) 3-(2 бромфенил)-6-фтор-2-[2-(2-метилтиазол-4 ил)винил]-3 Н-хиназолин-4-она в виде рыжевато-коричневого твердого материала. Точка плавления 233-234 С. ЯМР 7,967,90 (м, 1 Н), 7,90 (д, J = 15 Гц, 1 Н), 7,77-7,75 (м,2 Н), 7,55-7,53 (м, 2 Н), 7,46-7,38 (м, 2 Н), 7,21 (с,1 Н), 6,60 (д, J = 15 Гц, 1 Н), 2,61 (с, 3 Н). Анализ. Вычислено для C20H13BrFN3OS 0,5 Н 2 О: С 53,22; Н 3,10; N 9,31. Найдено: С 53,07; Н 2,93; N 9,25. Получение 55. 3-(2-Хлорфенил)-2-[2-(2 метилтиазол-4-ил)винил]-3 Н-хиназолин-4-он. Безводный хлорид цинка (0,136 г, 1,0 ммоль) сплавляли при продувании азота в круглодонной колбе открытым пламенем. Реакционный сосуд оставляли для возвращения к температуре окружающей среды, после этого времени добавляли диоксан (10 мл). К этой смеси добавляли 3-(2-хлорфенил)-2-метил-3 Н-хиназолин-4 он (0,135 г, 0,50 ммоль), уксусный ангидрид(0,141 мл, 1,5 ммоль) и 2-метилтиазол-4 карбоксальдегид (0,191 г, 1,5 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 3 ч и затем оставляли для охлаждения до комнатной температуры. После того, как реакционная смесь охлаждалась до комнатной температуры, ее разбавляли водой. Смесь повторно экстрагировали хлороформом. Объединенные слои хлороформа промывали водой и солевым раствором, сушили над сульфатом натрия и затем концентрировали, получая восковидный рыжевато-коричневый твердый остаток. Этот остаток растирали с простым эфиром,фильтровали и сушили, получая 0,139 г (73%) 3(2-хлорфенил)-2-[2-(2-метилтиазол-4-ил) 001963 42 винил]-3 Н-хиназолин-4-она в виде рыжеватокоричневого твердого материала. Точка плавления 219-221 С. ЯМР 8,30 (д, J = 7,8 Гц, 1 Н), 7,91 (д, J = 15 Гц, 1 Н), 7,78 (м, 2 Н), 7,63 (м, 1 Н), 7,48 (м,3 Н), 7,38 (м, 1 Н), 7,21 (с, 1 Н), 6,63 (д, J = 15 Гц,1 Н), 2,61 (с, 3 Н). Анализ. Вычислено для C20H14ClN3OS 0,5H2O: С 61,85; Н 3,87; N 10,82. Найдено: С 61,83; Н 3,75; N 10,55. Получение 56-68. Cоединения в таблице 1 получали по существу теми же методиками, как в приведенном в качестве примера получении 51-55.(100 мл) добавляли этилбромпируват (6,3 мл). Смесь кипятили с обратным холодильником в течение 6 ч и затем охлаждали до комнатной температуры. Добавляли еще этилбромпируват(3,2 мл для достижения общего количества 75 ммоль) и реакционную смесь кипятили с обратным холодильником в течение еще 2,5 ч. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток распределяли между водой и этилацетатом и рН устанавливали до 10 добавлением твердого карбоната калия. Фазы разделяли и водный слой экстрагировали этилацетатом. Объединенную органическую фазу промывали водой и солевым раствором, затем ее сушили над сульфатом натрия и концентрировали, получая янтарное масло. Это масло очищали флэш-хроматографией на силикагеле (120 г). Элюирование проводили следующим образом: 2% метанол/хлороформ,200 мл, без элюирования продукта; 10% метанол/хлороформ, 75 мл, без продукта; 750 мл,10,7 г (100%) этил-2-диметиламинометилтиазол-4-карбоксилата в виде светло-желтого масла, которое имело ЯМР 8,07 (д, J = 1,4 Гц,1 Н), 4,32 (кв, J = 7 Гц, 2 Н), 3,73 (с, 2 Н), 2,28 (с,6 Н), 1,31 (т, J = 7 Гц, 3 Н). Этот материал был пригоден для использования без дальнейшей очистки. К смеси литийалюминийгидрида (4,5 г, 119 ммоль) в охлажденном льдом тетрагидрофуране(100 мл) по каплям в течение 40 мин добавляли этил-2-диметиламинометилтиазол-4-карбоксилат (8,5 г, 39,7 ммоль в 40 мл тетрагидрофу 45 рана), поддерживая внутреннюю температуру 510 С. Смесь перемешивали при этом температурном диапазоне в течение 90 мин. Реакционную смесь осторожно гасили насыщенным водным хлоридом аммония (30 мл). Получаемую серую суспензию перемешивали 15 мин и фильтровали через целит. Подушку хорошо промывали этилацетатом. Фильтрат промывали солевым раствором и сушили над сульфатом натрия. Концентрирование этого органического раствора давало 4,2 г (62%) 2-диметиламинометил-4-гидроксиметилтиазола в виде янтарного масла, которое имело ЯМР 7,12 (с,1 Н), 4,71 (с, 2 Н), 3,73 (с, 2 Н), 2,50 (шир. с, 1 Н),2,32 (с, 6 Н). Этот материал использовали без дополнительной очистки. Раствор 2-диметиламинометил-4-гидроксиметилтиазола (4,2 г, 27,3 ммоль) в метиленхлориде (200 мл) обрабатывали реагентом ДессМартина (14,5 г, 34,1 ммоль). Смесь перемешивали при комнатной температуре 24 ч. Добавляли дополнительный реагент Десс-Мартина (2,9 г) и смесь перемешивали еще 4 ч. Реакционную смесь гасили добавлением насыщенного водного тиосульфата натрия (100 мл) и рН получаемой смеси устанавливали до 10 добавлением твердого карбоната калия. Двухфазную смесь фильтровали. Фазы фильтрата разделяли и водный слой экстрагировали метиленхлоридом. Объединенный органический слой промывали солевым раствором, сушили над сульфатом натрия и концентрировали, получая желтый твердый продукт. Этот твердый продукт очищали флэш-хроматографией на силикагеле (50 х 130 мм), элюируя сначала хлороформом (200 мл) и затем смесью 2% метанол/хлороформ и собирая фракции по 25 мл. Фракции 51-80 объединяли и концентрировали, оставляя 2,9 г молочного желтого масла. Это масло растирали с 50% эфирным хлороформом и твердую часть удаляли фильтрованием. Фильтрат концентрировали,получая 2,6 г (62%) 2-диметиламинометилтиазол-4-карбоксальдегида в виде желтого масла. ЯМР 9,95 (с, 1 Н), 8,14 (с, 1 Н), 3,81 (с,2 Н), 2,36 (с, 6 Н). Этот продукт использовали без дополнительной очистки. Получение 70. 2-Метилоксазол-4-карбоксальдегид. Этил-2-метилоксазолин-4-карбоксилат получали по опубликованной методике (Heterocycles 1976, 4, 1688). К находящемуся при комнатной температуре раствору этил-2-метилоксазолин-4-карбоксилата (6,28 г, 40 ммоль) в бензоле (300 мл) добавляли бромид меди (I) (6,31 г, 44 ммоль) и затем ацетат меди (II) (7,99 г, 44 ммоль). К этой смеси добавляли по каплям в течение 15 мин третичный бутилпербензоат (11,4 мл, 60 ммоль),и реакционная смесь слабо нагревалась, что можно было определить по прикосновению. 46 Черную смесь кипятили с обратным холодильником в течение 24 ч, охлаждали до комнатной температуры и фильтровали через целитную подушку (промывали простым эфиром). Фильтрат промывали водным хлоридом аммония, водой и солевым раствором, затем его сушили над сульфатом натрия и концентрировали. Рыжевато-коричневый остаток очищали флэш-хроматографией на силикагеле (80 г), элюируя смесью 40% этилацетат/гексан. После сбора 100 мл элюата (без продукта) собирали фракции по 20 мл. Фракции 11-22 собирали и концентрировали, получая 4,27 г (69%) этил-2-метилоксазол-4 карбоксилата в виде желтого масла, которое имело: ЯМР 8,04 (с, 1 Н), 4,32 (кв, J = 7 Гц,2 Н), 2,46 (с, 3 Н), 1,33 (т, J = 7 Гц, 3 Н). Этот материал использовали без дополнительной очистки. Раствор этил-2-метилоксазол-4-карбоксилата (0,31 г, 2,0 ммоль) в тетрагидрофуране (5 мл) охлаждали до -65 С и по каплям в течение 15 мин добавляли диизобутилалюминийгидрид(4,1 мл 1 н. раствора в толуоле, 4,1 ммоль). Раствор оставляли для нагревания до комнатной температуры и перемешивали 15 мин. Реакционную смесь охлаждали до 5 С и осторожно гасили добавлением метанола (2 мл). Реакционную смесь снова нагревали до комнатной температуры и добавляли воду (0,18 мл), затем фторид натрия (1,68 г). Эту смесь перемешивали 30 мин, затем сушили сульфатом магния и фильтровали. Фильтрат концентрировали и подвергали азеотропной перегонке с хлороформом,получая 0,215 г (96%) 4-гидроксиметил-2 метилоксазола в виде бледного масла, которое имело: ЯМР 7,45 (с, 1 Н), 4,52 (д, J = 6 Гц, 2 Н),3,41 (шир. с, 1 Н), 2,42 (с, 3 Н). Раствор 4-гидроксиметил-2-метилоксазола(0,79 г, 6,99 ммоль) в метиленхлориде (25 мл) обрабатывали реагентом Десс-Мартина (8,9 г,20,97 ммоль) и перемешивали 24 ч. Реакционную смесь гасили добавлением насыщенного водного тиосульфата натрия и перемешивали 30 мин. Смесь фильтровали. Фильтрат снова экстрагировали метиленхлоридом. Объединенный органический слой промывали насыщенным водным бикарбонатом (два раза), водой и солевым раствором. Органическую фазу сушили над сульфатом натрия и концентрировали до маслянистого белого твердого продукта. Этот остаток растирали с простым эфиром и фильтровали. Фильтрат концентрировали, получая 0,541 г(с, 3 Н). Получение 71-87. Соединения получений 71-87 получали способами, аналогичными способам получения 1. Получение 88. Гидрохлорид 3-(2 хлорфенил)-6-фтор-2-(2-пиридин-2-илэтил)-3 Нхиназолин-4-она. Раствор 1,00 г (2,65 ммоль) 3-(2 хлорфенил)-6-фтор-2-(2-пиридин-2-илвинил)3 Н-хиназолин-4-она приблизительно в 100 мл этилацетата обрабатывали 0,5 г 10% Pd/C и получаемую смесь гидрировали приблизительно 49 при 2 см Нg в течение двух часов, в это время прекращалось поглощение водорода. Катализатор удаляли фильтрованием при помощи суперцела (вспомогательное средство для фильтрования) и этилацетат удаляли выпариванием. Остаток растворяли в диэтиловом простом эфире и обрабатывали избытком раствора газообразного НСl в диэтиловом простом эфире. Продукт сразу осаждался, его оставляли для перемешивания в течение 3 ч, после чего продукт отделяли фильтрованием и сушили в потоке сухого азота. Продукт представлял собой 1,15 г (100%) гидрохлорида 3-(2-хлорфенил)-6-фтор-2-(2-пиридин-2-илэтил)-3 Н-хиназолин-4-она в виде аморфного белого твердого материала. Получение 89. 6-Диэтиламинометилпиридин-2-карбальдегид. Суспензию 1500 г 2,6-дибромпиридина(6,33 моль, 1,0 эквив., ММ 236,9) в 12 л (8 объемов) сухого IPE выдерживали в пропускаемом потоке азота в течение ночи в круглодонной колбе на 22 л. Суспензию затем охлаждали до-60 С и по каплям через капельную воронку добавляли 2532 мл n-BuLi (6,33 ммоль, 2,5 М в гексанах, 1,0 экв.) при поддержании температуры -60 С. Реакционную суспензию затем перемешивали в течение 30 мин. (Суспензия постепенно разжижалась). ТСХ (гексан/метиленхлорид, 50:50) аликвоты, погашенной в метаноле, показывала только следовые количества исходного материала. Через капельную воронку по каплям добавляли диэтилформамид (775 мл, 6,96 ммоль,1,1 эквив., ММ 101,15, d = 0,908) с такой скоростью, чтобы, поддерживать температуру около-60 С. После перемешивания в течение 30 мин суспензию нагревали до -10 С. В сосуд на 50 л добавляли 3 л сухого ТГФ(2 объема) и 1313 мл диэтиламина (12,7 моль,2,0 экв., ММ 73,14, d = 0,707). Реакционную смесь из колбы на 22 л переносили в черпаки и затем в сосуд на 50 л. В этой точке добавляли 1475 г триацетоксиборогидрида натрия (6,96 моль, 1,1 эквив., ММ 211,94). После нагревания до комнатной температуры по каплям добавляли 725 мл ледяной уксусной кислоты (12,7 моль,2,0 эквив., ММ 60, d = 1,05). Реакцию затем контролировали ТСХ (метиленхлорид/метанол,95:5) для установления исчезновения исходного материала. Реакционную суспензию гасили добавлением 15 л 1 н. гидроксида натрия (10 объемов) в реактор на 50 л. Следует остерегаться выделения газа. Конечное значение рН было около 10,5. Две фазы перемешивали в течение 60 мин и затем оставляли для разделения. Органический слой промывали 3 х 1,5 л воды. Летучие компоненты выпаривали в вакууме, получая продукт в виде масла, который выдерживали в вакууме в течение ночи, получая 1,430 г указанного в заголовке соединения (93% от теории,сырой продукт). Этот материал был достаточно 50 чистым для перенесения его в следующую стадию таким, как он есть. 1= 243. Продукт из вышеуказанной стадии (1,430 г, ММ 243,15, 5,88 моль, 1,0 эквив.) растворяли в 0,5 л IPE и затем переносили в капельную воронку. В колбу на 22 л помещали дополнительные 12 л (8 объемов) IPE. Систему продували струeй азота в течение ночи. Колбу на 22 л охлаждали до -78 С и в нее через канюлю добавляли 2470 мл n-BuLi (2,5 М,6,17 моль, 1,05 эквив.) при -60 С. По каплям добавляли раствор СР-457445, поддерживая температуру ниже -60 С, и смесь перемешивали в течение дополнительных 30 мин. Анализ ТСХ аликвоты, погашенной в метаноле, показывал,что исходный материал был израсходован. 487 мл безводного ДМФ (ММ 73,14, d = 0,944, 6,17 моль, 1,05 эквив.) добавляли со скоростью, позволяющей поддерживать температуру около -60 С. Раствор оставляли для нагревания до -20 С. В этой точке реакционную смесь гасили в реакторе на 50 л следующим образом. Реакционный раствор медленно наливали на 980 мл (12 н, 11,8 моль, 2,0 эквив.) концентрированной НСl, разбавленной до получения 7,5 л (5 объемов). Слои разделяли и водный слой экстрагировали два раза 7,5 л этилацетата (5 объемов). Конечное значение рН было около 10,5. Объединенные органические слои фильтровали для удаления частиц и концентрировали в вакууме. Сырое масло обрабатывали 917 г бисульфита натрия (ММ 104, 8,8 моль, 1,5 эквив.) в 15 л (10 объемов) воды и 1,5 л (1 объем) IPE. Двухфазную смесь перемешивали в течение одного часа (рН около 6,5). Смесь обрабатывали 985 г бикарбоната натрия (ММ 84, 11,8 моль, 2,0 эквив.), получая рН около 8,0. Следует остерегаться выделения газа. Смесь разбавляли 7,5 л (5 объемов) этилацетата и слои разделяли. За этим следовало два дополнительных промывания 7,5 л этилацетата. Водный слой, содержащий аддукт бисульфита, обрабатывали 7,5 л (5 объемов) этилацетата, затем 412 г (ММ 40, 10,3 моль, 1,75 эквив.) гидроксида натрия, растворенного в 1,5 л воды. Если необходимо, рН устанавливали до 11. Органический слой отделяли и водный слой экстрагировали более двух раз 7,5 л (5 объемов) этилацетата. Летучие компоненты выпаривали в вакууме, получая 904 г (80% от теории) указанного в заголовке соединения в виде масла. Этот материал был достаточно чистым для переноса непосредственно в следующую стадию. 1 где R2 представляет фенильную группу формулы Ph2 или пяти- или шестичленный гетероцикл; где указанный 6-членный гетероцикл имеет формулу где N представляет азот; где атомы указанных положений кольца К, L и М могут быть независимо выбраны из углерода и азота, при условии,что i) только один из К, L и М может быть азотом и ii) когда К, L или М представляет азот, то соответствующий ему заместитель R15, R16 илиR17 отсутствует; где указанный пятичленный гетероцикл имеет формулу где указанный Т представляет -СН-, N, NH,О или S, где атомы указанных положений кольца Р и Q могут быть независимо выбраны из углерода, азота, кислорода или серы; при условии, что (i) только один из Р, Q или Т может быть кислородом, NH или серой; (ii) по крайней мере один, из Р, Q или Т должен быть гетероатомом; и (iii) когда Р или Q представляет кислород или серу, то соответствующий ему заместитель R15 или R16 отсутствует; где указанный Ph2 представляет группу формулыR6 представляет водород или галоген;R7 представляет водород или галоген;R8 представляет водород или галоген;R9 представляет водород, галоген, СF3, (С 1 С 6)алкил, необязательно замещенный от одного 52 до трех атомами галогена, (С 1-С 6)алкокси, необязательно замещенный от одного до трех атомами галогена, (С 1-С 6)алкилтиол, амино-(СН 2)s-,(С 1-С 6)алкил-NH-(CH2)s-,ди(С 1-С 6)алкил-N(CH2)s-, (С 3-С 7)циклоалкил-NH-(СН 2)s-, H2N(C=O)-(СН 2)s-, (С 1-С 6)алкил-HN-(C=O)-(СН 2)s-,ди(С 1-С 6-алкил)-N-(С=O)-(СН 2)s-, (С 3-С 7)циклоалкил-NH-(С=O)-(СН 2)s-, R13O-(СН 2)s-, R13O(С=O)-(СН 2)s-, Н(O=С)-NH-(СН 2)s-, (С 1-С 6)алкил-(O=С)-NH-(СН 2)s-, Н-(С=O)-(СН 2)s-,С 1-С 6(алкил)-(С=O)-,гидрокси, гидрокси-(С 1-С 6)алкил-, (С 1-С 6)алкилO-(С 1-С 6)алкил-, и -CN;R10 представляет водород или галоген;R11 и R14 выбирают, независимо, из водорода, галогена, СF3, (С 1-С 6)алкила, необязательно замещенного от одного до трех атомами галогена, (С 1-С 6)алкокси, необязательно замещенного от одного до трех атомами галогена, (С 1 С 6)алкилтиол, амино-(СН 2)р-, (С 1-С 6)алкил-NН(СН 2)р-, ди(С 1-С 6)алкил-N-(СН 2)р-, (С 3-С 7)цикамино-(С 1-С 6)алкил-NHлоалкил-NH-(СН 2)р-,(СН 2)р-,(С 1-С 6)алкил-NH-(С 1-С 6)алкил-NН(СН 2)р-,ди(С 1-С 6)алкил-N-(С 1-С 6)алкил-NH(СН 2)p-, Н 2N-(С=O)-(СН 2)р-,(С 1-С 6)алкил-HN-(СО)(СН 2)р-, ди(С 1-С 6)алкил-N-(С=O)-(СН 2)р-, (С 3-С 7) циклоалкил-NH-(С=O)-(СН 2)р-,R13O-(СН 2)р-,13(С 1-С 6)алкил-(С=O)-О-(СН 2)р-, амино-(С 1 С 6)алкил-(С=O)-О-(СН 2)р-, (С 1-С 6)алкил-NH-(С 1 С 6)алкил-(С=O)-О-(СН 2)р-,ди(С 1-С 6)алкил-N(С 1-С 6)алкил-(С=O)-О-(СН 2)р-,амино-(С 1-С 6) алкил-O-(С=O)-(СН 2)р-, (С 1-С 6)алкил-NH-(С 1-С 6) алкил-O-(С=O)-(СН 2)р-, ди(С 1-С 6)алкил-N-(С 1 С 6)алкил-O-(С=O)-О-(СН 2)р-, гидрокси, гидрокси-(С 1-С 6)алкил-, гидрокси-(С 1-С 6)алкил-NH(СН 2)р-, (С 1-С 6)алкил-O-(С 1-С 6)алкил-, -CN, пиперидин-(СН 2)р-, пирролидин-(СН 2)p- и 3 пирролин-(СН 2)p-, где указанные пиперидин,пирролидин и 3-пирролин в упомянутых частей пиперидин-(СН 2)p-, пирролидин-(СН 2)p- и 3 пирролин-(СН 2)p- могут быть необязательно замещены на любом из атомов углерода кольца,способных иметь дополнительную связь, предпочтительно от нуля до двух заместителей, заместителем, независимо выбранным из галогена, СF3, (C1-С 6)алкила, необязательно замещен 53 ного от одного до трех атомами галогена, (C1C6)алкокси, необязательно замещенного от одного до трех атомами галогена, (C1-C6) алкилтиол, амино-(СН 2)p-, (C1-C6)алкил-NH-(СН 2)p-,ди(C1-C6)алкил-N-(СН 2)p-, (C3-C7)циклоалкилNH-(СН 2)p-,амино-(C1-C6)алкил-NH-(СН 2)p-,(C1-C6)алкил-NH-(C1-C6)алкил-NH-(СН 2)p-, диn равно целому числу от нуля до 3; каждый р независимо равен целому числу от нуля до 4;s равно целому числу от нуля до 4; где пунктирная линия представляет необязательную двойную связь; и фармацевтически приемлемые соли таких соединений. 2. Соединение по п.1, где R3 представляет водород, галоген или (C1-C6)алкил. 3. Соединение по п.1, где один из R5, R6, R7 или R8 представляет фтор, бром, хлор, метил или трифторметил. 4. Соединение по п.1, где R5 представляет фтор, бром, хлор, метил или трифторметил.Ph и либо R9 представляет фтор, хлор, -CN или гидрокси; либо R11 представляет -СНО, хлор,фтор, метил, (C1-C6)алкил-NH-(CH2)p-, ди(C1C6)алкил-N-(CH2)p- или циано. 8. Соединение по п.1, где R2 представляет гетероарил, где указанный гетероарил представляет либо необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод или К и L представляют углерод и М представляет азот (т.е. пиримидин-2-ил), либо указанный гетероарил представляет необязательно замещенный пятичленный гетероцикл,где Т представляет азот, Р представляет серу иQ представляет углерод или Т представляет азот или серу, Q представляет азот или серу и Р представляет углерод, или Т представляет кислород и Р и Q, каждый, представляют углерод. 9. Соединение по п.1, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод и где R14 представляет водород, -СНО, хлор, фтор,метил,(C1-C6)алкил-NH-(CH2)p-,ди(C1-C6) алкил-N-(CH2)p- или циано; R17 представляет водород, -СНО, хлор, фтор, метил, (C1-C6)алкилNH-(C1-C6)алкил, ди(C1-C6)алкил-N-(C1-C6)алкил или циано или R15 или R16 независимо представляют водород, -СНО, хлор, фтор, метил или циано. 10. Соединение по п.1, где R2 представляет необязательно замещенный шестичленный гетероцикл, где К, L и М представляют углерод иR14 представляет водород, -СНО, метил, (C1-C6) алкил-NH-(CH2)p-, ди(C1-C6)алкил-N-(CH2)p- или циано. 11. Соединение по п.1, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот, Р представляет серу и Q представляет углерод и R14, R15 илиR16, каждый независимо представляет водород,хлор, фтор, метил или циано. 12. Соединение по п.1, где R2 представляет необязательно замещенный пятичленный гетероцикл, где Т представляет азот или серу, Q представляет серу или азот и Р представляет углерод, и R14 или R15 независимо выбирают из водорода, хлора, фтора, метила или циано. 13. Соединение по п.1, где упомянутое соединение выбирают из группы, состоящей из(S)-6-фтор-2-[2-(2-метилтиазол-4-ил)винил]-3-(2-метилфенил)-3 Н-хиназолин-4-она. 14. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации,удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера,хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии(например, состояний, вызванных странгуляцией, хирургической операцией, вдыханием дыма,асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой,или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени,недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения,ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащая количество соединения по п.1, эффективное для лечения или профилактики такого состояния, и фармацевтически приемлемый носитель. 15. Способ лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии,травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИДиндуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или 56 трахеи, электротравмой или чрезмерной дозой лекарственного сердца или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм, и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени, недержания мочи,психоза, судорог, хронической или острой боли,глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1, эффективного для лечения или профилактики такого состояния. 16. Фармацевтическая композиция для лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации,удара, церебральной ишемии, травмы спинного мозга, травмы головы, болезни Альцгеймера,хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИД-индуцированной деменции, перинатальной гипоксии, гипоксии(например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма,асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой,или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического повреждения нейронов, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, головных болей типа мигрени,недержания мочи, психоза, судорог, хронической или острой боли, глазного повреждения,ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, содержащая количество соединения по п.1, эффективное для создания антагонизма АМРА-рецептору, и фармацевтически приемлемый носитель. 17. Способ лечения или профилактики состояния, выбранного из церебрального дефицита после операции на сердце с шунтированием и трансплантации, удара, церебральной ишемии,травмы спинного мозга, травмы головы, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, эпилепсии, СПИДиндуцированной деменции, перинатальной гипоксии, гипоксии (например, состояния, вызванные странгуляцией, хирургической операцией, вдыханием дыма, асфилаксией, утоплением, закупоркой или сдавливанием гортани или трахеи, электротравмой, или чрезмерной дозой лекарственного средства или алкоголя), остановки сердца, гипогликемического нейронного повреждения, опиатной толерантности, синдрома отмены (например, алкоголизм и привыкание к чрезмерному употреблению лекарственных средств, включая привыкание к опиатам, кокаину и никотину), идиопатической и индуцированной лекарственным средством болезни Паркинсона и отека мозга и мышечных спазм, го 58 ловных болей типа мигрени, недержания мочи,психоза, судорог, хронической или острой боли,глазного повреждения, ретинопатии, ретинальной нейропатии, шума в ушах, страха, рвоты и поздней дискинезии, у млекопитающего, включающий введение млекопитающему, нуждающемуся в таком лечении или профилактике, количества соединения по п.1, эффективного для создания антагонизма АМРА-рецептору.
МПК / Метки
МПК: A61P 21/02, C07D 239/91, A61K 31/517
Метки: использование, антагонистов, амра-рецепторов, атропизомеры, качестве, 3-арил-4(3н)-хиназолинонов
Код ссылки
<a href="https://eas.patents.su/30-1963-atropizomery-3-aril-43n-hinazolinonov-i-ih-ispolzovanie-v-kachestve-antagonistov-amra-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Атропизомеры 3-арил-4(3н)-хиназолинонов и их использование в качестве антагонистов амра-рецепторов</a>
Предыдущий патент: Поворотный механизм для разрезания и/или сварки
Следующий патент: Способ получения энантиомерно обогащенных n-производных лактамов
Случайный патент: Хинолины и их терапевтическое применение