Производные индол-2-она, двузамещенные в положении 3, их получение и их применение в терапии
Формула / Реферат
1. Соединение формулы (I)

в которой ![]() обозначает простую или двойную связь,
обозначает простую или двойную связь,
X обозначает -N<, -CH< или 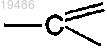 ,
,
Y обозначает >N- или >СН- при условии, что по меньшей мере один из X или Y обозначает N;
Ar обозначает (С6-10)арильную группу, выбранную из фенила и нафтила, или гетероарильную группу, выбранную из фуранила, пирролила, имидазолила, пиразолила, тиенила, оксадиазолила, оксазолила, изоксазолила, фуразанила, тиадиазолила, тиазолила, изотиазолила, пиридила, пиразинила, пиримидинила и пиридазинила, а также соответствующей группы, образующейся в результате конденсации с фенильной группой, выбранной из бензотиофена, бензофурана и бензотиазола, причем арильная или гетероарильная группа может быть замещена несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С1-6)алкила, (С1-6)галогеналкила, пергалоген(С1-3)алкила, (С1-6)алкокси, пергалоген(С1-3)алкокси и (С6-10)арила;
R1 обозначает атом водорода, (С1-6)алкил, -С(=O)(С1-6)алкил или -C(=O)(С6-10)арил;
R2, R3 и R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, CN, ОН, (С1-6)алкил, возможно замещенный атомом галогена или ОН; пергалоген(С1-3)алкил, (С1-6)алкокси, пергалоген(С1-3)алкокси, аминокарбонил, (С1-6)алкиламинокарбонил, ди(С1-6)алкиламинокарбонил, (С6-10)арил, (С6-10)арилокси или гетероарил, выбранный из фуранила, пирролила, имидазолила, пиразолила, тиенила, оксадиазолила, оксазолила, изоксазолила, фуразанила, тиадиазолила, тиазолила, изотиазолила, пиридила, пиразинила, пиримидинила и пиридазинила, а также соответствующей группы, образующейся в результате конденсации с фенильной группой, выбранной из бензотиофена, бензофурана и бензотиазола; при этом (С6-10)арильная, (С6-10) арилокси или гетероарильная группа возможно замещена атомом галогена, CN, ОН, (С1-6)алкилом, пергалоген(С1-3)алкилом или (С1-6)алкокси, при условии, что по меньшей мере один из R2, R3 или R4 не является Н;
R5 обозначает (С1-6)алкил или (С2-6)алкенил и
n обозначает 1 или 2;
или его фармацевтически приемлемая соль; за исключением 5-хлор-3-(2-хлорфенил)-1,3-дигидро-3-[2-(4-метилпиперазин-1-ил)ацетамидо]индол-2-она.
2. Соединение по п.1, где ![]() обозначает простую или двойную связь;
обозначает простую или двойную связь;
X обозначает -СН<, -N< или 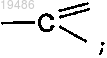
Y обозначает >N- или >СН-;
при условии, что по меньшей мере один из X или Y обозначает N;
Ar обозначает (С6-10)арильную группу, выбранную из фенила и нафтила, или гетероарильную группу, выбранную из фуранила, пирролила, имидазолила, пиразолила, тиенила, оксадиазолила, оксазолила, изоксазолила, фуразанила, тиадиазолила, тиазолила, изотиазолила, пиридила, пиразинила, пиримидинила и пиридазинила, а также соответствующей группы, образующейся в результате конденсации с фенильной группой, выбранной из бензотиофена, бензофурана и бензотиазола, причем арильная или гетероарильная группа может быть замещена одним или несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С1-6)алкокси, (С6-10)арила, пергалоген(С1-3)алкила и (С1-6)алкила;
R1 обозначает атом водорода, -С(=O)(С1-6)алкил, -С(=O)(С6-10)арил или (С1-6)алкил;
R2, R3 и R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, (С1-6)алкил, пергалоген(С1-3)алкил, CN, (С6-10)арил, гетероарил, ОН, (С1-6)алкокси, пергалоген(С1-3)алкокси, аминокарбонил, (С1-6)алкиламинокарбонил или ди(С1-6)алкиламинокарбонил, при условии, что по меньшей мере один из R2, R3 или R4 не является H;
R5 обозначает (С1-6)алкил;
n обозначает 1 или 2;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, где ![]() обозначает простую или двойную связь,
обозначает простую или двойную связь,
X обозначает -N<, -CH< или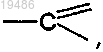
Y обозначает >N- или >СН-;
при условии, что по меньшей мере один из X или Y обозначает N;
Ar обозначает (С6-10)арильную группу, выбранную из фенила и нафтила, возможно замещенную одним или несколькими заместителями, выбираемыми из атомов галогена, (С1-6)алкокси, (С1-6)алкила, (С6-10)арила, трифторметила и трифторметокси;
R1 обозначает атом водорода, -С(=O)(С1-6)алкил, -С(=O)(С6-10)арил или (С1-6)алкил;
R2, R3 и R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, (С1-6)алкил или трифторметил, при условии, что по меньшей мере один из R2, R3 и R4 не является Н;
R5 обозначает (С1-6)алкил;
n обозначает 1 или 2;
или его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1-3, где ![]() обозначает простую или двойную связь,
обозначает простую или двойную связь,
X обозначает -N<, -CH< или ![]() ,
,
Y обозначает >N- или >СН-; при условии, что по меньшей мере один из X или Y обозначает N;
Ar обозначает фенил или нафтил, возможно замещенный одним или несколькими заместителями, выбираемыми из атомов галогена, метокси, метила, третбутила, фенила, трифторметила и трифторметокси;
R1 обозначает атом водорода, -C(=O)метил, -С(=O)фенил или метил;
R2, R3, R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена или трифторметил, при условии, что по меньшей мере один из R2, R3 или R4 не является Н;
R5 обозначает метил, этил или 2-пропил;
n обозначает 1 или 2;
или его фармацевтически приемлемая соль.
5. Соединение по п.1 или 2, где
Ar обозначает гетероарильную группу, выбранную из фуранила, пирролила, имидазолила, пиразолила, тиенила, оксадиазолила, оксазолила, изоксазолила, фуразанила, тиадиазолила, тиазолила, изотиазолила, пиридила, пиразинила, пиримидинила и пиридазинила, а также соответствующей группы, образующейся в результате конденсации с фенильной группой, выбранной из бензотиофена, бензофурана и бензотиазола, возможно замещенную одним или несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С1-6)алкокси, (С6-10)арила, пергалоген(С1-3)алкила и (С1-6)алкила.
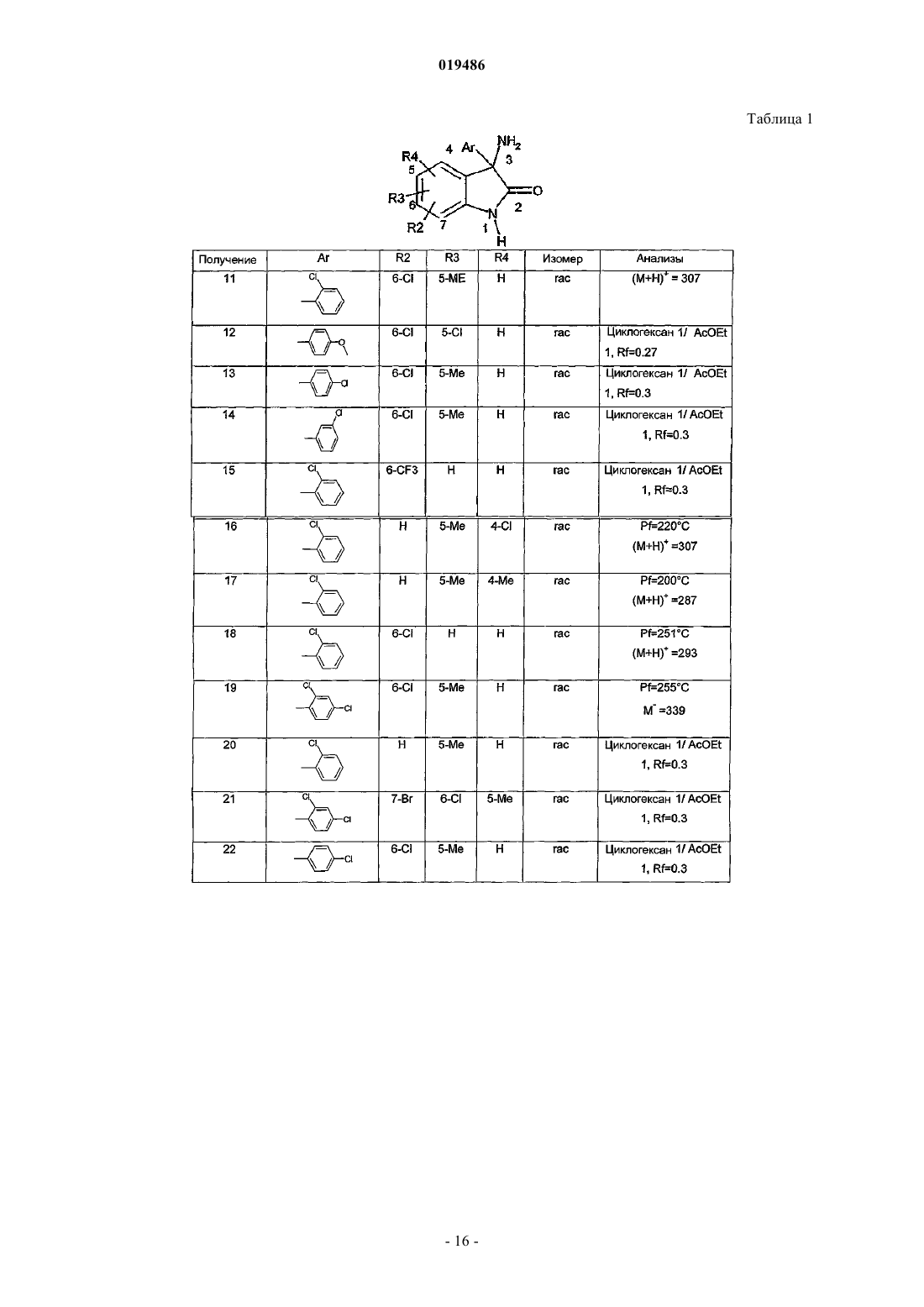
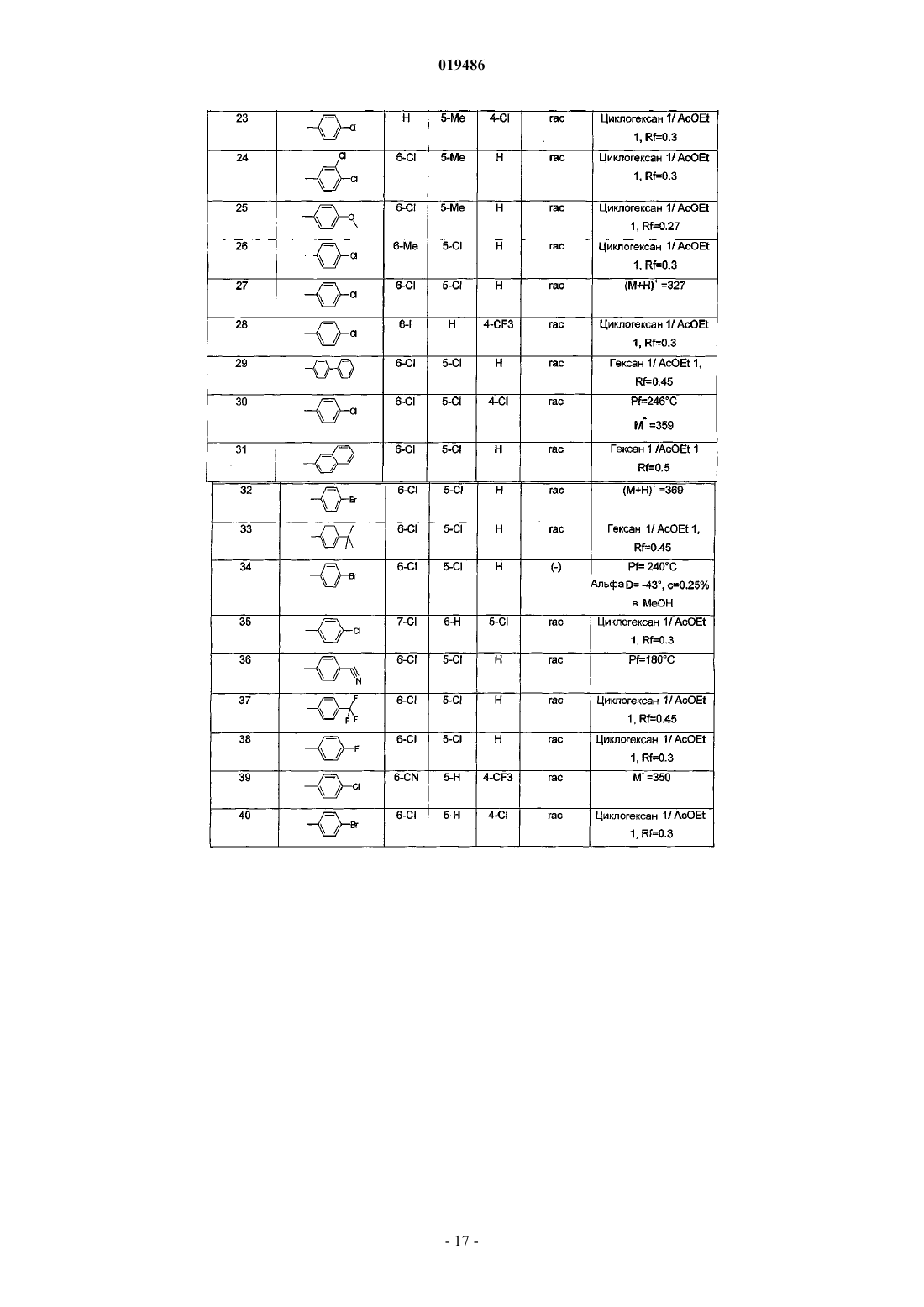
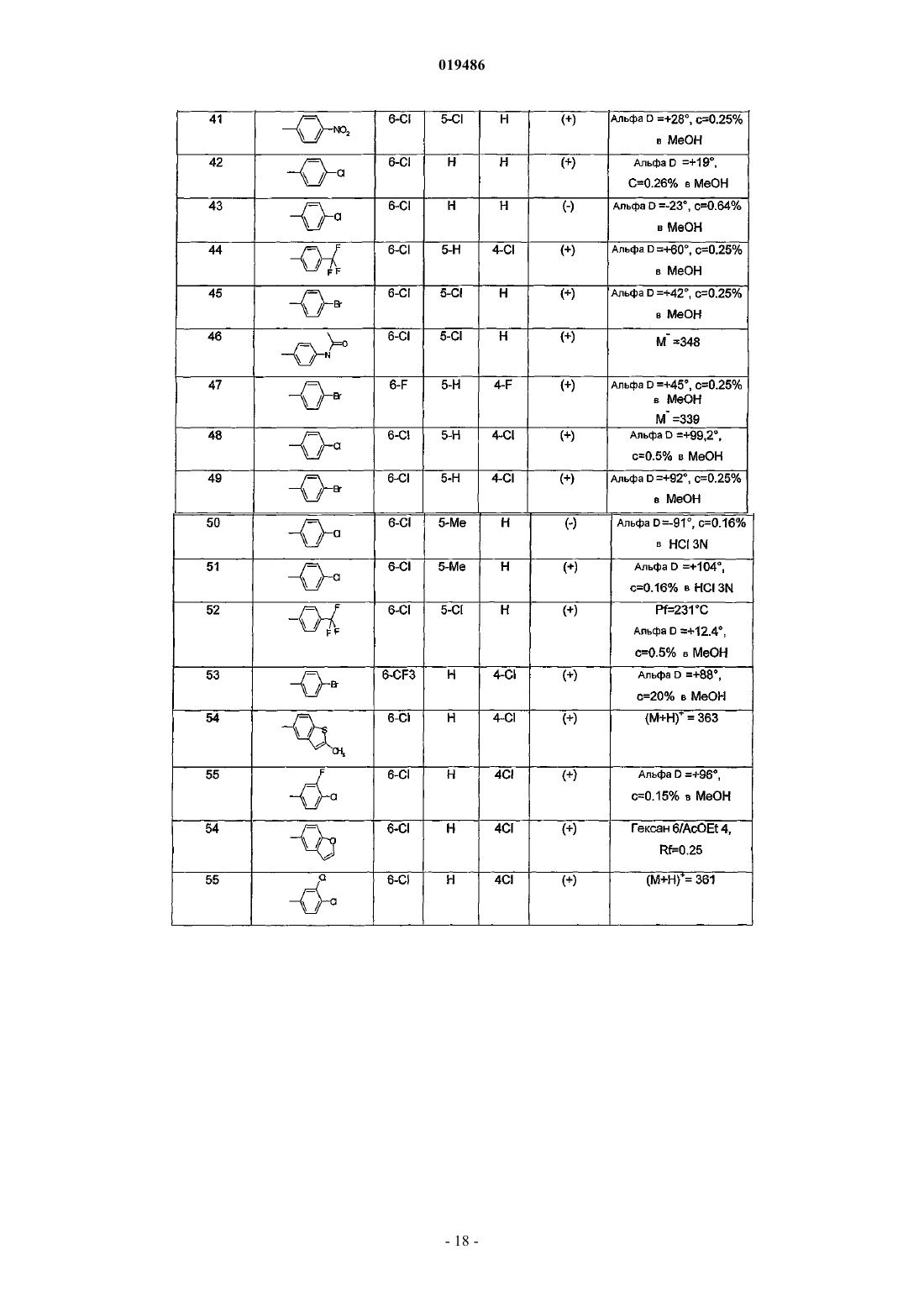
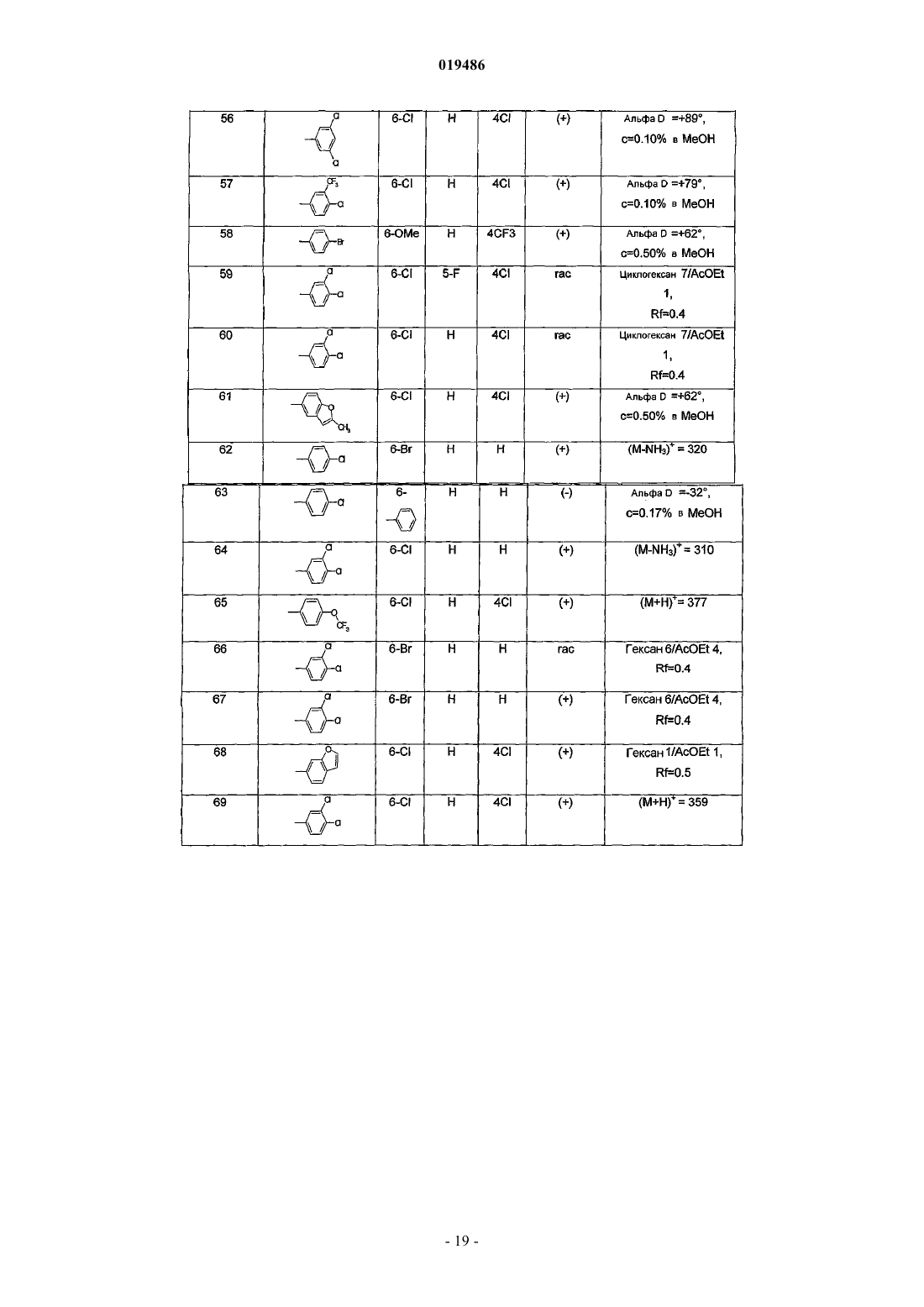
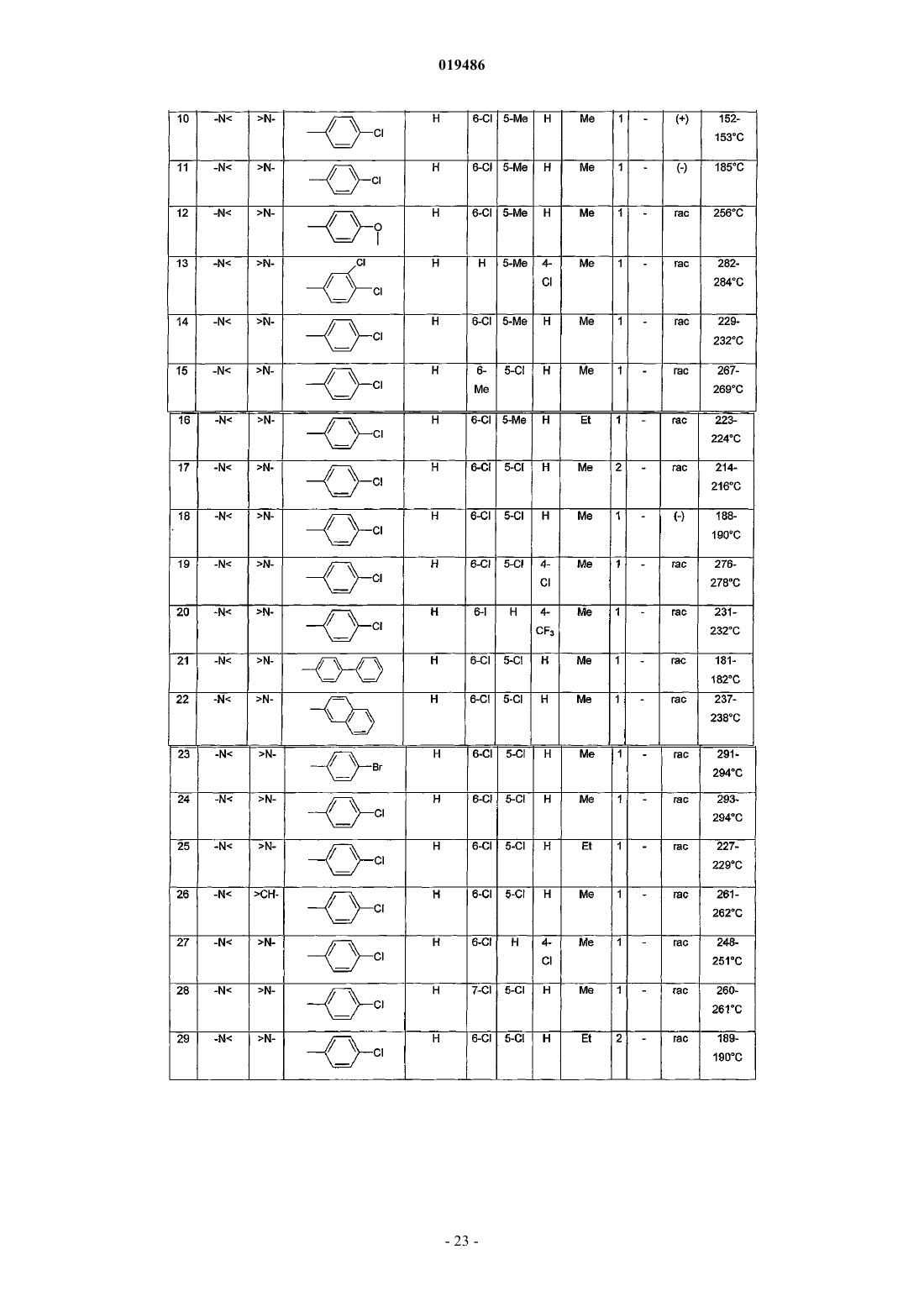
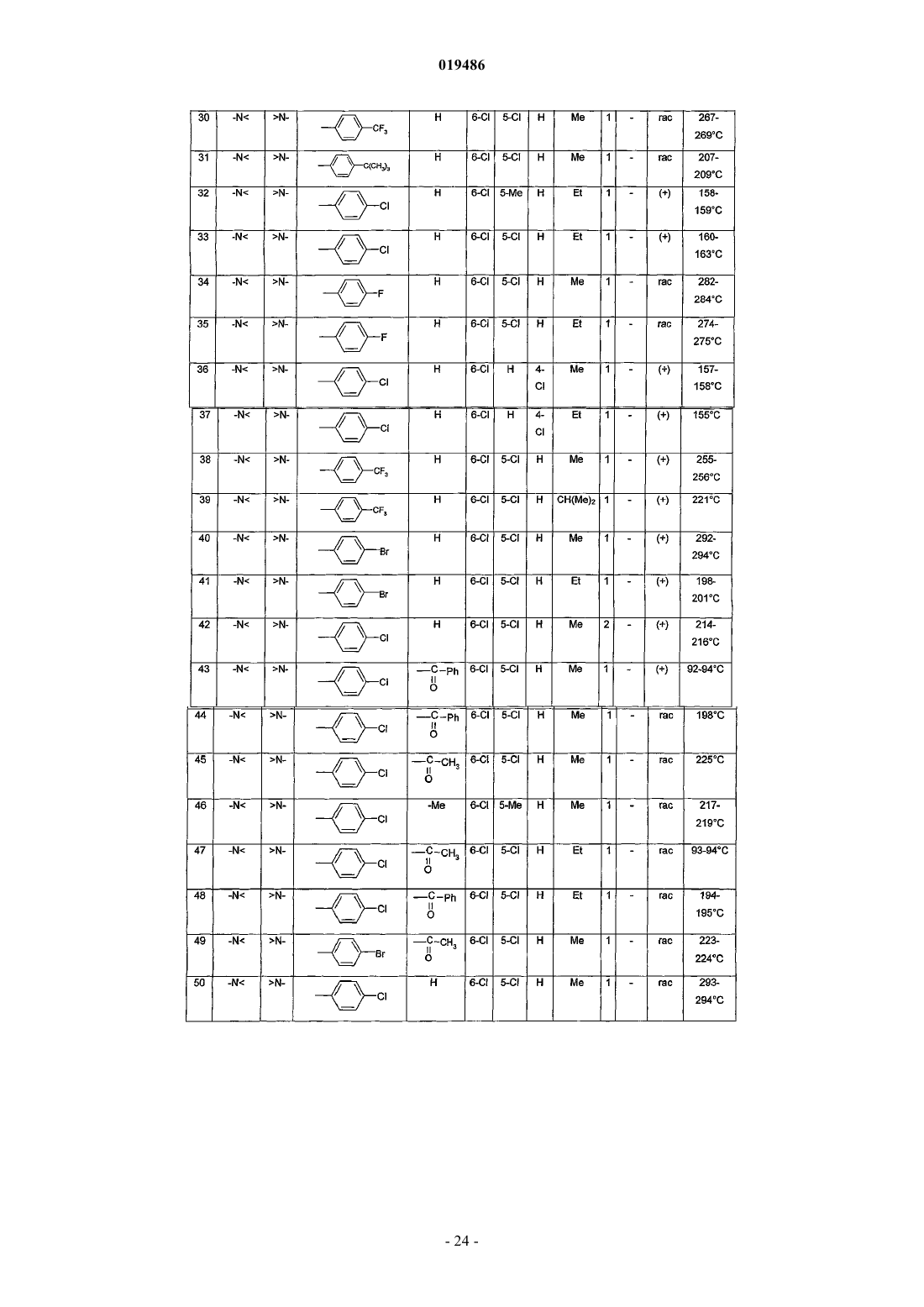
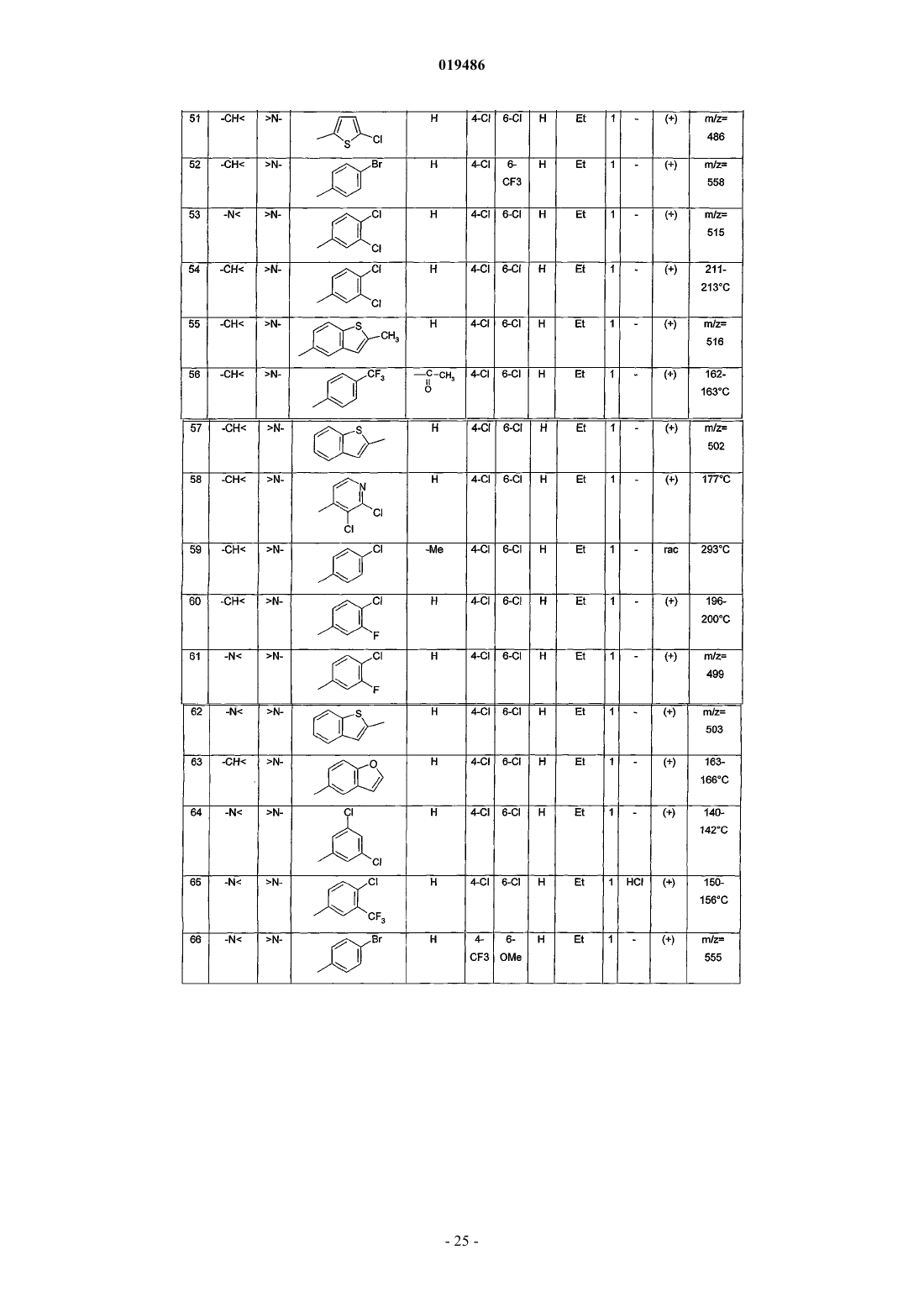
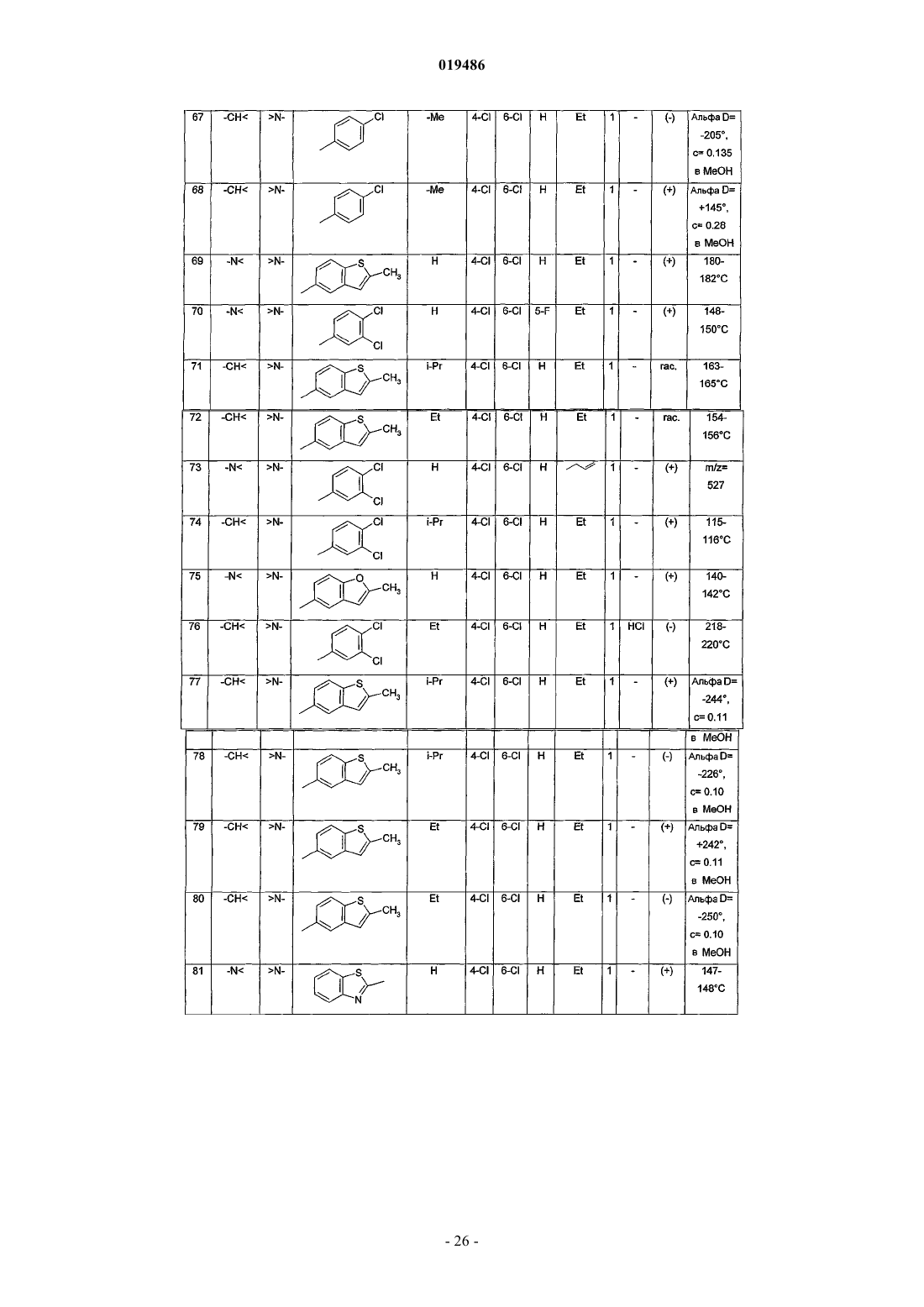
6. Соединение по любому из пп.1-5, выбираемое из
(+)N-[5,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамида;
(+)N-[4,6-дихлор-3-(4-трифторметилфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(1-этилпиперидин-4-ил)ацетамида;
N-[4,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамида;
N-[4-трифторметил-6-циано-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
(+)N-[1-бензоил-5,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамида;
3-(4-хлорфенил)-3-[2-(4-этилпиперазин-1-ил)ацетиламин]-2-оксо-4-трифторметил-2,3-дигидро-1Н-индол-6-карбоксамида;
N-[6-хлор-3-(4-хлорфенил)-1,5-диметил-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамида;
(+)N-[4,6-дихлор-3-(4-трифторметилфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(1-этил-1,2,3,6-тетрагидропирид-4-ил)ацетамида;
N-[4,6-дихлор-3-(3,4-дихлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
N-[4,6-дихлор-3-(3-фтор-4-хлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
N-[4,6-дихлор-3-(3-трифторметил-4-хлорфенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
N-[4,6-дихлор-1-этил-3-(2-метилбензо[b]тиофен-5-ил)-2-оксо-2,3-дигидро-1H-индол-3-ил]-2-(1-этилпиперидин-4-ил)ацетамида;
N-[4,6-дихлор-1-этил-3-(2-метилбензофуран-5-ил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
N-[4,6-дихлор-3-(4-трифторметоксифенил)-2-оксо-2,3-дигидро-1Н-индол-3-ил]-2-(4-этилпиперазин-1-ил)ацетамида;
или его фармацевтически приемлемой соли.
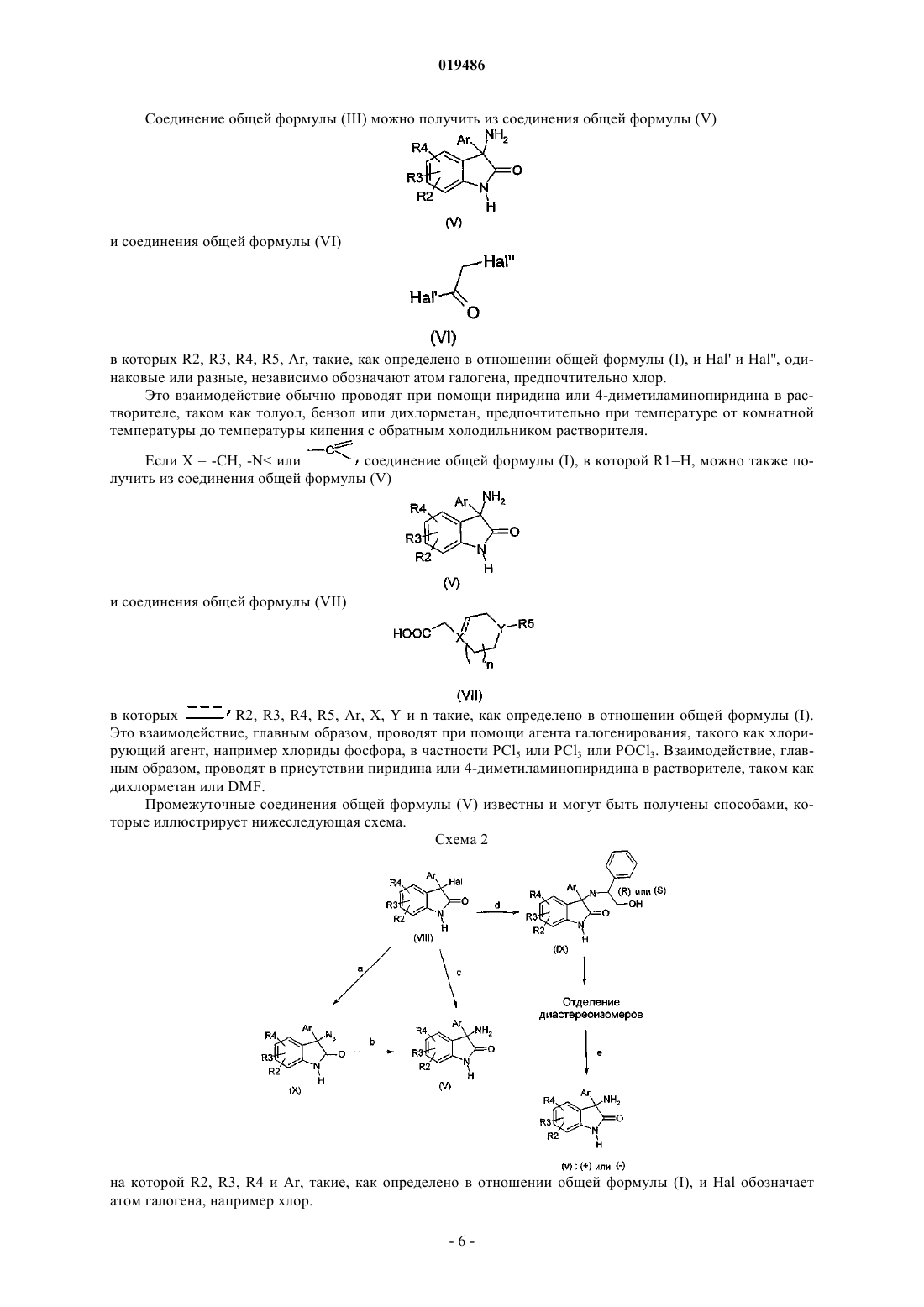
7. Способ получения соединения формулы (I) по любому из пп.1-6, в которой X обозначает -N<, отличающийся тем, что вводят в реакцию соединение общей формулы (V)
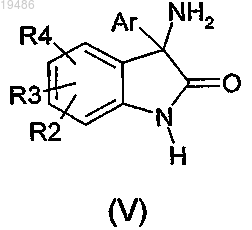
в которой R2, R3, R4 и Ar такие, как определено по любому из пп.1-6, и соединение общей формулы (VI)
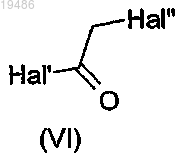
в которой Hal' и Hal'', одинаковые или разные, независимо обозначают атом галогена,
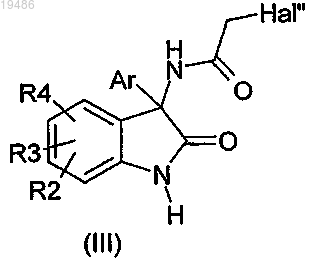
затем вводят в реакцию полученное соединение общей формулы (III)
и соединение общей формулы (IV)
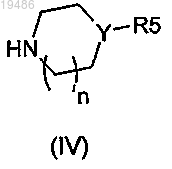
в которых R2, R3, R4, R5, Y, Ar и n такие, как определено в пп.1-6, и Hal'' обозначает атом галогена;
полученное соединение формулы (I), в которой X обозначает -N< и R1 обозначает Н, вводят в реакцию с соединением формулы (II)
R1-Hal (II)
в которой R1, не являющийся Н, имеет то же определение, что и в пп.1-6, и Hal обозначает атом галогена.
8. Способ получения соединения формулы (I) по любому из пп.1-6, в котором вводят в реакцию соединение общей формулы (V)
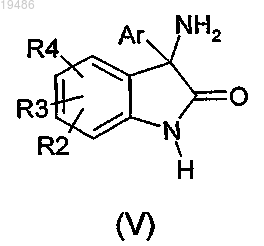
и соединение общей формулы (VII)
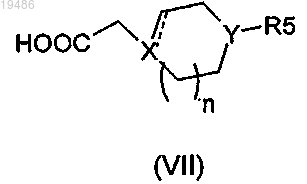
в которой ![]() X, Y, R5 и n определены по любому из пп.1-6;
X, Y, R5 и n определены по любому из пп.1-6;
вводят в реакцию полученное соединение формулы (I), в которой R1 обозначает Н, с соединением формулы (II)
R3-Hal (II)
в которой R1, не являющийся Н, имеет то же определение, что и в пп.1-6, и Hal обозначает атом галогена.
9. Способ получения соединения формулы (I) по любому из пп.1-6, в котором R1 обозначает (С1-6)алкил, а X обозначает -N<, отличающийся тем, что вводят в реакцию соединение общей формулы (XXVIII)
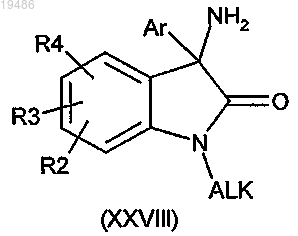
в которой R2, R3, R4 и Ar определены по любому из пп.1-6 и ALK обозначает (С1-6)алкил, и соединение общей формулы (VI)
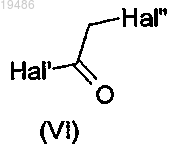
в которой Hal' и Hal'', одинаковые или разные, независимо обозначают атом галогена,
затем вводят в реакцию полученное соединение общей формулы (XXIX)
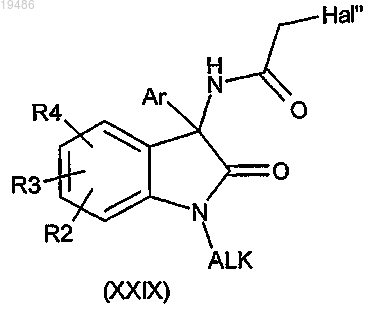
и соединение общей формулы (IV)
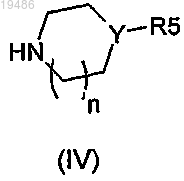
в которых R2, R3, R4, R5, Y, Ar и n такие, как определено в пп.1-6, и Hal'' обозначает атом галогена.
10. Способ получения соединения формулы (I) по любому из пп.1-6, в котором R1 обозначает (С1-6)алкил, в котором вводят в реакцию соединение общей формулы (XXVIII)
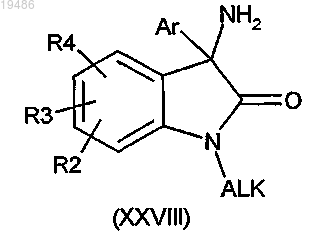
и соединение общей формулы (VII)
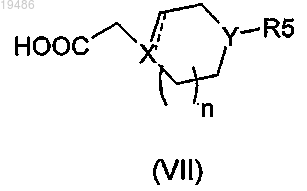
в которой ![]() X, Y, R5 и n определены по любому из пп.1-6.
X, Y, R5 и n определены по любому из пп.1-6.
11. Способ по любому из пп.7-10, включающий последующую стадию выделения целевого соединения общей формулы (I).
12. Соединение формулы (III)
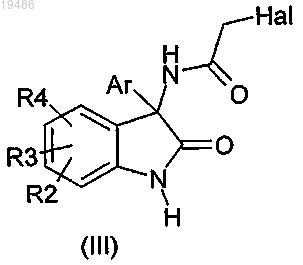
в которой R2, R3, R4 и Ar определены по любому из пп.1-6 и Hal обозначает атом галогена, за исключением 5-хлор-3-(2-хлорацетамид)-3-(2-хлорфенил)-1,3-дигидроиндол-2-она.
13. Соединение формулы (III) по п.12, в которой Ar обозначает гетероарильную группу, возможно замещенную одним или несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С1-6)алкокси, (С6-10)арила, пергалоген(С1-3)алкила и (С1-6)алкила.
14. Соединение общей формулы (XXVIII)

в которой R2, R3, R4 и Ar определены по любому из пп.1-6 и ALK обозначает (С1-6)алкил.
15. Соединение общей формулы (XXIX)
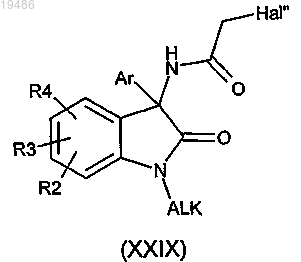
в которой R2, R3, R4 и Ar определены по любому из пп.1-6, ALK обозначает (С1-6)алкил и Hal'' обозначает атом галогена.
16. Лекарственное средство для профилактики или лечения ожирения, диабета, нарушений аппетита и избытка массы тела, отличающееся тем, что оно содержит соединение формулы (I) по любому из пп.1-6 или его фармацевтически приемлемую соль.
17. Фармацевтическая композиция для профилактики или лечения ожирения, диабета, нарушений аппетита и избытка массы тела, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-6 или его фармацевтически приемлемую соль.
18. Применение соединения по любому из пп.1-6 для получения лекарственного средства, предназначенного для профилактики или лечения ожирения, диабета, нарушений аппетита и избытка массы тела.
19. Фармацевтическая композиция для профилактики или лечения ожирения, диабета, нарушений аппетита и избытка массы тела, содержащая одно или несколько соединений по любому из пп.1-6 в комбинации с одним или несколькими активными ингредиентами, выбранными из средств против ожирения и антидиабетических средств.
Текст
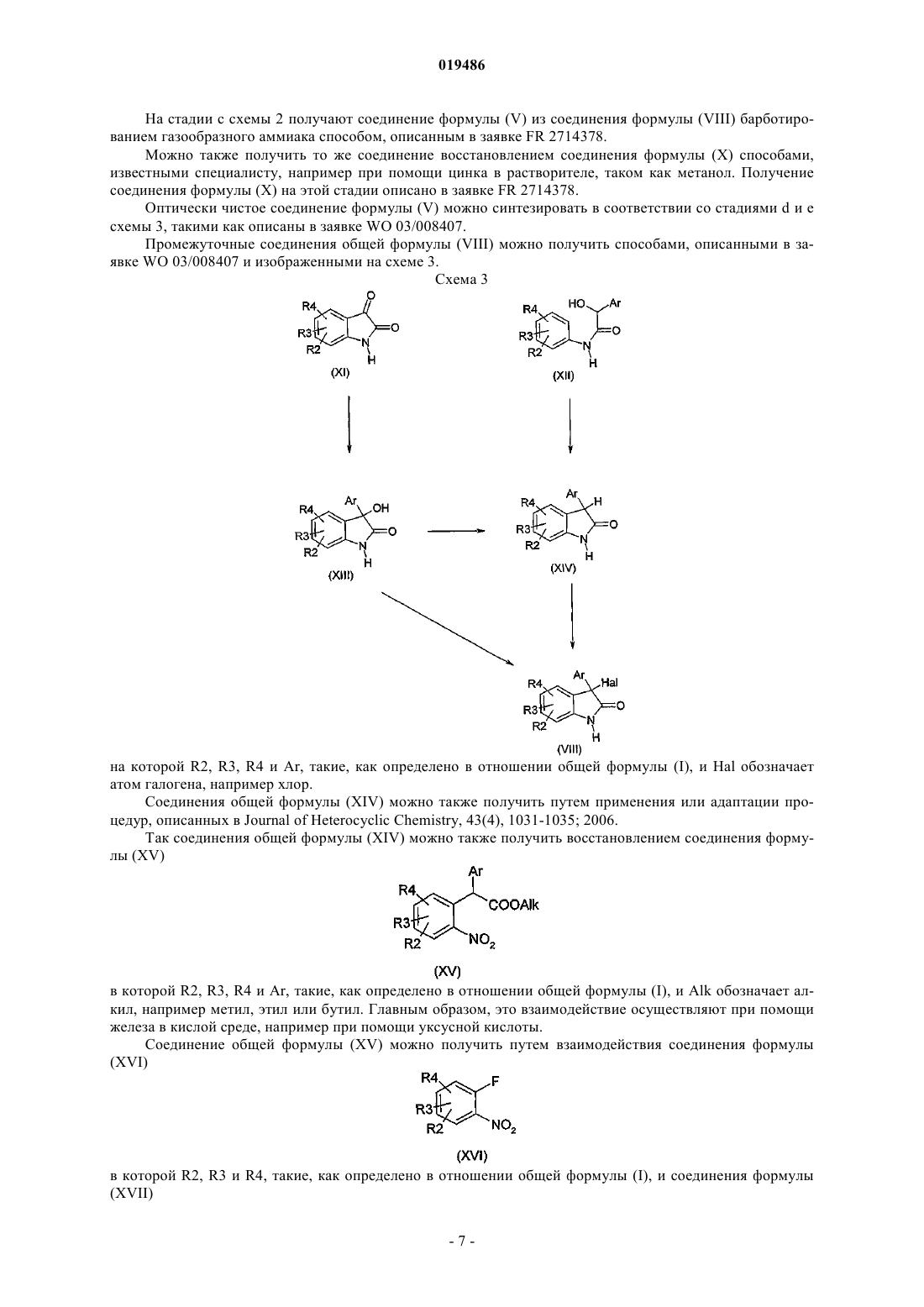
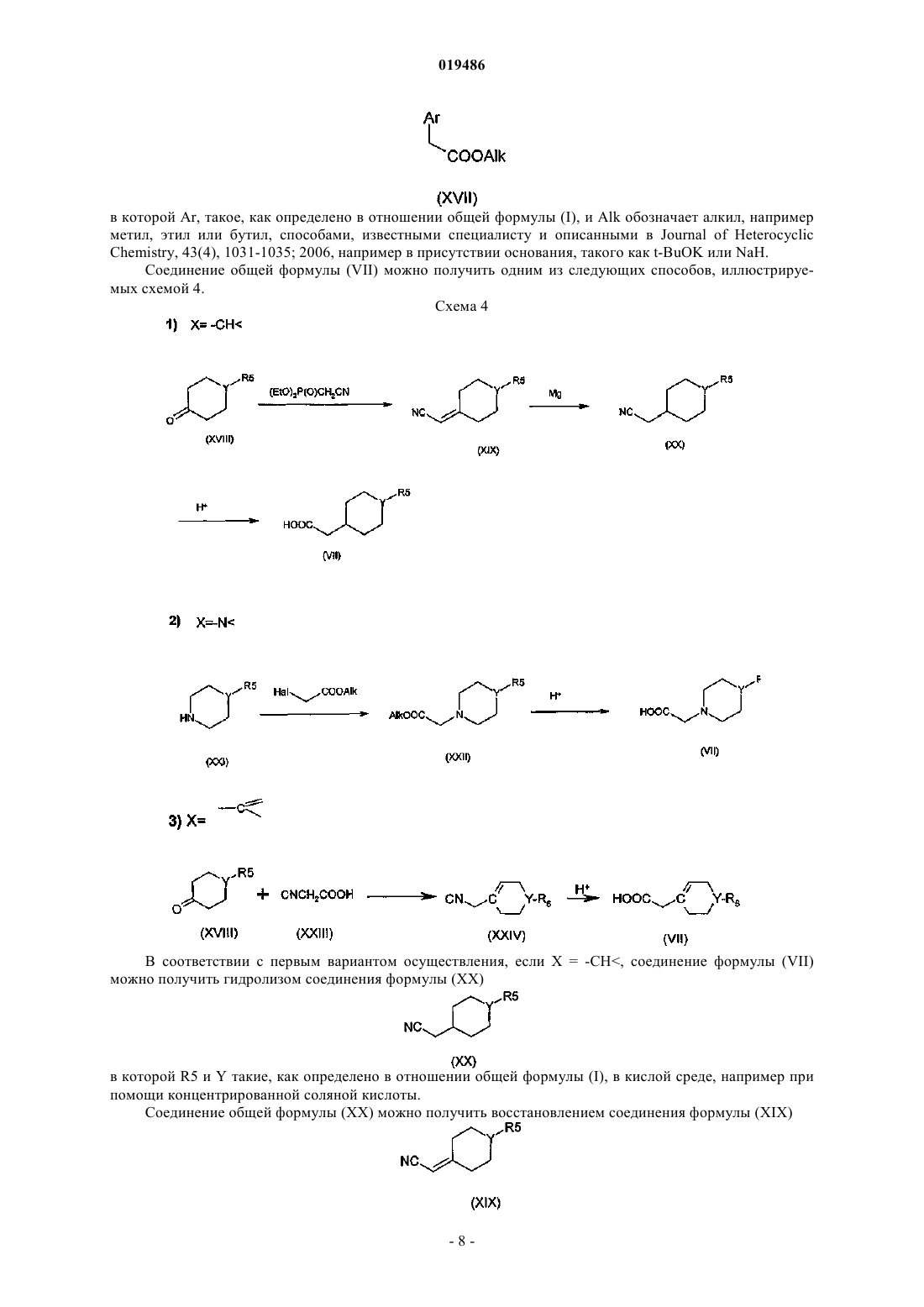
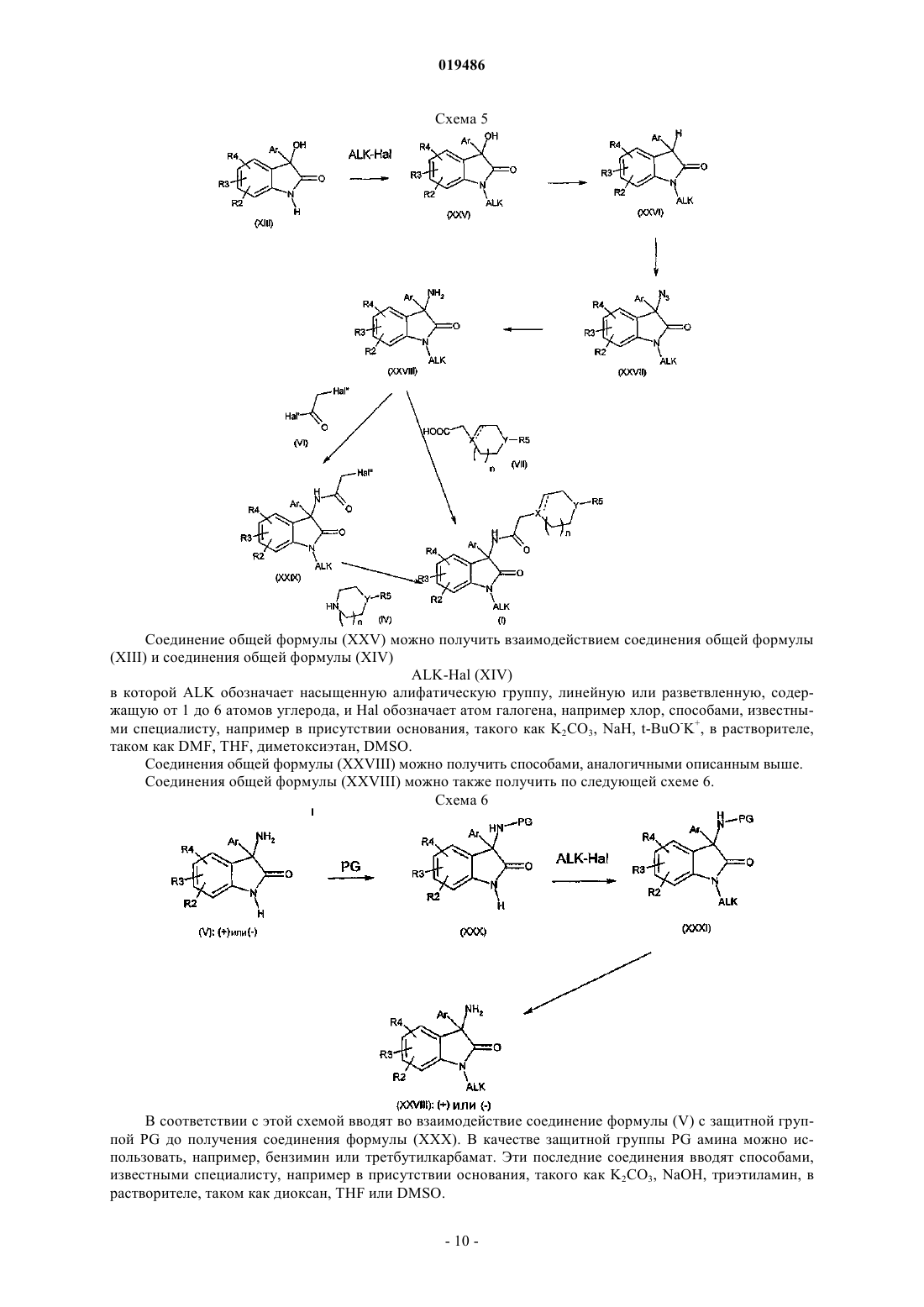
Объектом настоящего изобретения являются производные индол-2-она, двузамещенные в положении 3, общей формулы (I) в которой R1, R2, R3, R4, R5, Аr, X, Y и n такие, как определено в описании изобретения, способ получения и применение указанных соединений в терапии. Объектом настоящего изобретения являются производные индол-2-она, двузамещенные в положениях 5 и 3, их получение и их применение в терапии. Грелин представляет собой пептидный гормон, состоящий из 28 аминокислот, продуцируемый,главным образом, в желудке посредством посттрансляционного процесса после расщепления препрогрелина (Kojima M. et al., 1999, 402:656-60). Грелин является эндогенным лигандом гипофизного рецептора стимуляторов секреции гормона роста (GHSR1a).GHS-R кодируется двумя экзонами: экзон 1 кодирует трансмембранные домены (TMs) 1-5 и экзон 2 кодирует ТМ 6 и 7 рецептора, связанного с белком G(GPCR). Оба транскрипта были идентифицированы в гипофизе и в мозге: один, кодирующий GPCR полной длины (GHS-R1a), а другой, кодирующий усеченный рецептор (GHS-R1b), в котором отсутствуют ТМ 6 и 7. Только подвид GHS-R1a активируется грелином и миметиками грелина. GHS-R1b присутствует в печени и других периферических тканях, но его функция неизвестна (Smith R.G. et al., Trends in Endocrinology and Metabolism, 2005, 16,9). Это рецептор типа родопсина с шестью трансмембранными доменами семейства А, сопряженный сGg/фосфолипазой С. В некоторых тканях рецептор грелина может также связываться с путямиGs/протеинкиназа A (Ueno, N. et al. Endocrinology, 2004, 145, 4176-4184; Kim, M.S. et al., Int. J. Obes. Relat. Metab. Disord., 2004, 28:1264-1271). Интересно, что особенностью рецептора грелина является существенная конститутивная активность, независимая от лиганда (Barazzoni, R. et al., Am. J. Physiol. Endocrinol. Metab., 2004, 288: E228-E235). Низкие уровни экспрессии грелина были отмечены в разных тканях, таких как кишечник, поджелудочная железа, почки, иммунная система, плацента, яички, гипофизные ткани, гипоталамус (Horm. Res. 2003, 59 (3):109-17). Было показано, что грелин участвует в чувстве голода в момент приема пищи и в инициации приема пищи. Циркулирующие количества уменьшаются при приеме пищи и повышаются перед едой, достигая концентраций, достаточных для стимуляции чувства голода и приема пищи. Прием грелина внутрь быстро и на время стимулирует потребление пищи, главным образом изменяя пищевое поведение в сторону повышения аппетита и более частого приема пищи. Грелин кратковременно стимулирует потребление пищи более эффективно, чем любая другая молекула, за исключением нейропептида Y, с которым он имеет примерно одинаковый потенциал (Wren A.M., et al., J. Clin. Endocrinol. Metab., 2001; 86: 5992-5). Тем не менее, грелин уникален по своей способности оказывать такое действие независимо от того,впрыскивается ли он периферически или центрально. Это также единственное вещество млекопитающего, которое способно повышать аппетит и потребление пищи при его введении человеку (Druce M.R. et al., Int. J. Obes., 2005; 29: 1130-6; Wynne K., et al., J.Am. Soc. Nephrol., 2005; 16: 2111-8). Кроме своей роли в инициировании потребления пищи грелин соответствует критериям гормона,связанного с ожирением, участвующего в долгосрочной регуляции массы тела. Уровень содержания грелина изменяется в зависимости от энергетических запасов и показывает компенсаторные изменения в ответ на изменения массы тела. Грелин проходит через гематоэнцефалический барьер и стимулирует потребление пищи, воздействуя на некоторые традиционные центры регуляции массы тела, такие как гипоталамус, задний мозг и мезолимбическая компенсаторная система. Хроническое введение грелина увеличивает массу тела путем различных согласованных воздействий на потребление пищи, энергетические затраты и использование ресурсов. Врожденная аблация грелина или гена рецептора грелина вызывает резистентность к ожирению, вызываемому питанием, и фармакологическая блокировка грелина уменьшает потребление пищи и массу тела. Существующие доказательства свидетельствуют в пользу роли грелина как в краткосрочной инициации приема пищи, так и в долгосрочном энергетическом гомеостазе, что делает привлекательным его использование в качестве лекарственного средства для лечения ожирения и/или нарушений при похудении. Грелин оказывает также одновременно физиологическое и фармакологическое действие на поджелудочную железу. Ацилированный биоактивный грелин продуцируется в -клетке, недавно описанной в панкреатических островках (Prado, C.L., et al., 2004, Proc. Natl. Acad. Sci. USA, 101: 2924-2929), потенциально являясь локальным источником эндогенного грелина, который воздействует на клеткиостровков. Блокировка этой функции эндогенного грелина посредством антагониста его рецепторов существенно снижает концентрацию глюкозы натощак, смягчает гликемическое движение и усиливает ответы на инсулин в тестах на переносимость глюкозы, указывая на ингибирующую роль грелина при контроле секреции инсулина (Dezaki, K., et al., 2004, Diabetes, 53:3142-3151). Абляция грелина у мышей (мышь грелин -/-) повышает секрецию инсулинозависимой глюкозы клеткойподжелудочной железы путем снижения экспрессии Ucp2 и повышает чувствительность к периферическому инсулину (Sun Y. et al., 2006, Cell. Metabolism, 3:379-386). Таким образом, антагонисты рецептора грелина могут регулировать голод, прием пищи и их часто-1 019486 ту, а также в долгосрочном периоде массу тела, в частности увеличение массы тела в результате диетических или лечебных диет. К тому же в рамках противодиабетического лечения антагонисты грелина могут быть пригодны для поддержания равновесия между инсулином и глюкозой и для контроля диабетической гиперальгезии. Антагонисты грелина могут таким образом использоваться в качестве агентов анорексических и/или против ожирения или же в лечении диабета и его последствий. В заявке на патент WO 95/18105 описаны соединения 5-хлор-3-(2-хлорфенил)-1,3-дигидро-3-[2-(4 метилпиперазин-1-ил)ацетамидо]индол-2-он и 5-хлор-3-(2-хлорацетамидо)-3-(2-хлорфенил)-1,3-дигидроиндол-2-он в качестве промежуточных продуктов синтеза производных 1,3-дигидроиндол-2-она, замещенных в положении 3 азотной группой и обладающих сродством с вазопрессином и/или оцитоцином. Объектом настоящего изобретения являются соединения формулы (I) в которой обозначает простую или двойную связь,X обозначает -N, -CH илиY обозначает N- или СН- при условии, что по меньшей мере один из X, Y обозначает N;Ar обозначает арильную или гетероарильную группу, возможно замещенную несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С 1-6)алкила, (С 1-6)галогеналкила,пергалогено(С 1-3)алкила, (С 1-6)алкокси, пергалогено(С 1-3)алкокси, арила;R1 обозначает атом водорода или (С 1-6)алкил, -С(=O)(С 1-6)алкил, -С(=O)арил;R2, R3, R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, CN, ОН, (С 1-6)алкил, возможно замещенный атомом галогена или ОН; пергалогено(С 1-3)алкил, (С 1-6)алкокси, пергалогено(С 1-3)алкокси, аминокарбонил, (С 1-6)алкиламинокарбонил, ди(С 1-6)алкиламинокарбонил, арил, арилокси; гетероарил; группу арильную, арилокси или гетероарильную, возможно замещенную атомом галогена, CN, ОН или (С 1-6) алкил, пергалогено(С 1-3)алкил или (С 1-6)алкокси, при условии, что по меньшей мере один из R2, R3, R4 не является Н и что группа арильная, арилокси или гетероарильная возможно замещена атомом галогена,CN, ОН или (С 1-6)алкилом, пергалогено(С 1-3)алкилом, (С 1-6)алкокси;n обозначает 1 или 2; за исключением 5-хлор-3-(2-хлорфенил)-1,3-дигидро-3-[2-(4-метилпиперазин 1-ил)ацетамидо]индол-2-она. Соединения формулы (I) содержат один или несколько асимметрических атомов углерода. Они, таким образом, могут быть в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, относятся к изобретению. Соединения формулы (I) могут быть в виде оснований или солей присоединения с кислотами. Такие соли присоединения относятся к изобретению. Эти соли можно получать при помощи фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или выделения соединений формулы (I), также относятся к изобретению. В рамках настоящего изобретения понимают под атомом галогена - фтор, хлор, бром или йод; алкилом - линейную или разветвленную насыщенную алифатическую группу. В качестве примеров можно назвать (С 1-6)алкил, содержащий от 1 до 6 атомов углерода, более конкретно (С 1-4)алкил, который может обозначать метил, этил, пропил, изопропил, бутил, изобутил, третбутил; алкенилом - моно- или полиненасыщенную линейную или разветвленную алифатическую группу,содержащую, например, одну или две ненасыщенные связи и содержащую от 2 до 6 атомов углерода; галогеноалкилом - алкильную группу, один или несколько атомов водорода которой замещены атомом галогена; например фторалкил; алкильную группу, один или несколько атомов водорода которой замещены атомом фтора; пергалогеноалкилом - алкильную группу, все атомы водорода которой замещены атомом галогена,например перфторалкил; алкильную группу, все атомы водорода которой замещены атомом фтора; алкоксигруппой - -О-алкил, в котором алкильная группа такая, как определено выше; пергалогеноалкоксигруппой - -О-пергалогеноалкил, где пергалогеноалкильная группа такая, как определено выше; в качестве примера можно привести триформетокси; арилом - ароматическую циклическую группу, содержащую от 6 до 10 атомов углерода; в качестве примеров арилов можно назвать фенил или нафтил; гетероарилом - ароматическую циклическую группу, содержащую от 2 до 10 атомов углерода и содержащую от 1 до 3 гетероатомов, таких как азот, кислород или сера; в качестве примеров гетероарильных групп можно назвать фуранил, пирролил, имидазолил, пиразолил, тиенил, оксадиазолил, оксазолил,изоксазолил, фуразанил, тиадиазолил, тиазолил, изотиазолил, пиридил, пиразинил, пиримидинил, пиридазинил, а также соответствующие группы, образующиеся в результате слияния с фенильной группой,такой, например, как бензотиофен, бензофуран, бензотиазол. Из соединений формулы (I), являющихся объектом изобретения, группа соединений состоит из соединений, в которыхAr обозначает арил или гетероарил, возможно замещенный одним или несколькими заместителями,одинаковыми или разными, выбираемыми из атомов галогена, (С 1-6)алкила, пергалогено(C1-3)алкила, (С 1-6) алкокси, арила;R1 обозначает атом водорода или (С 1-6)алкил, -С(=O)(С 1-6)алкил, -С(=O)арил;R2, R3, R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, CN, ОН, (С 1-6)алкил, пергалогено(С 1-3)алкил, (С 1-6)алкокси, пергалогено(С 1-3)алкокси, аминокарбонил, (C1-6)алкиламинокарбонил, ди(С 1-6)алкиламинокарбонил, арил, арилокси; гетероарил, при условии, что по меньшей мере один из R2, R3, R4 не является Н;R5 обозначает (С 1-6)алкил. Из соединений формулы (I), объектов изобретения, группа соединений состоит из соединений, в которых обозначает простую или двойную связь, и/илиY обозначает N- или СН-, и/или при условии, что по меньшей мере один из X, Y обозначает N; и/илиAr обозначает арил, возможно замещенный одним или несколькими заместителями, выбираемыми из атомов галогена, предпочтительно хлора или брома и (С 1-6)алкокси, (С 1-6)алкила, арила, трифторметила, тифторметокси; и/илиR1 обозначает атом водорода или -С(=O)(С 1-6)алкил, -С(=O)арил, (С 1-6)алкил; и/илиR2, R3, R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, предпочтительно хлор или бром, или (С 1-6) алкил или трифторметил, при условии, что по меньшей мере один из R2, R3, R4 не является Н; и/илиn обозначает 1 или 2; в виде основания или соли присоединения с кислотой. Из соединений формулы (I), объектов изобретения, другая группа соединений состоит из соединений, в которых обозначает простую или двойную связь, и/илиY обозначает N- или СН-, и/или при условии, что по меньшей мере один из X, Y обозначает N; и/илиAr обозначает фенил или нафтил, возможно замещенный одним или несколькими заместителями,выбираемыми из атомов галогена, предпочтительно хлора или брома, и метокси, метила, третбутила,фенила, трифторметила, трифторметокси; и/илиR1 обозначает атом водорода или -С(=O)метил, -С(=O)фенил, метил; и/илиR2, R3, R4, одинаковые или разные, находящиеся в любом из свободных положений фенильного цикла, независимо обозначают атом водорода, атом галогена, предпочтительно хлор или бром, или метил или трифторметил, при условии, что по меньшей мере один из R2, R3, R4 не является Н; и/илиn обозначает 1 или 2; в виде основания или соли присоединения с кислотой. Из соединений формулы (I), объектов изобретения, другая группа соединений состоит из соединений, в которыхAr обозначает гетероарил, возможно замещенный одним или несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С 1-6)алкила, пергалогено(С 1-3)алкила, (С 1-6)алкокси, арила. Из соединений формулы (I), объектов изобретения, можно, в частности, назвать следующие соединения:N-[4,6-дихлор-3-(4-трифторметоксифенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(4-этилпиперазин 1-ил)ацетамид; в виде основания или соли присоединения с кислотой. Далее в тексте под защитной группой Pg понимают группу, которая позволяет, с одной стороны,защищать реактивную функциональную группу, такую как гидрокси или амин во время синтеза, а с другой стороны, регенерировать интактную функциональную группу в конце синтеза. Примеры защитных групп, а также способы защиты и снятия защиты приведены в Protective Groups in Orgnic Synthesis, Greenet al., 2nd Edition (John WileySons, Inc., New York). Под отделяемой группой далее в тексте понимают группу, которую можно легко отщипывать от молекулы путем разрыва гетеролитической связи с отделением электронной пары. Эту группу можно,таким образом, легко заменять другой группой в процессе реакции замещения, например. Такими отделяемыми группами являются, например, галогены или активированная гидроксигруппа, такая как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры отделяемых групп, а также информация об их получении приведены в Advances in Organic Chemistry, J. March, 3rd Edition,Wiley Interscience, p. 310-316. Согласно изобретению соединения общей формулы (I) можно получать следующим способом.R2, R3, R4, R5, Ar, X, Y и n такие, как определено в отношении общей формулы (I), можно получать путем взаимодействия соединения формулы (I), в которой R1=H, с соединением формулы (II)R1-Hal (II) в которой R1, не являющийся Н, имеет то же определение, что и по формуле (I), и Hal обозначает атом галогена, например хлор, способами, известными специалисту, например в присутствии основания, такого как K2CO3, NaH, t-BuO-K+, в растворителе, таком как диметилформамид (DMF), тетрагидрофуран(THF), диметоксиэтан, диметилсульфоксид (DMSO). Соединение общей формулы (I), в которой R1=H, можно получать по одному или другому из следующих вариантов. Если X = -N, соединение общей формулы (I), в которой R1=H, т.е. соединение общей формулы(II), можно получать путем взаимодействия соединения общей формулы (III) с соединением общей формулы (IV) в которых Y, R2, R3, R4, R5, Ar, n такие, как определено в отношении общей формулы (I). Это взаимодействие, главным образом, проводят при помощи основания, органического или неорганического, такого как K2CO3, Na2CO3, пиридин или 4-диметиламинопиридин, в присутствии Nal или Kl в инертном растворителе, таком как DMF, дихлорметан, THF, диметоксиэтан или толуол. Соединение общей формулы (III) можно получить из соединения общей формулы (V) и соединения общей формулы (VI) в которых R2, R3, R4, R5, Ar, такие, как определено в отношении общей формулы (I), и Hal' и Hal, одинаковые или разные, независимо обозначают атом галогена, предпочтительно хлор. Это взаимодействие обычно проводят при помощи пиридина или 4-диметиламинопиридина в растворителе, таком как толуол, бензол или дихлорметан, предпочтительно при температуре от комнатной температуры до температуры кипения с обратным холодильником растворителя. Если Х = -СН, -N или соединение общей формулы (I), в которой R1=H, можно также получить из соединения общей формулы (V) и соединения общей формулы (VII)R2, R3, R4, R5, Ar, X, Y и n такие, как определено в отношении общей формулы (I). Это взаимодействие, главным образом, проводят при помощи агента галогенирования, такого как хлорирующий агент, например хлориды фосфора, в частности PCl5 или PCl3 или POCl3. Взаимодействие, главным образом, проводят в присутствии пиридина или 4-диметиламинопиридина в растворителе, таком как дихлорметан или DMF. Промежуточные соединения общей формулы (V) известны и могут быть получены способами, которые иллюстрирует нижеследующая схема. Схема 2 на которой R2, R3, R4 и Ar, такие, как определено в отношении общей формулы (I), и Hal обозначает атом галогена, например хлор. На стадии с схемы 2 получают соединение формулы (V) из соединения формулы (VIII) барботированием газообразного аммиака способом, описанным в заявке FR 2714378. Можно также получить то же соединение восстановлением соединения формулы (X) способами,известными специалисту, например при помощи цинка в растворителе, таком как метанол. Получение соединения формулы (X) на этой стадии описано в заявке FR 2714378. Оптически чистое соединение формулы (V) можно синтезировать в соответствии со стадиями d и е схемы 3, такими как описаны в заявке WO 03/008407. Промежуточные соединения общей формулы (VIII) можно получить способами, описанными в заявке WO 03/008407 и изображенными на схеме 3. Схема 3 на которой R2, R3, R4 и Ar, такие, как определено в отношении общей формулы (I), и Hal обозначает атом галогена, например хлор. Соединения общей формулы (XIV) можно также получить путем применения или адаптации процедур, описанных в Journal of Heterocyclic Chemistry, 43(4), 1031-1035; 2006. Так соединения общей формулы (XIV) можно также получить восстановлением соединения формулы (XV) в которой R2, R3, R4 и Ar, такие, как определено в отношении общей формулы (I), и Alk обозначает алкил, например метил, этил или бутил. Главным образом, это взаимодействие осуществляют при помощи железа в кислой среде, например при помощи уксусной кислоты. Соединение общей формулы (XV) можно получить путем взаимодействия соединения формулы в которой R2, R3 и R4, такие, как определено в отношении общей формулы (I), и соединения формулы в которой Ar, такое, как определено в отношении общей формулы (I), и Alk обозначает алкил, например метил, этил или бутил, способами, известными специалисту и описанными в Journal of HeterocyclicChemistry, 43(4), 1031-1035; 2006, например в присутствии основания, такого как t-BuOK или NaH. Соединение общей формулы (VII) можно получить одним из следующих способов, иллюстрируемых схемой 4. Схема 4 В соответствии с первым вариантом осуществления, если Х = -СН, соединение формулы (VII) можно получить гидролизом соединения формулы (XX) в которой R5 и Y такие, как определено в отношении общей формулы (I), в кислой среде, например при помощи концентрированной соляной кислоты. Соединение общей формулы (XX) можно получить восстановлением соединения формулы (XIX) в которой R5 и Y такие, как определено в отношении общей формулы (I), например при помощи магния. Это взаимодействие, главным образом, осуществляют в растворителе, таком как метанол или этанол. Соединение общей формулы (XIX) можно получить реакцией Виттига-Хернера из соединения общей формулы (XVIII) в которой R5 и Y такие, как определено в отношении общей формулы (I). Главным образом, это взаимодействие осуществляют при помощи соответствующего производного фосфоната, такого как диэтил(цианометил)фосфонат. Преимущественно реакцию проводят в присутствии основания, такого какK2CO3, в растворителе, таком как THF или диметоксиэтан. В соответствии со вторым вариантом осуществления, если Х = -N, соединение формулы (VII) можно получить из соединения формулы (XXII) в которой R5 и Y такие, как определено в отношении общей формулы (I), и обозначает алкил, например метил, этил или бутил. Это взаимодействие обычно проводят в кислой среде, например при помощи концентрированной соляной кислоты. Соединение общей формулы (XXII) можно получить путем конденсации соединения общей формулы (XXI) в которой R5 и Y такие, как определено в отношении общей формулы (I), и соответствующего галогенированного соединения, такого как HalCH2COOAlk, в котором Hal обозначает атом галогена, такой как хлор, и Alk обозначает алкил, такой как этил. Это взаимодействие преимущественно проводят в растворителе, таком как толуол, или бензол, или диоксан. В соответствии с третьим вариантом осуществления, если Х = можно получить гидролизом соединения формулы (XXIV) в которой R5 и Y такие, как определено в отношении общей формулы (I), в кислой среде, например при помощи концентрированной соляной кислоты. Соединение общей формулы (XXIV) можно получить взаимодействием соединения общей формулы (XVIII) в которой R5 и Y такие, как определено в отношении общей формулы (I), при помощи соединения общей формулы (XXIII)NC-CH2COOH (XXIII) Главным образом, это взаимодействие проводят в растворителе, таком как THF. В соответствии с другим вариантом осуществления соединения общей формулы (I), в которой R1 обозначает алкил и R2, R3, R4, R5, Ar, X, Y и n такие, как определено в общей формуле (I), можно также получить по следующей схеме 5. Соединение общей формулы (XXV) можно получить взаимодействием соединения общей формулы(XIII) и соединения общей формулы (XIV)ALK-Hal (XIV) в которой ALK обозначает насыщенную алифатическую группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, и Hal обозначает атом галогена, например хлор, способами, известными специалисту, например в присутствии основания, такого как K2CO3, NaH, t-BuO-K+, в растворителе,таком как DMF, THF, диметоксиэтан, DMSO. Соединения общей формулы (XXVIII) можно получить способами, аналогичными описанным выше. Соединения общей формулы (XXVIII) можно также получить по следующей схеме 6. Схема 6 В соответствии с этой схемой вводят во взаимодействие соединение формулы (V) с защитной группой PG до получения соединения формулы (XXX). В качестве защитной группы PG амина можно использовать, например, бензимин или третбутилкарбамат. Эти последние соединения вводят способами,известными специалисту, например в присутствии основания, такого как K2CO3, NaOH, триэтиламин, в растворителе, таком как диоксан, THF или DMSO. Соединения общей формулы (XXXI) можно получить взаимодействием соединения формулыALK-Hal (XIV) в которой ALK обозначает насыщенную алифатическую группу, линейную или разветвленную, содержащую от 1 до 6 атомов углерода, и Hal обозначает атом галогена, например хлор. Соединение общей формулы (XXVIII) получают из соединения формулы (XXXI) путем удаления защитной группы, хорошо известными способами, например в кислой среде HCl или трифторуксусной кислоте. Применяя далее способы, описанные выше в отношении соединений общей формулы (XIII), (XIV),(X), (V), (III) и (I) по схемам 1, 2 и 3, получают соединения общей формулы (XXV), (XXVI), (XXVII),(XXVIII), (XXIX) и (I). Возможно соединение формулы (I) превращают в одну из его солей присоединения с кислотой. Способ по изобретению может содержать стадию, заключающуюся в выделении целевого продукта общей формулы (I). На схемах 1, 2, 3, 4, 5 и 6 исходные соединения и реагенты, если способ их получения не описан,являются коммерческими или описаны в литературе или могут быть получены способами, которые там описаны или известны специалисту. В соответствии с другим аспектом изобретения оно также относится к соединениям формулы (III),за исключением 5-хлор-3-(2-хлорацетамид)-3-(2-хлорфенил)-1,3-дигидроиндол-2-она. Эти соединения пригодны в качестве промежуточных продуктов при синтезе соединений формулы (I). Из соединений формулы (III), являющихся объектами изобретения, группа соединений состоит из соединений, в которыхAr обозначает гетероарил, возможно замещенный одним или несколькими заместителями, одинаковыми или разными, выбираемыми из атомов галогена, (С 1-6)алкила, пергалоген(С 1-3)алкила, (С 1-6)алкокси,арила. В соответствии с другим аспектом изобретение также относится к соединениям формулы (XXVIII) и (XXIX). Эти соединения пригодны в качестве промежуточных продуктов при синтезе соединений формулы (I). Нижеследующие примеры описывают получение некоторых соединений по изобретению. Эти примеры не ограничивают, а только иллюстрируют настоящее изобретение. Номера соединений в примерах соответствуют номерам, приведенным в нижеследующей таблице, которая иллюстрирует химические структуры и физические свойства нескольких соединений по изобретению. Физико-химические измерения проводили следующим образом: точки плавления измеряли при помощи аппарата BUCHI В-540. Спектры ядерного магнитного резонанса протона (1 Н ЯМР) регистрировали при 500 МГц аппаратом Bruker, снабженным консолью Avance III. Химические сдвиги выражены в м.д. по отношению к частоте TMS. Все спектры регистрировали при температуре 40 С. Для характеристики сигналов использовали следующие аббревиатуры: s = синглет, sb = уширенный синглет, m = мультиплет, d = дуплет, t = триплет, q = квадруплет;= не подлежит интегрированию в связи с интерференцией с широким пиком, связанным с водой;= не подлежит интегрированию в связи с интерференцией с пиком, связанным с растворителем ЯМР. ВЭЖХ проводили при помощи системы ThermoElectron Surveyor, снабженной детектором массспектрометрии с ионной ловушкой, а также детектором с диодной полосой. Условия проведения анализа путем жидкостной хроматографии в сочетании с масс-спектрометрией(ЖХ/УФ/МС) следующие. В части проведения жидкостной хроматографии использовали три хроматографические системы: хроматографическая система А элюент А=Н 2 О+0,005% TFA,элюент B=CH3CN,градиент от 95% А до 90% В в течение 17 мин, затем элюирование при помощи 90% В в течение 5 мин,расход 0,3 мл/мин,впрыскивание 2 мкл раствора с концентрацией 0,1 мг/мл в смесь CH3CN:H2O=9:1; хроматографическая система В элюент А=Н 2 О+0,01% TFA,элюент B=CH3CN,градиент от 98% А до 95% В в течение 10 мин, затем элюирование при помощи 95% В в течение 5 мин,расход 0,5 мл/мин, температура 40 С,впрыскивание 2 мкл раствора 0,1 мг/мл в смесь CH3CN: Н 2 О=9:1; хроматографическая система С элюент А=Н 2 О+0,005 М аммония ацетата рН 6,5,элюент B=CH3CN,градиент от 95% А до 90% В в течение 17 мин, затем элюирование при помощи 90% В в течение 5 мин,расход 0,3 мл/мин,впрыскивание 2 мкл раствора 0,1 мг/мл в смесь CH3CN:Н 2 О=9:1. Использовали следующие колонки: колонка Waters XTerra MS C18 2,150 мм 3,5 мкм n186000400,колонка Waters XBridge C18 2,150 мм 2,5 мкм n186003085,колонка Phenomenex Gemini C18 2,1100 мм 5,0 мкм n00D-4435-ВО,колонка Waters Sunfire C18 2,1100 мм 3,5 мкм n186002534. Детекцию продуктов проводили в УФ при 220 нм. В части масс-спектрометрии: режим ионизации: положительный электроспрей (API-ES полярность +),сканирование от 100 до 1200 аем. Хроматографию в тонком слое проводили на пластинках ХТС, покрытых силикагелем Merck. Силикагель для хроматографии на флэш-колонке выпускает фирма Biotage. Все используемые растворители обладают чистотой "reagent grade" или "HPLC grade". Измерения D проводили на поляриметре Perkin Elmer, модель РЕ 341, с использованием кюветы с траекторией светового луча 1 дм. В примерах и примерах получения АсОН и AcOEt обозначают уксусную кислоту и этилацетат соответственно,МеОН, EtOH, tBuOH обозначают метанол, этанол и третбутанол соответственно,Pf обозначает точку плавления. Получение 1. (1-Метилпиперидин-4-ил)уксусная кислота.(i) (1-Метилпиперидин-4-илиден)ацетонитрил. В колбу, снабженную магнитной мешалкой, в потоке азота вводят 9,36 г K2CO3, 8,89 мл диэтил(цианометил)фосфоната в 12 мл THF и оставляют для взаимодействия на 15 мин при комнатной температуре, затем нагревают с обратным холодильником в течение 20 мин. Охлаждают и вводят по каплям 6,5 мл 1-метил-4-пиперидона. Нагревают с обратным холодильником в течение 16 ч. Затем опрокидывают реакционную смесь в воду и экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4,фильтруют и выпаривают в вакууме. Получают 6,8 г масла.(ii) (1-Метилпиперидин-4-ил)ацетонитрил. В колбу, снабженную магнитной мешалкой, вводят 1 г продукта, полученного на предыдущей стадии, в 70 мл метанола. При 0 С небольшими порциями вводят 7,2 г магния. Продолжают перемешивать в течение 4 ч. Фильтруют для удаления твердых частиц магния и выпаривают фильтрационные воды. Остаток обрабатывают насыщенным раствором NaCl и экстрагируют дихлорметаном. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 450 мг масла.(iii) (1-Метилпиперидин-4-ил)уксусная кислота. В колбу, снабженную магнитной мешалкой, вводят 3,65 г продукта, полученного на стадии (ii), в 47 мл концентрированной соляной кислоты. Оставляют для нагревания с обратным холодильником в течение 20 ч. Разводят водой и экстрагируют досуха дихлорметаном для удаления примесей. рН водной фазы доводят до 5-6 и экстрагируют дихлорметаном. Выпаривают водную фазу в вакууме и выделяют белое твердое вещество. Обрабатывают этанолом для отделения солей. Выпаривают фильтрационные воды для получения 3,6 г твердого вещества бледно-желтого цвета. ССМ: MeOH 99/NH4OH 1, Rf=0,2. Получение 2. (1-Этилпиперидин-4-ил)уксусная кислота. Выполняя операции, описанные в получении 1, но с использованием 1-этил-4-пиперидона вместо 1 метил-4-пиперидона, получают соединение, указанное в заглавии. ССМ: 100% МеОН, Rf=0,15. Получение 3. (4-Этилпиперазин-1-ил)уксусная кислота.(i) (4-Этилпиперазин-1-ил)этилацетат. В колбу помещают 8,9 мл этилпиперазина в 91,5 мл толуола. Вводят по каплям раствор 4,1 мл этилбромацетата в 11,6 мл толуола. Оставляют для взаимодействия при 110 С в течение 1 ч, концентрируют до малого объема и оставляют в холодильнике на 3 ч. Образуется белый осадок, который фильтруют и промывают дихлорметаном. Выпаривают фильтрационные воды, получают 7 г целевого продукта.(ii) (4-Этилпиперазин-1-ил)уксусная кислота. Вводят 7 г продукта, полученного на предыдущей стадии, в 190 мл HCl 6N и оставляют для взаимо- 12019486 действия в течение 4 ч с обратным холодильником. Выпаривают досуха, промывают смесью AcOEt 1/EtOH 1 и сушат полученное твердое вещество белого цвета. Получают 7 г целевого продукта. ССМ: 100% МеОН, Rf=0,2. Получение 4. (4-Метилпиперазин-1-ил)уксусная кислота. Выполняя операции, описанные в получении 3, но с использованием 1-метилпиперазина вместо 1 этилпиперазина, получают соединение, указанное в заглавии. ССМ: 100% МеОН, Rf=0,25. Получение 5. (+)3-Амин-5,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он.(i) 5,6-Дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. А) Метил(4-хлорфенил)-(4,5-дихлор-2-нитрофенил)ацетат. В потоке азота вводят при -10 С в суспензию 2,85 г 60%-ного NaH в 45 мл DMF раствор 5 г 1,2 дихлор-4-фтор-5-нитробензола и 4,4 г метил-4-хлорфенилацетата в 70 мл DMF и поддерживают температуру -5 С. Оставляют для взаимодействия на 2 ч, при этом температура поднимается до комнатной температуры. Опрокидывают на лед, вводят по каплям 10%-ный водный раствор NH4Cl и экстрагируют этилацетатом. Органическую фазу сушат, фильтруют и концентрируют. Получают 30 г масла коричневого цвета, которое очищают в колонке при помощи Hex., затем смесью Hex./AcOEt 95/5 до получения 3,18 г масла. В) 5,6-Дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. В колбу, снабженную механической мешалкой, в потоке азота вводят 4,6 г продукта со стадии А в 60 мл метанола, 15 мл АсОН, 2,7 г железа и оставляют при нагревании с обратным холодильником в течение 1 ч 30 мин. Опрокидывают на лед и вводят 10%-ный раствор NaHCO3 до получения щелочного рН. Вводят этилацетат и фильтруют. Отделяют органическую фазу, которую сушат, фильтруют и концентрируют. Получают твердое вещество, которое обрабатывают простым изопропиловым эфиром и фильтруют. Получают 2,75 г твердого вещества белого цвета.(ii) 5,6-Дихлор-(1R)-2-гидрокси-1-фенилэтил]амин]-1,3-дигидро-3-(4-хлорфенил)индол-2-он, изомер А и изомер В. А) 3-Бром-5,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. В потоке азота растворяют 2,75 г продукта с предыдущей стадии В в 100 мл дихлорметана. Охлаждают на ледяной бане и вводят по каплям раствор 3,93 г PhMe3NBr3 в 100 мл дихлорметана. Оставляют для взаимодействия на 3 ч и постепенного поднятия температуры до комнатной температуры. Промывают соляной кислотой 1M и водой. Сушат, фильтруют и концентрируют. Получают 3,7 г масла. В) 5,6-Дихлор-(1R)-2-гидрокси-1-фенилэтил]амин]-1,3-дигидро-3-(4-хлорфенил)индол-2-он, изомер А и изомер В. В потоке азота смешивают 3,4 г соединения с предыдущей стадии в 50 мл хлороформа и 2,9 г Rфенилглицинола. Оставляют для взаимодействия на 2 ч при комнатной температуре, затем вводят 1,6 млDIPEA и оставляют для взаимодействия при комнатной температуре. Фильтруют образовавшееся твердое вещество, фильтрационные воды выпаривают досуха и очищают на колонке элюентом Hex./AcOEt 7:3]. Получают 1,8 г менее полярного продукта, изомер А (pf=79,8-80,5 С) и 2,2 г более полярного изомера В (pf=213,2C).(iii) (+)-3-Амин-5,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. Вводят во взаимодействие 1,8 г продукта, полученного на предыдущей стадии, со смесью 28 мл дихлорметана и 12 мл метанола. Водят 1,9 г Pb(OAc)4 и оставляют для взаимодействия при комнатной температуре на 3 ч. Выпаривают досуха и обрабатывают этилацетатом, затем промывают насыщенным водным раствором NaHCO3. Органическую фазу сушат, фильтруют и концентрируют. Обрабатывают смесью 36 мл соляной кислоты 3N и 3,7 мл метанола и перемешивают в течение одной ночи. Концентрируют и разбавляют смесью воды и дихлорметана. Органическую фазу промывают раствором соляной кислоты 1N. Водные фазы объединяют, доводят до щелочного рН при помощи водного раствора NH3 и экстрагируют дихлорметаном. Органическую фазу сушат, фильтруют и концентрируют для получения 540 мг твердого продукта белого цвета.Pf: 221C; D=+32,5, c=0,5 wt% MeOH. Получение 6. (-)-3-Амин-5,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. Осуществляя операции, описанные на предыдущей стадии 5(iii), но используя более полярный изомер В из получения 5(ii) вместо изомера А того же получения, получают соединение, указанное в заглавии. 88 мл дихлорметана, 4,2 мл ацетилхлорида. Оставляют для взаимодействия на 3 ч при 50 С. Затем вводят 7,8 мл тионилхлорида. Оставляют для взаимодействия на 2 ч с обратным холодильником. Выпаривают в вакууме и получают 13,7 г непрозрачной жидкости.b) 4-Хлор-N-3,5-фенилманделамид. В трехгорлую колбу, снабженную механической мешалкой, в потоке азота вводят 4,04 г 3,5 дихлоранилина, 50 мл толуола. Температуру доводят до 0 С. Потом добавляют 9,6 г карбоната калия. Медленно вводят 6,8 г продукта, полученного на предыдущей стадии, разведенного в 10 мл толуола. Оставляют для взаимодействия на 1 ч при комнатной температуре, затем вводят 4,15 мл метанола. Оставляют для взаимодействия на 2 ч при 80 С, затем вливают раствор соляной кислоты 1N и экстрагируют этилацетатом. Органическую фазу выпаривают в вакууме. Получают 5,7 г твердого вещества. с) 4,6-Дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. В колбу, снабженную магнитной мешалкой, вводят 22 мл 96%-ной серной кислоты и 5 мл дымящей серной кислоты. Охлаждают на ледяной бане и вводят небольшими порциями 5,7 г продукта, полученного на предыдущей стадии. Затем оставляют для взаимодействия при комнатной температуре на 4 ч. Реакционную среду выливают на ледяную баню и доводят до щелочного рН при помощи раствора NaHCO3,затем при помощи концентрированного раствора едкого натра. Экстрагируют дихлорметаном, отделяют органическую фазу, которую сушат над Na2SO4, фильтруют и выпаривают в вакууме до получения 7,5 г твердого вещества, которое обрабатывают простым этиловым эфиром. Фильтруют и получают 4,2 г порошка.(ii) 3-Азидо-4,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. А) 3-Бром-4,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. Этот продукт получают так же, как описано в п.(ii) получения 5, но с использованием соединения,полученного на предыдущей стадии.B) 3-Азидо-4,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. В трехгорлую колбу, снабженную механической мешалкой, в потоке азота вводят 550 мг соединения, полученного на предыдущей стадии, в 17 мл ацетонитрила и 270 мг NaN3. Нагревают с обратным холодильником в течение 2 ч и обрабатывают этилацетатом, промывают насыщенным раствором натрия хлорида. Отделяют органическую фазу, которую сушат над Na2SO4, фильтруют и выпаривают в вакууме до получения 320 мг смолы, которую очищают флэш-хроматографией при помощи элюента циклогексан/этилацетат 85/15. Выпаривают фазу, содержащую продукт, для получения 220 мг твердого вещества белого цвета.(iii) 3-Амино-4,6-дихлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. В двугорлую колбу, снабженную механической мешалкой, вводят 220 мг продукта, полученного на предыдущей стадии, в 5 мл THF, 10 мл метанола, 170 мг NH4Cl, 80 мг цинка. Оставляют для взаимодействия при комнатной температуре на 3 ч. Фильтруют, остаток выпаривают в вакууме. Обрабатывают этилацетатом и промывают насыщенным раствором натрия хлорида. Отделяют органическую фазу, которую сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 200 мг масла, которое очищают флэш-хроматографией при помощи элюента циклогексан/этилацетат 8/2. Получают 74 мг целевого продукта. ССМ: циклогексан 6/AcOEt 4, Rf=0,3. Получение 8.(i) 3-Гидрокси-4,6-дихлор-1,3-дигидро-3-(4-трифторметилфенил)индол-2-он. В колбу, снабженную механической мешалкой, в потоке азота вводят 1,8 г магния Grignard в 19 мл безводного простого этилового эфира. Затем вводят смесь 8,9 мл 4-бромтрифторметилбензола в 46 мл безводного простого этилового эфира. Перемешивают в течение 1 ч, затем вводят раствор 5,7 г 4,6 дихлор-1 Н-индол-2,3-диона в 100 мл безводного THF. Перемешивают в течение 4,5 ч при комнатной температуре. Добавляют воду и экстрагируют этилацетатом. Отделяют органическую фазу, которую сушат над Na2SO4, фильтруют и выпаривают в вакууме. Обрабатывают этилацетатом и промывают раствором едкого натра 1N. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Твердое вещество обрабатывают простым этиловым эфиром и фильтруют. Получают 4,7 г целевого продукта.(ii) 3,5,6-Трихлор-1,3-дигидро-3-(4-трифторметилфенил)индол-2-он. В колбу, снабженную магнитной мешалкой, и в потоке азота вводят 1,2 г продукта с предыдущей стадии в 8 мл дихлорметана. При 0 С вводят 0,47 мл пиридина и смесь 0,34 мл SOCl2 в 4 мл дихлорметана. Оставляют для взаимодействия при комнатной температуре, затем опрокидывают в насыщенный водный раствор NH4Cl. Отделяют органическую фазу, которую сушат над Na2SO4, фильтруют и выпаривают в вакууме.(iii) 4,6-Дихлор-(1S)-2-гидрокси-1-фенилэтил]амино]-1,3-дигидро-3-(4-трифторметилфенил)индол-2-он, изомер А и изомер В. Осуществляя операции, описанные на стадии (ii) А и В получения 5, но с использованием соединения с предыдущей стадии и (S)-фенилглицинол вместо (R)-фенилглицинола получают соединения, ука- 14019486(iv) (+)-3-Амино-5,6-дихлор-1,3-дигидро-3-(4-трифторметилфенил)индол-2-он. Это соединение получают, осуществляя операции, описанные на стадии (ii) B получения 5.(i) 6-Хлор-3-(4-хлорфенил)-3-гидрокси-1,5-диметил-1,3-дигидроиндол-2-он. Это соединение получают из 3-гидрокси-5-метил-6-хлор-1,3-дигидро-3-(4-хлорфенил)индол-2-она(соединение, полученное способом, описанным в п.(i) получения 8), 1,2 г этого соединения растворяют в 8 мл DMF. При 0 С в потоке азота вводят 167 мг 60%-ного NaH. Затем вводят 260 мкл CH3I и оставляют для взаимодействия на 30 мин. Выливают в воду и экстрагируют дихлорметаном. Органическую фазу сушат, фильтруют и концентрируют. Очищают на колонке при помощи элюента Hex./AcOEt 9/1. ССМ: AcOEt 1/Hex. 1, Rf=0,7.(ii) 6-Хлор-3-(4-хлорфенил)-1,5-диметил-1,3-дигидроиндол-2-он. Смешивают 1 г продукта, полученного на предыдущей стадии, в 4 мл TFA и 1,3 мл HSiEt3 и оставляют для взаимодействия на 1 ч при 80 С. Выливают в воду и доводят до щелочного рН при помощи водного раствора NH3. Экстрагируют этилацетатом. Органическую фазу сушат, фильтруют и концентрируют. Обрабатывают простым этиловым эфиром и фильтруют. Получают 688 мг твердого вещества белого цвета.(iii) 3-Амино-1,5-диметил-6-хлор-1,3-дигидро-3-(4-хлорфенил)индол-2-он. Соединение, указанное в заглавии, получают, осуществляя операции, описанные в пп.(ii) и (iii) получения 7, но с использованием продукта с предыдущей стадии вместо продукта, полученного на стадии(i) (1-Этил-1,2,3,6-тетрагидропирид-4-ил)ацетонитрил. В колбу, снабженную магнитной мешалкой, и в потоке азота вводят 2,9 г 1-этил-4-пиперидона, 3,3 г циануксусной кислоты и 36 мл толуола. Нагревают в течение 4 ч с обратным холодильником, удаляя воду при помощи аппарата Markusson. Выпаривают досуха. Получают 4,2 г масла.(ii) (1-Этил-1,2,3,6-тетрагидропирид-4-ил)уксусная кислота. Осуществляя операции, описанные в получении 1(iii), но используя продукт с предыдущей стадии вместо продукта из получения 1(ii), получают соединение, указанное в заглавии.(i) (+)-3-Амино-4,6-дихлор-1,3-дигидро-3-(3,4-дихлорфенил)индол-2-он. Это соединение получают, осуществляя операции, описанные в получении 5, но используя на стадии (i) 3,4-дихлорбромбензол вместо 4-бромтрифторметилбензола.(ii) (+)-3-Бензимино-4,6-дихлор-1,3-дигидро-3-(3,4-дихлофенил)индол-2-он. В колбу помещают 125 мг продукта, полученного на предыдущей стадии, а также 120 мкл бензальдегида. Нагревают до 100 С в течение 5 мин в микроволновом реакторе. Получают твердое вещество,которое сушат в вакууме для удаления бензальдегида.(iii) (+)-3-Бензимино-1-изопропил-4,6-дихлор-1,3-дигидро-3-(3,4-дихлорфенил)индол-2-он. В колбу помещают 144 мг продукта, полученного на предыдущей стадии в DMF (800 мкл), в присутствии K2CO3 (49 мг) и изопропилбромида (30 мкл). Нагревают до 140 С в течение 5 мин в микроволновом реакторе. Фильтруют и используют сырой продукт на следующей стадии.(iv) (+)-3-Амино-1-изопропил-4,6-дихлор-1,3-дигидро-3-(3,4-дихлорфенил)индол-2-он. Полученный на предыдущей стадии продукт (157 мг) растворяют в метаноле (550 мкл) и вводят 2,7 мл раствора 3N кислоты HCl. Через 5 ч при комнатной температуре нейтрализуют аммиаком и экстрагируют этилацетатом. Сушат и выпаривают. Получают полутвердый продукт (112 мг). Следующие промежуточные продукты общей формулы (V), в которой R1, R2, R3, R4 и Ar такие, как определено в табл. 1, были также получены способами, использованными для получений 5, 6, 7, 8 и 9. Нижеследующая табл. 1 иллюстрирует химические структуры и физические свойства нескольких полученных соединений по изобретению. В таблице в колонке "изомер", "рац" представлена рацемическая смесь и (+) или (-) обозначает один или другой из стереоизомеров.(i) 2-Хлор-N-[5,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]ацетамид. В колбу, снабженную магнитной мешалкой, и в потоке азота вводят 1,3 г продукта, полученного в получении 5, 47 мл толуола, 0,32 мл пиридина и 0,31 мл хлорацетилхлорида. Оставляют для взаимодействия при 110 С на 4 ч, затем выливают реакционную смесь в воду и экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 900 мг твердого вещества бежевого цвета, очищают на колонке флэш-хроматографией при помощи смеси циклогексан 8/этилацетат 2 для получения 400 мг целевого продукта.(ii) (+)N-[5,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(4-метилпиперазин-1 ил)ацетамид. В колбу, снабженную магнитной мешалкой, вводят 0,4 г продукта с предыдущей стадии, 0,11 мл Nметилпиперазина (d 0,903), 0,14 г карбоната калия, 0,07 г йодида натрия в 8 мл DMF. Оставляют для взаимодействия на 4 ч при 60 С, затем выливают реакционную смесь в воду и экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 240 мг масла, которое обрабатывают простым этиловым эфиром для получения 140 мг твердого вещества белого цвета. Фильтрационные воды очищают флэш-хроматографией при помощи элюента этилацетат 9/метанол 1,затем этилацетат 7/метанол 3 до получения 40 мг твердого вещества белого цвета.(м, 2 Н), 7,48 (м, 2 Н), 7,52 (с, 1 Н), 8,71 (с, 1 Н), 10,70 (с, 1 Н). LCMS: (M+H)+=m/z 467. Пример 2. (+)N-[4,6-дихлор-3-(4-трифторметилфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(1 этилпиперидин-4-ил)ацетамид. 1) В потоке азота вводят в 4,4 мл охлажденного на ледяной бане безводного дихлорметана, 172,84 мг PCl5, затем медленно вводят 142,13 мг кислоты из получения 2. Перемешивают реакционную смесь при 0 С в течение 10 мин, затем при комнатной температуре в течение 3 ч. 2) С другой стороны, суспендируют в потоке азота 100 мг продукта из получения 8 в 4,4 мл дихлорметана, затем вводят 0,1 мл пиридина. Охлаждают на ледяной бане. Вводят по каплям раствор, полученный в 1), и перемешивают при комнатной температуре в течение 1 ч. Выливают реакционную смесь в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором NaHCO3, сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 145 мг твердого вещества оранжевого цвета, очищают на колонке флэш-хроматографией при помощи элюента этилацетат 1/метанол 1 для получения 85 мг продукта, обрабатываемого простым изопропиловым эфиром, так, чтобы получить 75 мг твердого вещества бело-розового цвета.Pf=158-162C; [D]=+194, c=0,125 вес.% МеОН; 1 Н-ЯМР:(ppm, DMSO-d6): 0,97 (т, J=7,1 Гц, 3 Н), 1,07-1,23 (м, 2 Н), 1,47-1,67 (м, 3 Н), 1,71-1,85 (м,2 Н), 2,07-2,22 (м, 2 Н), 2,27 (кв, J=7,1 Гц, 2 Н), 2,78 (м, 2 Н), 6,90 (ушир с, 1 Н), 7,18 (ушир с, 1 Н), 7,47 (м,2 Н), 7,78 (м, 2 Н), 9,15 (с, 1 Н), 10,74 (ушир с, 1H); LCMS: (M+Н)+=m/z 514. Пример 3. N-[4,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(4-метилпиперазин-1-ил)ацетамид. Осуществляя те же операции, что и в примере 2, но с использованием соединения из получения 4 вместо соединения из получения 2 и соединения из получения 7 вместо соединения из получения 5, получают соединение, указанное в заглавии.(д, J=1,8 Гц, 1 Н), 7,18 (д, J=1,8 Гц, 1 Н), 7,26 (м, 2 Н), 7,50 (м, 2 Н), 8,70 (с, 1 Н), 10,78 (с, 1 Н). Пример 4. N-[4-трифторметил-6-циано-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(4 этилпиперазин-1-ил)ацетамид. Осуществляя операции, описанные в примере 1, но с использованием соединения из получения 28 вместо продукта из получения 5 и N-этилпиперазин вместо N-метилпиперазина, получают соединение,указанное в заглавии.H-ЯМР:(ppm, DMSO-d6): 0,98 (т, J=7,3 Гц, 3 Н), 2,23-2,42 (м, 6H), 2,42-2,61 (м, ), 2,87-3,17 (м,2 Н), 7,14 (м, 2H), 7,47 (м, 2 Н), 7,59 (ушир с, 1 Н), 7,91 (ушир с, 1 Н), 8,91 (с, 1 Н), 11,12 (ушир с, 1 Н). Пример 5. (+)N-[1-бензоил-5,6-дихлор-3-(4-хлорфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(4 метилпиперазин-1-ил)ацетамид. В колбу, снабженную магнитной мешалкой, и в потоке азота вводят 0,14 г соединения из примера 1 в 9 мл DMF. При 0 С вводят 0,01 г 60%-ного NaH. Затем вливают по каплям PhCOCl и перемешивают при комнатной температуре в течение 2 ч. Выливают реакционную смесь в воду и экстрагируют этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 120 мг масла, которое очищают на колонке флэш-хроматографией при помощи элюента этилацетат 95/метанол 5 для получения 20 мг твердого вещества белого цвета.LCMS: (М+H)+=m/z 571. Пример 6. 3-(4-Хлорфенил)-3-[2-(4-этилпиперазин-1-ил)ацетиламино]-2-оксо-4-трифторметил-2,3 дигидро-1 Н-индол-6-карбоксамид. В колбу, снабженную магнитной мешалкой, вводят 0,16 г продукта, полученного в примере 4, 0,47 г карбоната калия и 7 мл tBu-OH. Оставляют для взаимодействия при 50 С в течение 5 ч. Фильтруют через целит, промывают при помощи THF. Выпаривают в вакууме фильтрат, который обрабатывают этилацетатом и промывают водой. Органическую фазу сушат над Na2SO4, фильтруют и выпаривают в вакууме. Получают 100 мг масла, которое очищают флэш-хроматографией при помощи элюента этилацетат 8/метанол 2. Получают 10 мг твердого вещества белого цвета. 1 Осуществляя операции, описанные в примере 1, но с использованием продукта из получения 9 вместо продукта из получения 5, получают соединение, указанное в заглавии.LCMS: (M+H)+=m/z 461. Пример 8. (+)N-[4,6-дихлор-3-(4-трифторметилфенил)-2-оксо-2,3-дигидро-1 Н-индол-3-ил]-2-(1 этил-1,2,3,6-тетрагидропирид-4-ил)ацетамид. Осуществляя операции, описанные в примере 2, но с использованием продукта из получения 10 вместо продукта из получения 2, получают соединение, указанное в заглавии.(с, 1 Н). Табл. 2, которая следует ниже, иллюстрирует химические структуры и физические свойства нескольких примеров соединений по изобретению. На этой таблице в колонке "стереоизомер", "рац" обозначает рацемическую смесь и (+) или (-) обозначает один или другой из стереоизомеров, в колонке"соль" "-" обозначает соединение в виде свободного основания, тогда как "HCl" обозначает соединение в виде хлоргидрата, и отношение в скобках является отношением (кислота:основание), Me, Et, n-Pr, i-Pr, nBu и i-Bu обозначают соответственно метил, этил, н-пропил, изопропил, н-бутил и изобутил и Ph и Bn обозначают соответственно фенил и бензил. Таблица 2(уш.с, 1 Н); 7,29 (уш.с, 1 Н); 7,57 (уш.с, 1 Н); 7,83 (д, J=9 Гц; 1 Н); 9,13 (уш.с, 1 Н). Соединения по изобретению являлись объектом исследований in vivo. Испытания in vivo. Самцов крыс Crl CD BR (Charles River Italie) весом 150-175 г поместили в камеру при контролируемых температуре (221 С), влажности (5510%) с двенадцатичасовым циклом свет-темнота по меньшей мере на 7 дней перед использованием. Пища и вода предоставлялись ad libitum. Питание прекратили за 18 ч до умерщвления животных. Животных умерщвляли путем сворачивания головы, желудок удаляли хирургически, открывали вдоль самого малого изгиба и помещали в раствор Krebs (состав (мМ): NaCl 118,4; KCl 4,7; CaCl2 2,5, NaH2PO4 3,7; MgSO4 1,2; NaHCO3 25; глюкоза 5,6). Содержание и умерщвление животных осуществлялось в соответствии с международным этическим кодексом Sanofi-Aventis и международными принципами содержания и обращения с лабораторными животными (Е.Е.C. Directive 86/609, DJL358, 1, 12 декабря 1987). Полоски примерно 1 см (шириной 5 мм) дна желудка разрезали вдоль по продольной оси и суспендировали в 20 мл ванне, заполненной раствором Krebs при 37 С и газированной газообразной смесью 95% О 2-5% СО 2. В состоянии покоя полоски удерживали при помощи 1 груза весом 1 г и после промывания холином (предшественник ацетилхолина) 10 мкМ и 10 мкМ индометацина (ингибитора простагландин синтетазы) вводили в среду для уменьшения спонтанных фазовых сокращений (Depoortere et al., Eur. J. Pharmacol. 515, 1-3, 160-168, 2003; Dass et al., Neurosciences 120, 443453, 2003). Изотонические сокращения вызывали путем стимуляции электрическим полем. Два электрода в виде платиновой проволоки помещали на поверхности и на дне ванны с органом и стимуляцию электрическим полем осуществляли при помощи стимулятора Power Lab (AD Instruments Pty Ltd. Castle Hill,Australie), соединенного с многоканальным импульсным двигателем (Ugo Basile, Varese, Italie) (Fukuda etal., Scand. J. Gastroenterol. 12, 1209-1214, 2004). Для получения максимальных сокращений применяли сверхмаксимальную стимуляцию (20 Гц, ширина пульсации 2 мс; 5 В; trains de los каждые 2 мин, 150 мА). Затем электрический ток уменьшали для получения субмаксимальной стимуляции (50%-ное уменьшение максимального сократительного ответа). Сокращения регистрировали на компьютере при помощи системы регистрации и анализа данных (Power Lab., Chart 5), соединенной с изотоническими трансдукторами (Ugo Basile, Varese, Italie) через предусилители (Octal Bridge Amp). После стабилизации кумулятивные кривые концентрация-ответ грелина (0,1 нМ-1 мкМ) были построены с инкубацией или без инкубации (контактное время: 30 нм) молекул антагонистов. Стимуляция сверхмаксимальным электрическим полем использовалась для каждой полоски в качестве контрольной (100%) для классифицирования ответов тестируемого вещества. Концентрацию агониста, дающую 50% максимальный эффект(ЕС 50), вычисляли с использованием логистической модели с четырьмя параметрами по Ratkovsky иReedy (Biometrics, 42, 575-582, 1986), с корректировкой при помощи нелинейной регрессии с использованием алгоритма Levenberg-Marquard в программе Everstat. Значения рКВ антагонистов вычисляли по равенству Cheng-Prusoff (Kenakin et al., Competitive Antagonism, Pharmacologic Analysis of Drug-ReceptorInteraction, 3e edition, 331-373, Philadelphie, New York; Raven; Lippincott 1997). Соединения формулы (I) обладают активностью антагониста рецептора грелина с CI50, которые изменяются от 10-6 до 10-11 M. Например, соединения n 1 и 2 показали, что CI50 соответственно 510-8 и 110-9 М. Таким образом, оказалось, что соединения по изобретению обладают активностью антагониста рецептора грелина. Соединения по изобретению можно таким образом использовать для получения лекарственных средств, в частности лекарственных средств, предназначенных для профилактики или лечения любой патологии, в которой участвует рецептор грелина. Таким образом, в соответствии с другим аспектом объектом изобретения являются лекарственные средства, которые содержат соединение формулы (I) или соль присоединения этого последнего с фармацевтически приемлемой кислотой. Таким образом, соединения по изобретению можно использовать для лечения или профилактики различных грелинзависимых заболеваний человека или животных. Так, соединения по изобретению можно использовать в качестве анорексических агентов для регуляции аппетита, приема пищи и частоты приема пищи, а также в качестве долгосрочной цели, массы тела, в частности увеличения массы тела вследствие диетических или лечебных диет. Соединения по изобретению, таким образом, особенно пригодны для предупреждения или лечения ожирения, нарушений аппетита, диабета, избытка массы тела и/или их последствий. В соответствии с другим аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по изобретению или фармацевтически приемлемую соль, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в зависимости от фармацевтической формы и требуемого способа введения из обычных эксципиентов, которые известны специалисту. В фармацевтических композициях по настоящему изобретению для перорального, сублингвального, подкожного, внутримышечного, внутривенного, топического, местного, через трахею, через нос, чрескожного или ректального введения активное вещество указанной выше формулы (I) или его соль можно вводить в виде стандартной лекарственной формы в смеси с традиционными фармацевтически приемлемыми эксципиентами животным и людям для профилактики или лечения указанных выше нарушений и заболеваний. Пригодные для введения стандартные лекарственные формы включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для сублингвального введения, введения через рот, через трехею,внутриглазного введения, введения через нос, путем ингаляции, формы для топического нанесения, чрескожного, подкожного введения, внутримышечного или внутривенного введения, формы для ректального введения и имплантаты. Для топического нанесения можно использовать соединения по изобретению в кремах, гелях, мазях или лосьонах. В качестве примера стандартная лекарственная форма соединения по изобретению в форме таблетки может содержать следующие компоненты: Соединение по изобретению - 50,0 мг,- 29
МПК / Метки
МПК: A61P 3/00, C07D 401/14, C07D 401/12, A61K 31/454, C07D 209/40, A61K 31/496
Метки: положении, применение, индол-2-она, терапии, двузамещенные, получение, производные
Код ссылки
<a href="https://eas.patents.su/30-19486-proizvodnye-indol-2-ona-dvuzameshhennye-v-polozhenii-3-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индол-2-она, двузамещенные в положении 3, их получение и их применение в терапии</a>
Предыдущий патент: Сконструированные гибридные антитела против альфа v интегрина
Следующий патент: Соединения в качестве ингибиторов plk, фармацевтические композиции, их содержащие, и их применение
Случайный патент: Устройство и способ обработки данных