Сконструированные гибридные антитела против альфа v интегрина
Номер патента: 19485
Опубликовано: 30.04.2014
Авторы: Адан Хауме, Гудман Саймон, Ло Кин-Минь, Хан Диана, Митханс Франсеск
Формула / Реферат
1. Сконструированное рекомбинантное гибридное антитело против αv-интегрина, содержащее:
(i) участки CDR легкой цепи:

(ii) участки CDR тяжелой цепи:
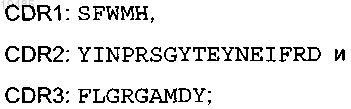
(iii) каркасные области легкой цепи:

(iv) каркасные области тяжелой цепи:

(v) константную область тяжелой цепи, имеющую происхождение от человеческого IgG, и человеческую константную область легкой цепи.
2. Сконструированное антитело по п.1, где константная область тяжелой цепи имеет происхождение от IgG2.
3. Сконструированное антитело по п.2, где константная область IgG2 содержит модифицированную шарнирную область IgG1.
4. Сконструированное антитело по п.3, где указанная модифицированная шарнирная область IgG1 содержит последовательность EPKSSDKTHTCPPCP.
5. Сконструированное антитело по любому из пп.2-4, где указанная константная область IgG2 модифицирована путем замены аминокислоты N на Q в положении 297.
6. Сконструированное антитело по п.5, где аминокислотный остаток F в положении 296 заменен на А с целью элиминации Т-клеточного эпитопа, получаемого в результате модификации положения 297.
7. Сконструированное антитело по любому из пп.1-6, где константная область легкой цепи представляет собой область каппа человека.
8. Рекомбинантное гибридное антитело против αv-интегрина по любому из пп.1-7, по существу, состоящее из:
(i) вариабельной и константной последовательностей легкой цепи:

(ii) вариабельной и константной последовательностей тяжелой цепи:

9. Гибридный белок, содержащий антитело по любому из пп.1-8, связанный на его С-конце с цитокином или фактором роста.
10. Молекула ДНК, кодирующая антитело по любому из пп.1-8.
11. Экспрессионный вектор, содержащий молекулу ДНК по п.10.
12. Клетка-хозяин млекопитающего, за исключением клетки человека, трансформированная экспрессионным вектором по п.11.
13. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая антитело по любому из пп.1-8 или гибридный белок по п.9, в фармацевтически эффективном количестве, вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
14. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая первый и второй фармацевтически эффективные терапевтические агенты, где первый агент представляет собой сконструированное антитело по любому из пп.1-8 или гибридный белок по п.9, а второй агент выбран из группы, состоящей из химиотерапевтического агента, ингибитора ангиогенеза и противоопухолевого агента, вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом.
15. Фармацевтическая композиция по п.14, где противоопухолевый агент представляет собой противоопухолевое антитело.
16. Фармацевтическая композиция по п.15, где противоопухолевое антитело представляет собой антитело против EGFR или против Her2.
17. Фармацевтическая композиция по п.16, где противоопухолевое антитело представляет собой антитело против EGFR цетуксимаб или матузумаб.
18. Фармацевтическая композиция по п.14, где ингибитор ангиогенеза представляет собой ингибитор интегрина циленгитид.
19. Фармацевтическая композиция по п.14, где химиотерапевтический агент представляет собой цисплатин, DTIC или дакарбазин.
20. Применение сконструированного антитела по любому из пп.1-8 или гибридного белка по п.9 для получения лекарства для лечения солидных опухолей или опухолевых метастазов.
21. Применение фармацевтической композиции по любому из пп.13-19 для получения лекарства для лечения опухолей.
22. Применение фармацевтической композиции по п.16 для получения лекарства для лечения опухолей, где противоопухолевое антитело представляет собой антитело против EGFR.
23. Применение фармацевтической композиции по любому из пп.14-16 для получения лекарства для лечения опухолей, где первый агент представляет собой антитело по п.8 и антитело против EGFR представляет собой цетуксимаб.
Текст
СКОНСТРУИРОВАННЫЕ ГИБРИДНЫЕ АНТИТЕЛА ПРОТИВ АЛЬФА V ИНТЕГРИНА Изобретение относится к сконструированным антителам, которые специфично связываются с интегриновыми рецепторами, в частности субъединицей альфа V интегринового рецептора. Эти антитела содержат участки связывания антигена (CDR) известного мышиного антитела к интегрину, гибридные вариабельные последовательности легкой цепи, мутированные вариабельные последовательности тяжелой цепи (FR) и модифицированные константные последовательности тяжелой цепи. Эти новые антитела обладают улучшенными иммуногенными и экспрессионными свойствами и вызывают отличные активности, как антиангиогенную, так и противоопухолевую, у людей при монотерапии, но также, и прежде всего, в комбинации с другими агентами, ингибирующими ангиогенез и опухоль.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Область изобретения Изобретение относится к сконструированным антителам, которые специфично связываются с интегриновыми рецепторами, в частности с субъединицей альфа v (v) интегринового рецептора. Эти антитела содержат антигенсвязывающие сайты (CDR) известного мышиного антитела к альфа-интегрину,гибридные вариабельные последовательности легкой цепи, мутированные вариабельные последовательности тяжелой цепи (Frs) и модифицированные константные последовательности тяжелой цепи. Новые антитела обладают улучшенными иммуногенными и экспрессионными свойствами и вызывают отличные активности, как антиангиогенную, так и противоопухолевую, у людей при монотерапии, а также,прежде всего, в комбинации с другими агентами, ингибирующими ангиогенез и опухоли, такими как циленгитид, цетуксимаб и химиотерапевтические агенты. Предшествующий уровень техники Лечение рака остается основной проблемой в здравоохранении. Одной из предложенных стратегий для лечения рака является ингибирование ангиогенеза и, следовательно, ингибирование образования и развития кровеносных сосудов, которые снабжают опухоль релевантными для роста средствами. Второй стратегией является прямое ингибирование специфичных рецепторов на поверхностях опухолевых клеток, как, например, ингибирование Her2 Герцептином или ингибирование EGFR цетуксимабом (эрбитуксом). Ингибиторы интегринов рассматривают как потенциально полезные противоопухолевые агенты,поскольку интегрины экспрессируются на новообразованных сосудах опухоли и опосредуют ангиогенез. Кроме того, интегрины экспрессируются на некоторых опухолевых клетках и могут непосредственно стимулировать рост и жизнеспособность опухоли. Интегрины не обладают ферментативной активностью, но интегрины, способные к связыванию их лигандов (компетентные к лигандам интегрины), активируются в результате связывания с белками ВКМ(внеклеточного матрикса). Интегрины, с одной стороны, запускают каскады внутриклеточных киназ,которые модулируют рост и жизнеспособность клеток, а, с другой стороны, связываются с цитоскелетом,направляя прикрепление и движение клеток. Интегрин v5 специфично связывает витронектин, тогда как v3 также связывает другие макромолекулы временного ВКМ. v3 был впервые отмечен при раке как маркер, зависимый от прогрессирования, при злокачественной меланоме. Он усиливал рост меланомы in vivo и жизнеспособность in vitro. Блокаторы v3 вызывали регрессию этих эффектов. Впоследствии v3 был обнаружен при других опухолях, включая глиобластому, карциномы почек, карциномы яичников и др. Широко распространенная гиперэкспрессия v3 также имела место в ЭК (эндотелиальных клетках) при многих злокачественных опухолях. В ангиогенных моделях in vitro, активируемых факторами роста опухолевого происхождения, имела место гиперэкспрессия и потребность в v3 на прорастающей сосудистой сети, тогда как блокирование v3 и v5 могло подавлять ангиогенный фенотип. Было также показано, что v5 поддерживает новообразованные сосуды, индуцированные некоторыми факторами роста опухолевого происхождения. Ингибирование v5 может запускать апоптоз опухолевых клеток. Гиперэкспрессия интегриновых рецепторов имеет место на опухолевых инвазивных кровеносных сосудах, на меланомах и некоторых других злокачественных опухолях, и они модулируют клеточный ответ на факторы роста. Область кровеносных сосудов является перспективной терапевтической мишенью, поскольку солидные опухоли зависят от кровеносных сосудов по кислороду, питанию, детоксикации и распространению метастазов, переносимых кровью; переключение на ангиогенный фенотип отмечает дискретную стадию в индукции злокачественности, которая поддается терапевтическому вмешательству; и сосудистая сеть претерпевает непрерывное изменение, кроме того, эндотелиальные клетки обладают геномной стабильностью относительно опухоли, и менее вероятно приобретение ими лекарственной устойчивости посредством мутации. Первым лекарством против интегрина является циленгитид, и его считают полезным противоопухолевым агентом (Eskens F.A., et al. (2003), Eur. J. Cancer. 39:917-26). Однако циленгитид представляет собой малую молекулу, которую необходимо вводить часто. Структура циленгитида, избранной солевой формы, например, описана в ЕР 0770622, WO 0015244 и PCT/US07/01446 и включена здесь путем ссылки. Вторым лекарством против интегрина является мышиное mAb 17E6 (EMD 73034), которое специфично ингибирует субъединицу v-интегрина человеческих клеток, несущих интегриновый рецептор. Мышиное IgG1 антитело описано, например, Mitjans et al. (1995; J. Cell Sci. 108, 2825) и в патентахUS 5985278 и EP 719859. Полноразмерные вариабельные последовательности тяжелой и легкой цепей изображены в SEQ ID25 и 26 (фиг. 20 А, Б). Мышиное 17 Е 6 было получено от мышей, иммунизированных очищенным и иммобилизованным на сефарозе человеческим v3. Лимфоциты селезенки от иммунизированных мышей гибридизовали с клетками миеломы мышей, и один из полученных в результате гибридомных клонов продуцировал моноклональное антитело 17 Е 6 (EMD 73034). Мышиное mAb 17E6 продуцируется линией клеток гибридомы 272-17 Е 6 и депонировано под номером по каталогу DSM-1 019485 Мышиное 17 Е 6 антагонизирует взаимодействие интегрина с внеклеточным матриксом (ВКМ) и нарушает функцию эндотелиальных и опухолевых клеток. Первичные эффекты антитела включают прерывание адгезии и движения эндотелиальных клеток (ЭК), индукцию их апоптоза и подавление активации биохимических путей факторов роста. Блокада указанным антителом непосредственно подавляет жизнеспособность как активированных эндотелиальных клеток, так и некоторых опухолевых клеток. Моноклональные антитела, такие как 17 Е 6, в целом полезны для ингибирования внеклеточных белок-белковых взаимодействий, как, например, ингибирование взаимодействия лиганда с рецептором. Однако моноклональные антитела часто трудно экспрессировать, и они часто провоцируют иммунный ответ, такой как антиидиотипический иммунный ответ, который ограничивает их эффективность. Эти данные и принципиальные знания, приобретенные до сих пор, подтверждают необходимость в разработке модифицированного мышиного антитела 17 Е 6 с улучшенными свойствами, которое специфично связывается с интегринами, может быть эффективно экспрессировано и является относительно неиммуногенным у людей в качестве терапевтического агента при раке. Такое сконструированное антитело должно обладать потенциалом подавления развития опухоли как косвенно, посредством сосудистой сети опухоли, так и прямо на самих опухолевых клетках. Краткое изложение сущности изобретения Изобретение относится к новым антителам, обладающим биологическими свойствами моноклонального мышиного антитела 17 Е 6 (EMD 73034), но с улучшенными свойствами, прежде всего в отношении иммуногенности у людей и удовлетворительной экспрессии в экспрессионных системах млекопитающих при промышленном получении и в промышленном масштабе. В изобретении предложено несколько сконструированных антител, имеющих модифицированные последовательности, которые распознают один и тот же рецепторный эпитоп, что и мышиное антитело 17 Е 6, но проявляют пониженную иммуногенность у людей и могут лучше экспрессироваться по сравнению с немодифицированным антителом. Следует отметить, что модификация или конструирование антитела мышиного происхождения в целях получения пониженной иммуногенности у людей, как правило, сопровождается отчетливой потерей экспрессии и/или связывающего сродства. Таким образом, химеризация или гуманизация в соответствии с хорошо известными стандартными методиками обычно приводит к снижению экспрессии, связывающего сродства и т.д., что можно только частично разрешить путем специфичных обратных мутаций или других мер. Модификации внутри соответствующей белковой молекулы, которые одновременно успешны в отношении пониженной иммуногенности, высокой экспрессии и удовлетворительного связывающего сродства, невозможно предсказать. Таким образом, уменьшение числа Т-клеточных эпитопов с целью элиминации или снижения иммунного ответа против лекарства у человека как основной проблемы, которую нужно решить, может привести к неприемлемой потере экспрессии, либо связывающего сродства, либо обоих свойств, что приведет к дополнительным проблемам, которые нужно решать. Следовательно, целью настоящего изобретения является разработка сконструированных антител с определенной специфичностью мишени, которые вызывают пониженную иммуногенность, удовлетворительную экспрессию и хорошее связывающее сродство. Эти свойства могут быть получены путем неожиданных модификаций молекулы из исходного источника мышиного mAb 17 Е 6. Во многих экспериментах имеет смысл сравнивать результаты не непосредственно с мышиным антителом 17 Е 6, но с химерным вариантом 17 Е 6 (содержащим человеческие константные области). Успешные химерные антитела уровня техники, как правило, проявляют достаточное связывающее сродство и достаточную экспрессию, но часто вызывают иммунный ответ у индивидуума человека. В принципе, в изобретении предложены сконструированные рекомбинантные гибридные антитела против v-интегрина с пониженной или элиминированной иммуногенностью у людей, содержащие:(i) участок CDR легкой и тяжелой цепей, имеющий происхождение от мышиного моноклонального антитела против v-интегрина 17 Е 6;(ii) каркасную область легкой цепи, которая имеет происхождение от гуманизированного моноклонального антитела против EGFR 425;(iii) каркасную область тяжелой цепи, имеющую происхождение от мышиного моноклонального антитела против v-интегрина 17 Е 6; и(iv) константную область тяжелой цепи, имеющую происхождение от человеческого IgG и константной области легкой цепи человека. Гуманизированное моноклональное антитело 425 (матузумаб) известно, например, из ЕР 531472 и имеет происхождение от его мышиного двойника 425 (мышиного mAb 425, ATCC HB9629), Это антитело было вызвано против клеточной линии карциномы человека А 431, и обнаружено, что оно связывается с полипептидным эпитопом на наружном домене человеческого рецептора эпидермального фактора роста (EGFR). Было обнаружено, что оно ингибирует связывание эпидермального фактора роста (EGF) в участках EGFR как низкого, так и высокого сродства. Матузумаб показал высокую эффективность в клинических испытаниях. Последовательности FR легкой цепи матузумаб изображены в SEQ ID No. 12-15,как описано ниже и в формуле изобретения.-2 019485 Комбинирование каркасных областей (FR) тяжелой цепи от мышиного антитела против интегрина 17 Е 6 с каркасными областями легкой цепи гуманизированного антитела против EGFR h425 другой специфичности (матузумаб) позволило создать, помимо другой модификации, несколько антител с наилучшими иммуногенными свойствами, которые, кроме того, в достаточной степени экспрессируются в стандартных экспрессионных системах млекопитающих. При использовании области VL (FR) от mAb h425 неожиданно отчетливо повысился уровень экспрессии, но, как показано ниже, необходимо было ввести дополнительные мутации, чтобы улучшить другие свойства, прежде всего, связывающее сродство. Следующей важной модификацией является замена аминокислотного остатка внутри участка CDR2 тяжелой цепи мышиного 17 Е 6. В результате замены остатка цистеина остатком тирозина неожиданно можно отчетливо улучшить стабильность белка и уровень экспрессии, по меньшей мере, по сравнению с химерным вариантом 17 Е 6. Дополнительные улучшения экспрессии и стабильности могут быть получены путем замены константной области тяжелой цепи исходного мышиного IgG1 человеческим IgG2 с модифицированной шарнирной областью человеческого IgG1. В предпочтительной форме осуществления указанный IgG2 может быть дополнительно модифицирован путем замены остатка аргинина в положении 297 глутамином (N297Q). Эта модификация элиминирует сайт N-гликозилирования и, таким образом, прекращает или снижает активность АЗКЦ (антителозависимой цитотоксичности) и КЗЦ (комплементзависимой цитотоксичности) антител, которые нужно конструировать. К сожалению, в результате этой меры повышается иммуногенность, очевидно, за счет образования нового Т-клеточного эпитопа. Неожиданно путем замены фенилаланина на аланин в положении 296 может быть восстановлена меньшая иммуногенность. С целью уменьшения числа Т-клеточных эпитопов в исходной каркасной области тяжелой цепи мышиного mAb 17 Е 6 осуществлены различные мутации. Подробно, мутации в одном, более чем одном или во всех приведенных ниже положениях мышиного антитела: А 9, Е 13, М 20, K38, R40, А 72, S76, Q82,G85, Т 87, S91 и S113 необходимы для понижения иммуногенности. Одно предпочтительное сконструированное антитело согласно изобретению, которое показывает лучшие значения улучшенных свойств, далее обозначено как "DI-17E6" или как синонимы"DI-17E62h(N297Q)" или "EMD 525797" и имеет приведенную ниже последовательность:(i) вариабельная и константная последовательности легкой цепи (SEQ ID No. 3):(ii) вариабельная и константная последовательности тяжелой цепи (SEQ ID No. 4): где подчеркнутые последовательности представляют собой вариабельные области и CDR (жирным шрифтом). Константная область легкой цепи представляет собой цепь каппа человека. Константная область тяжелой цепи представляет собой человеческий IgG2 с модифицированной шарнирной областью IgG1EPKSSDKTHTCPPCP (SEQ ID No. 40). Соответствующие последовательности ДНК DI-17E6 показаны на фиг. 17-19. Изобретение также направлено на сконструированные антитела, как описано выше и ниже, которые гибридизованы непосредственно или через линкерную молекулу с цитокинами, такими как ИЛ-2, ИЛ-12,TNFa, IFNa, IFNb, или факторами роста. Цитокины, гибридизованные с антителом, можно также применять в терапии опухолей и/или заболеваний, связанных с ангиогенезом, поскольку цитокиновый участок может вносить вклад в повышенную цитотоксичность. Гибридные белки с антителами, в частности иммуноцитокины, хорошо известны в данной области техники. Предпочтительным гибридным белком согласно изобретению является DI-17 Е 6-ИЛ-2 или DI-17E6-(L)-ИЛ-2, где L представляет собой линкерный пептид. В соответствии с настоящим изобретением было показано, что сконструированные антитела, как описано, можно применять в фармацевтических композициях для лечения заболеваний, связанных с ан-3 019485 гиогенезом, и/или заболевания, связанного с опухолью. Неожиданно антитела согласно изобретению вызывают прямой эффект на опухолевый рост, который оказался независимым от косвенного противоопухолевого эффекта, вызванного блокированием ангиогенеза. Целью изобретения также является разработка и применение фармацевтических композиций, содержащих второй терапевтический агент, который предпочтительно представляет собой химиотерапевтический агент, такой как цисплатин, доксорубицин и т.д., ингибитор v-интегрина, такой какerbB1 или erbB2. Предпочтительными примерами здесь являются цетуксимаб (моноклональное антитело с 225, эрбитукс), матузумаб (моноклональное антитело h424) или Герцептин (гуманизированное антитело 4D5). Согласно изобретению сконструированные антитела в указанных фармацевтических композициях,как раскрыто здесь, могут усиливать эффект второго терапевтического агента, во многих случаях посредством синергического взаимодействия. Согласно изобретению комбинация предпочтительного сконструированного антитела DI-17E6 или подобных вариантов с антителами против EGFR, предпочтительно цетуксимабом, вызывает удивительный эффект, а именно замедление или предупреждение повторного роста опухолевой ткани после прекращения введения сконструированного антитела. Фармацевтическую композицию, содержащую второй терапевтический агент, можно также применять в виде набора из частей, содержащего в первой упаковке сконструированное антитело, предпочтительно DI-17E6, и во второй упаковке фармацевтическую композицию, содержащую второй терапевтический агент, например ингибитор ангиогенеза, химиотерапевтический агент или ингибитор тирозинкиназы, такой как антитело против EGFR или против Her2. Предпочтительным вторым терапевтическим агентом указанного набора является ингибитор ангиогенеза циленгитид, либо антитело против EGFR цетуксимаб или матузумаб, либо химиотерапевтический агент. В кратком изложении изобретение относится к приведенному ниже. Сконструированное рекомбинантное гибридное антитело против v-интегрина, содержащее(i) участок CDR легкой и тяжелой цепей, имеющий происхождение от мышиного моноклонального антитела против v-интегрина 17 Е 6; (ii) каркасная область легкой цепи, которая имеет происхождение от гуманизированного моноклонального антитела против EGFR 425; (iii) каркасная область тяжелой цепи,имеющая происхождение от мышиного моноклонального антитела против v-интегрина 17 Е 6; и(iv) константная область тяжелой цепи, имеющая происхождение от человеческого IgG и константной области легкой цепи человека. Сконструированное антитело, как описано, где участки CDR легкой цепи, которые имеют происхождение от мышиного моноклонального антитела против v-интегрина 17 Е 6, представляют собой: и участки CDR тяжелой цепи представляют собой: Сконструированное антитело, как описано, где участок CDR2 тяжелой цепи имеет последовательность YINPRSGYTEYNEIFRD (SEQ ID No. 9). Сконструированное антитело, как описано, где каркасная область легкой цепи, которая имеет происхождение от гуманизированного моноклонального антитела против EGFR 425, содержит последовательность: Сконструированное антитело, как описано, где указанная каркасная область тяжелой цепи(FR1-FR4), имеющая происхождение от мышиного антитела 17 Е 6, мутирована при положениях аминокислотных остатков 1-15 для уменьшения или элиминации числа Т-клеточных эпитопов и, следовательно, иммуногенности у людей. Сконструированное антитело, как описано, где указанная каркасная область тяжелой цепи мутирована при одном, более чем одном или всех из приведенных ниже положений мышиного антитела: А 9, Е 13, М 20, K38, R40, А 72, S76, Q82, G85, Т 87, S91 и S113.-4 019485 Сконструированное антитело, как описано, где указанные положения мутированных аминокислотных остатков в сконструированном антителе представляют собой: A9G, Е 13K, M20V, K38R, R40A,А 72 Т, S76T, Q82E, G85S, T87R, S91T, S113T. Сконструированное антитело, как описано, где указанная каркасная область тяжелой цепи содержит приведенные ниже мутации:A9G, Е 13K, M20V, K38R, R40A, А 72 Т, S76T, Q82E, G85S, T87R, S91T и S113T. Сконструированное рекомбинантное гибридное антитело против v-интегрина, содержащее:iii) каркасные области легкой цепиiv) каркасные области тяжелой цепи где одно, более чем одно или все из выделенных жирным шрифтом и подчеркнутых положений мутированы с целью уменьшения числа или элиминации Т-клеточных эпитопов и, следовательно, иммуногенности у человека;(v) константная область тяжелой цепи, имеющая происхождение от человеческого IgG и константной области легкой цепи человека. Сконструированное антитело, как описано, где указанные каркасные области тяжелой цепи представляют собой: Сконструированное антитело, как описано, где константная область тяжелой цепи имеет происхождение от IgG2, где в предпочтительной форме осуществления указанная константная область IgG2 содержит модифицированную шарнирную область IgG1 . Сконструированное антитело, как описано, где указанная модифицированная шарнирная областьIgG1 содержит последовательность EPKSSDKTHTCPPCP (SEQ ID No. 24). Сконструированное антитело, как описано, где указанная константная область IgG2 модифицирована заменой аминокислоты N на Q при положении 297 (N297Q). Сконструированное антитело, как описано, где аминокислотный остаток F при положении 296 заменен A (F296A) с целью элиминации Т-клеточного эпитопа, образованного модификацией при положении 297. Сконструированное антитело, как описано, где константная область легкой цепи представляет собой каппа человека. Рекомбинантное гибридное антитело против v-интегрина, обозначенное как "DI-17E6", по существу, состоящее из:(i) вариабельной и константной последовательностей легкой цепи (SEQ ID No. 3):-5 019485 вариабельной и константной последовательностей тяжелой цепи (SEQ ID No. 4): где подчеркнутые отрезки последовательности представляют собой вариабельные области при включении CDR (жирным шрифтом), последовательности, выделенные жирным шрифтом в константных областях, представляют собой модифицированную шарнирную область (EPKSSDKTHTCPPCP) и мутации при положениях 296 и 297. Гибридный белок, содержащий антитело, как описано, которое гибридизовано предпочтительно через его С-конец с цитокином или фактором роста, предпочтительно цитокином. Молекула ДНК, кодирующая антитело или гибридный белок с антителом, как описано. Экспрессионный вектор, включающий указанную молекулу ДНК. Экспрессионная плазмида, включающая сегменты ДНК, как указано на фиг. 15, и обозначенная какpdHL10-DI-17E6g2h (N297Q). Система экспрессии белка, включающая клетку-хозяина млекопитающего, трансформированную указанной экспрессионной плазмидой. Фармацевтическая композиция, содержащая антитело или гибридный белок с антителом, как описано выше и ниже, в фармацевтически эффективном количестве, может быть, вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом. Фармацевтическая композиция, содержащая первый и второй фармацевтически эффективные агенты, где первый агент представляет собой антитело или гибридный белок с антителом, как описано, и второй агент выбран из группы, состоящей из химиотерапевтического агента, ингибитора ангиогенеза и противоопухолевого агента, может быть, вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом. Соответствующая фармацевтическая композиция, где второй терапевтический агент представляет собой противоопухолевое антитело, в частности антитело против EGFR (erbB1) или против Her2 (erbB2). Соответствующая фармацевтическая композиция, где второй агент представляет собой ингибитор интегрина циленгитид, ингибиторы против EGFR mAb с 225 (цетуксимаб, эрбитукс) и mAb h425 (матузумаб) и химиотерапевтические агенты цисплатин или DTIC. Применение сконструированного антитела или гибридного белка с антителом, как описано, для получения лекарства для лечения заболевания, связанного с ангиогенезом, и/или солидных опухолей или опухолевых метастазов. Применение фармацевтической композиции, как указано, для получения лекарства для лечения опухолей, где указанное сконструированное антитело повышает эффективность второго агента. Применение фармацевтической композиции, как указано, для получения лекарства для лечения опухолей, где второй агент представляет собой антитело против EGFR, и указанное сконструированное антитело предупреждает или замедляет повторный рост опухоли после прекращения введения сконструированного антитела. Применение по п.29, где первый терапевтический агент представляет собой сконструированное антитело по п.17 (DI-17E6) и второй терапевтический агент представляет собой mAb с 225 (цетуксимаб). Подробное описание изобретения В целях снижения потенциала иммуногенности у человека было получено антитело DI-17E6(EMD 525797) путем деиммунизации и генетического конструирования мышиного 17 Е 6 (EMD 73034). Деиммунизация антитела согласно изобретению означает обнаружение и удаление человеческих Т-клеточных эпитопов из исходного мышиного антитела. Эта технология является отличной от метода"гуманизации", при котором замещают мышиные последовательности человеческими консенсуспоследовательностями. Используемая технология деиммунизации описана, например, в WO 98/52976,WO 00/34317 и WO 02/69232. Вариабельные области легкой (VL) и тяжелой (VH) цепей мышиного 17 Е 6 анализируют in silico для удаления потенциальных эпитопов Т-хелперных клеток. Деиммунизированные последовательности VH иVL были сконструированы таким образом, чтобы сохранить те аминокислоты из мышиной последовательности, которые являются критическими для связывания, такие как CDR. Для оптимизации экспрессии каркасные области легкой цепи замещали таковыми гуманизированного антитела 425. Кроме того, неспаренный цистеин-60 в VH, который является редким среди последо-6 019485 вательностей VH, преобразовали в тирозин (C60Y) для улучшения стабильности белка. Одним из признаков EMD 525797 является то, что оно не запускает иммунные ответы. Чтобы осуществить это, константные области иммуноглобулина также модифицировали, как описано ниже. Для легкой цепи использовали геномную человеческую константную область каппа. Для тяжелой цепи использовали геномные человеческие константные области гамма-2 (72), но шарнирная область с четырьмя цистеиновыми дисульфидными связями была замещена модифицированной шарнирной областью у 1 для минимизации запутывания дисульфидной связи и для улучшения экспрессии. Мутацию Asn-297 в домене СН 2 на Gln (N297Q) вводили для удаления сигнала N-гликозилирования: полученное в результате дегликозилирование прекращает эффекторные функции и продлевает время полужизни антитела в сыворотке. Наконец, Phe-296 был мутирован на Ala, что удаляет потенциальные Т-клеточные эпитопы, созданные мутацией N297Q. Предпочтительное антитело DI-17E6, а также некоторые варианты, имеющие вышеописанную структуру, полученное способом, кратко описанным выше, обладает приведенными ниже свойствами.DI-17E6 проявляет эффективность и селективность при изолированном рецепторе и на клеточном уровне (например, исследования связывания рецептора, клеточной адгезии и миграции клеток).DI-17E6 проявляет активность ингибирования опухолевого роста in vitro и в животных моделях(например, экспериментальные опухоли бестимусных мышей с мутацией nude, химера кожи мыши с ТКИД (тяжелым комбинированным иммунодефицитом)/человека).DI-17E6 проявляет антиангиогенную активность в животных моделях (например, химера кожи мыши с ТКИД, тампоны Матригель у обезьян).DI-17E6 селективно ингибирует связывание белков внеклеточного матрикса (ВКМ) сv-интегриновыми рецепторами и ингибирует опосредованные v-интегрином клеточную адгезию, прикрепление и миграцию. Как только индуцировано отделение клеток, происходит два дополнительных события: блокируются биохимические пути клеточной активации, и происходит интернализацияv-интегрина в тканевой культуре. Связывание фибриногена с рецептором тромбоцитов GPIIbIIIa и агрегация тромбоцитов не подвергаются влиянию, и EMD не запускает ни антителозависимую клеточную цитотоксичность (АЗКЦ), ни комплементзависимую цитотоксичность (КЗЦ).DI-17E6 (EMD 525797) проявляет узкую видовую специфичность, и распознаются v-интегрины только человека и обезьян. Рост меланомы человека с дефицитом по v-интегрину и ответ роста сосудов были ингибированы EMD 525797 в коже человека, трансплантированной на мышей с ТКИД. Системное введение EMD 525797 у здоровых обезьян блокировало ангиогенез, спровоцированный подкожной имплантацией тампонов, содержащих ангиогенные факторы роста, такие как основной фактор роста фибробластов (bFGF). EMD 525797 также продемонстрировало прямую противоопухолевую активность в моделях ксенотрансплантатов человеческих опухолей, экспрессирующих v3-интегрин, включая некоторые меланомы. В исследованиях комбинированной терапии активность EMD 525797 проявляет хороший синергический эффект с химиотерапевтическими лекарствами, что дает возможность применять более низкие, менее токсичные концентрации стандартных химиотерапевтических средств и все же сохранять эффективность в условиях, подобных клиническим. В этих экспериментах смогли только продемонстрировать потенциальную противоопухолевую активность EMD 525797, поскольку сосудистый эндотелий мыши не экспрессирует целевой v-интегрин и, следовательно, не распознается антителом. Данные 4-недельного токсикологического исследования не выявили никаких эффектов DI-17E6,связанных с лечением, в отношении клинического наблюдения, массы тела и потребления пищи, ЭКГ,температуры тела, частоты дыхания, клинической патологии (гематологии, химии сыворотки), анализа мочи, массы органов, макроскопической патологии и гистопатологии. На основании этих данных дозы 10, 33 и 100 мг EMD 525797/кг массы тела/сутки, вводимые один раз в неделю в течение 4 недель путем внутривенной инфузии (1 ч), считали хорошо переносимыми и соответствующими условиям исследования. Антитело перорально неактивно, но успешно введено i.v. иi.p. путями в исследованиях на животных, в которых показано, что оно ингибирует ангиогенез и рост нескольких различных экспериментальных опухолей. Бактериальный скрининг-тест, исследующий мутагенный потенциал EMD 525797, показал, чтоEMD 525797 не является мутагенным. Никаких сигналов риска фармакологической безопасности EMD 525797 не наблюдали в исследованиях на токсичность повторной дозы у яванского макака.EMD 525797 имеет теоретическую молекулярную массу 145208 Да, которая проверена экспериментально с помощью анализа MALDI-TOF-MS (времяпролетного масс-спектра ионизации лазерной десорбцией из матрицы) и LC-ESI-Q-TOF MS (жидкостной хроматографии с масс-спектроскопией времяпролетной ионизации электрораспылением). Изоэлектрическая точка находится в интервале от 7,35 до 8,15 при среднем 7,75. Коэффициент экстинкции равен 1,42.EMD 525797 ингибирует адгезию человеческих эндотелиальных клеток к витронектину при ЕС 50 примерно 10 нМ. EMD 525797 блокирует адгезии опухолевых клеток, опосредованные v-интегринами,при ЕС 50 в интервале от 0,1 до 50 нМ. Индуцированная VEGF миграция человеческих эндотелиальных-7 019485 клеток на витронектин также блокирована EMD 525797 при ЕС 50 около 50 нМ. Подобным образом, пролиферация и жизнеспособность человеческих эндотелиальных клеток, высеянных на лигандыEMD 525797 направлено на эндотелиальные v-интегрины и прерывает образование сосудов. Оно ингибирует особенно интегрины v3 и v5 и блокирует опосредованное v-интегрином поведение клеток, включая прикрепление и миграцию. Биохимические пути передачи сигнала v-интегрина и фактора роста взаимодействуют, поэтому связывание EMD 525797 может также прерывать дифференциацию,пролиферацию и жизнеспособность. В дополнение к его антиангиогенному эффекту EMD 525797, очевидно, стимулирует апоптоз в качестве прямого противоопухолевого эффекта в презентирующих мишень злокачественных клетках. EMD 525797 может блокировать прикрепление клеток, индуцировать отделение клеток, блокировать миграцию, пролиферацию и жизнеспособность на лигандах vинтегрина.DI-17E6 является первым деиммунизированным белком, для которого доступны данные иммуногенности у людей. В соответствующем клиническом испытании антитела против DI-17E6 не были обнаружены при дозах выше 500 мг, которая представляет собой обычную терапевтическую дозу для антител. Для сравнения, антитела к лекарству можно было обнаружить в испытаниях на животных при соответственно вычисленных дозах. Как правило, подразумевают, что иммунные свойства DI-17E6 являются более сложными: связывание 17 Е 6 с v должно стимулировать захват в дендритные клетки. Как оказалось, связывание FcR 17E6 деактивировано. Связывание 17 Е 6 с интегриновым рецептором должно, вероятно, ингибировать естественный иммуносупрессивный механизм. Таким образом, результаты, полученные с помощью сконструированных антител, предпочтительно DI-17E6, являются неожиданными в любом случае и удивительными.DI-17E6 обладает связывающим сродством к интегриновому рецептору v, которое подобно химерному 17 Е 6, содержащему те же константные области, что и DI-17E6. Неожиданно мутация антитела,которое содержит уже вариабельные каркасные области гуманизированного mAb 425, но все же содержит исходную область VH мышиного антитела 17 Е 6, не связывается с интегриновым рецептором.DI-17E6 хорошо экспрессируется клетками NS0 и другими линиями клеток млекопитающих. Интересно, что мутация, которая не проявляет связывающее сродство к интегрину, как описано выше, проявляет такую же благоприятную скорость экспрессии. Эти и подобные результаты показывают, что предсказание этих желаемых свойств: пониженной иммуногенности, высоких уровней экспрессии и удовлетворительного связывающего сродства, невозможно. Стадии ангиогенеза in vitro и in vivo нарушены DI-17E6, как при опухолевом росте меланомы.DI-17E6 может усиливать активность терапий, основанных на цитотоксических лекарствах, приводя к большей противоопухолевой активности in vivo.DI-17E6 вызывает деполимеризацию фокальных адгезий, зависимых от v3 и v5. Эти комплексы передачи сигнала собираются после лигирования интегрина. Они организуют коммуникацию с биохимическими путями роста, жизнеспособности и движения, и их разрушение может запускать апоптоз. Таким образом, DI-17E6 использует комбинацию механохимических и биохимических эффектов для воздействия на эндотелий и для повышения нагрузки на опухолевые клетки.DI-17E6 проявляет свои биологические активности in vivo посредством эффектов по меньшей мере на две различные категории клеток в пределах опухоли: на сами опухолевые клетки и на ангиогенно активированные опухолевые эндотелиальные клетки. Прикрепление опухолевых и эндотелиальных клеток,опосредованное v3 или v5, прерывается DI-17E6. ЭК в культуре мигрируют в пределах временного ВКМ, и эта миграция прерывается DI-17E6. Морфогенетические изменения, вовлеченные в образование кровеносных сосудов, сложны, но их можно моделировать in vitro в анализах миграции человеческих эндотелиальных клеток, где DI-17E6 может блокировать этот процесс. Оно также блокирует ангиогенез при системном введении in vivo в модели химеры кожи человека - мышей ТКИД и в модели тампона Матригель у обезьян. Это позволяет предположить, что DI-17E6 влияет на ангиогенный эндотелий. Косвенное свидетельство антиангиогенеза представлено ниже. В зависимости от того, VEGFA или FGF-2 является индуктором, запускаемый ангиогенез зависит от v5 или от v3. Поскольку DI-17E6 блокирует оба v-интегрина, оно может блокировать оба биохимических пути. Хотя мишенью DI-17E6 считают, прежде всего, ЭК, оно может также ингибировать рост и жизнеспособность самих опухолевых клеток. До сих пор это продемонстрировано только для опухолей, экспрессирующих v3. Рост опухолевых клеточных линий от различных локализаций опухолей (меланомы, яичника, почек, ободочной кишки, молочной железы и легкого) подвергнут воздействию при обработке DI-17E6 invitro. Активность DI-17E6 по индукции антипролиферации варьирует на различных клеточных линиях, и это может быть следствием как генетического фона каждой клеточной линии, так и уровня экспрессииDI-17E6 может ингибировать рост ксенотрансплантатов опухолей у мышей. Оно также проявляет синергические эффекты в комбинации с химиотерапевтическими реагентами. Эти эффекты зависимы от-8 019485 окружения опухоли и от других условий (например, in vitro/in vivo), но эффективность наблюдали при подкожной и при ортотопической локализации, такой как поджелудочная железа (см. ниже). В солидных опухолях компетентный к лиганду v3 часто претерпевает гиперэкспрессию на инвазивной сосудистой сети опухоли, а также на некоторых опухолях человека, включая меланомы, карциномы почек, опухоли головного мозга. Эта экспрессия сопровождается депонированием лигандов v3,подобных витронектину, фактору Виллебранда и фибриногену, и аномальным синтезом таких белков. Например, витронектин, в основном продуцируемый в печени, экспрессируется в некоторых опухолях. У здоровых взрослых людей витронектин и фибриноген находятся в переносимой кровью неактивной форме, но при активации (например, у пациентов с опухолями) они претерпевают конформационное изменение и депонируются в субэндотелиальном ВКМ. Таким образом, мишени DI-17 Е 6 экспрессируются как инвазивными кровеносными сосудами опухоли, так и некоторыми опухолями, которые также экспрессируют рецептор витронектина. Подкожный рост v3-экспрессирующих клеток меланомы подавляется EMD 525797 при различных дозах. В химерной модели кожи человека - мышей ТКИД, где человеческие меланомы безv-интегринов были васкуляризированы человеческими ЭК, EMD 525797 также ингибировало опухолевый рост, что указывает на его антиангиогенный эффект. Кроме того, в безопухолевой модели у обезьян, где ангиогенез индуцирован ангиогенным фактором роста bFGF, DI-17E6 также блокировало ангиогенез, индуцированный этим фактором роста. На основании исследований in vivo и в соответствии с экспериментальными минимальными концентрациями в плазме, идентифицированными в некоторых исследованиях PK/PD in vivo, введения EMD 525797 в клинических испытаниях включает дозирование до достижения минимальных концентраций в плазме в диапазоне от 10 до 500 мкг/мл. Применительно к мышиным моделям ксенотрансплантатов меланомы (М 21, MeWo или CAKI-1)DI-17E6 вызывает при более низких дозах (примерно 30 мг/кг) небольшой эффект регрессии опухоли,тогда как этот эффект значительно увеличивается при введении более высоких доз (500 мкл/мл). Следует отметить, что основные биологические и терапевтические свойства, которые описаны выше для DI-17E6, также применимы к другим вариантам DI-17E6, которые описаны в данном патенте. Комбинированная терапия. Эндотелиальные клетки пролиферируют и внедряются в окружение опухоли в ответ на растворимые цитокины и на факторы роста, секретируемые опухолью. Такие эндотелиальные клетки являются подходящей мишенью для терапии, что недавно подтверждено у людей-пациентов с раком.v-интегрины, экспрессируемые de novo таким инвазивным эндотелием опухоли, поддерживают ее жизнеспособность в чужеродном окружении временного внеклеточного матрикса, и ингибирование этих интегринов может обладать антиангиогенным эффектом. Таким образом, терапия, направленная на v3 или v-интегрин, представляет идеальные условия для комбинирования антитела по настоящему изобретению с химиотерапевтическими агентами, другими ингибиторами интегринов или агентами, блокирующими опухолевые рецепторы, в фармацевтических композициях и наборах из частей для применения в комбинированной терапии рака. Неожиданно было обнаружено, что прямой противоопухолевый эффект можно усилить путем комбинирования сконструированного антитела согласно изобретению, предпочтительно DI-17E6, с дополнительными противоопухолевыми агентами, в частности с ингибиторами тирозинкиназы, предпочтительно с антителами против erbB1 (EGFR) и против erbB2 (Her2). Противоопухолевая терапия направлена на саму опухолевую ткань путем блокирования опухолеспецифических рецепторов и, следовательно, предотвращает опухолевый рост или стимулирует сокращение опухоли. В соответствии с изобретением можно было продемонстрировать, что некоторые химиотерапевтические агенты вызывают в комбинации со сконструированным антителом согласно изобретению, предпочтительно DI-17E6, только аддитивный эффект, тогда как в других экспериментах с использованием других химиотерапевтических агентов (например, дакарбазина, DTIC) можно наблюдать синергические эффекты. Кроме того, результаты зависят от используемой системы, например от использования системыin vivo или in vitro. Один из важных результатов комбинированных экспериментов состоит в том, что комбинированное применение предпочтительно DI-17E6 и циленгитида, циклического пептида RGD и ингибитора интегрина (цикло-(Arg-Gly-Asp-DPhe-NMeVal проявляет синергические эффекты при регрессии опухолевого роста как in vitro, так и in vivo. Подобные синергические эффекты на снижение опухолевого роста могут быть получены при комбинировании DI-17E6 с цетуксимабом (эрбитуксом). эрбитукс (цетуксимаб) представляет собой химерное моноклональное антитело мыши/человека (mAb) подкласса иммуноглобулина G1 (IgG1 ), которое направлено на рецептор эндотелиального фактора роста (EGFR) человека. Различные клеточные линии почечно-клеточной карциномы (RCC) экспрессируют EGFR. Эрбитукс является имеющимся в продаже препаратом и одобрен для нескольких опухолевых показаний.-9 019485 Во всех случаях синергизма на основании результатов можно сделать вывод, что сконструированное антитело DI-17E6 усиливает противоопухолевый эффект второго агента, используемого в комбинации. Согласно изобретению DI-17E6 вызывает при комбинировании с цетуксимабом стабильное уменьшение в размере/росте опухоли, которое можно наблюдать в течение более длительного периода (примерно 40 суток) даже при прекращении введения лекарств. Этого не наблюдают в случае, если цетуксимаб вводят в виде монотерапии. Сконструированные антитела согласно изобретению можно вводить пациенту, нуждающемуся в этом, до, после второго терапевтического агента или одновременно с ним. Химиотерапевтический агент, применяемый в комбинации с любым сконструированным антителом согласно изобретению, может представлять собой, например, метотрексат, винкристин, адриамицин,цисплатин, не содержащие сахар хлорэтилнитрозомочевины, 5-фторурацил, митомицин С, блеомицин,доксорубицин, дакарбазин, таксол, фрагилин, мегламин GLA, валрубицин, кармустин, UFT (тегафур/урацил), ZD 9331, таксотер/доцетаксел, фторурацил (5-FU), винбластин и другие хорошо известные соединения из этого класса. Терапевтические композиции или композиции DI-17E6 по изобретению со вторым терапевтическим агентом или без него можно также применять в комбинации с другими противораковыми стратегиями, и такие комбинированные терапии эффективны при ингибировании и/или элиминации опухолевого роста и метастазов. Способы по настоящему изобретению можно успешно применять с другими терапевтическими методами, включая без ограничения лучевую терапию, операцию, генотерапию и химиотерапию. Неожиданно было обнаружено, что антиангиогенный эффект может быть усилен в результате комбинирования антитела согласно изобретению с лечением дополнительными ингибиторами ангиогенеза. Антиангиогенная терапия направлена на сосудистую сеть опухоли и предотвращает опухолевый рост больше определенного размера, таким образом, во второй предпочтительной форме осуществления второе лекарство представляет собой ингибитор ангиогенеза, предпочтительно выбранный из приведенного ниже перечня. Ингибитор ангиогенеза может представлять собой, но не ограничен ими, например, циленгитид,BMS-275291, далтепарин (Фрагмин), сурамин, 2-метоксиэстрадиол (2-МЕ), талидомид, СС-5013(Неовастат; GW786034), антитело против VEGF (бевацизумаб; Авастатин), ZD6474, карбоксиамидотриазол (CAI), целекоксиб (Целебрекс). Антитела по изобретению могут быть включены в фармацевтическую композицию, пригодную для введения. Такие композиции типично содержат вариабельные области антитела и фармацевтически приемлемый носитель. Как используют здесь, выражение "фармацевтически приемлемый носитель" подразумевает включение любого и всех растворителей, дисперсионных сред, покрытий, антибактериальных и противогрибковых агентов, изотонических агентов и агентов, замедляющих всасывание, и т.п., совместимого с фармацевтическим введением. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. Фармацевтическую композицию по изобретению готовят таким образом, чтобы она была совместима с предназначенным для нее путем введения. Примеры путей введения включают парентеральное,например внутривенное, внутрикожное, подкожное, пероральное (например, ингаляцию), чрескожное(местное), введение в слизистую оболочку и ректальное введение. Растворы или суспензии, применяемые для парентерального, внутрикожного или подкожного применения, могут включать приведенные ниже компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор,нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регуляции тоничности, такие как хлорид натрия или декстроза. рН можно доводить кислотами или основаниями, такими как соляная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или флаконы многократных доз, изготовленные из стекла или пластика. Лекарства, которые содержат вариабельные области антитела по изобретению, могут иметь концентрацию от 0,01 до 100% (мас./мас.), хотя количество варьирует в соответствии с лекарственной формой лекарств. Введение предпочтительно проводят один раз в две недели или один раз в месяц, но его можно проводить чаще или реже в зависимости от фармакокинетических свойств белка 17 Е 6/425-101 у данного индивидуума. Дозировка DI-17E6 или других антител, которые описаны в данном патенте (например,цетуксимаба), для взрослого человека примерно 70 кг находится в диапазоне от примерно 50 до 1000 мг на дозу, где предпочтительный диапазон составляет от примерно 100 до 500 мг на дозу. Наиболее предпочтительная доза составляет примерно 400 мг для взрослого человека 70 кг при лечении один раз в месяц.- 10019485 Химиотерапевтические агенты, которые упомянуты здесь, вводят, как правило, в дозах между 10 и 100 мг/кг. При комбинированной терапии со вторым терапевтическим агентом, как описано, сконструированное антитело согласно изобретению можно давать одновременно со вторым агентом в начальный момент терапии, либо после или до введения второго агента. Краткое описание графических материалов Фиг. 1A: Вариабельные последовательности легкой цепи DI-17E6 (SEQ ID No. 1). Фиг. 1 Б: Вариабельные последовательности тяжелой цепи DI-17E6 (SEQ ID No. 2). Фиг. 1 В: Полноразмерная последовательность белка легкой цепи DI-17E6: вариабельные области подчеркнуты с CDR, выделенными жирным шрифтом. Фиг. 1 Г: Полноразмерная последовательность белка тяжелой цепи DI-17E6: вариабельные области подчеркнуты с CDR, выделенными жирным шрифтом. Последовательности, выделенные жирным шрифтом в константных областях, указывают модифицированную шарнирную область IgG1 и модификации в положениях 296 и 297. Фиг. 2: Антиангиогенная активность DI-17E6 в эксперименте с тампоном Матригель у обезьян: обнаружение антиантитела в сыворотке обезьян в зависимости от концентрации лекарства на различные сутки (однократная доза). Фиг. 3: Антиангиогенная активность DI-17E6 в эксперименте с тампоном Матригель у обезьян: обнаружение антиантитела в сыворотке обезьян для дозировки DI-17E6 (30 мг/кг) в зависимости от времени (длительное). Фиг. 4: Эффекты DI-17E6 на опухолевый рост в химерной модели кожи мыши ТКИД - человека с внутрикожной меланомой M21-L (вводимого 3 раза в неделю при 1 мг/доза i.p. в течение 4 недель, начало обработки через одни сутки после инокуляции опухолевых клеток). Фиг. 5: Эффекты DI-17E6 на ангиогенез, индуцированный фактором роста: модель тампона Матригель у обезьян: ингибирование ангиогенеза, индуцированного фактором роста, EMD 525797 у обезьян,получающих однократное терапевтическое введение i.v. (10 или 30 мг/кг). Обработку проводили на те же сутки, что и имплантацию Матригель. Использовали одно животное, содержащее вплоть до 6 тампонов Матригель, на группу. Анализ содержания гемоглобина (г гемоглобина/мг тампона Матригель) проводили через 6 суток; приведены средние значенияСО (ошибка среднего). Фиг. 6: Антипролиферативный эффект DI-17E6, комбинированного с паклитакселом in vitro, показанный на клетках HUVE. Фиг. 7: Антипролиферативный синергический эффект DI-17E6, комбинированного с циленгитидомin vitro, показанный на линии клеток меланомы человека М 21. Верхняя кривая: циленгитид один, нижняя кривая: DI-17E6 + циленгитид. Фиг. 8: Антипролиферативный синергический эффект DI-17E6, комбинированного с циленгитидомin vitro, показанный на линии клеток почек человека CAKI-2. Верхняя кривая: циленгитид один, нижняя кривая: DI-17E6 + циленгитид. Фиг. 9: Антипролиферативный синергический эффект DI-17E6, комбинированного с циленгитидомin vitro, показанный на линии клеток человека А 498. Кривая с треугольниками DI-17E6 + циленгитид,кривая с квадратами: один циленгитид. Фиг. 10: Эффект in vivo DI-17E6 (EMD 525797) на химиотерапевтическое лечение в модели ортотопического ксенотрансплантата опухоли рака поджелудочной железы: Ингибирование рака поджелудочной железы NP18-b3 (10 мг фрагментов опухоли, ортотопически пришитых на поджелудочную железу бестимусных мышей) путем комбинирования субоптимальных доз EMD 525797 и гемцитабина при различных дозах. Обработку начинали через 6 суток после операции с опухолевыми фрагментами. EMD 525797 вводили три раза в неделю i.p. при дозе 500 мкг/доза. Гемцитабин вводили три раза в неделю i.p. при дозе 50 мкг/кг. Изображена масса опухоли через 42 суток. Фиг. 11: Эффект in vivo DI-17E6 (EMD 525797) при комбинированной обработке цисплатином(сРТ) моделей ксенотрансплантатов опухоли с использованием опухолевых клеток человека М 21, трансплантированных мышам, используя субоптимальные дозы DI-17E6. Обработку для EMD 525797 начинали на те же сутки, что и инъекцию опухоли. Обработку сРТ начинали на сутки 11 после инъекции опухолевых клеток. EMD 525797 вводили один раз в неделю i.p. при 500 мкг/доза. сРТ вводили один раз в неделю i.p. при 10 мг/кг. Фиг. 12: Эффект in vivo DI-17E6 (EMD 525797) при комбинированной обработке дакарбазином(DTIC) моделей ксенотрансплантатов опухоли с использованием опухолевых клеток человека MeWo,трансплантированных мышам, используя субоптимальные дозы DI-17E6. Обработку для EMD 525797 начинали на те же сутки, что и инъекцию опухоли. Обработку DTIC начинали на сутки 11 после инъекции опухолевых клеток. EMD 525797 вводили один раз в неделю i.p. при 500 мкг/доза. DTIC вводили один раз в неделю i.p. при 50 мг/кг. Фиг. 13: Эффект in vivo одного DI-17E6 (EMD 525797) в моделях ксенотрансплантатов опухоли с использованием опухолевых клеток карциномы почек человека CAKI-1, трансплантированных мышам,используя различные дозы (мкг/мл сыворотки) DI-17E6. Ось у: объем опухоли (мм 3). Ось x: сутки.- 11019485 Фиг. 14: Эффект in vivo DI-17E6 (EMD 525797) при комбинированной обработке цетуксимабом (эрбитуксом) в опухолевых клетках карциномы почек CAKI-1, трансплантированных мышам, с использованием DI-17E6 при постоянной концентрации в сыворотке 100 мкг/мл и эрбитукс при дозе 4 и 12 мг/кг массы тела. Режим дозировки изображен на фиг. 13. Ось у: объем опухоли (мм 3). Ось x: сутки. Фиг. 15: Плазмидная карта экспрессионной плазмиды DI-17E6 pdHL10-DI-17E62h(N297Q). Фиг. 16: Схематическая структура mAb DI-17E6 (EMD 525797). Фиг. 17 А: Полноразмерная последовательность ДНК DI-17E6 от кодона инициации трансляции до стоп-кодона трансляции полноразмерной легкой цепи (каппа человека), которая использована в экспрессионной плазмиде pdHL10-DI-17 Е 6 (кодирующая последовательность в верхнем прямоугольнике и некодирующая последовательность в нижнем прямоугольнике, вариабельная и константная последовательность в сером цвете, вариабельная последовательность курсивом) (SEQ ID No. 27). Фиг. 17 Б: Последовательность ДНК вариабельной легкой цепи DI-17E6 (SEQ ID No. 29). Фиг. 17 В: Последовательность ДНК константной легкой цепи DI-17E6 (SEQ ID No. 31). Фиг. 18 А: Полноразмерная последовательность ДНК DI-17E6 от кодона инициации трансляции до стоп-кодона трансляции полноразмерной тяжелой цепи, которая использована в экспрессионной плазмиде pdHL10-DI-17E6 (кодирующая последовательность в верхнем прямоугольнике и некодирующая последовательность в нижнем прямоугольнике, вариабельная и константная последовательность в сером цвете, вариабельная последовательность курсивом; модифицированная шарнирная область IgG1 жирным шрифтом) (SEQ ID No. 33). Фиг. 18 Б: Последовательность ДНК вариабельной тяжелой цепи DI-17E6 (SEQ ID No. 35). Фиг. 18 В: Последовательность ДНК константной тяжелой цепи DI-17E6 (SEQ ID No. 37). Фиг. 18 Г: Последовательность ДНК модифицированной шарнирной области IgG1 тяжелой цепиDI-17E6 (SEQ ID No. 39). Фиг. 19 А: Полноразмерная последовательность ДНК тяжелой цепи DI-17E6 (SEQ ID No. 41). Фиг. 19 Б: Полноразмерная последовательность ДНК легкой цепи DI-17E6 (SEQ ID No. 43). Фиг. 20 А: Последовательность белка вариабельной легкой цепи мышиного антитела 17 Е 6. Последовательности, выделенные жирным шрифтом, представляют собой CDR (SEQ ID No. 25). Фиг. 20 Б: Последовательность белка вариабельной тяжелой цепи мышиного антитела 17 Е 6. Последовательности, выделенные жирным шрифтом, представляют собой CDR (SEQ ID No. 26). Фиг. 21 А: Анализ ЭЛАЙЗА связывания интегрина различных вариантов сконструированных антител: крест (х) = 17 Е 6 VH/425VL-g2h(N-Q),двойной крест= mAb 425,треугольник = DI 17E6 VH33/VL60.2-g2h(N-Q),ромб = 17E6-g2h(N-Q). Фиг. 21 Б: Анализ ЭЛАЙЗА связывания интегрина различных вариантов сконструированных антител: заполненный треугольник = мышиное 17E6-g2h(N-Q),треугольник = DI-17E6VL60-425VLFR4/VH33(C60Y-g2h(FNAQ),заполненный квадрат = DI-17E6VL60.2CDR-425VLFR3FR4/VH33(C60Y-g2h(FNAQ),заполненный круг = 17E6-g2h(N-Q)(C60Y). Приведенные ниже примеры описывают изобретение более подробно. Однако, хотя использованы конкретные параметры, молекулы, стадии способа и т.д., изобретение не ограничено ими, если специалист в данной области техники может легко сделать вывод из этих данных, что изобретение можно осуществлять аналогичными средствами и способами. Пример 1. Конструирование и экспрессия сконструированных антител в соответствии с изобретением. С целью понижения иммуногенности у человека DI-17E6 (EMD 525797) было получено путем деиммунизации и генетического конструирования мышиного 17 Е 6. Источник антитела представлял собой моноклональное мышиное антитело 17 Е 6, которое описано ранее. Это антитело было получено от мышей, иммунизированных очищенным человеческим v3. Лимфоциты селезенки от иммунизированных мышей гибридизовали с клетками миеломы мыши, и один из полученных в результате гибридомных клонов продуцировал моноклональное антитело 17 Е 6 (см.,например, ЕР 0719859). Линия клеток гибридомы, продуцирующая указанное антитело, была депонирована как DSM ACC2160. В принципе, вариабельные области легкой (VL) и тяжелой (VH) цепей мышиного 17 Е 6 были проанализированы in silico так называемой методологией деиммунизации (WO 98/52976, WO 00/34317 иWO 02/069232) для удаления потенциальных Т-клеточных эпитопов. Деиммунизированные последовательности VH и VL были сконструированы таким образом, чтобы сохранить те аминокислоты из мышиной последовательности, которые являются критическими для связывания, такие как CDR.- 12019485 Использование только этой технологии привело к антителу, которое показывает пониженную или элиминированную иммуногенность у индивидуума человека, но не показывает достаточное связывающее сродство и удовлетворительные скорости экспрессии в экспрессионной системе млекопитающих. Следовательно, антитело было реконструировано путем модификации аминокислотной последовательности при нескольких положениях, чтобы повторно установить связывающее сродство и экспрессию. Однако становится очевидным, что при улучшении паттерна экспрессии связывающее сродство снижается, и наоборот. Следовательно, необходимо было сконструировать множество вариантов антитела, которые были исследованы на экспрессию и связывающее сродство. Новый вариант часто показывает неожиданные результаты, которые не ожидали при планировании молекулярной конструкции. Комбинирование последовательностей от варианта антитела, показывающего хорошую экспрессию, с последовательностями вариантов антитела, показывающих хорошее связывающее сродство, часто приводит в результате к новым вариантам антитела, обладающим слабым связывающим сродством и слабой экспрессией. Следовательно, как уже отмечено, предсказание того, какие конкретные мутации вызывают хорошую экспрессию и связывающее сродство, было невозможно. Вариабельные области деиммунизированного 17 Е 6 (DI-17E6). Вариабельные области легкой (VL) и тяжелой (VH) цепей мышиного моноклонального антитела 17 Е 6 (SEQ ID No. 25 и 26) были деиммунизированы in silico с помощью технологии деиммунизации, как описано выше, которая удаляет потенциальные эпитопы Т-хелперных клеток. Это привело в результате к деиммунизированному варианту VL, названному VL60.2, и к деиммунизированному варианту VH, названному VH33. Деиммунизированное антитело 17 Е 6, состоящее из VL60.2 и VH33, продуцируемое путем трансфекции клеток млекопитающих, сохранило связывающее сродство к интегрину v3, но слабо экспрессировалось. Для оптимизации экспрессии каркасные области легкой цепи были замещены таковыми гуманизированного антитела 425 (Kettleborough et al., Protein Engineering 4:773, 1991). Кроме того, неспаренный цистеин-60 в VH33, который является редким среди последовательностей VH, был преобразован в тирозин (C60Y) для обеспечения стабильности белка. ДНК, кодирующая конечные деиммунизированные VL (DI-17E6 VL, фиг. 1 А) и VH (DI-17E6VH,фиг. 1 А), была синтезирована химическим путем с использованием кодонов, оптимизированных для экспрессии в млекопитающих. Происхождение и источник клеточной линии NS0-LD. Мышиная миелома NS0 была получена из Европейской коллекции клеточных культур (ЕСАСС 85110503). Клеточная линия NS0-LD была получена путем селекции клеток NS0 на рост в среде, свободной от липидов и свободной от сыворотки, которая состоит из среды SM1F6 (Invitrogen) с добавлением 1 мМ пирувата натрия (Invitrogen), 1 г/л глюкозы (Merck KGaA), 1% заменимых аминокислот (Invitrogen), 0,1 мкМ трополона (Sigma), 10 мкМ этаноламина (Sigma) и 2 мМ глутамина (Invitrogen). Замороженные концентрированные исходные суспензии NS0-LD готовили в среде для замораживания, состоящей из 10% (об./об.) фильтрованного ДМСО (Merck KGaA), 10% (об./об.) 1% суспензии метилцеллюлозы в воде (Sigma), 40% свежей ростовой среды и 40% кондиционированной среды клеток NS0-LD. Конструирование экспрессионного вектора для DI-17E62h(N297Q. Геномную последовательность сигнального пептида (438 п.о.) из мышиного гена легкой цепи иммуноглобулина использовали для секреции как тяжелой, так и легкой цепей. Последовательность гена,кодирующего сигнальный пептид -2 аминокислотных остатка (-1 аминокислота представляет собой С-концевой остаток сигнального пептида), подвергали мутагенезу остатка серина на остаток лейцина(AGC на ТТА), так что ДНК, кодирующая конец сигнального пептида, представляет собой CTTAAGC,где CTTAAG представляет собой созданный сайт AflII (Lo et al., Protein Engineering. 11:495, 1998). Кроме того, консенсус-последовательность Козака CCACCATGG вводили для оптимального связывания рибосомы для инициации трансляции при ATG (Kozak, Cell. 44:283, 1986). Это было достигнуто путем мутирования первого аминокислотного остатка после кодона инициации с AAG на GAG с получением последовательности TCTAGACCACCATGGAG, где консенсус-последовательность Козака подчеркнута, aTCTAGA представляет собой сайт XbaI. Таким образом, сигнальный пептид содержит замену при первом аминокислотном остатке после кодона инициации и другую замену при аминокислотном остатке в положении -2. Поскольку сигнальный пептид отщепляется сигнальной пептидазой внутри клетки и не оказывается в секретируемом белке, эти мутации не влияют на аминокислотный состав продукта антитела. ДНК деиммунизированной VL синтезировали в виде фрагмента AflII-BamHI, и ДНК деиммунизированной VH синтезировали в виде фрагмента AflII-HindIII. Для VL в результате лигирования с геномной лидерной последовательностью через сайт AflII получили фрагмент XbaI-BamHI, кодирующий сигнальный пептид-VL. Подобным образом, в результате лигирования ДНК VH с геномной лидерной последовательностью через сайт AflII получили фрагмент XhoI-HindIII, кодирующий сигнальный пептидVH, где XhoI заменял XbaI в результате лигирования линкера. Затем полученные в результате фрагментыXbaI-BamHI и XhoI-HindIII встраивали в экспрессионный вектор pdHL10 (фиг. 15), который уже содержит транскрипционные регуляторные элементы и последовательности константных областей иммуноглобулина (см. ниже). Конструкции ДНК кодирующие человеческие константные области. Для легкой цепи использовали геномную человеческую константную область каппа. Для тяжелой цепи использовали геномные человеческие константные области гамма-2 (2) с приведенными ниже модификациями. Во-первых, поскольку шарнирная область иммуноглобулина 2 содержит четыре цистеиновые дисульфидные связи, которые приводят к усиленному запутыванию дисульфида и агрегации белка в процессе очистки, она была замещена с помощью генетического конструирования с использованием модифицированной шарнирной области 1, как описано ниже. Конструирование ДНК Fc2h, кодирующей модифицированную шарнирную область 1, за которой следуют области СН 2 и СН 3 2, уже описано(Lo et al. Protein Engineering, DesignSelection, 18:1, 2005). С целью замещения экзона шарнирной области 2 в человеческом гене Ig2 модифицированным экзоном шарнирной области 1 авторы изобретения использовали полимеразную цепную реакцию (ПЦР) для повторного введения сайта рестрикции PstI непосредственно выше экзона шарнирной области, используя ДНК Fc2h в качестве матрицы. Прямой праймер имел последовательность 5'-ctgcagAGCCCTCTTC, где ctgcag представляет собой сайт PstI, исходно присутствующий на конце интрона (нижний прямоугольник), где ag представляет собой акцепторный сайт сплайсинга, aAGCCCTCTTC представляет собой 5' конец модифицированного экзона шарнирной области 1(верхний прямоугольник). Обратный праймер имел последовательность 5'-cagctggggcctgtccctg, которая гибридизуется с последовательностью в интроне между шарнирной областью и экзонами СН 2. Полученный в результате продукт ПЦР 130 п.о. PstI-PvuII, содержащий модифицированный экзон шарнирной области 1, после клонирования и проверки последовательности использовали для замещения соответствующего фрагмента в гене Ig2 в экспрессионном векторе pdHL10 (см. ниже). Во-вторых, мутацию Asn-297 в домене СН 2 на Gln (N297Q) вводили с помощью перекрывающейся ПЦР для удаления сигнала N-гликозилирования, что прекращает эффекторные функции и продлевает время полужизни антитела в сыворотке. Кроме того, Phe-296 мутировали на Ala, что удаляет какие-либо потенциальные эпитопы Т-хелперных клеток, созданные мутацией N297Q. В-третьих, сайт рестрикции SmaI локализован примерно на 280 п.о. выше стоп-кодона трансляции в последовательности ДНК дикого типа, кодирующей домен СН 3. Этот сайт SmaI разрушали путем введения молчащей мутации (ТСС на ТСА). Другую молчащую мутацию вводили для создания нового уникального сайта SmaI на 4 п.о. выше стоп-кодона (Lo et al. Protein Engineering. 11:495, 1998) для облегчения генетических манипуляций. Конструирование плазмиды pdHL10 (фиг. 15). Экспрессионный вектор pdHL10 имеет происхождение от pdHL7, который был описан ранее(Gillies et al. J. Immunol. 160:6195, 1998). Как в pdHL7, две транскрипционные единицы L и Н цепей вpdHL10 содержат энхансер-промотор CMV (Boshart et al., Cell, 41:521-530, 1985). ДНК для энхансерапромотора CMV была получена из фрагмента AflIII-HindIII имеющегося в продаже вектора pcDNAI(Invitrogen Corp., San Diego, CA). Основным различием между pdHL7 и pdHL10 является транскрипционная единица для селективного маркера дигидрофолатредуктазы (DHFR). Энхансер SV40 для этой транскрипционной единицы разрушали в pdHL10, как описано ниже. В энхансере/промоторе SV40 находится два повтора 72 п.о., и внутри каждых 72 п.о. находится сайт рестрикции SphI. В результате лигирования сайта SalI 5' энхансера с дистальным сайтом SphI посредством олигонуклеотидного линкера-адаптера получили делецию 120 п.о. из двух повторов 72 п.о. Такой промотор без энхансера должен дать значительно более низкий уровень экспрессии селективного маркера DHFR. Это теоретически должно привести в результате к меньшему количеству стабильно трансфецированных клеточных клонов, которые, чтобы пережить лекарственную селекцию, могут иметь плазмиду, интегрированную в область активной транскрипции хромосомы, так чтобы достаточное количество DHFR экспрессировалось с промотора без энхансера. Интересующие гены, направляемые полностью функциональными энхансерами и промоторами, должны экспрессироваться даже на более высоких уровнях в этой области активной транскрипции. Кроме того, ориентация этой аттенуированной транскрипционной единицы была обратной в pdHL10, так что энхансерCMV для L цепи не может проявлять прямой эффект на дистальный промотор SV40. Конструкция pdHL10-DI-17E62h(N297Q) была тщательно картирована с помощью перевара рестрикционными эндонуклеазами (фиг. 15). Кодирующие области полноразмерных L и Н цепей были полностью секвенированы. Их выраженные признаки описаны в приведенной ниже таблице. 1. Вариации шести нуклеотидов в интроне лидера были обнаружены между вектором pdHL10-DI17E62h(N297Q) и опубликованными последовательностями. ВекторpdHL10-DI17 Е 6(С 60Y)2h(N297Q) содержит G при 801, Т при 985, С при 993, Т при 1006, Т при 1045 и А при 1071. Опубликованная последовательность содержит С, A, A, G, АС (дополнительный нуклеотид) и G при этих соответствующих положениях. 2. Вариации шести нуклеотидов в интроне лидера были обнаружены между вектором pdHL10-DI17E62h(N297Q) и опубликованными последовательностями. ВекторpdHL10-DI17 Е 6(С 60Y)2h(N297Q) содержит G при 3780, Т при 3964, С при 3972, Т при 3985, Т при 4024 и А при 4050. Опубликованная последовательность содержит С, A, A, G, АС (дополнительный нуклеотид) и G при этих соответствующих положениях. 3. Варианты двух нуклеотидов в интроне между СН 2 и СН 3 были обнаружены между векторомpdHL10-DI-17E62h(N297Q) и опубликованной последовательностью. Вектор pdHL10-DI17E6(C60Y)2h(N297Q) содержит А при 5908 и А при 5922. Опубликованная последовательность содержит G при обоих соответствующих положениях. 4. Вариант одного нуклеотида в СН 1 были обнаружены между вектором pdHL10-DI-17E62h(N297Q) и опубликованной последовательностью. Вектор pdHL10-DI-17 Е 6(С 60Y)2h(N297Q) содержит G при 4736. Опубликованная последовательность содержит С при этом положении. Создание клеточных клонов-продуцентов и исследовательских клеточных банков. Трансфекция и селекция клонов с высоким продуцированием. Экспрессионную плазмиду pdHL10-DI-17E62h(N297Q), линеаризованную рестрикционной эндонуклеазой Fspl, которая режет один раз в последовательности, кодирующей -лактамазу, использовали для трансфекции клеток NS0-LD путем электропорации. Электропорацию проводили, используя системуGene Pulser XceII (BioRad, Hercules, CA) с установками при 250 В и продолжительности импульса 15 мс. Стабильно трансфецированные клоны были отобраны по росту в среде Super CD, дополненной до содержания 200 нМ метотрексата (Sigma,по каталогу М-8407). Среда Super CD содержит 9,69 г/л среды для гибридом AGT CD (Invitrogen, P/N RM-00-136), 2,52 г/л бикарбоната натрия (EMD, P/N SX03203), 30 мл/л CD растворимого концентрата кислот (Invitrogen, P/N 00-0336DK), 1,46 г/л L-глутамина (Sigma, P/N G8540), 3 г/л глюкозы (Sigma, P/N G-5400), 2 г/л BD Select Soytone (Becton Dickenson, P/N- 16019485 212488) и 2 г/л BD Ultrafiltered Select Phytone (Becton Dickenson, P/N 210931). Надосадочные жидкости примерно 474 стабильных клонов из двенадцати 96-луночных планшетов анализировали с помощью ЭЛАЙЗА против человеческой Fc для идентификации сильных продуцентов. Уровни экспрессии отобранных клонов дополнительно подтверждали с помощью аффинной хроматографии на рекомбинантном белке А (rPA). Клон 395, который продуцировал 607 мкг/мл DI-17E62h(N297Q) (по rPA) в конечной стационарной культуре в 25 см 2 Т-образном флаконе, был выбран для субклонирования путем ограничивающих разведений. Попытки субклонирования в среде Super CD не были успешными. Поэтому клон 395 адаптировали к росту в среде DMEM/F12 (Invitrogen, cat.21041-025), дополненной до содержания 5 мкМ трополона (Sigma, cat.Т 7387), 10 мкл/л этаноламина (Sigma, cat.E0135), 10 мкг/мл инсулина (бычий, лиофилизированный, Invitrogen, cat.13007-018), 2 г/л Нурер 4601 (Quest International, cat.5Z10419) и 2 г/л Нурер 1510 (Quest International, cat.5X59053), 3,5 мМ L-глутамина (Invitrogen, cat.25030-081) и 200 нМ метотрексата (Sigma, cat.М-8407), в течение одного пассажа и субклонировали в смеси 1:1 полной среды DMEM/F12 с 200 нМ метотрексатом и кондиционированной полной среды DMEM/F12(кондиционированной из культуры нетрансфецированных клеток-хозяев NS0-LD, центрифугированной,а затем отфильтрованной). Для субклонирования клетки высевали в количестве 1, 5, 10 клеток/лунка в 96-луночные планшеты. В течение примерно двух недель субклоны появлялись в планшетах, содержащих 10 и 5 клеток/лунка. Субклоны в лунках обследовали под микроскопом, чтобы гарантировать, что в лунке находится только один видимый клон. Надосадочные жидкости 16 субклонов из двух 96-луночных планшетов (10 клеток/лунка) и 1 субклона из двух 96-луночных планшетов (5 клеток/лунка) анализировали с помощью ЭЛАЙЗА против человеческой Fc, и высокопродуцирующие клоны были выбраны для анализа rPA. Лучшими субклонами были 395-2 и 395-6, продуцирующие 669 и 735 мкг/млDI-17E62h(N297Q) (по rPA) в конечной стационарной культуре в 75 см 2 Т-образных флаконах. Экспрессия антитела. Экспрессионные плазмиды млекопитающих были сконструированы, трансфецированы в клеткиNS/0, и выделены стабильные трансфектанты. Типично клетки NS/0 стабильно трансфецировали экспрессионным вектором и вносили в 75-миллилитровую культуру в Т-образном флаконе и выращивали в течение трех суток, так что плотность клеток составляла примерно 400000 клеток/мл. В этих условиях концентрация секретируемого DI-17E6 составляла примерно 50-100 мкг/мл. Очистка антитела. Антитело можно очистить, используя в последовательности некоторые или все из приведенных ниже стадий: колоночная хроматография на смешанной смоле Abx, хроматография на рекомбинантном белке А и колоночная хроматография на Q сефарозе с последующей тангенциальной проточной диафильтрацией Pellicon 2 для обмена буфера на буфер препарата. Стадии инактивации и удаления вирусов включают между этими стадиями. Стадии инактивации и удаления вирусов не являются необходимыми для самой очистки, но их используют для соответствия требованиям регулирующих органов. Анализ на определение связывания антитела DI-17E6 с субъединицей v-интегринового рецептора. Способность антитела DI-17E6 к связыванию v-интегрина анализировали, используя ЭЛАЙЗА. Кратко, различные количества антитела добавляли в лунки, содержащие v-интегрин, затем лунки промывали и связанное антитело анализировали в соответствии со стандартными методиками. Пример 2. Создание разнообразия мутаций антитела для нахождения оптимальной экспрессии и паттернов связывающего сродства. Суммирование данных по повышению уровня экспрессии DI-17E6 путем реконструкции. Проблема в экспрессии: уровни экспрессии деиммунизированных вариантов были даже ниже, чем таковые химерного варианта. Для повышения уровня экспрессии delmm 17E6 VH33-VL49/VL60.2-g2h(FN-AQ) авторы изобретения мутировали:(б) GEAA обратно на DGTV в VL для восстановления сети Н-связей, но потенциально слабого Т-клеточного эпитопа;(в) реверсия V20M в VH. Результаты двух серий транзитной трансфекции суммированы ниже.- 17019485 Уровень экспрессии мутанта Delmm 17E6 (C60S) против другого 17 Е 6 (транзитная трансфекция в Уровень экспрессии мутантов Delmm 17E6 (транзитная трансфекция в PER.C6, 24 мкг в 10 см чашке):C60S дает только пограничное улучшение, тогда как результат для C60Y является многообещающим. Если результат для C60Y сохраняется с макси-препаратом ДНК, трансфекции которой провели,авторы изобретения должны были убедиться, что отсутствует потеря связывающего сродства. РеверсияGEAA на DGTV улучшала экспрессию примерно в 0,5-2 раза. Результат для V20M с мини-препаратом ДНК ненадежен, но трансфекцию повторили макси-препаратом ДНК. Улучшение экспрессии delmm17E6. Приведенные ниже новые конструкции использовали для трансфекции клеток NS0: Данные ЭЛАЙЗА показали, что уровни экспрессии 17E6-g2h(FN-AQ) и 17 Е 6-g2h были сравнимыми. Неожиданно уровни экспрессии комбинаций (C60S)/(DGTV) были выше, чем уровни(C60Y)/(DGTV), тогда как более ранние результаты показали, что C60Y и DGTV по отдельности повышали уровень экспрессии Delmm17E6 от однократного до 2-3-кратного, тогда как C60S имеет минимальное преимущество. Проводили 17E6VH/425VL-g2h(FN-AQ) и описанные ниже транзитные трансфекции: Ясно, что изменение VL повышало уровень экспрессии до уровня 425 Ab. К сожалению, 17E6VH/425VL-g2h(FN-AQ) не связывало v3 в анализе ЭЛАЙЗА на связывание- 18019485 Чтобы решить проблему экспрессии/связывания, были сконструированы приведенные ниже молекулы: Клетки трансфецировали, хотя конечные конструкции подтверждали секвенированием (поскольку рестрикцией невозможно отличить рекомбинантную конструкцию от исходной). Комбинирование Т 8 Р и А 44 Р может быть необходимым. Прививали delmm 17 Е 6VLCDR на delmm 425VL FR. Были протестированы уровни экспрессии delmm 425VL/delmm 17E6VH, поскольку delmm 425VL может не экспрессироваться на таком же высоком уровне, как hu425VL Использовали DI-425VL1, но с реверсией Р на L (VL1 не связывалась). Впоследствии была получена реверсия Р на L в CDR3 для восстановления связывания. Ее спаривали с delmm 17E6VH33 (конструкция а ниже) и ch17E6 VH (конструкция 6 ниже). Проводили транзитные трансфекции, используя контроли hu425VL/ch17E6VH (конструкция в ниже) и ch17 Е 6. Результаты транзитной экспрессии показали, что, хотя (в) давала очень высокий уровень экспрессии, конструкции (а) и (б) с DI-425VL давали даже более низкие уровни, чем ch17E6. Трансплантаты (только FR1+FR2) не экспрессируются хорошо и связываются слабо, тогда как трансплантаты только (FR3+FR4) достаточно хорошо экспрессируются и хорошо связываются. ТолькоFR4 не работает. В приведенной ниже таблице показано, что только FR3 не повышает экспрессию. Транзитная трансфекция в PER.C6.DI-17E6-g2h(NtoQ)(C60Y) была выбрана как конечная молекула в связи с высоким уровнем экспрессии стабильных клонов NS0-LD и в связи с тем, что она сохраняет связывающее сродство. Пример 3. Чтобы охарактеризовать специфичность DI-17E6 к интегрину, использовали ЭЛАЙЗА, клеточный ЭЛАЙЗА и анализ проточной цитометрии, и это позволило авторам изобретения идентифицироватьv-цепь интегринов как специфичный лиганд для EMD 525797.EMD 525797 распознает очищенные v-интегрины, но, как ожидали, не обладает реактивностью против очищенного IIb3. EMD 525797 также взаимодействует с человеческими клеточными линиями сv-интегринами на их клеточной поверхности, независимо от ассоциированной субъединицы -цепи. Иммунореактивность EMD 525797 и LM609 изображены в приведенных ниже таблицах. Иммунореактивность на очищенные интегрины Иммунореактивность на опухолевые клеточные линии Реактивность LM609 (мышиного моноклонального антитела против v3) показана для сравнения. Линии опухолевых клеток человека: М 21, M21-L и MeWo меланомы; НТ 29 и Colo205 карциномы ободочной кишки; SKBR-3 карциномы молочной железы; А 498 карцномы почек и V+B2 глазной меланомы. CV-1 представляет собой линию клеток зеленой мартышки.EMD 525797 распознает только v-интегрины человека и обезьян и никаких других видов. Молекулярная основа этого необычного профиля определенно установлена путем эпитопного картирования,сравнения последовательностей и совместной рентгенокристаллографии. Эпитоп, распознаваемыйDI-17E6, подтвержден как уникальный для человека и обезьяны с помощью иммунопреципитации и вестерн-блот-анализа, проводимых с несколькими видами. Пример 4. Иммуногенность. Данные показывают, что DI-17E6 является значительно менее иммуногенным, чем исходный мышиный вариант 17 Е 6. На фиг. 2 показано, что сывороточные уровни мышиного 17 Е 6, даваемого подопытному животному, значительно снижались параллельно со временем эксперимента. С другой стороны, сывороточные уровни антител обезьян со специфичностью против мышиного 17 Е 6 повышались параллельно со временем эксперимента и проявляли обратную корреляцию с падением сывороточных уровней мышиного 17 Е 6. Эта обратная корреляция позволяет предположить, что мышиное 17 Е 6 обладает высокой иммуногенностью у обезьян и людей, и, следовательно, у обезьян и у людей развивается МАМА, соответственно НАМА, ответ, который оказывает вредное воздействие на фармакокинетику мышиного 17 Е 6. Другая цель исследования состояла, кроме того, в оценке антиангиогенной активности DI-17E6 в эксперименте с тампоном Матригель у обезьян. Для сравнения использовали мышиное 17 Е 6 в качестве контрольного соединения. Использовали четыре различные группы, содержащие единственное животное в каждой: носитель,мышиное 17 Е 6 при 30 мг/кг, DI-17E6 при 30 мг/кг и DI-17E6 при 10 мг/кг. Обезьяны получали одну i.v. инъекцию (в плечо) мышиного 17 Е 6 или DI-17E6 в начале эксперимента, который продолжался в течение 6 суток (фиг. 2). Сыворотки собирали в три различных момента времени (из ног): непосредственно перед инъекцией антитела, непосредственно (1-2 мин) после инъекции антитела и в конце исследования перед умерщвлением животного. Анализировали уровни как мышиного 17 Е 6, так и DI-17E6. Для определения данного сывороточного разведения обнаружение проводили в два различных момента времени в сыворотке: непосредственно после введения антитела и в конце исследования. Это наблюдали в обеих группах обработки DI-17E6: 10 и 30 мг/кг. Однако сывороточные уровни мышиного 17 Е 6 были обнаружимыми только непосредственно после введения антитела. Они были почти нулевыми в конце исследования. Эксперимент выявил массивный нейтрализующий ответ антитела обезьяна против мыши (МАМА, monkey-anti-mouse) против 17 Е 6, кото- 20019485 рый четко указывает на высокую иммуногенность мышиного 17 Е 6 у обезьян и других приматов, таких как люди. Этот ответ приводил к быстрому и полному клиренсу 17 Е 6 из сыворотки обезьян. Таким образом, можно предположить, что мышиное 17 Е 6 претерпевает более быстрый клиренс у людей вследствие сильного ответа человек против мыши НАМА (human-anti-mouse). В другом исследовании оценивали фармакокинетические параметры однократной дозы DI-17E6 у обезьян и, кроме того, данное исследование планировали для изучения иммуногенности DI-17E6.DI-17E6 давали в дозе 1 мг/кг в виде однократной i.v. инъекции в начале эксперимента. Длительность анализа составляла 6 недель. Сыворотки отбирали перед дозированием и через 1, 3 и 6 недель после введения. Анализировали уровни антител обезьяны против DI-17E6. В данном исследовании иммуногенность была непосредственно направлена с использованием специфичного способа сэндвич-ЭЛАЙЗА,разработанного для данного типа исследований (способ еще не утвержден). На фиг. 3 показано, что антитела обезьяны против DI-17E6 невозможно было обнаружить ни в какой момент времени анализа, что, следовательно, четко указывает на генерирование низкого ответа обезьяна против человека (МАНА, monkey-anti-human). В дополнительных экспериментах иммуногенность обоих антител была направлена косвенно путем исследования пролонгированных сывороточных уровней двух вариантов антител 17 Е 6, мышиного 17 Е 6 и DI-17E6. DI-17E6 имело высокие сывороточные уровни в каждый момент времени анализа, что позволяет предположить, что DI-17E6 не запускало ответ антител и, следовательно, не являлось иммуногенным у обезьян. Напротив, мышиное 17 Е 6 невозможно было обнаружить (от очень низких до нулевых уровней) в сыворотке к последнему моменту времени. Это снова указывает на то, что у обезьян был вызван ответ клиренса МАМА против мышиного 17 Е 6 вследствие его иммуногенности. Поскольку 17 Е 6 было деиммунизировано на основании элиминации эпитопов распознавания человеческими Т-клетками, ожидают, что иммуногенность DI-17E6 должна быть низкой у людей, что дает возможность повторного терапевтического дозирования без осложнения в связи с генерированием иммунного ответа, который может препятствовать терапевтической эффективности. Это является уникальным открытием, которое вследствие высокой степени гомологии между геномом обезьяны и человека,включая антиген 17 Е 6 v-интегрин, может быть легко распространено на человеческую ситуацию. Между тем это было подтверждено первым клиническим исследованием, проведенным в США в 2006-2007 гг. DI-17E6 вводили 5 группам здоровых волонтеров (каждая группа содержит 6 волонтеров) в различных дозах: 200, 120, 70, 35 мг/кг, соответствующих 250, 500, 1000 и 1500 мг на дозу. Только в группе 250 мг у одного волонтера развивались антитела против лекарства, тогда как в группах более высокой дозы (эти дозы находятся в диапазоне стандартного терапевтического введения) ни у одного волонтера не развивался иммунный ответ против DI-17E6. В противоположность этому мышиное 17 Е 6 развивает в животных моделях сильный иммунный ответ. В соответствии со способом Т-клеточных эпитопов, где последовательность мышиного антитела расщеплена на перекрывающиеся пептиды, потеря иммуногенности после деиммунизации была подтверждена отчетливым снижением баллов в in vitro Т-клеточном анализе, что показывает, что потенциальные человеческие Т-клеточные эпитопы делетированы: Легкая цепь 17 Е 6 мыши Пример 5. Хотя DI-17E6 перекрестно не реагирует с тромбоцитарным рецептором фибриногена IIb3, тромбоциты также экспрессируют некоторые v-интегрины. Для исключения возможных побочных эффектов антитела на тромбоциты EMD 525797 оценивали на ингибирование агрегации тромбоцитов in vitro с обогащенной тромбоцитами плазмой человека/коллагеном. Агрегационная активность не была обнаружена ни при 160 нМ, ни при 1600 нМ. Исследования агрегации и активации проводили, используя плазму,- 22019485 обогащенную тромбоцитами (PRP, Platelet Rich Plasma). Образование тромба исследовали с помощью перфузионной камеры с открытым субэндотелиальным матриксом. Результат эксперимента можно суммировать, как описано ниже.DI-17E6 не индуцирует ни какую-либо активацию тромбоцитов, ни агрегацию тромбоцитов при любой концентрации (от очень низкой до очень высокой: 0,1-1000 мкг/мл). Удивительно, что DI-17E6 блокирует агрегацию тромбоцитов, индуцированную слабым индуктором агрегации, подобным АДФ, зависимо от дозы. DI-17E6 не влияет на агрегацию тромбоцитов, индуцированную сильным индуктором агрегации, подобным коллагену. DI-17E6 также влияет (блокирует) на образование тромба тромбоцитами в перфузионной камере зависимо от дозы и проявляет антитромботическую активность. Слабое вмешательство в агрегацию тромбоцитов является неожиданным открытием для DI-17E6 как потенциала, который может оказаться терапевтически полезным, поскольку окружение опухоли характеризуется множеством тромбогенных сосудистых сайтов. Пример 6. Антиангиогенная активность in vivo в моделях ксенотрансплантатов опухоли у мыши. Кожу человека, содержащую клетки меланомы человека М 21, прививали путем имплантации/трансплантации на мышей ТКИД или бестимусных мышей. Экспериментальные опухоли росли в этой ткани после внутрикожной инокуляции опухолевых клеток, и исходная ангиогенная сосудистая сеть образовывалась из сосудов кожи человека. В следующем эксперименте использование клеток M21-L, в которых отсутствуют v-интегрины, означает, что мишенью были только интегрины, экспрессируемые на эндотелиальных клетках в пределах привитой кожи человека.DI-17E6 ингибировало рост опухолей M21-L в химерной модели мышь ТКИД-кожа человека и было активно при дозе 1 мг/доза, вводимой i.p. 3 раза в неделю, начиная обработку через одни сутки после инокуляции опухоли (фиг. 4). Это открытие демонстрирует, что EMD 525797 вызывает антиангиогенный эффект на опухолевый рост. Пример 7. Ингибирование ангиогенеза, индуцированного фактором роста, в модели тампонов Матригель у обезьян i.v.инъекцией EMD 525797. Чтобы расширить оценку антиангиогенной активности EMD 525797, оно было протестировано в безопухолевой модели у обезьян, где ангиогенез индуцирован ангиогенным фактором роста bFGF. Тампоны Матригель, содержащие bFGF, имплантировали подкожно в брюшную полость здоровых яванских макак. Животным инъецировали один раз EMD 525797 i.v. либо в дозе 10, либо 30 мг/кг. Оценку ангиогенеза проводили через 6 суток путем количественного определения содержания гемоглобина в тампонах Матригель. Обработка обезьян EMD 525797 блокировала образование новых кровеносных сосудов зависимо от дозы с высокой эффективностью при 30 мг/кг, но с отсутствием активности при 10 мг/кг (фиг. 5). Пример 8. Тестирование DI-17E6 in vitro в комбинации с химиотерапевтическими агентами в клетках HUVE. В данном исследовании изучали репрезентативные химиотерапевтические агенты из различных классов ингибиторов в комбинации с ингибитором v-интегрина циленгитидом и DI-17E6. Схема эксперимента дает ответ на вопрос, снижает ли блокада одного IC50 другого в отношении блокады роста эндотелиальных клеток в присутствии опухолевых факторов роста VEGFA и FGF-2. Тесты проводили с клетками HUVEC и эпителиальными клетками микрососудов, к которым добавляли VEGFA и FGF-2, стимулирующие рост таких клеток с коэффициентом вплоть до 500%. Планшеты покрывали 100 мкл VN при 1 мкг/мл в ФСБ на 96-луночный планшет при 4C в течение ночи. Клетки высевали при 5103 клеток/лунка в 100 мкл среды 199, содержащей 2% ФСТ. После 60 мин при 37C добавляли блокаторы v-интегрина и химиотерапевтические агенты по отдельности или в комбинации в двукратной концентрации в количестве 100 мкл/лунка в среде 199 с 2% ФСТ и 20 нг/мл FGF-2 для клеток HUVE или с 20 нг/мл VEGF для клеток HDMVEC (конечная концентрация факторов роста составляла 10 нг/мл). При добавлении в комбинации два тестируемых вещества смешивали в исходных концентрациях и смесь серийно разводили, как для каждого одного отдельного агента. В некоторых анализах химиотерапевтические агенты серийно разводили в присутствии постоянного количества блокаторов v-интегрина при концентрациях IC50 или IC70. Планшеты инкубировали в течение 72 ч, затем определяли относительное число клеток путем добавления 20 мкл/лунка красителя Alamar Blue (резазурина). После 4 ч инкубации при 37C флуоресценцию считывали в считывающем устройстве для планшетовBlue без клеток, ставили на каждом планшете. Значения чистых контролей вычитали из тестируемых значений, и они обычно составляли 5-10% значений контроля без ингибиторов. Циленгитид тестировали в диапазоне от 50 мкМ до 0,1 нМ. Антитела 17 Е 6 и DI-17E6 тестировали при 50 мкг/мл-0,1 нг/мл. Исходные концентрации химиотерапевтических агентов, которые были протес- 23019485 тированы, даны в приведенной ниже таблице. Блокирующее v-интегрин вещество циленгитид (EMD 121974) и два блокирующих v-интегрин антитела, 17 Е 6 (EMD 73034) и его деиммунизированная форма DI-17E6 (EMD 525979), были протестированы отдельно и в комбинации с распространенными химиотерапевтическими агентами в анализе стимуляции роста FGF, используя общепринятые эндотелиальные клетки человека (HUVEC), или в анализе стимуляции VEGF, используя эндотелиальные клетки микрососудов кожи человека. В данной системе анализа клетки культивируют в среде с пониженным содержанием сыворотки (2% ФСТ в среде 199) сFGF-2 или VEGF в качестве единственного стимулятора роста. Фактор роста FGF-2 оказался лучшим стимулятором роста для HUVEC, a VEGF был лучшим стимулятором для HDMVEC, что измеряли с использованием анализа Alamar Blue. HUVEC, получающие 12,5 нг/мл FGF-2, показывали 406%, а с VEGF 238% превышение числа контрольных клеток, не получающих добавленных факторов роста, после 72 ч роста на VN. Напротив, HDMVEC предпочтительно стимулировались VEGF, чем FGF-2 (484%). Тесты обычно проводили, используя HUVEC в среде, содержащей 10 нг/мл FGF-2 или HDMVEC в среде, содержащей 10 нг/мл VEGF. Блокаторы v-интегрина и паклитаксел ингибировали клеточный рост при добавлении в виде отдельных агентов. В типичном тесте с использованием HUVEC IC50 для циленгитида составляла 700 нМ, для 17 Е 6 составляла 5 нг/мл и для DI-17E64 нг/мл. Для паклитаксела IC50 составляла 0,27 нг/мл при добавлении отдельно, но IC50 была снижена до 0,13 нг/мл при использовании в комбинации с циленгитидом. Антитела 17 Е 6 и DI-17E6 вызывали снижение IC50 паклитаксела до 0,18 нг/мл и 0,1 мг/мл соответственно. Типичный результат для DI-17E6 при использовании в комбинации с паклитакселом показан на фиг. 6. Аддитивный эффект паклитаксела с блокаторами v-интегрина был также получен с HDMVEC. Полный перечень тестируемых химиотерапевтических агентов показан в приведенной ниже таблице. Результаты показывают, что в клетках HUVEC DI-17E6 вызывает отчетливый аддитивный эффект при комбинировании со вторым терапевтическим агентом, таким как паклитаксел, тогда как другие химиотерапевтические агенты при комбинировании со сконструированным антителом согласно изобретению не показывают никакого эффекта или только слабый аддитивный эффект. Пример 9. Тестирование in vitro DI-17E6 в комбинации с химиотерапевтическими агентами в различных клетках меланомы человека. В анализе пролиферации in vitro эффект разнообразных химиотерапевтических агентов, хорошо известных и применяемых в противоопухолевой терапии, исследовали при комбинировании DI-17E6 в различных клеточных линиях меланомы человека: М 21, SKMEL-23, SKMEI; MeWo, WM-793. Результаты показывают, что существуют только слабые различия в отношении используемого химиотерапевтического агента (в данном случае цисплатина, паклитаксела, винбластина, винкристина и темозоломида). Различия являются распознаваемыми в отношении используемой линии опухолевых клеток. Во всех случаях DI-17E6 вызывает не более чем аддитивные эффекты химиотерапевтического агента. Подробно: отсутствие эффекта или только слабый аддитивный эффект наблюдали при комбинацииDI-17E6 с химиотерапевтическим агентом для каждой линии опухолевых клеток, которые нечувствительны к DI-17E6. Сильный аддитивный эффект можно было обнаружить при комбинации DI-17 Е 6 с химиотерапевтическим агентом для таких линий опухолевых клеток, которые чувствительны к DI-17E6. В этом случае профиль пролиферации соответствует тому, который изображен для паклитаксела + DI-17E6 в HUVEC(см. фиг. 6). Пример 10. Синергическая комбинация DI-17E6 и циленгитида in vitro. Неожиданные открытия получены при тестировании комбинаций DI-17E6 и циленгитида in vitro. Клеточные линии NSCLC Н 322, А 549, Н 1975 и Н 460, линия клеток меланомы человека М 21 и линии клеток карциномы почки ACHN, A498, CAKI-1 и CAKI-2 обрабатывали циленгитидом в присутствии DI17E6. Результаты показали значительно большую клеточную гибель после 3 суток роста в нормальных средах, чем в присутствии одного циленгитида или DI-17E6. Типичные условия эксперимента для тестирования синергического эффекта DI-17E6 и циленгитида осуществляли в виде анализа пролиферации с клетками М 21, CAKI-2 и A498. 96-луночные планшеты покрыли витронектином, и после блокирования добавляли клетки (30005000 клеток/лунка) и через 4 ч (достаточного времени, чтобы дать возможность прикрепления и распределения клеток) добавляют лекарства и дают возможность роста в присутствии серийно разведенного циленгитида, одного или вместе с DI-17E6 при 1 мкг/мл. Клетки дополнительно проинкубировали в течение 3 суток и жизнеспособность клеток измеряли, следуя инструкциям изготовителя реагента Alamar- 25019485 На фиг. 7 приведена частота клеточной гибели для указанной комбинации в клетках М 21 (верхняя кривая: один циленгитид, нижняя кривая: циленгитид + DI-17 Е 6). На фиг. 8 приведена частота клеточной гибели для указанной комбинации в клетках CAKI-2 (верхняя кривая: один циленгитид, нижняя кривая: циленгитид + DI-17 Е 6). На фиг. 9 приведена частота клеточной гибели для указанной комбинации в клетках А 498 (верхняя кривая: один циленгитид, нижняя кривая: циленгитид + DI-17 Е 6). Это необычное открытие с обоими веществами, связывающими v-интегрины, подразумевает предварительное насыщение системы аллостерическим ингибитором перед импульсными добавлениями конкурентного ингибитора при постоянном присутствии аллостерического ингибитора. Это дает синергическую блокаду интегрина, значительно усиливающую эффект одного конкурентного ингибитора или одного стерического/аллостерического ингибитора. Важно, что постоянное присутствие конкурентных ингибиторов обычно не является необходимым, его роль состоит в ослаблении первичного взаимодействия, что дает возможность доступа для аллостерических ингибиторов. Пример 11. Тестирование in vivo DI-17E6 в комбинации с химиотерапевтическими агентами. Гемцитабин и DI-17E6 в клетках поджелудочной железы человека NP18-b3. Рост ортотопически ксенотрансплантированной опухоли поджелудочной железы у бестимусных мышей исследовали в условиях системной совместной обработки EMD 525797 и гемцитабином. Гемцитабин был выбран для комбинированной обработки модели ортотопически ксенотрансплантированной опухоли поджелудочной железы человека, поскольку он является лучшим одобренным химиотерапевтическим агентом для данного показания. Линию клеток NP18-b3 поджелудочной железы человека, которая экспрессирует v3-интегрин,имплантировали ортотопически в поджелудочную железу иммуносупрессивных мышей. Животных рандомизировали и спустя одну неделю начинали обработку лекарствами и носителем. Опухоли извлекали и нарезали на кусочки по 10 мг каждый. Затем эти кусочки пришивали к поджелудочной железе здоровых животных (один кусочек на животное). Спустя 4-6 недель опухоли извлекали, снова нарезали на кусочки и нашивали новым животным. Затем этих новых животных рандомизировали и спустя одну неделю начинали обработку лекарствами и носителем. EMD 525797 дозировали i.p. при 500 мкг на животное три раза в неделю. Гемцитабин вводили в субоптимальной дозе 50 мг/кг 3 раза в неделю (субоптимальная доза основана на предшествующих исследованиях). В четвертой группеEMD 525797 комбинировали с субоптимальными дозами гемцитабина, основанными на предшествующих экспериментах. Измерение опухолевого роста (массы извлеченных опухолей) проводили через 6 недель после прививания опухоли. Ортотопические опухоли, обработанные EMD 525797, имели размер и массу, подобные таковым контрольных животных, обработанных носителем. Подобным образом, гемцитабин при субоптимальной дозе был также неактивен. Однако при такой же дозировке, как при монотерапевтических режимах, гемцитабин с EMD 525797 обладал синергической активностью с уменьшением опухоли на 52% (фиг. 10). Цисплатин/дакарбазин и DI-17E6 в моделях ксенотрансплантатов меланомы человека М 21 илиMeWo. Клетки меланомы человека М 21 или MeWo, положительные по экспрессии v3-интегрина, инокулировали подкожно ТКИД или бестимусным мышам в соответствии с хорошо известными стандартными протоколами.DI-17E6 вводили системно вместе либо с цисплатином (сРТ), либо с дакарбазином (DTIC), двумя химиотерапевтическими агентами, применяемыми при клиническом лечении меланомы.DI-17E6 вводили i.p. один раз в неделю, начиная с тех же суток, что и s.c. инъекцию клеток М 21 или MeWo животным, в субоптимальной еженедельной поддерживающей дозе 27,2 мг/кг (соответствует примерно 500 мкл/мл сыворотки). DTIC вводили i.p. один раз в неделю при 50 мг/кг и сРТ вводили i.p. один раз в неделю при 10 мг/кг, каждый начиная с 11 суток после инъекции опухолевых клеток. Результаты, полученные с цисплатином в модели ксенотрансплантата М 21, показан на фиг. 11. В противоположность данным in vitro, показанным ранее, комбинация цисплатина и DI-17E6 in vivo явно вызывает статистически значимое синергическое повышение ответа по сравнению с введением любой лекарственной обработки по отдельности. Результаты, полученные с DTIC в модели ксенотрансплантата MeWo, показаны на фиг. 12. В противоположность данным in vitro, показанным ранее, комбинация дакарбазина и DI-17E6 in vivo явно вызывает статистически значимое синергическое повышение ответа по сравнению с введением любой лекарственной обработки по отдельности. Пример 12. Тестирование DI-17E6 in vivo в мышиной модели ксенотрансплантата клеток карциномы почки человека CAKI-1.CAKI-1 подкожно инокулировали ТКИД или бестимусным мышам в соответствии с хорошо известными стандартными протоколами.DI-17E6 вводили системно i.p. один раз в неделю, начиная с тех же суток, что и s.c. инъекцию клеток CAKI-1 животным, в различных дозах. На фиг. 13 показано, что неожиданно DI-17E6 может уменьшить объем/размер опухоли в дозах от низкой (1 мкг/мл) до средней (100 мкг/мл сыворотки) примерно в одинаковой степени (без реального эффекта дозы), тогда как введение высокой дозы (500 мкг/мл) приводит к полному уменьшению объема опухоли. Пример 13. Комбинированный эффект DI-17E6 с цетуксимабом (эрбитуксом) в модели ксенотрансплантата клеток карциномы почки человека CAKI-1. Линию клеток карциномы почки CAKI-1 выращивали в RPMI, содержащей 10% ФСТ (инактивированной нагреванием) с 2 мМ глутамином, 1 мМ пируватом натрия, 100 ед./мл пенициллина и 100 мкг/мл стрептомицина. Клетки пересевали при конфлюентности путем однократного промывания в ФСБ, свободном от катионов, с последующей 3-минутной инкубацией в растворе трипсина (0,5 мкг/мл)/ЭДТАIBERICA S.L. (Sant Feliu de Codines (Barcelona) Spain), и их держали в течение периода акклиматизации минимум 5 суток в карантинных помещениях в специальных свободных от патогенов вивариях. В течение периода акклиматизации регистрировали все наблюдения. Все животные были осмотрены ветеринаром для гарантии здоровья животных. Обработку начинали для всех групп на сутки 0 эксперимента (те же сутки, что и инъекцию клеток). Животных обрабатывали внутрибрюшинно (i.p.) препаратом или носителем в объеме 10 мг/мл один раз в неделю для EMD 525797 и два раза в неделю для эрбитукса. Дозировки обработки EMD 525797 доводили до ожидаемых значений минимальной концентрации в сыворотке 100 мкг/мл. Для достижения этих значений минимальной концентрации в сыворотке животных дозировали после однократной насыщающей дозы 17,1 мг/кг в режиме многократной (еженедельной) поддерживающей дозы 5,1 мг/кг, как описано в приведенной ниже таблице. Всех животных осматривали ежесуточно, контролируя их физическое состояние, поведение, присутствие повреждений и какие-либо клинические признаки. Группы: Животных, несущих ксенотрансплантаты опухоли почки человека CAKI-1, обрабатывали DI-17E6,эрбитуксом или комбинацией обоих веществ, начиная на сутки 0, когда были инокулированы опухолевые клетки. Продолжительность обработки для DI-17E6 составляла 40 суток, а для группы эрбитукса и комбинации 29 суток. За ростом опухоли следили вплоть до 111 суток после инокуляции опухолевых клеток. После обработки первоначальной дозой 17,1 мг/кг проводили еженедельную обработку 5,1 мг/кгDI-17E6, что приводило в результате к значениям минимальной концентрации 100 мкг/мл, вызывая значимое ингибирование опухолевого роста на сутки 40, в конце эксперимента (Т/С: 25%). После суток 40 задержку опухоли все еще можно было наблюдать до конца периода наблюдения. Обработка дважды в неделю либо 4, либо 12 мг/кг эрбитукса вызывала сильный и значимый противоопухолевый эффект. Т/С на сутки 29, в конце эксперимента, составляли 9%. Подобный сильный противоопухолевый эффект наблюдали для обеих комбинаций DI-17E6 с 4 мг/кг эрбитукса 2/нед. и DI-17E6 с 12 мг/кг 2/нед. Т/С на сутки 29, в конце обработки, составляли 10 и 9% (см. табл. 1) соответственно. Следует отметить, что 10 мкг/мл в сыворотке/плазме соответствует 0,55 мг/кг массы тела.- 27019485 Однако опухоли в группах обработки одним эрбитуксом начинали повторно расти после прекращения обработки. Напротив, в обеих группах комбинаций ингибирование опухолевого роста продолжалось,что очевидно на основании снижения среднего и медианного размера опухоли (фиг. 14). В конце периода наблюдения в обеих группах комбинаций только одна из опухолей достигла размера суток 7, которые являются сутками первого измерения размера опухоли. В группах монотерапии эрбитуксом 3 опухоли росли до значительных размеров (1000 мм 3), и большинство из них росли до размеров выше размера опухоли на сутки 7. Как правило, все обработки были хорошо переносимыми, что показано на основании прироста массы в течение эксперимента. Снижение массы в группе носителя и в группе обработки DI-17E6 при одном единственном измерении в сутки было, наиболее вероятно, вызвано недостаточным снабжением водой. В обеих релевантных группах снижение массы было обратимым с последующим продолжением прироста массы. Обработка исходной дозой 17,1 мг/кг с последующей еженедельной дозой 5,1 мг/кг DI-17E6, которая привела к значениям минимальной концентрации 100 мкг/мл, в течение периода обработки вызывала значимое ингибирование роста опухолей почек человека CAKI-1. Также, обработка двумя различными дозами одного эрбитукса, используя режим два раза в неделю, вызывала значимое ингибирование опухолевого роста. Обе дозы эрбитукса были примерно одинаково эффективными в их противоопухолевой активности. Комбинация DI-17E6 либо с 4 мг/кг эрбитукса, либо с 12 мг/кг эрбитукса вызывала также сильный противоопухолевый эффект, что сравнимо с обработками одним эрбитуксом в течение периода обработки. Однако резкое различие между монотерапиями эрбитукса и комбинированными обработками состоит в поведении роста после прекращения обработки на сутки 29. Настолько долго, как в течение 82 суток после прекращения обработки, только одна из опухолей в группе комбинации росла до размера суток 7, первых суток измерений размера опухоли, что означает, что опухоли, обработанные DI-17E6 и эрбитуксом, либо регрессировали, либо проявляли стабильное заболевание. Напротив, в двух группах, обработанных только эрбитуксом, некоторые опухоли росли после прекращения обработки до значительных размеров (варьирующих от 429 до 3581 мм 3), что указывает на то,что комбинация DI-17E6 и эрбитукса может предотвратить рецидив опухолевого роста после обработки эрбитуксом. Сильный синергический эффект DI-17E6 на обработку ингибиторами тирозинкиназы, такими как цетуксимаб (эрбитукс), можно рассматривать как экстраординарный, и он открывает область перспективной комбинированной терапии опухолей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Сконструированное рекомбинантное гибридное антитело против v-интегрина, содержащее:(iii) каркасные области легкой цепи:(iv) каркасные области тяжелой цепи:(v) константную область тяжелой цепи, имеющую происхождение от человеческого IgG, и человеческую константную область легкой цепи. 2. Сконструированное антитело по п.1, где константная область тяжелой цепи имеет происхождение от IgG2. 3. Сконструированное антитело по п.2, где константная область IgG2 содержит модифицированную шарнирную область IgG1. 4. Сконструированное антитело по п.3, где указанная модифицированная шарнирная область IgG1- 28019485 содержит последовательность EPKSSDKTHTCPPCP. 5. Сконструированное антитело по любому из пп.2-4, где указанная константная область IgG2 модифицирована путем замены аминокислоты N на Q в положении 297. 6. Сконструированное антитело по п.5, где аминокислотный остаток F в положении 296 заменен на А с целью элиминации Т-клеточного эпитопа, получаемого в результате модификации положения 297. 7. Сконструированное антитело по любому из пп.1-6, где константная область легкой цепи представляет собой область каппа человека. 8. Рекомбинантное гибридное антитело против v-интегрина по любому из пп.1-7, по существу, состоящее из:(i) вариабельной и константной последовательностей легкой цепи:(ii) вариабельной и константной последовательностей тяжелой цепи: 9. Гибридный белок, содержащий антитело по любому из пп.1-8, связанный на его С-конце с цитокином или фактором роста. 10. Молекула ДНК, кодирующая антитело по любому из пп.1-8. 11. Экспрессионный вектор, содержащий молекулу ДНК по п.10. 12. Клетка-хозяин млекопитающего, за исключением клетки человека, трансформированная экспрессионным вектором по п.11. 13. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая антитело по любому из пп.1-8 или гибридный белок по п.9, в фармацевтически эффективном количестве,вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом. 14. Фармацевтическая композиция, обладающая противоопухолевой активностью, содержащая первый и второй фармацевтически эффективные терапевтические агенты, где первый агент представляет собой сконструированное антитело по любому из пп.1-8 или гибридный белок по п.9, а второй агент выбран из группы, состоящей из химиотерапевтического агента, ингибитора ангиогенеза и противоопухолевого агента, вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом. 15. Фармацевтическая композиция по п.14, где противоопухолевый агент представляет собой противоопухолевое антитело. 16. Фармацевтическая композиция по п.15, где противоопухолевое антитело представляет собой антитело против EGFR или против Her2. 17. Фармацевтическая композиция по п.16, где противоопухолевое антитело представляет собой антитело против EGFR цетуксимаб или матузумаб. 18. Фармацевтическая композиция по п.14, где ингибитор ангиогенеза представляет собой ингибитор интегрина циленгитид. 19. Фармацевтическая композиция по п.14, где химиотерапевтический агент представляет собой цисплатин, DTIC или дакарбазин. 20. Применение сконструированного антитела по любому из пп.1-8 или гибридного белка по п.9 для получения лекарства для лечения солидных опухолей или опухолевых метастазов. 21. Применение фармацевтической композиции по любому из пп.13-19 для получения лекарства для лечения опухолей. 22. Применение фармацевтической композиции по п.16 для получения лекарства для лечения опухолей, где противоопухолевое антитело представляет собой антитело против EGFR. 23. Применение фармацевтической композиции по любому из пп.14-16 для получения лекарства для лечения опухолей, где первый агент представляет собой антитело по п.8 и антитело против EGFR представляет собой цетуксимаб.
МПК / Метки
МПК: A61P 35/00, A61K 39/395, C07K 16/28
Метки: антитела, против, сконструированные, альфа, гибридные, интегрина
Код ссылки
<a href="https://eas.patents.su/30-19485-skonstruirovannye-gibridnye-antitela-protiv-alfa-v-integrina.html" rel="bookmark" title="База патентов Евразийского Союза">Сконструированные гибридные антитела против альфа v интегрина</a>
Предыдущий патент: Способ получения сейсмических данных
Следующий патент: Производные индол-2-она, двузамещенные в положении 3, их получение и их применение в терапии
Случайный патент: Новые 7-замещенные производные 3-карбоксиоксадиазинохинолонов, способ их получения и применение в качестве антибактериальных средств












