Новые дигидроиндолоновые соединения, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 19481
Опубликовано: 30.04.2014
Авторы: Ортюно Жан-Клод, Лакост Жан-Мишель, Фейеш Имре, Пьерр Ален, Корди Алексис, Бёрбридж Майкл, Хикман Джон
Формула / Реферат
1. Соединения формулы (I)
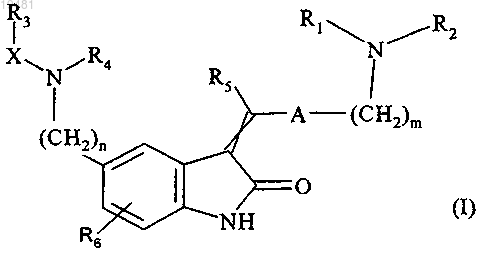
в которой m означает 1 или 2;
n означает 1 или 2;
А означает пирролильную группу, которая является незамещенной или замещенной посредством 1-3 линейных или разветвленных (C1-C6)алкильных групп;
X означает C(O), S(O) или SO2 группу;
R1 и R2 являются одинаковыми или разными и каждый означает линейную или разветвленную (C1-C6)алкильную группу или
R1 и R2 вместе с атомом азота, несущим их, образуют гетероциклическую группу;
R3 и R4 вместе с атомами, несущими их, образуют гетероциклическую группу;
R5 означает атом водорода или линейную или разветвленную (C1-C6)алкильную группу;
R6 означает атом водорода или атом галогена,
при этом предполагается, что
"гетероциклическая группа" означает моно- или бициклическую группу, которая может содержать от 5 до 8 атомов, от 1 до 3 гетероатомов, выбранных их азота, кислорода и серы, и одну или несколько ненасыщенных связей, причем таким образом определенная гетероциклическая группа может быть незамещенной или замещенной посредством одной или нескольких групп, выбранных из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (С2-С6)алкенила, оксо, гидрокси, линейного или разветвленного (C1-C6)алкокси, арила, арилалкила и арилалкенила;
"арил" означает фенильную группу, которая является незамещенной или замещенной посредством одной или нескольких групп, выбранных из атомов галогенов и линейных или разветвленных (C1-C6)алкильных групп;
![]() означает, что двойная связь имеет конфигурацию Z или Е,
означает, что двойная связь имеет конфигурацию Z или Е,
и их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, где n=1, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, где m=1, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, где R1 и R2 означают линейную или разветвленную (C1-C6)алкильную группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, где R1 и R2 вместе с атомом азота, несущим их, образуют 5- или 6-членную моноциклическую группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, где R1 и R2 вместе с атомом азота, несущим их, образуют морфолинильную группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, где R3 и R4 вместе с группой X и атомом азота, несущим их, образуют тиазолидиндионильную группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, где R5 означает атом водорода, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, где R6 означает атом водорода, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по п.1, где X означает группу С=О, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по п.1, где А означает 1H-пиррол-2,4-ильную группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по п.1, где R1 и R2 вместе с атомом азота, несущим их, образуют морфолинильную группу, m и n принимают значение 1, R5 и R6 означают атом водорода и А означает 1H-пиррол-2,4-ильную группу, их оптические и геометрические изомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Соединение формулы (I) по п.1, которое представляет собой 3-[(3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, его геометрические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Соединение формулы (I) по п.1, которое представляет собой 3-[((3Z)-3-{[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен}-2-оксо-2,3-дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион, а также его аддитивные соли с фармацевтически приемлемой кислотой или основанием.
15. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (II)
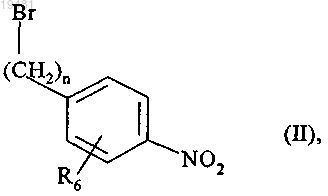
где n и R6 принимают значения, определенные в п.1,
с которым конденсируют в присутствии основания соединение формулы (III)
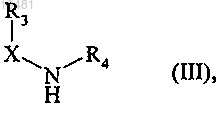
где X, R3 и R4 принимают значения, определенные в п.1,
с получением соединения формулы (IV)
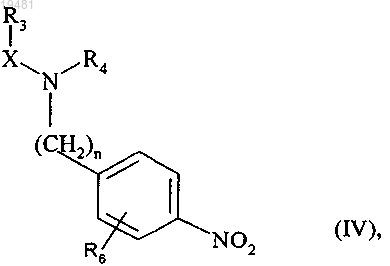
где n, X, R3, R4 и R6 принимают значения, определенные выше,
которое подвергают химическому или каталитическому гидрированию с получением соединения формулы (V)
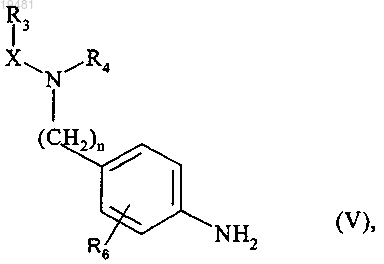
где n, X, R3, R4 и R6 принимают значения, определенные выше,
которое подвергают действию t-BuOCl в присутствии этил (метилсульфанил)ацетата, с последующим последовательным действием триэтиламина и соляной кислоты с получением соединения формулы (VI)
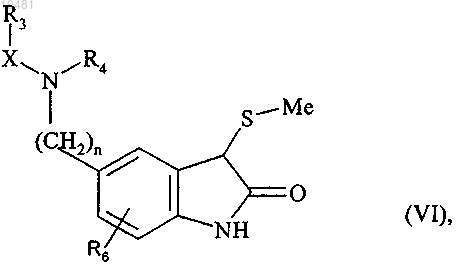
где n, X, R3, R4 и R6 принимают значения, определенные выше,
которое подвергают действию порошкообразного цинка, с получением соединения формулы (VII)

где n, X, R3, R4 и R6 принимают значения, определенные выше,
с которым конденсируют в присутствии пиперидина соединение формулы (VIII)
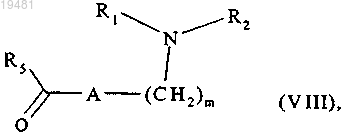
где m, A, R1, R2 и R5 принимают значения, определенные в п.1,
с получением после обработки кислотой соединения формулы (I), которое может быть очищено согласно обычным методам разделения, превращено в его аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделено на его изомеры согласно обычным методам разделения.
16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что используют в качестве исходного вещества соединение формулы (IX)
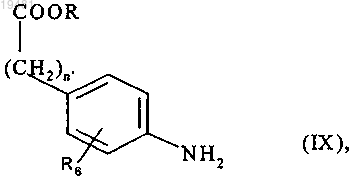
где n' означает 0 или 1, R означает линейную или разветвленную (C1-C6)алкильную группу и R6 принимает значения, определенные в п.1,
которое подвергают действию t-BuOCl в присутствии этил (метилсульфанил)ацетата с последующим последовательным действием триэтиламина и соляной кислоты с получением соединения формулы (X)
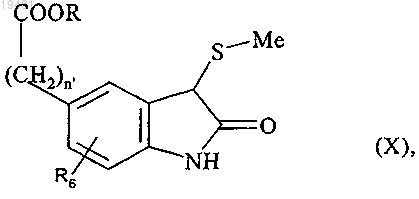
где n', R и R6 принимают значения, определенные выше,
которое подвергают действию порошкообразного цинка с получением соединения формулы (XI)
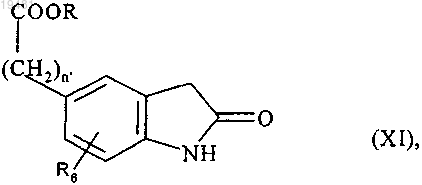
где n', R и R6 принимают значения, определенные выше,
которое помещают в восстановительную среду с получением соединения формулы (XII)

где n и R6 принимают значения, определенные выше,
с которым конденсируют в присутствии пиперидина соединение формулы (VIII)
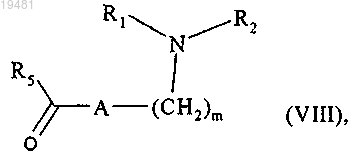
где m, A, R1, R2 и R5 принимают значения, определенные в п.1,
с получением после обработки кислотой соединения формулы (XIII)
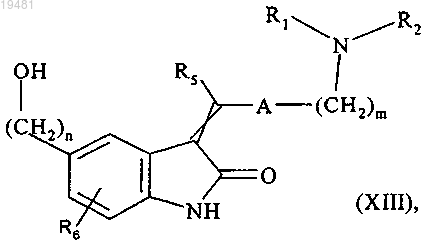
где m, n, A, R1, R2, R5 и R6 принимают значения, определенные выше,
с которым непосредственно конденсируют в присутствии трифенилфосфина и, например, этил азодикарбоксилата соединение формулы (III)
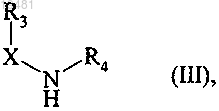
где X, R3 и R4 принимают значения, определенные в п.1,
с получением соединения формулы (I), которое может быть очищено согласно обычным методам разделения, превращено в его аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделено на его изомеры согласно обычным методам разделения.
17. Фармацевтические композиции, включающие по меньшей мере одно соединение формулы (I) по любому из пп.1-14 или его аддитивную соль с фармацевтически приемлемой кислотой или основанием в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
18. Применение фармацевтической композиции по п.17 для изготовления лекарственных средств, подавляющих миграцию клеток злокачественных опухолей.
19. Применение фармацевтической композиции по п.17 для изготовления лекарственных средств для лечения метастатических злокачественных опухолей.
20. Применение фармацевтической композиции по п.17 для изготовления лекарственных средств для лечения рака ободочной кишки, молочной железы, печени, почек, мозга, пищевода, меланом, миелом, рака яичника, немелкоклеточного рака легкого, мелкоклеточного рака легкого, рака предстательной железы и поджелудочной железы и сарком.
21. Комбинация соединения формулы (I) по любому из пп.1-14 с противоопухолевым препаратом, выбранным из генотоксичных агентов, митотических ядов, антиметаболитов, ингибиторов протеасомы и ингибиторов киназы.
22. Применение комбинации по п.21 при изготовлении лекарственных средств для применения при лечении злокачественных опухолей.
23. Применение соединения формулы (I) по любому из пп.1-14 совместно с радиотерапией при лечении злокачественных опухолей.
Текст
НОВЫЕ ДИГИДРОИНДОЛОНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХSO2 группу; R1 и R2 означают алкильную группу или вместе с атомом азота, несущим их, образуют гетероциклическую группу; R3 и R4 вместе с атомами, несущими их, образуют гетероциклическую группу; R5 означает атом водорода или алкильную группу; R6 означает атом водорода или атом галогена. Лекарственные средства.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Настоящее изобретение относится к новым дигидроиндолоновым соединениям, к способу их получения и к фармацевтическим композициям, содержащим их. Соединения настоящего изобретения являются новыми и обладают очень ценными фармакологическими характеристиками в области онкологии. Потребность в противоопухолевой терапии требует постоянной разработки новых противоопухолевых средств с целью получения лекарственных средств, которые одновременно являются и более активными, и лучше переносимыми. Одна из основных проблем в онкологии исходит из способности клеток злокачественных опухолей к миграции к другим местам из сформированной первичной опухоли. Миграция клеток представляет собой физиологический процесс, который является ключевым для эмбрионального развития и сохранения клеточного гомеостаза. Миграция вызывает появление существенных морфологических изменений и включает репрессию внутриклеточных сигнальных путей. Дерегуляция миграции клеток сильно вовлечена в злокачественные опухолевые патологии и, более конкретно, в процесс образования метастазов (Hanahan D. et al., 2000, Cell, 100, 57-70). Таким образом, особенно важно иметь возможность контролировать этот процесс, который неизбежно ведет к генерализированной злокачественной опухоли и верной смерти пациента. Соединения настоящего изобретения, помимо того, что являются новыми, имеют неожиданную invitro активность ингибирования миграции клеток злокачественных опухолей и, соответственно, развития опухолей. Таким образом, соединения настоящего изобретения обладают свойствами, которые делают их особенно полезными для лечения злокачественных опухолей и в особенности метастатических солидных опухолей. Настоящее изобретение более конкретно относится к соединениям формулы (I)n означает 1 или 2; А означает пирролильную группу, которая является незамещенной или замещенной посредством 1-3 линейных или разветвленных (C1-C6)алкильных групп;R1 и R2 являются одинаковыми или разными и каждый означает линейную или разветвленнуюR5 означает атом водорода или линейную или разветвленную (C1-C6)алкильную группу;R6 означает атом водорода или атом галогена,при этом предполагается, что"гетероциклическая группа" означает моно- или бициклическую группу, которая может содержать от 5 до 8 атомов, от 1 до 3 гетероатомов, выбранных их азота, кислорода и серы, и одну или несколько ненасыщенных связей, причем таким образом определенная гетероциклическая группа может быть незамещенной или замещенной посредством одной или нескольких групп, выбранных из линейного или разветвленного (C1-C6)алкила, линейного или разветвленного (С 1-С 6)алкенила, оксо, гидрокси, линейного или разветвленного (C1-C6)алкокси, арила, арилалкила и арилалкенила;"арил" означает фенильную группу, которая является незамещенной или замещенной посредством одной или нескольких групп, выбранных из атомов галогенов и линейных или разветвленных(C1-C6)алкильных групп; означает, что двойная связь имеет конфигурацию Z или Е,к их оптическим и геометрическим изомерам, а также их аддитивным солям с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот в этом отношении можно упомянуть, не подразумевая какого-либо ограничения, соляную, бромисто-водородную, серную, фосфоновую, уксусную, трифторуксусную, молочную, пировиноградную, малоновую, янтарную, глутаровую, фумаровую, винную, малеиновую, лимонную, аскорбиновую, щавелевую, метансульфоновую, камфорную кислоты и т.д. Среди фармацевтически приемлемых оснований в этом отношении можно упомянуть, не подразумевая какого-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтение отдают значению n и m, такому как 1.R1 и R2 преимущественно означают алкильную группу, такую как, например, этильная группа, или вместе с атомом азота, несущим их, образуют 5- или 6-членную моноциклическую группу, такую как,например, пиперидильная, морфолинильная, пирролидинильная, пиперазинильная или метилпиперазинильная группа, или бициклическую группу, имеющую от 6 до 8 членов, такую как, например, октагидроциклопентапирролильная или азабицикло[3.1.0]гексанильная группа. Предпочтительно R1 и R2 вместе с атомом азота, несущим их, образуют морфолинильную группу. Преимущественно R3 и R4 вместе с группой X и атомом азота, несущим их, образуют 5- или 6-членную моноциклическую группу, такую как, например, пирролидинонильная, пирролидиндионильная, оксазолидинонильная, оксазолидиндионильная, диметилоксазолидиндионильная, тиазолидинонильная, тиазолидиндионильная, диметилтиазолидиндионильная, имидазолидинонильная, имидазолидиндионильная, тиадиазинонильная или дигидротиадиазинонильная группа, или 6-членную бициклическую группу, такую как, например, азабицикло[3.1.0]гексанонильная или азабицикло[3.1.0]гександионильная группа. Предпочтение отдают R3 и R4, которые вместе с группой X и атомом азота, несущим их, образуют 2,4-диоксо-1,3-тиазолидин-3-ильную, 2,4-диоксо-1,3-оксазолидин-3-ильную, 2-оксо-1,3-тиазолидин-3 ильную, 2-оксо-1,3-оксазолидин-3-ильную, 4-гидрокси-2-оксо-1,3-тиазолидин-3-ильную или 2,4-диоксо 3-азабицикло[3.1.0]гекс-3-ильную группу.R5 преимущественно означает атом водорода или метильную или этильную группу.X предпочтительно означает C(O) группу. Предпочтение отдают А, такому как незамещенная пирролильная группа и, более конкретно,1H-пиррол-2,4-ильная группа. Изобретение предпочтительно относится к соединениям формулы (I), в которой R1 и R2 вместе с атомом азота, несущим их, образуют морфолинильную группу, m и n принимают значение 1, R5 и R6 означают атом водорода и А означает 1H-пиррол-2,4-ильную группу. Экзоциклическая двойная связь соединений формулы (I) имеет конфигурацию Z или Е, более конкретно конфигурацию Z. Еще более конкретно, изобретение относится к соединениям формулы (I), которые представляют собой 3-[(3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро-1H-индол-5 ил)метил]-1,3-тиазолидин-2,4-дион,3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро-1H-индол-5 илметил]оксазолидин-2,4-дион,3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксооксазолидин-3-илметил)-1,3 дигидроиндол-2-он,5-(4-гидрокси-2-оксотиазолидин-3-илметил)-3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)1,3-дигидроиндол-2-он,(1R,5S)-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро-1H-индол-5 илметил]-3-азабицикло[3.1.0]гексан-2,4-дион,3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксотиазолидин-3-илметил)-1,3 дигидроиндол-2-он,3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)пропилиден]-2-оксо-2,3-дигидро-1H-индол-5 илметилтиазолидин-2,4-дион,3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-2-оксо-2,3-дигидро-1H-индол-5 илметилтиазолидин-2,4-дион. Оптические и геометрические изомеры предпочтительных соединений изобретения, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием образуют неотъемлемую часть изобретения. Изобретение также относится к способу получения соединений формулы (I), отличающемуся тем,что в качестве исходного вещества используют соединение формулы (II) где n и R6 принимают значения, определенные для формулы (I),с которым конденсируют в присутствии основания соединение формулы (III) где X, R3 и R4 принимают значения, определенные для формулы (I),с получением соединения формулы (IV) где n, X, R3, R4 и R6 принимают значения, определенные выше,которое подвергают химическому или каталитическому гидрированию с получением соединения формулы (V) где n, X, R3, R4 и R6 принимают значения, определенные выше,которое подвергают действию т-BuOCl в присутствии этил (метилсульфанил)ацетата с последующим последовательным действием триэтиламина и соляной кислоты с получением соединения формулы (VI) где n, X, R3, R4 и R6 принимают значения, определенные выше,которое подвергают действию порошкообразного цинка с получением соединения формулы (VII) где n, X, R3, R4 и R6 принимают значения, определенные выше,с которым конденсируют в присутствии пиперидина соединение формулы (VIII) где m, A, R1, R2 и R5 принимают значения, определенные для формулы (I),с получением после обработки кислотой соединения формулы (I), которое может быть очищено согласно обычным методам разделения, превращено, при необходимости, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделено, когда это уместно, на его изомеры согласно обычным методам разделения. Соединения формул (II), (III) и (VIII) являются либо доступными для приобретения, либо доступны специалисту в данной области техники посредством обычных химических реакций или химических реакций, описанных в литературе. Предпочтительный вариант относится к способу получения соединений формулы (I), отличающемуся тем, что используют в качестве исходного вещества соединение формулы (IX) где n' означает 0 или 1, R означает линейную или разветвленную (C1-C6)алкильную группу и R6 принимает значения, определенные для формулы (I),которое подвергают действию t-BuOCl в присутствии этил (метилсульфанил)ацетата с последующим последовательным действием триэтиламина и соляной кислоты с получением соединения формулы (X) где n', R и R6 принимают значения, определенные выше,которое подвергают действию порошкообразного цинка с получением соединения формулы (XI) где n', R и R6 принимают значения, определенные выше,которое помещают в восстановительную среду с получением соединения формулы (XII) где n и R6 принимают значения, определенные выше,с которым конденсируют в присутствии пиперидина соединение формулы (VIII) где m, A, R1, R2 и R5 принимают значения, определенные для формулы (I),с получением после обработки кислотой соединения формулы (XIII) где m, n, A, R1, R2, R5 и R6 принимают значения, определенные выше,с которым непосредственно конденсируют в присутствии трифенилфосфина и, например, этил азодикарбоксилата соединение формулы (III) где X, R3 и R4 принимают значения, определенные для формулы (I),с получением соединения формулы (I), которое может быть очищено согласно обычным методам разделения, превращено, при необходимости, в его аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделено, когда это уместно, на его изомеры согласно обычным методам разделения. Соединения формул (III), (VIII) и (IX) являются либо доступными для приобретения, либо доступны специалисту в данной области техники посредством обычных химических реакций или химических реакций, описанных в литературе. Фармакологическое исследование соединений изобретения показало их способность подавлять миграцию клеток злокачественных опухолей. Это свойство поэтому представляет главную терапевтическую ценность при лечении рака, более конкретно - при лечении метастатических злокачественных опухолей. Из числа злокачественных опухолей, лечение которых представляется возможным, в этом отношении можно упомянуть, без ограничения перечисленным, рак ободочной кишки, молочной железы, печени, почки, мозга, пищевода, меланомы, миеломы, рак яичника, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак предстательной железы и поджелудочной железы и саркомы. Настоящее изобретение также относится к фармацевтическим композициям, включающим по меньшей мере одно соединение формулы (I) само по себе или в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Среди фармацевтических композиций в соответствии с изобретением в этом отношении можно упомянуть более конкретно те, которые пригодны для перорального, парентерального, назального, подили чрескожного, ректального, чрезъязычного, глазного или респираторного введения, главным образом таблетки или драже, подъязычные таблетки, саше, пакетики, капсулы, таблетки для медленного растворения под языком, пастилки, суппозитории, кремы, мази, гели для кожи и ампулы с пригодным для питья или инъецируемым содержимым. Пригодная дозировка варьируется в зависимости от пола, возраста и веса пациента, пути введения,природы терапевтического показания и каких-либо сопутствующих лечений и находится в диапазоне от 0,01 мг до 1 г в расчете на 24 ч за одно или несколько введений. Кроме того, настоящее изобретение также относится к ассоциации соединения формулы (I) с противоопухолевым препаратом, выбранным из генотоксичных агентов, митотических ядов, антиметаболитов, ингибиторов протеасомы и ингибиторов киназы, а также к применению такого типа ассоциации при изготовлении лекарственных средств для применения при лечении злокачественных опухолей. Соединения изобретения при лечении злокачественных опухолей можно также применять совместно с радиотерапией. Синтезы и примеры, которые следуют далее, иллюстрируют изобретение, не ограничивая его каким-либо способом. Температуры плавления измерены в капиллярном приборе. Синтез 1. 4-Морфолин-4-илметил-1H-пиррол-2-карбальдегид. К раствору морфолина (0,38 моль) в уксусной кислоте (120 мл) при 0 С добавляют раствор 1 Н-пиррол-2-карбальдегида (0,32 моль) в уксусной кислоте (100 мл). Затем по каплям добавляют формальдегид (37%-ный водн., 26 мл). Реакционную смесь затем перемешивают в течение 65 ч при температуре окружающей среды. Смесь концентрируют (около 50 мл) и охлаждают на ледяной бане. Значение рН раствора делают щелочным (pH 12), используя 20%-ный водный раствор гидроксида натрия. Продукт экстрагируют дихлорметаном (ДХМ) (3250 мл). Органические фазы объединяют. Полученную органическую фазу промывают насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный остаток (масло) очищают на силикагеле (SiO2, градиент ДХМ/MeOH) с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 195,1124 (M+H)+. Синтез 2. 1-(4-Морфолин-4-илметил-1H-пиррол-2-ил)этанон. К раствору морфолина (22 ммоль) в уксусной кислоте (60 мл) при 0 С добавляют 1-(1H-пиррол-2 ил)этанон (20 ммоль) и 37%-ный формальдегид (20 ммоль) в воде. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. При 0 С рН раствора доводят до щелочных значений(10-12), используя 20%-ный водный раствор NaOH, и затем экстрагируют ДХМ. Органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Очистка с помощью флэш-хроматографии на силикагеле (SiO2; градиент ДХМ/MeOH) приводит к получению указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 209,1289 (М+Н)+. Синтез 3. 4-[(1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил]-3,5-диметил-1H-пиррол-2-карбальдегид. К раствору (1R,5S)-3-азабицикло[3.1.0]гексана (10 ммоль) в уксусной кислоте (10 мл) добавляют 10 ммоль 3,5-диметил-1 Н-пиррол-2-карбальдегида и 37%-ного формальдегида (11 ммоль) в воде. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды и затем упаривают досуха. Очистка с помощью флэш-хроматографии на силикагеле (SiO2; гептан/AcOEt) и затем растирание в гептане приводят к получению указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 219,1503 (М+Н)+. Синтез 4. 4-1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на(1R,5S)-3-азабицикло[3.1.0]гексан. Масс-спектрометрия (ES+, m/z): 191,1179 (М+Н)+. Синтез 5. 1-(4-Морфолин-4-илметил-1H-пиррол-2-ил)пропан-1-он. К раствору морфолина (89,3 ммоль) в уксусной кислоте (50 мл) при 0 С добавляют 1-(1H-пиррол-2 ил)пропан-1-он (81,2 ммоль) и 37%-ный формальдегид (89,3 ммоль) в воде. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. После концентрации смеси рН раствора доводят до щелочных значений (10-12), используя 20%-ный водный раствор NaOH при 0 С, и затем экстрагируют ДХМ. Органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют, упаривают досуха и очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент 100% AcOEt-AcOEt/MeOH 9/1) с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 223,1444 (М+Н)+. Синтез 6. 1-Метил-4-морфолин-4-илметил-1H-пиррол-2-карбальдегид и 1-метил-5-морфолин-4 илметил-1H-пиррол-2-карбальдегид. К раствору морфолина (130 ммоль) в уксусной кислоте (60 мл) при 0 С добавляют 1-метил-1Hпиррол-2-карбальдегид (110 ммоль) и 37%-ный формальдегид (110 ммоль) в воде. Реакционную смесь перемешивают в течение 16 ч при 50 С. После упаривания досуха добавляют около 100 мл 25%-ного водного раствора гидроксида натрия. После экстрагирования ДХМ органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент AcOEt/MeOH) с получением указанных в заголовке продуктов - 1-метил-4-морфолин-4-илметил-1H-пиррол-2-карбальдегида и 1-метил-5-морфолин-4-илметил-1H-пиррол-2-карбальдегида в соотношении 1/5. 1-Метил-4-морфолин-4-илметил-1H-пиррол-2-карбальдегид. Масс-спектрометрия (ES+, m/z): 209,1282 (М+Н)+. 1-Метил-5-морфолин-4-илметил-1H-пиррол-2-карбальдегид. Масс-спектрометрия (ES+, m/z): 209,1286 (М+Н)+. Синтез 7. 5-Морфолин-4-илметил-1H-пиррол-2-карбальдегид. Стадия А. 4-(1 Н-Пиррол-2-илметил)морфолин. К раствору морфолина (22 ммоль) в уксусной кислоте (10 мл) по каплям при 0 С добавляют пиррол(20 ммоль). Затем по каплям добавляют формальдегид (37%-ный водн., 20 ммоль). Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды. Раствор охлаждают до 0 С и рН доводят до щелочных значений (10-11), используя 20%-ный водный раствор NaOH. После экстрагирования ДХМ органические фазы промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха с получением указанного в заголовке продукта в виде белого твердого вещества, которое непосредственно используют на следующей стадии. Стадия Б. 5-Морфолин-4-илметил-1 Н-пиррол-2-карбальдегид. К раствору ДМФА (18,04 ммоль) в ДХМ (10 мл) по каплям при 0 С добавляют POCl3. После перемешивания в течение 5 мин по каплям добавляют раствор соединения, полученного на стадии А,(9,02 ммоль). После перемешивания в течение 3 ч при 0 С реакционную смесь нагревают при 40 С в течение 30 мин. При температуре окружающей среды добавляют водный раствор ацетата калия (32 ммоль) и затем реакционную смесь перемешивают при 40 С в течение 30 мин. При температуре окружающей среды рН раствора доводят до щелочных значений, используя 2 М раствор NaOH, и затем экстрагируют ДХМ. Органическую фазу промывают водой и насыщенным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный остаток очищают на силикагеле (SiO2; градиент ДХМ/AcOEt) с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 195,1150 (М+Н)+. Синтез 8. 3-Морфолин-4-илметил-1H-пиррол-2-карбальдегид. Стадия А. 4-(1-Триизопропилсиланил-1 Н-пиррол-3-илметил)морфолин. К раствору морфолина (98,5 ммоль) в уксусной кислоте (100 мл) при 0 С добавляют 1-триизопропилсиланил-1H-пиррол (89,5 ммоль) и 37%-ный формальдегид (89,5 ммоль) в воде. Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. рН раствора доводят до щелочных значений (10-12), используя 20%-ный водный раствор NaOH, и затем экстрагируют ДХМ. Органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный остаток очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент ДХМ/AcOEt) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. 4-(1 Н-Пиррол-3-илметил)морфолин. К раствору соединения, полученного на стадии А, (75 ммоль) в ТГФ (100 мл) по каплям при 0 С добавляют 1 M Bu4NF в ТГФ (75,0 ммоль). После перемешивания при 0 С в течение 1 ч раствор выливают на лед и затем экстрагируют ДХМ. Органические фазы объединяют и затем промывают насыщенным водным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 3-Морфолин-4-илметил-1 Н-пиррол-2-карбальдегид. К раствору ДМФА (66 ммоль) в ДХМ по каплям при 0 С добавляют POCl3. После перемешивания в течение 5 мин по каплям добавляют раствор соединения, полученного на стадии Б, (33 ммоль) в ДХМ(60 мл). После перемешивания в течение 4 ч при 0 С и в течение 30 мин при нагревании с обратным холодильником добавляют водный раствор ацетата натрия (110 ммоль). После дополнительных 30 мин нагревания с обратным холодильником при температуре окружающей среды, пока рН не станет щелочным(9-10), добавляют 2 М водный раствор гидроксида натрия. Раствор перемешивают в течение 2 ч при температуре окружающей среды и затем добавляют 300 мл ДХМ. После экстрагирования ДХМ органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия,фильтруют и упаривают досуха. Полученный остаток очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент ДХМ/AcOEt) с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 195,1134 (М+Н)+. Синтез 9. 5-Диэтиламинометил-1 Н-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 7 с заменой морфолина на диэтиламин. Масс-спектрометрия (ES+, m/z): 181,1340 (М+Н)+. Синтез 10. 4-(4-Метилпиперазин-1-илметил)-1 Н-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на 1-метилпиперазин. Масс-спектрометрия (ES+, m/z): 208,1436 (M+H)+. Синтез 11. 4-Пирролидин-1-илметил-1 Н-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на пирролидин. Масс-спектрометрия (ES+, m/z): 179,1183 (М+Н)+. Синтез 12. 4-3aR,6aR)-Гексагидроциклопента[с]пиррол-2-(1 Н)-илметил)-1 Н-пиррол-2 карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на(3aR,6aS)-гексагидроциклопента[с]пиррол. Масс-спектрометрия (ES+, m/z): 193,1349 (М+Н)+. Синтез 14. 4-Диэтиламинометил-1 Н-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на диэтиламин. Масс-спектрометрия (ES+, m/z): 181,1342 (М+Н)+. Синтез 15. 4-3aR,6aS)-Гексагидроциклопента[с]пиррол-2(1H)-илметил)-3,5-диметил-1H-пиррол-2 карбальдегид. Методика аналогична таковой,приведенной в синтезе 3 с заменой(1R,5S)-3-азабицикло[3.1.0]гексана на (3aR,6aS)-гексагидроциклопента[с]пиррол. Масс-спектрометрия (ES+, m/z): 247,1785 (М+Н)+. Синтез 16. 5-Морфолин-4-илметил-1H-пиррол-3-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой 1H-пиррол-2-карбальдегида на 1H-пиррол-3-карбальдегид. Масс-спектрометрия (ES+, m/z): 195,1133 (М+Н)+. Синтез 17. 5-1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-3-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой 1H-пиррол-2-карбальдегида на 1H-пиррол-3-карбальдегид и заменой морфолина на (1R,5S)-3-азабицикло[3.1.0]гексан. Масс-спектрометрия (ES+, m/z): 191,1175 (М+Н)+. Синтез 18. 4-[2-(Пирролидин-1-ил)этил]-1H-пиррол-2-карбальдегид. Стадия А. 2,2,2-Трихлор-1-(1H-пиррол-2-ил)этанон. К раствору трихлорацетилхлорида (160,7 ммоль) в этиловом эфире (26 мл) по каплям на протяжении 3 ч добавляют раствор пиррола (149 ммоль) в этиловом эфире (83 мл). После перемешивания в течение дополнительного часа по каплям добавляют раствор карбоната калия (94 ммоль) в воде (39 мл). Фазы разделяют и органическую фазу сушат над сульфатом натрия и фильтруют. К этой органической фазе добавляют активированный уголь. После перемешивания в течение 5 мин органическую фазу фильтруют и упаривают досуха с получением указанного в заголовке продукта. Стадия Б. 5-(Трихлорацетил)-1H-пиррол-3-карбальдегид. К раствору соединения, полученного на стадии А, (87 ммоль) и AlCl3 в смеси ДХМ/нитрометан(80 мл/80 мл) по каплям при -30 С добавляют дихлорметоксиметан (130,5 ммоль). После перемешивания в течение 2 ч реакционную смесь выливают в 800 мл воды со льдом. Водную фазу экстрагируют AcOEt и затем органические фазы объединяют. Органическую фазу промывают насыщенным водным растворомNaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха с получением указанного в заголовке продукта (коричневые кристаллы), который непосредственно используют на следующей стадии. Стадия В. Этил 4-формил-1H-пиррол-2-карбоксилат. К раствору соединения, полученного на стадии Б, (83,7 ммоль) в этаноле (200 мл) по каплям и в течение 20 мин при температуре окружающей среды добавляют раствор этилата натрия (13,4 ммоль) в этаноле (45 мл). После перемешивания в течение 3 ч смесь упаривают досуха и затем переносят в этиловый эфир (200 мл). К такой органической фазе добавляют водный 2 н. раствор HCl (150 мл) и получающуюся смесь перемешивают; фазы затем разделяют и водную фазу экстрагируют этиловым эфиром. Органическую фазу промывают насыщенным водным раствором NaHCO3 и насыщенным водным раствором NaCl,сушат над сульфатом натрия, фильтруют и упаривают досуха с получением указанного в заголовке продукта (коричневые кристаллы), который непосредственно используют на следующей стадии. Стадия Г. Этил 4-[(диметиламино)метил]-1H-пиррол-2-карбоксилат. К раствору соединения, полученного на стадии В, и диметиламина (1,1 экв.) порциями добавляютNaBH(OAc)3 (952 мг). Смесь перемешивают в течение ночи при температуре окружающей среды. После упаривания досуха остаток вносят в CH2Cl2 и воду. Водную фазу экстрагируют CH2Cl2. Органические фазы объединяют и затем экстрагируют водным 1 н. раствором HCl. Водную фазу делают щелочной и затем экстрагируют CH2Cl2. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Д. Йодид [5-(этоксикарбонил)-1H-пиррол-3-ил]-N,N,N-триметилметанаминия. К раствору продукта, полученного на стадии Г, (0,3 г) в смеси тетрагидрофурана (2,2 мл) и CH2Cl2(2,2 мл) добавляют метилйодид (0,350 мл). Появляется осадок. Реакционную смесь перемешивают в течение 1 ч при температуре окружающей среды и затем оставляют при 4 С на всю ночь. Реакционную смесь упаривают досуха и полученный остаток непосредственно используют на следующей стадии. Стадия Е. Этил 4-(цианометил)-1H-пиррол-2-карбоксилат. Раствор продукта, полученного на стадии Д, и цианид натрия (0,225 г) в этаноле нагревают с обратным холодильником в течение 72 ч. После упаривания досуха остаток вносят в смесь CH2Cl2/вода. Водную фазу трижды экстрагируют CH2Cl2. Органические фазы объединяют. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Ж. Этил 4-(2-аминоэтил)-1H-пиррол-2-карбоксилат. К раствору продукта, полученного на стадии Е, (7,45 г) в MeOH (1,5 л) добавляют 223 мл 1,4 н. раствора NH3 в MeOH и PtO2 (5,2 г). Реакционную смесь помещают под атмосферу водорода и затем перемешивают в течение 20 ч при температуре окружающей среды. После фильтрования и упаривания досуха полученный остаток очищают на силикагеле (SiO2: градиент CH2Cl2/MeOH с добавлением 1,4 н. NH3 вMeOH) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия З. Этил 4-[2-(пирролидин-1-ил)этил]-1H-пиррол-2-карбоксилат. К раствору продукта, полученного на стадии Ж, (1,3 г) в ДМФА (134 мл) добавляют 2,6-лутидин(4,15 мл) и 1,4-дибромбутан (4,68 мл). Реакционную смесь перемешивают при 80 С в течение 12 ч и при температуре окружающей среды в течение ночи. Реакционную смесь разбавляют 600 мл этилацетата. Органическую фазу промывают насыщенным водным раствором NaHCO3, водой и насыщенным водным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают досуха. Полученный остаток очищают на силикагеле (SiO2: градиент CH2Cl2/MeOH с добавлением 1,4 н. NH3 в MeOH) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия И. 4-[2-(Пирролидин-1-ил)этил]-1H-пиррол-2-илметанол. К раствору продукта, полученного на стадии З (0,2 г) в ТГФ (10 мл) при 0 С порциями добавляют алюмогидрид лития. После перемешивания в течение 3 ч при температуре окружающей среды реакционную смесь гидролизуют при 0 С водн. раствором NaOH и водой. После фильтрования фильтрат упаривают досуха и полученный остаток очищают на силикагеле (SiO2: градиент CH2Cl2/MeOH с добавлением 1,4 н. NH3 в MeOH) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия К. 4-[2-(Пирролидин-1-ил)этил]-1 Н-пиррол-2-карбальдегид. К раствору продукта, полученного на стадии И, (0,09 г) в ТГФ (3,8 мл) добавляют активированныйMnO2 (0,315 г). После перемешивания в течение 20 ч при температуре окружающей среды смесь фильтруют и фильтрат упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Синтез 19. 4-[2-(Морфолин-4-ил)этил]-1H-пиррол-2-карбальдегид. Указанный в заголовке продукт получают, как описано в синтезе 18, с заменой 1,4-дибромбутана на стадии З на 1-бром-2-(2-бромэтокси)этан. Синтез 20. 5-[(3aR,6aR)-Гексагидроциклопента[с]пиррол-2(1H)-илметил]-1H-пиррол-2 карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на(3aR,6aS)-гексагидроциклопента[с]пиррол. Масс-спектрометрия (ES+, m/z): 219,1494 (М+Н)+. Синтез 21. 4-[(4-Метоксипиперидин-1-ил)метил]-1H-пиррол-2-карбальдегид. Методика аналогична таковой, приведенной в синтезе 1 с заменой морфолина на 4-метоксипиперидин. Синтез 22. 4-(Морфолин-4-илметил)-1H-пиррол-3-карбальдегид. Стадия А. Метил 4-(морфолин-4-илкарбонил)-1H-пиррол-3-карбоксилат. К раствору 4-(метоксикарбонил)-1H-пиррол-3-карбоновой кислоты (2,35 г) в ДМФА (49 мл) добавляют диизопропилэтиламин (2,11 мл) и HATU (4,9 мл). После перемешивания в течение 15 мин при 40 С добавляют морфолин (1,35 мл). После перемешивания в течение 9 ч при 60 С и при температуре окружающей среды в течение выходных дней смесь разбавляют CH2Cl2 и 1 н. раствором гидроксида натрия. Водную фазу 3 раза экстрагируют CH2Cl2 и органические фазы объединяют. Органическую фазу сушат над сульфатом магния, фильтруют и упаривают досуха с получением указанного в заголовке продукта,который непосредственно используют на следующей стадии. Стадия Б. [4-(Морфолин-4-илметил)-1H-пиррол-3-ил]метанол. Указанный в заголовке продукт получают с использованием протокола, описанного на стадии И синтеза 18 и исходя из продукта, полученного на стадии А. Стадия В. 4-Морфолин-4-илметил-1H-пиррол-3-карбальдегид. Указанный в заголовке продукт получают с использованием протокола, описанного на стадии К синтеза 18 и исходя из продукта, полученного на стадии Б. Работая таким же образом, как в синтезе 1, исходя из подходящих реагентов, получают следующий продукт. Синтез 23. 4-[(2-Метил-4-морфолинил)метил]-1H-пиррол-2-карбальдегид. Пример 1. Гидрохлорид 3-[(3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3 дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона. Стадия А. Этил 3-метилсульфанил-2-оксо-2,3-дигидро-1H-индол-5-карбоксилат. К раствору этил 4-аминобензоата (40,0 г) в ДХМ (900 мл) при -60 С под атмосферой азота по каплям добавляют этил (метилсульфанил)ацетат (34,5 мл). Затем к реакционной смеси по каплям в течение 25 мин, поддерживая температуру между -60 и -55 С, добавляют 29,0 г t-BuOCl. После перемешивания в течение 1 ч при -50 С по каплям добавляют триэтиламин (15,4 мл). Реакционную смесь доводят до 0 С и затем по каплям добавляют водный 3 М раствор HCl (485 мл). После перемешивания в течение 12 ч при температуре окружающей среды фазы разделяют и органическую фазу последовательно промывают водн. 2 М раствором HCl, водой и затем насыщ. водным раствором NaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный остаток вносят в эфир. Полученные кристаллы отфильтровывают, промывают эфиром и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. Этил 2-оксо-2,3-дигидро-1H-индол-5-карбоксилат. К раствору соединения, полученного на стадии А, (0,1448 моль) в ледяной уксусной кислоте(700 мл) добавляют порошкообразный цинк (0,8690 моль). Двухфазную смесь перемешивают при 40 С в течение 8 ч. Реакционную смесь фильтруют и фильтрат затем упаривают досуха. Остаток перемешивают в воде в течение ночи и отфильтровывают и полученный осадок промывают водой. Продукт вносят в толуол и упаривают досуха и затем вносят в эфир, отфильтровывают, промывают эфиром и затем сушат в вакууме при 40 С под Р 2 О 5 с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 5-Гидроксиметил-1,3-дигидроиндол-2-он. К раствору/суспензии соединения, полученного на стадии Б, (66,8 ммоль) в ТГФ (850 мл) в течение 1 ч и под инертной атмосферой при -65 С по каплям добавляют 1 М раствор DIBAL-H (546 ммоль). Реакционную смесь в течение 1 ч 30 мин доводят до -30 С. По каплям добавляют 22 мл воды и затем 22 мл 15%-ного водного раствора гидроксида натрия при 0 С и затем 55 мл воды. К реакционной смеси добавляют MgSO4 (300 г) и перемешивание осуществляют в течение 30 мин. Суспензию отфильтровывают на целите и промывают ТГФ. Фильтрат упаривают досуха с получением пастообразного вещества коричневого цвета. Остаток растирают в метаноле и полученный порошок отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Г. 5-Гидроксиметил-3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-1,3-дигидроиндол 2-он. Раствор соединения, полученного на стадии В, (18 ммоль) и соединения, полученного в синтезе 1,(19 ммоль) и пиперидина (18 ммоль) в этаноле нагревают с обратным холодильником. Через 40 мин реакционную смесь охлаждают на ледяной бане. Образуемый осадок отфильтровывают и промывают холодным этанолом. Полученный продукт вносят в толуол, нагревают с обратным холодильником в течение 5 мин и затем упаривают досуха и сушат в вакууме с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2). Масс-спектрометрия (ES+, m/z): 340,1657 (М+Н)+ и 340,1668 (М+Н)+. Стадия Д. Гидрохлорид 3-[(3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3 дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона. 15,4 ммоль тиазолидин-2,4-диона и трифенилфосфин на смоле - подложке (3 ммоль/г, 30,8 ммоль) перемешивают под инертной атмосферой в течение 10 мин при температуре окружающей среды в безводном ТГФ. Смесь охлаждают на ледяной бане и добавляют трет-бутил азодикарбоксилат (15,4 ммоль). После перемешивания в течение 10 мин при 0 С добавляют соединение, полученное на стадии Г,(10,2 ммоль). После перемешивания в течение 1 ч 30 мин при 0 С смесь фильтруют и смолу промывают ТГФ. Фильтрат упаривают досуха и затем хроматографируют на кремнеземе. Полученный продукт вносят в смесь ДХМ/метанол (4/1) (150 мл) и затем добавляют 1,25 М раствор HCl в этаноле (10 мл). Раствор концентрируют до приблизительно 15 мл и затем охлаждают на ледяной бане. Образуемые кристаллы отфильтровывают под азотом, промывают холодным этанолом и сушат в вакууме при 40 С с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 439,1439 (М+Н)+ и 439,1431 (М+Н)+. Температура плавления: 211 С. Пример 1 а. Гидрохлорид 3-[(3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3 дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона. Указанное в заголовке соединение получают с помощью очистки на силикагеле (SiO2, градиентCH2Cl2/MeOH) соединения, полученного на стадии Д примера 1, перед превращением в соль и затем превращения его в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (1,5/98,5). Масс-спектрометрия (ES+, m/z): 439,1422 (М+Н)+ и 439,1448 (М+Н)+. Элементарный микроанализ: Пример 1b. 3-[(3-[4-(4-Морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро-1Hиндол-5-ил)метил]-1,3-тиазолидин-2,4-дион. 15,4 ммоль тиазолидин-2,4-диона и трифенилфосфин на смоле - подложке (3 ммоль/г, 30,8 ммоль) перемешивают под инертной атмосферой в течение 10 мин при температуре окружающей среды в безводном ТГФ. Смесь охлаждают на ледяной бане и добавляют трет-бутил азодикарбоксилат (15,4 ммоль). После перемешивания в течение 10 мин при 0 С добавляют соединение, полученное на стадии Г примера 1 (10,2 ммоль). После перемешивания в течение 1 ч 30 мин при 0 С смесь фильтруют и смолу промывают ТГФ. Фильтрат упаривают досуха и затем хроматографируют на кремнеземе. Масс-спектрометрия (ES+, m/z): 439,1435 (М+Н)+. Пример 2. Гидрохлорид 3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-2-оксо-2,3 дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Стадия А. 5-Гидроксиметил-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-1,3 дигидроиндол-2-он. Раствор соединения, полученного на стадии В примера 1, (2,5 ммоль), соединение, полученное в синтезе 2, (2,9 ммоль) и ацетат аммония (5,2 ммоль) в этаноле (4 мл) нагревают при 120 С в микроволновой печи в течение 20 мин. Полученный осадок отфильтровывают, промывают этанолом и этиловым эфиром и затем сушат в вакууме с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 354,1799 (М+Н)+ и 354,1793 (М+Н)+. Стадия Б. Гидрохлорид 3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-2-оксо-2,3 дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (1,3 ммоль) и тиазолидин-2,4-диона(1,7 ммоль). Полученный после обработки продукт очищают на силикагеле (SiO2; градиентAcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 453,1586 (М+Н)+ и 453,1600 (М+Н)+. Температура плавления: 225 С. Элементарный микроанализ: Пример 3. Гидрохлорид 3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро 1H-индол-5-илметил]оксазолидин-2,4-диона. Стадия А. Оксазолидин-2,4-дион. К раствору NaOMe (1,05 ммоль) в MeOH (21 мл) добавляют 2-гидроксиацетамид (1 ммоль) и диэтилкарбонат (1,15 ммоль) и реакционную смесь затем нагревают с обратным холодильником в течение 1,5 ч. Реакционную смесь упаривают досуха и затем переносят в воду. Водную фазу экстрагируют диэтиловым эфиром. Водную фазу подкисляют (рН 2) и затем упаривают досуха. Остаток растирают в AcOEt и фильтруют. Полученный продукт очищают на силикагеле (ц-гексан/AcOEt; 1/1) с получением указанного в заголовке продукта в виде белого порошка. Стадия Б. Гидрохлорид 3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро 1H-индол-5-илметил]оксазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии Г примера 1, (4,8 ммоль) и соединения, полученного на стадии А (7,31 ммоль). Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH ) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Масс-спектрометрия (ES+, m/z): 423,1670 (М+Н)+ и 423,1697 (М+Н)+. Температура плавления: 216 С. Элементарный микроанализ: Пример 4. Гидрохлорид 3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-2-оксо-2,3 дигидро-1H-индол-5-илметилоксазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации продукта, полученного на стадии А примера 2, (1,54 ммоль) и соединения, полученного на стадии А примера 3 (2,31 ммоль). Полученный после обработки продукт реакционной смеси очищают на силикагеле (SiO2; градиент AcOEt - AcOEt/MeOH, 9/1) и затем превращают в гидрохлорид,как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 437,1816 (М+Н)+ и 437,1837 (М+Н)+. Температура плавления: 220 С. Элементарный микроанализ: Пример 5. Гидрохлорид 3-3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Hпиррол-2-илметилен]-2-оксо-2,3-дигидро-1H-индол-5-илметилоксазолидин-2,4-диона. Стадия А. 3-[4-1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил)-3,5-диметил-1 Н-пиррол-2-илметилен]5-гидроксиметил-1,3-дигидроиндол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Г примера 1,путем конденсации соединения, полученного на стадии В примера 1, (0,92 ммоль) и соединения, полученного в синтезе 3, (1 ммоль) в присутствии пиперидина в этаноле при 105 С при микроволновой активации. После фильтрования полученное твердое вещество очищают на силикагеле (SiO2; градиентAcOEt/MeOH) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2). Масс-спектрометрия (ES+, m/z): 362,1875 (М-Н)+ и 362,1883 (М-Н)+. Стадия Б. Гидрохлорид 3-3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Hпиррол-2-илметилен]-2-оксо-2,3-дигидро-1H-индол-5-илметилоксазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (0,63 ммоль) и оксазолидин-2,4-диона(0,95 ммоль). Полученный после обработки продукт реакционной смеси очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 445,1865 (М-Н)+ и 445,1846 (М-Н)+. Элементарный микроанализ: Пример 6. Гидрохлорид 1-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро 1H-индол-5-илметил]пирролидин-2,5-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на пирролидин-2,5-дион. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Пример 7. Гидрохлорид 5,5-диметил-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо 2,3-дигидро-1H-индол-5-илметил]оксазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на 5,5-диметилоксазолидин-2,4-дион. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (96/4). Масс-спектрометрия (ES+, m/z): 451,1981 (М+Н)+ и 451,1981 (М+Н)+. Температура плавления: 191 С. Элементарный микроанализ: Пример 8. Гидрохлорид 1-метил-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]имидазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на 1-метилимидазолидин-2,4-дион. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97,5/2,5). Масс-спектрометрия (ES+, m/z): 436,1981 (М+Н)+ и 436,2001 (М+Н)+. Элементарный микроанализ: Пример 9. Гидрохлорид 5-(4-хлорбензилиден)-3-[3-(4-морфолин-4-илметил-1H-пиррол-2 илметилен)-2-оксо-2,3-дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Стадия А. 5-(4-Хлорбензилиден)тиазолидин-2,4-дион. Раствор 4-хлорбензальдегида (3 ммоль), тиазолидин-2,4-диона (3 ммоль) и пиперидина (3 ммоль) в этаноле нагревают с обратным холодильником в течение ночи. Реакционную смесь охлаждают на ледяной бане. Образуемые кристаллы отфильтровывают, промывают холодным этанолом и сушат в вакууме (40 С) с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 237,9732 (М-Н)+. Стадия Б. Гидрохлорид 5-(4-хлорбензилиден)-3-[3-(4-морфолин-4-илметил-1H-пиррол-2 илметилен)-2-оксо-2,3-дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на соединение, полученное на стадии А. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 561,1377 (М+Н)+ и 561,1383 (М+Н)+. Элементарный микроанализ: Пример 10. Гидрохлорид 3-3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2 илметилен]-2-оксо-2,3-дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Стадия А. 3-[4-1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2-илметилен]-5 гидроксиметил-1,3-дигидроиндол-2-он. Раствор 5-гидроксиметил-1,3-дигидроиндол-2-она (2,75 ммоль), соединения, полученного в синтезе 4, (3,30 ммоль) и пиперидина (2,75 ммоль) в этаноле нагревают с обратным холодильником. Через 2 ч реакционную смесь упаривают и остаток растирают в AcOEt. Образуемый осадок отфильтровывают с получением указанного в заголовке продукта в виде смеси Z/Е изомеров (96/4). Масс-спектрометрия (ES+, m/z): 336,1706 (М+Н)+ и 336,1733 (М+Н)+. Стадия Б. Гидрохлорид 3-3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2 илметилен]-2-оксо-2,3-дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения,полученного на стадии Б,(2,02 ммоль) и 5-(4-хлорбензилиден)тиазолидин-2,4-диона (3,04 ммоль). Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Масс-спектрометрия (ES+, m/z): 435,1486 (М+Н)+ и 435,1493 (М+Н)+. Элементарный микроанализ: Пример 11. Гидрохлорид 3-(4-морфолин-4-илметил-1 Н-пиррол-2-илметилен)-5-(2-оксо[1,3,4]тиадиазол-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на 3H-[1,3,4]тиадиазол-2-он. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Масс-спектрометрия (ES+, m/z): 424,1437 (М+Н)+ и 424,1459 (М+Н)+. Элементарный микроанализ: Пример 12. Гидрохлорид 5,5-диметил-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2 оксо-2,3-дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Стадия А. 5,5-Диметилтиазолидин-2,4-дион. 41,4 ммоль метил 2-бром-2-метилпропионата и 4,56 ммоль тиомочевины растворяют в н-бутаноле(90 мл) и перемешивают при 110 С в течение 5 ч. Растворитель упаривают досуха и остаток переносят в этанол (120 мл) и HCl (2 н., 120 мл) и затем нагревают с обратным холодильником в течение 16 ч. Этанол упаривают и смесь разбавляют водой (120 мл) и затем экстрагируют AcOEt. Органическую фазу промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают досуха. Полученные кристаллы промывают пентаном, отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта. Температура плавления: 76,6 С. Стадия Б. Гидрохлорид 5,5-диметил-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо 2,3-дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на соединение, полученное на стадии А. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (95/5). Масс-спектрометрия (ES+, m/z): 467,1754 (М+Н)+ и 467,1750 (М+Н)+. Элементарный микроанализ: Пример 13. Гидрохлорид 5-изопропилиден-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)2-оксо-2,3-дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1, с заменой тиазолидин-2,4-диона на 5-изопропилиден-тиазолидин-2,4-дион. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 479,1739 (M+H)+ и 479,1744 (М+Н)+. Пример 14. Гидрохлорид 3-[3-(1-метил-4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Стадия А. 5-Гидроксиметил-3-(1-метил-4-морфолин-4-илметил-1H-пиррол-2-илметилен)-1,3 дигидроиндол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Г примера 1,путем конденсации 5-гидроксиметил-1,3-дигидроиндол-2-она (1,31 ммоль) и соединения, полученного в синтезе 6, (1,44 ммоль) в присутствии пиперидина в этаноле при 105 С при микроволновой активации. После упаривания досуха остаток очищают на силикагеле (SiO2, градиент AcOEt/MeOH) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (65/35). Масс-спектрометрия (ES+, m/z): 354,1791 (М+Н)+ и 354,1802 (М+Н)+. Стадия Б. Гидрохлорид 3-[3-(1-метил-4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1 Н-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (0,88 ммоль) и тиазолидин-2,4-диона(1,32 ммоль). Полученный после фильтрования реакционной смеси продукт очищают на силикагеле(SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (30/70). Масс-спектрометрия (ES+, m/z): 453,1607 (М+Н)+ и 453,1585 (М+Н)+. Элементарный микроанализ: Пример 15. Гидрохлорид 3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)пропилиден]-2-оксо-2,3 дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Стадия А. 5-Гидроксиметил-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)пропилиден]-1,3 дигидроиндол-2-он. Раствор 5-гидроксиметил-1,3-дигидроиндол-2-она (0,22 ммоль), соединения, полученного в синтезе 5, (0,44 ммоль) и ацетата аммония (0,44 ммоль) в н-бутаноле (4 мл) нагревают при 150 С при микроволновой активации в течение 1 ч. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (92/8). Масс-спектрометрия (ES+, m/z): 368,1941 (М+Н)+ и 368,1970 (М+Н)+. Стадия Б. Гидрохлорид 3-3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)пропилиден]-2-оксо-2,3 дигидро-1H-индол-5-илметилтиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (0,96 ммоль) и тиазолидин-2,4-диона(1,44 ммоль). Полученный после фильтрования реакционной смеси продукт очищают на силикагеле(SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 467,1762 (М+Н)+ и 467,1782 (М+Н)+. Пример 16. 5-(4-Гидрокси-2-оксотиазолидин-3-илметил)-3-(4-морфолин-4-илметил-1H-пиррол-2 илметилен)-1,3-дигидроиндол-2-он. К раствору соединения, полученного в примере 1, (1,37 ммоль) в смеси MeOH/диоксан (42 мл/55 мл) при 0 С добавляют NaBH4 (2,75 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 5 ч. Реакционную смесь упаривают досуха и переносят в воду (20 мл) и затем экстрагируют AcOEt (440 мл). Органические фазы объединяют. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток очищают на силикагеле (SiO2; градиент ДХМ/MeOH) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (94,5/5,5). Масс-спектрометрия (ES+, m/z): 441,1608 (М+Н)+ и 441,1621 (М+Н)+. Пример 17. Гидрохлорид 3-[3-(1-метил-5-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Стадия А. 5-Гидроксиметил-3-(1-метил-5-морфолин-4-илметил-1H-пиррол-2-илметилен)-1,3 дигидроиндол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Г примера 1,путем конденсации 5-гидроксиметил-1,3-дигидроиндол-2-она (1,84 ммоль) и соединения, полученного в синтезе 6, (2,02 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником в течение 4 ч. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле(SiO2; градиент AcOEt/MeOH) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (22/78). Масс-спектрометрия (ES+, m/z): 354,1860 (М+Н)+ и 376,1577 (М+Н)+. Стадия Б. Гидрохлорид 3-[3-(1-метил-5-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (1,63 ммоль) и тиазолидин-2,4-диона(2,69 ммоль). Полученный после обработки продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (30/70). Масс-спектрометрия (ES+, m/z): 453,1600 (М+Н)+ и 453,1559 (М+Н)+. Пример 18. Гидрохлорид 3-[3-(5-морфолин-4-илметил-1 Н-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]тиазолидин-2,4-диона. Стадия А. 5-Гидроксиметил-3-(5-морфолин-4-илметил-1H-пиррол-2-илметилен)-1,3-дигидроиндол 2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Г примера 1,путем конденсации 5-гидроксиметил-1,3-дигидроиндол-2-она (1,53 ммоль) и соединения, полученного в синтезе 7, (1,53 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником в течение 3 ч. Образуемый осадок отфильтровывают и промывают этанолом. Полученный продукт сушат в вакууме с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,8/0,2). Стадия Б. Гидрохлорид 3-[3-(5-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3-дигидро 1H-индол-5-илметил]тиазолидин-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 1,путем конденсации соединения, полученного на стадии А, (1,21 ммоль) и тиазолидин-2,4-диона(1,82 ммоль). Полученный после обработки продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 1, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Элементарный микроанализ: Пример 19. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Стадия А. 3-(4-Нитробензил)оксазолидин-2-он. К суспензии NaH (60%, в виде дисперсии в масле, 0,34 моль) в безводном ТГФ (60 мл) при 0 С под инертной атмосферой по каплям добавляют раствор оксазолидин-2-она (0,31 моль). Реакционную смесь доводят до температуры окружающей среды и перемешивают в течение 1 ч. По каплям при 0 С добавляют раствор 1-бромметил-4-нитробензола (0,35 моль) в смеси ТГФ/ДМФА (10/1) (250 мл). Реакционную смесь затем перемешивают в течение ночи при температуре окружающей среды. Раствор затем охлаждают до 0 С. К раствору затем последовательно добавляют 20 мл MeOH и 20 мл воды. Полученную суспензию затем концентрируют и выливают в 500 мл воды. Раствор затем экстрагируют ДХМ и органические фазы объединяют. Полученную органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия и затем фильтруют. Полученный фильтрат концентрируют и образуемое твердое вещество отфильтровывают, промывают этиловым эфиром и затем сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. 3-(4-Аминобензил)оксазолидин-2-он. Раствор соединения, полученного на стадии А, (0,244 моль) и SnCl22H2O (1,0 моль) в этаноле(300 мл) перемешивают при нагревании с обратным холодильником в течение 20 мин. Раствор доводят до 0 С и делают щелочным со значением pH 10-12 с помощью водного раствора гидроксида натрия; добавляют 500 мл ДХМ и полученную эмульсию фильтруют через целит. Фильтрат затем экстрагируют ДХМ (2300 мл); органические фазы объединяют. Полученную органическую фазу промывают водой и насыщенным водным раствором NaCl, сушат над сульфатом натрия и затем фильтруют. Полученный фильтрат упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 3-Метилсульфанил-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-он. К раствору соединения, полученного на стадии Б, (0,113 моль) в смеси CH3CN (200 мл) и ТГФ(200 мл) при -60 С под атмосферой азота по каплям добавляют этил (метилсульфанил)ацетат(0,136 моль). К реакционной смеси по каплям в течение 20 мин добавляют t-BuOCl (0,136 моль), поддерживая температуру между -60 и -55 С. После перемешивания в течение 1 ч при -50 С по каплям добавляют триэтиламин (0,152 моль). Реакционную смесь доводят до 0 С и затем по каплям добавляют 3 М водный раствор HCl (580 мл). После перемешивания в течение 12 ч при температуре окружающей среды органические фазы упаривают в вакууме и затем водную фазу экстрагируют ДХМ и органические фазы объединяют. Полученную органическую фазу промывают водой и затем насыщенным водным растворомNaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный продукт перекристаллизовывают из смеси этиловый эфир/этанол. Полученные кристаллы отфильтровывают, промывают эфиром и сушат в вакууме при 40 С с получением указанного в заголовке продукта,который непосредственно используют на следующей стадии. Стадия Г. 5-(2-Оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-он. К раствору соединения, полученного на стадии В, в ледяной уксусной кислоте (320 мл) добавляют порошкообразный цинк (1 моль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды и затем фильтруют. Фильтрат концентрируют и затем добавляют 100 мл воды. Образуемое твердое вещество отфильтровывают и затем перекристаллизовывают из этанола с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 233,0905 (М+Н)+. Стадия Д. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксооксазолидин 3-илметил)-1,3-дигидроиндол-2-она. Раствор соединения, полученного на стадии Г, (18,8 ммоль), соединения, полученного в синтезе 1,(20,7 ммоль) и пиперидина (13,2 ммоль) в EtOH (100 мл) перемешивают при нагревании с обратным холодильником в течение 3 ч и затем при температуре окружающей среды в течение 12 ч. Полученное желтое твердое вещество фильтруют с водой и этанолом. Полученный продукт растворяют в горячем состоянии в 300 мл смеси ДХМ/MeOH (1/1). Раствор доводят до температуры окружающей среды и добавляют 40 мл раствора HCl (1,25 М) в этаноле. Образуемое желтое твердое вещество отфильтровывают под азотом, промывают этиловым эфиром и сушат при 40 С в вакууме в течение 12 ч с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 409,1863 (М+Н)+ и 409,1886 (М+Н)+. Элементарный микроанализ: Пример 20. Гидрохлорид 3-(5-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,5 ммоль) и соединения,полученного в синтезе 7, (1,65 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После упаривания реакционной смеси досуха полученный остаток очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент ц-гексан/AcOEt). Полученный продукт превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,3/1,7). Масс-спектрометрия (ES+, m/z): 409,1881 (М+Н)+ и 409,1892 (М+Н)+. Температура плавления: 195 С. Пример 21. 3-(3-Морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксооксазолидин-3-илметил)1,3-дигидроиндол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,4 ммоль) и соединения,полученного в синтезе 8, (1,7 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после упаривания досуха очищают с помощью флэшхроматографии на силикагеле (SiO2; градиент ДХМ - ДХМ/MeOH 9/1) с получением указанного в заголовке продукта. Смесь Z/Е изомеров (90/10). Масс-спектрометрия (ES+, m/z): 409,1856 (М+Н)+ и 409,1867 (М+Н)+. Температура плавления: 192 С. Элементарный микроанализ: Пример 22. Гидрохлорид 3-[1-(4-морфолин-4-илметил-1H-пиррол-2-ил)этилиден]-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Смесь соединения, полученного в синтезе 2, (3,22 ммоль), 5-(2-оксооксазолидин-3-илметил)-1,3 дигидроиндол-2-она (2,15 ммоль) и NH4OAc (9,73 ммоль) в этаноле нагревают в микроволновой печи при 110 С в течение 45 мин. Образуемый осадок отфильтровывают и затем суспендируют в воде и снова нагревают в течение 10 мин при 110 С в микроволновой печи. Полученное твердое вещество отфильтровывают, суспендируют в этаноле и снова нагревают в течение 10 мин при 110 С в микроволновой печи. Полученный продукт превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Масс-спектрометрия (ES+, m/z): 423,2012 (М+Н)+ и 423,2056 (М+Н)+. Температура плавления: 212 С. Элементарный микроанализ: Пример 23. Гидрохлорид 3-(5-диэтиламинометил-1H-пиррол-2-илметилен)-5-(2-оксооксазолидин-3 илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,72 ммоль) и соединения, полученного в синтезе 9 (1,9 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после фильтрования реакционной смеси продукт очищают с помощью флэш-хроматографии на силикагеле (SiO2; градиент 100% ДХМ - ДХМ/MeOH 9/1). Полученный продукт превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Масс-спектрометрия (ES+, m/z): 393,1933 (М+Н)+ и 393,1933 (М+Н)+. Температура плавления: 238 С. Элементарный микроанализ: Пример 24. Гидрохлорид (1R,5S)-3-[3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]-3-азабицикло[3.1.0]гексан-2,4-диона. Стадия А. 3-Метилсульфанил-2-оксо-2,3-дигидро-1H-индол-5-карбонитрил. К раствору 4-аминобензонитрила (84,64 ммоль) в ДХМ (200 мл) под атмосферой азота при -78 С по каплям добавляют t-BuOCl (84,64 ммоль), растворенный в 20 мл ДХМ, и затем, через 10 мин к реакционной смеси по каплям добавляют этил (метилсульфанил)ацетат (84,64 ммоль), растворенный в 20 мл ДХМ. После перемешивания в течение 1 ч при -78 С по каплям добавляют триэтиламин (0,152 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч. Добавляют воду и фазы затем разделяют. Органическую фазу промывают водой и затем насыщенным водным растворомNaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток переносят в этиловый эфир и добавляют 2 М водн. раствор HCl. После перемешивания в течение ночи желтый осадок отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют в следующей реакции. Стадия Б. 2-Оксо-2,3-дигидро-1H-индол-5-карбонитрил. К суспензии никеля Ренея в ТГФ (100 мл) добавляют соединение, полученное на стадии А,(20 ммоль), растворенное в ТГФ (400 мл). Реакционную смесь перемешивают при температуре окружающей среды до тех пор, пока исходное вещество не исчезнет полностью. Реакционную смесь затем фильтруют через набивку целита и затем упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют в следующей реакции. Стадия В. 5-Аминометил-1,3-дигидроиндол-2-он. Раствор соединения, полученного на стадии Б, (35 ммоль) в MeOH (500 мл) добавляют к 6 мл концентрированной HCl. Реакционную смесь перемешивают в течение 3 дней под давлением водорода 10 бар. После фильтрования через целит фильтрат упаривают досуха с получением указанного в заголовке продукта в виде белого порошка, который непосредственно используют в следующей реакции. Стадия Г. (1R,5S)-3-(2-Оксо-2,3-дигидро-1 Н-индол-5-илметил)-3-азабицикло[3.1.0]гексан-2,4-дион. Раствор соединения, полученного на стадии В, (15 ммоль) и 3-оксабицикло[3.1.0]гексан-2,4-диона(22,5 ммоль) в уксусной кислоте (60 мл) нагревают с обратным холодильником в течение 48 ч. Смесь доводят до температуры окружающей среды и образуемое твердое вещество отфильтровывают с получением указанного в заголовке продукта, который непосредственно используют в следующей реакции. Масс-спектрометрия (ES+, m/z): 257,0913 (М+Н)+. Стадия Д. Гидрохлорид (1R,5S)-3-[3-(4-Морфолин-4-илметил-1H-пиррол-2-илметилен)-2-оксо-2,3 дигидро-1H-индол-5-илметил]-3-азабицикло[3.1.0]гексан-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии Г, (1,54 ммоль), и соединения, полученного в синтезе 1, (1,7 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования реакционной смеси превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 433,1857 (М+Н)+ и 433,1861 (М+Н)+. Элементарный микроанализ: Пример 25. Гидрохлорид 3-(3,5-диметил-4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Стадия А. 3-(3,5-Диметил-1H-пиррол-2-илметилен)-5-(2-оксооксазолидин-3-илметил)-1,3 дигидроиндол-2-он. Раствор 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (4,3 ммоль), 3,5-диметил-1Hпиррол-2-карбальдегида (5,17 ммоль) и пиперидина (3 ммоль) в этаноле (30 мл) нагревают с обратным холодильником в течение 24 ч. Образуемое твердое вещество отфильтровывают, промывают этанолом,водой и затем этанолом и сушат в вакууме с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 338,1485 (М+Н)+. Стадия Б. Гидрохлорид 3-(3,5-диметил-4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. К раствору соединения, полученного на стадии А, (1,3 ммоль) в уксусной кислоте (20 мл) при 0 С добавляют морфолин (1,43 ммоль) и формальдегид (37%-ный водн., 1,3 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Смесь упаривают досуха и остаток очищают на силикагеле (SiO2; градиент 100% ДХМ - ДХМ/MeOH 9/1). Полученный продукт превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Масс-спектрометрия (ES+, m/z): 435,2036 (М+Н)+ и 435,2035 (М+Н)+. Элементарный микроанализ: Пример 26. Дигидрохлорид 3-[3,5-Диметил-4-(4-метилпиперазин-1-илметил)-1 Н-пиррол-2 илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. К раствору соединения, полученного на стадии А примера 25, (1,18 ммоль) в уксусной кислоте(20 мл) при 0 С добавляют 1-метилпиперазин (1,18 ммоль) и формальдегид (37%-ный водн., 1,18 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. После кислотно-щелочного экстрагирования полученный продукт превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта.Z изомер. Масс-спектрометрия (ES+, m/z): 448,2377 (М+Н)+. Температура плавления: 230 С (разложение). Пример 27. Гидрохлорид 3-(3,5-диметил-4-пиперидин-1-илметил-1H-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. К раствору соединения, полученного на стадии А примера 25, (1,48 ммоль) в уксусной кислоте(20 мл) при 0 С добавляют пиперидин (1,48 ммоль) и формальдегид (37%-ный водн., 1,48 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. После кислотнощелочного экстрагирования полученный продукт очищают на силикагеле (SiO2; градиент 100% ДХМ - ДХМ/MeOH 9/1) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 435,2367 (М+Н)+ и 435,2382 (М+Н)+. Элементарный микроанализ: Пример 28. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксотиазолидин 3-илметил)-1,3-дигидроиндол-2-она. Стадия А. 5-(2-Оксотиазолидин-3-илметил)-1,3-дигидроиндол-2-он. Указанный в заголовке продукт получают, как описано на стадиях А-Г примера 19 с заменой оксазолидин-2-она на тиазолидин-2-он на стадии А. Стадия Б. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксотиазолидин-3 илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии А, (1,54 ммоль) и соединения, полученного в синтезе 1, (1,7 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после фильтрования реакционной смеси продукт очищают на силикагеле (SiO2; градиент 100% ДХМ - ДХМ/MeOH 9/1) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99/1). Масс-спектрометрия (ES+, m/z): 425,1633 (М+Н)+ и 425,1679 (М+Н)+. Температура плавления: 244 С. Элементарный микроанализ: Пример 29. Дигидрохлорид 3-[4-(4-метилпиперазин-1-илметил)-1H-пиррол-2-илметилен]-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,66 ммоль) и соединения, полученного в синтезе 10, (2,07 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент 100% ДХМ - ДХМ/MeOH 9/1) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2) Масс-спектрометрия (ES+, m/z): 422,2183 (М+Н)+ и 422,2198 (М+Н)+. Элементарный микроанализ: Пример 30. Гидрохлорид 5-[5-(4-хлорфенил)-2-оксо-6 Н-[1,3,4]тиадиазин-3-илметил]-3-(4 морфолин-4-илметил-1 Н-пиррол-2-илметилен)-1,3-дигидроиндол-2-она. Стадия А. 5-(4-Хлорфенил)-3,6-дигидро[1,3,4]тиадиазин-2-он. Смесь 2-бром-1-(4-хлорфенил)этанона (90,71 ммоль) и О-этилового сложного эфира гидразинтиокарбоновой кислоты (90,71 ммоль) в ацетонитриле (84 мл) перемешивают при температуре окружающей среды в течение 3 ч. Образуемое твердое вещество отфильтровывают, промывают ацетонитрилом и этиловым эфиром и затем сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. 5-(4-Хлорфенил)-3-(4-нитробензил)-3,6-дигидро[1,3,4]тиадиазин-2-он. К раствору соединения, полученного на стадии А, (57,83 ммоль) в ацетонитриле (260 мл) добавляют 1-бромметил-4-нитробензол (63,61 ммоль) и карбонат калия (231,32 ммоль). Реакционную смесь перемешивают при 80 С в течение 1 ч под азотом. Реакционную смесь доводят до температуры окружающей среды и добавляют 100 мл воды. Проводят экстрагирование этиловым эфиром (3350 мл) и органические фазы объединяют. Полученную органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Твердое вещество растирают в этиловом эфире, отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 3-(4-Аминобензил)-5-(4-хлорфенил)-3,6-дигидро[1,3,4]тиадиазин-2-он. Соединение, полученное на стадии Б, восстанавливают при условиях, описанных выше на стадии Б примера 19, с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Г. 5-[5-(4-Хлорфенил)-2-оксо-6 Н-[1,3,4]тиадиазин-3-илметил]-3-метилсульфанил-1,3 дигидроиндол-2-он. К раствору соединения, полученного на стадии В, (38,27 ммоль), в смеси CH3CN (115 мл) и ТГФ(115 мл) при -60 С по каплям под атмосферой азота добавляют этил (метилсульфанил)ацетат(45,92 ммоль). К реакционной смеси в течение 20 мин по каплям добавляют t-BuOCl (45,92 ммоль), поддерживая температуру между -60 и -55 С. После перемешивания в течение 1 ч при -60 С по каплям добавляют триэтиламин (51,66 ммоль). Реакционную смесь доводят до температуры окружающей среды. Добавляют 240 мл ДХМ и затем 3 М водный раствор HCl (340 мл). После перемешивания в течение 12 ч при температуре окружающей среды реакционную смесь делают щелочной (рН 10-11), используя 20%ный водный раствор гидроксида натрия. После экстрагирования ДХМ органическую фазу промывают насыщенным водным раствором NaCl. Органическую фазу сушат над сульфатом натрия, фильтруют и упаривают досуха. Полученный продукт растирают в этиловом эфире, отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Д. 5-[5-(4-Хлорфенил)-2-оксо-6 Н-[1,3,4]тиадиазин-3-илметил]-1,3-дигидроиндол-2-он. К раствору соединения, полученного на стадии Г, (27,68 ммоль) в ледяной уксусной кислоте(350 мл) добавляют порошкообразный цинк (18,09 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды и затем фильтруют. Фильтрат концентрируют и затем доводят до рН 8-9 насыщенным водным раствором бикарбоната натрия и обрабатывают ультразвуком в течение 5 мин. Образуемое твердое вещество отфильтровывают и затем перекристаллизовывают из этанола с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 372,0561 (М+Н)+. Элементарный микроанализ: Стадия Е. Гидрохлорид 5-[5-(4-хлорфенил)-2-оксо-6 Н-[1,3,4]тиадиазин-3-илметил]-3-(4-морфолин 4-илметил-1 Н-пиррол-2-илметилен)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии Д, (1,34 ммоль) и соединения, полученного в синтезе 1, (1,5 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования реакционной смеси превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2). Масс-спектрометрия (ES+, m/z): 548,1517 (М+Н)+ и 548,1540 (М+Н)+. Элементарный микроанализ: Пример 31. Гидрохлорид 5-(2-оксооксазолидин-3-илметил)-3-(4-пирролидин-1-илметил-1H-пиррол 2-илметилен)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,08 ммоль) и соединения, полученного в синтезе 11, (1,08 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество очищают на силикагеле(SiO2; AcOEt/MeOH 7/3) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Масс-спектрометрия (ES+, m/z): 393,1899 (М+Н)+ и 393,1896 (М+Н)+. Температура плавления: 204 С. Элементарный микроанализ: Пример 32. Гидрохлорид 3-[4-3aR,6aS)-гексагидроциклопента[с]пиррол-2-(1H)-илметил)-1 Нпиррол-2-илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,08 ммоль) и соединения, полученного в синтезе 12, (1,13 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество превращают в гидрохлорид,как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (96/4). Масс-спектрометрия (ES+, m/z): 433,2212 (М+Н)+ и 433,2217 (М+Н)+. Температура плавления: 237 С. Элементарный микроанализ: Пример 33. Гидрохлорид 5-(2-оксооксазолидин-3-илметил)-3-(4-пиперидин-1-илметил-1 Н-пиррол 2-илметилен)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,08 ммоль) и соединения, полученного в синтезе 13, (1,13 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество превращают в гидрохлорид,как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (97/3). Масс-спектрометрия (ES+, m/z): 407,2047 (М+Н)+ и 407,2053 (М+Н)+. Температура плавления: 256 С. Элементарный микроанализ: Пример 34. Гидрохлорид 3-(4-диэтиламинометил-1 Н-пиррол-2-илметилен)-5-(2-оксооксазолидин-3 илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,08 ммоль) и соединения, полученного в синтезе 14, (1,08 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество очищают на силикагеле(SiO2; градиент AcOEt - AcOEt/MeOH 7/3) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (93/7). Масс-спектрометрия (ES+, m/z): 395,2066 (М+Н)+ и 395,2082 (М+Н)+. Температура плавления: 192 С. Элементарный микроанализ: Пример 35. Гидрохлорид 5-[5-(4-хлорфенил)-2-оксо-6 Н-[1,3,4]тиадиазин-3-илметил]-3-[1-(4 морфолин-4-илметил-1 Н-пиррол-2-ил)этилиден]-1,3-дигидроиндол-2-она. Смесь соединения, полученного на стадии Д примера 30, (1 ммоль), соединения, полученного в синтезе 2, (1,5 ммоль) и NH4OAc (4,5 ммоль) в этаноле нагревают в микроволновой печи при 110 С в течение 20 мин. После фильтрования полученное твердое вещество очищают на силикагеле (SiO2; градиент AcOEt - AcOEt/MeOH 9/1) и затем превращают в гидрохлорид, как описано на стадии Д примера 19,с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2). Масс-спектрометрия (ES+, m/z): 562,1647 (М+Н)+ и 562,1666 (М+Н)+. Элементарный микроанализ: Пример 36. Гидрохлорид 3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-3,5-диметил-1 Н-пиррол 2-илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (0,63 ммоль) и соединения, полученного в синтезе 3, (0,69 ммоль) в присутствии пиперидина в этаноле при 110 С при микроволновой активации. После фильтрования полученное твердое вещество очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (93/7). Масс-спектрометрия (ES+, m/z): 431,2070 (М+Н)+ и 431,2074 (М+Н)+. Элементарный микроанализ: Пример 37. Гидрохлорид (1R,5S)-3-[2-оксо-3-(4-пиперидин-1-илметил-1 Н-пиррол-2-илметилен)-2,3 дигидро-1 Н-индол-5-илметил]-3-азабицикло[3.1.0]гексан-2,4-диона. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии 5 примера 19,путем конденсации (1R,5S)-3-(2-оксо-2,3-дигидро-1H-индол-5-илметил)-3-азабицикло[3.1.0]гексан-2,4 диона (0,62 ммоль) и соединения, полученного в синтезе 13, (0,65 ммоль), в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования реакционной смеси превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 431,2056 (M+H)+ и 431,2077 (М+Н)+. Температура плавления: 198 С. Элементарный микроанализ: Пример 38. Гидрохлорид 3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2 илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 3-(5-(2-оксооксазолидин-3-илметил-1,3-дигидроиндол-2-она (1,5 ммоль) и соединения, полученного в синтезе 4, (1,9 ммоль) в присутствии пиперидина при нагревании с обратным холодильником в этаноле в течение ночи. Полученный продукт после фильтрования реакционной смеси превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (94,5/5,5). Масс-спектрометрия (ES+, m/z): 405,1923 (М+Н)+ и 405,1926 (М+Н)+. Температура плавления: 179 С. Элементарный микроанализ: Пример 39. Гидрохлорид 3-[4-3aR,6aS)-гексагидроциклопента[с]пиррол-2(1H)-илметил)-3,5 диметил-1H-пиррол-2-илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,72 ммоль) и соединения, полученного в синтезе 15, (2,06 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество превращают в гидрохлорид,как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (96,5/3,5). Масс-спектрометрия (ES+, m/z): 461,2549 (M+H)+ и 461,2566 (М+Н)+. Температура плавления: 204 С. Элементарный микроанализ: Пример 40. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксопиперидин 1-илметил)-1,3-дигидроиндол-2-она. Стадия А. 5-(2-Оксопиперидин-1-илметил)-1,3-дигидроиндол-2-он. Указанный в заголовке продукт получают в соответствии со стадиями А-Г примера 19, используя пиперидин-2-он на стадии А. Масс-спектрометрия (ES+, m/z): 245,1275 (М+Н)+. Стадия Б. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксопиперидин-1 илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии А, (1,3 ммоль) и соединения, полученного в синтезе 1, (1,3 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. После фильтрования полученное твердое вещество превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98,5/1,5). Масс-спектрометрия (ES+, m/z): 421,2222 (М+Н)+ и 421,2245 (М+Н)+. Элементарный микроанализ: Пример 41. Гидрохлорид 3-[(4-морфолинилметил)-1 Н-пиррол-2-ил]метилен-5-[(1,1-диоксидо-2 изотиазолидинил)метил]-1,3-дигидро-2 Н-индол-2-она. Стадия А. 5-[(1,1-Диоксидо-2-изотиазолидинил)метил]-1,3-дигидро-2 Н-индол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадиях А-Г примера 19, используя изотиазолидин 1,1-диоксид на стадии А. Масс-спектрометрия (ES+, m/z): 267,0796 (М+Н)+. Стадия Б. Гидрохлорид 3-[(4-морфолинилметил)-1 Н-пиррол-2-ил]метилен-5-[(1,1-диоксидо-2 изотиазолидинил)метил]-1,3-дигидро-2 Н-индол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии А, (1,32 ммоль) и соединения, полученного в синтезе 1, (1,65 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Масс-спектрометрия (ES+, m/z): 443,1746 (М+Н)+ и 443,1758 (М+Н)+. Элементарный микроанализ: Пример 42. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксопирролидин 1-илметил)-1,3-дигидроиндол-2-она. Стадия А. 5-(2-Оксопирролидин-1-илметил)-1,3-дигидроиндол-2-он. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадиях А-Г примера 19, используя пирролидин-2-он на стадии А. Масс-спектрометрия (ES+, m/z): 231,1120 (М+Н)+. Стадия Б. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-(2-оксопирролидин-1 илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии А, (1,63 ммоль) и соединения, полученного в синтезе 1, (1,95 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (99,5/0,5). Масс-спектрометрия (ES+, m/z): 407,2056 (М+Н)+ и 407,2065 (М+Н)+. Пример 43. Гидрохлорид 3-(1-метил-4-морфолин-4-илметил-1 Н-пиррол-2-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (1,31 ммоль) и соединения, полученного в синтезе 6, (1,44 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент AcOEt/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (33/66). Масс-спектрометрия (ES+, m/z): 423,2034 (М+Н)+. Элементарный микроанализ: Пример 44. Гидрохлорид 3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1 Н-пиррол-2 илметилен]-5-[5-(4-хлорфенил)-2-оксо-6 Н-[1,3,4]оксадиазин-3-илметил]-1,3-дигидроиндол-2-она. Стадия А. 1-(4-Хлорфенил)-2-гидроксиэтанон. Смесь 2-бром-1-(4-хлорфенил)этанона (100 ммоль) и формиата калия (130 ммоль) в MeOH (100 мл) перемешивают при нагревании с обратным холодильником в течение 3 ч. Реакционную смесь выливают на дробленый лед. Образуемое твердое вещество отфильтровывают, промывают холодным MeOH и затем сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. Этил N'-[1-(4-хлорфенил)-2-гидроксиэтилиден]гидразинкарбоксилат. Смесь соединения, полученного на стадии А, (195 ммоль) и этил гидразинкарбоксилата (224 ммоль) в этаноле перемешивают при нагревании с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до 0 С и образуемый осадок отфильтровывают, промывают этиловым эфиром и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 5-(4-Хлорфенил)-3,6-дигидро[1,3,4]оксадиазин-2-он. К раствору соединения, полученного на стадии Б, (100,5 ммоль) в этаноле (800 мл) небольшими порциями и при температуре окружающей среды добавляют гидрид натрия (60%, в масле, 16 ммоль). После протекания реакции в течение 2 ч реакционную смесь охлаждают до 0 С и перемешивание продолжают в течение 30 мин. Образуемый осадок отфильтровывают, промывают холодным этанолом и затем сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Масс-спектрометрия (ES+, m/z): 211,0277 (М+Н)+. Стадия Г. 5-(4-Хлорфенил)-3-(4-нитробензил)-3,6-дигидро[1,3,4]оксадиазин-2-он. К раствору соединения, полученного на стадии В, (47,48 ммоль) в ацетонитриле (260 мл) добавляют 1-бромметил-4-нитробензол (52,23 ммоль) и карбонат калия (189,92 ммоль). Реакционную смесь перемешивают при нагревании с обратным холодильником в течение 4 ч под азотом. Реакционную смесь доводят до температуры окружающей среды и затем разбавляют 500 мл ДХМ и 100 мл воды. Проводят экстрагирование ДХМ (2200 мл) и затем органические фазы объединяют. Полученную органическую фазу промывают насыщенным раствором NaCl и затем сушат над сульфатом натрия, фильтруют и концентрируют до объема приблизительно 75 мл. После образования в суспензии осадка добавляют этиловый эфир(150 мл) и осуществляют перемешивание в течение ночи при температуре окружающей среды. Осадок отфильтровывают, промывают этиловым эфиром и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Д. 3-(4-Аминобензил)-5-(4-хлорфенил)-3,6-дигидро[1,3,4]оксадиазин-2-он. Суспензию соединения, полученного на стадии Г, (42,02 ммоль) в смеси EtOH (350 мл) и уксусной кислоты (26 мл) нагревают с обратным холодильником в течение 5 мин. К получающемуся раствору добавляют порошкообразное железо (309 ммоль) и FeCl36H2O (2,1 ммоль). Реакционную смесь перемеши- 24019481 вают при нагревании с обратным холодильником в течение ночи. После упаривания к остатку добавляют воду (250 мл) и затем обрабатывают ультразвуком в течение 2 мин. Смесь делают щелочной (рН 12), используя водный 2 М раствор гидроксида натрия, затем разбавляют AcOEt (500 мл) и затем фильтруют через целит. Фазы разделяют и водную фазу экстрагируют AcOEt. Органические фазы объединяют. Полученную органическую фазу промывают водой и затем насыщенным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток растирают в этиловом эфире, отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта в виде белого порошка, который непосредственно используют на следующей стадии. Стадия Е. 5-[5-(4-Хлорфенил)-2-оксо-6 Н-[1,3,4]оксадиазин-3-илметил]-3-метилсульфанил-1,3 дигидроиндол-2-он. Этил (метилсульфанил)ацетат (27,31 ммоль) в ТГФ (200 мл) при -60 С под атмосферой азота по каплям добавляют к раствору соединения, полученного на стадии Д, (23,75 ммоль). К реакционной смеси в течение 20 мин по каплям добавляют t-BuOCl (27,31 ммоль), поддерживая температуру между -60 и-55 С. После перемешивания в течение 3 ч при -60 С по каплям добавляют триэтиламин (29,68 ммоль). Реакционную смесь доводят до температуры окружающей среды; затем добавляют водный 3 М растворHCl (340 мл) и перемешивание осуществляют в течение дополнительных 2 ч. Органическую фазу упаривают и водную суспензию экстрагируют ДХМ. Органические фазы объединяют, затем промывают 2 М раствором HCl и затем насыщенным раствором NaCl, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток растирают в этиловом эфире, отфильтровывают и сушат в вакууме с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Ж. 5-[5-(4-Хлорфенил)-2-оксо-6 Н-[1,3,4]оксадиазин-3-илметил]-1,3-дигидроиндол-2-он. К раствору соединения, полученного на стадии Е, (15,73 ммоль) в ледяной уксусной кислоте(150 мл) добавляют порошкообразный Zn (157,3 ммоль). Реакционную смесь перемешивают в течение 6 ч и затем фильтруют. Фильтрат упаривают досуха и затем переносят в воду (200 мл) и ДХМ (400 мл). Фазы разделяют и водную фазу экстрагируют ДХМ; органические фазы объединяют. Полученную органическую фазу промывают водой и затем насыщенным раствором NaCl, сушат над сульфатом натрия,фильтруют и упаривают досуха. Полученный остаток перекристаллизовывают из этанола с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 356,0796 (М+Н)+. Стадия З. Гидрохлорид 3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1 Н-пиррол-2-илметилен]5-[5-(4-хлорфенил)-2-оксо-6 Н-[1,3,4]оксадиазин-3-илметил]-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии Ж, (1,2 ммоль) и соединения, полученного в синтезе 4, (1,38 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (94,5/5,5). Масс-спектрометрия (ES+, m/z): 528,1808 (М+Н)+ и 528,1803 (М+Н)+. Элементарный микроанализ: Пример 45. Гидрохлорид 5-[5-(4-хлорфенил)-2-оксо-6H-[1,3,4]оксадиазин-3-илметил]-3-(4 морфолин-4-илметил-1H-пиррол-2-илметилен)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-[5-(4-хлорфенил)-2-оксо-6H-[1,3,4]оксадиазин-3-илметил]-1,3-дигидроиндол-2-она(1,2 ммоль) и соединения, полученного в синтезе 1, (1,38 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (98/2). Масс-спектрометрия (ES+, m/z): 532,1721 (М+Н)+ и 532,1749 (М+Н)+. Элементарный микроанализ: Пример 46. Гидрохлорид 3-(5-морфолин-4-илметил-1 Н-пиррол-3-илметилен)-5-(2 оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (0,86 ммоль) и соединения, полученного в синтезе 16, (0,91 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (78/22). Масс-спектрометрия (ES+, m/z): 409,1883 (М+Н)+ и 409,1865 (М+Н)+. Пример 47. Гидрохлорид 3-[5-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1 Н-пиррол-3 илметилен]-5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она (0,95 ммоль) и соединения, полученного в синтезе 17, (0,95 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный после упаривания реакционной смеси досуха продукт очищают на силикагеле (SiO2; градиент ДХМ/MeOH) и затем превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Смесь Z/Е изомеров (82/18). Масс-спектрометрия (ES+, m/z): 405,1931 (М+Н)+ и 405,1931 (М+Н)+. Пример 48. Гидрохлорид 3-(4-морфолин-4-илметил-1 Н-пиррол-2-илметилен)-5-[2-(2 оксооксазолидин-3-ил)этил]-1,3-дигидроиндол-2-она. Стадия А. 2-[2-(4-Нитрофенил)этиламино]этанол. Смесь 1-(2-бромэтил)-4-нитробензола (86,9 ммоль) и 2-аминоэтанола (86,9 ммоль) нагревают при 150 С при микроволновой активации в течение 10 мин. Реакционную смесь упаривают досуха и полученный остаток очищают на силикагеле (SiO2; градиент ДХМ/MeOH) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Б. 3-[2-(4-Нитрофенил)этил]оксазолидин-2-он. К раствору соединения, полученного на стадии А, (44,5 ммоль) и DMAP (44,5 ммоль) в ДХМ(250 мл) добавляют CDI (89 ммоль). После перемешивания в течение 4 ч при температуре окружающей среды реакционную смесь разбавляют 300 мл ДХМ и затем промывают 2 М раствором HCl (5200 мл). Органическую фазу сушат над сульфатом магния, фильтруют и упаривают досуха с получением указанного в заголовке продукта в виде оранжевого твердого вещества, которое непосредственно используют на следующей стадии. Стадия В. 3-[2-(4-Аминофенил)этил]оксазолидин-2-он. К раствору соединения, полученного на стадии Б, (16,6 ммоль) в MeOH (100 мл) добавляют Pd/C 10% (500 мг). Реакционную смесь перемешивают при 50 С под давлением водорода 4,5 бар в течение 4 ч. Катализатор отфильтровывают и затем промывают MeOH. Фильтрат упаривают досуха и полученный продукт растирают в 10 мл MeOH. Полученное твердое вещество отфильтровывают и сушат в вакууме при 40 С в течение ночи с получением указанного в заголовке продукта в виде белого твердого вещества, которое непосредственно используют на следующей стадии. Стадия Г. 2-Гидроксиимино-N-4-[2-(2-оксооксазолидин-3-ил)этил]фенилацетамид. К раствору гидрата трихлорацетальдегида (32,5 ммоль) в воде (100 мл) добавляют сульфат натрия(78,3 г). К получающейся суспензии добавляют раствор 3-[2-(4-аминофенил)этил]оксазолидин-2-она в воде (20 мл) и концентрированный раствор HCl (2,83 мл). Затем добавляют раствор гидрохлорида гидроксиламина (95 ммоль) в воде (50 мл). Реакционную смесь нагревают с обратным холодильником в течение 2 ч. Смесь затем охлаждают до температуры окружающей среды. Образуемое твердое вещество затем отфильтровывают, промывают водой и сушат в вакууме в присутствии Р 2 О 5 и при 40 С в течение ночи с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Д. 5-[2-(2-Оксооксазолидин-3-ил)этил]-1 Н-индол-2,3-дион. Концентрированную H2SO4 (20 мл) нагревают до 50 С. Медленно, в твердой форме, добавляют соединение, полученное на стадии Г, (25,24 ммоль), поддерживая температуру между 60 и 70 С. Реакционную смесь затем перемешивают в течение 1 ч при 80 С. Смесь доводят до температуры окружающей среды и затем выливают на 200 г дробленого льда. Через 30 мин образующееся твердое вещество отфильтровывают и интенсивно промывают водой со льдом; вещество затем сушат в вакууме в присутствии Р 2 О 5 и при 40 С в течение ночи с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Е. 5-[2-(2-Оксооксазолидин-3-ил)этил]-1,3-дигидроиндол-2-он. К раствору соединения, полученного на стадии Д, (7,68 ммоль) в уксусной кислоте (15 мл) добавляют ТФУ (7 мл) и Pd/C 10% (400 мг). Реакционную смесь перемешивают при 50 С под давлением водорода 4 бар в течение ночи. Катализатор отфильтровывают на набивке целита и затем промывают уксус- 26019481 ной кислотой (20 мл). Фильтрат упаривают досуха и остаточную уксусную кислоту удаляют с помощью азеотропной перегонки с толуолом. Полученное твердое вещество перекристаллизовывают из смесиEtOH/этиловый эфир с получением указанного в заголовке продукта после сушки в вакууме. Масс-спектрометрия (ES+, m/z): 247,1078 (М+Н)+. Стадия Ж. Гидрохлорид 3-(4-морфолин-4-илметил-1H-пиррол-2-илметилен)-5-[2-(2 оксооксазолидин-3-ил)этил]-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации соединения, полученного на стадии Е, (1,62 ммоль) и соединения, полученного в синтезе 1, (1,86 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Пример 49. Гидрохлорид 3-[4-1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил)-1H-пиррол-2 илметилен]-5-[2-(2-оксооксазолидин-3-ил)этил]-1,3-дигидроиндол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-[2-(2-оксооксазолидин-3-ил)этил]-1,3-дигидроиндол-2-она (1 ммоль) и соединения,полученного в синтезе 4, (1,15 ммоль) в присутствии пиперидина в этаноле при нагревании с обратным холодильником. Полученный продукт после фильтрования превращают в гидрохлорид, как описано на стадии Д примера 19, с получением указанного в заголовке продукта. Пример 50. 3-[(6-Фтор-3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро 1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион. Стадия А. 5-(2-Хлорацетил)-6-фториндолин-2-он. К хлориду алюминия (31,1 ммоль) при 0-5 С по каплям под азотом добавляют 20 мл ДХМ. К смеси добавляют 6-фториндолин-2-он (5,18 ммоль) и ацетилхлорид (6,73 ммоль). Реакционную смесь нагревают при 50 С в течение ночи. Реакционную смесь охлаждают до температуры окружающей среды и затем выливают на ледяную баню и полученную суспензию фильтруют и затем промывают холодной водой с получением указанного в заголовке продукта. Стадия Б. Метил 6-фтор-2-оксоиндолин-5-карбоксилат. Раствор соединения, полученного на стадии А, (3,24 ммоль) в пиридине (99 ммоль) перемешивают при 90 С в течение 2 ч. Реакционную смесь охлаждают до температуры окружающей среды и затем фильтруют. Полученное твердое вещество промывают этанолом и сушат в вакууме при 50 С. Соединение растворяют в MeOH (80 мл) и добавляют 0,434 ммоль карбоната калия. Смесь перемешивают при 80 С в течение 5 ч. После охлаждения до температуры окружающей среды добавляют 4 М раствор HCl в диоксане (рН 3) и смесь упаривают досуха. Полученный остаток растирают в воде, отфильтровывают,промывают водой и затем сушат в вакууме при 50 С с получением указанного в заголовке продукта. Стадия В. 6-Фтор-5-(гидроксиметил)индолин-2-он. Раствор соединения, полученного на стадии Б, (2,68 ммоль) в безводном ТГФ (20 мл) выдерживают под азотом в присутствии 0,3 мл EtOH. Раствор охлаждают до 0 С и затем добавляют 5,28 ммоль LiBH4. Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды; затем добавляют вторую порцию LiBH4 (6,20 ммоль) и перемешивание поддерживают в течение дополнительных 3 ч. Добавляют EtOH (0,3 мл) и третью порцию LiBH4 (9,14 ммоль) и реакционную смесь перемешивают в течение ночи. Реакционную смесь гасят с помощью 10 мл воды и затем добавляют насыщенный водный раствор NH4Cl (30 мл). Проводят экстрагирование EtOAc и органические фазы сушат над Na2SO4, фильтруют и упаривают в вакууме. Полученный остаток очищают с помощью флэш-хроматографии(ДХМ/MeOH 10:1) с получением указанного в заголовке продукта. Стадия Г. 6-Фтор-5-(гидроксиметил)-3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-1,3 дигидро-2H-индол-2-он. К полученному на стадии В соединению (10,662 ммоль), растворенному в EtOH (3 мл), добавляют морфолин (0,662 ммоль) и соединение, полученное в синтезе 1, (0,696 ммоль) и смесь нагревают с обрат- 27019481 ным холодильником в течение 2 ч. Смесь охлаждают, используя ледяную баню, и образуемый твердый осадок отфильтровывают, промывают холодным EtOH, затем повторно суспендируют в толуоле и упаривают в вакууме (3 раза). Полученный остаток сушат в вакууме при 40 С в течение 4 ч с получением указанного в заголовке продукта. Стадия Д. 3-[(6-Фтор-3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро 1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион. Тиазолидин-2,4-дион (0,350 ммоль) и трифенилфосфин на смоле (1,66 ммоль/г, 0,415 ммоль) перемешивают в безводном ТГФ (9 мл) под азотом в течение 10 мин при температуре окружающей среды. Смесь охлаждают на ледяной бане и сразу добавляют весь ди-трет-бутил азодикарбоксилат(0,369 ммоль). Смесь перемешивают при 0 С в течение 10 мин и затем сразу добавляют все соединение,полученное на стадии Г (0,238 ммоль). Смесь перемешивают при 0 С в течение 1,5 ч и затем на протяжении 48 ч добавляют тиазолидин-2,4-дион (0,350 ммоль), три порции трифенилфосфина на смоле(1,66 ммоль/г; 0,166 ммоль, 0,415 ммоль и 0,166 ммоль) и три порции трет-бутил азодикарбоксилата (каждая порция по 0,369 ммоль). Добавляют силикагель и смесь упаривают в вакууме. Полученный остаток очищают с помощью флэш-хроматографии (ДХМ/MeOH 100:0-95:5) с получением темно-желтого твердого вещества, которое, после растирания в CH3CN, дает указанный в заголовке продукт в виде желтого твердого вещества. Температура плавления: 224-226 С. Пример 51. 3-[(7-Фтор-3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро 1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион. Методика аналогична таковой, приведенной на стадиях А-Д примера 50, с заменой 6-фториндолин 2-она на стадии А на 7-фториндолин-2-он. Указанный в заголовке продукт получают в виде желтого твердого вещества. Температура плавления: 246-248 С. Пример 52. 3-[(4-Фтор-3-[4-(4-морфолинилметил)-1H-пиррол-2-ил]метилен-2-оксо-2,3-дигидро 1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-дион. Методика аналогична таковой, приведенной на стадиях А-Д примера 50, с заменой 6-фториндолин 2-она на стадии А на 4-фториндолин-2-он. Указанный в заголовке продукт получают в виде желтого твердого вещества. Температура плавления: 248-250 С. Пример 53. Гидрохлорид 3-(4-[2-(4-морфолинил)этил]-1H-пиррол-2-илметилен)-5-[(2-оксо-1,3 оксазолидин-3-ил]метил 1-1,3-дигидро-2H-индол-2-она. Указанный в заголовке продукт получают, следуя протоколу, описанному на стадии Д примера 19,путем конденсации 5-(2-оксооксазолидин-3-илметил)-1,3-дигидроиндол-2-она и соединения, полученного в синтезе 19. Температура плавления: 174 С. Элементарный микроанализ: Пример 54. Гидрохлорид 3-[(3-[5-(морфолин-4-илметил)-1H-пиррол-3-ил]метилен-2-оксо-2,3 дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона. Стадия А. 5-(Гидроксиметил)-3-[5-(морфолин-4-илметил)-1H-пиррол-3-ил]метилен-1,3-дигидро 2H-индол-2-он. Указанное в заголовке соединение получают путем конденсации соединения, полученного на стадии В примера 1, и продукта синтеза 16 при условиях, описанных на стадии Г примера 1. Смесь Z/Е изомеров (46/54). Масс-спектрометрия (ES+, m/z): 340,1645 (М+Н)+ и 340,1665 (М+Н)+. Стадия Б. Гидрохлорид 3-[(3-[5-(морфолин-4-илметил)-1H-пиррол-3-ил]метилен-2-оксо-2,3 дигидро-1H-индол-5-ил)метил]-1,3-тиазолидин-2,4-диона. Указанный в заголовке продукт получают путем конденсации продукта, полученного на стадии А, и тиазолидин-2,4-диона при условиях, описанных на стадии Д примера 1. Смесь Z/E изомеров (47/53). Масс-спектрометрия (ES+, m/z): 439,1447 (М+Н)+ и 439,1425 (М+Н)+. Элементарный микроанализ: Пример 55. Гидрохлорид 3-[3-(5-[(1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил]-1H-пиррол-3 илметилен)-2-оксо-2,3-дигидро-1H-индол-5-ил]метил-1,3-тиазолидин-2,4-диона. Стадия А. 3-(5-[(1R,5S)-3-Азабицикло[3.1.0]гекс-3-илметил]-1 Н-пиррол-3-илметилен)-5(гидроксиметил)-1,3-дигидро-2 Н-индол-2-он. Указанное в заголовке соединение получают путем конденсации соединения, полученного на стадии В примера 1, и соединения, полученного в синтезе 17, при условиях, описанных на стадии Г примера 1. Смесь Z/Е изомеров (46/54). Масс-спектрометрия (ES+, m/z): 340,1645 (М+Н)+ и 340,1665 (М+Н)+. Стадия Б. Гидрохлорид 3-[3-(5-[(1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил]-1 Н-пиррол-3 илметилен)-2-оксо-2,3-дигидро-1 Н-индол-5-ил]метил-1,3-тиазолидин-2,4-диона. Указанный в заголовке продукт получают путем конденсации продукта, полученного на стадии А, и тиазолидин-2,4-диона при условиях, описанных на стадии Д примера 1. Смесь Z/E изомеров (60/40). Масс-спектрометрия (ES+, m/z): 435,1487 (М+Н)+ и 435,1504 (М+Н)+. Пример 56. Гидрохлорид 3-(4-[(1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил]-1 Н-пиррол-2 илметилен)-6-фтор-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2 Н-индол-2-она. Стадия А. 1-(Бромметил)-2-фтор-4-нитробензол. К раствору 2-фтор-1-метил-4-нитробензола (0,152 моль) в толуоле при нагревании с обратным холодильником в течение 5 ч добавляют по каплям 5,1 мл диброма. Реакционную смесь подвергают фракционной дистилляции. Полученный остаток растирают в циклогексане с получением указанного в заголовке продукта в виде кристаллов. Указанный в заголовке продукт непосредственно используют на следующей стадии. Стадия Б. 3-(2-Фтор-4-нитробензил)-1,3-оксазолидин-2-он. К суспензии 60% гидрида натрия в масле (4,48 ммоль) в смеси ТГФ/ДМФА (2,7 мл/0,45 мл) при 0 С под инертной атмосферой в течение 30 мин добавляют по каплям раствор 1,3-оксазолидин-2-она(24,1 ммоль) в смеси ТГФ/ДМФА (71 мл/5,6 мл). После перемешивания в течение 1 ч добавляют раствор соединения в течение 1,5 ч, полученного на стадии А, (26,5 ммоль) в смеси ТГФ/ДМФА (56 мл/11,2 мл),поддерживая температуру ниже 10 С. Перемешивание поддерживают в течение 1,5 ч. К реакционной смеси медленно добавляют воду (12 мл) и затем ТГФ удаляют под пониженным давлением. Реакционную смесь разбавляют насыщенным водным раствором NaCl и затем 3 раза экстрагируют 100 мл AcOEt. Органические фазы объединяют, промывают насыщенным водным раствором NaCl и затем сушатMgSO4. После фильтрования органическую фазу упаривают досуха. Остаток очищают на силикагеле(SiO2, элюант CH2Cl2) с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия В. 3-(4-Амино-2-фторбензил)-1,3-оксазолидин-2-он. К раствору соединения, полученного на стадии Б, (10,37 ммоль) в этаноле (25 мл) добавляют 122 мкл уксусной кислоты. Раствор нагревают с обратным холодильником и перемешивают в течение 10 мин. Добавляют порошкообразное железо (2,08 г) и 75 мг FeCl36H2O. После перемешивания в течение 2 ч при нагревании с обратным холодильником смесь доводят до температуры окружающей среды и затем концентрируют досуха. К полученному остатку добавляют 50 мл воды и рН делают щелочным,используя гидроксид натрия. Раствор 4 раза экстрагируют AcOEt. Органические фазы объединяют и промывают насыщенным водным раствором NaCl и затем сушат над MgSO4. После фильтрования органическую фазу упаривают досуха с получением указанного в заголовке продукта, который непосредственно используют на следующей стадии. Стадия Г. 6-Фтор-3-(метилсульфанил)-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2 Ниндол-2-он и 4-фтор-3-(метилсульфанил)-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2 Н-индол 2-он. Указанные в заголовке продукты получают, следуя протоколу, описанному на стадии В примера 19,используя в качестве исходного вещества 3-(4-амино-2-фторбензил)-1,3-оксазолидин-2-он и разделяя продукты на силикагеле (SiO2, градиент гептан/AcOEt). Указанные в заголовке продукты непосредственно используют на следующей стадии. Стадия Д. 6-Фтор-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2 Н-индол-2-он. 6-Фтор-3-(метилсульфанил)-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2H-индол-2-он,полученный на стадии Г, обрабатывают, как описано на стадии Г примера 19, с получением указанного в заголовке продукта. Масс-спектрометрия (ES+, m/z): 251,0834 (М+Н)+. Стадия Е. Гидрохлорид 3-(4-[(1R,5S)-3-азабицикло[3.1.0]гекс-3-илметил]-1 Н-пиррол-2 илметилен)-6-фтор-5-[(2-оксо-1,3-оксазолидин-3-ил)метил]-1,3-дигидро-2 Н-индол-2-она. Указанный в заголовке продукт получают, как описано на стадии Д примера 19, используя соединение, полученное на стадии Д, и соединение, полученное в синтезе 4. Смесь Z/Е изомеров (93/7).
МПК / Метки
МПК: C07D 471/04, A61P 35/00, C07D 413/14, C07D 417/14, C07D 403/14, A61K 31/404
Метки: содержащие, получения, фармацевтические, способ, дигидроиндолоновые, композиции, новые, соединения
Код ссылки
<a href="https://eas.patents.su/30-19481-novye-digidroindolonovye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые дигидроиндолоновые соединения, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Замещенные пиперидинодигидротиенопиримидины в качестве ингибиторов pde4
Следующий патент: Клетка, ферментирующая сахар-пентозу
Случайный патент: Изолирующая композиция в виде полиуретанового эластомерного геля и ее применение












