Производные хинуклидина карбоната и их медицинские композиции
Формула / Реферат
1. Соединение общей формулы (I)
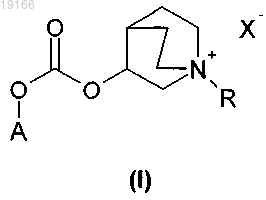
где А может представлять собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а)
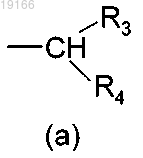
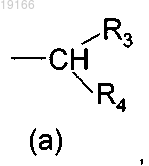
где R3 и R4 являются одинаковыми или разными и могут быть независимо выбраны из группы, состоящей из Н, (С3-С8)циклоалкила, арила или гетероарила, где указанные арил или гетероарил могут быть, возможно, замещены атомом галогена или одним или несколькими заместителями, независимо выбранными из групп ОН, SH, (С1-С10)алкилсульфанил, (C1-С10)алкил и (С1-С10)алкоксил, или, когда R3 и R4, оба независимо, представляют собой арил или гетероарил, тогда они могут быть соединены посредством простой связи с образованием трициклической кольцевой системы;
R представляет собой остаток, выбранный из
(С1-С10)алкила, (С2-С10)алкенила и (С2-С10)алкинила, возможно замещенных группой, выбранной из
CONR1R2;
Z-R1, где Z выбран из СО, О, SO2, S и SO или представляет собой связь;
R1 представляет собой остаток, выбранный из
Н;
арила, возможно замещенного метилом или метокси;
гетероарила, возможно замещенного галогеном;
R2 представляет собой Н;
X- представляет собой физиологически приемлемый анион,
где
"арил" относится к моно-, би- или трициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где по меньшей мере одно кольцо является ароматическим и один или более атомов водорода в указанных кольцах могут быть замещены фенилом или одним или более галогенами;
"арилалкил" относится к группе "(С1-С4)алкил", замещенной одним или более фенилами, и один или более атомов водорода в указанных фенилах могут быть замещены одним или более атомами галогена;
"гетероарил" относится к моно- или бициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где каждое кольцо является ароматическим и где по меньшей мере один атом в кольце является гетероатомом (N, S или О);
"гетероарилалкил" относится к группе "(С1-С4)алкил", замещенной одним или более тиенилами.
2. Соединение по п.1, где R представляет собой (С1-С6)алкил, замещенный -Z-R1.
3. Соединение по п.1, где R представляет собой (С1-С6)алкил, замещенный -Z-R1, где Z представляет собой О, СО или связь и R1 представляет собой арил или гетероарил, предпочтительно замещенный галогеном.
4. Соединение по п.1, где R представляет собой СН2, Z представляет собой СО и R1 представляет собой тиенил, согласно формуле (II)

5. Соединение по п.4, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а)
где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена.
6. Соединение по п.4, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена.
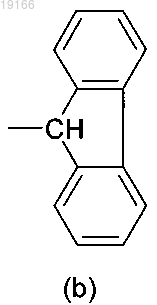
7. Соединение по п.4, где А представляет собой группу формулы (а), где R3 и R4, оба независимо, представляют собой фенил и соединены посредством простой связи с образованием трициклической кольцевой системы формулы (b)
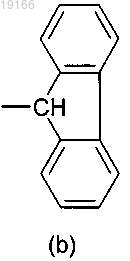
8. Соединение по п.4, где А представляет собой 9Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена.
9. Соединение по п.4, где А представляет собой бензил, возможно замещенный одним или более атомами галогена.
10. Соединение по п.4, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена.
11. Соединение по п.4, где А представляет собой тиофенилметил.
12. Соединение по п.1, где R представляет собой пропильную группу, замещенную группой -Z-R1, где Z представляет собой О и R1 представляет собой фенил, согласно формуле (III)
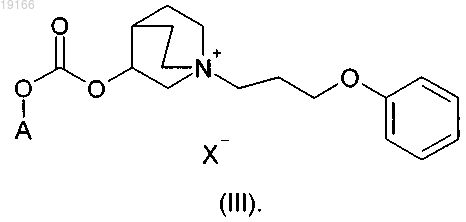
13. Соединение по п.12, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а), где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена.
14. Соединение по п.12, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена.
15. Соединение по п.12, где А представляет собой группу формулы (а), где R3 и R4, оба независимо, представляют собой фенил и они связаны посредством простой связи с образованием трициклической кольцевой системы формулы (b)
16. Соединение по п.12, где А представляет собой 9Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена.
17. Соединение по п.12, где А представляет собой бензил, возможно замещенный одним или более атомами галогена.
18. Соединение по п.12, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена.
19. Соединение по п.12, где А представляет собой тиофенилметил.
20. Фармацевтическая композиция, содержащая соединение по пп.1-19 в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами.
21. Применение соединения по любому из пп.1-19 для предупреждения и/или лечения любого бронхообструктивного или воспалительного заболевания.
22. Применение по п.21, где указанное заболевание представляет собой астму, или хронический бронхит, или хроническое обструктивное заболевание легких (COPD).
23. Устройство, выбранное из группы, состоящей из одно- или многодозового сухого порошкового ингалятора, дозирующего ингалятора и мягкого аэрозольного небулайзера, отличающееся тем, что оно содержит фармацевтическую композицию по п.20.
24. Способ получения соединений формулы (I) по п.1, включающий стадии:
1) взаимодействия аминоспирта формулы (2)
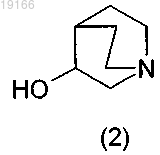
с 1,1'-карбонилдиимидазолом с получением имидазольного производного формулы (3)
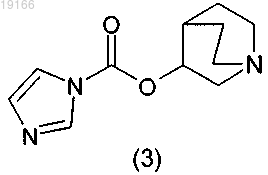
2) последующего взаимодействия со спиртом формулы (4)
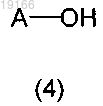
с получением соединения формулы (5)
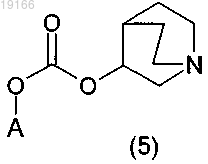
3) последующего алкилирования с помощью алкилирующего агента RX с получением четвертичной аммониевой соли формулы (I), где A, R и X являются такими, как определено в п.1.
Текст
ПРОИЗВОДНЫЕ ХИНУКЛИДИНА КАРБОНАТА И ИХ МЕДИЦИНСКИЕ КОМПОЗИЦИИ Изобретение относится к производным хинуклидина карбоната, действующим в качестве антагонистов мускариновых рецепторов, к способам получения таких производных, к композициям, содержащим их, и к их терапевтическому применению. Область изобретения Настоящее изобретение относится к производным хинуклидина карбоната, действующим в качестве антагонистов мускариновых рецепторов, к способам получения таких производных, к композициям,содержащим их, и к их терапевтическому применению. Предшествующий уровень техники Четвертичные аммониевые соли, действующие в качестве лекарственных средств - антагонистов мускариновых (М) рецепторов, в настоящее время используют в терапии для индуцирования бронходилатации для лечения респираторных заболеваний. Примеры хорошо известных лекарственных средств антагонистов М-рецепторов - представлены ипратропия бромидом и тиотропия бромидом. Некоторые химические классы, действующие в качестве лекарственных средств - селективных антагонистов М 3-рецепторов, были разработаны для лечения воспалительных или обструктивных заболеваний дыхательных путей, таких как астма и хроническое обструктивное заболевание легких (COPD). Производные хинуклидина карбамата и их применение в качестве антагонистов М 3 описано в WO 02051841, WO 03053966 и WO 2008012290. Указанные лекарственные средства - антагонисты рецепторов М и М 3 в настоящее время вводят посредством ингаляции с целью доставки лекарственного средства непосредственно в место действия и ограничения, таким образом, системного воздействия. Однако, хотя ингаляторный путь позволяет ограничивать системное воздействие, известные соединения могут, тем не менее, проявлять нежелательные побочные эффекты, вызванные системной абсорбцией. Следовательно, очень желательно предложить лекарственные средства - антагонисты рецепторов М 3, способные воздействовать местно и при этом обладающие высокой эффективностью и большой продолжительностью действия. Указанные лекарственные средства после адсорбции разлагаются до неактивных соединений, которые лишены каких-либо системных побочных эффектов, типичных для мускариновых антагонистов. В настоящем изобретении предлагаются производные хинуклидина карбоната с такими терапевтически желательными характеристиками. Соединения общей формулы (I) проявляют себя в качестве мягких лекарственных средств, так как они способны продуцировать устойчивый бронходилатирующий эффект в легком, но последовательно и быстро трансформируются в неактивные метаболиты после попадания в плазму человека. Такое поведение обеспечивает большие преимущества с точки зрения безопасности. Краткое изложение сущности изобретения Изобретение направлено на соединение общей формулы (I) где А может представлять собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4 являются одинаковыми или разными и могут быть независимо выбраны из группы, состоящей из Н, (С 3-С 8)циклоалкила, арила или гетероарила, где указанные арил или гетероарил могут быть, возможно, замещены атомом галогена или одним или несколькими заместителями, независимо выбранными из групп ОН, SH, (С 1-С 10)алкилсульфанил, (C1-С 10)алкил и (С 1-С 10)алкоксил, или когда R3 иR4, оба независимо, представляют собой арил или гетероарил, тогда они могут быть соединены посредством простой связи с образованием трициклической кольцевой системы;Z-R1, где Z выбран из СО, О, SO2, S и SO или представляет собой связь;R1 представляет собой остаток, выбранный из Н; арила, возможно замещенного метилом или метокси; гетероарила, возможно замещенного галогеном;X- представляет собой физиологически приемлемый анион, где"арил" относится к моно-, би- или трициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где по меньшей мере одно кольцо является ароматическим и один или более атомов водорода в указанных кольцах могут быть замещены фенилом или одним или более галогенами;"арилалкил" относится к группе "(С 1-С 4)алкил", замещенной одним или более фенилами и один или более атомов водорода в указанных фенилах могут быть замещены одним или более атомами галогена;"гетероарил" относится к моно- или бициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где каждое кольцо является ароматическим и где по меньшей мере один атом в кольце является гетероатомом (N, S или О);"гетероарилалкил" относится к группе "(С 1-С 4)алкил", замещенной одним или более тиенилами. Предпочтительно соединение формулы (I), где R представляет собой (С 1-С 6)алкил, замещенный -ZR1. Более предпочтительно соединение формулы (I), где R представляет собой (С 1-С 6)алкил, замещенный-Z-R1, где Z представляет собой О, СО или связь, и R1 представляет собой арил или гетероарил, предпочтительно замещенный галогеном. Также препочтительно соединение формулы (I), где R представляет собой СН 2, Z представляет собой СО и R1 представляет собой тиенил согласно формуле (II) Более предпочтительно соединение формулы (II), где А представляет собой арил, или гетероарил,или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена. Более предпочтительно соединение формулы (II), где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (II), где А представляет собой группу формулы (а), где R3 и R4, оба независимо, представляют собой фенил и соединены посредством простой связи с образованием трициклической кольцевой системы формулы (b) Также более предпочтительно соединение формулы (II), где А представляет собой 9 Н-флуорен-9 ил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (II), где А представляет собой бензил, возможно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (II), где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (II), где А представляет собой тиофенилметил. Кроме того, препочтительно соединение формулы (I), где R представляет собой пропильную группу, замещенную группой Z-R1, где Z представляет собой О и R1 представляет собой фенил, согласно формуле (III) Более предпочтительно соединение формулы (III), где А представляет собой арил, или гетероарил,или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (III), где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы(III), где А представляет собой группу формулы (а), где R3 и R4, оба независимо, представляют собой фенил и они связаны посредством простой связи с образованием трициклической кольцевой системы формулы (b) Также более предпочтительно соединение формулы (III), где А представляет собой 9 Н-флуорен-9 ил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (III), где А представляет собой бензил, возможно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (III), где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. Также более предпочтительно соединение формулы (III), где А представляет собой тиофенилметил. В настоящем изобретении также предлагаются фармацевтические композиции, содержащие соединение формулы (I) в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. В еще одном аспекте изобретения предлагается применение соединений формулы (I) для предупреждения и/или лечения любого бронхообструктивного или воспалительного заболевания. Предпочтительно заболевание представляет собой астму, или хронический бронхит, или хроническое обструктивное заболевание легких (COPD). Изобретение также направлено на устройство, которое представляет собой одно- или многодозовый сухой порошковый ингалятор, дозирующий ингалятор и мягкий аэрозольный небулайзер, содержащий фармацевтическую композицию, содержащую соединение формулы (I). В еще одном аспекте изобретения предлагается способ получения соединений формулы (I), включающий стадии: 1) взаимодействия аминоспирта формулы (2) с 1,1'-карбонилдиимидазолом с получением имидазольного производного формулы (3) 2) последующего взаимодействия со спиртом формулы (4) с получением соединения формулы (5) 3) последующего алкилирования с помощью алкилирующего агента RX с получением четвертичной аммониевой соли формулы (I), где A, R и X такие, как описано выше. Определения Термин "атомы галогена" при использовании в данном описании изобретения включает фтор, хлор,бром и йод. Выражение "(С 1-С 10)алкил" относится к алкильным группам с прямой и разветвленной цепью, где количество атомов углерода составляет от 1 до 10. Примеры групп представляют собой метил, этил, н-3 019166 пропил, изопропил, трет-бутил, пентил, гексил, гептил, октанил, ноненил и деценил. Возможно, один или более атомов водорода в указанных группах могут быть заменены атомами галогена. Производные выражения "(C1-С 10)алкоксикарбонил", "(С 1-С 10)алкилсульфанил", "(С 1 С 10)алкилсульфинил", "(С 1-С 10)алкилсульфонил" и "(С 1-С 10)алкоксил" следует понимать аналогично. Производные выражения "(С 2-С 10)алкенил" и "(С 2-С 10)алкинил" следует понимать аналогично. Выражение "алициклические соединения" включает"(С 3-С 8)циклоалкил", относящийся к циклическим неароматическим отдельным углеводородным насыщенным группам. Примеры включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктенил;"бициклоалкильные" и "трициклоалкильные" группы, которые представляют собой неароматические насыщенные циклические алкильные группировки, состоящие из двух или более колец соответственно, где указанные кольца имеют по меньшей мере один общий атом углерода. Для целей настоящего изобретения и если не указано иное, бициклоалкильные группы включают спирокольца и конденсированные кольца. Примеры бициклоалкильных групп включают, без ограничения ими, бицикло-[3.1.0]гексил, бицикло-[2.2.1]-гепт-1-ил, норборнил, спиро[4.5]децил, спиро[4.4]нонил, спиро[4.3]октил и спиро[4.2]гептил. Примером трициклоалкильной группы является адамантанил; циклические неароматические углеводородные ненасыщенные группы. Примеры включают циклогексенил, норборненил, бицикло[2.2.1]гептанил. Возможно, один или более атомов водорода в указанных группах могут быть заменены одним или более атомами галогена. Выражение "арил" относится к моно-, би- или трициклическим кольцевым системам, имеющим от 5 до 20, предпочтительно от 5 до 15 атомов в кольце, и где по меньшей мере одно кольцо является ароматическим. Возможно, один или более атомов водорода в указанных кольцах могут быть замещены одним или более атомами галогена или фенилами. Выражение "гетероарил" относится к моно-, би- или трициклическим кольцевым системам, имеющим от 5 до 20, предпочтительно от 5 до 15 атомов в кольце, где по меньшей мере одно кольцо является ароматическим и где по меньшей мере один атом в кольце является гетероатомом (например, N, S или О). Возможно, один или более атомов водорода в указанных кольцах могут быть замещены одним или более атомами галогена. Выражение "арилалкил" относится к группе "(С 1-С 4)алкил", возможно замещенной моно-, би- или три циклически ми кольцевыми системами, которые имеют от 5 до 20, предпочтительно от 5 до 15 атомов в кольце. Возможно, один или более атомов водорода в указанных кольцах могут быть замещены одним или более атомами галогена. Примеры подходящих арилалкильных групп включают бензил, бифенилметил и тиофенилметил. Выражение "гетероарилалкил" относится к группе "(С 1-С 4)алкил", возможно замещенной моно-, биили трициклическими кольцевыми системами, которые имеют от 5 до 20 атомов в кольце, предпочтительно от 5 до 15, где по меньшей мере одно кольцо является ароматическим и где по меньшей мере один атом в кольце является гетероатомом (например, N, S или О). Возможно, один или более атомов водорода в указанных кольцах могут быть замещены одним или более атомами галогена. Примеры подходящих моноциклических систем включают радикалы тиофена, циклопентадиена,бензола, пиррола, пиразола, имидазола, изоксазола, оксазола, изотиазола, тиазола, пиридина, имидазолидина, пиперидина и фурана. Примеры подходящих бициклических систем включают радикалы нафталина, бифенила, пурина,птеридина, бензотриазола, хинолина, изохинолина, индола, изоиндола и бензотиофена. Примеры подходящих трициклических систем включают радикалы флуорена. Подробное описание изобретения Изобретение направлено на производные хинуклидина карбоната, действующие в качестве антагонистов мускариновых рецепторов, и на их соли, где указанные производные предпочтительно действуют на М 3-рецепторы. Предпочтительно физиологически приемлемые анионы X включают анионы, выбранные из группы,состоящей из хлорида, бромида, иодида, сульфата, фосфата, метансульфоната, нитрата, малеата, ацетата,цитрата, фумарата, тартрата, оксалата, сукцината, бензоата и пара-толуолсульфоната, предпочтительно хлорида, бромида и иодида, более предпочтительно хлорида и бромида. Предпочтительной группой соединений формулы (I) является группа, где R представляет собой (С 1 С 6)алкил, замещенный -Z-R1, где Z и R1 такие, как описано выше. Другой предпочтительной группой соединений формулы (I) является группа, где R представляет собой (С 1-С 6)алкил, замещенный -Z-R1, где Z представляет собой О, СО или связь и R1 представляет собой арил или гетероарил, как описано выше, предпочтительно замещенный галогеном. Более предпочтительной группой соединений формулы (I) является группа, где R представляет собой СН 2, Z представляет собой СО и R1 представляет собой тиенил согласно формуле (II) где А такой, как определено выше. Первая группа соединений формулы (II) представлена соединениями, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена. Вторая группа соединений формулы (II) представлена соединениями, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. Третья группа соединений формулы (II) представлена соединениями, где А представляет собой соединение формулы (а), где R3 и R4, оба независимо, представляют собой фенил и они соединены посредством простой связи, образуя трициклическую кольцевую систему формулы (b) Четвертая группа соединений формулы (II) представлена соединениями, где А представляет собой 9 Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена. Пятая группа соединений формулы (II) представлена соединениями, где А представляет собой арилалкил, предпочтительно фенил-(С 1-С 4)алкил, более предпочтительно замещенный одним или более атомами галогена, и еще более предпочтительно А представляет собой бензил, возможно замещенный одним или более атомами галогена. Шестая группа соединений формулы (II) представлена соединениями, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. Седьмая группа соединений формулы (II) представлена соединениями, где А представляет собой тиофенилметил. Другой предпочтительной группой соединений формулы (I) является группа, где R представляет собой пропил, замещенный группой -Z-R1, где Z представляет собой О и R1 представляет собой фенил,согласно формуле (III) где А такой, как определено выше. Первая группа соединений формулы (III) представлена соединениями, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена. Вторая группа соединений формулы (III) представлена соединениями, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. Третья группа соединений формулы (III) представлена соединениями, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил и они соединены посредством простой связи с образованием трициклической кольцевой системы формулы (b) Четвертая группа соединений формулы (III) представлена соединениями, где А представляет собой 9 Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена. Пятая группа соединений формулы (III) представлена соединениями, где А представляет собой арилалкил, предпочтительно фенил-(С 1-С 4)алкил, более предпочтительно замещенный одним или более атомами галогена, и еще более предпочтительно А представляет собой бензил, возможно замещенный одним или более атомами галогена. Шестая группа соединений формулы (III) представлена соединениями, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. Седьмая группа соединений формулы (III) представлена соединениями, где А представляет собой тиофенилметил. Другой предпочтительной группой соединений формулы (I) является группа, где R представляет собой метил, замещенный группой -Z-R1, где Z представляет собой СО и R1 представляет собой фенил согласно формуле (IV) Другой предпочтительной группой соединений формулы (I) является группа, где R представляет собой метил, замещенный группой -Z-R1, где Z представляет собой СО и R1 представляет собой тиенил согласно формуле (V) Очевидно, что соединения формулы (I) могут содержать асимметрические центры. Следовательно,в изобретение также включены оптические стереоизомеры и их смеси. Если соединения согласно изобретению имеют по меньшей мере один асимметрический центр, они могут существовать в виде энантиомеров. Если соединения согласно изобретению имеют два или более асимметрических центра, они могут, кроме того, существовать в виде диастереоизомеров. Понятно, что все такие изомеры и их смеси в любом соотношении включены в объем настоящего изобретения. Активное соединение (I) демонстрирует по меньшей мере один хиральный центр, который представлен углеродным атомом хинуклидина, несущим карбонатную группу. В предпочтительных воплощениях активное соединение (I) находится в форме, по существу, чистого (R)-энантиомера, где энантиомерная чистота составляет выше 85%, более предпочтительно выше 90%,более предпочтительно выше 95% и еще более предпочтительно выше 99%. Согласно конкретным воплощениям в настоящем изобретении предлагаются соединения, представленные ниже Соединения формулы (I) могут быть получены согласно известным способам. Некоторые из способов, которые можно использовать, описаны ниже и представлены на схеме. Общий способ получения соединений формулы (I). Соединения общей формулы (I) могут быть получены согласно общему способу, который включает следующие стадии. Стадия 1. Аминоспирт формулы (2) приводят во взаимодействие с 1,1'-карбонилдиимидазолом (1) в апротонном растворителе. Предпочтительно взаимодействие выполняют в растворителе, выбранном изCH3CN, CH2Cl2, CHCl3, тетрагидрофурана (THF) и диоксана, при температуре в диапазоне от 0 С до точки кипения растворителя. Добавляют воду и производное имидазола (3) экстрагируют растворителем. Примерами растворителей, которые можно соответствующим образом использовать, являются этилаце-9 019166 тат, диэтиловый эфир, метиленхлорид. Стадия 2. Растворитель выпаривают досуха и остаток приводят во взаимодействие со спиртом формулы (4) в апротонном растворителе. Предпочтительно растворитель выбирают из тетрагидрофурана(THF), диметилформамида (DMF), диметилацеталя (DMA). Предпочтительно спирт активируют с помощью основания, предпочтительно выбранного из NaH, BuLi (бутиллитий), диизопропиламида лития(LDA), с получением соединения формулы (5). Стадия 3. Соединения формулы (5) можно алкилировать по атому азота третичного амина при помощи алкилирующего агента RX, где R такой, как определено ранее, и X представляет собой согласно известным условиям хлор, бром или йод, получая четвертичную аммониевую соль формулы (I). В изобретении также предлагаются фармацевтические композиции соединений формулы (I) в смеси с одним или более фармацевтически приемлемыми носителями, например, описанными в Remington'sPharmaceutical Sciences Handbook, XVII Ed., Mack Pub., N.Y., U.S.A. В настоящем изобретении также раскрыты фармацевтические композиции соединений формулы (I) самих по себе или в комбинации либо в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. В настоящем изобретении также раскрыты фармацевтические композиции, пригодные для введения посредством ингаляции. В настоящем изобретении также раскрыто применение соединений формулы (I) для изготовления лекарственного средства. В настоящем изобретении раскрыто применение соединений формулы (I) для изготовления лекарственного средства для предупреждения и/или лечения любого бронхообструктивного или воспалительного заболевания, предпочтительно астмы или хронического бронхита либо хронического обструктивного заболевания легких (COPD). Кроме того, в настоящем изобретении раскрыт способ предупреждения и/или лечения любого бронхообструктивного или воспалительного заболевания, предпочтительно астмы, или хронического бронхита, или хронического обструктивного заболевания легких (COPD), который включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения общей формулы(I). Введение соединений по настоящему изобретению можно выполнять согласно требованиям пациента, например перорально, назально, парентерально (подкожно, внутривенно, внутримышечно, интрастернально и инфузионно), ингаляционно, ректально, вагинально, местно, локально, трансдермально и посредством внутриглазного введения. Для введения соединений по изобретению можно использовать различные твердые пероральные лекарственные формы, включая такие твердые формы, как таблетки, желатиновые капсулы, капсулы,таблетки в форме капсулы, гранулы, пастилки и нерасфасованные порошки. Соединения по настоящему изобретению можно вводить сами по себе или в комбинации с различными фармацевтически приемлемыми носителями, разбавителями (такими как сахароза, маннит, лактоза, крахмалы) и известными эксципиентами, включая суспендирующие агенты, солюбилизаторы, буферные агенты, связывающие вещества, разрыхлители, консерванты, красители, ароматизаторы, смазывающие вещества и т.п. Капсулы,таблетки и гели с замедленным высвобождением также являются предпочтительными при введении соединений по настоящему изобретению. Различные жидкие пероральные лекарственные формы, включающие водные и неводные растворы,эмульсии, суспензии, сиропы и эликсиры, также можно использовать для введения соединений по изобретению. Такие лекарственные формы могут также содержать подходящие известные инертные разбавители, такие как вода, и подходящие известные эксципиенты, такие как консерванты, увлажняющие агенты, подсластители, ароматизаторы, а также агенты для эмульгирования и/или суспендирования соединений по изобретению. Соединения по настоящему изобретению можно инъецировать, например,внутривенно, в форме изотонического стерильного раствора. Также возможны другие препараты. Суппозитории для ректального введения соединений по изобретению могут быть получены смешиванием соединения с подходящим эксципиентом, таким как кокосовое масло, салицилаты и полиэтиленгликоли. Композиции для вагинального введения могут быть представлены в форме крема, геля, пасты, пены или спреевая композиция, содержащая в дополнение к активному ингредиенту такие подходящие носители, также известна. Для местного введения фармацевтическая композиция может быть представлена в форме кремов,мазей, линиментов, лосьонов, эмульсий, суспензий, гелей, растворов, паст, порошков, спреев и капель,пригодных для введения в кожу, глаз, ухо или нос. Местное введение может также включать трансдермальное введение посредством таких средств, как трансдермальные пластыри. Для лечения заболеваний респираторного тракта соединения согласно изобретению предпочтительно вводят посредством ингаляции. Ингаляционные препараты включают ингаляционные порошки, пропеллентсодержащие дозированные аэрозоли или не содержащие пропеллент ингаляционные композиции. Для введения в виде сухого порошка можно использовать одно- или многодозовые ингаляторы, известные из уровня техники. В этом случае порошком можно наполнять желатиновые, пластиковые или другие капсулы, картриджи или блистерные упаковки либо емкость. Разбавитель или носитель, как правило, нетоксичный и химически инертный к соединениям по изобретению, например лактоза или любая другая добавка, подходящий для улучшения вдыхаемой фракции, может быть добавлен к порошкообразным соединениям по изобретению. Ингаляционные аэрозоли, содержащие газ-пропеллент, такой как гидрофтороалканы, могут содержать соединения по изобретению либо в форме раствора, либо в дисперсной форме. Композиции с пропеллентом в качестве носителя также могут содержать другие ингредиенты, такие как сорастворители,стабилизаторы и, возможно, другие эксципиенты. Не содержащие пропеллент ингаляционные композиции, содержащие соединения по изобретению,могут находиться в форме растворов или суспензий в водной, спиртовой или водно-спиртовой среде, и они могут быть доставлены при помощи струйных или ультразвуковых небулайзеров, известных из уровня техники, или при помощи мягких аэрозольных небулайзеров, таких как Respimat. В настоящем изобретении также раскрыт набор, содержащий фармацевтические композиции соединений формулы (I) самих по себе или в комбинации либо в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами и устройство, которое может представлять собой одно- или многодозовый сухой порошковый ингалятор, дозирующий ингалятор и мягкий аэрозольный небулайзер, содержащий соединения общей формулы (I). Соединения по изобретению могут быть введены в виде одного активного агента или в комбинации с другими фармацевтическими активными ингредиентами, включая используемые в настоящее время в лечении респираторных расстройств, например бета 2-агонисты, кортикостероиды и ингибиторы PDE4(фосфодиэстеразы-4). Дозировки соединений по изобретению зависят от множества факторов, включая конкретное заболевание, подлежащее лечению, тяжесть симптомов, путь введения, частоту интервалов между введениями, конкретное используемое соединение, эффективность, токсикологический профиль и фармакокинетический профиль соединения. Предпочтительно соединения формулы (I) можно вводить, например, в дозировке от 0,001 и до 1000 мг/сутки, предпочтительно от 0,1 и до 500 мг/сутки. Если соединения формулы (I) вводят ингаляционным путем, их предпочтительно дают в дозировке от 0,001 и до 500 мг/сутки, предпочтительно от 0,1 и до 200 мг/сутки. Соединения формулы (I) можно вводить для предупреждения и/или лечения бронхообструктивных или воспалительных заболеваний, таких как астма, хронический бронхит, хроническое обструктивное заболевание легких (COPD), бронхиальная гиперреактивность, кашель, эмфизема или ринит; урологических расстройств, таких как недержание мочи, поллакиурия, цистоспазм, хронический цистит и сверхактивный мочевой пузырь (ОАВ); желудочно-кишечных расстройств, таких как кишечный синдром, спастический колит, дивертикулит, пептическая язва, моторика желудочно-кишечного тракта или желудочная секреция кислоты; сухость во рту; мидриаз, тахикардия; офтальмологические вмешательства, сердечно-сосудистые расстройства, такие как вагус-индуцированная синусовая брадикардия. Далее настоящее изобретение будет дополнительно описано при помощи следующих примеров. Пример 1. Получение (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты В атмосфере азота 7,0 г (55,0 ммоль) (R)-3-хинуклидинола суспендируют в 100 мл CH2Cl2. После охлаждения суспензии до 0 С добавляют раствор 1,1'-карбонилдиимидазола (10,7 г, 66,0 ммоль) в 150 млCH2Cl2. Реакционную смесь перемешивают при 0 С в течение 4 ч, затем добавляют воду (100 мл). Органический слой отделяют, промывают водой, сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток масла (13,1 г) используют без дополнительной очистки. Пример 2. Получение (R)-1-азабицикло[2.2.2]окт-3-илового эфира бис-(3-фторфенил)метилового эфира карбоновой кислотыBuLi (бутиллитий) 2,5 М в гексане (2,0 мл, 5 ммоль) при 0 С; после перемешивания в течение 30 мин добавляют раствор (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты (1,1 г, 5 ммоль), полученный как описано в примере 1, в безводном THF (16 мл) и смеси перемешивают при 0 С в течение 1,5 ч. Добавляют воду (100 мл) и смесь экстрагируют EtOAc (250 мл). Собранные органические слои сушат над сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле, элюируя смесью CH2Cl2/MeOH=95/5. Фракции, содержащие продукт, объединяют и концентрируют упариванием с получением 1,4 г (75% выход) указанного в заголовке соединения в виде светло-желтого масла. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.31 (m, 8H), 6.72 (s, 1H), 4.66 (m, 1H), 3.11 (m, 1H), 2.58 (m,5H), 1.96 (d, 1H, J=2,98 Гц), 1.59 (m, 4 Н). Следующие промежуточные соединения (примеры 3-13) получали способом, аналогичным способу,используемому для получения соединений из примера 2, посредством взаимодействия соединения, полученного в примере 1, с подходящими спиртами, такими как бензгидрол, флуоренол, 3-фторбензол, 4 фторбензол, 4-бромбензол, 2-гидроксибифенил, 2-гидроксиметилтиофен, бис-(4-хлорфенол) или бис-(4 бромфенол). Пример 3. Бензгидриловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с бензгидролом. Пример 4. 9 Н-Флуорен-9-иловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с флуоренолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.86 (d, 2H, J=7,5 Гц), 7.63 (t, 2 Н, J=6,5 Гц), 7.48 (t, 2H, J=7,5 Гц), 7.36 (m, 2H), 6.60 (s, 1H), 4.77 (t, 1H, J=4,2 Гц), 3.19 (dd, 1H, J=8,3, 14,9 Гц), 2.65 (m, 5 Н), 2.04 (d, 1H,J=2,9 Гц), 1.55 (m, 4H). Пример 5. 3-Фторбензиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с 3-фторбензолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.43 (m, 1 Н), 7.18 (m, 3 Н), 5.15 (s, 2H), 4.66 (m, 1H), 3.11 (m,1H), 2.54 (m, 4 Н), 1.96 (m, 1H), 1.49 (m, 5H). Пример 6. 4-Фторбензиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с 4-фторбензолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.46 (m, 2H), 7.22 (m, 2H), 5.11 (s, 2H), 4.63 (m, 1H), 2.61 (m,5H), 1.95 (d, 1 Н, J=3,0 Гц), 1.48 (m, 5H). Пример 7. 4-Бромбензиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с 2-гидроксибифенилом. Пример 9. Тиофен-2-илметиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с 2-гидроксиметилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.62 (m, 1 Н), 7.24 (m, 1 Н), 7.07 (М, 1 Н), 5.33 (s, 2H), 4.67 (m,1H), 3.14 (m, 1 Н), 2.64 (m, 5 Н), 1.98 (d, 1 Н, J=3,1 Гц), 1.30 (m, 4 Н). Пример 10. бис-(4-Хлорфенил)метиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с бис-(4-хлорфенолом). 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.47 (m, 8H), 6.74 (s, 1H), 4.66 (t, 1H, J=4,0 Гц), 3.13 (m, 1H),2.66 (m, 5 Н), 1.97 (d, 1H, J=3,0 Гц), 1.51 (m, 4H). Пример 11. бис-(4-Бромфенил)метиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с бис-(4-бромфенолом). 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.59 (m, 4H), 7.37 (m, 4H), 6.68 (s, 1H), 4.63 (t, 1H, J=3,0 Гц),3.30 (s, 1H), 3.08 (m, 1H), 2.64 (m, 4H), 1.94 (d, 1H, J=3,0 Гц), 1.59 (m, 4H). Пример 12. бис-(4-Фторфенил)метиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с бис-(4-фторфенолом). 1 Н ЯМР анализ (300 МГц, CDCl3-d6) : 7.34 (m, 4H), 7.06 (m, 4H), 6.67 (s, 1H), 4.72 (m, 1H), 3.23 (m,1H), 2.83 (m, 5H), 2.08 (m, 1H), 1.49 (m, 4H). Пример 13. 3-Бромбензиловый эфир (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового Целевой продукт получают посредством взаимодействия 1,4 г (3,7 ммоль) бис-(3 фторфенил)метилового эфира (R)-1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты (полученного, как описано в примере 2) с 2-(2-хлор)ацетилтиофеном (602 мг, 3,7 ммоль) в EtOAc (5 мл). После перемешивания в течение 8 ч при комнатной температуре осажденное твердое вещество фильтруют,промывают Et2O (2 мл) и сушат в вакууме при 50 С. Получают 1,3 г указанного в заголовке соединения в виде белого твердого вещества. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.06-1.97 (4 Н, m), 2.42 (1 Н, br s), 3.86-3.71 (6 Н, m), 4.25 (1 Н,m), 5.13 (2 Н, s), 6.78 (1 Н, s), 7.47-7.15 (9 Н, m), 8.11 (1 Н, d), 8.22 (1 Н, d). Следующие соединения получают, используя способ, описанный в примере 14, и, в частности, посредством взаимодействия соединений, описанных в примерах 3-13, с 2-(2-хлор)ацетилтиофеном, или 1 фенетилбромидом, или 1-бензилхлоридом, или метиломйодидом или 1-(3-феноксипропил)бромидом, как описано ниже. Пример 15. Целевой продукт получают посредством взаимодействия бензгидрилового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.03-1.95 (4 Н, m), 2.40 (1 Н, s), 3.88-3.65 (5 Н, m), 4.19 (1 Н,m), 5.13 (1 Н, br s), 5.24 (2H, s), 6.74 (1H, s), 7.45-7.30 (11H, m), 8.16 (1H, d), 8.22 (1H, d). Пример 16. Целевой продукт получают посредством взаимодействия 9 Н-флуорен-9-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.09-1.98 (4 Н, m), 2.50 (1 Н, s), 3.78-3.69 (4 Н, m), 3.95 (1 Н, d),4.28 (1 Н, m), 5.27-5.22 (3 Н, br s), 6.52 (1 Н, s), 7.39-7.35 (3 Н, m), 7.50 (2 Н, d), 7.67 (2 Н, t), 7.87 (2 Н, d), 8.17 Целевой продукт получают посредством взаимодействия 3-фторбензилового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.07-1.93 (4 Н, m), 2.42 (1 Н, s), 3.93-3.66 (5 Н, m), 4.27-4.21 Целевой продукт получают посредством взаимодействия 4-фторбензилового эфира (R)-1- 14019166 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.09-1.89 (4 Н, m), 2.41 (1 Н, br s), 3.89-3.67 (5 Н, m), 4.25-4.18 Целевой продукт получают посредством взаимодействия 4-бромбензилового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.06-1.93 (4 Н, m), 2.41 (1 Н, s), 3.91-3.35 (5 Н, m), 4.26-4.19 Целевой продукт получают посредством взаимодействия бифенил-2-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.03-1.88 (4 Н, m), 2.23 (1 Н, s), 3.79-3.60 (5 Н, m), 4.17-4.10 Целевой продукт получают посредством взаимодействия 9 Н-флуорен-9-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 1-фенетилбромидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.04-1.92 (4 Н, m), 2.50 (2 Н, s), 3.09-3.00 (2 Н, m), 3.70-3.43 Целевой продукт получают посредством взаимодействия 9 Н-флуорен-9-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 1-бензилхлоридом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 1.99-1.81 (4 Н, m), 2.42 (1 Н, s), 3.51-3.41 (4 Н, m), 3.71 (1 Н,m), 3.92 (1 Н, m), 4.63 (2 Н, q), 5.16 (1 Н, s), 6.64 (1 Н, s), 7.68-7.36 (11 Н, m), 7.87 (2 Н, d). Пример 23. (R)-3-(9 Н-Флуорен-9-илоксикарбонилокси)-1-метил-1-азониабицикло[2.2.2]октана йодид (соединение 10) Целевой продукт получают посредством взаимодействия 9 Н-флуорен-9-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с метилйодидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 1.99 (5 Н, m), 2.50 (1 Н, s), 3.00 (3 Н, s), 3.44 (3 Н, m), 3.47 (1 Н,d), 3.67 (1 Н, m), 5.25 (1 Н, m), 6.64 (1 Н, s), 7.88-7.36 (8 Н, m). Целевой продукт получают посредством взаимодействия 9 Н-флуорен-9-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 1-(3-феноксипропил)бромидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.19-1.90 (7 Н, m), 2.50 (1 Н, s), 3.68-3.32 (6 Н, m), 4.05-3.96 Целевой продукт получают посредством взаимодействия бифенил-2-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 1-(3-феноксипропил)бромидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.20-1.83 (7 Н, m), 2.50 (2 Н, s), 3.55-3.28 (5 Н, m), 3.90-3.83 Целевой продукт получают посредством взаимодействия бифенил-2-илового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с метилйодидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.18-1.80 (6 Н, m), 2.95 (3 Н, s), 3.47-3.32 (4 Н, m), 3.84-3.75 Целевой продукт получают посредством взаимодействия тиофен-2-илметилового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.10-1.95 (4 Н, m), 2.44 (1 Н, br s), 3.87-3.66 (5 Н, m), 4.25-4.16 Целевой продукт получают посредством взаимодействия бис-(4-хлорфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 1.90-2.06 (4 Н, m), 2.41 (1 Н, s), 3.61-3.85 (5 Н, m), 4.14 (1 Н, s),5.12 (3 Н, s), 7.35 (1 Н, t), 7.47 (9 Н, d), 8.11 (1 Н, d), 8.22 (1 Н, d). Пример 29. Целевой продукт получают посредством взаимодействия бис-(4-бромфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. Целевой продукт получают посредством взаимодействия бис-(4-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.09-1.96 (4 Н, m), 2.40 (1 Н, br s), 3.89-3.65 (5 Н, m), 4.23-4.16 Целевой продукт получают посредством взаимодействия 3-бромбензилового эфира (R)-1 азабицикло[2.2.2]окт-3-илового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 2.14-1.96 (4 Н, m), 2.45 (1 Н, br s), 3.91-3.64 (5 Н, m), 4.26-4.19NaH (60% дисперсия в минеральном масле, 36,3 мг, 0,9 ммоль) добавляют к раствору (2 фторфенил)-(3-фторфенил)метанола (200 мг, 0,9 ммоль) в безводном THF (3 мл) при 0 С. Реакционную смесь перемешивают при данной температуре в течение 30 мин, затем добавляют (R)-хинуклидин-3-ил 1 Н-имидазол-1-карбоксилат (201 мг, 0,9 ммоль), полученный, как описано в примере 1, и продолжают перемешивание при комнатной температуре в течение 1 ч. Затем добавляют насыщенный раствор NH4Cl и водную фазу экстрагируют EtOAc (330 мл). Органическую фазу сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученное неочищенное вещество очищают посредством флэш-хроматографии на силикагеле, элюируя смесью EtOAc/MeOH=9/1. Целевой продукт собирают в виде бесцветного вязкого масла (244 мг; 72% выход; смесь диастреоизомеров). 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.34-7.57 (m, 3 Н), 7.11-7.33 (m, 5 Н), 6.87 (s, 1 Н), 4.50-4.81LC-MS (ESI POS) (ионизация электрораспыление, положительная): 374,14 (МН+). Следующие промежуточные соединения (примеры 33-42) были получены способом, аналогичным способу, используемому для получения соединения из примера 32, посредством взаимодействия соединения, полученного в примере 1, с подходящими спиртами, такими как бис-(2-хлорфенил)метанол, фенилортотолилметанол, (3-фторфенил)-(3-метоксифенил)метанол, циклогексил-(3-фторфенил)метанол, (3 хлорфенил)-(3-фторфенил)метанол,(3,5-дифторфенил)-(3-фторфенил)метанол,(3 фторфенил)метатолилметанол, (3-фторфенил)-(4-метилсульфанилфенил)метанол, (3-фторфенил)-(4 фторфенил)метанол, (3,4-дифторфенил)фенилметанол, (3-фторфенил)фенилметанол. Пример 33. бис-(2-Хлорфенил)метиловый эфир (R)-(1-азабицикло[2.2.2]окт-3-илового) эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с бис-(2-хлорфенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.51-7.63 (m, 2 Н), 7.37-7.51 (m, 4 Н), 7.22-7.31 (m, 2 Н), 7.21LC-MS (ESI POS): 406,05 (МН+). Пример 34. Фенилортотолил метиловый эфир (R)-(1-азабицикло[2.2.2]окт-3-илового) эфира карбоновой кислоты Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с фенилортотолилметанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.09-7.51 (m, 9 Н), 6.80 (s, 1 Н), 4.47-4.79 (m, 1 Н), 3.10 (dd,1 Н), 2.54-2.77 (m, 5 Н), 2.27 (s, 3 Н), 1.94 (br s, 1 Н), 1.52-1.76 (m, 2 Н), 1.38-1.52 (m, 1 Н), 1.16-1.38 (m, 1 Н). Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3-фторфенил)-(3-метоксифенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.37-7.51 (m, 1 Н), 7.21-7.35 (m, 3 Н), 7.08-7.20 (m, 1 Н), 6.947.04 (m, 2 Н), 6.82-6.92 (m, 1 Н), 6.65 (s, 1 Н), 4.53-4.79 (m, 1 Н), 3.75 (s, 3 Н), 3.11 (dd, 1 Н), 2.5-2.79 (m, 5 Н),1.86-2.01 (m, 1 Н), 1.53-1.76 (m, 2 Н), 1.40-1.53 (m, 1 Н), 1.21-1.40 (m, 1 Н). Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с циклогексил-(3-фторфенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.33-7.49 (m, 1 Н), 7.02-7.21 (m, 3 Н), 5.31 (d, 1 Н), 4.34-4.69 Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3-хлорфенил)-(3-фторфенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.50-7.56 (m, 1 Н), 7.35-7.49 (m, 4 Н), 7.25-7.35 (m, 2 Н), 7.087.21 (m, 1 Н), 6.71 (s, 1 Н), 4.58-4.71 (m, 1 Н), 3.02-3.17 (m, 1 Н), 2.54-2.78 (m, 4 Н), 1.91-1.98 (m, 1 Н), 1.401.70 (m, 3 Н), 1.21-1.38 (m, 2 Н). Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3,5-дифторфенил)-(3-фторфенил)метанолом. Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3-фторфенил)метатолилметанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.36-7.49 (m, 1 Н), 7.06-7.32 (m, 7 Н), 6.64 (s, 1 Н), 4.32-4.80 Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3-фторфенил)-(4-метилсульфанилфенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.31-7.49 (m, 3 Н), 7.20-7.30 (m, 4 Н), 7.07-7.20 (m, 1 Н), 6.66 Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3-фторфенил)-(4-фторфенил)метанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.36-7.56 (m, 3 Н), 7.03-7.32 (m, 5 Н), 6.72 (s, 1 Н), 4.64 (ddd,1 Н), 3.10 (dd, 1 Н), 2.65-2.80 (m, 2 Н), 2.54-2.65 (m, 3 Н), 1.95 (br s, 1 Н), 1.53-1.74 (m, 2 Н), 1.40-1.53 (m, 1 Н),1.18-1.40 (m, 1 Н). Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового эфира имидазол-1-карбоновой кислоты с (3,4-дифторфенил)фенилметанолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.47-7.62 (m, 1 Н), 7.20-7.47 (m, 7 Н), 6.69 (s, 1 Н), 4.64 (m,1 Н), 3.10 (dd, 1 Н), 2.54-2.79 (m, 5 Н), 1.87-2.01 (m, 1 Н), 1.53-1.74 (m, 2 Н), 1.39-1.53 (m, 1 Н), 1.17-1.39 (m,1 Н). Целевой продукт получают посредством взаимодействия (R)-1-азабицикло[2.2.2]окт-3-илового Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-фенилэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.89-8.06 (m, 2H), 7.70-7.86 (m, 1H), 7.56-7.70 (m, 2H), 7.397.55 (m, 2H), 7.26-7.39 (m, 4H), 7.07-7.26 (m, 2H), 6.79 (s, 1H), 5.19 (s, 2H), 5.13-5.18 (m, 1H), 4.03-4.27 (m,1H), 3.56-3.86 (m, 5H), 2.35-2.47 (m, 1H), 1.91-2.16 (m, 4H). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бромацетамидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.92 (br s, 1 Н), 7.69 (br s, 1H), 7.38-7.53 (m, 2H), 7.25-7.38 (m,4H), 7.06-7.25 (m, 2H), 6.77 (s, 1H), 5.10 (br s, 1H), 4.02-4.20 (m, 1H), 3.99 (s, 2H), 3.76-3.85 (m, 1H), 3.493.74 (m, 4H), 2.32-2.43 (m, 1H), 1.83-2.09 (m, 4H). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-паратолилэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.73-8.03 (m, 2 Н), 7.26-7.50 (m, 8 Н), 7.03-7.25 (m, 2 Н), 6.78 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-(4-фторфенил)этаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.98-8.18 (m, 2 Н), 7.40-7.58 (m, 4 Н), 7.25-7.40 (m, 4 Н), 7.05- 20019166 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-(4-метоксифенил)этаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.92-8.03 (m, 2 Н), 7.25-7.52 (m, 6 Н), 6.95-7.25 (m, 4 Н), 6.78 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-тиофен-3-илэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.62 (dd, 1 Н), 7.74 (dd, 1 Н), 7.56 (dd, 1 Н), 7.39-7.52 (m, 2 Н),7.27-7.39 (m, 4 Н), 7.09-7.25 (m, 2 Н), 6.78 (s, 1 Н), 5.10-5.27 (m, 1 Н), 5.03 (s, 2 Н), 4.14 (dd, 1 Н), 3.45-3.94 (m,5 Н), 2.36-2.47 (m, 1 Н), 1.70-2.19 (m, 4 Н). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-N-фенилацетамидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 10.52 (s, 1 Н), 7.52-7.63 (m, 2 Н), 7.26-7.51 (m, 8 Н), 7.01-7.23 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-(5-хлортиофен-2-ил)этаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.00 (d, 1 Н), 7.38-7.60 (m, 3 Н), 7.25-7.38 (m, 4 Н), 7.02-7.25 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)- 21019166 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-тиазол-2-илэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.39 (d, 1 Н), 8.24 (d, 1 Н), 7.39-7.52 (m, 2 Н), 7.26-7.39 (m, 4 Н),7.10-7.25 (m, 2 Н), 6.78 (s, 1 Н), 5.22 (s, 2 Н), 4.98-5.19 (m, 1 Н), 4.07-4.33 (m, 1 Н), 3.52-4.01 (m, 5 Н), 2.362.45 (m, 1 Н), 1.80-2.17 (m, 4 Н). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-ортотолилэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.66-7.92 (m, 1 Н), 7.52-7.65 (m, 1 Н), 7.26-7.51 (m, 8 Н), 7.097.24 (m, 2 Н), 6.79 (s, 1 Н), 5.11-5.24 (m, 1 Н), 5.08 (s, 2 Н), 4.06-4.26 (m, 1 Н), 3.53-3.92 (m, 5 Н), 2.46 (s, 3 Н),2.36-2.45 (m, 1 Н), 1.83-2.19 (m, 4 Н). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 2-бром-1-метатолилэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.70-7.84 (m, 2 Н), 7.39-7.64 (m, 4 Н), 7.26-7.39 (m, 4 Н), 7.107.24 (m, 2 Н), 6.79 (s, 1 Н), 5.17 (s, 2 Н), 5.15-5.26 (m, 1 Н), 4.00-4.29 (m, 1 Н), 3.48-3.90 (m, 5 Н), 2.42-2.46 (m,1 Н), 2.41 (s, 3 Н), 1.86-2.15 (m, 4 Н). Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 5-бром-2-метилпент-2-еном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.39-7.52 (m, 2 Н), 7.25-7.39 (m, 4 Н), 7.08-7.23 (m, 2 Н), 6.77 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с 1-бензо[b]тиофен-2-ил-2-бромэтаноном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.50 (s, 1 Н), 8.01-8.26 (m, 2 Н), 7.58-7.67 (m, 1 Н), 7.51-7.58 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с бромметилбензолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.39-7.60 (m, 7 Н), 7.24-7.37 (m, 4 Н), 7.11-7.24 (m, 2 Н), 6.77 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с (2-бромоэтокси)бензолом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.39-7.51 (m, 2 Н), 7.26-7.37 (m, 6 Н), 7.11-7.23 (m, 2 Н), 6.947.06 (m, 3 Н), 6.78 (s, 1 Н), 4.92-5.20 (m, 1 Н), 4.44 (br s, 2 Н), 3.92-4.10 (m, 1 Н), 3.67-3.75 (m, 2 Н), 3.41-3.67 Целевой продукт получают посредством взаимодействия бис-(3-фторфенил)метилового эфира (R)1-азабицикло[2.2.2]окт-3-илового эфира с метилйодидом. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 7.40-7.52 (m, 2 Н), 7.25-7.37 (m, 4 Н), 7.10-7.25 (m, 2 Н), 6.77N,N-Диизопропилэтиламин (0,037 мл, 0,22 ммоль) добавляют к раствору 2-бром-1-(пиридин-4 ил)этанон-гидробромида (60,2 мг, 0,22 ммоль), растворенного в EtOAc (0,5 мл). Через 10 мин добавляют раствор (R)-бис-(3-фторофенил)метилхинуклидин-3-илкарбоната (80 мг, 0,22 ммоль), полученный, как описано в примере 2, в EtOAc (0,5 мл), и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Добавляют Et2O (1 мл) и осадок собирают фильтрованием с аспирацией. Твердое вещество растворяют в воде и экстрагируют DCM. Органическую фазу сушат над безводным сульфатом натрия,фильтруют и растворитель выпаривают при пониженном давлении с получением целевого соединения в виде розового твердого вещества (76 мг; 62% выход). 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.47-9.13 (m, 2 Н), 7.67-7.95 (m, 2 Н), 7.39-7.56 (m, 2 Н), 7.257.39 (m, 4 Н), 7.06-7.25 (m, 2 Н), 6.78 (s, 1 Н), 5.19 (s, 2 Н), 5.07-5.18 (m, 1 Н), 4.00-4.30 (m, 1 Н), 3.47-3.89 (m,5 Н), 2.39-2.46 (m, 1 Н), 1.88-2.22 (m, 4 Н). Целевой продукт получают посредством взаимодействия (3-фторфенил)-(2-фторфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (d, 1 Н), 7.97-8.15 (m, 1 Н), 7.10-7.59 (m, 9 Н), 6.93 (s, 1 Н),5.12-5.27 (m, 1 Н), 5.07 (s, 2 Н), 4.05-4.28 (m, 1 Н), 3.52-3.95 (m, 5 Н), 2.38-2.46 (m, 1 Н), 1.71-2.18 (m, 4 Н). Целевой продукт получают посредством взаимодействия бис-(2-хлорфенил)метилового эфира (R)(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.09 (dd, 1 Н), 7.52-7.69 (m, 2 Н), 7.39-7.53 (m,4 Н), 7.27-7.39 (m, 3 Н), 7.26 (s, 1 Н), 5.12-5.29 (m, 1 Н), 5.09 (s, 2 Н), 4.15 (dd, 1 Н), 3.45-3.95 (m, 5 Н), 2.45 (br Целевой продукт получают посредством взаимодействия фенилортотолил метилового эфира (R)-(1 азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (d, 1H), 7.99-8.14 (m, 1H), 7.12-7.53 (m, 10H), 6.85 (s,1H), 5.09-5.21 (m, 1H), 5.07 (s, 2H), 3.94-4.23 (m, 1H), 3.44-3.90 (m, 5H), 2.34-2.47 (m, 1H), 2.29 (s, 3H),1.77-2.16 (m, 4H). Целевой продукт получают посредством взаимодействия(3-фторфенил)-(3 метоксифенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.09 (d, 1 Н), 7.38-7.51 (m, 1 Н), 7.24-7.38 (m,4 Н), 7.09-7.22 (m, 1 Н), 6.97-7.06 (m, 2 Н), 6.84-6.95 (m, 1 Н), 6.72 (s, 1 Н), 5.12-5.20 (m, 1 Н), 5.09 (s, 2 Н),4.06-4.22 (m, 1 Н), 3.78-3.89 (m, 1 Н), 3.76-3.75 (s, 3 Н), 3.52-3.73 (m, 4 Н), 2.36-2.46 (m, 1 Н), 1.84-2.18 (m,4 Н). Целевой продукт получают посредством взаимодействия (циклогексил-(3-фторфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.12-8.31 (m, 1H), 7.88-8.15 (m, 1H), 7.29-7.53 (m, 2H), 6.967.24 (m, 3H), 5.30-5.47 (m, 1H), 5.02-5.20 (m, 3H), 3.99-4.25 (m, 1H), 3.47-3.89 (m, 5H), 1.45-2.21 (m, 9H),0.79-1.45 (m, 7H). Целевой продукт получают посредством взаимодействия (3-хлорфенил)-(3-фторфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.08 (dd, 1 Н), 7.52-7.61 (m, 1 Н), 7.26-7.51 (m,7 Н), 7.11-7.23 (m, 1 Н), 6.78 (s, 1 Н), 5.11-5.20 (m, 1 Н), 5.06 (s, 2 Н), 4.04-4.23 (m, 1 Н), 3.78-3.89 (m, 1 Н),3.51-3.78 (m, 4 Н), 2.37-2.46 (m, 1 Н), 1.69-2.21 (m, 4 Н). Целевой продукт получают посредством взаимодействия(3,5-дифторфенил)-(3 фторфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил) эфира карбоновой кислоты с 2-(2 хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.08 (dd, 1 Н), 7.39-7.60 (m, 2 Н), 7.31-7.39 (m,1 Н), 7.12-7.29 (m, 5 Н), 7.02 (s, 1 Н), 5.11-5.26 (m, 1 Н), 5.06 (s, 2 Н), 4.04-4.27 (m, 1 Н), 3.48-3.96 (m, 5 Н),2.33-2.45 (m, 1 Н), 1.83-2.22 (m, 4 Н). Целевой продукт получают посредством взаимодействия (3-фторфенил)метатолил метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (d, 1 Н), 8.08 (d, 1 Н), 7.39-7.52 (m, 1 Н), 7.04-7.38 (m, 8 Н),6.71 (s, 1 Н), 5.13 (m, 1 Н), 5.06 (s, 2 Н), 4.02-4.23 (m, 1 Н), 3.50-3.92 (m, 5 Н), 2.39-2.46 (m, 1 Н), 2.31 (s, 3 Н),1.76-2.18 (m, 4 Н). Целевой продукт получают посредством взаимодействия(3-фторфенил)-(4 метилсульфанилфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.09 (d, 1 Н), 7.32-7.59 (m, 4 Н), 7.22-7.32 (m,4 Н), 7.09-7.22 (m, 1 Н), 6.73 (s, 1 Н), 5.11-5.19 (m, 1 Н), 5.09 (s, 2 Н), 4.05-4.23 (m, 1 Н), 3.51-3.89 (m, 5 Н),2.46 (s, 3 Н), 2.37-2.44 (m, 1 Н), 1.79-2.14 (m, 4 Н). Целевой продукт получают посредством взаимодействия (4-фторфенил)-(3-фторфенил)метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.08 (dd, 1 Н), 7.40-7.58 (m, 3 Н), 7.35 (dd, 1 Н),7.08-7.33 (m, 5 Н), 6.78 (s, 1 Н), 5.10-5.19 (m, 1 Н), 5.05 (s, 2 Н), 3.97-4.23 (m, 1 Н), 3.50-3.89 (m, 5 Н), 2.332.46 (m, 1 Н), 1.88-2.17 (m, 4 Н). Целевой продукт получают посредством взаимодействия (3,4-дифторфенил)фенил метилового эфира (R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (ddd, 1 Н), 8.01-8.13 (m, 1 Н), 7.49-7.64 (m, 1 Н), 7.21-7.49 Целевой продукт получают посредством взаимодействия (3-фторфенил)фенил метилового эфира(R)-(1-азабицикло[2.2.2]окт-3-ил)ового эфира карбоновой кислоты с 2-(2-хлор)ацетилтиофеном. 1 Н ЯМР анализ (300 МГц, DMSO-d6) : 8.21 (dd, 1 Н), 8.08 (ddd, 1 Н), 7.22-7.54 (m, 9 Н), 7.00-7.23 (m,1 Н), 6.76 (s, 1 Н), 5.11-5.22 (m, 1 Н), 5.06 (s, 2 Н), 4.01-4.22 (m, 1 Н), 3.47-3.92 (m, 5 Н), 2.36-2.45 (m, 1 Н),1.70-2.17 (m, 4 Н).LC-MS (ESI POS): 479,94 (MH+). Условные обозначения- ЯМР,s - синглет,d - дуплет,t - триплет,q - квартет,dd - дублет дублетов,m - мультиплет,br - уширенный. Биологическая характеристика. Взаимодействие с мускариновыми рецепторами М 3 можно оценить по результатам исследований invitro, в которых оценивают анализы связывания М 3/М 2, эффективность испытываемого соединения и сдвиг ингибирующей активности, получаемый после вымывания антагонистов в изолированной трахее морской свинки, и по продолжительности действия in vivo против индуцированного ацетилхолином бронхоспазма у морской свинки. Пример 74. Анализы связывания М 3/М 2.P08172, Р 20309 соответственно), получали в не содержащем Ca/Mg фосфатно-солевом буферном растворе и собирали центрифугированием при 1500 об/мин в течение 3 мин. Осадок ресуспендировали в ледяном буфере А (15 мМ Трис-HCl рН 7,4, 2 мМ MgCl2, 0,3 мМ EDTA (этилендиаминтетрауксусная кислота), 1 мМ EGTA (этилен-бис-(оксиэтиленнитрило)тетрауксусная кислота и гомогенизировали при помощи PBI politron (настройка 5 в течение 15 с). Неочищенную мембранную фракцию собирали на двух последовательных стадиях центрифугирования при 40000g в течение 20 мин при 4 С, разделенных стадией промывания в буфере А. Полученный осадок в заключение ресуспендировали в буфере В (75 мМ Трис-HCl рН 7,4, 12,5 мМ MgCl2, 0,3 мМ EDTA, 1 мМ EGTA, 250 мМ сахарозы) и аликвоты хранили при-80 С. В день эксперимента замороженные мембраны ресуспендировали в буфере С (50 мМ Трис-HCl рН 7,4, 2,5 мМ MgCl2, 1 мМ EDTA). Неселективный мускариновый радиолиганд [3 Н]-N-метилскополамин(Mol. Pharmacol. 4 : 899-907) использовали для меченых участков связывания М 2 и М 3. Эксперименты по связыванию выполняли в двух повторностях (кривые по десяти точкам концентраций) в 96-луночных планшетах с концентрацией радиолиганда 0,1-0,3 нМ. Неспецифическое связывание определяли в присутствии 10 мкМ холодного N-метилскополамина. Образцы (конечный объем 0,75 мл) инкубировали при комнатной температуре в течение 60 мин для анализа связывания М 2 и 90 мин для анализа связывания М 3. Взаимодействие завершали при помощи быстрой фильтрации через планшеты GF/B Unifilter и двух промываний (0,75 мл) холодным буфером С, используя Packard Filtermate Harvester. Радиоактивность на фильтрах измеряли сцинтилляционным счетчиком для микропланшетов TriCarb 2500 (PerkinElmer). Пример 75. Взаимодействие с рецепторами М 3 in vitro. Величину антагонистической активности в изолированной трахее морской свинки исследовали согласно способу, ранее описанному в Haddad Е.В. et al. в Br. J. Pharmacol. 127, 413-420, 1999, с некоторыми модификациями. Суммарную кривую концентрация-ответ для тестирования антагонистов строили на препаратах, заранее сжатых карбахолом до достижения полного ингибирования тонуса гладких мышц. Концентрацию антагониста, обеспечивающую 50%-ную инверсию индуцированной карбахолом тонического сжатия(IC50), брали в качестве критерия его эффективности в данном биоанализе. В экспериментах, направленных на оценку компенсации ингибирующих эффектов, продуцируемых тестируемыми соединениями, минимальную концентрацию испытываемых соединений, которая, как было известно, продуцировала максимальный ингибирующий эффект, вводили в заранее сжатые карбахолом препараты. Как только тоническое сжатие было полностью реверсировано, обновляли раствор в ванне для органов и препараты тщательно промывали свежим раствором Кребса. Снова вводили карбахол (0,3 мкМ) (с 30 мин интервалом между промывкой и следующим введением) в течение следующих 4 ч. После введения карбахола ингибирующие эффекты соединений по изобретению, введенных в концентрации 10 нМ, выражали в виде процента восстановления сжимающего ответа на карбахол. Процент восстановления через 4 ч после промывки был ниже 50%. Значения ингибирующей М 3 активности, проверенной на соединениях 1-7, 9, 11-15, 17 и 18-48, составляют от 0,05 и до 414 нМ. Пример 76. Исследования in vivo. Испытания in vivo на индуцированном ацетилхолином бронхоспазме у морской свинки выполняли согласно Konzett H. and Rossler F. Arch Exp. Path. Pharmacol. 195, 71-74, 1940. Водные растворы тестируемых соединений закапывали внутритрахеально анестезированным, механически вентилируемым морским свинкам. Бронхиальный ответ на внутривенную ацетилхолиновую провокацию определяли до и после введения лекарственного средства и изменения сопротивления легких в некоторые моменты времени выражали в виде процента ингибирования бронхоспазма. Бронходилататорная активность тестируемых соединений сохранялась неизменной вплоть до 24 ч после введения. Пример 77. Стабильность соединения 1 в плазме. Чтобы продемонстрировать, что соединения разлагаются, исследовали стабильность в плазме крысы и человека типичного соединения по изобретению, которое представляет собой соединение 1, в 1 и 5 ч. В кратком изложении, 10 мкл стандартного раствора 250 мкМ соединения 1 в ацетонитриле добавляли к 1 мл плазмы крысы и человека и образцы инкубировали при 37 С. Плазму (50 мкл) отбирали через 0, 1 и 5 ч инкубирования и добавляли к 140 мкл ацетонитрила с добавлением верапимила в качестве внутреннего стандарта (250 нг/мл). Образцы анализировали посредством анализа HPLC-MS/MS. Стабильность в плазме рассчитывают как процент, сохраняющийся через 1 и 5 ч, путем деления площади пика в 1 или 5 ч на площадь пика в момент времени 0. Через 1 и 5 ч инкубирования обнаруживали менее 2% соединения 1, что показывало на то, что соединение 1 является очень нестабильным в обоих видах плазмы. Другие соединения по изобретению ведут себя аналогичным образом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где А может представлять собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4 являются одинаковыми или разными и могут быть независимо выбраны из группы, состоящей из Н, (С 3-С 8)циклоалкила, арила или гетероарила, где указанные арил или гетероарил могут быть, возможно, замещены атомом галогена или одним или несколькими заместителями, независимо выбранными из групп ОН, SH, (С 1-С 10)алкилсульфанил, (C1-С 10)алкил и (С 1-С 10)алкоксил, или, когда R3 иR4, оба независимо, представляют собой арил или гетероарил, тогда они могут быть соединены посредством простой связи с образованием трициклической кольцевой системы;Z-R1, где Z выбран из СО, О, SO2, S и SO или представляет собой связь;R1 представляет собой остаток, выбранный из Н; арила, возможно замещенного метилом или метокси; гетероарила, возможно замещенного галогеном;X- представляет собой физиологически приемлемый анион,где"арил" относится к моно-, би- или трициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где по меньшей мере одно кольцо является ароматическим и один или более атомов водорода в указанных кольцах могут быть замещены фенилом или одним или более галогенами;"арилалкил" относится к группе "(С 1-С 4)алкил", замещенной одним или более фенилами, и один или более атомов водорода в указанных фенилах могут быть замещены одним или более атомами галогена;"гетероарил" относится к моно- или бициклическим кольцевым системам, имеющим от 5 до 6 атомов в кольце, где каждое кольцо является ароматическим и где по меньшей мере один атом в кольце является гетероатомом (N, S или О);"гетероарилалкил" относится к группе "(С 1-С 4)алкил", замещенной одним или более тиенилами. 2. Соединение по п.1, где R представляет собой (С 1-С 6)алкил, замещенный -Z-R1. 3. Соединение по п.1, где R представляет собой (С 1-С 6)алкил, замещенный -Z-R1, где Z представляет собой О, СО или связь и R1 представляет собой арил или гетероарил, предпочтительно замещенный галогеном. 4. Соединение по п.1, где R представляет собой СН 2, Z представляет собой СО и R1 представляет собой тиенил, согласно формуле (II) 5. Соединение по п.4, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а) где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещен- 28019166 ный одним или более атомами галогена. 6. Соединение по п.4, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. 7. Соединение по п.4, где А представляет собой группу формулы (а), где R3 и R4, оба независимо,представляют собой фенил и соединены посредством простой связи с образованием трициклической кольцевой системы формулы (b) 8. Соединение по п.4, где А представляет собой 9 Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена. 9. Соединение по п.4, где А представляет собой бензил, возможно замещенный одним или более атомами галогена. 10. Соединение по п.4, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. 11. Соединение по п.4, где А представляет собой тиофенилметил. 12. Соединение по п.1, где R представляет собой пропильную группу, замещенную группой -Z-R1,где Z представляет собой О и R1 представляет собой фенил, согласно формуле (III) 13. Соединение по п.12, где А представляет собой арил, или гетероарил, или арилалкил, или гетероарилалкил либо группу формулы (а), где R3 и R4, оба независимо, представляют собой арил или гетероарил, предпочтительно замещенный одним или более атомами галогена. 14. Соединение по п.12, где А представляет собой группу формулы (а), где R3 и R4 оба представляют собой фенил, предпочтительно замещенный одним или более атомами галогена. 15. Соединение по п.12, где А представляет собой группу формулы (а), где R3 и R4, оба независимо,представляют собой фенил и они связаны посредством простой связи с образованием трициклической кольцевой системы формулы (b) 16. Соединение по п.12, где А представляет собой 9 Н-флуорен-9-ил, предпочтительно замещенный одним или более атомами галогена. 17. Соединение по п.12, где А представляет собой бензил, возможно замещенный одним или более атомами галогена. 18. Соединение по п.12, где А представляет собой бифенилметил, предпочтительно замещенный одним или более атомами галогена. 19. Соединение по п.12, где А представляет собой тиофенилметил. 20. Фармацевтическая композиция, содержащая соединение по пп.1-19 в смеси с одним или более фармацевтически приемлемыми носителями и/или эксципиентами. 21. Применение соединения по любому из пп.1-19 для предупреждения и/или лечения любого бронхообструктивного или воспалительного заболевания. 22. Применение по п.21, где указанное заболевание представляет собой астму, или хронический бронхит, или хроническое обструктивное заболевание легких (COPD). 23. Устройство, выбранное из группы, состоящей из одно- или многодозового сухого порошкового ингалятора, дозирующего ингалятора и мягкого аэрозольного небулайзера, отличающееся тем, что оно содержит фармацевтическую композицию по п.20. 24. Способ получения соединений формулы (I) по п.1, включающий стадии:
МПК / Метки
МПК: C07D 453/02, A61P 11/00, A61K 31/439
Метки: медицинские, производные, хинуклидина, карбоната, композиции
Код ссылки
<a href="https://eas.patents.su/30-19166-proizvodnye-hinuklidina-karbonata-i-ih-medicinskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинуклидина карбоната и их медицинские композиции</a>
Предыдущий патент: Способы и композиции для удаления примесей и воды из способа байера
Следующий патент: Соединения, ингибирующие активность семикарбазид-чувствительной аминооксидазы
Случайный патент: Конденсированные производные пиразола и способы лечения с их помощью заболеваний, вызванных нарушением обмена веществ












