Конъюгаты синтетических агонистов tlr и их применение
Номер патента: 19151
Опубликовано: 30.01.2014
Авторы: Ву Кристина С.Н., Коттам Ховард Б., Дэниелс Грегори А., Врасидло Вольфганг, Карсон Деннис А.
Формула / Реферат
1. Фармацевтическая композиция, содержащая соединение формулы А
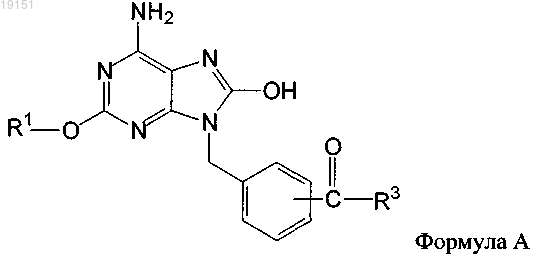
или его фармацевтически приемлемую соль, где
R1 обозначает водород, (C1-C10)алкил или (C1-C10)алкил, замещенный (C1-С6)алкокси;
R3 обозначает диолеоилфосфатидилэтаноламин (DOPE).
2. Фармацевтическая композиция по п.1, в которой соединение имеет формулу В
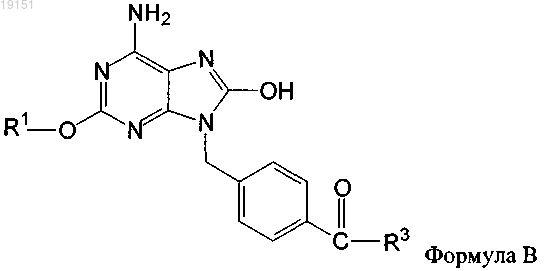
3. Фармацевтическая композиция по п.1 или 2, где R1 обозначает (C1-C10)алкил, замещенный (C1-6)алкокси.
4. Фармацевтическая композиция по любому из пп.1-3, где R1 обозначает -(CH2)2-ОСН3.
5. Фармацевтическая композиция по любому из пп.1-4, включающая липосому.
6. Применение соединения формулы А, охарактеризованного в п.1, для приготовления лекарственного средства, содержащего соединение формулы А, для лечения млекопитающего, страдающего или восприимчивого к состоянию, опосредованному активностью толл-подобных рецепторов (TLR).
7. Применение по п.6, где соединение имеет формулу В
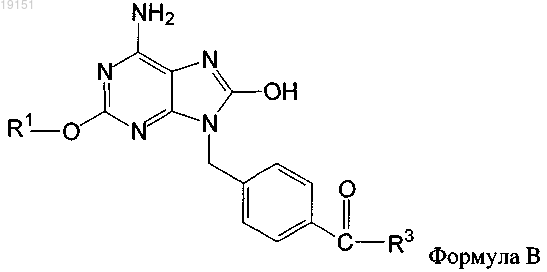
8. Применение по п.6 или 7, где R1 обозначает (C1-C10)алкил, замещенный (C1-6)алкокси.
9. Применение по любому из пп.6-8, где R1 обозначает -(CH2)2-OCH3.
10. Применение по любому из пп.6-9, где млекопитающее представляет собой человека.
11. Применение по любому из пп.6-10, где состояние является воспалением.
12. Применение по любому из пп.6-11, где состояние является раком.
13. Применение по любому из пп.6-12, где лекарственное средство содержит антиген.
Текст
КОНЪЮГАТЫ СИНТЕТИЧЕСКИХ АГОНИСТОВ TLR И ИХ ПРИМЕНЕНИЕ Изобретение предусматривает фармацевтическую композицию, содержащую конъюгат TLR агониста и макромолекулы формулы А, в которой R1 обозначает водород, (C1-C10)алкил или (C1C10)алкил замещнный (C1-С 6)алкокси и R3 обозначает диолеоилфосфатидилэтаноламин (DOPE) или его фармацевтически приемлемую соль. Фармацевтические композиции изобретения пригодны для вакцин и для предотвращения, ингибирования или лечения различных нарушений,включая инфекцию, вызванную патогенами, и астму. Также изобретение относится к применению соединения формулы А для приготовления лекарственного средства для лечения млекопитающего, страдающего или восприимчивого к состоянию, опосредованному активностью толл-подобных рецепторов (TLR).(71)(73) Заявитель и патентовладелец: ДЗЕ РЕГЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ КАЛИФОРНИЯ (US) Сведения о предшествующем уровне техники В последнее десятилетие стало многое известным о молекулярной основе распознавания микробных патогенов. Считается общепринятым, что многие соматические клетки экспрессируют ряд рецепторов распознавания, которые выявляют потенциальных патогенов независимо от адаптивной иммунной системы (см. Janeway et al., Annu. Rev. Immunol., 20: 197 (2002. Полагают, что эти рецепторы взаимодействуют с патоген-ассоциированными молекулярными структурами (образами), заканчивающимися микробными компонентами (PAMPs). Примеры PAMPs включают пептидогликаны, липотейхоевые кислоты из грамположительных клеточных стенок, маннозу (которая обычно содержится в углеводах микробов, но редко встречается у людей), бактериальную ДНК, двухспиральную ДНК из вирусов и глюканы из клеточных стенок грибов. PAMPs обычно отвечают некоторым критериям, которые включают (а) их экспрессию микробами, но не их хозяевами-млекопитающими, (б) консервацию структуры в широком спектре патогенов и (в) способность стимулировать врожденный иммунитет. Толл-подобные рецепторы(TLRs), как было установлено, играют центральную роль при обнаружении PAMPs и в раннем ответе на микробные инфекции (см. Underbill et al., Curr. Opin. Immunol., 14: 103 (2002. Были идентифицированы десять TLRs человека и ряд их агонистов. Например, TLR7 и TLR9 распознают и отвечают на наличие имиквода и иммуностимулирующих CpG олигонуклеотидов (Iss-ODN) соответственно. Синтетический иммуномодулятор R-848 (резиквимод) активирует как TLR7, так и TLR9. В то время как стимуляцияTLR инициирует обычный сигнальный каскад (включающий участие адапторного белка MyD88, транскрипционного фактора NF-kB и провоспалительных и эффекторных цитокинов), некоторые виды клеток имеют тенденцию к продуцированию некоторых TLRs. Например, TLR7 и TLR9 обнаруживаются, в основном, на внутренних поверхностях эндосом в дендритных клетках (DCs) и В-лимфоцитов (у людей; макрофаги у мышей экспрессируют TLRs и TLR9). С другой стороны, TLR8 обнаружен в моноцитах крови человека (см. Hornung et al., J. Immunol., 168: 4531, (2002. Интерфероны (INFs) также участвуют в эффективной индукции иммунного ответа, особенно после вирусной инфекции (Brassard et al., J. Leukoc. Biol., 71: 568 (2002. Однако многие вирусы продуцируют множество белков, которые блокируют образование интерферонов или действие интерферонов на различных уровнях. Полагают, что антагонизм интерферона является частью общей стратегии для того,чтобы избежать возникновения врожденного, а также адаптивного иммунитета (см. Levy et al., CytokineGrowth Factor Rev., 12: 143 (2001). Хотя TLR агонисты могут быть достаточно активными при осуществлении различных методов лечения, в некоторых случаях антагонисты микробного интерферона могут смягчать вспомогательное действие синтетического агониста TLR. Более специфический ответ на микробные инфекции основан на активной или пассивной иммунизации. Если универсальная иммунизация не считается эффективной для сокращения расходов (или фармакоэкономически жизнеспособной), идентификация населения с повышенным риском, которое выиграет от проведения иммунопрофилактики, может привести к сокращению расходов, хотя идентификация такой популяции может быть непростой. Тем не менее, существуют некоторые ярко выраженные популяции с повышенным риском получить некоторые бактериальные инфекции, такие как стафилококковые инфекции, включая больных, которым проведен диализ, больных с вентрикуло-перитонеальными шунтами, пациентов с повышенным риском заболеть инфекционным эндокардитом и резидентов домов для престарелых, все из которых страдают от хронических условий, которые приводят к тому, что их характеризует повышенный риск заболеть стафилококковыми инфекциями. Многие из этих пациентов рискуют в сильной степени заболеть связанной с медико-санитарной помощью метициллин-резистентнойStaphylococcus aureus (HA-MRSA). Однако блокирующая колонизация Staphylococcus может быть более успешной, чем защита от инфекции. Пассивная иммунопрофилактика, использующая или поликлональные антитела (Capparelli et al.,Antimicrob. Agents Chemo, 49: 4121, (2005, или моноклональные антитела (mAbs)(www.biosvnexus.com/productcandidates.html), может обеспечить немедленную (хотя и кратковременную) защиту пациентов, которые или не могут ждать эффекта от действия вакцины или иммунные системы которых слишком повреждены, чтобы получить ответ на введение вакцины. Одним возможным показателем пассивной иммунопрофилактики является вспышка MRSA-ассоциируемой инфекции в больницах. В этих случаях отдельные субъекты могут выиграть от немедленной профилактики, в то время как индивидуумы, находящиеся в том же самом отделении, могут выиграть от активной иммунизации. Более того, пациенты в отделениях интенсивной терапии являются возможными получателями пассивной иммунопрофилактики, так как каждый из них может характеризоваться одним или несколькими факторами риска заболеть стафилококковыми инфекциями. Сущность изобретения Данное изобретение предусматривает конъюгаты синтетического TLR агониста, связанные при помощи стабильной ковалентной связи с макромолекулой, и композиции, содержащие эти конъюгаты, а также способы применения этих конъюгатов. Конъюгаты могут включать макромолекулы, непосредственно связанные с синтетическим TLR агонистом, например TLR7 или TLR9 агонистами, или связанные при помощи линкера с TLR агонистом, например, связанные при помощи аминогруппы, карбоксильной группы или сукцинамидной группы. Например, конъюгаты по изобретению включают синтетическийTLR агонист (фармакофор), ковалентно связанный с макромолекулой, такой как, например, молекулы пептида, полипетида, например их антитело- или антигенсвязывающим фрагментом, липида, полимера,такого как полиэтиленгликоль, с гранулой, такой как гранула полистирола или дендримера. Конъюгаты по изобретению представляют собой иммуностимуляторные агенты широкого спектра с длительным сроком действия и нетоксичные, которые пригодны для активации иммунной системы млекопитающего,например человека. В частности, конъюгаты по изобретению оптимизируют иммунный ответ, в то же время ограничивая нежелательные системные побочные эффекты, связанные с неконъюгированнымиTLR агонистами. Синтетический TLR агонист может непосредственно способствовать связыванию с TLRs внутри эндосом целевых клеток и облегчать доставку макромолекулы. Согласно одному варианту синтетический TLR агонист является специфическим по отношению к эндосомальным TLRs. Согласно еще одному варианту TLR агонист может быть TLR7, TLR8, TLR3 или TLR9 агонистом. Более того, синтетический TLR агонист может усиливать ответ на действие макромолекулы (например, иммунный ответ). Подобно этому макромолекула может быть пригодной для активности иммунной системы и/или может направлять конъюгат в конкретные клетки. Так, макромолекула, например макромолекула с первичной аминогруппой, которая связана с синтетическим TLR агонистом, может усиливать активность синтетического TLR агониста или иметь свою желательную активность. Например, макромолекула может усиливать активность TLR агониста, способствуя направлению агониста кTLR внутри эндосом целевых клеток, усиливая трансдукцию сигнала, индуцированную TLR агонистом,или сшивая рецептор или же проявляя все эти указанные виды действия. Согласно одному варианту макромолекула представляет собой липид, который спонтанно введен в липосомы. Согласно еще одному варианту макромолекула представляет собой наночастицу, которая содержит на своей поверхности аминогруппы. В связанном с TLR агонистом виде наночастица конъюгата с TLR агонистом может иметь размер, например, около 100 нм, находясь (содержась) в эндосомах. Приобретенные в условиях больницы инфекции Staphylococcus aureus (SA) являются основной причиной заболеваемости и смертности. Однако при острых вспышках инфекции вакцины не применяются,так как они действуют через слишком большое время и они не эффективны для пациентов с нарушенным иммунитетом. Данное изобретение предусматривает способ быстрой вакцинации пациентов с повышенным риском к заболеванию инфекцией грамположительными бактериями, например SA инфекциями,который использует агонисты толл-подобного рецептора-7 (TLR7) и один или более антигенов (иммуногенов) грамположительных бактерий. Применение вакцин по изобретению индуцирует иммунитет примерно через 6 дней, что позволяет использовать их в областях, где не применяется стандартная вакцинация (например, в случае острых вспышек). Как описано в данной заявке, получают композицию, содержащую грамположительную бактериюBacillus anthracis (BA) и синтетический TLR7 агонист. Композиция индуцировала секрецию IL12 и IL6(показывающую наличие активации макрофагов, происходящих из костного мозга (BMDM, in vitro и защищала мышей от признаков последующей летальной внутрилегочной инфекции BA in vivo. В частности, введение композиции, содержащей конъюгат с TLR7 агонистом и иммуноген (UC-IV199 альбумин/облученные споры ВА), индуцировало защитный иммунитет к ВА в течение 6 дней. В противоположность этому инъекция животным спор ВА в отдельности или ВА в сочетании с обычным адъювантом, а именно токсином холеры (СТ), не защищает животных от летального исхода. Быстрота защитного иммунного ответа у ранее не подвергавшегося воздействию животного была неожиданной. Таким образом, настоящее изобретение предусматривает иммуногенные композиции. По одному варианту иммуногенная композиция по изобретению включает синтетический TLR агонист, такой какTLR7 агонист, например UC-IV199, связанный с грамположительной бактериальной клеткой, например связанный со свободными аминогруппами на мертвых Staphylococcus aureus; синтетический TLR агонист, такой как TLR7 агонист, связанный с бактериальным экстрактом изолированных грамположительных бактериальных антигенов; синтетический TLR агонист, такой как TLR7 агонист, связанный с изолированным грамположительным бактериальным белком, например рекомбинантным белком; или синтетический TLR агонист, такой как TLR7 агонист, связанный с изолированными грамположительными бактериальными углеводами. Например, синтетический TLR7 агонист может быть с бактериальными углеводами с применением методов присоединения Staphylococcus aureus полисахаридов к белковым носителям (таким как те, которые используются для таксоида столбняка). Убитый бактериальный препарат может быть приготовлен с применением гамма-излучения, тепловой или химический обработки. Согласно другому варианту иммуногенная композиция по изобретению включает синтетический TLR агонист, такой как TLR7 агонист, связанный с адъювантом, и препарат, содержащий мертвые грамположительные бактериальные клетки; синтетический TLR агонист, такой как TLR7 агонист, связанный с адъювантом, и препарат, содержащий грамположительный бактериальный экстракт; или синтетический TLR агонист, такой как TLR7 агонист, связанный с адъювантом, и препарат, содержащий изолированный грамположительный бактериальный антиген, например рекомбинантный белок. Например, иммуногенная композиция может включать UC-IV199, связанный с альбумином, и препарат с убитыми грамположительными бактериями, например убитыми Staphylococcus aureus. Согласно одному из вариантов им-2 019151 муногенная композиция по изобретению включает синтетический TLR7 агонист, связанный с адъювантом, и препарат, содержащий рекомбинантный грамположительный бактериальный антиген, такой как изолированный грамположительный бактериальный белок или его пептид, или изолированный грамположительный бактериальный углевод. По одному из вариантов единичная доза иммуногенной композиции может обладать очень высокой активностью, например она может обеспечить защитный иммунитет за короткий промежуток времени, например менее 10 дней. По одному из вариантов стерилизованную вакцину вводят субъекту за 0-7 дней до госпитализации. Согласно еще одному варианту вакцину вводят внутримышечно. Согласно еще одному варианту вакцину вводят с дозой между 10 мкг и 10 мг. Применение конъюгатов синтетических TLR агонистов, таких как TLR7 агонисты по изобретению,имеет преимущества вследствие их доступности и потому, что различные химические превращения позволяют связывание с любым антигеном и модифицируемые конъюгаты имеют определенную стереохимию. Получение конъюгатов является дорогим процессом, конъюгаты являются активными и поэтому обеспечивают быструю защиту, что делает возможным их применение в случае острых вспышек заболеваний, таких как травмы, ожоги, при подготовке хирургического вмешательства или в случае биотерроризма. Соответственно предусмотрено соединение формулы (I) где X1 обозначает -О-, -S- или -NRc; где Y обозначает S или NH; где Rc обозначает водород, C1-10 алкил или C1-10 алкил, замещенный C3-6 циклоалкилом, или Rc и R1,взятые вместе с атомом азота, могут образовать гетероциклическое кольцо или замещенное гетероциклическое кольцо, причем заместителями являются гидрокси, C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси, C1-6 алкокси-C1-6 алкилен или циано; где R1 обозначает (C1-10)алкил, замещенный (C1-С 10)алкил, (С 6-С 10)арил, замещенный (С 6-С 10)арил,С 5-9 гетероцикл, замещенный С 5-9 гетероцикл; где каждый R2 обозначает независимо водород, ОН, (C1-6)алкил, замещенный (C1-C6)алкил, (C1C6)алкокси, замещенный (C1-C6)алкокси, -С(О)-(C1-C6)алкил (алканоил), замещенный -С(О)-(C1C6)алкил, -С(О)-(C6-C10)арил (ароил), замещенный -С(О)-(С 6-С 10)арил, -С(О)ОН (карбоксил), -C(O)O(C1C6)алкил (алкоксикарбонил), замещенный С(О)О(C1-C6)алкил, -NRaRb, -C(O)NRaRb (карбамоил), замещенный -C(O)NRaRb-, галоид, нитро или циано; где каждый Ra и Rb обозначает независимо водород, (C1-C6)алкил, (C3-C8)циклоалкил, (C1C6)алкокси, гало-(C1-C6)алкил, (C3-C8)циклоалкил(C1-C6)алкил, (C1-C6)алканоил, гидрокси(C1-C6)алкил,арил, арил(C1-C6)алкил, Het, Het-(C1-C6)алкил или (C1-C6)алкоксикарбонил; где X2 обозначает связь или связывающую группу; где R3 обозначает макромолекулу; где n равен 1, 2, 3 или 4; где m равен 1, 2, 3 или более, например 5, 10, 15 или более; где q равен 1, 2, 3 или показателю, равному до примерно 1000, примерно 10000 или более, например примерно 105, примерно 106 или более; или его фармацевтически приемлемая соль. По одному из вариантов q равен 1 и m составляет от 1 до 20 или любое целое число в этом интервале. По другому варианту m равен 1 и q2. Согласно еще одному варианту m равен 1 и R3 может обозначать вирус, например лентивирус, отличный от обезьяньего вируса иммунодефицита (SIV), ретровирус,вирус гриппа, риновирус, вирус папилломы, вирус герпеса и т.п., грамположительную бактерию или бактериальную спору, или наночастицу либо гранулу, например гранулу двуокиси кремния, и q равен 102,103, 104, 105, 106 или более. Таким образом, конъюгат может включать мультимеры TLR агониста, макромолекулу или и то и другое. Мультимеры могут быть линейными или разветвленными. По одному из вариантов R3 может быть макромолекулой, содержащей грамположительную бактерию, пептид грамположительной бактерии, белок грамположительной бактерии, углевод грамположительной бактерии или адъювант, такой как гетерологичный белок или пептид, то есть из источника, отличающегося от грамположительной бактерии, такого как белок клетки-хозяина, например альбумин или яичный альбумин, или гетерологичный липид, гетерологичная нуклеиновая кислота, гранула, такая как полистирольная гранула, наночастица или дендример. Так, согласно различным вариантам m может быть равен 1 или 2; и q может быть равен 1 или 2. По-3 019151 некоторым вариантам m равен 1 и поверхность группы R3 связана с сотнями, тысячами или более группами q. Например, реактивные сайты частицы двуокиси кремния могут быть использованы для соединения частицы двуокиси кремния с фрагментами, указанными в описанной выше формуле. Для этой конфигурации R3 может быть любой другой макромолекулой, описанной в данной заявке, такой как наночастица, гранула, дендример, липид, спора или бактериальная клетка. Согласно другим вариантам соединение указанной формулы и группа R3 могут образовать чередующуюся цепь из примерно трех-десяти повторяющихся групп (например, соединение формулы - R3 - соединение формулы - R3 - соединение формулы - R3 и т.д.). Макромолекула в конъюгатах по изобретению образует стабильную связь с TLR агонистом, то есть конъюгат не действует как пролекарство. Макромолекула может включать органические молекулы, состоящие из углерода, кислорода, водорода, азота, серы, фосфора или любой их комбинации, если макромолекула не является вредной для тканей организма (например, она нетоксична и/или не вызывает воспаления). Макромолекула позволяет осуществить таргетирование или обеспечить иммунный ответ, например макромолекула может быть антигеном, таким как меланома-специфичный пептид. Согласно различным вариантам, когда в молекуле любой формулы, описанной в данной заявке,имеется более одного R3, все R3 могут быть одинаковыми или группы R3 могут отличаться друг от друга. Соответственно, когда содержится более одной группы R3, каждый R3 независимо обозначает группу,определение которой дано для каждой формулы. Кроме того, данное изобретение предусматривает фармацевтическую композицию, содержащую по меньшей мере одно соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым разбавителем или носителем. Настоящее изобретение включает применение конъюгатов синтетического TLR агониста и макромолекулу, а также конъюгаты TLR агониста и другую молекулу. Конъюгат может быть применен для профилактики, ингибирования или лечения расстройств, включая, но без ограничения, аллергическую астму, инфекционные болезни, такие как респираторная вирусная инфекция, например инфекции, связанные с вирусом гриппа или респираторным синцитиальным вирусом (RSV), волчанкой и другими аутоиммунными болезнями, а также как вакцина, например, для раковых и инфекционных болезней. Согласно одному из вариантов единичная доза конъюгата может быть очень активной для стимулирования иммунного ответа. Более того, вследствие низкой токсичности конъюгатов в некоторых случаях могут вводиться более высокие дозы, например, системно, в то время как в других случаях могут вводиться меньшие дозы, например, благодаря локализации конъюгата. По одному из вариантов при введении в высоких дозах синтетические конъюгаты TLR агониста могут вызывать антагонистический ответ и поэтому могут применяться для ингибирования или лечения астмы или аутоиммунных болезней. Первая доза может вызывать гиперответ, который, в свою очередь, подавляет иммунный ответ, что позволяет избежать воспаления. Таким образом, применение более высоких доз и повторное введение могут привести к ингибированию иммунного ответа. По одному из вариантов данное изобретение предусматривает способ предотвращения или ингибирования инфекции, вызванной грамположительными бактериями, у млекопитающего. Этот способ включает введение млекопитающему эффективного количества композиции, содержащей бактериальный антиген грамположительной бактерии и соединение, имеющее формулу (IA) где X обозначает -О-, -S- или -NRc; где Rc обозначает водород, C1-10 алкил или замещенный C1-10 алкил или Rc и R1, взятые вместе с атомом азота, могут образовать гетероциклическое кольцо или замещенное гетероциклическое кольцо, где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси,C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси, C3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано,галоген или арил;R1 обозначает водород, (C1-C10)алкил, замещенный (C1-С 10)алкил, (С 6-С 10)арил или замещенный (С 6 С 10)арил, C5-9 гетероцикл, замещенный С 5-9 гетероцикл, где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси, C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси,С 3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано, галоген или арил; каждый R2 обозначает независимо водород, ОН, (C1-C6)алкил, замещенный (C1-C6)алкил, (C1C6)алкокси, замещенный (C1-C6)алкокси, -С(О)-(C1-C6)алкил (алканоил), замещенный -С(О)-(C1C6)алкил, -С(О)-(C6-C10)арил (ароил), замещенный -С(О)-(С 6-С 10)арил, -С(О)ОН (карбоксил), -С(О)О(С 1 С 6)алкил (алкоксикарбонил), замещенный -С(О)О(С 1-С 6)алкил, -NRaRb, -C(O)NRaRb (карбамоил), заме-4 019151 щенный -C(O)NRaRb, галоид, нитро или циано; где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси, C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси,C3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано, галоген или арил; каждый Ra и Rb независимо обозначает водород, (C1-С 6)алкил, (C3-C8)циклоалкил, (C1-C6)алкокси,гало(C1-C6)алкил, (C3-C8)циклоалкил(C1-C6)алкил, (C1-C6)алканоил, гидрокси-(C1-C6)алкил, арил,арил(C1-C6)алкил, Het, Het-(C1-C6)алкил или (C1-C6)алкоксикарбонил;X2 обозначает связь или связывающую группу;R3 обозначает макромолекулу, включающую гетерологичный пептид, гетерологичный белок, гетерологичный липид, гранулу, такую как полистирольную гранулу, молекулу гетерологичной нуклеиновой кислоты или дендример; или его фармацевтически приемлемую соль, включая гидраты этого соединения. Согласно некоторым вариантам определение группы R1 может быть заменено определением группы 1R для любой другой формулы, описанной в данной заявке. Неограничивающие примеры макромолекул или линкеров для них включают не только атом кислорода, атом серы, атом азота или атом углерода (и подвешенные соответствующим образом атомы водорода, необходимые для заполнения валентностей), но и также макромолекулы или линкеры с боковыми цепями, которые повышают растворимость, такими как, например, группы, содержащие морфолиновые,пиперидиновые, пирролидиновые или пиперазиновые кольца и т.п.; аминокислоты, полимеры аминокислот (белки или пептиды), например дипептиды или трипептиды, и т.п.; углеводы (полисахариды), нуклеотиды, такие как, например, ПНК, РНК и ДНК и т.п.; полимеры органических веществ, такие как, например, полиэтиленгликоль, полилактид и т.п.; мономерные и полимерные липиды; нерастворимые органические наночастицы; нетоксичные вещества организма, такие как, например, клетки, липиды антигены, такие как, например, микробы, такие как, например, вирусы, бактерии, грибки и т.п. Антигены могут включать неактивированные целые организмы или их компоненты и т.п. Предусмотрен также способ профилактики или ингибирования инфекции, вызванной грамположительными бактериями, у млекопитающего. Этот способ включает введение млекопитающему эффективного количества соединения, имеющего формулу (IB) где X обозначает -О-, -S- или -NRc; где Rc обозначает водород, С 1-10 алкил или замещенный C1-10 алкил или Rc и R1, взятые вместе с атомом азота, могут образовать гетероциклическое кольцо или замещенное гетероциклическое кольцо, где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси,C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси, C3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано,галоген или арил;R1 обозначает водород, (C1-С 10)алкил, замещенный (C1-С 10)алкил, (С 6-С 10)арил или замещенный (С 6 С 10)арил, C5-9 гетероцикл, замещенный C5-9 гетероцикл, где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси, C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси,C3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано, галоген или арил; каждый R2 обозначает независимо водород, ОН, (C1-C6)алкил, замещенный (C1-C6)алкил, (C1C6)алкокси, замещенный (C1-C6)алкокси, -С(О)-(C1-C6)алкил (алканоил), замещенный -С(О)-(C1C6)алкил, -С(О)-(C6-C10)арил (ароил), замещенный С(О)-(С 6-С 10)арил, -С(О)ОН (карбоксил), -С(О)О(C1C6)алкил (алкоксикарбонил), замещенный -С(О)О(C1-C6)алкил, -NRaRb, -C(O)NRaRb (карбамоил), замещенный -C(O)NRaRb-, галоид, нитро или циано, где заместители у алкильных, арильных или гетероциклических групп представляют собой гидрокси, C1-6 алкил, гидрокси-C1-6 алкилен, C1-6 алкокси,C3-6 циклоалкил, C1-6 алкокси-C1-6 алкилен, амино, циано, галоген или арил; каждый Ra и Rb независимо обозначает водород, (C1-С 6)алкил, (C3-C8)циклоалкил, (C1-С 6)алкокси,гало-(C1-С 6)алкил, (С 3-С 8)циклоалкил-(C1-С 6)алкил, (C1-С 6)алканоил, гидрокси(C1-С 6)алкил, арил,арил(C1-С 6)алкил, Het, Het-(C1-С 6)алкил или (C1-С 6)алкоксикарбонил;X2 обозначает связь или связывающую группу;R3 обозначает грамположительную бактерию, изолированный антигенный белок или пептид грамположительной бактерии или выделенный полисахарид грамположительной бактерии; или его фармацевтически приемлемой соли, включая его гидраты. По одному из вариантов грамположительная бактерия представляет собой Staphylococcus. Согласно одному из вариантов R3 обозначает изолированный антигенный белок или пептид Staphy-5 019151lococcus и соединение вводится с препаратом убитого Staphylococcus. Данное изобретение предусматривает соединение по изобретению для применения в медицинской терапии (например, для профилактики бактериальных заболеваний, например, в виде вакцины). Соединения по изобретению могут быть также применены для биозащиты, например, от В. anthrax. Далее, предусмотрены композиции и соединение по изобретению для применения в медицинской терапии, например, для лечения астмы или вирусных инфекций или для профилактики вирусной инфекции, а также предложено применение конъюгатов для производства медикамента для лечения TLRассоциируемого состояния или симптома либо такого заболевания, при котором показаны увеличенный иммунный ответ или угнетенный иммунный ответ. Кроме того, данное изобретение также предусматривает фармацевтическую композицию, содержащую по меньшей мере одно соединение по изобретению или его фармацевтически приемлемую соль, в комбинации с фармацевтически приемлемым разбавителем или носителем, возможно в комбинации с препаратом выбранной грамположительной бактерии, например убитым препаратом или экстрактом или изолированным углеводом (полисахаридом) выбранной грамположительной бактерии или изолированным белком выбранной грамположительной бактерии. Настоящее изобретение включает применение конъюгатов TLR7 агонистов и макромолекулы, например макромолекулы с первичной аминогруппой, которая усиливает активность агониста, например альбумина, или имеет свою желательную активность, например, антигена грамположительной бактерии. Конъюгаты могут включать макромолекулы, непосредственно связанные с TLR7 агонистом или связанные с TLR7 агонистом при помощи линкера. Конъюгаты могут оптимизировать иммунный ответ, ограничивая в то же время нежелательные системные побочные эффекты TLR7 агонистов. Согласно одному из вариантов данное изобретение предусматривает способ профилактики или лечения инфекции, вызванной грамположительными бактериями, у млекопитающего, такого как человек. Этот способ включает введение млекопитающему, нуждающемуся в такой терапии, эффективного количества соединения по изобретению или его фармацевтически приемлемой соли, соединенных с адъювантом или по меньшей мере с одним антигеном грамположительной бактерии. Предусмотрен также способ идентификации конъюгатов, пригодных для профилактики, ингибирования или лечения конкретного состояния или симптома, например, путем идентификации профиля цитокинов, вызванного конъюгатом in vitro или in vivo или путем идентификации эндосомы, например, на ранней, средней или поздней стадии, содержащей TLR для TLR агониста. Так как различные клетки содержат разные эндосомы, идентификация профилей эндосом в клетках может позволить осуществление таргетирования конъюгатов на специфические виды клеток или улучшение доступа конъюгатов к эндосомам. Более конкретно изобретение относится к фармацевтической композиции, содержащей соединение формулы А или его фармацевтически приемлемую соль, гдеR3 обозначает диолеоилфосфатидилэтаноламин (DOPE). В одном из воплощений соединение формулы А имеет формулу В В одном из воплощений в соединении формулы А или В R1 обозначает (C1-С 10)алкил, замещенный(С 1-6)алкокси. В одном из воплощений в соединении формулы А или В R1 обозначает -(CH2)2-ОСН 3. В одном из воплощений композиция содержит липосому. Изобретение также относится к применению соединения формулы А для приготовления лекарственного средства, содержащего соединение формулы А, для лечения млекопитающего, страдающего или восприимчивого к состоянию, опосредованному активностью толл-подобных рецепторов (TLR). В одном из воплощений соединение формулы А имеет формулу В В одном из воплощений в соединении формулы А или В R1 обозначает (C1-С 10)алкил, замещенный(С 1-6)алкокси. В одном из воплощений в соединении формулы А или В R1 обозначает -(CH2)2-ОСН 3. В одном из воплощений млекопитающее представляет собой человека. В одном из воплощений состояние является воспалением. В одном из воплощений состояние является раком. В одном из воплощений лекарственное средство содержит антиген. Краткое описание чертежей На фиг. 1 показан конъюгат TLR агонист/альфагалактозилкерамид. На фиг. 2 показан UC-1V150 конъюгат G1 РАМАМ с этилендиаминовым ядром. На фиг. 3 А представлен линкер (SANH) для соединения макромолекулы и синтетического TLR агониста. Фиг. 3 В иллюстрирует синтез UC-1V150. На фиг. 3 С показано сопряжение UC-1V150 с MSA. 200 мкл MSA (25 мг/мл) смешивают со 100 мкл буфера сопряжения (1 М фосфат, рН 7,2) и 690 мкл PBS. 844 мкг SANH в 10 мл DMF (40-молярный избыток по отношению к MSA) добавляют к раствору белка (конечная концентрация NP в реакционной смеси составляет 5 мг/мл). После аккуратного перемешивания продолжают реакцию при комнатной температуре в течение 2 ч. Для удаления избытка SANH реакционную смесь загружают на конический вращающийся фильтр (YM-3, Millipore) и концентрируют до объема около 70 мкл. 460 мкг UC-1V150 растворенного в 10 мкл DMF добавляют к MSA, модифицированному SANH, и реакционную смесь инкубируют при комнатной температуре в течение ночи. Для удаления избытка UC-1V150 реакционную смесь вначале концентрируют до объема 50 мкл, используя конический вращающийся фильтр (Millipore: YM3) и загружают во вращающуюся микроколонку G-25 (GE Healthcare). На фиг. 4 приведена графическая иллюстрация абсорбционного профиля (при длине волны около 350 нм) соединения формулы (I) (конъюгат OVA/SANH/UC-1V150). Фиг. 5 иллюстрирует профиль абсорбции при реакции сопряжения синтетического TLR7 агониста,UC-1V150, с сывороточным альбумином мыши (MSA). Отношение UC-1V150 к MSA составляет примерно 5:1. На фиг. 6 показан конъюгат TLR агонист/фосфолипид. На фиг. 7 показан эффект от введения конъюгата UC-1V199/липид в различных дозах в различное время. Фиг. 8 А и 8 В показывают, что UC-1V199/липид ингибирует сигналы TLR7 и TLR2. Фиг. 9 иллюстрирует зависимость ответа от двухфазной дозы сильнодействующего TLR7 агониста(пико/наномолекуляный агонист и микромолекулярный агонист). Фиг. 10 А и 10 В иллюстрируют активацию как мышиных макрофагов из костного мозга (панель А),так и мононуклеарных клеток периферической крови человека (панель В) при введении конъюгатов UC1V150/MSA. Клетки инкубировали при различных концентрациях конъюгатов от 0,5 нМ до 10 мкМ сBMDM или от 0,1 до 10 мкМ с РВМС. Надосадочные жидкости собирали через 24 ч и определяли содержание цитокинов при помощи Luminex. Фиг. 11 А, В и С иллюстрируют in vivo эффективность конъюгата TLR7 агониста. Мышам C57BL/6 вводили инъекцией (внутривенно в хвостовую вену) различные количества UC-1V150 (альдегидмодифицированный SM-360320) или UC-1V150/MSA. Образцы сыворотки собирали и определяли содержание цитокинов при помощи Luminex. Действие несопряженного синтетического TLR7 агониста,SM-360320, длилось только 2 ч, тогда как UC-1V150/MSA характеризовался действием в течение по меньшей мере 6 ч. На фиг. 12 показана in vivo локальная активность конъюгата UC-1V150/MSA без системного эффекта. Мышей C57BL/6 анестезировали и вводили или (i.t.) 3 нмоль UC-1V150/MSA. В указанные моменты времени мышей умерщвляли и отбирали BALF и сыворотку. Соединяли результаты двух отдельных экспериментов (по меньшей мере 6 мышей в группе). Результаты показывают средние величиныSEM. На фиг. 13 показана индукция цитокинов в BMDM, вызванные конъюгатом облученные споры сибирской язвы - TLR7 агонист. На фиг. 14 представлены графики выживаемости после иммунизации мышей UC-1V150/MSA и введения спор. А) Подобранным по возрасту самкам мышей A/J вводили интраназально один физиоло-7 019151 гический раствор или физиологический раствор, содержащий MSA (количество эквивалентно UC1V150/MSA), UC-1V150 или UC-1V150/MSA в количестве нмоль/мышь до инфицирования В. anthracis и определяли выживаемость в течение до 13 дней. В) Мышам Balb/c вводили интраназально физиологический раствор или UC-1V150/MSA в количестве 5 нмоль/мышь за 1 день до инфицирования вирусом гриппа и определяли выживаемость в течение 21 дня. В каждой модели получали кривые выживаемостиKaplan-Meier и проводили тесты log/rank (однофакторные) для определения значимости. В каждой группе испытывали по меньшей мере 8 мышей. На фиг. 15 показан график, иллюстрирующий выживаемость после единичной дозы вакцины сTLR7 агонистами и конъюгатами. IRS - иммунная регуляторная последовательность. На фиг 16 показано, что защита от действия спор сибирской язвы зависит от клеток CD4+. На фиг. 17 показан локальный цитокиновый профиль у мышей. Мышам C57LB/6 вводили i.t. конъюгат UC-1V150/MSA или несопряженный UC-1V136 по 3 или 500 нмоль каждой мыши соответственно. В указанные моменты времени собирали BALF и сыворотку и определяли содержание цитокинов методом мультиплексного иммуноанализа. Приведены средние величины, полученные по меньшей мере из 35 мышейSEM. Фиг. 18 иллюстрирует спектр абсорбции для непосредственного связывания частиц SIV CUC1V150. Фиг. 19 иллюстрирует индукцию цитокинов в BMDC, вызванную конъюгатом синтетическогоTLR7 агониста и вирусных частиц. Фиг. 20 А и 20 В иллюстрируют действие конъюгата UC-1V150/инактивированный SIV (панель А) или UC-1V150/OVA/ODN (панель В) на продуцирование IL12. Миелоидные BMDC индуцировали в течение 24 ч при различных условиях при дозе 0,1 мкг/мл, как показано. Содержание IL12 в клеточном супернатанте измеряли про помощи ELISA. Фиг. 21 является графической иллюстрацией стимуляции дендритных клеток из костного мозгаOVA/1043 и OVA/1018 представляют собой конъюгаты ODN. Фиг. 24 является иллюстрацией сопряжения синтетического TLR агониста с липидным компонентом липосомы. Самосборка конъюгата TLR, сопряженного через спейсер-линкер с С-15 липидом, привела к образованию наночастиц размером 100 нм. TLR агонист и NHS-эфир липида реагировали в эквимолярных количествах в DMF и 1 экв. триэтиламина в течение 6 ч. Реакционную смесь очищали методом препаративной HPLC в изократических условиях в смеси 50:50 ацетонитрил/вода. На фиг. 25 схематически показан конъюгат TLR агонист/липосома. Липосомы получены с холестерином: DOPE:DSPC:mPEG2000-DSPE:TLR-DSPE:BODIPY-DOPE 30:30:30:5:5:1,5; DSPCE = дистеароилфосфатидилэтаноламин; DOPE = диолеоилфосфатидилэтаноламин; BODIPY = 6-4-4-дифтор-5-(2 тиенил)-4-бора-3 а,4 а-диаза-s-индацен-3-ил)стирилокси)ацетил)аминогексан-амидо-DOPE. Реагенты холестерин: DOPE:DSPC:DSPE:TLR агонист:DSPE-mPEG (в молярном отношении 1:1:1:0,16:0,16) в среде хлороформа помешали в стеклянные трубки для культур объемом 30 мл, высушивали в потоке газообразного азота и под вакуумом минимум в течение 6 ч для удаления остаточного органического растворителя. Высушенную липидную пленку гидратировали в стерильной деионизированной воде в объеме,равном 1 мл, минимум в течение 12 ч. Липосомы перемешивали на вортексе в течение 2-3 мин с целью удаления прилипшей липидной пленки и обрабатывали ультразвуком в ультразвуковой бане (ULTRAsonic 28 Х) в течение 2-3 мин при комнатной температуре с получением мультиламеллярных пузырьков(MLV). Затем MLV обрабатывали ультразвуком с Ti-зондом (используя прибор Branson 450 со 100% рабочим циклом и мощностью 25 Вт) на ледяной бане в течение 1-2 мин с получением маленьких униламеллярных пузырьков (SUVs), о чем свидетельствует образование прозрачного раствора. Раствор фильтровали под давлением через нуклеопорные поликарбонатные мембраны (вначале 200 и затем 100 нм),получая наночастицы липосом размером 100 нм с фактором полидисперсности менее 0,1. На фиг. 26 показан процесс синтеза липидного конъюгата WW-109. 0,45 мг (1 мкмоль) 1V199 добавляли к 100 мкл 10 мМ раствора DOPE в хлороформе. К этому раствору добавляли 0,1 мг триэтиламина из раствора в хлороформе. Смесь реагировала при комнатной температуре в течение 24 ч и хлороформ выпаривали в роторном выпаривателе. Белый твердый остаток промывали 3 раза в смеси 60%/метанол/гексан и центрифугировали с получением твердого продукта белого цвета. Массспектроскопия показала, что m/z составил 1086 и соединение характеризовалось max УФ-абсорбцией при длине волны 268 нм. Для получения аналогичных соединений могут быть применены жирные кислоты с цепями различной длины, включая С 14-С 22 карбоновые кислоты с одним, двумя, тремя или четырьмя сайтами ненасыщенности, эпоксидирования, гидроксилирования или комбинации этих превращений в любых подходящих положениях в цепи карбоновой кислоты. По одному конкретному варианту жирная кислота представляет собой С 17 карбоновую кислоту с сайтом ненасыщенности в положении C8-C9. По другому варианту применяют С 18 карбоновые кислоты с сайтом ненасыщенности в положении C9-С 10. Карбоксильные группы каждой жирной кислоты могут быть одинаковыми или разными (см., например, фиг. 6). Фиг. 27 иллюстрирует схематическое изображение частицы двуокиси кремния с TLR агонистами,ковалентно связанными с этими частицами. На фиг. 28 представлены примеры соединений для получения конъюгатов по изобретению или для применения при осуществлении способов по изобретению. Другие конъюгаты включают TLR агонисты,связанные с альбумином сыворотки человека, например HSA/UC-1V150 или DOPE/UC-1V199. UC-1X-51 повышает в 3 раза уровень TNF-альфа (110 нг/мл). Сведения, подтверждающие возможность осуществления изобретения Определения Применяемый в данной заявке термин "антитело" относится к белку, содержащему один или более полипептидов, кодированных генами иммуноглобулина или фрагментами генов иммуноглобулина. Распознанные гены иммуноглобулина включают гены каппа, лямбда, альфа, гамма, дельта, эпсилон и мю постоянного участка, а также большое количество генов вариабельного участка. Легкие цепи классифицируются как каппа или лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, что, в свою очередь, определяет классы иммуноглобулина IG, IgM, IgA, IgD и IgE соответственно. Как известно, основная структурная единица иммуноглобулина (антитело) включает тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидный цепей, при этом каждая пара имеет одну"легкую" (около 25 кД) и одну "тяжелую" цепь (около 50-70 кД). N-конец каждой цепи определяет вариабельный участок из примерно 100-110 или более аминокислот, в первую очередь, ответственный за распознавание антигена. Термины "вариабельная легкая цепь (VL)" и "вариабельная тяжелая цепь (VH)" относятся к этим легким и тяжелым цепям соответственно. Антитела могут существовать как интактные иммуноглобулины или как модификации в различных формах, включая, например, FabFc2, Fab, Fv, Fd, (Fab')2, при этом фрагмент Fv содержит только вариабельные участки легких и тяжелых цепей, а фрагмент Fab или (Fab')2 содержит вариабельные участки и части постоянных участков, одноцепное антитело, например scFv, CDR-привитые антитела и т.п. Тяжелая и легкая цепь Fv может быть из одного и того же антитела или разных антител с получением при этом химерного участка Fv. Антитело может быть животного (особенно мышиного или крысиного) или человеческого происхождения или может быть химерным или гуманизированным. Применяемый в данной заявке термин "антитело" включает эти различные формы. Композиция состоит из "практически одного" конкретного соединения или из конкретной формы соединения (например, изомера), когда композиция содержит по меньшей мере примерно 90% и предпочтительно по меньшей мере примерно 95, 99 и 99,9% конкретного соединения по весу. Композиция содержит "смесь" соединений или форм одного и того же соединения, когда каждое соединение (например, изомер) составляет по меньшей мере примерно 10% от веса композиции. Аналог пурина по изобретению или его конъюгат может быть получен в виде кислой соли или в виде основной соли, а также в виде свободной кислоты или свободного основания. В растворе некоторые из соединений по изобретению могут существовать как цвиттерионы, и противоионы образуют сами молекулы растворителя или другие ионы, растворенные или суспендированные в растворителе. Применяемый термин "изолированный" относится к in vitro препарату, выделению и/или очистке нуклеиновой кислоты, пептида или белка или другой молекулы так, что она не связана с in vivo веществами или находится в форме, отличающейся от той, которая обнаружена в природе. Так, термин "изолированная", применяемый по отношению к нуклеиновой кислоте, в "изолированном олигонуклеотиде" или "изолированном полинуклеотиде" относится к последовательности нуклеиновой кислоты, которая идентифицируется и отделяется по меньшей мере от одного загрязняющего вещества, с которым она обычно содержится в источнике получения. Изолированная нуклеиновая кислота находится в форме, которая отличается от формы, в которой она находится в природе. В противоположность этому, неизолированные нуклеиновые кислоты (например, ДНК и РНК) находятся в таком состоянии, в котором они существуют в природе. Например, последовательность ДНК (например, ген) находится на хромосоме клетки-хозяина вблизи от соседних генов; последовательности РНК (например, специфичная последовательность мРНК, кодирующая специфический белок) находятся в виде смеси с многочисленными другими мРНК, которые кодируют множество белков. Следовательно, в случае "изолированной молекулы нуклеиновой кислоты", которая включает полинуклеотид геномной, кДНК или ДНК синтетического происхождения или некоторую их комбинацию, "изолированная молекула нуклеиновой кислоты" (1) не связана со всем полинуклеотидом или частью полинуклеотида, в которых "изолированная молекула нуклеиновой кислоты" находится в природе,(2) связана с полинуклеотидом, с которым не связана в природе, или (3) не встречается в природе как часть большей последовательности. Изолированная молекула нуклеиновой кислоты может находиться в однонитевой или двухнитевой форме. Когда нуклеиновая кислота должна быть использована для экспрессирования белка, нуклеиновая кислота содержит минимум смысловую или кодирующую нить (то есть нуклеиновая кислота может быть однонитевой), но может содержать как смысловую, так и антисмысловую нити (то есть нуклеиновая кислота может быть двухнитевой). Термин "аминокислота" охватывает остатки природных аминокислот (например, Ala, Arg, Asn, Asp,-9 019151Cys, Glu, Gln, Gly, His, Hyl, Hyp, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val) в D- или L-форме, а также неприродных аминокислот (например, фосфосерина, фосфотреонина, фосфотирозина, гидроксипролина, гамма-карбоксиглутамата, гиппуровой кислоты, октагидроиндола-2-карбоновой кислоты, статина, 1,2,3,4-тетрагидрохинолин-3-карбоновой кислоты, пеницилл-амина, орнитина, цитрулина,-метилаланина, п-бензоилфенилаланина, фенилглицина, пропаргилглицина, саркозина и третбутилглицина). Этот термин охватывает также природные и неприродные аминокислоты, содержащие обычную группу, защищающую аминогруппу (например, ацетил или бензил-оксикарбонил), а также природные и неприродные аминокислоты, защищенные на карбоксильном конце (например, (C1C6)алкилом, фениловым или бензиловым эфиром или амидом или метилбензиламидом. Другие подходящие группы для защиты аминных и карбоксильных групп известны специалистам (см., например, Т.W.Greene, Protecting Groups in Organic Synthesis; Wiley: New York, 1981 и ссылки, приведенные в этой книге). Например, аминокислота может быть связана с остатком соединения формулы (I) через карбоксильный конец, аминоконец или через любую другую подходящую точку присоединения, такую как, например, через серу цистеина. Термин "толл-подобный" рецептор (TLR), применяемый в данной заявке, относится к члену семейства рецепторов, которые связываются с патоген-ассоциированными молекулярными структурами(PAMPs) и способствуют иммунному ответу у млекопитающего. Известны десять TLRs, например TLR110. Термин "толл-подобный агонист" (TLR агонист) относится к молекуле, которая связывается с TLR. Синтетические TLR агонисты представляют собой химические соединения, которые сконструированы так, чтобы они связывались с TLR и активировали рецептор. Примеры синтетических TLR агонистов,предусмотренных в данной заявке, включают "TLR-7 агонист", "TLR агонист", "TLR-3 агонист" и "TLR9 агонист". TLR агонисты включают имиквимод, резиквимод, бропримин и локсорибин. Термин "нуклеиновая кислота", используемый в данной заявке, относится к ДНК, РНК, однонитевым, двухнитевым или более сильно агрегированным мотивам гибридизации и к их любым химическим модификациям. Модификации включают, но без ограничения, модификации, вводящие химические группы, которые придают дополнительный заряд, поляризуемость, водородное связывание, электростатическое взаимодействие и патологическое истечение лигандным основаниям нуклеиновой кислоты или лиганду нуклеиновой кислоты в целом. Такие модификации включают, без ограничения, нуклеиновые кислоты пептидов (ПНК), фосфодиэфирные модификации (например, фосфоротиоаты, метилфосфонаты), модифицированные в 2'-положении сахара, модифицированные в 5-положении пиримидины, модифицированные в 7 положении пурины, модифицированные в 8-положении пурины, модифицированные в 9-положении пурины, модификации у экзоциклических аминов, замещенные 4-тиоуридина, замещенные 5-бром и 5 иодурацилов; модифицированные по основной цепи соединения, метилированные производные, необычные спаривающие основания, комбинации, такие как изооснования, изоцитидин и изогуанидин и т.п. Нуклеиновые кислоты включают также неприродные основания, такие как, например, нитроиндол. Модификации могут также включать 3'- и 5'-модификации, такие как кэппирование с BHQ, флуорофором или другим фрагментом. Применяемый в данной заявке термин "фармацевтически приемлемые соли" относится к производным описанных соединений, у которых родительское соединение модифицировано с образованием его кислых или основных солей. Примеры фармацевтически приемлемых солей включают, но без ограничения, соли минеральных или органических кислот и основных остатков, таких как амины, щелочные или органические соли кислых остатков, таких как остатки карбоновых кислот, и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммониевые соли родительского соединения, например, полученные из нетоксичных неорганических и органических кислот. Например,такие обычные нетоксичные соли включают соли, полученные из неорганических кислот, таких как соляная, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, полученные из органических кислот, таких как уксусная, пропионоавая, янтарная, гликолевая, стеариновая, молочная,яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная,глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфокислота, метансульфокислота, этандисульфокислота, щавелевая, изэтионовая кислота и т.п. Фармацевтически приемлемые соли соединений, используемых согласно данному изобретению,могут быть синтезированы из родительского соединения, которое содержит основной или кислый фрагмент, обычными химическими способами. Обычно такие соли могут быть получены путем взаимодействия свободных кислых или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе или в смесях того и другого; обычно предпочтительной является неводная среда, такая как простой эфир, этилацетат, этанол,изопропанол или ацетонитрил. Перечни подходящих солей можно найти в Remington's PharmaceuticalSciences, 17th ed., Mack Publishing Company. Easton, P.A., p. 1418 (1985), содержание этого источника включено в качестве ссылки в данную заявку. Выражение "фармацевтически приемлемые" относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые, с точки зрения специалиста-медика, пригодны для приме- 10019151 нения для контактирования с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, при разумном отношении польза/риск. В данном описании применяют следующие определения, если не указано иное: гало или галоген означает фтор, хлор, бром или йод. Алкил, алкокси, алкенил, алкинил и т.д. обозначают как линейные,так и разветвленные группы; но ссылка на отдельный радикал, такой как "пропил", охватывает только линейный радикал, а на разветвленный изомер, такой как "изопропил", дается особое указание. Арил обозначает фенильный радикал или орто-конденсированный бициклический карбоциклический радикал,содержащий примерно 9-10 атомов в кольце и по меньшей мере одно ароматическое кольцо. "Het" может быть гетероарилом, который охватывает радикал, присоединенный через атом углерода моноциклического ароматического кольца, содержащего 5 или 6 атомов, являющихся атомами углерода и однимчетырьмя гетероатомами, каждый из которых выбран из группы, состоящей из неперекисного кислорода,серы и N(X), где X отсутствует или обозначает Н, О, (С 1-С 4)алкил, фенил или бензил; а также радикал орто-конденсированного бициклического гетероцикла примерно с 8-10 атомами в кольце, в частности бензпроизводное, или кольцо, полученное конденсированием с ним пропилена, триметилена или тетраметилена. Специалистам очевидно, что соединения по изобретению, содержащие хиральный центр, могут существовать и могут быть выделены в оптически активной и рацемической формах. Некоторые соединения могут проявлять полиморфизм. Следует иметь в виду, что данное изобретение охватывает любую рацемическую, оптически активную, полиморфную или стереоизомерную форму или их смеси, соединения по изобретению, которые обладают полезными свойствами, описанными в данной заявке, при этом хорошо известно, как получить оптически активные формы (например, путем разрешения рацемической формы при перекристаллизации, путем синтеза из оптически активных исходных веществ, путем хирального синтеза или путем хроматографического разделения с применением хиральной стационарной фазы) и как определить активность агониста, применяя стандартные тесты, описанные в данной заявке,или другие похожие тесты, хорошо известные из уровня техники. Следует также иметь в виду, что, как известно специалистам в данной области соединения, описанные в данной заявке, включают различные таутомеры, которые могут существовать в различных состояниях равновесия друг с другом. Термин "терапевтически эффективное количество" означает количество соединения, применяемого по изобретению, или количество комбинации заявленных соединений, пригодные, например, для лечения или профилактики болезни или расстройства или для лечения симптомов болезни или расстройства у хозяина. Применяемые термины "лечение" или "лечить" включают (i) предотвращение патологического состояния от возникновения (например, профилактику); (ii) ингибирование патологического состояния или остановку его развития; (iii) облегчение патологического состояния и/или уменьшение симптомов,связанных с патологическим состоянием. Применяемый термин "пациент" относится к организмам, которые подвергаются лечению способами по изобретению. Такие организмы включают, без ограничения, млекопитающих, таких как люди. В контексте данного изобретения термин "субъект" обычно относится к индивидууму, который подвергается лечению или который уже прошел курс лечения (например, ему вводили соединение по изобретению)."Стабильное соединение" и "стабильная структура" предназначены для обозначения соединения,которое настолько стабильно, чтобы быть выделенным из реакционной смеси с достаточной степенью чистоты и быть включенным в состав эффективного терапевтического вещества. Согласно данному изобретению заявляются только стабильные соединения.TLR агонисты и конъюгаты по изобретению и их применение. По одному из вариантов данное изобретение предусматривает терапевтический способ предотвращения или лечения патологических состояния или симптома у млекопитающего, такого как человек, когда используется активность TLR агониста и желательно его действие. Этот способ включает введение млекопитающему, нуждающемуся в такой терапии, эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Неограничивающие примеры патологических состояний или симптомов, которые пригодны для лечения, включают раковые болезни, воспалительные болезни желудочно-кишечного тракта, мозга, кожи, суставов и других тканей, бактериальные или вирусные заболевания, аутоиммунные болезни и болезнь Крона. Соединения по изобретению можно также применять для изготовления вакцин от бактерий, вирусов, раковых клеток или рак-специфичных пептидов или для активации противораковых моноклональных антител, таких как стимулянт CNS (ЦНС), или биозащиты. Таким образом, соединение предусматривает соединения по изобретению для применения в медицинской терапии (например, для применения в качестве противоракового агента, для лечения бактериальных болезней, для лечения вирусных болезней, таких как гепатит С и гепатит В, для лечения болезни Крона и в качестве терапевтических агентов для лечения иммунологических болезней). Кроме того, соединения по изобретению могут предотвращать карциогенез, например, вызванный вирусами гепатита С и гепатита В, и могут быть применены для изготовления медикамента, пригодного для лечения рака, вирусной или бактериальной инфекции, болезни Крона и иммунологических нарушений у млекопитающего, такого как человек. По одному из вариантов данное изобретение предусматривает способ лечения вирусной инфекции у млекопитающего путем введения конъюгата TLR агониста по изобретению. Вирусная инфекция может быть вызвана вирусом РНК, продуктом вируса РНК, который действует как TLR агонист, и/или вирусом ДНК. Примером вируса ДНК является вирус гепатита В. Согласно одному из вариантов вирусная инфекция вызвана коронавирусом, который вызывает тяжелый острый респираторный синдром (SARS), вирусом гепатита В или вирусом гепатита С. По одному из вариантов данное изобретение предусматривает способ лечения рака путем введения эффективного количества конъюгата TLR агониста по изобретению. Раковая болезнь может представлять собой чувствительный к интерферону рак, такой как, например, лейкемия, лимфома, миелома, меланома или рак почек. Конкретные виды рака, которые можно подвергать лечению, включают меланому,поверхностный рак мочевого пузыря, старческий кератоз, интраэпителиальную неоплазию и карциному базальных клеток кожи, плоскоклеточный рак и т.п. Кроме того, способ по изобретению включает лечение предракового состояния, такого как, например, старческий кератоз или интраэпиталиальная неоплпзия, семейный полипоз (полипы), цервикальная дисплазия, рак шейных отделов, поверхностный рак мочевого пузыря и другие виды рака, связанные с инфекцией (например, лимфосаркома Капоши или лейкемия) и т.п. Согласно другому варианту данное изобретение включает способ лечения аутоиммунной болезни путем введения терапевтически эффективного количества конъюгата TLR агониста по изобретению или его фармацевтически приемлемой соли. Примеры аутоиммунных болезней включают рассеянный склероз, волчанку, ревматоидный артрит и т.д. Согласно еще одному варианту данное изобретение предусматривает способ лечения болезни Крона путем введения конъюгата TLR агониста по изобретению. Конъюгаты TLR агониста могут включать гомофункциональный полимер TLR агониста, например,образованный из TLR7 агониста или TLR3 агониста. TLR7 агонист может представлять собой 7-тиа-8 оксогуанозиниловый (TOG) фрагмент, 7-деазагуанозинильный (7DG) фрагмент, конъюгат TLR агониста может включать гетерофункциональный полимер TLR агониста. Гетерофункциональный полимер TLR агониста может включать TLR7 агонист, или TLR3 агонист, или TLR9 агонист, или все три агониста. Гетерофункциональный полимер TLR агониста может включать TLR8 агонист или TLR9 агонист. Данное изобретение включает ковалентное сопряжение синтетического TLR агониста с выбранными макромолекулами для достижения, например, желаемых молекулярной формы, размера и валентности с целью оптимизации иммунологических свойств получаемого конъюгата и/или таргетирования или доставки конъюгата в желаемые клетки и ткани. Как описано в данной заявке, конъюгаты имеют такое строение, что они пригодны для применения в различных медицинских областях, включая, но без ограничения, случаи аллергической астмы, респираторных вирусных инфекций (грипп и RSV), волчанки и других аутоиммунных болезней, и применения в качестве комбинаций антиген-адъювант для вакцин против раковых и инфекционных болезней. Конъюгаты обеспечивают оптимальный иммунный ответ,ограничивая при этом нежелательные системные побочные эффекты за счет "привязывания" иммунного активатора (синтетического TLR агониста) к макромолекуле при помощи прочной ковалентной связи. Макромолекула может служить в качестве таргетирующего фрагмента и/или интегральной части иммунного ответа, например, как антиген в конъюгате. Основное преимущество при введении стабильного конъюгата в локализованное окружение заключается в том, что только очень небольшие количества TLR агониста высвобождаются с течением времени в системной среде. По одному из вариантов макромолекула выбирается из продуктов, таких как белки, липиды или дендримеры либо полимеры, содержащие на своей поверхности аминогруппы, такие как полистирольные"аминогранулы", каждая из которых содержит первичные аминогруппы, доступные для сопряжения с линкером, таким как SANH, или для непосредственного сопряжения с синтетическим TLR7 агонистом. Например, в случае сопряжения линкера и макромолекулы TLR7 агонист, такой как UC-1V150, реагирует с NHS-эфиром конъюгата SANH-макромолекула с получением конъюгата TLR7 агонист-SANHмакромолекула. Обычно в случае острых вспышек болезни вакцины не используются, так как (1) они начинают действовать через длительное время и (2) они неэффективны для пациентов с нарушенным иммунитетом. Например, инфекции, вызванные Staphylococcus aureus (SA), являются основной причиной заболеваемости и смертности у госпитализированных пациентов. Группы с повышенным риском являются группами с подавленным иммунитетом вследствие ожогов, травм, введения катетеров, проведения диализа или пожилыми людьми в домах престарелых. Более того, многие штаммы SA в больницах являются устойчивыми к обычным антибиотикам. Данное изобретение преодолевает два барьера в процессе лечения. Согласно изобретению предусмотрено применение композиций, включающих синтетические TLR агонисты и конъюгаты с синтетическими TLR агонистами в комбинации с грамположительными бактериальными антигенами. TLR7 лиганды обычно характеризуются слабой фармакокинетикой и быстрыми системными абсорбцией и выделением. Из-за системного диспергирования они приводят к появлению цитокинового синдрома. Эффективные адъюванты должны создавать "иммунный градиент" цитокинов и хемокинов. По одному из вариан- 12019151 тов связывание активных синтетических TLR7 агонистов с макромолекулами улучшает доставку, фармакокинетику и позволяет избежать системной токсичности путем локализованного воздействия. Согласно еще одному варианту данное изобретение предусматривает способ предотвращения или ингибирования инфекции, вызванной грамположительными бактериями, у млекопитающего, включающий введение млекопитающему эффективного количества композиции, содержащей бактериальный антиген грамположительной бактерии и синтетический TLR7 агонист. По другому варианту настоящее изобретение предусматривает способ предотвращения или ингибирования инфекции, вызванной грамположительными бактериями, у млекопитающего, включающий введение млекопитающему эффективного количества синтетического TLR7 агониста, связанного с грамположительным бактериальным антигеном. Например, конъюгат 1V150-MSA сохраняет активность TLR7 агониста, имеет повышенную активность и пониженную токсичность, вызывает локальную активацию врожденного иммунитета и индуцирует иммунную защиту, зависящую от Т-клеток, в течение 6 дней после одной вакцинации бактериальным антигеном. По одному из вариантов синтетический TLR7 агонист вводится вместе с одним или более антигенами S. aureus или подвергается связыванию с этими антигенами. В табл. 1 приведены примеры антигенов для S. aureus для применения с синтетическими TLR7 агонистами, особенно в случае острых вспышек болезни. Вакцины по изобретению могут неожиданно обеспечить быстрый и эффективный иммунный ответ. Таблица 1 Согласно одному из вариантов изобретение предусматривает следующие конъюгаты:X1 обозначает -О-, -S- или -NRc; где Rc обозначает водород, С 1-10 алкил или С 1-10 алкил, замещенный С 3-6 циклоалкилом, или Rc и R1,взятые вместе с атомом азота, могут образовать гетероциклическое кольцо или замещенное гетероциклическое кольцо, причем заместителями являются гидрокси, С 1-6 алкил, гидрокси-С 1-6 алкилен, С 1-6 алкок- 13019151 си, С 1-6 алкокси-С 1-6 алкилен или циано; где R1 обозначает (С 1-C10)алкил, замещенный (С 1-С 10)алкил, (С 6-10)арил, замещенный (С 6-10)арил,С 5-9 гетероцикл, замещенный С 5-9 гетероцикл, причем заместители в алкильных, арильных и гетероарильных группах представляют собой гидрокси, С 1-6 алкил, гидрокси-С 1-6 алкилен, С 1-6 алкокси,С 1-6 алкокси-С 1-6 алкилен, амино, циано, галоген или арил; каждый R2 независимо обозначает водород, ОН, (С 1-С 6)алкил, замещенный (C1-C6)алкил, (C1C6)алкокси, замещенный (C1-C6)алкокси, -С(О)-(C1-C6)алкил (алканоил), замещенный -С(О)-(C1C6)алкил, -С(О)-(С 6-С 10)арил (ароил), замещенный -С(О)-(С 6-С 10)арил, -С(О)ОН (карбоксил), -C(O)O(C1C6)алкил (алкоксикарбонил), замещенный -С(О)О(С 1-С 6)алкил, -NRaRb, -C(O)NRaRb (карбамоил), -OC(O)NRaRb, -(C1-C6)алкилен-NRaRb, -(C1-C6)алкилен-C(O)NRaRb, галоид, нитро или циано; где каждый Ra и Rb обозначает независимо водород, (C1-C6)алкил, (C3-C8)циклоалкил, (C1C6)алкокси, гало (C1-C6)алкил, (C3-C8)циклоалкил (C1-C6)алкил, (C1-C6)алканоил, гидрокси(C1-C6)алкил,арил, арил(C1-C6)алкил, Het, Het-(C1-C6)алкил или (C1-C6)алкоксикарбонил; где X обозначает связь или связывающую группу; R3 обозначает макромолекулу; где n равен 1, 2, 3 или 4; где m равен 1 или 2; где q равен 1-1000, 104, 105, 106 или более; или фармацевтически приемлемые соли этих соединений. Макромолекулы могут быть органическими молекулами, состоящими из углерода, кислорода, водорода, азота,серы, фосфора или их сочетаний, которые не являются вредными для тканей организма (например, они нетоксичны и/или не вызывают воспаления) и могут включать, без ограничения, дендримеры, белки,пептиды, липиды и их составы (например, липосомные наночастицы) с линкерами или без линкеров(группы X2) и аминомодифицированные полимеры, например полистирольные гранулы, а также галактозилкерамиды (см. фиг. 1). Соединения по изобретению могут быть получены с применением соединений, имеющих формулу где X2 обозначает группу, которая может реагировать со специфической группой соединений, например, описанных в патенте США 6329381 (Kurimoto и др.) или образовывать связь со связывающей группой, или реагировать с образованием связи с макромолекулой, остальные переменные величины имеют значения, указанные выше для формулы (IA). Неограничивающие примеры макромолекул включают макромолекулы с боковыми цепями, которые повышают растворимость, такие как, например,группы, содержащие морфолиновые, пиперидиновые, пирролидиновые или пиперазиновые кольца и т.п.,аминокислоты, полимеры аминокислот (белки или пептиды), например дипептиды или трипептиды и т.п.; углеводы (полисахариды), нуклеотиды, такие как, например, ПНК, РНК и ДНК и т.п.; полимеры органических соединений, такие как, например, полиэтиленгликоль, полилактид и т.п.; мономерные и полимерные липиды; нерастворимые органические наночастицы; нетоксичные вещества из организма, такие как, например, вирусы, бактерии, грибки и т.п. Антигены могут включать целые инактивированные организмы или их компоненты, например клетки и т.п. Согласно одному из вариантов соединение по изобретению имеет формулу (IC) где X обозначает N или CRx, где Rx обозначает водород, галоген, замещенный алкил, незамещенный алкил, замещенный гетероалкил или незамещенный гетероалкил;) указывают возможные связи, при этом когда связь между Y и атомом углерода, отмеченным звездочкой, является двойной, Q2 отсутствует; когда связь между Q1 и атомом углерода, отмеченным звездочкой, является двойной, Q1 обозначает О, S, NY1 или NNY2Y3, и когда связь между Q1 и атомом углерода, отмеченным звездочкой, является простой связью, Q1 обозначает водород, циано, нитро, Q-Y2, S-Y2, NY1Y2 или NY2NY3Y4;Y1 обозначает водород, замещенный алкил, незамещенный алкил, замещенный циклоалкил, незамещенный циклоалкил, замещенный гетероалкил или незамещенный гетероалкил, замещенный арил,незамещенный арил, замещенный гетероарил, незамещенный гетероарил, С(=О)-замещенный алкил,С(=О)-незамещенный алкил, С(=О)О-замещенный алкил, С(=О)О-незамещенный алкил, циано, нитро,- 14019151 гидрокси или O-Y2;Rc обозначает водород, C1-10 алкил или замещенный C1-10 алкил или Rc и R1, взятые вместе с атомом азота, могут образовать гетероциклическое кольцо или замещенное гетероциклическое кольцо;R1 обозначает водород, C1-10 алкил, замещенный C1-10 алкил, C6-10 арил или замещенный C6-10 арил,С 5-9 гетероцикл или замещенный С 5-9 гетероцикл; каждый R2 обозначает независимо водород, ОН, (С 1-С 6)алкил, замещенный (С 1-С 6)алкил, (С 1 С 6)алкокси, замещенный (С 1-С 6)алкокси, С(О)-(С 1-С 6)алкил (алканоил), замещенный -С(О)-(С 1-С 6)алкил,-С(О)-(С 6-С 10)арил (ароил), замещенный С(О)-(С 6-С 10)арил, -С(О)ОН (карбоксил), -С(О)О(С 1-С 6)алкил(алкоксикарбонил), замещенный С(О)О(С 1-С 6)алкил, -NRaRb, -C(O)NRaRb (карбамоил), -O-C(O)NRaRb,-(С 1-С 6)алкилен-NRaRb, -(С 1-С 6)алкилен-C(O)NRaRb, галоид, нитро или циано; каждый Ra и Rb обозначает независимо водород, (С 1-С 6)алкил, (С 3-C8)циклоалкил,(С 1-С 6)гетероалкил, (С 1-С 6)алкокси, гало-(С 1-С 6)алкил, (C3-C8)циклоалкил(С 1-С 6)алкил, (С 1-С 6)алканоил,гидрокси(С 1-С 6)алкил, арил, арил-(С 1-С 6)алкил, Het, Het-(С 1-С 6)алкил или (С 1-С 6)алкоксикарбонил; при этом заместители у любого алкила, циклоалкила, аминогруппы, алкокси, алканоила, арила и гетероарила или гетероциклической группы представляют собой один или более заместителей (например,1, 2, 3, 4, 5 или 6) из гидрокси, С 1-6 алкила, гидрокси(С 1-С 6)алкилена, С 1-6 алкокси, C3-6 циклоалкила,С 1-6 алкокси-С 1-6 алкилена, амино, циано, галогена, гетероцикла (такого как пиперидинил или морфолинил) или арила;X2 обозначает связь или связывающую группу;R3 обозначает макромолекулу, представляющую собой клетку, вирус, витамин, кофактор, пептид,белок, нуклеиновую кислоту, липид, гранулу или частицу, такую как полистирольная гранула или наночастицы либо дендример; или это может быть фармацевтически приемлемая соль, включая гидраты. Согласно некоторым вариантам группы X2-R3 могут образовать линкер со вторым фрагментом формулы (IC), образуя димер. Например, линкер может быть любым линкером, описанным в данной заявке, таким как, например, двухвалентный арил или гетероарил, бис-амидарил, бис-амидгетероарил, бисгидразидарил, бис-гидразидгетероарил или т.п. Альтернативно, Q1 может образовать линкер для второго фрагмента формулы (IC) с образованием димера через дисульфидную связь; см., например, фиг. 28. В тех случаях, когда соединения являются достаточно основными или кислыми, чтобы образовать кислые или основные соли, может быть пригодным применения соединений в виде солей. Примерами подходящих солей являются соли присоединения к органическим кислотам, образованные с кислотами,которые образуют физиологически приемлемый анион, например тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, -кето-глутарат и -глицерофосфат. Могут быть также получены подходящие неорганические соли, включая гидрохлорид, сульфат, нитрат, бикарбонат и карбонат. Приемлемые соли могут быть получены с применением стандартных методов, хорошо известных из уровня техники, например, путем взаимодействия достаточно основного соединения, такого как амин, с подходящей кислотой, которая образует физиологически приемлемый анион. Могут быть также получены щелочные (например, натриевые, калиевые или литиевые) или щелочно-земельные (например, кальциевые) соли карбоновых кислот. Алкил включает линейные или разветвленные С 1-10 алкильные группы, например метил, этил, пропил, бутил, пентил, изопропил, изобутил, 1-метилпропил, 3-метилбутил, гексил и т.п. Низший алкил включает линейные или разветвленные С 1-6 алкильные группы, например метил,этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1 метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил и т.п. Термин "алкилен" относится к двухвалентной линейной или разветвленной углеводородной цепи(например, этилен: -СН 2-СН 2-). С 3-7 Циклоалкил включает такие группы, как циклопропил, циклопентил, циклогексил, циклогептил и т.п. и алкилзамещенную C3-7 циклоалкильную группу, предпочтительно линейную или разветвленную С 1-6 алкильную группу в качестве алкила, такую как метил, этил, пропил, бутил, пентил, и C5-7 циклоалкильную группу, такую как циклопентил или циклогексил и т.п. Низший алкокси включает С 1-6 алкоксигруппу, такую как метокси, этокси или пропокси и т.п. Низший алканоил включает С 1-6 алканоильные группы, такие как формил, ацетил, пропаноил, бутаноил, пентаноил или гексаноил и т.п.C7-11 Ароил включает такие группы, как бензоил или нафтоил. Низший алкоксикарбонил включает C2-7 алкоксикарбонильные группы, такие как метоксикарбонил,этоксикарбонил или пропоксикарбонил и т.п. Низшая алкиламиногруппа означает аминогруппу, замещенную С 1-6 алкильной группой, такую как метиламино, этиламино, пропиламино, бутиламино и т.п. Ди(низший алкил)аминогруппа означает аминогруппу, замещенную одинаковыми или разными С 1-6 алкильными группами (например, диметиламино, диэтиламино, этилметиламино). Низшая алкилкарбамоильная группа означает карбамоильную группу, замещенную С 1-6 алкильной группой (например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, бутилкарбамоил). Ди(низший алкил)карбамоильная группа означает карбамоильную группу, замещенную одинаковыми или разными С 1-6 алкильными группами (например, диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил). Атом галогена означает такой атом, как фтор, хлор, бром или йод. Термин "арил" относится к С 6-10 моноциклической или конденсированной циклической арильной группе, такой как фенил, инденил или нафтил, и т.п. Гетероциклил или гетероцикл относится к моноциклическим насыщенным гетероциклическим группам или ненасыщенным моноциклическим или конденсированным гетероциклическим группам,содержащим по меньшей мере один гетероатом, например 0-3 атома азота (NRd, где Rd обозначает Н,алкил или Y2, определение которого дано выше), 0-1 атома кислорода (-О-) и 0-1 атом серы (-S-). Неограничивающие примеры насыщенных моноциклических гетероциклических групп включают 5- или 6 членную насыщенную гетероциклическую группу, такую как тетрагидрофуранил, пирролидинил, морфолинил, пиперидил, пиперазинил или пиразолидинил. Неограничивающие примеры ненасыщенной моноциклической гетероциклической группы включают 5- или 6-членную ненасыщенную гетероциклическую группу, такую как фурил, пирролил, пиразолил, имидазолил, тиазолил, тиенил, пиридил или пиримидинил. Неограничивающие примеры ненасыщенных конденсированных гетероциклических групп включают ненасыщенные бициклические гетероциклические группы, такие как индолил, изоиндолил,хинолил, бензтиазолил, хроманил, бензофуранил и т.п.Het может быть насыщенной гетероциклической группой или ненасыщенной гетероциклической группой, такой как гетероарильная группа.Rc и R1, взятые вместе с атомом азота, к которому они присоединены, могут образовать гетероциклическое кольцо. Неограничивающие примеры гетероциклических колец включают 5- или 6-членные насыщенные гетероциклические кольца, такие как 1-пирролидинил, 4-морфолинил, 1-пиперидил, 1 пиперазинил или 1-пиразолинил, 5- или 6-членные ненасыщенные гетероциклические кольца, такие как 1-имидазолил, и т.п. Алкильные, арильные, гетероциклические группы R1 могут быть замещены одним или более заместителями, при этом заместители могут быть одинаковыми или разными и включают низший алкил; циклоалкил, гидроксил, гидрокси-С 1-6 алкилен, такой как гидроксиметил, 2-гидроксиэтил или 3 гидроксипропил; низший алкокси; С 1-6 алкокси-С 1-6 алкил, такой как 2-метоксиэтил, 2-этоксиэтил или 3 метоксипропил; амино; алкиламино; диалкиламино; циано; нитро; ацил; карбоксил; низший алкоксикарбонил; галоген; меркапто; С 1-6 алкилтио, такой как метилтио, этилтио, припилтио или бутилтио; замещенный С 1-6 алкилтио, такой как метоксиэтилтио, метилтиоэтилтио, гидроксиэтилтио или хлорэтилтио; арил; замещенный С 6-10 моноциклический или конденсированный циклический арил, такой как 4 гидроксифенил, 4-метоксифенил, 4-фторфенил, 4-хлорфенил или 3,4-дихлорфенил; 5-6-членный ненасыщенный гетероциклил, такой как фурил, пирролил, пиразолил, имидазолил, тиазолил, тиенил, пиридил или пиримидинил; и бициклический ненасыщенный гетероциклил, такой как индолил, изоиндолил, хинолил, бензтиазолил, хроманил, бензофуранил или фталимино. По некоторым вариантам одна или более указанных выше групп может быть исключена как заместитель различных других групп в соединении. Согласно некоторым вариантам 5-членным кольцом является тиазольное кольцо, например, когда Y в формуле (IA) выше обозначает S и Q2 отсутствует. Алкильные, арильные, гетероциклические группы в R2 могут быть замещены одним или несколькими заместителями, при этом заместители могут быть одинаковыми или разными и включают гидроксил; С 1-6 алкокси, такой как метокси, этокси или пропокси; карбоксил; С 2-7 алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил или пропоксикарбонил; и галоген. Алкил, арил, гетероцикл в Rc могут быть замещены одним или несколькими заместителями, при этом заместители могут быть одинаковыми или разными и включают С 3-6 циклоалкил; гидроксил; С 1-6 алкокси; амино; циано; арил; замещенный арил, такой как 4-гидроксифенил, 4-метоксифенил, 4-хлорфенил или 3,4-дихлорфенил; нитро и галоген.- 16019151 Гетероциклическое кольцо образованное вместе Rc и R1 и атомом азота, к которому они присоединены, могут быть замещены одним или несколькими заместителями, одинаковыми или разными, которые включают С 1-6 алкил; гидрокси-С 1-6 алкилен; С 1-6 алкокси-С 1-6 алкилен; гидроксил; С 1-6 алкокси и циано. Согласно некоторым вариантам, когда Q1 обозначает Q-Y2, Y2 не является водородом. Конкретное значение X представляет собой N. Другое конкретное значение X представляет собой СН. Конечно, в одной молекуле соединения указанной формулы может содержаться только одна из двух связей, указанных пунктирной линией. По одному из вариантов связь между Y и атомом углерода, который отмечен звездочкой, является двойной. По другому варианту связь между Q1 и атомом углерода,который отмечен звездочкой, представляет собой двойную связь. В конкретном случае Q1 обозначает О. В другом конкретном случае Q1 обозначает S. Еще одно значение Q1 представляет собой NY1, например =NH. Еще одно значение для Q1 представляет собой NNY2Y3. Согласно одному из вариантов связь между Q1 и атомом углерода, отмеченным звездочкой, является простой связью. Конкретное значение Q1 представляет водород. Другое конкретное значение Q1 представляет собой NH2. Еще одно конкретное значение Q1 представляет собой O-Y2. Конкретное значение Y1 представляет водород. Другим конкретным значением Y1 является алкил, например (С 1-C6)алкил, такой как метил. Другим значением Y1 является арил, например фенил. Конкретное значение для каждого из Y2, Y3 и Y4 представляет собой водород. Другое конкретное значение для каждого из Y2, Y3 и Y4 (независимо) представляет собой алкил, например (С 1-C6)алкил, такой как метил. Еще одно конкретное значение для Y2, Y3 и Y4 (независимо) представляет собой арил, такой как фенил. Конкретное значение для Z представляет собой О. Другим конкретным значением для Z является S. Еще одним конкретным значением для Z является NY5, где Y5 обозначает водород, метил или фенил. Конкретное значение для Q2 представляет собой водород. В другом конкретном случае Q3 может обозначать метил или фенил. Конкретным значением для Q3 является водород. Другим конкретным значением для Q3 является метил или фенил. Конкретное значение для X1 представляет собой атом серы, атом кислорода или NRc. Другим конкретным значением для X1 является атом серы. Еще одним конкретным значением для X1 является атом кислорода. Еще одним конкретным значением для X1 является NRc. Еще одним конкретным значением для X1 является NH. Конкретным значением для Y является Н. Другим конкретным значением для Y является S. Конкретным значением для Rc является водород, C1-4 алкил или замещенный C1-4 алкил. Конкретным значением для R1 и Rc, взятых вместе, является образование или гетероциклического кольца, или замещенного гетероциклического кольца. Другим конкретным значением для R1 и Rc, взятых вместе, является замещенные или незамещенные морфолиновое, пиперидиновое, пирролидиновое или пиперазиновое кольцо. Конкретным значением для R1 является водород, C1-4 алкил или замещенный C1-4 алкил. Другим конкретным значением для R1 является 2-гидроксиэтил, 3-гидроксипропил, 4 гидроксибутил, 2-аминоэтил, 3-аминопропил, 4-аминобутил, метоксиметил, 2-метоксиэил, 3 метоксипропил, этоксиметил, 2-этоксиэтил, метилтиометил, 2-метилтиоэтил, 3-метилтиопропил, 2 фторэтил, 3-фторпропил, 2,2,2-трифторэтил, цианометил, 2-цианоэтил, 3-цианопропил, метоксикарбонилметил, 2-метоксикарбонилэтил, 3-метоксикарбонилпропил, бензил, фенетил, 4-пиридилметил, циклогексилметил, 2-тиенилметил, 4-метоксифенилметил, 4-гидроксифенилметил, 4-фторфенилметил, 4 хлорфенилметил. Другим конкретным значением для R1 является водород, СН 3-, СН 3-СН 2-, СН 3 СН 2 СН 2-, гидроксиC1-4 алкилен или C1-4 алкокси-C1-4 алкилен. Другим конкретным значением для R1 является водород, СН 3-, СН 3-СН 2-, СН 3-О-СН 2 СН 2- или СН 3-СН 2-O-CH2CH2-. Конкретное значение для R представляет собой водород, галоген или C1-4 алкил. Другое конкретное значение для R2 представляет собой водород, хлор, бром, СН 3-или СН 3-СН 2-. Конкретными заместителями алкила, арила или гетероарила являются гидрокси, C1-6 алкил, гидро- 17019151 кси-C1-6 алкилен, C1-6 алкокси, C1-6 алкокси-C1-6 алкилен, C3-6 циклоалкил, амино, циано, галоген или арил. Конкретным значением для X2 является связь или цепь, содержащая до примерно 24 атомов, при этом атомы выбраны из группы, состоящей из углерода, азота, серы, неперекисного кислорода и фосфора. Другим конкретным значением для X является связь или цепь, содержащая от примерно 4 до примерно 12 атомов. Еще одним конкретным значением для X2 является связь или цепь, содержащая от примерно 6 до примерно 9 атомов. Еще одним конкретным значением для X2 являются Еще одним конкретным значением для X2 является По некоторым вариантам линкер или группа X2 не являются линкером, описанным в заявке WO 2007/024707. Кроме того, по некоторым вариантам R3 не является радикалом, описанным в заявке WO 2007/024707. Конкретная макромолекула представляет собой аминокислоту, углевод, пептид, белок, антиген,нуклеиновую кислоту, липид, дендример, вещество из организма или клетку, такую как микроб. Конкретный пептид содержит от 2 до примерно 20 остатков аминокислот. Другой конкретный пептид содержит от 10 до примерно 20 остатков аминокислот. Конкретная макромолекула является углеводом. Конкретная нуклеиновая кислота является ДНК, РНК или ПНК. Конкретная макромолекула представляет собой клетку, липид, витамин, липид или кофактор. Конкретным антигеном является микроб. Конкретным микробом является вирус, бактерия или грибок. Другим конкретным микробом является вирус или бактерия. Конкретными бактериями являются Bacillus anthracis, Listeria monocytogenes, Francisella tularensis,Salmonella или Staphylococcus. Конкретными бактериями Salmonella являются S. typhimurium или S. enteritidis. Конкретным Staphylococcus является S. aureus. Конкретные вирусы представляют собой вирусы РНК, включая RSV и вирус гриппа, продукт вируса РНК или вирус ДНК, включая вирус герпеса. Конкретным вирусом ДНК является вирус гепатита В. Согласно другим вариантам макромолекула не является аминокислотой, углеводом, пептидом, антигеном, таким как микроб, например вирус (например, вирусы РНК, например SIV, вирус гепатита С или коронавирус, продукт вируса РНК или вируса ДНК, такой как вирус гепатита В, грибки или бактерии, такие как Bacillus anthracis (anthrax), Listeria monocytogenes, Francisella tularensis, или Salmonella (например, typhimurium или enteritidis) нуклеиновой кислотой, такой как ДНК, РНК, ПНК или вещество организма, такое как клетка или липид. Конкретная величина k представляет собой 0. Другой конкретной величиной k является 1. Другой конкретной величиной k является 2. По некоторым вариантам k не равен 1. Конкретное соединение по изобретению представляет собойL отсутствует или является связывающей группой и каждая группа А 1 независимо представляет собой макромолекулу. Данное изобретение включает композиции соединения по изобретению, возможно, в комбинации с другими активными агентами, например рибавирином, лизорибином или микофенолятом мофетила. Другие известные неограничивающие примеры описаны в опубликованной заявке США на патент 20050004144. Другие варианты изобретения предусматривают способы получения соединений по изобретению,способы получения промежуточных соединений по изобретению. Промежуточные соединения, пригодные для получения соединений по изобретению, также предусмотрены как дальнейшие варианты изобретения. Например, соединения (конъюгаты) по изобретению могут быть получены с применением стандартных способов синтеза, известных из уровня техники. Общий способ синтеза сложного эфира и альдегида показан ниже. UC-1V150 был получен семистадийным методом из 2,6-дихлорпурина. Свободная альдегидная группа в бензильном фрагменте UC-1V150 дала возможность осуществить сочетание агониста со многими различными химическими соединениями, включая белки, олигонуклеотиды, ароматические молекулы, липиды, вирусы и клетки при помощи молекулы линкера, которая содержала гидразиновую группу или аминогруппу. Общая схема синтеза. Химический способ получения UC-1V150. Синтез UC-1V150 и получение указанных соединений 2-8 осуществляли следующим образом. Соединение 2. 4-(2,6-Дихлорпурин-9-илметил)бензонитрил. 2,6-Дихлор-9 Н-пурин (1,16 мол) растворяли в DMF (50 мл) с добавлением карбоната калия (50 ммоль) и перемешивали смесь при комнатной температуре в течение 16 ч после добавления -бром-птолунитрила (22 ммоль). После фильтрации для удаления нерастворимых неорганических солей фильтрат вылили в воду (1500 мл) и экстрагировали этилацетатом (2400 мл), сушили над сульфатом магния и выпаривали с получением остатка, который подвергали флэш-хроматографии на силикагеле, применяя смесь 1:2:10 этилацетат/ацетон/гексаны. Получали 3,33 г (69%). УФ, ЯМР и MS подвердили получение указанного соединения. Соединение 3. 4-(6-Амино-2-хлорпурин-9-илметил)бензонитрил. Соединение 2 (1,9 г) помещали в стальной реакционный сосуд и добавляли метанольный раствор аммиака (80 мл, 7 N). Герметизированный сосуд нагревали в течение 12 ч при температуре 60 С, охлаждали на льду и отфильтровывали полученный продукт: выход 1,09 г. УФ, ЯМР и MS подтвердили структуру указанного продукта. Соединение 4. 4-[6-Амино-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрил. Вначале получали натриевую соль 2-метоксиэтанола путем растворения металлического натрия (81 мг) в 2-метоксиэтаноле (30 мл) при нагревании и затем добавляли соединение 3 (1,0 г), растворенное в метоксиэтаноле (300 мл, при нагревании). Реакционную смесь нагревали в течение 8 ч при температуре бани, равной 115 С, концентрировали под вакуумом почти досуха и остаток распределяли между этилацетатом и водой. Путем флэш-хроматографии органического слоя с применением 5% метанола в дихлорметане получали 763 мг продукта. ЯМР подтверждала структуру полученного продукта. Соединение 5. 4-[6-Амино-8-бром-2-(2-метоксэтокси)пурин-9-илметил]бензонитрил. Соединение 4 (700 мг) растворяли в дихлорметане (400 мл) и по каплям добавляли бром (7 мл). Смесь перемешивали в течение ночи при комнатной температуре и экстрагировали вначале водным раствором тиосульфата натрия (2 л, 0,1 М), затем водным раствором бикарбоната натрия (500 мл, насыщ.). Остаток от органического слоя подвергали хроматографии на силикагеле, применяя 3% раствор метанола в дихлорметане, получали 460 мг бромированного продукта. ЯМР, УФ и МС подтверждали структуру полученного продукта. Соединение 6. 4-[6-Амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрил. Получали метоксид натрия по реакции металлического натрия (81 мг) в сухом метаноле (30 мл) и соединяли с раствором соединения 5 (700 мг), растворенного в сухом диметоксиэтане, и повышали температуру до 100 С. После проведения реакции в течение ночи смесь концентрировали под вакуумом и подвергали остаток хроматографии на силикагеле, применяя 5% раствор метанола в дихлорметане. Выход продукта составил 120 мг. ЯМР подтверждала структуру соединения. Соединение 7. 4-[6-Амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензальдегид. Соединение 6 (100 мг) растворяли в сухом ТГФ (3 мл) и охлаждали до 0 С в атмосфере аргона. Для превращения нитрильной группы в альдегидную применяли восстановитель N,N'-(диметилэтилендиамино)алюминийгидрид лития. Готовили 0,5 М раствор в сухом ТГФ и 0,72 мл этого раствора добавляли в реакционную колбу. Смесь перемешивали при температуре 0-5 С в течение 1 ч, обрывали реакцию путем добавления 3 М HCl, экстрагировали этилацетатом, затем дихлорметаном и после этого концентрировали под вакуумом, получая 85 мг продукта. ЯМР подтвердил структуру указанного продукта. Соединение 8. 4-[6-Амино-8-гидрокси-2-(2-метоксиэтокси)пурин-9-илметил]бензальдегид (UC1V150). Соединение 7 (800 мг) соединяли с иодидом натрия (504 мг) и ацетонитрилом (40 мл) и медленно добавляли хлортриметилсилан (0,5 мл). Смесь нагревали при температуре 70 С в течение 3,5 ч, охлаждали и отфильтровывали. Твердый продукт промывали водой, затем простым эфиром, получали 406 мг указанного выше соединения. ЯМР, УФ и МС подтвердили структуру полученного продукта. Ниже приведены дополнительные примеры получения конкретных соединений. Как описано в приведенных примерах, получали растворимый TLR7 агонист, способный к ковалентному соединению с первичными аминами в физиологических условиях. Затем с использованием дендритных клеток (DC) костного мозга мыши или мононуклеарных клеток периферической крови была определена in vitro активность нескольких соединений и комплексов антиген-адъювант, это делали с целью получения характеристики созревания DC и секреции цитокинов (например, IL-12, IL-6, TGF-бета и ми комплексами антиген-TLR7 агонист и вводили им опухолевые клетки меланомы В 16, экспрессирующие трансген cOVA. Определяли эффективную концентрацию (ЕС 50) для каждого соединения, обычно с последующим определением распределения расширенной формы при ингибирующих высоких дозах. Максимальная стимуляция происходила в интервале между 10 и 1000 нМ. Ковалентно связанные с TLR агонистом молекулы адъюванта сохраняли активность, но при более низких ЕС 50. Соединение UC-1V199 с яичным овальбумином почти вдвое увеличило среднюю выживаемость от 22 до 35 дней после подкожного введения опухолевых клеток по сравнению с введением одного яичного овальбумина. Таким образом, ковалентное связывание TLR7 агониста с опухолевым антигеном стимулировало продуцирование DC цитокина и защищало мышей от действия опухолевых клеток. Применение подходящего TLR7 агониста, который сохраняет свои стимулирующие иммунитет свойства в физиологических условиях после связывания с макромолекулой, такой как антиген, может быть полезным при создании insitu вакцины для терапии твердых опухолей. Было показано, что различные пурины, пиридины и имидазохинолины с молекулярными весами,равными 200-400 кД активируют TLR7 и соединения, которые являются специфичными TLR7 лигандами, оказались в 100-1000 раз более активными, чем имиквимод на молекулярной основе (Lee et al., infra). Вследствие того, что эти TLR7 агонисты в высокой степени структурно подобны обычному компоненту нуклеотидов, маловероятно, что они индуцируют иммунную реакцию гаптенов после повторного введения.TLR7 фармакор на основе аденина может нуждаться в ковалентном связывании со "вспомогательной группой" (макромолекулой) для промотирования обратного захвата эндосомами дендритных клеток,где TLR7 экспрессируется, и для сохранения TLR7 агониста. Соответственно получали TLR7 агонистUC-1V150 и его соединяли через его альдегидную группу и через линкер со свободными аминогруппами на различных белках, включая мышиный альбумин (MSA) (фиг. 3). Конъюгаты были в 100 раз более активными in vitro и in vivo, чем несвязанный аналог аденина. Более того, введение в легкие мыши конъюгата альбумина (UC-1V150/MSA) индуцировало локальное продуцирование цитокина в бронхиальной альвеолярной промывной жидкости (BALF) без системного высвобождения цитокина. В противоположность этому доставка несвязанного лекарства в дыхательные пути быстро запускала высвобождение цитокина в кровь. По одному из вариантов TLR7 агонист увеличивает до максимума продуцирование TH1 стимулирующих цитокинов (интерфероны и IL-12) по сравнению с THF- и IL-1. TLR7 локализован на внутренних поверхностях пузырьков в эндосомах, которые образуются постоянно и подвергаются созреванию в DC. Например, для профилактики астмы предпочтительно введение стабильного и активногоTLR агониста, который попадает в эндосомы дендритных клеток на ранней стадии и индуцирует в основном интерфероны типа I. TLR агонист был присоединен ковалентно к вспомогательной группе фосфолипида в надежде, что конъюгат, UC-1V199/L (фиг. 6) будет быстро и стабильно внедряться в липидные мембраны клеток, в том числе эндосомальные везикулы. Примечательно, что такая маленькая доза,как пикомольное количество UC-1V199, индуцировала синтез цитоксинов в мононуклеарных клетках костного мозга мыши. На фиг. 7, 8 показан синтез IL-12.TLR7 лиганды, которые представляют собой пурины или имидазохинолины, имеют особое свойство, а именно характеризуются двухфазной кривой ответа. При высоких концентрациях лекарство не индуцирует синтез цитокинов. Двухфазный характер кривой наблюдается в очень чистых дендритных клетках и оказывается автономным для клеток. Однако замечательная активность UC-1V199/L дала возможность снова изучить это явление с применением фармакологически приемлемых концентраций лекарства (фиг. 9). Максимальное продуцирование цитокинов наблюдалось при концентрации UC1V199/L, равной 10 нМ, в то время как более высокие концентрации индуцировали все меньшее высвобождение IL-12 (и TNF). Известно, что высокие и пролонгированные концентрации TLR7 агонистов индуцируют рефрактерность к повторной стимуляции TLR, которая может длиться 24 ч или более. Такая сложная система регуляции является, очевидно, частью безотказного механизма, который предохраняет клетки и ткани от саморазрушения во время воспалительных реакций. Так, было интересно определить, могут ли концентрации UC-1V199/L, которые не смогли индуцировать значительный синтез цитокинов, может, тем не менее, вызывать "TLR толерантность". В действительности, когда мононуклеарные клетки из костного мозга подвергались действию неактивирующей концентрации UC-1V199/L (1 мкМ) и затем их через 24 ч повторного стимулировали тем же самым соединением с UC-1V150 или с pam3Cys (P3C, трипальмитоилцистеин, активатор TLR2), они выявляли заметно сниженный ответ цитокинов. В противоположность этому клетки, обработанные UC-1V199/L, сохраняли способность к реакции с лигандами TLR3 и TLR4,которые проходят по TRIF пути (результаты не показаны). Предварительные опыты показали, что неспособность к реакции была вызвана также in vivo. Таким образом, ежедневное введение UC-1V199/L и родственных лекарств может подавлять воспаление, вызванное MyD88-зависимыми раздражителями, без системных побочных эффектов, связанных с активацией TLR. По одному из вариантов конъюгаты по изобретению могут быть полезными для профилактики, ин- 21019151 гибирования или лечения астмы. Астма характеризуется эпизодами чередующихся обратимого сжатия дыхательных путей, гиперплазии бронхиальных гладких мышц и хронического воспаления. Атопическое заболевание предрасполагает к астме, но для половины пациентов, пораженных болезнью, не являются атопическими. Другими факторами риска развития астмы являются табачный дым и вещества, загрязняющие воздух. Более того, вспышки болезни у больных астмой могут вызываться не только аллергенами, но также раздражителями дыхательных путей, изменениями температуры и инфекциями. Начальное развитие аллергического ответа частично регулируется балансом между Th1 и Th2 лимфоцитами и их соответствующими цитокинами, особенно интерферонами и IL-4. Вакцинация животных аллергеном в сочетании с Th2-смещенным адъювантом не быстро вызывает IgE ответ. Мыши, которых вакцинировали антигеном и TLR7 или TLR9 агонистами, были устойчивы к астме во время опытов. При лечении астмы TLR агонистами требуется подход, который отличается от подхода при профилактике астмы. У пациентов, больных астмой, дыхательные пути и легочные ткани уже инфильтрованы различной популяцией воспалительных клеток, включая многие подвиды лимфоцитов, макрофагов, дендритных клеток, тучных клеток, эозинофилов и нейтрофилов. В этом случае TLR агонисты могут активно усиливать болезнь при увеличении высвобождения воспалительных медиаторов, таких как TNF-альфа и IL-1. В действительности, способность различных микробных агентов к активации TLRs может объяснить, почему они вызывают приступы астмы.TLR агонист для профилактики астмы предпочтительно ограничен легкими, но он также вызывает максимальное продуцирование Th-1-стимулирующих цитокинов (интерфероны и IL-12) по сравнению сTNF-альфа и IL-1. И TLR7, и TLR9 локализованы на внутренних поверхностях эндосомальных пузырьков, которые образуются постоянно и подвергаются созреванию в дендритных клетках. TLR9 активирующие олигонуклеотиды, которые представляют собой агрегированные фосфодиэфирные олигонуклеотиды, остаются дольше в ранних эндосомальных пузырьках и поэтому индуцируют большее количество интерферонов типа I, чем неагрегированные фосфоротиоатные олигонуклеотиды, которые поступают и вызывают созревание пузырьков. Результаты показывают, что пространственная организацияTLR агониста управляет его перемещением и его структурой индуцированного синтеза цитокинов. Для профилактики астмы предпочтительным является стабильный, активный и молекулярно охарактеризованный TLR агонист, который поступает в эндосомы дендритных клеток на ранней стадии и в основном индуцирует образование интерферонов типа I. Для изучения действия конъюгатов по изобретению на аллергическую астму воспаление дыхательных путей индуцируется путем сенсибилизации мышей при подкожной инъекции мыши 20 мкг овальбумина, абсорбированного 500 мг окиси алюминия в физиологическом растворе в день 0, и в день 7. На день 16 и 21 мышам вводили интраназально (i.n.) по 5 мкг овальбумина. Конъюгаты вводили i.n., перорально (р.о.) или внутривенно (i.v.) в разные моменты времени до первого введения овальбумина на день 16. Через 24 ч после последнего введения (день 22) определяли способность к реакции дыхательных путей мышей умерщвляли и отбирали BALF клетки, образцы легких и селезенки. В качестве контрольных животных использовали мышей, не подвергнутых воздействию, и мышей, сенсибилизированных при помощи овальбумина/alum. Подсчитывали общее количество клеток в BALF и окрашивали образцы при помощи Wright-Giemsa для определения количества эозинофилов, лимфоцитов, нейтрофилов и тучных клеток. Уровень цитокинов в BALF определяли методом Luminex. Способность дыхательных путей к реакции на метахолин определяли через 24 ч после последнего введения, применяя однокамерный плетизмограф. Для мониторинга способности к реакции дыхательных путей применяли Penh, безразмерную величину, которая хорошо коррелирует с легочным сопротивлением, измеренным в обычном двухкамерном плетизмографе у мышей с насыщенной кислородом кровью. Соединения по изобретению вводят в терапевтически эффективном количестве субъекту, нуждающемуся в таком лечении. Введение композиций по изобретению можно проводить любым из подходящих путей введения, в частности парентерально, например внутривенно, внутриартериально, интраперитонеально, внутриоболочечно, интравентрикулярно, интрауретрально, введение в грудину, интракраниально, внутримышечно или подкожно. Введение можно осуществить в виде одной инъекции болюса,множественной инъекции или путем кратковременной или длительной инфузии. Можно также применять имплантируемые устройства (например, имплантируемые инфузионные насосы), которые используют для периодической парентеральной доставки во времени, при этом количество доставляемого лекарства эквивалентно дозам конкретного состава или меняющимся дозам. Для такого парентерального введения соединения предпочтительно применяют в виде стерильного раствора в воде или другом подходящем растворителе или в смеси растворителей. Раствор может содержать другие вещества, такие как соли, сахара (особенно глюкозу или маннит), для получения раствора, который является изотоническим по отношению крови, буферные агенты, такие как уксусная, лимонная и/или фосфорная кислоты и их натриевые соли, и консерванты. Соединения по изобретению могут входить в состав фармацевтических композиций и вводятся млекопитающему-хозяину, такому как человек, в виде различных форм, которые адаптированы для выбранного пути введения, а именно перорального или парентерального, внутривенного, внутримышечного, топического или подкожного введения. Так, указанные соединения могут быть введены системно, например перорально, в комбинации с фармацевтически приемлемым носителем, таким как инертный разбавитель или ассимилирующийся съедобный носитель. Они могут быть заключены в твердую или мягкую желатиновую капсулу, могут быть спрессованы с получением таблеток или могут быть введены непосредственно вместе с пищей, употребляемой пациентом. Для орального терапевтического введения активное соединение может быть соединено с одним или более эксципиентами и использовано в виде проглатываемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Конечно, содержание этого вещества в композициях и в препаратах может меняться и обычно может составлять от примерно 2 до примерно 60 вес.% от данной стандартной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях таково, что достигается уровень эффективной дозы. Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать следующие ингредиенты: связующие, такие как смола трагаканта, смола акации, кукурузный крахмал, желатин; эксципиенты, такие как дикальцийфосфат; дезинтегрирующий агент, такой как кукурузный крахмал, картофельный крахмал,альгиновая кислота и т.п.; смазочный агент, такой как стеарат магния, и подсластитель, такой как сахароза, фруктоза, лактоза или аспартам, или ароматизатор, такой как перечная мята, масло виноградных косточек или вишневый ароматизатор. Когда стандартной лекарственной формой является капсула, она может содержать, в дополнение к веществам указанного выше типа, жидкий носитель, такой как растительное масло или полиэтиленгликоль. Другие различные вещества могут быть в виде покрытий или же могут иным образом модифицировать физическую форму твердой стандартной лекарственной формы. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском, шеллаком или сахаром и т.п. Сироп или эликсир могут содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил- или пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как вещества, придающие вишневый или апельсиновый вкус. Конечно, любой материал, используемый при приготовлении любой стандартной лекарственной формы должен быть фармацевтически приемлемым и практически нетоксичным при введении в применяемых количествах. Кроме того, активное соединение может входить в состав препаратов и устройств с пролонгируемым высвобождением. Активное соединение может также вводиться внутривенно или интраперитонеально путем инфузии или инъекции. Растворы активного соединения или его солей могут быть приготовлены в воде, которая может быть смешана с нетоксичным поверхностно-активным веществом. Можно также готовить дисперсии в глицерине, жидких полиэтиленгликолях, триацетине и их смесях, а также в маслах. При обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов. Фармацевтические лекарственные формы, пригодные для инъекции или инфузии, могут включать стерильные водные растворы или дисперсии или стерильные порошки, содержащие активный ингредиент, которые адаптированы для индивидуального приготовления стерильных растворов или дисперсий дли инфузии или инъекции, которые могут быть заключены в липосомы. Во всех случаях конечные лекарственные формы должны быть стерильными, жидкими и стабильными при условиях изготовления и хранения. Жидкий носитель или наполнитель может быть растворителем или жидкой дисперсионной средой, включающей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, нетоксичные эфиры глицерина и их подходящие смеси. Соответствующую текучесть можно поддерживать, например, путем образования липосом, путем поддержания требуемого размера частиц в случае дисперсий или путем применения поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть достигнуто при помощи различных противобактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросаля и т.п. Во многих случаях предпочтительно включать изотонические агенты,например сахара, буферные агенты или хлорид натрия. Пролонгированную абсорбцию инъецируемых композиций можно получить при применении в композициях агентов, замедляющих абсорбцию, например моностеарата алюминия и желатина. Стерильные растворы для инъекции получают путем введения активного соединения в требуемом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными выше, если это требуется, с последующей фильтрацией в стерильных условиях. В случае стерильных порошков для приготовления стерильных растворов для инъекции предпочтительными методами приготовления являются сушка под вакуумом и сушка при замораживании, которые позволяют получить порошок активного ингредиента с любым дополнительным желаемым ингредиентом, находящимся в предварительно отфильтрованных в стерильных условиях растворах. Для топического введения соединения по изобретению могут быть нанесены в чистом виде, то есть когда они являются жидкими. Однако обычно желательно вводить их в кожу в виде композиций или составов в сочетании с дерматологически приемлемым носителем, который может быть твердым или жидким. Приемлемые твердые носители включают мелкодисперсные твердые вещества, такие как тальк,глина, микрокристаллическая целлюлоза, двуокись кремния, окись алюминия и т.п. Приемлемые жидкие носители включают воду, спирты или гликоли или смеси вода-спирт/гликоль, в которых соединения по изобретению могут быть растворены или диспергированы в эффективных количествах, возможно, при помощи нетоксичных поверхностно-активных веществ. Для оптимизации свойств для данного применения могут быть добавлены адъюванты, такие как отдушки и дополнительные антимикробные агенты. Получаемые жидкие композиции могут быть нанесены из абсорбирующих накладок, использованы для пропитки бинтов и других повязок или распылены на пораженную поверхность с применением распылителей насосного типа или распылителей для аэрозолей. Вместе с жидкими носителями для приготовления намазываемых паст, гелей, мазей, мыла и т.п. и нанесения прямо на кожу пациента можно также применять загустители, такие как синтетические полимеры, жирные кислоты, соли и эфиры жирных кислот, алифатические спирты, модифицированные целлюлозы или модифицированные минеральные вещества. Кроме того, по одному из вариантов данное изобретение предусматривает различные лекарственные составы на основе конъюгатов для доставки путем ингаляции. Например, составы могут быть получены для применения в виде аэрозоля в устройствах, таких как дозированные ингаляторы, ингаляторы с сухими порошками и небулайзеры. Примеры приемлемых дерматологических композиций, которые могут быть применены для доставки соединений по изобретению в кожу, известны из уровня техники; например, см. Jacquet et al. (патент США 46086392), Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman (патент США 4820508). Применяемые дозы соединений по изобретению могут быть определены путем сравнения их in vitro активности и in vivo активности в животных моделях. Методы экстраполяции эффективных доз для мышей и других животных на людей известны из уровня техники; см., например, патент США 4938949. Способность соединения по изобретению действовать в качестве TLR агониста может быть определена при применении фармакологических моделей, которые хорошо известны из уровня техники, включая методы, описанные Lee et al., Proc. Natl. Acad. Sci. USA, 100: 6646 (2003). Обычно концентрация соединения(ий) по изобретению в жидкой композиции, такой как лосьон, составляет примерно 0,1-25 вес.%, предпочтительно примерно 0,5-10 вес.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, обычно равна примерно 0,1-5 вес.%, предпочтительно примерно 0,5-2,5 вес.%. Для достижения пиковых концентраций активного соединения в плазме активное вещество может быть введено в количестве от примерно 0,5 до примерно 75 мкМ, предпочтительно примерно 1-50 мкМ,наиболее предпочтительно от примерно 2 до примерно 30 мкМ. Этого можно достичь, например, путем внутривенной инъекции 0,05-5%-ного раствора активного ингредиента, возможно в физиологическом растворе или путем орального введения в виде болюса, содержащего примерно 1-100 мг активного вещества. Желательные уровни в крови можно поддерживать путем непрерывной инфузии для обеспечения примерно 0,01-5,9 мг/кг/ч или путем чередующихся инфузий с дозой 0,4-15 мг активного ингредиента(ов) на 1 кг. Количество соединения, его соли или производного, требующееся для применения при лечении,будет меняться не только в зависимости от вида выбранной соли, но и от пути введения, природы состояния больного, возраста и состояния пациента и в конечном счете определяется лечащим врачом или клиницистом. В общем, однако, подходящая доза находится в интервале от примерно 0,5 до примерно 100 мг/кг, например от примерно 10 до примерно 75 мг/кг веса в день, например от 3 до примерно 50 мг на 1 кг веса пациента в день, предпочтительно в интервале 6-90 мг/кг/день, наиболее предпочтительно в интервале 15-60 мг/ кг/ день. Соединение обычно вводят в виде стандартной лекарственной формы, например, содержащей 51000 мг, обычно 10-750 мг, наиболее часто 50-500 мг активного ингредиента на эту стандартную форму. Желательная доза может вводиться в виде одной дозы или в виде разделенных доз, вводимых с соответствующими интервалами, например в виде двух, трех, четырех или более поддоз в день. Сама поддоза может быть также разделена, например, на какое-то количество дискретных доз для введения; например, ряд ингаляций из порошковдувателя или какого-то количества капель, вводимых в глаз. Доза и,вероятно, частота введения доз будут также меняться в соответствии с возрастом, весом, состоянием и реакцией индивидуального пациента. В общем, общая дневная доза соединения или соединений формулы (I) для состояний, описанных в данной заявке, может быть равна от примерно 50 до примерно 5000 мг, она вводится как одна доза или в виде разделенных доз. Предпочтительно, чтобы величина дневной дозы составляла от примерно 100 до примерно 4000 мг, наиболее предпочтительно примерно 1000-3000 мг, в виде одной дозы или в виде разделенных доз, например, вводится 750 мг соединения перорально каждые 6 ч. Это позволит достигнуть содержание в плазме, равное примерно 500-750 мкМ, что может быть эффективным для гибели раковых клеток. При лечении пациента терапию следует начинать с более низких доз и увеличивать их в зависимости от общей реакции пациента. Как описано выше, композиции, которые содержат соединение по изобретению, пригодны для лечения или профилактики болезни или расстройства, например, у людей или других млекопитающих (например, рогатого скота, лошадей, собак, кошек, овец и свиней), а также, возможно, и других животных. В зависимости от конкретного соединения композиция, например, будет пригодна для лечения рака, инфекции, повышения адаптивного иммунитета (например, продуцирования антител, активации Е-клеток и т.д.), для получения вакцин и/или стимуляции центральной нервной системы. Далее данное изобретение будет описано в следующих неограничивающих примерах. Пример 1. Способы получения соединений формулы (I) приведены в качестве дальнейших вариантов изобретения и проиллюстрированы следующими методиками, в которых общие радикалы имеют значения, указанные выше, если не указано иное. Общая химия. Реагенты и растворители приобретали в Aldrich, Milwaukee, WI. Нескорректированные точки плавления определяли в приборе для определения температуры плавления в капилляре Laboratory Device Mel-Temp II. Спектры протонного ядерного магнитного резонанса записывали на спектрофотометре Varian Unity 500 NMR при частоте 499,8 МГц или на спектрофотометре Varian Mercury NMR при частоте 400,06 МГц. Химические сдвиги указаны в м.д. на шкале от указанного стандарта. Масс-спектры в случае положительных и отрицательных ионов снимали в Department of ChemistryUCSD, San Diego, CA. Элементный анализ проводили в NuMega Resonance Labs, San Diego, CA. Хроматографию на колонке осуществляли с силикагелем Е Merck (230-400 меш) с указанной системой растворителей. Аналитическую тонкослойную хроматографию (TLC) проводили на пластинах силикагеля 60F254 (ЕМ Reagents). Получение 4-(2,6-дихлорпурин-9-илметил)бензонитрила. 2,6-дихлор-9 Н-пурин (16 ммоль) растворяли в DMF (50 мл) и добавляли карбонат калия (50 ммоль). Затем добавляли -бром-п-толуиленнитрил (22 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. После фильтрования с целью удаления нерастворимых неорганических солей фильтрат выливали в воду (1500 мл) и обрабатывали этилацетатом (2400 мл), сушили над сульфатом магния и выпаривали, получая остаток, который подвергали флэш-хроматографии на силикагеле, применяя смесь 1:2:10 этилацетат/ацетон/гексаны. Выход составил 3,33 г (69%). УФ, ЯМР и MS подтвердили получение целевого соединения. Получение 4-(6-амино-2-хлорпурин-9-илметил)бензонитрила. Полученный, как указано выше, продукт (1,9 г) помещали в стальной реакционный сосуд и добавляли метанольный раствор аммиака (80 мл, 7 N) Герметизированный сосуд нагревали при температуре 60 С в течение 12 ч, охлаждали на льду и отфильтровывали твердый продукт. Выход был равен 1,09. УФ,ЯМР и МС подтвердили получение целевого продукта. Получение 4-[6-амино-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрила. Путем растворения металлического натрия (81 мг) в 2-метоксиэтаноле (30 мл) при нагревании получали 2-метоксиэтанолат натрия. К этому раствору добавляли продукт из примера 2 (1,0 г), растворенный в метоксиэтаноле (300 мл, при нагревании). Реакционную смесь нагревали в течение 8 ч при температуре бани, равной 115 С, концентрировали под вакуумом почти досуха и распределяли между этилацетатом и водой. Флэш-хроматография органического слоя с применением 5% метанола в дихлорметане привела к получению 763 мг целевого продукта. ЯМР подтвердила получение этого соединения. Получение 4-[6-амино-8-бром-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрила. Продукт, полученный выше (700 мг), растворяли в дихлорметане (400 мл) и по каплям добавляли бром (7 мл). Смесь перемешивали в течение ночи при комнатной температуре и обрабатывали водным раствором тиосульфата натрия (2 л, 0,1 М) и затем водным раствором бикарбоната натрия (500 мл, насыщ.). Остаток от органического слоя подвергали хроматографии на силикагеле (применяя 3% метанола в дихлорметане), с получением 460 мг бромсодержащего продукта. ЯМР, УФ и МС подтвердили получение целевого продукта. Получение 4-[6-амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрила. Метоксид натрия получали по реакции металлического натрия (81 мг) в сухом метаноле (30 мл). Продукт, полученный выше (700 мг), растворяли в сухом диметоксиэтане и повышали температуру до 100 С. После проведения реакции в течение ночи смесь концентрировали под вакуумом и полученный остаток подвергали хроматографии на силикагеле, применяя 5% метанола в дихлорметане. Выход полученного продукта был равен 120 мг. ЯМР подтвердил получение целевого продукта. Получение N,N'-(диметилэтилендиамино)алюминийгидрида лития. Этот восстановитель применяли для превращения нитрильной группы в альдегидную, его получали в основном как описано в Bull. Korean Chem. Soc., 23: 1697 (2002). Готовили 0,5 раствор в сухом THF. Получение 4-[6-амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензальдегида. 4-[6-Амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрил (100 мг) растворяли в сухом ТГФ (3 мл) и охлаждали до 0 С в атмосфере аргона. Гидрид алюминия, полученный выше (0,72 мл),добавляли в реакционную колбу и перемешивали смесь при температуре 0-5 С в течение 1 ч и затем обрывали реакцию при помощи 3 М HCl. Затем смесь обрабатывали этилацетатом и затем дихлорметаном и концентрировали под вакуумом, получая 85 мг. ЯМР подтвердил получение целевого продукта. Получение 4-[6-амино-8-гидрокси-2-(2-метоксиэтокси)пурин-9-илметил]бензальдегида (UC-1V150). Продукт, полученный выше (800 мг), соединяли с иодидом натрия (504 мг) и ацетонитрилом (40 мл) и затем медленно добавляли хлортриметилсилан (0,5 мл). Смесь нагревали при температуре 70 С в течение 3,5 ч, охлаждали и фильтровали. Твердый продукт промывали водой, затем простым эфиром с получением 406 мг соединения. ЯМР, УФ и MS подтвердили строение целевого продукта. Это соединение подходило для реакций сопряжения между линкерами и макромолекулами. Получение метил-4-[6-амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил)бензоата. Методика, применяемая в этом примере, описана Jayachitra et al., Synth. Comm., 33: 3461 (2003). 4[6-амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензонитрил (1 ммоль) растворяли в сухом метаноле (5 мл) и к этому раствору добавляли свежеотогнанный эфират BF3 (4 ммоль). Полученную смесь нагревали с обратным холодильником в атмосфере аргона в течение 20 ч. Растворитель удаляли под вакуумом и остаток отбирали дихлорметаном (10 мл), экстрагировали разбавленным водным раствором бикарбоната натрия (210 мл) и высушивали органический слой над сульфатом магния. После выпаривания продукт очищали методом колоночной хроматографии на силикагеле, применяя 5% метанола в дихлорметане, получали 0,8 ммоль продукта. Получение 4-[6-амино-8-гидрокси-2-(2-метоксиэтокси)пурин-9-илметил]бензойной кислоты. 4-[6 Амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензоат (100 мг) соединяли с иодидом натрия (63 мг) и ацетонитрилом (10 мл) и затем медленно добавляют хлортриметилсилан (120 мл). Смесь нагревали при 70 С в течение 6 ч, охлаждали и отфильтровывали. Твердый продукт промывали водой и затем простым эфиром, получая 51 мг. Получение 2,5-диоксопирролидин-1-ил-4-[6-амино-8-гидрокси-2-(2-метоксиэтокси)пурин-9 илметил]бензоата. 4-[6-Амино-8-метокси-2-(2-метоксиэтокси)пурин-9-илметил]бензоат (2 ммоль) растворяли в дихлорметане или диоксане (10 мл) и добавляли EDC (2 ммоль). К этому раствору добавляли Nгидроксисукцинимид (2 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь высушивали досуха под вакуумом и сырой продукт очищали методом хроматографии на силикагеле с получением 2 ммоль продукта, который можно применять для реакций сопряжения с участием первичных аминов. Пример II. Соединение UC-1V150 ковалентно соединяли с линкером MSA, модифицированным сукцинимидил-6-гидразиноникотинамида ацетонгидразона (SANH), с получением стабильной молекулы с измененным УФ-спектром. Конъюгат UC-1V150/MSA идентифицировали по пику УФ-абсорбции при длине волны 342 нм, обусловленному образованием гидразона, адсорбция самого SANH имела место при длине волны 322 нм. Количественный выход конъюгата UC-1V150/MSA экстраполировали из стандартной кривой UC-1V150-SANH (фиг. 1). Конъюгаты UC-1V150/MSA получали при отношении около 5:1. Биологические исследования, описанные в данной заявке, проводили при отношении 5:1 UC-1V150/MSA. Модификация MSA при помощи SANH. 200 мкл MSA (25 мг/мл) смешивали с 100 мкл буфера сопряжения (1 М NaPi, рН 7,2) и 690 мклPBS. 844 мкг SANH в 10 мкл DFM (40-мольный избыток по отношению к MSA) добавляли к раствору белка (конечная концентрация MSA в реакционной смеси составляла 5 мг/мл). После аккуратного перемешивания реакцию продолжали при комнатной температуре в течение 2 ч. Для удаления избытка SANH реакционную смесь загружали в колонку NAP-10, уравновешенную PBS, и элюировали модифицированный MSA при помощи 1,5 мл PBS. Присоединение 1V150 к MSA, модифицированному SANH. 460 мкг 1V150, растворенного в 10 мкл DMF, добавляли к MSA, модифицированному SANH, и реакционную смесь инкубировали при комнатной температуре в течение ночи. Для удаления избытка 1V150 реакционную смесь вначале концентрировали до объема, равного 1 мл, применяя колонку Microspin (Millipore: BIOMAX 5K), и загружали в колонку NAP-10, как описано выше.TLR7 агонисты соединяли также с олигодезоксинуклеотидами (ODNs) (фиг. 20, 21), вирусом (фиг. 18, 19) и с липидным компонентом, который затем может быть введен в липосому (фиг. 24, 25). Синтез пространственно стабилизированного TLR7 агониста. Каждый конъюгат получают по стандартным методикам, хорошо известным в химии биосопряжения. Характеризация каждого конъюгата количественными УФ, LC/MS и PAGE методами позволяет определить "валентность" или отношение TLR агониста к его вспомогательной группе (макромолекуле). Имея эту информацию, легко определить размер и форму конъюгатов путем применения методов моделирования. Разнообразие размеров, формы и валентности конъюгатов обеспечивается путем выбора макромолекулы, обозначенной в структурной формуле как R3. Например, когда R3 обозначает дендример,такой как обычные поли(амидоамины), количество поверхностных функциональных групп для присоединения TLR агониста, определяется точно на основе количества точек разветвления или генераций этого конкретного дендримера. Первая генерация (G1) имеет 8 поверхностных аминогрупп, G2 имеет 16 и т.д., это приводит к возможности контроля валентности и размера конъюгатов (см. фиг. 2). Кроме того,некоторые наночастицы дендримера могут содержать и таргетирующий лиганд, и TLR7 агонист. Конъю- 26019151 гаты TLR7 агонист-липид могут также иметь разнообразные "валентности" в зависимости от выбора липидов. Например, активный конъюгат UV-1V199/L (фиг. 6) получали путем сопряжения карбоксильного производного TLR7 агониста (UC-1V199) с этаноламинной группой коммерчески доступного диолеоилфосфатидилэтаноламина (DOPE). Эти липидные конъюгаты включают в различные липосомные наночастицы, имеющие гидродинамический диаметр, равный примерно 100 нм (фиг. 24, 25). Гексагоны на чертежах представляют UC1V199/L и связанный TLR7 агонист с фосфолипидными хвостами.TLR7 агонисты и димеры, а также TLR конъюгаты имеют, как это было показано, цитокинвысвобождающую и/или цитокиновую активность in vivo по данным проведенных анализов, таких как описанные в данной заявке. Например, имиквимод, бропиримин, UC-1V138, UC-1V136, UC-1V150, UC1X105, UC-1V199, UC-1W236, UC-1X51, UC-1W247, UC-1X113, UC-1V199/L, UC-1V150/BSA, конъюгаты UC-1V150 с линкером или без него и с MSA, OVA, вирионами и/или ODN, конъюгаты UC-1V199 иDOPE, двуокисью кремния, липидом или облученными спорами, и конъюгаты UC-1V1043 и UC-1V1018 с OVA все имеют активность. Пример III. Материалы и методы. Оценка соединения in vitro. Способность TLR7 конъюгатов к стимуляции и/или ингибированию продуцирования цитокинов оценивалась с применением мононуклеарных клеток, полученных из костного мозга мышей (BMDM),которые в высокой степени обогащены дендритными клетками, а также с применением мононуклеарных клеток периферической крови человека (РВМС). BMDM помещали в лунки 96-луночного планшета и обрабатывали (по 3 раза) носителем или различными дозами соединений, начиная от 10 мкМ, разбавленными с трехразовыми инкрементами до пикомольных концентраций. Через 24 ч собирали надосадочные жидкости и анализировали, определяя до 30 различных цитокинов, хемокинов и других медиаторов,применяя систему Luminex и коммерчески доступные реагенты. ELISA данные о цитокинах/хемокинах дополняли количественным измерением экспрессии мРНК и двухмерными определениями фосфопротеина, чтобы можно было изучить объем и механизм индукции переносимости. В момент сбора надосадочной жидкости средства помещали в лунки с МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид), что дало возможность колориметрически оценить выживаемость клеток. Человеческие РВМС выделяли из коммерческой крови и обрабатывали подобным образом. Для оценки трафика нанолипосом и дендромеров, сопряженных с TLR агонистом, соответствующие наночастицы нагружают или модифицируют флуорохромом. Подклеточная локализация определяется микроскопически, в некоторых случаях в клетках, которые были обработаны ингибиторами созревания эндосом. Для сравнения противовоспалительной активности TLR конъюгатов с различными вспомогательными группами BMDM вначале обрабатывали наиболее активными соединениями при предварительно определенных концентрациях, которые обеспечивали минимальное действие на стимуляцию воспалительных цитокинов (TNF, IL-1). Через 24 ч среду заменяли и обрабатывали клетки активирующими лигандами различных членов семейства TLR (Pam3Cys для TLR2, poly (I:С) для TLR3, LPS (липополисахарид) для TLR4, флагеллин для TLR5, Malp-2 для TLR6, UC-1V150 для TLR7, R848 для TLR7/8, CpG олигонуклеотиды для TLR9 и т.п.) при концентрациях, которые эффективно вызывают продуцирование цитокинов в суррогатно-обработанных клетках. Клетки оценивали методами мультиплексного иммуноанализа, количественной PCR и блоттинга фосфопротеина. Для лучшего понимания кинетики индуцирования и поддержания переносимости клетки, примированные TLR-конъюгатом, также стимулировали в различные интервалы времени и анализировали на механизм продуцирования цитокинов.In vivo оценка соединения. Оценивали продуцирование бронхоальвеолярной промывной жидкости (BALF) в зависимости от наличия системных цитокинов после введения в дыхательные пути мышей. Анестезированным самкам мышей C57BL/6, подобранным по возрасту, интраназально (i.n.), орально (р.о.) или внутривенно (i.v.) вводили различные количества TLR7 конъюгатов, описанных выше, с липосомами или с дендримерами в подходящих носителях. После выделения и в различные моменты времени отбирали сыворотку и BALF и анализировали их на наличие цитокинов и хемокинов, применяя метод анализа Luminex. Записывали вес, температуру и величину поглощения жидкости у подвергнутых воздействию животных как клинический суррогат системного "цитокинового синдрома". Дальнейшие эксперименты оценивали способность различных агентов к продуцированию локальной и системной рефракторности (TLR переносимость) к активации TLR после введения высоких дозi.n., р.о. или i.v., как определено цитокинами сыворотки и BALF. Высокие дозы различных конъюгатовTLR7, которые не индуцируют значительное количество цитокинов in vivo и не приводят к появлению клинических признаков цитокинового синдрома, отбирались. Мышам вводили выбранные высокие дозы различными методами введения и затем стимулировали их активаторами различных TLRs в различные моменты времени. Отбирали сыворотку и BALF, анализировали и фиксировали клинические симптомы. Противовоспалительная активность конъюгатов подтверждалась в модели летального шока, ранее ис- 27019151 пользованной для изучения LPS и CpG. В этой модели мыши Balb/c, которым ранее вводили путем внутривенной i.p. инъекции D-галактозамин, погибали после системного стимулирования различными TLR активаторами вследствие стимуляции цитокинов и поражения печени. Активные противовоспалительные лекарства не индуцируют клинические симптомы у сенсибилизированных животных, а также предотвращают шок, вызванный другими TLR лигандами. До определенной степени эта модель особенно полезна для определения кинетики и продолжительности TLR переносимости (толерантности). Пример IV. Материалы и методы. Мыши. Самки мышей C57BL/6 (возраст 5-6 недель) были получены в Harlan West Coast (Germantown, CA),а самки мышей A/J (возраст 6-8 недель) были куплены в The Jackson Laboratories (Bar Harbor, ME). Мышей A/J использовали для инфицирования штаммом Sterne В. anthracis (Kenney et al., J. Infect. Dis., 190: 774 (2004. Мыши были выведены и выдерживались в стандартных условиях в университете The University of California at San Diego Animal Facility, который аккредитован The American Association for Accreditation of Laboratory Animal Care. Все протоколы получили предварительное одобрение в Institutional Review Voard. При изучении гриппа H1N1 самок мышей BALB/c (16-18 г) получали из Charles River Laboratories (Wilmington, MA) и выдерживали в The Americal Association for Accreditation of Laboratory AnimalBMDM выделяли из различных штаммов мышей и высевали в 96-луночные планшеты с плотностью 5104 кл/лунку. Соединения добавляли к 10-дневным культурам при конечной концентрации, равной от 0,01 до 10 мкМ, или как указано иначе. После 24 ч инкубации собирали надосадочные жидкости и определяли индукцию цитокинов при помощи или ELISA (BD Pharmingen, San Diego, СА), или мультиплексного анализа Luminex (Austin, TX) с применением набора Beadlyte Mouse MultiCytokine (Upstate,Charlottesville, VA и eBiosciences, San Diego, CA) в соответствии с инструкциями производителя. Введение соединений мышам. Самкам подобранных по возрасту мышей C57BL/6 вводили инъекцией в хвостовую вену 100 мкл физиологического раствора, содержащего UC-1V150 или UC-1V150/MSA, при этом каждый раствор содержал эквивалент 0,38-8 нмоль фармакора. Для внутрилегочного введения мышей анестезировали i.p. раствором Avertin и выбривали область шеи. Трахеи обнажали путем небольшого надреза и инъецировали мышам 50 мкл физиологического раствора, содержащего различные количества UC-1V150/MSA или несопряженного лекарства. После того как мыши пришли в себя, в различные моменты времени собирали сыворотку и BALF и анализировали на наличие IL-6, IL-12p40, IFN-, RANTES и МСР-1 методом анализа Luminex. В других опытах мышей анестезировали при помощи внутримышечной инъекции раствора кетамина в ксилоле и вводили им то же самое количество UC-1V150/MSA i.t. в дозе 50 мкл или i.n. в дозе 20 мкл. Поскольку через 24 ч после введения любым методом наблюдались одинаковые уровни цитокинов для изучения модели, инфекции выбирали более удобный интраназальный (i.n.) путь. Инфицирование мышей A/J спорами В. anthracis. Споры были приготовлены из штамма Sterne В. anthracis (рХ 01+ рХ 02-), как описано ранее (Sabet etal., FEMS Immunol. Med. Microbiol., 47: 369 (2006); Guidi-Rontani et al., Mol. Microbiol., 42: 931 (2001. Очищенные споры хранили в PBS при 4 С при концентрации 1108-4108 КОЕ/мл. Перед инъекцией споры нагревали до 65 С в течение 30 мин для инициирования всхожести (зарождения). Мышей A/J анестезировали внутримышечно вводимым раствором кетамина в ксилоле и вводили каждой мыши i.n. 0,75 нмоль UC-1V150 или UC-1V150/MSA за 1 день до инфицирования anthrax. Контрольные мыши получали только физиологический раствор или физиологический раствор, содержащий MSA, в эквивалентных количествах по отношению к UC-1V150/MSA. Инфицирование проводили i.n. 2105-8105 спорами В. anthracis в 20 мкл. Наблюдали за выживаемостью в течение 13 дней, так как большинство мышей, которым вводили физиологический раствор, погибали в течение 3-6 дней. Результаты получали для групп, состоящих из 8 мышей. Инфицирование мышей Balb/c вирусом гриппа. Вирус гриппа A/New Caledonia/20/99 (H1N1) получали из Centers for Disease Control and Prevention(Atlanta, GA). Размножение вируса проводили дважды в клетках почки собак Madin Darby (MDCK), затем осуществляли пассажи 7 раз в мышах для получения вирулентного вируса и затем другой пассаж в клеточной культуре с целью его амплификации. Мышей анестезировали i.p. кетамином (100 мг/кг) и инфицировали i.n. вирусом при инфицирующих дозах клеточной культуры примерно 105.0 каждой мыши в 50 мкл инокулята. До введения вируса каждой мыши вводили одну интраназальную дозу, равную 75 мкл,или в физиологическом растворе или в этом растворе, содержащем UC-1V150/MSA до 5 нмоль. Затем в течение 21 дня наблюдали за выживаемостью десяти инфицированных мышей в группе и двадцати контрольных мышей. Статистика. Уровень цитокинов сравнивали, применяя U-критерий Манна-Уитни с р 0,05 для определения ста- 28019151 тистической значимости. Получали кривые выживаемости Каплана-Майера и проводили тесты функций выживания (log rank tests), используя 4 версию программы GraphPad Prism (San Diego, CA) для сравнения разницы в выживаемости. Результаты. Активное in vitro и in vivo высвобождение цитокинов в ответ на действие конъюгатов UC1V150/MSA. Инкубирование макрофагов костного мозга (BMDM) с одним UC-1V150 стимулировало высвобождение цитокинов (фиг. 10). В случае конъюгата с MSA были обнаружены похожие или более высокие уровни цитокинов при меньшей (в 10 раз) эквивалентной концентрации TLR7 агониста. Опыты с трансформантами TLR, проведенные, как описано выше, подтвердили, что UC-1V150, подобно соединению, у которого отсутствует альдегидная группа (UC-1V136), является специфичным TLR7 агонистом(Lee et al., Proc. Natl. Acad. Sci. USA, 103: 1828 (2006. После i.v. введения мышкам UC-1V150 приводил к уровню цитокинов, который, достигая максимума примерно через 2 ч после инъекции, затем быстро уменьшался почти до первоначального значения (данные не приведены). Сравнение профилей продуцирования при помощи UC-1V150 цитокинов по сравнению с UC-1V150/MSA через 2 ч после i.v. инъекции при различных дозах показало, что конъюгат с MSA увеличивал активность в 10-100 раз (фиг. 11). Сыворотка из физиологического раствора или от мышей, получивших MSA, содержала небольшое количество цитокинов или вообще незначительное их количество (данные не приведены). Конъюгаты UC-1V150/MSA обеспечивают пролонгированную и локализованную легочную активность. Для обеспечения адекватной доставки TLR7 агонистов в дыхательную систему лекарства вначале вводили непосредственно в трахеи. Значительная индукция цитокинов была обнаружена в бронхиальной альвеолярной промывной жидкости (BALF), экстрагированной у мышей, которым проводили интратрахеальное (i.t.) введение UC-1V150/MSA, в то время как уровень цитокинов в сыворотке был очень низким и составляя почти фоновое значение у тех же самых животных (фиг. 12). В противоположность этому похожие величины содержания цитокина были выявлены и в BALF, и в сыворотке крови у мышей,которым вводили путем инъекции TLR7 агонисты с малыми молекулами, что иногда приводило к поведенческим изменениям, таким как "вставание шерсти дыбом" и дрожь, что предполагает наличие цитокинового синдрома (табл. 2). Последующие исследования с UC-1V150 показали, что интраназальная (i.n.) доставка также индуцировала селективное продуцирование цитокинов в BALF, вероятно, вследствие аспирации лекарства. Соответственно i.n. введение использовали для оценки конъюгатов UC-1V150 в двух моделях инфицирования пневмонии у животных. Мыши, которым предварительно i.n. вводили UC1V150/MSA за день до инфицирования спорами В. anthracis, выживали 7,5 дней по сравнению с контрольными мышами, которые жили в течение 5 дней (Р 0,025) (фиг. 14 А). В противоположность этому не было значительной разницы между мышами, которым вводили или физиологический раствор, в количестве эквивалентном количеству MSA, или только UC-1V150. Эти данные подтвердили, что конъюгатUC-1V150, но не свободная форма лекарства, обладал внутрилегочным иммунотерапевтическим действием. Таким образом, сопряжение TLR7 агониста с MSA усиливало его активность и снижало его токсичность после локальной доставки в дыхательные пути. В другом опыте мышам BALB/c предварительно i.n. вводили конъюгат UC-1V150/MSA за 1 день до инфицирования вирусом гриппа (штамм H1N1). Средняя продолжительность выживания этих мышей увеличилась до 11,5 дней по сравнению с 7 дней у контрольных мышей (Р 0,0001) (фиг. 14 В). Вместе эти результаты позволяют предположить, что сопряжение TLR7 агониста с MSA увеличивает его активность и уменьшает его токсичность после локальной доставки в дыхательный тракт.UC-1V150/MSA вводили i.n. до инфицирования anthrax и затем вводили ципрофлоксацин (25 мг/кг) на день 4. Введение плацебо с последующим введением ципрофлоксацина обеспечило 15-25%-ную выживаемость, в то время как лечение конъюгатом и ципрофлоксацином обеспечило 90%-ную выживаемость. Таким образом, конъюгат особенно полезен как коадъювант с вакциной против anthrax. Обсуждение. Соединение UC-1V150 является одним из самых активных и многосторонних синтетических TLR7 лигандов с малыми молекулами, который создан потому, что (i) он является активным в наномолярных концентрациях; (ii) он может соединяться с различными макромолекулами с повышением активности в некоторых случаях и (iii) его фармакокинетические свойства могут быть изменены путем модификации вспомогательных групп. Конъюгат TLR7-белок, UC-1V150/MSA, был охарактеризован как имеющий примерно пять малых молекул, ковалентно связанных с каждой молекулой MSA. Конъюгат сохранил активность TLR7 агониста и действительно является более активным и имеет большую продолжительность действия по сравнению со свободной формой мономерного лекарства. Более того, этот конъюгат может быть эффективно доставлен в дыхательные пути методом i.n. или i.t. введения. Доставка лекарства интраназальным (i.n.) путем оказалась эффективной в мышиной модели бактериальной инфекции. Что касается доставки в дыхательные пути, то потенциально важное преимущество приготовления TLR7 агонистов в виде конъюгатов макромолекул состоит в том, что при этом можно избежать возникновения системных побочных эффектов за счет ограничения иммуностимуляторной активности в локальной среде (слизистая оболочка). Следует ожидать, что макромолекулярный конъюгат будет абсорбироваться системной циркуляци- 29
МПК / Метки
МПК: A61K 31/4745, A61K 39/39, A61P 11/06, A61K 39/085
Метки: конъюгаты, агонистов, синтетических, применение
Код ссылки
<a href="https://eas.patents.su/30-19151-konyugaty-sinteticheskih-agonistov-tlr-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты синтетических агонистов tlr и их применение</a>
Предыдущий патент: Гранулы нитрата аммония
Следующий патент: Батарея и энергосистема
Случайный патент: Способ и установка для производства минеральной листовой фибры


































