Ингибиторы серин-протеаз, в частности ns3 протеазы вируса гепатита c (hvc)
Номер патента: 1915
Опубликовано: 22.10.2001
Авторы: Фармер Люк Дж., Танг Роджер Д., Мурко Марк А., Харбесон Скотт Л., Бхисетти Говинда Рао, Дейнинджер Дэвид Д
Формула / Реферат
1. Соединение структурной формулы (II)
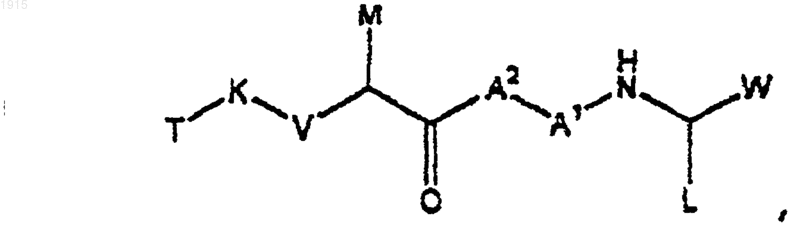
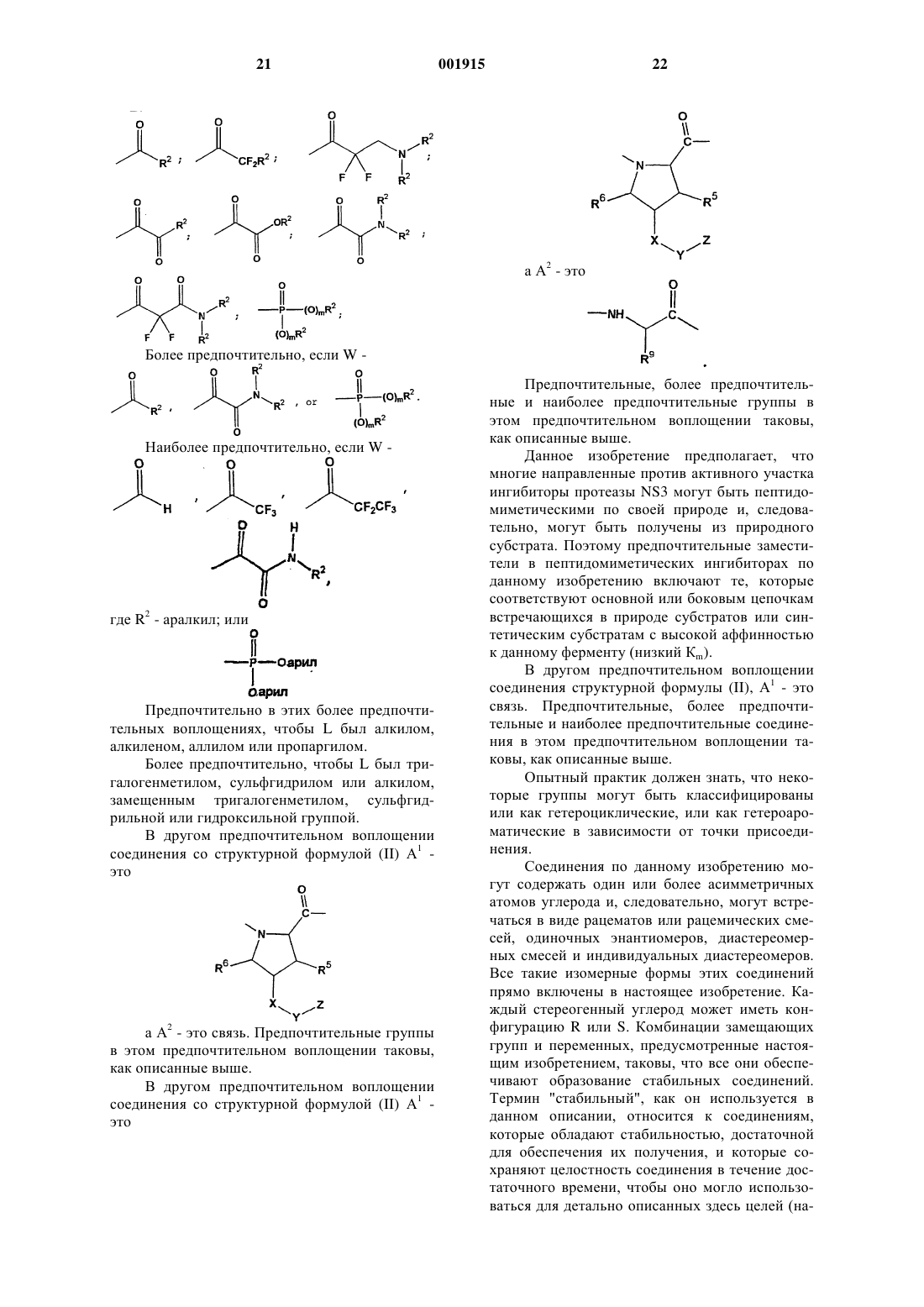
где W является
m равно 0 или 1;
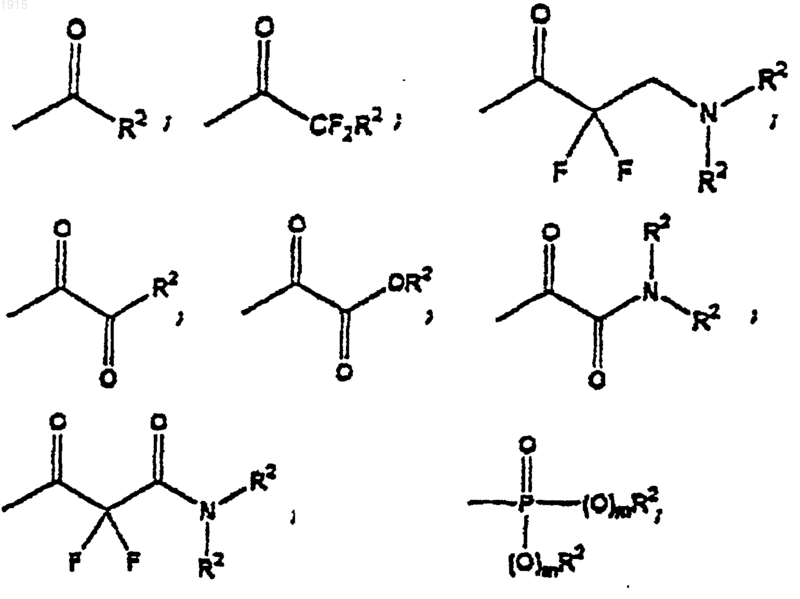
каждый R2 представляет собой независимо водород, алкил, алкенил, арил, аралкил, аралкенил, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, гетероциклилалкенил, гетероарил или гетероаралкил,
или две R2 группы, которые связаны с одним и тем же атомом азота, образуют вместе с этим атомом азота 5-7-членную моноциклическую гетероциклическую кольцевую систему; где любой атом углерода из R2 необязательно замещен J;
J представляет собой алкил, арил, аралкил, алкокси, арилокси, аралкокси, циклоалкил, циклоалкокси, гетероциклил, гетероциклилокси, гетероциклилалкил, кето-, гидрокси-, амино-, алкиламино, алканоиламино-, ароиламино-, аралканоиламино-, карбокси-, карбоксиалкил-, карбоксиамидоалкил-, галоген, циано-, нитро-, формил, ацил, сульфонил или сульфонамидогруппу, необязательно замещенные 1-3 J1 группами;
J1 представляет собой алкильную, арильную, аралкильную, алкокси-, арилокси-, гетероциклильную, гетероциклилокси-, кето-, гидрокси-, амино-, алканоиламино-, ароиламино-, карбокси-, карбоксиалкильную, карбоксиамидоалкильную, галоген, циано-, нитро-, формильную, сульфонильную или сульфонамидную группу;
L представляет собой алкил, алкенил или алкинил, где любой водород необязательно замещен галогеном и где любой атом водорода или галогена, связанный с любым терминальным атомом углерода, необязательно замещенный сульфгидрилом или гидроксилом;
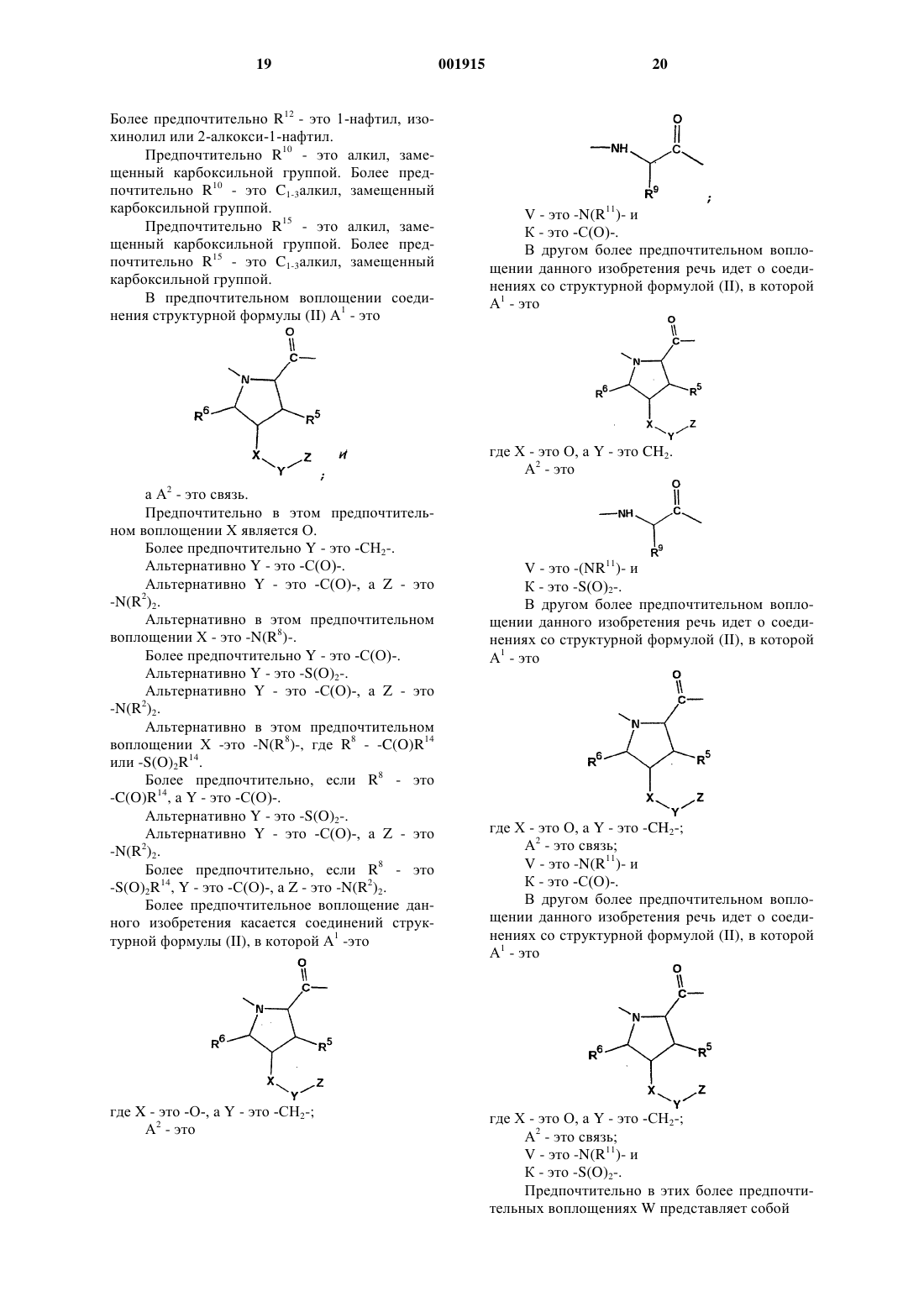
А1 является связью
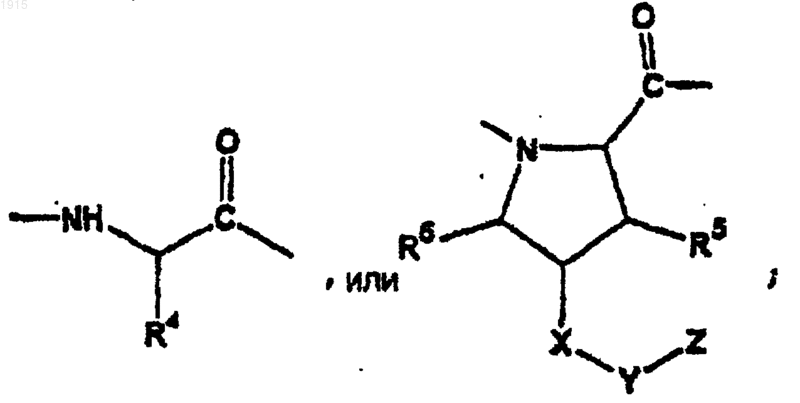
R4 представляет собой алкил, циклоалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, карбоксиалкил или карбоксамидоалкил, необязательно замещенный 1-3 J группами;
R5 и R6 независимо представляют собой водород, алкил, алкенил, арил, аралкил, аралкенил, циклоалкил, циклоалкилалкил, циклоалкенил, гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил, необязательно замещенные 1-3 J группами;
Х является связью, -С(Н)(R7)-, -О-, -S- или -N(R8)-;
R7 представляет собой водород, алкил, алкенил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил, необязательно замещенный 1-3 J группами;
R8 представляет собой водород, алкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, аралканоил, гетероцикланоил, гетероаралканоил, -C(O)R14, -SO2R14 или карбоксамидо и необязательно замещен 1-3 J группами; или R8 и Z вместе с атомами, с которыми они связаны, образуют содержащую азот моно- или бициклическую кольцевую систему, необязательно замещенную 1-3 J группами;
R14 представляет собой алкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил;
Y является связью, -СН2-, С(О)-, С(О)С(О)-, -S(О)-, S(O)2- или S(О)(NR7)-, где R7 такой, как определено выше;
Z представляет собой алкил, арил, аралкил, циклоалкил, циклоалкилалкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, -OR2 или -N(R2)2, где любой атом углерода необязательно замещен J, где R2 такой, как определено выше;
А2 является связью или
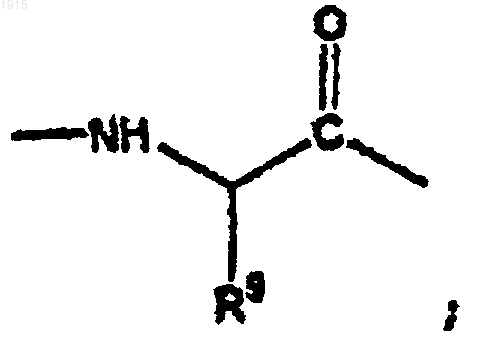
R9 представляет собой алкил, циклоалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, карбоксиалкил или карбоксамидоалкил и необязательно замещен 1-3 J группами;
М представляет собой алкил, циклоалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил, необязательно замещен 1-3 J группами, где любой алкильный атом углерода может быть замещен гетероатомом;
V является связью, -СН2-, -С(Н)(R11)-, -О-, -S- или -N(R11)-;
R11 представляет собой водород или C1-3алкил;
K является связью, -О-, -S-, -C(O)-, -S(O)-, -S(O)2- или -S(O)(NR11)-, где R11 такой, как определено выше;
Т представляет собой -R12, -алкил-R12, -алкенил-R12, -алкинил-R12, -OR12, -N(R12)2, C(O)R12, -С(=NОалкил) R12 или

R12 представляет собой водород, арил, гетероарил, циклоалкил, гетероциклил, циклоалкилиденил или гетероциклоалкилиденил, необязательно замещенный 1-3 J группами, или первый R12 и второй R12 вместе с азотом, с которым они связаны, образуют моно- или бициклическую кольцевую систему, необязательно замещенную 1-3 J группами;
R10 представляет собой алкил, циклоалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, карбоксиалкил или карбоксамидоалкил и необязательно замещен 1-3 J группами;
R15 представляет собой алкил, циклоалкил, арил, аралкил, гетероциклил, гетероциклилалкил, гетероарил, гетероаралкил, карбоксиалкил или карбоксамидоалкил и необязательно замещен 1-3 J группами; и
R16 представляет собой водород, алкил, арил, гетероарил, циклоалкил или гетероциклил, при условии, что когда
L является алкилом и
W представляет собой
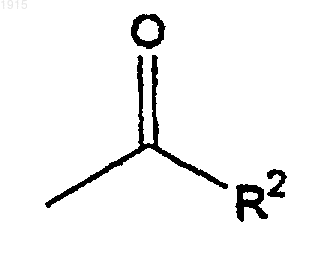
где R2 является водородом, метилом или этилом,
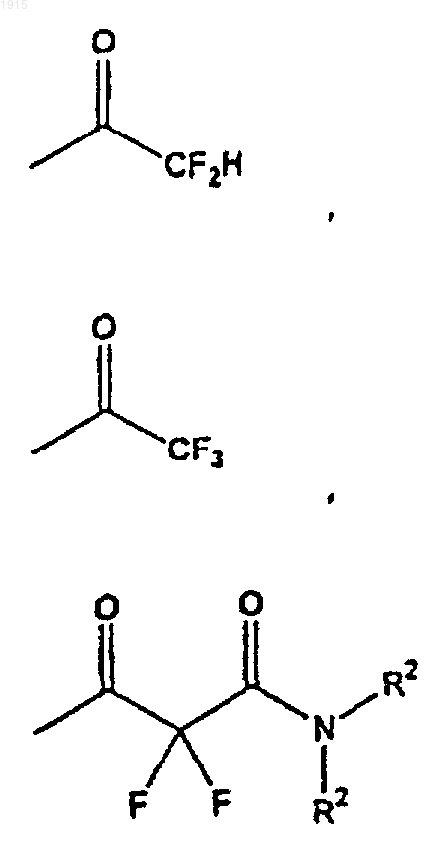
где один R2 является водородом, а другой R2 является водородом, алкилом, фенилом, циклогексилом, циклогексилметилом или бензилом, или
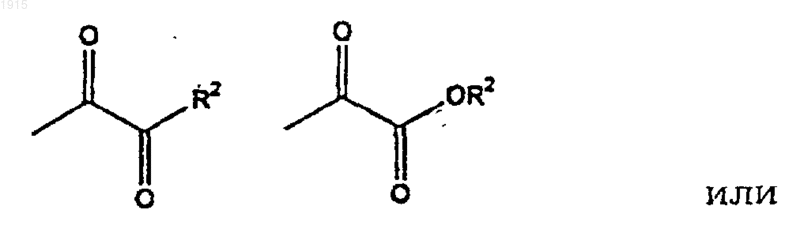
где R2 является алкилом,
то А1 должно быть
в которой алкил отдельно или в комбинации с любым другим алкилом из определения других радикалов является линейным или разветвленным насыщенным алифатическим углеводородом, предпочтительно имеющим 1-10 атомов углерода;
алкенил отдельно или в комбинации с любым другим алкенилом из определения других радикалов является моно- или полиненасыщенным алифатическим углеводородом с прямой или разветвленной цепью, предпочтительно имеющим 2-10 атомов углерода;
алкинил отдельно или в комбинации с любым другим алкинилом из определения других радикалов является моно- или полиненасыщенным алифатическим углеводородом с прямой или разветвленной цепью, предпочтительно имеющим 2-10 атомов углерода, в которой, по меньшей мере, один ненасыщенный алифатический углеводород содержит тройную связь;
циклоалкил отдельно или в комбинации с любым другим циклоалкилом из определения других радикалов является насыщенным циклическим алифатическим углеводородом, содержащим от 3 до 8 атомов углерода;
гетероциклил отдельно или в комбинации с любым другим гетероциклом из определения других радикалов является стабильным 5-15-членным моно-, би- или трициклическим гетероциклическим кольцом, которое является либо насыщенным или частично ненасыщенным, но не ароматическим и которое не обязательно является конденсированным;
арил отдельно или в комбинации с любым другим арилом из определения других радикалов является карбоциклическим ароматическим кольцом, предпочтительно имеющим 6-14 атомов углерода, которое может быть конденсировано с другой кольцевой системой;
гетероарил отдельно или в комбинации с любым другим гетероарилом из определения других радикалов является моноциклическим кольцом, предпочтительно имеющим от 3 до 7 членов, которое является ароматическим и которое может быть конденсировано с другим кольцом, гетероарильное кольцо может содержать от 1 до 4 гетероатомов, выбранных из N, О и S;
аралкил представляет алкил, замещенный арилом; и
аралкенил представляет алкенил, замещенный арилом.
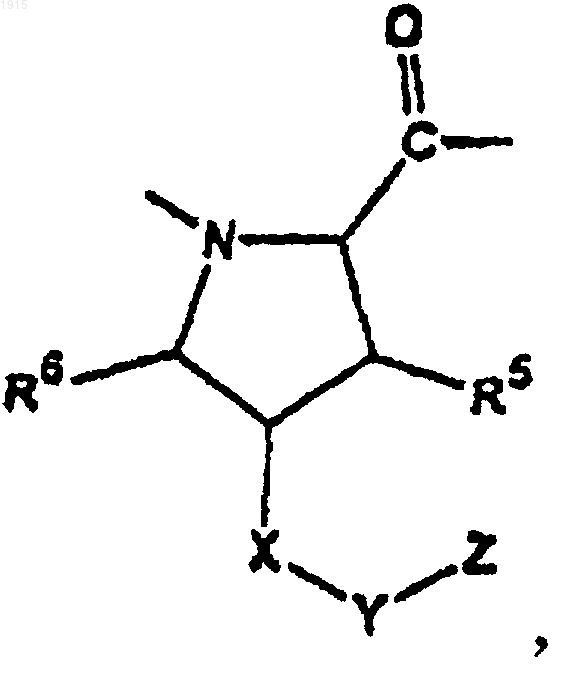
2. Соединение по п.1, где А1 является

3. Соединение по п.2, где R5 и R6 представляют собой водород.
4. Соединение по п.3, где А2 является
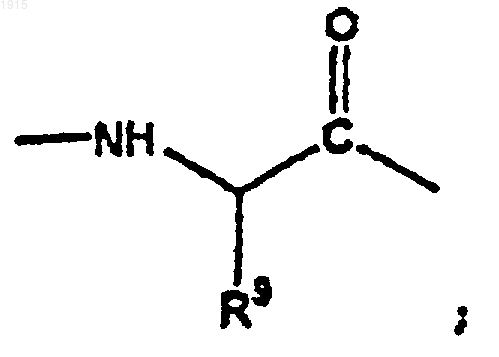
и R9 представляет собой алкил.
5. Соединение по п.4, где R9 представляет собой изопропил.
6. Соединение по п.5, где L представляет собой алкил, алкенил или алкинил, где любой водород необязательно замещен галогеном и где любой атом водорода или галогена, связанный с любым терминальным атомом углерода, необязательно замещен сульфгидрилом или гидроксилом.
7. Соединение по п.6, где L представляет собой тригалогенметил, сульфгидрил или алкил, замещенный тригалогенметилом, сульфгидрилом или гидроксилом.
8. Соединение по п.7, где Х является -О- или -N(H)- и Y является -СН2-, -С(О)- или -S(O)2-.
9. Соединение по п.8, где V является -N(H)- и K является -С (О)- или -S(O)2-.
10. Соединение по п.1, где А1 является
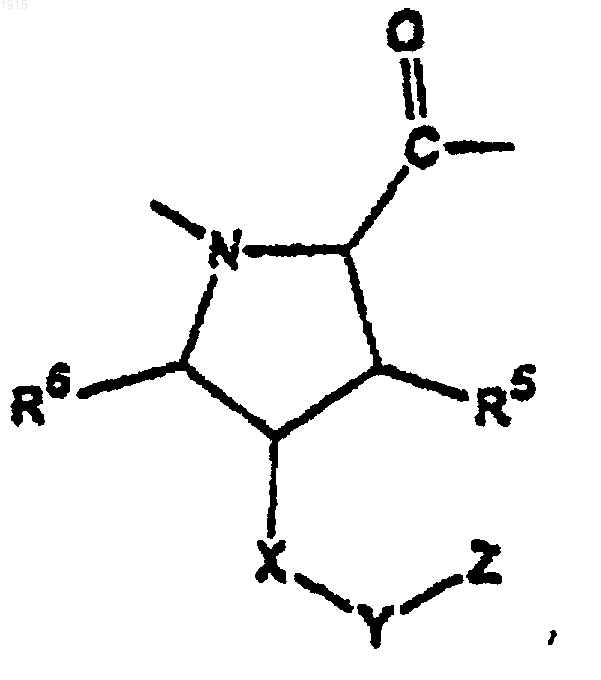
и R5 и R6 являются водородом;
А2 является
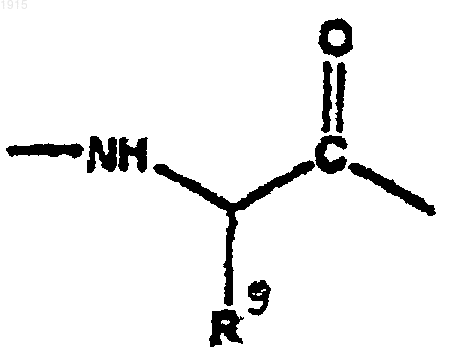
и R9 является изопропилом;
L является этилом;
Х является -О- или -N(H)-;
Y является -СН2-, -С(О)- или -S(O)2-;
V является -N(H)-; и
K является -С(О)-.
11. Соединение по п.10, где М является изопропилом.
12. Соединение по п.11, где Z является арилом или гетероарилом.
13. Соединение по п.12, где Т является арилом или гетероарилом.
14. Соединение по п.13, где Т является пиразином.
15. Соединение по п.10, где Х является -О- и Y является -СН2-.
16. Соединение по п.15, где Z является арилом или гетероарилом.
17. Соединение по п.16, где Z является арилом.
18. Соединение по п.17, где М является изопропилом.
19. Соединение по п.18, где Т является -R12, -OR12, -N(R12)2 или
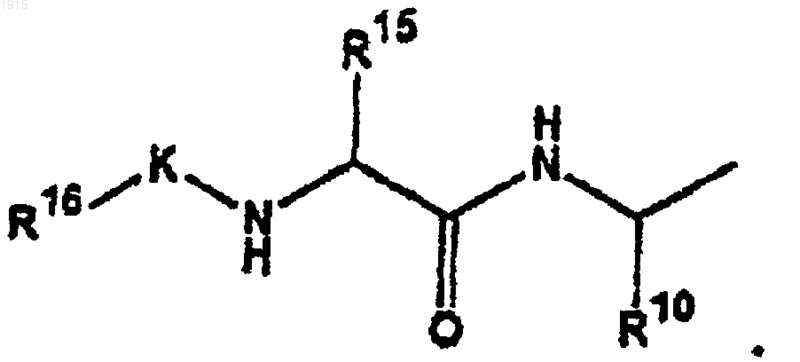
20. Соединение по п.10, где М представляет алкил, гетероаралкил, арил, циклоалкилалкил, аралкил или аралкил, где один из алкильных атомов углерода замещен О или S.
21. Соединение по п.20, где М представляет пропил, метил, пиридилметил, бензил, нафтилметил, фенил, имидазолилметил, тиофенилметил, циклогексилметил, фенетил, бензилтиометил или бензилоксиэтил.
22. Соединение по п.21, где Т является арилом или гетероарилом.
23. Соединение по п.22, где Т является пиразином.
24. Соединение по п.3, где
А2 является связью,
L является этилом;
Х является -О-;
Y является -CH2-;
V является -N(H)-;
K является -С(О)- или -S(O)2-.
25. Соединение по п.24, где М является изопропилом.
26. Соединение по п.25, где Z является арилом или гетероарилом.
27. Соединение по п.26, где Z является фенилом.
28. Соединение по п.27, где Т является -R12, -алкил-R12, -алкенил-R12, -OR12, -N(-R12)2, -С(=NOалкил)R12 или

29. Соединение по п.1, где А1 является
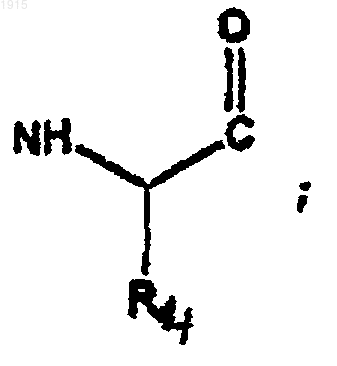
и А2 является
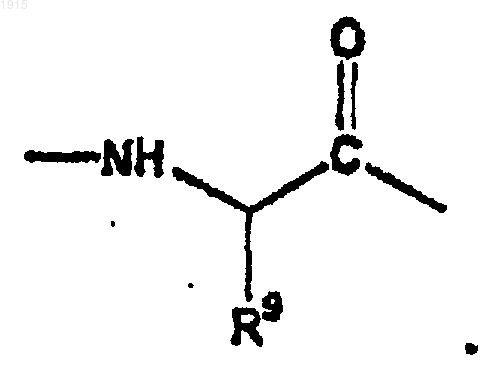
30. Соединение по п.29, где М является изопропилом и K является -С(О)-.
31. Соединение по п.30, где Т является -R12, -алкил-R12, -алкенил-R12, -OR12, -N(R12)2, -С(=NОалкил)R12 или
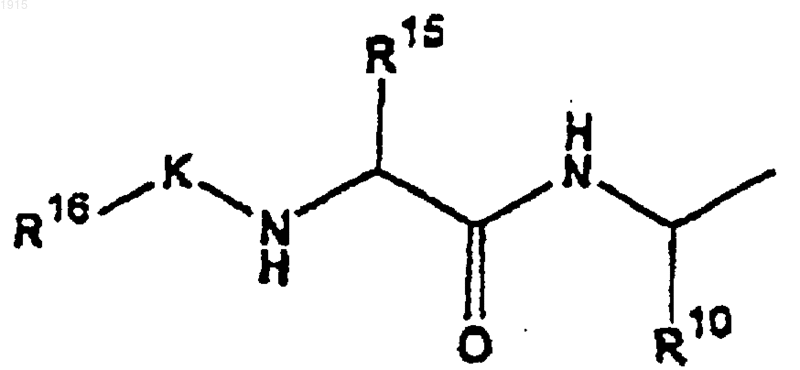
32. Соединение по п.1, в котором Z является фенилом, в котором любой атом углерода необязательно замещен J.
33. Фармацевтически приемлемая композиция, содержащая соединение по любому из пп.1-32, и фармацевтически приемлемый носитель.
34. Применение соединения по любому из пп.1-32 для ингибирования активности серин-протеазы.
35. Применение по п.34, где серин-протеаза является HCV NS3 протеазой.
36. Применение соединения по любому из пп.1-32 в производстве медикамента для лечения или профилактики вирусной инфекции гепатита С у пациента.
37. Применение по п.36, отличающееся тем, что указанное соединение соединяют с фармацевтически приемлемым носителем.
Текст
1 Область применения Настоящее изобретение относится к новому классу соединений, которые используются в качестве ингибиторов протеазы, в частности как ингибиторы серин-протеазы, а точнее как ингибиторы протеазы NS3 гепатита С. Как таковые,они действуют путем влияния на жизненный цикл вируса гепатита С (HVC) и полезны также в качестве антивирусных препаратов. Настоящее изобретение относится также к фармацевтическим композициям, включающим эти соединения. Соединения и фармацевтические композиции по данному изобретению особенно хорошо подходят для подавления активности протеазы NS3 HCV и, следовательно, могут эффективно использоваться в качестве лекарственных препаратов против вируса гепатита С и других вирусов, для пролиферации которых необходима серин-протеаза. Данное изобретение относится также к способам ингибирования активности протеаз, включая NSS протеазу вируса гепатита С и другие серин-протеазы, с применением соединений по данному изобретению и родственных соединений. Предшествующий уровень техники Инфекция, вызываемая вирусом гепатита С (HCV), является серьезной медицинской проблемой. HCV признается возбудителем большинства случаев не А, не В гепатита; серораспространенность среди населения земного шара оценивается в 1% [Purcell, R.H., "Hepatitis C virus: Historical perspective and current concepts"Kerger), pp. 137-163 (1994)]. Только в США инфицированными могут оказаться четыре миллиона индивидуумов [Alter, M.J. and Mast, E.E.,"The Epidemiology of Virial Hepatitis in the UnitedStates, Gastroenterol. Clin. North Am. 23, pp. 437455 (1994)]. После первого воздействия HCV острый клинический гепатит развивается только примерно у 20% инфицированных индивидуумов,тогда как у остальных инфекция, по-видимому,разрешается спонтанно. Однако в большинстве случаев вирус вызывает хроническую инфекцию, которая персистирует десятилетиямиHepatitis" FEMS Microbiology Reviews 14, pp. 201-204 (1994)]. Это обычно приводит к рецидивирующему и прогрессирующему воспалительному процессу в печени, который часто заканчивается более тяжелыми заболеваниями,такими как цирроз и печеночно-клеточный ракUSA, 87, pp. 6547-6549 (1990)]. К сожалению,пока нет эффективных способов предотвращения инвалидизирующего прогрессирования хронической инфекции HCV. Геном HCV кодирует полипротеин из 3010-3033 аминокислот [Choo, Q.-L, et al., "Genetic Organization and Diversity of the Hepatitis С(1991)]. Неструктурные (NS) протеины HCV предположительно составляют существенное звено каталитического механизма репликации вируса. NS протеины получают путем протеолитического расщепления полипротеина [Bartenschlager, R. et al., "Nonstructural Protein 3 ofNS протеин 3 (NS3) HCV обладает активностью серин-протеазы, которая помогает перерабатывать большинство вирусных ферментов и поэтому считается существенно важным для репликации и инфективности вируса. Известно,что мутации в протеазе NS3 вируса желтой лихорадки снижают инфективность вируса [Chambers, T.J., et al., "Evidence that the N-terminal Domain of Nonstructural Protein NS3 From YellowNS3 (остатки 1027-1207 вирусного полипротеина) содержат серин-протеазный домен NS3, который обрабатывает все четыре дальнейших места полипротеина HCV [С. Lin et al., "Hepatitis С Virus NS3 Serine Proteinase: Trans-CleavageRequirements and Processing Kinetics, J.Virol.,68, pp. 8147-8157 (1994)]. Серин-протеаза NS3 HCV, а также связанный с ней кофермент NS4A, помогает обрабатывать все вирусные ферменты и поэтому считается существенно важной для репликации вируса. Такая обработка, по-видимому, аналогична той, которую осуществляет аспартилпротеаза вируса иммунодефицита человека, которая также участвует в обработке вирусных фермен 3 тов ингибиторов протеазы ВИЧ, которые подавляют синтез вирусного белка и являются эффективными антивирусными препаратами. Это свидетельствует о том, что прерывание данной стадии жизненного цикла вируса является характерной особенностью терапевтически активных лекарственных препаратов, реализация которой должна быть желанной целью для разработчиков новых лекарственных препаратов. К сожалению, приходится констатировать, что в настоящее время отсутствуют ингибиторы серинпротеазы, которые использовались бы как антиHCV препараты. Более того, современное понимание инфекции HVC не обеспечивает каких-либо других удовлетворительных анти-HCV средств или способов лечения. Единственным установленным способом лечения болезни, вызваннойHCV, является лечение интерфероном. Однако интерферон дает существенные побочные эффекты (Janssen et al., 1994; Renault and Hoofnagle, 1989) [Janssen, H.L.A., et al. "Suicide Associated with Alfa-interferon Therapy for Chronic Viralalpha interferon. Seminars in Liver Disease 9, 273277 (1989)] и приводит к долгосрочной ремиссии только в части случаев (25%) [Weiland, О.(1994)]. Вдобавок, перспективы появления эффективных анти-HCV вакцин остаются неясными. Таким образом, ощущается острая потребность в разработке более эффективного антиHCV лечения. Такие ингибиторы должны были бы обладать терапевтическим потенциалом как ингибиторы протеаз, в частности как ингибиторы серин-протеазы, а более точно - как ингибиторы протеаз NS3 HCV. Конкретнее, такие соединения могут использоваться в качестве антивирусных препаратов, в частности таких, которые направлены против HCV. Сущность изобретения Настоящее изобретение касается соединений, а также их фармацевтически приемлемых производных, которые могут использоваться в качестве ингибиторов протеаз, в частности в качестве ингибиторов серин-протеазы, а более точно - в качестве ингибиторов NS3 HCV протеазы. Эти соединения могут использоваться самостоятельно или в комбинации с иммуномодуляторами, такими как -, - или интерфероны; другими антивирусными препаратами, такими как рибавирин и амантадин; другими ингибиторами протеазы гепатита С; ингибиторами других элементов жизненного цикла HCV, включая геликазу, полимеразу, металлопротеазу или внутренним введением рибосом как отдельно взятых, так и в любых сочетаниях. 4 Настоящее изобретение также касается способов подавления активности протеаз, в частности серин-протеаз, а более точно протеазыNS3 HCV. Настоящее изобретение касается и фармацевтических композиций, включающих соединения по данному изобретению, а также многокомпонентных композиций, включающих дополнительные иммуномодуляторы, такие как -,- или -интерфероны, другие антивирусные препараты, такие как рибавирин и амантадин; другие ингибиторы протеазы гепатита С; ингибиторы других элементов жизненного циклаHCV, включая геликазу, полимеразу, металлопротеазу или внутреннее введение рибосом как отдельно взятых, так и в любых сочетаниях. Изобретение также касается способов использования соединений, описанных в нем, и других родственных соединений для подавления HCV. Подробное описание изобретения Для более полного понимания описанного здесь изобретения, представляется следующее детальное его описание. В этом описании используются следующие сокращения: Обозначение Реактив или фрагмент аминомасляная кислота ацетил уксусная кислота бензил трет-бутилоксикарбонил бензоил карбобензилокси карбонилдиимидазол 1,2-дихлорэтан дихлорметан диизопропилэтиламин диметилацетамид диметиламинопиридин диметилформамид дифенилфосфорилазид диметилсульфоксид этил этилацетат 9-флуорэнилметоксикарбонил О-бензотриазолил-N,N,N',N'-тетраметилурония гексафторфосфатN-гидроксибензотриазол высокоэффективная жидкостная хроматография метил масс-спектрометрияN-метилпирролидинон не определяется пиперидин пиперазин бром-трис-пирролидинофосфония гексафторфосфат пиридин тетрагидрофуран трифторуксусная кислота трифторэтанол толуол В описании используются следующие термины. 5 Если явно не утверждается противное, то используемые здесь термины "-SO2" и "-S(O)2" относятся к сульфону или производному сульфона (т.е. обе соединенные группы связаны с S),а не к сульфинатному эфиру. Термин "замещенный" относится к замещению одного или более водородных радикалов в данной структуре на радикал, выбранный из приведенной группы. Если более чем один водородный радикал может быть замещен радикалом, выбранным из одной и той же приведенной группы, то замещающие радикалы могут быть одинаковыми или различными во всех положениях. Используемый здесь термин "амино" относится к трехвалентному азоту, который может быть первичным или замещенным 1-2 алкильными группами. Термин "алкил" или "алкан", используемый отдельно или в сочетании с любым другим термином, относится к насыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепочкой, который содержит указанное число атомов углерода или, если это количество не оговаривается, предпочтительно от 1 до 10 атомов углерода, а более предпочтительно от 1 до 5 атомов углерода. Примеры алкильных радикалов включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил,н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, н-гексил и т.п. Термин "алкенил" или "алкен", используемый отдельно или в сочетании с любым другим термином, относится к моно- или полиненасыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепочкой,который содержит указанное число атомов углерода или, если это количество не оговаривается, предпочтительно от 2 до 10 атомов углерода, а более предпочтительно от 2 до 5 атомов углерода. Примеры алкенильных радикалов включают, но не ограничиваются ими, этенил,Е- и Z-пропенил, Е- и Z-изобутенил, Е- и Zпентенил, Е- и Z-гексенил, Е,Е-, E,Z-, Z,E и Z,Zгексадиенил и т.п. Термин "алкинил" или "алкин", используемый отдельно или в сочетании с любым другим термином, относится к моно- или полиненасыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепочкой,который содержит указанное число атомов углерода или, если это количество не оговаривается, предпочтительно от 2 до 10 атомов углерода, а более предпочтительно от 2 до 5 атомов углерода, и в котором, по меньшей мере, один из ненасыщенных алифатических углеводородных радикалов содержит тройную связь. Примеры алкинильных радикалов включают, но не ограничиваются ими, этинил, пропинил, изобутинил, пентинил, гексинил, гексининил и т.п. Термин "арил", используемый отдельно или в сочетании с любым другим термином, 001915 6 относится к радикалу с ароматическим углеродным кольцом, содержащим указанное количество атомов углерода, которое может быть необязательно конденсировано, например бензоконденсировано, с 1-3 циклоалкильными, ароматическими, гетероциклическими или гетероароматическими кольцами. Предпочтительные арильные группы имеют от 6 до 14 атомов углерода, а более предпочтительные - от 6 до 10 атомов углерода. Примеры арильных радикалов включают, но не ограничиваются ими, фенил, нафтил, антраценил и т.п. Термин "углеродное кольцо", используемый отдельно или в сочетании с любым другим термином, относится к стабильному неароматическому 3-8-членному углеродному кольцурадикалу, которое может быть насыщенным,мононенасыщенным или полиненасыщенным и которое может быть необязательно конденсировано, например бензоконденсировано, с 1-3 циклоалкильными, ароматическими, гетероциклическими или гетероароматическими кольцами. Углеродное кольцо может присоединяться к любому эндоциклическому атому углерода, что дает стабильную структуру. Термин "циклоалкил" или "циклоалкан",используемый отдельно или в сочетании с любым другим термином, относится к стабильному неароматическому 3-8-членному углеродному кольцу-радикалу, которое является насыщенным и которое может быть необязательно конденсировано, например бензоконденсировано, с 1-3 циклоалкильными, ароматическими, гетероциклическими или гетероароматическими кольцами. Циклоалкильный радикал может присоединяться к любому эндоциклическому атому углерода, что дает стабильную структуру. Предпочтительные углеродные кольца имеют 56 атомов углерода. Примеры карбоциклических радикалов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил,циклогексил, циклогептил, циклопентенил, циклогексенил, индан, тетрагидронафталин и т.п. Термин "циклоалкенил" или "циклоалкен",используемый отдельно или в сочетании с любым другим термином, относится к стабильному циклическому углеводородному кольцурадикалу, которое содержит, по меньшей мере,одну эндоциклическую двойную связь углеродуглерод. Такое углеродное кольцо можно присоединить к любому циклическому атому углерода, что дает стабильную структуру. Если число атомов углерода не оговаривается, циклоалкенильный радикал предпочтительно имеет от 5 до 7 атомов углерода. Примеры циклоалкенильных радикалов включают, но не ограничиваются ими, циклопентенил, циклогексенил, циклопентадиенил, инденил и т.п. Термин "циклоалкилиденил", используемый отдельно или в сочетании с любым другим термином, относится к стабильному радикалу циклического углеводородного кольца, которое 7 содержит, по меньшей мере, одну экзоциклическую двойную связь углерод-углерод и в котором циклическое углеводородное кольцо может быть необязательно конденсировано, например бензоконденсировано, с 1-3 циклоалкильными,ароматическими, гетероциклическими или гетероароматическими кольцами. Такое углеродное кольцо можно присоединить к любому циклическому атому углерода, что дает стабильную структуру. Если число атомов углерода не оговаривается, циклоалкилиденильный радикал предпочтительно имеет от 5 до 7 атомов углерода. Примеры циклоалкилиденильных радикалов включают, но не ограничиваются ими, циклопентилиденил, циклогексилиденил, циклопентенилиденил и т.п. Опытный практик должен знать, что некоторые группы могут классифицироваться и как циклоалканы, и как арильные группы. Примеры таких групп включают инданиловую и тетрагидронафтильную группы. Термин "моноциклическое ядро" или "моноциклический", используемый отдельно или в сочетании с любым другим термином, если не оговаривается другое, относится к 5-7-членной кольцевой системе. Термин "бициклическое ядро" или "бициклический", используемый отдельно или в сочетании с любым другим термином, если не оговаривается другое, относится к 6-11-членной кольцевой системе. Термин "трициклическое ядро" или "трициклический", используемый отдельно или в сочетании с любым другим термином, если не оговаривается другое, относится к 11-15 членной кольцевой системе. Термин "гетероцикл" или "гетероциклический", используемый в отдельности или в сочетании с любым другим термином, если не оговорено другое, относится к стабильному 5-15 членному моно-, би-, три- или гетероциклическому кольцу, которое является насыщенным или частично ненасыщенным, но не ароматическим, и которое может быть конденсировано,например бензоконденсировано, с 1-3 циклоалкильными, ароматическими, гетероциклическими или гетероароматическими кольцами. Каждое гетероциклическое кольцо состоит из одного или более атомов углерода и из 1-4 гетероатомов, выбранных из группы, включающей азот,кислород и серу. Используемые здесь термины"гетероатомы азота и серы" включают любую окисленную форму азота и серы, а также кватернизованную форму любого основного азота. Гетероцикл можно присоединить к любому эндоциклическому углероду или гетероатому, что приводит к созданию стабильной структуры. Предпочтительные гетероциклы, определение которых приведено выше, включают, например, имидазолидинил, индазолинолил, пергидропиридазил, пирролинил, пирролидинил,пиперидинил, пиразолинил, пиперазинил, мор 001915 8 фолинил, тиаморфолинил, -карболинил, тиазолидинил, тиаморфолинил сульфон, оксопиперидинил, оксопирролидинил, оксоазепинил, азепинил, фуразанил, тетрагидропиранил, тетрагидрофуранил, оксатиолил, дитиолил, тетрагидротиофенил, диоксанил, диоксоланил, тетрагидрофуротетрагидрофуранил, тетрагидропиранотетрагидрофуранил, тетрагидрофуродигидрофуранил, тетрагидропиранодигидрофуранил, дигидропиранил, дигидрофуранил, дигидрофуротетрагидрофуранил, дигидропиранотетрагидрофуранил, сульфоланил и т.п. Термин "гетероарильный" или "гетероароматический", используемый отдельно или в сочетании с любым другим термином, если другое не оговаривается, относится к стабильному 3-7 членному моноциклическому гетероциклическому кольцу, которое является ароматическим и которое может быть по желанию конденсировано, например бензоконденсировано, с 1-3 циклоалкильными, ароматическими, гетероциклическими или гетероароматическими кольцами. Каждое гетероароматическое кольцо содержит один или более атомов углерода и от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Используемые здесь термины "гетероатомы азота и серы" включают любую окисленную форму азота и серы, а также кватернизованную форму любого основного азота. Гетероароматическое кольцо можно присоединить к любому эндоциклическому углероду или гетероатому, что приводит к созданию стабильной структуры. Предпочтительные гетероароматические кольца, определение которых приведено выше,включают, например, бензимидазолил, имидазолил, хинолил, изохинолил, индолил, индазолил, пиридазил, пиридил, пирролил, пиразолил,пиразинил, хиноксолил, пиранил, пиримидинил,пиридазинил, фурил, тиенил, триазолил, тиазолил, тетразолил, бензофуранил, оксазолил, бензоксазолил, изоксазолил, изотиазолил, тиадиазолил, тиофенил и т.п. Термин "галоген" относится к радикалу из фтора, хлора, брома или йода. Предпочтительные галогеновые радикалы включают фтор и хлор. В химических формулах используются круглые скобки, чтобы показать: 1) присутствие более чем одного атома или группы, связанных с одним и тем же атомом или группой; 2) точку ответвления в цепочке (т.е. группа или атом,расположенные непосредственно перед открывающей круглой скобкой, связываются непосредственно с группой или атомом, расположенными сразу же после закрывающей круглой скобки). Примером первого использования является "N(R1)2", означающий, что две группы R1 связаны с атомом азота. Примером второго применения является "-C(O)R1", означающий атом кислорода и R1, связанные с атомом углерода, как в следующей структуре: В дальнейшем описании "В" обозначает атом бора. Настоящее изобретение относится к соединениям, которые могут использоваться как ингибиторы протеаз, в частности как ингибиторы серин-протеаз, а более точно как ингибиторы протеазы NS3 HCV. Как таковые они действуют путем влияния на жизненный цикл вируса гепатита С и других вирусов, для пролиферации которых необходима серин-протеаза. Следовательно, такие соединения полезны в качестве антивирусных препаратов. Соответственно, в одном воплощении, настоящее изобретение касается соединения со следующей структурной формулой (I)C1-3 алкильная группа, причем C1-3 алкильная группа необязательно может быть замещена тиолом, гидроксильной группой, тиометилом,алкенильной группой, алкинильной группой,трифторметилом, С 1-2 алкоксильной группой или С 1-2 алкилтиогруппой;G2 - это алкильная, арильная, аралкильная группа или моно-, би- или трициклический гетероцикл, который необязательно может быть замещен 1-3 группами, выбранными из алкильной, алкенильной, алкинильной, аралкильной,алкоксильной, алкеноксильной, арилоксильной,гетероциклильной,гетероциклилалкильной,аралкоксильной,гетероциклилалкоксильной,оксо-, гидроксильной, амино-, алканоиламино-,алкоксикарбониламино-, уреидо-, карбоксильной, гетероциклилоксиалкильной, арилоксиалкильной, гетероциклилкарбонильной, ароил-,арилсульфонильной, гетероциклилсульфонильной, гетероциклилсульфониламино-, арилсульфонамидо-, аралкилсульфонамидо-, гетероциклилалканоиловой, карбоксиалкильной, карбоксиамидоалкильной, алкансульфонильной, сульфонамидо-, галогено-, циано- или галогеналкильной групп; 10 алкил, алкоксиалкил, алкилтиоалкил, арилтиоалкил или гетероциклилтиоалкил. Каждое Q1 - это гидроксильная, алкоксильная или арилоксильная группа, или каждоеQ1 - это атом кислорода. Вместе с бором, с которым они связаны, образуется 5-7-членное кольцо, атомами которого являются углерод,азот или кислород.G9 - это водород, алкил, карбоксиалкил,алкенил, арил, аралкил, аралкенил, циклоалкил,циклоалкилалкил, циклоалкенил, гетероциклил,гетероциклилалкил или гетероциклилалкенил,необязательно замещенный 1-3 группами, выбранными из алкильной, алкенильной, аралкильной, алкоксильной, алкеноксильной, арилоксильной, гетероциклильной, карбоксиалкильной, карбоксиамидоалкильной, алкилсульфонильной групп или сульфонамидогруппы; или две группы G9 вместе с атомом азота, с которым они связаны, образуют 4-10-членную,содержащую азот, моно- или бициклическую,насыщенную или частично ненасыщенную кольцевую систему, в которой 1-2 из атомов,образующих кольцо, представляют собой N, S или О, а остальные атомы, образующие кольцо,являются С; причем кольцевая система необязательно замещена одной или двумя группами,выбранными из алкильной, алкенильной, аралкильной, алкоксильной, алкеноксильной, арилоксильной, аралкоксильной, гетероциклильной, кето-, гидрокси-, амино, алканоиламино,карбокси-,карбоксиалкильной,карбоксиамидоалкильной, сульфонильной или сульфонамидогруппы. Е 4 - это связь где G13 - это циклоалкильная, аралкильная, гетероциклилалкильная, аралкоксиалкильная, гетероциклилалкоксиалкильная, аралкилтиоалкильная или гетероциклилалкилтиоалкильная группы, необязательно замещенные 1-2 алкильными,алкенильными, аралкильными, алкоксильными,алкеноксильными, арилоксильными, аралкоксильными, гетероциклильными, оксо-, гидрокси-, амино-, алканоиламино-, карбокси-, карбоксиалкильными, карбоксиамидоалкильными,сульфонильными или сульфонамидогруппами.G14 - это водород, алкильная, алкенильная,гидроксильная, алкоксильная группы или -CH2G8, где G8 - это арильная, аралкильная, карбоциклильная или гетероциклильная группа, причем кольцевая часть каждой из арильной, аралкильной групп или гетероцикла необязательно замещена 1-3 группами, выбранными из алкильной, алкенильной, аралкильной, алкоксильной, алкеноксильной, арилоксильной, гетероциклильной, гетероциклилалкильной, аралкоксильной, гетероциклилалкоксильной, оксо-,гидроксильной, амино-, алканоиламино-, алкоксикарбониламино-, уреидо-, карбоксильной,G13 и G14 вместе с атомами, с которыми они связаны (углерод и азот соответственно),образуют азотсодержащую гетероциклическую кольцевую систему, имеющую 4-7 членов, которая необязательно содержит один или два дополнительных гетероатома. Причем такая кольцевая система необязательно конденсирована с дополнительной карбоциклической или гетероциклической кольцевой системой с образованием бициклической кольцевой системы,включающей 7-11 атомов; при этом моноциклическая или бициклическая кольцевая система необязательно замещена одной или двумя группами, выбранными из оксо-, гидроксильной,алкильной, алкенильной, ариларалкильной, алкеноксильной, арилоксильной, аралкилоксильной, галогена или нитрогруппы. Каждый Q3 - это галоген, нитро-, циано-,алкильная, алкенильная, аралкильная, алкоксильная, алкеноксильная, арилоксильная, аралкоксильная, гетероциклическая, гетероциклилалкильная, гидроксильная, амино-, алкиламино-, алканоиламино-, карбоксильная, карбоксиалкильная, карбоксиамидоалкильная, алкилсульфонильная, арилсульфонильная, аралкилсульфонильная, алкилсульфонамидо-, арилсульфонамидо- или аралкилсульфонамидогруппа, где алкильная, алкенильная, арильная или гетероциклическая группы необязательно замещены 1-3 группами, выбранными из кето-,гидроксильной, нитро-, циано-, галогена, амино-, алкильной, алкоксильной или алкилтиогруппы, причем если Q3 не связан с каким-либо конкретным атомом, он может связываться с любым замещаемым атомом.Q4 - это независимо алкил, циклоалкил,арил, аралкил, гетероциклил, гетероциклилалкил, алканоил, арилкарбонил, аралкилкарбонил,алкоксикарбонил, арилоксикарбонил, аралкилоксикарбонил, алкилсульфонил, арилсульфонил, аралкилсульфонил, алкиламинокарбонил,ариламинокарбонил, аралкиламинокарбонил, в котором любая из указанных алкильной, циклоалкильной, арильной, аралкильной, гетероциклической групп необязательно замещена одной или более группами, независимо выбранными из кето-, гидроксильной, нитро-, циано-, галогена, амино-, алкильной, алкоксильной или алкилтиогруппы.Q5 - это арил или ароматический гетероцикл, в котором 13 арильный или ароматический гетероцикл является моноциклическим, бициклическим или трициклическим, имеющим 5-14 атомов и необязательно замещенным 1-3 группами, выбранными из гидроксильной, нитро-, циано-,галогена, амино-, алкильной, алкоксильной, алканоил-, алкиламино- или алкилтиогруппы. Е 5 - это связь или в которой G15 - это алкил, алкенил, циклоалкилалкил, аралкил, гетероциклилалкил, карбоксиалкил или карбоксиамидоалкил, где кольцо любой аралкильной или гетероциклилалкильной группы необязательно замещено 1-2 алкильными, алкенильными, аралкильными,алкоксильными, алкеноксильными, арилоксильными, аралкоксильными, гетероциклильными,оксо-, гидроксильными, амино-, алканоиламино-, карбоксильными, карбоксиалкильными,карбоксиамидоалкильными, сульфонильными или сульфонамидогруппами. Е 6 - это связь, или 14 связаны (углерод и азот соответственно), образуют азотсодержащую гетероциклическую кольцевую систему, имеющую 4-7 членов, которая по желанию может содержать 1-2 дополнительных гетероатома, причем моноциклическая или бициклическая кольцевая система необязательно может быть замещена одной или двумя группами, выбранными из оксо-, гидроксильной, алкильной, алкенильной, арильной,аралкильной, алкильной, алкеноксильной, арилоксильной, аралкилоксильной, галогена или нитрогруппы; иZ равен 0. Более предпочтительными соединениями структурной формулы (I) являются такие, в которых G1 представляет собой -SH, -CH2SH, -СF3 или -СF2 СF3. Наиболее предпочтительными соединениями структурной формулы (I) являются такие,в которых G представляет собой -SH или -СF3. В соответствии с другим воплощением настоящее изобретение касается соединения со структурной формулой (I), в котором W1 определен ниже, тогда как W и другие замещающие группы таковы, как описано выше. В соответствии с другим воплощением настоящее изобретение касается соединения структурной формулы (II) в которой G17 - это алкил, необязательно замещенный карбоксильной группой; алкил предпочтительно является C1-3 алкилом. Е 8 - это связь, или в которой G18 - это алкил, необязательно замещенный карбоксильной группой; алкил предпочтительно является C1-3 алкилом. Каждый Z1 - это независимо О или Н 2 при условии, что не более чем две Z1 группы представляют собой Н 2 в данном соединении. Предпочтительными соединениями со структурной формулой (I) являются такие соединения, в которых, по меньшей мере, один заместитель определяется следующим образом:G13 - это разветвленный алкил С 3-6 или G13 14 и G вместе с теми атомами, с которыми ониm равно 0 или 1. Каждый R1 представляет собой гидроксильную, алкоксильную или арилоксильную группу, или каждый R1 представляет собой атом кислорода и вместе с бором, с которым все они связаны, образует 5-7-членное кольцо, атомами которого являются углерод, азот или кислород. Каждый R2 представляет собой независимо водород, алкил, алкенил, арил, аралкил, аралкенил, циклоалкил, циклоалкилалкил, циклоалкенил, циклоалкенилалкил, гетероциклил, гетероциклилалкил, гетероциклилалкенил, гетероарил 15 или гетероаралкил или две группы R2, которые связаны с одним и тем же атомом азота, образуют вместе с этим атомом азота 5-7-членную моноциклическую гетероциклическую кольцевую систему; любой атом R2 необязательно может быть замещен на J.J представляет собой алкильную, арильную, аралкильную, алкоксильную, арилоксильную, аралкоксильную, циклоалкильную, циклоалкоксильную, гетероциклильную, гетероциклилокси-, гетероциклилалкильную, кето-, гидроксильную, амино-, алкиламино-, алканоиламино-, ароиламино-, аралканоиламино-, карбоксильную, карбоксиалкильную, карбоксиамидоалкильную, галоген, циано-, нитро-, формильную, ацильную, сульфонильную или сульфонамидогруппу, которая необязательно замещена 13 группами J1.L представляет собой алкил, алкенил или алкинил, в котором любой водород, связанный с атомами углерода, необязательно замещен галогеном и в котором любой атом водорода или галогена, связанный с любым терминальным атомом углерода, необязательно замещен сульфгидрильной или гидроксильной группой. А 1 - это связьR4 - это алкил, циклоалкил, арил, аралкил,гетероциклил, гетероциклилалкил, гетероарил,гетероаралкил, карбоксиалкил или карбоксиамидоалкил, который необязательно замещен 1-3 группами J.R5 и R6 - это независимо водород, алкил,алкенил, арил, аралкил, аралкенил, циклоалкил,циклоалкилалкил, циклоалкенил, гетероциклил,гетероциклилалкил, гетероарил или гетероаралкил и необязательно замещен 1-3 группами J. Х - это связь -С(Н)(R7)-, -О-, -S- или 8R7 - это водород, алкил, алкенил, арил,аралкил, гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил и необязательно замещен 1-3 группами J. 16 гетероаралканоил, -C(O)R14, -SО 2R14 или карбоксиамидогруппа и необязательно замещен 1-3 группами J; или R8 и Z вместе с атомами, с которыми они связаны, образуют азотсодержащую моно- или бициклическую кольцевую систему,необязательно замещенную 1-3 группами J.-N(R2)2, в котором любой атом углерода необязательно замещен на J и в котором R2 имеет такой вид, как определено выше. А 2 - это связь илиR9 - это алкил, циклоалкил, арил, аралкил,гетероциклил, гетероциклилалкил, гетероарил,гетероаралкил, карбоксиалкил или карбоксиамидоалкил и необязательно замещен 1-3 группами J. М - это алкил, циклоалкил, арил, аралкил,гетероциклил, гетероциклилалкил, гетероарил или гетероаралкил и необязательно замещен 1-3 группами J, в котором любой алкильный атом углерода может быть замещен гетероатомом.R11 - это водород или C1-3 алкил. К - это связь -О-, -S-, -С(О)-, -S(O)-,-S(O)2- или -S(О)(NR11)-, где R11 имеет вид, определенный выше. Т - это -R12, -алкил-R12, -алкенил-R12,-алкинил-R12,-OR12,-N(R12)2,-C(O)R12,12 Каждый R12 - это водород, арил, гетероарил, циклоалкил, гетероциклил, циклоалкилиденил или гетероциклоалкилиденил и необязательно замещен 1-3 группами J, или первый R12 и второй R12 вместе с азотом, с которым они связаны, образуют моно- или бициклическую кольцевую систему, необязательно замещенную 1-3 группами J.R10 - это алкил, циклоалкил, арил, аралкил,гетероциклил, гетероциклилалкил, гетероарил,гетероаралкил, карбоксиалкил или карбоксиамидоалкил и необязательно замещен 1-3 группами J.R15 - это алкил, циклоалкил, арил, аралкил,гетероциклил, гетероциклилалкил, гетероарил,гетероаралкил, карбоксиалкил или карбоксиамидоалкил и необязательно замещен 1-3 группами J. Предпочтительно J - это алкильная, алкоксильная, арилоксильная, арильная, аралкильная,аралкоксильная, галоген, гетероарильная, циано-, амино-, нитро-, гетероциклильная, ацильная, карбоксильная, карбоксиалкильная, алкиламино-, гидроксильная, гетероциклилалкильная, аралканоиламино-, ароиламино-, алканоиламино-, формил- или кетогруппа. Более предпочтительно J - это трет-бутил,метил, трифторметил, метокси, этокси, трифторметокси, карбокси, фенил, бензил, фенокси,бензилокси, фтор-, хлор-, бром-, изоксазолил,пиридинил, пиперидинил, карбоксиметил, карбоксиэтил, диалкиламино-, морфолинилметил,фенилацетиламино- или ациламиногруппа. Предпочтительно J1 - это алкокси, алкил,галоген или арил. Более предпочтительно J1 - это C1-3 алкокси, хлор-, C1-3 алкил или фенил. Предпочтительно L - это алкил, алкенил,аллил или пропаргил. Более предпочтительно L - это тригалометил, сульфгидрил или алкил, замещенный тригалометилом, сульфгидрилом или гидроксильной группой. 18 Предпочтительно R4 - это алкил, аралкил или циклоалкилалкил, или циклоалкил. Более предпочтительно R4 - это фенилалкил или циклоалкил. Наиболее предпочтительно R4 - это изобутил, циклогексилалкил или фенэтил. Предпочтительно R5 и R6 представляют собой водород. Предпочтительно Х - это -О- или -N(R8)-. Предпочтительно R8 представляет собой водород. Предпочтительно Y - это -СН 2-, -С(О)-,-С(О)С(О)- или -S(O)2-. Предпочтительно R2 - это водород, фтор,трифторметил, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероциклилалкил. Предпочтительно Z - это алкил, арил,аралкил, гетероциклил, циклоалкил, гетероарил,OR2 или N(R2)2, где R2 - это предпочтительно аралкил или алкенил. Более предпочтительно Z - это фенил, 1,4 бензодиоксанил, 1,3-бензодиоксолил, бензотиазолил, нафтил, бензил, оксадиазолил, изоксазолил, хинолил, бензотиофенил, тиазолил, циклогексил, бутил, нафтил, диоксоланил, бензил,пиридинил, морфолинил, М-анилинил, Nаминобензотиазол, N-аминобензодиоксол, Nаминонафтилен, N-бензиламин, N-аминопиридин, бензилокси-, аллилокси- или фенэтил и необязательно замещен на J. Наиболее предпочтительно Z - это нафтил,3,4-дихлорфенил, 2-карбометоксифенил. Предпочтительно R9 представляет собой алкил. Более предпочтительно R9 представляет собой пропил. Наиболее предпочтительно R9 представляет собой изопропил. Предпочтительно М представляет собой алкил, гетероаралкил, арил, циклоалкилалкил или аралкил, в котором один из алкильных атомов углерода замещен на О или S. Более предпочтительно М - это пропил,метил, пиридилметил, бензил, нафтилметил,фенил, имидазолилметил, тиофенилметил, циклогексилметил, фенэтил, бензилтиометил или бензилоксиэтил. Предпочтительно V - это -N(R11)-. Предпочтительно R11 - это водород. Предпочтительно К - это -С(О)- или-алкил-R12. Предпочтительно R12 - это арил или гетероарил и необязательно замещен 1-3 группами J. 19 Более предпочтительно R12 - это 1-нафтил, изохинолил или 2-алкокси-1-нафтил. Предпочтительно R10 - это алкил, замещенный карбоксильной группой. Более предпочтительно R10 - это C1-3 алкил, замещенный карбоксильной группой. Предпочтительно R15 - это алкил, замещенный карбоксильной группой. Более предпочтительно R15 - это C1-3 алкил, замещенный карбоксильной группой. В предпочтительном воплощении соединения структурной формулы (II) А 1 - этоV - это -N(R11)- и К - это -С(О)-. В другом более предпочтительном воплощении данного изобретения речь идет о соединениях со структурной формулой (II), в которой А 1 - это где Х - это О, а Y - это CH2. А 2 - это а А 2 - это связь. Предпочтительно в этом предпочтительном воплощении Х является О. Более предпочтительно Y - это -СН 2-. Альтернативно Y - это -С(О)-. Альтернативно Y - это -С(О)-, a Z - это-N(R2)2. Альтернативно в этом предпочтительном воплощении Х - это -N(R8)-. Более предпочтительно Y - это -С(О)-. Альтернативно Y - это -S(O)2-. Альтернативно Y - это -С(О)-, а Z - это-N(R2)2. Альтернативно в этом предпочтительном воплощении Х -это -N(R8)-, где R8 - -C(O)R14 или -S(O)2R14. Более предпочтительно, если R8 - это-S(O)2R14, Y - это -С(О)-, а Z - это -N(R2)2. Более предпочтительное воплощение данного изобретения касается соединений структурной формулы (II), в которой А 1 -этоV - это -(NR11)- и К - это -S(О)2-. В другом более предпочтительном воплощении данного изобретения речь идет о соединениях со структурной формулой (II), в которой А 1 - этоV - это -N(R11)- и К - это -С(О)-. В другом более предпочтительном воплощении данного изобретения речь идет о соединениях со структурной формулой (II), в которой А 1 - этоV - это -N(R11)- и К - это -S(O)2-. Предпочтительно в этих более предпочтительных воплощениях W представляет собой Предпочтительно в этих более предпочтительных воплощениях, чтобы L был алкилом,алкиленом, аллилом или пропаргилом. Более предпочтительно, чтобы L был тригалогенметилом, сульфгидрилом или алкилом,замещенным тригалогенметилом, сульфгидрильной или гидроксильной группой. В другом предпочтительном воплощении соединения со структурной формулой (II) А 1 это а А 2 - это связь. Предпочтительные группы в этом предпочтительном воплощении таковы,как описанные выше. В другом предпочтительном воплощении соединения со структурной формулой (II) А 1 это Предпочтительные, более предпочтительные и наиболее предпочтительные группы в этом предпочтительном воплощении таковы,как описанные выше. Данное изобретение предполагает, что многие направленные против активного участка ингибиторы протеазы NS3 могут быть пептидомиметическими по своей природе и, следовательно, могут быть получены из природного субстрата. Поэтому предпочтительные заместители в пептидомиметических ингибиторах по данному изобретению включают те, которые соответствуют основной или боковым цепочкам встречающихся в природе субстратов или синтетическим субстратам с высокой аффинностью к данному ферменту (низкий Кm). В другом предпочтительном воплощении соединения структурной формулы (II), А 1 - это связь. Предпочтительные, более предпочтительные и наиболее предпочтительные соединения в этом предпочтительном воплощении таковы, как описанные выше. Опытный практик должен знать, что некоторые группы могут быть классифицированы или как гетероциклические, или как гетероароматические в зависимости от точки присоединения. Соединения по данному изобретению могут содержать один или более асимметричных атомов углерода и, следовательно, могут встречаться в виде рацематов или рацемических смесей, одиночных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. Все такие изомерные формы этих соединений прямо включены в настоящее изобретение. Каждый стереогенный углерод может иметь конфигурацию R или S. Комбинации замещающих групп и переменных, предусмотренные настоящим изобретением, таковы, что все они обеспечивают образование стабильных соединений. Термин "стабильный", как он используется в данном описании, относится к соединениям,которые обладают стабильностью, достаточной для обеспечения их получения, и которые сохраняют целостность соединения в течение достаточного времени, чтобы оно могло использоваться для детально описанных здесь целей (на 23 пример, для терапевтического или профилактического введения млекопитающему или для применения в аффинной хроматографии). Обычно такие соединения стабильны при температуре 40 С или ниже, в отсутствии влаги или других химически агрессивных условий на протяжении не менее чем 1 недели. Соединения по данному изобретению могут быть синтезированы с помощью обычного оборудования. Их преимуществом является то,что исходные материалы являются легко доступными. Описанные здесь соединения по данному изобретению, включая соединения со структурными формулами (I) и (II), определены таким образом, что они включают и получаемые из них фармацевтически приемлемые производные и пролекарства. "Фармацевтически приемлемое производное или пролекарство" означает любую фармацевтически приемлемую соль, эфир, соль эфира или другое производное соединения по данному изобретению, которое после введения реципиенту способно обеспечить (прямо или косвенно) соединение по данному изобретению. Соответственно, данное изобретение касается также пролекарств из соединений по данному изобретению, которые являются производными, разработанными для улучшения биологических свойств, таких как оральное всасывание, клиренс, метаболизм или распределение в организме. Такие производные хорошо известны в медицине. Как должно быть понятно опытному практику, соединения по данному изобретению могут быть модифицированы присоединением соответствующих функциональных групп для усиления избирательных биологических свойств. Такие модификации известны в фармацевтике и включают такие, которые увеличивают биологическое проникновение в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), повышают оральную биодоступность,увеличивают растворимость, что позволяет использовать инъекционный способ введения, изменяют метаболизм и изменяют скорость экскреции. Термин "защищенная" используется тогда,когда функциональная группа присоединяется к соответствующей химической группе (защищающей группе). Примеры подходящих защищающих аминогрупп описаны в таких источниках, как Т.W. GreenP.G.M. Wuts, ProtectiveWiley and Sons (1995), в том числе на примере некоторых конкретных соединений, используемых в данном изобретении. 24 Особенно благоприятными производными и пролекарствами являются те, которые увеличивают биодоступность соединений по данному изобретению, когда такие соединения вводятся млекопитающему(например,обеспечивая орально вводимому соединению более быстрое всасывание в кровь), имеют более благоприятные скорости клиренса или метаболические профили, или которые усиливают доставку родительского соединения в требуемое место (например, головной мозг или лимфатическую систему). Предпочтительные пролекарства включают производные, в которых структурам по формулам (I) и (II) придается группа, которая усиливает водорастворимость или активный транспорт через мембрану кишечника. Фармацевтически приемлемые соли соединений по данному изобретению включают те, которые получены из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислых солей включают ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат,бутират, цитрат, камфорат, камфорсульфонат,циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формат, фумарат, глюкогептаноат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гидрохлорид,гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, пальмоат, пектинат, персульфат, 3 фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, сукцинат, сульфат, тартрат,тиоцианат, тозилат и ундеканоат. Другие кислоты, такие как щавелевая, хотя сами не являются фармацевтически приемлемыми, могут использоваться для получения солей, применяемых в качестве промежуточных продуктов при приготовлении соединений по данному изобретению и их фармацевтически приемлемых кислых солей. Соли, полученные из соответствующих оснований, включают соли щелочных металловN-(C1-4-алкил)4+ соли. Данное изобретение предусматривает также кватернизацию любых основных азотсодержащих групп описанных здесь соединений. С помощью такой кватернизации можно получить водо- или маслорастворимые продукты, а также диспергирующиеся продукты. В общем, соединения со структурными формулами (I) и (II) получают с помощью методов, проиллюстрированных в примерах 1-8. Однако как должно быть понятно специалисту,представленные здесь схемы синтеза не исчерпывают всех возможных способов получения соединений, описанных здесь и составляющих предмет данной заявки. Другие способы будут очевидными для среднего специалиста в данной 25 области. Кроме того, различные стадии синтеза,описанные здесь, могут выполняться в другой последовательности или в другом порядке, чтобы получить желаемые соединения. Не связываясь теоретическими соображениями, мы считаем, что соединения по данному изобретению взаимодействуют ковалентно или нековалентно с активным местом протеазы NS3HVC и других серин-протеаз, подавляя способность этого фермента расщеплять природные или синтетические субстраты. Нековалентные взаимодействия имеют то преимущество, что они обеспечивают относительно большую специфичность подавления и не подавляют другие нежелательные мишени, например цистеинпротеазы. Благодаря этому, эти соединения будут иметь более высокий терапевтический индекс при введении млекопитающим, чем ковалентные ингибиторы протеазы, которые могут взаимодействовать с широким кругом протеаз и вызывать нежелательные токсические эффекты. С другой стороны, ковалентные взаимодействия имеют то преимущество, что они обладают более высоким ингибиторным потенциалом, позволяя вводить более низкие дозы и, тем самым,смягчая проблемы, связанные с отсутствием специфичности. Новые соединения по настоящему изобретению являются отличными ингибиторами протеаз, в частности серин-протеаз, а более точно протеазы NS3 HVC. Соответственно, эти соединения способны находить и подавлять протеазы,в частности серин-протеазы, а более точно протеазу NS3 HVC. Как таковые эти соединения оказывают воздействие на жизненный цикл вирусов, включая HVC, и, следовательно, полезны в качестве антивирусных препаратов. Степень подавления может определяться различными способами, такими как описанные в примере 11. Термин "антивирусный препарат" относится к соединению или лекарственному препарату, который обладает активностью, направленной на подавление вирусов. Такие препараты включают ингибиторы обратной транскриптазы(включая нуклеозидные и ненуклеозидные аналоги) и ингибиторы протеаз. Предпочтительно ингибитор протеаз является ингибитором протеазы HVC. Термин "лечение", как он используется здесь, относится к ослаблению симптомов какого-либо конкретного расстройства у пациента или улучшению поддающегося оценке показателя, ассоциирующегося с конкретным расстройством. Термин "пациент", как он используется здесь, относится к млекопитающему,включая человека. Таким образом, согласно другому воплощению данное изобретение касается фармацевтических композиций, включающих соединение структурной формулы (I) или (II) или его фармацевтически приемлемую соль; дополнительный препарат, выбранный из, но не включаю 001915-интерферон; другие антивирусные препараты,такие как рибаварин или амантадин; другие ингибиторы протеазы HVC; ингибиторы других мишеней в жизненном цикле HVC, таких как геликаза, полимераза или металлопротеаза; или их комбинации и любой фармацевтически приемлемый носитель, адъювант или растворитель. Другое воплощение касается композиций, содержащих соединение со структурной формулой (I) или (II) или его фармацевтически приемлемую соль; и фармацевтически приемлемый носитель, адъювант или растворитель. Такая композиция может по желанию включать дополнительный агент, выбранный из иммуномодуляторов, таких как -, - или -интерферон; другие антивирусные препараты, такие как рибаварин; другие ингибиторы протеазы HCV; ингибиторы геликазы HCV; или их комбинации. Термин "фармацевтически приемлемый носитель или адъювант" относится к носителю или адъюванту, который можно вводить пациенту вместе с соединением по данному изобретению и который не разрушает его фармакологическую активность и является нетоксическим при введении в дозах, достаточных для доставки терапевтического количества соединения. Фармацевтически приемлемые носители,адъюванты и растворители, которые могут использоваться в фармацевтических композициях по данному изобретению, включают, но не ограничиваются ими, ионообменные материалы,глинозем, алюминия стеарат, лецитин, самоэмульгирующиеся системы доставки лекарственных препаратов (СЭСДЛП), такие как dтокоферол, полиэтиленгликоль 1000 сукцинат,поверхностно-активные вещества, используемые в фармацевтических лекарственных формах, такие как Твины или другие подобные полимерные матрицы, сывороточные белки, такие как альбумин сыворотки человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, калия сорбат, парциальные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протамин сульфат, динатрия гидрофосфат,калия гидрофосфат, натрия хлорид, соли цинка,коллоидный кремнезем, магния трисиликат,поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блоксополимеры, полиэтиленгликоль и ланолин. Циклодекстрины, такие как -, - и циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и -гидроксипропилциклодекстрины, или другие солюбилизированные производные также могут с успехом использоваться для усиления доставки соединений со структурными формулами (I) или (II). 27 Фармацевтические композиции по данному изобретению могут вводиться орально, парентерально, в виде ингаляционного аэрозоля,местно, ректально, назально, буккально, вагинально или с помощью имплантированного резервуара. Мы отдаем предпочтение оральному введению или введению путем инъекцирования. Фармацевтические композиции по данному изобретению могут содержать любые обычные нетоксичные фармацевтически приемлемые носители, адъюванты или растворители. В некоторых случаях рН состава можно регулировать с помощью фармацевтически приемлемых кислот, оснований или буферов, чтобы усилить стабильность соединения в данном составе или его формы доставки. Термин "парентеральное",как он используется здесь, включает подкожное,внутрикожное, внутривенное, внутримышечное,внутрисуставное, интрасиновиальное, интрастернальное, интратекальное, внутрь поражения и интракраниальное введение в виде инъекций или вливания. Фармацевтические композиции могут быть в виде стерильного инъецируемого препарата,например в виде стерильной инъецируемой водной или масляной суспензии. Такая суспензия может быть приготовлена в соответствии с методами, известными в данной области, с использованием подходящих диспергирующих или смачивающих веществ (таких как, например, Твин 80) и суспендирующих веществ. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. Приемлемыми носителями и растворителями, которые могут использоваться, являются маннит,вода, раствор Рингера и изотонический раствор натрия хлорида. Вдобавок, стерильные нелетучие масла обычно используются в качестве растворителя или среды для суспендирования. Для этой цели может использоваться любое легкое нелетучее масло, включая синтетические моноили диглицериды. Жирные кислоты, такие как олеиновая кислота, и ее глицеридные производные используются при изготовлении инъецируемых препаратов, как и природные фармацевтически приемлемые масла, такие как оливковое и касторовое, и особенно их полиоксиэтилированные варианты. Такие масляные растворы или суспензии также могут содержать разбавители или диспергаторы в виде спиртов с длинной цепочкой, аналогичных описанным в Pharmacopeia Helvetica (Ph.Helv.), или подобного спирта,или карбоксиметилцеллюлозы, или подобных диспергирующих агентов, которые обычно используются в составе фармацевтически приемлемых лекарственных форм, таких как эмульсии и/или суспензии. В рецептуре могут также использоваться другие широко применяемые поверхностно-активные вещества, такие как Тви 001915 28 ны или Спаны, и/или другие подобные эмульгаторы или усилители биодоступности, которые обычно используются при производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм. Фармацевтические композиции по данному изобретению могут быть орально вводимыми в любой орально приемлемой лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, а также водные суспензии и растворы. В случае таблеток для орального применения обычно используемые носители включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как магния стеарат,также обычно вводятся в состав. Составы для орального введения в виде капсул в качестве разбавителей обычно содержат лактозу и высушенный кукурузный крахмал. Если водные суспензии вводятся орально, активный ингредиент комбинируется с эмульгирующими и диспергирующими агентами. Если желательно, могут добавляться подслащивающие, и/или ароматизирующие, и/или окрашивающие агенты. Фармацевтические композиции по данному изобретению могут также вводиться в виде суппозиториев для ректального введения. Такие композиции могут приготавливаться путем смешения соединения по данному изобретению с подходящим, не вызывающим раздражения наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре, чтобы он плавился в прямой кишке и высвобождал активные ингредиенты. Такие материалы включают, но не ограничиваются ими, масло какао, пчелиный воск и полиэтилегликоли. Местное применение фармацевтических композиций по данному изобретению особенно полезно, когда желаемое лечение касается легко доступных участков или органов. Для нанесения на кожу фармацевтическая композиция должна представлять собой мазь, содержащую активные ингредиенты, суспендированные или растворенные в носителе. Носители для местного применения соединений по данному изобретению,включают, не ограничиваясь ими, минеральное масло, вазелиновое масло, вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен,эмульгирующий воск и воду. Как вариант, фармацевтическая композиция может представлять собой лосьон или крем, содержащие активные ингредиенты, суспендированные или растворенные в носителе. Подходящие носители включают, не ограничиваясь ими, минеральное масло, сорбит моностеарат, полисорбат 60, цетиловые эфиры, воск, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции по данному изобретению могут применяться путем местного введения в нижний отдел кишечного тракта в виде ректальных суппозиториев или клизмы. 29 Трансдермальные накладки также включены в данное изобретение. Фармацевтические композиции по данному изобретению могут вводиться в виде назального аэрозоля или ингаляции. Такие композиции приготавливаются методами, хорошо известными в области фармацевтики, и могут представлять собой растворы в солевом растворе с использованием бензилового спирта или других подходящих консервантов, усилителей всасывания для увеличения биодоступности,фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных в данной области. Дозовые уровни от примерно 0,01 до примерно 100 мг/кг веса тела в день, предпочтительно от 0,5 до 75 мг/кг веса тела в день, описанных здесь соединений ингибиторов протеазы используются в виде монотерапии для профилактики и лечения болезней, вызываемых вирусами, в частности вирусом гепатита С. Как правило, фармакологические композиции по данному изобретению будут вводиться от 1 до примерно 5 раз в день или, альтернативно, в виде непрерывного вливания. Такое введение может использоваться как хроническая или острая терапия. Количество активного ингредиента, который может комбинироваться с наполнителями в составе дозовой формы, будет варьироваться в зависимости от реципиента и конкретного способа введения. Типичный препарат будет содержать примерно от 5 до около 95% активного соединения (в/в). Предпочтительно такие препараты содержат 20-80% активного соединения. Если композиции по данному изобретению представляют собой комбинацию соединения структурной формулы (I) или (II) с одним или более дополнительным терапевтическим или профилактическим веществом, то это соединение и это дополнительное вещество должны присутствовать в дозовых уровнях между 10 и 100%, а более предпочтительно между 10-80% от той дозы, которая обычно вводится в случае монотерапии. В соответствии с одним воплощением фармацевтические композиции по данному изобретению содержат дополнительный иммуномодулятор. Примеры дополнительных иммуномодуляторов включают, не ограничиваясь ими,-, - и -интерфероны. В соответствии с другим воплощением фармацевтические композиции по данному изобретению могут содержать дополнительно антивирусный препарат. Примеры антивирусных препаратов включают рибавирин и амантадин. В соответствии с еще одним альтернативным воплощением фармацевтические композиции по данному изобретению могут содержать дополнительно другие ингибиторы протеазыHCV. В соответствии с еще одним альтернативным воплощением фармацевтические компози 001915 30 ции по данному изобретению могут дополнительно включать ингибитор других мишеней в жизненном цикле HCV, таких как геликаза, полимераза или металлопротеаза. После достижения улучшения состояния пациента может вводиться поддерживающая доза соединения, композиции или комбинации по данному изобретению, если это необходимо. Соответственно, доза или частота введения могут быть снижены как функция симптомов до уровня, при котором улучшенное состояние сохраняется. После ослабления симптомов до желаемого уровня лечение должно быть прекращено. Однако пациентам может потребоваться интермиттирующее лечение на долгосрочной основе при возврате симптомов болезни. Как понятно специалисту, могут потребоваться более низкие или более высокие дозы,чем приведенные здесь. Конкретная доза и схема лечения для каждого индивидуального пациента будут зависеть от разнообразных факторов,включая активность используемого соединения,возраст, вес тела, общее состояние здоровья,пол, рацион питания, время введения, скорость экскреции, комбинацию с другими лекарственными препаратами, тяжесть и течение инфекции, предрасположенность пациента к данной инфекции и решения лечащего врача. Когда такие соединения или их фармацевтически приемлемые соли находятся в одном составе с фармацевтически приемлемым носителем, то полученная композиция может вводиться in vivo млекопитающим, таким как человек, для подавления активности серин-протеаз, в частности протеазы NS3 HCV, или для лечения или предупреждения вирусной инфекции, в частности вирусной инфекции HCV. Для такого лечения могут также использоваться соединения по данному изобретению в комбинации с препаратами, которые включают, не ограничиваясь ими, иммуномодуляторы, такие как -, и -интерфероны; другие антивирусные препараты, такие как рибавирин и амантадин; другие ингибиторы протеазы NS3 HCV; ингибиторы других мишеней в жизненном цикле HCV, таких как геликаза, полимераза или металлопротеаза,или внутреннее введение рибосом; или их комбинации. Эти дополнительные препараты могут комбинироваться с соединениями по данному изобретению при создании одной дозовой формы. Как вариант, эти дополнительные препараты могут вводиться млекопитающему отдельно как часть множественной дозовой формы. Соответственно, другое воплощение данного изобретения касается методов подавления активности серин-протеазы у млекопитающих путем введения соединения структурной формулы (I) или (II) и такими замещающими группами, как определено выше. Предпочтительно серин-протеаза представляет собой NS3 HCV. 31 В другом воплощении данное изобретение касается методов подавления HCV или активности NS3 HCV у млекопитающего, включающих стадию введения указанному млекопитающему соединения со структурной формулой (I) или(II) и такими замещающими группами, как определено выше. В еще одном альтернативном воплощении данное изобретение касается методов снижения активности серин-протeазы у млекопитающего,включающих стадию введения указанному млекопитающему любой из фармацевтических композиций и комбинаций, описанных выше. Если данная фармацевтическая композиция содержит только соединение по данному изобретению в качестве активного ингредиента, то такие методы могут дополнительно предусматривать стадию введения указанному млекопитающему препарата, выбранного из иммуномодулятора, антивирусного препарата, ингибитора протеазы HCV или ингибитора других мишеней в жизненном цикле HCV. Такой дополнительный препарат может вводиться млекопитающему до введения композиции ингибитора HCV,одновременно с ней или после нее. В предпочтительном воплощении эти методы используются для снижения активности протеазы NS3 HCV у млекопитающего. Если данная фармацевтическая композиция содержит в качестве активного ингредиента только соединение по данному изобретению, то такие методы могут дополнительно предусматривать стадию введения указанному млекопитающему препарата, выбранного из иммуномодулятора,антивирусного препарата, ингибитора протеазыHCV или ингибитора других мишеней в жизненном цикле HCV, таких как геликoза, полимераза или металлопротеаза. Такой дополнительный препарат может вводиться млекопитающему до введения композиций по данному изобретению, одновременно с ними или после них. В другом предпочтительном воплощении эти методы используются для подавления репликации вируса у млекопитающего. Такие методы используются в лечении или профилактике,например, вирусных заболеваний, таких какHCV. Если данная фармацевтическая композиция содержит в качестве активного ингредиента только соединение по данному изобретению, то такие методы могут дополнительно предусматривать стадию введения указанному млекопитающему препарата, выбранного из иммуномодулятора, антивирусного препарата, ингибитора протеазы HCV или ингибитора других мишеней в жизненном цикле HCV. Такой дополнительный препарат может вводиться млекопитающему до введения композиции по данному изобретению, одновременно с ней или после нее. Соединения, описанные здесь, могут использоваться также в качестве лабораторных реактивов. Соединения по данному изобрете 001915 32 нию могут также использоваться для лечения или предупреждения вирусной контаминации материалов и, следовательно, для снижения риска вирусной инфекции у лабораторного или медицинского персонала или у пациентов, которые контактируют с такими материалами. Эти материалы включают, не ограничиваясь ими,биологические материалы, такие как кровь,ткань и т.п.; хирургические инструменты и одежду; лабораторные приборы и одежду; а также аппараты и материалы для сбора крови. Для того чтобы данное изобретение было более понятным, приведены следующие примеры. Эти примеры служат только для целей иллюстрации и никоим образом не ограничивают область применения данного изобретения. Общие материалы и методы В примере 1 представлена общая методология синтеза, используемая для получения соединений по данному изобретению. Более конкретные методологии для получения соединений по данному изобретению, включая соединения 1-198, представлены в примерах 2-9. Данные ВЭЖХ, приведенные в табл. 1-7,выражены как градиент растворителя; время удерживания и % чистоты. Во всех методах использовалась деионизированная вода. Правильные (М + Н)+ и/или (М + Na)+ молекулярные ионы для всех соединений были получены с помощью матричной лазерной десорбционной масс-спектрометрииMALDI I) или электрораспылительной массспектрометрии (MICROMASS Quatro II). Пример 1. Многочисленные аминокислоты, используемые в синтезе пептидильных и пептидомиметических соединений по данному изобретению, можно приобрести, например, у SigmaAG (Швейцария). Те аминокислоты, которые приобрести нельзя, можно получить, используя известные способы синтеза ("Kinetic ResolutionPrep.Procerure Int., 24, 585-621 (1992), на которые здесь делаются ссылки). Некоторые соединения структурной формулы (I) или (II) могут быть синтезированы из аминокислот методами, которые хорошо из 33 вестны в области синтеза пептидов и органических химических соединений. Примеры таких методов синтеза описаны в Bodanszky and Bodanszky, "The Practice of Peptide Synthesis",Springer-Verlag, Berlin, Germany (1984), "TheAcademic Press, San Diego, CA (1993), на которые здесь делаются ссылки. Обычно, для синтеза фазы раствора амин аминокислоты, которая должна быть присоединена, защищается уретаном, таким как Воc, Cbz, Fmoc или Alloc, тогда как свободная карбоксильная группа активируется реакцией с карбодиимидом, таким как DCC, EDC или DIC,необязательно в присутствии катализатора, такого как НОВТ, HOAt, HOSu или DMAP. Пригодны также и другие методы, которую проходят через промежуточные стадии активированных сложных эфиров, галогенангидридов, активированных ферментом аминокислот и ангидридов, включая фосфониевые реактивы, такие как ВОР, Ру-ВОР, N-карбоксиангидриды, симметричные ангидриды, смешанные карбоновые ангидриды, карбонофосфиновые и карбонофосфорные ангидриды. После образования пептида защищающие группы могут быть удалены методами, описанными в перечисленных выше ссылках, такими как гидрогенирование в присутствии палладиевого, платинового или родиевого катализатора, обработка натрием в жидком аммиаке, соляной, фтористо-водородной, бромисто-водородной, муравьиной, трифторметансульфоновой или трифторуксусной кислоте,вторичными аминами, ионом фторида, триметилсилиловыми галогенидами, включая бромид и йодид, или щелочами. Автоматизация процесса синтеза с использованием описанных выше методов может быть осуществлена на серийно выпускаемом оборудовании, включающем, но не ограничиваясь ими,. Advanced Chemtech 357FBS и 496 MOS; Tecan CombiTec и Applied Biosystems 433A в числе другого оборудования. Конкретное применение этих методов и их эквивалентов в зависимости от целевого соединения будет очевидным для специалистов в данной области. Модификации химических процессов и выбор оборудования не выходят за рамки компетенции среднего специалиста. Пример 2. Соединения 1-26 (табл. 1) были получены,как показано на схеме 1. Синтез 301-306 Стадия А. Синтез 301. 4-метилбензгидриламиновая смола (1,05 ммоль/г, 20,0 г) помещалась в воронку из матированного стекла и промывалась диметилформамидом (375 мл),10% (о/о) диизопропилэтиламином (DIEA) в диметилформамиде (275 мл) и наконец диметилформамидом (475 мл). Достаточное количество диметилформамида добавлялось к смоле,чтобы получить суспензию, а затем 300 (8,0 г; 20,8 ммоль, полученного из (2S) 2-(третбутилоксикарбониламино)бутиральдегида в соответствии с А.М.al.,J.Am.Chem.Soc., 114, 3156-3157 (1992, 1-гидроксибензотриазола гидрат (НОВТН 2 О; 3,22 г; 21,0 ммоль), O-бензотриазол-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU; 8,0 г; 21,0 ммоль) и DIEA (11,0 мл; 63 ммоль). Реакционная смесь перемешивалась в течение ночи при комнатной температуре, для чего использовался шейкер. Смола выделялась на воронке из матированного стекла с помощью аспирационной фильтрации и промывалась диметилформамидом (375 мл). Непрореагировавшие аминогруппы затем удалялись с помощью реакции смолы с 20% (о/о) уксусным ангидридом/диметилформамидом (250 мл) непосредственно в воронке (10 мин/промывку). Смола промывалась диметилформамидом (375 мл) и дихлорметаном (375 мл) перед сушкой в течение ночи под вакуумом, чтобы получить 300 а(26,3 г; 81% выход). Защищающая группа t-Boc удалялась из смолы с помощью синтезатора пептидов Advanced ChemTech 396 по следующей методике. Смола 300 а (0,05 ммоль) вспучивалась промыв 35 кой дихлорметаном (31 мл) с последующим отщеплением защищающей группы t-Boc путем воздействия 50% (о/о) TFA/дихлорметаном (1,0 мл) в течение 10 мин (при встряхивании), а затем свежим реактивом (1 мл) в течение 30 мин. Смола затем промывалась дихлорметаном (31 мл), затем DMF (31 мл), затем 10%DIEA/диметилформамидом (о/о) (21 мл) и наконец N-метилпирролидоном (31 мл), чтобы получить смолу 301. Стадия В. Синтез 303. Это соединение получалось из смолы 301 (0,05 ммоль) с помощью синтезатора пептидов Advanced ChemTech 396. Смола 301 ацилировалась раствором 0,4 М 302 и 0,4 М НОВТ в N-метилпирролидоне (0,5 мл),раствором 0,4 М HBTU в N-метилпирролидоне(0,5 мл) и раствором 1,6 М DIEA в Nметилпирролидоне (0,35 мл); реакция протекала при встряхивании в течение 4 ч при комнатной температуре. Реакция сочетания повторялась. Смола затем промывалась диметилформамидом(31 мл), а затем дихлорметаном (31 мл),чтобы получить 303. Стадия С. Синтез 305. Синтез связанного со смолой соединения завершался с помощью синтезатора пептидов Advanced ChemTech 396. Смола 303 промывалась дихлорметаном (31 мл), после чего отщеплялась защитная группа tBoc путем воздействия 50% (о/о) TFA/дихлорметаном (1,0 мл) в течение 10 мин (при встряхивании), а затем свежим реактивом (1 мл) в течение 30 мин. Смола затем промывалась дихлорметаном (31 мл), затем DMF (31 мл),затем 10% DIEA/диметилформамидом (о/о) (21 мл) и наконец N-метилпирролидоном (31 мл), чтобы получить смолу 304. Эта смола затем ацилировалась раствором 0,4 М Fmoc-валина и 0,4 М НОВТ в N-метилпирролидоне (0,5 мл),раствором 0,4 М HBTU в N-метилпирролидоне(0,5 мл) и раствором 1,6 М DIEA в Nметилпирролидоне (0,35 мл); реакция протекала при встряхивании в течение 4 ч при комнатной температуре. Реакция сочетания повторялась. Автоматизированные циклы состояли из (1) промывки смолы диметилформамидом (31 мл); (2) отщепления защитных групп 25% (о/о) пиперидином в диметилформамиде (1 мл) в течение 3 мин, а затем свежим реактивом (1 мл) в течение 10 мин; (3) промывки смолы диметилформамидом (31 мл) и N-метилпирролидоном(31 мл) перед реакцией сочетания, как описано выше. Таким способом обеспечивалось сочетание Fmoc-валина и пиразин-2-карбоновой кислоты. Стадия D. Синтез 306. Перед отщеплением смола промывалась смесью 1:1 дихлорметана/метилового спирта (31 мл), а затем высушивалась под вакуумом. Альдегид отщеплялся от смолы путем обработки 95% TFA/5% H2O(о/о, 1,5 мл) в течение 30 мин при комнатной температуре или путем обработки тетрагидро 001915 36 фураном/30% формалином/1N HCl 9:1:1 (о:о:о) в течение 1 ч при комнатной температуре. После промывки смолы реактивом для отщепления(1 мл) объединенные фильтраты разбавлялись водой и лиофилизировались, чтобы получить неочищенное соединение 306 в виде белого порошка. Это соединение очищалось с помощью полупрепаративной ВЭЖХ с обращенной фазой на колонке Waters DeltaPak 300 А С 18 (15 мкм,30300 мм) с элюированием при линейном градиенте ацетонитрила, содержащем 0,1% TFA(о/о), за 45 мин при расходной скорости 20 мл/мин. Фракции, содержащие желаемый продукт, собирались и лиофилизировались, чтобы получить 306. Пример 3. Соединения 27-29 (табл. 1) были получены, как показано на схеме 2. Схема 2 Стадия А. Синтез 301. См. стадию А, методология схемы 1. Стадия В. Синтез 308. Смола 301 (6,0 г; 0,65 ммоль/г; 3,9 ммоль) вспучивалась в воронке из матированного стекла промыванием дихлорметаном (350 мл). Защитная группа Воc затем отщеплялась 50% (о/о) TFA/дихлорметаном (50 мл) в течение 10 мин (при периодическом перемешивании), а затем в течение 30 мин свежим реактивом (50 мл). Затем смола промывалась дихлорметаном (350 мл), диметилформамидом (250 мл), 10% DIEA/диметилформамидом(о/о) (250 мл) и наконец N-метилпирролидоном (350 мл). После перенесения смолы в 100 мл колбу, добавлялся N-метилпирролидон,чтобы получить суспензию, затем 307 (2,83 г; 8,0 ммоль), НОВТН 2O (1,22 г; 8,0 ммоль),HBTU (3,03 г; 8,0 ммоль) и DIEA (4,2 мл; 24 ммоль). Реакционная смесь перемешивалась в 37 течение ночи при комнатной температуре, для чего использовался шейкер. Выделение смолы и удаление непрореагировавших аминогрупп 20%(о/о) уксусным ангидридом в диметилформамиде осуществлялись, как описано для 301, чтобы получить 308 (6,86 г - количественный выход). Стадия С. Синтез 309. Это соединение получалось из смолы 308 (0,15 ммоль) с использованием синтезатора Tecan CombiTec. Смола 308(0,076 ммоль) промывалась диметилформамидом (2,5 мл) в течение 5 мин, а затем свежим реактивом (2 мл) в течение 20 мин. Полученная смола промывалась диметилформамидом (32,5 мл) и N-метилпирролидоном (32,5 мл) перед ацилированием раствором 0,4 М Fmocвалина и 0,4 М НОВТ в N-метилпирролидоне(0,8 мл), раствором 0,4 М HBTU в N-метилпирролидоне (0,8 мл) и раствором 1,6 М DIEA в Nметилпирролидоне (0,6 мл); реакция протекала при встряхивании в течение 8 ч при комнатной температуре. Реакция сочетания повторялась. Операции по отщеплению защитных групп и сочетанию повторялись, чтобы добавить второй остаток валина и последний остаток пиразин-2 карбоновой кислоты. Эта смола затем промывалась дихлорметаном (32,5 мл), чтобы получить смолу 309. Стадия D. Синтез 310. К смоле 309 добавляли 1:1 пиридин/дихлорметан (о/о) (1 мл), 0,8 М диметиламинопиридин в диметилформамиде(1,5 мл). Реакция протекала при встряхивании в течение 8 ч при комнатной температуре. Реакция ацилирования повторялась. Полученная смола промывалась дихлорметаном (32,5 мл), диметилформамидом (32,5 мл), дихлорметаном (32,5 мл) и наконец смесью 1:1 дихлорметана/метилового спирта (32,5 мл), чтобы получить смолу 310. Стадия Е. Синтез 311. Перед отщеплением смола промывалась смесью 1:1 дихлорметана/метилового спирта (31 мл), а затем высушивалась под вакуумом. Альдегид отщеплялся от смолы путем обработки тетрагидрофураном/формалином/уксусной кислотой/1N HCl 5:1:1:0,1 (о:о:о:о) в течение 1 ч при комнатной температуре. После промывки смолы реактивом для отщепления (1 мл) объединенные фильтраты разбавлялись водой и лиофилизировались,чтобы получить неочищенное соединение 311 в виде белого порошка. Это соединение очищалось с помощью полупрепаративной ВЭЖХ с обращенной фазой на колонке Waters DeltaPak 300 А С 18 (15 мкм, 30300 мм) с элюированием при линейном градиенте ацетонитрила, содержащем 0,1% TFA (о/о), за 45 мин при расходной скорости 20 мл/мин. Фракции, содержащие желаемый продукт, собирались и лиофилизировались, чтобы получить 311. 38 Пример 4. Соединения 30-56 (табл. 1) были получены, как показано на схеме 3. Схема 3 Стадия А. Синтез 301. См. стадию А, схема 1 методологии. Стадия В. Синтез 308. См. стадию В, схема 2 методологии. Стадия С. Синтез 312. Это соединение получалось из смолы 308 (0,15 ммоль) с помощью синтезатора Tecan CombiTec. Смола 308 промывалась толуолом (32,5 мл), а затем суспендировалась в толуоле (1,0 мл). К полученному добавлялся или раствор 0,8 М R3 -изоцианата в толуоле (1,0 мл), а затем 0,8 М DIEA в толуоле(1,0 мл), или раствор 0,8 М R3 -карбоновой кислоты с 0,8 М DIEA в толуоле (1,0 мл), а затем 0,8 М дифенилфосфорилазид в толуоле (1,0 мл). Реакция протекала при встряхивании в течение 8 ч при 55 С. Полученная смола затем промывалась толуолом (32,5 мл) и диметилформамидом (42,5 мл), чтобы получить смолу 312. Стадия D. Синтез 313. См. стадию D, схема 2 методологии. Стадия Е. Синтез 314. См. стадию Е, схема 2 методологии. Пример 5. Соединения 57-70 (табл. 1) были получены, как показано на схеме 4. Стадия А. Синтез 301. См. стадию А, схема 1 методологии. Стадия В. Синтез 316. Это соединение было получено из смолы 301 (0,05 ммол) с помощью пептидного синтезатора Advanced ChemTech 396. Смола 301 ацилировалась раствором 0,4 М 315 и 0,4 М НОВТ в N-метилпирролидонеDIEA в N-метилпирролидоне (0,35 мл), и реакция протекала при встряхивании в течение 4 ч при комнатной температуре. Реакция сочетания повторялась. Полученная смола затем промывалась диметилформамидом (31 мл), затем дихлорметаном (31 мл). Защищающая группа Воc затем отщеплялась 50% (о/о) TFA/дихлорметаном (1,0 мл) в течение 10 мин при перемешивании, а затем в течение 30 мин свежим реактивом (1,0 мл). Полученная смола затем промывалась дихлорметаном (31,0 мл), диметилформамидом (21,0 мл), 10% DIEA/диметилформамидом (о/о) (21,0 мл), диметилформамидом (31,0 мл) и наконец дихлорметаномHBTU в N-метилпирролидоне (0,5 мл) и раствором 1,6 М DIEA в N-метилпирролидоне (0,35 мл), и реакция протекала при встряхивании в течение 4 ч при комнатной температуре. Реакция сочетания повторялась. Полученная смола затем промывалась диметилформамидом (31 мл), чтобы получить 317 а. Стадия С. Синтез 317b. Смола 316 ацилировалась раствором 0,5 М Z-COCl в диметилформамиде (1 мл) и 1,6 М DIEA в N 001915 40 метилпирролидоне (0,35 мл), и реакция протекала при встряхивании в течение 2 ч при комнатной температуре. Стадия ацилирования повторялась. Полученная смола промывалась диметилформамидом (32,5 мл), чтобы получить смолу 317b. Стадия С. Синтез 317 с. Смола 316 реагировала с 1,0 М Z-хлоридом сульфонила в дихлорметане (0,5 мл) и 1 М пиридине в дихлорметане (0,60 мл) в течение 4 ч при комнатной температуре. Эта реакция повторялась. Полученная смола промывалась дихлорметаном (31,0 мл),а затем диметилформамидом (31,0 мл), чтобы получить смолу 317 с. Стадия С. Синтез 317d. Смола 316 реагировала с 0,5 М Z-изоцианатом в диметилформамиде (1,2 мл) в течение 8 ч при комнатной температуре. Эта реакция повторялась. Полученная смола промывалась диметилформамидом (31,0 мл), чтобы получить смолу 317d. Стадия С. Синтез 317 е. Смола 316 реагировала с 0,5 М Z-CHO в диметилформамиде (1,2 мл) в присутствии уксусной кислоты (0,1 мл) и цианоборогидрида натрия (200 мг) в течение 4 ч при комнатной температуре. Эта реакция повторялась. Полученная смола промывалась диметилформамидом (31,0 мл), чтобы получить смолу 317 е. Стадия D. Синтез 318. Синтез этого связанного со смолой соединения осуществлялся с помощью синтезатора пептидов AdvancedFmoc-валин и, наконец, пиразин-2-карбоновую кислоту. Стадия Е. Синтез 319. См. стадию Е, схема 2 методологии. Пример 6. Соединения 81-100 и 127-142 (табл. 3 и 4) были приготовлены, как показано на схеме 5. Схема 5 41 Стадия А. Синтез 301. См. стадию А, схема 1 методологии. Стадия В. Синтез 320. Синтез этого связанного со смолой соединения осуществлялся с помощью синтезатора пептидов AdvancedChemTech 396, начиная со смолы 165 (0,05 ммоль). Автоматизированные циклы, описанные для стадии С, схема 1, использовались для добавления Fmoc-A1, затем Fmoc-валина и, наконец, терминальной Fmoс-аминокислоты. ГруппаFmoc удалялась уже описанным способом 25% пиперидином/диметилформамидом (о/о), чтобы получить смолу 166. Стадия С. Синтез 321a. Смола 320 ацилировалась раствором 0,4 М Т-СO2 Н и 0,4 М НОВТ в N-метилпирролидоне (0,5 мл), раствором 0,4 МHBTU в N-метилпирролидоне (0,5 мл) и раствором 1,6 М DIEA в N-метилпирролидоне (0,35 мл), реакция протекала при встряхивании в течение 4 ч при комнатной температуре. Эта реакция сцепления повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта (о/о) (31 мл), чтобы получить смолу 321 а. Стадия С. Синтез 321b. Смола 320 ацилировалась 0,5 М Т-СОСl в диметилформамиде (1 мл) и 1,6 М DIEA в N-метилпирролидоне (0,35 мл), реакция протекала при встряхивании в течение 2 ч при комнатной температуре. Стадия ацилирования повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта (о/о) (31 мл), чтобы получить смолу 321b. Стадия С. Синтез 321 с. Смола 320 вступала в реакцию с 1,0 М Т-хлоридом сульфонила в дихлорметане (0,5 мл) и 1 М пиридином в дихлорметане (0,60 мл), которая продолжалась 4 ч при комнатной температуре. Эта реакция повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта(о/о) (31 мл), чтобы получить смолу 303 с. Стадия С. Синтез 321d. Смола 320 вступала в реакцию с 0,5 М Т-изоцианатом в диметилформамиде (1,2 мл), которая продолжалась 8 ч при комнатной температуре. Эта реакция повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта(о/о) (31 мл), чтобы получить смолу 321d. Стадия D. Синтез 322. Альдегид отщеплялся от смолы и полностью лишался защитных групп в результате обработки 95% TFA/5% Н 2 О(о/о, 1,5 мл) в течение 45 мин при комнатной температуре. После промывки смолы свежим реактивом для отщепления (1 мл) объединенные фильтраты добавлялись к холодной смеси 1:1 эфира/пентана (12 мл) и полученный осадок отделялся с помощью центрифугирования и 42 декантирования. Затем осадок растворяли в 10% ацетонитриле/90% Н 2O/0,1% TFA (15 мл) и лиофилизировали, чтобы получить неочищенный 322 в виде белого порошка. Это соединение очищалось с помощью полупрепаративной ВЭЖХ с обращенной фазой на колонке WatersDeltaPak 300 А С 18 (15 мкм, 30300 мм) с элюированием при линейном градиенте ацетонитрила, содержащем 0,1% TFA (о/о) за 45 мин при расходной скорости 20 мл/мин. Фракции,содержащие желаемый продукт, собирались и лиофилизировались, чтобы получить 322. Пример 7. Соединения 143-197 (табл. 6) были приготовлены, как показано на схеме 6. Схема 6 Стадия А. Синтез 301. См. стадию А, схему 1 методологии. Стадия В. Синтез 326. Данное соединение было получено из смолы 301 (0,50 ммоль) с помощью синтезатора пептидов Applied Biosystems модели 433 А. Аминокислоты, защищенныеN-Fmос, добавлялись к смоле 301 последовательно посредством стандартных циклов сочетания с использованием HBTU и HOBt в качестве добавок к N-метилпирролидону, чтобы получить смолу 326. Стадия С. Синтез 327 а. Этот синтез был осуществлен с использованием синтезатора пептидов Advanced ChemTech 396. Смола 326(0,05 ммоль) была лишена защитных групп с помощью обработки 25% (о/о) пиперидином в диметилформамиде (1 мл) в течение 3 мин, а затем свежим реактивом (1 мл) в течение 10 мин. Полученная смола промывалась диметилформамидом (31 мл) и N-метилпирролидоном(31 мл). Далее смола ацилировалась раствором 0,4 М Т-СО 2 Н и 0,4 М HOBT в N 43 метилпирролидоне (0,5 мл), раствором 0,4 М 15HBTU в N-метилпирролидоне (0,5 мл) и раствором 1,6 М DIEA в N-метилпирролидоне (0,35 мл), и реакция при встряхивании продолжалась 4 ч при комнатной температуре. Эта реакция сочетания повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта (о/о) (31 мл), чтобы получить смолу 327 а. Стадия С. Синтез 327b. Этот синтез был осуществлен с использованием синтезатора пептидов Advanced ChemTech 396. Смола 326(0,05 ммоль) была лишена защитных групп с помощью обработки 25% (о/о) пиперидином в диметилформамиде (1 мл) в течение 3 мин, а затем свежим реактивом (1 мл) в течение 10 мин. Полученная смола промывалась диметилформамидом (31 мл) и N-метилпирролидоном(31 мл). Далее смола ацилировалась с использованием 0,5 М Т-СОСl в диметилформамиде (1 мл) и 1,6 М DIEA в N-метилпирролидоне (0,35 мл) в течение 2 ч при комнатной температуре. Эта реакция сочетания повторялась. Затем смола промывалась диметилформамидом (31 мл),дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта (о/о) (31 мл),чтобы получить смолу 327b. Стадия С. Синтез 327 с. Этот синтез был осуществлен с использованием синтезатора пептидов Advanced ChemTech 396. Смола 326(0,05 ммоль) была лишена защитных групп с помощью обработки 25% (о/о) пиперидином в диметилформамиде (1 мл) в течение 3 мин, а затем свежим реактивом (1 мл) в течение 10 мин. Полученная смола промывалась диметилформамидом (31 мл) и дихлорметаном (31 мл). Затем смола вступала в реакцию с 1,0 М Тхлоридом сульфонила в дихлорметане (0,60 мл),которая продолжалась 4 ч при комнатной температуре. Эта реакция повторялась. Затем смола промывалась диметилформамидом (31 мл),дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта (о/о) (31 мл),чтобы получить смолу 327 с. Стадия С. Синтез 327d. Этот синтез был осуществлен с использованием синтезатора пептидов Advanced ChemTech 396. Смола 326(0,05 ммоль) была лишена защитных групп с помощью обработки 25% (о/о) пиперидином в диметилформамиде (1 мл) в течение 3 мин, а затем свежим реактивом (1 мл) в течение 10 мин. Полученная смола промывалась диметилформамидом (31 мл). Затем смола вступала в реакцию с 0,5 М Т-изоцианатом в диметилформамиде (1,2 мл), которая продолжалась 8 ч при комнатной температуре. Эта реакция повторялась. Затем смола промывалась диметилформамидом (31 мл), дихлорметаном (31,0 мл) и смесью 1:1 дихлорметана/метилового спирта(о/о) (31 мл), чтобы получить смолу 327d. 44 Стадия D. Синтез 328. См. стадию D, схему 1 методологии. Пример 8. Соединения 79-80 и 101-123 (табл. 2, 3 и 4) были получены, как показано на схеме 7. Схема 7 Стадия А. Синтез 330. 2-Хлорхлортритиловая смола (2,2 ммоль/г; 1,69 г) вступала в реакцию с 329 (0,385 г; 1,1 ммоль), полученной в соответствии с S.L. Harbeson et al.,J.Med.Chem., 37, 2918 (1994 в дихлорметане в присутствии DIEA (0,47 мл; 2,7 ммоль), которая протекала при комнатной температуре в течение 1 ч. Реакция гасилась добавлением метилового спирта, после чего смола выделялась на воронке из матированного стекла с помощью аспирационной фильтрации и промывалась дихлорметаном (325 мл). Затем смола высушивалась в течение ночи под вакуумом, чтобы получить 330 (1,92 г; 0,49 мэк/г). Стадия В. Синтез 332. Синтез этого связанного со смолой соединения осуществлялся с помощью синтезатора пептидов Applied Biosystems модели 433 А, начиная со смолы 330 (0,74 ммоль). Автоматизированные циклы, описанные для стадии С, схема 1, использовались для добавления Fmoc-A1, затем Fmoc-A2 и, наконец,Fmoc-A3. Группа Fmoc удалялась уже описанным способом 25% пиперидином/диметилформамидом (о/о), чтобы получить смолу 332. Стадия С. Синтез 333. Перед отщеплением смола промывалась смесью 1:1 дихлорметана/метилового спирта (31 мл), после чего высушивалась под вакуумом. Пептид отщеплялся от смолы посредством обработки уксусной кислотой:трифторэтанолом:дихлорметаном (1:1:3) в течение 1 ч при комнатной температуре. После промывки смолы дихлорметаном объединенные фильтраты концентрировались под вакуумом, чтобы получить неочищенный 333 в виде белого порошка (0,48 г; 76%).(0,20 ммоль) и РуВrор (0,12 ммоль). Реакция протекала при перемешивании в течение 2 ч при 70 С. Реакционная смесь затем разбавлялась водой (8 мл) и центрифугировалась, чтобы получить осадок. Осадок высушивался под вакуумом и давал неочищенное соединение 334, которое затем подвергалось окислению непосредственно в соединение 335. Неочищенное соединение 334 растворялось в N-метилпирролидоне(3 мл) и вступало в реакцию с Dess-Martin периодинаном (110 мг; 0,26 ммоль), которая протекала в течение ночи при комнатной температуре. Насыщенный водный раствор бикарбоната натрия (5 мл) и 10% (в/о) водный раствор тиосульфата натрия (5 мл) добавлялись к реакционной смеси, перемешивались, после чего добавлялась вода (40 мл). Осадок отделялся центрифугированием, твердая фаза высушивалась под вакуумом. При необходимости, кислотолабильные защищающие группы удалялись посредством обработки смесью 1:1 трифторуксусной кислоты и дихлорметана при комнатной температуре в течение 30 мин. Растворитель удалялся под вакуумом и неочищенное соединение очищалось с помощью полупрепаративной ВЭЖХ с обращенной фазой на колонкеWaters DeltaPak 300 А С 18 (15 мкм, 30300 мм) с элюированием при линейном градиенте ацетонитрила, содержащего 0,1% TFA (о/о), за 45 мин при расходной скорости 20 мл/мин. Фракции, содержащие желаемый продукт, собирались и лиофилизировались, чтобы получить 335. Пример 9. Соединения 71-78 и 124-126 были получены из соответствующих кислот с защищенными пептидами. Кислоты с защищенными пептидами получались, как было описано в схеме 7, с использованием 2-хлорхлортритиловой смолы. Эти пептидные кислоты затем сочетались с одной из следующих групп с использованием стандартной методологии сочетания пептидов в фазе раствора. Ссылки, в которых описано получение этих групп, также приведены.E. Edwards, et al., J. Medicinal Chemistry,38, 3972-3982 (1995). При необходимости, полученные продукты окислялись до кетонов с помощью периодинана Desws Martin, как описано для схемы 7. При необходимости, кислотолабильные защищающие группы удалялись посредством обработки смесь 1:1 трифторуксусной кислоты и дихлорметана при комнатной температуре в течение 30 мин. Растворитель удалялся под вакуумом, а неочищенное соединение очищалось с помощью полупрепаративной ВЭЖХ с обращенной фазой на колонке Waters DeltaPak 300 А С 18 (15 мкм, 30300 мм) с элюированием при линейном градиенте ацетонитрила, содержащем 0,1% TFA (о/о), за 45 мин при расходной скорости 20 мл/мин. Фракции, содержащие желаемый продукт, собирались и лиофилизировались, чтобы получить готовые продукты 71-78 и 124-126. Пример 10. Соединение 198 было получено с помощью модифицированной общей методологии,описанной в примере 1. Таблица 2 Структуры и аналитические данные соединения 71-79 Таблица 4 Структуры и аналитические данные соединения 89-126 Таблица 3 Структуры и аналитические данные соединения 80-88 55 Таблица 5 Структуры и аналитические данные соединения 127-142 56 Таблица 6 Структуры и аналитические данные соединения 143-197 Таблица 7 Структура и аналитические данные соединение 198 Пример 11. Поскольку соединения структурной формулы (I) и (II) способны подавлять серинпротеазу NS3, то они обладают очевидной клинической полезностью для лечения вирусных заболеваний, включая HCV. Эти тесты позволяют предсказывать способность соединений подавлять HCV in vivo. Пептиды и пробы. Пептиды EDVV AbuCSMSY (Abu означает аминомасляную кислоту), DEMEECSQHLPYI,ECTTPCSGSWLRD и EDW AbuC-p-нитроанилид приобретались у фирмы "AnaSpec Inc."(Сан Хосе, Калифорния, США). Содержание пептида в очищенных лиофилизированных пептидах и пептидах собственного производства определялось с помощью количественного анализа на азот, и соответствующие величины использовались при приготовлении основных растворов пептидов (Galbreath). Определения рКа осуществлялись фирмой "Robertson Microlit Laboratories, Inc." (Мэдисон, Нью Джерси, США). ВЭЖХ пробы на расщепление выполнялись с использованием от 25 нМ до 3,0 мкМ фермента в 100 мкл объемах при 30 С, содержащих 50 мМ HEPES-KOH (рН 7,8), 100 мМNaCl, 20% глицерина, 5 мМ DTT и соответствующее количество субстрата (в DMSO), с пептидом NS4A или без него, таким образом, чтобы окончательная концентрация DMSO (=ДМСО) не превышала 4%. Отдельными контрольными экспериментами было подтверждено, что такое содержание ДМСО не оказывает влияния на активность фермента. Реакции расщепления гасились путем добавления равного объема смеси из 10% TFA и ацетонитрила (1:1) с оценкой активности на колонке ВЭЖХ с обращенной фазой (Rainin C18 Microsorb-MV, 5 мм, 4,6250 мм; 0-50% ацетонитрила, 0,1% TFA3,33%min) при использовании прибора Hewlett Packard 1050 с автовпрыскиванием и диодным детектированием при 210 и 280 нм (что подходит). Фрагменты целевого пептида, выделенные промыванием, собирались и идентифицировались с помощью масс-спектрометрии и анализа Nтерминальной последовательности. Идентичность и концентрация фрагмента подтверждались также с помощью аутентичных синтезиро 60 ванных продуктов. Начальные скорости расшепления определялись при 20% конверсии субстрата, а каталитические параметры определялись в предположении кинетики MichaelisMenten с использованием программного обеспечения MultiFit ("Day Computing", Массачусетс, США). Спектрофотометрические анализы проводились с использованием 96-луночной пластинки для микротитрования при 30 С и считывателя SpectrMax 250 ("Molecular Devices", Саннивейл, Калифорния, США) с кинетическими возможностями. Расщепление субстрата EDWAbuC-p-нитроанилида (5A-pNA) осуществлялось с NS44 или без него в том же буфере, который использовался в ВЭЖХ анализах при 30 С,и высвобождение pNA контролировалось при 405 нм. Коэффициент экстинкции рнитроанилида зависит от рН при его значениях 5,5 и выше [Тирру, Н., et al., Норре-Seyler'sZ.Physiol.Chem., 329, pp. 278-288 (1962)]; Raybuck and Luong, неопубликованные наблюдения). Процент ДМСО не превышал 4% в этих анализах. Определение зависимости Vmах, Кm иVmax/Km от рН осуществлялось с помощью серии буферов с постоянной ионной силой, содержащих 50 мМ MES, 25 Nm Tris, 25 мМ этаноламина и 0,1 М NaCl [Morrison, L.F. and Stone,R.F., Biochemistry, 27, pp. 5499-5506 (1988)]. Точка перегиба для log V данных вычислялась с помощью нелинейной подгонки этих данных методом наименьших квадратов к уравнениюPress: New York; Vol., pp. 138-164 (1979)]. Точки перегиба для log(V/K) данных вычислялись с помощью нелинейной подгонки этих данных методом наименьших квадратов к уравнениюPress: New York; Vol., pp. 138-164 (1979)]. В обоих случаях использовалась программа KineTic ("BioKin Ltd."). Кинетические константы для быстрой равновесной реакции упорядоченного биосубстрата определялись по данным зависимости скорости от [4 А], [EDVV AbuC-pNA] с помощью нелинейной подгонки по методу наименьших квадратов к уравнению 1 [Morrison, J.F., Biochim.Biophys. Acta, 185, pp. 269-286 (1969)], как описано в тексте. Величины Кii и Kis для пептидильных ингибиторов определялись по данным зависимости скорости от [ингибитора], [субстрата] и подгонке к уравнению для смешанного ингибирования: Скорость=Vmax[S]/Km(1+[I]/Kis)+[S](1+[I]/Kii) Для обеих операций использовалась серийная программа Kinet-Asyst (StateCollege, PA). Величины Ki вычислялись по графикам зависимости скорости от [ингибитора] с помощью нелинейной подгонки данных по методу наименьших
МПК / Метки
МПК: A61P 1/16, C07K 5/10, A61K 38/55
Метки: серин-протеаз, протеазы, вируса, гепатита, hvc, ингибиторы, частности
Код ссылки
<a href="https://eas.patents.su/30-1915-ingibitory-serin-proteaz-v-chastnosti-ns3-proteazy-virusa-gepatita-c-hvc.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы серин-протеаз, в частности ns3 протеазы вируса гепатита c (hvc)</a>
Предыдущий патент: Способ получения бензотиофенов.
Следующий патент: Способ получения триметилгидрохинона
Случайный патент: Предмет одежды и способ его изготовления