Способ получения бензотиофенов.
Формула / Реферат
I. Способ получения соединения формулы Ib
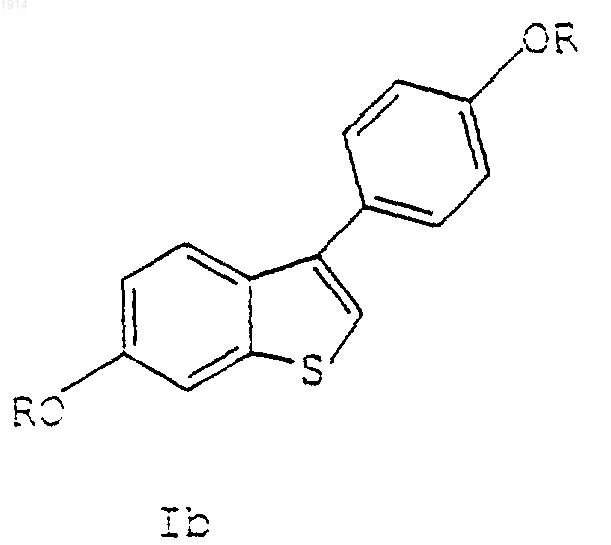
где группы R являются одинаковыми или различными и представляют С1-С6 алкил, который включает циклизацию диалкокси соединения формулы II
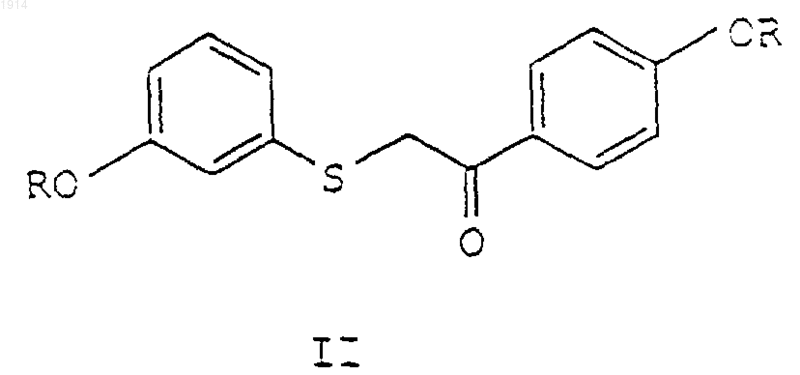
в присутствии катионообменной смолы.
2 . Способ по п.1, где R является метилом.
3. Способ по п.1, где упомянутая катионообменная смола является сульфокислотной смолой на основе полистирола.
4. Способ по п.1, который дополнительно включает контактирование реакционной смеси с метансульфокислотой в толуоле.
5. Способ по п.4 , который дополнительно включает контактирование упомянутой реакционной смеси с гептаном.
6. Способ по п.5, который дополнительно включает контактирование упомянутой реакционной смеси с изопропанолом.
7. Способ по п.1, где упомянутую циклизацию проводят при температуре примерно от 70 до примерно 90шС.
8. Способ по п.1, где упомянутый способ проводят как периодический процесс.
9. Способ по п.1, где упомянутый способ проводят как непрерывный процесс.
Текст
1 Это изобретение относится к области фармацевтической химии и обеспечивает преимущественный способ получения группы бензотиофенов из диалкоксиацетофенонов. Способ обеспечивает желаемые соединения с высоким выходом в большом объеме. Получение бензотиофенов через диалкоксибензотиофеновое промежуточное производное было ранее описано в патенте US 4380635,раскрытие которого включено здесь в качестве ссылки, в котором показана внутримолекулярная циклизация-(3-метоксифенилтио)-4 метоксиацетофенона в присутствии полифосфорной кислоты (РРА). Нагревание исходного ацетофенона в РРА при примерно 85 С в течение 1 ч обеспечивает смесь двух изомеров примерно в соотношении 3:1, 6-метокси-2-(4 метоксифенил)бензо[b]тиофена и 4-метокси-2(4-метоксифенил)бензо[b]тиофена. Однако, когда эту реакцию проводят в промышленном масштабе, изомерные бензотиофены выпадают в осадок и образуют густую пасту, которую невозможно адекватным образом перемешивать в обычном промышленном оборудовании. Для преодоления проблемы, вызываемой пастой, Guy et. al., Synthesis, 222 (1980) пытались использовать растворитель в другой реакционной схеме. Однако, когда этот подход применили для данной схемы, то добавление растворителя привело к неполной циклизации исходного ацетофенона, неполной перегруппировке 6-метокси-3-(4-метоксифенил)бензо[b]тиофена и значительно увеличило время реакции. Таким образом, имеется необходимость в улучшенном способе, который использует альтернативные катализаторы для превращения производных диалкоксиацетофенона в бензотиофены с подходящими выходами и приемлемым временем реакции. Настоящее изобретение обеспечивает способ получения бензотиофенов, использующий катионообменную смолу. Данное получение основано на внутримолекулярной циклизации производного диалкоксиацетофенона с образованием бензотиофена. Таким образом изобретение обеспечивает способ получения соединения формулы I где радикалы R являются одинаковыми или различными и представляют C1-C6 алкил; который включает циклизацию соединения формулы II где радикалы R определены выше, в присутствии катионообменной смолы. Бензотиофен является ключевым промежуточным соединением в синтезе ралоксифена,модулятора избирательного эстрогенного рецептора или SERM. В дополнении к обеспече 001914 2 нию улучшенного способа получения этого промежуточного соединения, дополнительно настоящее изобретение обеспечивает улучшенный способ получения соединения формулы III где R1 и R2 независимо являются C1-C6 алкилом или соединяются с образованием, вместе с азотом, с которым они связаны, пиперидинила,пирролидинила, метилпирролидинила, диметилпирролидинила или гексаметиленимино или его фармацевтически приемлемых солей или сольватов; который включает циклизацию соединения формулы II где радикалы R являются одинаковыми или различными и представляют C1-C6 алкил, в присутствии катионообменной смолы. Многие исходные материалы и соединения, приготовленные по способу этого изобретения, дополнительно предоставлены в патентахUS 4133814 и US 4380635, раскрытие которых включено здесь в качестве ссылки. В данном описании все значения температуры будут выражены в градусах Цельсия. Все количества, соотношения, концентрации, пропорции и тому подобное будут выражены в весовых единицах, если не указано иначе, за исключением соотношений растворителей, которые находятся в объемных единицах. Термин "кислотный катализатор", используемый здесь, представляет кислоту Льюиса или кислоту Бренстеда. Представителями кислот Льюиса являются хлорид цинка, йодид цинка,хлорид алюминия и бромид алюминия. Представители кислот Бренстеда включают неорганические кислоты, такие как серная и фосфорная кислоты, карбоновые кислоты, такие как уксусная и трифторуксусная кислоты, сульфокислоты, такие как метансульфокислота, бензолсульфокислота, 1-нафталинсульфокислота,1-бутансульфокислота, этансульфокислота, 4 этилбензолсульфокислота, 1-гексансульфокислота, 1,5-нафталинсульфокислота, 1-октансульфокислота, камфорсульфокислота, трифторметансульфокислота и п-толуол-сульфокислота. Кроме того, "кислотный катализатор" включает катионообменные смолы, которые можно также отнести к кислотным катализаторам на основе смол. Эти катионообменные смолы по определению являются нерастворимыми, кислотными смолами. Упомянутые катионообменные смолы включают, но не ограничиваются ими, катионообменники на декстране, такие, например, как СМ Сефадекс (карбоксиметил Сефадекс), SP Сефадекс (сульфопропил Сефадекс) и тому по 3 добное; катионообменники на агарозе такие,например, как СМ Сефароза, S Сефароза и тому подобное; катионообменники на целлюлозе такие, например, как СМ Целлюлоза, Фосфатцеллюлоза, Сульфоксиэтилцеллюлоза и тому подобное; катионообменники на основе полистирола такие, например, как сульфонированные полистироловые смолы (которые обычно различаются по общему числу остатков сульфокислоты на смоле), включающие Амберлист XN1010, Амберлист 15, Амберлит ХЕ 586 и тому подобное; сульфонированные полифторкарбоновые смолы, включающие смолы Нафион-НR; Оксицеллюлозу; смолы SP ТрисакрилR, такие,например, как SP Трисакрил Плюс MR и SP Трисакрил Плюс LSR; поли(N-трис[гидроксиметил]метилметакриламидную смолу и тому подобное. Термин "галоген" относится к группе фтора, хлора, брома или йода. Термин "C1-C6 алкил" представляет нормальную или разветвленную алкильную цепь,имеющую от одного до шести атомов углерода. Типичные C1-C6 алкильные радикалы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторичный бутил, третичный бутил, нпентил, изопентил, н-гексил, 2-метилпентил и тому подобное. Термин "C1-C6 алкил" означает нормальную или разветвленную алкильную цепь, имеющую от одного до четырех атомов углерода и включает метил, этил, н-пропил,изопропил, н-бутил, вторичный бутил, изобутил и третичный бутил. Соответствующие активирующие эфирные группы известны в этой области. Многочисленные реакции для образования и удаления защитных групп описаны в ряде классических работ, включая, например, Protective Groups inThe Peptides, Vol. I, Schrooder and Lubke, Academic Press (London and New York, 1965). В этой области техники известны способы неизбирательного в отношении участка молекулы удаления оксизащитных групп, особенно метила. Соединения формулы III, которые предварительно были защищены в 6- и 4'-положении метоксигруппой, могут быть избирательно расщеплены с образованием соединений формулы III с 4'мeтoкcигpyппoй. В целом, способ отщепления метоксигруппы в 4'-положении включает взаимодействие 6-, 4'-диметоксисубстрата с деметилирующим реактивом, выбранным из группы трибромида бора, трихлорида бора или трийодида бора, или с АlСl3, или различными тиоловыми реагентами, таким как EtSH. Реакцию проводят в инертной атмосфере, такой как азот,с одним или более молями реагента на моль метоксигруппы, которую отщепляют. Подходящими растворителями для реакции снятия защиты являются такие растворите 001914 4 ли или смеси растворителей, которые остаются инертными в течение реакции деметилирования. Галоидированные растворители, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, или ароматические растворители, такие как бензол или толуол, являются предпочтительными. Используемая в этой реакции температура должна быть достаточной для полного завершения реакции деметилирования. Однако полезно сохранять температуру ниже 0 С для того, чтобы максимально увеличить избирательность отщепления 4'-метоксигруппы и избежать образования нежелательных побочных продуктов, особенно продукта 6, 4'-дигидроксианалога, образующегося при интенсивном протекании деметилирования. При предпочтительных условиях реакции избирательно деалкилированный продукт будет образовываться после перемешивания реакционной смеси в течение примерно 124 ч. В предпочтительном варианте используется трибромид бора в количестве примерно 1,5 молей на один моль 6-, 4'-диметоксисубстрата в дихлорметане в атмосфере азота при температуре -20 С в течение 1-4 ч. Исходные материалы для способов настоящего изобретения можно получить многочисленными путями, включая таковые, раскрытые в патентах US 4133814 и US 4380635. Способ получения соединения формулы I, как обеспечено данным изобретением, показан ниже на схеме I. Схема I Весь реакционный способ включает первую стадию циклизации и последующую стадию перегруппировки. Соединение формулы I является желаемым продуктом. Реакция циклизации на первой стадии протекает с различными кислотными катализаторами и в целом происходит примерно в 50-100 раз быстрее, чем последующая реакция перегруппировки. Данное изобретение использует катионообменную смолу в качестве кислотного катализатора. Скорость реакции циклизации можно увеличить при увеличении количества используемой в реакционной смеси смолы. Исследовано влияние загрузки катализатора на выходе реак 5 ции при использовании смолы А 15 в качестве катионообменной смолы. При уровне 5-33 мл катализатора/г реагента эффекта на выход или уровень образования деметилированного продукта не было. Однако скорость реакции была прямо пропорциональна загрузке катализатора. На стадии циклизации можно использовать любую катионообменную смолу или комбинацию катионообменных смол. Для осуществления на практике настоящего изобретения предпочтительны катионообменные смолы на основе полистирола. Особенно предпочтительны сульфокислотные катализаторы на основе полистирола. Катионообменные смолы можно легко отделить от общей реакционной смеси любыми способами, включающими, но не ограничивающимися фильтрованием, и любые извлеченные смолы можно использовать повторно. Фильтрование можно проводить любыми способами,включая использование ватмановской бумаги,сита с отверстиями 100 меш, картриджей для фильтрования с порами 5-20 микрон и тому подобное. Реакцию обычно проводят при нагревании с обратным холодильником с азеотропным удалением воды. Влияние воды на активность сульфокислотных смол в некоторых реакциях ранее обсуждалось в A.R. Pitochelli, Ion Exchange Catalysis and Matrix Effects, брошюре,опубликованной RohmHaas, Inc. 1975. Смотри также G. Zundel, Hydration and IntermolecularInteraction Infrared Investigations with Polyelectroyte Membranes, Academic Press, New York,1969 and G. Zundel et. al. Physik. Chem, 59, 225,1968. Во время реакции могут образоваться различные побочные деметилированные продукты. Структуры 4 различных деметилированных побочных продуктов приведены на схеме II ниже: Схема II Изомеры А и В являются производными соединения формулы Iа', в то время как изомеры С и D являются производными соединения формулы I. Обычно соотношение изомеровA:B:C:D в обычной реакционной смеси приблизительно равняется 1:1:9:9. Изомеры были идентифицированы с помощью ВЭЖХ. Соотношение изомеров и, следовательно, общий выход определяли в кинетически контролируемой реакции циклизации. При использовании катионообменной смолы в толуоле на стадии циклизации получили предпочтительное соотношение изомеров 88:12 (I/la') по сравнению с соотношением изомеров 75:25, полученное при использо 001914 6 вании на стадии циклизации полифосфорной кислоты. Дополнительного равновесия между орто- и параизомерами во время данного способа не наблюдали. Реакция перегруппировки является термодинамически контролируемой реакцией. Константы равновесия для упомянутой реакции являются следующими: K1100, в то время как К 2 составляет примерно 7-9. При использовании катионообменной смолы и толуол/гептан в качестве системы растворителей соединение Iа по мере образования выпадает в осадок, посредством чего реакция движется к завершению. Перегруппировка нежелательного изомера, соединения lb' шла в 3-5 раз быстрее, чем перегруппировка желаемого изомера, соединения формулыIb. Растворители, включающие смеси растворителей и сорастворителей, используемые при осуществлении на практике настоящего изобретения, могут оказывать влияние на реакцию в целом, включая продукты реакции и общий выход. Обычно выбранным растворителем является очень слабое основание. Кроме того, растворитель не должен сольватировать протон в сульфокислоте на смоле. Предпочтительным растворителем для осуществления на практике настоящего изобретения является ароматический растворитель, вместе с тем приемлемые результаты получают как с алифатическими, так и хлорированными растворителями. Примеры растворителей включают толуол, гептан, ксилол, хлорбензол, диметоксиэтан и тетрахлорэтилен. Предпочтительным для осуществления на практике настоящего изобретения является толуол. Особенно предпочтительным является толуол с добавленной метансульфокислотой. Добавленная метансульфокислота способствует протеканию последующей реакции перегруппировки. Необходимо добавить к толуолу достаточное количество метансульфокислоты, чтобы образовалась отдельная фаза MSA. Гептан является дополнительным предпочтительным растворителем, который оказывает воздействие на кристаллизацию бензотиофеновых продуктов. Данная кристаллизация приводит к значительному снижению растворимости вышеупомянутых продуктов, приводя в результате к равновесию в реакции. Лучше всего добавить гептан в реакционную смесь перед наступлением равновесия. По изобретению реакцию циклизации проводят при значениях температуры примерно от 50 С до примерно 110 С, предпочтительно примерно от 75 С до 110 С и наиболее предпочтительно примерно от 80 С до 110 С. Выход реакции циклизации является одинаковым, если реакцию проводят при нагревании с обратным холодильником или при 70 С. Однако, нагревание с обратным холодильником является весьма предпочтительным, поскольку скорость реакции в 10-20 раз выше. Использование более высоких 7 значений температуры во время реакции является нежелательным, поскольку это может привести к повышенному уровню деметилированных побочных продуктов. Исходный ацетофенон нагревается в присутствии катионообменной смолы и толуола, по меньшей мере, в течение 30 мин и предпочтительно примерно от 60 до 180 мин. Практически ацетофенон циклизуется примерно при 110 С примерно в течение 3-5 ч. Вслед за первоначальным периодом нагревания реакцию охлаждают до температуры примерно от 50 С до 90 С и катионообменную смолу удаляют фильтрованием. Если реакцию охлаждают ниже 50 С, может иметь место незначительное осаждение бензотиофена, которое является функцией протекания перегруппировки, проходящей на стадии циклизации. Обычно на стадии циклизации происходит 1-7% перегруппировки. Обычно реакция перегруппировки протекает в присутствии метансульфокислоты и толуола в реакционной смеси. Дальнейшее добавление гептана в это время является необязательным, но может обеспечить повышенный выход реакции. Увеличение температуры от 90 С до 106 С после добавления гептана во время реакции является нежелательным вследствие отрицательного влияния на выход. В конце реакции перегруппировки для остановки реакции можно дополнительно добавить пригодный растворитель или смесь растворителей. В примеры пригодного растворителя входит, но им не ограничиваются, изопропанол(IPA) и тому подобное. Добавление этого растворителя понизит растворяемость продукта и также повысит его чистоту. Весь способ можно проводить, как синтез в "одном сосуде", периодически, полунепрерывно, непрерывно и тому подобное. Специалист в этой области техники оценит различия между этими способами, включая, какую реакцию следует использовать для данной цели. Например, в полунепрерывном и непрерывном процессе исходный материал и растворитель подают на колонку, наполненную твердой кислой смолой. Извлечение и выделение избытка растворителя и продукта можно выполнять перегонкой. Дополнительно, реакцию необязательно проводят в присутствии органического растворителя, который образует азеотропную смесь с водой, и таким образом способствует удалению побочного продукта азеотропной перегонкой во время реакционного процесса. Примеры таких растворителей, которые можно использовать, включают ароматические углеводороды, такие как бензол, толуол, ксилол и подобные. Бензотиофеновый продукт можно выделить обычным экстракционным методом путем добавления воды, разделением слоев, необязательно повторным экстрагированием водного слоя органическим растворителем, объединени 001914 8 ем органических слоев и концентрированием объединенных органических слоев. Когда исходным материалом является метоксипроизводное, желаемое 6-алкоксисоединение кристаллизуется в концентрированном растворителе, в то время как 4-алкоксиизомер остается в растворе. Желаемое 6-алкоксисоединение собирают фильтрованием. При предпочтительном способе циклизации по изобретению исходным материалом является -(3-метоксифенилтио)-4-метоксиацетофенон, который в результате циклизации дает 6 метокси-2-(4-метоксифенил)бензо[b]тиофен. Это соединение в последующем можно превратить в соединение формулы III, например, такое как 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 аминоэтокси)бензоил]бензо[b]тиофен. Превращение 6-алкокси-2-(4-алкоксифенил)бензо[b]тиофена в соединения формулы III можно провести по реакциям, предоставленным в патенте US 4380635. Соединения формулы III очень часто применяют в форме аддитивных солей кислоты. Соли удобно образуются, как это обычно бывает в органической химии, при взаимодействии соединения, приготовленного по данному изобретению, с подходящей кислотой. Соли быстро образуются с высоким выходом при средних значениях температуры и часто образуются уже просто при выделении соединения из подходящей кислотной промывной жидкости на конечной стадии синтеза. Например, соли могут образоваться с неорганическими и органическими кислотами. Типичные неорганические кислоты, используемые для образования таких солей, включают хлористо-водородную,бромистоводородную, йодисто-водородную, азотную,серную, фосфорную и фосфорноватую и тому подобное. Можно также использовать соли,производные органических кислот, таких как алифатические моно- и дикарбоновые кислоты,алкановые кислоты, фенилзамещенные алкановые кислоты, одно- и двухосновные гидроксиалкановые кислоты, ароматические кислоты,алифатические и ароматические сульфокислоты. Таким образом, подобные фармацевтически приемлемые соли включают ацетат, фенилацетат, трифторацетат, акрилат, аскорбат, бензоат,хлорбензоат, динитробензоат, гидроксибензоат,метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират, фенилбутират, -гидроксибутират, бутин 1,4-диоат, гексин-1,4-диоат, капрат, каприлат,хлорид, циннамат, цитрат, формиат, фумарат,гликолят, гептаноат, гиппурат, лактат, малат,малеат, гидроксималеат, малонат, манделат,месилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, дигидрофосфат, моногидрофосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, 9 салицилат, себацат, сукцинат, суберат, сульфат,бисульфат, пиросульфат, сульфит, бисульфит,сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,п-толуолсульфонат, ксилолсульфонат, тартрат и тому подобное. Предпочтительной солью является гидрохлорид. В качестве дополнительной иллюстрации всего раскрываемого здесь способа предоставляется следующая группа соединений:-6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 диметиламиноэтокси)бензоил]бензо[b]тиофен; 3-[4-(2-этоксиметиламиноэтокси)бензоил]6-гидрокси-2-(4-гидроксифенил)бензо[b]тиофен; 3-[4-(2-этоксиизопропиламиноэтокси)бензоил]6-гидрокси-2-(4-гидроксифенил)бензо[b]тиофен; 3-[4-(2-дибутиламиноэтокси)бензоил]-5 гидрокси-2-(4-гидроксифенил)бензо[b]тиофен; 3-[4-(2-(1-метилпропил)метиламиноэтокси)бензоил]-6-гидрокси-2-(4-гидроксифенил)бензо[b]тиофен; 6-гидрокси-2-(4-гидроксифенил)-3-[4-[2 ди(2-метилпропил)аминоэтокси]бензоил]бензо[b]тиофен; 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 пирролидиноэтокси)бензоил]бензо[b]тиофен; 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 пиперидиноэтокси)бензоил]бензо[b]тиофен; 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 морфолиноэтокси)бензоил]бензо[b]тиофен; 3-[4-(2-гексаметилениминоэтокси)бензоил]-6 гидрокси-2-(4-гидроксифенил)бензо[b]тиофен. Для лучшего разъяснения осуществления на практике настоящего изобретения представлены следующие примеры, и никоим образом их не следует рассматривать в качестве ограничения вышеупомянутого. Специалисты в этой области техники признают, что могут быть сделаны различные модификации, не выходя за рамки сущности и объема изобретения. Все публикации и патентные заявки, упомянутые в описании, указывают на уровень специалистов в области техники, к которой относится это изобретение. Примеры Все опыты проводились при положительном давлении сухого азота. Все растворители и реагенты использовались в том виде, в каком были получены. В основном проценты вычисляли по весу (вес/вес), за исключением растворителей для высокоэффективной жидкостной хроматографии, где растворители выражали по объему (объем/объем). Спектры протонноядерно-магнитного резонанса (1 Н-ЯМР) и 13 Сядерно-магнитного резонанса (13C-ЯMP) снимали на спектрометре Bruker AC-300 FTNMR при 300,135 MHz или спектрометре GE QE-300 при 300,15 MHz. Флэш-хроматографию на силикагеле можно проводить, как описано Still et. al.,используя силикагель 60 (230-400 меш.(1978). Элементный анализ на углерод, водород и азот проводили на элементном анализатореControl Equipment Corporation 440. Элементные анализы на серу проводили на колориметрическом элементном анализаторе Brinkman. Точки плавления определяли в открытых стеклянных капиллярах в аппарате для определения точки плавления с горячей воздушной баней Gallenkamp или автоматическом аппарате Mettler FP 62. Масс-спектры с десорбцией электрическим полем (FDMS) снимали на масс-спектрометреVarian Instruments VG 70-SE или VG ZAB-3F. Масс-спектры с высокой разрешающей "бомбардировкой" свободных атомов (FABMS) получили при использовании масс-спектрометраVarian Instruments VG ZAB-2SE. Выходы 6-метокси-2-(4-метоксифенил)бензо[b]тиофена можно определять высокоэффективной жидкостной хроматографией (ВЭЖХ) в сравнении с подлинным образцом этого соединения, приготовленным по опубликованным синтетическим способам. Смотри, например,патент US4133814. Пример 1. Циклизация: 40 г -(3-метоксифенилтио)-4-метоксиацетофенона, 4 г сухой смолы АмберлистR 15(А 15) (поставляется RohmHaas) и 120 мл толуола (DrumStock) вносят в 3-горлую круглодонную колбу на 1 л,снабженную обратным холодильником и ловушкойDean Stark. Ловушку либо заранее заполняют толуолом, либо в реактор добавляют избыток растворителя. Смесь нагревают до кипения с обратным холодильником и перемешивают в течение 3-5 ч, в то время, как из азеотропной смеси удалялась вода. Затем эту смесь охлаждают до 50-70 С. Смолу фильтруют, используя воронку Бюхнера длиной 4,25 см, и промывают 20 мл толуола. Регистрируют общую массу фильтрата и рассчитывают объем толуола, необходимый для переноса фильтрата в колбу на 500 мл для проведения реакции перегруппировки [объем для смыва=(масса-161,5)/0,866]. Применение: этот объем для смыва рассчитан с учетом потерь при выпаривании, которые имеют место во время горячего фильтрования толуолом. Перегруппировка: Фильтрат переносят в круглодонную колбу на 500 мл, снабженную обратным холодильником. 14 г Метансульфокислоты (MSA) добавляют в течение 2-5 мин с помощью капельной воронки. Смесь орошают 3 мл толуола и перемешивают при 90 С в течение 3-5 ч. В течение 520 мин добавляют 56 мл гептана (Drum Stock). Затем смесь перемешивают при 90 С в течение 1 ч и перемешивают при 80 С в течение 3-4 ч. В течение 5-20 мин добавляют 98 мл изопропанола (IPA) (Drum Stock) и затем нагревают с обратным холодильником в течение 30 мин примерно при 83 С. Затем смесь охлаждают до 0 С со скоростью не больше 50 С в ч. Затем смесь перемешивают, по меньшей мере, в течение 1 ч при 0 С, фильтруют, дважды промывают 75 мл 70/30 (толуол/изопропанол) и высушивают при 60 С в полном ваккуме. Выход=77-80,4%, чистота 100%, деметилированные соединения 0,1%, соединение D 0,1%, близкие соединения 0,3%. Пример 2. На опытной установке проводят следующую реакцию. Как циклизацию, так и перегруппировку проводят в реакторе Hastelloy С на 50 галлон. Если не указано особо, условия реакции были теми же,что указаны в примере 1. Циклизация:-(3-метоксифенилтио)-4 метоксиацетофенон: 14 кг Смола А 15: 1,4 кг Толуол: 42 л Время циклизации при нагревании с обратным холодильником: 2,5 ч Промывание А 15 толуолом: 6 л Температура фильтрования смолы А 15:60 С Перегруппировка: Метансульфокислота: 4,9 кг Промывание метансульфокислотой/толуолом: 1 л Время перемешивания при 90 С перед добавлением гептана: 3 ч Время перемешивания при 90 С после добавления гептана: 1 ч Время перемешивания при 80 С после добавления гептана: 3 ч Гептан: 20 л Время добавления гептана: 20 мин Количество изопропанола для остановки реакции: 34 л Время добавления изопропанола: 17 мин Время нагревания с обратным холодильником после добавления изопропанола: 30 мин Скорость охлаждения: 50 С в ч Конечная температура перед фильтрованием продукта: 0 С Промывание осадка на фильтре: 2 х 26 л смеси толуол/изопропанол 70/30. Полученные результаты составили: выход 77,5% чистота 100,1% близкие соединения 0,21% деметилированные соединения 0,08%. Пример 3. Условия реакции, использованные для этого примера, были идентичными таковым, что в примере 2, за исключением следующих переменных величин: используют облицованные стеклом реакторы на 50 галлонов вместо реакторов Hastelloy на 50 галлонов; время перемешивания при 90 С перед добавлением гептана увеличивают до 4 ч; и время перемешивания при 80 С после добавления гептана увеличивают до 4 ч. Полученные результаты были следующими: выход 55% 12 чистота 99,5% близкие соединения 0,30% диметилированные соединения 0,09%. Пример 4. На опытной установке проводят следующую реакцию. Как циклизацию, так и перегруппировку проводят в облицованном стеклом реакторе на 50 галлонов. Если не указано особо, условия реакции были теми же, что указаны в примере 1. Количество -(3-метоксифенилтио)-4-метоксиацетофенона увеличивают до 16,5 кг и все другие загрузки соответствующим образом пропорционально увеличивают. Общий объем реакционного сосуда увеличивают соответственно. Перемешивание реакционной смеси увеличивают от 95 до 115 оборотов в минуту. Полученные результаты были: выход 79,6% чистота 100,6% близкие соединения 0,25% деметилированные соединения 0,08%. ФОРМУЛА ИЗОБРЕТЕНИЯI. Способ получения соединения формулы Ib где группы R являются одинаковыми или различными и представляют С 1-С 6 алкил, который включает циклизацию диалкоксисоединения формулы II в присутствии катионообменной смолы. 2 . Способ по п.1, где R является метилом. 3. Способ по п.1, где упомянутая катионообменная смола является сульфокислотной смолой на основе полистирола. 4. Способ по п.1, который дополнительно включает контактирование реакционной смеси с метансульфокислотой в толуоле. 5. Способ по п.4 , который дополнительно включает контактирование упомянутой реакционной смеси с гептаном. 6. Способ по п.5, который дополнительно включает контактирование упомянутой реакционной смеси с изопропанолом. 7. Способ по п.1, где упомянутую циклизацию проводят при температуре примерно от 70 до примерно 90 С. 8. Способ по п.1, где упомянутый способ проводят как периодический процесс. 9. Способ по п.1, где упомянутый способ проводят как непрерывный процесс.
МПК / Метки
МПК: C07D 333/52
Метки: получения, способ, бензотиофенов
Код ссылки
<a href="https://eas.patents.su/7-1914-sposob-polucheniya-benzotiofenov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензотиофенов.</a>
Предыдущий патент: Фармацевтические соединения
Следующий патент: Ингибиторы серин-протеаз, в частности ns3 протеазы вируса гепатита c (hvc)
Случайный патент: Соединения тетрагидроциклопента[b]индола в качестве модуляторов рецептора андрогенов











