Тгф-содержащие сульфонамидные ингибиторы аспартил-протеазы
Формула / Реферат
1. Фармацевтическая композиция, содержащая
а) фармацевтически приемлемое количество ингибитора протеазы - соединения формулы I
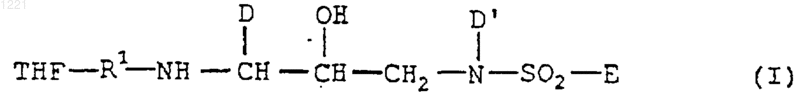
где каждый R1, независимо, выбран из группы, включающей -С(О)-, -S(O)2-, -С(O)-С(O)-, -О-С(О)-, -O-S(O)2, -NR2-S(O)2-, -NR2-С(O)- и -NR2-C(O)-С((О)-;
каждый Het, независимо, выбран из группы, включающей С3-С7 карбоцикл; C6-С10 арил; фенил, конденсированный с гетероциклом; и гетероцикл; где любой член указанного Het может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей оксо, -OR2, -R2, -N(R2)(R2), -NHOH, -R2OH, -CN, -CO2R2, -C(O)-N(R2)(R2), -S(O)2-N(R2)(R2), -N(R2)-C(O)-R2, -C(O)-R2, -S(O)n-R2, -OCF3, -S(O)n-R6, -N(R2)-S(O)2(R2), галоген, -СF3, -NO2, -R6 и -O-R6;
каждый R2, независимо, выбран из группы, включающей Н и C1-С3 алкил, необязательно замещенный R6;
каждый R3, независимо, выбран из группы, включающей Н, Het, C1-С6 алкил и С2-С6 алкенил, где любой член указанной R3, кроме Н, может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей -OR2, -C(O)-NH-R2, -S(O)n-N(R2)(R2), Het, -CN, -SR2, -CO2R2, -NR2-C(O)-R2;
каждый n, независимо, равен 1 или 2;
каждый D и D', независимо, выбран из группы, включающей R6; C1-C5 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2, -R3, -O-R6, -S-R6 и R6; C2-C4 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2, -R3, -O-R6 и R6; и С3-С6 карбоцикл, который может быть необязательно замещен или конденсирован с R6; и С5-С6 циклоалкенил, который может быть необязательно замещен или конденсирован с R6;
каждый Е, независимо, выбран из группы, включающей Het; -O-Het; Het-Het; -O-R3; -NR2R3; C1-C6 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы, включающей R4 или Het; и С2-С6 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы, включающей R4 или Het;
каждый R4, независимо, выбран из группы, включающей -OR2, -C(O)-NHR2, -S(O)2-NHR2, галоген, -NR2-C(О)-R2 и -CN;
каждый R5, независимо, выбран из группы, включающей Н и C1-C4 алкил, необязательно замещенный арилом; и
каждый R6, независимо, выбран из группы, включающей арил, карбоцикл или гетероцикл, где указанные карбоцикл или гетероцикл могут быть необязательно замещены одной или несколькими группами, выбранными из группы, включающей оксо, -OR5, -R5, -N(R5)(R5), -N(R5)-C(O)-R5, -R5-OH, -CN, -CO2R5, -C(O)-N(R5)(R5), галоген и -СF3;
b) одно или несколько дополнительных антивирусных агентов и иммуностимуляторов, независимо выбранных из группы, включающей (2R,цис)-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он (3ТС, ламивудин, EpivirR), [4-(1,3-диметил-2,6-диоксо-2,3,6,9-тетерагидро-1H-пурин-8-ил)фенокси]уксусную кислоту (935U83), сульфатную соль (2:1) (1S,цис)-4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил-2-циклопентен-1-метанола (1592U89, абакавир, ZiagenR), 4-амино-5-фтор-1-[(2R,5S)-2-гидроксиметил)-1,3-оксотиолан-5-ил]-2(1Н)-пиримидинон (524W91), пиперазин-1-[3-[(1-метилэтил)амино]-2-пиридинил]-4-[[5-метилсульфонил)амино]-1Н-индол-2-ил]карбонил]монометансульфонат (делавирдин, U90) и 4-[(2-формил-3-гидроксифенокси)метил]бензойную кислоту (тускаразол); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
2. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-амино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) одно или несколько дополнительных антивирусных агентов и иммуностимуляторов, независимо выбранных из группы, включающей (2R,цис)-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он (3ТС, ламивудин, EpivirR), [4-(1,3-диметил-2,6-диоксо-2,3,6,9-тетерагидро-1Н-пурин-8-ил)фенокси]уксусную кислоту (935U83), сульфатную соль (2:1) (1S,цис)-4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил-2-циклопентен-1-метанола (1592U89, абакавир, ZiagenR), 4-амино-5-фтор-1-[(2R,5S)-2-гидроксиметил)-1,3-оксотиолан-5-ил]-2(1Н)-пиримидинон (524W91), пиперазин-1-[3-[(1-метилэтил)амино]-2-пиридинил]-4-[[5-метилсульфонил)амино]-1Н-индол-2-ил]карбонил]монометансульфонат (делавирдин, U90) и 4-[(2-формил-3-гидроксифенокси)метил]бензойную кислоту (тускаразол); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
3. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-aмино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) (2R,цис)-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1Н)-пиримидин-2-он (3ТС, ламивудин, EpivirR); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
4. Фармацевтическая композиция, содержащая
а) фармацевтически приемлемое количество 4-амино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) сульфатную соль (2:1) (1S,цис)-4-[2-амино-6-(циклопропиламино)-9Н-пурин-9-ил-2-циклопентен-1-метанола (1592U89, абакавир, ZiagenR); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
5. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-амино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) [4-(1,3-диметил-2,6-диоксо-2,3,6,9-тетрагидро-1Н-пурин-8-ил)фенокси]уксусную кислоту (935U83); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
6. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-амино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) 4-амино-5-фтор-1-[(2R,5S)-2-гидроксиметил)-1,3-оксотиолан-5-ил]-2(1Н)-пиримидинон (524W91); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
7. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-амино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонаьшф (соединение 168);
b) пиперазин-1-[3-[(1-метилэтил)амино]-2-пиридинил]-4-[[5-метилсульфонил)-амино]-1Н-индол-2-ил]карбонил]монометансульфонат (делавирдин, U90); и
с) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
8. Фармацевтическая композиция, содержащая
a) фармацевтически приемлемое количество 4-aмино-N-((2син,3S)-2-гидрокси-4-фенил-3-((S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамид (соединение 168);
b) 4-[(2-формил-3-гидроксифенокси)метил]бензойную кислоту (тускаразол); и
c) фармацевтически приемлемый носитель, адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы.
9. Фармацевтическая композиция по любому из пп.1-8, где указанная фармацевтическая композиция вводится перорально.
10. Способ предупреждения ВИЧ-инфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтически эффективного количества фармацевтической композиции по любому из пп.1-9.
11. Способ лечения ВИЧ-инфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтически эффективного количества фармацевтической композиции по любому из пп.1-9.
Текст
1 Область техники Данное изобретение относится к композициям, содержащим класс ТГФ-содержащих сульфонамидов, которые представляют собой ингибиторы аспартил-протеазы в сочетании с другими терапевтическими или профилактическими агентами. Фармацевтические композиции по данному изобретению особенно хорошо подходят для ингибирования активности ВИЧ-1 и ВИЧ-2 протеаз и, следовательно, могут быть с успехом использованы в качестве антивирусных средств в отношении ВИЧ-1 и ВИЧ-2 вирусов. Кроме того, данное изобретение относится к способам ингибирования активности ВИЧ аспартил-протеазы с использованием композиций по данному изобретению. Предшествующий уровень техники Вирус иммунодефицита человека ("ВИЧ") является возбудителем синдрома приобретенного иммунодефицита ("СПИД") - заболевания,характеризующегося разрушением иммунной системы, в частности, CD4- Т-клеток, сопровождающегося восприимчивостью к условнопатогенным инфекциям - и его предшественника СПИД-связанного комплекса ("ССК"), - синдрома, характеризующегося симптомами, такими как персистентная общая лимфаденопатия,лихорадка и потеря веса. Как в случае некоторых других ретровирусов,ВИЧ кодирует продуцирование протеазы, которая осуществляет посттрансляционное расщепление предшественников полипептидов в процессе, необходимом для образования инфекционных вирионов (S. Crawford et al., "A DeletionMurine Leukemia Virus Bloks Proteolytic Processing of the gag and pol Polyproteins", J. Virol.,53, p. 899 (1985. Эти генные продукты включают пол, который кодирует вирион РНКзависимую ДНК полимеразу (обратную транскриптазу), эндонуклеазу, ВИЧ протеазу, и гаг,который кодирует кор-протеины вирионов (Н.SRV-1, a Type D Simian Acquired Immune Deficiency Syndrome Retrovirus", Science, 231, p. 1567 (1986. Ряд синтетических антивирусных агентов был сконструирован для того, чтобы отметить различные стадии в цикле репликации ВИЧ. Эти агенты включают соединения, которые блокируют вирусное связывание CD4+ Т-лимфоцитов(например, растворимых CD4), и соединения,которые мешают вирусной репликации за счет ингибирования вирусной обратной транскриптазы (например, диданозин и зидовудин (AZT,и ингибируют интеграцию вирусной ДНК в кле 001221 2 точную ДНК (M.S. Hirsh and R.T. D'Aqulia,"Therapy for Human Immunodeficiency Virus Infection", N. Eng. J. Med., 328, p. 1686 (1993. Однако такие агенты, которые направлены,главным образом, на ранние стадии вирусной репликации, не предотвращают продуцирование инфекционных вирионов в хронически инфицированных клетках. Кроме того, введение некоторых таких агентов в эффективных количествах приводит к клеточной токсичности и нежелательным побочным эффектам, таким как анемия и угнетение костного мозга. Совсем недавно усилия по конструированию лекарственных средств были направлены на создание соединений, которые ингибируют образование инфекционных вирионов за счет нарушения процессинга предшественников вирусных полипротеинов. Процессинг этих белков-предшественников требует действия вирускодируемых протеаз, которые существенны для репликации (Kohl, N.E. et al. "Active HIV Protease is Required for Viral Infectivity" Proc. Natl.Acad. Sci. USA, 85, p. 4686 (1988. Антивирусный потенциал ингибирования ВИЧ протеазы был продемонстрирован с использованием пептидных ингибиторов. Такие пептидные соединения, однако, представляют собой обычно большие и сложные молекулы, которые имеют тенденцию демонстрировать слабую биодоступность и которые обычно не годятся для перорального применения. Таким образом, все еще существует потребность в соединениях,которые могут эффективно ингибировать действие вирусных протеаз, для использования в качестве агентов для предотвращения и лечения хронических и острых вирусных инфекций. Такие средства, как можно предположить, действуют как эффективные терапевтические средства. Кроме того, поскольку они действуют на отдельной стадии в жизненном цикле вируса в отличие от ранее описанных противоретровирусных средств, введение комбинации агентов,как ожидают, как можно предположить, приведет к повышению терапевтической эффективности. Сущность изобретения Настоящее изобретение относится к новой композиции, содержащей класс соединений и их фармацевтически приемлемых производных,которые могут использоваться в качестве ингибиторов аспартил-протеаз, в частности, ВИЧ аспартил-протеазы. Эти композиции содержат ингибиторы аспартил-протеаз, которые могут использоваться в сочетании с другими терапевтическими или профилактическими средствами,такими как антивирусные агенты, антибиотики,иммуномодуляторы или вакцины, для лечения или профилактики вирусной инфекции, при условии, что композиция не содержит второго ингибитора протеаз. Согласно предпочтительному варианту воплощения, соединения по данному изобретению 3 способны ингибировать репликацию ВИЧ вируса в CD4+ клетках человека, включая Т-клетки, в моноцитных линиях, включая макрофаги и дендроциты, и в других пермиссивных клетках. Эти соединения могут использоваться в качестве терапевтических и профилактических средств для лечения или предотвращения инфицирования ВИЧ-1 и родственными вирусами, что может привести к асимптоматической инфекции,СПИД-связанному комплексу ("ССК"), синдрому приобретенного иммунодефицита ("СПИД"),или аналогичному заболеванию иммунной системы. Главным объектом данного изобретения является композиция, содержащая соединение класса ТГФ-содержащих сульфонамидов, которые являются ингибиторами аспартил-протеазы,и, в частности, ингибиторами ВИЧ аспартилпротеазы, в сочетании с другим терапевтическими или профилактическими средствами, при условии, что композиция не содержит второго ингибитора протеазы. Этот класс ТГФсодержащих сульфонамидов представлен формулой I-NR2-C(O)-С(О)-; каждый Het, независимо, выбран из группы, включающей С 3-С 7 карбоцикл; С 6-С 10 арил; фенил, конденсированный с гетероциклом; и гетероцикл; где любой член указанного Het может быть, необязательно, замещен одним или несколькими заместителями, выбранными из группы, включающей оксо, -OR2, -R2,-N(R2)(R2), -NHOH, -R2-OH, -CN, -CO2R2, -C(O)N(R2)(R2), -S(O)2-N(R2)(R2), -N(R2)-C(O)-R2,-C(O)-R2, -S(O)n-R2, -ОСF3, -S(O)n-R6, -N(R2)S(O)2-(R2), галоген, -СF3, -NO2, -R6 и -O-R6; каждый R2, независимо, выбран из группы,включающей Н и C1-С 3 алкил, необязательно замещенный R6; каждый R3, независимо, выбран из группы,включающей Н, Het, C1-С 6 алкил и С 2-С 6 алкенил, где любой член указанного R3, кроме Н,может быть, необязательно, замещен одним или несколькими заместителями, выбранными из группы, включающей -OR2, -C(O)-NH-R2,-S(O)n-N(R2)(R2), Het, -CN, -SR2, -CO2R2, -NR2C(O)-R2; каждый n, независимо, равен 1 или 2; каждый D и D', независимо, выбран из группы, включающей R6; C1-C5 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2,-R3, -O-R6, -S-R6 и R6; C2-C4 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2,-R3, -O-R6 и R6; и С 3-С 6 карбоцикл, который мо 001221 4 жет быть необязательно замещен или конденсирован с R6; каждый Е, независимо, выбран из группы,включающей Het; -O-Het; Het-Het; -O-R3;-NR2R3; C1-C6 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы, включающейR4 или Het; и С 2-С 6 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы,включающей R4 или Het; каждый R4, независимо, выбран из группы,включающей -OR2, -C(O)-NHR2, -S(O)2-NHR2,галоген, -NR2-C(O)-R2 и -CN; и каждый R5, независимо, выбран из группы,включающей Н и C1-C4 алкил, необязательно замещенный арилом; и каждый R6, независимо, выбран из группы,включающей арил, карбоцикл или гетероцикл,где указанные арил, карбоцикл или гетероцикл могут быть необязательно замещены одной или несколькими группами, выбранными из группы,включающей оксо, -OR5, -R5, -N(R5)(R5), -N(R5)C(O)-R5, -R5-OH, -CN, -CO2R5, -C(O)-N(R5)(R5),галоген и -СF3. Объектом данного изобретения являются также фармацевтические композиции, содержащие ТГФ-содержащие сульфонамиды формулы I и другие противовирусные агенты, антибиотики или иммуномодуляторы, включая 3 ТС,935U83, 1592U89, 524W91 и делавирдин, при условии, что композиция не содержит второй ингибитор протеазы. Еще одним объектом данного изобретения являются фармацевтические композиции, содержащие ТГФ-содержащие сульфонамиды формулы I, и способы их применения в качестве ингибиторов ВИЧ аспартил-протеазы. Подробное описание изобретения Для того чтобы более полно понять описываемое здесь изобретение, ниже следует его детальное описание. В описании использованы следующие сокращения: Обозначение Ас Реагент или фрагмент ацетил метил этил бензил трифенилметилD- или L-валин трет-бутоксикарбонил бензилоксикарбонил (карбобензилокси) дициклогексилкарбодиимид 1,8-диазабицикло(5,4,0)ундец-7-ен диизопропилкарбодиимид диизопропилэтиламид диметилформамид диметилсульфоксид 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид этилацетат 9-флуоренилметоксикарбонил 1-гидроксибензотриазол 1-гидроксисукцинимид изобутил трифторуксусная кислота тетрагидропиран тетрагидрофуран хлортриметилсилан В описании применяются следующие термины. Если не оговорено особо, используемые здесь термины "-SO2-" и "-S(O)2-" относятся к сульфону или производному сульфона (т.е. обе прилагаемые группы связаны с S), а не к сложному эфиру сульфината. Термин "основная цепь" относится к структурному изображению соединения по данному изобретению, представленного на фигурах, показанных в данной заявке. Термин "основная цепь" не включает переменных, показанных на этих фигурах. Для соединений формулы I и для промежуточных соединений для их синтеза, стереохимия точно показанного гидроксила определяется относительно D на соседнем атоме углерода, когда молекула изображена в виде вытянутого зигзага (так, как это показано для соединений формулы VI). Если и ОН и D остаток находятся по одну и ту же сторону от плоскости,определяемой вытянутой основной цепью, стереохимию гидроксила обычно называют "син". Если ОН и D остаток находятся на противоположных сторонах от этой плоскости, стереохимию гидроксила обычно называют "анти". Используемый здесь термин "алкил", один или в сочетании с любым другим термином,относится к насыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепью, содержащему определенное число атомов углерода, или в случае, когда это число не оговорено, предпочтительно содержащему 1-10 и более предпочтительно содержащему 1-5 атомов углерода. Примеры алкильных радикалов включают, но ими не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, нгексил и т.п. Термин "алкенил", один или в сочетании с любым другим термином, относится к моноили полиненасыщенному алифатическому углеводородному радикалу с прямой или разветвленной цепью, содержащему определенное число атомов углеводорода, или, в случае, когда это число не оговорено, предпочтительно содержащему 2-10 атомов углерода, или более предпочтительно содержащему 2-6 атомов углерода. Примеры алкенильных радикалов включают, но ими не ограничиваются, этенил, Е- и Zпропенил, изопропенил, Е- и Z-бутенил, Е- и Zизобутенил, Е- и Z-пентенил, Е- и Z-гексенил,Е,Е-, E,Z-, Z,Z-гексадиенил и т.п. 6 Термин "арил", один или в сочетании с другим термином, относится к карбоциклическому ароматическому радикалу (такому как фенил или нафтил), содержащему определенное число атомов углерода, предпочтительно от 614 атомов углерода и более предпочтительно от 6-10 атомов углерода. Примеры арильных радикалов включают, но ими не ограничиваются,фенил, нафтил, инденил, инданил, азуленил,флуоренил, антраценил и т.п. Термин "циклоалкил", один или в сочетании с любым другим термином, относится к циклическому насыщенному углеводородному радикалу, содержащему конкретное число атомов углерода, предпочтительно от 3-7 атомов углерода. Примеры циклоалкильных радикалов включают, но ими не ограничиваются, циклопропил, циклобутил, циклопентил, циклогексил,циклогептил и т.п. Термин "циклоалкенил", один или в сочетании с любым другим термином, относится к циклическому углеводородному радикалу, содержащему определенное число атомов углерода, по крайней мере, с одной эндоциклической углерод-углеродной связью. В случае когда число атомов углерода не оговорено особо, циклоалкенильный радикал предпочтительно имеет от 5-7 атомов углeрода. Примеры циклоалкенильных радикалов включают, но ими не ограничиваются, циклопентенил, циклогексенил,циклопентадиенил и т.п. Термин "ТГФ" относится к тетрагидрофурановому кольцу, присоединенному по любому углероду кольца с образованием стабильной структуры, но предпочтительно присоединенному по 3-му положению тетрагидрофуранового кольца (т.е. тетрагидрофуран-3-ил). Предпочтительно хиральный углерод ТГФ находится в (S) конфигурации. Термин "карбоцикл" относится к стабильному радикалу неароматического 3-8-членного углеродного кольца, который может быть насыщенным, мононенасыщенным или полиненасыщенным. Карбоцикл может быть присоединен к любому эндоциклическому атому углерода с образованием стабильной структуры. Предпочтительные карбоциклы имеют 5-6 углеродов. Примеры карбоциклических радикалов включают, но ими не ограничиваются, циклопропил,циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклопентадиенил и т.п. Термин "гетероцикл", если здесь не оговорено особо, относится к стабильному 3-7 членному моноциклическому гетероциклическому кольцу или 8-11-членному бициклическому гетероциклическому кольцу, которое является либо насыщенным, либо ненасыщенным,и которое может быть, необязательно, бензоконденсированным, если оно моноциклическое. Каждый гетероцикл состоит из одного или более атомов углерода и от одного до четырех ге 7 тероатомов, выбранных из группы, включающей азот, кислород и серу. Используемые здесь термины "азот- и сера-гетероатомы" включают любую окисленную форму азота и серы и кватернизованную форму любого основного азота. Кроме того, любой азот кольца может быть необязательно замещен заместителем R2, как определено здесь для соединений формулы I. Гетероцикл может быть присоединен к любому эндоциклическому углероду или гетероатому, что приводит к образованию стабильной структуры. Предпочтительные гетероциклы включают 5-7 членные моноциклические гетероциклы и 8-10 членные бициклические гетероциклы. Определенные выше предпочтительные гетероциклы включают, например, бензимидазолил, имидазолил, имидазолиноил, имидазолидинил, хинолил, изохинолил, индолил, индазолил, индазолинолил, пергидропиридазил, пиридазил, пиридил, пирролил, пирролинил, пирролидинил, пиразолил, пиразинил, хиноксолил, пиперидинил,пиранил, пиразолинил, пиперазинил, пиримидинил, пиридазинил, морфолинил, тиаморфолинил, фурил, тиенил, триазолил, тиазолил, карболинил, тетразолил, тиазолидинил, бензофураноил, тиаморфолинил сульфон, оксазолил,бензоксазолил, оксопиперидинил, оксопирролдинил, оксоазепинил, азепинил, изоксазолил,изотиазолил, фуразанил, тетрагидропиранил,тетрагидрофуранил, тиазолил, тиадиазоил, диоксолил, диоксинил, оксатиолил, бензодиоксолил, дитиолил, тиофенил, тетрагидротиофенил,диоксанил, диоксоланил, тетрагидрофуротетрагидрофуранил, тетрагидропиранотетрагидрофуранил, тетрагидрофуродигидрофуранил, тетрагидропиранодигидрофуранил, дигидропиранил,дигидрофуранил, дигидрофуротетрагидрофуранил, дигидропиранотетрагидрофуранил, сульфоланил и т.п. Термин "галоген" относится к радикалу фтора, хлора, брома или иода. Термины "ВИЧ протеаза" и "ВИЧ аспартил-протеаза" используют взаимозаменяемо, и они относятся к аспартил-протеазе, кодируемой вирусом иммунодефицита человека типа 1 или 2. В предпочтительном варианте воплощения данного изобретения эти термины относятся к аспартил-протеазе вируса иммунодефицита человека типа 1. Термин "антивирусный агент" или "противоретровирусное средство" относится к соединению или лекарственному средству, которое обладает ингибирующей вирус активностью. Такие средства включают ингибиторы обратной транскриптазы (включая нуклеозидные и ненуклеозидные аналоги) и ингибиторы протеаз. Предпочтительно ингибитором протеаз является ингибитор ВИЧ протеазы. Примеры нуклеозидных аналогов ингибиторов обратной транскриптазы включают, но ими не ограничиваются, зидовудин (AZT), дидезоксицитидин (ddC), диданозин (ddl), ставудин (d4T), 3TC, 935U83, 001221 8 1592U89 и 524W91. Примеры ненуклеозидных аналогов ингибиторов обратной транскриптазы включают, но ими не ограничиваются, делавирдин (U90) и невирапин. Примеры ингибиторов ВИЧ протеазы включают, но ими не ограничиваются, саквинавир (Ro 31-8959), МК 639, АВТ 538 (А 80538), AG 1343, ХМ 412, ХМ 450, BMS 186318 и CPG 53 437. Термин "уходящая группа" или "УГ" относится к группам, легко замещаемым нуклеофилом, таким как амин, спирт, фосфористый или тиольный нуклеофил или их соответствующие анионы. Такие уходящие группы хорошо известны и к ним относятся карбоксилаты, Nгидроксисукцинимид, N-гидроксибензотриазол,галоген (галогениды), трифлаты, тозилаты, мезилаты, алкокси, тиоалкокси, фосфинаты, фосфонаты и т.п. К другим потенциальным нуклеофилам относятся органометаллические реагенты, известные специалистам в данной области. Кроме того, предполагается, что термин "уходящая группа" или "УГ", охватывает предшественников уходящей группы (т.е. части, которые легко могут быть превращены в отщепляемую группу с помощью простых синтетических способов, таких как алкилирование, окисление или протонирование). Такие предшественники уходящей группы и способы превращения их в уходящие группы хорошо известны специалистам в данной области. К предшественникам уходящей группы относятся, например, вторичные и третичные амины. В качестве примера,радикал -N(R3)(R4), хотя он сам по себе не является уходящей группой, охватывается термином"уходящая группа" или "УГ", потому что ее можно легко превратить в уходящую группу,такую как -N+CH3(R3)(R4). Термин "защитная группа" относится к подходящей химической группе, которая может быть присоединена к функциональной группе и которая может быть удалена на более поздней стадии, открывая незатронутую функциональную группу. Примеры подходящих защитных групп для различных функциональных групп описаны T.W. Greene and P.G.M. Wuts, Protective"силил" относится к тризaмещенному радикалу кремния, в котором заместителями являются, независимо, C1-C8 алкил, С 5-С 7 арил или C5-C7 карбоцикл. Примеры силильных групп включают, но ими не ограничиваются, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил, третбутилдиизопропилсилил, трет-бутилдифенилсилил, трифенилсилил, циклогексилдиметилсилил и т.п. 9 Термин "фармацевтически эффективное количество" относится к количеству средства,эффективному при лечении ВИЧ инфекции у пациента либо путем монотерапии, либо в комбинации с другими средствами. Используемый здесь термин "лечение" относится к облегчению симптомов определенного заболевания у пациента или к улучшению установленного показателя, ассоциируемого с конкретным расстройством. В частности, в отношении ВИЧ, эффективное лечение с использованием соединений и композиций данного изобретения должно приводить к улучшению установленного показателя, ассоциированного с ВИЧ. Такие показатели включают, но ими не ограничиваются, снижение вирусной нагрузки в плазме или другом определенном тканевом компартменте, измеряемой, например, с помощью RT-PCR или разветвленной ДНК ПЦР или показателей культивируемого вируса, уровни -2 микроглобулина или р 24, число CD4+ клеток или отношениеCD4+/CD8+ клеток, или функциональные маркеры, такие как улучшение качества жизни, способности выполнять нормальные функции,снижение деменции (слабоумие) или действия,родственные иммунодепрессии, включая, но не ограничиваясь, условно-патогенные инфекции и опухоли. Термин "профилактически эффективное количество" относится к количеству, эффективному для предотвращения ВИЧ инфекции у пациента. Указанный здесь термин "пациент" относится к млекопитающему, включая человека. Термин "фармацевтически пригодный носитель или адъювант" относится к носителю или адъюванту, который можно ввести пациенту вместе с соединением по данному изобретению,и который не разрушает его фармакологическую активность и нетоксичен при введении в дозах, достаточных для доставки терапевтического количества противоретровирусного средства. Термин "место присоединения" относится к атому, при помощи которого часть присоединяется к указанной структуре. Термин "замещенный", независимо от того выражает или подразумевает и или ему предшествует термин "необязательно", относится к замене одного или более водород-радикалов в данной структуре радикалом указанного заместителя. Когда более чем одно положение в данной структуре может быть замещено заместителем, выбранным из указанной группы, заместители могут быть либо одинаковыми, либо различными в каждом положении. Обычно, когда структура может быть необязательно замещенной, предпочтительно, чтобы она имела 0-3 замещения, и наиболее предпочтительно, чтобы она имела 0-1 замещение. Наиболее предпочтительными заместителями являются те, которые усиливают активность ингибирования протеазы или внутриклеточную противовирусную актив 001221 10 ность в пермиссивных клетках млекопитающего или иммортализованных клеточных линиях млекопитающего, или которые увеличивают способность к доставке путем повышения характеристик растворимости или усиления фармакокинетических или фармакодинамических профилей по сравнению с незамещенным соединением. К другим наиболее предпочтительным заместителям относятся заместители, используемые в соединениях, представленных в табл. 1. Предполагается, что соединения, используемые в композициях по данному изобретению, включающие соединения формулы I, охватывают их фармацевтически пригодные производные или их пролекарственные средства."Фармацевтически пригодное производное или пролекарство" означает любую фармацевтически пригодную соль, сложный эфир, соль сложного эфира, или другое производное соединения по данному изобретению, которое при введении реципиенту может обеспечить (прямо или косвенно) соединение по данному изобретению или его метаболит или его остаток с активным ингибирующим действием. В частности, предпочтительными производными и пролекарствами являются те, которые увеличивают биодоступность соединений данного изобретения, когда такие соединения вводят млекопитающему (например, позволяя перорально вводимому соединению более легко абсорбироваться в кровь),или которые усиливают доставку исходного соединения в биологический компартмент (например, мозг или лимфатическая система) по сравнению с исходным видом. К предпочтительным пролекарствам относятся производные,где группа, которая усиливает растворимость в воде или активный транспорт через кишечную мембрану, присоединена к точно указанному гидроксилу в формуле (I) или к "Е" в формуле(I). Фармацевтически приемлемые соли соединений по данному изобретению включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. К примерам приемлемых кислот относятся хлористо-водородная, бромистоводородная, серная, азотная, перхлорная, фумаровая, малеиновая, фосфорная, гликолевая, молочная, салициловая, янтарная, п-толуолсульфоновая, винная, уксусная, лимонная, метансульфоновая, этансульфоновая, муравьиная,бензойная, малоновая, нафталин-2-сульфоновая и бензолсульфоновая кислоты. К предпочтительным кислотам относятся хлористоводородная, серная, метансульфоновая и этансульфоновая кислоты. Метансульфоновая кислота наиболее предпочтительна. Другие кислоты, такие как щавелевая, хотя сами по себе фармацевтически не приемлемы, могут быть использованы для получения солей, используемых в качестве промежуточных продуктов при полу 11 чении соединений по изобретению и их фармацевтически приемлемых солей присоединения кислот. К солям, полученным из соответствующих оснований, относятся соли щелочного металла(например, натрий), щелочно-земельного металла (например, магний), аммония и N-(C1-4 алкил)4+. Термин "тиокарбаматы" относится к соединениям,содержащим функциональную группу N-SO2-O. Соединения, используемые в композициях по данному изобретению, содержат один или более асимметрических атомов углерода и поэтому могут существовать в виде рацематов и рацемических смесей, отдельных энантиомеров,диастереомерных смесей и индивидуальных диастереомеров. Все такие изомерные формы этих соединений также включены в данное изобретение. Каждый стереогенный углерод может иметь как R, так и S конфигурацию. Предпочтительно также, чтобы идентифицированный гидроксил находился в син-положении по отношению к D, в конформации растянутой зигзагообразной конформации между азотами, указанными в соединениях формулы I. Комбинации заместителей и переменных,предусмотренные данным изобретением, являются только такими комбинациями, которые приводят к образованию стабильных соединений. Используемый здесь термин "стабильный" относится к соединениям, которые обладают стабильностью, достаточной для того, чтобы обеспечить их получение, и сохранить целостность соединения на протяжении периода времени, достаточного для его использования в целях, подробно изложенных здесь (например,терапевтическое или профилактическое введение млекопитающему или для использования в аффинной хроматографии). Обычно, такие соединения стабильны при температуре 40 С или ниже, в отсутствии влаги или других химически активных условий, на протяжении, по крайней мере, недели. Соединения, используемые в композициях по данному изобретению, могут использоваться в виде солей, получаемых из неорганических или органических кислот. К таким солям кислот, например, относятся следующие: ацетат,адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат,диглюконат, додецилсульфат, этансульфонат,фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид,гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2 нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат,пикрат, пивалат, пропионат, сукцинат, тартрат,тиоцианат, тозилат и ундеканоат. 12 Кроме того, данное изобретение охватывает кватернизованные формы любых основных азотсодержащих групп рассматриваемых здесь соединений. Основной азот может быть кватернизован любыми средствами, известными специалистам в данной области, включая, например, галогениды низших алкилов, такие как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды; диалкил сульфаты, включая диметил-,диэтил-, дибутил- и диамилсульфаты; длинноцепочечные галогениды, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и-иодиды; и аралкил галогениды, включая бензил- и фенэтилбромиды. Путем такой кватернизации можно получить водо- или маслорастворимые или диспергируемые продукты. ТГФ-содержащие сульфонамиды, используемые в композициях по данному изобретению, представляют собой соединения формулы-NR2-C(O)-С(О)-; предпочтительно каждый R1 представляет -О-С(О)- или -С(О)-; более предпочтительно каждый R1 представляет -О-С(О)-; каждый Het, независимо, выбран из группы, включающей С 3-С 7 карбоцикл; С 6-С 10 арил; фенил, конденсированный с гетероциклом; и гетероцикл, где любой член указанного Het может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей оксо, -OR2, -R2,-N(R2)(R2), -NHOH, -R2-OH, -CN, -CO2R2, -C(O)N(R2)(R2), -S(O)2-N(R2)(R2), -N(R2)-C(O)-R2,-C(O)-R2, -S(O)n-R2, -ОСF3, -S(O)n-R6, -N(R2)S(O)2-(R2), галоген, -СF3, -NO2, -R6 и -O-R6; каждый R2, независимо, выбран из группы,включающей Н и C1-С 3 алкил, необязательно замещенный R6; каждый R3, независимо, выбран из группы,включающей Н, Het, C1-С 6 алкил и С 2-С 6 алкенил, где любой член указанного R3, кроме Н,может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей -OR2, -C(O)-NH-R2,-S(O)n-N(R2)(R2), Het, -CN, -SR2, -CO2R, -N(R2)C(O)-(R2); каждый n, независимо, равен 1 или 2; каждый D и D', независимо, выбран из группы, включающей R6; C1-C5 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2,-R3, -О-R6 и R6; C2-C4 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы,включающей -OR2, -R3, -O-R6 и R6; С 3-С 6 карбоцикл, который может быть необязательно замещен или конденсирован с R6; и C5-C6 циклоал 13 кенил, который может быть необязательно замещен или конденсирован с R6; предпочтительно каждый D представляет, независимо, C1-C5 алкил, который может быть необязательно замещен одной или более Het; более предпочтительно D представляет C1-C5 алкил, который может быть необязательно замещен одной группой, выбранной из С 6-С 10 арила и С 3-C6 циклоалкила; еще более предпочтительно D выбран из бензила, изобутила, циклопентилметила и циклогексилметила; и наиболее предпочтительно D представляет бензил или изобутил; предпочтительно каждый D', независимо, выбран из группы, включающей C1-С 6 алкил, необязательно замещенный R6; более предпочтительно D' выбран из группы, включающей C1-C4 алкил, необязательно замещенный одним 3-6 членным карбоциклом или одним 5-6-членным гетероциклом; наиболее предпочтительно D' выбран из группы, включающей изобутил, циклопентилметил и циклогексилметил; каждый Е, независимо, выбран из группы,включающей Het; -O-Het; Het-Het; -O-R3;-NR2R3; C1-C6 алкил, который может быть необязательно замещен одной или более группами, выбранными из группы, включающей R4 или Het; С 2-С 6 алкенил, который может быть необязательно замещен одной или более группами, выбранными из группы, включающей R4 или Het; и фенил, конденсированный с 5-6 членным гетероциклом, и предпочтительно каждый Е представляет Het и более предпочтительно Е представляет фенил, замещенный одним или более заместителями, выбранными из группы, включающей -ОН, -ОСН 3, -NH2,NHCOCH3, -SH, и -СН 3; или фенил, конденсированнный с 5-6-членным гетероциклом, и наиболее предпочтительно Е представляет фенил,замещенный -NH2 (предпочтительно в мета- или параположении); каждый R4, независимо, выбран из группы,включающей -OR2, -C(O)-NHR2, -S(O)2-NHR2,галоген, -N(R2)-С(О)-(R2) и -CN; каждый R5, независимо, выбран из группы,включающей Н и C1-C4 алкил, необязательно замещенный арилом; предпочтительно каждыйR5 выбран из группы, включающей Н и C1-С 3 алкил, и каждый R6, независимо, выбран из группы,включающей арил, карбоцикл или гетероцикл,где указанные карбоцикл или гетероцикл могут быть необязательно замещены одной или более группами, выбранными из группы, включающей оксо, -OR5, -R5, N(R5)(R5), -N(R5)-C(O)-R5, -R5OH, -CN, -CO2R5, -C(O)-N(R5)(R5), галоген и СF3; предпочтительно каждый R6, независимо,выбран из группы, включающей 3-6-членный карбоцикл или 5-6-членный гетероцикл, где указанные гетероцикл и карбоцикл могут быть необязательно замещены одной или более группами, выбранными из группы, включающей оксо, -OR5 , -R5, -N(R5)(R5), -N(R5)-C(O)-R5, -R5 001221OH, -CN, -CO2R5, -C(O)-N(R5)(R5), галоген и СF3. Если не оговорено особо, термин "[переменная], как определено в формуле I," относится к определениям, указанным непосредственно выше. Предпочтительные соединения формулы I,используемые в композициях по данному изобретению, включают соединения, имеющие, по крайней мере, одну переменную, определяемую как предпочтительное, более предпочтительное,еще более предпочтительное или наиболее предпочтительное определение, указанное выше. Более предпочтительные соединения формулы I, используемые в композициях по данному изобретению, включают соединения, имеющие, по крайней мере, две-три переменные, определяемые независимо как предпочтительные,более предпочтительные, еще более предпочтительные или наиболее предпочтительные определения, указанные выше. Наиболее предпочтительные соединения формулы I, используемые в композициях по данному изобретению, включают соединения, имеющие, по крайней мере,четыре-пять переменных, определяемых независимо как предпочтительные, более предпочтительные, еще более предпочтительные или наиболее предпочтительные определения, указанные выше. Табл. 1 иллюстрирует предпочтительные соединения, используемые в композициях по данному изобретению: Более предпочтительные соединения, используемые в композициях по данному изобретению, выбраны из группы, состоящей из соединения 35; соединения 37; соединения 48; соединения 52; соединения 60; соединения 66; соединения 86; соединения 88; соединения 91; соединения 93; соединения 94; соединения 95; соединения 99; соединения 100; соединения 112; соединения 113; соединения 116; соединения 124; соединения 125; соединения 132; со 23 единения 134; соединения 135; соединения 138; соединения 140; соединения 144; соединения 145; соединения 148; соединения 149; соединения 150; соединения 151; соединения 152; соединения 157; соединения 158; соединения 159; соединения 160; соединения 165; соединения 167; соединения 168; соединения 169; соединения 170; соединения 171; соединения 173; соединения 175; соединения 176; соединения 180; соединения 181; соединения 182; соединения 183; соединения 195; соединения 196; соединения 197; соединения 198; соединения 200; соединения 201; соединения 202; соединения 203; соединения 204; соединения 205; соединения 206; соединения 208; соединения 209; соединения 210; соединения 211; соединения 212; соединения 213; соединения 216; соединения 217; соединения 218; соединения 219; соединения 220; соединения 221; соединения 222; соединения 224; соединения 227; соединения 233, где каждое соединение имеет формулу, представленную в табл. 1. Еще более предпочтительные соединения,используемые в композициях по данному изобретению, выбраны из группы, состоящей из соединения 48; соединения 100; соединения 116; соединения 140; соединения 148; соединения 158; соединения 160; соединения 168; соединения 169; соединения 171; соединения 173; соединения 175; соединения 176; соединения 180; соединения 181; соединения 195; соединения 197; соединения 198; соединения 202; соединения 206; соединения 211; соединения 216; соединения 217; соединения 219; соединения 220, где каждое соединение имеет формулу,представленную в табл. 1. Наиболее предпочтительные соединения,используемые в композициях по данному изобретению, выбраны из группы, состоящей из соединения 140; соединения 168; соединения 169; соединения 171; соединения 175; соединения 216; соединения 217, где каждое соединение имеет формулу, представленную в табл. 1. ТГФ-содержащие сульфонамиды по данному соединению можно синтезировать, используя стандартные способы. Преимущественно, эти соединения удобно синтезировать из легко доступных исходных веществ. Соединения, используемые в композициях по данному изобретению, являются одними из наиболее легко синтезируемых известных ингибиторов ВИЧ протеазы. Ранее описанные ингибиторы ВИЧ протеазы часто содержат четыре или более хиральных центра, многочисленные пептидные связи и/или требуют чувствительных к атмосфере реагентов (таких как металлоорганические комплексы) для их эффективного синтеза. Относительная легкость, с которой соединения по данному изобретению можно синтезировать, представляет огромное преимущество при больших масштабах производства этих соединений. 24 Обычно ТГФ-содержащие сульфонамиды,используемые в композициях по данному изобретению, удобно получать из -аминокислот и их производных, имеющих общую формулу II(II) где W представляет водород или Р; Р представляет подходящую аминозащитную группу; Q представляет водород, бензил или A-R1-; Y представляет -С(О)ОН, -С(O)Н или -СН 2OН; иD и A-R1- такие, как описано выше для соединений формулы I. W и Q могут быть также соединены вместе с азотом, к которому они присоединены с образованием гетероцикла. Например, такое строение имеет фталимид. Подходящие аминозащитные группы описаны в многочисленных ссылках, включая T.W. Greene andL. Paquette, ed. Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995). Примеры таких аминозащитных групп включают, но ими не ограничиваются, Воc, Cbz и Alloc. Альтернативно, амин может быть защищен в виде алкильного производного, такого как N,Nдибензил или тритил. Такие производные аминокислоты часто коммерчески доступны или их удобно получать из коммерчески доступных производных -аминокислоты, используя известные способы. Хотя изобретение предусматривает использование рацемических смесей таких исходных веществ, отдельный энантиомер(предпочтительно в S конфигурации) предпочтителен. Используя известные способы, производные -аминокислоты общей формулы P-N(Q)СН(D)-СООН можно легко преобразовать в производное аминокетона общей формулы PN(Q)-СН(D)-СО-СН 2-Х, где Р, Q и D являются такими, как определено для соединений формулII, и X представляет уходящую группу, которая соответствующим образом активирует углерод (т.е. увеличивает восприимчивость метилена к нуклеофильной атаке). Подходящие уходящие группы хорошо известны в данной области и включают галогениды, соли диалкилсульфония и сульфонаты, такой как метансульфонат, трифторметансульфонат или 4 толуолсульфонат. Х может быть, кроме того,гидроксилом, который образуется в процессе реакции в уходящую группу (например, путем обработки с триалкил- или триарилфосфином в присутствии диалкилазодикарбоксилата). Способы получения таких производных аминокетона хорошо известны специалистам в данной области (см., например, S.J. Fittkau, J. Prakt.Chem., 315, р. 1037 (1973. Кроме того, некоторые производные аминокетона коммерчески доступны (например, от Bachem Biosciences,Inc., Philadelphia, Pennsylvania). 25 Затем производные аминокетона можно восстановить в соответствующий аминоспирт,представленный формулойP-N(Q)-CH(D)СН(ОН)-СН 2-Х, где Р, Q и D являются такими,как определено для соединений формул II, и Х представляет уходящую группу, как определено выше. Альтернативно, производное аминокетона может быть восстановлено в соответствующий спирт затем по схеме синтеза. Специалистам в данной области хорошо известно много способов восстановления аминокетоновых производных, таких как P-N(Q)-CH(D)-CO-CH2-XTransformations", pp. 527-547, VCH Publishers,Inc. 1989 и цитированные там ссылки). Предпочтительным восстанавливающим агентом является боргидрид натрия. Реакцию восстановления обычно проводят при температуре от около -40 С до около 40 С (предпочтительно от около 0 С до около 20 С), в подходящей системе растворителей, такой как, например, водный или чистый тетрагидрофуран или низший спирт,такой как метанол или этанол. Хотя данное изобретение предусматривает как стереоспецифическое, так и нестереоспецифическое восстановление аминокетонового производного PN(Q)-CH(D)-CO-CH2-X, стереоспецифическое восстановление предпочтительно. Стереоселективное восстановление можно осуществлять с использованием хиральных реагентов, известных в данной области, или с использованием нехирального восстанавливающего агента на хиральном субстрате. В данном изобретении стереоселективное восстановление может быть удобно проведено,например,в нехелатирующих восстанавливающих условиях,когда хиральное введение вновь образуемой гидроксильной группы устанавливается посредством стереохимии D группы (т.е. Felkin-Ahn присоединение гидрида). Особенно предпочтительны стереоселективные восстановления, в которых образующийся гидроксил находится в син-положении к D. Обнаружено, что когда гидроксильная группа находится в синположении к D, то конечный сульфонамидный продукт является более сильнодействующим ингибитором ВИЧ протеазы, чем его антидиастереомер. Гидроксильная группа аминоспирта может быть необязательно защищена с помощью любой известной кислородзащитной группы (такой как триалкилсилил, бензил, ацеталь или алкилоксиметил) с получением защищенного аминоспирта, имеющего формулу P-N(Q)-CH(D)С(OR7)-СН 2-Х, где P, Q и D являются такими,как определено для соединений формулы II, и Х представляет определенную выше уходящую группу, и R7 представляет Н или подходящую гидроксизащитную группу. Некоторые используемые защитные группы описаны T.W. GreeneL. Paquette, ed. Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995). Затем аминоспирт может быть подвергнут взаимодействию с нуклеофильным соединением амина с образованием промежуточного продукта формулы III где W, Q и D такие, как определено для формулы II, R7 представляет Н или любую подходящую кислородзащитную группу и L представляет либо D' (как описано для соединений формулы I), либо водород. Альтернативно, аминокислотное производное может быть подвергнуто взаимодействию с нуклеофильным нитросоединением (например, анион нитрометана или его производное), которое можно восстановить в одну или более стадий с образованием интермедиата формулы III. По особенно преимущественной схеме синтеза одновременная активация метилена и защита спирта могут достигаться путем образования N-защищенного аминоэпоксида из кислорода и его соседнего метилена с получением промежуточного соединения формулы IV где W, Q и D такие, как определено для соединений формулы II. Приемлемые системы растворителей для получения N-защищенного аминоэпоксида включают этанол, метанол, изопропанол, тетрагидрофуран, диоксан, диметилформамид и т.п.(включая их смеси). К предпочтительным основаниям для получения эпоксида относятся гидроксиды щелочного металла, трет-бутоксид калия, ДБУ и т.п. Предпочтительным основанием является гидроксид калия. Альтернативно, N-защищенный аминоэпоксид можно получить путем взаимодействия дианиона (алкилтио) или (фенилтио)уксусной кислоты с циклическим N-карбоксиангидридом защищенной -аминокислоты (такой как BOCPhe-NCA, доступный из пропептида). Предпочтительным дианионом уксусной кислоты является дианион (метилтио)уксусной кислоты. Затем полученный аминокетон можно восстановить (например, боргидридом натрия). Полученный аминоспирт легко превращают в аминоэпоксид путем кватернизации (например, метилиодидом) с последующим закрытием кольца 27 активированного интермедиата) с амином выполняют как таковые, т.е. в отсутствии растворителя, или в присутствии полярного растворителя, такого как низшие алканолы, вода, диметилформамид или диметилсульфоксид. Реакцию удобно проводить при температуре от около-5 С и 100 С. Альтернативно, реакцию можно проводить в присутствии активирующего агента, такого как активированный оксид алюминия в инертном растворителе, предпочтительно в простом эфире, таком как диэтиловый эфир,тетрагидрофуран, диоксан или трет-бутил метиловый эфир, удобно от комнатной температуры до около 110 С, как описано Posner and Rogers,J. Am. Chem. Soc. 99, p. 8208 (1977). Другие активирующие реагенты включают производное низшего триалкилалюминия, такое как триэтилалюминий,или производное диалкилалюминийгалогенида, такое как диэтилалюминийхлорид (Overman and Flippin, TetrahedronLetters, p. 195 (1981. Реакции, включающие эти производные, удобно проводить в инертных растворителях, таких как дихлорметан, 1,2 дихлорэтан, толуол или ацетонитрил, при температуре от около 0 С до около 110 С. Известны другие способы вытеснения уходящих групп, или раскрытия эпоксидов с помощью аминов или других эквивалентов, таких как азиды или триметилсилилцианид (Gassman and(1982), и они очевидны для специалистов в данной области. Соединения формул II, III и IV, и их функционально-защищенные производные, используют в качестве промежуточных соединений для получения соединений формулы I. В тех случаях, когда L представляет D', соединения формулы III могут быть преобразованы в соединения формулы I путем взаимодействия с сульфонилактивированным производным с получением сульфонамидов, сульфонилмочевин, тиокарбаматов и т.п. Способы получения таких сульфонилактивированных производных хорошо известны специалистам в данной области. Обычно для получения сульфонамидов используют сульфонилгалогениды. Многие сульфонилгалогениды коммерчески доступны, другие можно легко получить, используя обычные стандартные способы синтеза (Gilbert, E.E. "Recent Developments in Preparative Sulfonation andFuran-2-sulfonamides as Topical Carbonic Anhydrase Inhibitors" J. Med. Chem., 35, p.3822 (1992) и ссылки, цитируемые там. Сульфонилмочевины обычно получают взаимодействием амина с сульфурилхлоридом или подходящим эквивалентом, таким как сульфурил-бис 001221 28 имидазол или сульфурил-бис-N-метилимидазол. Тиокарбаматы обычно получают взаимодействием спирта с сульфурилхлоридом или подходящим эквивалентом, таким как сульфурил-бисимидазол или сульфурил-бис-N-метилимидазол. В случае соединений формулы III, где L обозначает водород, превращение полученного первичного амина во вторичный амин можно осуществить с помощью известных способов. Такие способы включают взаимодействие с алкилгалогенидом или алкилсульфонатом, или воссстановительное алкилирование альдегидом или карбоновой кислотой, или их активированным производным, используя, например, каталитическое гидрирование или цианборгидрид натрия (Borch et al., J. Am. Chem. Soc., 93, p. 2897 (1971. Альтернативно, первичный амин можно ацилировать с последующим восстановлением бораном или другим подходящим восстанавливающим реагентом, например, как описано Cushman et al., J. Org. Chem., 56, р. 4161(1991). Этот способ особенно используют для соединений формулы III, где W представляет защитную группу,такую как третбутоксикарбонил (Воc) или бензилоксикарбонил (Cbz), и Q представляет Н, или где как W,так и Q являются бензилом. Если переменные W и Q конкретного соединения формулы V представляют удаляемые защитные группы, то удаление любой или обеих групп с последующим взаимодействием полученного амина с соответствующим активированным реагентом преимущественно приводит к получению другого соединения формулы V. Например, соответствующий амид обычно получают взаимодействием с активированным карбоксилатом, таким как ацильное галоидное соединение (например, фторангидриды, хлорангидриды и бромангидриды), активированным сложным эфиром, таким как 2- или 4-нитрофениловые сложные эфиры, галогенарильными сложными эфирами (например, пентафторфенильным или пентахлорфенильным) или 1 гидроксисукцинимидным (HOSu) сложным эфиром, производным активированного карбодиимида, ангидридом, таким как симметричный ангидрид (например, изобутиловый ангидрид),или смешанными ангидридами угольнойфосфорной кислот или угольной-фосфиновой кислот. Мочевины можно получить реакцией с изоцианатами или аминами в присутствии бисактивированных производных угольной кислоты, таких как фосген или карбонилдиимидазол("КДИ"). Карбаматы можно получить реакцией с хлоркарбонатами, карбонатами, эстерифицированными отщепляемыми группами, такими как 1-гидроксибензотриазол ("НОБТ"), HOSu, 29 или 4-нитрофенолом или спиртами в присутствии бис-активированных производных угольной кислоты, таких как фосген или его синтетические эквиваленты, включая дифосген и трифосген, или карбонилдиимидазол. Примером такого карбоната являетсяN-сукцинимидил-(3S)тетрагидрофуран-3-ил карбонат. Легко предвидеть, что для облегчения протекания конкретных реакций, может потребоваться защита одной или более потенциально реакционноспособных групп с последующим удалением этой защитной группы. Такая модификация в реакционных схемах, описанных в общих чертах выше, очевидна для специалиста в данной области. Ниже представлена особенно используемая схема синтеза для получения предпочтительных сульфонамидных промежуточных соединений формулы VIII, где для соединений формул VI, VII и VIII, W и Q такие, как определены выше для соединений формулы II, D' и Е такие, как определены для соединений формулы Соединения формулы VIII могут быть преимущественно синтезированы из легко доступных исходных веществ, таких как эпоксид(1993) и В.Е. Evans et al., J. Org. Chem., 50, p. 4615 (1985. Каждая стадия вышеупомянутой схемы синтеза может быть осуществлена, как описано выше. С точки зрения специалиста в данной области, предполагается, что вышеупомянутые схемы синтеза не включают исчерпывающий перечень всех способов, с помощью которых могут быть синтезированы соединения, описанные в этой заявке. Специалистам в данной области совершенно очевидны другие способы. Кроме того, различные синтетические стадии,описанные выше, могут быть осуществлены в альтернативной последовательности или порядке с получением требуемых соединений. Соединения, используемые в композициях по данному изобретению, можно модифициро 001221 30 вать с помощью присоединяемых подходящих функциональных групп, чтобы повысить селективные биологические свойства. Такие модификации известны в данной области и включают модификации, которые повышают биологическое проникновение в данный биологический компартмент (например, кровь, лимфатическая система, центральная нервная система), повышают пероральную доступность, повышают растворимость, что позволяет осуществить введение при помощи инъекций, позволяет изменять метаболизм и изменять скорость выведения. Соединения, используемые по данному изобретению, являются превосходными лигандами для аспартил-протеаз, в частности ВИЧ-1 и ВИЧ-2 протеаз. Таким образом, эти соединения способны помечать и ингибировать протекание поздней стадии при ВИЧ репликации, т.е. процессинг вирусных полипротеинов ВИЧ кодируемыми протеазами. Такие соединения ингибируют протеолитический процессинг предшественников вирусных полипротеинов путем ингибирования аспартил-протеазы. Поскольку аспартил-протеаза является существенной для продуцирования зрелых вирионов, ингибирование такого процессинга эффективно блокирует распространение вируса путем ингибирования получения инфекционных вирионов, в частности из хронически инфицированных клеток. Соединения, используемые в композициях по данному изобретению, успешно ингибируют способность ВИЧ-1 вируса инфицировать иммортализованные Т клетки человека на протяжении периода дней, определяемого с помощью анализа экстрацеллюларного р 24 антигена специфического маркера вирусной репликации. Другие антивирусные анализы подтвердили эффективность этих соединений. Соединения, используемые в композициях по данному изобретению, могут быть использованы обычным способом для воздействия на вирусы, такие как ВИЧ и HTLV, что зависит от аспартил-протеаз для облигатных событий в их жизненном цикле. Такие способы воздействия,их уровни дозирования и требования могут быть выбраны специалистом в данной области из доступных способов и техник. Например, композиции по данному изобретению содержат аспартил-протеазу в сочетании с одним или несколькими дополнительными противовирусными агентами и иммуностимуляторами и фармацевтически приемлемым адъювантом для введения вирусноинфицированному пациенту фармацевтически приемлемым способом и в количестве, эффективном для уменьшения тяжести вирусной инфекции или облегчения патологических воздействий, связанных с ВИЧ инфекцией или иммунодепрессией, таких как условнопатогенные инфекции или различные злокачественные новообразования, при условии, что 31 композиции не содержат второй ингибитор протеаз. Альтернативно, композиции по данному изобретению можно использовать для профилактики и способов защиты индивидуумов от вирусной инфекции во время конкретного случая, такого как роды, или на протяжении длительного периода времени. При такой профилактике можно использовать композиции, которые содержат ингибитор аспартил-протеазы вместе с другими противоретровирусными средствами для повышения эффективности каждого средства. Как таковые, новые композиции по данному изобретению можно применять в качестве средств для лечения или предотвращения ВИЧ инфекции у млекопитающего. Соединения формулы I, используемые в композициях по данному изобретению, в частности, имеющие молекулярную массу менее чем около 700 г/моль, могут легко абсорбироваться в кровоток млекопитающих после перорального применения. Соединения формулы I,имеющие молекулярную массу менее чем около 600 г/моль и растворимость в воде выше, чем или равную 0,1 мг/мл, наиболее вероятно демонстрируют высокую и логичную пригодность для орального применения. Эта неожиданно впечатляющая пригодность для орального применения делает эти соединения превосходными средствами для лечения путем перорального применения и схем предотвращения ВИЧ инфекции. Помимо оральной биодоступности, соединения, используемые в композициях по данному изобретению, также имеют впечатляюще высокий терапевтический индекс (который измеряет токсичность в зависимости от антивирусного действия). Таким образом, соединения, используемые в композициях по данному изобретению, эффективны при более низких уровнях доз, чем многие ранее описанные обычно используемые противоретровирусные средства, и позволяют избежать многих из тяжелых токсичных воздействий, связанных со стандартными лекарственными средствами. Потенциал этих подлежащих доставке соединений при дозах,значительно превышающих их эффективные противовирусные уровни, благоприятен (полезен) для замедления или предотвращения возможности развития устойчивых форм. Соединения, используемые в композициях по данному изобретению, вводят здоровому или ВИЧ-инфицированному пациенту в сочетании с другими антивирусными средствами, которые мешают циклу репликации ВИЧ, при условии,что композиция не содержит второй ингибитор протеазы. При введении соединений, используемых в композициях по данному изобретению, с другими антивирусными средствами,которые отмечают различные стадии в жизненном цикле вируса, терапевтическое действие этих соединений усиливается. Например, совме 001221 32 стно введенное антивирусное средство может быть одним, которое на ранней стадии отмечает процесс в жизненном цикле вируса, такие как проникновение в клетку, обратная транскрипция и интеграция вирусной ДНК (DNA) в клеточную ДНК (DNA). Противо-ВИЧ средства,отмечающие такие ранние процессы жизненного цикла, включают диданозин (ddl), дидезоксицитидин (ddC), d4T, зидовудин (AZT), 3 ТС,935U83, 1592U89, 524W91, полисульфированные полисахариды, sT4 (растворимый CD4),ганикловир, тринатрий фосфонформиат, эфлорнитин, рибавирин, ацикловир, альфа интерферон и триметрексат. Кроме того, ненуклеозидные ингибиторы обратной транскриптазы, такие как TIBO, делавирдин (U90) или невирапин, можно использовать для усиления действия соединений, используемых в композициях по данному изобретению, как могут это делать ингибиторы декапсидации вириона, ингибиторы транс-активирующих белков, таких как тат или рев, или ингибиторы вирусной интегразы. Комбинированная терапия согласно данному изобретению проявляет дополнительное или синергическое действие при ингибировании ВИЧ репликации, так как каждый компонентагент комбинации действует на различный сайт ВИЧ репликации. Использование таких комбинационных терапий приводит также к полезному уменьшению дозы даваемого стандартного противоретровирусного средства,которая обычно требуется для желаемого терапевтического или профилактического действия, по сравнению с тем, когда такое средство применяют в виде монотерапии. Такие комбинации могут уменьшить или устранить побочные действия стандартных терапий с использованием только одного противоретровирусного средства,не мешая противоретровирусной активности этих средств. Эти комбинации понижают потенциал устойчивости к терапиям с использованием только одного средства, сводя к минимуму любую связанную с ними токсичность. Эти комбинации могут также повысить эффективность стандартного средства без увеличения связанной с ним токсичности. В частности, нами обнаружено, что в сочетании с другими противо-ВИЧ средствами, соединения по данному изобретению действуют дополнительным или синергическим способом в предотвращении репликации ВИЧ в Т клетках человека. Предпочтительные комбинированные терапии включают применение композиций по данному изобретению, содержащих ингибитор аспартилпротеазы, такой как AZT, ddT, ddC, d4T, 3TC,935U83, 1592U89, 524W91 или их комбинацией. Композиции по данному изобретению содержат аспартил-протеазу в сочетании с ингибиторами ретровирусной обратной транскриптазы, такими как нуклеозидные производные,включая составные комбинации, содержащие 3 33 5 средств. Заявители полагают, что совместное применение аспартил-протеазы с ингибиторами ретровирусной обратной транскриптазы может оказывать значительное добавочное или синергическое действие, тем самым предотвращая,значительно понижая или полностью устраняя вирусную репликацию или инфекцию или и то,и другое, и симптомы, связанные с ними. Кроме того, поскольку вирусы способны достаточно быстро развить устойчивость к некоторым ингибиторам аспартил-протеазы, мы полагаем, что применение комбинации агентов может способствовать замедлению развития устойчивых вирусов по сравнению с применением только единственных агентов. Композиции по данному изобретению могут также содержать ингибитор аспартилпротеазы в сочетании с иммуномодуляторами и иммуностимуляторами (например, бропиримин,анти-человек альфа интерферон антитело, IL-2,GM-CSF, интерферон альфа, диэтилдитиокарбамат, фактор некроза опухоли, налтрексон,тускаразол, и rЕРО); и антибиотиками (например, пентамидин изетиорат), чтобы предотвратить или бороться с инфекцией и болезнью, связанными с BИЧ инфекциями, такими как СПИД,СПИД-ассоциированный комплекс (ССК) и ВИЧ-ассоциируемые злокачественные опухоли. Фармацевтические композиции согласно данному изобретению могут включать комбинацию ингибитора аспартил-протеазы и одного или несколько терапевтических или профилактических средств, при условии, что композиция не содержит второй ингибитор протеазы. Хотя данное изобретение фокусируется на использовании композиций, описанных здесь для предотвращения и лечения ВИЧ инфекции,композиции по данному изобретению можно также использовать в качестве ингибирующих средств для других вирусов, которые зависят от аналогичных аспартил-протеаз для облигатных событий в их жизненном цикле. Эти вирусы включают другие СПИД-подобные заболевания,вызываемые ретровирусами, такими как вирусы иммунодефицита обезьяны, HTLV-1 и HTLV-II. Кроме того, композиции по данному изобретению можно также использовать для ингибирования других аспартил-протеаз, и, в частности,других аспартил-протеаз человека, включая ренин и аспартил-протеазы, которые процессируют предшественников эндотелина. Фармацевтические композиции по данному изобретению включают любые соединения по данному изобретению, и фармацевтически приемлемые их соли, с любым фармацевтически приемлемым носителем, адъювантом или разбавителем. Фармацевтически приемлемые носители, адъюванты и разбавители, которые можно использовать в фармацевтических композициях этого изобретения, включают, но ими не ограничиваются, ион-обменники, оксид алюминия,стеарат алюминия, лецитин, системы доставки(SEDDS), такие как d-токоферол полиэтиленгликоль 1000 сукцинат, или другие подобные полимерные матрицы доставки, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протамин сульфат,динатрий кислый фосфат, калий кислый фосфат,хлорид натрия, соли цинка, коллоидный оксид кремния, магний трисиликат, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлоза,полиакрилаты, воски, полиэтилен-полиоксипропилен-блок полимеры, полиэтилен-гликоль и жир для волос. Циклодекстрины, такие как -,-, и -циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и 3-гидроксипропилциклодекстрины, или другие солюбилизированные производные, также полезно использовать для повышения доставки соединений формулы I. Фармацевтические композиции по данному изобретению можно применять орально, парентерально, путем ингаляции с помощью распыления, местно, ректально, назально, букально, вагинально или через имплантированный резервуар. Предпочтительно оральное введение или введение путем инъекции. Фармацевтические композиции по данному изобретению могут содержать любые нетоксичные фармацевтически пригодные носители, адъюванты или наполнители. В некоторых случаях, рН состава может быть доведен фармацевтически пригодными кислотами, основаниями или буферами для усиления стабильности введенного в состав соединения или его формы доставки. Используемый здесь термин парентеральный включает подкожное, внутрикожное, внутривенное, внутримышечное, интраартикулярное,внутрисуставное, внутригрудинное, внутриоболочечное, внутриопухолевое, и внутричерепное введение или техники инфузии. Фармацевтические композиции могут быть в форме стерильного инъецируемого препарата,например, в виде стерильной водной или маслянистой суспензии. Эта суспензия может быть составлена согласно известным в данной области техникам с использованием подходящих диспергирующих или увлажняющих агентов(таких как, например, Твин 80) или суспендирующих агентов. Стерильный препарат для инъекции также может представлять стерильный раствор или суспензию для инъекции в нетоксичном, пригодном для парентерального применения, разбавителе или растворителе, например, в виде раствора в 1,3-бутандиола. К пригодным носителям и растворителям, кото 35 рые можно применять, относятся маннит, вода,Ringer's раствор и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. В этом случае, можно применять любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные,применяют при приготовлении препаратов для инъецирования, каковыми являются природные фармацевтическипригодные масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти растворы масел или суспензии могут также включать длинноцепочечный спирт-разбавитель или диспергирующее вещество, такое как Ph.Hely или аналогичный спирт. Фармацевтические композиции по данному изобретению можно применять перорально в любой орально приемлемой лекарственной форме, включая, но не ограничиваясь, капсулы,таблетки и водные суспензии и растворы. В случае таблеток для перорального применения носители, которые обычно используют, включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие средства, такие как стеарат магния. Для орального применения в виде капсул, используемые разбавители включают лактозу и высушенный кукурузный крахмал. Когда водную суспензию вводят орально, активный ингредиент комбинируют с эмульгирующими и суспендирующими средствами. При необходимости, можно добавить некоторые сластители и/или отдушки, и/или красители. Фармацевтические композиции по данному изобретению можно вводить в форме суппозиториев для ректального применения. Эти композиции можно получить путем смешения соединения по данному изобретению с подходящим нераздражающим наполнителем, который является твердым веществом при комнатной температуре, но становится жидким при ректальной температуре и поэтому будет плавиться в ректуме, освобождая активные компоненты. Такие вещества включают, но ими не ограничиваются, масло какао, пчелиный воск и полиэтиленгликоли. Местное применение фармацевтических композициий по данному изобретению особенно полезно, когда требуемое лечение включает поверхности или органы, легко доступные для местного применения. Для местного применения к коже, фармацевтическую композицию следует составлять с подходящей мазью, содержащей активные компоненты, суспендированные или растворенные в носителе. Носители для местного применения соединений по данному изобретению включают, но ими не ограничиваются, минеральное масло, вазелиновое масло,белый вазелин, пропиленгликоль, эмульгирую 001221 36 щий воск и вода. Альтернативно, фармацевтическую композицию можно составить с подходящим лосьоном или кремом, содержащим активное соединение, суспендированное или растворенное в носителе. К подходящим носителям относятся, но ими не ограничиваются, минеральное масло (вазелиновое масло), сорбитан моностеарат, полисорбат 60, цетиловые сложные эфиры воска, цетариловый спирт, 2 октилдодеканол, бензиловый спирт и вода. Кроме того, фармацевтические композиции по данному изобретению можно применять местно к области нижнего кишечного тракта, используя ректальный состав для суппозиториев или подходящий состав для клизмы. Трансдермальные повязки для местного применения также включены в данное изобретение. Фармацевтические композиции по данному изобретению можно применять в виде назального аэрозоля или путем ингаляции. Такие композиции получают согласно способам, общепринятым в данной области технологии приготовления лекарственного средства, и их можно получить в виде растворов в физиологическом растворе, используя бензиловый спирт или другие подходящие консерванты, промоторы абсорбции для повышения биодоступности,фторуглеводороды, и/или другие солюбилизирующие или диспергирующие средства, известные в данной области. Для предотвращения или лечения вирусной инфекции, включая ВИЧ инфекцию, используют уровни доз от около 0,01 до около 100 мг/кг веса в день, предпочтительно от около 0,5 до около 75 мг/кг веса в день, активного ингредиента-соединения. Обычно фармацевтические композиции по данному изобретению применяют от 1 до 5 раз в день или альтернативно в виде длительного вливания. Такое применение можно использовать при лечении хронических и острых заболеваний. Количество активного ингредиента, которое можно комбинировать с веществами-носителями для получения разовой лекарственной формы, может варьироваться в зависимости от хозяина, подвергаемого лечению, и конкретного способа введения. Обычный препарат может содержать от около 5 до около 95% активного соединения (вес/вес). Предпочтительно такие препараты содержат от около 20 до около 80% активного соединения. После улучшения состояния пациента, при необходимости, можно применять поддерживающую дозу соединения, композиции или комбинации по данному изобретению. Затем дозу или частоту применения, или и то, и другое можно уменьшить, как функцию симптомов заболевания, до уровня, при котором улучшенное состояние сохраняется, после того как симптомы облегчаются до требуемого уровня, лечение следует прекратить. Пациентам, однако,может потребоваться периодическое лечение в 37 течение длительного времени после рецидива симптомов заболевания. Для специалистов в данной области очевидно, что могут потребоваться более низкие или более высокие дозы, чем цитированные выше. Конкретная доза и схемы лечения для любого конкретного пациента обычно зависят от ряда факторов, включая активность используемого конкретного соединения, возраста, веса тела, общего состояния здоровья, пола, диеты,времени приема, степени выделения, комбинации лекарственного средства, тяжести и течения инфекции, предрасположения пациента к инфекции и оценки лечащего врача. Соединения по данному изобретению также используют как коммерческие реагенты, которые эффективно связываются с аспартилпротеазами, особенно ВИЧ аспартил-протеазой. Как коммерческие реагенты, соединения по данному изобретению, и их производные, можно использовать для блокирования протеолиза пептида-мишени или их можно превратить в производное для того, чтобы связать со стабильной смолой в качестве связываемого субстрата для применения в аффинной хроматографии. Например, соединение формулы I можно связать с аффинной колонкой, чтобы очистить рекомбинантно полученную ВИЧ протеазу. Дериватизация соединений по данному изобретению с получением смол для аффинной хроматографии и способы, используемые для очистки протеаз, использующие такие смолы,хорошо известны и очевидны для специалистов в данной области. Эти и другие применения,которые характеризуют коммерческие ингибиторы аспартил-протеаз, очевидны для специалистов в данной области (см. Rittenhouse, et al.(1989. Для более полного понимания данного изобретения представлены нижеследующие примеры. Эти примеры носят только иллюстративный характер и их не следует рассматривать как ограничивающие каким-либо путем объем данного изобретения. Основные вещества и способы Все температуры выражают в градусах Цельсия. Тонкослойную хроматографию (ТСХ,TLC) осуществляют, используя Е. Merck силикагеля 60 F254 пластины толщиной 0,25 мм и элюирование указанной системой растворителей. Обнаружение соединений осуществляют путем обработки пластины соответствующим визуализирующим агентом, таким как 10% раствор фосфорно-молибденовой кислоты в этаноле или 0,1% раствор нингидрина в этаноле, с последующим нагреванием и/или последующей экспозицией УФ-светом или парами иода, когда целесообразно. Толстослойную хроматографию на силикагеле осуществляют, используя Е. 38 щиной 0,5, 1,0, или 2,0 мм. После проявления пластины, полосу диоксида кремния, содержащую требуемое соединение, изолируют и элюируют соответствующим растворителем. Аналитическую ВЭЖХ (HPLC) осуществляют, используя Water's Delta Pak, 5 мкМ диоксид кремния, колонку с С 18 обращенной фазой, 3,9 мм ВД (ID) x 15 см Д (L), при скорости протока 1,5 мл/мин, используя следующую таблицу: Мобильная фаза: А=0,1% СF3 СO2 Н в H2O В=0,1% СF3 СO2 Н в CH3CN Градиент: Т=0 мин, А (95%), В (5%) Т=20 мин, А (0%), В (100%) Т=22,5 мин, А (0%), В (100%) Препаративную ВЭЖХ (HPLC) также осуществляют, используя среды с C18 обращенной фазой. Времена удерживания в методе ВЭЖХ регистрируются в минутах. Спектральные данные ЯМР записывают, используя BrukerQNP датчиком, при 500 МГц, и спектр снимают в указанном растворителе. Нами определены константы ингибирования каждого соединения по отношению к ВИЧ 1 протеазе, используя способ, описанный, в основном, M.W. Pennington et al., Peptides 1990,Gimet, Е. и D. Andrew, Eds., Escom; Leiden,Netherlands (1990). Соединения формулы I испытывают на их противовирусную эффективность в нескольких вирологических анализах. В первом анализе соединения добавляют в виде раствора в диметилсульфоксиде (ДМСО, DMSO) к культуре клеток теста CCRM-CEM клеток, штамму CD4+ клеток Т-клеток лимфомы человека, ранее остро инфицированных ВИЧIIIb, используя стандартные протоколы (см. Meek, T.D. et al., "Inhibition(1990). Предпочтительными соединениями являются соединения, которые способны ингибировать 90% вирусной инфективности при концентрации 1 мкМ или менее. Более предпочтительными соединениями являются соединения,которые способны ингибировать 90% вирусной инфективности при концентрации 100 нМ или менее. Действие соединений на ингибирование репликации вируса измеряют путем определения концентрации ВИЧ внеклеточного р 24 антигена, используя коммерческий иммуноферментный анализ (полученный от Coulter Corporation, Hialeah, FL). В зависимости от типа клетки и требуемого считывания данных в качестве отсчета противовирусной активности можно использовать образование синцития, активность обратной транскриптазы (RT) или цитопатическое действие, анализируемое с помощью метода поглощения красителя. См. H.Mitsuya and S.Broder,"Inhibition of the in vitro infectivity and cytopathicAcad. Sci. USA, vol. 83, pp. 1911-1915 (1986). Действие соединений формулы I на клинические изоляты других ВИЧ-1 штаммов определяют путем получения низко-пассажного (lowpassages) вируса от ВИЧ-инфицированных пациентов и анализа действия ингибиторов на предотвращение инфекции ВИЧ вируса в свежеполученных одноядерных клетках периферической крови человека (PBMCs). Поскольку соединения формулы I способны ингибировать репликацию ВИЧ вируса в Тклетках человека и, кроме того, могут доставляться перорально млекопитающим, то представляется очевидным их клиническое использование для лечения ВИЧ инфекции. Эти тесты предсказывают способность соединений ингибировать ВИЧ протеазу in vivo. Пример 1. Синтез соединения 35. А. Соединение VII (D'=изобутил, W=третбутоксикарбонил, Q=Н, Р'=Н). Раствор 4,1 г эпоксида VI (W=Boc, Q=H) в 30 мл этанола обрабатывают 22,4 мл изобутиламина и нагревают при температуре кипения флегмы в течение 1 ч. Смесь концентрируют, получая названное соединение в виде белого твердого вещества, которое используют без последующей очистки. ЯМР (CDCl3) :0,91 (д, 3 Н); 0,93 (д, 3 Н); 1,37 (с, 9 Н); 1,68 (ш с, 2 Н); 2,40 (д, 2 Н); 2,68 (д,2 Н); 2,87 (дд, 1 Н); 2,99 (дд, 1 Н); 3,46 (дд, 1 Н); 3,75 (ш с, 1 Н); 3,80 (ш с, 1 Н); 4,69 (д, 1 Н); 7,197,32 (м, 4 Н). В. Соединение 32. Раствор 391 мг полученного соединения примера 1 А в 4:1 смеси СН 2 Сl2/насыщенный водный NаНСО 3 обрабатывают последовательно при температуре окружающей среды в атмосфере азота, 271 мг 4 фторбензолсульфонил хлорида и 117 мг бикарбоната натрия. Смесь перемешивают в течение 14 ч, разбавляют СН 2 Сl2, промывают насыщенным NaCl, затем сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией низкого давления на силикагеле, используя 5% диэтиловый эфир в CH2Cl2 в качестве элюента, получая 420 мг названного соединения в виде белого твердого вещества. ТСХ (TLC): Rf=0,20, 5% диэтиловый эфир в(СDСl3) соответствует структуре. С. Соединение VIII (W=Н, Q=Н, D'= изобутил, Е=4-фторфенил, гидрохлоридная соль). Раствор 398 мг полученного соединения примера 1 В в этилацетате обрабатывают при -20 СHCl-газом. НСl пробулькивают через смесь в течение 20 мин, и на протяжении этого времени температура смеси поднимается до 20 С. Затем смесь пробулькивают азотом еще в течение 15 мин и растворитель удаляют в вакууме, получая 347 мг названного соединения в виде белого твердого вещества. ТСХ: Rt=0,82, 5:10:85D. Соединение 35. Раствор 111 мг полученного соединения примера 1 С в CH2Cl2 добавляют при температуре окружающей среды в атмосфере азота к раствору 118 мг Nсукцинимидил-(S)-3-тетрагидрофуранил карбоната (здесь и далее "ТГФ-ОСу (THF-OSu)") и 133 мг N,N-диизопропилэтиламина в CH2Cl2. Смесь перемешивают в течение 14 ч, разбавляют СН 2 Сl2, промывают насыщенным NаНСО 3 и насыщенным NaCl, затем сушат над MgSO4,фильтруют и концентрируют в вакууме. Остаток подвергают препаративной тонкослойной хроматографии на силикагеле, используя 5% СН 3 ОН в CH2Cl2, получая 98,8 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,48, 5% СН 3 ОН в CH2Cl2. ВЭЖХ(HPLC): Rt=15,18 мин; (1 Н)-ЯМР (CDCl3) соответствуют структуре. Пример 2. Синтез соединения 101. А. Соединение VII (W=трет-бутоксикарбонил, Q=Н, D'=метил, Р'=Н). К раствору соединения VI (W=Boc, Q=H) (1,7 ммоль) в этаноле (20 мл) добавляют газ метиламина при температуре окружающей среды в течение 30 мин. Раствор перемешивают на протяжении ночи, затем концентрируют при пониженном давлении, получая 0,47 г названного соединения,которое используют без последующей очистки. ТСХ: Rf=0,19, 1:10:90 NН 4OН/метанол/CH2Cl2,(1H)-ЯМР (CDCl3) соответствует структуре. В. Соединение 128. К раствору продукта примера 2 А (0,15 г, 0,51 ммоль) в CH2Cl2 (6 мл) добавляют насыщенный раствор бикарбоната натрия (3 мл) с последующим добавлением твердого бикарбоната натрия (90 мг, 1,0 ммоль),а затем ацетамидобезолсульфонил хлорида (0,24 г, 1,02 ммоль). Смесь перемешивают при температуре окружающей среды на протяжении ночи. Органику экстрагируют в 100 мл CH2Cl2, сушат над безводным MgSO4, концентрируют при пониженном давлении, затем очищают с помощью хроматографии среднего давления на силикагеле, используя градиентную систему CH2Cl2, затем смесь 5:95 EtOAc/CH2Cl2, а затем 10:90EtOAc/CH2Cl2. Получают 244 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,13, 3:97 метанол/CH2Cl2, ВЭЖХ: Rt=13,47 мин; (1H)-ЯМР (СDСl3) соответствует структуре. С. Соединение 101. Это соединение получают из полученного соединения примера 2 В путем обработки газом-хлористым водородом,как описано в примере 1 С, и последующей реакции этого вещества с ТГФ-ОСу (THF-OSu) по способу, описанному в примере 1D. После обработки и очистки при помощи препаративной ВЭЖХ с C18 обращенной фазой, используя линейный градиент 35-100% СН 3 СN/Н 2 О с 0,1% ТФК (TFA) в качестве элюента, части неочищенной смеси, получают 4,2 мг названного со 41 единения в виде белого твердого вещества. ТСХ: Rf=0, 2, 4% MeOH/CH2Cl2. ВЭЖХ: Rt= 11,53 мин; (1 Н)-ЯМР (CDCl3) соответствует структуре. Пример 3. Синтез соединения 116. А. Аминометилциклопентан. К растворуLiAlH4 (38 г, 1,0 моль) в диэтиловом эфире (2 л) добавляют циклопентанкарбонитрил (73,2 г,0,77 моль) в виде раствора в 250 мл эфира. Раствор перемешивают на протяжении ночи при температуре окружающей среды и затем гасят путем добавления органики к 3 л насыщенного раствора тартрата калия, натрия. Амин экстрагируют в 3 л эфира, сушат над безводным К 2 СО 3, затем концентрируют дистилляцией до приблизительно 400 мл суммарного объема. Неочищенный продукт очищают при помощи дистилляции, получая 58,2 г названного соединения в виде бесцветного масла. (1H)-ЯМР(W=третбутоксикарбонил, Q=Н, D'=циклопентилметил,Р'=Н). К полученному соединению примера 3 А(20 г, 0,2 моль) добавляют соединение VI (W= Воc, Q=Н) (5,84 г) и смесь перемешивают в течение 24 ч при температуре окружающей среды. Раствор концентрируют дистилляцией при пониженном давлении. Остаток растирают с гексаном и твердое вещество собирают фильтрацией отсасыванием и промывают гексаном, получая 7,08 г белого твердого вещества, которое используют без дальнейшей очистки. ТСХ: Rf= 0,59 (1:10:90 концентрированный NН 4OН/метанол/CH2Cl2), (1H)-ЯМР (CDCl3) соответствует структуре. С. Соединение VIII (W=трет-бутоксикарбонил, Q=Н, D'=циклопентилметил, Е=4 хлорфенил). Полученное соединение примера 3 В (252 мг) подвергают взаимодействию с 4 хлорбензолсульфонилхлоридом (175 мг) по способу, описанному в примере 8 Н. Обработка и очистка хроматографией на силикагеле, используя EtOAc/CH2Cl2 в качестве элюента, дает продукт в виде белого твердого вещества; (1H)-ЯМРD. Соединение VIII (W=Н, Q=H,D'=циклопентилметил, Е=4-хлорфенил, гидрохлоридная соль). Раствор 320 мг полученного соединения примера 3 С в 20 мл EtOAc обрабатывают безводным HCl-газом в течение 5 мин. Реакционную смесь продувают азотом, затем концентрируют в вакууме, получая белое твердое вещество, которое используют непосредственно для последующей реакции. Е. Соединение 116. К раствору 63,4 мг полученного соединения примера 3D в 1 мл ТГФ(THF-OSu) в 1 мл ТГФ. Смесь перемешивают в течение 24 ч и затем концентрируют в вакууме. Остаток очищают колоночной хроматографией низкого давления на силикагеле, используя 20%(3,3 ммоль) в этаноле (30 мл) добавляют тетрагидрофурфуриламин (1,03 мл, 10 ммоль). Смесь нагревают до 85 С и перемешивают на протяжении ночи. Раствор фильтруют и раствор концентрируют при пониженном давлении, получая 1,29 г названного соединения, которое используют без последующей очистки. ТСХ: Rf=0,52,1:10:90 NН 4 ОН/метанол/CH2Cl2. В. Соединение 129. К раствору полученного соединения примера 4 А (200 мг, 0,55 ммоль) в CH2Cl2 (6 мл) добавляют 4-фторбензолсульфонил хлорид (320 мг, 1,6 ммоль), а затем насыщенный раствор бикарбоната натрия (3 мл) и твердый бикарбонат натрия (0,1 г, 1,2 ммоль). Смесь перемешивают при температуре окружающей среды на протяжении ночи. Раствор разбавляют 100 мл CH2Cl2, органический слой отделяют, сушат над безводным MgSO4 и органику концентрируют при пониженном давлении. Неочищенный продукт очищают при помощи жидкостной хроматографии среднего давления, используя систему градиентного растворителя CH2Cl2, затем раствор 5:95 эфир/CH2Cl2, затем раствор 10:90 эфир/CH2Cl2,получая 130 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,35, 3:97 метанол/CH2Cl2, ВЭЖХ: Rt=16,37 мин, (1H)ЯМР (СDСl3) соответствует структуре. С. Соединение VIII (W=H, Q=H, D'=(2 тетрагидрофурил)-метил, Е=4-фторфенил, гидрохлоридная соль). К раствору полученного соединения примера 4 В (30 мг, 0,057 ммоль) вEtOAc (1 мл). Смесь перемешивают на протяжении ночи при температуре окружающей среды. Раствор концентрируют при пониженном давлении, получая 16 мг названного соединения в виде белого твердого вещества, которое используют без последующей очистки. ТСХ: Rf= 0,60 (1:10:90 NН 4OН/метанол/CH2Cl2).D. Соединение 132. К раствору полученного соединения примера 4 С (16 мг) в CH2Cl2 (5 мл) добавляют триэтиламин (0,1 мл, 0,72 ммоль) с последующим добавлением ТГФ-ОСу (THFOSu) (20 мг, 0,09 ммоль). Смесь перемешивают при температуре окружающей среды в течение 24 ч. Раствор концентрируют при пониженном давлении и неочищенный продукт очищают при помощи колоночной хроматографии среднего давления, используя 20:80 EtOAc/CH2Cl2 в качестве системы растворителя, получая 7,4 мг. 43 Пример 5. Синтез соединения 134. А. Соединение VII (W=трет-бутоксикарбонил, Q=Н, D'=(изобутенил, Р'=Н). К раствору соединения VI (W=трет-бутоксикарбонил,Q=Н) (2,5 ммоль) в этаноле (30 мл) добавляют раствор 2-металлиламин гидрохлорида (1,34 г,12,5 ммоль) и КОН (0,70 г, 12,5 ммоль) в этаноле (20 мл). Смесь перемешивают 30 мин при температуре окружающей среды. Растворы объединяют и нагревают до 85 С в течение 24 ч. Раствор фильтруют и концентрируют при пониженном давлении, получая 0,82 г названного соединения, которое используют без последующей очистки. ТСХ: Rf=0,45, 1:10:90 концентрированный NН 4OН/метанол/CH2Cl2. В. Соединение 131. К раствору полученного соединения примера 5 А (200 мг, 0,60 ммоль) в(6 мл) добавляют 4-ацетамидобензолсульфонил хлорид (410 мг, 1,76 ммоль), с последующим добавлением насыщенного раствора бикарбоната натрия (3 мл) и твердого бикарбоната натрия (0,1 г, 1,2 ммоль). Смесь перемешивают при температуре окружающей среды на протяжении ночи. Раствор разбавляют 100 мл CH2Cl2, органику отделяют,сушат над безводным МgSО 4 и органику концентрируют при пониженном давлении. Неочищенный продукт очищают жидкостной хроматографией среднего давления, используя систему градиентного растворителя CH2Cl2, а затем раствор 30:70 EtOAc/CH2Cl2, получая 140 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,19, 3:97 метанол/CH2Cl2,ВЭЖХ: Rt=15,06 мин, (1H)-ЯМР (СDСl3) соответствует структуре. С. Соединение VIII (W=Н, Q=Н, D'=изобутенил, Е=4-ацетамидофенил, гидрохлоридная соль). К раствору полученного соединения примера 5 В (40 мг, 0,075 ммоль) в EtOAc (5 мл) добавляют 30% вес/вес НСl в EtOAc (2 мл). Смесь перемешивают на протяжении ночи при температуре окружающей среды. Раствор концентрируют при пониженном давлении, получая названное соединение, которое используют без последующей очистки. ТСХ: Rf=0,38, 1:10:90D. Соединение 134. К раствору полученного соединения примера 5 С в CH2Cl2 (5 мл) добавляют триэтиламин (0,1 мл, 0,72 ммоль), а затем ТГФ-ОСу (THF-OSu) (26 мг, 0,11 ммоль). Смесь перемешивают при температуре окружающей среды в течение 24 ч. Раствор концентрируют при пониженном давлении и неочищенный продукт очищают при помощи колоночной хроматографии среднего давления, используя систему градиентного растворителя 44 Пример 6. Синтез соединения 136. А. Соединение VII (W=трет-бутоксикарбонил, Q=Н, D'=2-фурфурил, Р'=Н). К раствору соединения VI (W=Воc, Q=H) (2,5 ммоль) в этаноле (30 мл) добавляют фурфуриламин (0,67 мл,7,5 ммоль) и смесь нагревают до 85 С в течение 24 ч. Раствор фильтруют и концентрируют при пониженном давлении, получая 0,80 г названного соединения, которое используют без последующей очистки. ТСХ: Rf=0,38, 1:10:90 концентрированный NН 4OН/метанол/CH2Cl2. В. Соединение VIII (W=трет-бутоксикарбонил, Q=Н, D'=2-фурил, Е=4-фторфенил). К раствору продукта примера 6 А (0,20 г, 0,60 ммоль) в CH2Cl2 (6 мл) добавляют насыщенный раствор бикарбоната натрия (3 мл) с последующим добавлением твердого бикарбоната натрия(0,1 г, 1,2 ммоль), затем п-фторбензолсульфонил хлорида (0,32 г, 1,6 ммоль). Смесь перемешивают при температуре окружающей среды в течение 24 ч. Органику экстрагируют 100 млCH2Cl2, сушат над безводным MgSO4, концентрируют при пониженном давлении, затем очищают при помощи хроматографии среднего давления на силикагеле, используя градиентную систему CH2Cl2, а затем 1:99 метанол/CH2Cl2. Названное соединение получают в виде белого твердого вещества (86,1 мг). ТСХ: Rf=0,17, 3:97 метанол/CH2Cl2, ВЭЖХ: Rt= 16,5 мин; (1H)-ЯМР(СDСl3) соответствует структуре. С. Соединение VIII (W=Н, Q=Н, D'=2 фурил, Е=4-фторфенил, гидрохлоридная соль). К раствору полученного соединения примера 6 В(16 мг, 0,031 ммоль) в EtOAc (3 мл) добавляют 30% вес/вес НСl в EtOAc (1 мл). Смесь перемешивают на протяжении ночи при температуре окружающей среды. Раствор концентрируют при пониженном давлении, получая названное соединение, которое используют без последующей очистки. ТСХ:D. Соединение 136. К раствору полученного соединения примера 6 С в CH2Cl2 (5 мл) добавляют триэтиламин (0,1 мл, 0,72 ммоль), а затем ТГФ-ОСу (THF-OSu) (11 мг, 0,05 ммоль). Смесь перемешивают при температуре окружающей среды в течение 24 ч. Раствор концентрируют при пониженном давлении и неочищенный продукт очищают при помощи колоночной хроматографии среднего давления, используя систему градиентного растворителя 45 перемешивают в течение 3 ч при температуре окружающей среды. Раствор фильтруют и концентрируют при пониженном давлении, получая 1,49 г белого твердого вещества, которое используют непосредственно для последующей реакции. ТСХ: Rf=0,14, 3:97 метанол/CH2Cl2.(1 Н)-ЯМР (СDСl3) соответствует структуре. В. Соединение VIII (W=трет-бутоксикарбонил, Q=Н, D'=циклогексилметил, Е=4 метоксифенил). К раствору полученного соединения примера 7 А (400 мг, 1,06 ммоль) в CH2Cl2(10 мл) добавляют 4-метоксибензолсульфонил хлорид (0,66 г, 3,1 ммоль) с последующим добавлением насыщенного раствора бикарбоната натрия (3 мл) и 0,18 г твердого бикарбоната натрия. Смесь перемешивают при температуре окружающей среды. Раствор разбавляют 200 млCH2Cl2, органику отделяют, сушат над безводным MgSO4 и органический слой концентрируют при пониженном давлении. Неочищенный продукт очищают при помощи жидкостной хроматографии среднего давления, используяCH2Cl2, а затем 1:90 метанол/CH2Cl2 в качестве системы растворителя, получая 340 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,39, 3:97 метанол/CH2Cl2, (1H)ЯМР (СDСl3) соответствует структуре. С. Соединение VIII (W=Н, Q=Н, D'=циклогексилметил, Е=4-метоксифенил, гидрохлоридная соль). К раствору полученного соединения примера 7 В (0,34 г, 0,62 ммоль) в EtOAc (10 мл) добавляют 30% вес/вес НСl в EtOAc (5 мл). Смесь перемешивают в течение 3 ч при температуре окружающей среды. Раствор концентрируют при пониженном давлении, получая 0,3 г белого твердого вещества, которое используют непосредственно для последующей реакции. ТСХ: Rf=0,12, 3:97 метанол/CH2Cl2.D. Соединение 158. К раствору полученного соединения примера 7 С (100 мг, 0,21 ммоль) в CH2Cl2 (8 мл) добавляют триэтиламин (0,2 мл,1,44 ммоль), а затем ТГФ-ОСу (THF-OSu) (71 мг, 0,31 ммоль). Смесь перемешивают при температуре окружающей среды в течение 6 ч. Раствор разбавляют CH2Cl2 (200 мл), промывают насыщенным раствором бикарбоната натрия (30 мл), органику отделяют, сушат над безводнымMgSO4 и концентрируют при пониженном давлении и неочищенный продукт очищают при помощи колоночной хроматографии среднего давления, используя систему градиентного растворителя CH2Cl2, а затем 10:90 EtOAc/CH2Cl2 в качестве системы растворителя, получая 84,9 мг названного соединения. ТСХ: Rf=0,48, 3:97 метанол/CH2Cl2, ВЭЖХ: Rt=16,35 мин; (1H)-ЯМР(CDCl3) соответствует структуре. Пример 8. Синтез соединения 195. А. Соль 3(S)-амино-2(син)-гидрокси-4 фенил-1-хлорбутан формиата. К суспензии 16,33 г 10% палладий на углероде (25% по весу) в метаноле и тетрагидрофуране (400 мл, 1:1) добавляют под N2 65,35 г 3(S)-N-(-бензил 001221 46 оксикарбонил)-амино-1-хлоро-2(син)-гидрокси 4-фенилбутана (195,77 ммоль) в виде раствора в метаноле и тетрагидрофуране (1,2 л). К этой суспензии добавляют 540 мл муравьиной кислоты. Спустя 15 ч, реакционную смесь фильтруют через диатомовую землю и концентрируют досуха. Полученное масло суспензируют в толуоле и испаряют, затем растирают последовательно с диэтиловым эфиром и CH2Cl2, получая 47,64 г продукта в виде гранулированного желтовато-коричневого твердого вещества. ТСХ:Rf=0,17, 5% уксусная кислота/этилацетат. В. 3(S)-N-(3(S)-тетрагидрофурилоксикарбонил)-амино-1-хлоро-2(син)-гидрокси-4-фенилбутан. К раствору полученного соединения примера 8 А (1,97 г, 7,95 ммоль) в CH2Cl2 (20 мл) добавляют насыщенный раствор бикарбоната натрия (5 мл), а затем твердый бикарбонат натрия (1,33 г, 17,9 ммоль) и ТГФ-Осу (2,0 г, 8,7 ммоль). Смесь перемешивают при температуре окружающей среды на протяжении ночи. Раствор разбавляют 200 мл CH2Cl2, органику отделяют, сушат над безводным MgSO4 и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетат/гексан, получая 1,01 г названного соединения в виде белого твердого вещества. ТСХ: Rf= 0,35, 3:97 метанол/CH2Cl2. (1H)-ЯМР (СDСl3) соответствует структуре. С. Соединение VI (W=Н, Q=3(S)-тетрагидрофурилоксикарбонил). К раствору полученного соединения примера 8 В (1,0 г, 3,2 ммоль) в абсолютном этаноле (15 мл) добавляют твердый КОН (0,21 г, 3,8 ммоль). Смесь перемешивают при температуре окружающей среды в течение 1,0 ч. Раствор фильтруют через подкладку целита, затем концентрируют при пониженном давлении. Остаток поглощают эфиром (100 мл),промывают соляным раствором, сушат надMgSO4, концентрируют при пониженном давлении, получая 0,88 г названного соединения в виде белого твердого вещества. ТСХ: Rf=0,49D. Соединение III (W=Н, Q=(S)-3-тетрагидрофурилоксикарбонил, D=бензил, D'=циклопентилметил, R7=Н, L=Н). Полученное соединение примера 8 С (0,88 г, 3,2 моль) добавляют к полученному соединению примера 3 А (5,0 г,50,4 ммоль) и перемешивают в течение 24 ч при температуре окружающей среды. Раствор концентрируют дистилляцией при пониженном давлении. Остаток растирают с гексаном и твердое вещество собирают фильтрацией отсасыванием и промывают гексаном, получая 0,93 г названного соединения. ТСХ: Rf=0,44, 1:10:90 концентрированный(1H)-ЯМР (CDCl3) соответствует структуре. Е. Соединение VII (W=Н, Q=(S)-3-тетрагидрофурил, D'=циклопентилметил, Р'=третбутоксикарбонил). К раствору 264 мг полученного соединения примера 8D в 10 мл CH2Cl2CH2Cl2, промывают 0,5N HCl и соляным раствором, сушат над сульфатом магния, фильтруют и концентрируют в вакууме, получая 364 мг названного соединения в виде белого твердого вещества, которое используют без последующей очистки. ТСХ: Rf=0,58, 40% EtOAc/CH2Cl2.F. Раствор 334 мг полученного соединения примера 8 Е в 5 мл этанола гидрируют при давлении водорода 2,109 кг/см 2 (30 psi) в присутствии 80 мг оксида платины (IV) в течение 24 ч. Смесь фильтруют и концентрируют. Остаток очищают при помощи колоночной хроматографии низкого давления на силикагеле, используя 20% EtOAc в CH2Cl2 в качестве элюента, получая 268 мг названного соединения. ТСХ: Rf= 0,55, 40% EtOAc/CH2Cl2. (1H)-ЯМР (CDCl3) соответствует структуре.G. Раствор 268 мг полученного соединения примера 8F в 10 мл EtOAc обрабатывают безводным HCl-газом в течение 5 мин. Реакционную смесь пробулькивают азотом, затем концентрируют в вакууме и полученное белое твердое вещество используют без последующей очистки для последующей реакции. Н. Соединение 195. К раствору 233 мг неочищенного полученного соединения примера 8G в 10 мл CH2Cl2 добавляют 2 мл насыщенного водного раствора бикарбоната натрия и 149 мг 4-метилоксибензолсульфонил хлорида. Спустя 3 ч, полученную смесь разбавляют CH2Cl2, промывают бикарбонатом натрия, соляным раствором, сушат над сульфатом магния, фильтруют и концентрируют в вакууме. Остаток очищают при помощи колоночной хроматографии низкого давления на силикагеле, используя 0-20%EtOAc/CH2Cl2, получая 225 мг названного соединения в виде белого твердого вещества. ТСХ: Rf=0,40, 20% EtOAc/CH2Cl2; ВЭЖХ: Rt= 15,65 мин; (1H)-ЯМР (CDCl3) соответствует структуре. Пример 9. Синтез соединения 196.A. (1S,2 син)-N-(1-изобутил-3-хлоро-2-гидроксипропил)бензилоксикарбониламин. К раствору N-Cbz-лейцин хлорметил кетона (2,0 г) в 20 мл метанола добавляют при 0 С 1,0 г борогидрида натрия и смесь перемешивают при температуре окружающей среды в течение 24 ч. Раствор концентрируют при пониженном давлении и остаток распределяют между 20 мл насыщенного водного раствора NH4Cl и 500 мл диэтилового эфира. Органическую фракцию отделяют, сушат над МgSO4 и концентрируют в вакууме и остаток очищают хроматографией на силикагеле, получая 1,8 г белого твердого вещества. В. (1S,2S)-N-(1-Изобутил-2,3-эпоксипропил)бензилоксикарбониламин. К раствору полученного соединения примера 9 А (300 мг) в абсолютном этаноле добавляют 67 мг порошко 001221 48 образного КОН. Смесь перемешивают в течение 3 ч при температуре окружающей среды,фильтруют через диатомовую землю и концентрируют в вакууме. Остаток растворяют в диэтиловом эфире, сушат над MgSO4 и концентрируют, получая 230 мг бесцветного масла,которое используют непосредственно для следующей реакции. С. (2R,3S)-N3-Карбобензилокси-N1-изобутил-1,3-диамино-2-гидрокси-5-метилгексан. 230 мг порцию полученного соединения примера 9 В суспендируют в 5 мл изобутиламина и смесь перемешивают на протяжении ночи при температуре окружающей среды. Смесь концентрируют в вакууме, получая названный продукт в виде 179 мг белого твердого вещества, которое используют непосредственно для последующей реакции.D. Соединение V (W=бензилоксикарбонил,Q=Н, D=изобутил, R7=Н, Е=4-метоксифенил,(S)-гидрокси). Следуя методике, описанной в примере 8 Н, раствор полученного соединения примера 9 С (170 мг) в CH2Cl2 подвергают обработке 4-метоксибензолсульфонил хлоридом(150 мг) в присутствии водного NаНСО 3. Обработка и хроматография на силикагеле дает 90 мг продукта в виде белого твердого вещества. Е. Соединение V (W=Н, Q=Н, D=изобутил,D'=изобутил, R7=Н, Е=4-метоксифенил, (син)гидрокси). Раствор полученного соединения примера 9D (90 мг) в этаноле обрабатывают 50 мг 10% палладий на углероде и смесь перемешивают в атмосфере водорода. После завершения реакции смесь фильтруют и концентрируют в вакууме, получая 60 мг названного соединения, которое используют непосредственно для дальнейшей реакции.(150 мг), как описано ранее, получая после водной обработки, сушки над МgSO4, фильтрации,и концентрирования в вакууме остаток, который очищают хроматографией на силикагеле, используя метанол/CH2Cl2 в качестве элюента,получая 40 мг названного продукта в виде белого твердого вещества. (1H)-ЯМР (CDCl3) соответствует структуре. Пример 10. Синтез соединения 203. А. Эпоксид, полученный в примере 9 В(R.T.) в течение 48 ч. Раствор разбавляют 25 мл этанола и концентрируют при пониженном давлении. Неочищенное вещество очищают при помощи СДЖХ (жидкостная хроматография среднего давления, MPLC) (градиент: CH2Cl2; 1%(0,120 г, 0,331 ммоль), подвергают процедуре,описанной в примере 7 В. Очистка неочищенного вещества при помощи СДЖХ (градиент:(2 син, 3S изомер) и 70 мг фракции В (2R, 3S изомер). (1H)-ЯМР (СDСl3) соответствует структуре. С. Cbz-аминовую фракцию А, полученную в примере 10 В (0,010 г, 0,019 ммоль), поглощают 5 мл абсолютного спирта и добавляют Pd/C(15 мг). Смесь перемешивают в атмосфере водорода в течение 24 ч. Раствор фильтруют и концентрируют при пониженном давлении, получая аминовый продукт с количественным выходом. Это вещество используют без дальнейшей очистки.(0,010 г, 0,025 ммоль), используют в способе,описанном в примере 1D. Очистка неочищенного вещества при помощи СДЖХ (MPLC) (градиент: CH2Cl2; 1% МеОН/CH2Cl2) дает 2,8 мг(29%) соединения 203. Пример 11. Синтез соединения 212. А. 1,12 часть безводного ДМФ охлаждают до 0 С и обрабатывают по каплям 2,06 г сульфурил хлорида. Полученную суспензию перемешивают в течение 30 мин, затем обрабатывают 1,50 г бензилфенилового эфира. Смесь нагревают при 90 С в течение 3 ч, затем охлаждают, экстрагируют соляным раствором и метиленхлоридом и сушат над MgSO4. Хроматографирование на силикагеле (i-PrOH/гексаны) дает 4-бензилоксибензолсульфонил хлорид. В. Амин, полученный в примере 7 А (0,150 г, 0,398 ммоль), и 4-(фенилметокси)бензолсульфонил хлорид (0,170 г, 0,601 ммоль) используют в способе, описанном в примере 7 В, получая после СДЖХ (MPLC) очистки (градиент:(0,120 г, 0,214 ммоль), подвергают процедуре,описанной в примере 10 С, получая 50 мг (59%) неочищенного амина, который используют без дальнейшей очистки.(0,050 г, 0,125 ммоль), используют в способе,описанном в примере 1D. Очистка неочищенного вещества при помощи СДЖХ (MPLC) (градиент: CH2Cl2; 1% MeOH/CH2Cl2; 2%(CDCl3) соответствует структуре. Пример 12. Синтез соединения 213. А. Эпоксид, описанный в примере 9 В (0,53 г, 2,01 ммоль), подвергают взаимодействию с 2 фенилэтиламином (5,0 мл, 40 ммоль), как описано в примере 9 С, получая 640 мг (83% выход) амина после СДЖХ очистки (градиент: CH2Cl2; 1%, затем 5%, затем 10% MeOH/CH2Cl2).(0,150 г, 0,39 ммоль), подвергают процедуре,описанной в примере 11 В, получая после СДЖХ очистки (градиент: CH2Cl2; 5%, затем 10%(0,110 г, 0,177 ммоль), подвергают обработке,как описано в примере 10 С, получая 40 мг (56%) амина, который используют без дальнейшей очистки. (1 Н)-ЯМР (СDСl3) соответствует структуре.(0,040 г, 0,098 ммоль), подвергают обработке,как описано в примере 1D. Очистка неочищенного вещества при помощи СДЖХ (MPLC)(1 Н)-ЯМР (CDCl3) соответствует структуре. В. Осуществляют процедуру, описанную в примере 7 В, используя амин, полученный в примере 13 А (0,040 г, 0,106 ммоль) и замещая бикарбонат натрия на бикарбонат калия (как в форме твердого вещества, так и форме водного раствора), получая 30 мг (52%) ВОС-амин сульфонамида после хроматографированияMgSO4. Это неочищенное вещество подвергают процедуре, описанной в примере 1D, получая 5 мг (59%) соединения 223 после хроматографирования (СНСl3/МеОН, 10:1). (1H)-ЯМP (СDСl3) соответствует структуре. Пример 14. Синтез соединения 224. А. Циклопентилуксусную кислоту (5,2 г,41 ммоль) и тионил хлорид (10 мл) объединяют,затем добавляют ДМФ (0,2 мл) и раствор перемешивают 1,5 ч при К.Т. (R.T.). Добавляют дихлорметан (10 мл) и раствор охлаждают на бане со льдом, после чего добавляют 25% водный аммиак и смесь перемешивают в течение 0,5 ч. Раствор экстрагируют CH2Cl2 (3 Х) и объединенные экстракты промывают 1N HCl, сушат над MgSO4 и концентрируют, получая циклопентилацетамид (2,699 г, 52%). (1H)-ЯМР(СDСl3) соответствует структуре. В. Циклопентилацетамид (2,70 г, 21,0 ммоль) растворяют в 100 мл Et2O, после чего добавляют литийалюминийгидрид (2,2 г, 58 ммоль) и смесь нагревают до 60 С в течение 4 ч. После стандартных условий обработки неочи 51 щенное вещество дистиллируют, получая 2 циклопентилэтиламин (750 мг, 32%); т.к.: 78 С при 40 мм Hg. (1H)-ЯМР (CDCl3) соответствует структуре. С. Осуществляют процедуру, описанную в примере 1 А, используя 14 мг эпоксида VI (W=(0,188 г, 0,5 ммоль), растворяют в CH2Cl2 и добавляют ТЭА (TEA) (0,09 мл) и 4 метоксибензолсульфонил хлорид (0,124 г, 0,6 ммоль). После перемешивания в течение 2 ч смесь промывают насыщенным водн. NаНСО 3(3 Х), 10% водн. HCl (3 Х) и сушат над MgSO4,получая 240 мг (88%) ВОС-амин сульфонамида после хроматографирования (гексаны/EtOAc; 8:2). (1 Н)-ЯМР (СDСl3) соответствует структуре. Е. ВОС-амин сульфонамид, полученный в примере 14D (0,235 г, 0,43 ммоль) поглощаютEtOAc и обрабатывают HCl, получая 214 мг (количественно) неочищенной амин-НСl соли, которую используют без дальнейшей очистки.F. Неочищенную амин-HCl соль, полученную в примере 14 Е (0,211 г, 0,43 ммоль), обрабатывают, как описано в примере 1D, получая 178 мг (74%) соединения 224. (1 Н)-ЯМР (CDCl3) соответствует структуре. Пример 15. Синтез соединения 225. А. 4-Пиперидинкарбоксамид (10,2 г, 78,0 ммоль) в ДМСО (10 мл) обрабатывают бензил бромидом (20,0 мл, 168 ммоль). Смесь разбавляют EtOAc и промывают 1N водн. НСl, 5N водн. NаОН, сушат над MgSO4, концентрируют,получая 5,90 г (35%) N-бензил-4-пиперидинкарбоксамида. (1 Н)-ЯМР (CDCl3) соответствует структуре. В.(0,100 г, 0,78 ммоль), получая 25 мг (14%) Восамина после хроматографирования (гексаны:G. N-бензилпиперидин (0,055 г, 0,092 ммоль), полученный в примере 15F, обрабатывают, как описано в примере 10 С, получая неочищенный продукт, который после очистки при помощи хроматографии CH2Cl2/MeOH/(CDCl3) соответствует структуре. Пример 16. Синтез соединения 228. А. 4-Гидроксипиперидин (10,8 г, 107 ммоль) и Et3N (17 мл, 123 ммоль) в 80 мл CH2Cl2 охлаждают на бане со льдом, после чего добавляют бензил хлорформиат (16,3 мл, 114 ммоль). После перемешивания 1,5 ч при К.Т. (R.T.) смесь подвергают стандартным условиям обработки, получая 13,9 г (55%) N-Cbz-пиперидина после хроматографирования (СНСl3/МеОН; 10:1). (1 Н)-ЯМР (CDCl3) соответствует структуре. В. Раствор DEAD (1,61 мл, 10,2 ммоль) в 20 мл ТГФ (THF) добавляют к раствору трифенилфосфина (2,69 г, 10,3 ммоль), N-Cbzпиперидина, полученного в примере 16 А (2,36 г,100 ммоль) и фталимида (1,50 г, 10,2 ммоль) в 80 мл ТГФ (THF). После перемешивания 10,5 ч при К.Т. (R.T.) смесь гасят водой, экстрагируютEtOAc (3X) и объединенные экстракты промывают соляным раствором, сушат над Na2SO4 и концентрируют, получая неочищенный продукт. Очистка этого вещества с помощью хроматографии (гексаны/EtOAc; 2:1) дает 1,81 г (50%) 1-бензилоксикарбонил-4-фталимидилпиперидина. (1H)-ЯМР (СDСl3) соответствует структуре. С. 1-Бензилоксикарбонил-4-фталимидилпиперидин (1,50 г, 4,27 ммоль), полученный в примере 16 В, поглощают в 20 мл этанола. К этому раствору добавляют гидразин моногидрат(35 мл, 700 ммоль) и эту смесь нагревают при 100 С в течение 3 ч. Добавляют соляной раствор (40 мл) и 10% водн. К 2 СО 3 (60 мл) и смесь экстрагируют 5% MeOH/CHCl3 (3X). Объединенные экстракты промывают 2N водн. НСl, 2N водн. NaOH, соляным раствором, сушат надNН 4OН; 95:5:1). (1 Н)-ЯМР (СDСlз) соответствует структуре. Е. Осуществляют процедуру, описанную в примере 14D, используя ВОС-амин, полученный в примере 16D (0,059 г, 0,320 ммоль), получая неочищенный продукт, который после хро 53 матографирования(CDCl3) соответствует структуре. Н. Неочищенный карбамат, полученный в примере 16G (0,116 г, 0,163 ммоль), обрабатывают, как описано в примере 10 С. Очистка неочищенного вещества с помощью хроматографии (СНСl3/МеОН/NH4OH, 95:5:1) дает 28 мг(CDCl3) соответствует структуре. Пример 18. Синтез соединения 234. А. Осуществляют процедуру, описанную в примере 1 А, используя эпоксид VI (W=Воc, Q= Н) (0,200 г, 0,76 ммоль) и 2-аминотиазол (1,2 г,12,0 ммоль), получая 150 мг (54%) Вос-амина после хроматографирования (СНСl3/МеОН,10:1). (1H)-ЯМР (CDCl3) соответствует структуре. В. Осуществляют процедуру, описанную в примере 14D, используя ВОС-амин, полученный в примере 18 А (0,004 г, 0,011 ммоль), получая неочищенный продукт, который после хроматографирования (CHCl3/EtOAc; 3:4) дает сульфонамид. (1H)-ЯМР (CDCl3) соответствует структуре. 54 С. Сульфонамид, полученный в примере 18 В (0,010 г, 0,019 ммоль), обрабатывают, как описано в примере 14 Е, получая неочищенную амин-HCl соль. Это вещество подвергают процедуре, описанной в примере 1D, получая 6 мг(0,035 г, 0,169 ммоль) растворяют в пиридине и добавляют 4-амино-1,2,4-триазол (0,17 г, 0,202 ммоль). После 4 дней при К.Т. смесь подвергают стандартным условиям обработки, получая 33 мг сульфонамида. В. Сульфонамид, полученный в примере 19 А (0,356 г, 0,140 ммоль), обрабатывают КОН(0,078 г, 0,139 ммоль), получая соответствующую соль калия. С. Эпоксид VI (W=Воc, Q=H) (0,049 г,0,168 ммоль) и калиевую соль амина, полученную в примере 19 В (0,044 г, 0,169 ммоль), подвергают взаимодействию в ДМСО (DMSO) при 80 С в течение 2 дней, получая 9 мг (10%) Восамина. (1H)-ЯМР (CDCl3) соответствует структуре.D. Сульфонамид, полученный в примере 19 С (0,143 г, 0,276 ммоль), обрабатывают, как описано в примере 14 Е, получая неочищенную амин-НСl соль. Это вещество подвергают процедуре, описанной в примере 1D, получая 97 мг(CDCl3) соответствует структуре. Пример 20. Синтез соединений 167 и 168. А. Соединение 167. Раствор 102 мг N-2 син,3S)-2-гидрокси-4-фенил-3-S)-тетрагидрофуран-3-илоксикарбониламино)бутил)-N-изобутилбензолсульфонамида в 4:1 СН 2 Сl2/насыщенный водный NаНСО 3 обрабатывают последовательно при температуре окружающей среды в атмосфере азота 65 мг п-нитробензолсульфонил хлорида и 51 мг бикарбоната натрия. Смесь перемешивают в течение 14 ч, разбавляют СН 2 Сl2,промывают насыщенным NaCl, затем сушат надMgSO4, фильтруют, и концентрируют в вакууме. Остаток очищают хроматографией низкого давления на силикагеле, используя 20% диэтиловый эфир/СН 2 Сl2 в качестве элюента, получая 124 мг названного продукта в виде белого твердого вещества. ТСХ: Rf=0,36, 20% диэтиловый эфир/СН 2 Сl2. ВЭЖХ: Rt=15,15 мин. (1H)-ЯМР(CDCl3) соответствует структуре. В. Соединение 168. Раствор 124 мг соединения 167 в этилацетате обрабатывают при температуре окружающей среды 13 мг 10% палладий на углероде. Смесь перемешивают в течение 14 ч в атмосфере водорода, фильтруют через подкладку целитного фильтрующего средства и концентрируют в вакууме. Остаток подвергают препаративной ВЭЖХ, получая 82 мг названного продукта в виде белого твердого веще 55Rt=13,16 мин. (1H)-ЯМР (CDCl3) соответствует структуре. Пример 21. Нами измерены константы ингибирования соединений, перечисленных в табл. II, против Вич-1 (HIV-1) протеиназы, используя вышецитированный способ Pennington et al. Нами также измерена антивирусная эффективность соединений в CCRM-CEM клетках при помощи цитированного выше способа Meeket al. Результаты представлены в табл. III. В нижеследующих таблицах Ki и IС 90 значения выражены в нМ. Обозначение "ND" используют,когда данное соединение не подвергают испытанию. В табл. III использованы следующие обозначения: А: ингибирует ВИЧ репликацию при концентрации 100 нМ или менее. В: ингибирует ВИЧ репликацию при концентрации между 101 и 1000 нМ. С: ингибирует ВИЧ репликацию при концентрации между 1001 и 10000 нМ.D: ингибирует ВИЧ репликацию при концентрации между 10001 и 40000 нМ. Соединение кi 35 4.0 37 0.1 48 1.4 51 Как следует из табл. II и III, все из испытываемых соединений демонстрируют ингибирующую и антивирусную активность. Кроме того, некоторые из этих соединений демонстрируют уровни активности, которые находятся среди самых высоких известных на сегодняшний день уровней для ингибиторов ВИЧ протеаз. Хотя нами описан ряд вариантов воплощения данного изобретения, очевидно, что возможны изменения наших основных конструкций с целью получения других вариантов воплощения, которые используют продукты и способы данного изобретения. Поэтому следует иметь в виду, что объем данного изобретения должен определяться прилагаемой формулой изобретения, а не конкретными вариантами осуществления, которые представлены при помощи примера. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая а) фармацевтически приемлемое количество ингибитора протеазы - соединения формулы I где каждый R1 независимо выбран из группы,включающей -С(О)-, -S(O)2-, -С(O)-С(O)-, -ОС(О)-, -O-S(O)2, -NR2-S(O)2-, -NR2-С(O)- и -NR2C(O)-СО)-; каждый Het независимо выбран из группы,включающей С 3-С 7 карбоцикл; C6-С 10 арил; фенил, конденсированный с гетероциклом; и гетероцикл; где любой член указанного Het может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей оксо, -OR2, -R2,-N(R2)(R2), -NHOH, -R2OH, -CN, -CO2R2, -C(O)N(R2)(R2), -S(O)2-N(R2)(R2), -N(R2)-C(O)-R2,-C(O)-R2, -S(O)n-R2, -OCF3, -S(O)n-R6, -N(R2)S(O)2(R2), галоген, -СF3, -NO2, -R6 и -O-R6; каждый R2 независимо выбран из группы,включающей Н и C1-С 3 алкил, необязательно замещенный R6; каждый R3 независимо выбран из группы,включающей Н, Het, C1-С 6 алкил и С 2-С 6 алкенил, где любой член указанной R3, кроме Н,может быть необязательно замещен одним или несколькими заместителями, выбранными из группы, включающей -OR2, -C(O)-NH-R2,-S(O)n-N(R2)(R2), Het, -CN, -SR2, -CO2R2, -NR2C(O)-R2; каждый n независимо равен 1 или 2; 58 каждый D и D' независимо выбран из группы, включающей R6; C1-C5 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2,-R3, -O-R6, -S-R6 и R6; C2-C4 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из -OR2,-R3, -O-R6 и R6; и С 3-С 6 карбоцикл, который может быть необязательно замещен или конденсирован с R6; и С 5-С 6 циклоалкенил, который может быть необязательно замещен или конденсирован с R6; каждый Е независимо выбран из группы,включающей Het; -O-Het; Het-Het; -O-R3;-NR2R3; C1-C6 алкил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы, включающейR4 или Het; и С 2-С 6 алкенил, который может быть необязательно замещен одной или несколькими группами, выбранными из группы,включающей R4 или Het; каждый R4 независимо выбран из группы,включающей -OR2, -C(O)-NHR2, -S(O)2-NHR2,галоген, -NR2-C(О)-R2 и -CN; каждый R5 независимо выбран из группы,включающей Н и C1-C4 алкил, необязательно замещенный арилом; и каждый R6 независимо выбран из группы,включающей арил, карбоцикл или гетероцикл,где указанные карбоцикл или гетероцикл могут быть необязательно замещены одной или несколькими группами, выбранными из группы,включающей оксо, -OR5, -R5, -N(R5)(R5), -N(R5)C(O)-R5, -R5-OH, -CN, -CO2R5, -C(O)-N(R5)(R5),галоген и -СF3;b) одно или несколько дополнительных антивирусных агентов и иммуностимуляторов,независимо выбранных из группы, включающейc) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 2. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4-амино-N-2 син,3S)-2-гидрокси-4-фенил-3S)-тетрагидрофуран-3-илоксикарбониламино)b) одно или несколько дополнительных антивирусных агентов и иммуностимуляторов,независимо выбранных из группы, включающейc) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 3. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4aмино-N-2 син,3S)-2-гидрокси-4-фенил-3-S)тетрагидрофуран-3-илоксикарбониламино)бутил)-Nизобутилбензолсульфонамид (соединение 168);c) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 4. Фармацевтическая композиция, содержащая а) фармацевтически приемлемое количество 4-амино-N-2 син,3S)-2-гидрокси-4-фенил-3S)-тетрагидрофуран-3-илоксикарбониламино) бутил)-N-изобутилбензолсульфонамид (соединение 168);c) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 5. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4-амино-N-2 син,3S)-2-гидрокси-4-фенил-3S)-тетрагидрофуран-3-илоксикарбониламино) бутил)-N-изобутилбензолсульфонамид (соединение 168);c) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 6. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4-амино-N-2 син,3S)-2-гидрокси-4-фенил-3-S)тетрагидрофуран-3-илоксикарбониламино)бутил)N-изобутилбензолсульфонамид (соединение 168);c) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 7. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4-амино-N-2 син,3S)-2-гидрокси-4-фенил-3S)-тетрагидрофуран-3-илоксикарбониламино) бутил)-N-изобутилбензолсульфонамид (соединение 168);b) пиперазин-1-[3-[(1-метилэтил)амино]-2 пиридинил]-4-5-метилсульфонил)-амино]-1 Ниндол-2-ил]карбонил]монометансульфонат (делавирдин, U90); и с) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 8. Фармацевтическая композиция, содержащаяa) фармацевтически приемлемое количество 4-aмино-N-2 син,3S)-2-гидрокси-4-фенил-3S)-тетрагидрофуран-3-илоксикарбониламино) бутил)-N-изобутилбензолсульфонамид (соединение 168);c) фармацевтически приемлемый носитель,адъювант или наполнитель; при условии, что композиция не содержит второго ингибитора протеазы. 9. Фармацевтическая композиция по любому из пп.1-8, где указанная фармацевтическая композиция вводится перорально. 10. Способ предупреждения ВИЧинфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтически эффективного количества фармацевтической композиции по любому из пп.1-9. 11. Способ лечения ВИЧ-инфекции у млекопитающего, включающий стадию введения указанному млекопитающему фармацевтически эффективного количества фармацевтической композиции по любому из пп.1-9.
МПК / Метки
МПК: A61K 31/164, A61P 31/18
Метки: тгф-содержащие, ингибиторы, аспартил-протеазы, сульфонамидные
Код ссылки
<a href="https://eas.patents.su/30-1221-tgf-soderzhashhie-sulfonamidnye-ingibitory-aspartil-proteazy.html" rel="bookmark" title="База патентов Евразийского Союза">Тгф-содержащие сульфонамидные ингибиторы аспартил-протеазы</a>












