Дизамещенные фталазины-антагонисты сигнального пути hedgehog
Номер патента: 18931
Опубликовано: 29.11.2013
Авторы: Уилсон Такако, Бастиан Джоли Энн, Хипскинд Филип Артур, Сэлл Дэниел Джон
Формула / Реферат
1. Соединение формулы
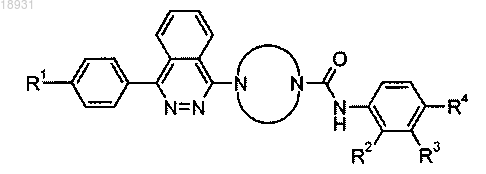
где R1 представляет собой водород, фтор, циано, трифторметил или метокси;
R2 представляет собой водород, фтор или трифторметил;
R3 представляет собой водород или хлор;
при условии, что по меньшей мере один из R2 и R3 представляет собой водород;
R4 представляет собой хлор, фтор, циано, трифторметил, дифторметокси, метокси или трифторметокси;
 представляет собой замещенный пиперазин-1,4-диил, выбранный из группы, состоящей из
представляет собой замещенный пиперазин-1,4-диил, выбранный из группы, состоящей из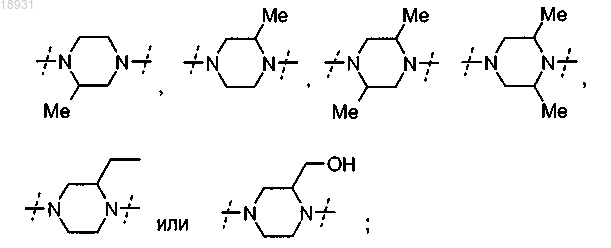
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, где R1 представляет собой водород, фтор или циано, или фармацевтически приемлемая соль указанного соединения.
3. Соединение по п.1 или 2, где R1 представляет собой фтор, или фармацевтически приемлемая соль указанного соединения.
4. Соединение по любому из пп.1-3, где R2 представляет собой водород или фтор, или фармацевтически приемлемая соль указанного соединения.
5. Соединение по любому из пп.1-4, где R2 представляет собой водород, или фармацевтически приемлемая соль указанного соединения.
6. Соединение по любому из пп.1-5, где R3 представляет собой водород, или фармацевтически приемлемая соль указанного соединения.
7. Соединение по любому из пп.1-6, где R4 представляет собой фтор, хлор, циано, трифторметокси, трифторметил или дифторметокси, или фармацевтически приемлемая соль указанного соединения.
8. Соединение по любому из пп.1-7, где R4 представляет собой фтор или циано, или фармацевтически приемлемая соль указанного соединения.
9. Соединение по любому из пп.1-8, где представляет собой
представляет собой или
или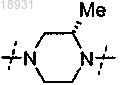 , или фармацевтически приемлемая соль указанного соединения.
, или фармацевтически приемлемая соль указанного соединения.
10. Соединение по любому из пп.1-9, представляющее собой (S)-N-(4-фторфенил)-4-(4-(4-фторфенил)фталазин-1-ил)-2-метилпиперазин-1-карбоксамид, или фармацевтически приемлемая соль указанного соединения.
11. Соединение по п.10, представляющее собой (S)-N-(4-фторфенил)-4-(4-(4-фторфенил)фталазин-1-ил)-2-метилпиперазин-1-карбоксамида гидрохлорид.
12. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 или фармацевтически приемлемую соль указанного соединения в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем.
13. Применение соединения по любому из пп.1-11 или фармацевтически приемлемой соли указанного соединения для лечения рака.
14. Применение соединения или соли по п.13, отличающееся тем, что указанный рак выбран из группы, состоящей из рака головного мозга, базально-клеточной карциномы, рака пищевода, рака желудка, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почек и меланомы.
Текст
В изобретении предложены новые 1,4-дизамещенные фталазины-антагонисты сигнального путиHedgehog, подходящие для лечения рака.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 018931 Настоящее изобретение относится к антагонистам сигнального пути Hedgehog и, в частности, к новым 1,4-дизамещенным фталазинам и применению указанных соединений в терапии. Сигнальный путьHedgehog (Hh) играет важную роль в образовании эмбриональной структуры и обеспечении жизнедеятельности взрослой ткани за счет регулирования дифференцировки и пролиферации клеток. Семейство белков Hedgehog (Hh), включающее Sonic Hedgehog (Shh), Indian Hedgehog (Ihh) и Desert Hedgehog(Dhh), представляет собой секретируемые гликопротеины, подвергающиеся посттрансляционным модификациям, включая автокаталитическое отщепление и присоединение холестерина к аминоконцевому пептиду с образованием фрагмента, обладающего активностью в отношении передачи сигналов. Hh связывается с состоящим из 12 доменов трансмембранным белком Ptch (Ptch1 и Ptch2), тем самым способствуя опосредуемому Ptch подавлению белка Smoothened (Smo). Активация Smo запускает ряд внутриклеточных процессов, завершающихся стабилизацией транскрипционных факторов Gli (Gli1, Gli2 и Gli3) и экспрессией Gli-зависимых генов, отвечающих за пролиферацию клеток, выживаемость клеток, ангиогенез и инвазию. Сигнальный путь Hh в последнее время привлекает значительный интерес, обусловленный обнаружением того факта, что нарушенная активация сигнального пути Shh приводит к образованию различных опухолей, например вызывает рак поджелудочной железы, медуллобластому, базально-клеточную карциному, мелкоклеточный рак легкого и рак простаты. Сообщалось о нескольких антагонистах Hh, таких как стероидный алкалоид IP-609, аминопролин CUR61414 и 2,4-дизамещенный тиазол JK18. ВWO 2005/033288 описаны некоторые 1,4-дизамещенные фталазины, которые, как утверждают, являются антагонистами Hedgehog. Аналогично, в документе WO 2008/110611 описаны некоторые 1,4 дизамещенные фталазины, связанные с диагностикой и лечением патологий, связанных с сигнальным путем Hedgehog. По-прежнему существует потребность в мощных ингибиторах сигнального пути Hedgehog, в частности ингибиторах, обладающих желаемыми фармакодинамическими, фармакокинетическими и токсикологическими характеристиками. В настоящем изобретении предложены новые 1,4-дизамещенные фталазины, являющиеся мощными антагонистами указанного пути. Согласно настоящему изобретению предложено соединение формулы (I)R3 представляет собой водород или хлор,при условии, что по меньшей мере один из R2 и R3 представляет собой водород;R4 представляет собой хлор, фтор, циано, трифторметил, метокси, дифторметокси или трифторметокси; представляет собой замещенный пиперазин-1,4-диил, выбранный из группы, состоящей из или фармацевтически приемлемая соль указанного соединения. Следует понимать, что в приведенных выше структурах пиперазиновых колец левая часть изображенного пиперазинового кольца присоединена к бициклическому фталазину, а правая часть пиперазинового кольца присоединена к карбонилу. Опытному специалисту в данной области техники понятно, что соединения согласно настоящему изобретению содержат фрагмент, представляющий собой третичный амин, и способны взаимодействовать с рядом неорганических и органических кислот, образуя фармацевтически приемлемые соли присоединения кислот. Такие фармацевтически приемлемые соли присоединения кислот и общая методика получения указанных солей известны в данной области техники. См., например, P. Stahl, et al., Handbook-1 018931 Конкретные варианты осуществления настоящего изобретения включают соединения формулы (I) или фармацевтически приемлемую соль указанного соединения, где:(c) R2 представляет собой водород или фтор;(g) R4 представляет собой фтор или циано;(l) R1 представляет собой водород, фтор или циано и R2 представляет собой водород или фтор;(m) R1 представляет собой водород, фтор или циано и R2 представляет собой водород;(n) R1 представляет собой фтор и R2 представляет собой водород или фтор;(о) R1 представляет собой фтор и R2 представляет собой водород;(р) R1 представляет собой водород, фтор или циано; R2 представляет собой водород или фтор и 4(q) R1 представляет собой водород, фтор или циано; R2 представляет собой водород и R4 представляет собой фтор, хлор, циано, трифторметокси, дифторметокси или трифторметил;(r) R1 представляет собой фтор; R2 представляет собой водород или фтор и R4 представляет собой фтор, хлор, циано, трифторметокси, дифторметокси или трифторметил;(s) R1 представляет собой фтор; R2 представляет собой водород и R4 представляет собой фтор, хлор,циано, трифторметокси, дифторметокси или трифторметил;(t) R1 представляет собой водород, фтор или циано; R2 представляет собой водород или фтор; 3R представляет собой водород и R4 представляет собой фтор, хлор, циано, трифторметокси, дифторметокси или трифторметил;(u) R1 представляет собой водород, фтор или циано; R2 представляет собой водород; R3 представляет собой водород и R4 представляет собой фтор, хлор, циано, трифторметокси, дифторметокси или трифторметил;(v) R1 представляет собой фтор; R2 представляет собой водород или фтор; R3 представляет собой водород и R4 представляет собой фтор, хлор, циано, трифторметокси, дифторметокси или трифторметил;(w) R1 представляет собой фтор; R2 представляет собой водород; R3 представляет собой водород и 4(x) R1 представляет собой фтор; R2 представляет собой водород; R3 представляет собой водород и 4(y) R1 представляет собой водород, фтор или циано; R2 представляет собой водород или фтор; представляет собой(z) R1 представляет собой фтор; R2 представляет собой водород или фтор;(аа) R1 представляет собой водород, фтор или циано; R2 представляет собой водород или фтор;(bb) R1 представляет собой водород, фтор или циано; R2 представляет собой водород; R3 представляет собой водород; R4 представляет собой фтор или циано; В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение формулы (I) или фармацевтически приемлемую соль указанного соединения в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем. Соединения согласно настоящему изобретению предпочтительно входят в состав фармацевтических композиций, подходящих для введения различными путями. Предпочтительно указанные композиции предназначены для перорального или внутривенного введения. Такие фармацевтические композиции и способы их получения хорошо известны в данной области техники. См., например, Remington: TheScience and Practice of Pharmacy (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). В настоящем изобретении также предложен способ лечения рака головного мозга, базальноклеточной карциномы, рака пищевода, рака желудка, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака,рака печени, рака почек или меланомы у пациента, включающий введение пациенту, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или фармацевтически приемлемой соли указанного соединения. Следует понимать, что фактически вводимое количество соединения будет определять лечащий врач с учетом соответствующих обстоятельств, включая состояние, лечение которого проводят, выбранный путь введения, конкретное вводимое соединение или соединения, возраст, массу тела и ответ конкретного пациента, а также степень тяжести симптомов заболевания у пациента. Суточные дозировки обычно составляют примерно от 0,1 примерно до 5 мг/кг массы тела. В некоторых случаях более чем достаточными могут быть уровни дозировок ниже нижней границы вышеуказанного диапазона, тогда как в других случаях можно применять еще более высокие дозы. Следовательно, вышеуказанный диапазон дозировок никоим образом не ограничивает объем настоящего изобретения. Согласно настоящему изобретению также предложено соединение формулы (I) или фармацевтически приемлемая соль указанного соединения для применения в качестве лекарственного средства. Кроме того, согласно настоящему изобретению предложено применение соединения формулы (I) или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства для лечения рака. В частности, указанный рак выбран из группы, состоящей из рака головного мозга,базально-клеточной карциномы, рака пищевода, рака желудка, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почек и меланомы. Далее, в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или фармацевтически приемлемую соль указанного соединения в качестве активного агента, для лечения рака головного мозга, базально-клеточной карциномы, рака пищевода, рака желудка,рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почек или меланомы. Соединения формулы (I) или соли указанных соединений можно получить при помощи множества методик, известных в данной области техники, а также описанных на схемах и в синтезах и примерах,приведенных ниже. Для получения соединений формулы (I) или солей указанных соединений можно различными способами комбинировать конкретные стадии синтеза в каждом из описанных путей или использовать их в сочетании со стадиями из других схем. Если не указано иное, заместители являются такими, как определено ранее. Реагенты и исходные вещества, в общем случае, легко доступны среднему специалисту в данной области техники. Другие реагенты и исходные вещества можно получить стандартными методами органической и гетероциклической химии, методами, аналогичными синтезу известных похожих по структуре соединений, и методами, описанными в синтезах и примерах, приведенных далее, включая любые новые методы.-3 018931 В настоящем описании следующие термины имеют указанные значения:IC50 - концентрация агента, обеспечивающая 50% от максимально возможного для данного агента ингибиторного ответа. Схема 1 Соединение формулы (6b) можно получить в соответствии с реакциями, приведенными на схеме 1. Согласно схеме 1, стадия 1, 1,4-дихлорфталазин (2) может взаимодействовать с замещенным пиперазином (3 а) или (3b) в реакции ароматического нуклеофильного замещения (SNAr) с образованием пиперазинилфталазина формулы (4 а) или (4b). Реакция протекает в диполярном апротонном растворителе,таком как ДМСО или ДМФА, в присутствии подходящего основания, такого как триэтиламин, диизопропилэтиламин или карбонат калия. Смесь нагревают примерно при 70-150C. Опытному специалисту в данной области техники понятно, что в некоторых случаях может быть предпочтительным применение защитной группы, такой как группа t-boc в пиперазине формулы (3a), обеспечивающей защиту менее экранированного атома азота, как в (S)-трет-бутил-3-метилпиперазин-1-карбоксилате. Напротив, если реакция проходит по менее экранированному атому азота, можно использовать незащищенные пиперазины, такие как цис-2,6-диметилпиперазин или пиперазин-2-илметанол. Также не требуется проведения зашиты при применении 2,5-диметилпиперазина. На стадии 2 фталазинилхлорид формулы (4) взаимодействует с фенилбороновой кислотой в условиях реакции перекрестного сочетания Сузуки. Опытному специалисту в данной области техники понятно, что существует множество условий, способствующих протеканию указанных реакций перекрестного сочетания. При проведении реакции используют подходящий растворитель, такой как диоксан или диоксан/вода. Реакцию проводят в присутствии основания, такого как карбонат цезия или фторид цезия. Реакция протекает в присутствии палладиевого катализатора, такого как дихлорид бис-(ди-трет-бутил(4 диметиламинофенил)фосфин)палладия(II), хлорид (1,1'-бис-(дифенилфосфино)ферроцен)палладия(II) или дихлорид (SP-4-1)-бис-[бис-(1,1-диметилэтил)(4-метоксифенил)фосфин-P]палладия (полученный в соответствии с синтезом катализатора D в J. Org. Chem. 2007, 12, 5104-5112) в инертной атмосфере при температуре примерно 80-100C, образуя фенилпиперазинилфталазин формулы (6a) или (6b). В качестве альтернативы на стадии 3 фенилфталазинилхлорид формулы (5) взаимодействует с пиперазином формулы (3a) или (3b) в реакции нуклеофильного ароматического замещения (SNAr), аналогичной реакции, описанной для стадии 1 выше. Согласно схеме 1, стадия 4, можно снять защиту с аминной функциональной группы, такой как группа, присутствующая в фенилпиперазинилфталазине формулы (6 а), получив соединение формулы(6b), которое далее вступает в реакцию с образованием соединения согласно настоящему изобретению. Способы удаления защитных групп при атоме азота хорошо известны в данной области техники (см.,например, Greene and Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons, New York,-4 018931(1999. Например, удаление защитной группы boc из фенилпиперазинилфталазина формулы (6) можно проводить в кислой среде, например, при помощи хлористого водорода. Полученную соль HCl можно превратить в свободный амин при помощи колонки с SCX или неорганического основания, такого как бикарбонат натрия. Опытному специалисту в данной области техники известно, что соединения формулы (5) на схеме 1 коммерчески доступны или легко могут быть получены способами, аналогичными способам, описанным в настоящем изобретении, или при помощи общепринятых в данной области техники методик. Например, 2-фенилкарбонилбензойная кислота, полученная реакцией Гриньяра из фенилмагнийбромида и фталевого ангидрида, может вступать в реакцию циклизации с гидразином с образованием 4-фенил-2Hфталазин-1-она. При последующем воздействии оксихлоридом фосфора получают 1-хлор-4-фенилфталазин формулы (5). Альтернативно, 1,4-дихлорфталазин может вступать в реакцию с фенилбороновой кислотой по реакции перекрестного сочетания Сузуки, образуя соответствующий 1 хлор-4-фенилфталазин формулы (5). Схема 2 Согласно схеме 2 пиперазинилфталазин формулы (6b), из которого удалена защитная группа, можно ацилировать при помощи замещенного фенилизоцианата в инертном растворителе, таком как дихлорметан, получая мочевину формулы (I). Следующие синтезы и примеры приведены с целью более подробной иллюстрации настоящего изобретения и представляют типичные способы синтеза соединений формулы (I). Названия соединений согласно настоящему изобретению в общем случае получены при помощи ChemDraw Ultra 10.0. Синтез 1.(97 мл) при 115C в течение 3 дней. Реакционную смесь выливали в воду, промывали CH2Cl2. Экстрагировали Et2O. Органический слой промывали водой (2), затем сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 0 до 20% EtOAc в CH2Cl2) с получением целевого соединения в виде бледно-желтой пены (7,05 г,84%).ES/MS m/z 423,2 (M+1). Альтернативная методика. Добавляли (S)-трет-бутил-2-метилпиперазин-1-карбоксилат (276 г, 1,38 моль) к суспензии 1-хлор-4(4-фторфенил)фталазина (275 г, 1,06 моль) и диизопропилэтиламина (346 мл, 1,99 моль) в ДМСО (2,56 л) при 25C. Нагревали полученную смесь при 102C в течение 9 ч. Охлаждали реакционную смесь до 25C и перемешивали в течение 48 ч. Добавляли смесь к EtOAc (2,5 л) и воде (3,5 л). Водную фазу экстрагировали этилацетатом (22,0 л). Органические слои объединяли, промывали водой (2,5 л) и концентрировали до образования коричневой пены. Пену растворяли в ацетонитриле (1,0 л) и охлаждали до 1C в течение 30 мин. Осадок отфильтровывали, получая желтовато-коричневое твердое вещество. Концентрировали оставшуюся жидкость и суспендировали полученный остаток в ацетонитриле (500 мл) в течение 30 мин. Фильтровали полученную смесь, получая желтовато-коричневое твердое вещество. Твердые осадки объединяли и сушили в вакуумном шкафу (14 торр (1,87 кПа), 25C) в течение 25 ч с получением целевого соединения в виде желтовато-коричневого твердого вещества (435 г, 96%).ES/MS m/z 423,0 (M+1). Пиперазинилфталазины, представленные в табл. 1, получали, по существу, в соответствии с методикой, описанной в синтезе 1, с использованием 1,5 экв. соответствующим образом замещенного пиперазина и 3-5 экв. триэтиламина при температуре от 115 до 150C в течение от 3 до 6 дней. В качестве растворителя использовали ДМФА. Альтернативная методика синтеза 2. Добавляли 1-хлор-4-(4-фторфенил)фталазин (200 г, 773 ммоль) к раствору (S)-трет-бутил-3 метилпиперазин-1-карбоксилата (232 г, 1,16 моль), диизопропилэтиламина (674 мл, 28,1 моль) и ДМСО(2,0 л). Нагревали полученную смесь при 120C в течение 60 ч. Охлаждали смесь до 25C, выливали в ледяную воду (3,0 л) и фильтровали. Твердое вещество собирали, растворяли в CH2Cl2 (2,0 л) и экстрагировали водой (2,0 л). Органическую фазу концентрировали и помещали на слой диоксида кремния (3,0 кг диоксида кремния), элюируя 3% ТГФ в CH2Cl2 с получением целевого соединения в виде желтой пены Нагревали смесь 1-хлор-4-(4-фторфенил)фталазина (5,02 г, 19,4 ммоль), (S)-трет-бутил-2 этилпиперазин-1-карбоксилата (5,00 г, 23,3 ммоль) и K2CO3 (5,38 г, 38,9 ммоль) в ДМСО (75 мл) при 120C в течение 1 дня. Выливали реакционную смесь в воду, ополаскивали EtOAc. ЭкстрагировалиEtOAc. Органический слой промывали водой (2), затем раствором соли, сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 20 до 80% EtOAc в гексане) с получением целевого соединения (5,11 г, 60%). Растворяли 1-хлор-4-(4-фторфенил)фталазин (0,1 г, 0,39 ммоль), (R)-пиперазин-2-илметанол (0,07 г,0,58 ммоль) и диизопропилэтиламин (0,34 мл, 1,93 ммоль) в ДМСО (1 мл). Перемешивали реакционную смесь при 120C в течение 64 ч. Очищали реакционную смесь флэш-хроматографией на силикагеле(0-10% 2 М аммиак/MeOH в CH2Cl2) с получением целевого соединения в виде коричневого твердого вещества (0,11 г, 84%).ES/MS m/z 339,0 (M+1). Пиперазинилфталазины в табл. 3 получали, по существу, в соответствии с методикой, описанной в синтезе 9, с использованием соответствующим образом замещенного пиперазина. Таблица 3-7 018931 течение 2 дней. Выливали реакционную смесь в воду, ополаскивали CH2Cl2. Экстрагировали Et2O. Промывали органический слой водой (2), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 0 до 20% EtOAc вCH2Cl2) с получением целевого соединения в виде бледно-желтого твердого вещества (6,0 г, 33%). Нагревали смесь 1,4-дихлорфталазина (7,80 г, 39,2 ммоль), (S)-трет-бутил-2-метилпиперазин-1 карбоксилата (4,98 г, 24,9 ммоль) и триэтиламина (10,3 мл, 73,9 ммоль) в ДМСО (110 мл) при 80C в течение 18 ч. Выливали реакционную смесь в воду, ополаскивали EtOAc. Экстрагировали EtOAc. Органический слой промывали водой (2) и раствором соли, сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 20 до 80% EtOAc в гексане) с получением целевого соединения (4,13 г, 46%). Нагревали смесь (S)-трет-бутил-4-(4-хлорфталазин-1-ил)-3-метилпиперазин-1-карбоксилата (4,0 г,11,0 ммоль), 4-цианфенилбороновой кислоты (2,43 г, 16,5 ммоль), карбоната цезия (14,4 г, 44,1 ммоль) и дихлорида (SP-4-1)-бис-[бис-(1,1-диметилэтил)-(4-метоксифенил)фосфин-Р]палладия (J. Org. Chem. 2007, 72, 5104-5112) (75,4 мг, 0,11 ммоль) в 1,4-диоксане (80 мл) и воде (20 мл) при 90C в течение ночи. Реакционную смесь распределяли между водой и CH2Cl2. Водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 0 до 20% EtOAc в CH2Cl2) с получением целевого соединения в виде светло-оранжевой пены (4,46 г, 94%).ES/MS m/z 430,2 (M+1). Пиперазинилфталазины, представленные в табл. 4, получали, по существу, в соответствии с методикой, описанной в синтезе 16, с использованием соответствующих 4-хлорфталазина и бороновой кислоты. В синтезах 19, 20 проводили дегазирование перед добавлением в качестве катализатора дихлорида бис-(ди-трет-бутил(4-диметиламинофенил)фосфин)палладия(II) и нагревали полученные смеси при 90C в течение 72 ч.(1,1'-бис-(дифенилфосфино)ферроцен)палладия(II) (0,27 г, 0,33 ммоль). Полученную смесь нагревали при 95C в течение ночи. Распределяли реакционную смесь между водой и EtOAc. Водный слой экстрагировали EtOAc. Промывали органическую часть водой и раствором соли, сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали флэш-хроматографией на силикагеле (градиент от 15 до 70% EtOAc в гексане) с получением целевого соединения (0,94 г, 96%). Раствор (S)-трет-бутил 4-(4-(4-фторфенил)фталазин-1-ил)-2-метилпиперазин-1-карбоксилата (7,05 г,16,2 ммоль) в 1,4-диоксане (50 мл) обрабатывали 4 М HCl в 1,4-диоксане (25 мл). Добавляли MeOH для растворения полученного осадка и перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в MeOH и переносили на колонку 50 г Varian SCX. Ополаскивали MeOH и CH2Cl2, затем элюировали продукт 1:1CH2Cl2:2 М аммиаком в MeOH. Элюент концентрировали при пониженном давлении с получением целевого соединения в виде бледно-желтой пены (4,83 г, 93%).ES/MS m/z 323,2 (M+1). Альтернативная методика синтеза 22. Метанол (2,82 л) охлаждали до 0C на бане 1:1 ацетон/вода с сухим льдом и добавляли ацетилхлорид (142 мл, 2,0 моль) по каплям в течение 30 мин, поддерживая в процессе добавления температуру ниже 15C. Перемешивали полученную смесь в течение 15 мин. Добавляли за один прием (S)-трет-бутил-4-9 018931(4-(4-фторфенил)фталазин-1-ил)-2-метилпиперазин-1-карбоксилат (282 г, 667 ммоль). Перемешивали полученную смесь в течение 12 ч при 25C. Концентрировали и полученный остаток растворяли в воде(3,0 л). Добавляли твердый NaHCO3 до достижения рН 7. Экстрагировали продукт CH2Cl2 (22,0 л), объединяли органические слои и концентрировали с получением целевого соединения в виде коричневой хрупкой пены с количественным выходом (236 г, 100%).ES/MS m/z 323,0 (M+1). Пиперазинилфталазины в табл. 5 получали, по существу, в соответствии с методикой, описанной в синтезе 22, с использованием соответствующего защищенного boc пиперазинилфталазина, при времени реакции от 2 ч до ночи. В синтезах 30-34 в качестве растворителя применяли MeOH. Таблица 5 Раствор трифосгена (1,09 г, 3,67 ммоль) в толуоле (20 мл) охлаждали на водяной бане со льдом. Добавляли к полученной смеси по каплям раствор 4-амино-3-фторбензонитрила (1,36 г, 10,0 ммоль) и триэтиламина (2,8 мл, 20,0 ммоль) в толуоле (30 мл). Нагревали полученную смесь при 70C в течение 5 ч. Охлаждали реакционную смесь до комнатной температуры и отфильтровывали твердое вещество. Фильтрат концентрировали при пониженном давлении с получением белого твердого вещества (1,44 г,84%), которое использовали без дополнительной очистки. ЖХ/МС m/z 162 (M+). Известный изоцианат в табл. 6 получали из соответствующего анилина, по существу, в соответствии с методикой, описанной в синтезе 35. Таблица 6(31 мл) обрабатывали 1-фтор-4-изоцианатобензолом (0,42 мл, 3,72 ммоль). Перемешивали в течение 3 дней при комнатной температуре. Концентрировали реакционную смесь при пониженном давлении. Остаток растирали с Et2O и фильтровали. Ополаскивали твердое вещество пентаном, а затем сушили в вакууме при 45C. Растворяли твердое вещество в смеси CH2Cl2 и MeOH и обрабатывали 3 экв. 1 М HCl вEt2O. Полученную смесь перемешивали, концентрировали при пониженном давлении и сушили в вакууме при 45C, получая целевую гидрохлоридную соль в виде желтой пены (1,5 г, 98%).ES/MS m/z 460,0 (M+1). Альтернативная методика примера 1. Добавляли по каплям в течение 1 ч 1-фтор-4-изоцианатобензол (105 мл, 930 ммоль) к раствору(S)-l-(4-фторфенил)-4-(3-метилпиперазин-1-ил)фталазина (300 г, 930 ммоль) в CH2Cl2 (4,5 л) при 25C. Перемешивали полученную смесь в течение 25 мин и концентрировали до пены. Пену суспендировали в МТБЭ (3,0 л) и промывали влажный остаток на фильтре МТБЭ (500 мл). Оставшийся раствор концентрировали до масла. Масло суспендировали в этилацетате (2,0 л) с получением твердого вещества и фильтровали. Отфильтрованные твердые вещества объединяли и сушили с получением целевого соединения в виде желтовато-коричневого твердого вещества (344 г, 80%). Суспендировали указанное твердое вещество (327 г, 711 ммоль) в изопропаноле (3,27 л) при 42C и обрабатывали 4 М HCl в 1,4-диоксане(177 мл, 711 ммоль). Полученную смесь нагревали при 60C в течение 30 мин. Медленно охлаждали до 25C в течение 2 ч. Фильтровали и промывали влажный остаток на фильтре изопропанолом (200 мл) и гептаном (200 мл). Сушили остаток в вакууме (12 торр, 35C, 2 ч) с получением целевого соединения в виде бледно-желтого твердого вещества (308 г, 87%).(15,5 мл) обрабатывали 1-фтор-4-изоцианатобензолом (0,194 мл, 1,71 ммоль). Перемешивали в течение ночи при комнатной температуре. Реакционную смесь очищали флэш-хроматографией на силикагеле(градиент от 0 до 3% 2 М аммиак/MeOH в CH2Cl2). Очищенное свободное основание растворяли в смесиCH2Cl2 и MeOH и обрабатывали 3 экв. 1 М HCl в Et2O. Полученную смесь перемешивали, концентрировали при пониженном давлении и сушили в вакууме при 45C с получением целевой гидрохлоридной- 11018931 соли в виде желтой пены (0,72 г, 94%).ES/MS m/z 460,0 (M+1). Альтернативная методика примера 2. Добавляли 1-фтор-4-изоцианатобензол (27,9 мл, 245 ммоль) к раствору (S)-1-(4-фторфенил)-4-(2 метилпиперазин-1-ил)фталазина (72 г, 223 ммоль) в CH2Cl2 (500 мл) при 25C по каплям в течение 1 ч. Перемешивали полученную смесь в течение 25 мин и концентрировали до пены. Ацетилхлорид (16,5 мл,231 ммоль) добавляли к метанолу при 0C и перемешивали в течение 5 мин. К полученному метанольному раствору добавляли указанную пену и перемешивали в течение 1 ч. Полученный раствор концентрировали до образования пены. Пену суспендировали в ацетонитриле (200 мл) и CH2Cl2 (30 мл), фильтровали и собирали целевое соединение в виде желтого твердого вещества (91 г, 86%).ES/MS m/z 460,0 (M+1). Мочевины, представленные в табл. 7, получали, по существу, в соответствии с методиками, описанными в примере 1 или 2, с использованием соответствующего пиперазинилфталазина и небольшого избытка соответствующего изоцианата. Время реакции варьировали от 0,5 ч до 3 дней. Полученные соединения очищали растиранием (с Et2O или 1:1 CH2Cl2:гексан) или флэш-хроматографией на силикагеле. В примерах 57-60 и 66-69 очистку проводили при помощи контролируемой по массе обращенно-фазовой хроматографии (колонка Waters XBridge C18 ODB MS HPLC, 3075 мм, размер частиц 5 мкм, градиент от 20 до 70% ацетонитрила в воде, содержащей 0,01 М бикарбоната аммония, при расходе 85 мл/мин в течение 8 мин). В примерах 75-82 использовали неочищенные изоцианаты (синтезы 35-36) в 1,5-2-кратном избытке. В примерах 18, 29 и 38 исключали MeOH из процесса получения соли HCl.CH2Cl2 (3 мл) обрабатывали 1-фтор-4-изоцианатобензолом (0,04 г, 0,31 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение 30 мин, после чего концентрировали реакционную смесь. Полученный остаток очищали флэш-хроматографией на силикагеле (0-50% EtOAc в гексане, а затем 3% MeOH в CH2Cl2) с получением твердого вещества. Полученное твердое вещество растворяли вMeOH (1 мл) и обрабатывали 1 н. водным HCl (0,13 мл, 0,13 ммоль). Полученный раствор концентрировали с получением целевого соединения в виде твердого вещества (0,065 г, 29%).ES/MS m/z 476,0 (M+1). Пиперазинилфталазинмочевины, представленные в табл. 8, получали, по существу, в соответствии с методикой, описанной в примере 90, с использованием соответствующих пиперазинилфталазина и изоцианата. Таблица 8CH2Cl2 (5 мл) обрабатывали 1-фтор-4-изоцианатобензолом (0,17 г, 1,25 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение 1 ч. Очищали реакционную смесь флэш-хроматографией на силикагеле (0-50% EtOAc в гексане). Собирали и концентрировали соответствующие фракции. Смесь изомеров N-(4-фторфенил)-4-(4-(4-фторфенил)фталазин-1-ил)-транс-2,5 диметилпиперазин-1-карбоксамида (0,3 г, 0,59 ммоль) растворяли в MeOH (2 мл). Смесь транс-изомеров разделяли при помощи хиральной хроматографии (Chiralcel OJ-H, расход 30 мл/мин, детектирование- 28018931 225 нм, 6:4 MeOH:ацетонитрил). Собирали соединение, соответствующее первому пику при элюировании, в качестве изомера 1, а соединение, соответствующее второму пику при элюировании, в качестве изомера 2. Соответствующие фракции собирали и концентрировали. Разделенные изомеры растворяли вMeOH (1 мл) и обрабатывали каждый раствор 1 экв. 1 н. водного HCl. Концентрировали, получая гидрохлоридные соли изомера 1 (0,131 г, 44%) и изомера 2 (0,129 г, 43%). Изомер 1: ES/MS m/z 474,2 (M+1), 99% э.и. Изомер 2: ES/MS m/z 474,2 (M+1), 99% э.и. Примеры 96 и 97. Примеры 96 и 97 получали, по существу, в соответствии с методикой, описанной для примеров 94 и 95, с использованием смеси цис-диметилпиперазинов из синтеза 12. Смесь цис-изомеров разделяли при помощи хиральной ВЭЖХ и получали соли HCl, получая изомер 1 (0,21 г, 34%) и изомер 2 (0,20 г, 33%). Изомер 1: ES/MS m/z 474,2 (M+1), 95% э.и. Изомер 2: ES/MS m/z 474,2 (M+1), 92% э.и. Биология. Было показано, что Hedgehog как фактор выживаемости связан со следующими видами рака: базально-клеточная карцинома; рак верхней части желудочно-кишечного тракта (пищевода, желудка, поджелудочной железы и желчевыводящих путей); рак простаты; рак молочной железы; мелкоклеточный рак легкого; немелкоклеточный рак легкого; В-клеточная лимфома; множественная миелома; рак желудка; рак яичников; колоректальный рак; рак печени; меланома; рак почек и рак головного мозга. Было доказано, что элементы сигнального пути Hedgehog являются потенциальными мишенями лекарственных средств для лечения различных видов рака. Линия клеток Daoy, происходящая из опухоли медуллобластомы (АТСС, НТВ-186), чувствительна к лигандам Hh. При воздействии на указанные клетки экзогенно внесенной Shh-кондиционированной среды происходит активация сигнального пути Hh,приводящая к увеличенной экспрессии Gli1. Циклопамин - алкалоид, выделенный из полевого вьюнкаVeratrum californicum - является слабым антагонистом Hedgehog и, как показано, подавляет экспрессиюGli1 в ответ на стимуляцию Shh. Последние наблюдения позволяют предположить, что циклопамин ингибирует рост клеток медуллобластомы в культуре и аллотрансплантатов. С использованием модельной системы на клетках Daoy можно идентифицировать мощные ингибиторы сигнального пути Hedgehog. Поскольку соединения согласно настоящему изобретению представляют собой антагонисты Hedgehog,они подходят для лечения указанных выше типов опухолей. Определение биологической активности IC50. Следующий протокол и результаты исследования дополнительно демонстрируют применимость и эффективность соединений и способов согласно настоящему изобретению. Функциональные исследования подтверждают, что соединения согласно настоящему изобретению проявляют способность ингибировать сигнальный путь Shh. Все лиганды, растворители и реактивы, применяемые в следующем исследовании, легко доступны из коммерческих источников или легко могут быть получены опытным специалистом в данной области техники. Биологическую активность определяли при помощи функционального исследования на клетках нейронального рака Daoy и измеряли уровни рибонуклеиновой кислоты Gli1 при помощи тестовой системы рДНК (разветвленной дезоксирибонуклеиновой кислоты) (Panomics, Inc., Fremont, CA). Gli первоначально открыт в линии клеток глиобластомы и кодирует белок "цинковый палец", активируемый сигнальным путем Shh. Максимальный отклик получен при включении транскрипции Gli1 в клетках Daoy с кондиционированной средой (клетки мезонефроса человека, HEK-293, стабильно экспрессирующие рекомбинантный Shh) в течение 24 ч и последующем измерении количества стимулированного транскрипта Gli1. Минимальный отклик представляет собой количество транскрипта Gli1, ингибированного контрольным соединением в клетках Daoy, которое было стимулировано кондиционированной средой(клетки мезонефроса человека, HEK-293, стабильно экспрессирующие рекомбинантный Shh) в течение 24 ч. Функциональное исследование для измерения ингибирования Gli1 в клетках Daoy. В системе анализа рДНК используют технологию ДНК с разветвленной цепью, чтобы сделать возможной амплификацию рибонкулеиновой кислоты-мишени (транскрипта). В указанной технологии применяют три типа синтетических гибридных коротких специфических к Gli1 кДНК-зондов, которые определяют специфичность транскрипта-мишени [усилители захвата (СЕ), усилители метки (LE) и блокаторы
МПК / Метки
МПК: A61P 35/00, A61K 31/502, C07D 403/04
Метки: фталазины-антагонисты, hedgehog, пути, сигнального, дизамещенные
Код ссылки
<a href="https://eas.patents.su/30-18931-dizameshhennye-ftalaziny-antagonisty-signalnogo-puti-hedgehog.html" rel="bookmark" title="База патентов Евразийского Союза">Дизамещенные фталазины-антагонисты сигнального пути hedgehog</a>
Предыдущий патент: Сокристаллы пропиконазола
Следующий патент: Способ получения жидкого экстракта зерна злаков и устройство для использования в данном способе
Случайный патент: Композиция, включающая ингибитор pde4 и ингибитор pde5












