Соединения, модулирующие активность каннабиноидного рецептора св1, композиции на их основе и их применение
Номер патента: 18900
Опубликовано: 29.11.2013
Авторы: Нильсен Петер Одаль, Линже Жан-Мишель, Ноэрегор Пиа Карина, Хёгберг Томас, Альмхольт Дортэ, Ресевёр Жан-Мари, Бьюрлинг Эмели, Мюррей Энтони
Формула / Реферат
1. Соединение формулы (I) или его соль, гидрат, сольват или N-окись
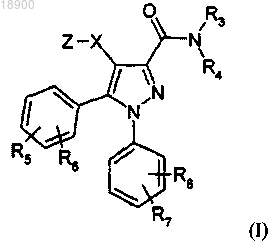
где X означает связь или -СН2-;
Z обозначает радикал, выбранный из группы, состоящей из следующих радикалов формул (1)-(26):
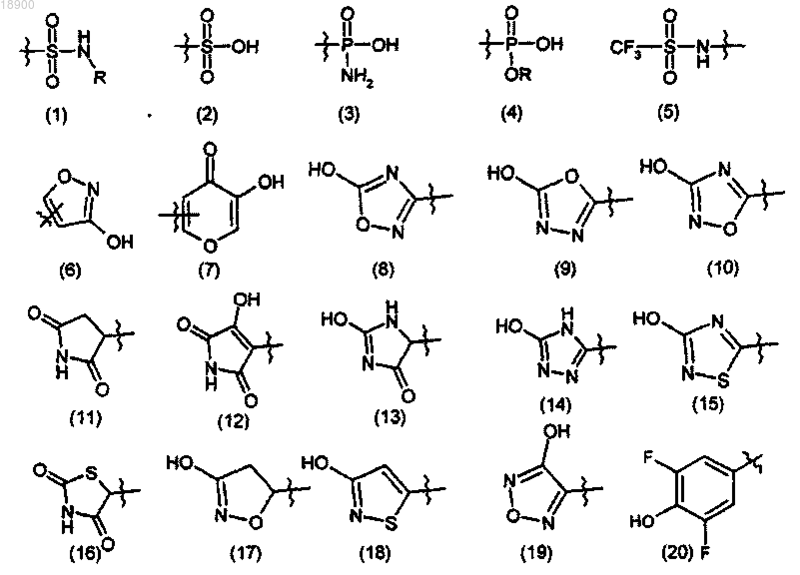
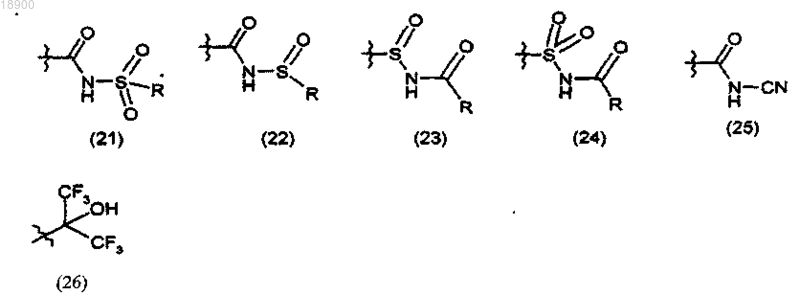
где R обозначает (C1-С6)алкил, фенил или бензил, возможно замещенный R5 в кольце; или
моноциклическое неароматическое карбоциклическое кольцо, содержащее 3-6 атомов в кольце;
R3 обозначает водород, (C1-С3)алкил;
R4 обозначает радикал формулы -(Alk1)p-(Q1)r-(L)s-Q2, где р, r равны 1 и s равен 0 или 1;
Alk1 обозначает двухвалентный (C1-С4)алкилен, который является замещенным R10 и/или R11 у одного атома углерода;
L обозначает двухвалентный радикал формулы –(Alk2)n-(W)m- в любой ориентации, где
n равен 0 и m равен 1; и
W обозначает -О-;
Q1 обозначает фенильное кольцо, необязательно замещенное (C1-C3)фторалкилом или -F;
Q2 (а) в случае, когда s в -(L)s-Q2 равен 1, обозначает фенильное кольцо, необязательно замещенное (C1-С3)фторалкилом или -F, б) только в случае, когда s в -(L)s-Q2 равен 0, обозначает водород;
или R3 и R4, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое аминное кольцо, содержащее в кольце 6 атомов; которое может быть замещено радикалом формулы
-(L)s-Q2, где s и L определены выше и Q2 обозначает фенильное кольцо, необязательно замещенное (C1-С3)фторалкилом или -F;
R5, R6, R7 и R8, каждый независимо, выбраны из водорода, -F, -Cl и
R10 и R11 обозначают водород или (C1-С3)алкил при условии, что по меньшей мере один из R10 и R11 обозначает (C1-С3)алкил; или R10 и R11, взятые вместе с атомом углерода, к которому они присоединены, образуют (С3-С5)циклоалкильное кольцо.
2. Соединение по п.1, отличающееся тем, что R3 обозначает водород.
3. Соединение по любому из пп.1 или 2, отличающееся тем, что одно или оба из колец Q1 и Q2 являются незамещенными.
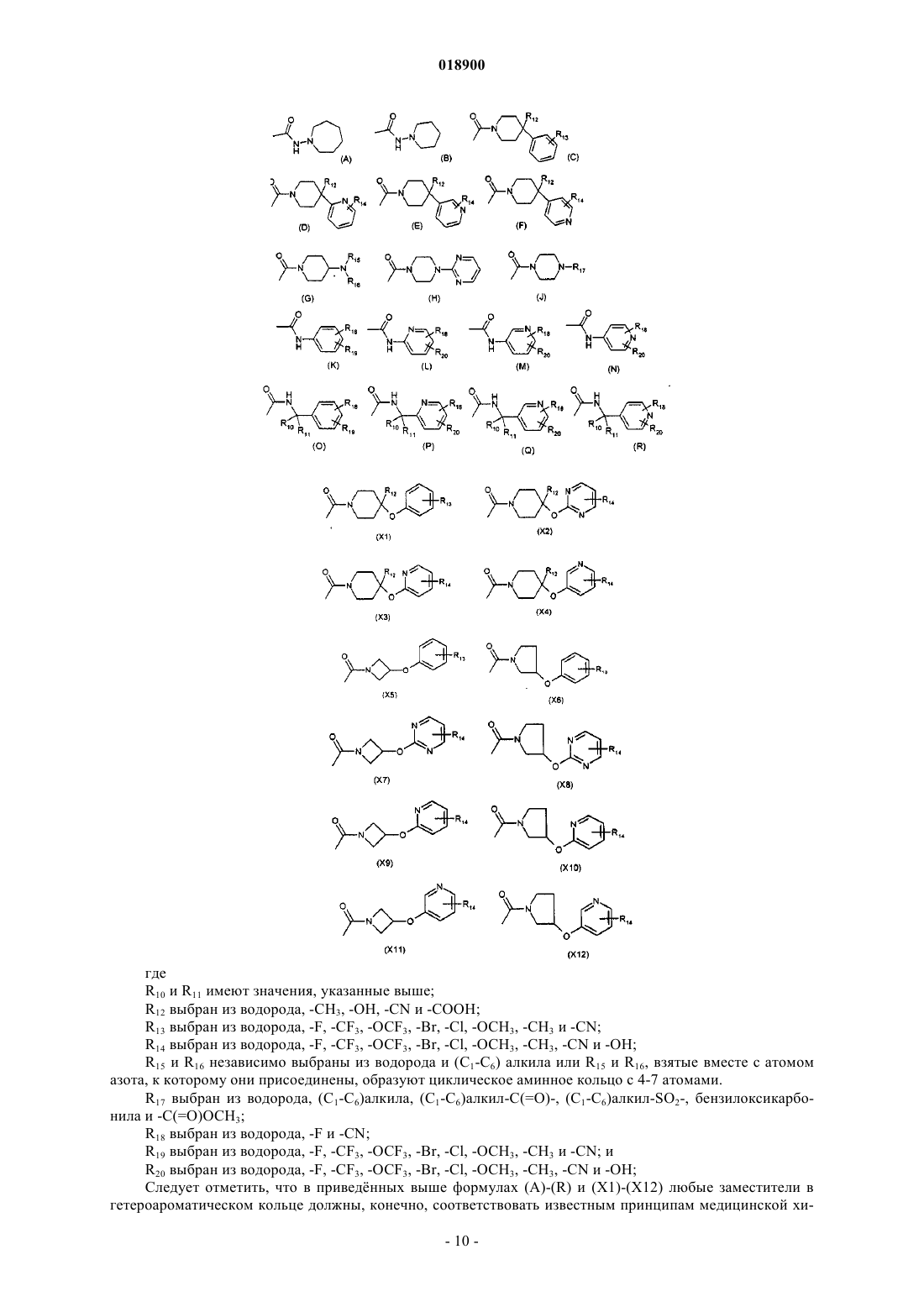
4. Соединение по любому из пп.1-3, отличающееся тем, что радикал -С(=О)NR3R4 в формуле (I) выбран из группы, состоящей из радикалов (С), (О) и (X1)
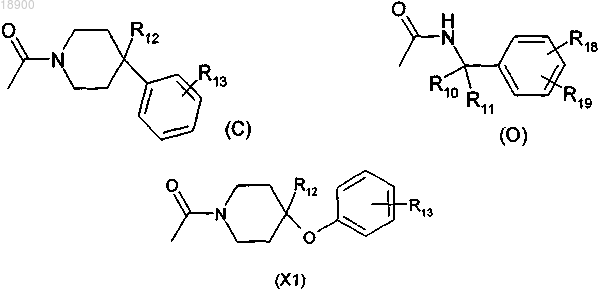
где R10 и R11 имеют значения, указанные в п.1;
R12 выбран из водорода;
R13 выбран из водорода, -F, -CF3;
R18 выбран из водорода, -F;
R19 выбран из водорода, -F, -CF3.
5. Фармацевтическая композиция, модулирующая активность каннабиноидного рецептора СВ1, содержащая соединение по любому из предыдущих пунктов, вместе с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
6. Применение соединения по любому из пп.1-4 в изготовлении лекарственного средства для лечения болезней или состояний, которые опосредованы сигнализирующей активностью рецептора СВ1.
7. Применение по п.6 для лечения ожирения, избыточного веса; лечения болезней и состояний, прямо или косвенно связанных с ожирением и избыточным весом; или нарушения питания, аддиктивного расстройства, умственного расстройства, неврологических расстройств, сексуальной дисфункции, репродуктивной дисфункции, болезни печени или болезни, связанной с фиброзом.
8. Применение по п.7, отличающееся тем, что болезнью, прямо или косвенно связанной с ожирением и избыточным весом, является метаболический синдром, диабет типа 2, сердечно-сосудистая болезнь, метаболическая дисфункция, метаболическое заболевание или расстройство или заболевание печени.
Текст
СОЕДИНЕНИЯ, МОДУЛИРУЮЩИЕ АКТИВНОСТЬ КАННАБИНОИДНОГО РЕЦЕПТОРА СВ 1, КОМПОЗИЦИИ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ Соединения формулы (I) являются модуляторами активности каннабиноидного рецептора СВ 1. Изобретение относится также к фармацевтическим композициям, содержащим указанные соединения. Соединения формулы (I) могут быть использованы для изготовления лекарственных средств для лечения болезней или состояний, которые опосредованы сигнализирующей активностью рецептора СВ 1, которые прямо или косвенно могут быть связаны с ожирением и избыточным весом; или нарушением питания, аддиктивным расстройством, умственным расстройством, неврологическим расстройством, сексуальной дисфункцией, репродуктивной дисфункцией, болезнью печени или болезнью, связанной с фиброзом. Ресевр Жан Мари (DK), Бьюрлинг Эмели (SE), Мюррей Энтони (DK),Хгберг Томас (SE), Нильсен Петер Одаль, Линже Жан-Мишель,Ноэрегор Пиа Карина, Альмхольт Дортэ (DK) Дементьев В.Н. (RU) Данное изобретение относится к соединениям, которые являются модуляторами каннабиноидного рецептора СВ 1 и которые подавляют нормальную сигнализирующую активность таких рецепторов. Кроме того, настоящее изобретение относится также к композициям и способам с применением таких соединений для лечения болезней или состояний, которые опосредуются сигнализирующей активностью рецептора СВ 1, например, для лечения ожирения и избыточного веса, предотвращения увеличения веса,лечения болезней и состояний, прямо или косвенно связанных с ожирением и избыточным весом, таких как метаболический синдром, диабет типа 2, сердечно-сосудистые заболевания, метаболические дисфункции у больных, страдающих от ожирения, избыточного веса и имеющих нормальный вес, метаболические болезни или нарушения, рак, болезни печени и другие вторичные заболевания, которые указаны ниже, а также для лечения некоторых расстройств, не связанных непосредственно с ожирением и избыточным весом, таких как нарушения питания, аддиктивные расстройства, умственные расстройства, неврологические расстройства, сексуальные дисфункции, репродуктивные дисфункции, заболевания печени,болезни, относящиеся к фиброзу и другие клинические показания, указанные ниже. Данное изобретение относится также к фармацевтическим композициям, содержащим соединения по изобретению, и к применению таких соединений в комбинации с другими видами лечения таких расстройств. Область техники, к которой относится изобретение Количество людей, страдающих от ожирения в Северной Америке и в большинстве европейских стран увеличилось в последние 20 лет более, чем вдвое и более половины взрослого населения теперь страдает или от избыточного веса, или от ожирения. В настоящее время ожирение считается хроническим заболеванием и критической проблемой, угрожающей здоровью людей во всм мире (Fiegal et al.,1998, Int. J. Obesity 22: 39-41, Mokdad et al., 1999, JAMA 282: 1519-1522; Halford, 2006, Appetite, 46, 6-10)."Идентифицируемые признаки и симптомы" ожирения включают избыточное накопление жира или адипозной ткани, увеличение размера или количества жировых клеток (дифференциация адипоцитов), стойкость к инсулину, повышенный уровень глюкозы (гипергликемия), повышенное кровяное давление, повышенное содержание холестерина и триглицеридов и пониженное содержание липопротеинов высокой плотности. Ожирение связано со значительным риском развития диабета типа 2, коронарного сердечного заболевания, инсульта, повышенного давления, различных типов рака и многочисленных других болезней и увеличением смертности от всех этих болезней (Must et al., 1999, JAMA 282: 1523-1529, Calle et al.,1999, N. Engl. J. Med. 341: 1097-1105). Накопление метаболических факторов риска сердечно-сосудистых болезней и диабета типа 2 часто называют метаболическим синдромом, синдромом X или синдромом стойкости к инсулину. Основные компоненты метаболического синдрома X включают избыток абдоминального жира (известного также как висцеральное ожирение, ожирение по мужскому типу и ожирение типа "яблоко"), атерогенную дислипидемию (пониженное содержание холестерина липопротеина высокой плотности (HDL- С, повышенное содержания триглицеридов), повышенное давление, гипергликемию (сахарный диабет типа 2 или ухудшенную переносимость глюкозы, ухудшенную усвояемость глюкозы или стойкость к инсулину), провоспалительное состояние и протромботическое состояние(AHA/NHLBI/ADA Conference Proceedings, Circulation 2004; 109: 551-556). Другие аномалии, часто связанные с метаболическим синдромом, включают повышенные концентрации аполипопротеина В, низкие уровни адипонектина в плазме, низкое содержание частиц липопротеинов низкой плотности (LDL), гиперурикемию, неалкогольное жировое повреждение печени/стеноз печени, повышенное содержание трансаминаз, гамма-глутанил-трансферазы в печени и микроальбуминерию. Как и в случае ожирения,количество болезней, связанных с ожирением, также продолжает расти. Уменьшение веса является критическим для пациентов, страдающих ожирением, так как оно может улучшить сердечно-сосудистые и метаболические факторы с целью уменьшения заболеваемости и смертности, связанных с ожирением(Blackturn, 1999, Am. J. Clin. Nujtr. 69: 347-349, Galuska et al., 1999, JAMA 282: 1576). Было показано, что снижение веса на 5-10% может значительно улучшить метаболические параметры, такие как уровень глюкозы в крови, определнный натощак и после принятия пищи, HbA1c (гликозилированного гемоглобина), инсулина, общего холестерина в плазме, липопротеинов низкой плотности (LDL), триглицеридов,мочевой кислоты и кровяное давление, и снизить риск развития диабета, рака и сердечно-сосудистых заболеваний (Goldstein, 1992, J. Obesity, 6, 397-415). Таким образом, основной целью лечения ожирения и расстройств, связанных с ожирением, является снижение веса. Вначале способы лечения основывались на диете и изменении образа жизни с применением терапии фармакологическими агентами. Однако хотя физическая нагрузка и снижение количества потребляемых калорий могут уменьшить ожирение, такое лечение дат небольшие результаты из-за сидячего образа жизни и избыточного потребления пищи, особенно пищи с высоким содержанием жира. Кроме того, лечение при помощи доступных фармакологических агентов с целью облегчения потери веса не обеспечивает нужного результата у многих пациентов,страдающих от ожирения вследствие появления побочных эффектов, наличия противопоказаний и отсутствия положительной реакции. Следовательно, имеется стимул к развитию новых и альтернативных способов лечения ожирения. В настоящее время изучаются несколько потенциальных агентов от ожирения (см. обзор Bays, 2004,Obesity Research, 12, 1197-1211), таких как:i) агенты, действующие на центральную нервную систему, которые воздействуют на нейротранс-1 018900 миттеры или нейронные ионные каналы (например, антидепрессанты (бупропион, ингибиторы обратного захвата норадреналина (GW 320659), селективные агонисты рецептора 5 НТ 2 с, противосудорожные средства (топирамат, зонисамид), некоторые антагонисты допамина, антагонисты каннабиноидного рецептора СВ 1 (римонабант);ii) агенты путей метаболизма лептина/инсулина/центральной нервной системы (например, аналоги лептина, промоторы транспорта лептина и/или рецепторов лептина, CNTF (Axokine), антагонисты NPY,антагонисты AgRP, промоторы РОМС, промоторы CART, аналоги MSH, агонисты рецептора МС 4 агенты, которые влияют на метаболизм/активность инсулина [ингибиторы РТР-1 В, антагонисты рецептораiii) агенты путей метаболизма в желудочно-кишечном тракте/нейронов (например, агенты, которые повышают активность ССК и PYY, агенты, которые повышают активность GLP-1 (экстендин 4, мераглутид, ингибитор дипептидилпептидазы IV), агенты, которые снижают активность грелина, амилин (прамлинитид), агонисты нейропептида Y);iv) агенты, которые могут повышать скорость метаболизма покоя (агонисты бета-3, гомологи UCP,агонисты тироидного рецептора; иv) другие разнообразные агенты, такие как, например, антагонисты-гормоны концентрации меланина (МСН), аналоги фитостанола, функциональные масла, Р 57, ингибиторы амилазы, фрагменты гормонов роста, синтетические аналоги DHEAS (флуастерон), антагонисты активности адипоцитной 11-бетагидроксистероид-дегидрогеназы типа 1, агонисты CRH, ингибиторы карбоксипептидазы, ингибиторы синтеза жирных кислот (церуленин и С 75), инданоны/инданолы, аминостеролы (trodusquemine) и другие ингибиторы липазы в желудочно-кишечном тракте (ATL 962). Лекарства, которые являются эффективными для лечения ожирения, могут действовать по различным механизмам, таким как снижение потребления пищи (например, путм индуцирования сигналов насыщаемости), изменение метаболизма (например, путм модификации абсорбции питательных веществ, например, ингибирования поглощения жира), увеличение расхода энергии (например, увеличение термогенезиса), ингибирование липогенеза или стимулирование апоптоза адипоцитов. Однако для лечения ожирения доступны только немногие лекарства (см. обзор Gadde and Allison, Circulation, 114, 974984; Weigle, 2003, J. Clin. Endocrinol Metab., 88, 2462-2469; Schioth, 2008, CNS Neurol. Disorders Drug Targets, 5, 241-249). Сибутрамин является смешанным ингибитором пресинаптического обратного захвата серотонина и норэпинефрина центрального действия. Ормистат представляет собой ингибитор липаз в желудочно-кишечном тракте, который снижает абсорбцию жира в кишечнике. Римонабант (SR 141716,Acomplia) является модулятором каннабиноида СВ 1 центрального и периферического действия (антагонистом и обратным агонистом), который недавно был одобрен для лечения ожирения (см. обзор Pagotto et al., 2006, Endocrine Reviews, 27, 73-100; for reports on phase III clinical trials see Despress et al.,2005, N. Engl. J. Med. 353, 212; van Gaal et al., 2005, Lancet, 16, 1389; Pi-Sunyer et al., 2006, JAMA, 295,761). В настоящее время охарактеризованными являются два каннабиноидных рецептора: СВ 1, рецептор,обнаруженный в мозгу млекопитающих и в ряде других сайтов в периферических тканях; и СВ 2, периферический рецептор, в основном, обнаруженный в клетках, связанных с иммунной системой. Обзор,относящийся к модуляторам каннабиноидных рецепторов СВ 1 и СВ 2 см. в Pertwee, 2000, Exp. Opin. Invest. Drugs, 9, 1553-1571 and Muccioli, 2005, Cur. Med. Chem., 12, 1361-1394. Значительное количество данных свидетельствует о том, что антагонисты СВ 1 (например, римонабант) способны модулировать гомеостаз энергии и что антагонисты СВ 1 способны модулировать поглощение пищи, а также процессы периферического блокирования липогенеза (Pagotto et al., Endocrine Reviews, 2006, 27, 73-100; Tucci etDev., 7, 498-506). Периферическое действие антагонистов СВ 1 может быть опосредовано несколькими целевыми органами и механизмами, например, i) печень: блокирование de novo липогенеза, ii) мышцы: увеличение поглощения глюкозы, iii) адипозная ткань: стимулирование экспрессии и/или сереции адипонектина, ингибирование липогенных ферментов, стимулирование GLUT4, генерирование футильных циклов, iv) поджелудочная железа: регулирование инсулина и v) желудочно-кишечный тракт: стимулирование сигналов насыщения. Римонабант (Acomplia ) одобрен как дополнение к диете и физической нагрузке при лечении ожирения. В то время, как воздействие на вес и метаболические параметры (уровни триглицеридов в плазме, уровень холестерина ЛВП, уровень инсулина в плазме, уровень HbA1c [гликозилированного гемоглобина], стойкость к инсулину и содержание адипонектина) дат благоприятные результаты, имеются неблагоприятные побочные эффекты, возможно опосредованные центральной нервной системой (расстройства нервной системы и психиатрические расстройства), такие как беспокойство, депрессивные расстройства,нарушения сна,рвота и тошнотаhttp//www.emea.europa.eu/humandocs/PDFs/EPAR/acomplia/AcompliaEpaScientific-D-en.pdf). Следовательно, вс ещ имеется необходимость в создании альтернативных антагонистов рецептора СВ 1, ассоции-2 018900 руемых с различными фармакокинетическими, фармакологическими профилями и профилем побочных эффектов. Рецептор СВ 1 задействован во многих болезненных состояниях (см. Pacher et al., 2006, Pharmacol.Rev. 58, 389-462). Модуляторы активности рецептора СВ 1 могут быть полезными при лечении болезней и состояний, связанных с регулированием рецептора СВ 1, таких как ожирение и наличие избыточного веса, предотвращение увеличения веса (например, вызванного примом лекарств или прекращением курения) и при лечении болезней и состояний, непосредственно или косвенно связанных с состоянием ожирения (см. Bray, 2004, J. Clin. Endocrinol. Metab. 89, 2583-9; Manson et al., 1995, N. Engl. J. Med. 333,677-85; Grundy, 2004, J. Clin. Endocrinol. Metab. 89, 2595-600; Esposito et al., 2004, JAMA 291, 2978-84;Ejerblad et al., 2006, J. Am. Soc. Nephrol. 17, 695-702; Whitmer et al., 2005, BMJ 330 (7504), 1360), таких как метаболический синдром, называемый также синдромом X или синдромом стойкости к инсулину,диабет типа 2, сердечно-сосудистые заболевания (например, аневризмы, ангина, аритмия, атеросклероз,кардиомиопатия, церебрально-васкулярная патология (удар), церебро-васкулярные заболевания, врожднное заболевание сердца, острая сердечная недостаточность, миокардит, заболевание клапанов сердца,заболевание коронарных артерий, дилатационная кардиомиопатия, диастолическая дисфункция, эндокардит, высокое давление (гипертония), гипертрофическая кардиомиопатия и связанные с ней аритмия и головокружение, пролапс митрального клапана, инфаркт миокарда (сердечный приступ), венозная тромбоэмболия, варикоз вен и лгочная энболия, провоспалительное состояние, повышенная склонность к тромбозу (протромботическое состояние) и интракраниальная гипертония; метаболические дисфункции у людей с ожирением, избыточным весом или нормальным весом (например, дислипидимия, гиперлипидемия, низкий уровень HDL и/или высокий уровень LDL холестерина, гипертриглицеридемия, низкое содержание адипонектина, ухудшенная переносимость глюкозы, стойкость к инсулину, повышение уровня HbA1c (гликозилированного гемоглобина), сахарный диабет, диабет типа 2, сниженная метаболическая активность); метаболические заболевания или нарушения (состояния, при которых имеется отклонение от метаболического процесса или которые вызваны аномальным метаболическим процессом; или которые могут быть врожднными из-за унаследованной аномалии ферментной системы или могут быть приобретены вследствие болезни эндокринного органа или недостаточности метаболически значимого органа, такого как печень); раковые заболевания (например, колоректальный рак, рак груди, рак матки, рак прямой кишки), заболевания печени (например, неалкогольное ожирение печени, стеатогепатит, стеатоз, фиброз печени, цирроз печени и другие вторичные заболевания, связанные с ожирением и избыточным весом, такие как менструальные расстройства, гастроэзофагеальная рефлюксная болезнь,желчнокаменная болезнь (камни в печени), грыжа, недержание мочи, хроническая почечная недостаточность, гипогонадизм (у мужчин), рождение мртвого плода, растяжки, акантокератодермия, лимфедема,целлюлит, бородавки, интертриго, гиперурикемия, неподвижность, остеоартрит, боль в поясничнокрестцовой области, головная боль, синдром канала запястья, деменция, идиопатическая одышка, обструктивная остановка дыхания во время сна, синдром гиповентиляции, Пикквикский синдром, астма,депрессия, низкая самооценка, дисморфофобия, социальная стигматизация. Рецептор СВ 1 участвует во многих болезненных состояниях, которые необязательно связаны с ожирением и избыточным весом, такие как нарушения питания,аддиктивные расстройства (например, пристрастие к марихуане, психостимулянтам, никотину, алкоголю, кокаину и опиатам),ментальные расстройства (например, шизофрения, шизо-аффективное расстройство, биполярные расстройства, беспокойство, паническое расстройство), неврологические расстройства,сексуальные дисфункции (например, эректильная дисфункция), репродуктивные дисфункции (например, синдром поликистозных яичников, бесплодие),болезни печени (например, вирусный гепатит, дисфункция печени при других инфекционных заболеваниях, воспалительные заболевания печени (например, аутоиммунный гепатит), алкогольная болезнь печени, токсичная болезнь печени, опухоли печени (такие как карцинома печночных клеток, гепатоцеллюлярная карцинома, гепатома, холангиокарцинома, гепатобластома, ангиосаркома печени, саркома клеток Купффера, другие саркомы печени), стеатогепатит, неалкогольное ожирение печени, фиброз печени,цирроз печени, цирротическая портальная гипертония, метаболические болезни печени (такие как гемохроматоз, болезнь Вильсона, синдром Гилберта, синдром Криглера-Наджара, синдром ДубинаДжонсона, синдром Ротора,заболевания, связанные с фиброзом (такие как муковисцидоз поджелудочной железы и лгких, эндомия, кардиальный фиброз, идиопатическая миокардиопатия, идиопатический фиброз лгкого, диффузная паренхимальная болезнь лгкого, медиастинальный фиброз, миелофиброз, синдром боли после вазэктомии, ретроперитонеальный фиброз, прогрессивный массивный фиброз, пролиферативный фиброз,неопластический фиброз, серповидноклеточная анемия может вызвать увеличение и, в конце концов,фиброз селезнки), и другие клинические показания, такие как эпилепсия, остеопороз, ревматоидный артрит, воспалительные заболевания кишечника (язвенный колит (UC) и болезнь Крона (CD), застойное обструктивное заболевание лгких (COPD), воспаление, боль при воспалениях, атеросклероз, диарея,астма, застойные явления, кожные болезни, глаукома и выпадение волос. В связи с тем, что ожирение приводит к риску или значительно повышает риск возникновения заболеваний, вовлекающих различные системы в организме (см. Bays, 2004, Obesity Research, 12, 11971211), включая:i) сердечно-сосудистую систему (гипертония, застойная кардиомиопатия, варикоз, лгочная эмболия, коронарное заболевание сердца (CHD, неврологическую (удар, идиопатическая интракраниальная гипертония, мералгия),ii) респираторную систему (одышка, обструктивная остановка дыхания во время сна, синдром гиповентиляции, пикквикский синдром, астма),iii) мышечно-скелетную (неподвижность, дегенеративный остеоартрит, боль в поясничнокрестцовой области),iv) кожную (растяжки, венозный стаз (застой) нижних конечностей, лимфедема, целлюлит, интертриго, карбункулы, акантоз, мягкие бородавки),v) желудочно-кишечную (гастроэзофагеальная рефлюксная болезнь, неалкогольное ожирение печени, стеатогепатит, желчнокаменная болезнь, грыжа, рак прямой кишки),vi) мочеполовую (стрессовое недержание мочи, гломерулопатия, связанная с ожирением, рак груди и матки),vii) психологическую (депрессия и низкая самооценка, ухудшенное качество жизни) иviii) эндокринную (метаболический синдром, диабет типа 2, дислипидемия, гиперандрогенемия у женщин, синдром поликистозных яичников, дисменорея, бесплодие, осложнения при беременности, гипогонадизм у мужчин),было бы также полезно соединить модулятор СВ 1 с лекарствами, применяемыми для лечения болезней, которые могут быть не связаны с ожирением, таких как нарушение питания, аддиктивные расстройства, ментальные расстройства, неврологические расстройства, сексуальные дисфункции, репродуктивные дисфункции, заболевания печени, болезни, относящиеся к фиброзу, и другие клинические показания, которые могут не относиться к ожирению. Предшествующий уровень техники Данное изобретение делает доступным класс пиразольных соединений, которые модулируют активность каннабиноидного рецептора СВ 1. Указанные ниже публикации относятся к другим пиразольным соединениям, обладающим модулирующей активностью по отношению к СВ 1: Как описано в данной заявке, соединения по изобретению полезны при лечении ожирения и избыточного веса, для предотвращения увеличения веса и при лечении болезней и состояний, которые указаны выше и которые выигрывают при подавлении нормальной сигнализирующей активности рецепторов СВ 1. Как указывалось, такие болезни и состояния включают ожирение и наличие избыточного веса и болезни, которые прямо или косвенно связаны с ожирением и избыточным весом (например, метаболический синдром, диабет типа 2, сердечно-сосудистые заболевания, метаболические нарушения, раковые болезни, болезни печени и другие вторичные заболевания), а также некоторые болезни, которые могут быть не связаны с ожирением (например, нарушение питания, аддуктивные расстройства, умственные расстройства, неврологические расстройства, сексуальные дисфункции, репродуктивные дисфункции,болезни печени, болезни, относящиеся к фиброзу и другие клинические показания). Они являются полезными для управления весом и потребления энергии у млекопитающих и для модулирования параметров плазмы, задействованных в метаболическом синдроме, таких как низкий уровень HDL холестерина и/или высокий уровень LDL холестерина и/или частиц LDL с небольшой плотностью, высокий уровень триглицеридов, низкий уровень адипонектина и высокий уровень HbA1c (гликозилированного гемоглобина) и для модулирования других характеристик метаболического синдрома, таких как ухудшенная переносимость глюкозы, стойкость к инсулину, избыток жировой ткани в брюшной полости или вокруг не, неалкогольное ожирение печени, стеатогепатит, стеатоз, фиброз печени, цирроз печени, опухоли в печени, метаболические заболевания печени и высокое кровяное давление. Соединения по изобретению обладают отличающимися физико-химическими свойствами и полезны для модулирования периферических рецепторов СВ 1 и различных центральных рецепторов СВ 1. Эти соединения по изобретению связаны со сниженным центральным действием на рецепторы СВ 1 и могут иметь уменьшенную склонность к индуцированию побочных эффектов в отношении психиатрии и нервной системы. Сущность изобретения В соответствии с данным изобретением предложено соединение формулы (I) или его соль, гидрат,сольват или N-окись:X означает связь или -СН 2-;Z обозначает радикал, выбранный из группы, состоящей из следующих радикалов формул (1)-(26): где R обозначает (C1-С 6)алкил, фенил или бензил, возможно замещнный R5 в кольце; или моноциклическое неароматическое карбоциклическое кольцо, содержащее 3-6 атомов в кольце;R4 обозначает радикал формулы -(Alk1)p-(Q1)r-(L)s-Q2, где р, r равны 1 иAlk1 обозначает двухвалентный (C1-C4)алкилен, который является замещнным R10 и/или R11 у одного атома углерода;L обозначает двухвалентный радикал формулы -(Alk2)n-(W)m- в любой ориентации, где(C1-С 3) фторалкилом или F; б) только в случае, когда s в -(L)s-Q2 равен 0, обозначает водород; или R3 и R4, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое аминное кольцо, содержащее в кольце 6 атомов; которое может быть замещено радикалом формулыR5, R6 R7 и R8 каждый независимо выбраны из водорода, -F, -Cl; и R10 и R11 обозначают водород или(С 1-С 3) алкил при условии, что по меньшей мере один из R10 и R11 обозначает (C1-С 3) алкил; или R10 и Другой аспект данного изобретения относится к фармацевтической композиции, содержащей соединение формулы (I) или его соль, гидрат, сольват или N-окись, вместе с одним или более фармацевтически приемлемыми носителями или эксципиентами. Соединения, которых касается изобретение, подавляют обычную сигнализирующую активность каннабиноидного рецептора СВ 1. Следовательно, дальнейшие аспекты настоящего изобретения включают:i) Применение соединения формулы (I) или его соли, гидрата, сольвата или N-окиси для приготовления композиции для лечения болезней или состояний, которые опосредованы сигнализирующей активностью рецептора СВ 1 (примеры таких болезней перечислены выше); иii) Способ лечения болезней или состояний, которые опосредованы сигнализирующей активностью рецептора СВ 1, который включает введение субъекту, страдающему от такой болезни или состояния,эффективного количества соединения формулы (I) или его соли, гидрата, сольвата или N-окиси. Опятьтаки примеры таких болезней указаны выше. Терминология Используемый в данной заявке термин алкил относится к линейному или разветвлнному алкильному радикалу, содержащему от 1 до 6 атомов углерода. Таким образом, этот термин охватывает, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.бутил, трет.бутил, н-пентил и н-гексил. Применяемый термин "двухвалентный (С 1-С 4) алкиленовый радикал", относится к насыщенному линейному или разветвлнному углеводородному радикалу, содержащему от 1 до 4 атомов углерода и две ненасыщенные валентности. Используемый термин "карбоциклический", если не указано иначе, относится к моно-, би- или трициклическому радикалу, содержащему в кольце до 16 атомов, все из которых являются атомами углерода, и включает арил и циклоалкил. Термин "циклоалкил", если не указано иначе, относится к моноциклическому насыщенному карбоциклическому радикалу, содержащему 3-8 атомов углерода, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Если иное не указано в контексте заявки, термин "замещнный", применяемый в отношении любого фрагмента в данной заявке, означает радикал, замещнный совместимыми заместителями в количестве до четырх, каждый из которых независимо может обозначать, например, (C1-С 6)алкил, (C1-С 6)алкокси,гпдрокси, гидрокси (C1-C6)алкил, меркапто, меркапто (C1-C6)алкил, (C1-C6)алкилтио, галоид (включая фтор, бром и хлор), полностью или частично фторированный (C1-С 3)алкил, (С 1-С 3)алкокси или (C1 С 3)алкилтио, такие как трифторметил, трифторметокси и трифторметилтио, нитро, нитрил (-CN), оксо,фенил, фенокси, моноциклический гетероарил или гетероарилокси, содержащий в кольце 5 или 6 атомов,тетразолил, -COORA, -CORA, -OCORA, -SO2RA, -CONRARB, -SO2NRARB, -NRARB, -OCONRARB, NRBCORA,-NRBCOORA, -NRBSO2CORA, или -NRACONRARB, где RA и RB независимо обозначают водород или (C1C6) алкил, или в случае, когда RA и RB связаны с одним и тем же атомом N, RA и RB вместе с этил атомом азота могут образовывать циклическое аминокольцо, такое как морфолин, пиперидинил или пиперазинил. Когда заместитель является фенилом, фенокси или моноциклическим гетероарилом или гетероарилокси с 5 или 6 атомами в кольце, тогда фенил или гетероарильное кольцо сами могут быть замещены любым из указанных выше заместителей, кроме фенила, фенокси, гетероарила или гетероарилокси."Возможным заместителем" может быть любой из указанных выше радикалов. Применяемый в данной заявке термин "соль" включает моли присоединения к основанию, кислоте и четвертичные соли. Соединения по изобретению, которые являются кислыми, могут образовать соли,включая фармацевтически приемлемые соли, с основаниями, такими как гидроокиси щелочных металлов, например гидроокиси натрия и калия, гидроокиси щелочно-земельных металлов, такие как гидроокиси кальция, бария и магния, с органическими основаниями, например N-метил-D-глюкамином, холином, трис(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидинои, дибензиламином и т.п. Те соединения формулы (I), которые являются основными, могут образовывать соли, включая фармацевтически приемлемые соли, с неорганическими кислотами, например, с галоидводородными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота или фосфорная кислота и т.п., и с органическими кислотами, например с уксусной, винной, янтарной,фумаровой, малеиновой, яблочной, салициловой, лимонной, метан- сульфокислотой, птолуолсульфокислотой, с бензойной, с бензолсульфокислотой, глутаминовой, молочной и миндальной кислотами и т.п. Обзор подходящих солей можно найти в Handbook of Pharmaceutical Salts: Properties,Selection, and Use by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Используемый в данной заявке термин "сольват" описывает молекулярный комплекс, включающий соединение по изобретению и стехиометрическое количество одной или более молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" применяют, когда указанным растворителем является вода. Соединения, которых касается данное изобретение, могут находиться в одной или нескольких стереоизомерных формах, так как в них содержатся асимметричные атомы или имеются ротационные ограничения, соединения эти могут существовать в виде ряда стереоизомеров с R- или S-стереохимией у ка-6 018900 ждого хирального центра или в виде атропизомеров R- или S-стереохимией у каждой хиральной оси. Данное изобретение включает все такие энантиомеры и диастереомеры и их смеси. Соединения по изобретению включают соединения формулы (I), описанные выше, включая все полиморфы и их кристаллические аналоги, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры), описанные в данной заявке, а также соединения формулы (I), меченые изотопами. Некоторые производные соединений формулы (I), обладающие небольшой фармакологической активностью или не обладающие ею вовсе, могут при введении в организм или на поверхность тела превращаться в соединения формулы (I), обладающие желаемой активностью, например, при гидролитическом расщеплении. Такие производные называют "пролекарствами". Дальнейшую информацию о применении пролекарств можно найти в публикациях Pro-drugs as Novel Delivery Systems, Vol. 14, ACSof prodrugs, In Textbook of Drug Design and Discovery, 3rd Edition, 2002, Taylor and Francis). Пролекарства могут, например, быть получены путм замещения соответствующих функциональных групп, содержащихся в соединениях формулы (I), некоторыми фрагментами, известными специалистам в данной области как "про-фрагменты", такие как описанные, например, в Design of Prodrugs by H.Bundgaard (Elsevier, 1985). Примерами могут служить пролекарство карбоксильной группы (такое как-COOCH2O-CO-tBu, применяемое в пролекарстве ампициллина-пивампициллине), амид (-CONHCH2NAlK2) или амидин (-С(=N-O-CH3)-NH2). Метаболиты соединений формулы (I), то есть соединения, образовавшиеся in vivo при введении лекарства, например, включают случаи:(i) когда соединение формулы (I) содержит метильную группу, е гидроксипроизводное (-СН 3(ii) когда соединение формулы (I) содержит алкоксильную группу, е гидроксипроизводное (-OR(iii) когда соединение формулы (I) содержит третичную аминогруппу, е производное с вторичной аминогруппой (-NR1R2-NHR1 или -NHR2);(iv) когда соединение формулы (I) содержит вторичную аминогруппу, е производное с первичной группой (-NHR1-NH2);(v) когда соединение формулы (I) содержит фенильную группу, фенольную группу (-Ph-PhOH);(vi) когда соединение формулы (I) содержит амидную группу, е производное с карбоксильной группой (-CONH2-COOH). Согласно данному изобретению в соединениях формулы (I) содержатся следующие структурные параметры в любой совместимой комбинации. Переменная ZZ представляет собой радикал, выбранный из группы радикалов формул (1)-(26), описанных выше.R обозначает (C1-С 6)алкил, такой как метил или этил; фенил или бензил, возможно замещнный R5 в кольце, где R5 независимо выбран из водорода, -F, -Cl; или моноциклическое неароматическое карбоциклическое кольцо, содержащее 3-6 атомов в кольце. Радикалы формул (1)-(26), образуют группу, в которой все они могут рассматриваться как биоизостеры карбоксильной группы или тетразолильной группы(которая сама рассматривается как биоизостер карбоксильной группы). Такие биоизостеры описаны в литературе, см., например, Olessen, P.H. Current Opinion in Drug Discovery and Development (2001), 4, 471; Очевидно, что некоторые из радикалов формул (1)-(26), указанных выше, могут существовать в таутомерном равновесии и что все такие таутомеры должны рассматриваться как включенные в состав этих радикалов формул (1)-(26). Например, радикалы (13) и (9) могут иметь следующие таутомерные формы:R3 обозначает водород, (C1-С 3)алкил, такой как метил или этил. является водородом. Заместитель R4R4 имеет формулу -(Alk1)p-(Q1)r-(L)s-Q2, где р, r равны 1 и s равен 0 или 1 в любой совместимой комбинации. В R4 Alk1, если он имеется, представляет собой двухвалентный (С 1-С 4)-алкиленовый радикал, который (а) может быть замещн R10 и/или R11 у одного атома углерода. В этом контексте R10 и R11 могут быть, например, метилом; или R10 и R11, взятые вместе с атомом углерода, к которому они присоединены,могут образовывать, например, циклопропил или циклопентил. В R4 L, если он содержится, представляет собой двухвалентный радикал формулы -(Alk2)n-(W)m- в любой ориентации, где n равен 0 и m равен 1; W обозначает-О-. В R4 Q1 обозначает моноциклический карбоциклическое кольцо, выбранное из фенила, и Q2 (а) в случае, когда s в -(L)s-Q2 равен 1, обозначает фенильное кольцо, необязательно замещенное (С 1 С 3)фторалкилом или F; (б) только в случае, когда s в -(L)s-Q2 равен 0, обозначает водород. Группы R3 и R4 вместе В других типах соединений по изобретению R3 и R4, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое аминное кольцо, содержащее в кольце 6 атомов; которое может быть замещено радикалом формулы -(L)s-Q2, где s и L определены выше и Q2 обозначает фенильное кольцо, необязательно замещенное (С 1-С 3) фторалкилом или -F. Заместители R5, R6, R7 и R8R5, R6, R7 и R8 каждый независимо выбран из водорода, -F, и -Cl. Заместители R10 и R11R10 и R11 обозначают водород или (C1-С 3) алкил при условии, что по меньшей мере один из R10 и R11 обозначает (C1-С 3)алкил; или R10 и R11, взятые вместе с атомом углерода, к которому они присоединены,образуют (С 3-С 5)циклоалкильное кольцо. В одном из вариантов изобретения радикал -С(=О) NR3R4 в формуле (I) выбран из группы, состоящей из радикалов (С), (О) и (XI)R19 выбран из водорода, -F, -CF3 Конкретные соединения по изобретению включают соединения, описанные в примерах, приведнных в данной заявке. Очевидно, что некоторые из радикалов формул (1)-(26), указанных выше, могут существовать в таутомерном равновесии и что все такие таутомеры должны рассматриваться как включенные в состав этих радикалов формул (1)-(26). Например, радикалы (13) и (9) могут иметь следующие таутомерные формы:R3 обозначает водород, (C1-С 3)алкил, такой как метил или этил, или (C1-С 3) фторалкил, такой как ди- или трифторметил. R3 часто является водородом. Заместитель R4 Как это видно из определения этого радикала выше, в соединениях по изобретению может быть большое число заместителей.R4 имеет формулу -(Alk1)p-(Q1)r-(L)s-Q2, где р, r и s равны 0 или 1 в любой совместимой комбинации,при условии, что по меньшей мере один из р, r и s равен 1. В одном конкретном типе соединений по изобретению р и s равны 0 и r равен 1, а в другом - p и r равны 1 и s равен 0 или 1. В R4 Alk1, если он имеется, представляет собой двухвалентный (С 1-С 4)-алкиленовый радикал, который (а) может быть замещн R10 и/или R11 у одного атома углерода или одним или двумя возможными заместителями и/или (б) возможно содержит -О-, -S-, -CO-, -SO- или -NR9-. В этом контексте R10 и R11 могут быть, например, метилом; или R10 и R11, взятые вместе с атомом углерода, к которому они присоединены, могут образовывать, например, циклопропил или циклопентил. Возможные заместители в этом контексте включают фтор и гидроксил. Примеры таких радикалов включают -СН 2-, -СН 2 СН 2-, -CH2CH2CH2-, - СН 2 СН 2 СН 2 СН 2-, -СН 2 Т-,-СН 2 ТСН 2-, -СН 2 СН 2 ТСН 2-, -СН 2 СН 2 ТСН(СН 3)-, -СН 2 ТСН 2 СН 2- и -CH2TCH2CH2WCH2-, где Т обозначает-О- -S-, -NH- или -N(СН 3)- и любой из указанных радикалов, в которых один или несколько атомов водорода заменены атомами фтора и/или в которых один или два атома углерода замещены метилом или трифторметилом, или в которых один атом углерода замещн спиро-связанным циклопропильным заместителем. В соединениях по изобретению Alk1, если он содержится, часто обозначает просто -СН 2-. В R4 L, если он содержится, представляет собой двухвалентный радикал формулы -(Alk2)n-(W)m- в любой ориентации, где n и m независимо равны 0 или 1; Alk2 обозначает -C(R10)(R11)- и W обозначает-СО-, -SO2-, -О-, -NR9- или -SO-, при условии, что когда W и/или Alk2 соединены с гетероатомом, W не является -О-, -NR9- или -SO-. Последнее ограничение служит для того, чтобы избежать получения нестабильных или нежелательных возможных структур. В этом контексте R9 может обозначать, например,водород или метил. Примеры Alk2, если он содержится, включают -СН 2-, -СН(СН 3)-, циклопропильное кольцо, которое связано с каждым соседним атомом при помощи того же самого атома углерода в кольце, и в любой ориентации -СН 2 О-, -CH2NH-, -CH(CH3)O- и -CH(CH3)NH-. В R4 Q1, если он содержится, и Q2, каждый независимо, обозначает моноциклический карбоциклический радикал с 3-7 атомами в кольце; бициклическую карбоциклическую кольцевую систему, содержащую 7-10 атомов в кольце, моноциклическое гетероциклическое кольцо, содержащее 4-7 атомов в кольце, или бициклическую карбоциклическую кольцевую систему с 8 - 10 атомами в кольце, причм любое из колец или любая кольцевая система могут быть замещены; Q2 может также обозначать водород, когда s в -(L)s-Q2 равен 0. Примеры Q1, когда он содержится, включают возможно замещнные двухвалентный фенил, пиридин, пиперидин, пиперазин или (C3-С 7) циклоалкил, например циклогексил, циклопентил или циклопропил. Примеры Q2 включают водород или возможно замещнный фенил или пиридил. Возможные заместители в кольцах Q1 и Q2 включают -F, -Cl, -Br, -CN, -CF3, -СН 3, циклопропил или -ОСН 3 и могут, например, содержаться у 1 или 2 атомов в кольце. Группы R3 и R4 вместе В других типах соединений по изобретению R3 и R4, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое аминное кольцо, в котором содержатся 4-7 атомов. Примеры таких колец включают морфолинил, пирролидинил, пиперидинил, азепанил и пиперазинил. Кольцо, образованное R3 и R4, взятыми вместе с атомом азота, к которому они присоединены, может быть замещено радикалом формулы -(L)s-Q2, где s, L и Q2 определены выше, или возможным заместителем, выбранным из гидрокси, метокси, -NH2- или моно- или ди-(С 1-С 3) алкиламино, таким как метиламино, этиламино,диметиламино и диэтиламино. Конкретные примеры радикала -C(=O)NR3R4 включают радикалы формул (А)-(R) и (Х 1)-(Х 12):R15 и R16 независимо выбраны из водорода и (C1-С 6) алкила или R15 и R16, взятые вместе с атомом азота, к которому они присоединены, образуют циклическое аминное кольцо с 4-7 атомами.R20 выбран из водорода, -F, -CF3, -OCF3, -Br, -Cl, -ОСН 3, -СН 3, -CN и -ОН; Следует отметить, что в приведнных выше формулах (A)-(R) и (Х 1)-(X12) любые заместители в гетероароматическом кольце должны, конечно, соответствовать известным принципам медицинской хи- 10018900 мии. Например, маловероятно, что любой замещающий галоид или CN в азотсодержащем гетероароматическом кольце будет примыкать к атому азота, так как ожидается, что такой заместитель будет вести себя как вытесняемая группа, и in vivo такие соединения будут стремиться к реакции с нуклеофильными соединениями, что приводит к образованию ковалентной связи, что является, в общем, не желательным по причине возможной токсичности. Также, например, вероятно, что любой заместитель ОН будет примыкать к атому азота, так как опять-таки такие соединения могут привести к потенциальной токсичностиR5, R6, R7 и R8 каждый независимо выбран из водорода, -F, -Br, -Cl, -CN, (C1-С 3)алкила, такого как метил или этил, (C1-С 3)фторалкила, такого как ди- или трифторметил, и OR9, где R9 обозначает водород,(C1-С 3)алкил, такой как метил или этил, (C1-С 3)фторалкил, такой как ди- или трифторметил и циклопропил. Во многих случаях R5, R6, R7 и R8 независимо выбраны из водорода и -Cl. Заместители R10 И R11R10 обозначает водород, (C1-С 3)алкил, гидроксил или -NH2, и R11 обозначает водород или (C1 С 3)алкил. Во многих случаях и R10, и R11 обозначают водород или один из R10 и R11 обозначает водород, а другой - метил. Конкретные соединения по изобретению включают соединения, описанные в примерах, приведнных в данной заявке. Соединения согласно настоящему изобретению действуют на центральный и периферический каннабиноидный рецептор СВ 1. Некоторые соединения в меньшей степени распределяются в центральной нервной системе, то есть соединение не так легко пересекает гематоэнцефалический барьер и будет ассоциироваться с меньшими побочными эффектами, касающимися центральной нервной системы. Соединения по изобретению модулируют каннабиноидный рецептор СВ 1 путм подавления его природной сигнализирующей функции. Следовательно, эти соединения представляют собой антагонисты, обратные агонисты или частичные агонисты рецептора СВ 1. Термин "антагонист СВ 1" или "антагонист каннабиноидного рецептора СВ 1" относится к соединению, которое связывается с рецептором или с сайтом вблизи и у которого отсутствует выраженная способность к активации самого рецептора. Антагонист СВ 1 может поэтому предотвращать или уменьшать функциональную активацию или замещение рецептора агонистом СВ 1, таким как, например, эндогенный агонист Nарахидонилэтаноламин (анандамид). Этот термин хорошо известен в уровне техники. Термин "обратный агонист СВ 1" или "обратный агонист каннабиноидного рецептора СВ 1" относится к соединению, которое связывается с рецептором и проявляет противоположный фармакологический эффект как агонист рецептора СВ 1. Обратные агонисты являются эффективными по отношению к некоторым типам рецепторов, которые имеют характеристическую активность без действия на них лиганда (называемую также "конститутивной активностью"). Этот термин хорошо известен специалистам в данной области. Из уровня техники также хорошо известно, что такой обратный агонист СВ 1 можно также называть антагонистом СВ 1, так как общие свойства обоих типов являются эквивалентными. Соответственно, в контексте данного изобретения термин "антагонист СВ 1" следует в общем понимать как термин, включающий как "антагонист СВ 1", определнный выше, так и "обратный агонист СВ 1". Термин "частичный агонист СВ 1" или "частичный агонист каннабиноидного рецептора СВ 1" относится к соединению, которое действует на тот же рецептор, что и полный агонист, но которое приводит к слабому максимальному фармакологическому ответу и имеет низкий уровень характеристической активности. Этот термин хорошо известен из уровня техники. Согласно предпочтительному варианту данного изобретения "модулятор рецептора СВ 1" или "модулятор каннабиноидного рецептора СВ 1" представляет собой антагонист СВ 1 или обратный агонист СВ 1. Соединения согласно данному изобретению полезны при лечении болезней и состояний, которые опосредованы сигнализирующей активностью рецептора СВ 1. Примеры таких болезней и состояний и методы их лечения были перечислены выше. Без ограничения они включают ожирение и избыточный вес, предотвращение увеличения веса, лечение болезней и состояний, прямо или косвенно связанных с ожирением (например, метаболического синдрома, диабета типа 2, сердечно-сосудистых болезней, метаболических дисфункций у людей с ожирением, избыточным весом или нормальным весом, метаболических болезней или нарушений, рака, болезней печени и других вторичных болезней, указанных выше) и лечение болезней и состояний, не обязательно связанных с ожирением (например, нарушение питания,аддиктивные расстройства, неврологические расстройства, сексуальные дисфункции, репродуктивные дисфункции, заболевания печени, болезни, относящиеся к фиброзу и другие клинические показания, указанные выше). Эти соединения пригодны для модулирования веса и потребления энергии у млекопитающих, например избытка жира в брюшной области, атерогенной дислипидемии (аномальных уровней Соединения по изобретению обладают различающимися физико-химическими свойствами и пригодны для модулирования периферических рецепторов СВ 1 и различных центральных рецепторов СВ 1. Соединения по изобретению, ассоциируемые со сниженным центральным действием на рецепторы СВ 1,могут иметь уменьшенную склонность к индуцированию побочных эффектов в отношении психиатрической и нервной систем. Соединения по изобретению могут быть соединены с другим терапевтическим агентом, применяемым для лечения ожирения и действующим по другому механизму, такому как центральное действие на сигналы насыщения или голода, механизмы сильного желания, регулирование аппетита, метаболические пути лептина/инсулина/центральной нервной системы, метаболические пути желудочно-кишечного тракта - нейронов, скорость метаболизма, расход энергии, усвоение пищи, хранение жира, экскрецию жира, подвижность желудочно-кишечного тракта, липогенез, транспорт глюкозы, глюкогенолиз, гликолиз, липолиз и т.д., включая модуляторы (ингибиторы, агонисты, антагонисты, аналоги) рецепторов или транспортров моноаминергического вещества (NA (норадреналина), 5-НТ (серотонина), DA (допамина),нейронных ионных каналов, лептина или рецептора лептина, рецепторов нейропептида Y, РР (полипептида поджелудочной железы), PYY, протеина YY3-36, грелина или рецептора грелина, мотилина или рецептора мотилина, орексинов или рецепторов орексина, бомбесина или рецепторов бомбесинподобных пептидов, соматостатина или рецепторов соматостатина, MCHR 1 (рецептора 1 меланинконцентрирующего гормона), CNTF (цилиарного нейтрофического фактора), AgRP (агутисвязанный пептид), РОМС (пропиомеланокартин), CART (коксин- и аморфетамин-регулируемый транскрипт), альфа-MSH (альфа-меланоцит-стимулирующий гормон), рецептора МС 4 (меланокортин-4) или МС 3 (меланокортина-3), рецепторов галанина, рецептора релаксина-3, рецептора GPR7, рецептора GPR119, рецептора GPR 10, рецепторов нейромедина U, рецепторов свободных жирных кислот, гормона роста, несфатина-1, опиоидных рецепторов, рецепторов нейропептида FF, PTP-1B (протеин-тирозин-фосфатаза),PPAR (пероксисон-пролифератор-активируемые рецепторы), гетеродимеры рецептора ретиноида X, адипонектина, известного также как Acrp30 (адипоцит-комплемент-связанный белок 30 kDa), метаболизма жирных кислот, рецепторов Н (гистамина), ССК-А (холецистокинин-А) или рецептора ССК-А, GLP-1(глюкогон-подобный пептид-1) или рецептора GLP-1, оксинтомодулина, адреномедуллина, DPP-IV (дипептидилпептидаза IV), амилина, рецептора бета-3-адренергического, UCP (разъединяющего белка), тироидного рецептора, рецептора тироид-стимулирующего гормона, 11-бета-гидроксистероиддегидрогеназы типа 1, амилазы, DHEAS (дегидроепиандростеронсульфата), CRH (кортикотропинвысвобождающий гормон) или рецепторов CRH, карбоксипептидазы, синтеза жирных кислот, HMGCoA-редуктазы, транспорта желчных кислот, липазы в желудочно-кишечном тракте, Р 57, АМРактивированной протеинкиназы (АМРК). Соединения по изобретению можно соединять с другим терапевтическим агентом, применяемым для лечения метаболического синдрома или болезней, которые могут быть прямо или косвенно связаны с ожирением, таких как сердечно-сосудистые болезни (гипертония, кардиомиопатия, варикоз, лгочная эмболия, венозная тромбоэмболия, коронарная болезнь сердца, ангина, аритмии, атеросклероз, сердечнососудистые заболевания, врожднный порок сердца, застойная сердечная недостаточность, миокардит,болезнь сердечных клапанов, болезнь коронарных артерий, диастолическая дисфункция, эндокардит,пролапс митрального клапана, инфаркт миокарда, тромбоз), болезни печени (неалкогольное ожирение печени, стеатогепатит, стеатоз, фиброз печени, цирроз печени), нейрологические болезни (удар, идиопатическая внутричерепная гипертония, боль в области бедра, головная боль, синдром канала запястья,деменция), респираторные заболевания (одышка, обструктивная остановка дыхания во время сна, синдром гиповентиляции, пикквикский синдром, астма), болезни скелетно-мышечной системы (неподвижность, дегенеративный остеоартрит, боль в пояснично-крестцовой области, остеопороз), кожные болезни(полосы растяжения кожи или "растяжки", венозный стаз нижних конечностей, лимфедема, целлюлит,интертриго, карбункулы, акантокератодермия, мягкие бородавки), заболевания желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь, неалкогольное ожирение печени/стеатогепатит, желчнокаменная болезнь, грыжа, рак прямой кишки, колоректальный рак), болезни мочеполовой системы(стрессовое недержание мочи, гломерулопатия, связанная с ожирением, хроническая почечная недостаточность, рождение мртвого плода, рак груди и рак матки), психологические болезни (депрессия и низкая самооценка, ухудшенное качество жизни, социальная стигматизация, телесное дисморфическое расстройство) и болезни эндокринной системы (метаболический синдром, диабет типа 2, сахарный диабет,дислипидемия, гиперлипидемия, низкий уровень холестерина HDL и/или высокий уровень холестеринаLDL, гиперглицеридемия, низкий уровень адипонектина, ухудшенная переносимость глюкозы, стойкость к инсулину, повышение уровня HbA1c, пониженная метаболическая активность, гиперандрогенемия у женщин, синдром поликистозного яичника, дисменорея, бесплодие, осложнения во время беременности,гипогонадизм у мужчин, гиперурикемия, менструальные расстройства, камни в желчном пузыре, гипогонадизм, лимфедема). Применение соединений по изобретению можно сочетать с соответствующим уменьшением количества потребляемых калорий и с физической нагрузкой. Следует иметь в виду, что конкретная величина доз для конкретного пациента будет зависеть от це- 12018900 лого ряда факторов, включая активность конкретного применяемого соединения, возраст, вес, общее состояние здоровья, пол, диета, время введения, метод введения, скорость экскрекции, комбинация лекарств и степень серьзности конкретного заболевания, подвергающегося лечению. Оптимальные величины доз и частота дозирования определяются при клиническом испытании, как это требуется в фармацевтической практике. Однако при введении людям общая дневная доза соединений по изобретению обычно находится в интервале от 1 до 1000 мг, конечно, в зависимости от метода введения. Например, в случае орального введения может потребоваться общая дневная доза от 10 до 1000 мг, а в случае внутривенного введения может потребоваться только от 1 до 500 мг. Дневная доза может вводиться в виде единичной дозы или нескольких доз или по предписанию врача может находиться вне указанных выше обычных пределов. Эти дозы рассчитаны для среднего пациента - человека с весом от примерно 60 до 100 кг. Врач легко может определить дозы для субъектов, вес которых находится вне указанных пределов, например, для детей и пожилых людей и, особенно, для пациентов, страдающих от ожирения. Соединения, которых касается изобретение, могут быть приготовлены для введения любым путм,соответствующим их фармакокинетическим свойствам. Вводимые орально композиции могут быть в виде таблеток, капсул, порошков, гранул, леденцов, жидких или гелевых препаратов, таких как оральные, топические или стерильные парентеральные растворы или суспензии. Таблетки или капсулы, предназначенные для орального введения, могут быть в виде стандартных унифицированных дозированных форм и могут содержать обычные эксципиенты, такие как связующие, например сироп, смола акации,желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; смазочный агент, например стеарат магния, тальк,полиэтиленгликоль или окись кремния; дезинтегранты, например, картофельный крахмал, или приемлемые смачивающие агенты, такие как лаурилсульфат натрия. Таблетки могут иметь покрытие, полученные способами, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть в виде сухого продукта, который восстанавливают при помощи воды или других подходящих носителей перед применением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сироп, сорбит, метилцеллюлоза, сироп глюкозы,желатин, гидрированные пищевые жиры, эмульгирующие агенты, например лецитин, моноолеат сорбитана, смола акации; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, эфиры масел, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота,и, если желательно, обычные ароматизаторы или красители. Активный агент может быть также введн парентерально в стерильной среде. В зависимости от используемых носителя и концентрации лекарство может быть или суспендированным, или растворнным в носителе. В носителе могут быть также растворены адъюванты, такие как местный анестетик, консервант и буферные агенты. Синтез Существует много подходов к синтезу соединений формулы (I), которых касается данное изобретение, но все они основываются на известных химических принципах, известных химику-органику. Так,соединения формулы (I) могут быть синтезированы в соответствии с методами, описанными в обычной литературе и известными специалисту в данной области. Типичными литературными источниками являются "Advanced organic chemistry", 4th Edition (Wiley), J. March, "Comprehensive Organic Transformation", 2nd Edition (Wiley), R. C. Larock, "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A. R.(Wiley), статьи, например, в "Synthesis ", "Acc. Chem. Res. ", "Chem. Rev. " или первичные литературные источники, выявляемые в процессе стандартных поисков online или из вторичных источников, таких как"Chemical Abstracts" или"Beilstein". Общие методы синтеза Методы, описанные ниже, не являются исчерпывающими. Условия эксперимента, описанные ниже, являются общими и могут быть найдены в обычной литературе, такой как источники, указанные выше. Конкретные ссылки указаны для информации, и описанные условия можно применять для данного субстрата без модификации/оптимизации или при наличии модификации/оптимизации. Соединения формулы (I) могут быть получены путм введения группы -N(R3)R4 в соответствующую карбоновую кислоту или в защищенную форму карбоновой кислоты, как показано на следующей схеме. Схема А Так, группа HN(R3)R4 содержит нуклеофильный азотсодержащий центр, а остальная часть может включать конечный заместитель, защищенную версию заместителя или группу, которая может быть превращена в конечный заместитель с применением стандартных методов, известных специалисту в данной области. Таким образом, соединения формулы (I) могут быть получены или непосредственно по схеме А,или после стандартных превращений, таких как удаление защитных групп. Карбоновые кислоты могут быть в активированных формах (например, хлорангидридов кислот или активных эфиров), или альтернативно конверсию можно осуществить прямо из кислоты с применением подходящих агентов сочетания, таких как дициклогексилкарбодиимид (DCC), и промоторов, таких как 1 гидроксибензотриазол (НОВТ). Соединения формулы (I) могут быть также получены по следующему способу, родственному описанному выше, когда производные карбоновой кислоты (например, нитрил, сложный эфир или амид) или другой подходящий предшественник превращается в группу Z (по одностадийному или много- стадийному способу ) после образования амида. Например, такой способ показан на следующей схеме: Схема В Такой способ может включать, например, конверсию нитрильной группы в: а) [1,2,4]триазол-3-ол (Y = NH) или [1,2,4]оксадиазол-5-ол (Y = О) с получением соединений общей формулы (Ia): Так, нитрильная группа сначала может быть превращена в тиоамид путм обработки сероводородом и основанием, таким как триэтиламин, в пиридине. По реакции или с гидразином, или с гидроксиламином тиамид может быть превращн в соответствующие промежуточные амидразон или амидоксим. Циклизация амидразона или амидоксима с соответствующим образованием [1,2,4]триазол-3-олов или[1,2,4]оксадиазол-5-олов формулы (Ia) может быть достигнута путм обработки соответствующим агентом (например, фосгеном, тиофосгеном, карбонилдиимидазолом, этилхлорформиатом, в среде апротонного полярного растворителя, такого как THF) в присутствии основания или без него при комнатной температуре или при нагревании. См. описание примеров и BioorganicMedicinal Chemistry, 14 (21),7324-7332, 2006; European Journal of Medicinal Chemistry, 28 (6), 513-16,1993. б) гидантоин с получением соединений общей формулы (Ib): Так, нитрильная группа может быть вначале восстановлена в альдегидную группу путм обработки сначала восстанавливающим агентом, таким как диизобутилалюминийгидрид, и затем реагентами, образующими кольцо, такими как цианид калия и карбонат аммония (например, по реакции Бюхерера - Бергса), с получением гидантоинов общей формулы (Ib). Или же нитрильная группа может быть превращена в гидантоины общей формулы (Ib) по одностадийному способу путм обработки металлорганическими реагентами (такими как RLi или RMgX) и затем цианидом калия и карбонатом аммония (см. BioorganicMedicinal Chemistry Letters, (2005), 15 (22),5039-5044; Synlett, (14), 2203-2206, 2006). с) тиазолидин-2,4-дион с образованием соединений общей формулы (Ic): Нитрильная группа может быть вначале восстановлена до альдегидной группы путм обработки восстанавливающим агентом, таким как диизобутилалюминий-гидрид. Затем альдегид превращают в метиловый эфир гидроксиуксусной кислоты с применением триметилсилилцианида и метанола в кислых условиях, например, в присутствии НС 1. Этот -гидроксильный эфир активируют путм обработки сульфинилхлоридом в присутствии пиридина и затем подвергают взаимодействию с тиомочевинной с образованием после гидролиза тиазолидин- 2,4-дионов общей формулы (Ic). См. BioorganicMedicinalChemistry, (2005), 13 (11), 3627-3639. Такой способ может также включать, например, конверсию производного формулы CO2W вd) ацилсульфонамид (Z = RSO2-NH-) или ацилцианамид (Z = CN-NH-) с получением соединений общей формулы (Id): Карбоксильная группа может быть в активированной форме (например, в виде хлорангидридов кислот или активных эфиров, или же конверсию можно осуществить непосредственно из кислоты с применением подходящих реагентов сочетания, таких как дициклогексилкарбодиимид (DCC) и промоторов,таких как 1-гидроксибензотриазол (НОВТ). Реакция активированной карбоксильной группы с алкил/ арилсульфонамидом или цианамидом может быть проведена, например, в дихлорметане в присутствии основания, например диизопропилэтиламина, при комнатной температуре с получением ацилсульфонамидов и ацилцианамидов общей формулы (Id). См. раздел, описывающий примеры. е) 3 Н-[1,3,4] оксадиазол-2-он с образованием соединений общей формулы (Ie): Так, сложноэфирная группа может быть вначале превращена в гидразид кислоты путм обработки гидразином при нагревании. Циклизация промежуточного соединения с получением 3 Н[1,3,4]оксадиазол-2-онов формулы (Ie) может быть достигнута путм обработки соответствующим активирующим агентом, (например, фосгеном, хлорформиатами, карбонилдиимидазолом, диэтилкарбонатом в апротонном полярном растворителе, таком как THF) в присутствии основания или без него при комнатной температуре или при нагревании. См. описание примеров.f) изоксазол-3-ол с получением соединений общей формулы (If): Карбоксильная группа может быть в активированной форме (например, в виде хлорангидридов кислот или активных эфиров, или же конверсию можно осуществить непосредственно из кислоты с применением подходящих реагентов сочетания, таких как дициклогексилкарбодиимид (DCC) и промоторов,- 15018900 таких как 1-гидроксибензотриазол (НОВТ). Так, активированная карбоксильная группа вначале может быть превращена в ацильную группу кислоты Мелдрема, которая при аминолизе N,О-бис-(трет.бут-оксикарбонил)гидроксиламином позволяет получить промежуточное соединение, которое подвергается циклизации в присутствии соляной кислоты в среде, например, метанола с получением 3-изоксазола (R = Н) общей формулы (Ie). Или же это промежуточное соединение может быть обработано сильным основанием, например LDA, и алкилирующим агентом, например алкилгалоидным соединением, с целью получения различных химических производных в метиленовом положении. Циклизация алкилированного промежуточного соединения, проводимая как описано выше, приводит к получению 4-алкилизоксазол-3-олов (R = алкил) общей формулы (If). См.g) [1,2,4]оксадиазол-3-ол с получением соединений общей формулы (Ig): Так, активированная группа карбоновой кислоты (например, хлорангидрид) может быть превращена в ацилизоцианат при обработке изоцианатом серебра в среде, например, диэтилового эфира. Или же ацилизоцианат может быть синтезирован из первичного амида по реакции с оксалилхлоридом в среде,например, дихлорметана или дихлорэтана. Промежуточный ацилизоцианат затем может реагировать с гидрохлоридом гидроксиламина в среде пиридина с получением [1,2,4] оксадиазол-3-олов общей формулы (Ig). См. Tetrahedron, 31 (17), 2007-14; 1975; Eur. Pat. Appl., 585165, 02 Mar 1994; Organic Letters, 6 (15), 2571-2574, 2004.h) трифторметилсульфонамид с получением соединений общей формулы (Ih): Так, карбоксильная или амидная группа может быть превращена в промежуточный первичный амин (в соответствии с хорошо известными методами, например, при помощи перегруппировки Куртиуса, Лоссена или Хофмана), который затем может реагировать с трифторметансульфоновым ангидридом в среде, например, дихлорметана, в присутствии основания, например триэтиламина, при низкой температуре с получением трифторметансульфонамидов общей формулы (Ih). Angewandte Chemie, Internationali) пирролидин-2,5-дион с получением соединений общей формулы (Ii): Так, активированная форма карбоновой кислоты (например, хлорангидрид кислоты) может быть вначале превращена в более высокий гомолог в соответствии с хорошо известными методиками (например, по реакции Арндта-Эйстерта). Гомологичное производное сложного эфира затем может быть обработано сильным основанием, например LDA, в среде тетрагидрофурана при низкой температуре с последующей реакцией с алкилирующим агентом, например этилбромацетатом, с получением промежуточного диэфира, который при гидролизе в основных условиях может быть превращен в пирролидин-2,5 дионы общей формулы (Ii) путм обработки мочевиной или аммиаком в воде. См. Heterocycles (1999), 50j) изотиазол-3-ол с получением соединений общей формулы (Ij): Нитрильная группа вначале может быть восстановлена с получением альдегида путм обработки сначала восстанавливающим агентом, таким как диизобутилалюминийгидрид, и затем получают олефиновое соединение при помощи фосфонатного эфира в присутствии основания (например, триэтилфосфонацетамида и гидрида натрия в среде 1,2-диметоксиэтана) с образованием промежуточного аллиламида. Затем проводят 1-4-присоединение по реакции Михаэля при помощи тиоуксусной кислоты и затем гидролиз с получением соответствующего тиола (с применением гидроокиси натрия) и последующее окисление до дисульфида (с применением таких окисляющих агентов, как перекись водорода). Затем осуществляют циклизацию при помощи сульфурилхлорида в среде дихлорэтана с получением изотиазол 3-олов общей формулы (Ij). См. Journal of Medicinal Chemistry, 2006, 49 (4), 1389-1393.k) фуразан-3-ол с получением соединений общей формулы (Ik): Так, эфирная группа или активированная кислота могут быть вначале превращены в ацилгидразид путм обработки гидразином при нагревании. Промежуточное соединение затем реагирует с получением фуразан-3-олов общей формулы (Ik) путм обработки соответствующим активирующим агентом, например, азотистой кислотой и уксусным ангидридом или диазометаном, в среде растворителей типа этанола и хлороформа. См. Journal of Heterocyclic Chemistry, 16 (4), 684-689, 1979.l) 3-гидроксипиррол-2,5-дион с получением соединений общей формулы (II): Так, активированная форма карбоновой кислоты (например, хлорангидрид кислоты) может быть вначале превращена в следующий гомологичный амид согласно хорошо известным методам (например,по реакции Арндта-Эйстерта). Гомологичный амид затем может быть обработан сильным основанием,например трет.бутоксидом калия, в среде тетрагидрофурана при низкой температуре и затем подвергнут взаимодействию с диметилоксалатом с получением 3-гидроксипиррол-2,5-дионов формулы (II) путм обработки мочевиной или аммиаком в воде. См. Bioorganic and Medicinal Chemistry (2006), 14 (17), 57815794.m) N-ацилалкилсульфинамид с получением соединений общей формулы (Im): Так, активированная форма карбоновой кислоты (например, хлорангидрид кислоты) может вначале реагировать с алкилсульфенамидом (R-S-NH2) в среде, например, дихлорметана, в присутствии основа- 17018900 ния, например триэтиламина, с получением промежуточного N-ацилалкилсульфенамида. Этот промежуточный продукт может быть затем превращен в N-ацилалкилсульфинамиды общей формулы (Im) при обработке окисляющим агентом, например МСРВА, в среде дихлорметана или NaIO4 в смеси вода/метанол или Н 2 О 2 в смеси вода/уксусная кислота. См. Journal of Organic Chemistry, 71 (4), 1380-1389; 2006; Tetrahedron, 60 (52), 12147-12152; 2004; Bioorganic and Medicinal Chemistry, 14 (11), 3775-3784;(2006); Monatshefte fuer Chemie, 121 (6-7), 539-47; 1990. Такой метод может включать, например, конверсию брома вn) изоксазол-3-ол с образованием соединений общей формулы (In): Бромсодержащее производное может быть получено путм обработки N-бромсукцинимидом и 1,1'азо-бис-(изобутиронитрилом) в четырххлористом углероде как описано в US 2004/0192667. Так, атом брома может быть замещн кетоэфиром в присутствии основания, например этоксида натрия, например в этаноле, с получением промежуточного продукта, который может циклизоваться по реакции с гидрохлоридом гидроксиламина, например, в смеси вода/этанол в присутствии основания, например, гидроокиси натрия, с получением изоксазол-3-олов общей формулы (In). См. Journal of Medicinal Chemistry, 45 (12),2454-2468, 2002. о) N-алкилсульфонамид (R = алкил) или N-ацилсульфонамид (R = -С(=О)-алкил) с получением соединений общей формулы (Io): Бромпроизводное может быть получено путм обработки N-бромсукцинимидом и 1,1'-азо-бис(изобутиронитрилом) в четырххлористом углероде как описано в US 2004/0192667. Так, атом брома может быть замещн тиоацетатом калия, например, в тетрагидрофуране и затем обработан хлором, например, в смеси этанол/дихлорметан с получением промежуточного сульфонилхлорида, который при реакции с алкиламином или алкиламидом образует N-алкилсульфонамиды или N-ацилсульфонамиды общей формулы (Io). См. BioorganicMedicinal Chemistry Letters, 17 (1), 73-77; 2007; BioorganicMedicinal Chemistry Letters, 17 (1), 1991-1995; 2007. Следующие примеры соединений по изобретению, их получение и свойства проиллюстрированы ниже. Общие положения Реакции при действии микроволн осуществляют в Personal Chemistry Emrys Optimizer, спектры ЯМР были получены на приборе Bruker Avance AMX 300 МГц. LC/MS снимали на приборе Agilent 1100.UPLC/MS проводили на приборе Waters Acquity. LC/MS (A - Е) и UPLC/MS (F) проводили следующим образом:(F) HCO2 H20t9850V: Колонка: ACQUITY UPLC ВЕН С 18, 1,7 мкм, 2,150 мм. Поток: 0,5 мл/мин. Градиент: 0,1-1,0 мин: 24-94% ацетонитрила в воде, 1-1,8 мин: 94% ацетонитрила. Модификатор: 0,1% НСООН. Метод MS-ионизации: API-ES (пол. и отр. ионизация). Для всех соединений указаны молекулярные ионы и время удерживания (RT) с применением метода (А), если не указано иное. Соединения основной формулы [I]. Соединения формулы [F] были получены так, как было описано выше на схеме 1. Сложные эфиры формулы [А] были получены путм применения хорошо известных методов (Rioxi et al., J. Med. Chem.,1999, 42, 769-776). Сложные эфиры формулы [А] были бромированы путм обработки Nбромсукцинимидом (1,1 экв.) и 1,1'-азобис (изобутиронитрилом) (0,01 экв.) в тетрахлориде углерода, как описано в US 2004/0192667. Получающиеся соединения брома не подвергались очистке, однако обрабатывались цианидом калия (2 экв.) и 18-краун-6-эфиром (0,4 экв.) в ацетонитриле при нагревании в течение 15 ч в сосуде с обратным холодильником. Реакционную смесь распределяли между 1 М раствором гидроксида натрия и этилацетатом. Органические фазы высушивали над сульфатом натрия, фильтровали и выпаривали. Остатки очищали путм применения хроматографии на двуокиси кремния, элюировали смесями этилацетат/циклогексан с целью получения производных этилового эфира соединений с формулой [В]. Эфиры были конвертированы в их соответствующие кислоты с формулой [В] путм обработки гидроксидом натрия в условиях, подобных тем, которые приняты в практике в данной области. Альтернативно, соединения брома могли быть обработаны цианидом натрия в смеси этанол/вода при нагревании в сосуде с обратным холодильником, что напрямую привело бы к получению кислот с формулой [В]. Соединения с формулой [В] были конвертированы в соединения с формулой [С] путм применения хорошо известных методов с использованием подходящего амина R3NHR4 и реагентов сочетания. Нитрилы формулы [С] были обработаны насыщенным раствором сероводорода в триэтаноламине (2 экв.) и пиридине (растворитель), что после перемешивания при комнатной температуре приводит к получению тиоамидов с формулой [D]. Соединения с формулой [D] были конвертированы в амидоксимы формулы[Е] путм взаимодействия с гидроксиламином (50 вес.% в воде; 2 экв.) в метаноле. Соединения формулы [F] были получены путм взаимодействия соединений с формулой [Е] со смесью 20% фосгена/толуол (1 экв.) в тетрагидрофуране в течение 5 мин при температуре 0 С, затем при комнатной температуре до образования белого осадка (приблизительно 15 мин), что указывает на образование нециклического промежуточного продукта. Гетерогенная смесь затем была нагрета до температуры 100 С в течение 5 мин в микроволновой печи, что приводило к получению соединений формулы [F] после очистки путм применения препаративной LCMS или хроматографии на двуокиси кремния. Соединение 1.01. Получали по методике, указанной на схеме 2. Схема 2 2,2'-азобисизобутиронитрил (0,35 г, 2,13 ммоль) добавляли к перемешанному раствору [А 1] (16 г,42,6 ммоль) и N-бромсукцинимида (8,35 г, 46,9 ммоль) в тетрахлорметане (160 мл) и смесь в течение 2 ч нагревали в сосуде с обратным холодильником, затем охлаждали до комнатной температуры. Добавляли насыщенный водный раствор метабиссульфита натрия (30 мл) и смесь перемешивали в течение 24 ч, затем разбавляли водой (160 мл) с рассолом (40 мл) и экстрагировали этилацетатом (240 мл). Органические экстракты экстрагировали с 1 М раствором гидроксида натрия (100 мл), высушивали над безводным сульфатом магния и выпаривали под вакуумом. Остаток растворяли в этаноле (100 мл) и добавляли раствор цианида калия в воде (8,33 г, 127,8 ммоль). Смесь нагревали в сосуде с обратным холодильником в течение 16 ч. Добавляли 2 М раствор гидроксида натрия (20 мл) и продолжали нагревать в сосуде с обратным холодильником в течение 30 мин. Смесь разбавляли водой (300 мл), подкисляли 2 М соляной кислотой и экстрагировали этилацетатом (2300 мл). Объединнные органические экстракты высушивали над сульфатом магния и фильтровали через слой двуокиси кремния, сначала промывали этилацетатом,затем 1% уксусной кислотой в этилацетате. Фильтрат выпаривали под вакуумом, затем остаток повторно выпаривали с толуолом для того, чтобы удалить уксусную кислоту и получить 5-(4-хлорфенил)-1-(2 хлорфенил)-4-цианометил-1 Н-пиразол-3-карбоновую кислоту [В 1] (14,7 г, 93%) в виде пены. 1 Н ЯМР (DMSO-D6):3,91 (2 Н, s), 7,10 (2 Н, d), 7,23-7,37 (6 Н, m). LCMS (метод A): RT = 2,476 мин,(М + Н)+ = 372. Добавляли изобутилхлорформиат (1,15 мл, 8,87 ммоль) к перемешиваемому раствору с формулой туре 0 С в атмосфере аргона. Реакционную смесь оставляли до достижения комнатной температуры и перемешивание продолжали в течение 18 ч, после чего по каплям добавляли (R)-1-[4(трифторметил)фенил]этиламин (1,52 г, 8,06 ммоль). Реакционную смесь перемешивали до прекращения выделения газа (приблизительно 5 мин). LCMS показала полную конверсию кислоты в форму ожидаемого продукта. Смесь разбавляли этилацетатом (60 мл), промывали 1N водным раствором соляной кислоты, затем водой, затем 1N водным раствором NaOH, затем рассолом, высушивали над сульфатом магния и концентрировали под вакуумом с целью получения пены светло-жлтого цвета (4,5 г), которую затем очищали путм применения комбинированной флэш-хроматографии (двуокись кремния: 40 г; загрузка: раствор CH2Cl2 (20 мл); элюирование: гептан/EtOAc градиент: 1/9 к 1/1 в течение 30 мин; поток: 38 мл); размер фракции 100 мл) с целью получения 5-(4-хлорфенил)-1-(2-хлорфенил)-4-цианометил-1 Н-пиразол 3-карбоновой кислоты [(R)-1-(4-трифторметилфенил)этил]амид [C1] в виде пены белого цвета (1,6 г, 2,95 ммоль, 37%). LCMS (метод A): RT = 3,42 мин, API-ES, положит., 543,0 (М + Н)+. К раствору [C1] (0,93 г, 1,71 ммоль) в безводном пиридине (2 мл) добавляли триэтиламин (0,48 мл,3,42 ммоль). Через реакционную смесь барботировали сероводород в течение приблизительно 5 мин. Закрытый микроволновый сосуд (20 мл) помещали под давление сероводорода (шприц объмом в 20 мл 3 раза наполняли сероводородом, затем сероводород "впрыскивали" (3) в сосуд через перегородку) и перемешивали в течение 1 суток, после чего LCMS показала отсутствие SM [C1] и образование желаемого продукта. Реакционную смесь резко охлаждали 1N водным раствором HCl и экстрагировали CH2Cl2. Органическую фазу промывали 1N водным раствором соляной кислоты, рассолом и высушивали при помощи "фазово-разделительной" колонки (Biotage). Аргон барботировали через органический раствор с целью удаления остаточного сероводорода. Органическую фазу концентрировали под вакуумом с целью получения 5-(4-хлорфенил)-1-(2-хлорфенил)-4-тиокарбамоилметил-1 Н-пиразол-3-карбоновой кислоты[(R)-1-(4-трифторметилфенил)этил]амида [D1] в виде пены белого цвета (0,84 г, 1,46 ммоль, 85,4%).LCMS показала чистое желаемое соединение. Использовалось без дальнейшей очистки. LCMS (метод A):RT = 3,365 мин, API-ES, положит., 577,0 (М + Н)+. К раствору [D1] (60 мг, 0,1 ммоль) в метаноле (1 мл) добавляли гидроксиламин 50 вес. % в среде воды (7,42 мкл, 0,1 ммоль). Реакционную смесь перемешивали в течение 18 ч при комнатной температуре, после чего LCMS показала наличие, в основном, желаемого продукта и небольшого количества SM[D1]. Затем добавляли эквивалентное количество гидроксиламина 50 вес.% в среде воды (7,42 мкл, 0,1 ммоль) и реакционную смесь в течение 10 мин нагревали при температуре 40 С. LCMS показала завершение реакции. Растворитель удаляли под вакуумом. Остаток распределяли между дихлорметаном и водой. Органическую фазу высушивали путм применения колонки с "разделением фаз" (Biotage) и концентрировали под вакуумом с целью получения 5-(4-хлорфенил)-1-(2-хлорфенил)-4-(Nгидроксикарбамимидоилметил)-1 Н-пиразол-3-карбоновой кислоты[(R)-1-(4-трифторметилфенил)этил]амида [Е 1] в виде пены белого цвета (53 мг, 0,088 ммоль, 88,5%), которая использовалась без дальнейшей очистки. UPLC/MS (метод F): RT = 1,10 мин, ES+ = 576,4 (М + Н)+. К охлажднному (0 С) раствору [Е 1] (53 мг, 0,088 ммоль) в безводном тетрагидрофуране (1 мл) добавляли 20 вес.% фосгена в среде толуола (45,97 мкл, 0,088 ммоль). Реакционную смесь в течение 5 мин перемешивали при температуре 0 С и 15 мин при комнатной температуре, после чего выпадал осадок белого цвета. LCMS показала конверсию около 50% SM [E1] в активированный промежуточный продукт. Затем реакционную смесь в течение 5 мин нагревали в микроволновой печи при температуре 100 С, после чего LCMS показала полную конверсию промежуточного продукта в желаемый продукт. Реакционную смесь затем охлаждали до комнатной температуры и оставляли на двое суток до образования осадка белого цвета. Осадок отфильтровывали и фильтрат концентрировали под вакуумом. LCMS осадка показала, в основном, SM [E1], фильтрат очищали путм применения препаративной LCMS (метод Е) с целью получения основного соединения [1.01] в виде тврдого вещества белого цвета (6 мг,0,0095 ммоль, 10,8%). 1 Н ЯМР (300 МГц, DMSO):1,49 (d,3H), 3,94 (q, 2 Н), 5,22 (квант, 1 Н), 7,25 (d, 2H), 7,42 (d, 2H), 7,48-7,72 Соединения формулы [K] были получены так, как было описано на схеме 3 выше. К нитрилу в этаноле добавляли гидроксид натрия (6 экв.) и смесь в течение ночи нагревали в сосуде с обратным холодильником. После охлаждения образовывался осадок динатриевой соли белого цвета,который отфильтровывали, дважды промывали этанолом и высушивали в течение ночи в вакуумном осушителе. Тврдое вещество затем добавляли к воде и подкисляли 4N HCl, тврдый продукт отфильтровывали и высушивали в течение 72 ч в вакуумном осушителе с целью получения дикислоты [G]. К этому соединению в среде толуола добавляли пиридин (0,05 экв.) и уксусный ангидрид (1,1 экв), реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли дополнительное количество пиридина (0,025 экв) и уксусного ангидрида (0,5 экв) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем в течение 45 мин при температуре 50 С. Затем добавляли этанол и реакционную смесь в течение 48 ч перемешивали при комнатной температуре, концентрировали под вакуумом и остаток очищали от этанола путм перекристаллизации с целью получения моноэфира[Н]. Соединения с формулой [Н] конвертировали в соединения с формулой [I] путм применения хорошо известных методов с использованием приемлемого амина R3NHR4 и реагентов сочетания. Соединения с формулой [I] обрабатывали моногидратом гидразина (2 экв) при нагревании с этанолом в сосуде с обратным холодильником. Смесь экстрагировали (3) дихлорметаном. Органические фазы объединяли, высушивали и концентрировали под вакуумом с целью получения соединений с формулой [J]. Соединения формулы [К] синтезировали путм взаимодействия соединений с формулой [J] с 20% фосгена/толуол (1 экв) в среде тетрагидрофурана при температуре 0 С в течение 15 мин, затем при комнатной температуре в течение 1 ч. Растворитель удаляли под вакуумом и остаток экстрагировали дихлорметаном (2). Органические фазы объединяли, высушивали и концентрировали под вакуумом с целью получения соединений с формулой [К], после очистки путм применения препаративной LCMS или силикагелевой хроматографии. Соединение 2.01. Получали в соответствии с методиками, указанными на схеме 4. Соединения с формулой [В 1] получали так, как это описано выше на схеме 2. К 1-(2-хлорфенил)-5(4-хлорфенил)-4-цианометил-1 Н-пиразол-3-карбоновой кислоте [В 1] (30 г, 0,8 ммол) добавляли гидроксид натрия (19 г, 4,8 ммоль), этанол (250 мл) и воду (150 мл). Реакционную смесь в течение ночи нагревали в сосуде с обратным холодильником. Прекращали нагревание и реакционную смесь оставляли до достижения комнатной температуре. Образовавшийся осадок собирали, промывали этанолом и в течение ночи высушивали в эксикаторе. Соль натрия растворяли в воде (400 мл) и во время интенсивного перемешивания добавляли соляную кислоту (4N) для того, чтобы предотвратить образование смолы, а осадок собирали и высушивали в вакуумной печи с выходом 27 г (0,7 моль, 86%) 4-карбоксиметил-1-(2 хлорфенил)-5-(4-хлорфенил)-1 Н-пиразол-3-карбоновой кислоты [G1]. LCMS (метод A): RT = 2,1 мин,ES+ = 390,9 (М + Н)+.[G1] (19 г, 49 ммол) растворяли в толуоле (80 мл) в атмосфере N2 и во время перемешивания добавляли пиридин (0,39 мл, 4,9 ммоль) и затем по каплям уксусный ангидрид (5,05 мл, 53 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Так как согласно анализу LCMS реакция не была завершена, реакционную смесь в течение 3 ч нагревали при температуре 35 С. Так как реакция вс ещ не была завершена, нагревание прекращали и вводили дополнительные порции уксусного ангидрида (0,5 экв) и пиридина (0,05 экв). Реакционную смесь в течение ночи продолжали перемешивать. Добавляли этанол (100 мл) и в течение трх дней перемешивали реакционную смесь при комнатной температуре. Растворитель удаляли под вакуумом и остаток перекристаллизовывали из этанола (75 мл) и горячей воды (35 мл) с получением приблизительно 20 г. Так как эти кристаллы не являлись чистыми,соединение дважды перекристаллизовывали с получением дополнительно 11,37 г (56%) 1-(2-хлорфенил)5-(4-хлорфенил)-4-этоксикарбо-нилметил-1 Н-пиразол-3-карбоновой кислоты [H1]. UPLC/MS (метод F):RT = 1,10 мин, ES+ = 576,4 (М + Н)+. 1 Н ЯМР (300 МГц, CDCl3): 1,27 (t, 3 Н), 3,80 (s, 2H), 4,19 (q, 2H), 7,16 (d, 2H), 7,27-7,47 (m, 8 Н). Эфир [H1] (12 г, 29 ммол) растворяли в дихлорметане (120 мл) и охлаждали до температуры 0 С. К этой суспензии добавляли оксалилхлорид (5 мл, 57 ммоль) и диметилформамид (0,05 мл) и убирали охлаждающую баню. Суспензия становилась более и более растворимой, и через 3 ч тврдое вещество снова становилось видимым. Так как какая-то часть исходного материала была видима, по результатам анализа LCMS добавляли дополнительное количество оксалилхлорида (0,5 мл, 0,2 экв). Это дополнительное количество позволило завершить реакцию и под вакуумом удаляли растворитель. В сосуд, содержащий несколько молекулярных сит, добавляли гидрохлорид 4-(2-фторфенил)пиперидина (7,4 г, 34 ммоль),DIPEA (6 мл) и дихлорметан (60 мл). Эту смесь охлаждали до температуры 0 С и затем по каплям через воронку добавляли хлорангидрид кислоты, растворнный в дихлорметане (60 мл). Реакционную смесь перемешивали в течение ночи. Молекулярные сита были отфильтрованы и реакционную смесь экстрагировали дихлорметаном (3). Объединнные органические фазы экстрагировали NaHCO3 (насыщенный),промывали рассолом, высушивали над Na2SO4, фильтровали и выпаривали, что приводило к получению 15 г сырого эфира. Сырой продукт очищали на короткой силикагелевой колонке (EtOAc/гептан, 1:4 с последующим 1:1), фракции, содержащие продукт, объединяли и перекристаллизовывали из EtOAc (45 мл) и гептана (80 мл), что позволяло получить 9,1 г этиловый эфир 1-(2-хлорфенил)-5-(4-хлорфенил)-3[4-(2-фторфенил)пиперидин-1-карбонил]-1 Н-пиразол-4-илуксусной кислоты [I1]. Маточный раствор концентрировали под вакуумом и очищали методом перекристаллизации ЕЮАс и гептана, что позволяло получить дополнительно 1,7 г [I1]. LCMS (метод A): RT = 3,6 мин, ES+ = 580,1 (М +1)+. 1 Н ЯМР (300 МГц, CDCl3): 1,28 (t, 3 Н), 1,71-2,04 (m, 4 Н), 2,91 (t, 1 Н), 3,21 (tt, 1H), 3,31 (t, 1H), 3,72 0,18 ммоль). Сосуд закрывали и нагревали в течение ночи с обратным холодильником. Так как LCMS показала только исходный материал, то добавили второе эквивалентное количество гидразина (10 мкл,0,18 ммоль) и реакционную смесь нагревали в сосуде с обратным холодильником в течение недели. К реакционной смеси добавляли воду с последующей экстракцией дихлорметаном (2). Объединнные органические фазы высушивали над Na2SO4, фильтровали и выпаривали с получением 108 мг сырого продукта [J1], который использовали без дальнейшей очистки. UPLC/MS (метод F): RT = 1,27 мин, ES+ = 566,4 (М + Н)+. Сырой продукт [J1] растворяли в THF (1 мл) и охлаждали до температуры 0 С. Добавляли фосген(20% в среде толуола, 20 мкл) и реакционную смесь перемешивали в течение 15 мин при температуре 0 С и затем в течение 1 ч при комнатной температуре. Сырой продукт экстрагировали смесью CH2Cl2/ вода, объединнные органические фазы высушивали над Na2SO4, фильтровали и выпаривали с целью получения сырого продукта. Некоторое количество сырого продукта ( 25 мг ) очищали путм применения препаративной LCMS (метод Е) с целью получения основного соединения [2.01] в виде тврдого вещества белого цвета (5,88 мг, 0,0099 ммоль, 5,5%). UPLC/MS (метод F): RT = 1,34 мин, ES+ = 592,4 (М + Н)+. 1 Н ЯМР (300 МГц, DMSO-d6): 1,52-1,92 (m, 4H), 2,88 (t, 1H), 3,08-3,34 (m, 2H) (obscured by water signal), 3,89 (AB-q, 2H), 4,46 (d, 1H), 4,67 (d, 1H), 7,10-7,15 (m, 1H), 7,16 (d, 1H), 7,21-7,31 (m, 3H), 7,35 (t,1H), 7,40-7,53 (m, 4H), 7,58 (dd, lH), 7,66 (dd, lH), 12,07 (br s, 1H). Соединение 2.02. Получали в соответствии с методом, указанным на схеме 4, которая идентична схеме, описанной для получения соединения 2.01. Схема 4 а Соединение формулы [I2] получали по методу, описанному на схеме 4 с использованием [H1] и (R)1-(4-трифторметилфенил)этиламина. Соединения с общей формулой [3]. Соединения формулы [M] были получены так, как описано выше на схеме 5. Соединения формулы [L] были выделены путм гидролиза соединений формулы [I] в щелочной среде путм применения хорошо известных методов. Кислоты с формулой [L] были конвертированы в реактивные промежуточные продукты путм обработки, например, 4-(диметиламино)пиридином (1,7 экв), гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида (2 экв) и диизопропилэтиламином(3 экв), а также взаимодействия с приемлемым алкилсульфонамидом (2 экв) в дихлорметане с целью получения соединений формулы [М] после очистки на колонке SAX (Biotage). Соединение 3.01. Получали в соответствии с методом, указанным на схеме 6. Схема 6 Соединение формулы [I1] получали так, как это было выше описано на схеме 4. К этиловому эфиру 1-(2-хлорфенил)-5-(4-хлорфенил)-3-[4-(2-фторфенил)-пиперидин-1-карбонил]1H-пиразол-4-илуксусной кислоты [I1] (12,3 г, 21,2 ммоль), который был описан в примере 2.01, добавляли THF (100 мл), воду (100 мл) и гидроксид лития (9 г, 214 ммоль). Реакционную смесь перемешивали в течение ночи. Органический растворитель удаляли под вакуумом и оставшуюся водную фазу подкисляли 2 М HCl, после чего экстрагировали EtOAc (2). Объединнные органические фазы промывали водой и рассолом, высушивали над сульфатом натрия, фильтровали и выпаривали с получением 11,5 г сырого продукта. Повторно перекристаллизовывали из EtOAc и гептана с получением 7,8 г чистой 1-(2 хлорфенил)-5-(4-хлорфенил)-3-[4-(2-фторфенил)пиперидин-1-карбонил]-1 Н-пиразол-4-илуксусной кислоты [L1]. LCMS (метод A): RT = 3,5 мин, ES+ = 552,1 (М +1)+. 300 МГц, (CDCl3): 1,80-2,12 (4H, m), 3,02(1H, dt), 3,20-3,43 (2H, m), 3,60 (2H, q), 5,01 (1 Н, d), 5,20 (1H, d), 7,01-7, 54 (12H, m) 14,48 (1H, br s). К смеси [L1] (100 мг, 0,18 ммоль), 4-(диметиламино)пиридина (37,6 мг, 0,31 ммол), 1-этил-3-(3 диметиламинопропил) карбодиимида гидрохлорида (69,4 мг, 0,36 ммоль) и метансульфонамида (34,44 мг, 0,36 ммоль) в среде дихлорметана (0,5 мл) добавляли диизопропилэтиламин (90 мкл, 0,54 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, после чего LCMS показала полную конверсию соединения [L1] в требуемый продукт. Смесь промывали 1N водной соляной кислотой, органическую фазу высушивали и выпаривали под вакуумом с целью получения 110 г сырого продукта, который очищали на колонке SAX, используя дихлорметан в качестве элюента с целью получения основного соединения [3.01] (54 мг, 0,085 ммоль, 47,4%).]. LCMS (метод A): RT = 3,39 мин, APIES (положит.), 629,0 (М + Н)+. Соединение 3.02. Получали в соответствии с методом, указанным на схеме 6 а, который идентичен методу, который описан для получения соединения [3.01]. Схема 6 а Соединение формулы [I2] получали так, как это было описано выше на схеме 4, используя соединение [H1] и метил-[(R)-1-(4-трифторметилфенил)этил]амин. Соединения с общей формулой [4]. Соединения формулы [N] были получены так, как указано выше на схеме 7 в соответствии с методом, который идентичен методу, описанному для синтеза соединений с формулой [М] с использованием цианамида (CN-NH2) вместо алкилсульфонамида. Соединение 4.01. Получали в соответствии с методом, указанным на схеме 8. Схема 8 Соединения формулы [L1] получали так, как описано выше на схеме 6. К смеси соединения формулы [L1] (100 мг, 018 ммоль), 4-(диметиламино)пиридина (26,54 мг, 0,22 ммол), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (48,58 мг, 0,25 ммоль) и цианамида(15,22 мг, 0,36 ммол) в дихлорметане (0,5 мл) добавляли диизопропилэтиламин (60 мкл, 0,36 ммоль). Реакционную смесь в течение ночи перемешивали при комнатной температуре, после чего LCMS показала полную конверсию соединения [L1] в желаемый продукт. Смесь промывали 1N водной соляной кислотой, органическую фазу высушивали и выпаривали под вакуумом с целью получения 110 г сырого продукта, который очищали на колонке SAX с использованием дихлорметан в качестве элюента, что приводило к получению основного соединения [4.01] (43 мг, 0,114 ммоль, 63,2%).]. LCMS (метод A): RT = 3,3 мин, API-ES (положит.), 576,0(М + Н)+. Соединение 4.02. Получали в соответствии с методом, указанным на схеме 8 а, который идентичен методу, описанному для получения соединения [4.01]. Соединение формулы [L2] получали так, как это было описано выше на схеме 6 а. Соединение 4.03. Получали в соответствии с методом, указанным на схеме 8b, который идентичен методу, описанному для получения соединения [4.01]. Схема 8b Соединение формулы [L3] получали из соединения с формулой [I3] так, как это описано на схеме 7. Соединение с формулой [I3] получали так, как это описано на схеме 4, используя соединение [H1] и 4-(3,5-дифторфенокси)пиридин. Соединения с общей формулой [5]. Соединения формулы [Q] получали так, как это указано выше на схеме 9. Соединения формулы [С] получали так, как это указано выше на схеме 1. Соединения формулы [О] синтезировали путм обработки соединения [С] одним экв LDA с последующим алкилированием 1,5 экв этилбромацетата в среде безводного THF при температуре -78 С. Алкилированные соединения с формулой [О] конвертировали в амиды с формулой [Р] путм быстрой реакции (10 мин) с горячей (80 С) смесью концентрированной H2SO4/уксусная кислота. Реакция амидов с формулой [Р] с LiOH в смеси THF /вода при комнатной температуре приводила к полной конверсии в циклические соединения формулы [Q]. Соединение 5.01. Получали в соответствии с методом, указанным на схеме 10. Схема 10 Соединение формулы [С 2] получали так, как это было описано на схеме 1 с использованием соединения [В 1] и метил-[(R)-1-(4-трифторметилфенил)этил]амина. LDA получали при добавлении 2,5 М бутиллития в среде гексана (230 мкл, 0,57 ммоль) к охлажднному раствору (-20 С) диизопропиламина (97 мкл, 0,69 ммол) в сухом THF (3 мл) в атмосфере аргона. После перемешивания в течение 20 мин эту смесь добавляли к охлажднному раствору (-78 С) соединения [С 2] (320 мг, 0,57 ммоль) в сухом THF (2 мл) в атмосфере аргона. Реакционную смесь в течение 30 мин перемешивали при температуре -78 С. Добавляли этилбромацетат (95,5 мкл, 0,86 ммоль) и реакционную смесь перемешивали при температуре-78 С в течение 1 ч. Затем реакционную смесь медленно доводили до температуры 5 С в течение 14 ч и перерабатывали. Добавляли насыщенный водный раствор NH4Cl и реакционную смесь экстрагировали диэтиловым эфиром. Органическую фазу высушивали над MgSO4 и концентрировали под вакуумом с целью получения масла коричневого цвета (350 мг). Сырое соединение с формулой [О 1] очищали путм применения силикагелевой хроматографии (двуокись кремния: 12 г; загрузка: раствор CH2Cl2 (5 мл); элюирование: гептан/ EtOAc (изократич.): 1/1; размер фракции: 10 мл) с целью получения масла светложлтого цвета (239 мг). TLC показал только одно ультрафиолетовое пятно, но UPLC/MS (метод F) показал два пика при Rt = 1,47 мин и Rt = 1,51 мин (приблизительно 40/60) соответственно, что свидетельствует о неустановленной примеси и соединении [01]. Загрязннное соединение с формулой [O1] использовали без дальнейшей очистки. Раствор соединения с формулой [01] (239 мг, 0,37 ммоль) в уксусной кислоте (0,5 мл) нагревали до температуры 60 С. Добавляли концентрированную серную кислоту (0,3 мл) и реакционную смесь нагревали до температуры 80 С в течение 10 мин. После охлаждения реакционную смесь обрабатывали. Реакционную смесь выливали на лд и экстрагировали дихлорметаном. Органическую фазу высушивали над сульфатом магния и концентрировали под вакуумом с целью получения масла светло-жлтого цвета (100 мг). Сырое соединение с формулой [Р 1] очищали с помощью силикагелевой хроматографии (двуокись кремния: 4 г; загрузка: раствор CH2Cl2 (2 мл); элюирование: гептан/EtOAc (изократич.): 1/1, затем 4/1; размер фракции: 3 мл) с целю получения соединения с формулой [Р 1] (37 мг, 15%). Соединение с формулой [Р 1] было загрязнено неустановленной примесью и использовалось без дальнейшей очистки. К суспензии соединения с формулой [Р 1] (37 мг, 0,06 ммоль) в среде смеси THF/вода (1 мл, 1/1) добавляли моногидрат гидроокиси лития (9,39 мг, 0,22 ммоль). Реакционную смесь в течение 1 ч перемешивали при комнатной температуре, после чего LCMS показала полную конверсию в сукцинимид [5.01]. С целью удаления THF реакционную смесь концентрировали под вакуумом. Водную фазу подкисляли IN водной соляной кислотой до рН 1-2 и экстрагировали дихлорметаном. Органическую фазу высушивали в фазово-разделяющей колонке (Biotage) и концентрировали под вакуумом с целью получения сырого соединения [5.01], которое очищали путм применения препаративной LCMS (метод Е) для получения соединения [5.01] в виде тврдого вещества белого цвета (23 мг, 67%). Соединения с общей формулой [6]. Схема 11 Соединения формулы [I] получали, как описано на схеме 3 выше. Сложный эфир восстанавливали при помощи боргидрида натрия (16 экв.) в этаноле с получением первичного спирта формулы (R), затем спирт окисляли реагентом Десса-Мартина (2 экв.) с получением альдегида формулы [S]. Затем альдегид превращали в гидантоин при помощи карбоната аммония (9 экв.) и цианида калия (5 экв.) в этаноле и воде, получая конечный продукт [Т]. Соединение 6.01. Это соединение получали по методу, показанному на схеме 12. Схема 12 Соединения формулы [I1] получали, как указано на схеме 4 выше. К раствору [I1] (307 мг, 0,53 ммоль) в этаноле (12 мл) добавляли боргидрид натрия (320 мг, 8,5 ммоль) и перемешивали полученную суспензию при комнатной температуре. Затем проводили UPLC, но через 2 дня ещ определялось некоторое количество исходного соединения, поэтому добавляли снова некоторое количество этанола и боргидрида натрия два раза при продолжении перемешивания. Реакция
МПК / Метки
МПК: A61P 3/04, C07D 231/14, C07D 401/12, C07D 413/06, A61K 31/415, C07D 403/04, C07D 401/14, A61K 31/4155
Метки: модулирующие, композиции, применение, рецептора, св1, основе, активность, каннабиноидного, соединения
Код ссылки
<a href="https://eas.patents.su/30-18900-soedineniya-moduliruyushhie-aktivnost-kannabinoidnogo-receptora-sv1-kompozicii-na-ih-osnove-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, модулирующие активность каннабиноидного рецептора св1, композиции на их основе и их применение</a>
Предыдущий патент: Контакторы адсорбента с низким содержанием мезопор для использования в процессах адсорбции за счет перепада
Следующий патент: N,n-дизамещенные аминоалкилбифенилы в качестве антагонистов рецепторов простагландина d2
Случайный патент: Производные 2-гетероариламинопиримидина в качестве ингибиторов киназ