Бициклические ароматические соединения, фармацевтическая и косметическая композиции на их основе, и применение косметической композиции
Формула / Реферат
1. Биароматические соединения пропинила общей формулы (I)
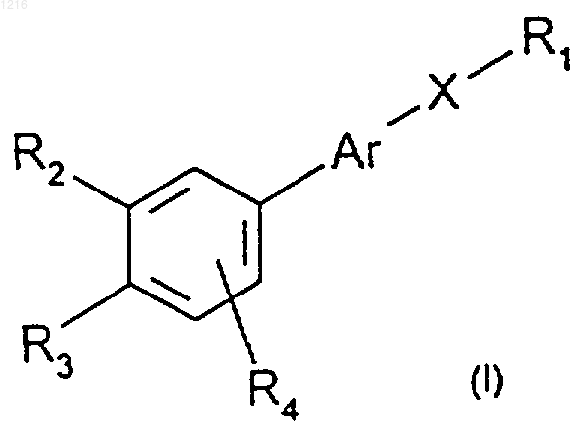
где R1 является (I) радикалом -СН3; (II) радикалом -CH2-O-R5; (III) радикалом -СО-R6,
где R5 и R6 имеют значения, приведенные ниже,
Аr является радикалом, выбираемым из радикалов формул (а)-(е):
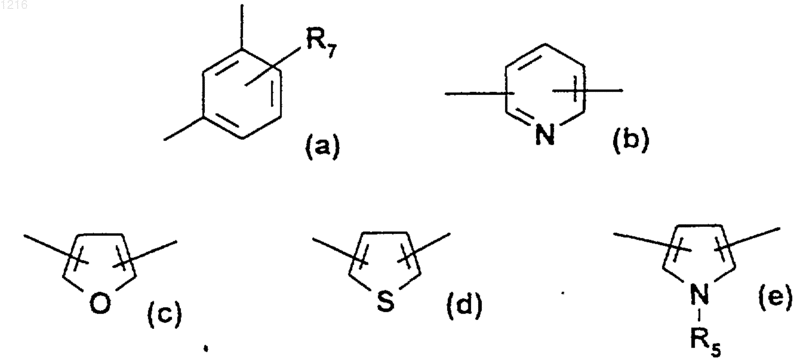
где R5 и R7 имеют значения, приведенные ниже,
Х является радикалом формулы
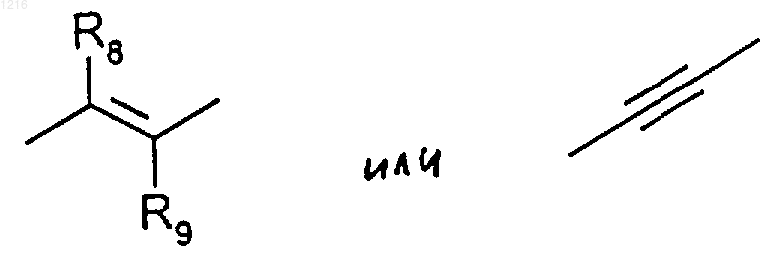
где R8 и R9 имеют значения, приведенные ниже,
R2 и R3, одинаковые или различные, являются (I) атомом водорода; (II) алкилом, имеющим, по крайней мере, 3 атома углерода, из которых связанный с фенильным радикалом углерод, по крайней мере, замещен двумя атомами углерода; (III) радикалом -OR5; (IV) радикалом -SR5, где R5 имеет значение, приведенное ниже,
при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,
при этом R2 и R3 не могут одновременно иметь вышеуказанные значения (I), (III) и (IV),
R4 и R7, одинаковы или различные, являются атомом водорода, атомом галогена, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, радикалом - OR5,
R5 является водородом, низшим алкилом или радикалом -COR10,
где R10 имеет значения, определенные ниже,
R6 является: (а) водородом; (б) низшим алкилом; (в) радикалом формулы
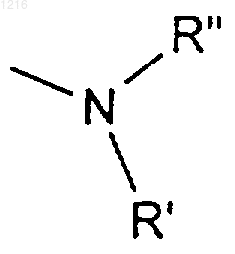
где R' и R" имеют значения, определенные ниже; (г) радикалом -ОR11, где R11 имеет значения, определенные ниже,
R8 и R9, одинаковые или различные, являются водородом или низшим алкилом,
R10 является низшим алкилом,
R11 является водородом, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом моно- или полигидроксиалкилом, арилом или аралкилом, которые могут быть замещены, или остатком сахара, или остатком аминокислоты, или пептида,
R' и R", одинаковые или различные, являются водородом, низшим алкилом, моно- или полигидроксиалкилом, арилом, который может быть замещен, или остатком аминокислоты или сахара, или вместе образуют гетероцикл,
а также их соли и оптические и геометрические изомеры.
2. Соединения по п.1, отличающиеся тем, что они находятся в виде солей щелочного или щелочно-земельного металла, или цинка, или органического амина.
3. Соединения по п.1, отличающиеся тем, что отдельно или в смеси они составляют группу соединений
-5-(3-трет-бутил-4-метоксифенил)-2-тиофенакриловая кислота,
-5-(3-трет-бутил-4-метоксифенил)-2-тиофенпропиоловая кислота,
-2-(3-трет-бутил-4-метоксифенил)-4-тиофенакриловая кислота,
-4-(3-трет-бутил-4-метоксифенил)-2-тиофенакриловая кислота,
-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-тиофенакриловая кислота,
-4-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-тиофенакриловая кислота,
-4-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2-тиофенакриловая кислота,
-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-тиофенпропиоловая кислота,
-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилпропиоловая кислота,
N-метил-4-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2-пирролакриловая кислота,
-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
N-метил-4-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-пирролакриловая кислота,
-4-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-пирролакриловая кислота,
-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-3-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилпропиоловая кислота,
-2-метокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-2-пропилокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-2-гептилокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-2-метоксиметокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
2-гидрокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-3-(3-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
-3-(3-пропилокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
-3-(3-гептилокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
-3-(3-метоксиметокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
-3-(3-гидрокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота,
-3-(4,4,7-триметилтиохроман-6-ил)фенилакриловая кислота,
-N-этил-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенилакриламид,
-N-4(гидроксифенил)-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриламид,
-морфолид 3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты,
-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилэтилакрилат,
-3-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенил]бут-2-еновая кислота,
-4-метоксиметокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-4-гидрокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-4-метокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-4-пропилокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-4-гептилокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,
-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакролеин,
3-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилнил]проп-2-ен-1-ол,
-цис-3-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенил]бут-2-еновая кислота,
-цис-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенилакриловая кислота,
-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-3-пиридинакриловая кислота,
-3-(3-бутил-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил) фенилакриловая кислота,
-6-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-пиридинакриловая кислота.
4. Соединения по п.1, отличающиеся тем, что для них выполняются, по крайней мере, одно и, предпочтительно, все следующие условия:
R1 является радикалом -CO-R6,
Аr является радикалами формулы (а) или (d),
Х является радикалом
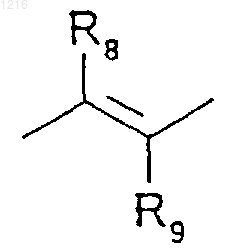
R2 и R3 вместе образуют с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы.
5. Применение соединений формулы (I) в качестве лекарственного средства.
6. Применение по п.5 в качестве лекарственного средства для лечения дерматологических заболеваний, связанных с нарушением кератинизации, обусловленной дифференциацией и пролиферацией, в частности для лечения акне обыкновенного, юношеского, полиморфного, розового, кистозного, шаровидного, старческого, а также вторичных акне, например, вызванных солнечным, медикаментозным воздействием, или имеющих профессиональный характер, для лечения других типов нарушений кератинизации, в частности ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонно-подошвенные кератодермии, лейкоплакии и лейкоплакиеподобэых состояния, кожный лишай или лишай слизистой (полости рта); для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительной и/или иммунно-аллергической компонентой и, в частности, любых форм псориаза кожи, слизистой или ногтей и псориатического артрита или кожной атопии такой как экзема, или респиратурной атопии, а также гипертрофию десен; соединения могут быть также использованы для лечения некоторых воспалительных процессов, не связанных с нарушением кератинизации; для лечения дермических или эпидермических пролифераций, как доброкачественных, так и злокачественных, вирусного или невирусного происхождения, например обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации, которые могут быть вызваны ультра-фиолетовыми лучами, в частности, базоцеллюлярные и спиноцеллюлярные эпитилиомы; для лечения других дерматологических расстройств, таких как пузырчатый дерматоз и коллагеноз;
для лечения некоторых офтальмологических заболеваний, в частности корнеопатий; для восстановления или борьбы со старением кожи, как возрастным, так и в результате воздействия света, а также для уменьшения пигментации и белковых кератозов или любых патологий, связанных с возрастным или белковым старением; для профилактики или лечения признаков эпидермической и/или дермической атрофии, вызванной наружными или системными кортикостероидами, или других форм кожной атрофии; для профилактики или лечения нарушений процесса рубцевания или для заживления рубцов, для лечения нарушений функции сальных желез, например, гиперсеборея акне или простая себорея; при лечении и профилактики раковых или предраковых состояний; при лечении некоторых воспалительных процессов, таких как артрит; при лечении любых вирусных общих или кожных заболеваний, например синдром Капоши; при профилактике или лечении облысения; при лечении дерматологических или общих заболеваний с иммунологической компонентой; при лечении заболеваний сердечно-сосудистой системы, таких как артериосклероз или гипертония, а также инсулинонезависимый диабет, при лечении кожных заболеваний, вызванных ультрафиолетовым облучением.
7. Фармацевтическая композиция, отличающаяся тем, что содержит в фармацевтически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-4.
8. Композиция по п.7, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-4 составляет от 0,001 до 5 мас.% от общей массы композиции.
9. Косметическая композиция, отличающаяся тем, что содержит в косметически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-4.
10. Композиция по п.9, отличающаяся тем, что концентрация соединения(ий) по одному из пп.1-4 составляет от 0,001 до 3 мас.% по отношению к общей массе композиции.
11. Применение косметической композиции по одному из пп.9 или 10 для гигиены тела или волос.
Текст
1 Изобретение относится к бициклическим ароматическим соединениям. Оно относится также к использованию этих соединений в фармацевтических композициях, предназначенных для использования в медицине и ветеринарии,или же в косметических композициях. Соединения согласно изобретению имеют выраженную активность в области дифференциации и пролиферации клеток и могут найти применение, в частности, для наружного или системного лечения дерматологических заболеваний, связанных с нарушением процесса кератинизации, дерматологических (или других) заболеваний с воспалительной или иммунноаллергической компонентой, и дермических или эпидермических пролифераций, как доброкачественных, так и злокачественных. Кроме того,эти соединения могут быть использованы для лечения заболеваний, связанных с дегенерацией соединительных тканей, для борьбы со старением кожи, как в результате воздействия света, так и возрастных факторов, а также для лечения нарушений процесса рубцевания. Кроме того,они могут найти применение в офтальмологии,в частности, для лечения корнеопатий. Можно также использовать предложенные соединения в косметических композициях для ухода за кожей и волосами. Соединения согласно изобретению соответствуют следующей общей формуле (I):(III) радикалом -CO-R6 где R5 и R6 имеют значения, приведенные ниже,Аr является радикалом, выбираемым из радикалов формул (а)-(е)(I) атомом водорода,(II) алкилом, имеющим, по крайней мере, 3 атома углерода, из которых углерод, соединенный с фенильным радикалом, по крайней мере,замещен двумя атомами углерода,(III) радикалом - OR5, (IV) радикалом -SR5,где R5 имеет значение, приведенное ниже,при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,при этом R2 и R3 не могут одновременно иметь вышеуказанные значения (I), (III) и (IV),R4 и R7, одинаковые или различные, являются атомом водорода, галогена, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, радикалом -OR5,R5 является водородом, низшим алкилом или радикалом -COR10,где R10 имеет значения, определенные ниже,R6 является: где R' и R" имеют значения, определенные ниже, (г) радикалом -ОR11, где R11 имеет значение,определенное ниже,R8 и R9, одинаковые или различные, являются водородом или низшим алкилом,R10 является низшим алкилом,R11 является водородом, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом, моно- или полигидроксиалкилом, арилом или аралкилом, который(ые) могут быть замещены, или остатком сахара, или остатком аминокислоты или пептида,R' и R", одинаковые или различные, являются водородом, низшим алкилом, моно- или полигидроксиалкилом, арилом, который может быть замещен, или остатком аминокислоты или сахара, или вместе образуют гетероцикл. Изобретение касается также солей соединений формул (I), когда R1 является функцией карбоновой кислоты, а также геометрических или оптических изомеров вышеуказанных соединений формулы (I). Если соединения согласно изобретению находятся в виде солей, то речь идет, предпочтительно, о солях щелочного или щелочноземельного металла, или цинка или органического амина. Согласно изобретению, под низшим алкилом подразумевается радикал, имеющий 1-12, 3 предпочтительно, 1-9 атомов углерода, предпочтительно, метил, этил, пропил, изопропил,бутил, трет-бутил, пентил, гексил, гептил,нонил, децил и додецил. Под линейным алкилом, имеющим 1-20 атомов углерода подразумевается, в частности,метил, этил, пропил, пентил, гексил, октил, децил, додецил, гексадецил и октадецил. Под разветвленным алкилом, имеющим 120 атомов углерода, подразумевается, в частности, 2-этилгексил, 2-метилбутил, 2-метилпентил, 1-метилгексил, 3-метилгептил. Среди алкилов, имеющих, по крайней мере, 3 атома углерода, где связанный с фенильным радикалом углерод, по крайней мере, замещен двумя атомами углерода, можно привести третбутил, изопропил, 1,1-диметилгексил и 1,1-диметилдецил. Предпочтительно, эти радикалы имеют не более 20 атомов углерода, наиболее предпочтительно, не более 12 атомов углерода. Предпочтительно, радикал (II) является третбутилом. Среди моногидроксиалкилов предпочтителен радикал, имеющий 2 или 3 атома углерода, в частности, 2-гидроксиэтил, 2-гидроксипропил или 3-гидроксипропил. Среди полигидроксиалкилов предпочтителен радикал, имеющий 3-6 атомов углерода и 25 гидроксигрупп, такие как 2,3-дигидроксипропил, 2,3,4-тригидроксибутил, 2,3,4,5-тетрагидроксипентил или остаток пентаэритритола. Среди арилов предпочтителен фенил, при необходимости, замещенный, по крайней мере,атомом галогена, гидроксила или нитрофункцией. Среди аралкилов предпочтителен бензил или фенэтил, который может быть замещен, по крайней мере, одним галогеном, одним гидроксилом или одной нитрофункцией. Среди алкенилов предпочтителен- радикал, содержащий 25 атомов углерода и имеющий одну или несколько этиленненасыщенных связей, такой как,в частности, аллил. Под остатком сахара подразумевается остаток, в частности, глюкозы, галактозы, или маннозы, а также глюкуроновой кислоты. Под аминокислотным остатком подразумевается, в частности, остаток лизина, глицина или аспарагиновой кислоты, а под пептидным остатком подразумевается, в частности, дипептидный или трипептидный остаток, представляющий собой результат комбинации аминокислот. Под гетероциклом подразумевается, предпочтительно, пиперидино-морфолино-, пирролидино- или пиперазино-радикал, который может быть замещен в положении 4 алкилом C1C6, или моно- или полигидроксиалкилом, описанными выше. Если R4 и R7 являются галогеном, последний, предпочтительно, является фтором, бромом или хлором. 4 Среди соединений формулы (I) в рамках настоящего изобретения можно назвать, в частности, следующие:-3-(4,4,7-триметилтиохроман-6-ил)фенилакриловая кислота,-N-этил-3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил) фенилакриламид,-N-4(гидроксифенил)-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриламид,-морфолид 3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилакриловой кислоты,-3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилэтилакрилат,-3-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенил]бут-2-еновая кислота,-4-метоксиметокси-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидpo-N-нафтил)фенилакриловая кислота,-4-гидрокси-3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,-4-метокси-3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилакриловая кислота,-4-пропилокси-3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,-4-гептилокси-3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота,-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенил акролеин,3-[3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенил]проп-2-ен-1-ол,-цис-3-[3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенил]бут-2-еновая кислота,-цис-3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил) фенилакриловая кислота,-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-3-пиридинакриловая кислота,-3-(3-бутил-5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил) фенилакриловая кислота,-6-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-пиридинакриловая кислота. Согласно изобретению, наиболее предпочтительными соединениями формулы (I) являются те, для которых выполняется, по крайней мере, одно и, предпочтительно, все следующие условия:- R1 является радикалом -CO-R6,- Аr является радикалами формулы (а) или- R2 и R3 вместе, образуют с прилегающим ароматическим циклом, цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы. Настоящее изобретение относится также к способам получения соединений формулы (I), в 6 частности, согласно реакционной схеме, приведенной на рис. 1. Так, производные формулы (1 а) могут быть получены (рис. 1), исходя из альдегидных или кетоновых соединений (5) по реакции типаHorner с литиевым или натриевым производным фосфаната (7). Карбонильные соединения (5) могут быть получены:- либо реакцией сочетания между бороновой кислотой (3) и галогенсодержащим производным (4). Эту реакцию осуществляют в присутствии палладиевого катализатора, например,тетракис(трифенилфосфин)палладий, в условиях, описанных N.Miyaura et al. Synthetic Communications (1981) 11(7), 513-519. Производное бороновой кислоты может быть получено, например, исходя из галогенпроизводного (1) путем преобразования в литиевое производное (2),затем путем взаимодействия с триметилборатом и гидролиза;- либо реакцией сочетания между производным цинка (8) и галогенсодержащим производным сложного эфира (9) в присутствии катализатора, например, производного палладия или никеля (NiCl2/DOPE), затем преобразованием эфирной функции (10) в спиртовую (11) и окислением в альдегид (5). Соединения формулы (1b) могут быть получены (рис. 1) из производного ацетилена (6) путем реакции с н-бутиллитием, затем карбоксилированием в присутствии СО 2. Ацетиленовые соединения (6) могут быть получены:- исходя из альдегидных производных (5)- исходя из кетонных производных (5) (гдеR8 является низшим алкилом) путем последовательно проведенных реакций, включающих обработку основанием, таким как диизопропиламидид лития, затем диалкилфосфатхлоридом и снова диизопропиламидидом лития. Когда R1 является радикалом -СООН, то соединения получают путем защиты R1 защитной группой типа алкила, аллила, бензила или трет-бутила. Переход к свободной форме может осуществляться:- при алкильной защитной группе - с помощью едкого натра или гидроксида лития в спиртовом растворителе, таком как метанол,или в ТГФ;- при аллильной защитной группе - с помощью катализатора, такого как некоторые комплексы переходных металлов, в присутствии вторичного амина, такого как морфолин;- при бензильной защитной группе - путем дебензилирования в присутствии водорода с 7 помощью катализатора, такого как палладий на угле;- при защитной группе типа третбутиловой - с помощью триметилсилилиодида. Объектом настоящего изобретения являются также соединения вышеописанной формулы (I в качестве лекарственного средства. Некоторые из этих соединений показали активность в тесте, который состоит в идентификации молекул-агонистов рецепторов RXR и описан в заявке на патент Франции 95-07301,поданной 19 июня 1995 заявителем. Этот тест включает следующие этапы:(I) наносят на участок кожи млекопитающего достаточное количество соединения, являющегося активным лигандом, по крайней мере, одного рецептора суперкласса стероидных/тироидных рецепторов, отличающегося от специфического лиганда рецепторов RXR и могущего гетеродимеризоваться с RXR такого как молекула агонист рецепторов RAR,(II) вводят системно или наносят на этот же участок кожи млекопитающего, до или после этапа (I) молекулу, которая имеет агонистическую активность к RXR и(III) оценивают ответную реакцию обработанного таким образом участка кожи млекопитающего. Таким образом ответная реакция при наружном нанесении на ухо млекопитающего молекулы агониста RAR, которая соответствует утолщению этого уха, может быть повышена путем системного или наружного применения молекулы агониста RXR. Некоторые из соединений согласно изобретению имеют также активность в тесте на дифференциацию клеток(Cancer Research 43, р. 5268, 1983) и/или в тесте ингибирования орнитиндекарбоксилазы после наведения с помощью ТРА у мыши (Cancer Research 38, р. 793-801, 1978). Эти тесты выявляют активность этих соединений в области дифференциации и пролиферации клеток. Соединения согласно изобретению особенно подходят для следующих областей медицины: 1) для лечения дерматологических заболеваний, связанных с нарушением кератинизации,обусловленной дифференциацией и пролиферацией, в частности, для лечения акне обыкновенного, юношеского, полиморфного, розового,кистозного, шаровидного, старческого, а также вторичных акне, например, вызванных солнечным или медикаментозным воздействием, или имеющих профессиональный характер,2) для лечения других типов нарушений кератинизации, в частности, ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонноподошвенные кератодермии, лейкоплакии и лейкоплакиеподобные состояния, кожный лишай или лишай слизистой (полости рта). 3) для лечения других дерматологических заболеваний, связанных с нарушением керати 001216 8 низации, имеющих воспалительную и/или иммуноаллергическую компоненту и, в частности,любых форм псориаза, кожи, слизистой или ногтей, и псориатического артрита, или кожной атопии, такой как экзема, или респиратурной атопии, а также гипертрофию десен; соединения могут быть также использованы для лечения некоторых воспалительных процессов, не связанных с нарушением кератинизации,4) для лечения дермических или эпидермических пролифераций, как доброкачественных, так и злокачественных, вирусного или невирусного происхождения, например, обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации, которые могут быть вызваны ультрафиолетовыми лучами, в частности базоцеллюлярные и спиноцеллюлярные эпителиомы,5) для лечения других дерматологических расстройств, таких как пузырчатый дерматоз и коллагеноз,6) для лечения некоторых офтальмологических заболеваний, в частности корнеопатий,7) для восстановления или борьбы со старением кожи, как возрастным, так и в результате воздействия света, а также для уменьшения пигментации и белковых кератозов, или любых патологий, связанных с возрастным или белковым старением,8) для профилактики или лечения признаков эпидермической и/или дермической атрофии, вызванной наружными или системными кортикостероидами, или других форм кожной атрофии,9) для профилактики или лечения нарушений процесса рубцевания или для заживления рубцов,10) для лечения нарушений функции сальных желез, например гиперсеборея акне или простая себорея,11) при лечении и профилактики раковых или предраковых состояний,12) при лечении некоторых воспалительных процессов, таких как артрит,13) при лечении любых вирусных общих или кожных заболеваний, например синдром Капоши,14) при профилактике или лечении облысения. 15) при лечении дерматологических или общих заболеваний с иммунологической компонентой,16) при лечении заболеваний сердечнососудистой системы, таких как артериосклероз или гипертония, а также инсулино независимый диабет,17) при лечении кожных заболеваний, вызванных ультрафиолетовым облучением. В вышеупомянутых областях медицины соединения согласно изобретению могут с успехом применяться в сочетании с другими соеди 9 нениями, имеющими ретиноидную активность,с витаминами группы Д и их производными, с кортикостероидами, с агентами, подавляющими свободные радикалы, с -гидрокси и -кето кислотами и их производными, или же с блокаторами ионных каналов. Под витаминами группы Д и их производными подразумеваются, например, производные витамина Д 2 или Д 3 и, в частности, 1,25-дигидрокси-витамин Д 3. Под агентами, подавляющими свободные радикалы,подразумеваются, например -токоферол, Супер Оксид Дисмутат, Убехинол или некоторые агенты образования халатного элементоорганического соединения металлов. Под -гидрокси или -кето кислотами или их производными подразумеваются, например, молочная, яблочная, лимонная, гликолевая, миндальная, винная,глицериновая или аскорбиновая кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов подразумеваются,например, Миноксидил (2,4-диамино-6-пиперидино-пиримидин-3-оксид) или его производные. Объектом настоящего изобретения являются также фармацевтические композиции, содержащие, по крайней мере, одно соединение формулы (I), или один из его оптических или геометрических изомеров или одну из его солей в терапевтически эффективном количестве. Таким образом, объектом настоящего изобретения является фармацевтическая композиция, предназначенная, в частности, для лечения вышеописанных заболеваний, которая отличается тем, что содержит в фармацевтически приемлемом и совместимом со способом введения этой композиции носителе, по крайней мере,одно из соединений формулы (I), один из его оптических или геометрических изомеров или одну из его солей. Композиции по изобретению предназначены для энтерального, парентерального, наружного и офтальмологического применения. Препараты для энтерального введения могут быть представлены в виде таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, микросфер или наносфер, или липидных или полимерных везикул, обеспечивающих контролируемое высвобождение активного начала. Композиции для парентерального введения могут находиться в виде растворов или суспензий для перфузии или для инъекций. Соединения согласно изобретению, как правило, вводятся в дневных дозах приблизительно от 0,01 мг/кг до 100 мг/кг на массу тела,из расчета 1-3 раза в день. Фармацевтические композиции на основе соединений согласно изобретению для наружного применения предназначены в частности,для лечения кожи и слизистых и могут находиться в виде мазей, кремов, молочка, порошка,пропитанных тампонов, растворов, гелей, спре 001216 10 ев, лосьонов или суспензий. Они могут находиться также в виде микросфер или наносфер или липидных или полимерных везикул или полимерных пластырей и гидрогелей, обеспечивающих контролируемое высвобождение. Эти композиции для наружного применения могут также находиться либо в безводной, либо в водной форме, в зависимости от клинического назначения. Для офтальмологического применения композиции, как правило, представлены в виде примочек. Композиции для наружного или офтальмологического применения содержат, по крайней мере, одно соединение формулы (I), или один из его оптических или геометрических изомеров, или одну из его солей в концентрации, предпочтительно, от 0,001 до 5 мас.% от общей массы композиции. Соединения формулы 1 по изобретению могут найти также применение в косметике, в частности, для гигиены тела и волос и, особенно, для лечения кожи с тенденцией к акне, для роста и против выпадения волос, для лечения жирной кожи и волос; для защиты от негативных воздействий солнечных лучей или для лечения физиологически сухой кожи, для профилактики и/или борьбы со старением кожи в результате воздействия солнечного света или возрастных факторов. В косметологии соединения согласно изобретению, целесообразно применять в сочетании с другими соединениями, имеющими активность типа ретиноидной активности, с витаминами группы Д и их производными, с кортикостероидами, с агентами, подавляющими свободные радикалы с -гидрокси и -кетокислотами и их производными, или же с блокаторами ионных каналов, описанными выше. Настоящее изобретение касается также косметической композиции, которая отличается тем, что содержит, в косметически приемлемом и подходящем для наружного назначения носителе, по крайней мере, одно соединение формулы (I), или один из его оптических или геометрических изомеров, или одну из его солей, причем эта косметическая композиция может быть,в частности, представлена в виде крема, молочка, лосьона, геля, микро- или наносфер, или липидных или полимерных везикул, мыла или шампуня. Концентрация соединения формулы (I) в косметических композициях по изобретению,предпочтительно, составляет от 0,001 до 3 масс.% от общей массы композиции. Фармацевтические или косметические композиции согласно изобретению могут, кроме того, содержать инертные, фармакодинамически или косметически активные добавки или комбинации этих добавок и, в частности: смачиватели, депигментирующие агенты, такие как гидрохинон, азелаиновая, кафеиновая или койевая 11 кислоты; мягчители; гидратанты, такие как глицерин PEG 400, тиаморфолин и его производные или мочевина; противосеборейные или антиугревые агенты, такие как S-карбоксиметилцистеин, S-бензилцистеамин, их соли или их производные, или бензоилпероксид; антибиотики, такие как эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины; противогрибковые агенты,такие как кетоконазол или 4,5-полиметилен 3-изотиазолидоны; агенты, способствующие росту волос, такие как миноксидил (2,4 диамино-6-пиперидино-пиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил 1,2,4-бензотиадиазин-1,1-диоксид) и фенитоин(5,4-дифенил-имидазолидин-2,4-дион); нестероидные противовоспалительные агенты; каротеноиды и, в частности, -каротин; противопсориазные агенты, такие как антаралин и его производные; и наконец, эйкоза-5,8,11,14 тетраинойная и эйкоза-5,8,11-тринойная кислоты, их сложные эфиры и амиды. Композиции согласно изобретению могут также содержать вкусовые добавки, консерванты, такие как сложные эфиры парагидроксибензойной кислоты, стабилизаторы, регуляторы влажности, регуляторы рН, модификаторы осмотического давления, эмульгаторы, УФ-А и УФ-В фильтры, антиоксиданты, такие как токоферол, бутилгидроксианизол или бутилгидрокситолуол. В качестве иллюстрации даны неограничивающие примеры получения активных соединений формулы (I), а также конкретные композиции на основе этих соединений. В приведенных выше и ниже примерах концентрации даны в мас.%, если не оговорено иного. Пример 1. 5-(3-Трет-бутил-4-метоксифенил)-2-тиофенакриловая кислота. а) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофен-метилкарбоксилат. В суспензию 300 мг (12 ммолей) магния в 10 мл ТГФ прикапывают раствор 2 г (8,2 ммолей) 3-трет-бутил-4-метоксибромбензола. По окончании прикапывания, нагревают с обратным холодильником в течение часа. При комнатной температуре добавляют 1,35 г (9,9 ммолей) безводного хлорида цинка и перешивают в течение часа. Затем добавляют последовательно 1,2 г (5,5 ммолей) 5-бром-2-тиофен-метилкарбоксилата и 60 мг (0,12 ммоля) комплекса NiCl2/DPPE и перемешивают при комнатной температуре в течение 12 ч. Реакционную среду выливают в ледяную воду, экстрагируют этиловым эфиром, декантируют органическую фазу, сушат на сульфате магния и выпаривают. Полученный остаток хроматографируют на колонке из двуокиси кремния, элюируя смесью гексана и дихлорметана (50/50 объемных %). После выпаривания растворителей, получают 1,56 г (93%) 12 целевого метилового сложного эфира с температурой плавления 94-95 С. б) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофенметанол. В трехгорлую колбу в потоке азота вводят 1,5 г (5 ммолей) полученного выше метилового сложного эфира и 50 мл безводного ТГФ. Добавляют 280 мг (7,4 ммоля) двойного гидрида лития и алюминия и нагревают с обратным холодильником в течение 4 ч. Гидролизуют раствором двойного тартрата натрия и калия, отфильтровывают соль, выпаривают фильтрат. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя смесью дихлорметана и гексана (70/30 объемных(в) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофенкарбоксальдегид. В колбу вводят 7,15 г (19 ммолей) дихроматпиридиния и 350 мл дихлорметана. При 0 С прикапывают раствор 3,9 г (14 ммолей) 5-(3 трет-бутил-4-метоксифенил)-2-тиофененметанола в 50 мл дихлорметана и перемешивают при комнатной температуре в течение двух часов. Реакционную среду фильтруют на двуокиси кремния, после выпаривания получают 3,26 г(г) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофен-этилакрилат. В трехгорлую колбу в потоке азота вводят 200 мг (6,6 ммолей) гидрида натрия (80%-ая эмульсия в масле) и 50 мл диметоксиэтана и прикапывают раствор 1,3 мл (6,6 ммолей) триэтилфосфонацетата в 10 мл диметоксиэтана. Перемешивают при комнатной температуре в течение часа, затем при 0 С прикапывают раствор 1,5 г (5,5 ммолей) 5-(3-трет-бутил-4 метоксифенил)-2-тиофенкарбоксальдегида в 200 мл диметоксиэтана. Перемешивают при комнатной температуре в течение 4 ч, реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя смесью дихлорметана и гексана (30/70 объемных %),получают 1,88 г (100%) целевого сложного этилового эфира в виде коричневого масла. д) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофенакриловая кислота. В колбу вводят 1,88 г (5,4 ммоля) вышеполученного этилового эфира, 20 мл метанола и 1,88 г (47 ммолей) гидроксида натрия и нагревают с обратным холодильником в течение 4 ч. Реакционную среду выпаривают досуха, извлекают подкисленной до рН 1 водой, отфильтровывают твердый остаток и сушат.Твердый остаток перекристаллизовывают в этаноле, отфильтровывают и сушат. Получают 1,09 г (63%) 5-(3 13 трет-бутил-4-метоксифенил)-2-тиофенакриловой кислоты с температурой плавления 218219 С. Пример 2. 5-(3-Трет-бутил-4-метоксифенил)-2-тиофенпропиоловая кислота.(13 ммолей) трифенилфосфина и 850 мг (13 ммолей) порошка цинка и перемешивают при комнатной температуре в течение 2 ч. Реакционную среду выпаривают и полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя дихлорметаном. Получают 2,5 г (89%) целевого продукта.(б) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофенацетилен. В трехгорлую колбу в потоке азота вводят 2,48 г (5,7 ммолей) 2'-2'-дибром-5-(3-трет-бутил 4-метоксифенил)-2-тиофенэтилена и 40 мл ТГФ. При -78 С прикапывают 5,1 мл (12,7 ммолей) раствора н-бутиллития (2,5 М раствор в гексане) и повышают температуру до комнатной в течение часа. Реакционную среду выливают в воду,экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния,выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя гептаном. Получают 1,4 г (71%) целевого ацетиленового производного в виде желтого масла.(в) 5-(3-Трет-бутил-4-метоксифенил)-2 тиофенпропиоловая кислота. В трехгорлую колбу в потоке азота вводят 1,1 г (4 ммоля) вышеполученного производного ацетилена и 20 мл ТГФ. При -78 С прикапывают 1,95 мл (4,9 ммолей) раствора н-бутиллития(2,5 М раствор в гексане) и перемешивают в течение 30 мин. При -78 С пропускают поток СО 2 в течение 15 мин и повышают температуру до комнатной. Реакционную среду выливают в водный раствор хлорида аммония, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя дихлорметаном. После выпаривания растворителей получают 300 мг (23%) 5-(3-трет-бутил-4 метоксифенил)-2-тиофенпропиоловой кислоты с температурой плавления 124-126 С. Пример 3. 2-(3-Трет-бутил-4-метоксифенил)-4-тиофенакриловая кислота.(а) 3-трет-бутил-4-метоксифенилбороновая кислота. В трехгорлую колбу в потоке азота вводят 4 г (16,5 ммолей) 3-трет-бутил-4-метоксибромбензола и 50 мл ТГФ. При -78 С прикапывают 7,9 мл (19,8 ммолей) н-бутиллития (2,5 М 14 раствор в гексане) и перемешивают в течение 15 мин, при этой же температуре добавляют 5,6 мл(49,5 ммолей) триметилбората и перемешивают в течение 2 ч. При -50 С добавляют 20 мл хлористоводородной кислоты (1N) и повышают температуру до комнатной. Реакционную среду экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния,выпаривают. Получают 3,79 мг (100%) целевой бороновой кислоты, которая используется на последующем этапе синтеза.(б) 2-(3-Трет-бутил-4-метоксифенил)-4 тиофен-этилкарбоксилат. В трехгорлую колбу в потоке азота вводят 260 мг (0,5 ммоля) тетракис(трифенилфосфин) палладия(О), 50 мл толуола и 2,59 г (10,9 ммоля) 2-бром-4-тиофен-этилкарбоксилата и перемешивают при комнатной температуре в течение 20 мин. Затем добавляют 3,7 г (16,5 ммолей) 3-трет-бутил-4-метоксифенилбороновой кислоты, 11 мл водного раствора карбоната натрия(2N) и нагревают с обратным холодильником в течение 8 ч. Реакционную среду выпаривают досуха, извлекают водой и этиловым эфиром,органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя этилацетатом и гептаном (10/90 об %). Получают 3,53 мг (69%) 2(3-трет-бутил-4-метоксифенил)-4-тиофенэтилкарбоксилата.(4,7 ммолей) 2-(3-трет-бутил-4 метоксифенил)-4-тиофен-карбоксальдегида с 1,28 г (5,7 ммолей) триэтилфосфонацетата получают 1,1 г (67%) целевого этилового эфира с температурой плавления 119-120 С.(3,2 ммолей) ранее полученного этилового эфира, получают 750 мг (74 %) 2-(3-трет-бутил-4 метоксифенил)-4-тиофенакриловой кислоты с температурой плавления 197-198 С. Пример 4. 4-(3-Трет-бутил-4-метоксифенил)-2-тиофенакриловая кислота.(б) 4-(3-Трет-бутил-4-метоксифенил)-2 тиофен-этилакрилат. Аналогично примеру 1(г), путем реакции 1,2 г (4,3 ммоля) 4-(3-трет-бутил-4-метоксифенил)-2-тиофенкарбоксальдегида с 1,17 г (5,2 ммолей) триэтилфосфонацетата, получают 1,55 г (100%) целевого этилового эфира в виде масла.(4,5 ммолей) ранее полученного этилового эфира получают 1,14 г (88%) 4-(3-трет-бутил-4 метоксифенил)-2-тиофенакриловой кислоты с температурой плавления 206-207 С. Пример 5. 5-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил)-2-тиофенакриловая кислота(5,2 ммолей) полученного выше этилового эфира получают 1,79 г (96%) 5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2 тиофенакриловой кислоты с температурой плавления 175177 С. Пример 6. 4-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил)-2-тиофенакриловая кислота.(7,1 ммолей) полученного выше этилового эфира получают 2,5 г (98%) 4-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)-2-тио-фенакриловой кислоты с температурой плавления 215220 С. Пример 7. 4-(5,6,7,8-Тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-тиофенакриловая кислота.(12,3 ммолей) 4-бром-2-тиофенкарбоксальдегида получают 2,3 мг (63%) целевого альдегида производного с температурой плавления 84-85 С.(в) 4-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2-тиофен-этилакрилат. Аналогично примеру 1(г) путем реакции 2,28 г (8,3 ммолей) (5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-тиофенкарбоксальдегида с 2 мл (9,9 ммолей) триэтилфосфон-ацетата получают 810 мг (26%) целевого этилового эфира с температурой плавления 82-84 С.(4,5 ммолей) полученного выше ацетиленового производного получают 800 мг (51%) 5(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2-тиофенпропиоловой кислоты с температурой плавления 138-140 С. Пример 9. 3-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилпропиоловая кислота.(а) 3,5,5,8,8-Пентаметил-5,6,7,8-тетрагидро-2-нафтилбороновая кислота. В 2-х литровый реактор в потоке азота вводят 100 г (0,356 моля) 2-бром-3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафталина и 1 л ТГФ и охлаждают до -60 С. Прикапывают 157 мл (0,392 моля) н-бутиллития (2,5 М раствор в гексане) и перемешивают в течение часа. При-35 С добавляют 500 мл хлористоводородной кислоты (1N) и поднимают температуру до комнатной. Реакционную среду экстрагируют этилацетатом, органическую фазу декантируют,дважды промывают в 500 мл хлористоводородной кислоты (IN), сушат на сульфате магния,выпаривают. Получают 83 г (95%) целевой бороновой кислоты(б) 3-(3,5,5,8,8-Пентаметил-5,6,7,8-тетрагидро-2-нафтил)бензальдегид. В трехгорлую колбу в потоке азота вводят 700 мл ДМЕ, 2,4 г (2 ммолей) тетракис(трифенилфосфин)палладия(О), 8,44 г (45,6 ммолей) 3-бромбензальдегида и перемешивают 10 мин. Затем добавляют раствор 17 г (69,1 ммолей) 3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтилбороновой кислоты в 25 мл этанола, затем 46 мл (91 ммоль) раствора карбоната калия (2 М) и нагревают с обратным холодильником в течение 4 ч. Реакционную среду охлаждают, отфильтровывают твердый остаток,промывают бикарбонатной водой, затем этилацетатом. Полученный твердый остаток перекристаллизовывают в этаноле, получают 7 г(6,5 ммолей) вышеполученного альдегида получают 1,96 г (65%) целевого продукта в виде бесцветного масла.(4,23 ммолей) 2'-2'-дибром-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилэтилена получают 1,29 г (99%) целевого ацетиленового производного в виде светло-желтого масла.(3,9 ммолей) полученного выше ацетиленового производного получают 900 мг (67%) 3(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилпропиоловой кислоты с температурой плавления 180-181 С. Пример 10. N-метил-4-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-2-пирролакриловая кислота.(б) N-метил-4-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-пирролкарбоксальдегид. В трехгорлую колбу в потоке азота вводят 1,3 г (4,6 ммоля) 4-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-пирролкарбоксальдегида и 50 мл ТГФ. Добавляют небольшими порциями 300 мг (10 ммолей) гидрида натрия (80%ая эмульсия в масле) и перемешивают до прекращения газовыделения. Затем добавляют 640 мкл (10 ммолей) иодметана и перемешивают при комнатной температуре в течение часа. Реакционную среду выливают в воду, экстрагируют этилацетатом, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя смесью дихлорметана и гептана (70-30). После выпаривания растворителей получают 600 мг(в) N-метил-4-(5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-пирролэтилакрилат. Аналогично примеру 1(г) путем реакции 480 мг (1,3 ммолей) N-метил-4-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2 пирролкарбоксальдегида с 400 мкл (152 ммолей) триэтилфосфонацетата получают 350 мг целевого этилового эфира в виде масла. 19 Аналогично примеру 1(д), исходя из 350 мг (0,94 ммоля) выше полученного этилового эфира получают 170 г (23%) N -метил-4-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)-2 пирролакриловой кислоты с температурой плавления 185-186 С. Пример 11. 3-(5,6,7,8-Тетрагидро-5,5,8,8 тетраметил-2-нафтил)-2-фенилакриловая кислота(б) 3-(5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилэтилакрилат. Аналогично примеру 1(г) путем реакции 800 мг (2,7 ммолей) 3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил) фенилкарбоксальдегида с 650 мл (3,3 ммоля) триэтилфосфонацетата получают 900 мг (91%) целевого этилового эфира в виде бесцветного масла.(2,7 ммоля) выше полученного этилового эфира получают 380 мг (41%) 3-(5,6,7,8-тетрагидро 5,5,8,8-тетраметил-2-нафтил)-2-фенилакриловой кислоты с температурой плавления 210-211 С. Пример 12. N-Метил-4-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2 пирролакриловая кислота.(в) N-метил-4-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)-2-пирролэтилакрилат. Аналогично примеру 1(г) путем реакции 1,85 г (6 ммолей) N-метил-4-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2 пиррол-карбоксальдегида с 1,4 мл (7,2 ммолей) триэтилфосфонацетата получают 2,1 г (92%) целевого этилового эфира в виде оранжевого масла. 20 Аналогично примеру 1(д) из 2 г (5,3 ммоля) выше полученного этилового эфира получают 730 мг (39,5%) N-метил-4-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)-2 пирролакриловой кислоты с температурой плавления 185186 С. Пример 13. 4-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил)-2-пирролакриловая кислота.(0,20 моля) 4-бромфенилакриловой кислоты получают после перекристаллизации в этаноле 48 г (61%) 3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилакриловой кислоты с температурой плавления 207-208 С. Пример 15. 3-(5,6,7,8-Тетрагидро-5,5,8,8 тетраметил-2-нафтил)фенилпропиоловая кислота.(б) 3-(5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилпропиоловая кислота. В трехгорлую колбу в потоке азота вводят 900 мг (2 ммоля) 2'-2'-дибром-3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил) фенилэтилена и 40 мл ТГФ. При -50 С прикапывают 2,2 мл (5,2 ммолей) раствора н-бутиллития(2,5 М раствора в гексане) и повышают темпера 21 туру до комнатной. При 0 С вводят СО 2 в течение 20 мин и перемешивают при комнатной температуре в течение часа. Реакционную среду выливают в насыщенный раствор хлорида аммония, подкисляют до рН 1 хлористоводородной кислотой, экстрагируют этилацетатом, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя смесью дихлорметана и метанола (95-5). После выпаривания растворителей получают 80 мг (12%) 3-(5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2 нафтил)фенилпропиоловой кислоты с температурой плавления 164-165 С. Пример 16. 2-Метокси-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота.(в) 2-Метокси-5-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилэтилакрилат. Аналогично примеру 1(г) путем реакции 1,65 г (5 ммолей) 2-метокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)бензальдегида с 1,68 г (7,5 ммолей) триэтилфосфонацетата получают 1,7 г (83%) целевого этилового эфира в виде масла.(3,9 ммоля) полученного выше этилового эфира получают 1,4 г (93%) 2-метокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты с температурой плавления 181-182 С. Пример 17. 2-Пропилокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота.(б) 2-Пропилокси-5-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилэтилакрилат. Аналогично примеру 1(г) путем реакции 2,18 г (6 ммолей) 2-пропилокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил) бензальдегида с 2,03 г (9 ммолей) триэтилфосфонацетата получают 2,13 г (82%) целевого этилового эфира в виде желтого масла.(4,8 ммоля) полученного выше этилового эфира получают 1,68 г (86%) 2-пропилокси-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенилакриловой кислоты с температурой плавления 125-126 С. Пример 18. 2-Гептилокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота.(б) 2-Гептилокси-5-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилэтилакрилат. Аналогично примеру 1(г) путем реакции 1,78 г (4,2 ммолей) 2-гептилокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)бензальдегида с 1,44 г (6,3 ммоля) триэтилфосфонацетата получают 1,89 г (90%) целевого этилового эфира в виде желтого масла.(3,9 ммоля) полученного выше этилового эфира получают 1,2 г (67%) 2-гептилокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты с температурой плавления 137-138 С. Пример 19. 2-Метоксиметокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота. 23 Аналогично примеру 1(г) путем реакции 3,4 г (9,3 ммолей) 2-метоксиметокси-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил) бензальдегида с 4,16 г (18,6 ммолей) триэтилфосфонацетата получают 3,5 г (86%) целевого этилового эфира с температурой плавления 100101 С.(3,5 ммоля) полученного выше этилового эфира получают 1,2 г (86%) 2-метоксиметокси-5(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2 нафтил)фенилакриловой кислоты с температурой плавления 191-192 С. Пример 20. 2-Гидрокси-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловая кислота.(а) 2-Гидрокси-5-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилметилакрилат. В колбу вводят 1,9 г (4,35 ммоля) 2 метоксиметокси-5-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилакриловой кислоты,20 мл метанола и 30 мл ТГФ. Добавляют 2,8 мл концентрированной серной кислоты и перемешивают при комнатной температуре в течение 12 ч. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, декантируют органическую фазу, промывают водой, сушат на сульфате магния, выпаривают. Получают 1,63 г(4,25 ммоля) полученного выше этилового эфира получают 1,3 г (85%) 2-гидрокси-5-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты с температурой плавления 204-205 С. Пример 21. 3-(3-Метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловая кислота.(а) 3-Бром-2-метокси-5,6,7,8-тетрагидро 5,5,8,8-тетраметилнафталин. В трехгорлую колбу в потоке азота вводят 7 г (24,7 ммоля) 3-бром-2-гидрокси-5,6,7,8 тетрагидро-5,5,8,8-тетраметилнафталина и 40 мл ДМФ. Небольшими порциями добавляют 890 мг(29,6 ммолей) гидрида натрия (80%-ая эмульсия в масле) и перемешивают до прекращения газовыделения. Затем добавляют 1,7 мл (27 ммолей) иодометана и перемешивают при комнатной температуре в течение часа. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Получают 7,3 г(99%) целевого продукта в виде медленно кристаллизующегося масла. Температура плавления 77-78 С.(22,5 ммолей) 3-бром-2-метокси-5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталина получают 4,54 г (77%) целевой бороновой кислоты с температурой плавления 151-152 С.(б) 2-Пропилокси-5,6,7,8-тетрагидро-5,5,8,8 тетраметилнафтанилбороновая кислота. Аналогично примеру 3(а) путем реакции 8 г (24,6 ммолей) 3-бром-2-пропилокси-5,6,7,8 тетрагидро-5,5,8,8-тетраметилнафталина получают 5,7 г (80%) целевой бороновой кислоты с температурой плавления 138- 139 С.(26,2 ммолей) 3-бром-2-гептилокси-5,6,7,8 25 тетрагидро-5,5,8,8-тетраметилнафталина получают 6,1 г (67%) целевой бороновой кислоты с температурой плавления 102-103 С.(б) 2-Метоксиметокси-5,6,7,8-тетрагидро 5,5,8,8-тетраметилнафтилбороновая кислота. Аналогично примеру 3(а) путем реакции 8 г (24,4 ммолей) 3-бром-2-метоксиметокси 5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталина получают 5,5 г (77%) целевой бороновой кислоты с температурой плавления 133-134 С.(а) 3-(3-Гидрокси-5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)фенилметилакрилат. В колбу вводят 2 г (5 ммолей) 3-(3 метоксиметокси-5,6,7,8-тетрагидро-5,5,8,8 тетраметил-2-нафтил)фенилакриловой кислоты,10 мл метанола и 10 мл ТГФ. Добавляют 2,8 мл концентрированной серной кислоты и перемешивают при комнатной температуре. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, промывают водой, сушат на сульфате магния, выпаривают. Получают 1,80 г (98%) целевого метилового эфира с температурой плавления 182-183 С.(4,1 ммоля) выше полученного метилового эфира получают 1,3 г (90%) 3-(3-гидрокси-5,6,7,8 тетрагидро-5,5,8,8-тетраметил-2-нафтил)фенилакриловой кислоты с температурой плавления 244-245 С. Пример 26. 3-(4,4,7-Триметилтиохроман-6 ил)фенилакриловая кислота.(а) 1-Метил-3-(3-метилбут-2-енил)сульфанилбензол. В трехгорлую колбу вводят 5 г (40 ммолей) 3-метилтиофенола, 5,6 г (40 ммолей) карбоната калия и 50 мл ДМФ. Добавляют 7,2 г (48 ммолей) 3-метил-2-бутен-бромида и перемешивают при комнатной температуре в течение 4 ч. Реакционную среду выливают в воду, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Получают 7,8 г (100%) целевого продукта в виде желтого масла.(б) 4,4,7-Триметилтиохроман. В колбу вводят 7 г (36,4 ммолей) 1-метил 3-(3-метил-бут-2-енил)сульфанилбензола, 50 мл толуола и добавляют 10,4 г (54,6 ммолей) паратолуолсульфоновой кислоты. Нагревают с обратным холодильником в течение 4 ч. Реакционную среду выпаривают досуха, извлекают водой и этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Получают 6,8 г (197%) тиохромана в виде коричневого масла.(в) 6-Бром-4,4,7-триметилтиохроман. В трехгорлую колбу вводят 6,2 г (32,2 ммолей) 4,4,7-триметилтиохромана, 40 мл дихлорметана и 90 мг железного порошка. Добавляют 1,65 мл (32,2 ммоля) брома и перемешивают при комнатной температуре в течение двух часов. Реакционную среду выливают в раствор бикарбоната натрия, экстрагируют дихлорметаном, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя гептаном. Получают 5,9 г (67%) бромсодержащего производного в виде светло-желтого масла.(21,4 ммолей) 6-бром-4,4,7-триметилтиохромана получают 3,88 г (76%) целевой бороновой кислоты с температурой плавления 252-253 С.(д) 3-(4,4,7-Триметилтиохроман-6-ил)фенилакриловая кислота. Аналогично примеру 9(б) путем реакции 1,5 г (6,3 ммолей) 4,4,7-триметилтиохроманбороновой кислоты с 1,2 г (5,3 ммолей) 3 бромфенилакриловой кислоты получают 1,1 г(а) 3-(3,5,5,8,8-Пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакрилоилхлорид. В колбу вводят 3,5 г (10 ммолей) 3(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2 нафтил)фенилакриловой кислоты, 50 мл дихлорметана и добавляют 2 мл (10 ммолей) дициклогексиламина. Перемешивают при комнатной температуре 10 мин, затем вводят 729 мкл(10 ммолей) тионилхлорида и перемешивают 15 мин. Реакционную смесь выпаривают досуха,извлекают этиловым эфиром, отфильтровывают соль дициклогексиламина, выпаривают фильтрат. Получают 3,7 г (100%) хлорида неочищенной кислоты, который используется для дальнейшего синтеза.(б) N -этил-3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенилакриламид. В колбу вводят 20 мл ТГФ и добавляют 2,8 мл (35 ммолей) раствора этиламина (70%). Прикапывают раствор 1,2 г (3,2 ммоля) 3-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакрилоилхлорида в 40 мл ТГФ и перемешивают при комнатной температуре в течение часа. Реакционную смесь подкисляют хлористоводородной кислотой, экстрагируют этиловым эфиром, органическую фазу декантируют, сушат на сульфате магния, выпаривают. Полученный остаток очищают хроматографией на колонке из двуокиси кремния, элюируя дихлорметаном. После выпаривания растворителей получают 817 мл (68%) N -этил-3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакриламида с температурой плавления 158-159 С. Пример 28. N-(4-гидроксифенил)-3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриламид. Аналогично примеру 27(а) путем реакции 1,2 г (3,2 ммолей) 3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакрилоилхлорида с 349 мл (3,2 ммоля) 4-гидроксиани-лина получают 810 мг (57%) N-(4-гидроксифенил)-3(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2 нафтил)фенилакриламида с температурой плавления 240-241 С. Пример 29. Морфолид 3-(3,5,5,8,8-пентаметил-5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты. Аналогично примеру 27(а) путем реакции 1,3 г (3,4 ммоля) 3-(3,5,5,8,8-пентаметил-5,6,7,8 тетрагидро-2-нафтил) фенилакрилоилхлорида с 620 мкл (7,12 ммоля) морфолина получают 1,25 г (88%) морфолида 3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил)фенилакриловой кислоты с температурой плавления 158-159 С. Пример 30. 3-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил) фенилэтилакрилат.(б) 3-[3-(3,5,5,8,8-Пентаметил-5,6,7,8 тетрагидро-2-нафтил)фенил]бут-2-еноат этила. Аналогично примеру 1(г) путем реакции 3,7 г (11,5 ммолей) 3-(3,5,5,8,8-пентаметил 5,6,7,8-тетрагидро-2-нафтил) ацетофенона с 3,9 г (17,3 ммоля) триэтилфосфонацетата получают 2,67 г (60%) целевого этилового эфира в виде желтого масла.(6,4 ммолей) выше полученного этилового эфира получают 1,63 г (70%) 3-[3-(3,5,5,8,8 пентаметил-5,6,7,8-тетрагидро-2-нафтил) фенил]бут-2-еновой кислоты с температурой плавления 166-167 С. Пример 32. В этом примере проиллюстрированы различные конкретные композиции на основу соединений согласно изобретению. А - Для орального введения(б) Суспензия для питья в ампулах объемом 5 мл Соединение примера 3 0,001 г Глицерин 0,500 г 70%-ный Сорбитол 0,500 г Сахаринат натрия 0,010 г Парагидроксиметилбензоат 0,040 г Ароматическое вещество(Достаточное количество) Очищенная вода До 5 мл(в) таблетка 0,8 г Соединение примера 5 Крахмал предварительно желатинированный Микрокристаллическая целлюлоза Лактоза Стеарат магния(г) Суспензия для питья в ампулах объемом 10 мл Соединение примера 2 0,05 г Глицерин 1,000 г 70%-ый Сорбитол 1,000 г Сахаринат натрия 0,010 г Парагидроксиметилбензоат 0,080 г Ароматическое вещество(Достаточное количество) Очищенная вода До 10 мл Б - Для наружного применения(а) Мазь Соединение примера 21 0,20 г Изопропилмиристат 81,700 г Жидкое вазелиновое масло 9,100 г Двуокись кремния ("Aerosil 200 выпускаемый фирмой DEGUSSA) 9,180 г(б) Мазь Соединение примера 9 Вазелин белый codex(д) Гидрофобная мазь Соединение примера 25 Изопропилмиристат Силиконовое масло ("Rhodorsil 47v300 выпускаемое фирмойRHONE-POULENC) Пчелиный воск Силиконовое масло ("Abil 300,000cst"выпускаемое фирмой Стеарат PEG50 Масло сального дерева Пропиленгликоль Парагидроксиметилбензоат Парагидроксипропилбензоат Стерильная деминерализованная вода ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Биароматические соединения пропинила общей формулы (I)R5 и R6 имеют значения, приведенные ниже,Аr является радикалом, выбираемым из радикалов формул (а)-(е):(в) Неионный крем вода-в-масле Соединение примера 7 0,100 г Смесь эмульсионных ланолиновых спиртов ланолина, восков и масел(Eurocerine arhydre",выпускаемый фирмой BDF) 39,900 г Парагидроксиметилбензоат 0,075 г Парагидроксипропилбензоат 0,075 г Стерильная деминерализованная До 100 г вода(г) Лосьон Соединение примера 30 Полиэтиленгликоль ( PEG 400) 95% ЭтанолR2 и R3, одинаковые или различные, являются (I) атомом водорода; (II) алкилом, имеющим, по крайней мере, 3 атома углерода, из которых связанный с фенильным радикалом углерод, по крайней мере, замещен двумя атомами углерода; (III) радикалом -OR5; (IV) радикалом-SR5, где R5 имеет значение, приведенное ниже,при этом R2 и R3 вместе могут образовывать с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы,при этом R2 и R3 не могут одновременно иметь вышеуказанные значения (I), (III) и (IV),R4 и R7, одинаковые или различные, являются атомом водорода, атомом галогена, линейным или разветвленным алкилом, имеющим 120 атомов углерода, радикалом - OR5,R5 является водородом, низшим алкилом или радикалом -COR10, гдеR' и R" имеют значения, определенные ниже; (г) радикалом -ОR11, где R11 имеет значения, определенные ниже,R8 и R9, одинаковые или различные, являются водородом или низшим алкилом,R10 является низшим алкилом,R11 является водородом, линейным или разветвленным алкилом, имеющим 1-20 атомов углерода, алкенилом моно- или полигидроксиалкилом, арилом или аралкилом, которые могут быть замещены, или остатком сахара, или остатком аминокислоты, или пептида,R' и R", одинаковые или различные, являются водородом, низшим алкилом, моно- или полигидроксиалкилом, арилом, который может быть замещен, или остатком аминокислоты, или сахара, или вместе образуют гетероцикл,а также их соли и оптические и геометрические изомеры. 2. Соединения по п.1, отличающиеся тем,что они находятся в виде солей щелочного или щелочно-земельного металла, или цинка, или органического амина. 3. Соединения по п.1, отличающиеся тем,что отдельно или в смеси они составляют группу соединенийR1 является радикалом -CO-R6,Аr является радикалами формулы (а) илиR2 и R3 вместе образуют с прилегающим ароматическим циклом цикл с 5 или 6 звеньями, который может быть замещен метильными группами и/или может быть прерван атомом кислорода или серы. 5. Применение соединений формулы (I) в качестве лекарственного средства. 6. Применение по п.5 в качестве лекарственного средства для лечения дерматологических заболеваний, связанных с нарушением кератинизации, обусловленной дифференциацией и пролиферацией, в частности для лечения акне обыкновенного, юношеского, полиморфного,розового, кистозного, шаровидного, старческого, а также вторичных акне, например, вызванных солнечным, медикаментозным воздействием, или имеющих профессиональный характер,для лечения других типов нарушений кератинизации, в частности ихтиозы, ихтиозоподобные состояния, болезнь Дарье, ладонно-подошвенные кератодермии, лейкоплакии и лейкоплакиеподобные состояния, кожный лишай или лишай слизистой (полости рта); для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительной и/или иммунно-аллергической компонентой и, в частности, любых форм псориаза кожи, слизистой или ногтей и псориатического артрита или кожной атопии, такой как экзема,или респиратурной атопии, а также гипертрофию десен; соединения могут быть также использованы для лечения некоторых воспалительных процессов, не связанных с нарушением кератинизации; для лечения дермических или эпидермических пролифераций, как доброкачественных, так и злокачественных, вирусного 34 или невирусного происхождения, например обыкновенные бородавки, плоские бородавки и бородавчатые эпидермодисплазии, оральный или багровый папиломатоз, и пролиферации,которые могут быть вызваны ультрафиолетовыми лучами, в частности, базоцеллюлярные и спиноцеллюлярные эпитилиомы; для лечения других дерматологических расстройств, таких как пузырчатый дерматоз и коллагеноз; для лечения некоторых офтальмологических заболеваний, в частности корнеопатий; для восстановления или борьбы со старением кожи,как возрастным, так и в результате воздействия света, а также для уменьшения пигментации и белковых кератозов или любых патологий, связанных с возрастным или белковым старением; для профилактики или лечения признаков эпидермической и/или дермической атрофии, вызванной наружными или системными кортикостероидами, или других форм кожной атрофии; для профилактики или лечения нарушений процесса рубцевания или для заживления рубцов,для лечения нарушений функции сальных желез, например гиперсеборея акне или простая себорея; при лечении и профилактики раковых или предраковых состояний; при лечении некоторых воспалительных процессов, таких как артрит; при лечении любых вирусных общих или кожных заболеваний, например синдром Капоши; при профилактике или лечении облысения; при лечении дерматологических или общих заболеваний с иммунологической компонентой; при лечении заболеваний сердечнососудистой системы, таких как артериосклероз или гипертония, а также инсулинонезависимый диабет, при лечении кожных заболеваний, вызванных ультрафиолетовым облучением. 7. Фармацевтическая композиция, отличающаяся тем, что содержит в фармацевтически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-4. 8. Композиция по п.7, отличающаяся тем,что концентрация соединения(ий) по одному из пп.1-4 составляет от 0,001 до 5 мас.% от общей массы композиции. 9. Косметическая композиция, отличающаяся тем, что содержит в косметически приемлемом носителе, по крайней мере, одно соединение по одному из пп.1-4. 10. Композиция по п.9, отличающаяся тем,что концентрация соединения(ий) по одному из пп.1-4 составляет от 0,001 до 3 мас.% по отношению к общей массе композиции. 11. Применение косметической композиции по одному из пп.9 или 10 для гигиены тела или волос.
МПК / Метки
МПК: C07C 69/618, C07D 333/24, A61K 31/38
Метки: бициклические, основе, косметическая, соединения, ароматические, фармацевтическая, косметической, композиции, применение
Код ссылки
<a href="https://eas.patents.su/19-1216-biciklicheskie-aromaticheskie-soedineniya-farmacevticheskaya-i-kosmeticheskaya-kompozicii-na-ih-osnove-i-primenenie-kosmeticheskojj-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические ароматические соединения, фармацевтическая и косметическая композиции на их основе, и применение косметической композиции</a>
Следующий патент: Селективные β3-адренергические агонисты.
Случайный патент: Терминал связи, базовая станция и система связи












