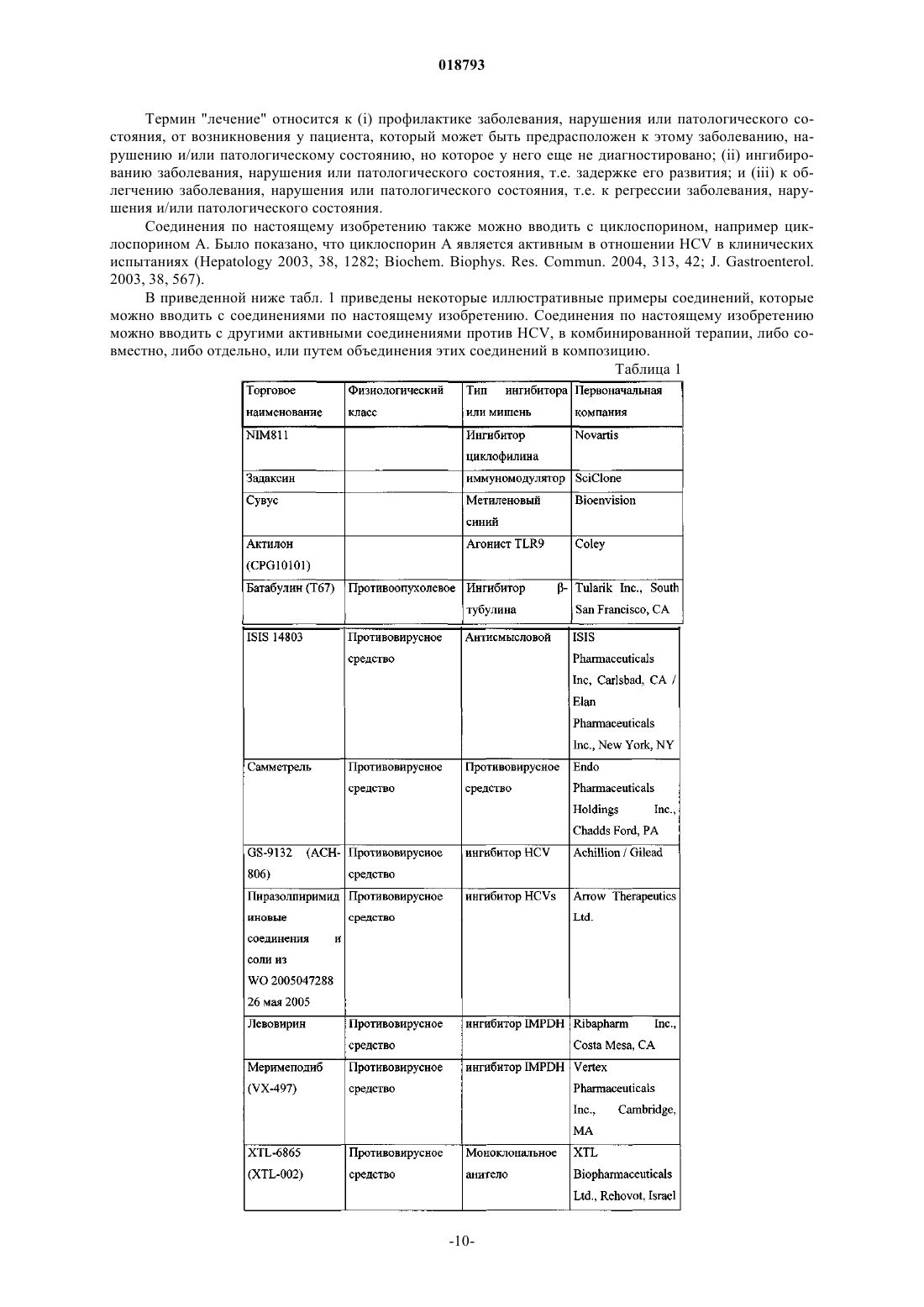
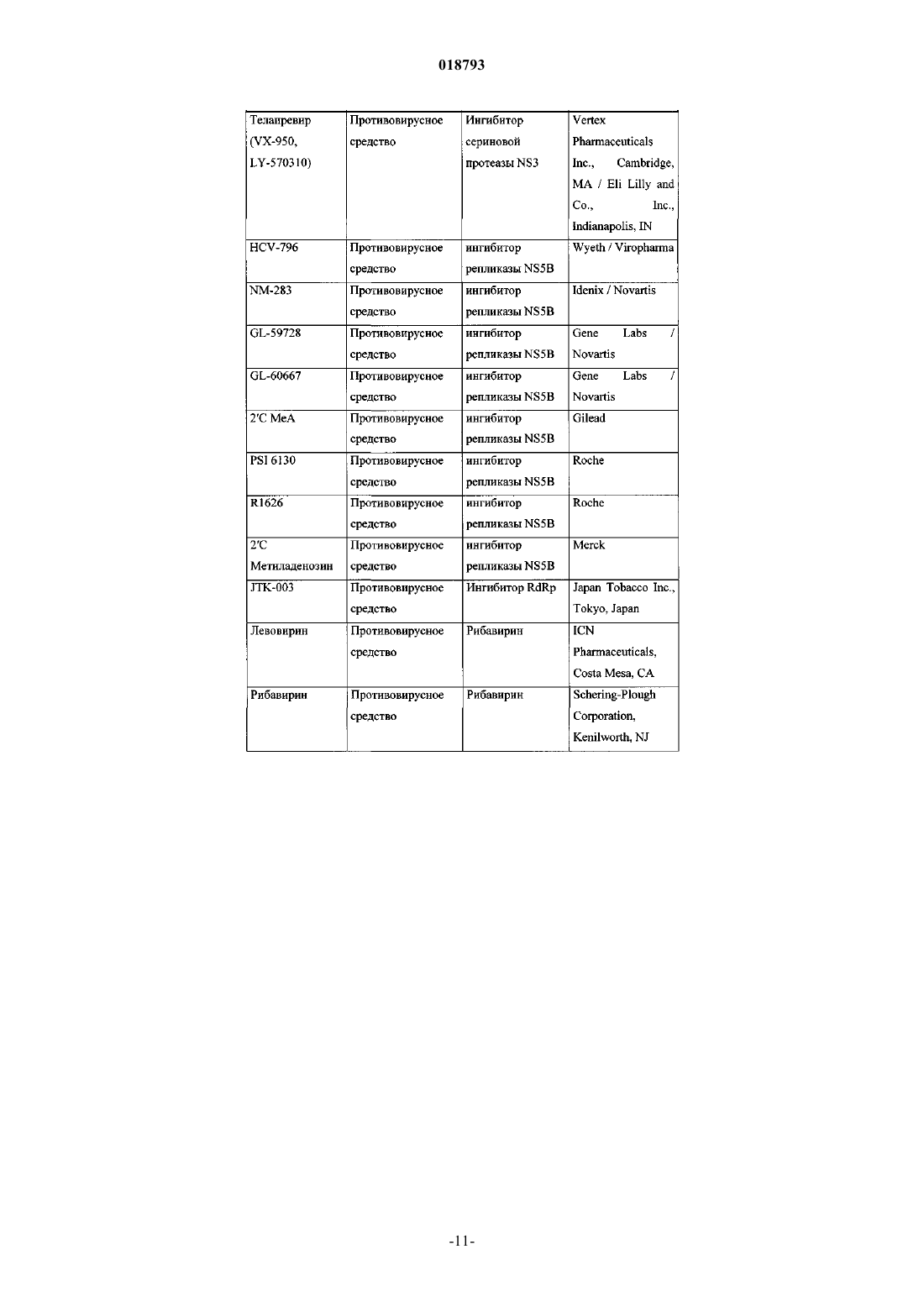
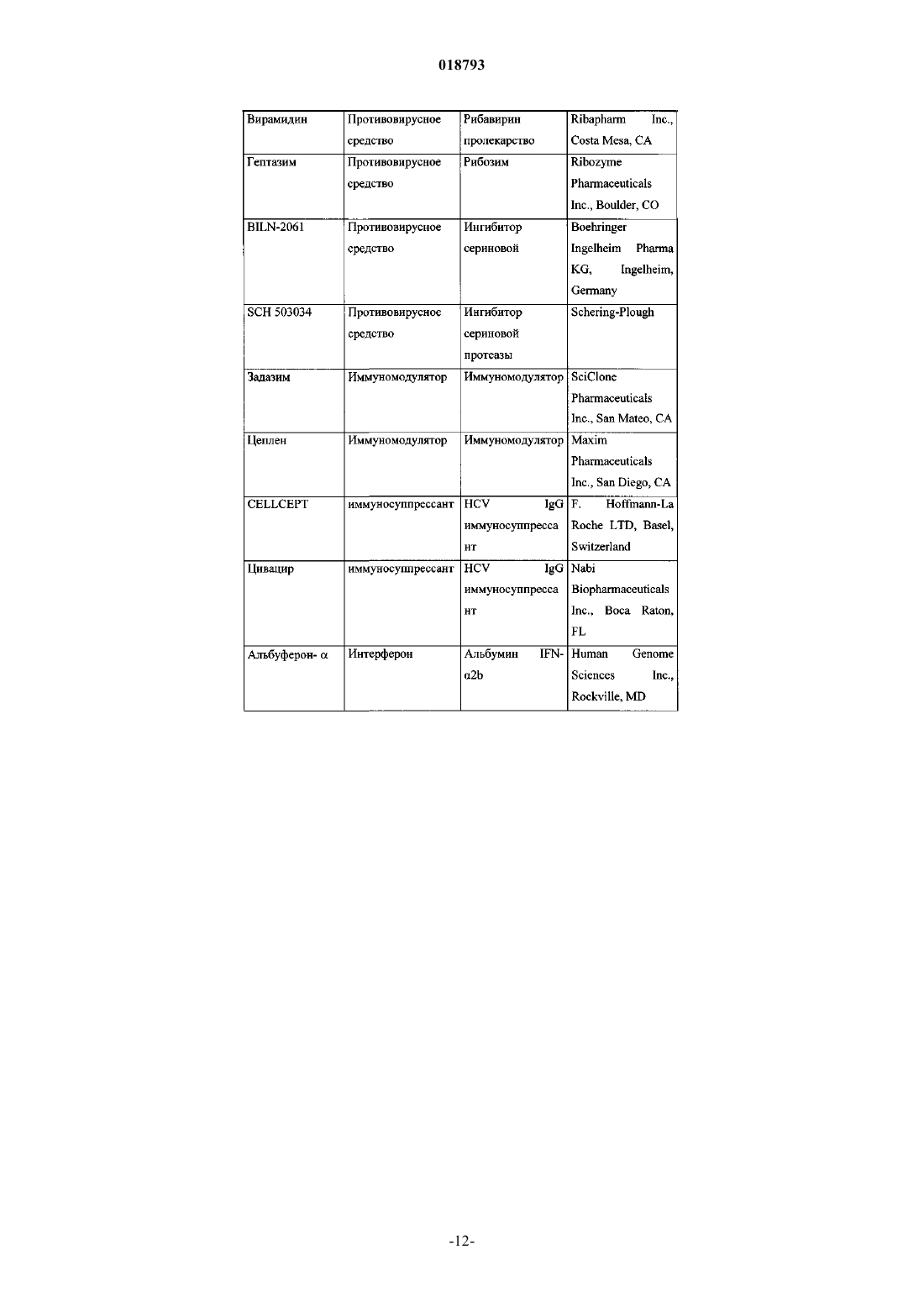
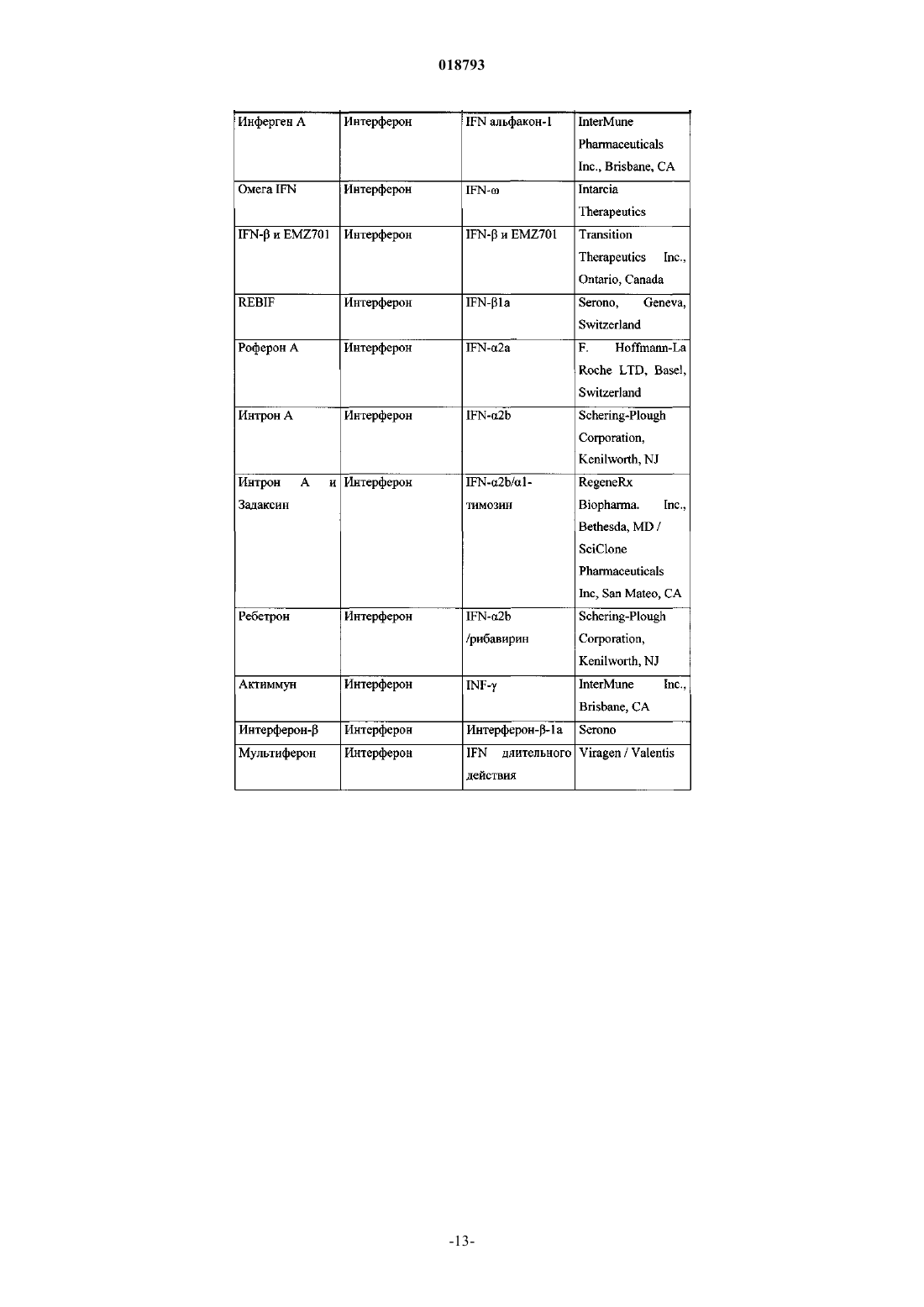
Ингибиторы вируса гепатита с
Формула / Реферат
1. Соединение формулы (I)
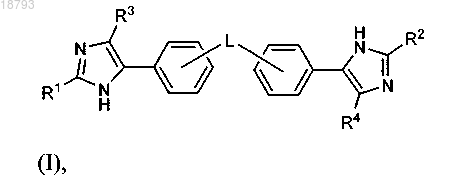
или его фармацевтически приемлемая соль, где L выбран из связи,
R1 и R2 представляют собой
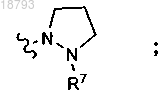
или R1 представляет собой
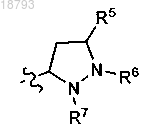
и R2 выбран из
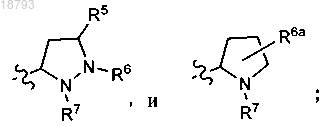
где![]() обозначает точку присоединения к исходной молекуле;
обозначает точку присоединения к исходной молекуле;
R3 и R4 независимо выбраны из водорода и гало;
каждый R5 независимо выбран из водорода;
каждый R6 независимо выбран из алкила;
R6a представляет собой алкил, где алкил необязательно может образовывать конденсированное 3-членное кольцо со смежным атомом углерода;
каждый R7 независимо выбран из -C(O)R8;
каждый R8 независимо выбран из арилалкокси, арилалкила, гетероциклилалкила и (NRcRd)алкила;
при этом (NRcRd)алкил относится к алкильной группе, замещенной -NRcRd, которая относится к двум группам, Rc и Rd, которые присоединены к исходной части молекулы через атом азота, и Rc и Rd независимо выбраны из водорода и алкоксикарбонила,
причем гетероциклилалкил относится к алкильной группе, замещенной 6-членной гетероциклической группой, содержащей один атом кислорода в качестве гетероатома;
арилалкил относится к алкильной группе, замещенной арильной группой;
при этом алкильная часть арилалкила и гетероциклилалкила необязательно замещена -NRcRd;
алкил относится к углеводородной группе, с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода;
арил относится к фенильной группе.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где L представляет собой связь.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где R1 представляет собой
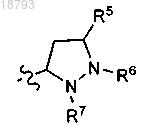
R2 выбран из
4. Соединение по п.3 или его фармацевтически приемлемая соль, где R5 представляет собой водород, R6 представляет собой метил и R6a представляет собой алкил, где указанный алкил образует конденсированное 3-членное кольцо со смежным атомом углерода.
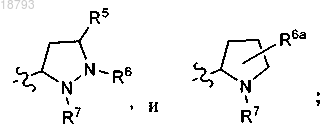
5. Соединение по п.2 или его фармацевтически приемлемая соль, где R1 и R2, каждый, представляют собой
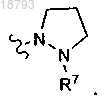 6. Соединение по п.1 или его фармацевтически приемлемая соль, где L представляет собой
6. Соединение по п.1 или его фармацевтически приемлемая соль, где L представляет собой7. Соединение по п.6 или его фармацевтически приемлемая соль, где R1 и R2, каждый, представляют собой
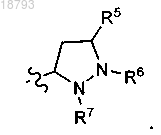
8. Соединение по п.7 или его фармацевтически приемлемая соль, где R5 представляет собой водород и R6 представляет собой метил.
9. Соединение, выбранное из
метил ((1S)-1-(((5S)-5-(5-(4'-(2-((3S)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-1-метил-3-пиразолидинил)-1H-имидазол-5-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)карбонил)-2-метилпропил)карбамата;
диметил (4,4'-бифенилдиил-бис-(1H-имидазол-4,2-диил((5S)-2-метил-5,1-пиразолидиндиил)((1S)-2-оксо-1-(тетрагидро-2Н-пиран-4-ил)-2,1-этандиил)))бискарбамата;
диметил (4,4'-бифенилдиил-бис-(1H-имидазол-5,2-диил((5S)-2-метил-5,1-пиразолидиндиил)((2S)-1-оксо-1,2-бутандиил)))бискарбамата;
метил ((1R)-2-((5S)-5-(5-(4'-(2-((3S)-2-((2S)-2-((метоксикарбонил)амино)-2-фенилацетил)-1-метил-3-пиразолидинил)-1H-имидазол-5-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)-2-оксо-1-фенилэтил)карбамата;
диметил (4,4'-бифенилдиил-бис-(1H-имидазол-5,2-диил((5S)-2-метил-5,1-пиразолидиндиил)((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамата;
метил ((1S)-1-(((5S)-5-(4-(4'-(2-((3S)-2-((2S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)ацетил)-1-метил-3-пиразолидинил)-1H-имидазол-4-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)карбонил)-2-метилпропил)карбамата;
диметил (4,4'-бифенилдиил-бис-((4-хлор-1H-имидазол-5,2-диил)((5S)-2-метил-5,1-пиразолидиндиил)((2S)-1-оксо-1,2-бутандиил)))бискарбамата;
метил ((1S)-1-(((5S)-5-(5-(4-((4-(2-((3S)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-1-метил-3-пиразолидинил)-1H-имидазол-5-ил)фенил)этинил)фенил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)карбонил)-2-метилпропил)карбамата;
метил ((1S)-1-(((5S)-5-(5-(4'-(2-((1R,3S,5R)-2-((2S)-2-((метоксикарбонил)амино)-2-(тетрагидро-2Н-пиран-4-ил)ацетил)-2-азабицикло[3.1.0]гекс-3-ил)-1H-имидазол-5-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)карбонил)-2-метилпропил)карбамата;
дибензил 2,2'-(4,4'-бифенилдиил-бис-(1H-имидазол-4,2-диил))ди(1-пиразолидинкарбоксилата);
метил ((1S)-1-((2-(4-(4'-(2-(2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-1-пиразолидинил)-1H-имидазол-4-ил)-4-бифенилил)-1H-имидазол-2-ил)-1-пиразолидинил)карбонил)-2-метилпропил)карбамата;
диметил (4,4'-бифенилдиил-бис-(1H-имидазол-4,2-диил-2,1-пиразолидиндиил((1R)-2-оксо-1-фенил-2,1-этандиил)))бискарбамата и
метил ((1S)-1-(((5S)-5-(4-хлор-5-(4'-(4-хлор-2-((3S)-2-((2S)-2-((метоксикарбонил)амино)-3-метилбутаноил)-1-метил-3-пиразолидинил)-1H-имидазол-5-ил)-4-бифенилил)-1H-имидазол-2-ил)-2-метил-1-пиразолидинил)карбонил)-2-метилпропил)карбамата.
10. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция по п.10, дополнительно содержащая одно или два дополнительных соединения, обладающих анти-HCV активностью.
12. Фармацевтическая композиция по п.11, где по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин.
13. Фармацевтическая композиция по п.12, где интерферон выбран из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А и лимфобластоидного интерферона tau.
14. Фармацевтическая композиция по п.11, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие клеточного ответа Т-хелперов, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина и ингибитора инозин 5'-монофосфатдегидрогеназы, амантадина и римантадина.
15. Фармацевтическая композиция по п.11, где по меньшей мере одно из дополнительных соединений является эффективным для ингибирования функции мишени, выбранной из HCV металлопротеазы, HCV сериновой протеазы, HCV полимеразы, HCV геликазы, NS4B белка HCV, вхождения HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH, для лечения HCV инфекции.
16. Способ лечения HCV инфекции у пациента, предусматривающий введение указанному пациенту терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
17. Способ по п.16, дополнительно предусматривающий введение одного или двух дополнительных соединений, обладающих анти-HCV активностью, до, после или одновременно с соединением по п.1 или его фармацевтически приемлемой солью.
18. Способ по п.17, где по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин.
19. Способ по п.18, где интерферон выбран из интерферона альфа 2В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2А и лимфобластоидного интерферона tau.
20. Способ по п.17, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие клеточного ответа Т-хелперов, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина и ингибитора инозин 5'-монофосфатдегидрогеназы, амантадина и римантадина.
21. Способ по п.17, где по меньшей мере одно из дополнительных соединений является эффективным для ингибирования функции мишени, выбранной из HCV металлопротеазы, HCV сериновой протеазы, HCV полимеразы, HCV геликазы, белка NS4B HCV, вхождения HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH для лечения HCV инфекции.
Текст
ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С или его фармацевтически приемлемым солям, композициям и способам лечения инфекции вируса гепатита C (HCV). Также описаны фармацевтические композиции, содержащие такие соединения,и способы использования этих соединений в лечении HCV инфекции. По заявке на настоящий патент испрашивается приоритет предварительной заявки США с серийным номером 61/167989, поданной 9 апреля 2009 г. Область техники Настоящее описание в основном направлено на противовирусные соединения и, более конкретно,направлено на соединения, которые обладают способностью ингибировать функцию белка NS5A, кодируемого вирусом гепатита С (HCV), композиции, содержащие такие соединения, и способы ингибирования функции белка NS5A. Уровень техникиHCV является основным патогеном человека, инфицирующим приблизительно 170 млн человек во всем мире - примерно в пять раз больше инфицированных вирусом иммунодефицита 1 типа. У значительной части этих людей, инфицированных HCV, развивается тяжелое прогрессирующее заболевание печени, в том числе цирроз и гепатоклеточная карцинома. В настоящее время стандартное лечение HCV, в котором используется комбинация пэгилированного интерферона и рибавирина, имеет неоптимальный показатель эффективности в достижении устойчивого вирусологического ответа и вызывает многочисленные побочные эффекты. Таким образом, существует очевидная и назревшая потребность в разработке эффективных терапевтических средств, чтобы направить их на эти недостаточно удовлетворенные медицинские нужды.HCV представляет собой вирус с положительной цепью РНК. На основании сравнения расшифрованной аминокислотной последовательности и большого сходства в 5' нетранслируемой области, HCV был классифицирован как отдельный род в семействе флавивирусов (Flaviviridae). Все представители семейства флавивирусов имеют вирионы, заключенные в оболочку, которые содержат геномположительную цепь РНК, кодирующий все известные вирус-специфичные белки посредством трансляции одной непрерывной открытой рамки считывания. Значительная гетерогенность обнаружена в пределах нуклеотидной и кодируемой аминокислотной последовательности по всему геному HCV вследствие высокой частоты появления ошибки кодируемой РНК-зависимой РНК полимеразы, которая лишена способности проверочного считывания. Было охарактеризовано по меньшей мере шесть основных генотипов и более 50 подтипов было описано по всему миру. Клиническая значимость генетической гетерогенности HCV продемонстрировала способность к возникновению мутаций во время монотерапевтического лечения, следовательно, для применения желательны дополнительные варианты лечения. Возможное модулирующее действие генотипов на патогенез и лечение остается неясным. Одноцепочечный РНК геном HCV составляет приблизительно 9500 нуклеотидов в длину и имеет одну открытую рамку считывания (ORF), кодирующую один крупный полипротеин примерно 3000 аминокислот. В инфицированных клетках этот полипротеин расщепляется во множестве сайтов под действием клеточных и вирусных протеаз для образования структурных и неструктурных (NS) белков. В случае HCV образование зрелых неструктурных белков (NS2, NS3, NS4A, NS4B, NS5A и NS5B) осуществляется под действием двух вирусных протеаз. Считается, что первая является металлопротеазой и расщепляет в месте соединения NS2-NS3; вторая представляет собой сериновую протеазу, находящуюся вN-концевой области NS3 (также называемая в настоящем описании NS3 протеазой), и опосредует все последующие расщепления ниже NS3, как в цис, в NS3-NS4A сайте расщепления, так и в транс, для оставшихся сайтов NS4A-NS4B, NS4B-NS5A, NS5A-NS5B. Белок NS4A, по-видимому, выполняет множество функций, действуя и как кофактор для NS3 протеазы и способствуя мембранной локализации NS3 и других компонентов вирусной репликазы. Образование комплекса NS3-NS4A необходимо для надлежащей активности протеазы, приводящей в результате к повышенной протеолитической эффективности событий расщепления. Белок NS3 также проявляет нуклеозидтрифосфатазную и РНК геликазную активности. NS5B (в настоящем изобретении также называется HCV полимеразой) представляет собой РНКзависимую РНК полимеразу, которая вовлечена в репликацию HCV с другими белками HCV, в том числеNS5A, в репликазном комплексе. Необходимы соединения, применяемые для лечения HCV-инфицированных пациентов, которые селективно ингибируют репликацию вируса HCV. В частности, необходимы соединения, которые эффективно ингибируют функцию белка NS5A. Белок NS5A HCV описан, например, в следующих ссылках: В первом аспекте настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где обозначает точку присоединения к исходной молекуле; гдеR3 и R4 независимо выбраны из водорода и гало; каждый R5 независимо выбран из водорода и алкила; каждый R6 независимо выбран из водорода и алкила;R6a представляет собой водород или алкил, где алкил необязательно может образовывать конденсированное 3-членное кольцо со смежным атомом углерода; каждый R7 независимо выбран из водорода и -C(O)R8; каждый R8 независимо выбран из алкокси, алкила, арилалкокси, арилалкила, циклоалкила, гетероциклила, гетероциклилалкила, (NRcRd)алкенила и (NRcRd)алкила. В первом варианте осуществления первого аспекта настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где L представляет собой связь. Во втором варианте осуществления первого аспекта R1 представляет собой В третьем варианте осуществления первого аспекта R5 представляет собой водород, R6 представляет собой метил и R6a представляет собой алкил, где указанный алкил образует конденсированное 3 членное кольцо со смежным атомом углерода. В четвертом варианте осуществления первого аспекта настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где L представляет собой связь, R1 и R2,каждый, представляют собой-2 018793 каждый R5 представляет собой водород, каждый R6 представляет собой метил и каждый R4 представляет собой хлор. В пятом варианте осуществления первого аспекта настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, где L представляет собой связь и R1 и R2, каждый, представляют собой В шестом варианте осуществления первого аспекта настоящее описание относится к соединению формулы (I) или его фармацевтически приемлемой соли, где L представляет собой В седьмом варианте осуществления R1 и R2, каждый, представляют собой В восьмом варианте осуществления R5 представляет собой водород и R6 представляет собой метил. Во втором аспекте настоящее изобретение относится к композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. В первом варианте осуществления второго аспекта композиция дополнительно содержит одно или два дополнительных соединения, обладающих анти-HCV активностью. Во втором варианте осуществления второго аспекта по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин. В третьем варианте осуществления интерферон выбран из интерферона альфа 2 В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона tau. В четвертом варианте осуществления второго аспекта настоящее описание относится к соединению формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемому носителю и одному или двум дополнительным соединениям, обладающим анти-HCV активностью, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12,соединения, которое усиливает развитие клеточного ответа T-хелперов, интерферирующей РНК, антисмысловой РНК, имиквимода, рибавирина и ингибитора инозин 5'-монофосфатдегидрогеназы, амантадина и римантадина. В пятом варианте осуществления второго аспекта настоящее описание относится к соединению формулы (I) или его фармацевтически приемлемой соли, фармацевтически приемлемому носителю и одному или двум дополнительным соединениям, обладающим анти-HCV активностью, где по меньшей мере одно из дополнительных соединений является эффективным для ингибирования функции мишени,выбранной из HCV металлопротеазы, HCV сериновой протеазы, HCV полимеразы, HCV геликазы, белкаNS4B HCV, вхождения HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH для лечения HCV инфекции. В третьем аспекте настоящее изобретение относится к способу лечения HCV инфекции у пациента,предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В первом варианте осуществления третьего аспекта указанный способ дополнительно предусматривает введение одного или двух дополнительных соединений, обладающих анти-HCV активностью до, после или одновременно с соединением формулы (I) или его фармацевтически приемлемой солью. Во втором варианте осуществления третьего аспекта по меньшей мере одно из дополнительных соединений представляет собой интерферон или рибавирин. В третьем варианте осуществления третьего аспекта интерферон выбран из интерферона альфа 2 В, пэгилированного интерферона альфа, консенсусного интерферона, интерферона альфа 2 А и лимфобластоидного интерферона tau. В четвертом варианте осуществления третьего аспекта настоящее изобретение относится к способу лечения HCV инфекции у пациента, предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и одного или двух дополнительных соединений, обладающих анти-HCV активностью до, после или одновременно с соединением формулы (I) или его фармацевтически приемлемой солью, где по меньшей мере одно из дополнительных соединений выбрано из интерлейкина 2, интерлейкина 6, интерлейкина 12, соединения, которое усиливает развитие клеточного ответа T-хелперов, интерферирующей РНК, антисмысловой РНК,имиквимода, рибавирина и ингибитора инозин 5'-монофосфатдегидрогеназы, амантадина и римантадина. В пятом варианте осуществления третьего аспекта настоящее изобретение относится к способу лечения HCV инфекции у пациента, предусматривающему введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли и одного или двух дополнительных соединений, обладающих анти-HCV активностью до, после или одновременно с соединением формулы (I) или его фармацевтически приемлемой солью, где по меньшей мере одно из дополнительных соединений является эффективным для ингибирования функции мишени, выбранной из HCV металлопротеазы, HCV сериновой протеазы, HCV полимеразы, HCV геликазы, белка NS4B HCV, вхождения HCV, сборки HCV, выхода HCV, белка NS5A HCV и IMPDH для лечения HCV инфекции. Другие варианты осуществления настоящего изобретения могут включать подходящие сочетания двух или более вариантов осуществления и/или аспектов, изложенных в настоящем изобретении. Другие варианты осуществления и аспекты изобретения будут очевидны в соответствии с описанием, представленным ниже. Соединения по настоящему изобретению также существуют в виде таутомеров; следовательно, настоящее изобретение также охватывает все таутомерные формы. Описание настоящего изобретения следует истолковывать в соответствии с законами и принципами образования химических связей. Должно быть понятно, что соединения, охватываемые настоящим изобретением, представляют собой соединения, которые являются достаточно стабильными для применения в качестве фармацевтического средства. Предполагается, что определение любого заместителя или переменной (например, R5, R6 и R7) в конкретном положении в молекуле не зависит от его определений в другом месте в этой молекуле. Все патенты, патентные заявки и литературные ссылки, процитированные в описании, включены посредством ссылки в полном объеме. В случае несоответствий настоящее описание, включая определения, будет иметь приоритетное значение. В контексте настоящего изобретения следующие термины имеют указанные значения. В контексте настоящего изобретения формы единственного числа включают ссылку на формы множественного числа, если из контекста явным образом не следует иное. Если не указано иное, все арильные, циклоалкильные и гетероциклильные группы по настоящему изобретению могут быть замещены, как описано в каждом из соответствующих им определений. Например, арильная часть арилалкильной группы может быть замещена, как описано в определении термина"арил". Термин "алкокси" в контексте настоящего изобретения относится к алкильной группе, присоединенной к исходной части молекулы через атом кислорода. Термин "алкил" в контексте настоящего изобретения относится к группе, происходящей из насыщенного углеводорода с прямой или разветвленной цепью, содержащего от одного до шести атомов углерода. В соединениях по настоящему изобретению, где R6a представляет собой алкил, каждый алкил необязательно может образовывать конденсированное 3-6-членное кольцо со смежным атомом углерода с получением структуры, представленной ниже Термин "арил" в контексте настоящего изобретения относится к фенильной группе или бициклической конденсированной кольцевой системе, где одно или оба кольца представляют собой фенильную группу. Бициклические конденсированные кольцевые системы состоят из фенильной группы, конденсированной с 4-6-членным ароматическим или неароматическим карбоциклическим кольцом. Арильные группы по настоящему изобретению могут быть присоединены к исходной части молекулы через любой подходящий атом углерода в группе. Характерные примеры арильных групп включают, но не только,инданил, инденил, нафтил, фенил и тетрагидронафтил. Арильные группы по настоящему изобретению необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси, алкоксиалкила, алкоксикарбонила, алкила, алкилкарбонила, второй арильной группы,арилалкокси, арилалкил, арилкарбонила, циано, галогена, галоалкокси, галоалкила, гетероциклила, гетероциклилалкила, гетероциклилкарбонила, гидрокси, гидроксиалкила, нитро, -NRxRy, (NRxRy)алкила, оксо и -P(O)OR2, где каждый R независимо выбран из водорода и алкила; алкильная часть арилалкила и гетероциклилалкил являются незамещенными и где вторая арильная группа, арильная часть арилалкила,арильная часть арилкарбонила, гетероциклил и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонил дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галоалкокси, галоалкила и нитро. Термин "арилалкил" в контексте настоящего изобретения относится к алкильной группе, замещенной одной, двумя или тремя арильными группами. Алкильная часть арилалкила дополнительно необязательно замещена одной или двумя дополнительными группами, независимо выбранными из алкокси,алкилкарбонилокси, галогена, галоалкокси, галоалкила, гетероциклила, гидрокси и -NRcRd, где гетероциклил дополнительно необязательно замещен одним или двумя заместителями, независимо выбранными из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкокси-4 018793 карбонила, галогена, галоалкокси, галоалкила, гидрокси, -NRxRy и оксо. Термин "циклоалкил" в контексте настоящего изобретения относится к насыщенной моноциклической углеводородной кольцевой системе, имеющей от трех до семи атомов углерода и ноль гетероатомов. Характерные примеры циклоалкильных групп включают, но не только, циклопропил, циклобутил,циклопентил и циклогексил. Циклоалкильные группы по настоящему изобретению необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси,алкила, арила, циано, галогена, галоалкокси, галоалкила, гетероциклила, гидрокси, гидроксиалкила, нитро и -NRxRy, где арил и гетероциклил дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкил, циано, галогена, галоалкокси, галоалкила,гидрокси и нитро. Термин "гетероциклил" в контексте настоящего изобретения относится к 4-, 5-, 6- или 7-членному кольцу, содержащему один, два, три или четыре гетероатома, независимо выбранных из азота, кислорода и серы. 4-членное кольцо имеет ноль двойных связей, 5-членное кольцо имеет от нуля до двух двойных связей и 6- и 7-членные кольца имеют от нуля до трех двойных связей. Термин "гетероциклил" также включает бициклические группы, в которых гетероциклическое кольцо конденсировано с другой моноциклической гетероциклической группой, или 4-6-членным ароматическим или неароматическим карбоциклическим кольцом; а также мостиковыми бициклическими группами, такими как 7 азабицикло[2.2.1]гепт-7-ил, 2-азабицикло[2.2.2]окт-2-ил и 2-азабицикло[2.2.2]окт-3-ил. Гетероциклические группы по настоящему изобретению могут быть присоединены к исходной части молекулы через любой атом углерода или атом азота в группе. Примеры гетероциклических групп включают, но не только, бензотиенил, фурил, имидазолил, индолинил, индолил, изохинолинил, изотиазолил, изоксазолил,морфолинил, оксазолил, пеперазинил, пиперидинил, пиразолил, пиридинил, пирролидинил, пирролопиридинил, пирролил, хинолинил, тиазолил, тиенил и тиоморфолинил. Гетероциклические группы по настоящему изобретению необязательно замещены одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкенила, алкокси, алкоксиалкила, алкоксикарбонила, алкила, алкилкарбонила, арила, арилалкила, арилкарбонила, циано, галогена, галоалкокси, галоалкила, второй гетероциклической группы, гетероциклилалкила, гетероциклилкарбонила, гидрокси, гидроксиалкила, нитро, NRxRy, (NRxRy)алкила и оксо, где алкильная часть арилалкила и гетероциклилалкила являются незамещенными и где арил, арильная часть арилалкила, арильная часть арилкарбонила, вторая гетероциклическая группа и гетероциклильная часть гетероциклилалкила и гетероциклилкарбонила дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси,алкила, циано, галогена, галоалкокси, галоалкила и нитро. Термин "гетероциклилалкил" в контексте настоящего изобретения относится к алкильной группе,замещенной одной, двумя или тремя гетероциклическими группами. Алкильная часть гетероциклилалкила дополнительно необязательно замещена одной или двумя дополнительными группами, независимо выбранными из алкокси, алкилкарбонилокси, арила, галогена, галоалкокси, галоалкила, гидрокси и-NRcRd, где арил дополнительно необязательно замещен одним или двумя заместителями, независимо выбранными из алкокси, алкила, незамещенного арила, незамещенного арилалкокси, незамещенного арилалкоксикарбонила, галогена, галоалкокси, галоалкила, гидрокси и -NRxRy. Термин "-NRcRd" в контексте настоящего изобретения относится к двум группам, Rc и Rd, которые присоединены к исходной части молекулы через атом азота. Rc и Rd независимо выбраны из водорода,алкенилоксикарбонила, алкоксиалкилкарбонила, алкоксикарбонила, алкила, алкилкарбонила, алкилсульфонила, арила, арилалкоксикарбонила, арилалкила, арилалкилкарбонила, арилкарбонила, арилоксикарбонила, арилсульфонила, циклоалкила, циклоалкилоксикарбонила, циклоалкилсульфонила, формила,галоалкоксикарбонила, гетероциклила, гетероциклилалкоксикарбонила, гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила, гетероциклилоксикарбонила, гидроксиалкилкарбонила,(NReRf)алкила, (NReRf)алкилкарбонила, (NReRf)карбонила, (NReRf)сульфонила, -C(NCN)OR' и-C(NCN)NRxRy, где R' выбран из алкила и незамещенного фенила и где алкильная часть арилалкила, арилалкилкарбонила, гетероциклилалкила и гетероциклилалкилкарбонила дополнительно необязательно замещены одной -NReRf группой и где арил, арильная часть арилалкоксикарбонила, арилалкила, арилалкилкарбонила, арилкарбонила, арилоксикарбонила и арилсульфонила, гетероциклил и гетероциклическая часть гетероциклилалкоксикарбонила, гетероциклилалкила, гетероциклилалкилкарбонила, гетероциклилкарбонила и гетероциклилоксикарбонила дополнительно необязательно замещены одним, двумя или тремя заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галоалкокси, галоалкила и нитро.-5 018793 Термин "(NRcRd)алкенил" в контексте настоящего изобретения относится к где Rc и Rd определены в настоящем описании и каждый Rq независимо представляет собой водород или C1-3 алкил. Термин "(NRcRd)алкил" в контексте настоящего изобретения относится к алкильной группе, замещенной одной или двумя -NRcRd группами. Алкильная часть (NRcRd)алкила дополнительно необязательно замещена одной или двумя дополнительными группами, выбранными из алкокси, алкоксиалкилкарбонила, алкоксикарбонила, алкилсульфанила, арилалкоксикарбонила, карбокси, циклоалкила, гетероциклила, гетероциклилкарбонила, гидрокси и (NReRf)карбонила; где гетероциклил дополнительно необязательно замещен одним, двумя, тремя, четырьмя или пятью заместителями, независимо выбранными из алкокси, алкила, циано, галогена, галоалкокси, галоалкила и нитро. Термин "-NReRf" в контексте настоящего изобретения относится к двум группам, Re и Rf, которые присоединены к исходной части молекулы через атом азота. Re и Rf независимо выбраны из водорода,алкила, незамещенного арила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного(циклоалкил)алкила, незамещенного гетероциклила, незамещенного гетероциклилалкила, (NRxRy)алкила и (NRxRy)карбонила. Термин "-NRxRy" в контексте настоящего изобретения относится к двум группам, Rx и Ry, которые присоединены к исходной части молекулы через атом азота. Rx и Ry независимо выбраны из водорода,алкоксикарбонила, алкила, алкилкарбонила, незамещенного арил, незамещенного арилалкоксикарбонила, незамещенного арилалкила, незамещенного циклоалкила, незамещенного гетероциклила и(NRxRy)карбонила, где Rx и Ry независимо выбраны из водорода и алкила. В соединениях по настоящему изобретению существуют асимметричные центры. Эти центы обозначаются символами "R" или "S" в зависимости от конфигурации заместителей вокруг хирального атома углерода. Должно быть понятно, что настоящее изобретение охватывает все стереохимические изомерные формы или их смеси, которые обладают способностью ингибировать NS5A. Отдельные стереоизомеры соединений могут быть получены синтетическим путем из коммерчески доступных исходных веществ, которые содержат хиральные центры, или путем получения смесей энантиомерных продуктов с последующим их разделением, например, превращением в смесь диастереомеров с последующим разделением или рекристаллизацией, методами хроматографии или прямым разделением энантиомеров на хиральных хроматографических колонках. Исходные соединения конкретной стереохимии либо являются коммерчески доступными, либо могут быть получены и разделены способами, известными в данной области. Некоторые соединения по настоящему изобретению также могут существовать в различных стабильных конформационных формах, которые могут быть разделимыми. Торсионная асимметрния вследствие ограниченного вращения около асимметричной одинарной связи, например, вследствие стерического несоответствия или напряжения кольца, может дать возможность разделить различные конформационные изомеры. Настоящее изобретение включает каждый конформационный изомер этих соединений и их смеси. Термин "соединения по настоящему изобретению" и эквивалентные выражения охватывают соединения формулы (I) и фармацевтически приемлемые энантиомеры, диастереомеры и их соли. Аналогично,ссылки на производные охватывают их соли, в случае, если это допускается контекстом. Настоящее изобретение включает все изотопы атомов, встречающиеся в соединениях по настоящему изобретению. Изотопы включают те атомы, которые имеют такое же атомное число, но различные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают дейтерий и тритий. Изотопы углерода включают 13 С и 14 С изотопно меченные соединения по изобретению в основном могут быть получены с помощью общепринятых методик, известных специалистам в данной области, или способами, аналогичными тем, которые описаны в настоящем изобретении, используя соответствующий изотопно меченный реагент вместо немеченого реагента, используемого в иных случаях. Такие соединения могут иметь целый ряд потенциальных применений, например, в качестве стандартов и реагентов при определении биологической активности. В случае стабильных изотопов такие соединения могут иметь возможность положительно модифицировать биологические, фармакологические или фармакокинетические свойства. Соединения по настоящему изобретению могут существовать в виде фармацевтически приемлемых солей. Термин "фармацевтически приемлемая соль" в контексте настоящего изобретения представляет соли или цвиттерионные формы соединений по настоящему изобретению, которые являются водорастворимыми или растворимыми в масле или диспергируемыми, которые в объеме тщательной медицин-6 018793 ской проверки подходят для применения в контакте с тканями пациентов без чрезмерной токсичности,раздражения, аллергической реакции или других проблем или осложнений сопоставимым с разумным соотношением польза/риск и являются эффективными для предназначенного применения. Соли могут быть получены во время конечного выделения и очистки соединений или отдельно путем взаимодействия подходящего атома азота с подходящей кислотой. Характерные кислотно-аддитивные соли включают ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат,камфорсульфонат, диглюконат, дигидробромид, дигидрохлорид, дигидройодид, глицерофосфат, гемисульфат, гептаноат, гексаноат, формиат, фумарат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, лактат, малеат, мезитиленсульфонат, метансульфонат, нафтиленсульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, персульфат, 3-фенилпропионат, пикрат,пивалат, пропионат, сукцинат, тартрат, трихлорацетат, фосфат, глутамат, бикарбонат, паратолуолсульфонат и ундеканоат. Примеры кислот, которые могут быть использованы для образования фармацевтически приемлемых кислотно-аддитивных солей, включают неорганические кислоты, такие как соляная, бромисто-водородная, серная и фосфорная и органические кислоты, такие как щавелевая,малеиновая, янтарная и лимонная. Основные аддитивные соли могут быть получены во время конечного выделения и очистки соединений путем взаимодействия карбоксильной группы с подходящим основанием, таким как гидроксид,карбонат или бикарбонат катиона металла или с аммиаком или органическим первичным, вторичным или третичным амином. Катионы фармацевтически приемлемых солей включают литий, натрий, калий,кальций, магний и алюминий, а также катионы нетоксичных четвертичных аминов, таких как аммоний,тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин,дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенэтиламин и N,N'-дибензилэтилендиамин. Другие характерные органические амины, применяемые для образования основных аддитивных солей,включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин. В тех случаях, когда это возможно, для использования в терапии терапевтически эффективные количества соединения формулы (I), а также его фармацевтически приемлемых солей, можно вводить в виде необработанного химического вещества, возможно представить активный ингредиент в виде фармацевтической композиции. Соответственно настоящее изобретение дополнительно относится к фармацевтическим композициям, которые включают терапевтически эффективные количества соединений формулы (I) или их фармацевтически приемлемых солей и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Термин "терапевтически эффективное количество" в контексте настоящего изобретения относится к общему количеству каждого активного компонента, которое является эффективным для демонстрации значимой пользы для пациента, например, снижения вирусной нагрузки. При применении к индивидуальном активному ингредиенту, вводимому отдельно,этот термин относится только к тому ингредиенту. При применении к комбинации этот термин относится к объединенным количествам активных ингредиентов, которые в результате приводят к терапевтическому эффекту, при введении будь то в сочетании, либо последовательно, либо одновременно. Соединения формулы (I) и их фармацевтически приемлемые соли описаны выше. Носитель(и), разбавитель(и),или эксципиент(ы) должны быть приемлемыми в смысле совместимости с другими ингредиентами состава и безвредными для реципиента. В соответствии с другим аспектом настоящего изобретения также представлен способ получения фармацевтической композиции, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или несколькими фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Термин "фармацевтически приемлемый" в контексте настоящего изобретения относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые в объеме тщательной медицинской проверки подходят для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, сопоставимой с разумным соотношением польза/риск, и которые являются эффективными для предназначенного использования. Фармацевтические составы могут быть представлены в единичных лекарственных формах, содержащих заранее определенное количество активного ингредиента на единичную дозу. Уровни доз составляют примерно от 0,01 примерно до 250 мг/кг массы тела в день, предпочтительно примерно от 0,05 примерно до 100 мг/кг массы тела в день соединений по настоящему изобретению являются характерными в монотерапии для профилактики и лечения заболевания, опосредованного HCV. Обычно фармацевтические композиции по настоящему изобретению будут вводить примерно от 1 примерно до 5 раз в день или, альтернативно, в виде непрерывной инфузии. Такое введение может быть использовано в качестве длительной или неотложной терапии. Количество активного ингредиента, которое можно объединить с веществами-носителями для получения отдельной лекарственной формы, будет варьировать в зависимости от состояния, подвергаемого лечению, тяжести состояния, времени введения, пути введения, скорости экскреции используемого соединения, длительности лечения и возраста, пола, массы тела и состояния пациента. Предпочтительными составами единичной дозы являются те, которые содержат суточную дозу или субдозу, как указано выше, или их соответствующую фракцию, активного ингреди-7 018793 ента. Лечение может бытьначато с малых доз, существенно ниже оптимальной дозы соединения. После этого дозу повышают небольшим шагом повышения дозы до достижения оптимального эффекта в этих условиях. В основном, соединение наиболее целесообразно вводить с уровнем концентрации, который в основном будет давать эффективные противовирусные результаты, не вызывая никаких опасных или вредных побочных эффектов. В тех случаях, когда композиции по настоящему изобретению содержат комбинацию соединения по настоящему изобретению и одного или более дополнительных терапевтических или профилактических средств, как соединение, так и дополнительное средство обычно присутствует на уровнях доз примерно от 10 до 150% и более предпочтительно примерно от 10 до 80% дозы, обычно вводимой в режиме монотерапии. Фармацевтические составы могут быть адаптированы для введения любым подходящим путем, например пероральным (в том числе буккальным или подъязычным), ректальным, назальным, местным (в том числе буккальным, подъязычным или трансдермальным), вагинальным или парентеральным путем(в том числе подкожным, внутрикожным, внутримышечным, внутрь сустава, интрасиновиальным,внутрь грудины, интратекально, внутрь пораженных тканей, внутривенно или внутрикожными инъекциями или инфузиями). Такие составы могут быть получены любым способом, известным в области фармации, например путем объединения активного ингредиента с носителем (носителями) или эксципиентом (эксципиентами). Пероральное введение или введение инъекционным путем являются предпочтительными. Фармацевтические составы, адаптированные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пригодных к употреблению пен или муссов; или жидких эмульсий масло-в-воде или вода-в-масле. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и подобное. Порошки получают путем измельчения до подходящего мелкого размера и перемешивания с аналогично измельченным фармацевтическим носителем, таким как пригодный для употребления в пищу углевод, как, например, крахмал или маннит. Также может присутствовать вкусоароматический, консервирующий, диспергирующий и красящий агент. Капсулы получают путем приготовления порошкообразной смеси, как описано выше, и заполнения сформированных желатиновых оболочек. Регуляторы сыпучести и смазывающие вещества, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль,могут быть добавлены к порошкообразной смеси перед операцией заполнения. Вещество для улучшения распадаемости или солюбилизирующий компонент, например агар-агар, карбонат кальция или карбонат натрия, также могут быть добавлены для улучшения доступности лекарственного средства при приеме капсулы внутрь. Кроме того, при желании или необходимости, подходящие связующие, смазывающие вещества,вещества для улучшения распадаемости и красители также могут быть включены в эту смесь. Подходящие связующие включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза,сахаристые вещества из кукурузы, природные и синтетические камеди, такие как акациевая, трагакантовая, или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль и подобные. Смазывающие вещества, используемые в этих лекарственных формах, включают олеат натрия, хлорид натрия и подобные. Вещества для улучшения распадаемости включают, без ограничения, крахмал, метилцеллюлозу, агар,бетонит, ксантановую камедь и подобное. Таблетки получают, например, путем получения порошкообразной смеси, гранулирования или агрегирования, добавления смазывающего вещества и вещества для улучшения распадаемости и прессования в таблетки. Порошкообразную смесь получают путем перемешивания соединения, измельченного соответствующим образом, с разбавителем или основой, как описано выше, и, необязательно, со связующим, таким как карбоксиметилцеллюлоза, альгинат, желирующее вещество или поливинилпирролидон, вещество, замедляющее растворение, такое как парафин, вещество,ускоряющее всасывание, такое как четвертичная соль и/или абсорбент, например, бетонит, каолин или дикальция фосфат. Порошкообразная смесь может быть гранулирована путем увлажнения со связующим, таким как сироп, крахмальная паста, клейкое вещество акадии, или растворами целлюлозных или полимерных материалов и просеивания через сито. В качестве альтернативы гранулированию, порошкообразная смесь может быть пропущена через таблетировочную машину и полученные в результате неполностью сформированные крупинки, раздробленные на гранулы. Гранулы могут быть смазаны для предотвращения слипания с фасонной матрицей путем добавления стеариновой кислоты, соли - стеарата,талька или минерального масла. Смазанную смесь затем прессуют в таблетки. Соединения по настоящему изобретению также могут быть объединены с сыпучем инертным носителем и спрессованы в таблетки напрямую без прохождения через стадии гранулирования и агрегации. Может быть представлено прозрачное или непрозрачное защитное покрытие, состоящее из изолирующего слоя шеллака, покрытия сахаром или полимерным материалом и полирующего воскового покрытия. Красящие вещества могут быть добавлены к этим покрытиям для отличия различных единичных доз. Жидкости для перорального приема, такие как раствор, сиропы и эликсиры, могут быть получены в единичной дозированной форме таким образом, чтобы заданное количество содержало заранее определенное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящими вкусоароматическими добавками, тогда как эликсиры получают путем использования нетоксичного носителя. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и простые эфиры полиоксиэтиленсорбитола, консерванты,вкусоароматические добавки, такие как масло мяты перечной или натуральные подсластители, или сахарин или другие искусственные подсластители и подобное. В соответствующих случаях составы единичной дозы для перорального введения могут быть микроинкапсулированы. Состав также может быть получен для пролонгирования или замедления высвобождения, например, путем нанесения покрытия или заключения зернистого материала в полимеры, воск или подобное. Соединения формулы (I) и их фармацевтически приемлемые соли также можно вводить в форме липосомных систем доставки, таких как небольшие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из целого ряда фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть доставлены путем использования моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Эти соединения также могут быть присоединены к растворимым полимерам в качестве носителей лекарственных средств направленной доставки. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидефенол или полиэтиленоксидеполилизин, замещенный остатками палитоила. Кроме того, соединения могут быть присоединены к классу биоразлагаемых полимеров, применяемых для достижения контролируемого высвобождения лекарственного средства, например, полимолочной кислоте,полэпсилонкапролактону, полигидроксимасляной кислоте, сложным полиортоэфирам, полиацеталям,полидигидропиранам, полицианоакрилатам и поперечно сшитым или амфипатическим блоксополимерам гидрогелей. Фармацевтические композиции, адаптированные для трансдермального введения, могут быть представлены в виде отдельных пластырей, предназначенных для сохранения тесного контакта с эпидермисом реципиента в течение длительного периода времени. Например, активный ингредиент может быть доставлен из пластыря путем ионофореза, как в основном описано в Pharmaceutical Research 1986, 3(6),318. Фармацевтические композиции, адаптированные для местного применения, могут быть получены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Фармацевтические композиции, адаптированные для ректального введения, могут быть получены в виде суппозиториев или в виде клизм. Фармацевтические композиции, адаптированные для назального введения, в которых носителем является твердое вещество, включают курсовой порошок, имеющий размер частиц, например, в диапазоне от 20 до 500 мкм, который вводят таким же образом, как и нюхательный табак, т.е. быстрым вдыханием через носовой ход из контейнера с порошком близко к носу. Подходящие составы, в которых носитель представляет собой жидкость, для введения в качестве спрея для носа или капель в нос, включают водные или масляные растворы активного ингредиента. Фармацевтические композиции, адаптированные для введения ингаляционным путем, включают тонкодисперсные порошки или аэрозоли, которые могут быть получены посредством различных типов мерных, находящихся под давлением дозирующих аэрозолей, небулайзеров или инжекторов. Фармацевтические композиции, адаптированные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические композиции, адаптированные для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворы, которые придают составу изотоничность с кровью определенного реципиента; водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Эти составы могут быть представлены в контейнерах для единичной дозы или в контейнерах для множественных доз, например, герметично закрытых ампулах и флаконах и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требуя только добавления стерильного жидкого носителя, например, воды для инъекций непосредственно перед применением. Приготовленные для немедленного приема инъекционные растворы и суспензии могут быть получены из стерильных порошков,гранул и таблеток. Должно быть понятно, что помимо ингредиентов, в частности упомянутых выше, составы могут включать другие агенты, общепринятые в данной области, имеющие отношение к типу рассматриваемого состава, например, те, которые подходят для перорального введения, могут включать вкусоароматические агенты. Термин "пациент" включает как людей, так и других животных. Термин "лечение" относится к (i) профилактике заболевания, нарушения или патологического состояния, от возникновения у пациента, который может быть предрасположен к этому заболеванию, нарушению и/или патологическому состоянию, но которое у него еще не диагностировано; (ii) ингибированию заболевания, нарушения или патологического состояния, т.е. задержке его развития; и (iii) к облегчению заболевания, нарушения или патологического состояния, т.е. к регрессии заболевания, нарушения и/или патологического состояния. Соединения по настоящему изобретению также можно вводить с циклоспорином, например циклоспорином A. Было показано, что циклоспорин A является активным в отношении HCV в клинических испытаниях (Hepatology 2003, 38, 1282; Biochem. Biophys. Res. Commun. 2004, 313, 42; J. Gastroenterol. 2003, 38, 567). В приведенной ниже табл. 1 приведены некоторые иллюстративные примеры соединений, которые можно вводить с соединениями по настоящему изобретению. Соединения по настоящему изобретению можно вводить с другими активными соединениями против HCV, в комбинированной терапии, либо совместно, либо отдельно, или путем объединения этих соединений в композицию. Таблица 1 Соединения по настоящему изобретению также могут быть использованы в качестве лабораторных реагентов. Соединения могут служить средством в обеспечении инструмента исследования для разработки исследований репликации вирусов, определения надежности систем исследования животных и изучений структурной биологии для дальнейшего расширения знаний о механизмах HCV заболевания. Далее, соединения по настоящему изобретению применимы в установлении или определении сайта связывания других противовирусных соединений, например, путем конкурентного ингибирования. Соединения по настоящему изобретению также могут быть использованы для лечения или предотвращения вирусной контаминации материалов и, следовательно, уменьшения риска вирусного инфицирования лаборатории или медицинского персонала или пациентов, которые контактируют с такими материалами, например, кровью, тканью, хирургическими инструментами и спецодеждой, лабораторными инструментами и спецодеждой и материалами и устройствами для сбора крови и трансфузии. Настоящее изобретение охватывает соединения формулы (I), полученные с помощью процессов синтеза или путем метаболических процессов, включая те, которые имеют место в организме человека или животного (in vivo) или процессов, происходящих in vitro. Сокращения, используемые в настоящем изобретении, в том числе, в частности, на иллюстративных схемах и в примерах, которые следуют далее, хорошо известны специалистам в данной области. Некоторые используемые сокращения представляют собой следующее: мин - минуты;RT - комнатная температура или время удерживания (в зависимости от контекста);Rt - время удерживания. Соединения и способы по настоящему изобретению будут лучше понятны в сочетании со следующими схемами синтеза, которые иллюстрируют способы, которыми могут быть получены соединения по настоящему изобретению. Исходные материалы могут быть получены из коммерческих источников или получены общепринятыми способами, описанными в литературе, известными специалистам в данной области. Специалисту в данной области будет очевидно, что соединения, определенные выше, могут быть синтезированы путем замены соответствующих реагентов и веществ в синтезе, показанном ниже. Специалисту в данной области также будет очевидно, что стадии селективной защиты и снятия защиты,а также порядок самих стадий может проводиться в различном порядке в зависимости от природы изменяемых компонентов для успешного завершения синтеза, представленного ниже. Изменяемые компоненты определены выше, если иное не определено ниже. Схема 1. Замещенные производные фенилглицина. Замещенные производные фенилглицина могут быть получены целым рядом способов, показанных ниже. Сложный т-бутиловый эфир фенилглицина может быть восстановительно алкилирован (путь А) с использованием соответствующего альдегида и восстановителя, такого как цианоборгидрид натрия в кислой среде. Гидролиз сложного т-бутилового эфира может осуществляться с использованием сильной кислоты, такой как HCl, или трифторуксусной кислоты. Альтернативно, фенилглицин может быть алкилирован алкилгалидом, таким как этилйодид и основанием, таким как бикарбонат натрия или карбонат калия (путь В). Путь С иллюстрирует восстановительное алкилирование фенилглицина как в пути А с последующим вторым восстановительным алкилированием альтернативным альдегидом, таким как формальдегид в присутствии восстановителя и кислоты. Путь D иллюстрирует синтез замещенных фенилглицинов через соотстветствующие аналоги миндальной кислоты. Превращение вторичного спирта в соответствующую требованиям уходящую группу может осуществляться с использованием птолуолсульфонилхлорида. Замещение тозилатной группы соответствующим амином с последующим восстановительным удалением бензилового сложного эфира может предоставить замещенные производные фенилглицина. В пути Е рацемическое замещенное производное фенилглицина может быть выделено путем этерификации с использованием энантиомерно чистой хиральной добавки, такой как, но не только (+)-1-фенилэтанол, (-)-1-фенилэтанол, оксазолидинон Эвана, или энантиомерно чистого пантолактона. Разделение диастереомеров осуществляется путем хроматографии (силикагель, HPLC, кристаллизация и так далее) с последующим удалением хиральной добавки, получая энантиомерно чистые производные фенилглицина. Путь Н иллюстрирует последовательность синтеза, которая пересекается с путем Е, где указанную выше хиральную добавку помещают перед добавлением амина. Альтернативно,сложный эфир арилуксусной кислоты может быть бромирован с использованием источника иона бромония, такого как бром, N-бромсукцинимид или CBr4. Полученный в результате бензиловый бромид может быть замещен целым рядом моно- или двузамещенных аминов в присутствии третичного аминного основания, такого как триэтиламин или основание Хунига. Гидролиз сложного метилового эфира путем обработки гидроксидом лития при низкой температуре, или 6 н. HCl при повышенной температуре обеспечивает получение замещенных производных фенилглицина. Другой способ покаан в пути G. Аналоги глицина могут быть преобразованы в производные с использованием целого ряда арилгалидов в присут-16 018793 ствии источника палладия (0), такого как палладий бис-(трибутилфосфин) и основания, такого как фосфат калия. Полученный в результате сложный эфир затем может быть гидролизован обработкой основанием или кислотой. Должно быть понятно, что другие хорошо известные способы получения производных фенилглицина существуют в уровне техники и могут быть изменены для получения желаемых соединений в этом описании. Также должно быть понятно, что конечные производные фенилглицина могут быть очищены до энантиомерной чистоты более 98 о/оо посредством препаративной HPLC. Схема 2. Ацилированные аминокислотные производные. В другом варианте осуществления настоящего изобретения ацилированные производные фенилглицина могут быть получены, как показано ниже. Производные фенилглицина, где карбоновая кислота защищена как легко удаляемый сложный эфир, могут быть ацилированы с использованием хлорангидрида в присутствии основания, такого как триэтиламин, для получения соответствующих амидов (путь А). Путь В иллюстрирует ацилирование исходного производного фенилглицина соответствующим хлорформиатом, тогда как путь С показывает взаимодействие с соответствующим изоцианатом или карбомоилхлоридом. С каждого из трех промежуточных соединений, показанных в путях А-С, может быть снята защита способами, известными специалистам в данной области (т.е. обработкой сложного т-бутилового эфира сильной кислотой, такой как HCl или трифторуксусная кислота). Схема 3. Аминозамещенные фенилуксусные кислоты могут быть получены путем обработки хлорметилфенилуксусной кислоты избытком амина. Синтез общих кислых предшественников. Оценку чистоты и массовый анализ с низким разрешением проводили на системе Shimadzu LC, соединенной с системой Waters Micromass ZQ MS. Следует отметить, что время удерживания может несколько варьировать между устройствами. Условия LC применимы к текущему разделу, если не указано иное. Условия MS-W1 Колонка=XTERRA 3,0 мм S7 Исходный % В=0 Конечный % В=100 Время градиентного элюирования=2 мин Время остановки=3 мин Скорость потока=5 мл/мин Длина волны=220 нм Растворитель А=0,1% TFA в 10% метаноле/90%H2O Растворитель В=0,1% TFA в 90% метаноле/10% H2O Условия MS-W2 Колонка=XTERRA 3,050 мм S7 Исходный % В=0 Конечный % В=100 Время градиентного элюирования=3 мин Время остановки=4 мин Скорость потока=4 мл/мин Длина волны=220 нм Растворитель А=0,1% TFA в 10% метаноле/90%H2O Растворитель В=0,1% TFA в 90% метаноле/10% H2O Условия MS-W5 Колонка=XTERRA 3,050 мм S7 Исходный % В=0 Конечный % В=30 Время градиентного элюирования=2 мин Время остановки=3 мин Скорость потока=5 мл/мин Длина волны=220 нм Растворитель А=0,1% TFA в 10% метаноле/90%H2O Растворитель В=0,1% TFA в 90% метаноле/10% H2O Условия D1 Колонка=XTERRA C18 3,050 мм S7 Исходный % В=0 Конечный % В=100 Время градиентного элюирования=3 мин Время остановки=4 мин Скорость потока=4 мл/мин Длина волны=220 нм Растворитель А=0,1% TFA в 10% метаноле/90%H2O Растворитель В=0,1% TFA в 90% метаноле/10% H2O Условия D2 Колонка=Phenomenex-Luna 4,650 мм S10 Исходный % В=0 Конечный % В=100 Время градиентного элюирования=3 мин Время остановки=4 мин Скорость потока=4 мл/мин Длина волны=220 нм Суспензию 10% Pd/C (2,0 г) в метаноле (10 мл) добавляли к смеси (R)-2-фенилглицина (10 г, 66,2 ммоль), формальдегида (33 мл 37 мас.%, в воде), 1 н. HCl (30 мл) и метанола (30 мл) и подвергали воздействию H2 (60 фунтов на квадратный дюйм) в течение 3 ч. Реакционную смесь фильтровали через диатомовую землю (Celite) и фильтрат концентрировали под вакуумом. Полученное в результате сырое вещество перекристаллизовывали из изопропанола с получением HCl соли "Кэп"-1 в виде белых игл(4,0 г). Вращение плоскости поляризации света: -117,1 [c=9,95 мг/мл в H2O; =589 нм]. 1LC (Cond. I): RT=0,25; LC/MS: Аналитический расчет для [M+H]+ C10H14NO2 180,10; найдено 180,17; HRMS: Аналитический расчет для [M+H]+ C10H14NO2 180,1025; найдено 180,1017.NaBH3CN (6,22 г, 94 ммоль) добавляли частями на протяжении нескольких минут в охлажденную(лед/вода) смесь (R)-2-фенилглицина (6,02 г, 39,8 ммоль) и метанола (100 мл) и перемешивали в течение 5 мин. Ацетальдегид (10 мл) добавляли по каплям на протяжении 10 мин и перемешивание продолжали при той же охлажденной температуре в течение 45 мин и при окружающей температуре в течение 6,5 ч. Реакционную смесь снова охлаждали на бане с ледяной водой, обрабатывали водой (3 мл) и затем гасили путем добавления по каплям концентрированной HCl на протяжении 45 мин, пока pH смеси не составил 1,5-2,0. Охлаждающую баню удаляли и перемешивание продолжали, добавляя концентрированную HCl для поддержания pH смеси около 1,5-2,0. Реакционную смесь перемешивали в течение ночи, фильтровали для удаления белой суспензии и фильтрат концентрировали под вакуумом. Сырое вещество перекристаллизовывали из этанола с получением HCl соли соединения "Кэп"-2 в виде сверкающего твердого вещества белого цвета в двух порциях (порция-1: 4,16 г; порция-2: 2,19 г). 1LC (условие I): RT=0,43 мин; LC/MS: Аналитический расчет для [M+H]+ C12H18NO2: 208,13; найдено 208,26.HCl (30 мл) и метанола (40 мл). Охлаждающую баню удаляли и реакционную смесь перемешивали в камере с H2 в течение 17 ч. Добавляли дополнительное количество ацетальдегида (10 мл, 178,2 ммоль) и перемешивание продолжали в атмосфере H2 в течение 24 ч [примечание: доставку H2 пополняли по мере необходимости на протяжении реакции]. Реакционную смесь фильтровали через диатомовую землю(Celite) и фильтрат концентрировали под вакуумом. Полученное в результате сырое вещество перекристаллизовывали из изопропанола с получением HCl соли (R)-2-(этиламино)-2-фенилуксусной кислоты в виде сверкающего твердого вещества белого цвета (2,846 г). 1[M+H]+ C10H14NO2: 180,10; найдено 180,18. Суспензию 10% Pd/C (536 мг) в метаноле/H2O (3 мл/1 мл) добавляли к смеси (R)-2-(этиламино)-2 фенилуксусной кислоты/HCl (1,492 г, 6,918 ммоль), формальдегида (20 мл 37 мас.%, в воде), 1 н. HCl (20 мл) и метанола (23 мл). Реакционную смесь перемешивали в камере с Н 2 в течение 72 ч, где доставку Н 2 восполняли по мере необходимости. Реакционную смесь фильтровали через диатомовую землю (Celite) и фильтрат концентрировали под вакуумом. Полученное в результате сырое вещество перекристаллизовывали из изопропанола (50 мл) с получением HCl соли соединения "Кэп"-3 в виде твердого вещества белого цвета (985 мг). 1[M+H]+ C11H16NO2: 194,12; найдено 194,18; HRMS: Аналитический расчет для [M+H]+C11H16NO2: 194,1180; найдено 194,1181.ClCO2Me (3,2 мл, 41,4 ммоль) добавляли по каплям к охлажденному (лед/вода) THF (410 мл) золю 81,52 ммоль) на протяжении 6 мин, перемешивали при аналогичной температуре в течение 5,5 ч. Летучий компонент удаляли под вакуумом и остаток разделяли между водой (100 мл) и этилацетатом(200 мл). Органический слой промывали с использованием 1 н. HCl (25 мл) и насыщенного раствораNaHCO3 (30 мл), сушили (MgSO4), фильтровали и концентрировали под вакуумом. Полученное в результате бесцветное масло растирали с гексаном, фильтровали и промывали гексаном (100 мл) с получением(R)-трет-бутил 2-(метоксикарбониламино)-2-фенилацетата в виде твердого вещества белого цвета (7,7 г). 1TFA (16 мл) добавляли по каплям к охлажденному (лед/вода) CH2Cl2 (160 мл) раствору указанного выше продукта на протяжении 7 мин, охлаждающую баню удаляли и реакционную смесь перемешивали в течение 20 ч. Поскольку снятие защиты все еще не было завершено, добавляли дополнительное количество TFA (1,0 мл) и перемешивание продолжали в течение дополнительных 2 ч. Летучий компонент удаляли под вакуумом и полученный в результате масляный остаток обрабатывали простым диэтиловым эфиром (15 мл) и гексаном (12 мл) с получением осадка. Осадок фильтровали и промывали простым диэтиловым эфиром/гексаном (соотношение 1:3; 30 мл) и сушили под вакуумом с получением "Кэп"-4 в виде рассыпчатого твердого вещества белого цвета (5,57 г). Вращение плоскости поляризации света:176,9 [с=3,7 мг/мл в H2O; =589 нм]. 1[M+H]+ C10H12NO4 210,08; найдено 210,17; HRMS: Аналитический расчет для [M+H]+ C10H12NO4 210,0766; найдено 210,0756. Смесь (R)-2-фенилглицина (1,0 г, 6,62 ммоль), 1,4-дибромбутана (1,57 г, 7,27 ммоль) и Na2CO3 (2,10 г, 19,8 ммоль) в этаноле (40 мл) нагревали при 100C в течение 21 ч. Реакционную смесь охлаждали до окружающей температуры и фильтровали, фильтрат концентрировали под вакуумом. Остаток растворяли в этаноле и подкисляли 1 н. HCl до pH 3-4, летучий компонент удаляли под вакуумом. Полученное в результате сырое вещество очищали с помощью HPLC с обращенной фазой (вода/метанол/TFA) с получением TFA соли "Кэп"-5 в виде полувязкой пены белого цвета (1,0 г). 1RT=0,30 мин (условие I); 98% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+TFA соль "Кэп"-6 синтезировали из (R)-2-фенилглицина и 1-бром-2-(2-бромэтокси)этана, используя способ получения "Кэп"-5. 1RT=0,32 мин (условие I); 98%; LC/MS: Аналитический расчет для [M+H]+ C12H16NO3: 222,11; найдено 222,20; HRMS: Аналитический расчет для [M+H]+ C12H16NO3: 222,1130; найдено 222,1121.CH2Cl2 (200 мл) раствор п-толуолсульфонилхлорида (8,65 г, 45,4 ммоль) добавляли по каплям к охлажденному (-5C) CH2Cl2 (200 мл) раствору (S)-бензил 2-гидрокси-2-фенилацетата (10,0 г, 41,3 ммоль),триэтиламина (5,75 мл, 41,3 ммоль) и 4-диметиламинопиридина (0,504 г, 4,13 ммоль), поддерживая температуру между -5 и 0C. Реакционную смесь перемешивали при 0C в течение 9 ч и затем хранили в морозильной камере (-25C) в течение 14 ч. Указанную реакционную смесь оставляли оттаивать до окружающей температуры и промывали водой (200 мл), 1 н. HCl (100 мл) и солевым раствором (100 мл),сушили (MgSO4), фильтровали и концентрировали под вакуумом с получением бензил 2-фенил-2(тозилокси)ацетата в виде вязкого масла, которое твердеет при стоянии (16,5 г). Хиральную чистоту продукта не проверяли и этот продукт использовали на следующей стадии без дополнительной очистки. 1RT=3,00 (условие III); 90% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+(3,36 мл, 30,3 ммоль) и N,N-диизопропилэтиленамина (13,2 мл, 75,8 ммоль) нагревали при 65C в течение 7 ч. Реакционную смесь оставляли охлаждаться до окружающей температуры и летучий компонент удаляли под вакуумом. Остаток разделяли между этилацетатом и водой и органический слой промывали водой и солевым раствором, сушили (MgSO4), фильтровали и концентрировали под вакуумом. Полученное в результате сырое вещество очищали с помощью флэш-хроматографии (силикагель, этилацетат) с получением бензил 2-(4-метилпиперазин-1-ил)-2-фенилацетата в виде оранжевато-коричневого вязкого масла (4,56 г). Хиральный HPLC анализ (Chiralcel OD-H) показал, что образец представляет собой смесь энантиомеров в соотношении от 38,2 до 58,7. Разделение энантиомеров осуществляли следующим образом: продукт растворяли в 120 мл смеси этанол/гептан (1:1) и вводили (5 мл/введение) в хиральнуюRT=2.10 (условие III); 98% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+C20H25N2O2: 325,19; найдено 325,20. Метанольный (10 мл) раствор любого энантиомера бензил 2-(4-метилпиперазин-1-ил)-2 фенилацетата (1,0 г, 3,1 ммоль) добавляли к суспензии 10% Pd/C (120 мг) в метаноле (5,0 мл). Реакционную смесь помещали в водородную камеру под пристальным мониторингом в течение 50 мин. Сразу же после завершения реакции катализатор фильтровали через диатомовую землю (Celite) и фильтрат концентрировали под вакуумом с получением соединения "Кэп"-7, с загрязнением фенилуксусной кислотой в виде пены желтовато-коричневого цвета (867,6 мг; масса выше теоретического выхода). Этот продукт использовали на следующей стадии без дополнительной очистки. 1RT=0,31 (условие II); 90% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+C13H19N2O2: 235,14; найдено 235,15; HRMS: Аналитический расчет для [M+H]+ C13H19N2O2: 235,1447; найдено 235,1440. Синтез "Кэп"-8 и "Кэп"-9 проводили в соответствии с синтезом "Кэп"-7, используя соответствующие амины для стадии замещения SN2 (т.е. 4-гидроксипиперидина для "Кэп"-8 и (S)-3-фторпирролидина для "Кэп"-9) и модифицированные условия для разделения соответствующих стереоизомерных промежуточных соединений, описанные ниже. Энантиомерное разделение промежуточного соединения бензил 2-(4-гидроксипиперидин-1-ил)-2 фенилацетата осуществляли, используя следующие условия: соединение (500 мг) растворяли в смеси этанол/гептан (5 мл/45 мл). Полученный в результате раствор вводили (5 мл/введение) в хиральнуюHPLC колонку (Chiracel OJ, 2 см ID25 см L, 10 мкм), элюируя с использованием смеси 80:20 гептан/этанол при 10 мл/мин, контролировали при 220 нм, с получением 186,3 мг энантиомера-1 и 209,1 мг энантиомера-2 в виде светло-желтых вязких масел. Этот сложный бензиловый эфир подвергали гидрогенолизу в соответствии с получением "Кэп"-7 с получением "Кэп"-8. 1RT=0,28 (условие II); 98% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+ Диастереомерное разделение промежуточного соединения бензил 2-S)-3-фторпирролидин-1-ил)-2 фенилацетата осуществляли, используя следующие условия: сложный эфир (220 мг) разделяли на хиральной HPLC колонке (Chiracel OJ-Н, 0,46 см ID25 см L, 5 мкм), элюируя с использованием 95%CO2/5% метанола с 0,1% TFA, при давлении 10 бар, со скоростью потока 70 мл/мин и при температуре 35C. HPLC элюат для соответствующих стереоизомеров концентрировали, остаток растворяли в CH2Cl2(20 мл) и промывали водной средой (10 мл воды + 1 мл насыщенного раствора NaHCO3). Органическую фазу сушили (MgSO4), фильтровали и концентрировали под вакуумом с получением 92,5 мг фракции -1 и 59,6 мг фракции -2. Эти бензиловые сложные эфиры подвергали гидрогенолизу в соответствии с получением "Кэп"-7 для получения "Кэпов"-9 а и 9b."Кэп"-9 а (диастереомер-1; образец представляет собой соль TFA как результат очистки на HPLC с обращенной фазой с использованием растворителя H2O/метанол/TFA). 1RT=0,42 (условие I); 95% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+LC/MS: Аналитический расчет для [M+H]+ C12H15FNO2: 224,11; найдено 224,14. К раствору D-пролина (2,0 г, 17 ммоль) и формальдегида (2,0 мл 37 мас.%, в H2O) в метаноле (15 мл) добавляли суспензию 10% Pd/C (500 мг) в метаноле (5 мл). Смесь перемешивали в камере с водородом в течение 23 ч. Реакционную смесь фильтровали через диатомовую землю (Celite) и концентрировали под вакуумом с получением "Кэп"-10 в виде твердого вещества беловатого цвета (2,15 г). 1RT=0,28 (условие II); 98% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+ Смесь (2S,4R)-4-фторпирролидин-2-карбоновой кислоты (0,50 г, 3,8 ммоль), формальдегид (0,5 мл 37 мас.%, в H2O), 12 н. HCl (0,25 мл) и 10% Pd/C (50 мг) в метаноле (20 мл) перемешивали в камере с водородом в течение 19 ч. Реакционную смесь фильтровали через диатомовую землю (Celite) и фильтрат концентрировали под вакуумом. Остаток перекристаллизовывали из изопропанола с получением HCl соли "Кэп"-11 в виде твердого вещества белого цвета (337,7 мг). 1RT=0,28 (условие II); 98% индекс гомогенности; LC/MS: Аналитический расчет для [M+H]+L-аланин (2,0 г, 22,5 ммоль) растворяли в 10% водном растворе карбоната натрия (50 мл) и к нему добавляли THF (50 мл) раствор метилхлорформиата (4,0 мл). Реакционную смесь перемешивали при окружающих условиях в течение 4,5 ч и концентрировали под вакуумом. Полученное в результате твердое вещество белого цвета растворяли в воде и подкисляли 1 н. HCl до pH 2-3. Полученные в результате растворы экстрагировали этилацетатом (3100 мл), объединенную органическую фазу сушили (Na2SO4),фильтровали и концентрировали под вакуумом с получением бесцветного масла (2,58 г). 500 мг этого вещества очищали с помощью HPLC с обращенной фазой (H2O/метанол/TFA) с получением 150 мг Смесь L-аланина (2,5 г, 28 ммоль), формальдегида (8,4 г, 37 мас.%), 1 н. HCl (30 мл) и 10% Pd/C (500 мг) в метаноле (30 мл) перемешивали в атмосфере водорода (50 фунтов на квадратный дюйм) в течение 5 ч. Реакционную смесь фильтровали через диатомовую землю (Celite) и фильтрат концентрировали под вакуумом с получением HCl соли "Кэп"-13 в виде масла, которое твердеет при стоянии под вакуумом(4,4 г; масса выше теоретического выхода). Продукт использовали без дополнительной очистки. 1 Стадия 1. Смесь (R)-(-)-D-фенилглицин трет-бутилового сложного эфира (3,00 г, 12,3 ммоль),NaBH3CN (0,773 г, 12,3 ммоль), KOH (0,690 г, 12,3 ммоль) и уксусной кислоты (0,352 мл, 6,15 ммоль) перемешивали в метаноле при 0C. К этой смеси добавляли глутаровый диальдегид (2,23 мл, 12,3 ммоль) по каплям на протяжении 5 мин. Реакционную смесь перемешивали, оставляя нагреваться до окружающей температуры, и перемешивание продолжали при той же температуре в течение 16 ч. Растворитель в последствии удаляли и остаток разделяли с использованием 10% водного NaOH и этилацетата. Органическую фазу отделяли, сушили (MgSO4), фильтровали и концентрировали до сухости с получением прозрачного масла. Это вещество очищали препаративной HPLC с обращенной фазой (Primesphere C-18,30100 мм; CH3CN-H2O-0,1% TFA) с получением промежуточного сложного эфира (2,70 г, 56%) в виде прозрачного масла. 1LC/MS: Аналитический расчет для C17H25NO2: 275; найдено: 276 (M+H)+. Стадия 2. К перемешанному раствору промежуточного сложного эфира (1,12 г, 2,88 ммоль) в дихлорметане (10 мл) добавляли TFA (3 мл). Реакционную смесь перемешивали при окружающей температуре в течение 4 ч и затем эту смесь концентрировали до сухости с получением светло-желтого масла. Это масло очищали, используя препаративную HPLC с обращенной фазой (Primesphere C-18, 30 100 мм;CH3CN-H2O-0,1% TFA). Соответствующие фракции объединяли и концентрировали до сухости под вакуумом. Остаток затем растворяли в минимальном количестве метанола и наносили на МСХ LP экстракционные картриджи (26 г). Эти картриджи промывали метанолом (40 мл) и затем желаемое соединение элюировали, используя 2 М аммиак в метаноле (50 мл). Фракции, содержащие продукт, объединяли и концентрировали и остаток помещали в воду. Лиофилизация этого раствора давала названное соединение (0,492 г, 78%) в виде твердого вещества светло-желтого цвета. 1LC/MS: Аналитический расчет для C13H17NO2: 219; найдено: 220 (M+H)+.(100 мл) добавляли твердый EDCI (12,46 г, 0,065 моль) все сразу. Полученный в результате раствор перемешивали при комнатной температуре в атмосфере Ar в течение 18 ч и затем этот раствор разбавляли этилацетатом, промывали (H2O2, солевой раствор), сушили (Na2SO4), фильтровали и концентрировали с получением бледно-желтого масла. Флэш-хроматография (SiO2 гексан-этилацетат, 4:1) этого масла давала названное соединение (11,64 г, 73%) в виде твердого вещества белого цвета. 1(S)-1-фенилэтил 2-бром-2-фенилацетата (0,464 г, 1,45 ммоль) в THF (8 мл) добавляли триэтиламин (0,61 мл, 4,35 ммоль), с последующим добавлением тетрабутиламминия йодида (0,215 г, 0,58 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин и затем добавляли раствор 4 метил-4-гидроксипиперидина (0,251 г, 2,18 ммоль) в THF (2 мл). Смесь перемешивали в течение 1 ч при комнатной температуре и затем эту смесь нагревали при 55-60C (температура масляной бани) в течение 4 ч. Охлажденную реакционную смесь затем разбавляли этилацетатом (30 мл), промывали (H2O2, солевой раствор), сушили (MgSO4), фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (0-60% этилацетат-гексан) с получением сначала (S,R) изомера названного соединения (0,306 г, 60%) в виде твердого вещества белого цвета и затем соответствующего (S,S) изомера(0,120 г, 23%), также в виде твердого вещества белого цвета.LCMS: Аналитический расчет для C22H27NO3: 353; найдено: 354 (M+H)+.LCMS: Аналитический расчет для C22H27NO3: 353; найдено: 354 (M+H)+. Стадия 3. (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилуксусная кислота. К раствору (S)-1 фенилэтил (R)-2-(4-гидрокси-4-метилпиперидин-1-ил)-2-фенилацетата (0,185 г, 0,52 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества в последствии удаляли под вакуумом и остаток очищали препаративной HPLC с обращенной фазой (Primesphere C-18, 20100 мм; CH3CN-H2O-0,1% TFA) с получением названного соединения (в виде соли TFA) в виде твердого вещества бледного голубоватого цвета (0,128 г, 98%).LCMS: Аналитический расчет для C14H19NO3: 249; найдено: 250 (M+H)+. Стадия 1. (S)-1-фенилэтил 2-(2-фторфенил)ацетат. Смесь 2-фторфенилуксусной кислоты (5,45 г,35,4 ммоль), (S)-1-фенилэтанола (5,62 г, 46,0 ммоль), EDCI (8,82 г, 46,0 ммоль) и DMAP (0,561 г, 4,60 ммоль) в CH2Cl2 (100 мл) перемешивали при комнатной температуре в течение 12 ч. Растворитель затем концентрировали и остаток разделяли H2O-этилацетатом. Эти фазы разделяли и водный слой обратно экстрагировали этилацетатом (2). Объединенные органические фазы промывали (H2O, солевой раствор), сушили (Na2SO4), фильтровали и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на силикагеле (Biotage/0-20% этилацетат-гексан) с получением названного соединения в виде бесцветного масла (8,38 г, 92%).H NMR (400 MHz, CD3OD)7,32-7,23 (m, 7 Н), 7,10-7,04 (m, 2), 5,85 (q, J=6,5 Hz, 1H), 3,71 (s, 2H),1,48 (d, J=6,5 Hz, 3H). Стадия 2. (R)-S)-1-фенилэтил) 2-(2-фторфенил)-2-(пиперидин-1-ил)ацетат. К раствору (S)-1 фенилэтил 2-(2-фторфенил)ацетата (5,00 г, 19,4 ммоль) в THF (1200 мл) при 0C добавляли DBU (6,19 г,40,7 ммоль) и раствор оставляли нагреваться до комнатной температуре при перемешивании в течение 30 мин. Этот раствор затем охлаждали до-78C и добавляли раствор CBr4 (13,5 г, 40,7 ммоль) в THF (100 мл) и смесь оставляли нагреваться до -10C и перемешивали при этой температуре в течение 2 ч. Реакционную смесь гасили насыщенным водным NH4Cl и слои разделяли. Водный слой обратно экстрагировали этилацетатом (2) и объединенные органические фазы промывали (H2O, солевой раствор), сушили(Na2SO4), фильтровали и концентрировали под вакуумом. К остатку добавляли пиперидин (5,73 мл, 58,1 ммоль) и раствор перемешивали при комнатной температуре в течение 24 ч. Летучие вещества затем концентрировали под вакуумом и остаток очищали с помощью хроматографии на силикагеле (Biotage/030% диэтиловый простой эфир-гексан) с получением чистой смеси диастереомеров (соотношение 2:1 по данным 1H NMR) в виде желтого масла (2,07 г, 31%), вместе с непрореагировавшим исходным веществом (2,53 г, 51%). Дальнейшая хроматография диастереомерной смеси (Biotage/0-10% диэтиловый простой эфир-толуол) давала названное соединение в виде бесцветного масла (0,737 г, 11%). 1LCMS: Аналитический расчет для C21H24FNO2: 341; найдено: 342 (M+H)+. Стадия 3. (R)-2-(2-фторфенил)-2-(пиперидин-1-ил)уксусная кислота. Смесь (R)-S)-1-фенилэтил) 2(2-фторфенил)-2-(пиперидин-1-ил)ацетата (0,737 г, 2,16 ммоль) и 20% Pd(OH)2/C (0,070 г) в этаноле (30 мл) гидрогенизировали при комнатной температуре и атмосферном давлении (H2 камера) в течение 2 ч. Раствор затем продували Ar, фильтровали через диатомовую землю (Celite) и концентрировали под вакуумом. Это давало названное соединение в виде бесцветного твердого вещества (0,503 г, 98%). 1LCMS: Аналитический расчет для C13H16FNO2: 237; найдено: 238 (M+H)+.(S)-1-фенилэтил 2-бром-2-фенилацетата (1,50 г, 4,70 ммоль) в THF (25 мл) добавляли триэтиламин (1,31 мл, 9,42 ммоль) с последующим добавлением тетрабутиламмония йодида (0,347 г, 0,94 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 мин и затем добавляли раствор 4 фенил-4-гидроксипиперидина (1,00 г, 5,64 ммоль) в THF (5 мл). Смесь перемешивали в течение 16 ч и затем эту смесь разбавляли этилацетатом (100 мл), промывали (H2O2, солевой раствор), сушили(MgSO4), фильтровали и концентрировали. Остаток очищали на колонке с силикагелем (0-60% этилацетат-гексан) с получением приблизительно 2:1 смеси диастереомеров по данным 1H NMR. Разделение этих изомеров проводили с помощью сверхкритической хроматографии (Chiralcel OJ-H, 30250 мм; 20% этанол в CO2 при 35C) с получением сначала (R) изомера названного соединения (0,534 г, 27%) в виде желтого масла и затем соответствующего (S) изомера (0,271 г, 14%), также в виде желтого масла.LCMS: Аналитический расчет для C27H29NO3: 415; найдено: 416 (M+H)+.LCMS: Аналитический расчет для C27H29NO3: 415; найдено: 416 (M+H)+. Следующие сложные эфиры были получены аналогичным образом. Хиральная SFC Условия для определения времени удерживания Условие I Колонка: Chiralpak AD-H Column, 4,6250 мм, 5 мкм Растворители: 90% CO2-10% метанол с 0,1% DEA Темп.: 35C Давление: 150 бар Скорость потока: 2,0 мл/мин УФ-контроль 220 нм Введение: 1,0 мг/3 мл метанол Условие II Колонка: Chiralcel OD-H Column, 4,6250 мм, 5 мкм Растворители: 90% СО 2-10% метанол с 0,1%DEA Темп.: 35C"Кэп"-17, стадия 2. (R)-2-(4-гидрокси-4-фенилпиперидин-1-ил)-2-фенилуксусная кислота. К раствору (S)-1-фенилэтил (R)-2-(4-гидрокси-4-фенилпиперидин-1-ил)-2-фенилацетата (0,350 г, 0,84 ммоль) в дихлорметане (5 мл) добавляли трифторуксусную кислоту (1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Летучие вещества в последствии удаляли под вакуумом и остаток очищали препаративной HPLC с обращенной фазой (Primesphere C-18, 20100 мм; CH3CN-H2O-0,1% TFA) с получением названного соединения (в виде соли TFA) в виде твердого вещества белого цвета (0,230 г, 88%).LCMS: Аналитический расчет для C19H21NO3: 311,15; найдено: 312 (M+H)+. Следующие карбоновые кислоты были получены в оптически чистой форме аналогичным образом.LCMS Условия для определения времени удерживания Условие I Колонка: Phenomenex-Luna 4,650 мм S10 Исходный % В=0 Конечный % В=100 время градиентного элюирования=4 мин Скорость потока=4 мл/мин Длина волны=220 Растворитель А=10% метанол - 90% H2O - 0,1% TFA Растворитель В=90% метанол - 10% H2O - 0,1% TFA Условие II Колонка: Waters-Sunfire 4,650 мм S5
МПК / Метки
МПК: C07D 405/14, A61K 31/439, C07D 403/04, A61K 31/4178, A61P 31/14
Метки: вируса, гепатита, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-18793-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита с</a>
Предыдущий патент: Трубное соединение с самофиксирующимися резьбами для применения в нефтедобывающей промышленности
Следующий патент: Способ активации катализатора в процессах фишера-тропша
Случайный патент: Новый способ бурения подземных полостей