Замещенные 2-[2-(фенил)этиламино]алканамидные производные и применение указанных соединений в качестве модуляторов натриевых и/или кальциевых каналов
Номер патента: 18195
Опубликовано: 28.06.2013
Авторы: Иццо Эмануела, Рэстиво Алессандра, Коломбо Елена, Франчискони Симона, Сабидо-Давид Чибэле, Меллони Пьеро
Формула / Реферат
1. Соединение общей формулы (I)
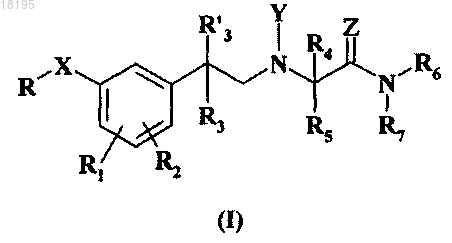
где X означает -О-, -S- или -SO2-;
Y означает водород или O-(C1-C4)алкил;
Z означает =O или =S;
R означает (C3-C8)алкил или w-трифтор(C3-C8)алкил;
R1 и R2 независимо означают водород, (C1-C4)алкокси или галоген;
R3 и R'3 независимо означают водород или (C1-C4)алкил;
R4 и R5 независимо означают водород, (C1-C4)алкил или
R4 означает водород и R5 означает -CH2-OH;
R6 и R7 независимо означают водород или (C1-C6)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбранный из -О- и -NR8-, выбранный из пирролидина, пиперидина, морфолина и пиперазина, где дополнительный гетероатом представляет собой группу -NR8-, где R8 означает водород или (C1-C4)алкил,
при условии, что, когда X означает -S- или -SO2-, Y не может означать O-(C1-C4)алкил;
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором
X означает -O-, -S-;
Y означает водород или O-(C1-C3)алкил;
Z означает =O или =S;
R означает (C4-C6)алкил или w-трифтор(C4-C6)алкил;
R1 и R2 независимо означают водород, (C1-C4)алкокси или галоген;
R3 и R'3 независимо означают водород или (C1-C3)алкил;
R4 и R5 независимо означают водород или (C1-C3)алкил или
R4 означает водород и R5 означает -CH2-OH;
R6 и R7 независимо означают водород или (C1-C4)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбранный из -О- и -NR8-, пирролидина, пиперидина, морфолина и пиперазина, где дополнительный гетероатом представляет собой группу -NR8-, где R8 означает водород или (C1-C4)алкил,
при условии, что, когда X означает -S-, Y не может означать О-(C1-C3)алкил;
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и его фармацевтически приемлемые соли.
3. Соединение по п.1, в котором
X означает -О- или -S-;
Y означает водород или метокси;
Z означает =O или =S;
R означает (C4-C6)алкил или w-трифторбутил;
R1 и R2 независимо означают водород, метокси или фтор;
R3 и R'3 независимо означают водород или метил;
R4 и R5 независимо означают водород или метил или
R4 означает водород и R5 означает группу -CH2-OH;
R6 и R7 независимо означают водород или (C1-C4)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, выбранный из пирролидина, пиперидина, морфолина и N-метилпиперазина,
при условии, что, когда X означает -S-, Y не может означать метокси;
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и его фармацевтически приемлемые соли.
4. Соединение по п.1, в котором
X означает -O-;
Y означает водород;
Z означает =O;
R означает (C4-C6)алкил;
R1 и R2 независимо означают водород или фтор;
R3, R'3, R4 и R5 означают водород;
R6 и R7 независимо означают водород или (C1-C3)алкил;
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и его фармацевтически приемлемые соли.
5. Соединение по п.1, выбираемое из
2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида;
2-{2-[3-(4,4,4-трифторбутокси)фенил]этиламино}-N,N-диметилацетамида;
2-[2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-гексилоксифенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутоксифенил)этиламино]-N,N-дипропилацетамида;
2-[2-(3-бутоксифенил)этиламино]-N,N-дибутилацетамида;
2-[2-(3-пентилоксифенил)этиламино]-N,N-дипропилацетамида;
2-[2-(3-бутоксифенил)этиламино]ацетамида;
2-[2-(3-бутоксифенил)этиламино]-N-метилацетамида;
2-[2-(3-изопропоксифенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутоксифенил)этиламино]-N,N-диэтилацетамида;
2-[2-(3-бутоксифенил)этиламино]-1-пирролидин-1-илэтан-1-она;
2-[2-(3-бутокси-4-фторфенил)этиламино]-N,N-диэтилацетамида;
2-[2-(3-бутокси-4-метоксифенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутоксифенил)этиламино]-2,N,N-триметилпропанамида;
2-[2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамида;
2-[2-(3-бутоксифенил)этиламино]-3-гидрокси-N,N-диметилпропанамида;
2-[2-(3-бутокси-2,6-дифторфенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутоксифенил)-2-метилпропиламино]-N,N-диметилацетамида;
2-[2-(3-бутилтиофенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутилсульфонилфенил)этиламино]-N,N-диметилацетамида;
2-[2-(3-бутоксифенил)этиламино]-N,N-диметилтиоацетамида;
2-[2-(3-бутоксифенил)-(N'-метокси)этиламино]-N,N-диметилацетамида,
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и фармацевтически приемлемые соли указанных соединений, предпочтительно соли с хлористо-водородной или метансульфоновой кислотой.
6. Соединение по п.1, которым является
2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид;
2-[2-(3-бутокси-2,6-дифторфенил)этиламино]-N,N-диметилацетамид;
2-[2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамид;
2-[2-(3-гексилоксифенил)этиламино]-N,N-диметилацетамид;
2-[2-(3-бутоксифенил)этиламино]-N-метилацетамид;
2-[2-(3-бутокси-4-метоксифенил)этиламино]-N,N-диметилацетамид;
2-[2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамид;
2-[2-(3-бутоксифенил)этиламино]-1-пирролидин-1-илэтан-1-он;
2-[2-(3-бутоксифенил)-2-метилпропиламино]-N,N-диметилацетамид;
2-[2-(3-бутоксифенил)-(N'-метокси)этиламино]-N,N-диметилацетамид или
2-[2-(3-бутокси-4-фторфенил)этиламино]-N,N-диэтилацетамид,
и фармацевтически приемлемые соли указанных соединений, предпочтительно соли с хлористо-водородной или метансульфоновой кислотой.
7. Соединение по п.6, которым является 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид или фармацевтически приемлемая соль указанного соединения, предпочтительно гидрохлорид или метансульфонат.
8. Соединение по п.1, в котором
X означает -SO2-; или
Y означает О-(C1-C4)алкил; или
Z означает =S; или
R означает w-трифтор(C3-C8)алкил; или
R1 и/или R2 отличны от водорода; или
как R3, так и R'3 отличны от водорода; или
как R4, так и R5 отличны от водорода; или
R6 и R7 вместе со смежным атомом азота образуют моноциклический 5-6-членный насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбранный из -О- и -NR8-, где R8 означает водород или (C1-C4)алкил, выбранный из пирролидина, пиперидина, морфолина и пиперазина, где дополнительный гетероатом представляет собой группу -NR8-, где R8 означает водород или (C1-C4)алкил,
при условии, что, когда X означает -S- или -SO2-, Y не может означать О-(C1-C4)алкил;
в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме, либо в виде смеси указанных изомеров в любом соотношении,
и его фармацевтически приемлемые соли.
9. Применение соединения по любому из пп.1-8 в качестве лекарственного средства, активного в качестве модулятора натриевых и/или кальциевых каналов.
10. Применение соединения по п.1 в качестве лекарственного средства, активного в качестве модулятора натриевых и/или кальциевых каналов, для лечения патологий, при которых вышеуказанный(ые) механизм(ы) считается(ются) выполняющим(ими) патологическую роль, таких как неврологические, когнитивные, психические, воспалительные, мочеполовые или желудочно-кишечные нарушения, указанное лекарственное средство, по существу, не обладает ингибирующей активностью в отношении MAO или обладает существенно пониженной ингибирующей активностью в отношении MAO.
11. Применение по п.10, где соединением является соединение по любому из пп.2-4.
12. Применение по п.10, где соединением является соединение по п.5.
13. Применение по п.10, где соединением является соединение по п.6.
14. Применение по п.10, где соединением является соединение по п.7.
15. Применение по п.10, где нарушением является неврологическое нарушение, выбираемое из боли и мигрени.
16. Применение по п.15, где боль представляет собой синдром невропатической боли или синдром воспалительной боли.
17. Применение по п.15, где боль является острой или хронической болью.
18. Применение по п.10, где нарушение является неврологическим нарушением, выбираемым из болезни Альцгеймера, болезни Паркинсона, эпилепсии, синдрома усталых ног, внезапного приступа или ишемии головного мозга.
19. Применение по п.10, где нарушение представляет собой воспалительный процесс, затрагивающий все системы организма, такие как скелетно-мышечная система, артритическое состояние, такое как анкилозирующий спондилит, цервикальный артрит, фибромиалгия, подагра, ювенильный ревматоидный артрит, пояснично-крестцовый артрит, остеоартрит, остеопороз, псориатический артрит и ревматизм, нарушение, затрагивающее кожу и родственные ткани, нарушение дыхательной системы или нарушение иммунной и эндокринной системы.
20. Применение по п.10, где нарушение представляет собой когнитивное и/или психическое нарушение, выбираемое из умеренного когнитивного нарушения, депрессии, биполярного расстройства, мании, шизофрении, психоза, тревожности и зависимости.
21. Применение по п.10, где нарушение представляет собой мочеполовое расстройство.
22. Применение по п.10, где нарушение представляет собой желудочно-кишечное расстройство.
23. Применение по любому из пп.10 и 15-22, где указанное соединение используется в сочетании с одним или несколькими другими терапевтическими средствами.
24. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства, активного в качестве модулятора натриевых и/или кальциевых каналов, для лечения патологий, в которых вышеуказанный(ые) механизм(ы) играет(ют) патологическую роль, таких как неврологические, когнитивные, психические, воспалительные, мочеполовые или желудочно-кишечные нарушения, указанное лекарственное средство, по существу, не обладает ингибирующей активностью в отношении MAO или обладает существенно пониженной ингибирующей активностью в отношении MAO.
25. Применение по п.24, где нарушение представляет собой любое нарушение по пп.15-22.
26. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-8 вместе с фармацевтически приемлемыми терапевтически инертными органическими или неорганическими веществами-носителями.
27. Применение по п.20, где указанное соединение используют в сочетании с одним или несколькими другими терапевтическими средствами по п.23, где другим терапевтическим средством является антипсихотическое средство.
28. Применение по п.20, где указанное соединение используют в сочетании с одним или несколькими другими терапевтическими средствами по п.23, где указанным соединением является 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид или фармацевтически приемлемая соль указанного соединения и антипсихотическое средство выбирают из галоперидола, рисперидона и клозапина.
29. Применение по п.20, где указанное соединение используют в сочетании с одним или несколькими терапевтическими средствами по п.23, где указанным соединением является гидрохлорид или метансульфонат 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамида и антипсихотическим средством является галоперидол или рисперидон.
30. Применение по п.19, где нарушением является нарушение иммунной системы, такое как рассеянный склероз или другие демиелинизирующие нарушения.
31. Применение по любому из пп.10-25, 27-30, где пациенты, страдающие нарушением (нарушениями), особенно чувствительны к неблагоприятным побочным действиям, обусловленным ингибирующей активностью в отношении MAO.
Текст
ЗАМЕЩЕННЫЕ 2-[2-(ФЕНИЛ)ЭТИЛАМИНО]АЛКАНАМИДНЫЕ ПРОИЗВОДНЫЕ И ПРИМЕНЕНИЕ УКАЗАННЫХ СОЕДИНЕНИЙ В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ И/ИЛИ КАЛЬЦИЕВЫХ КАНАЛОВ Изобретение относится к замещенным 2-[2-(фенил)этиламино]алканамидным производным формулы (I), в которой X, Y, Z, R, R1, R2, R3, R'3, R4, R5, R6, R7 имеют указанные в описании значения, и фармацевтически приемлемым солям указанных соединений, фармацевтическим композициям, содержащим такие соединения в качестве активного ингредиента, и применению указанных композиций в качестве модуляторов натриевых и/или кальциевых каналов, полезных для предупреждения, ослабления и излечивания широкого ряда патологий, включающих, но не в порядке ограничения, неврологические, когнитивные, психические, воспалительные, мочеполовые и желудочно-кишечные заболевания, для которых вышеуказанные механизмы установлены как выполняющие патологическую роль. Настоящее изобретение относится к замещенным 2-[2-(фенил)этиламино]алканамидным производным, фармацевтически приемлемым солям указанных соединений, фармацевтическим композициям,содержащим указанные соединения, и применению указанных соединений в качестве модуляторов натриевых и/или кальциевых каналов. Производные, являющиеся целью настоящего изобретения, активны в качестве модуляторов натриевых и/или кальциевых каналов и поэтому полезны для предупреждения, ослабления и излечивания широкого ряда патологий, включающих, но не в порядке ограничения, неврологические, когнитивные,психические, воспалительные, мочеполовые и желудочно-кишечные заболевания, при которых вышеуказанные механизмы считаются выполняющими патологическую роль. Соединения по настоящему изобретению, по существу, не оказывают ингибирующего действия в отношении моноаминоксидазы (MAO), в особенности при дозах, терапевтически эффективных для предупреждения, ослабления и/или излечивания указанных болезней. Уровень техники Химическое обоснование. Патент GB 586645 описывает синтез аминокислотных производных следующей общей формулы: В частности, указанный патент описывает синтез N-гидроксиалкиламидов, обладающих стимулирующими свойствами в отношении гладкой мышцы матки. Патентная заявка WO 90/14334 описывает монозамещенные производные N-фенилалкил-альфааминокарбоксамида следующей общей формулы: где R означает (C1-C8)алкил, (C3-C8)циклоалкил, фурил, тиенил, пиридил или фенильный цикл, необязательно замещенный 1-4 заместителями, независимо выбираемыми из галогена, (C1-C6)алкила,(C1-C6)алкокси и трифторметила; А означает -(CH2)m-, -(CH2)р-Х-(CH2)q-группу, где m является целым числом от 1 до 4, один из p и q равен 0 и другой равен 0 или означает целое число от 1 до 4, X означает -О-, -S- или -NR4-, где R4 означает водород или (C1-C4)алкил, n равно 0 или 1; каждый из R1 и R2 независимо означает водород или (C1-C4)алкил;R3 и R3' вместе образуют (C3-C6)циклоалкильное кольцо; каждый из R5 и R6 независимо означает водород или (C1-C6)алкил,при условии, что, когда R означает (C1-C8)алкил, А означает -(CH2)P-X-(CH2)q- группу, в которой р и q,оба, равны 0 и X означает -О-, -S- или -NR4-, где R4 означает водород или C1-C4-алкил, полезные для применения в качестве противоэпилептических средств, средств для лечения болезни Паркинсона, нейропротективных, антидепрессорных, антиспастических и/или снотворных средств. Ни одно из производных, синтезированных согласно данной патентной заявке, не описано конкретно и не имеется данных о его получении в WO 90/14334. В других патентных заявках выбранные соединения, подпадающие под общую формулуWO 90/14334, заявлены для применения в композициях, обладающих другими активностями, а именно:WO 03/020273 - фармацевтическая композиция, включающая габапентин или соответствующие аналоги и альфа-аминоамид, и применение указанной композиции для обезболивания;WO 04/062655 - альфа-аминоамидные производные, полезные в качестве средств против мигрени;WO 05/070405 - альфа-аминоамидные производные, полезные для лечения нарушений нижних мочевыводящих путей;WO 05/102300 - альфа-аминоамидные производные, полезные для лечения синдрома усталых ног и аддитивных нарушений;WO 06/027052 - применение (галогенбензилокси)бензиламинопропанамидов для производства лекарственных средств, активных в качестве селективных модуляторов натриевых и/или кальциевых каналов; ЕР 06012352.8 - -аминоамидные производные, полезные для лечения когнитивных расстройств. В патентной заявке WO 98/35957 описаны амидные производные следующей общей формулы: и заявлены как полезные против ожирения и расстройств пищевого поведения. Ни одно из соединений, синтезированных согласно данной патентной заявке, не описано конкретно и не было фактически синтезировано или конкретно перечислено в указанной WO 98/35957. В WO 2004/087125 описаны соединения следующей общей формулы: Заявлены механизм блокирования натриевых каналов и многочисленные фармакологические активности, в частности противоболевые активности и действия против дисфункции мочевого пузыря. Следует подчеркнуть, что когда Х 2 означает алкилен, то алкилен не может представлять собой-CH2-CH2-, а только является -CH2-, таким образом, ни одно из 2-[2-(фенил)этиламино]алканамидных производных по настоящей заявке не подпадает под вышеуказанную общую формулу.Eleonora Ghidini и др. в BioorganicMedicinal Chemistry. 2006, 14, 3263-3274 описывают соединения следующей общей формулы: Указанные соединения прошли испытание на противосудорожную активность. Ни одно из соединений, описанных и синтезированных в данной патентной заявке, не подпадает под вышеуказанную общую формулу. Совместно рассматриваемая заявка РСТ/ЕР 2006/011443 (WO 2007/071311), поданная 29 ноября 2006 г., касается 2-фенилэтиламинопроизводных следующей общей формулы: Ни одно из соединений, заявленных в данной патентной заявке, не подпадает под РСТ/ЕР 2006/011443 (WO 2007/071311). Биологическое обоснование. Натриевые каналы играют важную роль в нейронной сети, быстро передавая электрические импульсы через клетки и сети клеток, координируя, таким образом, высшие процессы, охватывающие диапазон от локомоции до когнитивности. Указанные каналы представляют собой крупные трансмембранные белки, способные переключаться в различные состояния, обеспечивающие избирательную проницаемость для натриевых ионов. Для такого процесса требуется потенциал действия, чтобы деполяризовать мембраны, и, следовательно, указанные каналы являются потенциалозависимыми. За последние несколько лет достигнуто значительно лучшее понимание роли натриевых каналов и взаимодействующих с указанными каналами лекарственных средств. Потенциалозависимые натриевые каналы были первоначально классифицированы на основе чувствительности к тетродотоксину, от низкой наномолярной (чувствительные к тетродотоксину, TTXs) до высокой микромолярной (устойчивые к тетродотоксину, TTXr). К настоящему времени идентифицированы 9 различных -субъединиц натриевых каналов и классифицированы как Nav1.1-Nav1.9.Nav1.1-Nav1.3 и Nav1.6 главным образом экспрессируются в ЦНС, тогда как Nav1.4 и Nav1.5 в основном экспрессируются в мышце (скелетной и сердечной соответственно), a Nav1.7, Nav1.8 и Nav1.9 преимущественно экспрессируются в DRG-сенсорных нейронах. Выяснилось, что ряд лекарственных средств с неизученным механизмом действия фактически оказывает действие путем модулирования проводимости натриевых каналов, включая местные анестезирующие вещества, антиаритмические препараты класса I и противосудорожные средства. Нейронные блокаторы натриевых каналов нашли применение, включающее использование указанных блокаторов в лечении эпилепсии (фенитоин и карбамазепин), биполярного расстройства (ламотригин), предупреждении нейродегенерации и ослаблении невропатической боли. Различные противоэпилептические лекарственные средства, стабилизирующие нейронную возбудимость, эффективны при невропатической боли Кроме того, увеличение экспрессии или активности натриевых каналов наблюдается в ряде моделей воспалительной боли, что говорит о роли натриевых каналов в воспалительной боли. Кальциевые каналы представляют собой перекрывающие мембрану белки из многих субъединиц,которые позволяют контролировать вход кальциевых ионов в клетки из внеклеточной жидкости. Вообще, кальциевые каналы являются зависимыми от потенциала и носят название потенциалозависимых кальциевых каналов (VGCC). VGCC найдены во всей нервной системе млекопитающих, где указанные каналы регулируют внутриклеточные уровни ионов кальция, которые важны для жизнеспособности и функционирования клеток. Внутриклеточные концентрации ионов кальция непосредственно вовлечены в ряд процессов жизнедеятельности животных, таких как высвобождение нейромедиатора, сокращение мышцы, пейсмейкерная активность и секреция гормонов. Все "возбудимые" клетки в организме животных, такие как нейроны центральной нервной системы (ЦНС), периферические нервные клетки и мышечные клетки, включая соответствующие клетки скелетных мышц, сердечных мышц и венозных и артериальных гладких мышц, имеют зависимые от напряжения кальциевые каналы. Кальциевые каналы образуют большое семейство с множеством генетически, физиологически и фармакологически различных субтипов. На основании биофизических свойств кальциевых токов, регистрируемых на отдельных нейронах, охарактеризованы два суперсемейства: активируемые высоким напряжением (HVA) и активируемые низким напряжением (LVA) кальциевые каналы. Кальциевые токи,называемые L-типа, P-типа, Q-типа, N-типа, R-типа, являются HVA, тогда как T-типа относятся к LVA. На основании молекулярной идентичности установлено десять различных субтипов кальциевых каналов,клонированных, экспрессированных и подразделенных на три семейства: семейство Cav1 (Cav1.1, 1.2,1.3, 1.4) функционально связано с Ca-током L-типа; семейство Cav2 (Cav2.1, 2.2, 2.3) функционально связано с токами P/Q, N, R-типа и семейство Cav3 (Cav3.1, 3.2, 3.3) функционально связано с токами Tтипа. Считается, что кальциевые каналы имеют отношение к некоторым болезненным состояниям. Предполагается, что ряд соединений, полезных для лечения различных сердечно-сосудистых заболеваний у млекопитающих, включая людей, оказывает благоприятные воздействия посредством модулирования функций зависимых от потенциала кальциевых каналов, присутствующих в сердечной и/или сосудистой гладкой мышце. Соединения, обладающие активностью по отношению к кальциевым каналам, могут также быть привлечены в случае лечения боли. В частности, предполагается как по распределению в тканях, так и по результатам некоторых фармакологических исследований, что кальциевые каналы Nтипа (Cav2.2), отвечающие за регуляцию высвобождения нейромедиатора, играют существенную роль в ноцицептивной передаче. На моделях невропатической боли при телесном повреждении установлено,что кальциевые каналы N-типа являются активированными в ипсилатеральном заднем роге (Cizkova D.,Marsala J., Lukacova N., Marsala M Jergova S., Orendacova J., Yaksh T.L. Exp. Brain. Res. (2002), 147: 456463). Показано, что специфические блокаторы кальциевых каналов N-типа эффективны для ослабления болевых реакций в моделях невропатической боли (Mattews E.-A., Dickenson A.H. Pain (2001), 92: 235246), на II фазе формалинового теста (Diaz A., Dickenson A.H. Pain (1997), 69: 93-100) и при гипералгезии, вызванной воспалением коленного сустава (Nebe J., Vanegas H., Schaible H.G. Exp. Brain. Res. (1998),120: 61-69). Обнаружено, что мутантные мыши, лишенные кальциевых каналов N-типа, обладают пониженной реакцией на постоянную боль, как видно из снижения болевой реакции на II фазе формалинового теста (Kim С., Jun K., Lee Т., Kim S.S., Mcenery M.W., Chin H., Kim H.L, Park J.M., Kim D.K., Jung S.J.,Kim J., Shin H.S. Mol. Cell Neurosci. (2001), 18: 235-245; Hatakeyama S., Wakamori M., Ino M., MiyamotoN., Takahashi E., Yoshinaga Т., Sawada K., Imoto K., Tanaka I., Yoshizawa Т., Nishizawa Y., Mori Y., Nidome Т., Shoji S. Neuroreport (2001), 12: 2423-2427), а также на невропатическую боль, что оценено по снижению механической аллодинии и термической гипералгезии на модели лигатуры спинального нерва. Интересно, что такие мыши также характеризуются более низкими уровнями тревожности по сравнению с немутантным типом (Saegusa H., Kurihara Т., Zong S., Kazuno A., Matsuda Y., Nonaka Т., Han W., ToriyamaH., Tanabe Т., ЕМВО J. (2001), 20: 2349-2356). Вовлеченность кальциевых каналов N-типа в болевой синдром дополнительно подтверждена в клинике с помощью зиконотида, пептида, полученного из яда морской змеи, Conus Magnus. Ограничение в терапевтическом применении данного пептида состоит в том,что указанный пептид вводят человеку интратекально (Bowersox S.S. and Luther R. Toxicon (1998), 36: 1651-1658). Все вместе полученные данные указывают на то, что соединения, обеспечивающие блокаду натриевых и/или кальциевых каналов, обладают высоким терапевтическим потенциалом в отношении предупреждения, ослабления и излечивания широкого ряда патологий, включающих неврологические, психические, мочеполовые и желудочно-кишечные заболевания, для которых вышеуказанные механизмы установлены как выполняющие патологическую роль. Существуют многочисленные документы и патенты,описывающие модуляторы или антагонисты натриевых каналов и/или кальциевых каналов для лечения или модулирования множества заболеваний, так, например, применение указанных модуляторов или антагонистов в качестве местных анестезирующих веществ, антиманиакальных средств, антидепрессантов, средств для лечения таких нарушений, как униполярная депрессия, недержание мочи, диарея, воспаление, эпилепсия, нейродегенеративные состояния, гибель нервных клеток, невропатическая боль, миг-3 018195 рень, острые гипералгезия и воспаление, почечная недостаточность, аллергия, астма, бронхоспазм, дисменорея, спазм пищевода, глаукома, нарушения мочевыводящих путей, нарушения моторики желудочнокишечного тракта. Неполный перечень таких документов и патентов/патентных заявок, описывающих блокаторы натриевых и/или кальциевых каналов и применение указанных блокаторов, включает приведенные ниже ссылки: С. Alzheimer описывает в Adv. Exp. Med. Biol. 2002, 513, 161-181 натриевые и кальциевые каналы как мишени для нейропротективных веществ.Vanegas e Schaible (Pain 2000, 85, 9-18) обсуждает влияние антагонистов кальциевых каналов на спинальные механизмы боли, гипералгезии и аллодинии.WO 03/057219 касается блокаторов натриевых каналов, полезных в качестве средств для лечения или модулирования расстройства центральной нервной системы, такого как невропатическая боль, воспалительная боль, родственная воспалительной боль или эпилепсия.WO 99/14199 описывает замещенные 1,2,3,4,5,6-гексагидро-2,6-метано-3-бензазоцины-10-олы в качестве эффективных блокаторов натриевых каналов, полезных для лечения некоторых заболеваний, таких как внезапный приступ, нейродегенеративные нарушения, болезнь Альцгеймера, болезнь Паркинсона и сердечно-сосудистые нарушения.WO 01/74779 описывает новые аминопиридиновые блокаторы натриевых каналов и применение указанных блокаторов в качестве противосудорожных средств, местных анестезирующих веществ, в качестве антиаритмических средств, для лечения или предупреждения нейродегенеративных состояний,таких как боковой амиотрофический склероз (ALS), для лечения или предупреждения как острой, так и хронической боли и для лечения или предупреждения диабетической невропатии.WO 04/087125 описывает аминокислотные производные в качестве ингибиторов натриевых каналов млекопитающих, полезных для лечения таких нарушений, как хроническая и острая боль, тиннитус, заболевания кишечника, дисфункция мочевого пузыря и демиелинизирующие заболевания. Патент США 5051403 касается способа ослабления нейронального нарушения, связанного с ишемическим состоянием, таким как внезапный приступ, путем введения связывающего/ингибирующего омега-конотоксин-пептида, где пептид отличается специфическим избирательным ингибированием токов потенциалозависимых кальциевых каналов в нейрональных тканях. Патент США 5587454 касается композиций и способов создания аналгезии, в частности, при лечении боли и невропатической боли. Патент США 5863952 касается антагонистов кальциевых каналов, предназначенных для лечения ишемического инсульта. Патент США 6011035 касается блокаторов кальциевых каналов, полезных для лечения состояний,таких как внезапный приступ и боль. Патент США 6117841 касается блокаторов кальциевых каналов и применения указанных блокаторов для лечения внезапного приступа, ишемии головного мозга, боли, травмы головы или эпилепсии. Патент США 6362174 касается блокаторов кальциевых каналов N-типа, предназначенных для лечения внезапного приступа, ишемии головного мозга, боли, эпилепсии и травмы головы. Патент США 6420383 и патент США 6472530 касаются новых блокаторов кальциевых каналов, полезных для лечения и предупреждения ряда нарушений, таких как гиперчувствительность, аллергия, астма, бронхоспазм, дисменорея, спазм пищевода, глаукома, преждевременные роды, нарушения мочевыводящих путей, нарушения моторики желудочно-кишечного тракта и сердечно-сосудистые нарушения. Патент США 6458781 касается соединений, которые действуют путем блокирования кальциевых каналов, и применения указанных соединений для лечения внезапного приступа, ишемии головного мозга, боли, травмы головы или эпилепсии. Патент США 6521647 касается применения блокаторов кальциевых каналов для лечения почечной недостаточности у животных, в особенности хронической почечной недостаточности.WO 97/10210 касается трициклических гетероциклических производных и применения указанных производных в терапии, в частности в качестве антагонистов кальциевых каналов, например, для лечения ишемии, в частности ишемического инсульта.WO 03/018561 касается хинолиновых соединений в качестве антагонистов кальциевых каналовN-типа и способов применения таких соединений для лечения или предупреждения боли или ноцицепции. Моноаминоксидаза (MAO) является ферментом, присутствующим в наружной митохондриальной мембране нейронных и ненейронных клеток. Существуют две изоформы MAO: MAO-А и MAO-B. Ферменты MAO отвечают за окислительное дезаминирование эндогенных и ксенобиотических аминов и характеризуются различным субстратным предпочтением, ингибиторной специфичностью и распределением в тканях. Серотонин, норадреналин и адреналин являются предпочтительными субстратами дляMAO-А, и клоргилин является селективным ингибитором MAO-А; тогда как предпочтительным субстратом для MAO-B является -фенилэтиламин и ингибируется MAO-B селегилином. Допамин, тирамин и триптамин окисляются как MAO-А, так и MAO-B, в частности допамин в человеческом мозге дезамини-4 018195 рован на 80% посредством MAO-B. Ингибирование MAO позволяет аккумуляцию эндогенных и экзогенных субстратов и может, таким образом, при почти полном ингибировании (90%) изменять динамики регулярных моноаминовых медиаторов. MAO регулируют концентрации в головном мозге наиболее важных нейромедиаторов, таких как норадреналин, серотонин и допамин, которые имеют отношение к эмоции, тревожности и движению. Таким образом, считается, что MAO тесно связаны с различными психическими и неврологическими нарушениями, такими как депрессия, тревожность и болезнь Паркинсона (PD). Ингибиторы MAO-А в основном используют в психиатрии для лечения глубокой, рефракторной и атипичной депрессии вследствие способности указанных ингибиторов повышать пониженные уровни серотонина и норадреналина в головном мозге. Совсем недавно ингибиторы MAO-А были использованы для лечения пациентов с тревожными расстройствами, такими как социофобия, панические расстройства, посттравматические стрессовые расстройства и обсессивно-компульсивные расстройства. Ингибиторы MAO-B в основном используют в неврологии для лечения PD. Существуют также последние данные и интерес к роли MAO-B в других патологических состояниях, таких как болезнь Альцгеймера (AD). К настоящему времени отсутствуют данные по вовлеченностиMAO-B в метаболизм сопутствующих медиаторов, таких как холецистокинин, субстанция P, соматостатин и нейротензин, которые вовлечены в модуляцию болевого ощущения. Поэтому отсутствует научное обоснование для применения ингибиторов MAO-B при болевых синдромах. Сообщается о неблагоприятных побочных реакциях при использовании в клинической практике ингибиторов MAO. Первое поколение неселективных и необратимо действующих ингибиторов MAO,таких как транилципромин и фенелзин, обладает рядом побочных эффектов, включающих гепатотоксичность, ортостатическую гипотензию и, что наиболее важно, гипертонический криз, возникающий после приема пищи, содержащей тирамин (Cooper A.J. - Tyramine and irreversible monoamine oxidase inhibitorsin clinical practice. - Br. J. Psych. Suppl. 1989: 38-45). При использовании указанных неселективных и необратимо действующих ингибиторов MAO следует соблюдать строгую диету с пониженным содержанием тирамина. Прессорная чувствительность к тирамину нормализуется за 4 недели после отмены транилципроминовой терапии и более чем за 11 недель после отмены фенелзиновой терапии. Селегилин, необратимо действующий ингибитор MAO-B, в особенности, при использовании в комбинации с леводопой, может вызывать такие нарушения, как анорексия/тошнота, сухость во рту, дискинезия и ортостатическая гипотензия у пациентов с PD, последнее является наиболее проблематичнымAging 13 (1998), p. 341-355). При монотерапии, анорексия/тошнота, скелетно-мышечные повреждения и аритмии сердца возникают чаще у пациентов, принимающих селегилин, чем у пациентов, принимающих плацебо. Помимо указанных побочных действий, были отмечены возросшие соотношения повышенных сывороточных уровней AST и ALT. Наиболее часто упоминаемыми побочными действиями моклобемида, селективного и обратимо действующего ингибитора MAO-А, являются нарушения сна, повышенная тревожность, возбужденное состояние и головная боль. Комбинация селективных ингибиторов обратного захвата серотонина (SSRI) и моклобемида обладает хорошей эффективностью в случаях рефракторной депрессии, но вызывает спор о том, действительно ли токсические побочные действия, такие как серотонинергический синдром, является следствием применения такой комбинации (Baumann P. - Pharmacokinetic-pharmacodynamic relationship of the selective serotonin reuptake inhibitors. Clin Pharmacokinet 31 (1996), p. 444-469). По причине аритмии сердца и повышенных уровней фермента в печени следует регулярно контролировать электрокардиограмму и данные лабораторных анализов. Многие типы физиологических изменений, возникающих с возрастом, оказывают влияние на фармакодинамику и фармакокинетику ингибиторов MAO. В самом деле, фармакокинетические параметры у пожилых людей заметно отличаются от соответствующих параметров для более молодых пациентов. Такие параметры, включающие всасывание, распределение, метаболизм и экскрецию, следует учитывать, чтобы исключить или свести к минимуму некоторые побочные действия и межлекарственные взаимодействия. Пожилые пациенты обычно больше, чем молодые, подвержены побочным действиям, включающим неблагоприятные побочные реакции на лекарства. Гипертонический криз может проявляться чаще у пожилых, чем у молодых пациентов, поскольку сердечно-сосудистая система пожилых уже нарушается с возрастом. Применение симпатомиметических средств в комбинации с ингибиторами MAO может также повышать кровяное давление. К тому же, по сравнению с плацебо, фенелзин связан со значительно более высоким уровнем сонливости, тремора, дискинезии, диареи, трудностей с мочеиспусканием, ортостатических эффектов и неблагоприятных дерматологических эффектов. Интересно отметить, что при лечении моклобемидом у пожилых людей головная боль отмечается чаще, чем у молодых пациентов Ингибиторы MAO (преимущественно, MAO-А, но также неселективные MAO-A/MAO-B) иногда прописывают от депрессии. По причине потенциального риска суицида неблагоприятные побочные реакции препарата и токсичность из-за передозировки являются важными факторами, которые следует учитывать при выборе антидепрессанта. Вдобавок, когда ингибиторы MAO применяют в высокой дозировке, неблагоприятные сердечно-сосудистые эффекты, по-видимому, существенно возрастают; и поскольку избирательность в отношении MAO утрачивается при таких больших дозах, тирамин может вызывать потенциально опасные гипертензивные реакции. Сильная передозировка ингибиторов MAO вызывает возбуждение, галлюцинации, гиперпирексию, гиперрефлексию и конвульсии. Аномальное кровяное давление также является токсическим признаком, так что могут потребоваться промывание желудка и поддержание сердечно-легочной деятельности. Передозировка традиционных неселективных и необратимо действующих ингибиторов MAO весьма опасна и иногда смертельна (Yamada and Richelson, 1996.aging. Boca Raton: CRC Press. 1996). При лечении болезней, в которых механизм(ы) натриевых и кальциевых каналов выполняет (выполняют) патологическую роль, ингибирование ферментов MAO не дает эффекта. Более того, побочные эффекты ингибирования MAO могут накладывать по меньшей мере два типа отрицательных ограничений: 1) диетарное: употребление пищи с высоким содержанием тирамина может вызвать серьезное, даже опасное для жизни увеличение системного кровяного давления (так называемый "сырный эффект"); 2) фармакологическое: например, боль часто лечат комбинацией лекарственных средств, таких как опиоидные производные и трициклический антидепрессант. С ингибиторами MAO такое сочетание является опасным, поскольку может вызвать серотонинергический синдром (возбуждение, тремор, галлюцинация, гипертермия и аритмия). Таким образом, устранение или существенное снижение ингибирующего действия в отношенииMAO в лекарственных препаратах, активных в качестве модуляторов натриевых и/или кальциевых каналов, полезных для предупреждения, ослабления и излечивания широкого ряда патологий, в которых указанный(ые) механизм(ы) выполняет (выполняют) патологическую роль, включающих неврологические,психические, воспалительные, мочеполовые и желудочно-кишечные заболевания, является неожиданным и существенным терапевтическим усовершенствованием против соединений подобной эффективности, но с вышеупомянутыми побочными эффектами. С учетом полученных данных по ингибиторам MAO и, в частности, отсутствия каких-либо данных о роли MAO-B в патологических заболеваниях, таких как боль, мигрень, воспалительные, мочеполовые и желудочно-кишечные заболевания, можно предположить, что ингибирование MAO-B не должно являться существенным признаком для соединений, показанных для вышеупомянутых патологий, позволяющих избежать любых возможных побочных действий при постоянном и/или долговременном лечении. Выгодное решение вышеуказанной проблемы состояло бы в обеспечении лекарственными средствами, являющимися "избирательно активными в качестве модуляторов натриевых и/или кальциевых каналов" или являющимися полезными для "избирательного лечения" болезней, нарушений или заболеваний, в которых механизм(ы) натриевых и кальциевых каналов выполняет (выполняют) патологическую роль. Под данным выражением подразумеваются лекарственные средства, которые при введении нуждающемуся в таком лечении пациенту в количествах, эффективных для лечения вышеупомянутых болезней, в которых вышеуказанный механизм(ы) натриевых и кальциевых каналов выполняет (выполняют) патологическую роль, не обладают какой бы то ни было ингибирующей активностью в отношении MAO или обладают существенно пониженной ингибирующей активностью, что приводит, таким образом, к предотвращению побочных действий, обусловленных аккумуляцией эндогенных и экзогенных моноаминовых медиаторов. Исходная цель настоящего изобретения состояла в применении 2-[2-(фенил)этиламино]алканамидных производных для изготовления лекарственного средства, активного в качестве модулятора натриевых и/или кальциевых каналов, предназначенного для лечения патологий, в которых вышеуказанный механизм(ы) выполняет (выполняют) патологическую роль, таких как неврологические, когнитивные, психические, воспалительные, мочеполовые или желудочно-кишечные нарушения, указанные лекарственные средства, по существу, не обладают ингибирующей активностью в отношении MAO или обладают существенно пониженной ингибирующей активностью в отношении MAO и поэтому характеризуются пониженной потенциальной возможностью оказывать нежелательные побочные действия. Таким образом, основная цель настоящего изобретения состоит в получении 2-[2-(фенил)этиламино]алканамидных производных для применения в качестве лекарственных средств для лечения вышеуказанных патологий, отличающихся тем, что указанные лекарственные средства, по существу, не обладают ингибирующей активностью в отношении MAO или обладают существенно пониженной ингибирующей активностью в отношении MAO и поэтому характеризуются пониженной потенциальной возможностью оказывать нежелательные побочные действия. Указанное применение обеспечивает улучшенный избирательный способ предупреждения, ослабления и/или излечивания вышеуказанных патологических болезней, в частности, у пациентов, особенно чувствительных к нежелательным побочным действиям, обусловленным ингибирующей активностью в отношении MAO, таким как перечисленные выше. Дальнейший аспект настоящего изобретения состоит в разработке способа лечения пациента, страдающего нарушением, вызванным дисфункциями потенциалозависимых натриевых и/или кальциевых каналов, который включает введение указанному пациенту эффективного количества 2-[2-(фенил)этиламино]алканамидного производного. Вышеуказанные неврологические нарушения включают боль обоих типов, как хроническую, так и острую, в частности невропатическую и воспалительную боль, головные боли, мигрень, спазмы; нейродегенеративные нарушения, такие как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия, синдром усталых ног, внезапный приступ и ишемия головного мозга; когнитивные расстройства, такие как умеренные когнитивные нарушения (MCI), и психические расстройства, включающие депрессию, биполярное расстройство, манию, шизофрению, психоз, тревожность и зависимость. Вышеупомянутые воспалительные нарушения включают воспалительные процессы, поражающие все системы организма, например воспалительные процессы мышечно-скелетной системы, артритные состояния, нарушения, поражающие кожу и родственные ткани; нарушения дыхательной системы, а также нарушения иммунной и эндокринной системы. Более подробное разъяснение всех вышеупомянутых патологий приведено в этом документе ниже. Описание изобретения Целью настоящего изобретения является новый класс 2-[2-(фенил)этиламино]алканамидных производных, высокоэффективных в качестве модуляторов натриевых и/или кальциевых каналов и, по существу, не обладающих ингибирующей активностью в отношении MAO или обладающих существенно пониженной ингибирующей активностью в отношении MAO и поэтому характеризующихся пониженной потенциальной возможностью оказывать нежелательные побочные действия при предупреждении, ослаблении и излечивании широкого ряда патологий, включающих, но не в порядке ограничения, неврологические, когнитивные, психические, воспалительные, мочеполовые и желудочно-кишечные заболевания, в которых вышеуказанные механизмы, как установлено, выполняют патологическую роль. В настоящем описании и формуле изобретения выражение "модулятор(ы) натриевых и/или кальциевых каналов" означает соединения, способные блокировать натриевые и/или кальциевые токи потенциалозависимым образом. Таким образом, целью настоящего изобретения является соединение общей формулы (I)R1 и R2 независимо означают водород, гидрокси, (C1-C8)алкокси, (C1-C8)алкилтио, галоген,трифторметил или 2,2,2-трифторэтил или один из R1 и R2 находится в орто-положении относительно R-X- и вместе с указанным R-X- образуетR3 и R'3 независимо означают водород или (C1-C4)алкил;R4 и R5 вместе со смежным атомом углерода образуют остаток (C3-C6)циклоалкил;R6 и R7 независимо означают водород или (C1-C6)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбираемый из -O-, -S- и -NR8-, где R8 означает водород или (C1-C6)алкил; при условии, что, когда X означает -S- или -SO2-, Y не может означать OH или O-(C1-C4)алкил; в зависимости от обстоятельств, либо в виде отдельного оптического изомера в изолированной форме,либо в виде смеси указанных изомеров в любом соотношении, и фармацевтически приемлемые соли указанных соединений. Хотя некоторые соединения, конкретно указанные в данном описании, подпадают под общую формулу WO 90/14334, конкретное описание данных соединений в указанной заявке отсутствует. Ни одно из соединений, описываемых общей формулой (I) по данной заявке, конкретно не описано или не упомянуто в WO 90/14334. Фактически, только незначительное количество 2-(2-фенилэтиламино)алканамидных производных идентифицировано в указанном предшествующем документе, которые, однако, содержат бензилокси-, бензиламино- или бензилзаместитель в 4-положении фенильной составляющей. Кроме того,следующие выбранные классы соединений формулы (I) по настоящему изобретению не подпадают под общую формулу WO 90/14334:(C3-C6)циклоалкильный остаток вместе со смежным атомом углерода;h) соединения, в которых R6 и R7 вместе со смежным атомом азота образуют моноциклический 5-6 членный насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбираемый из -О-, -S- и -NR8-, где R8 означает водород или (C1-C6)алкил. Термин "алкил", используемый в настоящем описании и формуле изобретения, если не оговорено иное, означает линейный или разветвленный алкильный радикал; примеры указанных радикалов или составляющих групп включают метил, этил, пропил, изопропил, бутил, изобутил, пентил, изопентил,гексил, гептил, октил, нонил, децил и соответствующие изомеры. Термин "алкокси", используемый в настоящем описании и формуле изобретения, означает линейный или разветвленный алкоксирадикал; примеры указанных радикалов включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси, изогексилокси, гептилокси, октилокси и соответствующие изомеры. Термин "(C3-C6)циклоалкил" означает циклоалифатический цикл; примеры указанных циклов включают циклопропил, циклобутил, циклопентил и циклогексил. Термин "галоген" означает радикал атома галогена, такого как фтор, хлор, бром и йод. Примерами моноциклических 5- или 6-членных насыщенных гетероциклов, необязательно содержащих один дополнительный гетероатом, выбираемый из -O-, -S- или -NR8-, где R8 означает водород или(C1-C6)алкил, являются, например, пирролидин, пиразолидин, имидазолидин, оксазолидин, изоксазолидин, пиперидин, пиперазин, N-метилпиперазин, морфолин и тиоморфолин. Когда соединения по настоящему изобретению содержат один или несколько асимметрических углеродных атомов и, кроме того, могут существовать в форме отдельных оптических изомеров или смеси указанных изомеров, в рамки изобретения входят все возможные отдельные оптические изомеры (например, энантиомеры, диастереоизомеры) указанных соединений в изолированной форме и смеси указанных изомеров в любом соотношении, включая рацемические смеси. Примерами фармацевтически приемлемых солей соединений формулы (I) являются соли с органическими и неорганическими кислотами, такими как хлористо-водородная, бромисто-водородная, йодисто-водородная, азотная, серная, фосфорная, уксусная, пропионовая, винная, фумаровая, лимонная, бензойная, янтарная, коричная, миндальная, салициловая, гликолевая, молочная, щавелевая, яблочная, малеиновая, малоновая, п-толуолсульфоновая, метансульфоновая, глутаровая кислота и другие кислоты,которые, например, могут быть найдены в Р. Heinrich Stahl, Camille G. Wermuth "Handbook of pharmaceutical salts: properties, selection and use", WILEY-VCH, 2002. Соединения формулы (I) активны в качестве модуляторов натриевых и/или кальциевых каналов и поэтому полезны для предупреждения, ослабления и излечивания широкого ряда патологий, включающих, но не в порядке ограничения, неврологические, когнитивные, психические, воспалительные, мочеполовые и желудочно-кишечные заболевания, в которых вышеуказанные механизмы, как установлено,выполняют патологическую роль. Предпочтительными соединениями формулы (I) являются соединения, в которыхR1 и R2 независимо означают водород, (C1-C4)алкокси, галоген, трифторметил или 2,2,2-трифторэтил или один из R1 и R2 находится в орто-положении относительно R-X- и вместе с указанным R-X- образуетR3 и R'3 независимо означают водород или (C1-C3)алкил;R4 и R5 независимо означают водород или (C1-C4)алкил илиR6 и R7 независимо означают водород или (C1-C4)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один допол-8 018195 нительный гетероатом, выбираемый из -О- и -NR8-, где R8 означает водород или (C1-C3)алкил; при условии, что, когда X означает -S-, Y не может означать OH или O-(C1-C4)алкил; в зависимости от обстоятельств, либо в виде отдельных оптических изомеров в изолированной форме,либо в виде смеси указанных изомеров в любом соотношении, и фармацевтически приемлемые соли указанных соединений. Более предпочтительными соединениями формулы (I) являются соединения, в которыхY означает водород или O-(C1-C3)алкил;R1 и R2 независимо означают водород, (C1-C3)алкокси, фтор, хлор, трифторметил или 2,2,2-трифторэтил или один из R1 и R2 находится в орто-положении относительно R-X- и вместе с указанным R-X- образугруппу, в которой R0 означает (C3-C4)алкил;R3 и R'3 независимо означают водород или (C1-C3)алкил;R4 и R5 независимо означают водород или (C1-C4)алкил илиR6 и R7 независимо означают водород или (C1-C3)алкил или вместе со смежным атомом азота образуют 5-6-членный моноциклический насыщенный гетероцикл, необязательно содержащий один дополнительный гетероатом, выбираемый из -О- и -NR8-, где R8 означает водород или (C1-C3)алкил; при условии, что, когда X означает -S-, Y не может означать O-(C1-C4)алкил; в зависимости от обстоятельств, либо в виде отдельных оптических изомеров в изолированной форме,либо в виде смеси указанных изомеров в любом соотношении, и фармацевтически приемлемые соли указанных соединений. Еще более предпочтительными соединениями формулы (I) являются соединения, в которыхR1 и R2 независимо означают водород или галоген, предпочтительно фтор;R6 и R7 независимо означают водород или (C1-C3)алкил; в зависимости от обстоятельств, либо в виде отдельных оптических изомеров в изолированной форме,либо в виде смеси указанных изомеров в любом соотношении, и фармацевтически приемлемые соли указанных соединений. Наиболее предпочтительно соединение формулы (I) по настоящему изобретению выбирают из группы, включающей следующие соединения: 2-[2-(3-бутоксифенил)этиламино]ацетамид; 2-[2-(3-пентилоксифенил)этиламино]ацетамид; 2-[2-(3-гексилоксифенил)этиламино]ацетамид; 2-[2-(3-бутоксифенил)этиламино]-N-метилацетамид; 2-[2-(3-пентилоксифенил)этиламино]-N-метилацетамид; 2-[2-(3-гексилоксифенил)этиламино]-N-метилацетамид; 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутилтиофенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутилсульфонилфенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутоксифенил)-(N'-гидрокси)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутоксифенил)-(N'-метокси)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутоксифенил)-(N'-пропокси)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилтиоацетамид; 2-[2-(3-бутоксифенил)-2-метилпропиламино]-N,N-диметилацетамид; 2-2-[3-(4,4,4-трифторбутокси)фенил]этиламино-N,N-диметилацетамид; 2-[2-(3-бутилтиофенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутокси-2-хлорфенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутокси-2-фторфенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутокси-4-метоксифенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутоксифенил)этиламино]-N,N-диэтилацетамид; 2-[2-(3-бутоксифенил)этиламино]-N,N-дипропилацетамид; 2-[2-(3-бутоксифенил)этиламино]-N,N-дибутилацетамид; 2-[2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамид;(R)-2-[2-(3-бутоксифенил)этиламино]-N,N-диметилпропанамид; 2-[2-(3-бутокси-2-трифторметилфенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутокси-4-трифторметилфенил)этиламино]-N,N-диметилацетамид; 2-[2-(3-бутокси-5-трифторметилфенил)этиламино]-N,N-диметилацетамид,в зависимости от обстоятельств, либо в виде отдельных оптических изомеров в изолированной форме,либо в виде смеси указанных изомеров в любом соотношении, и фармацевтически приемлемые соли указанных соединений, предпочтительно соли с хлористо-водородной или метансульфоновой кислотой. Соединения по настоящему изобретению получают по общепринятым методикам, описанным более подробно в экспериментальной части. В частности, большинство соединений формулы (I), где X означает -О- и Y означает водород, составляющих предмет изобретения, получают синтетическим способом, показанным на схеме I. Схема I где R, R1, R2, R3, R'3, R4, R5, R6 и R7 имеют те же значения, что указаны выше для формулы (I);EWG означает "электронно-акцепторную группу", такую как, например, галоген или мезилокси,или тозилокси, или трифторметансульфонатную группу. Реагентом Лавессона является 2,4-бис-(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид(The Merck Index, 13th Ed., 5408, p. 966). Согласно предпочтительному варианту осуществления изобретения реакции алкилирования с помощью R-EWG проводят в присутствии основания и болеее предпочтительно указанное основание выбирают из группы, включающей K2CO3, триэтиламин и диизопропилэтиламин. Альтернативный способ получения соединений формулы (I), где R, R1, R2, R3, R'3, R4, R5, R6 и R7 имеют те же значения, что для формулы (I), X означает O и Y означает водород, состоит в том, что альдегид формулы подвергают восстановительному алкилированию под действием -аминоалканамида формулы Восстанавливающий агент может быть выбран из группы, включающей NaBH4, NaBH3CN и цианоборгидрид (полистирилметил)триметиламмония. Полученные 2-[2-(фенил)этиламино]алканамидные соединения формулы (I), где Z означает =O, могут быть превращены в соответствующие соединения, в которых Z означает =S, путем защиты -NHгруппы с помощью boc2O, осуществления взаимодействия N-boc-защищенного производного с реагентом Лавессона и, наконец, снятием защиты с помощью HCl, как показано на схеме I. В качестве дополнительной альтернативы указанных способов амин формулы алкилируют, осуществляя взаимодействие с эфиром алкановой кислоты формулы в присутствии основания (например, триэтиламина), и полученные производные алканового эфира, формулы подвергают взаимодействию с амином формулы HNR6R7, необязательно, в присутствии катализатора амидирования (например, триметилалюминия), получая соединение формулы (I), где Y означает водород. Соединения формулы (I), где R5 означает водород, необязательно, можно превращать в соответствующие соединения формулы (I), где R5 означает (C1-C4)алкил, -CH2OH, -CH2-О-(C1-C6)алкил,-CH(CH3)-OH, -(CH2)2-S-CH3, бензил или 4-гидроксибензил, подвергая N-защищенное производное вышеуказанного соединения формулы (I) процедуре С-алкилирования с использованием алкилирующего агента формулы EWGR5, в которой EWG имеет то же самое значение, что указано выше, R5 означает одну из вышеперечисленных групп. В данном случае, когда требуется конечное соединение формулы (I), в котором группа R5 содержит гидроксисоставляющую, обычно используют реагент EWGR5, в котором соответствующую гидроксигруппу защищают, например, ацетилированием. Все защитные группы затем удаляют из полученных С-алкилированных соединений. По желанию, когда соединение формулы (I) получают в форме свободного основания, указанное соединение может быть превращено в соответствующую соль (например, с помощью хлористо-водородной кислоты) общепринятыми способами. Соединения формулы (I), где X означает S или SO2 и Y означает водород, получают синтетическим способом, представленным на схеме II. где R, R1, R2, R3, R'3, R4, R5, R6 и R7 имеют те же значения, что указаны для формулы (I);EWG имеет то же значение, что указано выше;"оксон" означает пероксимоносульфат калия и реагентом Лавессона является 2,4-бис-(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид. Соединения формулы (I), где X означает -О- и Y означает OH или O-(C1-C4)алкил, получают синтетическим способом, представленным на схеме III. где R, R1, R2, R3, R'3, R4, R5, R6 и R7 имеют те же значения, что указаны выше для формулы (I);EWG имеет то же значение, что указано выше; периодинан Десс-Мартина, см. Dess, D.B.; Martin, J.C. J. Am. Chem. Soc., 1991, 113, 7277. Промежуточные соединения, используемые в схемах I-III, являются коммерчески доступными или могут быть получены из коммерчески доступных соединений по хорошо известным методикам. Оценка полезности необязательной защиты, равно как выбор подходящего защитного агента, в зависимости от взаимодействия, осуществляемого при получении соединений по изобретению и защищаемой функциональной группы, находятся в рамках компетенции квалифицированного специалиста. Снятие необязательных защитных групп выполняют согласно общепринятым методикам. Что касается общей ссылки по применению защитных групп в органической химии, см. TheodoraW. Greene and Peter G.M. Wuts "Protective groups in organic synthesis", John WileySons, Inc., II Ed., 1991. Получение солей соединений формулы (I) осуществляют в соответствии с известными методиками. Что касается получения отдельного оптического изомера соединения формулы (I), указанное соединение может быть получено путем стерически контролируемого синтеза или с применением реагентов, обладающих соответствующей хиральностью, или выделением требуемого изомера из энантиомерной смеси оптических изомеров согласно общепринятым методикам. Фармакология. Соединения по изобретению могут быть применены для изготовления лекарственного средства, активного в качестве модулятора натриевых и/или кальциевых каналов, против болезней, вызванных дисфункциями потенциалозависимых натриевых и/или кальциевых каналов. Такие соединения являются зависимыми от потенциала блокаторами натриевых и/или кальциевых каналов с эффективностью в низком микромолярном диапазоне, как показано блокадой притока натрия и/или кальция (флуоресцентные анализы) и потенциалозависимой блокадой токов (методы пэтч-клампа). Проведено сравнение активности соединений, представленных настоящим изобретением, с активностью соединений, известных из WO 90/14334, клинически одобренных для терапевтических применений, таких как "ралфинамид" (S)-(+)-2-[4-(2-фторбензилокси)бензиламино]пропанамид и/или"сафинамид" (S)-(+)-2-[4-(3-фторбензилокси)бензиламино]пропанамид. Сафинамид (NW-1015, FCE-26743A, PNU-151774E) является блокатором натриевых каналов, модулятором кальциевых каналов, ингибитором моноаминооксидазы В (MAO-B), ингибитором высвобождения глутамата и модулятором биотрансформации допамина. Сафинамид полезен для лечения расстройств ЦНС, в частности эпилепсии, болезни Паркинсона,болезни Альцгеймера, синдрома усталых ног (WO 90/14334, WO 04/089353, WO 05/102300) и когнитивных расстройств (ЕР 06/012352.8). Ралфинамид (NW-1029, FCE-26742A, PNU-0154339E) является ингибитором натриевых и кальциевых каналов и модулятором NMDA-рецептора, полезным для лечения болевых состояний, включающих невропатическую и воспалительную боль обоих типов, как хроническую, так и острую, мигрень, депрессии, сердечно-сосудистые, воспалительные, мочеполовые, метаболические и желудочно-кишечные расстройства (WO 99/35125, WO 03/020273, WO 04/062655, WO 05/018627, WO 05/070405, WO 06/02705). Активность в модулировании натриевых каналов для 2-[2-(фенил)этиламино]алканамидных производных оценивают основанным на флюоресценции анализом притока натрия на ND7/23 клеточной линии (табл. 1) и электрофизиологическим методом пэтч-клампа на кортикальных нейронах крыс (табл. 3) и на ND7/23 клеточной линии (табл. 4) соответственно. Активность в модулировании кальциевых каналов для 2-[2-(фенил)этиламино]алканамидных производных оценивают основанным на флюоресценции анализом притока кальция (табл. 2) на AtT20 клеточной линии. Активность в отношении MAO-B вышеуказанных соединений оценивают, используя радиоферментативное исследование (табл. 5) на митохондриях головного мозга крыс. Аналгетическую активность вышеуказанных соединений in vivo исследуют посредством "формалинового теста" на мышах (табл. 6) и с помощью "модели невропатической боли с лигатурой спинального нерва (SNL)" на крысах (фиг. 1). Активность против воспалительной боли оценивают, используя "модель с введением полного адъюванта Фрейнда (CFA)" на крысах. Активность против висцеральной боли оценивают, используя модель "вызванной уксусной кислотой висцеральной боли" на мышах (фиг. 2). Противосудорожную активность оценивают, используя "тест максимального электрошока" на мышах (табл. 7 и 8). Противоманиакальную активность оценивают, используя модель "гиперлокомоции, вызванной амфетамином и хлордиазепоксидом на мышах" (фиг. 3) и в модели "депривации парадоксального сна" на крысах. Антиамнестическую активность оценивают, используя "тест водного лабиринта Морриса", в котором амнезию у крыс вызывают скополамином, и с помощью "теста на распознавание нового объекта" на крысах. Для исследования антидепрессивной активности соединений используют "тест подвешивания за хвост" в модели на мышах. Противошизофреническую активность оценивают, используя "тест когнитивных нарушений при шизофрении" и "преимпульсное ингибирование реакции испуга (PPI) на мышах и крысах (фиг. 4)."Тест на модели вызванной кокаином поведенческой сенсибилизации" на крысах используют для оценки действий соединений против наркотической зависимости. Тесты на "острое раздражение мочевого пузыря под действием уксусной кислоты у крыс" и на"промежуточное раздражение мочевого пузыря под действием циклофосфамида у крыс" используют в качестве моделей урологических заболеваний. Активность против мигрени оценивают, используя "тест на мигрень" на крысах. В электрофизиологических исследованиях по методу пэтч-клампа такие вещества характеризуются также "зависимостью от использования и частоты", т.е. усилением блокирования во время высокочастотной стимуляции, когда существует высокая аккумуляция каналов в инактивированном состоянии,таком как при нейронных патологических состояниях. Функционально, зависимое от использования блокирование приводит к подавлению неврональной активности при высокочастотном возбуждении и меньшей блокирующей способности при нормальной частоте возбуждения, что указывает на способность соединений по настоящему изобретению селективно подавлять аномальную активность натриевых и/или кальциевых каналов, оставляя незатронутой физиологическую активность, оказывая, таким образом, ограниченное подавляющее действие на ЦНС (W.А. Catterall, Trends Pharmacol. Sci. 1987, 8: 57-65). Одним из наиболее характерных соединений по настоящему изобретению является 2-[2-(3 бутоксифенил)этиламино]-N,N-диметилацетамидгидрохлорид (NW-3509), который, как установлено,высокоактивен почти во всех экспериментальных моделях in vitro и in vivo. Соединения по настоящему изобретению активны in vivo при введении перорально, внутрибрюшинно или внутривенно, в диапазоне от 0,1 до 100 мг/кг, в различных описанных ниже моделях на животных. Ввиду вышеописанных механизмов действия соединения по настоящему изобретению полезны для предупреждения или лечения невропатической боли. Синдромы невропатической боли включают, но не в порядке ограничения, такие нарушения, как диабетическая невропатия; ишиас; неспецифическая боль поясничного отдела спины; боль при рассеянном склерозе; фибромиалгия; связанная с ВИЧ невропатия; невралгия, такая как постгерпетическая невралгия и невралгия тройничного нерва, мортоновская метатарзальная невралгия, каузалгия; и боль, возникающая вследствие физической травмы, ампутации, при фантоме конечности, раке, токсинах или хронических воспалительных состояниях; центральная боль,такая как боль, наблюдаемая при таламических синдромах, смешанные центральные и периферические формы боли, такие как комплексные региональные болевые синдромы (CRPS), называемые также симпа- 14018195 тическими рефлекторными дистрофиями. Соединения по изобретению также полезны для лечения хронической боли. Хроническая боль включает, но не в порядке ограничения, хроническую боль, вызванную воспалением или родственным воспалительному состоянием, таким как остеоартрит, ревматоидный артрит, острое повреждение или травма, боль верхней части спины или боль поясничного отдела спины (возникающую вследствие системного, регионарного или первичного заболевания позвоночника, такого как радикулопатия), боль в костях (в результате остеоартрита, остеопороза, костного метастаза или неизвестных причин), тазовую боль, боль, вызванную повреждением спинного мозга, кардиальную боль в груди, некардиальную боль в груди, центральную постинсультную боль, миофасциальный болевой синдром, серповидно-клеточную боль, раковую боль, болезнь Фабри, боль при СПИДе, гериатрическую боль или боль, вызванную головной болью, болевой синдром височно-нижнечелюстного сустава, подагрическую боль, фиброзный синдром или компрессионный синдром верхней апертуры грудной клетки, в особенности ревматоидный артрит и остеоартрит. Соединения по изобретению также полезны для лечения острой боли (вызванной острым повреждением, болезнью, спортивными травмами, карпальным туннельным синдромом, ожогами, скелетномышечными вывихами и растяжениями, мышечно-сухожильным растяжением, шейно-плечевыми болевыми синдромами, диспепсиями, язвой желудка, язвой двенадцатиперстной кишки, дисменореей, эндометриозом или оперативным вмешательством (таким как операция на открытом сердце или операция шунтирования), послеоперационной боли, боли при почечных камнях, боли в желчном пузыре, боли при камнях желчного пузыря, родовой боли или зубной боли. Соединения по изобретению также полезны для лечения головных болей: мигрени, головной боли при напряжении, трансформированной мигрени или эволютивной головной боли, кластерной головной боли, а также вторичной головной боли, вызванной такими нарушениями, как инфекции, нарушения обмена веществ или другие системные заболевания, и прочих острых головных болей, пароксизмальной гемикрании и т.п.,возникающих как усложненные состояния вышеупомянутой первичной и вторичной головной боли. Соединения по изобретению также полезны для лечения неврологических состояний, таких как эпилепсия, включая простой парциальный припадок, сложный парциальный припадок, вторичный генерализованный припадок, а также включая малый эпилептический припадок, миоклонический припадок,клонический припадок, тонический припадок, тонико-клонический припадок и атонический припадок. Соединения по изобретению также полезны для лечения нейродегенеративных нарушений различного генеза, включающих болезнь Альцгеймера, болезнь Паркинсона и другие состояния слабоумия, такие как деменция с тельцами Леви, фронто-темпоральная деменция и таупатии; бокового амиотрофического склероза и других синдромов паркинсонизма; другой спинно-мозжечковой дегенерации и невропатии Шарко-Мари-Тута, травматического повреждения мозга, внезапного приступа и ишемии головного мозга. Соединения по изобретению также полезны для лечения когнитивных расстройств, психических расстройств. Примерами когнитивных расстройств являются умеренные когнитивные нарушения (MCI) и соответствующие нарушения, вызванные аутизмом, дислексия, синдром дефицита внимания и гиперактивности, шизофрения, обсессивно-компульсивные расстройства, психоз, биполярные расстройства,депрессия, синдром Туретта и расстройство научения в детском, подростковом и взрослом возрасте, возрастное нарушение памяти, возрастное ухудшение когнитивной способности, болезнь Альцгеймера, болезнь Паркинсона, синдром Дауна, травматическое повреждение мозга, болезнь Хантингтона, синдром прогрессирующего супрануклеарного паралича (PSP), ВИЧ, внезапный приступ, сосудистые заболевания, болезнь Пика или Крейтцфельдта-Якоба, рассеянный склероз (MS) и другие нарушения белого вещества мозга и вызванное лекарственными средствами ухудшение когнитивной способности. Психические расстройства включают, но не в порядке ограничения, такие состояния, как глубокая депрессия,апатия, дистимия, мания, биполярное расстройство (такое как биполярное расстройство типа I, биполярное расстройство типа II), циклотимическое нарушение, "быстрая" цикличность, ультрадианная цикличность, мания, гипомания, шизофрения, шизофреноформные расстройства, шизоаффективные расстройства, личностные нарушения, расстройства внимания с гиперактивным поведением или без гиперактивного поведения, бредовые расстройства, кратковременные психические расстройства, совместные психические расстройства, психическое расстройство, вызванное общим состоянием здоровья, психические расстройства, вызванные злоупотреблением психоактивными веществами, психические расстройства без дополнительных уточнений, тревожные расстройства, такие как генерализованное тревожное расстройство, панические расстройства, посттравматическое стрессовое расстройство, расстройства контроля над побуждениями, фобическое расстройство, диссоциативные состояния и, помимо всего прочего, при злоупотреблении курением, психотропными средствами и алкоголем; в особенности, биполярные расстройства, шизофрения, психоз, тревожность и зависимость. Соединения по изобретению ингибируют воспалительные процессы, поражающие все системы организма. Таким образом, соединения по изобретению полезны для лечения воспалительных процессов скелетно-мышечной системы, примеры которых, но не ограничивающие все мишеневые заболевания, приведены в следующем списке: артритные состояния, такие как анкилозирующий спондилит, цервикальный артрит, фибромиалгия, подагра, ювенильный ревматоидный артрит, пояснично-крестцовый артрит,остеоартрит, остеопороз, псориатический артрит, ревматизм; нарушения, поражающие кожу и родственные ткани: экзема, псориаз, дерматит и воспалительные состояния, такие как солнечный ожог; нарушения дыхательной системы: астма, аллергический ринит и респираторный дистресс-синдром, заболевания легких, в которые вовлечено воспаление, такие как астма и бронхит; хроническое обструктивное заболевание легких; нарушения иммунной и эндокринной систем: узелковый периартрит, тиреоидит, апластическая анемия, склеродома, миастения гравис, рассеянный склероз и другие демиелинизирующе нарушения, энцефаломиелит, саркоидоз, нефритический синдром, синдром Бехчета, полимиозит, гингивит. Соединения по изобретению также полезны для лечения нарушений со стороны желудочнокишечного (GI) тракта, таких как воспалительные заболевания кишечника, включающие, но не в порядке ограничения, неспецифический язвенный колит, болезнь Крона, илеит, проктит, глютеиновая болезнь,энтеропатия, микроскопический или коллагенозный колит, эозинофильный гастроэнтерит или паучит,возникающий после проктоколэктомии и после илеоанального анастомоза, и синдром раздраженной толстой кишки, включая любые нарушения, связанные с болью в животе и/или желудочно-кишечным дискомфортом, такие как пилороспазм, нервная диспепсия, спастическая толстая кишка, спастический колит, спастический кишечник, невроз кишечника, функциональный колит, слизистый колит, лаксативный колит и функциональная диспепсия; а также для лечения таких нарушений, как атрофический гастрит,гастрит (varialoforme), неспецифический язвенный колит, пептическая язва, пирезис и другие нарушения желудочно-кишечного тракта, например, под действием Helicobacter pylori, гастроэзофагеальная рефлюксная болезнь, гастропарез, такой как диабетический гастропарез; и других функциональных заболеваний кишечника, таких как неязвенная диспепсия (NUD); рвота, диарея и висцеральное воспаление. Соединения по изобретению также полезны для лечения нарушений мочеполового тракта, таких как гиперактивный мочевой пузырь, простатит (хронический бактериальный и хронический не бактериальный простатит), простадиния, интерстициальный цистит, недержание мочи и доброкачественная гиперплазия предстательной железы, аднексит, пельвиоперитонит, бартолинит и вагинит; в особенности,гиперактивный мочевой пузырь и недержание мочи. Следует учесть, что соединения по изобретению могут быть успешно использованы в сочетании с одним или несколькими другими терапевтическими средствами. Примеры подходящих средств для смежной терапии включают модулятор серотонинового рецептора, содержащий агонист 5HT1B/1D, такой как триптан (например, суматриптан или наратриптан); А 1-аденозиновый агонист; А 2-аденозиновый агонист; Р 2 Х-пуринергический антагонист, ЕР-лиганд; NMDA-модулятор, такой как глициновый антагонист; АМРА-модулятор; антагонист субстанции Р (например, NK1-антагонист); каннабиноид; агонист никотинового рецептора; альфа-1- или -2-адренергический агонист; ацетаминофен или фенацетин; 5-липоксигеназный ингибитор; антагонист лейкотриенового рецептора; DMARD (например, метотрексат); габапентин, прегабалин и родственные соединения; L-dopa- и/или допаминовые агонисты; ингибитор катехол-О-метилтрансферазы; трициклический антидепрессант (например, амитриптилин); нейронстабилизирующие противоэпилептические лекарственные средства; ингибитор моноаминергического захвата (например, венлафаксин); ингибитор матриксной металлопротеиназы; ингибитор синтазы оксида азота (NOS), такой как iNOS- или nNOS-ингибитор; поглотитель свободных радикалов; ингибитор альфа-синуклеиновой агрегации; ингибитор холинэстеразы, понижающий холестерин агент; модулятор альфа-секретазы; модулятор бета-секретазы; ингибитор бета-амилоидной агрегации; ингибитор высвобождения или действия, альфа-фактора некроза опухоли; терапия антителами, такая как терапия моноклональными антителами; противовирусный агент, такой как нуклеозидный ингибитор (например, ламивудин) или модулятор иммунной системы (например, интерферон); опиоидный аналгетик, такой как морфин; агонист и антагонист ваниллоидного рецептора; аналгетик, такой как ингибитор циклооксигеназы-1 и/или циклооксигеназы-2; анестезирующее средство местного действия, такое как лидокаин и соответствующие производные; стимулятор, включающий кофеин; Н 2-антагонист (например, ранитидин); ингибитор протонного насоса (например, омепразол); антацидное средство (например, гидроксид алюминия или магния); ветрогонное средство (например, симетикон); противозастойное средство (например,фенилэфрин, фенилпропаноламин, псевдоэфедрин, оксиметазолин, эпинефрин, нафазолин, ксилометазолин, пропилгекседрин, или леводесоксиэфедрин, нафазолин, ксилометазолин, пропилгекседрин, или лево-десоксиэфедрин); средство против кашля (например, кодеин, гидрокодон, кармифен, карбетапентан или декстрометорфан); диуретик; или седативное или неседативное антигистаминное средство; антипсихотическое средство, включающее типичные и атипичные антипсихотические средства (например, галоперидол, рисперидон, клозапин); антидепрессант, такой как селективные ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, MAO-ингибиторы и трициклические антидепрессорные лекарственные средства; нормотимик (например, литий, ламотригин, вальпроат); анксиолитическое средство (например, бензодиазепины, буспирон, антагонисты бетаадренергических рецепторов); морфин или производные морфина; другие блокаторы кальциевых или натриевых каналов. Считается, что настоящее изобретение охватывает применение соединения формулы (I) или соответствующей фармацевтически приемлемой соли в комбинации с одним или несколькими терапевтическими средствами. Соединения по настоящему изобретению приемлемы в лекарственных препаратах, предназначенных для человека и животных. Следует понимать, что используемые в описании термины "лечение" или"лечить", если не оговорено иное, включают предупреждение, ослабление и излечивание патологии, в частности указанные термины включают как лечение установленных симптомов, так и профилактическое лечение. Соединения по настоящему изобретению, в целях терапевтического или профилактического применения при вышеупомянутых патологиях, предпочтительно используют в качестве активных ингредиентов в фармацевтической композиции. Следовательно, дальнейшей целью настоящего изобретения являются фармацевтические композиции, содержащие терапевтически эффективное количество соединения по изобретению, или соли указанного соединения в смеси с фармацевтически приемлемым носителем. Таким образом, выражение "терапевтически эффективное" по отношению к "количеству", "дозе" или "дозировке" соединений по настоящему изобретению следует понимать как "количество", "доза" или"дозировка" любого указанного соединения, достаточные для применения как в случае лечения установленных симптомов, так и в случае профилактического лечения вышеуказанных патологических состояний. Составляющие предмет настоящего изобретения фармацевтические композиции могут быть введены в разнообразных лекарственных формах с немедленным или замедленным высвобождением, например перорально, в форме таблеток, пастилок, капсул, таблеток с сахарной или пленочной оболочкой,жидких растворов, эмульсий или суспензий; ректально, в форме суппозиториев; парентерально, например, внутримышечно и/или с применением составов пролонгированного действия; внутривенной инъекцией или инфузией; местно и трансдермально в форме пластыря, геля и крема. Подходящие фармацевтически приемлемые, терапевтически инертные органические и/или неорганические несущие материалы, полезные для получения такой композиции, включают, например, такие вещества, как вода, желатин, гуммиарабик, лактоза, крахмал, целлюлоза, стеарат магния, тальк, растительные масла, циклодекстрины, полиалкиленгликоли и т.п. Композиция, содержащая фенилэтиламинопроизводные вышеуказанной формулы (I) может быть стерилизована и может также дополнительно содержать хорошо известные компоненты, такие как, например, консерванты, стабилизаторы, смачивающие или эмульгирующие средства, например парафиновое масло, маннидмоноолеат, соли для доведения до нужной величины осмотического давления, буферы и т.п. Например, твердые формы для перорального приема могут содержать, вместе с активным ингредиентом, разбавители, например, такие как лактоза, декстроза, сахароза, целлюлоза, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например, такие как диоксид кремния, тальк, стеариновая кислота, стеарат магния или кальция и/или полиэтиленгликоли; связывающие средства, например, такие как крахмалы, гуммиарабик, желатин, метилцеллюлоза, карбоксиметилцеллюлоза или поливинилпирролидон; дезагрегирующие средства, например, такие как крахмал, алгиновая кислота, альгинаты или натриевая соль гликолята крахмала; шипучие смеси; окрашивающие вещества; подсластители; смачивающие средства, такие как лецитин, полисорбаты, лаурилсульфаты; и, в общем, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических составах. Указанные фармацевтические препараты могут быть изготовлены известным способом, например путем смешивания,гранулирования, таблетирования, покрытия сахарной или пленочной оболочкой. Получение составляющих предмет изобретения фармацевтических композиций может быть осуществлено общепринятыми способами. Составы для перорального приема включают составы с замедленным высвобождением, которые могут быть получены общепринятым способом, например нанесением интеросолюбильного покрытия на таблетки и гранулы. Жидкая дисперсия для перорального приема может представлять собой, например, сиропы, эмульсии и суспензии. Сиропы могут содержать в качестве носителя, например, сахарозу или сахарозу с глицерином, и/или маннитом, и/или сорбитом. Суспензии и эмульсии могут содержать в качестве носителя, например, такие вещества, как природная камедь, агар, альгинат натрия, пектин, метилцеллюлоза, карбоксиметилцеллюлоза или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать, наряду с активным соединением, фармацевтически приемлемый носитель, например, такой как стерильная вода, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, по желанию, целесообразное количество лидокаингидрохлорида. Растворы для внутривенных инъекций или инфузии могут содержать в качестве носителя, например, стерильную воду или предпочтительно могут быть в форме стерильных, водных,изотонических солевых растворов. Суппозитории могут содержать, наряду с активным соединением, фармацевтически приемлемый носитель, например, такой как масло какао, полиэтиленгликоль, поверхностно-активные вещества на основе полиоксиэтиленовых эфиров сорбита и жирной кислоты или лецитин. Фармацевтические композиции, включающие фенилэтиламинопроизводные вышеуказанной формулы (I), должны содержать на единицу дозирования, например, капсулу, таблетку, порошок для инъекции, чайную ложку с верхом, суппозиторий и т.п., приблизительно от 0,1 до 500 мг одного или нескольких активных ингредиентов, наиболее предпочтительно от 1 до 10 мг. Оптимальные терапевтически эффективные дозы для введения легко могут быть установлены специалистом в данной области и могут варьироваться в зависимости от эффективности препарата, способа введения и развития излечиваемого состояния или нарушения. Кроме того, факторы, связанные с конкретным излечиваемым субъектом, включающие возраст субъекта, вес, диету и время введения, приводят к необходимости регулирования дозы в пределах соответствующего терапевтически эффективного уровня. Следует понимать, что, хотя изобретение раскрыто с помощью приведенных предпочтительных вариантов осуществления, специалисту в данной области известно, что может быть осуществлен иной вариант осуществления без отклонения от сущности изобретения. Экспериментальная часть. Спектр 1 Н-ЯМР снимают в растворе CDCl3 или ДМСО-d6 с помощью спектрометра Varian Gemini 200 MHz. Химические сдвиги, обозначенные , определены с CDCl3 или ДМСО-d6 и D2O в качестве внутреннего стандарта. Анализы методом ВЭЖХ/МС проводят с помощью аппарата Gilson, используя колонку X-Terra RP 18 (5 мкм, 4,650 мм), соединенную с УФ-детектором (220 нм) и масс-спектрометром Finnigan Aqa(электрораспыление, режим ионизации положительными ионами). Условия, используемые для анализа: расход: 1,2 мл/мин; температура колонки: 50 С; А/В градиент элюирования (элюент А: 0,1% муравьиная кислота в воде; элюент В: 0,1% муравьиная кислота в ацетонитриле): 5-95% В от 0 до 8,0 мин, 95% В от 8,0 до 9,5 мин. Для лучшей иллюстрации изобретения приводятся следующие примеры. Пример 1. 2-[2-(3-Бутоксифенил)этиламино]-N,N-диметилацетамидгидрохлорид. Соединение синтезируют согласно схеме I. Стадия 1. 2-(3-Гидроксифенил)-(трет-бутоксикарбонил)этиламин. Методика А. К суспензии 2-(3-бензилоксифенил)этиламингидрохлорида (12,6 г, 47,7 ммоль) в H2O (120 мл) и 1 М NaOH (95 мл) добавляют по каплям раствор boc2O (15,6 г, 71,5 ммоль) в ТГФ (120 мл) и смесь перемешивают при комнатной температуре. Спустя 16 ч органический растворитель удаляют при пониженном давлении и смесь экстрагируют CH2Cl2 (2100 мл). Собранные органические фазы сушат надNa2SO4, раствор фильтруют и растворитель выпаривают при пониженном давлении, получая сырой масляный продукт, который используют без дополнительной очистки. 1ESI+MS: вычислено для C20H25NO3: 327,43; найдено: 328,1 (МН+). 2-(3-Бензилоксифенил)-(трет-бутоксикарбонил)этиламин, полученный на стадии 1, и 10% Pd/C (1,3 г) в MeOH (240 мл) гидрируют в аппарате Парра в течение 16 ч при 35 фунт/кв.дюйм (2,46074 кг/см 2). Катализатор удаляют фильтрованием через рыхлый слой целита и растворитель выпаривают при пониженном давлении. Сырой маслянистый продукт используют без дополнительной очистки. 1ESI+MS: вычислено для C13H19NO3: 237,30; найдено: 238,2 (МН+). Методика В. 33% раствор HBr в уксусной кислоте (150 мл) охлаждают до 0 С и добавляют порциями 3-метоксифенетиламин (10,0 г, 66,0 ммоль). Смесь нагревают до 80 С и перемешивают в течение 16 ч. Растворитель выпаривают при пониженном давлении и остаток растворяют в воде (160 мл). Добавляют 4 М NaOH (15 мл) с последующим добавлением 2 М NaOH (130 мл). Добавляют по каплям раствор boc2O(15,8 г, 72,6 ммоль) в ТГФ (160 мл) и смесь перемешивают при комнатной температуре в течение 16 ч. Верхний органический слой полученной смеси отделяют и водный слой экстрагируют CH2Cl2(3100 мл). Объединенные органические растворы сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Сырое указанное в заголовке соединение (16,8 г) получают в виде коричневой смолы, которую используют на следующих стадиях без дополнительной очистки. Стадия 2. 2-(3-Бутоксифенил)-(трет-бутоксикарбонил)этиламин. К раствору в ацетоне (240 мл) добавляют 2-(3-гидроксифенил)-(трет-бутоксикарбонил)этиламин,полученный на стадии 1, K2CO3 (19,8 г) и 1-бромбутан (15 мл). Суспензию нагревают до температуры кипения с обратным холодильником в течение 3 дней и растворитель выпаривают при пониженном давлении. Остаток растворяют в Н 2 О (200 мл) и экстрагируют CH2Cl2 (2200 мл). Растворитель удаляют при пониженном давлении и остаток очищают флэш-хроматографией (смесь петролейный эфир/EtOAc 85:15), получая 1 (11,3 г, 81% за 3 стадии) указанное в заголовке соединение в виде бесцветного масла. 1ESI+MS: вычислено для C17H27NO3: 293,41; найдено: 294,1 (МН+). Стадия 3. 2-[2-(3-Бутоксифенил)-(трет-бутоксикарбонил)этиламино]-N,N-диметилацетамид. К суспензии NaH (60%, 2,0 г, 51 ммоль) в сухом ДМФА (125 мл), охлажденной до 0 С, добавляют по каплям раствор 2-(3-бутоксифенил)-(трет-бутоксикарбонил)этиламина (7,5 г, 25,5 ммоль) в сухом ДМФА (125 мл). После выдерживания в течение 1 ч при комнатной температуре добавляют 2-хлор-N,Nдиметилацетамид (5,2 мл, 51 ммоль) и смесь перемешивают в течение 16 ч при комнатной температуре. Добавляют Н 2 О (10 мл) и растворитель выпаривают при пониженном давлении. Остаток растворяют в Н 2 О (150 мл) и экстрагируют CH2Cl2 (2150 мл). Собранные органические фазы сушат над Na2SO4,фильтруют и упаривают. Сырой продукт очищают флэш-хроматографией (смесь петролейный эфир/EtOAc 4:6), получая указанное в заголовке соединение (7,2 г, 75%) в виде светло-желтого масла. 1ESI+MS: вычислено для C21H34N2O4: 378,52; найдено: 379,0 (МН+). Стадия 4. 2-[2-(3-Бутоксифенил)этиламино]-N,N-диметилацетамидгидрохлорид. Раствор 2-[2-(3-бутоксифенил)-(трет-бутоксикарбонил)этиламино]-N,N-диметилацетамида (9,6 г,25,3 ммоль) в HCl/Et2O (127 мл) перемешивают при комнатной температуре в течение 16 ч. Растворитель выпаривают при пониженном давлении, остаток растирают со смесью Et2O/iPr2O 50/50, фильтруют и промывают смесью Et2O/iPr2O, получая указанное в заголовке соединение в виде белого твердого вещества (1,71 г, выход 95%). 1 Н-ЯМР (300 МГц, CDCl3):9,63 (шир.с, 1 Н), 7,23 (дд, 1 Н), 6,83-6,91 (м, 2 Н), 6,80 (ддд, 1 Н), 3,96 (с,2 Н), 3,96 (т, 2 Н), 3,32-3,44 (м, 2 Н), 3,22-3,32 (м, 2 Н), 2,97 (с, 6 Н), 1,70-1,83 (м, 2 Н), 1,41-1,58 (м, 2 Н), 0,99ESI+MS: вычислено для C16H26N2O2: 278,40; найдено: 279,3 (МН+). Аналогично, исходя из соответствующих промежуточных соединений, получают следующие соединения. 2-2-[3-(4,4,4-Трифторбутокси)фенил]этиламино-N,N-диметилацетамидгидрохлорид. 1 Н-ЯМР (300 МГц, ДМСО-d6):9,00 (шир.с, 2 Н), 7,17-7,32 (м, 1 Н), 6,78-6,94 (м, 3 Н), 4,04 (шир.с,2 Н), 3,91-4,20 (м, 2 Н), 3,08-3,22 (м, 2 Н), 2,93-3,00 (м, 2 Н), 2,94 (с, 3 Н), 2,90 (с, 3 Н), 2,30-2,48 (м, 2 Н), 1,782,05 (м, 2 Н).ESI+MS: вычислено для C17H28N2O3 (свободное основание): 308,42; найдено: 309,21 (МН+). Пример 2. 2-[2-(3-Бутоксифенил)этиламино]-2,N,N-триметилпропанамидгидрохлорид. Стадия 1. Этиловый эфир 2-[2-(3-бутоксифенил)этиламино]-2-метилпропионовой кислоты. К раствору 2-(3-бутоксифенил)этиламингидрохлорида (0,27 г, 1,42 ммоль; полученного из соединения со стадии 2 по примеру 1 согласно стандартной методике, описанной для стадии 4 примера 1) в ацетонитриле (8 мл) добавляют этиловый эфир 2-бром-2-метилпропионовой кислоты (0,27 мл, 1,85 ммоль) и триэтиламин (0,52 мл, 3,70 ммоль). Раствор нагревают при 100 С при микроволновом облучении в течение 3 ч. Смесь охлаждают до комнатной температуры и распределяют между водой и CH2Cl2. Органический слой отделяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией (диоксид кремния, смесь CH2Cl2:MeOH от 100:0 до 95:5), получая указанное в заголовке соединение (0,17 г, 39% выход) в виде бесцветного масла.ESI+MS: вычислено для C18H29NO3: 307,44; найдено: 308,2 (МН+). Стадия 2. 2-[2-(3-Бутоксифенил)этиламино]-2,N,N-триметилпропанамидгидрохлорид. К раствору диметиламина, 2 M в ТГФ (0,6 мл, 1,1 ммоль) в толуоле (3 мл) добавляют триметилалюминий, 2 М в гексане (1,4 мл, 2,77 ммоль) и смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют этиловый эфир 2-[2-(3-бутоксифенил)этиламино]-2-метилпропионовой кислоты(0,17 г, 0,55 ммоль) в сухом толуоле (8 мл) и раствор нагревают до 90 С и перемешивают в течение 24 ч. Смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток распределяют между водой и диэтиловым эфиром. Органический слой отделяют, промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией (первая очистка: диоксид кремния, смесь водородную соль фильтруют, промывают iPr2O и сушат при 40 С в вакууме. Чистое указанное в заголовке соединение (18,5 мг, 20% выход) получают в виде белого твердого вещества. 1ESI+MS: вычислено для C18H30N2O3: 306,45; найдено: 307,32 (МН+). Пример 3. 2-[2-(3-Бутоксифенил)этиламино]-N,N-диметилпропанамидгидрохлорид. Стадия 1. 2-[2-(3-Бутоксифенил)-(трет-бутоксикарбонил)этиламино]-N,N-диметилпропанамид. Раствор 2-[2-(3-бутоксифенил)-(трет-бутоксикарбонил)этиламино]-N,N-диметилацетамида (0,410 г,1,1 ммоль; полученного в соответствии со стадией 3 примера 1) в сухом ТГФ (5 мл) охлаждают до -78 С и добавляют по каплям LiHMDS (литийгексаметилдисилазид), 1 М в ТГФ (1,43 мл, 1,4 ммоль). Смесь перемешивают 30 мин, затем добавляют по каплям раствор метилиодида (0,187 г, 1,3 ммоль) в сухом ТГФ (1 мл). Смесь перемешивают в течение 2 ч до прекращения действия охлаждающей бани. Растворитель выпаривают при пониженном давлении и остаток растворяют в EtOAc (15 мл) и промывают водой(215 мл). Органическую фазу сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Остаток очищают флэш-хроматографией (диоксид кремния, смесь петролейный эфир:EtOAc от 8:2 до 6:4), получая указанное в заголовке соединение (0,22 г, 52% выход) в виде бесцветного масла.ESI+MS: вычислено для C22H36N2O4: 392,54; найдено: 393,3 (МН+). Стадия 2. 2-[2-(3-Бутоксифенил)этиламино]-N,N-диметилпропанамидгидрохлорид. Указанное в заголовке соединение получают из 2-[2-(3-бутоксифенил)-(третбутоксикарбонил)этиламино]-N,N-диметилпропанамида по стандартной методике, описанной для стадии 4 примера 1. Белый твердый продукт (47% выход). 1ESI+MS: вычислено для C17H28N2O2 (свободное основание): 292,42; найдено: 293,25 (МН+). Пример 4. 2-[2-(3-Бутоксифенил)этиламино]-3-гидрокси-N,N-диметилпропанамидгидрохлорид. Стадия 1. 2-[2-(3-Бутоксифенил)-(трет-бутоксикарбонил)этиламино]-3-ацетокси-N,Nдиметилпропанамид. Указанное в заголовке соединение получают из[2-[2-(3-бутоксифенил)-(третбутоксикарбонил)этиламино]-N,N-диметилацетамида и бромметилового эфира уксусной кислоты согласно стадии 1 примера 3. Бесцветное масло (38% выход).(0,19 г, 0,42 ммоль) растворяют в смеси 3% NH4OH/MeOH (15 мл) и перемешивают при комнатной температуре в течение 5 ч. Растворитель выпаривают при пониженном давлении и остаток очищают флэшхроматографией (диоксид кремния, смесь петролейный эфир:EtOAc от 7:3 до 3:7), получая указанное в заголовке соединение (0,13 г, 66% выход) в виде бесцветного масла.ESI+MS: вычислено для C22H36N2O5: 408,54; найдено: 409,2 (МН+). Стадия 3. 2-[2-(3-Бутоксифенил)этиламино]-3-гидрокси-N,N-диметилпропанамидгидрохлорид. Указанное в заголовке соединение получают из 2-[2-(3-бутоксифенил)-(третбутоксикарбонил)этиламино]-3-ацетокси-N,N-диметилпропанамида по стандартной методике, описанной для стадии 4 примера 1. Получено в виде белого твердого вещества (76% выход). 1 Н-ЯМР (300 МГц, ДМСО-d6):8,46-9,44 (м, 2 Н), 7,10-7,33 (м, 1 Н), 6,65-6,92 (м, 3 Н), 5,54 (т, 1 Н),4,44 (т, 1 Н), 3,95 (т, 2 Н), 3,65-3,88 (м, 2 Н), 3,11-3,22 (м, 1 Н), 3,03-3,09 (м, 1 Н), 3,02 (с, 3 Н), 2,91-2,99 (м,2 Н), 2,90 (с, 3 Н) 1,61-1,79 (м, 2 Н), 1,35-1,53 (м, 2 Н), 0,86-1,00 (м, 3 Н).ESI+MS: вычислено для C17H28N2O2 (свободное основание): 308,42; найдено: 309,21 (МН+). Пример 5. 2-[2-(3-Бутокси-4-метилфенил)этиламино]-N,N-диметилацетамидгидрохлорид. Стадия 1. (3-Гидрокси-4-метилфенил)ацетонитрил. К раствору 3-метокси-4-метилфенилацетонитрила (2,0 г, 12,4 ммоль) в сухом CH2Cl2 (50 мл), охлажденному до -78 С, добавляют по каплям 1 М BBr3 в CH2Cl2 (27 мл, 27 ммоль). Смесь перемешивают в течение ночи, до прекращения действия охлаждающей бани. Смесь медленно выливают в смесь лед/вода,при перемешивании. После того как лед растает, водную фазу экстрагируют EtOAc и органическую фазу сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Сырое указанное в заголовке соединение (1,7 г, 93% выход) используют на следующей стадии без дополнительной очистки. Стадия 2. (3-Бутокси-4-метилфенил)ацетонитрил. К раствору (3-гидрокси-4-метилфенил)ацетонитрила (1,7 г, 11,5 ммоль) в ацетоне (100 мл) добавляют K2CO3 (7,9 г, 57,5 ммоль) и 1-бромбутан (6,1 мл, 57,5 ммоль). Суспензию нагревают до температуры кипения с обратным холодильником в течение 24 ч и растворитель выпаривают при пониженном давлении. Остаток растворяют в CH2Cl2 и промывают водой и насыщенным раствором соли. Органический слой сушат над Na2SO4, фильтруют и растворитель выпаривают при пониженном давлении. Сырой продукт очищают флэш-хроматографией (смесь петролейный эфир:EtOAc 9,5:0,5), получая указанное в заголовке соединение (1,43 г, 61% выход) в виде бесцветного масла.ESI+MS: вычислено для C13H17NO: 203,29; найдено: 204,1 (МН+). Стадия 3. трет-Бутиловый эфир N-[2-(3-бутокси-4-метилфенил)этил]карбаминовой кислоты. К раствору (3-бутокси-4-метилфенил)ацетонитрила (0,94 г, 5,0 ммоль) в метаноле (38 мл) добавляют гексагидрат хлорида никеля (0,12 г, 0,5 ммоль) и boc2O (2,18 г, 10,0 ммоль). Раствор охлаждают до 0 С и добавляют порциями, за 30 мин, натрийборгидрид (1,32 г, 35,0 ммоль). Смесь перемешивают в течение ночи до прекращения действия охлаждающей бани. Реакцию гасят добавлением диэтилентриамина(0,54 мл, 5 ммоль) и реакционную смесь перемешивают в течение 30 мин. Растворитель удаляют при пониженном давлении и остаток повторно растворяют в EtOAc, промывают водой, сушат над Na2SO4,фильтруют и растворитель выпаривают при пониженном давлении. Сырой продукт очищают флэшхроматографией (диоксид кремния, смесь петролейный эфир:EtOAc 90:10), получая указанное в заголовке соединение. Бесцветное масло (80% выход).ESI+MS: вычислено для C18H29NO3: 307,44; найдено: 308,1 (МН+). Стадия 4. 2-[2-(3-Бутокси-4-метилфенил)этиламино]-N,N-диметилацетамидгидрохлорид. Указанное в заголовке соединение получают из трет-бутилового эфира [2-(3-бутокси-4 метилфенил)этил]карбаминовой кислоты по стандартным методикам, описанным для стадий 3 и 4 примера 1. Получено в виде белого твердого вещества. 1ESI+MS: вычислено для C16H24F2N2O2 (свободное основание): 314,37; найдено: 315,20 (МН+). Пример 6. 2-[2-(3-Бутоксифенил)-2-метилпропиламино]-N,N-диметилацетамидгидрохлорид. Стадия 1. 2-(3-Метоксифенил)-2-метилпропионитрил. К раствору (3-метоксифенил)ацетонитрила (8,0 г, 0,054 моль) в ДМФА (25 мл), охлажденному до 0 С, добавляют NaH (1,3 г, 0,054 моль). Реакционную смесь перемешивают в течение 30 мин и добавляют MeI (3,3 мл, 0,054 моль). Реакционную смесь перемешивают I ч при комнатной температуре. По истечении указанного периода реакционную смесь вновь охлаждают до 0 С, добавляют NaH (1,3 г,0,054 моль) с последующим добавлением MeI (3,3 мл, 0,054 моль), спустя 30 мин. Реакционную смесь перемешивают при комнатной температуре в течение ночи. ДМФА выпаривают и сырой продукт разбавляют насыщенным раствором соли и экстрагируют Et2O. Органическую фазу промывают водой, сушат над Na2SO4, растворитель выпаривают при пониженном давлении и остаток очищают флэшхроматографией (смесь петролейный эфир:AcOEt 95:5), получая указанное в заголовке соединение (4 г,42% выход) в виде бесцветного масла.ESI+MS: вычислено для C11H13F2NO: 175,23; найдено: 176,1 (МН+). Стадия 2. 2-[2-(3-Бутоксифенил)-2-метилпропиламино]-N,N-диметилацетамидгидрохлорид. Указанное в заголовке соединение получают из 2-(3-метоксифенил)-2-метилпропионитрила по методике, описанной в примере 5. 1(2,4 мл, 24,6 ммоль) в н-BuOH (5 мл) добавляют CuI (0,156 г, 0,8 ммоль), этиленгликоль (0,96 мл,1,7 ммоль) и K2CO3 (2,4 г, 17,3 ммоль) и смесь нагревают при микроволновом облучении до 110 С в течение 1 ч. Реакционную смесь разбавляют AcOEt и фильтруют через рыхлый слой целита. Органическую фазу промывают водой и насыщенным раствором соли, сушат над Na2SO4 и растворитель выпаривают при пониженном давлении. Сырой продукт очищают флэш-хроматографией (смесь петролейный эфир:AcOEt от 10:0 до 9:1), получая чистое указанное в заголовке соединение в виде светло-желтого масла (1,0 г, 64% выход), используемое без дополнительной очистки на следующей стадии.ESI+MS: вычислено для C12H15NS: 205,32, масса не поддается обнаружению. Стадия 2. 2-[2-(3-Бутилтиофенил)этиламино]-N,N-диметилацетамидгидрохлорид. Указанное в заголовке соединение получают из (3-бутилтиофенил)ацетонитрила по методике, описанной в примере 5. 1ESI+MS: вычислено для C16H26N2OS (свободное основание): 294,46; найдено: 295,20 (МН+). Пример 8. 2-[2-(3-Бутилсульфонилфенил)этиламино]-N,N-диметилацетамидгидрохлорид. Стадия 1. 2-[2-(3-Бутилсульфонилфенил)-(трет-бутоксикарбонил)этиламино]-N,Nдиметилацетамид. К раствору 2-[2-(3-бутилтиофенил)-(трет-бутоксикарбонил)этиламино]-N,Nдиметилацетамидгидрохлорида (0,25 г, 0,62 ммоль; полученного из соединения со стадии 2 примера 7 при взаимодействии c boc2O по методике, описанной в первой части стадии 1 примера 1) в смеси ацетонитрил (20 мл)/вода (10 мл) добавляют порциями, за 5 мин, смесь оксона (0,92 г, 1,5 ммоль) и NaHCO3(0,2 г, 2,3 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч. Смесь распределяют между водой и CH2Cl2, органическую фазу промывают водой и насыщенным раствором соли, сушат надNa2SO4 и растворитель выпаривают при пониженном давлении. Сырой продукт очищают флэшхроматографией (смесь петролейный эфир:AcOEt 3:7), получая чистое указанное в заголовке соединение в виде бесцветного масла (0,20 г, 75% выход).ESI+MS: вычислено для C21H34N2O5S: 426,58; найдено: 427,1 (MH+). Стадия 2. 2-[2-(3-Бутилсульфонилфенил)этиламино]-N,N-диметилацетамидгидрохлорид. Указанное в заголовке соединение получают из 2-[2-(3-бутилсульфонилфенил)-(третбутоксикарбонил)этиламино]-N,N-диметилацетамида по стандартной методике, описанной для стадии 4 примера 1. 1(0,38 г, 1,0 ммоль) в сухом толуоле (20 мл) добавляют одной порцией реагент Лавессона (0,58 г,1,2 ммоль) и смесь нагревают до температуры кипения с обратным холодильником и перемешивают в течение 2 ч. Растворитель выпаривают при пониженном давлении и остаток очищают флэшхроматографией (смесь петролейный эфир:AcOEt от 9:1 до 8:2), получая чистое указанное в заголовке соединение в виде бесцветного масла (0,11 г, 28% выход).ESI+MS: вычислено для C21H34N2O3S: 394,58; найдено: 395,1 (МН+). Стадия 2. 2 [2-(3-Бутоксифенил)этиламино]-N,N-диметилтиоацетамидгидрохлорид. Указанное в заголовке соединение получают из 2-[2-(3-бутоксифенил)-(третбутоксикарбонил)этиламино]-N,N-диметилтиоацетамида по стандартной методике, описанной для стадии 4 примера 1. Получено в виде белого твердого вещества. 1ESI+MS: вычислено для C16H26N2OS (свободное основание): 294,46; найдено: 295,22 (МН+). Пример 10. 2-[2-(3-Бутоксифенил)-(N'-метокси)этиламино]-N,N-диметилацетамид. Стадия 1. 2-(3-Бутоксифенил)ацетальдегид. К раствору 2-(3-бутоксифенил)этанола (3,00 г, 15,4 ммоль; полученного из 2-(3-гидроксифенил)этанола по методике, описанной для стадии 2 примера 1) в CH2Cl2 (100 мл) добавляют периодинанреагент Десс-Мартина (8,5 г, 20,1 ммоль) и реакционную смесь оставляют при комнатной температуре на ночь. Раствор выливают в насыщенный раствор NaHCO3, содержащий Na2S2O3 (35 г) и смесь перемешивают в течение 30 мин. Органический слой отделяют, сушат над Na2SO4, фильтруют и упаривают при пониженном давлении. Остаток, содержащий указанное в заголовке соединение (2,9 г, 99% выход), используют на следующей стадии без дополнительной очистки.(0,66 г, 6,2 ммоль) в воде (20 мл). Реакционную смесь оставляют при комнатной температуре на ночь и затем экстрагируют диэтиловым эфиром. Органический слой сушат над Na2SO4, фильтруют и упаривают при пониженном давлении. Остаток, содержащий требуемое оксимовое промежуточное соединение (2,24 г, 10,2 ммоль), растворяют в метаноле (60 мл) и добавляют уксусную кислоту (8,8 мл, 153,0 ммоль). Раствор охлаждают до 0 С и добавляют порциями NaCNBH3. Реакционную смесь перемешивают при комнатной температуре в течение ночи, затем растворитель удаляют при пониженном давлении и остаток распределяют между 5% раствором NaHCO3 и этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют досуха в вакууме. Сырой остаток очищают колоночной хроматографией (смесь петролейный эфир:этилацетат 9:1), получая 0,88 г (38% выход) указанного в заголовке соединения. Стадия 3. 2-[2-(3-Бутоксифенил)-(N'-метокси)этиламино]-N,N-диметилацетамид. 2-(3-Бутоксифенил)-(N-метокси)этиламин (0,5 г, 2,25 ммоль), полученный, как описано на стадии 2,растворяют в ацетонитриле (15 мл) и добавляют этилдиизопропиламин (1,95 мл, 11,25 ммоль), с последующим добавлением 2-хлор-N,N-диметилацетамида (1,15 мл, 11,25 ммоль). Раствор нагревают при 130 С при микроволновом облучении в течение 6 ч. Смесь охлаждают до комнатной температуры, растворитель удаляют при пониженном давлении и остаток распределяют между 5% NaHCO3 и этилацетатом. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют досуха в вакууме. Сырой остаток очищают колоночной хроматографией (смесь петролейный эфир:этилацетат 1:1), получая 0,25 г (36% выход) указанного в заголовке соединения. 1ESI+MS: вычислено для C17H28N2O3 (свободное основание): 308,42; найдено: 309,18 (МН+). Пример 11. Исследование притока TTXs-натриевых каналов. Линия клеток ганглия заднего корешка крыс, ND7/23, эндогенно экспрессирует смешанную популяцию TTXs-натриевых каналов. Указанные клетки не имеют TTXr-натриевых каналов, что установлено по отсутствию соответствующих транскриптов. Клетки ND7/23 выращивают в DMEM, пополненной 10% FBS и 1 мМ пируватом натрия. Клетки высевают с плотностью 50000 клетка/лунка на 96-луночные планшеты с поли-L-лизиновым покрытием и затем инкубируют в течение 18-24 ч перед употреблением. В данном исследовании используют аналитический набор для определения трансмембранного потенциала (Molecular Devices), основанного на отрицательно заряженном флуоресцентном красителе,дающем возможность контролировать изменения в мембранном потенциале, вызванные притоком натрия из-за открытия канала. Клетки инкубируют с нагрузочным красителем в течение 30 мин при 25 С. Затем добавляют еще в течение 15 мин 100 нМ токсина Anemonia sulcata (используемого в качестве усилителя реакции на активатор каналов), в чистом виде или в присутствии ТТХ (в качестве эталона сравнения), или испытуемого соединения. Флуоресценцию (длина волны, возбуждение: 530 нм, эмиссия: 565 нм) измеряют до и после(40-45 с) автоматического впрыскивания активатора натриевых каналов-вератридина (100 мкМ), используя спектрофотометр для прочтения планшетов Victor (Perkin Elmer). Кривые ингибирования рассчитывают из 5 концентраций, каждая в трипликате, и IC50 определяют,применяя линейно-регрессионный анализ. Соединения по настоящему изобретению ингибируют TTXs-натриевые каналы при фармакологически значимых величинах IC50. Результаты, полученные с рядом соединений, являющихся характерными примерами всего класса соединений по изобретению, в сравнении с эталонными ралфинамидом и сафинамидом, приведены в табл. 1. Пример 12. Исследование притока кальциевых каналов. Линия опухолевых клеток гипофиза мышей AtT20/D16v-F2 преимущественно экспрессирует кальциевые каналы L-типа.AtT20 клетки выращивают в DMEM с 10% FBS, 4 мМ глутамина. Клетки высевают с плотностью 200000 клетка/лунка на 96-луночные планшеты с поли-L-лизиновым покрытием и затем инкубируют в течение 18-24 ч, перед употреблением. В данном исследовании используют аналитический набор для определения Ca (MolecularDevices), основанного на флуоресцентном кальциевом индикаторе для регистрации притока кальция,определяемого в условиях деполяризации. Клетки инкубируют с нагрузочным красящим веществом для кальция в течение 30 мин при 37 С. Затем добавляют еще в течение 15 мин -конотоксин в чистом виде (1 мкМ) или в присутствии нифедипина (в качестве эталона сравнения) или испытуемого соединения. Флуоресценцию (длина волны, возбуждение: 485 - эмиссия: 535 нм) измеряют до и после (30-40 с) автоматического впрыскивания 100 мМ KCl-деполяризующего раствора, используя спектрофотометр для прочтения планшетов Victor (Perkin Elmer). Кривые ингибирования рассчитывают из 5 концентраций, каждая в трипликате, и IC50 определяют,применяя линейно-регрессионный анализ. Результаты, полученные с рядом соединений, являющихся характерными примерами всего класса соединений по изобретению, в сравнении с эталонными ралфинамидом и сафинамидом, приведены в табл. 2. Пример 13. Оценка блокады Na+-токов в кортикальных нейронах крыс методом пэтч-клампа. Клеточный препарат и культивирование. Процедуры, касающиеся животных и содержания таких животных, осуществляют в соответствии с установленными руководящими принципами в согласии с государственным правом (D.L. n. 116, G.U.,suppl. 40, Feb. 18, 1992) и международными правами и политикой (EEC Council directive 86/609,OJL358.1, Dec. 12 1987; Guide for the Care and Use of Laboratory Animals, U.S. National Research Council,1996). Кортикальные нейроны получают препарированием эмбриональных крыс Wistar (E17-E19). Самок крыс на сроке беременности 17-19 недель анестезируют и забивают. Иссекают эмбрионы(n=4-5) и помещают в охлажденный льдом раствор Ханка (раствор Ханка (Life Tech. 14170-088) + 30% глюкоза + Pen-Strep 100(Life Tech. 15140-122) 100 Ед-100 мкг/мл и Hepes-NaOH 5 мМ). Удаляют матку и плаценту, эмбрионы декапитируют и головы помещают в охлажденный льдом раствор Ханка. Удаляют кожу головы, используя пинцет, скальп вскрывают, выполняя боковой разрез от затылка до глаз, и извлекают мозг, используя изогнутый пинцет. Мозг разрезают на две половины, наружную соединительно-тканную оболочку удаляют пинцетом и, удерживая мозг перевернутым, используя изогнутый пинцет, извлекают мозжечок, ствол мозга и промежуточный мозг, стараясь максимально очистить внутреннюю часть кортекса. Каждый кортекс нарезают на небольшие кусочки ножницами, кусочки переносят в центрифужную пробирку на 15 мл, используя пипетку на 5 мл, и дважды промывают раствором Ханка. Раствор удаляют, за исключением 1-2 мл, и ткань сначала диссоциируют пипеткой на 5 мл, затем двумя пастеровскими пипетками с огневой полировкой (среднее и малое отверстия соответственно). После механической диссоциации добавляют 5 мл полной DMEM (модифицированной по способу Дульбекко среды Игла) (Gibco 41966-029) + 10% FBS (Hyclone) + 2 мМ глутамин (Life Tech. 25030-024) + PenStrep 100 Ед-100 мкг/мл и клеточную суспензию центрифугируют в течение 5 мин при 1000 об/мин. Супернатант удаляют и добавляют 5 мл полной нейробазальной среды (NB среды) (Life Tech. 21103-049) + 2% B27 (Life Tech. 17504-044) + 2 мМ глутамин + Pen-Strep 100 Ед-100 мкг/мл. Клетки подсчитывают и разбавляют нейробазальной средой до концентрации 400000 клеток на чашку Петри, обработанную 5 мкг/мл поли-D-лизина. Кортикальные нейроны используют с 6-го по 11-й день после посева на чашках Петри и один раз в неделю заменяют нейробазальную среду. Регистрация по методу пэтч-клампа всей клетки. Эксперименты на кортикальных нейронах выполняют, используя стандартные методики пэтчклампа всей клетки (Hamill et al., PFUGHERS ARCH., 1981 Aug, 391(12), 85-100).). Мембранные токи регистрируют и фильтруют при 5 кГц с помощью усилителя Axon Axopatch 200B и данные оцифровывают с помощью Axon Digidata 1322 А (Axon Instruments, CA, USA). Выполнение протокола и сбор информации контролируют онлайн с помощью программного обеспечения Axon pClamp8. Измерительными и эталонными электродами являются электроды AgCl-Ag. Устройство для продвижения Sutter Instrument P-87 Puller (CA, USA) используют в целях выведения пэтч-кламп-пипеток с сопротивлением 2-3 МОм из пробирок Harward'а боросиликатного стекла. Клетки непрерывно омывают внеклеточными растворами, используя устройство для смены раствора Biologic RSC-200. Протоколы замеров напряжения и анализ данных. Для исследования влияния соединений на натриевые токи в кортикальных нейронах клетки фиксируют при -90 мВ, затем двухстадийный протокол используют для определения потенциалозависимости блока. Натриевые токи активируют ступенчатым импульсом в 30 мс до -10 мВ (пробный импульс) от преобусловленного потенциала -110 мВ (состояние покоя) и до потенциала примерно -50 мВ (полумаксимальное стационарное состояние), 2000 мс. Тонический блок токов покоя и деполяризованных токов при данной концентрации лекарственного препарата вычисляют по разнице между пиковым Na+-током в контрольном внешнем омывающем растворе и пиковыми токами с испытуемым веществом, разделенной на пик контроля. Кривые концентрация лекарственного средства - ингибирование получают, строя график зависимости тонических блоков в состоянии покоя и деполяризованном состоянии от концентраций лекарственных средств. Выполняют подгонку кривых доза-эффект к данным тонического блока согласно логистическому уравнению: y=A2 + (A1-A2)/[1 + (x/IC50)p], где A1 и A2 являются фиксированными величинами 0 и 1, соответствующими 0 и 100% ингибированию тока; x равно концентрации лекарственного средства;IC50 равно концентрации лекарственного средства, приводящей к 50% ингибированию тока; и р равно соответствующему угловому коэффициенту. Кажущееся сродство лекарственного средства для инактивированного состояния (Ki) рассчитывают по уравнению 1/Kdep=h/Kr + (1-h)/Ki, где Kr означает сродство лекарственного средства для состояния покоя/закрытого состояния; Kdep равно IC50 в деполяризованном состоянии; h и (1-h) означают доли каналов, имеющие потенциалы покоя и деп. соответственно. Растворы и лекарственные средства. Контрольный внешний омывающий раствор содержит (мМ): NaCl - 60, Холин Cl - 60, CaCl2 - 1,3,MgCl2 - 2, KCl -2, CdCl2 - 0,4, NiCg2 - 0,3, TEACl - 20, Hepes - 10, глюкозы - 10. Внутренний пипеточный раствор содержит (мМ): CsF - 65, CsCl - 65, NaCl - 10, CaC12 - 1,3,MgCl2 - 2, Hepes - 10, EGTA - 10, MgATP - 1. Соединения растворяют для получения исходных растворов (20 мМ) в ДМСО. Исходные растворы разбавляют до конечных концентраций внешним раствором. Результаты. Соединения по настоящему изобретению обладают способностью блокировать Na+-токи в кортикальных нейронах крыс. Результаты, полученные с 2-[2-(3-бутоксифенил)этиламино]-N,N-диметилацетамидгидрохлоридом (NW-3509), характерным соединением для химического класса по настоящему изобретению, в сравнении с эталонными сафинамидом и ралфинамидом, приведены в табл. 3. Таблица 3 Данные, выраженные через значение IC50 при мкМ-концентрации, а также через сродство в отношении инактивированного состояния (Ki), демонстрируют, что соединение по настоящему изобретению является высокоэффективным и потенциалозависимым блокатором натриевых каналов.- 27018195 Пример 14. Оценка блокады Na+-токов в ND7/23 клеточной линии методом пэтч-клампа. Поддержание клеточной линии.ND7/23 (ЕСАСС No 92090903 от SIGMA) представляет собой гибридную клеточную линию, полученную из DRG неонатальных крыс, слившуюся с N18Tg2 мышиной нейробластомы (Wood et al., Proc.Biol. Sci., 1990 Sept., 241(1302), 187-194). ND7/23 клетки обладают подобными сенсорному нейрону свойствами и экспрессируют тетродотоксин-чувствительные (TTXs), но не тетродотоксин-устойчивые(ТТХ-r) токи (Zhou et al.; J. Pharmacol. Exp. Ther., 2003 Aug., 306(2), 498-504; John et al., Neuropharmacology, 2004 Mar, 46(3), 425-438). Отсутствие TTXr токов соответствует отсутствию транскриптов TTXr каналов в указанных клетках. Молекулярная идентичность каналов, ответственных за TTXs проводимость, неизвестна, но исходят из того, что, по всей видимости, указанная проводимость является результатом активности смешанной популяции натриевых каналов. Клетки поддерживают обычным образом в DMEM с 10% FBS, 4 мМ глутамина, 1 мМ пирувата натрия. За один день до эксперимента по методу пэтч-клампа клетки отделяют и высевают с плотностью 100000 клетка/35-мм чашка Петри с полилизиновым покрытием. Регистрация по методу пэтч-клампа всей клетки. Эксперименты на ND7/23 клетках выполняют, используя стандартные методики пэтч-клампа всей клетки (Hamill et al., PFUGHERS ARCH., 1981 Aug, 391(12), 85-100), как описано в предыдущем разделе. Протоколы замеров напряжения и анализ данных. Для исследования влияния соединений на натриевые токи в ND7/23 клетках исходный трансмембранный потенциал устанавливают на -90 мВ, затем двухстадийный протокол используют для определения потенциалозависимости блока. Натриевые токи активируют ступенчатым импульсом в 30 мс до 0 мВ(пробный импульс) от преобусловленного потенциала -110 мВ (состояние покоя) и до потенциала примерно -70 мВ (полумаксимальное стационарное состояние), 2000 мс. Тонический блок токов покоя и деполяризованных токов при данной концентрации лекарственного препарата вычисляют по разнице между пиковым Na+-током в контрольном внешнем омывающем растворе и пиковыми токами с испытуемым веществом, разделенной на пик контроля. Кривые концентрация лекарственного средства - ингибирование получают, строя график зависимости тонических блоков в состоянии покоя и деполяризованном состоянии от концентраций лекарственных средств. Выполняют подгонку кривых доза-эффект к данным тонического блока согласно логистическому уравнению: у=А 2 + (А 1-А 2)/[1 + (х/IC50)р], где А 1 и А 2 являются фиксированными величинами 0 и 1, соответствующими 0 и 100% ингибированию тока; х равно концентрации лекарственного средства;IC50 равно концентрации лекарственного средства, приводящей к 50% ингибированию тока; и р равно соответствующему угловому коэффициенту. Кажущееся сродство лекарственного средства для инактивированного состояния (Ki) рассчитывают по уравнению 1/Kdep=h/Kr + (1-h)/Ki, где Kr означает сродство лекарственного средства для состояния покоя/закрытого состояния; Kdep равно IC50 в деполяризованном состоянии; h и (1-h) означают доли каналов, имеющие потенциалы покоя и деп. соответственно. Растворы и лекарственные средства. Контрольный внешний омывающий раствор содержит (мМ): NaCl - 80, Холин HCl - 40, CaCl2 - 1,3,MgCl2 - 2, KCl - 2, CdCl2 - 0,4, NiCl2 - 0,3, TEACl - 20, Hepes - 10, глюкозы - 10. Внутренний пипеточный раствор содержит (мМ): CsF - 65, CsCl - 65, NaCl - 10, CaC12 - 1,3,MgCl2 - 2, Hepes - 10, EGTA - 10, MgATP - 1. Соединения растворяют для получения исходных растворов (20 мМ) в ДМСО. Исходные растворы разбавляют до конечных концентраций внешним раствором. Результаты. Соединения по настоящему изобретению обладают способностью блокировать Na+-токи в ND7/23 клетках. Результаты, полученные с 2-[2-(3-пентилоксифенил)этиламино]-N,N-диметилацетамидгидрохлоридом, NW-3525, и 2-[2-(3-бутокси-2-фторфенил)этиламино]-N,N-диэтилацетамидом, характерными соединениями для химического класса по настоящему изобретению, в сравнении с эталонным ралфинамидом, приведены в табл. 4. Данные, выраженные через значение IC50 при мкМ-концентрации, а также через сродство в отношении инактивированного состояния (Ki), демонстрируют, что два соединения по настоящему изобретению являются высокоэффективными и потенциалозависимыми блокаторами натриевых каналов. Пример 15. Исследование ферментативной активности в отношении MAO-B in vitro. Мембранный препарат (сырая митохондриальная фракция). Самцов крыс Wistar (Harlan, Italy, весящих 175-200 г) забивают при легкой анестезии, быстро извлекают головной мозг и гомогенизируют в 8 объемах охлажденного льдом 0,32 М сахарозного буфера,содержащего 0,1 М EDTA, рН 7,4. Сырой гомогенат центрифугируют при 2220 об/мин в течение 10 мин и извлекают супернатант. Осадок в пробирке после центрифугирования гомогенизируют и вновь центрифугируют. Два супернатанта объединяют и центрифугируют при 9250 об/мин в течение 10 мин при 4 С. Осадок в пробирке после центрифугирования ресуспендируют в свежем буфере и центрифугируют при 11250 об/мин в течение 10 мин при 4 С. Полученный осадок в пробирке после центрифугирования хранят при -80 С. Исследование ферментативной активности in vitro. Ферментативную активность оценивают радиоферментативным исследованием, используя субстрат 14 С-фенилэтиламин (PEA), специфический для MAO-B. Митохондриальный осадок в пробирке после центрифугирования (500 мкг белка) ресуспендируют в 0,1 М фосфатном буфере (рН 7,4). 200 мкл суспензии добавляют к 50 мкл раствора испытуемого соединения или буфера и инкубируют 30 мин при 37 С (преинкубация), затем добавляют субстрат (50 мкл). Инкубацию проводят в течение 10 мин при 37 С (14 С-РЕА, 0,5 мкМ). Взаимодействие прекращают добавлением 0,2 мл перхлорной кислоты. После центрифугирования дезаминированные метаболиты экстрагируют 3 мл толуола и измеряют радиоактивную органическую фазу, содержащую нейтральные и/или кислотные метаболиты, образующиеся в результате активности в отношении MAO-B, жидкостной сцинтилляционной спектрометрией с эффективностью 90%. Активность в отношении MAO-B выражают через нмоли трансформированного субстрата/мг белка/мин. Соединения, являющиеся характерными примерами всего химического класса по настоящему изобретению, не обнаруживают ингибирования MAO-B, при рассматриваемых концентрациях, как показано в табл. 5 через значения IC50 (концентрацию соединения, способную ингибировать 50% ферментативной активности MAO-B). На самом деле, ингибирование MAO-B считается значимым, когда значения IC50 находятся в субмолекулярном диапазоне, таком как для стандартных сафинамида и ралфинамида.
МПК / Метки
МПК: C07C 237/06, A61K 31/165, C07D 295/182
Метки: кальциевых, каналов, применение, натриевых, замещенные, производные, 2-[2-(фенил)этиламино]алканамидные, соединений, качестве, указанных, модуляторов
Код ссылки
<a href="https://eas.patents.su/30-18195-zameshhennye-2-2-feniletilaminoalkanamidnye-proizvodnye-i-primenenie-ukazannyh-soedinenijj-v-kachestve-modulyatorov-natrievyh-i-ili-kalcievyh-kanalov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 2-[2-(фенил)этиламино]алканамидные производные и применение указанных соединений в качестве модуляторов натриевых и/или кальциевых каналов</a>
Предыдущий патент: Линия и способ изготовления изделий из алюминиевых сплавов с декоративно-защитным металлическим покрытием
Следующий патент: Упаковочные материалы для двойной упаковки инфузионного раствора
Случайный патент: Электрохимический датчик












