Способ повышения плотности кальциевых каналов
Формула / Реферат
1. Способ повышения плотности кальциевых каналов в ткани сосудов и сердца, включающий введение теплокровному животному, которое в этом нуждается, фармацевтически эффективного количества соединения формулы
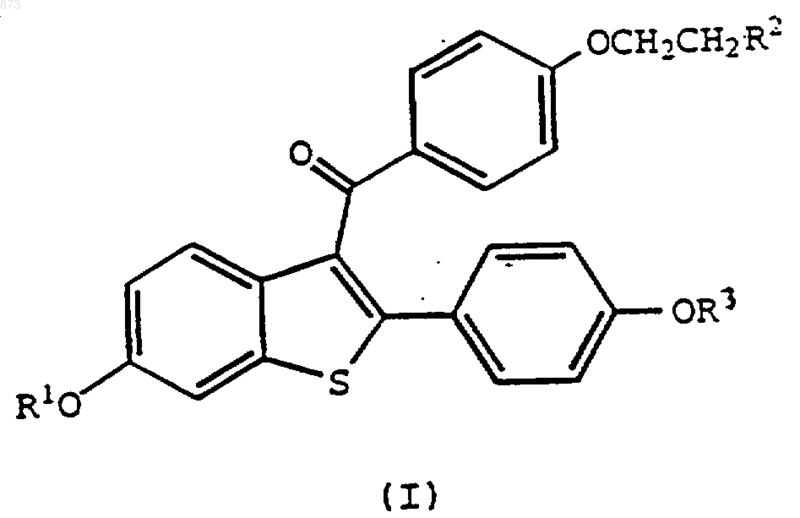
в котором R1 и R3 независимо представляют водород;
R2 выбирают из группы, состоящей из пирролидино, гексаметиленимино и пиперидино;
или его фармацевтически приемлемой соли.
2. Способ по п.1, в котором R2 представляет пиперидиногруппу.
3. Способ по п.2, в котором указанной фармацевтически приемлемой солью является гидрохлорид.
Текст
1 Это изобретение относится к открытию того факта, что группа 2-арил-3-ароилбензо[b] тиофенов является эффективной в отношении модулирования кальциевых каналов, повышая плотность кальциевых каналов в сосудистой и сердечной ткани без изменений инотропного или прессорного ответа. Заместительная терапия эстрогенами широко признана как оказывающая благоприятное действие на сердечно-сосудистую систему женщин в период постменопаузы. См. Knopt,Obstet. Gynecol., 72, стр.23-30 (1988). У женщин в постменопаузе, получающих эстрогены,смертность от сердечно-сосудистых заболеваний снижается приблизительно на 30-50%, а смертность от цереброваскулярных причин снижается приблизительно на 50%. См. Stampferet al., N.Engl.J.Med., 325, 756-762 (1991). Несмотря на то, что эти благоприятные сердечнососудистые эффекты могут включать в себя изменения липидного профиля, недавние сведения предполагают, что эстрогены могут также оказывать благоприятное действие на сосудистые реакции атеросклеротических коронарных артерий. См. Gisclard et al., J.Pharmacol. and Experimental Therapeutics, 244, 19-22 (1988); Williamsal., Lancet. 388, 839-842 (1991) и Williams et al.,JACC, 20, 452-457 (1992). В ткани сосудов описаны как эндотелий-независимые, так и эндотелий-зависимые эффекты эстрогенов. См. Tiang(1993); Salas et al., European Journal of Pharmacol,258, 47-55 (1994); Williams et al., Circulation, 81,1680-1687 (1990); Cheng et al., Life Sciences, 10,187-191 (1994); Gilligan et al., Circulation, 89,2545-2551 (1994) и Reis et al., Circulation, 89, 5260 (1994). В нескольких сообщениях высказывалось предположение, что вазодилатирующие эффекты эстрадиола и/или его способность ослаблять контрактильные реакции может быть опосредована через ингибирование притока кальция через потенциал-зависимые кальциевые каналы. См. Jiang et al., Br.J.Pharmacol., 104,1033-1037 (1991); Jiang et al, American Journal ofJournal of Pharmacol., 258, 47-55, 1994. Другие данные утверждают, что эстрадиол может увеличивать содержание циклического АМФ и циклического ГМФ или увеличивать количество АТФ-чувствительных кальциевых каналов. См.(1993); Sudhir et al., Am.Heart J., 129, 726-732. 2-Арил-3-ароилбензо[b]тиофеновые соединения, которые используются в способах настоящего изобретения, были впервые разра 000873(выданный 9 января 1979). Эти соединения, в основном, пригодны для подавления роста опухолей молочной железы. Позже Jones обнаружил, что группа этих соединений, в частности,пригодна для антиэстрогеновой и антиандрогеновой терапии, особенно для лечения опухолей молочной железы и простаты. См. патент США 4418068 (выданный 29 ноября 1983). Одно их этих соединений, 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофен, проходило клинические испытания по лечению рака молочной железы. Это соединение названо ралоксифеном, прежнее название- кеоксифен. Это изобретение обеспечивает способы повышения плотности кальциевых каналов, повышая плотность кальциевых каналов в ткани сосудов и сердца, без изменений инотропного или прессорного ответов, которые включают введение теплокровным животным, нуждающимся в таком лечении, эффективного количества соединения формулыR1 и R3 независимо представляют водород,R2 выбирают из группы, состоящей из пирролидино, гексаметиленимино и пиперидино; или его фармацевтически приемлемой соли. Настоящее изобретение также обеспечивает применение соединений формулы I или его фармацевтически приемлемой соли для производства лекарственного средства для модулирования кальциевых каналов в ткани сосудов и сердца. Настоящее изобретение касается открытия того факта, что выбранная группа 2-арил-3 ароилбензо[b]тиофенов,(бензо[b]тиофенов) соединений формулы I эффективна в отношении модулирования кальциевых каналов, повышая плотность кальциевых каналов в ткани сосудов и сердца, без изменений инотропного или прессорного ответов. Таким образом, настоящее изобретение обеспечивает способы модулирования кальциевых каналов в ткани сосудов и сердца. Одним аспектом изобретения является способ лечения заболеваний сердца, включая,но не ограничиваясь, вариантную стенокардию,стенокардию напряжения, нестабильную стенокардию, ишемическое-реперфузионное повреждение миокарда и аритмии. Другим аспектом изобретения является способ лечения цереброваскулярных расстройств, включая, но не огра 3 ничиваясь, спазм церебральных сосудов вследствие разрыва артерии, инсульт и головные боли типа мигрени. Другим аспектом является способ лечения нарушений функции почек путем повышения почечного клиренса вследствие повышения кровотока через почки, который полезен для замедления развития почечной недостаточности. Другим аспектом является способ лечения расстройств функции желудочнокишечного тракта, включая, но не ограничиваясь, заболевания, связанные с диареей, такие какIBS и IBD, а также diarrhea predominant. Медикаментозное лечение, предлагаемое настоящим изобретением, осуществляется путем введения теплокровным животным, нуждающимся в таком лечении, фармацевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Термин "фармацевтически эффективное количество" используется в описании для обозначения количества соединения формулы I,которое способно повышать плотность кальциевых каналов в ткани сосудов и сердца. Конкретная доза соединения формулы I будет, разумеется, определяться конкретными обстоятельствами, сопутствующими случаю, включая вводимое соединение, способ введения, конкретное состояние, которое подвергается лечению, и другие подобные соображения. Термин "модулирование" в настоящем документе означает повышение плотности кальциевых каналов в ткани сосудов и сердца без изменений инотропного или прессорного ответа. Термин "теплокровное животное" включает людей, таких животных, как собаки и кошки,и домашних животных, таких как лошади,крупный рогатый скот, овцы, свиньи, козы и куры. Предпочтительно теплокровным животным является человек или животное - собака или кошка. Более предпочтительно теплокровным животным является человек. В то время, как все соединения формулы I пригодны для модулирования кальциевых каналов в ткани сосудов и сердца, некоторые соединения являются предпочтительными. Предпочтительно, R1 и R3 независимо представляет водород, a R2 представляет пиперидино- или пирролидиногруппу. Типичными соединениями из этой предпочтительной группы являются 6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 пирролидиноэтокси)бензоил]бензо[b]тиофен,6-гидрокси-2-(4-гидроксифенил)-3-[4-(2 пиперидиноэтокси)бензоил]бензо[b]тиофен. Наиболее предпочтительно, R1 и R3 представляют водород, а R2 представляет пиперидино. Этим наиболее предпочтительным соединением является 6-гидрокси-2-(4-гидроксифенил)3-[4-(2-пиперидиноэтокси)бензоил]бензо[b]тиофен. Соединения формулы I, используемые в способах настоящего изобретения, могут быть 4 получены в соответствии с рутинными процедурами, которые описаны в патентах США 4133814, 4418068 и 4380635. Обычно процесс получения начинается с 6-гидрокси-2-(4 гидроксифенил)бензо[b]-тиофена. Это исходное соединение защищают, ацилируют в положении С-3 4-(2-аминоэтокси)бенэоильной группой и необязательно удаляют защитную группу до получения соединений формулы I. Примеры получения таких соединений приводятся в патентах США, упомянутых выше. Соединения, которые используют в способах настоящего изобретения, образуют фармацевтически приемлемую соль и, если R и/или R3 представляют водород, соли присоединения оснований, с множеством органических и неорганических кислот и оснований, включая физиологически приемлемые соли, которые часто используются в фармацевтической химии. Типичные неорганические кислоты, которые используют для получения таких солей, включают хлористоводородную,бромистоводородную,иодистоводородную, азотную, серную, фосфорную, гипофосфорную и т.п. кислоты. Также могут использоваться соли, полученные с органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые и гидроксиалкандиновые кислоты, ароматические кислоты, алифатические и ароматические сульфокислоты. Такие фармацевтически приемлемые соли включают, следовательно,ацетат, фенилацетат, трифторацетат, акрилат,аскорбат, бензоат, хлорбензоат, динитробензоат,гидроксибензоат, метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат,бромид, изобутират, фенилбутират и гидроксибутират, бутин-1,4-диоат, гексин-1,6 диоат, каприат, каприлат, хлорид, цинномат,цитрат, формиат, фумарат, гликолят, гептаноат,деканоат, гиппурат, лактат, малат, малеат, гидроксималеат, малонат, манделат, мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат,терефталат, фосфат, двузамещенный фосфат,однозамещенный фосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат, салицилат, себакат, сукцинат, суберат,сульфат, бисульфат, пиросульфат, сульфит, бисульфит, сульфонат, бензолсульфонат, пбромфенилсульфонат,хлорбензолсульфонат,этансульфонат, 2-гидроксиэтансульфонат, метансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, п-толуолсульфонат, ксилолсульфонат, тартрат и т.п. Наиболее предпочтительной солью является гидрохлорид. Фармацевтически приемлемые соли присоединения кислот обычно получают реакцией соединения формулы I с эквимолярным или избыточным количеством кислоты. Реагенты обычно объединяют в органическом растворителе, таком как метанол, диэтиловый эфир или бензол. Соль обычно выпадает из раствора в 5 осадок в течение приблизительно от одного часа до 10 дней и может быть выделена фильтрованием, или же растворитель можно отогнать любыми обычными способами. Основания, обычно используемые для получения солей, включают гидроксид аммония и гидроксиды щелочных и щелочно-земельных металлов, карбонаты, а также алифатические первичные, вторичные и третичные амины, и алифатические диамины. Основания, особенно подходящие для получения солей присоединения оснований, включают гидроксид аммония,карбонат калия, метиламин, диэтиламин, этилендиамин и циклогексиламин. Эти соли обычно получают реакцией соединения формулы I, в котором R1 и/или R3 представляют водород, с одним из вышеперечисленных оснований в органическом растворителе, таком как метанол,диэтиловый эфир или бензол. Эти соли выделяют,как описано выше. Эти фармацевтически приемлемые соли обычно обладают улучшенной растворимостью по сравнению с соединением, из которого они были получены, и, таким образом, зачастую более пригодны для получения лекарственных форм в виде жидкостей или эмульсий. Соединения формулы I предпочтительно составляют в виде готовой лекарственной формы до введения, включающей соединение формулы I и фармацевтически приемлемый носитель, разбавитель или наполнитель. Эти фармацевтические лекарственные формы изготавливают с помощью известных технологий, с использованием хорошо известных и легко доступных ингредиентов. При изготовлении этих композиций активный ингредиент обычно смешивают с носителем, разводят носителем и помещают внутрь носителя, который может иметь форму капсулы, саше, бумажного пакетика или иного контейнера. Если носитель служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который служит носителем, наполнителем или средой для активного ингредиента. Эти композиции могут быть в форме таблеток, пилюль, порошков, лепешек,саше, крахмальных капсул, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей,мазей, содержащих, например, до 10 вес.% активного соединения, мягких и твердых желатиновых капсул, кожных пластырей, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. Некоторые примеры приемлемых носителей, наполнителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит,крахмалы, камедь, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу,поливинилпирролидон, поперечно-сшитый поливинилпирролидон, целлюлозу или ее производные, водный сироп, метилцеллюлозу, метили пропилгидроксибензоаты, тальк, стеарат маг 000873 6 ния и минеральное масло. Эти лекарственные формы дополнительно могут включать смазывающие агенты, увлажняющие агенты (например, поверхностно-активные агенты), эмульгирующие и суспендирующие агенты, разрыхляющие агенты, консервирующие агенты, подсластители или корригенты. Композиции настоящего изобретения могут составляться таким образом, чтобы обеспечивать быстрое, замедленное или отсроченное высвобождение активного ингредиента после введения пациенту, с помощью способов, хорошо известных специалистам. Конкретная дозировка соединения формулы I, которая требуется для модулирования кальциевых каналов в ткани сосудов и сердца,согласно настоящему изобретению, будет зависеть от тяжести состояния, способа введения и сопутствующих факторов, на основании которых будет принимать решение лечащий врач. Обычно эффективные суточные дозы будут составлять приблизительно от 0,1 до 1000 мг в день и более типично приблизительно от 10 до 100 мг в день. Эти дозы вводят пациенту, нуждающемуся в таком лечении, от одного до трех раз ежедневно или чаще, если это необходимо для эффективного лечения состояния или симптома. Обычно предпочтительно вводить соединение формулы I в форме соли присоединения кислоты, что является обычной практикой при введении лекарств, имеющих основную группу,такую как пиперидиновая группа. Для этих целей доступны следующие лекарственные формы для перорального введения. В лекарственной форме, приведенной ниже, "активный ингредиент" означает соединение формулы I. Лекарственная форма 1. Желатиновые капсулы. Твердые желатиновые капсулы изготавливаются из следующих ингредиентов. Ингредиент: Количество (мг в капсуле): активный ингредиент 0,1-1000 крахмал, NF 0-650 крахмал, текучий порошок 0-650 жидкий силикон 350 сСт 0-15 Эти ингредиенты смешивают, пропускают через сито 45 меш США и наполняют этой смесью твердые желатиновые капсулы. Примеры конкретных изготовленных лекарственных форм ралоксифена в виде капсул включают примеры, приведенные ниже. Лекарственная форма 2. Капсулы ралоксифена. Ингредиент: Количество (мг в капсуле): ралоксифен 1 крахмал, NF 112 крахмал, текучий порошок 225,3 жидкий силикон 350 сСт 1,7 Лекарственная форма 3. Капсулы ралоксифена. Ингредиент: Количество (мг в капсуле): ралоксифен 5 крахмал, NF 108 крахмал, текучий порошок 225,3 жидкий силикон 350 сСт 1,7 Лекарственная форма 4: Капсулы ралохсифена. Ингредиент: Количество (мг в капсуле): ралоксифен 50 крахмал, NF 103 крахмал, текучий порошок 225,3 жидкий силикон 350 сСт 1,7 Лекарственная форма 5. Капсулы ралоксифена. Ингредиент: Количество (мг в капсуле): ралоксифен 50 крахмал, NF 150 крахмал, текучий порошок 397 жидкий силикон 35 сСт 3,0 Конкретные лекарственные формы, приведенные выше, можно изменять в соответствии с необходимостью. Композиция для таблеток изготавливается из следующих ингредиентов. Лекарственная форма 6. Таблетки. Ингредиент: Количество (мг в таблетке): активный ингредиент 0,1-1000 микрокристаллическая целлюлоза 0-650 диоксид кремния, мелкоизмельченный 0-650 стеариновая кислота 0-15 Эти компоненты смешивают и прессуют в таблетки. Альтернативно, таблетки, содержащие 0,1-1000 мг активного ингредиента, изготавливаются следующим образом: Лекарственная форма 7. Таблетки. Ингредиент: Количество (мг в таблетке): активный ингредиент 0,1-1000 крахмал 45 микрокристаллическая целлюлоза 35 Поливинилпирролидон 4(в форме 10% раствора в воде) натрий-карбоксиметилцеллюлоза 4,5 стеарат магния 0,5 тальк 1 Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученными порошками, которые затем пропускают через сито 14 меш США. Полученные таким образом гранулы высушивают при 50-60 С и пропускают через сито 18 меш США. Затем к гранулам добавляют предварительно пропущенные через сито 60 меш США натрий-карбоксиметилкрахмал, стеарат магния и тальк и после пере 8 мешивания прессуют на таблетирующей машине для получения таблеток. Суспензии, содержащие 0,1-1000 мг активного ингредиента в 5 мл дозе, изготавливают следующим образом: Лекарственная форма 8. Суспензия. Ингредиент: Количество (мг в 5 мл): активный ингредиент 0,1-1000 мг натрий-карбоксиметилцеллюлоза 50 мг сироп 1,25 мг раствор бензойной кислоты 0,10 мл корригент по желанию краситель по желанию очищенная вода до 5 мл Активный ингредиент пропускают через сито 45 меш США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом до получения однородной пасты. Раствор бензойной кислоты, корригент и краситель разводят в небольшом количестве воды и добавляют при перемешивании. Затем добавляют достаточное количество воды до получения нужного объема. Соединения, которые могут использоваться в способах настоящего изобретения, представлены в таблице 1. СоединениеR1 и R3 1 Н 2 Н 3 Н 4 Н 5 НR2 пиперидино пиперидино пирролидино пирролидино гексаметиленимино Форма основание НС 1 основание НС 1 НС 1 Полезность соединений формулы I иллюстрируется тем положительным воздействием,которое они продемонстрировали по меньшей мере в одном из экспериментов, описанных ниже. Материалы и методы Подбор крыс и дозировки, в основном, те же, что описаны Sato et al., J.Bone and MineralResearch, 9, 715-724 (1994). Вкратце, овариэктомированных (ovex) девственных самок крыс (6 месячного возраста) разделили на 3 группы по 6 животных, обозначенных как ovex; этинилэстрадиол (ЕЕ 2, 0,1 мг/кг в день перорально) и ралоксифен (соединение 14,1 мг/кг в день перорально). Четвертая группа самок, подвергнутых имитации операции (sham), служила вторым контролем. Дозы ЕЕ 2 и 14 подбирали по сравнимым влияниям на параметры плотности кости(Sato et al.); случайно обнаружили, что они вызывали сходные достоверные (Р,0,05 противovex) эффекты понижения уровня общего холестерина (362 и 384 мг/дл, ЕЕ 2 и 14, соответственно, против 857 и 877 мг/дл, ovex и sham,соответственно). Крысам из групп sham и ovex вводили носитель (100 мкг/г веса тела 20% гидроксипропил-3-циклодекстрина). Животные получали дозы в течение 35 дней, а затем их умерщвляли в атмосфере СО 2. Сердца и аорты аккуратно вырезали, быстро замораживали и хранили при -70 С, если мембраны не приготавливались немедленно. Микросомальные мембраны везикулы выделяли из 3-4 г оттаявших сердец или аорт из каждой группы, описанной выше, Jones et ai.,J.Biol.Chem., 254, 530-535 (1979). Препараты хранили в 0,25 М сахарозе/30 мМ гистидине при-70 С. Исследования на связывание с использованием возрастающих концентраций лиганда кальциевых каналов [3 Н] PN200-110 (0,01-4,0 нМ) выполняли в стеклянных пробирках 12 х 75 мм (общим объемом 500 мкл) при 23 С в течение 2 ч, с использованием 100 (сердце) или 200(аорта) мкг белка на пробирку. Анализы заканчивали быстрым фильтрованием через ватмановскую фильтровальную бумагу GF/C. Буфером для анализа (и промыванния) являлся 50 мМ Трис/НСl (рН 7,3), 1 мМ ЭДТК и 12 мМMgCl2. Неспецифическое связывание определяли как связывание, которое оставалось в присутствии 1 мкМ нифедипина. Связывающее сродство к радиолиганду и плотность рецепторов определяли по данным изотермического насыщения с использованием программы нелинейного регрессивного анализа LUNDON-1.Research, 31-49, 1986. Сердечно-сосудистые гемодинамические параметры в ответ на BAY k 8644 определяли на обездвиженных повреждением спинного мозга крысах из каждой из четырех групп (sham, ovex,ЕЕ 2 и 14), как описано Hayes and Bowling со следующими модификациями: лекарство вводили через бедренную вену и проводили прямое измерение систолического кровяного давления в левом желудочке посредством введения небольшого отрезка катетера РЕ 90, соединенного с преобразователем давления, непосредственно в левый желудочек. Hayes and Bowling,J.Pharmacol. and Exp.Ther.,241,861-869 (1987). Были получены результаты измерения среднего,систолического и диастолического кровяного давления, частоты сердечных сокращений, систолического давления в левом желудочке и левожелудочкового индекса dP/dt. Результаты Определили и сравнили с контролями ovex и sham воздействие ЕЕ 2 и 14 на связывание Са 2 каналов ([3 Н] PN200-110) в тканях сердца и аор 10 ты, а также на гемодинамические ответы наBAY k 8644 in vivo. В то время, как сильное сродство участков связывания дигидропиридина(Вмах) в тканях сердца и аорты достоверно возрастало у крыс, получивших ЕЕ 2 и 14, по сравнению с крысами ovex, связывающее сродство(Кd) не отличалось значимым образом в разных группах в тканях как сердца, так и аорты. Экспер. группа Несмотря на повышение Вмах Са 2 каналов,контрактильные по частоте сердечных сокращений и прессорные ответы in vivo на BAY k 8644 у крыс, получавших ЕЕ 2, не возрастали по сравнению с ответами контролей ovex или sham. Таким образом, повышение плотности Са 2 каналов не приводило к более сенсибилизированному ответу на агонист кальциевых каналов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ повышения плотности кальциевых каналов в ткани сосудов и сердца, включающий введение теплокровному животному,которое в этом нуждается, фармацевтически эффективного количества соединения формулыR2 выбирают из группы, состоящей из пирролидино, гексаметиленимино и пиперидино; или его фармацевтически приемлемой соли. 2. Способ по п.1, в котором R2 представляет пиперидиногруппу. 3. Способ по п.2, в котором указанной фармацевтически приемлемой солью является гидрохлорид.
МПК / Метки
МПК: A61P 9/10, C07D 413/00, A01N 43/40
Метки: способ, плотности, повышения, каналов, кальциевых
Код ссылки
<a href="https://eas.patents.su/6-873-sposob-povysheniya-plotnosti-kalcievyh-kanalov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ повышения плотности кальциевых каналов</a>
Предыдущий патент: Раствор для промывки фосфатированных металлических поверхностей
Следующий патент: Сыпучий гранулят на основе органических кислот
Случайный патент: Способ и устройство для заполнения заливочной массой фильтрующего устройства, и заливочный колпачок










