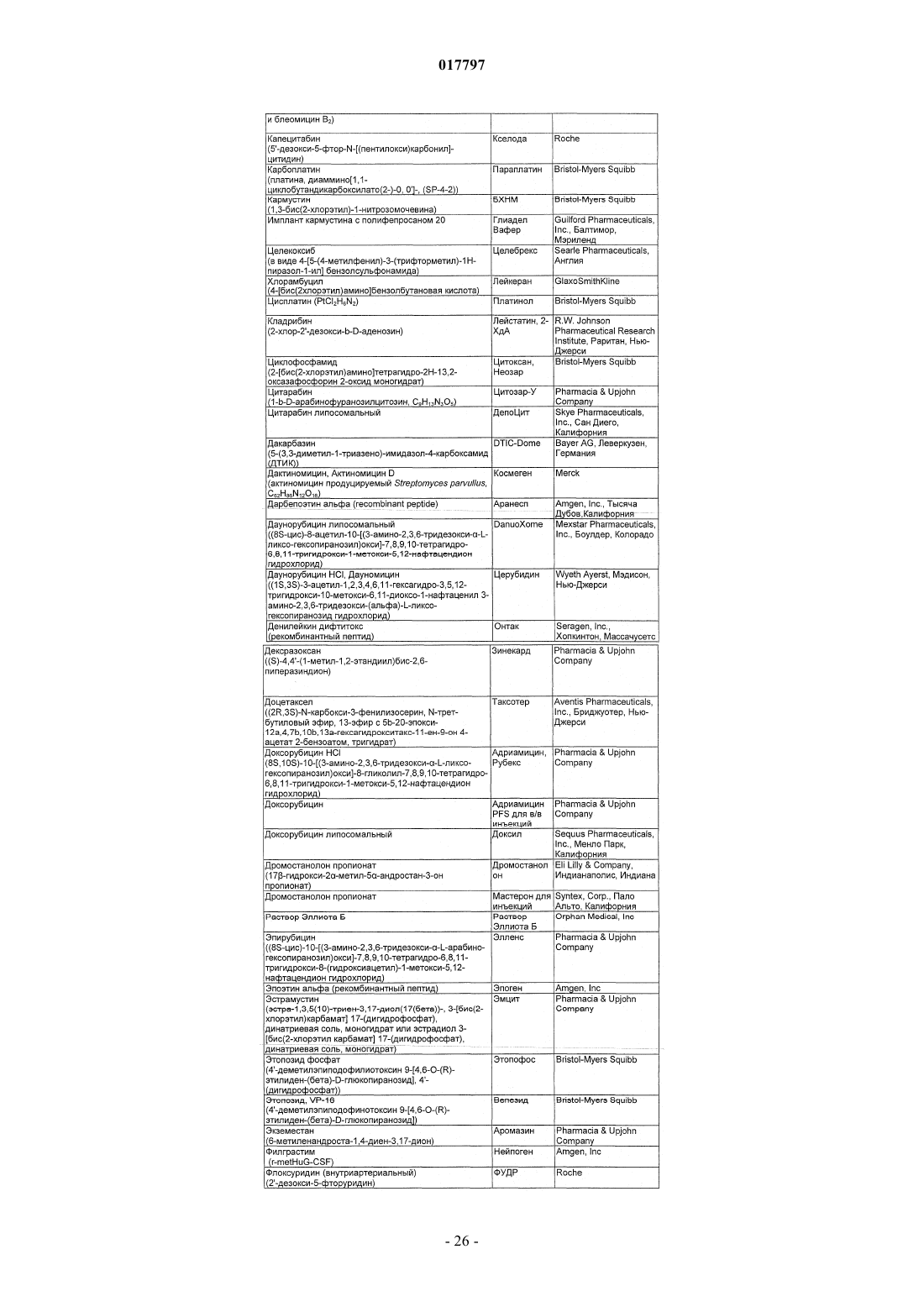
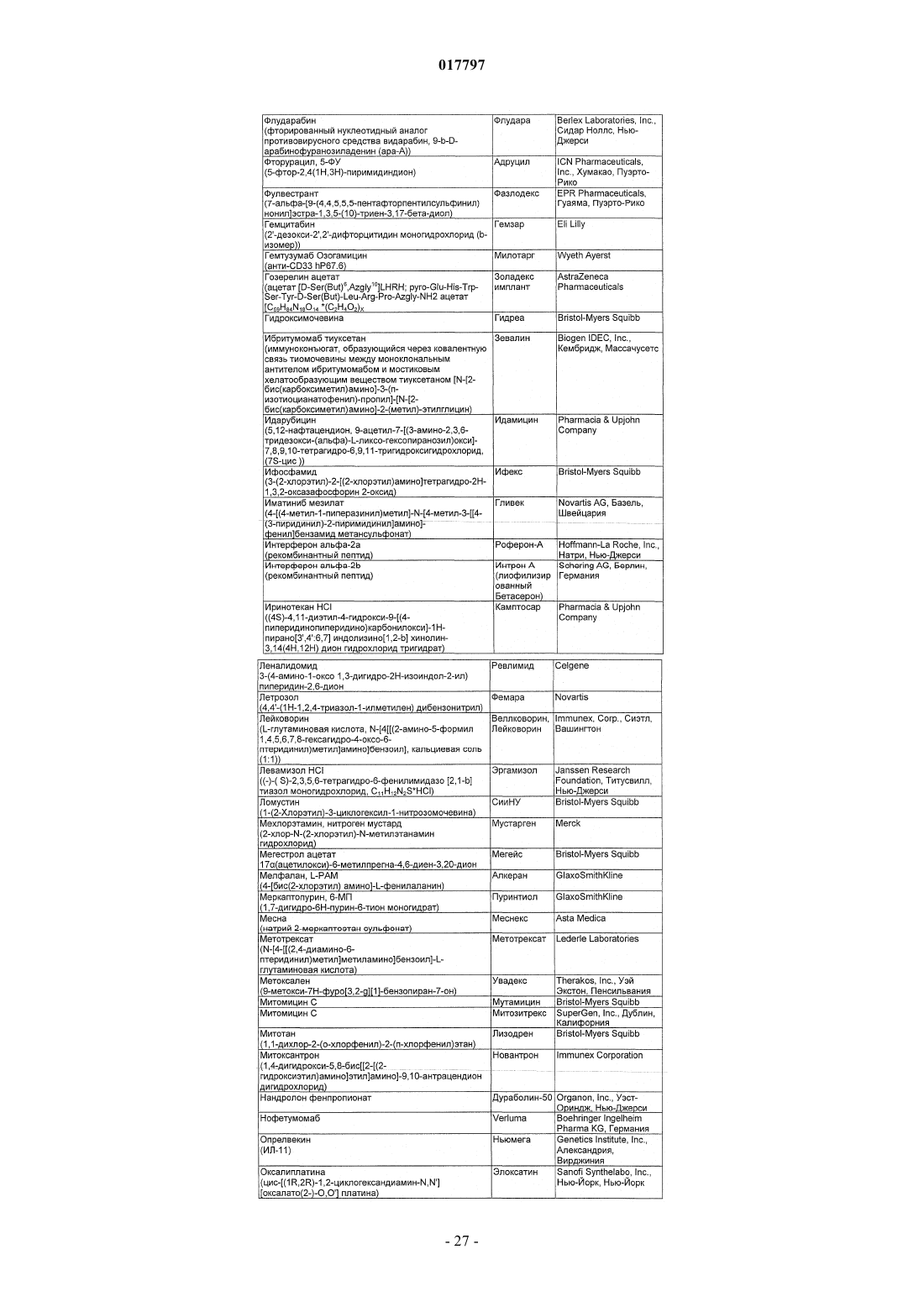
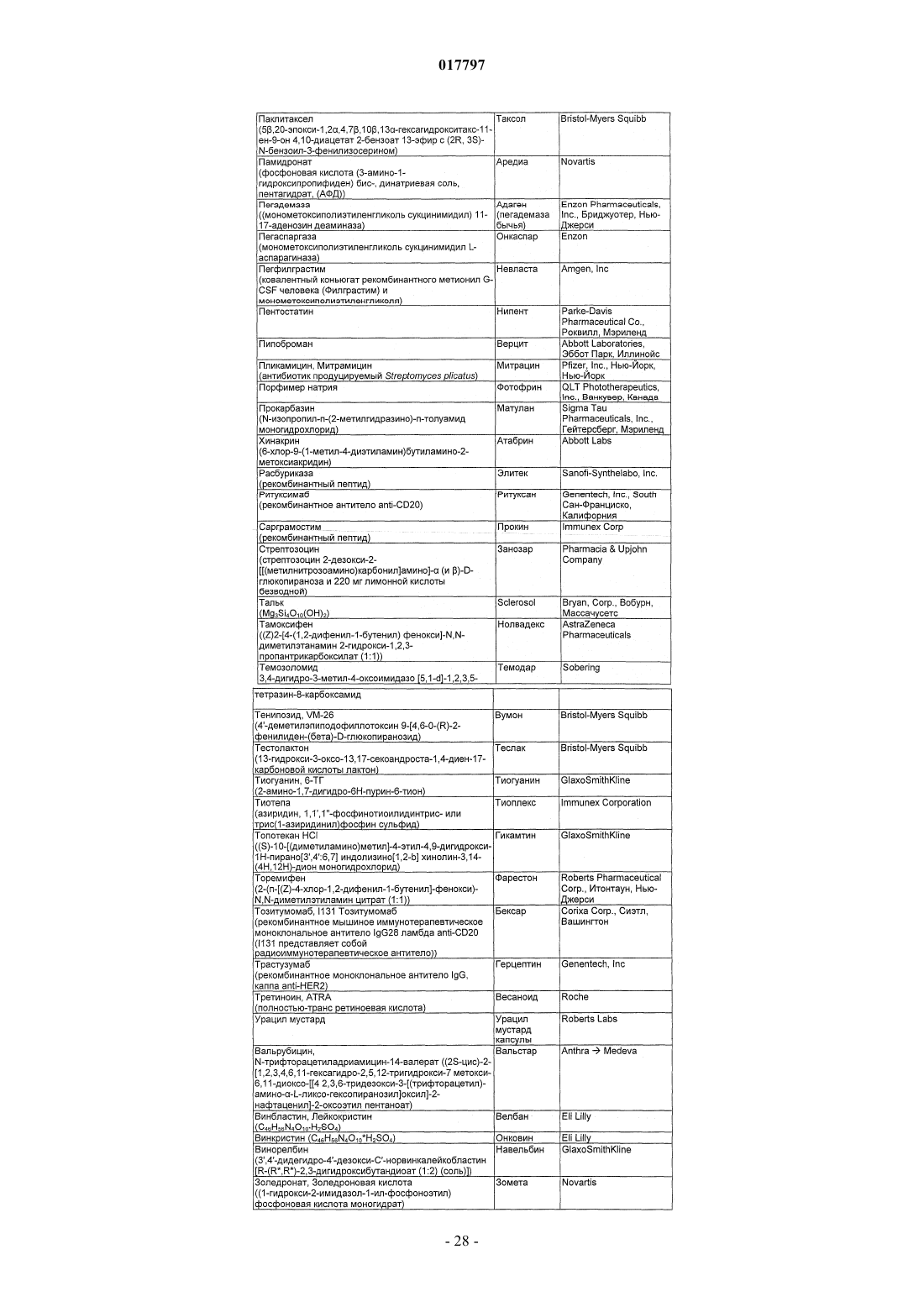
Бициклические диазомиметики smac, способы их получения, их применения, содержащие их фармацевтические композиции и набор, содержащий указанные композиции
Номер патента: 17797
Опубликовано: 29.03.2013
Авторы: Николовска-Цолеска Занета, Сунь Хайин, Ван Шаомэн, Цай Цянь, Пэн Юэфэн, Цю Су, Лу Цзяньфэн
Формула / Реферат
1. Соединение формулы I
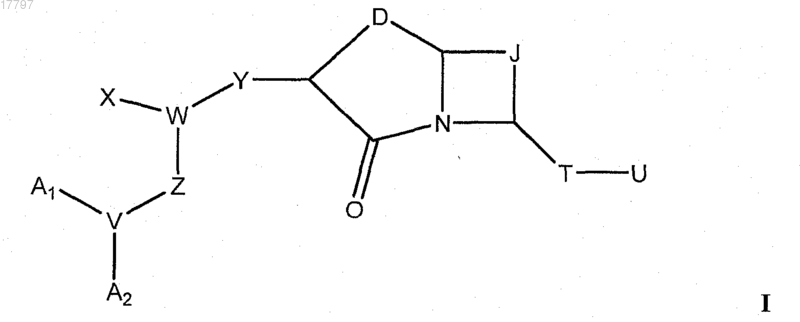
где A1 и А2 независимо выбирают из группы, состоящей из водорода и С1-18 алкила, необязательно замещенного гидроксильной группой;
V представляет собой N;
W представляет собой СН;
X представляет собой C1-3 алкил, необязательно замещенный индолилом;
Y представляет собой NHCO;
Z представляет собой (CR1R2)r;
D представляет собой (CR1R2)n-NR5-(CR3R4)m;
J представляет собой незамещенный С1-4 алкиленил;
Т выбирают из группы, состоящей из С=O и CR1R2;
U выбирают из группы, состоящей из NR1R2 и N(R1)COR7;
n и m независимо выбирают из 1, 2 или 3;
r равно 0;
каждую из групп R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода; С1-18 алкила, необязательно замещенного:
а) одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом;
б) нафтилом или
в) пиридилом, циклогексилом, инданилом, тетранилом и COR7;
R5 представляет собой COR7;
R7 выбирают из группы, состоящей из С1-18 алкила, необязательно замещенного:
а) фенилом, необязательно замещенным одним или двумя атомами фтора;
б) циклопентилом, необязательно замещенным гидроксильной группой;
в) оксопиперазинилом;
г) гидроксильной группой и -CO2H;
д) имидазолилом или
е) тетрагидрофуранилом;
и циклопентила, необязательно замещенного гидроксильной группой;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы VI
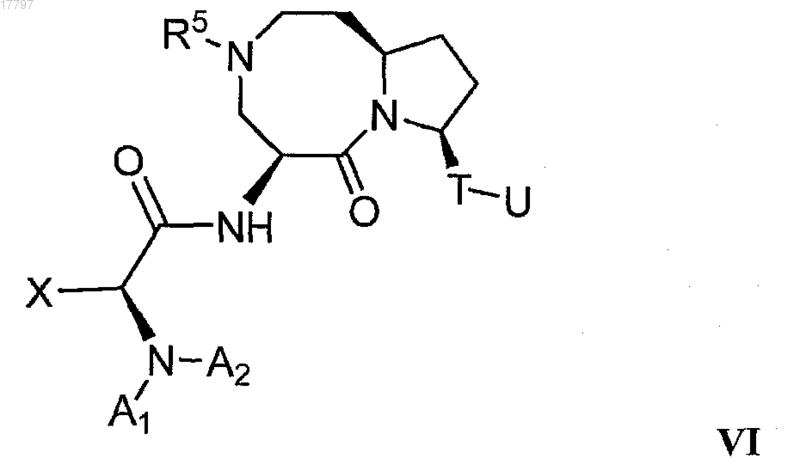
3. Соединение по п.2, где А1 представляет собой незамещенный С1-18 алкил, а А2 представляет собой водород.
4. Соединение по п.2, где R1 выбирают из группы, состоящей из C1-18 алкила, необязательно замещенного одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом; инданила и тетранила.
5. Соединение по п.4, где R1 представляет собой С1-18 алкил, необязательно замещенный двумя фенилами, необязательно замещенными атомом фтора.
6. Соединение по п.5, где R7 представляет собой незамещенный C1-18 алкил.
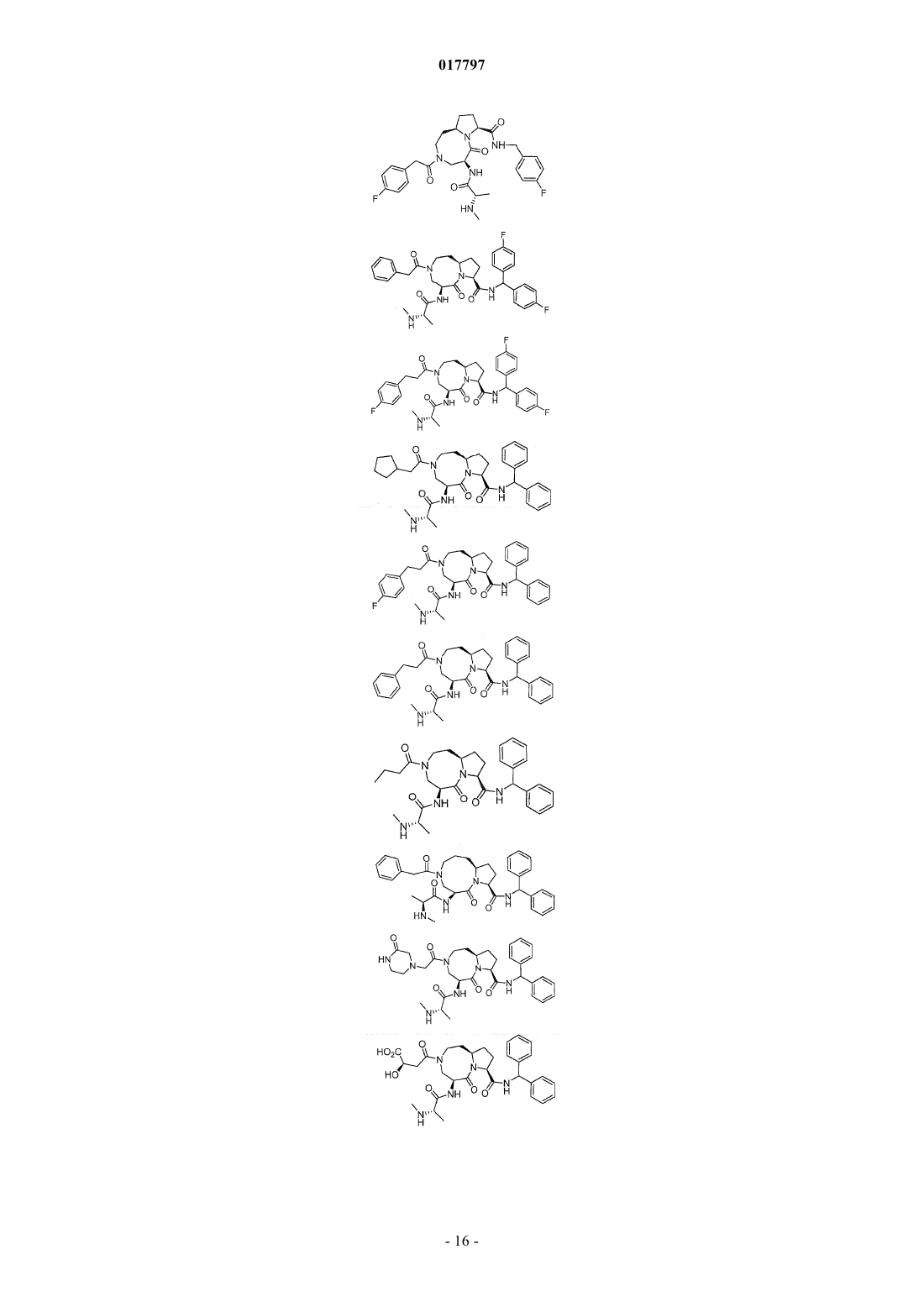
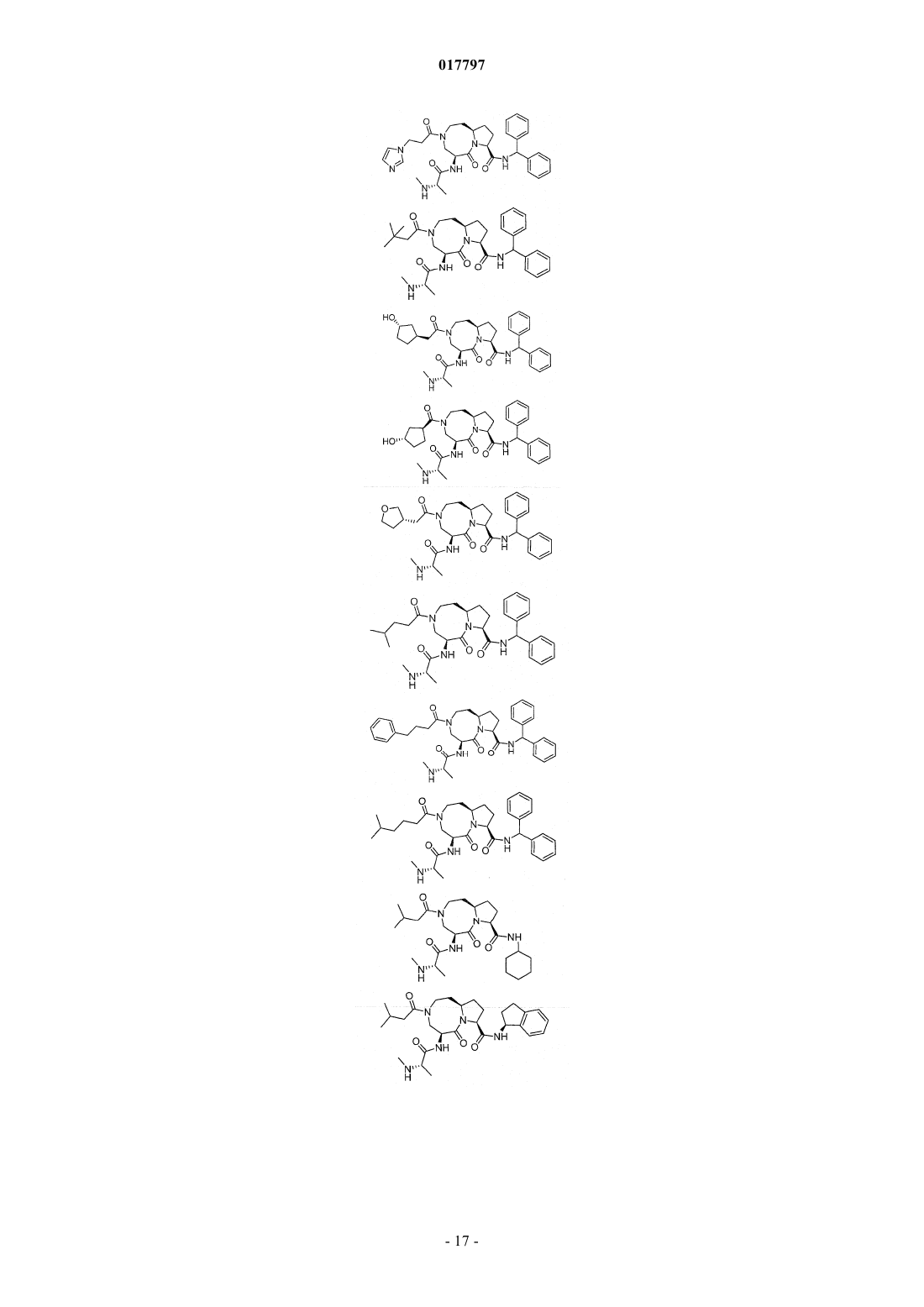
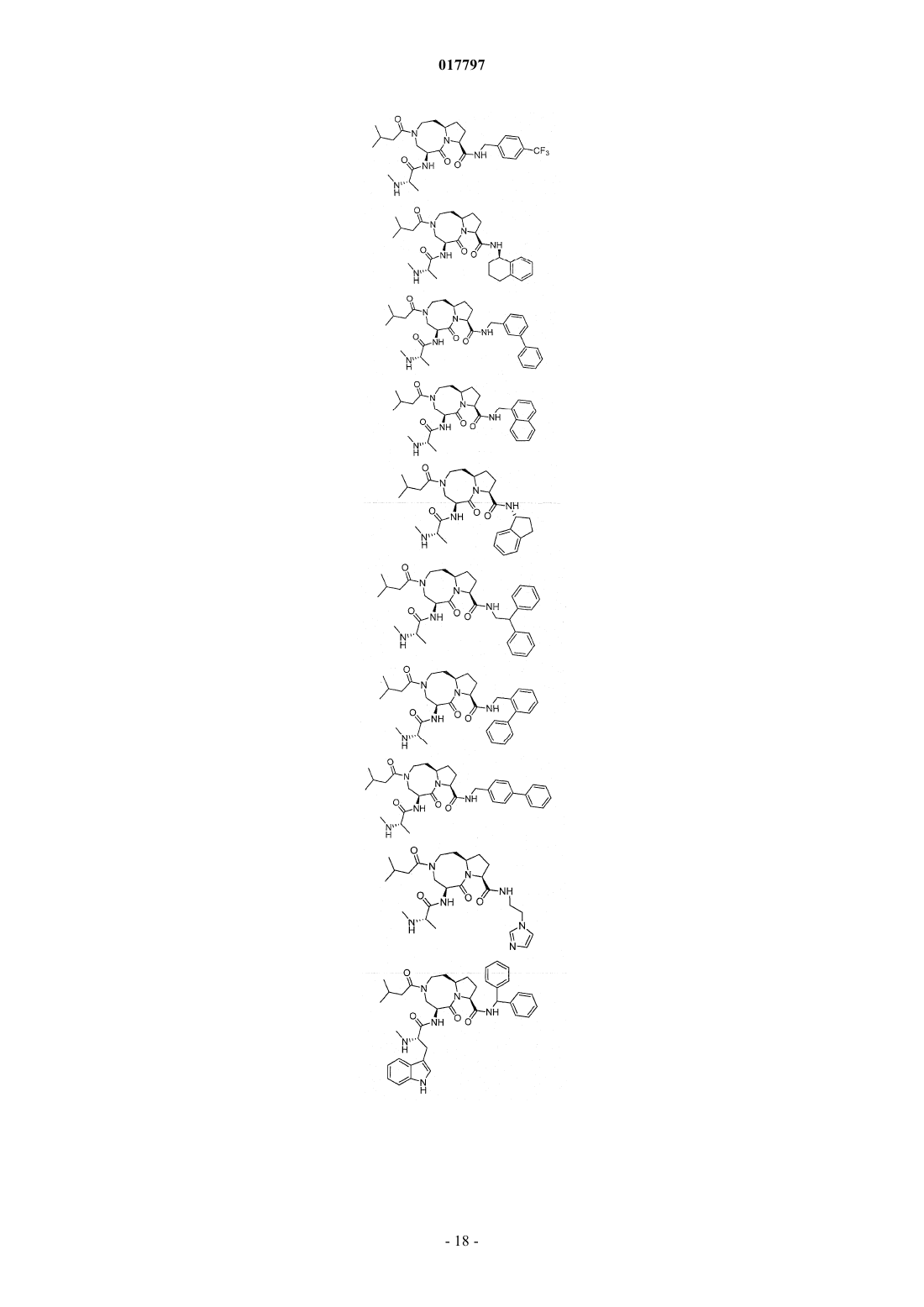
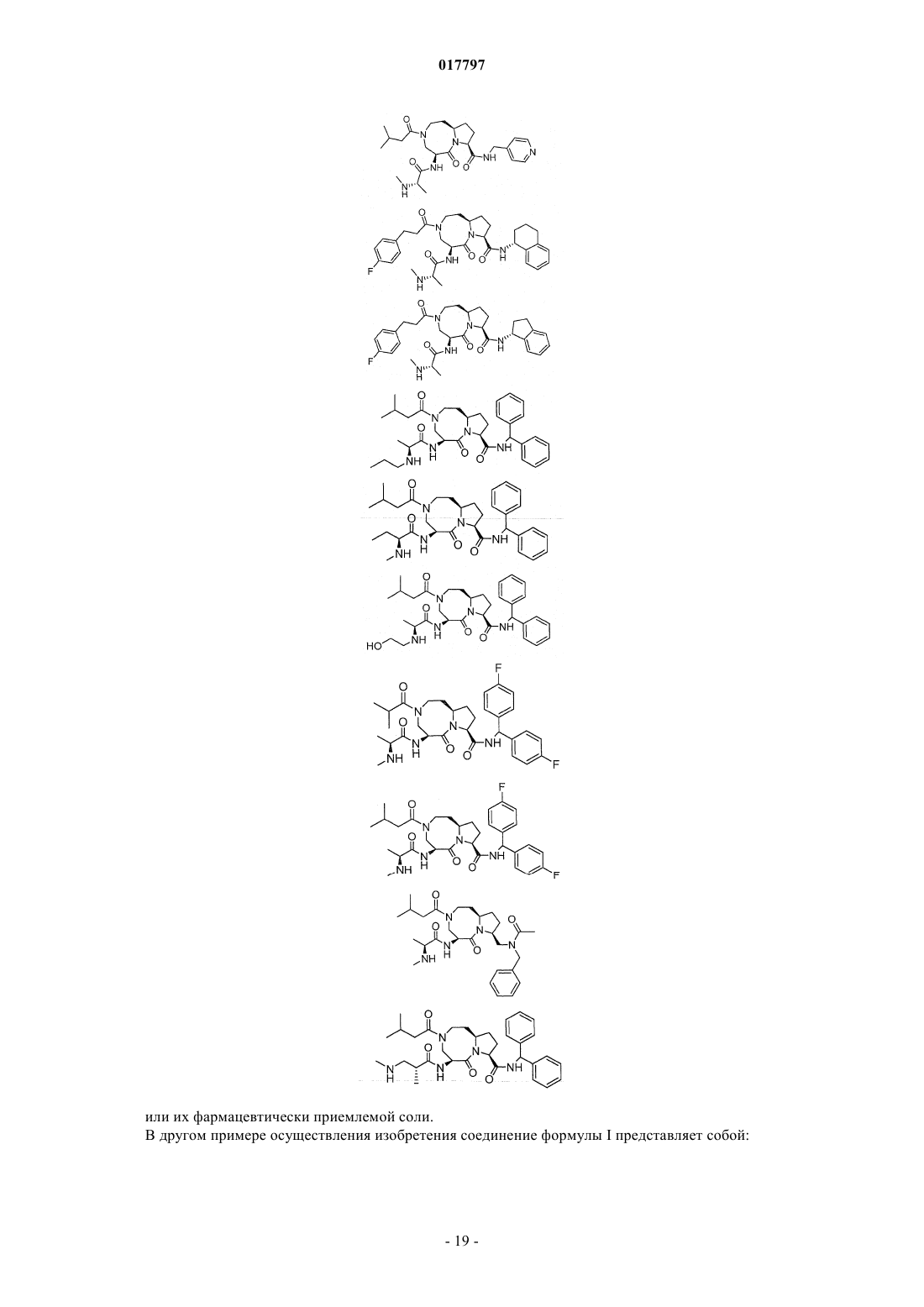
7. Соединение по п.1, выбранное из группы, состоящей из
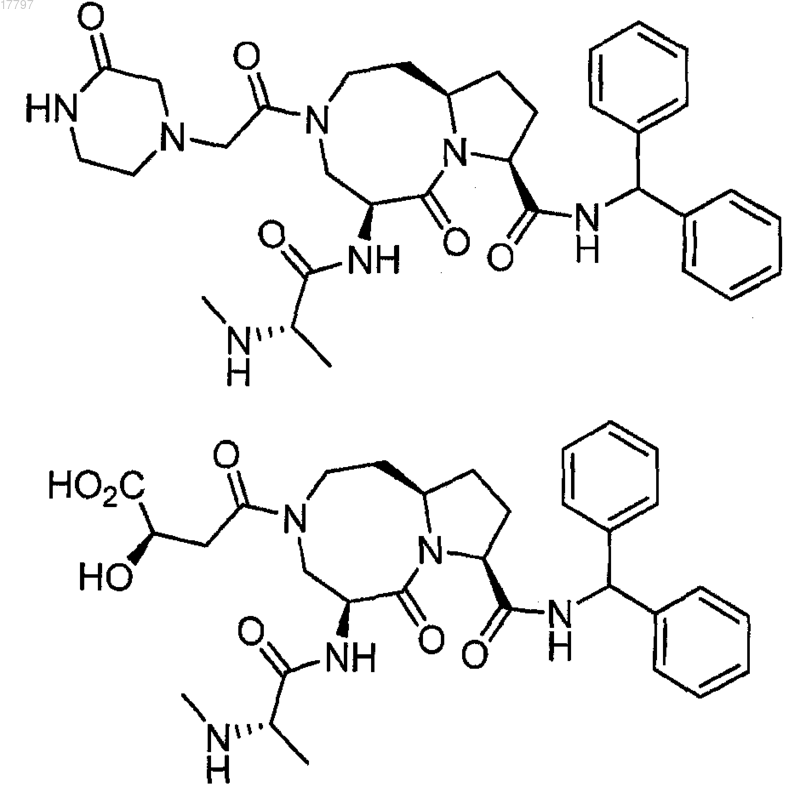
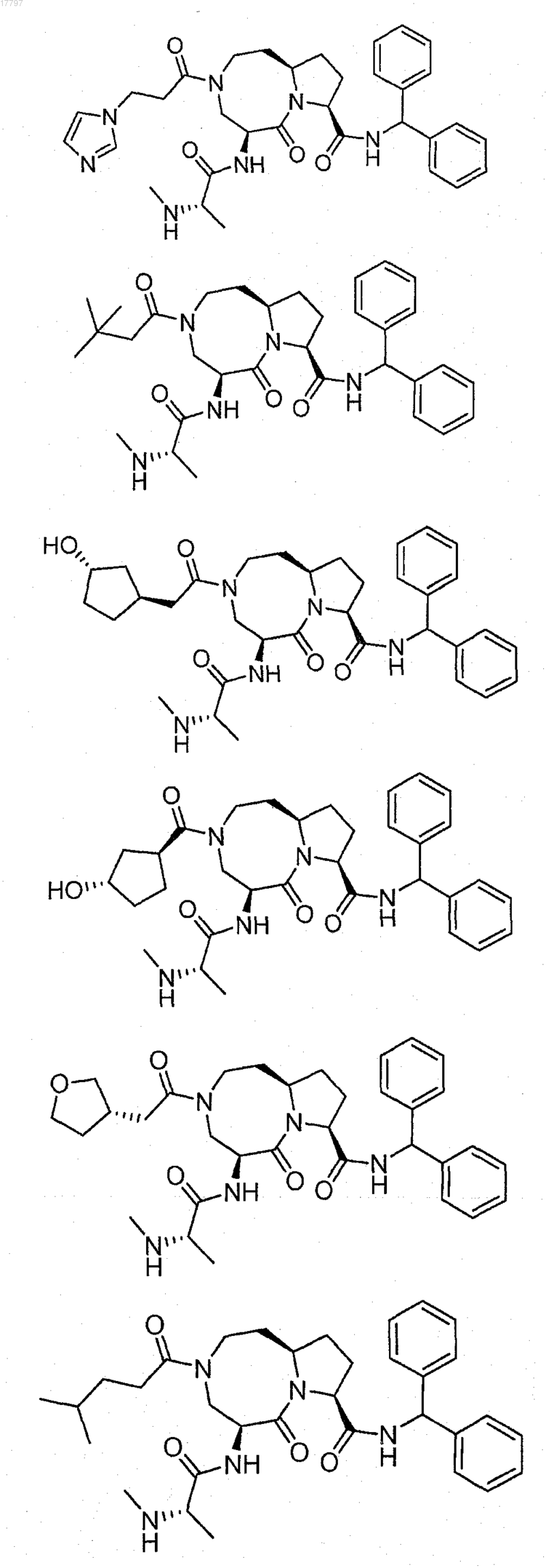
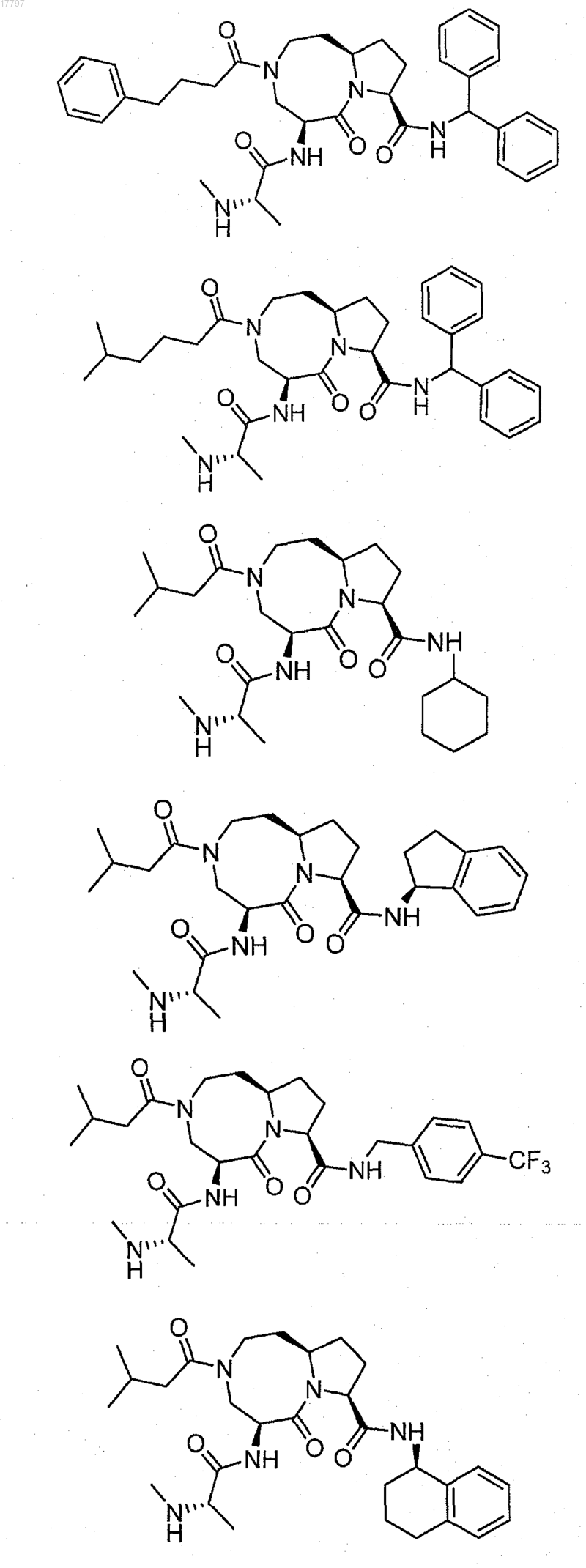
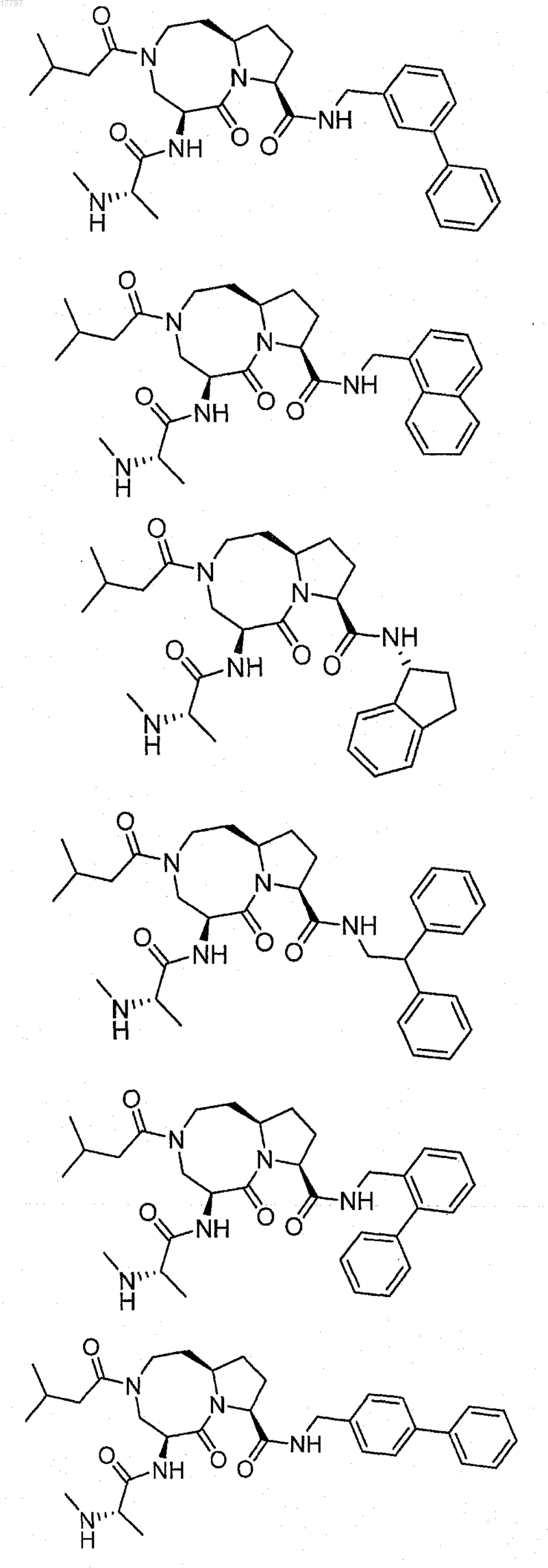
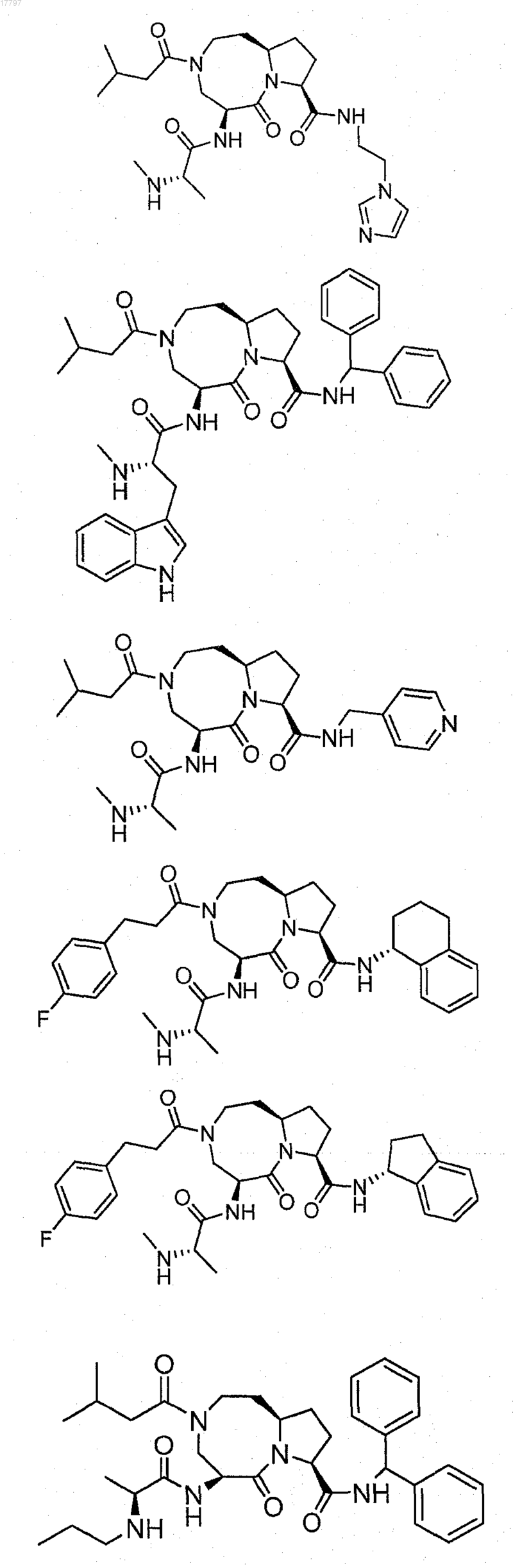
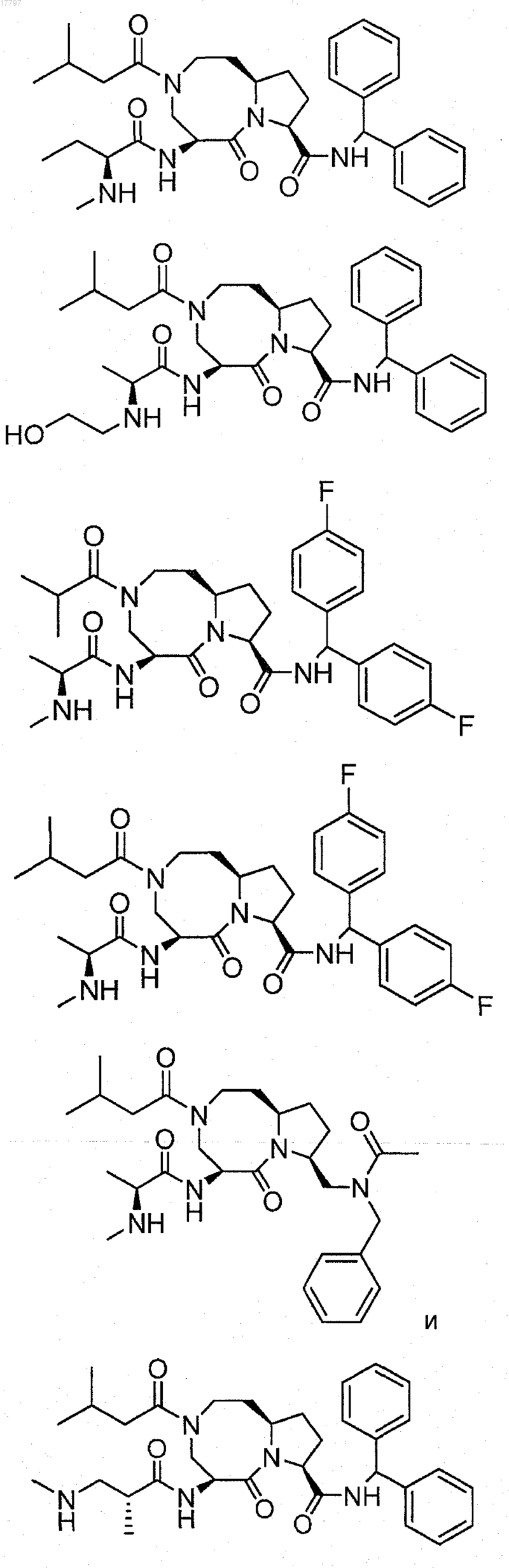
или их фармацевтически приемлемая соль.
8. Соединение по п.1, выбранное из группы, состоящей из
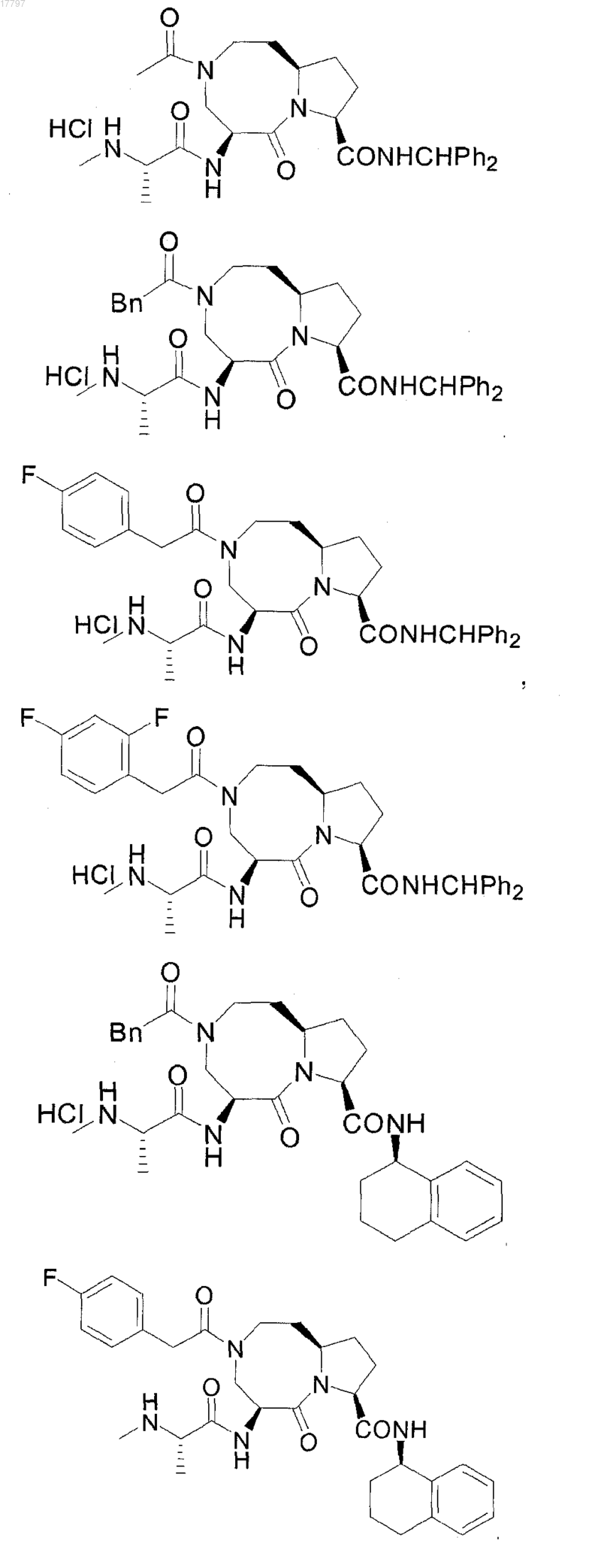
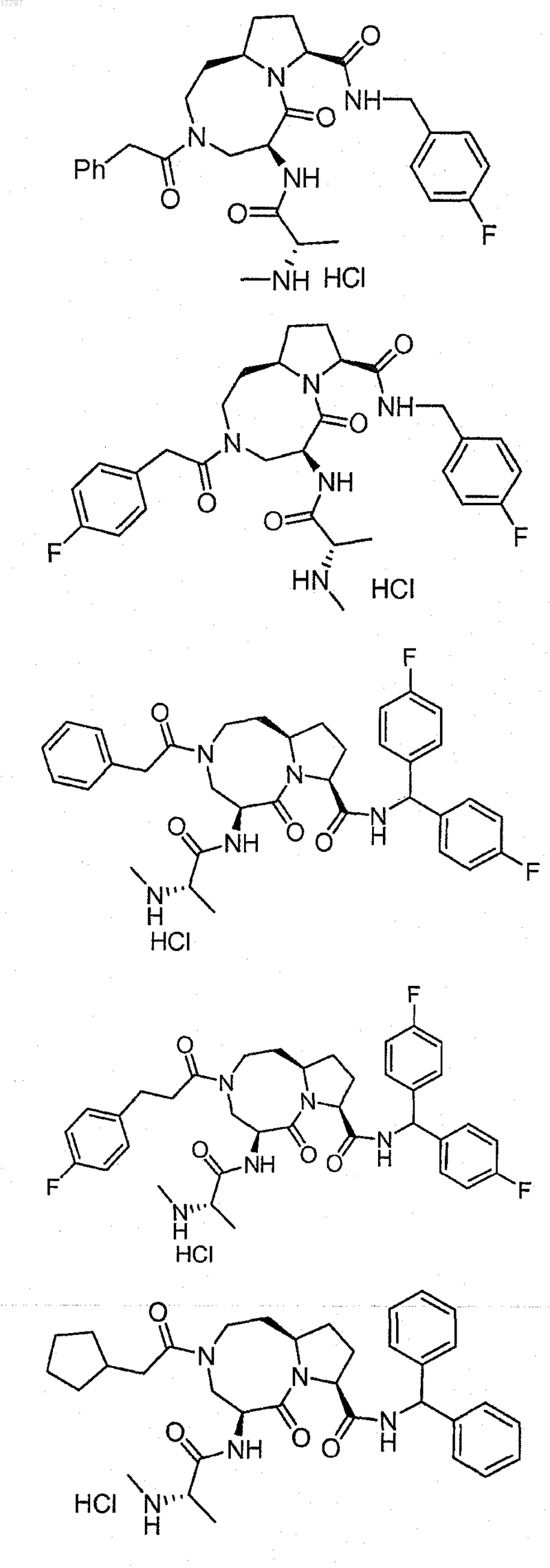
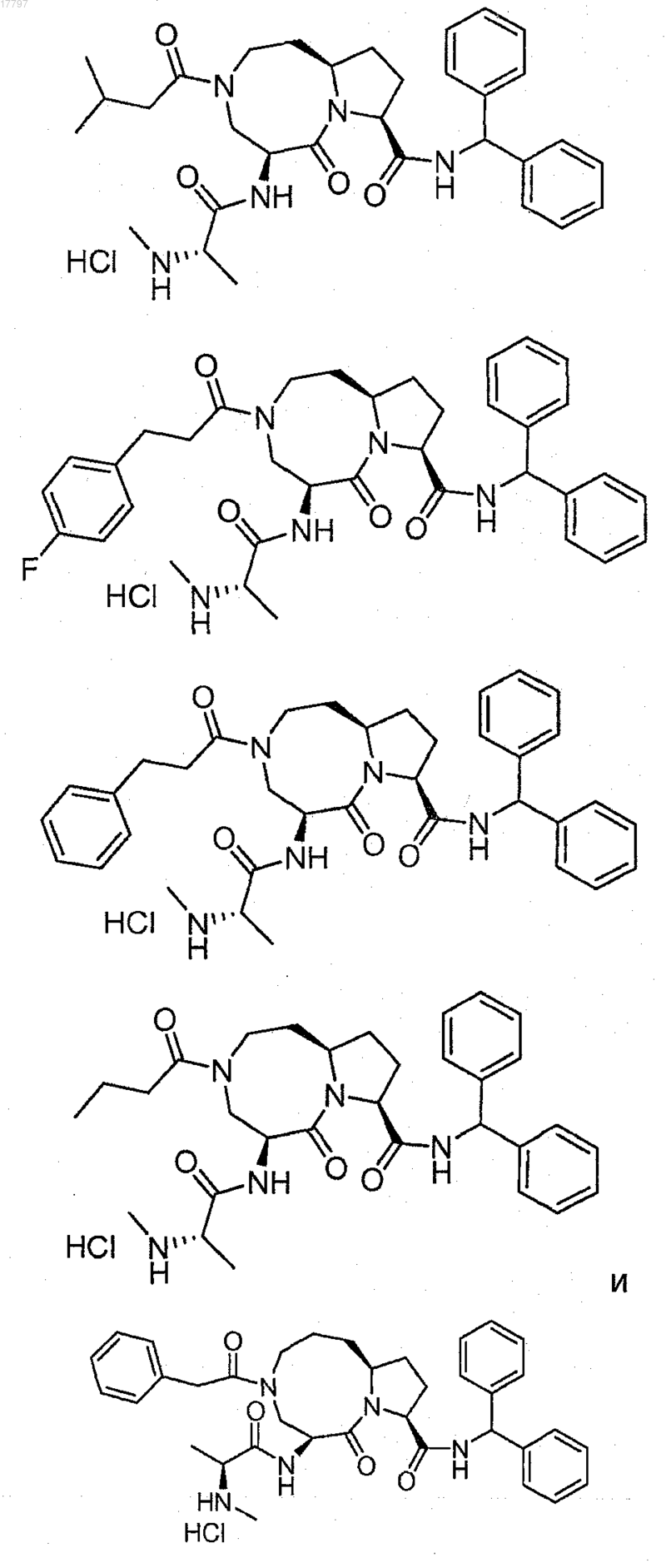
или их свободного основания или другой фармацевтически приемлемой соли.
9. Соединение формулы
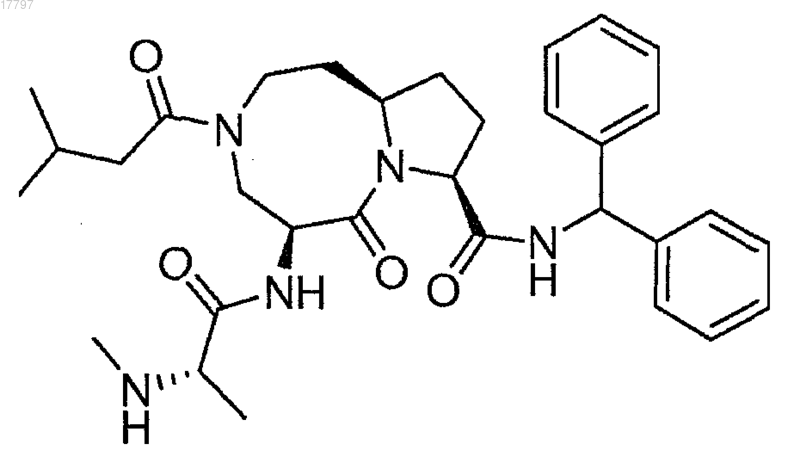
или его фармацевтически приемлемая соль.
10. Фармацевтическая композиция, предназначенная для лечения, улучшения состояния или предотвращения рака у животного, содержащая соединение по любому из пп.1-8 и фармацевтически приемлемый носитель.
11. Фармацевтическая композиция, предназначенная для лечения, улучшения состояния или предотвращения рака у животного, содержащая соединение по п.9 и фармацевтически приемлемый носитель.
12. Способ индуцирования апоптоза в клетке, включающий контактирование клетки с соединением по любому из пп.1-9.
13. Способ сенсибилизации клетки к индуктору апоптоза, включающий контактирование клетки с соединением по любому из пп.1-9.
14. Способ по п.13, отличающийся тем, что дополнительно включает контактирование указанной клетки с индуктором апоптоза.
15. Способ по п.13, отличающийся тем, что указанный индуктор апоптоза представляет собой химиотерапевтический агент.
16. Способ по п.13, отличающийся тем, что указанный индуктор апоптоза представляет собой облучение.
17. Способ по п.13, отличающийся тем, что указанный индуктор апоптоза представляет собой фактор некроза опухоли (TNF), связанный с TNF лиганд или агонист TRAIL-R1 или TRAIL-R2.
18. Способ по п.17, отличающийся тем, что указанный связанный с TNF лиганд выбирают из группы, состоящей из лиганда TRAMP, лиганда Fas/CD95, лиганда TNFR-1 и TRAIL.
19. Способ по п.18, отличающийся тем, что указанный связанный с TNF лиганд представляет собой TRAIL.
20. Способ по п.19, отличающийся тем, что указанный агонист TRAIL-R1 или TRAIL-R2 представляет собой антитело.
21. Способ лечения, улучшения состояния или предотвращения рака у животного, включающий введение указанному животному терапевтически эффективного количества соединения по любому из пп.1-9.
22. Способ по п.21, отличающийся тем, что дополнительно включает введение противоракового агента, выбранного из группы, состоящей из митоксантрона, росковитрина, VP-16, таксотера и гемцитабина.
23. Способ по п.21, отличающийся тем, что дополнительно включает введение индуктора апоптоза, выбранного из группы, состоящей из TNFα и TRAIL.
24. Способ по п.21, отличающийся тем, что рак выбран из группы, состоящей из рака груди, рака яичника, рака простаты, рака поджелудочной железы, лейкемии и меланомы.
25. Способ по п.24, отличающийся тем, что рак выбран из группы, состоящей из рака груди, рака простаты и рака поджелудочной железы.
26. Способ предотвращения или ингибирования ангиогенеза у животного, нуждающегося в этом, включающий введение указанному животному терапевтически эффективного количества соединения по любому из пп.1-9.
27. Способ по п.26, отличающийся тем, что указанное животное имеет заболевание или расстройство, выбранное из группы, включающей дегенерацию желтого пятна, ревматоидный артрит, псориаз, диабетическую ретинопатию, ретинопатию недоношенных, отторжение роговичного имплантата, неоваскулярную глаукому, ретролентальную фиброплазию, покраснение радужки, синдром Ослера-Вебера, миокардиальный ангиогенез, неоваскуляризацию бляшки, телангиэктазию, кровоизлияния в суставы при гемофилии, ангиофиброму, грануляцию раны, кишечные спайки, атеросклероз, склеродерму и гипертрофические рубцы.
28. Набор, включающий фармацевтическую композицию по п.10 или 11 и инструкции по введению указанной композиции животному.
29. Набор по п.28, отличающийся тем, что дополнительно включает противораковый агент, выбранный из группы, состоящей из митоксантрона, росковитина, VP-16, таксотера и гемцитабина.
30. Набор по п.28, отличающийся тем, что дополнительно включает индуктор апоптоза, выбранный из группы, состоящей из TNFα и TRAIL.
31. Набор по п.28, отличающийся тем, что указанные инструкции предназначены для введения указанного соединения животному, имеющему рак.
32. Способ получения соединения формулы XI
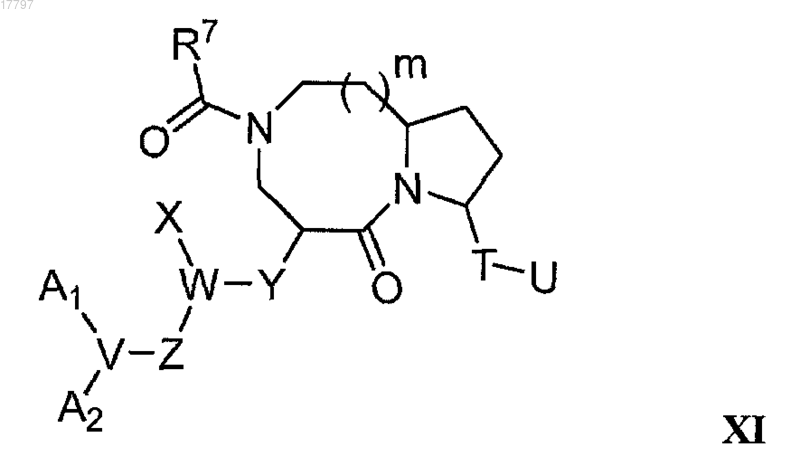
где A1 и А2 независимо выбирают из группы, состоящей из водорода и C1-18 алкила, необязательно замещенного гидроксильной группой;
V представляет собой N;
W представляет собой СН;
X представляет собой C1-3 алкил, необязательно замещенный индолилом;
Y представляет собой NHCO;
Z представляет собой (CR1R2)r;
Т выбирают из группы, состоящей из С=O и CR1R2;
U выбирают из группы, состоящей из NR1R2 и N(R1)COR7;
m равно 1 или 2;
r равно 0;
каждую из групп R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода; С1-18 алкила, необязательно замещенного:
а) одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом;
б) нафтилом или
в) пиридилом, циклогексилом, инданилом, тетранилом и COR7;
R7 выбирают из группы, состоящей из С1-18 алкила, необязательно замещенного:
а) фенилом, необязательно замещенным одним или двумя атомами фтора;
б) циклопентилом, необязательно замещенным гидроксильной группой;
в) оксопиперазинилом;
г) гидроксильной группой и -CO2H;
д) имидазолилом или
е) тетрагидрофуранилом;
и циклопентила, необязательно замещенного гидроксильной группой;
включающий конденсацию соединения формулы XII
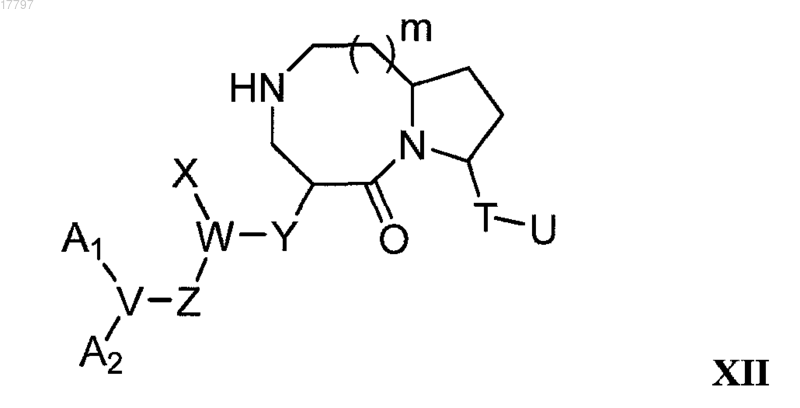
где A1, A2, V, W, X, Y, Z, T, U и m имеют то же значение, как описано выше для формулы XI, с соединением R7CO-L, где
R7 выбирают из группы, состоящей из С1-18 алкила, необязательно замещенного:
а) фенилом, необязательно замещенным одним или двумя атомами фтора;
б) циклопентилом, необязательно замещенным гидроксильной группой;
в) оксопиперазинилом;
г) гидроксильной группой и -СО2Н;
д) имидазолилом или
е) тетрагидрофуранилом;
и циклопентила, необязательно замещенного гидроксильной группой; и
L представляет собой уходящую группу,
с образованием соединения формулы XI.
33. Способ по п.32, отличающийся тем, что U представляет собой NR1R2.
34. Способ по п.32, отличающийся тем, что L выбирают из группы, состоящей из Cl и ОН.
35. Способ по п.34, отличающийся тем, что L представляет собой ОН, и указанную конденсацию проводят в присутствии активирующего агента.
36. Способ получения соединения формулы XIX
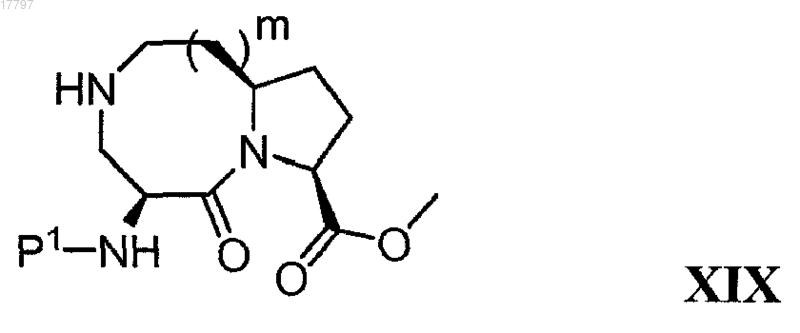
где m равно 1 или 2, а Р1 представляет собой защитную группу для амина, включающий:
а) конденсацию соединения формулы XX
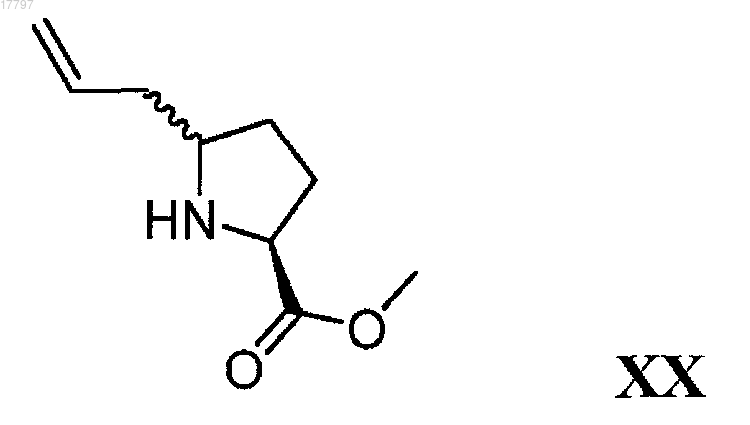
с соединением формулы XXI
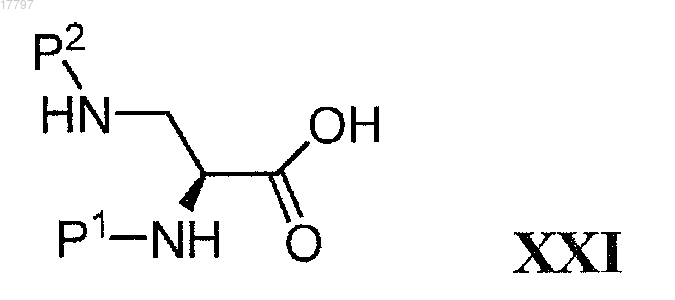
где Р1 и Р2 представляют собой защитные группы для амина и Р1 не равно Р2, с получением соединения формулы XXII
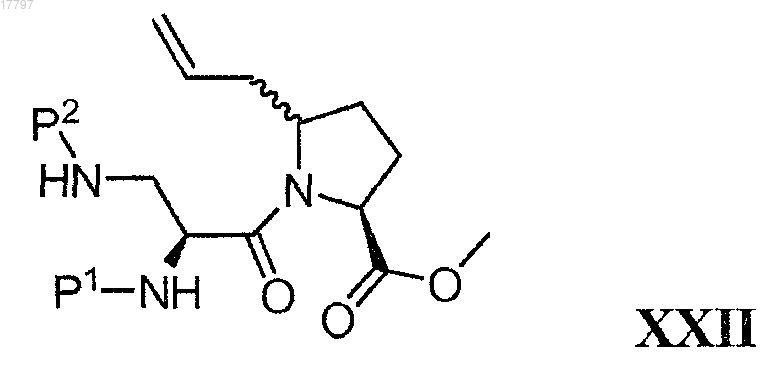
б) превращение алкена формулы XXII в альдегид с получением соединения формулы XXIII
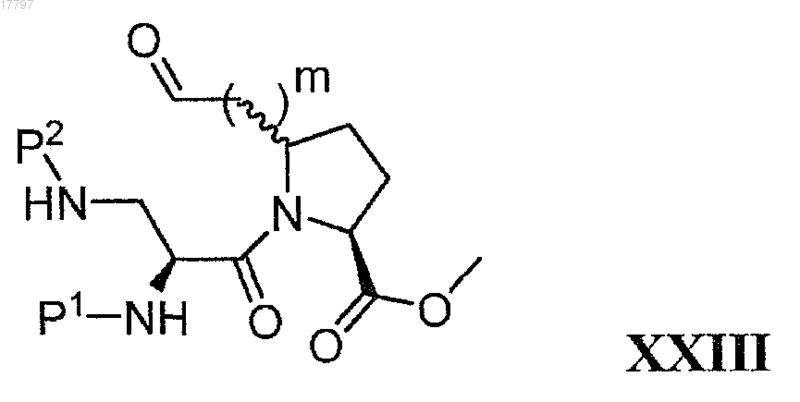
в) удаление Р2 из соединения формулы XXIII с получением соединения формулы XXIV
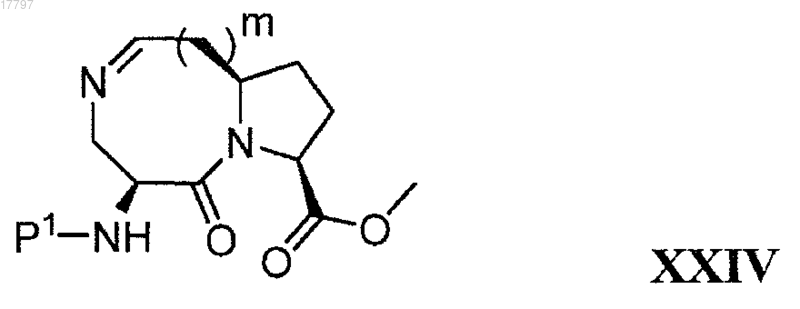
и
г) восстановление двойной связи C=N в соединении формулы XXIV с получением соединения формулы XIX.
37. Способ по п.36, отличающийся тем, что Р1 представляет собой трет-бутилоксикарбонил.
38. Способ по п.37, отличающийся тем, что Р2 представляет собой карбобензилокси.
39. Способ по п.36, отличающийся тем, что указанное соединение формулы XXIV выделяют перед указанным восстановлением двойной связи C=N.
40. Способ по п.39, отличающийся тем, что указанное восстановление проводят с помощью NaBH(OAc)3.
Текст
БИЦИКЛИЧЕСКИЕ ДИАЗОМИМЕТИКИ SMAC, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ИХ ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И НАБОР, СОДЕРЖАЩИЙ УКАЗАННЫЕ КОМПОЗИЦИИ Изобретение относится к бициклическим диазомиметикам Smac, которые функционируют как ингибиторы ингибитора белков апоптоза, и к применению этих миметиков для индуцирования апоптотической смерти клетки и для сенсибилизации клеток к индукторам апоптоза. Изобретение также относится к способам получения указанных миметиков, к фармацевтическим композициям,содержащим их, и к набору, включающему указанные композиции.(71)(73) Заявитель и патентовладелец: ДЗЕ РИДЖЕНТС ОФ ДЗЕ ЮНИВЕРСИТИ ОФ МИЧИГАН (US) Предпосылки создания изобретения Область техники Данное изобретение относится к области медицинской химии. В частности, изобретение относится к конформационно ограниченным миметикам N-терминальной последовательности Smac, которые функционируют как ингибиторы ингибитора белков апоптоза. Изобретение также относится к применению этих миметиков для индуцирования или сенсибилизации клеток к индукции апоптотической смерти клеток. Предшествующий уровень техники Агрессивный фенотип раковой клетки представляет собой результат разнообразия генетических и эпигенетических изменений, приводящих к прекращению регулирования внутриклеточных сигнальных путей (Ponder, Nature 411:336 (2001. Общим для всех раковых клеток, однако, является их неспособность выполнить апоптотическую программу, а отсутствие соответствующего апоптоза вследствие дефектов в механизме апоптоза при нормальном развитии является признаком рака (Lowe et al., Carcinogenesis 21:485 (2000. Большая часть применяемых в настоящее время противораковых терапий, включая химиотерапевтические агенты, облучение и иммунотерапию, действует, косвенно вызывая апоптоз в раковых клетках. Неспособность раковых клеток выполнять апоптотическую программу вследствие дефектов в механизме апоптоза при нормальном развитии, таким образом, часто связана с увеличением резистентности к химиотерапии, облучению или апоптозу, вызванному иммунотерапией. Первичная или приобретенная резистентность рака различного происхождения у человека к текущим протоколам лечения пациента вследствие дефектов апоптоза является главной проблемой в современной терапии рака(Lowe et al., Carcinogenesis 21:485 (2000); Nicholson, Nature 407:810 (2000. Соответственно, в настоящее время и в будущем усилия по созданию и разработке новых молекулярных специфичных противораковых терапий, для улучшения выживаемости и состояния больных раком должны включать стратегии,которые специфически направлены на изменение сопротивления раковой клетки к апоптозу. В этом отношении целевое воздействие на критические отрицательные регуляторы, которые играют центральную роль в прямом ингибировании апоптоза в раковых клетках, представляет очень многообещающую терапевтическую стратегию для нового подхода к созданию противораковых препаратов. Было идентифицировано два класса центральных отрицательных регуляторов апоптоза. Первый класс регуляторов представляет собой семейство белков Bcl-2, примером которого являются две эффективные анти-апоптотические молекулы, белки Bcl-2 и Bcl-XL (Adams et al., Science 281:1322 (1998);Reed, Adv. Pharmacol. 41:501 (1997); Reed et al., J. Cell. Biochem. 60:23 (1996. Терапевтические стратегии для таргетирования Bcl-2 и Bcl-XL при раке, позволяющие восстановить чувствительность раковой клетки и преодолеть резистентность раковых клеток к апоптозу, уже широко рассматривались (Adams et(1996. Несколько лабораторий занято созданием небольших молекул - ингибиторов Bcl-2 и Bcl-XL. Второй класс центральных отрицательных регуляторов апоптоза представляют собой ингибиторы белков апоптоза (IAP) (Deveraux et al., Genes Dev. 13:239 (1999); Salvesen et al., Nat. Rev. Mol. Cell. Biol. 3:401 (2002. Этот класс включает белки, например, XIAP, cIAP-1, cIAP-2, ML-IAP, HIAP, KIAP, TSIAP,NAIP, сурвивин, ливин, ILP-2, аполлон и BRUCE. Белки IAP эффективно подавляют апоптоз, вызванный целым рядом апоптотических стимулов, включая химиотерапевтические агенты, облучение и иммунотерапию в раковых клетках. Связанный с Х-хромосомой ингибитор белков апоптоза (XIAP) является самым эффективным ингибитором в подавлении апоптоза среди всех представителей IAP (Holcik et al., Apoptosis 6:253 (2001);al., Cancer Res. 61:1862 (2001. XIAP играет ключевую роль в отрицательном регулировании апоптоза в путях, опосредованных как рецептором смерти, так и митохондриями. XIAP функционирует как эффективный эндогенный ингибитор апоптоза, действующий путем непосредственного связывания и сильного ингибирования трех представителей семейства ферментов каспаз: каспазы-3, -7 и -9 (Takahashi et al., J.(2001); Chai et al., Cell 104:769 (2001); Huang et al., Cell 704:781 (2001. XIAP содержит три повторяющихся домена бакуловирусного ингибитора апоптоза (BIR), а также С-терминальный RING-домен. Третий домен BIR (BIR3) селективно нацелен на каспазу-9, инициаторную каспазу в митохондриальном пути, тогда как область линкера между BIR1 и BIR2 ингибирует и каспазу-3 и каспазу-7 (Salvesen et al., Nat.Rev. Mol. Cell. Biol. 3:401 (2002. В то время как связывание с XIAP предотвращает активацию всех трех каспаз, очевидно, что взаимодействие с каспазой-9 является наиболее важным для ингибирования апоптоза (Ekert et al., J. Cell Biol. 752:483 (2001); Srinivasula et al., Nature 470:112 (2001. Поскольку XIAP блокирует апоптоз в нисходящей эффекторной фазе в точке, где сходятся многочисленные пути передачи сигналов, для преодоления сопротивления раковых клеток к апоптозу особенно эффективными могут оказаться стратегии, нацеленные на XIAP (Fulda et al., Nature Med. 8:808 (2002); Arnt et al., J. Biol. Chem. 277:44236 (2002.-1 017797 Хотя точная роль XIAP при каждом типе рака далека от полного понимания, появляются свидетельства, указывающие на то, что XIAP сверхэкспрессируется при многих типах рака и может играть важную роль в резистентности раковых клеток к разнообразным современным терапевтическим агентам(Holcik et al., Apoptosis 6:253 (2001); LaCasse et al., Oncogene 77:3247 (1998. Найдено, что белок XIAP экспрессируется в большинстве линий раковых клеток NCI 60 человека(Tamm et al., Clin. Cancer Res. 6:1796 (2000. Анализ образцов опухоли у 78 ранее не подвергавшихся лечению пациентов показал, что пациенты с более низкими уровнями XIAP имели значительно более длительный срок существования (Tamm et al., Clin. Cancer Res. 6:1796 (2000. Найдено, что XIAP экспрессируется при злокачественной глиоме человека (Wagenknecht et al., Cell Death Differ. 6:370 (1999);Fulda et al., Nature Med. 8:808 (2002. Найдено, что при митохондриальной активации XIAP экспрессируется в раковых клетках простаты человека и блокирует апоптоз раковых клеток простаты, опосредованный апоптоз-индуцирующим лигандом Аро-2, связанным с фактором некроза опухоли (McEleny et al.,Prostate 57:133 (2002); Ng et al., Mol. Cancer Ther. 1:1051 (2002. XIAP сверхэкспрессируется у пациентов при немелкоклеточном раке легкого (NSCLC) и участвует в патогенезе NSCLC (Hofmann et al., J. CancerRes. Clin. Oncol. 128:554 (2002. Экспрессия XIAP и отсутствие понижающей регуляции XIAP при лечении цисплатином приводили к резистентности по отношению к цисплатину при раке яичника человека(Li et al., Endocrinology 142:370 (2001); Cheng et al., Drug Resist. Update 5:131 (2002. Взятые вместе, эти данные дают возможность предположить, что XIAP может играть важную роль в резистентности некоторых видов рака человека к имеющимся терапевтическим агентам. Целостность стенок кровеносных сосудов является существенной для гомеостаза сосудов и функционирования органа. Динамический баланс между выживанием и апоптозом эндотелиальной клетки вносит свой вклад в эту целостность в процессе развития сосудов и патологического ангиогенеза. Было показано, что cIAP-1 является необходимым для поддержания выживания эндотелиальной клетки и гомеостаза кровеносных сосудов при развитии сосудов (Santoro et al., Nature Genetics 39: 1397 (2007). Как таковой, cIAP-1 может играть важную роль в контроле ангиогенеза и гомеостаза кровеносных сосудов при эмбриогенезе, регенерации и туморогенезе. Апоптоз не является отдельным процессом, скорее он связан с множеством различных, иногда взаимосвязанных, сигнальных путей, приводящих к распаду клетки. Пути, участвующие в конкретной форме апоптоза, зависят от многих факторов, например, поражения или поражений, которые инициируют процесс. Другие факторы включают активацию или гиперактивацию специфических рецепторов, например, активацию "рецепторов смерти" альфа-фактором некроза опухоли (TNF), апоптоз-индуцирующим лигандом, связанным с фактором некроза опухоли (TRAIL или Apo2L), или лигандом FAS. Другим определяющим фактором является тип участвующей клетки, поскольку после активации рецептораFAS или TNF для клеток так называемого типа I и типа II показаны различные пути передачи сигналов. Было показано, что TRAIL (Apo2L) является селективным и эффективным индуктором апоптоза в раковых клетках (но не в нормальных клетках) при связывании с любым из двух про-апоптотическихDR5) (Wu et al., Nat. Genet. 17:141-143 (1997); Pan et al., Science 277:815 (1997); Walczak et al., EMBO J. 16:5386 (1997. Активация про-апоптотических рецепторов смерти с помощью TRAIL индуцирует образование сигнального комплекса, индуцирующего смерть (DISC), который содержит рецептор FADD в качестве адаптера (Kischkel et al., Immunity 72:611 (2000); Kuang et al., J. Biol. Chem. 275:25065 (2000, и каспазу-8 в качестве инициирующей каспазы. После образования DISC, каспаза-8 аутопроцессируется и активируется путем индуцирования при сближении (Medema et al., EMBO J. 76:2794 (1997); Muzio et al.,J. Biol. Chem. 273:2926 (1998.TRAIL вызывает значительный интерес в качестве потенциального терапевтического средства при лечении рака (French et al., Nat. Med. 5:146 (1999 благодаря своему селективному нацеливанию на раковые клетки, тогда как большинство нормальных клеток, по-видимому, является устойчивыми к TRAIL(Ashkenazi et al., Science 287:1305 (1998); Walczak et al., Nat. Med. 5:157 (1999. Доказано, что систематическое назначение TRAIL является безопасным и эффективным при лизисе опухоли молочной железы или толстой кишки в модели ксенотрансплантата и для продления длительности жизни мышей (Walczaket al., Nat. Med.5:157 (1999. Хотя TRAIL может специфично подавлять многие типы раковых клеток,многие другие проявляют резистентность к TRAIL (Kim et al., Clin. Cancer Res. 6:335 (2000); Zhang et al.,Cancer Res. 59:2747 (1999. Кроме того, раковые клетки подавляли путем применения антител (моноклональных или поликлональных), которые специфично опознают как TRAIL-R1, так и TRAIL-R2. В качестве потенциальных факторов, ответственных за резистентность к TRAIL, было определено множество механизмов. Такие механизмы существуют на множестве уровней, включая рецепторный уровень, митохондриальный уровень, пост-митохондриальный уровень и уровень DISC. Например, недостаточная экспрессия каспазы-8 (Teitz et al., Nat. Med. 6:529 (2000); Griffith et al., J. Immunol. 161:2833(1998 или высокая экспрессия клеточного ингибирующего протеина FLICE (cFLIP) (Kim et al., Clin.Cancer Res. 6:335 (2000); Zhang et al., Cancer Res. 59:2747 1999; Kataoka et al., J. Immunol. 161:3936 (1998 делают раковые клетки устойчивыми к TRAIL. Yeh et al. показали, что cFLIP-дефицитные фибропласты-2 017797 эмбрионов мышей, в частности, чувствительны к рецептор-опосредованному апоптозу (Yeh et al., Immunity 12:533 (2000. Известно несколько вариантов cFLIP, включая вариант короткого соединения, cFLIPS, и вариант более длинного соединения, cFLIP-L. Было показано, что cFLIP-дефицитные фибропласты эмбрионов мышей становятся резистентными к TRAIL-индуцированному апоптозу в результате ретровирус-опосредованной трансдукции cFLIP-S (Bin et al., FEBS Lett. 510:37 (2002. Хотя TRAIL является потенциально многообещающим кандидатом для специфической активации рецептора смерти опухоли (то есть, он вызывает апоптоз предпочтительно в клетках опухоли, а не в нормальных тканях), многие раковые клетки являются резистентными к лекарствам, вызывающим апоптоз, как обсуждалось выше. В результате для достижения терапевтического эффекта лечение такими лекарствами часто требует совместной обработки облучением и/или цитостатическими веществами. Однако как облучение, так и химиотерапия имеют существенные побочные эффекты, и по возможности их вообще избегают. Таким образом, имеется потребность в агенте, который может селективно и эффективно сенсибилизировать клетки опухоли к селективным лекарственным препаратам, вызывающим апоптоз, например,TRAIL или антителам TRAIL-рецептора, при этом не сенсибилизируя окружение нормальных клеток. Такой агент также был бы полезным для уменьшения или предотвращения резистентности к препарату,обычно связанной с использованием рецептор-опосредованных апоптотических противораковых лекарств, таким образом, улучшая их эффективность и устраняя необходимость применения комбинационных терапий. Недавно был идентифицирован Smac/DIABLO (второй активатор каспаз, полученный из митохондрий) в виде белка, выделяемого митохондриями в цитозоль в ответ на апоптотические стимулы (Budihardjo et al., Annu. Rev. Cell Dev. Biol. 15:269 (1999); Du et al., Cell 102:33 (2000. Smac синтезируют с помощью N-терминальной митохондриальной таргетирующей последовательности, которую протеолитически удаляют при созревании до зрелого полипептида. Показано, что Smac непосредственно взаимодействует с XIAP и другими IAP и разрушает их связывание с каспазами, а также облегчает активацию каспаз. Smac является эффективным эндогенным ингибитором XIAP. Недавно с высокой разрешающей способностью были определены экспериментальные трехмерные(3D) структуры области BIR3 XIAP в комплексе с белком Smac и пептидом (Sun et al., J. Biol. Chem. 275:36152 (2000); Wu et al., Nature 408:1008 (2000 (Фиг. 1). N-терминальный тетрапептид Smac (AlaVal-Pro-IIe или AVPI (последовательность SEQ ID NO:1 распознает бороздку на поверхности областиBIR3 XIAP путем образования нескольких водородных связей и Ван-дер-Ваальсового взаимодействия. Также было показано, что взаимодействие между BIR3 и каспазой-9 включает четыре остатка (Ala-ThrPro-Phe или ATPF (последовательность SEQ ID NO:2 на амино-сайте терминации транскрипции небольшой субъединицы каспазы-9 с этой же бороздкой на поверхности области BIR3. Некоторые недавние исследования убедительно показали, что Smac промотирует каталитическую активность каспазы-9 путем конкурирующего взаимодействия каспазы-9 за то же связывание с бороздкой на поверхности области BIR3 (Ekert et al., J. Cell Biol. 152:483 (2001); Srinivasula et al., Nature 410:112 (2001. В отличие от большинства взаимодействий белка с белком, взаимодействие Smac-XIAP опосредуется только четырьмя аминокислотными остатками на белке Smac и хорошо выраженной бороздкой на поверхности области BIR3 XIAP. Величина Kd для Smac пептида AVPI (последовательность SEQ IDNO:1) относительно XIAP (Kd = 0,4 мкМ) является практически той же, что и для зрелого белка Smac (Kd= 0,42 мкМ). Этот хорошо выраженный участок взаимодействия является идеальным для разработки небольших целевых непептидных молекул, подобных лекарственному препарату, которые подражают связыванию Smac с XIAP. Проникающий в клетку Smac пептид, который состоит из первых четырех аминокислотных остатков (AVPI (последовательность SEQ ID NO: 1 N-сайта терминации транскрипции Smac, связанный с белком-носителем для улучшения внутриклеточной доставки, как недавно было показано, повышает чувствительность различных клеток опухоли in vitro и клеток злокачественной глиомы in vivo к апоптозу, индуцированному лигированием рецептора смерти или цитотоксическими лекарственными препаратами Fulda et al., Nature Med. 8:808 (2002. Что важно, этот Smac пептид сильно увеличивал противоопухолевую активность Apo2L/TRAIL во внутричерепной злокачественной глиоме в модели ксенотрансплантата in vivo. Полное уничтожение установленных опухолей и выживание мышей были достигнуты только после совместной обработки пептидами Smac и Apo2L/TRAIL Важно отметить, что у Smac пептида нет заметной токсичности по отношению к нормальной ткани мозга. Второе недавнее независимое исследование также показало, что пептиды, состоящие из первых четырех-восьми аминокислотных остатков N-сайта терминации транскрипции Smac, соединенные с различными белками-носителями, увеличивали индукцию апоптоза и долговременные антипролиферативные эффекты разнообразных химиотерапевтических лекарственных препаратов, включая паклитаксел,этопозид, SN-38, и доксорубицин в MKF-7 и других клеточных линиях рака молочной железы человека(Arnt et al., J. Biol. Chem. 277:44236 (2002). Это исследование окончательно показало, что XIAP и cIAP-1 представляют собой первичные молекулярные цели для этих пептидов в клетках. Третье исследование показало, что пептид Smac из первых семи остатков N-сайта терминации-3 017797 транскрипции, соединенный с полиаргинином, восстанавливал апоптосомную активность и полностью изменял резистентность к апоптозу в клетках Н 460 немелкоклеточного рака легкого (Yang et al., CancerRes. 63:831 (2003. Было показано, что XIAP является ответственным за недостаток апоптосомной активности и подавление активности каспазы в клетках Н 460. При использовании в комбинации с химиотерапией, проникающий в клетку пептид Smac вызывал замедление роста опухоли in vivo при незначительной токсичности в отношении крыс. В своей совокупности эти последние независимые исследования дают веские основания предположить, что эффективный, устойчивый, проникающий в клетку Smac миметик может обладать большим терапевтическим потенциалом при лечении рака молочной железы человека и других типов рака. Ингибиторы на основе пептидов являются полезными инструментами для объяснения антиапоптотической функции IAP и роли IAP в ответе раковых клеток на действие химиотерапевтических агентов. Но ингибиторы на основе пептидов обычно имеют ограничения, свойственные им как потенциально полезным терапевтическим агентам. Эти ограничения включают их плохую проникаемость в клетки и плохую стабильность in vivo. Действительно, в этих трех опубликованных исследованиях с использованием пептидных ингибиторов на основе Smac, указанные пептиды должны были быть гибридизованы с пептидами носителя, чтобы сделать их относительно проницаемыми в клетку. Чтобы преодолеть ограничения, свойственные ингибиторам на основе пептидов, настоящее изобретение включает разработку конформационно ограниченных Smac миметиков. Краткое описание изобретения Общепринято, что неспособность раковых клеток или поддерживающих их клеток подвергаться апоптозу в ответ на генетические повреждения или воздействие индукторов апоптоза (например, противораковых агентов и облучения) является главным фактором в начальной стадии и при прогрессирующем раке. Полагают, что индукция апоптоза в раковых клетках или поддерживающих их клетках (например, неоваскулярных клетках в сосудистой сети опухоли) является универсальным механизмом действия практически для всех эффективных противораковых терапевтических лекарственных средств или радиационных методов лечения, предлагаемых рынком или имеющихся в медицинской практике сегодня. Одной из причин неспособности клетки подвергаться апоптозу является увеличенная экспрессия и накопление IAP. В настоящем изобретении предполагается, что воздействие на животных, страдающих от рака или других гиперпролиферативных расстройств или заболеваний, связанных с дисрегуляцией апоптоза, терапевтически эффективного количества лекарственного препарата(ов) (например, небольших молекул),которые ингибируют функцию(и) IAP, подавляет больные клетки или поддерживающие их клетки (те клетки, продолжительное выживание которых зависит от гиперактивности или сверхэкспрессии IAP),и/или делает такие клетки как популяцию более восприимчивыми к действию терапевтических лекарственных препаратов или радиационных методов лечения, индуцирующих гибель раковой клетки. В настоящем изобретении предполагается, что ингибиторы IAP соответствуют неудовлетворенной потребности в лечении разнообразных типов рака, при назначении как монотерапии, чтобы вызвать апоптоз в раковых клетках, зависящих от функции IAP, так и при назначении временно связанных с другими лекарственными средствами или радиационными методами лечения, стимулирующими гибель раковой клетки,чтобы создать большую долю раковых клеток или поддерживающих их клеток, восприимчивых к выполнению программы апоптоза, по сравнению с соответствующей долей клеток в животном, подвергающемся лечению только противораковым лекарственным препаратом или только радиационной терапией. В настоящем изобретении также предполагается, что лечение животных, страдающих от заболеваний, связанных с эндотелиальными клетками (таких как опухолевый ангиогенез, ретинопатия и атеросклероз) с помощью терапевтически эффективных количеств препарата(ов) (например, небольшими молекулами), которые ингибируют функцию(и) IAP (например, с IAP-1), может предотвратить или ингибировать ангиогенез и разрушить гомеостаз кровеносного сосуда при развитии сосуда в патологических условиях. Конкретные расстройства, которые можно лечить с помощью соединений по изобретению,включают дегенерацию жлтого пятна, ревматоидный артрит, псориаз, диабетическую ретинопатию,ретинопатию недоношенных, отторжение роговичного имплантата, неоваскулярную глаукому, ретролентальную фиброплазию, покраснение радужки, синдром Ослера-Веббера, миокардиальный ангиогенез,неоваскуляризацию бляшки, телангиэктазию, кровоизлияния в суставы при гемофилии, ангиофиброму,грануляцию раны, кишечные спайки, атеросклероз, склеродерму и гипертрофические рубцы. Заявители также обнаружили, что введение NR5 в бициклическую кольцевую систему неожиданно оказывает определенное влияние на связывание с XIAP по сравнению с карбоциклическими аналогами(например, SM-122) (диаграмма 1). Например, сродство к связыванию с XIAP BIR3 и клеточная активность в линиях раковых клеток MDA-MB-231 и SK-OV-3 для соединений SM-245 РЗ (R5 = Me) и SM-246P(R5 = Bn) меньше, чем сродство для соединения SM-122. Как ни странно, сродство к связыванию с XIAPBIR3 и клеточная активность в линиях раковых клеток MDA-MB-231 и SK-OV-3 для соединений SM-337(R5 = COCH2Ph) и SM-406 (R5 = СОСН 2 СН(СН 3)2 равно или лучше, чем сродство для соединения SM-122. В дополнение к определенным биологическим свойствам, заявители нашли, что соединение SM-406 и-4 017797 другие родственные аналоги проявляют неожиданно лучшие результаты в отношении перорального бионакопления по сравнению с соединением SM-122. Диаграмма 1 Заявители также нашли, что соединения по настоящему изобретению при объединении с другими противораковыми агентами (такими как Тайкерб, таксотер, гемцитабин, митоксантрон, этопозид) проявляют неожиданно лучшую активность in vitro в линиях раковой клетки. Кроме того, заявители нашли,что соединения по настоящему изобретению при объединении с другими противораковыми агентами(такими как Тайкерб, таксотер, гемцитабин) проявляют удивительное уменьшение среднего объема опухоли in vivo в модели ксенотрансплантата рака. Таким образом, в определенных примерах осуществления изобретения комбинированное лечение животных сочетанием терапевтически эффективного количества соединения по настоящему изобретению и курса противоракового агента или облучения производит больший ответ опухоли и клиническую пользу в таких животных по сравнению с животными, которых подвергали лечению только указанным соединением или только одними противораковыми лекарственными препаратами/облучением. Другими словами, поскольку соединения по настоящему изобретению понижают апоптотический порог всех клеток, которые экспрессируют IAP, увеличивается доля клеток, которые успешно выполняют программу апоптоз в ответ на апоптоз-индуцирующую активность противораковых лекарственных препаратов/облучения. С другой стороны, соединения по настоящему изобретению можно применять для назначения более низкой, и поэтому менее токсичной и более переносимой, дозы противоракового агента и/или облучения, чтобы продуцировать тот же ответ/клиническую пользу в опухоли, как и обычная доза одного только противоракового агента/облучения. Поскольку дозы для всех одобренных противораковых лекарственных препаратов и радиационных методов лечения известны, в настоящем изобретении рассмотрены различные сочетания их с соединениями по настоящему изобретению. Кроме того, поскольку соединения по настоящему изобретению, по меньшей мере частично, действуют путем ингибирования IAP, может оказаться, что воздействие терапевтически эффективного количества соединений на раковые клетки и поддерживающие их клетки по времени совпадает с попытками клеток выполнить программу апоптоза в ответ на противораковый агент или радиационную терапию. Таким образом, в некоторых примерах осуществления изобретения, назначение соединения по настоящему изобретения в связи с определенными временными отношениями, обеспечивает особенно эффективные способы лечения. Настоящее изобретение относится к Smac миметикам, которые полезны для ингибирования активности белков IAP и - среди прочего - для увеличения чувствительности клеток к индукторам апоптоза. В одном специфическом примере осуществления изобретения Smac миметики являются соединениями формулы I где A1 и А 2 независимо выбирают из группы, состоящей из водорода и C1-18 алкила,необязательно замещенного гидроксильной группой;J представляет собой незамещенный С 1-4 алкиленил; Т выбирают из группы, состоящей из С=O и CR1R2;n и m независимо выбирают из 1, 2 или 3;r равно 0; каждую из групп R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода; C1-18 алкила, необязательно замещенного: а) одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом; б) нафтилом или в) пиридилом, циклогексилом, инданилом, тетранилом и COR7;R7 выбирают из группы, состоящей из С 1-18 алкила, необязательно замещенного: а) фенилом, необязательно замещенным одним или двумя атомами фтора; б) циклопентилом, необязательно замещенным гидроксильной группой; в) оксопиперизинилом; г) гидроксильной группой и -СО 2 Н; д) имидазолилом или е) тетрагидрофуранилом; и циклопентила, необязательно замещенного гидроксильной группой; или его фармацевтически приемлемая соль. В другом конкретном примере осуществления изобретения Smac миметики представляют собой соединения формулы VI где А 1, А 2, R5, Т и U имеют то же значение, как описано выше для формулы I; или их фармацевтически приемлемую соль. Настоящее изобретение относится к соединениям, представленным формулами I-Х, которые являются ингибиторами белков IAP. Изобретение относится к применению соединений по изобретению, которые индуцируют апоптоз в клетках и ингибируют ангиогенез. Изобретение также относится к применению соединений по изобретению для сенсибилизации клеток к индукторам апоптоза. Данные соединения полезны для лечения, улучшения состояния или предотвращения расстройств, чувствительных к индукции апоптотической гибели клетки, например расстройств, характеризующихся дисрегуляцией апоптоза, включая гиперпролиферативные болезни, такие как рак. В определенных примерах осуществления изобретения данные соединения могут применяться для лечения, улучшения состояния или предотвращения рака, который характеризуется резистентностью к методам лечения (например, видов рака, которые являются химиорезистентными, устойчивыми к облучению, гормонам и т.п.). В других примерах осуществления изобретения данные соединения можно применять для лечения гиперпролиферативных заболеваний, характеризующихся сверхэкспрессией IAP. В других примерах осуществления изобретения, данные соединения можно применять в качестве способа предотвращения или ингибирования ангиогенеза у животных, нуждающихся в этом. Настоящее изобретение представляет фармацевтические композиции, содержащие соединение формул I-Х в терапевтически эффективном количестве, чтобы вызвать апоптоз в клетках или сенсибилизировать клетки к индукторам апоптоза. Изобретение дополнительно представляет наборы, включающие соединение формулы I и инструкции по введению соединения животному. Наборы могут необязательно содержать другие терапевтические вещества, например противораковые агенты или апоптоз-модулирующие агенты. Настоящее изобретение также обеспечивает способ получения соединения формулы XI где A1 и А 2 независимо выбирают из группы, состоящей из водорода и C1-18 алкила, необязательно замещенного гидроксильной группой;r равно 0; каждую из групп R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода;C1-18 алкила, необязательно замещенного: а) одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом; б) нафтилом или в) пиридилом, циклогексилом, инданилом, тетранилом и COR7;R7 выбирают из группы, состоящей из C1-18 алкила, необязательно замещенного: а) фенилом, необязательно замещенным одним или двумя атомами фтора; б) циклопентилом, необязательно замещенным гидроксильной группой; в) оксопиперизинилом; г) гидроксильной группой и -СО 2 Н; д) имидазолилом или е) тетрагидрофуранилом; и циклопентила, необязательно замещенного гидроксильной группой; включающий конденсацию соединения формулы XII где A1, А 2, V, W, X, Y, Z, T, U и m имеют то же значение, как описано выше для формулы XI, сR7 выбирают из группы, состоящей из С 1-18 алкила, необязательно замещенного: а) фенилом, необязательно замещенным одним или двумя атомами фтора; б) циклопентилом, необязательно замещенным гидроксильной группой; в) оксопиперизинилом; г) гидроксильной группой и -CO2H; д) имидазолилом или е) тетрагидрофуранилом; и циклопентила, необязательно замещенного гидроксильной группой; иL представляет собой уходящую группу,с образованием соединения формулы XI. Настоящее изобретение также обеспечивает способ получения соединения формулы XIX где m равно 1 или 2, а Р 1 представляет собой защитную группу для амина, включающий: а) конденсацию соединения формулы XX где Р 1 и Р 2 представляют собой защитные группы для амина, и Р 1 не равно Р 2, с получением соединения формулы XXII б) превращение алкена формулы XXII в альдегид, с получением соединения формулы XXIII; в) удаление Р 2 из соединения формулы XXIII, с получением соединения формулы XXIV; и г) восстановление C=N двойной связи в соединении формулы XXIV, с получением соединения формулы XIX. Краткое описание графических материалов На фиг. 1 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) в модели ксенотрансплантата рака молочной железы. На фиг. 2 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) и таксотера в модели ксенотрансплантата рака простаты. На фиг. 3 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) и Тайкерб в модели ксенотрансплантата рака простаты. На фиг. 4 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) и таксотера в модели ксенотрансплантата рака молочной железы. На фиг. 5 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) и Тайкерб в модели ксенотрансплантата рака молочной железы. На фиг. 6 представлена диаграмма, иллюстрирующая противоопухолевую активность соединенияSM-406 (АТ-406) и гемцитабина в модели ксенотрансплантата рака поджелудочной железы. На фиг. 7 представлена диаграмма, иллюстрирующая исследования по оптимизации схемы применения соединения SM-406 (АТ-406) в модели ксенотрансплантата рака молочной железы. На фиг. 8 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемSM-406 в линии клеток рака молочной железы MDA-MB-231, в клеточных линиях рака яичника SK-OV3 и OVCAR-4 и в линии клеток меланомы SK-MeI-2. На фиг. 9 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемSM-406 в клеточных линиях лейкемии HL-60 и SR. На фиг. 10 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемSM-406 в клеточных линиях рака молочной железы человека ВТ-549, MDA-MB-415, SUM-159, MDAMB-468, MDA-MB-453 и 2LMP. На фиг. 11 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемTNF в сочетании с соединением SM-406 в линии клеток рака молочной железы человека MDA-MB-436. На фиг. 12 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемTNF в сочетании с соединением SM-406 в линии клеток рака молочной железы человека SUM-159. На фиг. 13 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемTRAIL в сочетании с соединением SM-406 в линии клеток рака поджелудочной железы человека Panc-1. На фиг. 14 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемTRAIL в сочетании с соединением SM-406 в линии клеток рака молочной железы человека MDA-MB231(2LMP). На фиг. 15 представлена диаграмма, иллюстрирующая ингибирование роста клеток гемцитабином в сочетании с соединением SM-406 в линии клеток рака поджелудочной железы человека Panc-1. На фиг. 16 представлена диаграмма, иллюстрирующая ингибирование роста митоксантроном в сочетании с соединением SM-406 в линии клеток рака поджелудочной железы человека Panc-1. На фиг. 17 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемSM-406 в сочетании с росковитином (Ros) в линии клеток рака простаты человека РС 3. На фиг. 18 представлена диаграмма, иллюстрирующая ингибирование роста клеток таксотером(ТХТ) в сочетании с соединением SM-406 в линии клеток рака молочной железы человека MDA-MB-453. На фиг. 19 представлена диаграмма, иллюстрирующая ингибирование роста клеток соединениемVP-16 в сочетании с соединением SM-406 в линии клеток рака поджелудочной железы человека Panc-1. На фиг. 20 представлена диаграмма, иллюстрирующая эффект Smac миметиков на белок cIAP-1 в раковых клетках MDA-MB-231. На фиг. 21 представлена диаграмма, иллюстрирующая эффект Smac миметиков на белки cIAP-1/2 в раковых клетках SK-OV-3. На фиг. 22 представлена диаграмма, иллюстрирующая индукцию апоптоза соединением SM-406 в клетках рака молочной железы MDA-MB-231. На фиг. 23 представлена диаграмма, иллюстрирующая индукцию апоптоза соединением SM-406 в-8 017797 клетках рака яичников SK-OV-3. На фиг. 24 представлена диаграмма, иллюстрирующая индукцию апоптоза соединением SM-406 в клетках рака поджелудочной железы Panc-1. На фиг. 25 представлена диаграмма, иллюстрирующая ингибирование роста опухоли соединениемSM-406 в модели ксенотрансплантата рака молочной железы человека MDA-MB-231 в мышах, пораженных тяжлым комбинированным иммунодефицитом (SCID). На фиг. 26 представлена диаграмма, иллюстрирующая ингибирование роста опухоли соединениемSM-406 в модели ксенотрансплантата рака простаты человека РС-3 в "голой" мыши. На фиг. 27 представлена диаграмма, иллюстрирующая ингибирование роста опухоли соединениемSM-406 в модели ксенотрансплантата рака молочной железы человека 2LMP в "голой" мыши. На фиг. 28 представлена серия диаграмм, иллюстрирующих кривые конкурирующего связывания соединений SM-406 и SM-428 с доменами BIR3 в четырех представителях белков IAP A) XIAP; (Б)cIAP1; (В) cIAP2; (Г) ML-IAP), что определено с использованием анализа связывания на основе флуоресцентной поляризации. Подробное описание изобретения Настоящее изобретение относится к конформационно ограниченным соединениям, представленными формулами 1-Х, которые являются Smac миметиками и функционируют как ингибиторы IAP. Эти соединения увеличивают чувствительность клеток к индукторам апоптоза и, в некоторых случаях, непосредственно вызывают апоптоз, ингибируя IAP. Следовательно, изобретение относится к способам увеличения чувствительности клеток к индукторам апоптоза и к способам индуцирования апоптоза в клетках, включая контакт клеток только с соединениями формул 1-Х или в сочетании с индуктором апоптоза. Кроме того, данное изобретение относится к способам лечения, улучшения состояния или предотвращения расстройств у животного, которые являются восприимчивыми к индукции апоптоза, включая назначение животному соединения формул 1-Х и индуктора апоптоза. Такие расстройства включают расстройства, характеризующиеся дисрегуляцией апоптоза, и расстройства, характеризующиеся сверхэкспрессией IAP. Кроме того, данное изобретение относится к способам предотвращения или ингибирования ангиогенеза у животного, нуждающегося в этом, включающим введение животному соединения формул 1-Х. Термин "белки IAP", применяемый здесь, относится к любому известному представителю семейства IAP (ингибитор белков апоптоза), включающего, но не ограниченного ими, XIAP, cIAP-1, cIAP-2, MLIAP, HIAP, TSIAP, KIAP, NAIP, сурвивин, ливин, ILP-2, аполлон и BRUCE. Термин "сверхэкспрессия IAP", применяемый здесь, относится к повышенному уровню (например,аберрантному уровню) иРНК, кодирующих белок(белки) IAP, и/или к повышенным уровням белка(белков) IAP в клетках по сравнению с подобными соответствующими непатологическими клетками,экспрессирующими основные уровни иРНК, кодирующих белки IAP или имеющих основные уровни белков IAP. Способы определения уровней иРНК, кодирующих белки IAP, или уровней белков IAP в клетке включают, но не ограничиваются ими, Вестерн-блоттинг с использованием антител белков IAP,иммуногистохимические методы, а также методы амплификации нуклеиновой кислоты или прямого обнаружения РНК. Столь же важным, как и определение абсолютного уровня белков IAP в клетках должно быть определение того, что они сверхэкспрессируют белки IAP, а также уровень белков IAP по отношению к другим проапоптотическим сигнальным молекулам (например, проапоптотическим белкам семейства Bcl-2) в таких клетках. Когда баланс этих двух параметров таков, что, если бы это не относилось к уровням белков IAP, проапоптотических, сигнальных молекул было бы достаточно, чтобы заставить клетки выполнить программу апоптоза и погибнуть, то указанные клетки будут зависеть от белков IAP для своего выживания. В таких клетках воздействие ингибирующих эффективных количеств ингибитора белка IAP будет достаточно, чтобы заставить клетки выполнить программу апоптоза и погибнуть. Таким образом, термин "сверхэкспрессия белка IAP" также относится к клеткам, которые из-за относительных уровней проапоптотических сигналов и антиапоптотических сигналов подвергаются апоптозу в ответ на ингибирующие эффективные количества соединений, которые ингибируют функцию белков IAP. Термины "противораковый агент" и "противораковый препарат", используемые здесь, относятся к любым терапевтическим агентам (например, химиотерапевтическим соединениям и/или молекулярным терапевтическим соединениям), радиационным методам лечения или хирургическим вмешательствам,используемым при лечении гиперпролиферативных болезней, таких как рак (например, у млекопитающих). Термин "пролекарство", применяемый здесь, относится к фармакологически неактивному производному молекулы исходного "лекарства", которое требует биотрансформации (например, самопроизвольной или ферментативной) в целевой физиологической системе для высвобождения или преобразования (например, ферментативного, физиологического, механического, электромагнитного) пролекарства в активный лекарственный препарат. Пролекарства разрабатывают для решения проблем, связанных со стабильностью, токсичностью, неспецифичностью или ограниченным бионакоплением. Типичные пролекарства включают непосредственно молекулу активного препарата и химическую маскирующую группу (например, группу, которая обратимо подавляет активность препарата). Некоторые предпочтительные-9 017797 пролекарства представляют собой вариации или производные соединений, имеющих группы, которые легко отщепляются в метаболических условиях. Типичные пролекарства становятся фармацевтически активными in vivo или in vitro, где они подвергаются сольволизу в физиологических условиях или подвергаются ферментативному расщеплению или другому биохимическому преобразованию (например,фосфорилированию, гидрированию, дегидрированию, гликозилированию). Пролекарства часто предоставляют преимущества, заключающиеся в растворимости, тканевой совместимости или отсроченном высвобождении в организме млекопитающих. (См., например, публикацию Bundgard, Design of Prodrugs,pp. 7-9, 21-24, Elsevier, Amsterdam (1985); а также публикацию Silverman, The Organic Chemistry of DrugDesign and Drug Action, pp. 352-401, Academic Press, San Diego, CA (1992. Обычные пролекарства включают производные кислот, например, сложные эфиры, получаемые взаимодействием исходных кислот с подходящим спиртом (например, низшим алканолом), амиды, получаемые взаимодействием исходной кислоты с амином или основными группами, которые реагируют с образованием ацилированного производного основания (например, низшего алкиламида). Термин "фармацевтически приемлемая соль", применяемый здесь, относится к любой соли (например, получаемой взаимодействием с кислотой или основанием) соединения по настоящему изобретению,которое физиологически допустимо в целевом животном (например, млекопитающем). Соли соединений по настоящему изобретению можно получать из неорганических или органических кислот и оснований. Примеры кислот включают, но не ограничиваются ими, хлористоводородную, бромистоводородную,серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую,янтарную, п-толуолсульфо-, винную, уксусную, лимонную, метансульфо-, этансульфо-, муравьиную,бензойную, малоновую, сульфоновую, нафталин-2-сульфо-, бензолсульфо- и т.п. кислоту. Другие кислоты, например щавелевая кислота, хотя сами и не являются фармацевтически приемлемыми, могут применяться для получения солей, полезных в качестве полупродуктов при получении соединений по изобретению и их фармацевтически приемлемых солей присоединения кислоты. Примеры оснований включают, но не ограничиваются ими, гидроксиды щелочного металла (например, натрия), гидроксиды щелочно-земельного металла (например, магния), аммиак и соединения формулы NW4+, где W представляет собой C1-4 алкильную группу и т.п. Примеры солей включают, но не ограничиваются ими: ацетат, адипинат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат,диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат,гептаноат, гексаноат, хлорид, бромид, йодид, 2-гидроксиэтансульфонат, лактат, малеат, мезилат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат,пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и т.п. Другие примеры солей включают анионы соединений по настоящему изобретению, в сочетании с подходящим катионом,например, Na+, NH4+ и NW4+ (где W представляет собой С 1-4 алкильную группу) и т.п. Соли соединений по настоящему изобретению рассматриваются как фармацевтически приемлемые для терапевтического применения. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми,могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Термин "терапевтически эффективное количество", применяемый здесь, относится к такому количеству терапевтического агента, которого достаточно для того, чтобы привести к улучшению одного или более чем одного симптома расстройства или предотвратить прогрессирование расстройства или вызвать ослабление симптомов расстройства. Например, относительно лечения рака, терапевтически эффективное количество предпочтительно относится к количеству терапевтического агента, которое уменьшает скорость роста опухоли, уменьшает массу опухоли, сокращает количество метастазов, увеличивает время до прогрессирования опухоли или увеличивает продолжительность выживания по меньшей мере на 5%,предпочтительно по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95% или по меньшей мере на 100%. Термины "сенсибилизировать" и "сенсибилизирующий", используемые здесь, относятся к тому, как путем назначения первого агента (например, соединения формулы II), сделать животное или клетку животного более восприимчивыми или более чувствительными к биологическим эффектам (например,промотированию или замедлению аспекта клеточной функции, включая, но не ограничиваясь ими, деление клетки, рост клетки, пролиферацию, инвазию, ангиогенез или апоптоз) второго агента. Сенсибилизирующий эффект первого агента на целевую клетку может быть измерен как различие в предполагаемом биологическом эффекте (например, промотирование или замедление аспекта клеточной функции, включая, но не ограничиваясь ими, рост клетки, пролиферацию, инвазию, ангиогенез или апоптоз), наблюдаемом при назначении второго агента с назначением и без назначения первого агента. Ответ сенсибилизированной клетки можно увеличить по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей- 10017797 мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 100%, по меньшей мере на 150%, по меньшей мере на 200%, по меньшей мере на 250%, по меньшей мере на 300%, по меньшей мере на 350%, по меньшей мере на 400%, по меньшей мере на 450% или по меньшей мере на 500% относительно ответа в отсутствии первого агента. Термин "дисрегуляция апоптоза", применяемый здесь, относится к любому отклонению в способности (например, предрасположенности) клетки подвергаться гибели через апоптоз. Дисрегуляция апоптоза связана или вызвана множеством условий, включающих, например, аутоиммунные расстройства(например, системную красную волчанку, ревматоидный артрит, реакцию "трансплантат против хозяина", злокачественную миастению или синдром Шгрена), хронические воспалительные состояния (например, псориаз, астму или болезнь Крона), гиперпролиферативные расстройства (например, опухоли,лимфомы В клетки или лимфомы Т клетки), вирусные инфекции (например, герпес, папиллому или ВИЧ), и другие состояния, такие как остеоартрит и атеросклероз. Следует отметить, что, когда дисрегуляция индуцирована или связана с вирусной инфекцией, вирусная инфекция может обнаруживаться или не обнаруживаться в то время, когда имеет место или наблюдается дисрегуляция. Таким образом, индуцированная вирусами дисрегуляция может иметь место даже после исчезновения признаков вирусной инфекции. Термин "ангиогенез", применяемый здесь, означает образование новых кровеносных сосудов в ткани или органе. Термин "антиангиогенез", применяемый здесь, относится к предотвращению или уменьшению роста новых кровеносных сосудов. Примеры болезней или расстройств, связанных с ангиогенезом, которые можно лечить с помощью соединений по изобретению, включают дегенерацию жлтого пятна, ревматоидный артрит, псориаз, диабетическую ретинопатию, ретинопатию недоношенных, отторжение роговичного имплантата, неоваскулярную глаукому, ретролентальную фиброплазию, покраснение радужки, синдром Ослера-Веббера, миокардиальный ангиогенез, неоваскуляризацию бляшки, телангиэктазию, кровоизлияния в суставы при гемофилии, ангиофиброму, грануляцию раны, кишечные спайки, атеросклероз, склеродерму и гипертрофические рубцы. Термин "гиперпролиферативная болезнь", применяемый здесь, относится к любому состоянию, при котором локализованная популяция пролиферирующих клеток в животном не управляется обычными ограничениями нормального роста. Примеры гиперпролиферативных расстройств включают, но не ограничиваются ими, виды рака (опухоли, новообразования, лимфомы и т.п.) и аутоиммунные расстройства. Говорят, что новообразование является доброкачественным, если оно не подвергается инвазии или метастазам, и злокачественным, если оно подвергается любому из них. Термин "метастатическая клетка" означает, что клетка может распространяться и разрушать соседние структуры тела. Гиперплазия представляет собой форму пролиферации клетки, включающую увеличение числа клеток в ткани или органе без существенного изменения в структуре или функции. Метаплазия представляет собой форму контролируемого роста клетки, при котором один тип полностью дифференцированной клетки заменяется другим типом дифференцированной клетки. В другом примере осуществления изобретения гиперпролиферативная болезнь представляет собой ревматоидный артрит, воспалительное кишечное заболевание, остеоартрит, лейомиомы, аденомы, липомы, гемангиомы, фибромы, окклюзию сосуда, рестеноз, атеросклероз, повреждения, предшествующие новообразованию (например, аденоматозная гиперплазия и простатическая интраэпителиальная неоплазия), карцинома in situ, волосистая лейкоплакия языка или псориаз. Патологический рост активированных лимфоидных клеток часто приводит к аутоиммунному расстройству или хроническому воспалительному состоянию. Применяемый здесь термин "аутоиммунное расстройство" относится к любому состоянию, при котором организм продуцирует антитела или иммунные клетки, которые распознают молекулы, клетки или ткани собственного организма. Неограничивающие примеры аутоиммунных расстройств включают аутоиммунную гемолитическую анемию, аутоиммунный гепатит, болезнь Бергера или IgA нефропатию, нетропическую энтеропатию, хронический синдром усталости, болезнь Крона, дерматомиозит, фибромиалгию, реакцию "трансплантат против хозяина", болезнь Грейва, тиреоидит Хашимото, идиопатическую тромбоцитопеническую пурпуру, красный плоский лишай, рассеянный склероз, злокачественную миастению, псориаз, ревматизм, ревматоидный артрит, склеродерму, синдром Шгрена, системную красную волчанку, диабет 1 типа, язвенный колит,витилиго и т.п. Термин "новообразование", применяемый здесь, относится к любому аномальному росту клеток,являющемуся доброкачественным (нераковым) или злокачественным (раковым). Термин "противоопухолевый агент", применяемый здесь, относится к любому соединению, которое замедляет пролиферацию, рост или распространение целевого (например, злокачественного) новообразования. Термины "предотвращать", "предотвращающий" и "предотвращение", применяемые здесь, относятся к уменьшению возникновения патологических клеток (например, гиперпролиферативных или опухолевых клеток) в животном. Предотвращение может быть полным, например полное отсутствие патологических клеток в субъекте. Предотвращение также может быть частичным, так что возникновение патологических клеток в субъекте является меньшим, чем возникновение, которое произошло бы без настоя- 11017797 щего изобретения. Термин "апоптоз-модулирующие вещества", применяемый здесь, относится к веществам, которые участвуют в модуляции (например, ингибировании, уменьшении, увеличении, промотировании) апоптоза. В одном примере осуществления изобретения апоптоз-модулирующий агент представляет собой индуктор апоптоза. Термин "индуктор апоптоза", применяемый здесь, относится к агенту, который индуцирует апоптоз в клетках (например, раковых клетках), делая такие клетки более восприимчивыми к выполнению программы апоптоза. В одном примере осуществления изобретения агент, который вызывает апоптоз, представляет собой противораковый агент. Примеры апоптоз-модулирующих веществ включают белки, которые включают домен смерти, такие как, не ограничиваясь ими, Fas/CD95, TRAMP, TNFR1, DR1, DR2, DR3, DR4, DR5, DR6, FADD и RIP. Другие примеры апоптоз-модулирующих веществ включают, но не ограничиваются ими, TNF, лиганд Fas, антитела к Fas/CD95 и другим рецепторам семейства TNF, TRAIL (также известный как лиганд Аро 2 или Apo2L/TRAIL), агонисты (например, моноклональные или поликлональные агонистические антитела) TRAIL-R1 или TRAIL-R2, Bcl-2, p53, BAX,BAD, Akt, CAD, PI3 киназу, РР 1 и белки каспазы. Модулирующие вещества широко включают агонисты и антагонисты рецепторов семейства TNF и лиганды семейства TNF. Апоптоз-модулирующие вещества могут быть растворимыми или связаны с мембраной (например, лиганд или рецептор). Предпочтительные апоптоз-модулирующие вещества являются индукторами апоптоза, например, TNF или TNFсвязанный лиганд, в частности лиганд TRAMP, лиганд Fas/CD95, лиганд TNFR-1 или TRAIL. Ингибиторы IAP по настоящему изобретению представляют собой Smac миметики общей формулы где А 1 и А 2 независимо выбирают из группы, состоящей из водорода и C1-18 алкила, необязательно замещенного гидроксильной группой;J представляет собой незамещенный С 1-4 алкиленил; Т выбирают из группы, состоящей из С=O и CR1R2;n и m независимо выбирают из 1, 2 или 3;r равно 0; каждую из групп R1, R2, R3 и R4 независимо выбирают из группы, состоящей из водорода; C1-18 алкила, необязательно замещенного: а) одним или двумя фенилами, необязательно замещенными фтором, трифторметилом или фенилом; б) нафтилом или в) пиридилом, циклогексилом, инданилом, тетранилом и COR7;R7 выбирают из группы, состоящей из С 1-18 алкила, необязательно замещенного: а) фенилом, необязательно замещенным одним или двумя атомами фтора; б) циклопентилом, необязательно замещенным гидроксильной группой; в) оксопиперизинилом; г) гидроксильной группой и -CO2H; д) имидазолилом или е) тетрагидрофуранилом; и циклопентила, необязательно замещенного гидроксильной группой; или его фармацевтически приемлемая соль. В одном примере осуществления изобретения необязательные заместители не включают карбоновую кислоту, циклоалкил, необязательно замещенный одним или более алкилом, галогеном, гидроксильной или галогеналкильной группами, или арил, необязательно замещенный арильной группой, и необязательно замещенная гетероциклическая группа не включает оксопиперизинил. В другом примере осуществления изобретения n и m независимо выбирают из 1-3 таким образом,чтобы n+m равнялось 3 или 4. В другом конкретном примере осуществления изобретения Smac миметики представляют собой со- 12017797 единения формулы VI где A1, A2, R5, Т и U имеют значение как описано выше для формулы I; или их фармацевтически приемлемую соль. В одном примере осуществления изобретения Т представляет собой С=O, U представляет собойNR1R2 и R5 представляет собой COR7. В другом примере осуществления изобретения A1 представляет собой необязательно замещенный гидроксильной группой C1-18 алкил, а А 2 представляет собой водород. В другом примере осуществления изобретения R1 представляет собой -CHPh2. В другом примере осуществления изобретения R7 представляет собой С 1-18 алкил, необязательно замещенный: а) фенилом, необязательно замещенным одним или двумя атомами фтора; б) циклопентилом, необязательно замещенным гидроксильной группой; в) оксопиперизинилом; г) гидроксильной группой и -CO2H; д) имидазолилом или е) тетрагидрофуранилом. В другом примере осуществления изобретения R7 представляет собой-СН 2 СН(СН 3)2. Применимые алкильные группы включают С 1-18 алкильные группы с прямой или разветвленной цепью, в частности метильную, этильную, пропильную, изопропильную, трет-бутильную, втор-бутильную,3-пентильную и 3-гексильную группы. В одном примере осуществления изобретения алкил представляет собой C1-6 алкильную группу. Термин "алкиленил" относится к двухвалентному алкильному радикалу, содержащему 1, 2, 3 или 4 соединенных друг с другом метиленовые группы, примером чего является -(СН 2)4-. Применимые алкенильные группы включают С 2-18 алкенильные группы с прямой или разветвленной цепью, в частности, этенил, пропенил, изопропенил, бутенил, изобутенил и гексенил. Применимые алкинильные группы представляют собой С 2-18 алкинильные группы, в частности этинильную, пропинильную, бутинильную и 2-бутинильную группы. Применимые циклоалкильные группы включают С 3-10 циклоалкильные группы. Типичные циклоалкильные группы включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил и норборнил. Применимые арильные группы включают С 6-14 арил, в частности фенильную (сокращенное обозначение Ph), нафтильную, фенантренильную, антраценильную, инденильную, азуленильную, бифенильную, бифениленильную и флуоренильную группы. Применимые гетероарильные группы включают С 2-14 гетероарильные группы, в частности тиенил,бензо[b]тиенил, нафто[2,3-b]тиенил, тиантренил, фурил, пиранил, изобензофуранил, хроменил, ксантенил, феноксантенил, 2 Н-пирролил, пирролил, имидазолил, триазолил, пиразолил, пиридил, пиразинил,пиримидинил, пиридазинил, индолизинил, изоиндолил, 3 Н-индолил, индолил, индазолил, пуринил, 4 Нхинолизинил, изохинолил, хинолил, фталзинил, нафтиридинил, хинозалинил, циннолинил, птеридинил,карбазолил, -карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил, изоксазолил, фуразанил, феноксазинил, 1,4-дигидрохиноксалин-2,3-дион, 7 аминоизокумарин, пиридо[1,2-а]пиримидин-4-он, 1,2-бензоизоксазол-3-ил, бензимидазолил, 2-оксиндолил и 2-оксобензимидазолил. Если гетероарильная группа содержит атом азота в кольце, такой атом азота может быть в форме N-оксида, например пиридил-N-оксида, пиразинил-N-оксида, пиримидинил-Nоксида и т.п. Необязательные заместители включают один или более алкил; галоген; гидроксил; карбоновую кислоту (например, -СО 2 Н и ее соли); галогеналкил; циклоалкил, необязательно замещенный одним или более алкилом, галогеном, гидроксильной или галогеналкильной группами; арил, необязательно замещенный одним или более низшим алкилом, галогеном, галогеналкилом, арильной или гетероарильной группами; арилокси, необязательно замещенный одним или более низшим алкилом, галогеналкильной или гетероарильной группами; аралкил; гетероарил, необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами; гетероарилокси, необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами; алкокси; алкилтио; арилтио; амидо; амино; ацилокси; арилацилокси, необязательно замещенный одним или более низшим алкилом,галогеналкильной и арильной группами; дифенилфосфинилокси, необязательно замещенный одним или более низшим алкилом, галогеном или галогеналкильной группами; гетероцикло, необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами; гетероциклоалкокси, необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами; частично ненасыщенный гетероциклоалкил, необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами; или частично ненасыщенный гетероциклоалкилокси,необязательно замещенный одним или более низшим алкилом, галогеналкильной и арильной группами. Применимые насыщенные или частично насыщенные карбоциклические группы представляют со- 13017797 бой циклоалкильные группы как определено выше, а также циклоалкенильные группы, например циклопентенил, циклогептенил и циклооктенил. Карбоциклические группы также включают группы, имеющие конденсированные, необязательно замещенные арильные группы, например, тетралин. Применимые галогенгруппы или группы галогена включают фтор, хлор, бром и йод. Применимые аралкильные и гетероаралкильные группы включают любую из вышеупомянутых C118 алкильных групп, замещенных одним или более из вышеупомянутых необязательно замещенных С 6-14 арильных групп или гетероарильных групп. В одном примере осуществления изобретения аралкил замещен двумя необязательно замещенными С 6-14 арильными группами. В другом примере осуществления изобретения аралкил замещен одной необязательно замещенной С 6-14 арильной группой. В одном примере осуществления изобретения необязательно замещенная С 6-14 арильная группа представляет собой необязательно замещенную фенильную группу. Применимые аралкильные группы включают бензил (сокращенное обозначение Bn), фенэтил и нафтилметил. Применимые галогеналкильные группы включают C1-10 алкильные группы, замещенные одним или более атомом фтора, хлора, брома или йода, например, фторметильную, дифторметильную, трифторметильную, пентафторэтильную, 1,1-дифторэтильную, хлорметильную, хлорфторметильную и трихлорметильную группы. Применимые алкокси группы включают кислород, замещенный одной из C1-18 алкильных групп,упомянутых выше. Применимые алкилтио группы включают серу, замещенную одной из C1-18 алкильных групп, упомянутых выше. Примеры таких алкилтио групп также включают сульфоксиды и сульфоны. Применимые амидогруппы включают карбониламидо, а также любой C1-6 ацил (алканоил), присоединенный к азоту аминогруппы, например, ацетамидо, пропионамидо, бутаноиламидо, пентаноиламидо,гексаноиламидо, а также арил-замещенные С 2-6 замещенные ацильные группы. Применимые ацилокси группы представляют собой любой С 1-6 ацил (алканоил), присоединенный к окси(-O-)группе, например формилокси, ацетокси, пропионоилокси, бутаноилокси, пентаноилокси, гексаноилокси и т.п. Применимые арилацилокси группы включают любую из вышеупомянутых арильных групп, замещенных любой из вышеупомянутых ацилокси групп, например 2,6-дихлорбензоилокси, 2,6-дифторбензоилокси и 2,6-ди-(трифторметил)бензоилокси группы. Применимые аминогруппы включают -NH2, -NHR11 и -NR11R12, где R11 и R12 представляют собой С 1-18 алкильные или циклоалкильные группы, как определено выше. Применимые насыщенные и частично насыщенные гетероциклические группы включают тетрагидрофуранильную, пиранильную, пиперидинильную, пиперизинильную, оксопиперизинильную, пирролидинильную, имидазолидинильную, имидазолинильную, индолинильную, изоиндолинильную, хинуклидинильную, морфолинильную, изохроманильную, хроманильную, пиразолидинильную, пиразолинильную, тетроноильную и тетрамоильную группы. Применимые ариленовые группы включают С 6-14 ариленовые, в частности фениленовую, нафтиленовую, фенантрениленовую, антрацениленовую, индениленовую, азулениленовую, бифениленовую, бифенилениленовую и флуорениленовую группы. Применимые гетероариленовые группы включают дизамещенные гетероарильные группы, такие как 2,5-тиенилен, 2,4-имидазоилен и 1,3-триазолилен. Термин "уходящая группа", применяемый здесь, относится к атому или группе, которая отделяется от атома или группы, рассматриваемой как остающаяся или главная часть субстрата в указанной реакции. В реакциях сочетания амидов примеры уходящих групп включают -F, -Cl, -Br, -ОН, -OC6F5,-O(СО)алкил и т.п. В одном примере осуществления изобретения уходящая группа представляет собой-Cl. В другом примере осуществления изобретения уходящая группа представляет собой активириованную форму -ОН (например, OBt, О-ацилизомочевина). При образовании амида для активации карбоновой кислоты (т.е., уходящая группа представляет собой -ОН) может применяться активирующий агент(например, дициклогексилкарбодиимид (DCC), 1-этил-3-(3-диметиламинопропил)карбодиимид (P-DC),бензотриазол-1-илокси)трипирролидинофосфониум гексафторфосфат (РуВор. Такие активирующие агенты хорошо известны специалистам в данной области органического синтеза. Для оптимизации параметров реакции (например, скорости, выхода, чистоты, рацемизации) также могут добавляться другие добавки, такие как N-гидроксибензотриазол (HOBt) или N-гидроксисукцинимид (HOSu). Термин "выделенный", применяемый здесь к продукту химической реакции, означает, что желательный продукт или продукты отделяют от нежелательных компонентов реакционной смеси (например,растворителей, исходных материалов, химических реагентов) перед последующим химическим превращением. Желательный продукт(ы) химической реакции можно отделить от нежелательных компонентов с помощью разнообразных методов, например, фильтрации через целит или силикагель, с последующим удалением летучих (например, растворителя) компонентов. Термин "защитные группы для амина", применяемый здесь, относится к группе, которая блокирует(т.е. защищает) аминную группировку при проведении реакции по другой функциональной группе или частям молекулы. Специалисты в данной области знакомы с подбором, присоединением и снятием за- 14017797 щитных групп для амина и понимают, что в технике существует множество различных защитных групп,причем применимость той или иной защитной группы зависит, в частности, от планируемой схемы синтеза. Для справки доступны монографии по данному предмету, такие как Greene and Wuts, "ProtectiveGroups in Organic Synthesis," 3rd Ed., pp. 17-245 (J. WileySons, 1999), описание которой включено здесь в виде ссылки. Подходящие защитные группы для амина включают карбобензилокси (Cbz), третбутилоксикарбонильную (ВОС), 9-флуоренилметилоксикарбонильную (FMOC) и бензильную (Bn) группы. Термин "примерно", применяемый здесь, включает упоминаемое значение 10%. Таким образом,"примерно 10" означает от 9 до 11. В данной спецификации выбирают такие группы и их необязательные заместители, чтобы обеспечить устойчивые фрагменты и соединения. Определенные соединения по настоящему изобретению могут существовать в виде стереоизомеров,включая оптические изомеры. Изобретение включает все стереоизомеры, как чистые индивидуальные препараты стереоизомеров, так и обогащенные препараты каждого стереоизомера и рацемические смеси таких стереоизомеров, а также индивидуальные энантиомеры, которые могут быть выделены согласно методам, которые хорошо известны специалистам в данной области. В определенных примерах осуществления изобретения соединение формулы I выбирают из группы,состоящей из или их фармацевтически приемлемой соли. В другом примере осуществления изобретения соединение формулы I представляет собой: или его фармацевтически приемлемую соль. Настоящее изобретение также относится к способу получения соединения формулы XI включающему конденсацию соединения формулы XII с соединением R7CO-L, где A1, А 2, V, W, X, Y, Z, T, U и R7 имеют значение, как описано выше для формулы I, m равно 1 или 2, и L представляет собой уходящую группу. В одном примере осуществления изобретения L представляет собой Cl или OBt. В одном примере осуществления изобретения Z представляет собой (CR1R2)r, и r равно 0. В другом примере осуществления изобретения m равно 1. В одном примере осуществления изобретения реакцию конденсации проводят в инертном органическом растворителе, таком как ацетонитрил, бензол, хлороформ, 1,2-дихлорэтан, 1,2-диметоксиэтан,диметилформамид, диметилсульфоксид, диоксан, дихлорметан, N-метил-2-пирролидинон или тетрагидрофуран. В другом примере осуществления изобретения реакцию конденсации проводят в тетрагидрофуране. В другом примере осуществления изобретения реакцию конденсации проводят в дихлорметане. В одном примере осуществления изобретения реакцию конденсации проводят при температуре примерно от -20 до примерно 25 С. В другом примере осуществления изобретения реакцию конденсации проводят примерно при 20 С. В одном примере осуществления изобретения реакция конденсации завершается в течение примерно от 1 ч до примерно 48 ч. В другом примере осуществления изобретения реакция конденсации завершается примерно за 12 ч. В одном примере осуществления изобретения L представляет собой -ОН. В другом примере осуществления изобретения реакцию конденсации проводят в присутствии активирующего агента. В другом примере осуществления изобретения активирующий агент представляет собой дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид или бензотриазол-1-илокси)трипирролидинофосфониум гексафторфосфат. В другом примере осуществления изобретения активирующий агент представляет собой 1-этил-3-(3-диметиламинопропил)карбодиимид. В другом примере осуществления изобретения реакцию конденсации проводят в присутствии активирующего агента и аддитива, что позволяет оптимизировать параметры реакции, такие как чистота и выход. В другом примере осуществления изобретения аддитив представляет собой N-гидроксибензотриазол. Протекание реакции конденсации между соединением формулы XII и соединением R7CO-L можно контролировать с помощью аналитических методов, хорошо известных в технике, например ТСХ, ЖХ,ЖХ/МС, ВЭЖХ, ЯМР и т.д. Соединение формулы XI можно выделить и очистить с помощью любых способов, известных в технике, таких как колоночная хроматография с нормальной и обращенной фазой(например, колоночная хроматография на силикагеле или ВЭЖХ с обращенной фазой), кристаллизация,экстракция и т.д. Выделенный таким образом продукт может быть подвергнут дальнейшей очистке (например, перекристаллизации), пока не будет достигнут требуемый уровень чистоты. В одном примере осуществления изобретения соединение формулы XI имеет чистоту 90, 91, 92, 93, 94, 95, 96, 97, 98, 99% или более. Настоящее изобретение относится к получению соединения формулы XIX где m равно 1 или 2, и Р 1 представляет собой защитную группу для амина, включающему а) конденсацию соединения формулы XX где Р 1 и Р 2 представляют собой защитные группы для амина, и Р 1 не равно Р 2, с получением соединения формулы XXII б) превращение алкена формулы XXII в альдегид, с получением соединения формулы XXIII; в) удаление защитной группы для амина Р 2 из соединения формулы XXIII, с получением соединения формулы XXIV; и г) восстановление C=N двойной связи в соединении формулы XXIV, с получением соединения формулы XIX. В одном примере осуществления изобретения соединение формулы XXI представляет собой N-(трет-бутоксилкарбонил)-N(бензоксилкарбонил)-L-диаминопропионовую кислоту (Boc-Dap(Z)-OH). В одном примере осуществления изобретения конденсацию соединения формулы XX с соединением формулы XXI проводят в присутствии активирующего агента. В другом примере осуществления изобретения активирующий агент представляет собой дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид или бензотриазол-1-илокси)трипирролидинофосфониум гексафторфосфат. В другом примере осуществления изобретения активирующий агент представляет собой 1-этил-3-(3-диметиламинопропил)карбодиимид. В другом примере осуществления изобретения реакцию конденсации проводят в присутствии активирующего агента и аддитива, что позволяет оптимизировать параметры реакции,такие как чистота и выход. В другом примере осуществления изобретения аддитив представляет собойN-гидроксибензотриазол. Защитные группы для амина Р 1 и Р 2, которые пригодны для применения в способах по настоящему изобретению, представляют собой хорошо известные группы, но не ограничиваются ими, например: трифторацетил, трет-бутоксикарбонил (Boc), бензилоксикарбонил (CBz), аллилоксикарбонил (Alloc),тритил (трифенилметил), 9-флуоренилметиленоксикарбонил (Fmoc) и т.п. Обычно такие группы можно селективно вводить и удалять с использованием мягких реакционных условий, что позволяет не затрагивать другие части рассматриваемых соединений. Эти защитные группы можно вводить или удалять на подходящей стадии с использованием методов, хорошо известных в технике. Химические свойства таких защитных групп, способы их введения и их удаления хорошо известны в технике и могут быть найдены,например, в публикации Greene and Wuts, "Protective Groups in Organic Synthesis," 3rd Ed., pp. 17-245 (J.WileySons, 1999), включенной здесь во всей полноте в виде ссылки. В одном примере осуществления изобретения Р 1 и Р 2 выбирают из группы, включающий трифторацетил, трет-бутоксикарбонил (Boc), бензилоксикарбонил (CBz), аллилоксикарбонил (Alloc), тритил(трифенилметил) и 9-флуоренилметиленоксикарбонил (Fmoc), так что Р 1 не равно Р 2. В одном примере осуществления изобретения Р 1 и Р 2 являются ортогональными защитными группами, т.е., защитную группу Р 1 можно селективно удалить в присутствии защитной группы Р 2, или защитную группу Р 2 можно селективно удалить в присутствии защитной группы Р 1. Стратегии ортогональных защитных групп хорошо известны в технике. В одном примере осуществления изобретения Р 1 представляет собой третбутоксикарбонил (Boc). В одном примере осуществления изобретения Р 2 представляет собой бензилок- 21017797 сикарбонил (CBz). В одном примере осуществления изобретения Р 1 представляет собой третбутоксикарбонил (Boc) и Р 2 представляет собой бензилоксикарбонил (CBz). В одном примере осуществления изобретения конденсацию соединения формулы XX с соединением формулы XXI проводят в инертном органическом растворителе, таком как ацетонитрил, бензол, хлороформ, 1,2-дихлорэтан, 1,2-диметоксиэтан, диметилформамид, диметилсульфоксид, диоксан, дихлорметан, N-метил-2-пирролидинон или тетрагидрофуран. В другом примере осуществления изобретения конденсацию соединения формулы XX с соединением формулы XXI проводят в тетрагидрофуране. В другом примере осуществления изобретения конденсацию соединения формулы XX с соединением формулы XXI проводят в дихлорметане. В одном примере осуществления изобретения конденсацию соединения формулы XX с соединением формулы XX) проводят при температуре примерно от -20 до примерно 30 С. В другом примере осуществления изобретения реакцию конденсации проводят при температуре примерно от 20 до примерно 30 С. В одном примере осуществления изобретения реакция конденсации завершается в течение примерно от 1 до примерно 48 ч. В другом примере осуществления изобретения реакция конденсации завершается примерно за 12 ч. В другом примере осуществления изобретения алкен формулы XXII обрабатывают озоном с получением альдегида формулы XXIII, и m равно 1. В одном примере осуществления изобретения реакцию с озоном проводят в инертном органическом растворителе, например хлороформе, 1,2-дихлорэтане, диоксане, дихлорметане или тетрагидрофуране. В другом примере осуществления изобретения реакцию с озоном проводят в дихлорметане. В одном примере осуществления изобретения реакцию с озоном проводят при температуре от примерно -100 до примерно 0 С. В другом примере осуществления изобретения реакцию с озоном проводят приблизительно при -78 С. В одном примере осуществления изобретения реакцию с озоном завершают, когда цвет реакционной массы становится голубым, указывая на избыток озона в растворе. В одном примере осуществления изобретения алкен формулы XXII сначала превращают в первичный спирт, а спирт окисляют с получением альдегида формулы XXIII, и m равно 2. В одном примере осуществления изобретения алкен формулы XXII превращают в первичный спирт путем гидроборирования. В одном примере осуществления изобретения гидроборирование проводят в инертном органическом растворителе, например ацетонитриле, бензоле, 1,2-диметоксиэтане, диоксане или тетрагидрофуране. В другом примере осуществления изобретения гидроборирование проводят в тетрагидрофуране. В другом примере осуществления изобретения гидроборирование проводят с использованием 9 борабицикло[3.3.1]нонана (9-BBN). В одном примере осуществления изобретения первичный спирт окисляют в альдегид с помощью периодинана по Дессу-Мартину с получением альдегида формулыXXIII, и m равно 2. В одном примере осуществления изобретения окисление проводят в инертном органическом растворителе, например, дихлорметане. В одном примере осуществления изобретения окисление проводят при температуре от примерно -20 до примерно 25 С. В другом примере осуществления изобретения окисление проводят примерно при 20 С. В одном примере осуществления изобретения окисление завершается в течение примерно от 1 до примерно 48 ч. В другом примере осуществления изобретения окисление завершается примерно через 12 ч. В одном примере осуществления изобретения Р 2 представляет собой Cbz группу. В другом примере осуществления изобретения Р 2 представляет собой Cbz группу и отщепляется путем гидрирования в присутствии палладия на угле. В одном примере осуществления изобретения гидрирование проводят в метаноле, этаноле, 1-бутаноле, 2-бутаноле, 3-бутаноле, трет-бутаноле, 1-пропаноле или 2-пропаноле. В другом примере осуществления изобретения гидрирование проводят в 2-пропаноле. В одном примере осуществления изобретения гидрирование проводят при температуре от примерно 0 до примерно 40 С. В другом примере осуществления изобретения гидрирование проводят при температуре от примерно 20 до примерно 30 С. В одном примере осуществления изобретения гидрирование завершается в течение от примерно 1 до примерно 24 ч. В другом примере осуществления изобретения гидрирование завершается примерно через 12 ч. В одном примере осуществления изобретения соединение формулы XXIV выделяют перед восстановлением C=N двойной связи. В одном примере осуществления изобретения соединение формулыXXIV выделяют путем фильтрации через целит. В одном примере осуществления изобретения соединение формулы XXIV выделяют путем фильтрации через целит с последующим испарением растворителя(ей). В одном примере осуществления изобретения C=N двойную связь в соединении формулы XXIV восстанавливают с помощью Н 2 и палладия на угле, Na(CN)BH3 или NaBH(OAc)3. В другом примере осуществления изобретения восстановитель представляет собой NaBH(OAc)3. В одном примере осуществления изобретения восстановление проводят в инертном органическом растворителе, например метаноле, этаноле, 1-бутаноле, 2-бутаноле, 3-бутаноле, трет-бутаноле, 1-пропаноле, 2-пропаноле, ацетонитриле, бензоле, хлороформе, 1,2-дихлорэтане, 1,2-диметоксиэтане, диметилформамиде, диметилсульфоксиде, диоксане, дихлорметане, N-метил-2-пирролидиноне или тетрагидрофуране. В другом примере осуществления изобретения восстановление проводят в тетрагидрофуране. В одном примере осуществления- 22017797 изобретения восстановление проводят при температуре примерно от 0 до примерно 25C. В одном примере осуществления изобретения восстановление проводят при температуре примерно от 20 до примерно 30 С. В одном примере осуществления изобретения восстановление завершается в течение примерно от 1 до примерно 24 ч. В другом примере осуществления изобретения реакция с озоном завершается примерно через 12 ч. Протекание любой из вышеупомянутых реакций для получения соединения формулы XIX можно контролировать с помощью любых аналитических методов, хорошо известных в технике, например ТСХ,ЖХ, ЖХ/МС, ВЭЖХ, ЯМР и т.д. Соединение формулы XIX можно выделить и очистить с помощью любых способов, известных в технике, таких как колоночная хроматография с нормальной и обращенной фазой (например, колоночная хроматография на силикагеле или ВЭЖХ с обращенной фазой), кристаллизация, экстракция и т.д. Выделенный таким образом продукт может быть подвергнут дальнейшей очистке (например, перекристаллизации), пока не будет достигнут требуемый уровень чистоты. В одном примере осуществления изобретения соединение формулы XIX имеет чистоту 90, 91, 92, 93, 94, 95, 96, 97,98, 99% или более. Соединения по этому изобретению можно получить с использованием методов, хорошо известных специалистам в данной области. Конкретно, соединения формул I-XXIII можно получить как показано на примере реакций, приведенных в примерах. Важным аспектом настоящего изобретения является то, что соединения формул I-Х индуцируют апоптоз, а также усиливают индукцию апоптоза в ответ на сигналы индукции апоптоза. Поэтому предполагают, что эти соединения сенсибилизируют клетки к индукторам апоптоза, включая клетки, которые являются резистентными к таким индукторам. Ингибиторы IAP по настоящему изобретению могут применяться для того, чтобы индуцировать апоптоз при любом расстройстве, которое можно подвергать лечению, улучшать условия жизни при нем или предотвращать путем индукции апоптоза. Таким образом, настоящее изобретение обеспечивает композиции и способы таргетирования животных, характеризующихся сверхэкспрессией белка IAP. В некоторых примерах осуществления изобретения, клетки (например, раковые клетки) проявляют повышенные уровни экспрессии белков IAP по сравнению с непатологическими образцами (например, незлокачественными клетками). В других примерах осуществления изобретения клетки оперативно проявляют повышенные уровни экспрессии белков IAP посредством выполнения программы апоптоза и гибели в ответ на ингибирующее эффективное количество соединения формул I-Х, причем указанный ответ проявляется, по меньшей мере частично, вследствие зависимости в таких клетках от функции белка IAP, необходимой для их выживания. В другом примере осуществления изобретение относится к модуляции апоптозсвязанного состояния, которое связано с одним или более чем одним апоптоз-модулирующим агентом. Примеры апоптозмодулирующих агентов включают, но не ограничиваются ими, Fas/CD95, TRAMP, TNF R1, DR1, DR2,DR3, DR4, DR5, DR6, FADD, RIP, TNF, лиганд Fas, TRAIL, антитела к TRAIL-R1 или TRAIL-R2, Bcl-2,p53, BAX, BAD, Akt, CAD, PI3 киназу, РР 1 и протеины каспазы. Также участвуют другие агенты, которые вовлечены в фазу инициации, выбора решения и деградации апоптоза. Примеры апоптозмодулирующих агентов включают вещества, активность, присутствие или изменение концентрации которых может смодулировать апоптоз в субъекте. Предпочтительные апоптоз-модулирующие агенты представляют собой индукторы апоптоза, например, TNF или TNF-связанный лиганд, в частности, лиганд TRAMP, лиганд Fas/CD95, лиганд TNFR-1 или TRAIL. В некоторых примерах осуществления изобретения применяются композиции и способы по настоящему изобретению для лечения больных клеток, тканей, органов или патологических состояний и/или болезненных состояний в животном (например, млекопитающем, включая, но не ограничиваясь ими, людей и домашних животных). В этой связи, различные заболевания и патологии поддаются лечению или профилактике с использованием настоящих способов и композиций. Неограничивающий примерный список этих заболеваний и состояний включает, но не ограничивается ими, рак молочной железы, рак простаты, лимфому, рак кожи, рак поджелудочной железы, рак толстой кишки, меланому, злокачественную меланому, рак яичников, рак мозга, первичную карциному мозга, рак головы и шеи, глиому,глиобластому, рак печени, рак мочевого пузыря, немелкоклеточный рак легкого, карциному головы или шеи, карциному молочной железы, карциному яичников, карциному легкого, мелкоклеточную карциному легкого, опухоль Вильмса, карциному шейки матки, карциному яичек, карциному мочевого пузыря,карциному поджелудочной железы, карциному желудка, карциному толстой кишки, карциному простаты, карциному мочеполовой системы, карциному щитовидной железы, карциному пищевода, миелому,множественную миелому, карциному надпочечников, почечно-клеточную карциному, эндометриальную карциному, карциному коры надпочечников, злокачественную инсулиному поджелудочной железы, злокачественную карциноидную карциному, хориокарциному, фунгоидный микоз, злокачественную гиперкальцемию, гиперплазию шейки матки, лейкемию, острую лимфоцитарную лейкемию, хроническую лимфоцитарную лейкемию, острую миелогенную лейкемию, хроническую миелогенную лейкемию, хроническую гранулоцитарную лейкемию, острую гранулоцитарную лейкемию, волосатоклеточный лейкоз,нейробластому, рабдомиосаркому, саркому Капоши, истинную полицитемию, существенный тромбоцитоз, болезнь Ходжкина, не-ходжкинскую лимфому, саркому мягких тканей, остеогенную саркому, пер- 23017797 вичную макроглобулинемию, ретинобластому и т.п., аутоиммунные заболевания, опосредованные Т и Вклетками; воспалительные заболевания; инфекции (например, в качестве противоязвенных средств, например, в контексте инфекции Н. pylori); гиперпролиферативные болезни; СПИД; дегенеративные состояния, заболевания кровеносных сосудов (например, первичный варикоз) и т.п. Соединения по настоящему изобретению также могут быть полезны при лечении заболеваний, в которых присутствует дефект в программируемой смерти клетки или апоптотическом механизме, таких как рассеянный склероз, астма, атеросклероз и т.п. В некоторых примерах осуществления изобретения, раковые клетки, подвергаемые лечению, являются метастатическими. В других примерах осуществления изобретения, раковые клетки, подвергаемые лечению, являются стойкими к противораковым агентам. В некоторых примерах осуществления изобретения, инфекции, подходящие для лечения с помощью композиций и способов по настоящему изобретению, включают, но не ограничиваются ими, инфекции, вызванные вирусами, бактериями, грибами, микоплазмой, прионами и т.п. Некоторые примеры осуществления настоящего изобретения обеспечивают способы введения эффективного количества соединения формул I-Х и по меньшей мере одного дополнительного терапевтического средства (включая, но не ограничиваясь ими, химиотерапевтические противоопухолевые средства, апоптоз-модулирующие агенты, антибактериальные препараты, противовирусные средства, противогрибковые средства и противовоспалительные агенты) и/или терапевтическую технику (например, хирургическое вмешательство, и/или радиотерапию). Для применения в способах по настоящему изобретению предлагается ряд подходящих противораковых агентов. Действительно, в настоящем изобретении предполагается, но не ограничивается ими,введение многочисленных противораковых агентов, таких как агенты, которые индуцируют апоптоз; полинуклеотиды (например, антисмысловые, рибозимы, малая интерферирующая РНК); полипептиды(например, ферменты и антитела); биологические миметики (например, госсипол или ВН 3 миметики); агенты, которые связываются (например, образуют олигомеры или комплекс) с белком семейства Bcl-2,например, Вах; алкалоиды; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные или поликлональные антитела (например, антитела,конъюгированные с противораковыми препаратами, токсинами, дефензинами), токсины; радионуклиды; биологические модификаторы ответа (например, интерфероны (например, IFN-) и интерлейкины (например, IL-2; агенты для адоптивной иммунотерапии; гематопоэтические факторы роста; агенты, которые вызывают дифференциацию клетки опухоли (например, полностью транс-ретиноевая кислота); реагенты для генной терапии (например, реактивы и нуклеотиды для антисмысловой терапии); противоопухолевые вакцины; ингибиторы ангиогенеза; ингибиторы протеосом: модуляторы NF-KB; соединения анти-CDK; ингибиторы HDAC; и т.п. Другие многочисленные примеры химиотерапевтических соединений и противораковых терапий, пригодные для совместного назначения с описанными соединениями,хорошо известны специалистам в данной области. В определенных примерах осуществления изобретения противораковые агенты включают агенты,которые индуцируют или стимулируют апоптоз. Агенты, которые индуцируют апоптоз, включают, но не ограничиваются ими, облучение (например, рентгеновское излучение, гамма-лучи, ультрафиолет); факторы, связанные с фактором некроза опухоли (TNF) (например, белки рецептора семейства TNF, лиганды семейства TNF, TRAIL, антитела к TRAIL-R1 или TRAIL-R2); ингибиторы киназы (например, ингибитор киназы эпидермального рецептора фактора роста (EGFR), ингибитор киназы сосудистого рецептора фактора роста (VGFR), ингибитор киназы рецептора фибробластного фактора роста (FGFR), ингибитор киназы рецептора фактора роста, полученного из тромбоцитов (PDGFR), и ингибиторы киназы Bcr-Ab1(например, гливек; антисмысловые молекулы; антитела (например, герцептин, ритуксан, зевалин и авастин); антиэстрогены (например, ралоксифен и тамоксифен); анти-андрогены (например, флутамид, бикалутамид, финастерид, аминоглутетамид, кетоконазол, и кортикостероид); ингибиторы циклооксигеназы 2 (СОХ-2) (например, целекоксиб, мелоксикам, NS-398, а также нестероидные противовоспалительные лекарственные препараты (NSAID; противовоспалительные лекарственные препараты (например,бутазолидин, декадрон, дельтазон, дексаметазон, дексаметазон интензол, дексон, гексадрол, гидроксихлорохин, метикортен, орадексон, оразон, оксифенбутазон, педиапред, фенилбутазон, плаквенил, преднизолон, преднизон, прелон и тандеарил); и химиотерапевтические противораковые препараты (например, иринотекан (камптосар), СРТ-11, флударабин (флудара), дакарбазин (ДТИК), дексаметазон, митоксантрон, милотарг, VP-16, цисплатин, карбоплатин, оксалиплатина, 5-ФУ, доксорубицин, гемцитабин,бортезомиб, гефитиниб, бевацизумаб, таксотер или таксол); сигнальные молекулы клеток; керамиды и цитокины; стауроспорин и т.п. В других примерах осуществления изобретения композиции и способы по настоящему изобретению обеспечивают соединения формул I-Х и по меньшей мере один антигиперпролиферативный или противоопухолевый агент, выбранный из алкилирующих веществ, антиметаболитов и природных продуктов (например, трав и других соединений растительного и/или животного происхождения). Алкилирующие агенты, пригодные для применения в настоящих композициях и способах, включают, но не ограничиваются ими: 1) нитроген мустард (например, мехлорэтамин, циклофосфамид, ифосфамид, мелфалан (L-сарколизин); и хлорамбуцил); 2) этиленимины и метилмеламины (например, гекса- 24017797 метилмеламин и тиотепа); 3) алкилсульфонаты (например, бусульфан); 4) нитрозомочевины (например,кармустин (BCNU); ломустин (CCNU); семустин (метил-CCNU); и стрептозоцин (стрептозотоцин; и 5) триазены (например, дакарбазин (ДТИК; диметилтриазеноимидазолкарбоксамид). В некоторых примерах осуществления изобретения антиметаболиты, пригодные для применения в настоящих композициях и способах, включают, но не ограничиваются ими: 1) аналоги фолиевой кислоты (например, метотрексат (аметоптерин; 2) аналоги пиримидина (например, фторурацил (5 фторурацил; 5-ФУ), флоксуридин (фтордезоксиуридин; FudR), и цитарабин (цитозин арабинозид; и 3) аналоги пурина (например, меркаптопурин (6-меркаптопурин; 6-МП), тиогуанин (6-тиогуанин; ТГ), и пентостатин (2'-дезоксикоформицин. В других примерах осуществления изобретения химиотерапевтические агенты, пригодные для применения в композициях и способах по настоящему изобретению, включают, но не ограничиваются ими: 1) алкалоиды барвинка (например, винбластин (VLB), винкристин); 2) эпиподофиллотоксины (например,этопозид и тенипозид); 3) антибиотики (например, дактиномицин (актиномицин D), даунорубицин (дауномицин; рубидомицин), доксорубицин, блеомицин, пликамицин (митрамицин) и митомицин (митомицин С; 4) ферменты (например, L-аспарагиназа); 5) биологические модификаторы ответа (например,интерферон-альфа); 6) координационные комплексы платины (например, цисплатин (цис-ДДП) и карбоплатин); 7) антрацендионы (например, митоксантрон); 8) замещенные мочевины (например, гидроксимочевина); 9) производные метилгидразина (например, прокарбазин (N-метилгидразин; MIH; 10) адренокортикальные супрессивные средства (например, митотан (о,п'-ДДД) и аминоглутетимид); 11) адренокортикостероиды (например, преднизон); 12) прогестины (например, гидроксипрогестерон капроат, медроксипрогестерон ацетат и мегестрол ацетат); 13) эстрогены (например, диэтилстильбэстрол и этинил эстрадиол); 14) антиэстрогены (например, тамоксифен); 15) андрогены (например, тестостерон пропионат и флуоксиместерон); 16) антиандрогены (например, флутамид): и 17) аналоги гонадотропинрилизинг гормона (например, лейпролид). Любой онколитический агент, который обычно применяют при лечении рака, находит применение в композициях и способах по настоящему изобретению. Например, FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) утверждает формуляр онколитических агентов, одобренных для применения в Соединенных Штатах. Международные агентства, являющиеся партнерами FDA, утверждают подобные формуляры. В таблице 1 представлен список типичных противоопухолевых агентов, одобренных для применения в США. Специалисты в данной области согласятся с тем, что в "товарных этикетках", требуемых для всех одобренных в США химиотеравпевтических агентов, описаны утвержденные указания по применению, информация о дозировке, данные о токсичности и т.п. для указанных типичных агентов. Таблица 1- 28017797 Противораковые агенты дополнительно включают соединения, которые, как уже было определено,обладают противораковой активностью, но в настоящее время не одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США или другими партнерскими агентствами или же проходят испытания для нового применения. Примеры включают, но не ограничиваются ими, 3-АР, 12-O-тетрадеканоилфорбол-13-ацетат, 17AAG, 852 А, ABI-007, ABR-217620, ABT-751, ADIPEG 20, АЕ-941, AG-013736, AGRO100, аланозин, AMG 706, антитело G250, антинеопластоны, АР 23573,апазиквон, АРС 8015, атипримод, ATN-161, атрасентан, азацитидин, ВВ-10901, ВСХ-1777, бевацизумаб,BG00001, бикалутамид, BMS 247550, бортезомиб, бриостатин-1, бусерелин, кальцитриол, CCI-779, CDB2914, цефиксим, цетуксимаб, CG0070, циленгитид, клофарабин, комбретастатин А 4 фосфат, СР-675206,СР-724714, CpG 7909, куркумин, децитабин, DENSPM, доксеркальциферол, Е 7070, Е 7389, эктеинасцидин 743, эфапроксирал, эфломитин, ЕКВ-569, энзастаурин, эрлотиниб, эксисулинд, фенретинид, флавопиридол, флударабин, флутамид, фотемустин, FR901228, G17DT, галиксимаб, гефитиниб, генистеин,глюфосфамид, GTI-2040, гистрелин, HKI-272, гомогаррингтонин, HSPPC-96, гибридный белок hul4.18 интерлейкин-2, HuMax-CD4, илопрост, имихимод, инфликсимаб, интерлейкин-12, IPI-504, ирофульвен,иксабепилон, лапатиниб, лестауртиниб, лейпролид, иммунотоксин LMB-9, лонафарниб, лумиликсимаб,мафосфамид, МВ 07133, MDX-010, MLN2704, моноклональное антитело 3F8, моноклональное антителоJ591, мотексафин, MS-275, MVA-MUC1-IL2, нилутамид, нитрокамптотецин, нолатрексед дигидрохлорид, нолвадекс, NS-9,O,6-бензилгуанин, облимерсен натрий, ONYX-015, ореговомаб, OSI-774, панитумумаб, параплатин, PD-0325901, пеметрексед, PHY906, пиоглитазон, пирфенидон, пиксантрон, PS-341,PSC 833, PXD101, пиразолоакридин, R115777, RAD001, ранпирназа, аналог ребеккамицина, белок rhuангиостатин, rhuMab 2C4, розиглитазон, рубитекан, S-1, S-8184, сатраплатин, SB-15992, SGN-0010, SGN40, сорафениб, SR31747A, ST1571, SU011248, субероиланилид-гидроксамовая кислота, сурамин, талабостат, талампанел, тарихидар, темсиролимус, иммунотоксин TGFa-PE38, талидомид, тимальфазин, типифарниб, тирапазамин, TLK286, трабектедин, триметрексат глюкуронат, TroVax, UCN-1, вальпроевая кислота, винфлунин, VNP40101M, волоциксимаб, вориностат, VX-680, ZD1839, ZD6474, зилейтон и зосуквидар тригидрохлорид. В одном примере осуществления изобретения противораковый агент выбирают из группы, состоящей из таксотера, гемцитабина, лапатиниба (Тайкерб) и этопозида. Для более детального описания противораковых агентов и других терапевтических агентов специалисты в данной области адресуются к любым полезным руководствам, включающим, но не ограниченным ими, публикации Physician's Desk Reference а также Goodman and Gilman's "Pharmaceutical Basis ofTherapeutics" tenth edition, Eds. Hardman et al., 2002. Настоящее изобретение обеспечивает способы введения соединения формул 1-Х с радиационной терапией. Изобретение не ограничено типами, количествами или системами доставки и введения, применяемыми для доставки терапевтической дозы радиации животному. Например, животное может быть подвергнуто фотонной радиотерапии, радиационной терапии с помощью потока частиц, другим типам радиотерапии и их комбинациям. В некоторых примерах осуществления изобретения животное подвергают облучению с использованием линейного ускорителя. В других примерах осуществления изобретения, подвергают облучению с использованием гамма пучка. Источник облучения может быть внешним или внутренним по отношению к животному. Внешняя радиационная терапия наиболее распространена и включает направление пучка высокоэнергетического излучения на участок опухоли через кожу с использованием, например, линейного ускорителя. Поскольку пучок лучей ограничен участком опухоли, почти невозможно избежать воздействия на нормальную,здоровую ткань. Однако внешнее облучение обычно хорошо переносится животными. Внутренняя радиационная терапия включает введение источника излучения, например, бусинок, проводов, гранул, капсул, частиц и т.п., внутрь тела на участок или около участка опухоли, включая применение систем доставки, которые специфично таргетируют раковые клетки (например, с использованием частиц, которые соединяются с лигандами, которые связываются с раковой клеткой). Такие импланты можно удалять после лечения или оставлять в теле неактивными. Типы внутренней радиационной терапии включают, но не ограничиваются ими, брахитерапию, внутритканевое облучение, внутриполостное облучение, радиоиммунотерапию и т.п. Животное может необязательно получать радиосенсибилизирующее вещество (например, метронидазол, мизонидазол, БДУ (Budr) внутриартериально, йододезоксиуридин (ludR) внутривенно, нитроимидазол, 5-замещенные-4-нитроимидазолы, 2 Н-изоиндолдионы, (2-бромэтил)амино]метил]нитро-1 Нимидазол-1-этанол, производные нитроанилина, цитотоксины со сродством к ДНК, селективные по отношению к гипоксии, галогенированные ДНК лиганды, оксиды 1,2,4-бензотриазина, производные 2 нитроимидазола, фторсодержащие производные нитроазола, бензамид, никотинамид, акридининтеркалатор, производные 5-тиотетразола, 3-нитро-1,2,4-триазол, производные 4,5-динитроимидазола,гидроксилированные тексафрины, цисплатин, митомицин, тирипазамин, нитрозомочевина, меркаптопурин, метотрексат, фторурацил, блеомицин, винкристин, карбоплатин, эпирубицин, доксорубицин, циклофосфамид, виндезин, этопозид, паклитаксел, высокая температура (гипертермия), и т.п.), радиопротекторы (например, цистеамин, аминоалкилдигидрофосфотиоаты, амифостин (WR 2721), IL-1, IL-6 и т.п.).
МПК / Метки
МПК: C07D 487/00, A61K 31/55, A61P 35/00
Метки: содержащие, бициклические, содержащий, фармацевтические, способы, диазомиметики, указанные, smac, получения, композиции, применения, набор
Код ссылки
<a href="https://eas.patents.su/30-17797-biciklicheskie-diazomimetiki-smac-sposoby-ih-polucheniya-ih-primeneniya-soderzhashhie-ih-farmacevticheskie-kompozicii-i-nabor-soderzhashhijj-ukazannye-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклические диазомиметики smac, способы их получения, их применения, содержащие их фармацевтические композиции и набор, содержащий указанные композиции</a>
Предыдущий патент: Бумажный стакан и способ его изготовления
Следующий патент: Водонепроницаемая паропроницаемая обувь
Случайный патент: Ингибиторы вирусной полимеразы