Соединения 5,6-дигидро-1н-пиридин-2-она
Номер патента: 17685
Опубликовано: 28.02.2013
Авторы: Мерфи Дуглас Эрик, Рюбзам Франк, Фиртельхаус Мартин, Чжоу Юэфэнь, Драгович Питер, Кучера Дэвид, Чэнь Лицзянь, Блаттер Фритц, Тран Чинх Виет
Формула / Реферат
1. Соединение формулы I
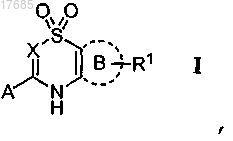
в которой X обозначает N или CR3,
А обозначает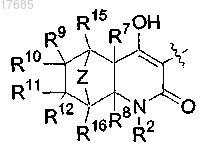 или
или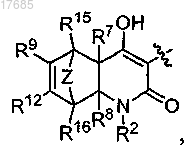
кольцо В обозначает 6-членный арил или пиридил, необязательно замещенный 1-3 группами R1, причем R1 обозначает H, галоген, -CHR4-S(О)2R5, -С(S(О)2R5)=CHR4-, -NR5R6, -NR4S(O)2R5 или -NR4S(O)2NR5R6, где R4, R5 и R6 независимо обозначают H, C1-C6-алкил, C3-C8-циклоалкил, C(O)O-(C1-C6-алкил), фенил или пиридил или R4 и R5 или R5 и R6 вместе с атомом(ами), к которому они присоединены, образуют 5- или 6-членное гетероциклильное кольцо;
R2 обозначает H, C1-C6-алкил, C3-C8-циклоалкил, -C1-C6-алкилен(C3-C8-циклоалкил), -C1-C6-алкилен(фенил), -C1-C6-алкилен(пиридил);
R3 обозначает H;
Z обозначает -(CR13R14)n- или О;
n=1 или 2;
R7 и R8 обозначают H;
R9, R10, R11, R12, R13, R14, R15 и R16 независимо обозначают H, C1-C6-алкил, гидрокси или галоген,
причем указанные алкил, алкилен, арил, циклоалкил или гетероциклил, обозначенные R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15 и R16, могут быть, каждый необязательно и независимо, замещены 1-3 заместителями, выбранными из C1-C6-алкила, C1-C6-галогеналкила, галогена, гидрокси,
или его фармацевтически приемлемая соль или стереоизомер.
2. Соединение по п.1, в котором кольцо В выбрано из
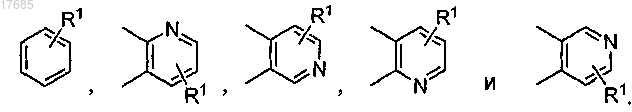
3. Соединение по п.2, в котором
кольцо В представляет собой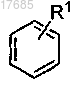
и
R1 обозначает H, галоген, -CHR4-S(О)2R5, -С(S(О)2R5)=CHR4-, -NR5R6, -NR4S(O)2R5 или -NR4S(O)2NR5R6.
4. Соединение по п.3, в котором R1 обозначает -NR4S(O)2R5 и R4 и R5 независимо обозначают H, C1-C6-алкил или C3-C8-циклоалкил.
5. Соединение по п.4, в котором R1 выбран из
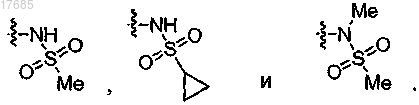
6. Соединение по п.1, в котором R2 выбран из
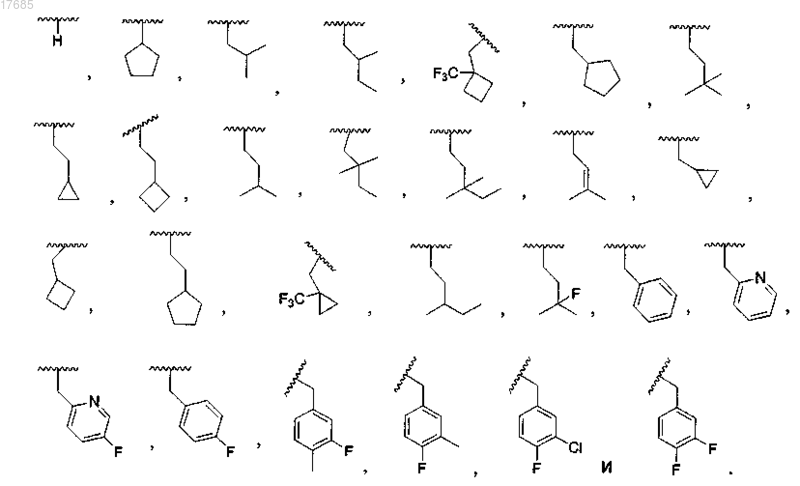
7. Соединение по п.6, в котором R2 выбран из
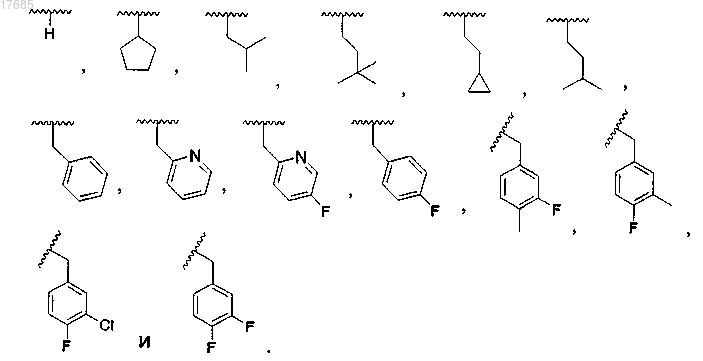
8. Соединение по п.7, в котором R2 выбран из
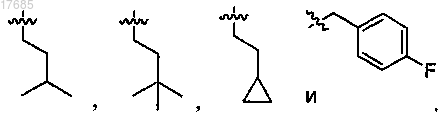
9. Соединение по п.1, в котором R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбраны из
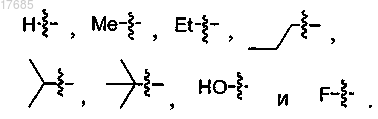
10. Соединение по п.9, в котором R9, R10, R11, R12, R13, R14, R15 и R16 независимо выбраны из
11. Соединение по п.10, в котором R9, R10, R11, R12, R13, R14, R15 и R16 обозначают Н или гидрокси.
12. Соединение по п.11, в котором R9, R10, R11, R12, R13, R14, R15 и R16 обозначают Н.
13. Соединение по п.1, в котором n=1.
14. Соединение, выбранное из следующих соединений:
(рац-ди-экзо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-эндо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-эндо)-N-{3-[3-(5-фторпиридин-2-илметил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1S,2S,7R,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2R,7S,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1S,2R,7S,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-эндо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1S,2R,7S,8R)-3-(4-фтор-3-метилбензил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(4-фтор-3-метилбензил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(3,3-диметилбутил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1S,2R,7S,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(4-фтор-3-метилбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(3,4-дифторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(3,4-дифторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}-N-метилметансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(4-фтор-3-метилбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}-N-метилметансульфонамид,
(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-5-[7-(1,1-диоксо-4,5-дигидро-1Н-1l6-тиофен-2-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил]-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-5-[7-(1,1-диоксотетрагидро-1l6-тиофен-2-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил]-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(2-циклопропилэтил)-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}-N-метилметансульфонамид,
(рац-ди-экзо)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-5-[7-(1,1-диоксо-1l6-изотиазолидин-2-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил]-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-N-[3-(6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид,
(1R,2S,7R,8S)-5-(1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,4]тиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-5-(7-амино-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(рац-ди-экзо)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(3,3-диметилбутил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(3-метилбутил)-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-6-гидрокси-5-(7-йод-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-3-(3-метилбутил)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид циклопропансульфоновой кислоты,
(рац-ди-экзо)-N-{3-[3-(3,3-диметилбутил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,4]тиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,4]тиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,4]тиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}-N-метилметансульфонамид,
{3-(1R,2S,7R,8S)-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид циклопропансульфоновой кислоты,
(1R,2S,7R,8S)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}бензолсульфонамид,
{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид (рац-ди-экзо)циклопропансульфоновой кислоты,
{3-[3-(3,3-диметилбутил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид (рац-ди-экзо)циклопропансульфоновой кислоты,
N-[3-(1R,2S,7R,8S)-(3-циклопентил-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид,
{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид (рац-ди-экзо)циклопропансульфоновой кислоты,
{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундека-5,9-диен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид (рац-ди-экзо)циклопропансульфоновой кислоты,
N-[3-(1R,2S,7R,8S)-(3-циклопентил-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид-N-изопропилкарбамат,
(рац-ди-экзо)-N-[3-(3-циклопентил-6-гидрокси-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид,
N-{3-[(2S,7R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
цис-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
рац-N-{3-[(1R,2R,7S,8S,9S,11R)-3-[(4-фторфенил)метил]-6-гидрокси-4-оксо-3-азатетрацикло [6.3.2.02,7.09,11]тридец-5-ен-5-ил]-1,1-диоксо-4H-1l6,2,4-бензотиадиазин-7-ил}метансульфонамид,
рац-N-{3-[(1R,2S,7R,8S,9S,11R)-3-[(4-фторфенил)метил]-6-гидрокси-4-оксо-3-азатетрацикло[6.3.2.02,7.09,11]тридец-5,12-диен-5-ил]-1,1-диоксо-4Н-1l6,2,4-бензотиадиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-5-(1,1-диоксо-7-пирролидин-1-ил-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-3-ил)-6-гидрокси-3-(3-метилбутил)-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}амид пиридин-3-сульфоновой кислоты,
(1R,2S,7R,8S)-N-{3-[3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}сульфамид,
(1R,2S,7R,8S)-N-[3-(3-бензил-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид,
(1R,2S,7R,8S)-N-[3-(6-гидрокси-3-изобутил-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил)-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил]метансульфонамид,
(1R,2S,7R,8S)-N-{3-[3-(3-хлор-4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(рац-ди-экзо)-N-{3-[6-гидрокси-3-(3-метилбутил)-4-оксо-11-окса-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}-N-метилметансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(3-фтор-4-метилбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-5-(7-бром-1,1-диоксо-1,4-дигидро-1l6-пиридо[2,3-е][1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-пиридо[2,3-е][1,2,4]тиадиазин-7-ил}метансульфонамид,
(1R,2S,7R,8S)-5-(1,1-диоксо-1,4-дигидро-1l6-пиридо[2,3-е][1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-5-(1,1-диоксо-1,4-дигидро-1l6-пиридо[4,3-е][1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
(1R,2S,7R,8S)-5-(1,1-диоксо-1,4-дигидро-1l6-пиридо[3,2-е][1,2,4]тиадиазин-3-ил)-3-(4-фторбензил)-6-гидрокси-3-азатрицикло[6.2.1.02,7]ундец-5-ен-4-он,
N-{3-[(1R,2S,7R,8S)-3-(2-циклопропилэтил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6,9-дигидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль L-аргинина,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль L-лизина,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, полусоль магния,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль натрия и
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль калия.
15. Соединение по п.14, выбранное из следующих соединений:
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль L-аргинина,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль L-лизина,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, полусоль магния,
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль натрия и
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид, соль калия.
16. Соединение по п.14, выбранное из следующих соединений:
N-{3-[(1S,2S,7R,8R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
N-{3-[(2S,7R)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.2.02,7]додец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид и
N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид,
или его фармацевтически приемлемая соль.
17. Соединение по п.16, которое представляет собой N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид.
18. Соединение по п.17 в кристаллической форме.
19. Соединение по п.18, причем кристаллическая форма имеет
дифракцию рентгеновских лучей (2 тета) с линией наибольшей интенсивности, наблюдаемой под углами 6,2; 17,9; 19,7; 20,5; 22,6 и 24,8±0,3°2θ, с линиями меньшей интенсивности при 12,4; 16,5; 18,7; 21,6; 23,2; 24,1; 25,6; 26,6; 27,1; 28,5 и 29,3°2θ;
ИК характеристические полосы поглощения при 1617, 1524, 1321, 1260, 1229, 1217 и 1163 см-1 с незначительными полосами при 1498, 1465, 1147, 836, 727 и 406 см-1.
20. Соединение, выбранное из
21. Фармацевтически приемлемая композиция, содержащая соединение по пп.1-17 и фармацевтически приемлемый носитель.
22. Способ ингибирования репликации вируса гепатита C, включающий экспонирование вируса гепатита C к терапевтически эффективному количеству соединения по любому из пп.1-17.
23. Способ по п.22, в котором ингибирование репликации происходит в присутствии одного или более дополнительного терапевтического средства, выбранного из группы, состоящей из антибиотика, противорвотного средства, антидепрессанта, противогрибкового средства, противовоспалительного средства, противовирусного средства, противоракового средства, иммуномодулирующего средства, α-интерферона, β-интерферона, рибавирина, алкилирующего агента, гормона, цитокина и модулятора толл-подобного рецептора.
24. Способ лечения или профилактики инфекции вируса гепатита C у млекопитающего, включающий введение млекопитающему терапевтически или профилактически эффективного количества соединения по любому из пп.1-17.
25. Способ по п.24, в котором млекопитающим является человек.
26. Способ по п.24, дополнительно включающий введение млекопитающему одного или более дополнительного терапевтического средства.
27. Способ по п.26, в котором дополнительное терапевтическое средство выбрано из группы, состоящей из антибиотика, противорвотного средства, антидепрессанта, противогрибкового средства, противовоспалительного средства, противовирусного средства, противоракового средства, иммуномодулирующего средства, α-интерферона, β-интерферона, рибавирина, алкилирующего агента, гормона, цитокина и модулятора толл-подобного рецептора.
28. Способ по п.24, в котором соединение представляет собой N-{3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]-1,1-диоксо-1,4-дигидро-1l6-бензо[1,2,4]тиадиазин-7-ил}метансульфонамид.
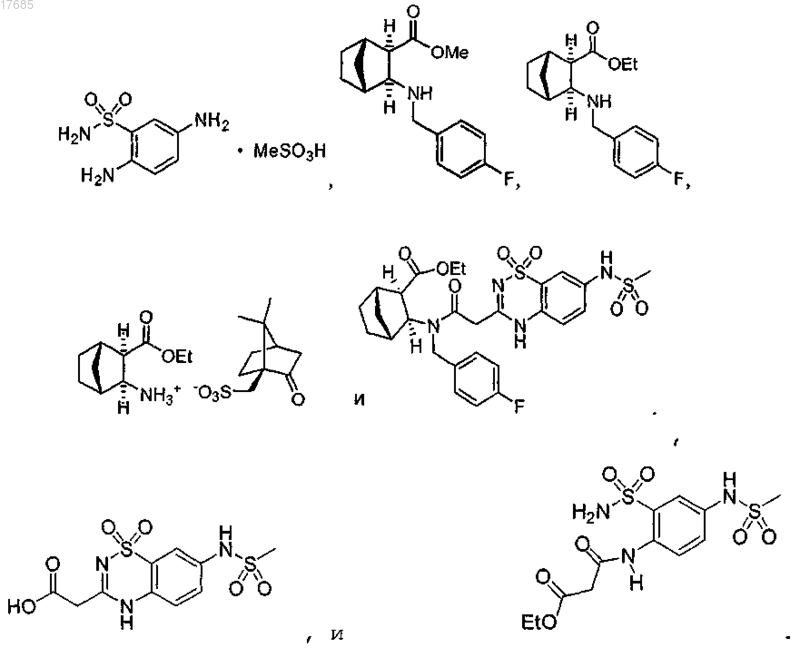
29. Способ получения 5,6-дигидро-1H-пиридин-2-она формулы
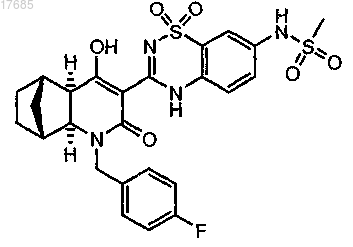
включающий:
(i) взаимодействие трициклического соединения формулы
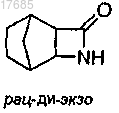
с (1S)-(+)-10-камфорсульфоновой кислотой в присутствии этилацетата и этанола с получением камфорсульфоната формулы
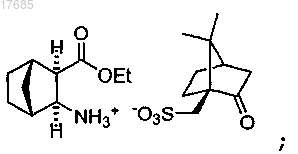
(ii) восстановительное аминирование путем добавления 4-фторбензальдегида к камфорсульфонату, полученному на стадии (i), и восстановление полученного имина с получением эфира формулы
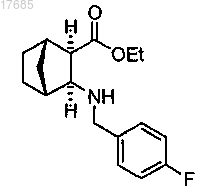
(iii) сочетание эфира, полученного на стадии (ii), с производным уксусной кислоты формулы
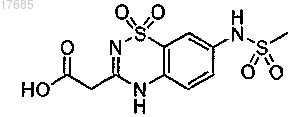
с образованием 5,6-дигидро-1H-пиридин-2-она формулы
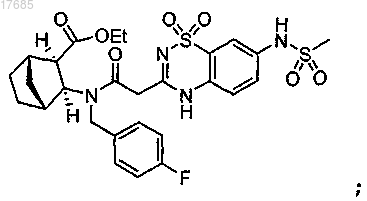
(iv) циклизацию соединения, полученного на стадии (iii), с образованием 5,6-дигидро-1H-пиридин-2-она формулы
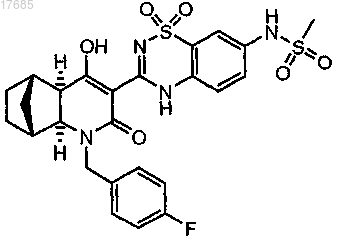
30. Способ по п.29, где на стадии (i) дополнительно осуществляют:
(а) раскрытие азетидинонового кольца трициклического соединения формулы
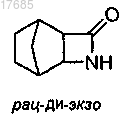
с образованием бициклического соединения формулы
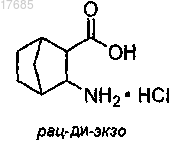
(b) обработку бициклического соединения, полученного на стадии (а), тионилхлоридом и этанолом с образованием эфира формулы
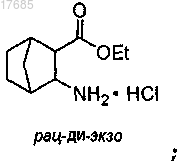
(с) добавление основания и затем добавление (1S)-(+)-10-камфорсульфоновой кислоты с образованием камфорсульфоната формулы
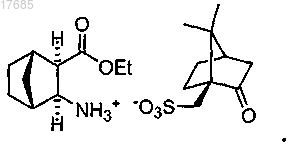
31. Способ по п.30, в котором раскрытие цикла на стадии (а) осуществляют в присутствии водного раствора хлороводородной кислоты.
32. Способ по п.29, где восстановление имина на стадии (ii) осуществляют с помощью цианборгидрида натрия, боргидрида натрия, триацетоксиборгидрида натрия или водородом на палладиевом или платиновом катализаторе.
33. Способ по п.29, где реакцию сочетания (iii) осуществляют в присутствии 4-диметиламинопиридина или N-метилморфолина и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида.
34. Способ по п.29, где реакцию циклизации на стадии (iv) осуществляют в присутствии этоксида натрия в этаноле или триэтиламина.
Текст
Изобретение относится к соединениям 5,6-дигидро-1 Н-пиридин-2-она и фармацевтическим композициям, содержащим такие соединения, которые могут быть использованы для лечения инфекций вируса гепатита С. 017685 Область изобретения Изобретение относится к соединениям 5,6-дигидро-1 Н-пиридин-2-она и фармацевтическим композициям, содержащим такие соединения, которые могут быть использованы для лечения инфекций, вызванных вирусом гепатита C. Уровень техники Гепатит C является значительной проблемой для здравоохранения во всем мире. По оценкам Всемирной Организации Здравоохранения 170 миллионов человек являются хроническими носителями вируса гепатита C (HCV), причем 4 миллиона носителей приходятся на одни только Соединенные Штаты Америки. В Соединенных Штатах Америки на инфекции HCV приходится 40% хронических заболеваний печени, и заболевания HCV является наиболее частой причиной трансплантации печени. ИнфекцияHCV приводит к хронической инфекции, и у приблизительно 70% инфицированных людей проявляются хронические гистологические изменения в печени (хронический гепатит) с риском цирроза 10-40% и риском развития в течение жизни гепатоцеллюлярного рака приблизительно 4%. По оценке CDC каждый год в Соединенных Штатах Америки наблюдается 35000 новых случаев инфекции HCV и приблизительно 10000 смертей связаны с заболеванием HCV. Используемое в настоящее время стандартное лечение представляет собой комбинацию ПЭГилированный интерферон/рибавирин стоимостью приблизительно 31000 /год. Эти препараты имеют проблемы, связанные со сложностью дозирования, и побочные эффекты, которые препятствуют их использованию у почти половины диагностированных пациентов. Лечение ПЭГилированным интерфероном связано с опасными гриппоподобными симптомами, раздражительностью, неспособностью к концентрации,суицидальными мыслями и лейкоцитопенией. Рибавирин связан с гемолитической анемией и врожденными пороками. Общий ответ на эту стандартную терапию является слабым; приблизительно у одной трети пациентов ответа не наблюдается. Из тех, у кого действительно наблюдается ответ, у значительной части случаются рецидивы в течение 6 месяцев после завершения 6-12 месяцев терапии. Как следствие, процент долгосрочного ответа для всех пациентов, поступающих на лечение, составляет только приблизительно 50%. Относительно низкий процент ответа и значительные побочные эффекты фармакотерапии существующими средствами анти-HCV, вместе с негативными долгосрочными эффектами хронической инфекции HCV, приводят к по-прежнему существующей медицинской потребности в улучшенных способах терапии. Противовирусные фармацевтические средства для лечения вирусных заболеваний, вызванных РНК-содержащими вирусами, такими как HCV, являются немногочисленными и, как описано выше, часто связаны с множественными неблагоприятными эффектами. Во многих публикациях описаны ингибиторы NS5B, пригодные для использования при лечении инфекции гепатита C. См., например, публикацию заявки на патент США 2008/0031852 (в которой описаны соединения [1,2-b]пиридазинона); публикацию заявки на патент США 2006/0189602 (раскрывающую некоторые пиридазиноны); публикацию заявки на патент США 2006/0252785 (раскрывающую селективные гетероциклические соединения) и международные публикации WO 03/059356,WO 2002/098424 и WO 01/85172 (в каждой из которых описан конкретный класс замещенных тиадиазинов). Несмотря на существование в некоторых случаях доступных лекарственных средств для облегчения симптомов заболеваний, существует немного лекарственных средств, способных эффективно ингибировать репликацию лежащего в их основе вируса. Значение и распространенность заболеваний, вызываемых РНК-содержащими вирусами, включая, но не ограничиваясь ими, хроническую инфекцию вируса гепатита C, и вместе с ограниченной доступностью и эффективностью существующих противовирусных фармацевтических средств, привели к неизбежной и нескончаемой потребности в новых фармацевтических средствах для лечения этих заболеваний. Сущность изобретения В настоящем изобретении описаны новые соединения 5,6-дигидро-1 Н-пиридин-2-она и их фармацевтически приемлемые соли, которые могут быть использованы для лечения или профилактики инфекции вируса гепатита C у пациента, включающих введение пациенту терапевтически или профилактически эффективного количества соединения 5,6-дигидро-1 Н-пиридин-2-она. В общем аспекте изобретение относится к соединениям формулы IR4, R5 и R6 независимо обозначают H, C1-C6-алкил, C3-C8-циклоалкил, C(O)O-(C1-C6-алкил), арил или гетероциклил илиR9, R10, R11, R12, R13, R14, R15 и R16 независимо обозначают H, C1-C6-алкил, гидрокси или галоген, где указанные алкил, алкилен, арил, циклоалкил или гетероциклил, обозначенные R1, R2, R3, R4, R5, R6, R7,R8, R9, R10, R11, R12, R13, R14, R15 и R16, могут быть, каждый необязательно и независимо, замещены 1-3 заместителями, выбранными из алкиламина,амино,арила, циклоалкила, гетероциклила,C1-C6-алкила, C1-C6-галогеналкила, C1-C6-гидроксиалкила, C1-C6-алкокси, C1-C6-алкиламина,C1-C6-диалкиламина, C2-C6-алкенила или C2-C6-алкинила, причем каждый из которых может быть прерван одним или более гетероатомами,карбоксильной группы,циано,галогена,гидрокси,кето,нитро,-C(O)OH, -C(O)NH2, -C(O)(C1-C6-алкиламина), -C(O)(C1-C6-диалкиламина), -C(О)2-(C1-C6-алкила),-C(О)2-(C3-C8-циклоалкила), -C(О)2-(арила), -C(О)2-(гетероциклила), -C(О)2-(C1-C6-алкилен)арила,-С(О)2-(C1-C6-алкилен)гетероциклила,-С(О)2-(C1-C6-алкилен)циклоалкила,-C(О)(C1-C6-алкила),-C(О)(C3-C8-циклоалкила), -C(О)(арила), -C(О)(гетероциклила), -C(О)(C1-C6-алкилен)арила, -C(O)(C1-C6 алкилен)гетероциклила и -C(О)(C1-C6-алкилен)циклоалкила,причем каждый из указанных выше необязательных заместителей может быть дополнительно необязательно замещен 1-5 заместителями, выбранными из амино, циано, галогена, гидрокси, нитро,C1-C6-алкиламина,C1-C6-диалкиламина,C1-C6-алкила,C1-C6-алкокси,C1-C6-алкенила иC1-C6-гидроксиалкила, где каждый алкил необязательно замещен одним или более галогенсодержащими заместителями,или к их фармацевтически приемлемой соли, гидрату, сольвату, таутомеру или стереоизомеру. В одном варианте осуществления изобретение относится к соединениям формулы I, в которой кольцо В выбрано из 4 В другом варианте осуществления кольцо В представляет собой, где R1 обозначает H, галоген,4 5 5 4 5 6 4 5 4 нитро, -CHR -S(О)2R , -C(S(O)2R )=CHR -, -NR R , -NR S(O)2R или -NR S(O)2NR5R6. В одном варианте осуществления изобретение относится к соединениям формулы I, в которой R1 обозначает -NR4S(O)2R5, где R4 и R5 независимо обозначают H, C1-C6-алкил или C3-C8-циклоалкил. В другом варианте осуществления изобретение относится к соединениям формулы I, в которой R1 выбран из В одном варианте осуществления изобретение относится к соединениям формулы I, в которой R2 выбран из В другом варианте осуществления изобретение относится к соединениям формулы I, в которой R2 выбран из В еще одном варианте осуществления изобретение относится к соединениям формулы I, в которой В одном варианте осуществления изобретение относится к соединениям формулы I, в которой R3 выбран из водорода или C1-C6-алкила. В другом варианте осуществления изобретение относится к соединениям формулы I, в которой R3 выбран из В одном варианте осуществления изобретение относится к соединениям формулы I, в которой R7 и 8R обозначают Н. В одном варианте осуществления изобретение относится к соединениям формулы I, в которой R9,10 В другом варианте осуществления изобретение относится к соединениям формулы I, в которой R9,R , R11, R12, R13, R14, R15 и R16 независимо выбраны из 10 В другом варианте осуществления изобретение относится к соединениям формулы I, в которой R9,R , R11, R12, R13, R14, R15 и R16 обозначают Н или гидрокси. В еще одном варианте осуществления изобретение относится к соединениям формулы I, в которойR9, R10, R11, R12, R13, R14, R15 и R16 обозначают Н. В одном варианте осуществления n=1. 10-3 017685 В другом варианте осуществления изобретение относится к соединениям, выбранным из следующих соединений:N-3-[(1R,2S,7R,8S)-3-(4-фторбензил)-6-гидрокси-4-оксо-3-азатрицикло[6.2.1.02,7]ундец-5-ен-5-ил]1,1-диоксо-1,4-дигидро-16-бензо[1,2,4]тиадиазин-7-илметансульфонамид, соль калия. Изобретение также относится к фармацевтически приемлемым солям и фармацевтически приемлемым сольватам соединений формулы I. Также описаны предпочтительные способы получения соединений формулы I. В одном аспекте изобретение охватывает способ лечения или профилактики инфекции вируса гепатита C у млекопитающего, нуждающегося в этом, предпочтительно у человека, нуждающегося в этом,включающий введение пациенту терапевтически или профилактически эффективного количества соединения формулы I. В одном варианте осуществления изобретение охватывает способ лечения или профилактики инфекции вируса гепатита C путем введения пациенту, нуждающемуся в этом, терапевтически или профилактически эффективного количества соединения формулы I, которое является ингибиторомHCV NS5B полимеразы. В другом аспекте изобретение охватывает способ лечения или профилактики инфекции вируса гепатита C у пациента, нуждающегося в этом, включающий введение пациенту терапевтически или профилактически эффективного количества соединения формулы I и фармацевтически приемлемого эксципиента, основы или носителя. В другом аспекте изобретение охватывает способ лечения или профилактики инфекции вируса гепатита C у пациента, нуждающегося в этом, включающий введение пациенту терапевтически или профилактически эффективного количества соединения формулы I и дополнительного терапевтического средства, предпочтительно дополнительного противовирусного средства или иммуномодулирующего средства. Подробное описание изобретения Если в этом описании используются следующие термины, они используются, как определено ниже. Термины "содержащий", "имеющий" и "включающий" используются в описании в их открытом,неограничивающем смысле. Используемый в описании термин "алкил", если не указано иное, включает C1-C12-насыщенные одновалентные углеводородные радикалы, имеющие прямые, разветвленные или циклические группы(включая конденсированные и соединенные мостиковой связью бициклические и спироциклические группы) или комбинацию этих групп. Если алкильная группа имеет циклические группы, то эта группа должна иметь по меньшей мере три атома углерода. Используемый в описании термин "алкилен", если не указано иное, включает C1-C12-двухвалентный радикал, полученный из алкила, как иллюстрируется формулой -CH2CH2CH2CH2-. Используемый в описании термин "алкенил", если не указано иное, включает C1-C12-алкильные группы, имеющие по меньшей мере одну углерод-углеродную двойную связь, причем алкил является таким, как определено выше, и включая Е- и Z-изомеры указанной алкенильной группы. Используемый в описании термин "алкинил", если не указано иное, включает C1-C12-алкильные группы, имеющие по меньшей мере одну углерод-углеродную тройную связь, причем алкил является таким, как определено выше.-6 017685 Используемый в описании термин "алкокси", если не указано иное, включает O-алкильные группы,причем алкил является таким, как определено выше. Термин "Me" означает метил, "Et" означает этил и "Ac" означает ацетил. Используемый в описании термин "циклоалкил", если не указано иное, относится к неароматическому, насыщенному или частично насыщенному, моноциклическому или конденсированному, спиро или неконденсированному бициклическому или трициклическому углеводороду, указанному в описании,содержащему в общей сложности от 3 до 10 атомов углерода, предпочтительно 5-8 кольцевых атомов углерода. Примеры циклоалкилов включают моноциклические кольца, имеющие от 3-7, предпочтительно 3-6 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. Иллюстративные примеры циклоалкила являются производными, но не ограничены ими, от следующих структур: Используемый в описании термин "арил", если не указано иное, включает органический радикал,полученный из ароматического углеводорода удалением одного водорода, такой как фенил или нафтил,содержащий в общей сложности от 6 до 10 атомов углерода. Используемый в описании термин "гетероциклический" или "гетероциклил", если не указано иное,включает ароматические (например, гетероарилы) и неароматические гетероциклические группы, содержащие от 1 до 4 гетероатомов, каждый из которых выбран из О, S и N, где каждая гетероциклическая группа имеет 4-10 атомов в кольцевой системе, и при условии, что кольцо указанной группы не содержит двух смежных атомов О. Неароматические гетероциклические группы включают группы, имеющие только 3 атома в кольцевой системе, но ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в кольцевой системе. Гетероциклические группы включают бензоконденсированные кольцевые системы. Примером 4-членной гетероциклической группы является азетидинил (производное азетидина). Примером 5-членной гетероциклической группы является тиазолил, и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил,пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3-пирролинил, индолинил, 2 Н-пиранил, 4 Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиенил, дигидрофуранил, пиразолидинил, имидазолинил, имидазолидинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил,3 Н-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил,изотиазолил, пирролил, хинолинил, изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил,оксадиазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил,хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Вышеназванные группы, как производные указанных выше групп, могут быть С-присоединены или(N-присоединенным) или имидазол-2-илом (С-присоединенным). 4-10-членные гетероциклические группы могут быть необязательно замещены на любом кольцевом атоме(ах) углерода, серы или азота однойдвумя оксогруппами на кольцо. Примером гетероциклической группы, в которой 2 кольцевых атома углерода замещены оксогруппами, является 1,1-диоксотиоморфолинил. Другие иллюстративные примеры 4-10-членных гетероциклических групп являются производными, но не ограничены ими, от следующих структур: Если не определено иначе, "алкил", "алкилен", "алкенил", "алкинил", "арил," "циклоалкил" или "гетероциклил" могут быть, каждый необязательно и независимо, замещены 1-3 заместителями, выбранными из алкиламина, амино, арила, циклоалкила, гетероциклила, C1-C6-алкила, C1-C6-галогеналкила,C1-C6-гидроксиалкила, C1-C6-алкокси, C1-C6-алкиламина, C1-C6-диалкиламина, C2-C6-алкенила илиC2-C6-алкинила, причем каждый из которых может быть прерван одним или более гетероатомами, карбоксильной группой, циано, галогеном, гидрокси, нитро, -С(О)ОН, -С(О)2-(C1-C6-алкилом),-С(О)2-(C3-C8-циклоалкилом), -С(О)2-(арилом), -С(О)2-(гетероциклилом), -С(О)2-(C1-C6-алкилен)арилом,-C(О)2-(C1-C6-алкилен)гетероциклилом, -C(O)2-(C1-C6-алкилен)циклоалкилом, -C(О)(C1-C6-алкилом),-C(О)(C3-C8-циклоалкилом), -С(О)(арилом), -С(О)(гетероциклилом), -C(О)(C1-C6-алкилен)арилом,-С(О)(C1-C6-алкилен)гетероциклилом и -C(О)(C1-C6-алкилен)циклоалкилом, где каждый из этих необязательных заместителей может быть дополнительно необязательно замещен 1-5 заместителями, выбранными из амино, циано, галогена, гидрокси, нитро, C1-C6-алкиламина, C1-C6-диалкиламина, C1-C6-алкила,C1-C6-алкокси, C1-C6-алкенила и C1-C6-гидроксиалкила, где каждый алкил необязательно замещен одним или более галогенсодержащими заместителями, например CF3. Термин "иммуномодулятор" относится к природным или синтетическим продуктам, способным модифицировать нормальную или аберрантную иммунную систему через механизмы возбуждения или подавления. Термин "профилактика" относится к способности соединения или композиции по изобретению предотвращать идентифицированное в описании заболевание у больных, у которых диагностировано наличие заболевания или у которых установлен риск развития такого заболевания. Этот термин также охватывает предотвращение дальнейшего развития заболевания у пациентов, которые уже страдают им или имеют симптомы такого заболевания. Термин "пациент" или "субъект" означает животное (например, корову, лошадь, овцу, свинью, курицу, индейку, перепелку, кошку, собаку, мышь, крысу, кролика, морскую свинку и т.д.) или млекопитающее, включая химерных и трансгенных животных и млекопитающих. При лечении или профилактике инфекции HCV термин "пациент" или "субъект" предпочтительно означает обезьяну или человека, наиболее предпочтительно человека. В конкретном варианте осуществления пациент или субъект инфицирован вирусом гепатита C или подвергается его воздействию. В некоторых вариантах осуществления пациент означает человека младенческого (возраст 0-2), детского (возраст 2-12), подросткового (возраст 12-17), взрослого (возраст 18 и более) или старческого (возраст 70 и более) возраста. Кроме того, пациент включает пациентов с иммунодефицитом, таких как ВИЧ-положительные пациенты, больные раком, пациенты, получающие иммунотерапию или химиотерапию. В конкретном варианте осуществления пациент является здоровым человеком, т.е. не демонстрирующим симптомы других вирусных инфекций. Термин "терапевтически эффективное количество" относится к количеству соединения по изобретению, достаточному, чтобы обеспечить пользу при лечении или профилактике вирусного заболевания,задержать или минимизировать симптомы, связанные с вирусной инфекцией или вызванным вирусом заболеванием, или вылечить или облегчить заболевание или инфекцию или их причины. В частности,терапевтически эффективное количество означает количество, достаточное для обеспечения терапевтической пользы in vivo. Используемый в связи с количеством соединения по изобретению этот термин-8 017685 предпочтительно охватывает нетоксичное количество, которое приводит к общему улучшению терапии,уменьшению или избеганию симптомов или причин заболевания, или усиливает терапевтическую эффективность или синергизм с другим терапевтическим средством. Термин "профилактически эффективное количество" относится к количеству соединения по изобретению или другого активного ингредиента, достаточному для профилактики инфекции, рецидива или распространения вирусной инфекции. Профилактически эффективное количество может относиться к количеству, достаточному, чтобы предотвратить начальную инфекцию или рецидив или распространение инфекции или заболевания, связанного с инфекцией. Используемый в связи с количеством соединения по изобретению этот термин предпочтительно охватывает нетоксичное количество, которое приводит к общему улучшению профилактики или усиливает профилактическую эффективность или синергизм с другим профилактическим или терапевтическим средством. Термин "в комбинации" относится к использованию более чем одного профилактического и/или терапевтического средств одновременно или последовательно и таким образом, чтобы их соответствующие эффекты были аддитивными или синергическими. Термин "лечение" относится к:(i) предотвращению появления заболевания, нарушения или состояния у животного, которое может быть предрасположено к заболеванию, нарушению и/или состоянию, но у которого еще не было диагностировано его наличие;(iii) облегчению заболевания, нарушения или состояния, т.е. вызыванию регрессии заболевания, нарушения и/или состояния. Термины "R" и "S" указывают определенную стереохимическую конфигурацию заместителя на асимметрическом атоме углерода в показанной химической структуре. Термин "рац" указывает, что соединение представляет собой рацемат, который определен как эквимолярная смесь пары энантиомеров. Соединение "рац" не показывает оптическую активность. Химическое название или формула рацемата отличается от таковых энантиомеров приставкой - или рац- (или рацем-) или символами RS и SR. Термины "эндо" и "экзо" описывают относительную ориентацию заместителей, присоединенных к немостиковым атомам в бицикло[х.у.z]алкане (xyz0). Термины "син" и "анти" описывают относительную ориентацию заместителей, присоединенных к мостиковым атомам в бицикло[х.у.z]алкане (xyz0). Термин "экзо" присваивается заместителю (например, брому, присоединенному к С-2 в примере ниже), который ориентирован к мостику, пронумерованному самым высоким числом (z мостику, например С-7 в примере ниже); если заместитель ориентирован от мостика, пронумерованного самым высоким числом, ему присваивают описание "эндо". Термин "син" присваивается заместителю, присоединенному к мостику, пронумерованному самым высоким числом (z мостику, например F, присоединенный к С-7 в примере ниже) и ориентированному к мостику, пронумерованному самым низким числом (х мостик, например С-2 и С-3 в примере ниже); если заместитель ориентирован от мостика, пронумерованного самым низким числом, ему присваивают описание "анти". 2-эндо-бром-7-анти-фторбицикло[2.2.1]гептан Термины "цис" и "транс" являются дескрипторами, которые показывают отношение между двумя лигандами, присоединенными к раздельным атомам, которые связаны двойной связью или содержатся в кольце. Эти два лиганда называют расположенными в положении цис по отношению друг к другу, если они лежат на одной и той же стороне плоскости. Если они находятся на противоположных сторонах, их-9 017685 относительное положение называют транс. Соответствующая референсная плоскость двойной связи перпендикулярна плоскости релевантных -связей и проходит через двойную связь. Для кольца - это средняя плоскость кольца (колец). Соединения по изобретению могут демонстрировать явление таутомерии. Хотя формула I не может явно показать все возможные таутомерные формы, следует понимать, что формула I обозначает любую таутомерную форму представленного соединения и не должна быть ограничена конкретной формой соединения, изображенной этой формулой. Для иллюстрации, и никоим образом не ограничивая диапазон таутомеров, соединения формулы I могут существовать в следующих формах: или соединения формулы I могут существовать в следующих формах: Некоторые из соединений по изобретению могут существовать как отдельные стереоизомеры (т.е. в основном не содержащие других стереоизомеров), рацематы и/или смеси энантиомеров и/или диастереомеров. Все такие отдельные стереоизомеры, рацематы и их смеси входят в объем настоящего изобретения. Предпочтительно соединения по изобретению, которые являются оптически активными, используются в оптически чистой форме. Как это обычно понимается специалистом в данной области, оптически чистое соединение, имеющее один хиральный центр (т.е. один асимметрический атом углерода), является соединением, которое состоит, по существу, из одного из двух возможных энантиомеров (т.е. является энантиомерно чистым),- 10017685 и оптически чистое соединение, имеющее более одного хирального центра, представляет собой соединение, которое является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно соединения согласно настоящему изобретению используют в форме, которая является по меньшей мере на 90% не содержащей других энантиомеров или диастереомеров соединений,т.е. в форме, которая содержит по меньшей мере 90% одного изомера (80% энантиомерный избыток("э.и.") или диастереомерный избыток ("д.и.", более предпочтительно по меньшей мере 95% (90% э.и. или д.и.), еще более предпочтительно по меньшей мере 97,5% (95% э.и. или д.и.) и наиболее предпочтительно по меньшей мере 99% (98% э.и. или д.и.). Дополнительно, формула I охватывает сольватированные, а также несольватированные формы идентифицированных структур. Например, формула I включает соединения обозначенной структуры как в гидратированной, так и в негидратированной форме. Другие примеры сольватов включают структуры в комбинации с изопропанолом, этанолом, метанолом, ДМСО, этилацетатом, пентилацетатом, уксусной кислотой или этаноламином. В дополнение к соединениям формулы I, изобретение включает фармацевтически приемлемые пролекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов."Фармацевтически приемлемое пролекарство" является соединением, которое в физиологических условиях или в результате сольволиза может быть преобразовано в указанное соединение или в фармацевтически приемлемую соль такого соединения до проявления его фармакологического эффекта (эффектов). Как правило, пролекарство составляют для улучшения химической стойкости, улучшения восприимчивости и комплаентности пациента, улучшения биодоступности, увеличения продолжительности действия, улучшения органоселективности, улучшения состава (например, увеличения водорастворимости) и/или уменьшения побочных эффектов (например, токсичности). Пролекарство может быть легко получено из соединений формулы I с использованием способов, известных из уровня техники, таких как описанные Burger's Medicinal Chemistry and Drug Chemistry, 1, 172-178, 949-982 (1995). См. также"Фармацевтически активный метаболит" означает фармакологически активный продукт, полученный в результате метаболизма указанного соединения или его соли в организме. После попадания в организм большинство лекарственных средств становятся субстратами для химических реакций, которые могут изменить их физические свойства и биологические эффекты. Эти метаболические преобразования,которые обычно влияют на полярность соединений формулы I, изменяют путь распределения и выведения лекарственных средств из организма. Однако в некоторых случаях метаболизм лекарственного средства требуется для терапевтического эффекта. Например, противораковые лекарственные средства класса антиметаболитов должны быть преобразованы в их активные формы после того, как они были транспортированы в раковую клетку. Так как большинство лекарственных средств подвергается метаболической трансформации того или иного вида, биохимические реакции, которые играют роль в метаболизме лекарственного средства,могут быть многочисленными и разнообразными. Главным участком метаболизма лекарственного средства является печень, хотя другие ткани также могут участвовать. Отличительной особенностью многих из этих трансформаций является то, что продукты метаболизма, или "метаболиты", являются более полярными, чем исходные лекарственные средства, хотя полярное лекарственное средство иногда приводит к менее полярному продукту. Вещества с высокими коэффициентами распределения липид/вода, которые легко проходят через мембраны, также легко диффундируют обратно из мочеточников через тубулярные клетки почек в плазму. Таким образом, такие вещества имеют тенденцию к низкому почечному клиренсу и длительной персистенции в организме. Если лекарственное средство метаболизируется до более полярного соединения, имеющего более низкий коэффициент распределения, то его тубулярная реабсорбция будет значительно снижена. Кроме того,определенные секреторные механизмы для анионов и катионов в проксимальных тубулярных структурах почек и в паренхиматозных клетках печени работают с очень полярными веществами. В качестве конкретного примера фенацетин (ацетофенетидин) и ацетанилид являются одновременного мягкими анальгетиками и жаропонижающими средствами, но преобразуются в организме в более полярный и более эффективный метаболит, п-гидроксиацетанилид (ацетаминофен), который в настоящее время широко используется. При введении дозы ацетанилида человеку в плазме последовательно наблюдают пики и спады сменяющих друг друга метаболитов. В течение первого часа основным плазменным компонентом является ацетанилид. На втором часу, когда уровень ацетанилида падает, концентрация метаболита ацетаминофена достигает пика. Наконец, через несколько часов основным плазменным компонентом становится следующий метаболит, который является инертным и может быть выведен из орга- 11017685 низма. Таким образом, концентрации в плазме одного или более метаболитов, а также непосредственно лекарственного средства могут быть фармакологически важными."Фармацевтически приемлемая соль" означает соль, которая сохраняет биологическую эффективность свободных кислот и оснований указанного соединения и не является нежелательной в биологическом или ином отношении. Соединение по изобретению может обладать достаточно кислыми, достаточно основными или обеими функциональными группами и, соответственно, вступать в реакцию с любым числом неорганических или органических оснований и неорганических и органических кислот, образуя фармацевтически приемлемую соль. Примеры фармацевтически приемлемых солей включают соли, полученные реакцией соединений согласно настоящему изобретению с неорганической или органической кислотой или неорганическим основанием, включая такие соли, как сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацинаты,фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты, гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2-сульфонаты и манделаты. Если соединение по изобретению представляет собой основание, желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, известным из уровня техники, например обработкой свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, -гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота,такая как аспарагиновая кислота или глутаминовая кислота, кислота ароматического ряда, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как п-толуолсульфоновая кислота или этансульфоновая кислота, или т.п. Если соединение по изобретению представляет собой кислоту, то желаемая фармацевтически приемлемая соль может быть получена любым подходящим способом, например обработкой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щлочно-земельного металла или т.п. Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. В случае средств, которые являются твердыми частицами, специалисту понятно, что соединения и соли по изобретению могут существовать в различных кристаллических, co-кристаллических или полиморфных формах, которые все входят в объем настоящего изобретения и конкретных формул. Способы лечения и профилактики инфекций вируса гепатита C. Настоящее изобретение относится к способам лечения или профилактики инфекций вируса гепатита C у пациента, нуждающегося в этом. Настоящее изобретение также относится к способам введения терапевтически эффективного количества соединения формулы I или комбинации таких соединений в кровоток пациента при лечении и/или профилактике инфекций вируса гепатита C. Размер профилактической или терапевтической дозы соединения формулы I по изобретению или его фармацевтически приемлемой соли, сольвата или гидрата при лечении или профилактике острой или хронической инфекции варьирует, однако в зависимости от характера и серьезности инфекции и пути введения активного ингредиента. Доза, и в некоторых случаях частота дозы, также варьирует в зависимости от подлежащей лечению инфекции, возраста, массы тела и реакции индивидуального пациента. Подходящие режимы введения могут быть легко выбраны специалистом с должным учетом таких факторов. Способы согласно настоящему изобретению особенно хорошо подходят для человека. В частности,способы и дозы согласно настоящему изобретению могут быть использованы в случае пациентов с иммунодефицитом, включая, но не ограничиваясь ими, больных раком, ВИЧ-инфицированных пациентов и пациентов с иммунодегенеративным заболеванием. Кроме того, эти способы могут быть использованы в случае пациентов с иммунодефицитом в стадии ремиссии. Способы и дозы согласно настоящему изобретению также могут быть использованы в случае пациентов, получающих другие противовирусные виды лечения. Способы профилактики согласно настоящему изобретению являются особенно подходящими для пациентов, для которых существует риск вирусной инфекции. Эти пациенты включают, но не ограничиваются ими, работников здравоохранения, например врачей, медсестер, сиделок; военный персонал;- 12017685 преподавателей; работников детских учреждений; пациентов, путешествующих или проживающих за границей, в частности жителей стран третьего мира, включая работников социальных служб, миссионеров и иностранных дипломатов. Наконец, способы и композиции включают лечение рефрактерных пациентов или пациентов, резистентных к лечению, таких как пациенты, резистентные к ингибиторам обратной транскриптазы, ингибиторам протеазы и т.д. Дозы. Токсичность и эффективность соединений по изобретению могут быть определены в соответствии со стандартными фармацевтическими процедурами в клеточных культурах или на подопытных животных, например, для определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Отношение дозы между токсическими и терапевтическими эффектами дает терапевтический индекс, и он может быть выражен как отношение LD50/ED50. Данные, полученные в тестах клеточной культуры и экспериментальном исследовании, могут быть использованы при составлении диапазона доз соединений для применения у человека. Доза таких соединений находится предпочтительно в пределах диапазона циркулирующих концентраций, которые включают ED50 с незначительной токсичностью или с отсутствием токсичности. Доза может варьировать в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения. Для любого соединения, используемого в способе по изобретению, терапевтически эффективная доза может быть оценена первоначально на основании тестов в клеточной культуре. Доза может быть определена на моделях животных для достижения диапазона циркулирующей плазменной концентрации, который включает IC50 (т.е. концентрацию тестируемого соединения, которая приводит к полумаксимальному ингибированию симптомов), определенную в клеточной культуре; альтернативно, доза соединения формулы I может быть определена на моделях животных для достижения диапазона циркулирующей плазменной концентрации соединения, который соответствует концентрации, необходимой для достижения фиксированной магнитуды ответа. Такая информация может быть использована для более точного определения полезных доз для человека. Уровни в плазме могут быть измерены, например,методом высокоэффективной жидкостной хроматографии. Протоколы и композиции по изобретению перед использованием для людей предпочтительно проверяют in vitro, а затем in vivo на желаемую терапевтическую или профилактическую активность. Например, тесты in vitro, которые можно использовать для определения, показано ли введение определенного терапевтического протокола, включают тесты in vitro на клеточной культуре, в который клетки, которые являются чувствительными к эффектам соединения формулы I, подвергают действию лиганда и магнитуду ответа измеряют с использованием подходящей методики. Исследование соединения формулы I оценивают тогда относительно потенциала соединения формулы I и степени преобразования пролекарства соединения формулы I. Соединения для использования в способах по изобретению могут быть проверены в подходящих системах моделей животных до испытания на людях, включая, но не ограничиваясь ими, исследования на крысах, мышах, курах, коровах, обезьянах, кроликах, хомяках и т.д. Соединения можно затем использовать в соответствующих клинических испытаниях. Величина профилактической или терапевтической дозы пролекарства соединения формулы I по изобретению или его фармацевтически приемлемой соли, сольвата или гидрата при лечении или профилактике острой или хронической инфекции варьирует в зависимости от характера и серьезности инфекции и пути введения активного ингредиента. Доза, и возможно частота дозы, также варьирует в зависимости от подлежащей лечению инфекции, возраста, массы тела и реакции индивидуального пациента. Подходящие режимы введения могут быть легко выбраны специалистом с должным учетом таких факторов. В одном варианте осуществления вводимая доза зависит от конкретного соединения, которое используется, и массы тела и состояния пациента. Кроме того, доза может отличаться для различных конкретных соединений формулы I; подходящие дозы могут быть предсказаны на основе указанного измерения in vitro и на основе исследования на животных, так что меньшие дозы будут подходящими для тех соединений формулы I, эффективность которых проявляется в более низких концентрациях, чем в случае других соединений формулы I, при измерении в системах, описанных или упомянутых в описании. Как правило, доза в сутки находится в диапазоне от приблизительно 0,001 до 100 мг/кг, предпочтительно приблизительно от 1 до 25 мг/кг, более предпочтительно приблизительно от 5 до 15 мг/кг. Для лечения людей, инфицированных вирусом гепатита C, от приблизительно 0,1 мг до приблизительно 15 г в сутки вводят приблизительно в виде от 1 до 4 дробных введений в сутки, предпочтительно от 100 мг до 12 г в сутки, более предпочтительно от 100 до 8000 мг в сутки. Дополнительно, рекомендованная суточная доза может быть введена в циклах в качестве единственного средства или в комбинации с другими терапевтическими средствами. В одном варианте осуществления суточную дозу вводят в виде единственной дозы или в форме одинаковых раздельных доз. В родственном варианте осуществления рекомендованная суточная доза может быть введена один раз в неделю, два раза в неделю, три раза в неделю, четыре раза в неделю или пять раз в неделю. В одном варианте осуществления соединения по изобретению вводят, чтобы обеспечить системное распределение соединения в организме пациента. В родственном варианте осуществления соединения по изобретению вводят, чтобы произвести общее действие в организме.- 13017685 В другом варианте осуществления соединения по изобретению вводят перорально, через слизистую оболочку (включая подъязычный, щечный, ректальный, носовой или вагинальный пути введения), парентерально (включая подкожный, внутримышечный, болюсным вливанием, внутриартериальный или внутривенный пути введения), чрескожным или топическим введением. В конкретном варианте осуществления соединения по изобретению вводят через слизистую оболочку (включая подъязычный, щечный,ректальный, носовой или вагинальный пути введения), парентерально (включая подкожный, внутримышечный, болюсным вливанием, внутриартериальный или внутривенный пути введения), чрескожным или топическим введением. В следующем конкретном варианте осуществления соединения по изобретению вводят перорально. В другом конкретном варианте осуществления соединения по изобретению не вводят перорально. Различные терапевтически эффективные количества могут быть использованы для различных инфекций, как известно специалисту в данной области. Аналогично, количества, достаточные для лечения или профилактики таких инфекций, но недостаточные для того, чтобы вызвать, или достаточные для того, чтобы уменьшить, неблагоприятные эффекты, связанные с обычными видами терапии, также охвачены описанными выше вводимыми количествами и расписаниями частоты введения. Комбинированная терапия. Конкретные способы по изобретению дополнительно включают введение дополнительного терапевтического средства (т.е. терапевтического средства, отличного от соединения по изобретению). В некоторых вариантах осуществления настоящего изобретения соединения по изобретению могут быть использованы в комбинации по меньшей мере с одним другим терапевтическим средством. Терапевтические средства включают, но не ограничиваются ими, антибиотики, противорвотные средства, антидепрессанты и противогрибковые средства, противовоспалительные средства, противовирусные средства, противораковые средства, иммуномодулирующие средства, -интерфероны,-интерфероны, рибавирин, алкилирующие агенты, гормоны, цитокины или модуляторы толл-подобных рецепторов. В одном варианте осуществления изобретение охватывает введение дополнительного терапевтического средства, которое является HCV-специфическим или демонстрирует анти-HCV активность. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с антибиотиками. Например, они могут быть составлены с макролидами (например, тобрамицином (Tobi,цефалоспорином (например, цефалексином (Keflex), цефрадином (Velosef), цефуроксимом (Ceftin),цефпрозилом (Cefzil), цефаклором (Ceclor), цефиксимом (Suprax) или цефадроксилом (Duricef,кларитромицином (например, кларитромицином (Biaxin, эритромицином (например, эритромицином(например, офлоксацином (Floxin), ципрофлоксацином (Cipro) или норфлоксацином (Noroxin,аминогликозидными антибиотиками (например, апрамицином, арбекацином, бамбермицином, бутирозином, дибекацином, неомицином, неомицин ундециленатом, нетилмицином, паромомицином, рибостамицином, сисомицином и спектиномицином), амфениколовыми антибиотиками (например, азидамфениколом, хлорамфениколом, флорфениколом и тиамфениколом), ансамициновыми антибиотиками (например,рифамидом и рифампином), карбацефемами (например, лоракарбефом), карбапенемами (например, биапенемом и имипенемом), цефалоспоринами (например, цефаклором, цефадроксилом, цефамандолом,цефатризином, цефазедоном, цефозопраном, цефпимизолом, цефпирамидом и цефпиромом), цефамицинами (например, цефбуперазоном, цефметазолом и цефминоксом), монобактамами (например, азтреонамом, карумонамом и тигемонамом), оксацефемами (например, фломоксефом и моксалактамом), пенициллинами (например, амдиноциллином, амидиноциллин пивоксилом, амоксициллином, бакампициллином, бензилпенициллиновой кислотой, бензилпенициллином натрия, эпициллином, фенбенициллином,флоксациллином, пенамоциллином, пенетаматом гидройодидом, пенициллин-о-бенетамином, пенициллином 0, пенициллином V, пенициллин V бензатином, пенициллин V гидрабамином, пенимепициклином и фенцигициллином калия), линкосамидами (например, клиндамицином и линкомицином), амфомицином, бацитрацином, капреомицином, колистином, эндурацидином, энвиомицином, тетрациклинами (например,апициклином,хлортетрациклином,кломоциклином и демеклоциклином),2,4-диаминопиримидинами (например, бродимопримом), нитрофуранами (например, фуралтадоном и фуразолия хлоридом), хинолонами и их аналогами (например, циноксацином, клинафлоксацином, флумехином и грепаглоксацином), сульфонамидами (например, ацетилсульфаметоксипиразином, бензилсульфамидом, ноприлсульфамидом, фталилсульфацетамидом, сульфахризоидином и сульфацитином),сульфонами (например, диатимосульфоном, глюкосульфоном натрия и соласульфоном), циклосерином,мупироцином и туберином. Соединения формулы I по изобретению могут также быть введены или составлены в комбинации с противорвотным средством. Подходящие противорвотные средства включают, но не ограничиваются ими, метоклопрамид, домперидон, прохлорперазин, прометазин, хлорпромазин, треметобензамид, ондансетрон, гранисетрон, гидроксизин, ацетиллейцин моноэтаноламин, ализаприд, азасетрон, бензхинамид, биетанаутин, бромоприд, буклизин, клебоприд, циклизин, дименгидринат, дифенидол, доласетрон,меклизин, металлатал, метопимазин, набилон, оксиперидил, пипамазин, скополамин, сульпирид, тетра- 14017685 гидроканнабинолы, тиэтилперазин, тиопроперазин, трописетрон и их смеси. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с антидепрессантом. Подходящие антидепрессанты включают, но не ограничиваются ими, бинедалин, кароксазон, циталопрам, диметазан, фенкамин, индалпин, инделоксазин гидрохлорид, нефопам, номифенсин,окситриптан, оксипертин, пароксетин, сертралин, тиазесим, тразодон, бенмоксин, ипроклозид, ипрониазид, изокарбоксазид, ниаламид, октамокин, фенелзин, котинин, ролициприн, ролипрам, мапротилин,метралиндол, миансерин, миртазепин, адиназолам, амитриптилин, амитриптилиноксид, амоксапин, бутриптилин, кломипрамин, демексиптилин, десипрамин, дибензепин, диметакрин, дотиепин, доксепин,флуацизин, имипрамин, имипрамин N-оксид, иприндол, лофепрамин, мелитрацен, метапрамин, нортриптилин, ноксиптилин, опипрамол, пизотилин, пропизепин, протриптилин, хинупрамин, тианептин, тримипрамин, адрафинил, бенактизин, бупропион, бутацетин, диоксадрол, дулоксетин, этоперидон, фебарбамат, фемоксетин, фенпентадиол, флуоксетин, флувоксамин, гематопорфирин, гиперицин, левофацетоперан, медифоксамин, милнаципран, минаприн, моклобемид, нефазодон, оксафлозан, пибералин, пролинтан, пирисукцидеанол, ритансерин, роксиндол, рубидий хлорид, сульпирид, тандоспирон, тозалинон,тофенацин, толоксатон, транилципромин, L-триптофан, венлафаксин, вилоксазин и зимельдин. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с противогрибковым средством. Подходящие противогрибковые средства включают, но не ограничиваются ими,амфотерицин В, итраконазол, кетоконазол, флуконазол, интратекал, флуцитозин, миконазол, бутоконазол, клотримазол, нистатин, терконазол, тиоконазол, циклопирокс, эконазол, галопрогрин, нафтифин,тербинафин, ундециленат и гризеофульвин. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с противовоспалительным средством. Пригодные противовоспалительные средства включают, но не ограничиваются ими, нестероидные противовоспалительные лекарственные средства, такие как салициловая кислота, ацетилсалициловая кислота, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин,ацетаминофен, индометацин, сулиндак, этодолак, фенамовая кислота, меклофенамат натрия, толметин,кеторолак, диклофенак, ибупрофен, напроксен, напроксен натрия, фенопрофен, кетопрофен, флурбинпрофен, оксапрозин, пироксикам, мелоксикам, ампироксикам, дроксикам, пивоксикам, теноксикам, набуметом, фенилбутазон, оксифенбутазон, антипирин, аминопирин, апазон и нимесулид; антагонисты лейкотриена, включая, но не ограничиваясь ими, зилейтон, ауротиоглюкозу, тиомалат золота-натрия и ауронафин; стероиды, включая, но не ограничиваясь ими, алклометазон дипроприонат, амцинонид, беклометазон дипропионат, бетаметазон, бетаметазон бензоат, бетаметазон дипроприонат, бетаметазон фосфат натрия, бетаметазон валерат, клобетазол проприонат, клокортолон пивалат, гидрокортизон, производные гидрокортизона, дезонид, дезоксиматазон, дексаметазон, флунизолид, флукоксинолид, флурандренолид, галциноцид, медризон, метилпреднизолон, метпреднизолон ацетат, метилпреднизолон сукцинат натрия, мометазон фуроат, параметазон ацетат, преднизолон, преднизолон ацетат, преднизолон фосфат натрия, преднизолон тебуатат, преднизон, триамцинолон, триамцинолон ацетонид, триамцинолон диацетат и триамцинолон гексацетонид; и другие противовоспалительные средства, включая, но не ограничиваясь ими, метотрексат, колхицин, аллопуринол, пробенецид, сулфинпиразон и бензбромарон. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с другим противовирусным средством. Полезные противовирусные средства включают, но не ограничиваются ими, ингибиторы протеазы, ингибиторы обратной нуклеозидтранскриптазы, ингибиторы обратной ненуклеозидтранскриптазы и аналоги нуклеозида. Противовирусные средства включают, но не ограничиваются ими, зидовудин, ацикловир, гангцикловир, видарабин, идоксуридин, трифлуридин, левовирин,вирамидин и рибавирин, а также фоскарнет, амантадин, римантадин, сахинавир, индинавир, ампренавир,лопинавир, ритонавир, -интерфероны, -интерфероны, адефовир, клевадин, энтекавир, плеконарил. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с иммуномодулирующим средством. Иммуномодулирующие средства включают, но не ограничиваются ими,метотрексат, лефлуномид, циклофосфамид, циклоспорин А, микофенолат мофетил, рапамицин (сиролимус), мизорибин, дезоксиспергуалин, брехинар, малононитрилоамиды (например, лефлунамид), модуляторы Т-клеточного рецептора и модуляторы рецептора цитокина, миметики пептида и антитела (например, человеческие, гуманизированные, химерные, моноклональные, поликлональные, фрагменты Fvs,ScFvs, Fab или F(ab)2 или эпитопсвязывающие фрагменты), молекулы нуклеиновой кислоты (например,молекулы антисмысловой нуклеиновой кислоты и тройные спирали), малые молекулы, органические соединения и неорганические соединения. Примеры модуляторов Т-клеточного рецептора включают, но не ограничиваются ими, антитела анти-Т-клеточного рецептора (например, антитела анти-CD4 (например, cM-Т 412 (Boehringer), IDEC-CE9,1 (IDEC и SKB), mAB 4162W94, Orthoclone и OKTcdr4aIDEC-114 (IDEC, CTLA4-иммуноглобулин и модуляторы толл-подобного рецептора (TLR). Примеры модуляторов рецептора цитокина включают, но не ограничиваются ими, растворимые рецепторы цитокина (например, внеклеточный домен рецептора TNF- или его фрагмент, внеклеточный домен рецептора IL- или его фрагмент и внеклеточный домен рецептора IL-6 или его фрагмент), цитокины или их фрагменты (например, интерлейкин IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-15,TNF-, интерферон (IFN)-, IFN-, IFN- и GM-CSF), антитела к рецептору цитокина (например, антитела к рецептору анти-IFN, антитела к рецептору анти-IL-2 (например, Zenapax (Protein Design Labs, антитела к рецептору анти-IL-4, антитела к рецептору анти-IL-6, антитела к рецептору анти-IL-10 и антитела к рецептору анти-IL-12), антитела к цитокину (например, антитела анти-IFN, антитела анти-TNF-,антитела анти-IL-1, антитела анти-IL-6, антитела анти-IL-8 (например, ABX-IL-8 (Abgenix и антитела анти-IL-12). Соединения формулы I по изобретению могут быть введены или составлены в комбинации со средством, которое ингибирует вирусные ферменты, включая, но не ограничиваясь ими, ингибиторы HCV протеазы, такие как BILN 2061, SCH-503034, ITMN-191 или VX-950; и ингибиторы NS5B полимеразы,такие как NM107 (и его пролекарство NM283), R1626, R7078, BILN1941, GSK625433, GILD9128 илиHCV-796. Соединения формулы I по изобретению могут быть введены или составлены в комбинации со средством, которое ингибирует HCV полимеразу, таким как описано в Wu, Curr Drug Targets Infect Disord. 2003, 3(3), 207-19, или в комбинации с соединениями, которые ингибируют функцию геликазы вируса,такими как описанные в Bretner M., et al. Nucleosides Nucleotides Nucleic Acids. 2003, 22(5-8), 1531, или с ингибиторами других специфических мишеней HCV, такими как описанные в Zhang X., IDrugs 2002,5(2), 154-8. Соединения формулы I по изобретению могут быть введены или составлены в комбинации со средством, которое ингибирует репликацию вируса. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с цитокинами. Примеры цитокинов включают, но не ограничиваются ими, интерлейкин-2 (IL-2), интерлейкин-3(IL-3), интерлейкин-4 (IL-4), интерлейкин-5 (IL-5), интерлейкин-6 (IL-6), интерлейкин-7 (IL-7), интерлейкин-9 (IL-9), интерлейкин-10 (IL-10), интерлейкин-12 (IL-12), интерлейкин-15 (IL-15), интерлейкин 18 (IL-18), тромбоцитарный фактор роста (PDGF), эритропоэтин (Еро), эпидермальный фактор роста(EGF), фактор роста фибробластов (FGF), гранулоцит-макрофаг стимулирующий фактор (GM-CSF), гранулоцитарный колониестимулирующий фактор (G-CSF), макрофагальный колониестимулирующий фактор (M-CSF), пролактин и интерферон (IFN), например IFN- и IFN-). Соединения формулы I по изобретению могут быть введены или составлены в комбинации с гормонами. Примеры гормонов включают, но не ограничиваются ими, гормон, высвобождающий лютеинизирующий гормон (LHRH), гормон роста (GH), гормон, высвобождающий гормон роста АСТН, соматостатин, соматотропин, соматомедин, паратгормон, гипоталамические релизинг-факторы, инсулин, глюкагон, энкефалины, вазопрессин, кальцитонин, гепарин, низкомолекулярные гепарины, гепариноиды,синтетические и природные опиоиды, инсулин тиреостимулирующие гормоны и эндорфины. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с-интерферонами, которые включают, но не ограничиваются ими, интерферон -1 а, интерферон -1b. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с-интерферонами, которые включают, но не ограничиваются ими, интерферон -1, интерферон -2 а (роферон), интерферон -2b, интрон, Peg-Intron, Pegasys, консенсусный интерферон (инферген) и альбуферон. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с усилителями абсорбции, в частности, с такими, которые имеют мишенью лимфатическую систему, включая,но не ограничиваясь ими, гликохолат натрия; капринат натрия; N-лаурилD-мальтопиранозид; EDTA; смешанную мицеллу; и они описаны в публикации Muranishi Crit. Rev. Ther. Drug Carrier Syst., 7, 1-33,которая полностью включена в настоящее описание путем ссылки. Также могут быть использованы другие известные усилители абсорбции. Таким образом, изобретение также охватывает фармацевтическую композицию, включающую одно или более соединений формулы I по изобретению и один или более усилителей абсорбции. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с ингибитором цитохроммонооксигеназы Р 450, таким как, без ограничения, ритонавир или его фармацевтически приемлемая соль, сложный эфир и пролекарство, для улучшения фармакокинетики (например, увеличения периода полужизни, увеличения времени достижения максимальной плазменной концентрации,увеличения уровней в крови) соединения формулы I, которое метаболизируется цитохроммонооксигеназой Р 450. Таким образом, изобретение также охватывает фармацевтическую композицию, содержащую соединения формулы I по изобретению и один или более ингибиторов цитохроммонооксигеназы Р 450. Соединения формулы I по изобретению могут быть введены в комбинации с пищей для усиления абсорбции соединений формулы I в желудочно-кишечном тракте и увеличения биодоступности соедине- 16017685 ний формулы I. Соединения формулы I по изобретению могут быть введены или составлены в комбинации с алкилирующим агентом. Примеры алкилирующих агентов включают, но не ограничиваются ими, азотные горчицы, этиленимины, метилмеламины, алкилсульфонаты, нитрозомочевины, триазены, мехлоретамин,циклофосфамид, ифосфамид, мелфалан, хлорамбуцил, гексаметилмелаин, тиотепа, бусульфан, кармустин, стрептозоцин, дакарбазин и темозоломид. Соединения по изобретению и другие терапевтические средства могут действовать аддитивно или более предпочтительно синергически. В одном варианте осуществления композицию, содержащую соединение по изобретению, вводят одновременно с введением другого терапевтического средства, которое может быть частью той же самой композиции или находиться в композиции, отличной от композиции, содержащей соединения по изобретению. В другом варианте осуществления соединение по изобретению вводят до или после введения другого терапевтического средства. В отдельном варианте осуществления соединение по изобретению вводят пациенту, который ранее не подвергался или в настоящее время не подвергается лечению другим терапевтическим средством, в частности противовирусным средством. В одном варианте осуществления способы по изобретению включают введение одного или более соединений формулы I по изобретению без дополнительного терапевтического средства. Фармацевтические композиции и лекарственные формы Фармацевтические композиции и разовые лекарственные формы, содержащие соединение формулыI по изобретению или его фармацевтически приемлемую соль или гидрат, также охватываются настоящим изобретением. Индивидуальные лекарственные формы по изобретению могут быть подходящими для перорального, через слизистую оболочку (включая подъязычное, щечное, ректальное, носовое или вагинальное введение), парентерального (включая подкожное, внутримышечное, болюсным вливанием,внутриартериальное или внутривенное введение), чрескожного или топического введения. Фармацевтические композиции и лекарственные формы по изобретению обычно также включают один или более фармацевтически приемлемых эксципиентов. Также рассматриваются стерильные лекарственные формы. В альтернативном варианте осуществления фармацевтическая композиция, охваченная этим вариантом осуществления, содержит соединение формулы I по изобретению или его фармацевтически приемлемую соль или гидрат и по меньшей мере одно дополнительное терапевтическое средство. Примеры дополнительных терапевтических средств включают, но не ограничиваются ими, таковые, перечисленные выше. Композиция, форма и тип лекарственных форм по изобретению обычно варьируют в зависимости от их использования. Например, лекарственная форма, используемая при лечении острого заболевания или родственного заболевания, может содержать большие количества одного или более активных ингредиентов, чем лекарственная форма, используемая при лечении того же самого заболевания в хронической форме. Аналогично, парентеральная лекарственная форма может содержать меньшие количества одного или более активных ингредиентов, чем пероральная лекарственная форма, используемая для лечения того же самого заболевания или нарушения. Эти и другие отличия, которыми конкретные лекарственные формы, охваченные данным изобретением, отличаются друг от друга, будут очевидны для специалиста в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing,Easton PA (1990). Примеры лекарственных форм включают, но не ограничиваются ими, таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; облатки; пастилки; таблетки для рассасывания; дисперсии; суппозитории; мази; катаплазмы (припарки); пасты; порошки; дрессинги; кремы; пластыри; растворы; повязки; аэрозоли (например, спреи или ингаляторы для носа); гели; жидкие лекарственные формы, подходящие для перорального введения или введения через слизистую оболочку пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа масло-вводе или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; и стерильные твердые частицы (например, кристаллические или аморфные твердые вещества), которые могут быть ресуспендированы с образованием жидких лекарственных форм, подходящих для парентерального введения пациенту. Типичные фармацевтические композиции и лекарственные формы включают один или более носителей, эксципиентов или разбавителей. Подходящие эксципиенты известны специалисту в области фармации, и неограничивающие примеры подходящих эксципиентов приведены в описании. Является ли конкретный эксципиент подходящим для включения в фармацевтическую композицию или лекарственную форму, зависит от различных факторов, известных из уровня техники, включая, без ограничения,путь, которым лекарственную форму будут вводить пациенту. Например, пероральные лекарственные формы, такие как таблетки, могут содержать эксципиенты, не пригодные для использования в парентеральных лекарственных формах. Пригодность конкретного эксципиента может также зависеть от конкретных активных ингредиентов в лекарственной форме. Данное изобретение дополнительно охватывает безводные фармацевтические композиции и лекарственные формы, содержащие активные ингредиенты, так как вода может способствовать разложению- 17017685 некоторых соединений. Например, добавление воды (например, 5%) широко распространено в области фармации в качестве средства моделирования долговременного хранения для определения таких характеристик, как срок хранения или стабильность составов в течение времени. См., например, Carstensen,Drug Stability: PrinciplesPractice, 2nd Ed., Marcel Dekker, NY, NY, 1995, p. 379-80. В действительности,вода и высокая температура ускоряют разложение некоторых соединений. Таким образом, действие воды на состав может иметь большое значение, так как влажность и/или влага обычно присутствует в процессе производства, обращения, упаковки, хранения, отгрузки и использования составов. Безводные фармацевтические композиции и лекарственные формы по изобретению могут быть получены с использованием безводных или содержащих малое количество влаги ингредиентов и условий низкой влажности. Безводная фармацевтическая композиция должна быть получена и сохранена так, чтобы поддерживалась ее безводная природа. Соответственно, безводные композиции предпочтительно упаковывают,используя материалы, известные как предотвращающие воздействие воды, так чтобы они могли быть включены в подходящие упакованные наборы. Примеры подходящей упаковки включают, но не ограничиваются ими, герметично запечатанные упаковки из фольги, пластмассы, контейнеры для разовой дозы(например, ампулы), блистерные упаковки и контурные упаковки. Изобретение также охватывает фармацевтические композиции и лекарственные формы, которые включают одно или более соединений, которые уменьшают скорость распада активного ингредиента. Такие соединения, которые называют в описании "стабилизаторами", включают, но не ограничиваются ими, антиоксиданты, такие как аскорбиновая кислота, буферы pH или солевые буферы. Подобные количества и типы эксципиентов, количества и конкретные типы активных ингредиентов в лекарственной форме могут различаться в зависимости от таких факторов, как, без ограничения, путь введения пациентам. Однако типичные лекарственные формы по изобретению включают соединения формулы I по изобретению или его фармацевтически приемлемую соль или гидрат в количестве от 0,1 до 1500 мг на лекарственную форму, что обеспечивает дозы приблизительно от 0,01 до 200 мг/кг в сутки. Пероральные лекарственные формы. Фармацевтические композиции по изобретению, которые являются подходящими для перорального введения, могут быть представлены как отдельные лекарственные формы, такие как, но не ограничиваясь ими, таблетки (например, жевательные таблетки), каплеты, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат предварительно определенные количества активных ингредиентов и могут быть получены способами, известными специалисту в области фармации. См. для общей информации Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA(1990). Типичные пероральные лекарственные формы по изобретению получают, комбинируя активный ингредиент(ы) в тесной смеси по меньшей мере с одним эксципиентом согласно обычным фармацевтическим методикам компаундирования. Эксципиенты могут иметь широкую разновидность форм в зависимости от формы препарата, желательной для введения. Например, эксципиенты, подходящие для использования в пероральной жидкости или аэрозольных лекарственных формах, включают, но не ограничиваются ими, воду, гликоли, масла, спирты, ароматизирующие средства, консерванты и окрашивающие агенты. Примеры эксципиентов, подходящих для использования в твердых пероральных лекарственных формах (например, порошках, таблетках, капсулах и каплетах), включают, но не ограничиваются ими,крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие средства, лубриканты, связующие и дезинтегрирующие средства. Благодаря легкости введения, таблетки и капсулы представляют собой самые предпочтительные пероральные стандартные лекарственные формы, когда используются твердые эксципиенты. Если желательно, таблетки могут быть покрыты по стандартным методикам нанесения водных или неводных покрытий. Такие лекарственные формы могут быть получены любым из фармацевтических способов. Как правило, фармацевтические композиции и лекарственные формы получают, однородно и тесно смешивая активные ингредиенты с жидкими носителями, тонкодисперсными твердыми носителями или обоими, а затем, в случае необходимости, формируя продукт в желаемую форму. Например, таблетка может быть получена прессованием или литьем под давлением. Прессованные таблетки могут быть получены прессованием в подходящем механизме активных ингредиентов в сыпучей форме, такой как порошок или гранулы, необязательно смешанных с эксципиентом. Отлитые под давлением таблетки могут быть получены отливом в подходящем механизме смеси порошкованного соединения, увлажненного инертным жидким разбавителем. Примеры эксципиентов, которые могут быть использованы в пероральных лекарственных формах по изобретению, включают, но не ограничиваются ими, связующие, наполнители, дезинтеграторы и лубриканты. Связующие, подходящие для использования в фармацевтических композициях и лекарственных формах, включают, но не ограничиваются ими, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические смолы, такие как гуммиарабик, альгинат натрия,альгиновую кислоту, другие альгинаты, порошковый трагакант, гуаровую камедь, целлюлозу и ее производные (например, этилцеллюлозу, ацетилцеллюлозу, кальцийкарбоксиметилцеллюлозу, натрийкарбок- 18017685 симетилцеллюлозу), поливинилпирролидон, метилцеллюлозу, предварительно желатинированный крахмал, гидроксипропилметилцеллюлозу (например,2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси. Примеры наполнителей, подходящих для использования в фармацевтических композициях и лекарственных формах, раскрытых в описании, включают, но не ограничиваются ими, тальк, карбонат кальция(например, гранулы или порошок), микрокристаллическую целлюлозу, порошковую целлюлозу, декстраты, каолин, маннит, кремневую кислоту, сорбит, крахмал, предварительно желатинированный крахмал и их смеси. Связующее или наполнитель в фармацевтических композициях по изобретению обычно присутствует в количестве от приблизительно 50 до приблизительно 99 вес.% от массы фармацевтической композиции или лекарственные формы. Подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются ими, материалы, выпускаемые как AVICEL-PH-101, AVICEL-PH-103 AVICEL RC-581, AVICEL-PH-105 (доступные от FMC Corporation, American Viscose Division, Avicel Sales, Marcus Hook, PA) и их смеси. Конкретным связующим является смесь микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы, выпускаемая как AVICEL RC-581. Подходящие безводные или с низкой влажностью эксципиенты или добавки включают AVICEL-PH-103 и Starch 1500 LM. Дезинтеграторы используются в композициях по изобретению для получения таблеток, которые распадаются под действием водной среды. Таблетки, которые содержат слишком много дезинтеграторов,могут распадаться при хранении, в то время как таблетки, которые содержат слишком мало дезинтеграторов, могут не распадаться в желаемой степени или в желаемых условиях. Таким образом, для получения твердых пероральных лекарственных форм по изобретению нужно использовать достаточное количество дезинтеграторов, которое не является ни слишком большим, ни слишком маленьким для правильного высвобождения активных ингредиентов. Количество используемых дезинтеграторов варьирует в зависимости от типа состава и может быть легко определено специалистом. Типичные фармацевтические композиции содержат от приблизительно 0,5 до приблизительно 15 вес.% дезинтеграторов, в частности от приблизительно 1 до приблизительно 5 вес.% дезинтеграторов. Дезинтеграторы, которые могут быть использованы в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничиваются ими, агар-агар, альгиновую кислоту,карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия, натриевый гликолят крахмала, картофельный крахмал или крахмал тапиоки, предварительно желатинированный крахмал, другие крахмалы, глины, другие альгины, другую целлюлозу, смолы и их смеси. Лубриканты, которые могут быть использованы в фармацевтических композициях и лекарственных формах по изобретению, включают, но не ограничиваются ими, стеарат кальция, стеарат магния, минеральное масло, легкое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, стеариновую кислоту, лаурилсульфат натрия, тальк, гидрированное растительное масло (например,арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, этилолеат, этиллаурат, агар-агар и их смеси. Дополнительные лубриканты включают, например, силоидный силикагель (AEROSIL 200, производства W.R. Grace Co.,of Baltimore, MD), коагулированный аэрозоль синтетического диоксида кремния (выпускаемый DegussaCo., of Piano, TX), CAB-O-SIL (пирогенный диоксид кремния, выпускаемый Cabot Co., of Boston, MA) и их смеси. Если они используются, лубриканты обычно используются в количестве менее чем приблизительно 1 вес.% от массы фармацевтических композиций или лекарственных форм, в которые они включены. Лекарственные формы замедленного высвобождения. Активные ингредиенты по изобретению могут быть введены средствами контролируемого высвобождения или устройствами для доставки, которые являются известными специалисту. Примеры включают, но не ограничиваются ими, описанные в патентах США 3845770, 3916899, 3536809, 3598123,4008719, 5674533, 5059595, 5591767, 5120548, 5073543, 5639476, 5354556 и 5733566, каждый из которых включен в настоящее описание путем ссылки. Такие лекарственные формы могут быть использованы для обеспечения замедленного или контролируемого высвобождения одного или более активных ингредиентов с использованием, например, гидропропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосом, микросфер или их комбинаций, чтобы обеспечить желаемый профиль высвобождения в варьирующих соотношениях. Подходящие составы с контролируемым высвобождением, известные специалисту, включая раскрытые в описании, могут быть легко выбраны для использования с активными ингредиентами по изобретению. Изобретение, таким образом, охватывает разовые лекарственные формы, подходящие для перорального введения, такие как, но не ограничиваясь ими, таблетки, капсулы, гелевые капсулы и каплеты,адаптированные для контролируемого высвобождения. Все фармацевтические продукты с контролируемым высвобождением имеют общую цель улучшения лекарственной терапии по сравнению с достигаемой терапией их неконтролируемыми аналогами. Предпочтительно использование оптимально разработанного препарата с контролируемым высвобожде- 19017685 нием для лечения характеризуется использованием минимального количества лекарственного средства для лечения или контроля состояния за минимальное время. Преимущества составов с контролируемым высвобождением включают увеличенную активность лекарственного средства, сниженную частоту введения и увеличенную комплаентность со стороны пациента. Кроме того, составы с контролируемым высвобождением могут быть использованы для изменения времени начала действия или других характеристик, таких как уровни лекарственного средства в крови, и могут, таким образом, воздействовать на частоту побочных (например, неблагоприятных) эффектов. Большинство составов с контролируемым высвобождением разработаны таким образом, что первоначально высвобождают количество лекарственного средства (активного ингредиента), которое быстро производит желаемый терапевтический эффект, и постепенно и непрерывно высвобождают другие количества лекарственного средства, чтобы поддерживать этот уровень терапевтического или профилактического эффекта в течение расширенного промежутка времени. Чтобы поддерживать этот постоянный уровень лекарственного средства в организме, лекарственное средство должно высвобождаться из лекарственных форм с такой скоростью, которая обеспечивает восполнение количества лекарственного средства, метаболизируемого и выводимого из организма. Контролируемое высвобождение активного ингредиента можно стимулировать различными условиями, включая, но не ограничиваясь ими, pH, температуру,ферменты, воду, или другими физиологическими условиями или соединениями. Парентеральные лекарственные формы. Парентеральные лекарственные формы можно вводить пациентам различными путями, включая, но не ограничиваясь ими, подкожный, внутривенный (включая болюсное вливание), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит естественную защиту пациентов от загрязнителей, парентеральные лекарственные формы предпочтительно являются стерильными или могут быть стерилизованы перед введением пациенту. Примеры парентеральных лекарственных форм включают, но не ограничиваются ими, готовые растворы для инъекции, сухие и/или лиофилизованные продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции (порошки для восстановления), готовые для инъекции суспензии и эмульсии. Подходящие носители, которые могут быть использованы для получения парентеральных лекарственных форм по изобретению, известны специалисту. Примеры включают, но не ограничиваются ими,воду для инъекции USP; водные носители, такие как, без ограничения, раствор хлорида натрия для инъекций, раствор Рингера для инъекции, раствор декстрозы для инъекции, раствор декстрозы и хлорида натрия для инъекций и лактат-содержащий раствор Рингера для инъекций; смешиваемые с водой носители, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. Соединения, которые увеличивают растворимость одного или более активных ингредиентов, раскрытых в описании, могут также быть включены в парентеральные лекарственные формы по изобретению. Трансдермальные лекарственные формы. Трансдермальные лекарственные формы включают "резервуарный тип" или "матриксный тип" пластыря, которые могут быть нанесены на кожу для ношения в течение определенного промежутка времени, достаточного, чтобы обеспечить проникновение желаемого количества активных ингредиентов. Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут быть использованы для получения трансдермальных и топических лекарственных форм, охваченные данным изобретением, известны специалисту в области фармации и зависят от конкретной ткани, на которую будет нанесена данная фармацевтическая композиция или лекарственная форма. В этой связи типичные эксципиенты включают, но не ограничиваются ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, подлежащей обработке, дополнительные компоненты могут быть использованы до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, усилители проникновения могут быть использованы, чтобы помочь доставке активных ингредиентов к ткани. Подходящие усилители проникновения включают, но не ограничиваются ими, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; марки Коллидона (Повидон, Поливидон); мочевину; и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как Tween 80 (полисорбат 80) и Span 60 (моностеарат сорбитана). Величина pH фармацевтической композиции, или лекарственной формы, или ткани, на которую нанесена фармацевтическая композиция или лекарственная форма, может также быть отрегулирована для улучшения доставки одного или более активных ингредиентов. Аналогично, полярность растворителя,используемого в качестве носителя, его ионная сила или тоничность могут быть отрегулированы для улучшения доставки. Такие соединения, как стеараты, могут также быть добавлены к фармацевтическим композициям или лекарственным формам, чтобы предпочтительным образом изменить гидрофильность- 20017685 или липофильность одного или более активных ингредиентов для улучшения доставки. В этом отношении стеараты могут служить липидным носителем для состава, эмульгатором или поверхностноактивным веществом, а также как усиливающим доставку или усиливающим проникновение средством. Различные соли, гидраты или сольваты активных ингредиентов могут быть использованы для дополнительного изменения свойств полученной композиции. Топические лекарственные формы. Топические лекарственные формы по изобретению включают, но не ограничиваются ими, кремы,лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалисту. См.,например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) и Introductionto Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут быть использованы для получения трансдермальных и топических лекарственных форм, охваченных данным изобретением, известны специалисту в области фармации и зависят от конкретной ткани, на которую будет нанесена данная фармацевтическая композиция или лекарственная форма. В этом отношении типичные эксципиенты включают, но не ограничиваются ими, воду, ацетон, этанол, этиленгликоль,пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси. В зависимости от конкретной ткани, подлежащей обработке, дополнительные компоненты можно использовать до, в сочетании с или после обработки активными ингредиентами по изобретению. Например, усилители проникновения можно использовать, чтобы помочь доставке активных ингредиентов к ткани. Подходящие усилители проникновения включают, но не ограничиваются ими, ацетон; различные спирты, такие как этанол, олеил и тетрагидрофурил; алкилсульфоксиды, такие как диметилсульфоксид; диметилацетамид; диметилформамид; полиэтиленгликоль; пирролидоны, такие как поливинилпирролидон; марки Коллидона (Повидон, Поливидон); мочевину; и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как Tween 80 (полисорбат 80) и Span 60 (моностеарат сорбитана). Лекарственные формы для введения через слизистую оболочку. Лекарственные формы для введения через слизистую оболочку по изобретению включают, но не ограничиваются ими, глазные растворы, спреи и аэрозоли или другие формы, известные специалисту. См., например, Remington's Pharmaceutical Sciences, 18th eds., Mack Publishing, Easton PA (1990) иIntroduction to Pharmaceutical Dosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Лекарственные формы, подходящие для лечения тканей слизистой оболочки в пределах полости рта, могут быть составлены в форме жидкостей для полоскания рта или в форме гелей для полости рта. В одном варианте осуществления аэрозоль включает носитель. В другом варианте осуществления аэрозоль не содержит носитель. Соединения формулы I по изобретению можно также вводить непосредственно в легкое с помощью ингаляции. Для введения ингаляцией соединение формулы I может быть доставлено в легкое с использованием множества различных устройств. Например, для доставки соединения формулы I непосредственно в легкое может быть использован ингалятор с отмеренными дозами ("MDI"), в котором используют контейнеры, содержащие подходящий пропеллент с низкой температурой кипения, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. Устройства MDI доступны от множества поставщиков, таких как 3 М Corporation, Aventis, BoehringerIngelheim, Forest Laboratories, Glaxo-Wellcome, Schering Plough и Vectura. Альтернативно, для доставки соединения формулы I в легкое может быть использовано такое устройство, как сухой порошковый ингалятор (DPI) (см., например, Raleigh et al., Proc. Amer. Assoc. CancerResearch Annual Meeting, 1999, 40, 397, который включен в настоящее описание путем ссылки). В устройствах DPI обычно используют такой механизм, как взрыв газа, для того, чтобы создать в контейнере облако сухого порошка, которое пациент может тогда вдохнуть. Устройства DPI также известны из уровня техники и могут быть приобретены у множества поставщиков, которые включают, например, Fisons,Glaxo-Wellcome, Inhale Therapeutic Systems, ML Laboratories, Qdose и Vectura. Популярным вариантом является многодозовая система DPI ("MDDPI"), которая обеспечивает доставку более чем одной терапевтической дозы. Устройства MDDPI доступны от таких компаний, как AstraZeneca, Glaxo Wellcome,IVAX, Schering Plough, SkyePharma и Vectura. Например, могут быть получены желатиновые капсулы и картриджи для использования в ингаляторе или инсуффляторе, содержащие порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал для этих систем. Другой тип устройства, которое может быть использовано для доставки соединения формулы I в легкое, представляет собой устройство с жидким спреем, например, от Aradigm Corporation. В системах с жидким спреем используют форсунки с очень маленькими порами для распыления в виде аэрозоля жидких составов лекарственного средства, которые можно тогда непосредственно вдохнуть в легкое. В одном варианте осуществления для доставки соединения формулы I в легкое используется небулайзер. Небулайзеры создают аэрозоли из жидких составов лекарственного средства за счет использования, например, ультразвуковой энергии, образуя тонкие частицы, которые можно легко вдохнуть (см. например, Verschoyle et al., British J. Cancer, 1999, 80, Suppl 2, 96, который включен в настоящее описа- 21017685 ние путем ссылки). Примеры небулайзеров включают устройства, поставляемые Sheffield/SystemicPulmonary Delivery Ltd. (см., Armer et al., патент США 5954047; van der Linden et al., патент США 5950619; van der Linden et al., патент США 5970974, которые включены в настоящее описание путем ссылки), Aventis и Batelle Pulmonary Therapeutics. В одном варианте осуществления для доставки соединения формулы I в легкое используется электрогидродинамическое аэрозольное устройство ("EHD"). В аэрозольном устройстве EHD используют электрическую энергию для распыления в форме аэрозоля жидких растворов или суспензий, лекарственного средства (см., например, Noakes et al., патент США 4765539; Coffee, патент США 4962885;Coffee, заявка РСТ, WO 94/12285; Coffee, заявка РСТ, WO 94/14543; Coffee, заявка РСТ, WO 95/26234,Coffee, заявка РСТ, WO 95/26235, Coffee, заявка РСТ, WO 95/32807, которые включены в настоящее описание путем ссылки). Электрохимические свойства состава соединений формулы I могут быть важными параметрами оптимизации при доставке этого лекарственного средства в легкое с помощью аэрозольного устройства EHD, и такая оптимизация выполняется специалистом рутинным образом. Аэрозольные устройства EHD могут более эффективно доставлять лекарственные средства в легкое, чем существующие технологии легочной доставки. Другие способы интрапульмонарной доставки соединений формулыI известны специалисту и входят в объем изобретения. Жидкие составы лекарственного средства, подходящие для использования с небулайзером, и устройствами с жидким спреем, и аэрозольными устройствами EHD, обычно включают соединение формулы I с фармацевтически приемлемым носителем. Предпочтительно фармацевтически приемлемый носитель является жидким, таким как спирт, вода, полиэтиленгликоль или перфторуглеводород. Необязательно, другой материал может быть добавлен для изменения аэрозольных свойств раствора или суспензии соединения формулы I. Предпочтительно этот материал представляет собой жидкость, такую как спирт, гликоль, полигликоль или жирная кислота. Другие способы составления жидких растворов или суспензий лекарственного средства, подходящих для использования в аэрозольных устройствах, известны специалисту (см., например, Biesalski, патент США 5112598; Biesalski, патент США 5556611, которые включены в настоящее описание путем ссылки). Соединение формулы I может также быть составлено в ректальные или влагалищные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. В дополнение к составам, описанным выше, соединение формулы I может также быть составлено в форме препарата депо. Такие составы длительного действия могут быть введены путем имплантации(например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например,соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в форме эмульсии в приемлемом масле), или ионоообменными смолами, или как умеренно растворимые производные, например как умеренно растворимая соль. Альтернативно, могут быть использованы другие фармацевтические системы доставки. Липосомы и эмульсии являются известными примерами носителей для доставки, которые можно использовать для доставки соединений формулы I. Могут также быть использованы некоторые органические растворители, такие как диметилсульфоксид, хотя обычно ценой повышения токсичности. Соединение формулы I может также быть доставлено в системе с контролируемым высвобождением. В одном варианте осуществления может использоваться насос (Sefton, CRC Crit. Ref Biomed Eng., 1987, 14, 201; Buchwald et al.,Surgery, 1980, 88, 507; Saudek et al., N Engl. J. Med., 1989, 321, 574). В другом варианте осуществления могут использоваться полимерные материалы (см. Medical Applications of Controlled Release, Langer andMacromol. Chem., 1983, 23, 61; см. также Levy et al., Science, 1985, 228, 190; During et al., Ann. Neurol.,1989, 25, 351; Howard et al., J. Neurosurg., 71, 105 (1989). В еще одном варианте осуществления система с контролируемым высвобождением может быть помещена вблизи мишени соединений по изобретению,например легкого, таким образом требуя только фракции системной дозы (см., например, Goodson, inMedical Applications of Controlled Release, supra, vol. 2, p. 115 (1984. Может быть использована другая система с контролируемым высвобождением (см., например, Langer, Science, 1990, 249, 1527). Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые могут быть использованы для получения лекарственных форм для введения через слизистую оболочку, рассматриваемые в соответствии с данным изобретением, известны специалисту и зависят от конкретного участка или способа, которым будет введена данная фармацевтическая композиция или лекарственная форма. В этой связи типичные эксципиенты включают, но не ограничиваются ими, воду, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, которые являются нетоксичными и фармацевтически приемлемыми. Примеры таких дополнительных ингредиентов известны из уровня техники. См., например, Remington's PharmaceuticalSciences, 18th eds., Mack Publishing, Easton PA (1990). Величина pH фармацевтической композиции, или лекарственной формы, или ткани, на которую нанесена фармацевтическая композиция или лекарственная форма, может также быть отрегулирована для улучшения доставки одного или более активных ингредиентов. Аналогично, полярность растворителя,- 22017685 используемого в качестве носителя, его ионная сила или тоничность могут быть отрегулированы для улучшения доставки. Такие соединения, как стеараты, могут также быть добавлены к фармацевтическим композициям или лекарственным формам, чтобы предпочтительным образом изменить гидрофильность или липофильность одного или более активных ингредиентов для улучшения доставки. В этом отношении, стеараты могут служить липидным носителем для состава, эмульгатором или поверхностноактивным веществом, а также как усиливающим доставку или усиливающим проникновение средством. Различные соли, гидраты или сольваты активных ингредиентов могут быть использованы для дополнительного изменения свойств полученной композиции. Наборы. Изобретение относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих соединение формулы I, пригодное для лечения или профилактики инфекции вируса гепатита C. В других вариантах осуществления изобретение относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих соединение формулы I, пригодное для лечения или профилактики инфекции вируса гепатита C, и один или более контейнеров, содержащих дополнительное терапевтическое средство, включая, но не ограничиваясь ими, перечисленные выше, в частности противовирусное средство, интерферон, средство, которое ингибирует ферменты вируса, или средство, которое ингибирует репликацию вируса, предпочтительно дополнительное терапевтическое средство является HCV-специфичным или демонстрирует анти-HCV активность. Изобретение также относится к фармацевтической упаковке или набору, включающему один или более контейнеров, содержащих один или более ингредиентов фармацевтических композиций по изобретению. Необязательно, к такому контейнеру (контейнерам) может быть приложено уведомление в форме,предписанной правительственным органом, регулирующим производство, использование или продажу фармацевтических средств или биологических продуктов, в котором отражено одобрение указанным органом производства, использования или продажи для введения человеку. Средства по изобретению могут быть получены с использованием путей реакции и схем синтеза,описанных ниже, с использованием общих методик, известных из уровня техники, с использованием исходных веществ, которые являются легко доступными. Синтез не проиллюстрированных соединений согласно изобретению может быть успешно осуществлен с помощью модификаций, очевидных для специалиста, например соответствующей защитой интерферирующих групп, заменой на другие подходящие реагенты, известные из уровня техники, или обычными модификациями реакционных условий. Альтернативно, другие реакции, раскрытые в описании или известные из уровня техники, могут быть признаны применимыми для получения других соединений по изобретению. Получение соединений. На схемах синтеза, описанных ниже, если не указано иное, все температуры указаны в градусах Цельсия и все части и проценты являются весовыми. Реагенты были приобретены у коммерческих поставщиков, таких как Aldrich Chemical Company или Lancaster Synthesis Ltd., и использовались без дополнительной очистки, если не указано иное. Все растворители были приобретены у коммерческих поставщиков, таких как Aldrich, EMD Chemicals илиFisher, и использовались в том виде, как они были получены. Реакции, показанные ниже, обычно осуществляли при давлении аргона или азота выше атмосферного, при температуре окружающей среды (если не указано иное), в безводных растворителях, и реакционные колбы были оснащены резиновыми перегородками для введения субстратов и реагентов через шприц. Стеклянную посуду высушивали в сушильном шкафу и/или высушивали воздействием высокой температуры. Реакции тестировали ТСХ и/или анализировали LC-MS или ВЭЖХ и завершали на основании оценки расхода исходного вещества. Аналитическую тонкослойную хроматографию (ТСХ) осуществляли на стеклянных планшетах, предварительно покрытых силикагелем 60 F254 0,25 мм (EMD Chemicals), и визуализировали с использованием УФ (254 нм) и/или йода на силикагеле и/или нагревания с окрашиванием для ТСХ, таким как окрашивание раствором фосфорно-молибденовой кислоты в этаноле, раствором нингидрина, раствором перманганата калия или раствором сульфата церия. Препаративную тонкослойную хроматографию (препТСХ) осуществляли на стеклянных планшетах, предварительно покрытых силикагелем 60 F254 0,5 мм (2020 см, от Thomson Instrument Company), и визуализировали с использованием УФ (254 нм). Обработку обычно осуществляли удвоением объема реакции с помощью реакционного растворителя или экстракционного растворителя и затем промывкой обозначенными водными растворами, используя 25 об.% экстракционного объема, если не указано иное. Растворы продукта высушивали над безводным Na2SO4 и/или MgSO4 до фильтрования и выпаривания растворителей при пониженном давлении на роторном испарителе и отмечали после удаления растворителей в вакууме. Колоночную хроматографию осуществляли под давлением выше атмосферного, используя силикагель Merck 60, 230-400 меш или 50200 меш нейтрального оксида алюминия, ISCO флэш-хроматографию с использованием предварительно заполненных колонок с силикагелем RediSep или флэш-хроматографию Analogix с использованием предварительно заполненных колонок с силикагелем SuperFlash. Гидрогенолиз осуществляли при давле- 23017685 нии, указанном в примерах, или при давлении окружающей атмосферы. Спектры 1 Н-ЯМР и 13 С-ЯМР регистрировали на приборе Varian Mercury-VX400, эксплуатируемом при 400 МГц. Спектры ЯМР получали как растворы CDCl3 (представлены в м.д.), используя хлороформ в качестве исходного эталона (7,27 м.д. для протона и 77,00 м.д. для углерода), CD3OD (3,4 и 4,8 м.д. для протонов и 49,3 м.д. для углерода), ДМСО-d6 (2,49 м.д. для протона), или внутренний тетраметилсилановый стандарт (0,00 м.д.), если применимо. Другие растворители ЯМР использовали в случае необходимости. Когда указаны пиковые мультиплетности, используются следующие сокращения: с (синглет), д(дублет), т (триплет), кв (квартет), м (мультиплет), уш. (уширенный), уш.с (уширенный синглет), дд (дублет дублетов), дт (дублет триплетов). Константы сочетания, когда они указаны, даны в герцах (Гц). Инфракрасные спектры (ИК) регистрировали на спектрометре ATR FT-IR как беспримесные масла или твердые частицы и, когда они указаны, даны в числе волн (см-1). Масс-спектры указаны как (+)-ES или APCI (+) LC/MS, проводимый Analytical Chemistry Department of Anadys Pharmaceuticals, Inc. Элементные исследования проводили Atlantic Microlab, Inc. в Norcross, GA. Температуру плавления (Т.пл.) определяли на открытом капиллярном приборе и не корректировали. Энантиомерный избыток (э.и.) определяли ВЭЖХ-анализом, используя Chiralpak (ChiralAS-RH, 2,1150 мм, 5 мкм: разделение ВЭЖХ по бинарному градиенту. Растворитель А: 0,1% муравьиной кислоты в воде. Растворитель В: 0,1% муравьиной кислоты в ацетонитриле. Введенные 10 мкл образца растворяли в 50% метанола-50% воды [0,1 мг/мл].AS-RH, 4,6250 мм, 5 мкм: разделение ВЭЖХ по бинарному градиенту. Растворитель А: 0,05% TFA в воде. Растворитель В: 0,05% TFA в ацетонитриле. Введенные 3-5 мкл образца растворяли в ацетонитриле [1 мг/мл]. В описанных путях синтеза и экспериментальных процедурах используют много общих химических сокращений: 2,2-DMP - 2,2-диметоксипропан,Ac - ацетил,AGN - ацетонитрил,Bn - бензил,BnOH - бензиловый спирт,Boc - трет-бутоксикарбонил,BOC2O - ди-трет-бутилдикарбонат,Bz - бензоил,CSI - хлорсульфонилизоцианат,DBU - 1,8-диазабицикло[5.4.0]ундец-7-ен,DCC - N,N'-дициклогексилкарбодиимид,DCE - 1,2-дихлорэтан,DCM - дихлорметан,DEAD - диэтилазодикарбоксилат,DIEA - диизопропилэтиламин,DMA - N,N-диметилацетамид,DMAP - 4-(N,N-диметиламино)пиридин,ДМФА - N,N-диметилформамид,ДМСО - диметилсульфоксид,EDC - гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида,- 24017685Et - этил,EtOAc - этилацетат,EtOH - этанол,HATU - гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония,HBTU - гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония,HF - фторид водорода,НОАс - уксусная кислота,НОВТ - 1-гидроксибензотриазол, гидрат,ВЭЖХ - высокоэффективная жидкостная хроматография,IPA - изопропиловый спирт,KHMDS - бис-(триметилсилил)амид калия,KN(TMS)2 - бис-(триметилсилил)амид калия,KOtBu - трет-бутоксид калия,LDA - литий диизопропиламин,MCPBA - 3-хлорпербензойная кислота,Me - метил,MeCN - ацетонитрил,МеОН - метанол,NaBH(OAc)3 - триацетоксиборгидрид натрия,NaCNBH3 - цианоборгидрид натрия,NaH - гидрид натрия,NaN(TMS)2 - бис-(триметилсилил)амид натрия,NaOAc - ацетат натрия,NaOEt - этоксид натрия,Phe - фенилаланин,PPTS - п-толуолсульфонат пиридиния,PS - полимер на подложке,Py - пиридин,руВОР - (гексафторфосфат бензотриазол-1-илокси)трипирролидинофосфония,TEA - триэтиламин,TFA - трифторуксусная кислота,TFAA - ангидрид трифторуксусной кислоты,ТГФ - тетрагидрофуран,ТХС - тонкослойная хроматография,Tol - толуоил,Val - валин и т.п. На схеме 1 представлена общая методика, которая может быть использована для получения насыщенных соединений 5,6-дигидро-1 Н-пиридин-2-она формулы I. Схема 1- 25017685 Насыщенные циклические промежуточные соединения эфира N-замещеннойаминокислоты, которые могут быть получены одним из способов, описанных на схемах 3, 4, 6, 7 или 8, могут быть конденсированы с промежуточной карбоновой кислотой (или ее солью, например натриевой солью) с использованием стандартных условий пептидного сочетания, используемых для образования амидных связей,таких как DCC, с получением показанного амида. Это промежуточное соединение может быть циклизовано, с выделением или без него, в присутствии основания (например, триэтиламина) с получением желаемых насыщенных соединений 5,6-дигидро-1 Н-пиридин-2-она. На схеме 2 представлена общая методика, которая может быть использована для получения ненасыщенных соединений 5,6-дигидро-1 Н-пиридин-2-она формулы I. Схема 2 Ненасыщенные циклические промежуточные соединения эфира N-замещеннойаминокислоты(где R имеет значения, определенные на схеме 1), которые могут быть получены одним из способов,описанных на схемах 5 или 9, могут быть конденсированы с промежуточной карбоновой кислотой (или ее солью, например натриевой солью) с использованием стандартных условий пептидного сочетания,используемых для образования амидных связей, таких как DCC, с получением показанного амида. Это промежуточное соединение может быть циклизовано, с выделением или без него, в присутствии основания (например, триэтиламина) с получением желаемых ненасыщенных соединений 5,6-дигидро-1 Нпиридин-2-она. На схеме 3 представлена общая методика, которая может быть использована для получения насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты из насыщенных ангидридов. Схема 3 Коммерчески доступные насыщенные циклические мезоангидриды могут быть десимметризованы с помощью ферментов или хиральных реагентов, таких как алкалоиды хинной коры (например, хинин или хинидин), как описано в литературе, с получением оптически активных насыщенных циклических моноэфиров дикарбоновой кислоты (с R, определенным на схеме 1). См. J. Org. Chem., 65, 6984-6991 (2000);Synthesis, 11, 1719-1730 (2001) и указанные там ссылки. Эти промежуточные соединения могут быть далее переработаны в защищенные оптически активные эфиры насыщенной циклической -аминокислоты (например, Cbz-защищенные) реакцией перегруппировки, такой как (показанная) перегруппировка Курциуса (Curtius) или разложение по Гофману(Hofmann). Гидрирование защищенных насыщенных циклических эфиров -аминокислоты в нормальных условиях может быть использовано для удаления защитной группы и получения оптически активных насыщенных циклических эфиров -аминокислоты, которые могут быть выделены (и использованы) либо в форме свободных оснований, либо как их соответствующие соли. Оптически активные эфиры насыщенной циклической -аминокислоты (или их соли) могут затем быть обработаны альдегидами или кетонами, где Rx и Rw независимо обозначают C1-C5-алкил, C3-C8-циклоалкил, -C1-C5-алкилен(C3-C8 циклоалкил), -C1-C5-алкилен(арил), -C1-C5-алкилен(гетероциклил), арил или гетероциклил, или Rw может вместе с Rx образовывать 3-8-членное кольцо, в присутствии восстановителя (такого как цианоборгидрид натрия) с получением желаемых оптически активных насыщенных циклических эфиров N-замещенной-аминокислоты. Альтернативно, последовательность реакций, описанная выше, может быть выполнена без ферментов или хиральных реагентов, приводя к соответствующим ахиральным промежуточным соединениям и продуктам. На схеме 4 представлена общая методика, которая может быть использована для получения насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты из ненасыщенных ангидридов. Схема 4 Коммерчески доступные ненасыщенные циклические мезоангидриды могут быть десимметризованы, как описано выше (схема 3), с получением оптически активных ненасыщенных циклических моноэфиров дикарбоновой кислоты (с R, определенным на схеме 1). Эти промежуточные соединения могут быть далее переработаны в защищенные оптически активные ненасыщенные циклические эфиры аминокислоты (например, Cbz-защищенные) реакцией перегруппировки, такой как (показанная) перегруппировка Курциуса (Curtius) или разложение по Гофману (Hofmann). Гидрирование защищенных оптически активных ненасыщенных циклических эфиров -аминокислоты в стандартных условиях удаляет защитную группу и восстанавливает олефин, приводя к оптически активным насыщенным циклическим эфирам -аминокислоты, которые могут быть выделены (и использованы) либо в форме свободных оснований, либо как их соответствующие соли. Оптически активные насыщенные циклические эфиры -аминокислоты (или их соли) могут затем быть обработаны альдегидами или кетонами (где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя (такого как цианоборгидрид натрия) с получением желаемых оптически активных насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты. Альтернативно, последовательность реакций, описанная выше, может быть выполнена без ферментов или хиральных реагентов, приводя к соответствующим ахиральным промежуточным соединениям и продуктам. На схеме 5 представлена общая методика, которая может быть использована для получения ненасыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты из ненасыщенных ангидридов. Коммерчески доступные ненасыщенные циклические мезоангидриды могут быть десимметризованы, как описано выше (схема 4), с получением оптически активных ненасыщенных циклических моноэфиров дикарбоновой кислоты (с R, определенным на схеме 1). Эти промежуточные соединения могут быть далее переработаны в защищенные оптически активные ненасыщенные циклические эфиры-аминокислоты (например, Вос-защищенные) реакцией перегруппировки, такой как (показанная) перегруппировка Курциуса (Curtius) или разложение по Гофману (Hofmann). Защитная группа Boc может быть затем селективно удалена в присутствии олефина с получением, таким образом, оптически активных ненасыщенных циклических промежуточных эфиров -аминокислоты, которые могут быть выделены (и использованы) либо в форме солей, либо в форме соответствующих свободных оснований. Оптически активные ненасыщенные циклические эфиры -аминокислоты (или их соли) могут затем быть обработаны альдегидами или кетонами (где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя (такого как цианоборгидрид натрия) с получением желаемых оптически активных ненасыщенных циклических промежуточных соединений эфира N-замещенной-аминокислоты. Альтернативно, последовательность реакций, описанная выше, может быть выполнена без ферментов или хиральных реагентов, приводя к соответствующим ахиральным промежуточным соединениям и продуктам. На схеме 6 представлена альтернативная общая методика, которая может быть использована для получения насыщенных циклических промежуточных соединений эфира N-замещенной-аминокислоты. Схема 6 Бициклические олефины, такие как норборнен, могут быть подвергнуты взаимодействию с хлорсульфонилизоцианатом с получением показанных -лактамов. Эти промежуточные соединения могут быть гидролизованы в присутствии сильной кислоты (такой как соляная кислота) с получением насыщенных циклических -аминокислот (или их солей), которые могут быть затем переработаны в соответствующие сложные эфиры с использованием стандартных условий (с R, определенным на схеме 1). Насыщенные циклические эфиры -аминокислоты могут затем быть обработаны альдегидами или кетонами(где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя, такого как цианоборгидрид натрия, с получением желаемых насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты. На схеме 7 представлена общая схема, описывающая способ, который может быть использован для разделения ди-экзо-энантиомеров диастереомерной кристаллизацией. Рацемические ди-экзо-производные эфира -аминокислоты, полученные из норборнена, как описано выше, могут быть разделены путем образования диастереомерной соли с оптически чистой кислотой,такой как (1S)-(+)-10-камфорсульфоновая кислота. Производные эфира (1R,2R,3S,4S)аминокислоты образуют кристаллическую соль с (1S)-(+)-10-камфорсульфоновой кислотой, которая может быть селективно выделена фильтрованием из подходящего растворителя (например, этилацетата) и обработана основанием, таким как карбонат натрия, с получением свободных энантиомерно чистых циклических эфиров (1R,2R,3S,4S)аминокислоты. Оптически чистые циклические эфиры (1R,2R,3S,4S)-аминокислоты (или их соли) могут затем быть обработаны альдегидами или кетонами (где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя, такого как цианоборгидрид натрия, с получением желаемых оптически чистых насыщенных циклических промежуточных соединений эфираN-замещенной-(1R,2R,3S,4S)аминокислоты. На схеме 8 представлена альтернативная методика, которая может быть использована для получения энантиомерно чистых насыщенных циклических промежуточных соединений эфира N-замещенной-аминокислоты. Схема 8-Лактам (полученный, как описано на схеме 6) может быть раскрыт и разделен путем образования диастереомерной соли с оптически чистой кислотой, такой как (1S)-(+)-10-камфорсульфоновая кислота(как описано на схеме 7), в присутствии спирта (например, этанола) с непосредственным получением диастереомерно чистого эфира (1R,2R,3S,4S)аминокислоты в форме соли с (1S)-(+)-10 камфорсульфоновой кислотой. Обработка основанием, таким как карбонат калия, с последующим восстановительным алкилированием альдегидами или кетонами (где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя, такого как цианоборгидрид натрия, приводит к желаемым энантиомерно чистым насыщенным циклическим промежуточным соединениям эфира N-замещенной(1R,2R,3S,4S)аминокислоты. На схеме 9 представлена общая методика, которая может быть использована для получения насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты. Схема 9 Насыщенные циклические эфиры -аминокислоты (или их соли, с R, определенным на схеме 1) могут быть приобретены, получены из соответствующих коммерчески доступных насыщенных циклических -аминокислот или могут быть получены способами, описанными на схемах 3, 4, 6 или 7. Насыщенные циклические эфиры -аминокислоты могут затем быть обработаны альдегидами или кетонами(где Rx и Rw имеют значения, определенные на схеме 3) в присутствии восстановителя, такого как цианоборгидрид натрия, с получением желаемых насыщенных циклических промежуточных соединений эфира N-замещеннойаминокислоты. В каждом случае насыщенные циклические эфиры -аминокислоты или желаемые насыщенные циклические промежуточные соединения эфира N-замещенной 29
МПК / Метки
МПК: A01N 43/66
Метки: соединения, 5,6-дигидро-1н-пиридин-2-она
Код ссылки
<a href="https://eas.patents.su/30-17685-soedineniya-56-digidro-1n-piridin-2-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения 5,6-дигидро-1н-пиридин-2-она</a>
Предыдущий патент: Способ получения агомелатина
Следующий патент: Способ стабилизации альдегида
Случайный патент: Аналоги морфолинила и пирролидинила












