[4-(6-галоген-7-замещенные-2,4-диоксо-1,4-дигидро-2н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, их формы, способы получения соединений, фармацевтические композиции, содержащие эти соединения, и их применение
Номер патента: 17402
Опубликовано: 28.12.2012
Авторы: Чжанг Ксиаоминг, Скарборо Роберт М., Грант Крейг М., Мехротра Мукунд, Кэннон Хилари, Хуанг Волин
Формула / Реферат
1. Соединение формулы
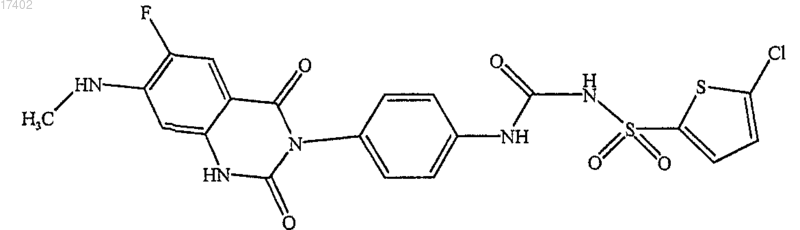
или его фармацевтически приемлемая соль.
2. Соединение формулы
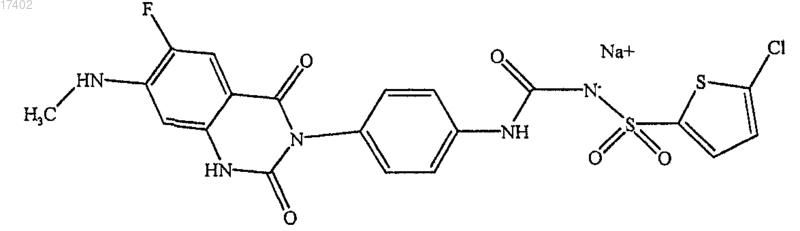
3. Соединение формулы
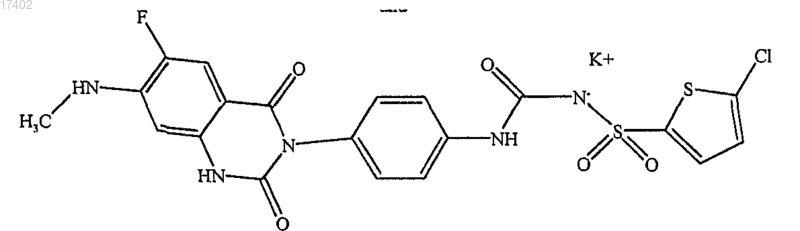
4. Соединение по п.3 в кристаллической твердой форме А, характеризующееся по меньшей мере одним из признаков из числа:
(i) инфракрасного спектра, по существу, в соответствии с фиг. 5;
(ii) рентгеновской дифрактораммы, по существу, в соответствии с фиг. 2 и
(iii) кривой ДСК, по существу, в соответствии с фиг. 14.
5. Соединение по п.3 в кристаллической твердой форме А, характеризующееся инфракрасным спектром, по существу, в соответствии с фиг. 5.
6. Соединение по п.3 в кристаллической твердой форме А, характеризующееся по меньшей мере одним из признаков из числа:
(i) инфракрасного спектра, содержащего пики поглощения примерно при 3559, 3389, 3324, 1698, 1623, 1563, 1510, 1448, 1431, 1403, 1383, 1308, 1269, 1206, 1174, 1123, 1091, 1072,1030, 987, 939, 909, 871, 842, 787, 780, 769, 747, 718, 701, 690 и 667 см-1;
(ii) рентгеновской дифрактораммы, содержащей пики примерно при 2θ 9,5 и 25,5°; и
(iii) эндотермического максимума при ДСК примерно при 246°С.
7. Соединение по п.3 в кристаллической твердой форме А, характеризующееся инфракрасным спектром, содержащим пики поглощения примерно при 3559, 3389, 3324, 1698, 1623, 1563, 1510, 1448, 1431, 1403, 1383, 1308, 1269, 1206, 1174, 1123, 1091, 1072, 1030, 987, 939, 909, 871, 842, 787, 780, 769, 747, 718, 701, 690 и 667 см-1.
8. Соединение по п.3 в кристаллической твердой форме А, характеризующееся инфракрасным спектром, содержащим пики примерно при 3389 см-1 и примерно при 1698 см-1.
9. Соединение по п.3 в кристаллической твердой форме А, характеризующееся рентгеновской дифрактораммой, содержащей пики примерно при 2θ 9,5 и 25,5°.
10. Соединение по п.3 в кристаллической твердой форме А, характеризующееся рентгеновской дифрактораммой, содержащей пик примерно при 2θ 9,5 и примерно при 25,5°, и инфракрасным спектром, содержащим по меньшей мере один пик, выбранный из числа пиков примерно при 3389 см-1 и примерно при 1698 см-1.
11. Соединение по п.3 в кристаллической твердой форме А, характеризующееся эндотермическим максимумом при ДСК примерно при 246°С.
12. Соединение по п.3 в кристаллической твердой форме В, характеризующееся по меньшей мере одним из признаков из числа:
(i) инфракрасного спектра, по существу, в соответствии с фиг. 6;
(ii) рентгеновской дифрактораммы, по существу, в соответствии с фиг. 3 и
(iii) кривой ДСК, по существу, в соответствии с фиг. 16.
13. Соединение по п.3 в кристаллической твердой форме В, характеризующееся инфракрасным спектром, по существу, в соответствии с фиг. 6.
14. Соединение по п.3 в кристаллической твердой форме В, характеризующееся по меньшей мере одним из признаков из числа:
(i) инфракрасного спектра, содержащего пики поглощения примерно при 3584, 3327, 3189, 2935, 2257, 2067, 1979, 1903, 1703, 1654, 1630, 1590, 1557, 1512, 1444, 1429, 1406, 1375, 1346, 1317, 1288, 1276, 1243, 1217, 1182, 1133, 1093, 1072, 1033, 987, 943, 907, 883, 845, 831, 805, 776, 727, 694 и 674 см-1;
(ii) рентгеновской дифрактораммы, содержащей пики примерно при 2θ 20,3° и примерно 2θ 25,1°; и
(iii) эндотермического максимума при ДСК примерно при 293°С.
15. Соединение по п.3 в кристаллической твердой форме В, характеризующееся инфракрасным спектром, содержащим пики поглощения примерно при 3584, 3327, 3189, 2935, 2257, 2067, 1979, 1903, 1703, 1654, 1630, 1590, 1557, 1512, 1444, 1429, 1406, 1375, 1346, 1317, 1288, 1276, 1243, 1217, 1182, 1133, 1093, 1072, 1033, 987, 943, 907, 883, 845, 831, 805, 776, 727, 694 и 674 см-1.
16. Соединение по п.3 в кристаллической твердой форме В, характеризующееся инфракрасным спектром, содержащим пики примерно при 3327 см-1 и примерно при 1630 см-1.
17. Соединение по п.3 в кристаллической твердой форме В, характеризующееся рентгеновской дифрактораммой, содержащей пики примерно при 2θ 20,3° и примерно 2θ 25,1°.
18. Соединение по п.3 в кристаллической твердой форме В, характеризующееся рентгеновской дифрактораммой, содержащей пики примерно при 2θ 20,3° и примерно 2θ 25,1°, и инфракрасным спектром, содержащим по меньшей мере один пик, выбранный из числа пиков примерно при 3327 см-1 и примерно при 1630 см-1.
19. Соединение по п.3 в кристаллической твердой форме В, характеризующееся эндотермическим максимумом при ДСК примерно при 293°С.
20. Соединение по п.2, имеющее аморфную форму, которая дает по меньшей мере одну картину из числа:
(i) инфракрасного спектра, по существу, в соответствии с фиг. 7;
(ii) рентгеновской дифрактораммы, по существу, в соответствии с фиг. 4 и
(iii) кривой ДСК, по существу, в соответствии с фиг. 18.
21. Соединение по п.2, имеющее аморфную форму, характеризующееся инфракрасным спектром, содержащим пики поглощения примерно при 3560, 1711, 1632, 1556, 1512, 1445, 1407, 1375, 1309, 1280, 1227, 1133, 1092, 1032, 987, 905, 781, 770 и 691 см-1.
22. Соединение по п.2, имеющее аморфную форму, которое дает рентгеновскую дифракторамму, по существу, в соответствии с фиг. 4.
23. Соединение по п.2, имеющее аморфную форму, характеризующееся рентгеновской дифрактораммой, содержащей широкий пик, по существу, между 2θ примерно 15 и примерно 30°.
24. Соединение по п.3 в кристаллической твердой форме А, полученное по меньшей мере одним из способов из числа:
(i) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из этанола, метанола и их сочетания, и сушки таким образом, чтобы кристалл содержал некоторое количество растворителя; и
(ii) нагревания калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из этанола, метанола и их сочетания; кристаллизации при температуре от примерно 50 до -10°С и сушки до тех пор, когда кристаллы содержат по меньшей мере примерно 0,05% растворителя.
25. Соединение по п.3 в кристаллической твердой форме В, полученное по меньшей мере одним из способов из числа:
(i) нагревания калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в сочетании растворителей этанола и воды; кристаллизации при температуре от примерно 50 до -10°С и сушки до тех пор, когда кристаллы содержат менее 0,05% растворителя; и
(ii) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины из сочетания растворителей этанола и воды и сушки таким образом, чтобы кристалл содержал менее 0,05% растворителя.
26. Соединение по п.2, имеющее аморфную форму, полученное по меньшей мере одним из способов из числа:
(i) нагревания натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и кристаллизации при температуре от примерно 50 до -10°С;
(ii) кристаллизации натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и
(iii) нагревания натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в атмосфере с высокой влажностью.
27. Соединение по пп.1, 4, 12 или 20 в выделенной и очищенной форме.
28. Фармацевтическая композиция для лечения и предупреждения нежелательного тромбоза и родственных тромбозу состояний, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый наполнитель или носитель.
29. Фармацевтическая композиция по п.28, где соединение в композиции находится по меньшей мере в одной твердой форме.
30. Фармацевтическая композиция по п.28, где указанную твердую форму выбирают из группы, состоящей из формы А, формы В и аморфной формы.
31. Фармацевтическая композиция по п.28, где по меньшей мере одна форма из числа формы А, формы В и аморфной формы присутствует в терапевтически эффективном количестве.
32. Фармацевтическая композиция по пп.30-31, где композицию выбирают из группы, состоящей из твердой пероральной композиции, таблетки, капсулы и сухого порошка для ингаляции.
33. Фармацевтическая композиция по п.32, где твердая пероральная композиция представляет собой таблетку или капсулу.
34. Фармацевтическая композиция по п.28, где указанное терапевтически эффективное количество является количеством, эффективным для ингибирования агрегации тромбоцитов у млекопитающего.
35. Фармацевтическая композиция по п.34, где указанная агрегация тромбоцитов является АДФ-зависимой агрегацией тромбоцитов.
36. Фармацевтическая композиция по п.35, где указанное млекопитающее является человеком.
37. Фармацевтическая композиция по п.28, где указанное соединение является эффективным ингибитором связывания [3Н]2-MeS-АДФ с АДФ-рецепторами тромбоцитов.
38. Фармацевтическая композиция по п.28, представляющая собой твердую пероральную композицию.
39. Фармацевтическая композиция по п.28, представляющая собой таблетку или капсулу.
40. Фармацевтическая композиция по п.28, представляющая собой аэрозоль или сухой порошок для ингаляции.
41. Фармацевтическая композиция для лечения и предупреждения нежелательного тромбоза и родственных тромбозу состояний, содержащая терапевтически эффективное количество соединения по п.1 и другое лечебное средство.
42. Фармацевтическая композиция по п.41, где другое лечебное средство применяют для лечения состояния или расстройства, выбранного из группы, состоящей из тромбоза, острого инфаркта миокарда, нестабильной стенокардии, хронической стабильной стенокардии, преходящего ишемического нарушения мозгового кровообращения, ударов, болезни периферических кровеносных сосудов, преэклампсии/эклампсии, тромбоза глубоких вен, эмболии, диссеминированного внутрисосудистого свертывания и тромбоцитопенической пурпуры, тромботических и рестенотических осложнений после инвазивных процедур в результате ангиопластики, каротидной эндартерэктомии, после операции CABG (обходного шунтирования коронарной артерии), операции сосудистого шунтирования, постановки стента и внедрения эндоваскулярных устройств и протезов, и состояний гиперкоагуляции, связанных с генетической предрасположенностью или онкозаболеваниями.
43. Способ получения калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме А, включающий по меньшей мере одну из операций из числа:
(i) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из этанола, метанола и их сочетания, и сушки таким образом, чтобы кристалл содержал некоторре количество растворителя; и
(ii) нагревания калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2H-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из этанола, метанола и их сочетания; кристаллизации при температуре примерно от 50 до -10°С и сушки до тех пор, когда кристаллы содержат по меньшей мере примерно 0,05% растворителя.
44. Способ получения калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме В, включающий по меньшей мере одну из операций из числа:
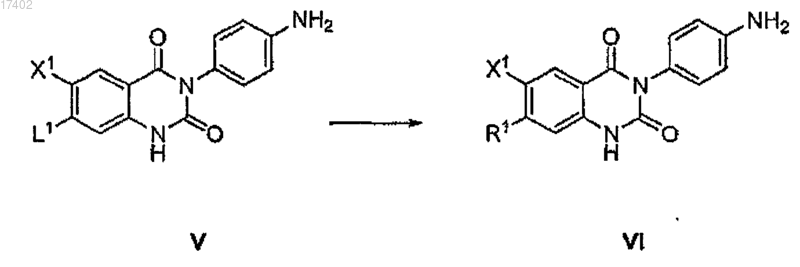
(i) нагревания калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2H-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в сочетании растворителей этанола и воды; кристаллизации при температуре примерно от 50 до -10°С и сушки до тех пор, когда кристаллы содержат менее 0,05% растворителя; и
(ii) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины из сочетания растворителей этанола и воды и сушки таким образом, чтобы кристалл содержал менее 0,05% растворителя.
45. Способ получения натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в аморфной форме, включающий по меньшей мере одну из операций из числа:
(i) нагревания натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и кристаллизации при температуре примерно от 50 до -10°С;
(ii) кристаллизации натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и
(iii) нагревания натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в атмосфере с высокой влажностью.
46. Применение соединения по п.1 или его фармацевтически приемлемой соли для производства лекарственного средства для предупреждения или лечения тромбоза и родственных тромбозу состояний у млекопитающего.
47. Применение соединения по п.1 или его фармацевтически приемлемой соли для производства лекарственного средства для предупреждения или лечения у млекопитающего состояния или расстройства, опосредуемого, по меньшей мере, частично АДФ-индуцированной агрегацией тромбоцитов.
48. Применение по п.47, где млекопитающее предрасположено к или страдает от сердечно-сосудистого заболевания.
49. Применение по п.48, где указанное сердечно-сосудистое заболевание представляет собой по меньшей мере одно заболевание, выбранное из группы, состоящей из острого инфаркта миокарда, нестабильной стенокардии, хронической стабильной стенокардии, преходящего ишемического нарушения мозгового кровообращения, ударов, болезни периферических кровеносных сосудов, преэклампсии/эклампсии, тромбоза глубоких вен, эмболии, диссеминированного внутрисосудистого свертывания и тромбоцитопенической пурпуры, тромботических и рестенотических осложнений после инвазивных процедур в результате ангиопластики, каротидной эндартерэктомии, после операции CABG (обходного шунтирования коронарной артерии), операции сосудистого шунтирования, постановки стента, тромбоза из-за стента и внедрения эндоваскулярных устройств и протезов, и состояний гиперкоагуляции, связанных с генетической предрасположенностью или онкозаболеваниями.
50. Применение по п.46, при котором соединения вводят перорально, парентерально или местно.
51. Применение по п.46, при котором соединение вводят в сочетании с другим лечебным средством.
52. Применение по п.51, при котором пациентом является человек.
53. Применение по п.51, при котором другое лечебное средство используют для лечения состояния или расстройства, выбранного из группы, состоящей из острого инфаркта миокарда, нестабильной стенокардии, хронической стабильной стенокардии, преходящего ишемического нарушения мозгового кровообращения, ударов, болезни периферических кровеносных сосудов, преэклампсии/эклампсии, тромбоза глубоких вен, эмболии, диссеминированного внутрисосудистого свертывания и тромбоцитопенической пурпуры, тромботических и рестенотических осложнений после инвазивных процедур в результате ангиопластики, каротидной эндартерэктомии, после операции CABG (обходного шунтирования коронарной артерии), операции сосудистого шунтирования, постановки стента и внедрения эндоваскулярных устройств и протезов, и состояний гиперкоагуляции, связанных с генетической предрасположенностью или онкозаболеваниями.
54. Применение по п.51, при котором указанное соединение вводят в сочетании с другим лечебным средством, выбранным из группы, состоящей из антитромботических соединений, антикоагулянтов, фибринолитических средств, противовоспалительных соединений, средств, понижающих уровень холестерина, ингибиторов протонного насоса, средств, снижающих кровяное давление, блокаторов серотонина и нитратов (т.е. нитроглицерина).
55. Применение по п.54, при котором указанное другое лечебное средство представляет собой антитромботическое соединение, выбранное из группы, состоящей из антагонистов GPIIB-IIIa, аспирина, ингибиторов фосфодиэстеразы III и антагонистов рецепторов тромбоксана А2.
56. Применение по п.54, при котором указанное другое лечебное средство представляет собой антикоагулянт, выбранный из группы, состоящей из ингибиторов тромбина, кумадина, гепарина и ингибиторов fXa.
57. Применение по п.54, при котором указанное другое лечебное средство представляет собой противовоспалительное соединение, выбранное из группы, состоящей из нестероидных противовоспалительных средств, ингибиторов циклооксигеназы-2 и средств от ревматоидного артрита.
58. Применение соединения по п.1 или его фармацевтически приемлемой соли для производства лекарственного средства для предупреждения появления вторичного ишемического события.
59. Применение по п.58, при котором указанное первичное и/или вторичное ишемическое событие выбирают из группы, состоящей из инфаркта миокарда, нестабильной или стабильной стенокардии, острой реокклюзии после чрезкожной коронарной интервенции и/или постановки стента, рестеноза, баллонной ангиопластики и/или постановки стента на периферический сосуд, тромботического удара, преходящего ишемического нарушения мозгового кровообращения, обратимого ишемического неврологического расстройства и перемежающейся хромоты.
60. Применение по п.58, при котором указанное первичное и/или вторичное ишемическое событие выбирают из группы, состоящей из чрескожной коронарной интервенции (PCI), включая ангиопластику и/или постановку стента, острого инфаркта миокарда (AMI), нестабильной стенокардии (USA), ишемической болезни сердца (CAD), преходящего ишемического нарушения мозгового кровообращения (TIA), удара, болезни периферических кровеносных сосудов (PVD), операции коронарного шунтирования, каротидной эндартерэктомии.
61. Способ получения фармацевтической композиции для лечения и предупреждения нежелательного тромбоза и родственных тромбозу состояний, содержащей смесь терапевтически эффективного количества соединения по п.1 с фармацевтически приемлемым наполнителем или носителем, включающий смешивание указанных ингредиентов.
62. Способ получения соединения формулы VIII
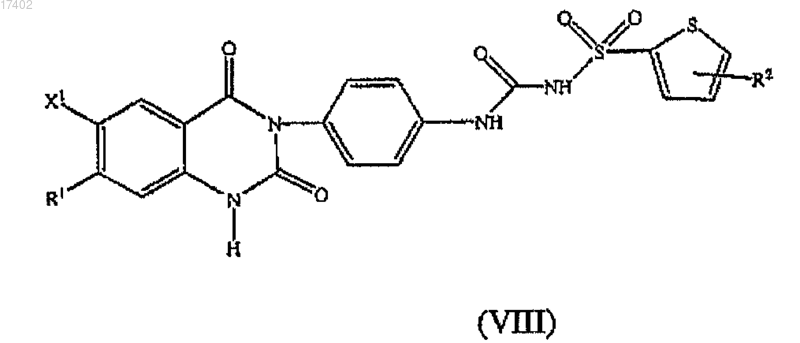
или его фармацевтически приемлемой соли, гидратного или сольватного производного, где
каждый R1 выбран из группы, состоящей из Н, галогена, -ОН, -О-С1-10-алкила, амино и C1-6-алкиламино;
R2 представляет собой Н или -О-С1-10-алкил;
X1 представляет собой галоген,
включающий стадии:
(а) ацилирование аминогруппы соединения формулы I соединением формулы II в щелочных условиях в присутствии необходимого растворителя с образованием соединения формулы III
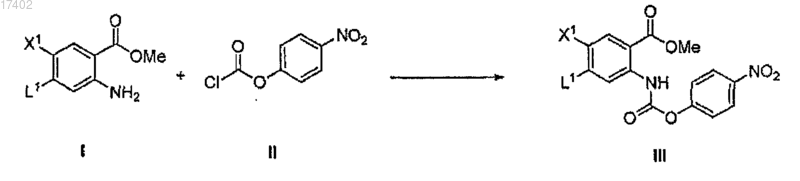
где L1 представляет собой уходящую группу, выбранную из группы, состоящей из галогена и -О-С1-10-алкила;
(b) взаимодействие соединения формулы III с аминсодержащим соединением формулы IV в присутствии основного катализатора и растворителя при необходимой температуре с образованием производного циклизованного хиназолина формулы V

где Q представляет собой защитную группу;
(с) замену группы L1 формулы V группой R1 путем взаимодействия с соединением формулы R1H с образованием соединения формулы VI
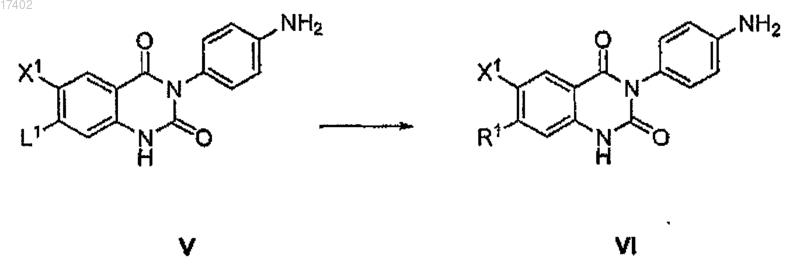
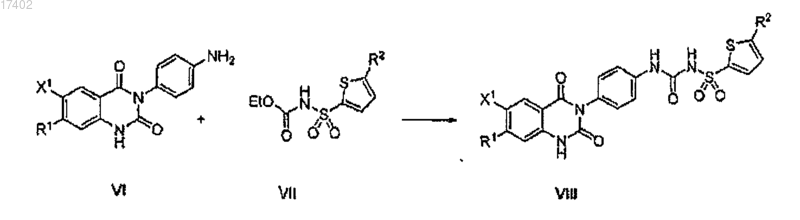
(d) взаимодействие соединения формулы VI с соединением формулы VII с образованием соединения формулы VIII
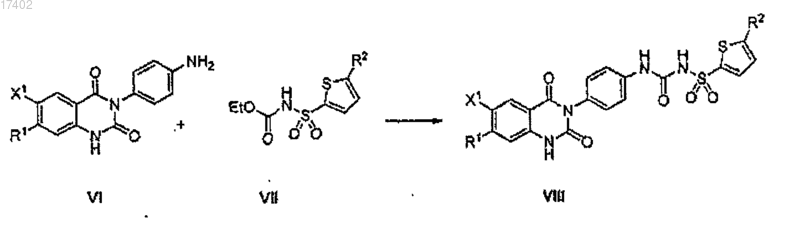
63. Способ по п.62, в котором аминное соединение на стадии (b) представляет собой 4-нитроанилин.
64. Способ по п.62, в котором защитная группа Q представляет собой t-BOC.
65. Способ по п.62, в котором на стадии (с) дополнительно в качестве растворителя используют ДМСО.
66. Способ по п.62, в котором стадия (с) осуществляется при температуре около 110°С.
67. Способ по п.62, в котором стадия (d) осуществляется при температуре около 65°С.
68. Способ по п.62, который включает дополнительный этап получения соли или гидрата соединения формулы VIII
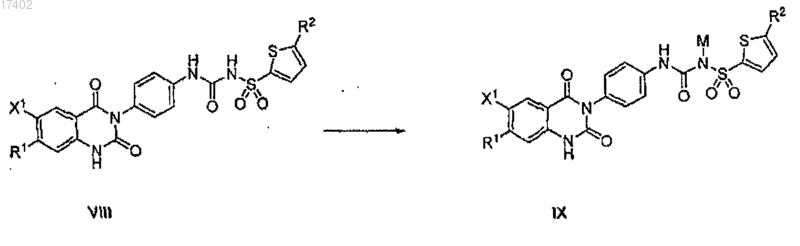
путем обработки соединения VIII основанием, выбранным из группы, состоящей из карбоната калия, карбоната натрия, гидроксида калия и гидроксида натрия, где М представляет собой Na или K.
69. Соединение формулы
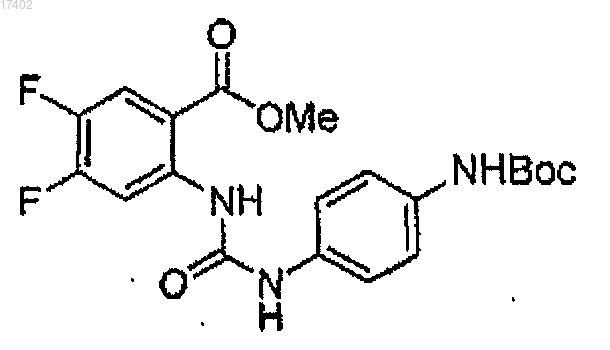
70. Соединение формулы
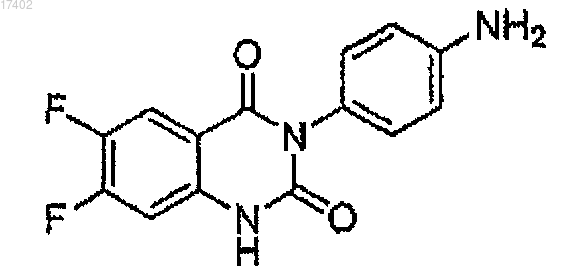
71. Соединение формулы

72. Способ получения соединения формулы III, включающий ацилирование аминогруппы соединения формулы I соединением формулы II при основных условиях в присутствии подходящего растворителя с получением соединения формулы III
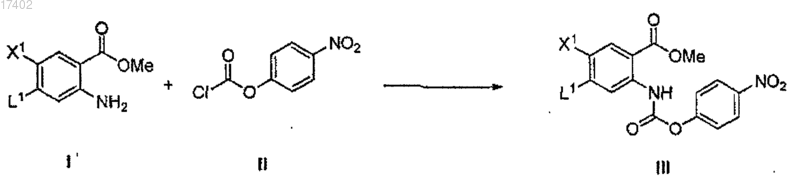
где L1 представляет собой уходящую группу, выбранную из группы, состоящей из галогена и -О-С1-10-алкила.
73. Способ получения соединения формулы V, включающий взаимодействие соединения формулы III с аминсодержащим соединением IV в присутствии основного катализатора и растворителя при необходимой температуре с образованием производного циклизованного хиназолина формулы V
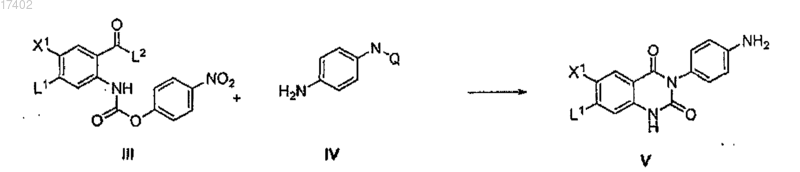
где Q представляет собой защитную группу.
74. Способ получения соединения формулы VI, включающий замену уходящей группы L1 соединения формулы V на R1 путем взаимодействия с соединением формулы R1H с образованием соединения формулы VI
75. Способ получения соединения формулы VIII, включающий взаимодействие соединения формулы VI с соединением формулы VII с образованием соединения формулы VIII
76. Способ получения соединения формулы IX, включающий получение соли или гидрата соединения формулы VIII
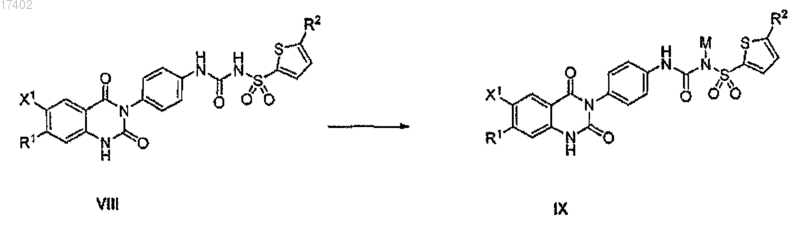
путем обработки соединения VIII основанием, выбранным из группы, состоящей из карбоната калия, карбоната натрия, гидроксида калия и гидроксида натрия, где М представляет собой Na или K.
77. Способ по п.63 или 75, который представляет собой процесс для получения соединения формулы XXVIII
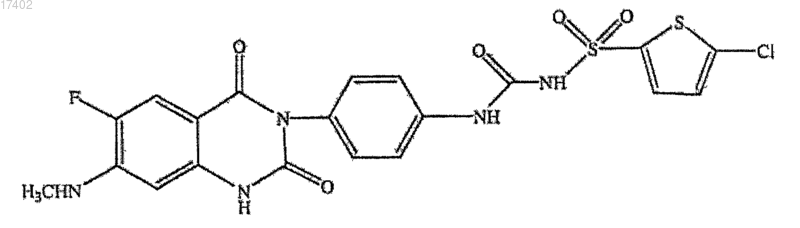
и его фармацевтически приемлемой соли или его гидратного или сольватного производного.
78. Способ по любому из пп.62-68 и 72-76, где X1 представляет собой -F.
79. Способ по любому из пп.62-68 и 72-76, где R1 выбран из группы, состоящей из -ОН, NH2 и -NH(-С1-6алкил).
80. Способ по любому из пп.62-68 и 72-76, где R1 представляет собой -NHCH3.
81. Способ по любому из пп.62-68 и 72-76, где R2 представляет собой хлор.
82. Способ по любому из пп.62-68 и 72-76, где уходящая группа L1 независимо выбрана из группы, состоящей из галогена, алкилсульфоната, галогеналкилсульфоната и арилсульфоната.
Текст
Настоящее изобретение относится к новым сульфонилмочевинам формулы (I) и их фармацевтически приемлемым производным и их полиморфным и аморфным формам. Соединения в их различных формах являются эффективными ингибиторами АДФ-рецепторов тромбоцитов и могут использоваться в различных фармацевтических композициях и являются особенно эффективными для предупреждения и/или лечения сердечно-сосудистых заболеваний,в частности заболеваний, связанных с тромбозом. Изобретение также относится к способу получения таких соединений и форм и способу предупреждения или лечения тромбоза и связанных с тромбозом состояний у млекопитающего, включающему стадию введения терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или их форм. 017402 Предпосылки создания изобретения Тромботические осложнения являются основной причиной смерти в промышленно развитом мире. Примеры таких осложнений включают острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящее нарушение мозгового кровообращения, удары, болезнь периферических кровеносных сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, эмболию, диссеминированное внутрисосудистое свертывание и тромбоцитопеническую пурпуру. Тромботические и рестенотические осложнения также имеют место после инвазивных процедур, например ангиопластики,каротидной эндартерэктомии, после операции CABG (обходное шунтирование коронарной артерии),операции сосудистого шунтирования, постановки стента и внедрения эндоваскулярных устройств и протезов и состояний возможной гиперкоагуляции, связанных с генетической предрасположенностью или онкозаболеваниями. Тромбоциты, которые обычно свободно циркулируют в сосудистой сети, становятся активированными и агрегируют с образованием тромба из кровотока, нарушенного из-за атеросклеротических повреждений или инвазивным лечением, таким как ангиопластика, что приводит к закупорке сосудов. Активация тромбоцитов может вызываться различными агентами, например открытыми молекулами эндотелиальной матрицы, такими как коллаген, или тромбином, который образуется в системе свертывания крови. Важным посредником активации и агрегации тромбоцитов является АДФ (ADP, аденозин-5'дифосфат), который высвобождается из тромбоцитов в сосудистой сети после активации различными агентами, такими как коллаген и тромбин, и из поврежденных клеток крови, эндотелия или тканей. Активация АДФ приводит к рекрутменту большего числа тромбоцитов и стабилизации существующих агрегатов тромбоцитов. Рецепторы АДФ тромбоцитов, опосредующие агрегацию, активируются АДФ и некоторыми его производными и антагонизируются АТФ (аденозин-5'-трифосфат) и некоторыми его производными (Mills D.C.O. (1996), Thromb. Hemost., 76: 835-856). Следовательно, АДФ-рецепторы тромбоцитов являются членами семейства рецепторов Р 2, активируемых пурин- и/или пиримидиннуклеотидами (King B.F., Townsend-Nicholson A.Burnstock G. (1998), Trends Pharmacol. Sci., 19: 506-514). Последние фармакологические результаты с использованием антагонистов предполагают, что АДФ-зависимая агрегация тромбоцитов требует активации по меньшей мере двух АДФ-рецепторов(Kunapuli S.P. (1998), Trends Pharmacol. Sci., 19: 391-394; Kunapuli S.P.Daniel J.L. (1998), Biochem. J.,336: 513-523; Jantzen H.M. et al. (1999), Thromb. Hemost, 81: 111-117). Оказывается, один рецептор, идентичный клонированному рецептору P2Y1, опосредует активацию фосфолипазы С и мобилизацию внутриклеточного кальция и требуется для изменения формы тромбоцита. Другой АДФ-рецептор тромбоцитов, важный для агрегации, опосредует ингибирование аденилилциклазы. На основании его фармакологических свойств и свойств передачи сигнала этот рецептор условно называют P2YADP (Fredholm В.В. et(Hechier B. et al. (1998), Blood, 92, 152-159). Позднее молекулярное клонирование данного рецептора(Hollopeter G. et al. (2001), Nature, 409: 202-207) показало, что он является новым членом объединенного семейства G-белков и является мишенью для тиенопиридиновых лекарственных средств тиклопидина и клопидогреля. Название, данное этому рецептору, P2Y12. Сообщалось о различных прямо или косвенно действующих синтетических ингибиторах АДФзависимой агрегации тромбоцитов с антитромботической активностью. Перорально активные антитромботические тиенопиридины тиклопидин и клопидогрель ингибируют вызванную АДФ агрегацию тромбоцитов, связывая меченный изотопом агонист АДФ-рецептора 2-метилтиоаденозин-5'-дифосфат с тромбоцитами, и, косвенно, другие АДФ-зависимые события, вероятно, через образование неустойчивых и действующих необратимо метаболитов (Quinn M.J.Fitzgerald D.J. (1999), Circulation, 100: 1667-1667). Некоторые пуриновые производные эндогенного антагониста АТФ, например AR-C (прежде FPL илиARL) 67085MX и AR-C69931Mx, являются селективными антагонистами АДФ-рецепторов тромбоцитов,ингибирующими АДФ-зависимую агрегации тромбоцитов, и эффективны на животных моделях тромбоза (Humphries et al. (1995), Trends Pharmacol. Sci., 16, 179; Ingall A.H. et al. (1999), J. Med. Chem., 42, 213230). Новые соединения триазоло[4,5-d]пиримидина раскрыты как P2T-антагонисты (WO 99/05144). ВWO 99/36425 также раскрыты трициклические соединения как ингибиторы АДФ-рецепторов тромбоцитов. Представляется, что мишенью таких антитромботических соединений является P2Y12 - АДФрецептор тромбоцитов, опосредующий ингибирование аденилилциклазы. Несмотря на наличие таких соединений, существует потребность в более эффективных ингибиторах АДФ-рецепторов тромбоцитов. В частности, существует потребность в ингибиторах АДФрецепторов тромбоцитов с антитромботической активностью, которые применимы при предупреждении и/или лечении сердечно-сосудистых заболеваний, в частности связанных с тромбозом. Кроме того, хотя биологическая активность является необходимым условием для эффективного лекарственного средства, соединение должно подходить для крупномасштабного производства, а физические свойства соединения могут заметно влиять на эффективность и стоимость вводимого в состав препарата активного ингредиента. Соли кислых и основных соединений могут изменять или улучшать физические свойства исходного соединения. Однако такие солеобразующие вещества должны идентифицироваться эмпирически химиками-фармацевтами, так как не существует надежного способа для предска-1 017402 зания влияния формы соли на поведение исходного соединения в лекарственных формах. Эффективные методы скрининга, которые потенциально могли бы упростить процесс отбора, к несчастью, отсутствуютGennaro, Ed.; Mack Publishing Co. Easton, Pa., 1995; pp. 1456-1457). Среди фармацевтически применимых соединений часто встречаются аморфные и различные кристаллические твердые/полиморфные формы солей. Полиморфизм является способностью элемента или соединения кристаллизоваться в нескольких различных кристаллических формах. Физические свойства,в том числе растворимость, температура плавления/эндотермический максимум, плотность, твердость,кристаллическая форма и устойчивость могут заметно различаться для различных форм одного и того же соединения. Кристаллические твердые и аморфные формы можно характеризовать методами рассеяния, например порошковой рентгенограммой, спектроскопическими методами, например инфракрасной спектроскопией, спектроскопией ядерного магнитного резонанса 13 С и 19F в твердом состоянии, и термическими методами, например методом дифференциальной сканирующей калориметрии или дифференциальным термическим анализом. Хотя интенсивность пиков на порошковых рентгенограммах различных партий соединения может несколько изменяться, пики и расположение пиков являются характерными для определенной кристаллической твердой или аморфной формы. Кроме того, используют инфракрасный метод,метод Рамана и термические методы для анализа и характеризации кристаллических и твердых аморфных форм. Твердые и аморфные формы можно характеризовать данными порошковой рентгенограммы,полученной согласно процедурам, известным в технике (см. J. Haleblian, J. Pharm. Sci., 1975, 64: 12691288, и J. Haleblian and W. McCrone, J. Pharm. Sci., 1969, 58: 911-929). Хотя интенсивность пиков на порошковых рентгенограммах различных партий соединения может несколько изменяться, пики и расположение пиков являются характерными для определенной кристаллической твердой формы. Проблемой, которую необходимо решать, является идентификация подходящей соли и формы, которая (i) обладает адекватной химической устойчивостью во время процесса получения, (ii) эффективно получается, очищается и извлекается, (iii) обеспечивает приемлемую растворимость в фармацевтически приемлемых растворителях, (iv) поддается обработке (например, в силу текучести и размера частиц) и составлению композиций с незначительным разложением или изменением физических и химических характеристик соединения, (v) обнаруживает приемлемую химическую устойчивость в препарате. Кроме того, соли и формы, содержащие высокий молярный процент активного ингредиента, являются весьма желательными, так как они минимизируют количество вещества, которое следует включить в композицию и вводить для получения терапевтически эффективной дозы. Такие часто противоречивые требования делают идентификацию подходящих солей, требующей усилий, и важной проблемой, которую должны очень серьезно решать научные сотрудники в области фармации до того, как может быть продолжена разработка лекарственного средства. Следовательно, существует потребность в соединениях и солях и аморфных и кристаллических твердых формах таких соединений по изобретению и эффективном способе получения соединений, солей и кристаллических твердых форм соединений по изобретению. Необходимы решения в отношении вышеуказанных трудностей и недостатков, прежде чем соединения становятся эффективными для обычного лечения тромбоза. Полиарильные соединения, как правило, являются высококристаллическими, плохо растворимыми в воде и гидрофобными, что приводит к трудностям при получении фармацевтических препаратов и проблемам, связанным с биологической доступностью. Соответственно усилия направляются на обнаружение других форм соединений по изобретению и на исследование их свойств. Раскрыты кристаллические твердые формы солей соединений по изобретению. Настоящее изобретение удовлетворяет вышеуказанные потребности за счет полиморфов и способов лечения и предупреждения тромбоза, причем в то же время представляет более хороший профиль вредного действия. Сущность изобретения В одном аспекте настоящее изобретение относится к соединениям формулы (I) Изобретение также относится ко всем фармацевтически приемлемым солям соединений формулы В другом аспекте изобретение относится к кристаллическим твердым и аморфным формам калиевых и натриевых солей [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевины. В другом аспекте изобретение относится к фармацевтическим композициям для предупреждения или лечения тромбоза и родственных тромбозу состояний у млекопитающего. Композиции содержат терапевтически эффективное количество одного или нескольких соединений формулы (I) или его(их) фармацевтически приемлемой(ых) соли(ей) и фармацевтически приемлемый носитель или эксципиент. Изобретение также относится к способу предупреждения или лечения тромбоза и родственных тромбозу состояний у млекопитающего путем введения терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящее изобретение относится к способам получения соединений формулы(I), их кристаллических твердых и аморфных форм и фармацевтических композиций для предупреждения или лечения тромбоза и родственных тромбозу состояний у млекопитающего. Краткое описание чертежей Фиг. 1 представляет структуру калиевой и/или натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 2 а показывает порошковую дифракцию рентгеновских лучей (XRPD) на кристаллической твердой форме А дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 2b показывает XRPD на кристаллической твердой форме А дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины с предоставлением информации о пиках; фиг. 3 а показывает XRPD на кристаллической твердой форме В калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 3b показывает XRPD на кристаллической твердой форме В калиевой соли [4-(6-фтор-7-метиламино 2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины с предоставлением информации о пиках; фиг. 4 показывает XRPD на аморфной форме натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 5 показывает инфракрасный спектр с преобразованием Фурье (FT-IR) кристаллической твердой формы А дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 6 показывает инфракрасный спектр с преобразованием Фурье (FT-IR) кристаллической твердой формы В дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 7 показывает инфракрасный спектр с преобразованием Фурье (FT-IR) аморфной формы натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 8 показывает спектр 1 Н-ЯМР кристаллической твердой формы А дигидрата калиевой соли [4(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 9 показывает спектр 1 Н-ЯМР кристаллической твердой формы В калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 10 показывает спектр 1 Н-ЯМР аморфной формы натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 11 представляет данные по гравиметрической сорбции паров (GVS) кристаллической твердой-3 017402 формы А дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 12 а представляет данные по гравиметрической сорбции паров (GVS) кристаллической твердой формы В дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. Образец извлекают после завершения эксперимента по GVS и повторно проверяют методом XRPD. Результаты (фиг. 12b) показывают, что в ходе эксперимента по GVS изменения фазы не происходит. Изменение интенсивности пика при 2 са. 5,4 является эффектом предпочтительной ориентации; фиг. 13 представляет данные по гравиметрической сорбции паров (GVS) аморфной формы натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевины; фиг. 14 представляет данные дифференциальной сканирующей калориметрии (ДСК, DSC) кристаллической твердой формы А дигидрата калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро 2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 15 представляет данные ТГА (TGA) кристаллической твердой формы А дигидрата калиевой соли[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 16 представляет данные ДСК кристаллической твердой формы В калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 17 представляет данные ТГА кристаллической твердой формы В калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 18 представляет данные ДСК аморфной формы натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины; фиг. 19 представляет данные ТГА аморфной формы натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. Осуществление изобретения Настоящее изобретение относится к соединениям сульфонилмочевинам, их производным и их твердым кристаллическим и аморфным формам и их получению. Калиевая соль[4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевины имеет превосходную кристалличность, устойчивость и чистоту. Соединения по настоящему изобретению применимы для лечения и предупреждения нежелательного тромбоза и родственных тромбозу состояний у млекопитающих.I. Определения. Согласно настоящему изобретению используемые в данном описании перечисленные далее термины имеют приведенные далее значения, если не указано иное. Термин "примерно", используемый в данном описании, обозначает разброс, который можно видеть при измерениях, проводимых различными инструментами, в образцах и приготовлении образцов. Такой разброс может включать, например, обобщающие характеристики в случае тепловых измерений. Типичный разброс между различными рентгеновскими дифрактометрами и приготовлениями образцов для кристаллических твердых форм является величиной 2 порядка 0,2. Типичный разброс для рамановских и ИК-спектрометров имеет порядок двойного разрешения спектрометра. Разрешение используемого спектрометра составляет примерно 2 см-1. Термин "сольват", используемый в данном описании, обозначает соединение по изобретению или его соль, которые также включают стехиометрическое или нестехиометрическое количество растворителя, присоединенного при получении согласно изобретению за счет нековалентных межмолекулярных сил в количестве, превышающем примерно 0,3%. Термин "гидрат", используемый в данном описании, обозначает соединение по изобретению или его соль, которые также включают стехиометрическое или нестехиометрическое количество воды, присоединенной за счет нековалентных межмолекулярных сил. Гидраты образуются путем объединения одной или нескольких молекул воды с одним из веществ, в котором вода остается в своем молекулярном состоянии как Н 2 О, причем при таком объединении могут образовываться один или несколько гидратов. Термин "безводный", используемый в данном описании, обозначает соединение по изобретению или его соль, которые содержат менее примерно 3 мас.% воды или растворителя, когда получены согласно изобретению. Термин "сушка", используемый в данном описании, обозначает способ удаления растворителя и/или воды из соединения по изобретению, который, если не указано иное, может осуществляться при атмосферном давлении или при пониженном давлении и при нагревании или без нагревания до тех пор,пока уровень содержащихся растворителя и/или воды не достигнет приемлемого уровня. Термин "полиморфы", используемый в данном описании, обозначает кристаллические структуры, в которых может кристаллизоваться соединение в различных кристаллических упаковках, которые все имеют одинаковый элементный состав. Различные кристаллические формы, как правило, имеют различ-4 017402 ные рентгеновские дифрактограммы, инфракрасные спектры, температуры плавления/эндотермические максимумы, плотность, твердость, форму кристаллов, оптические и электрические свойства, устойчивость и растворимость. Растворитель для перекристаллизации, скорость кристаллизации, температура хранения и другие факторы могут вызвать преобладание одной кристаллической формы. Термин "твердая форма", используемый в данном описании, обозначает кристаллические структуры, в которых может кристаллизоваться соединение в различных кристаллических упаковках. Твердые формы включают полиморфы, гидраты и сольваты, как они определены в данном изобретении. Различные твердые формы, в том числе различные полиморфы одного и того же соединения показывают различные порошковые дифрактограммы и различные спектры, в том числе инфракрасные, рамановские спектры и спектры ЯМР в твердом состоянии. Их оптические и электрические свойства, устойчивость и растворимость также могут различаться. Термин "характеризация", используемый в данном описании, обозначает набор данных аналитических измерений, таких как рентгеновская дифракция, инфракрасная спектроскопия, рамановская спектроскопия и/или спектроскопия ЯМР в твердом состоянии, для того, чтобы отличить одну твердую форму соединения по изобретению от других твердых форм соединения. Термин "млекопитающее" включает, без ограничения, людей, домашних животных (например, собак и кошек), сельскохозяйственных животных (коров, лошадей или свиней), обезьян, кроликов, мышей и лабораторных животных. Термин "алкил" относится к насыщенным алифатическим группам, включая линейные, разветвленные и циклические группы, с определенным числом атомов углерода или, если число атомов углерода не конкретизировано, содержащим до 12 атомов углерода. Примеры алкильных групп включают метил,этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, н-пентил, н-гексил, н-гептил, ноктил и т.п. Термин "алкиламино" используется в его обычном значении и относится к алкильным группам,присоединенным костальной части молекулы через атом кислорода, аминогруппу или атом серы соответственно. Для краткости термин "C1-6-алкил" предназначен для включения линейных, разветвленных или циклических алкильных групп или их сочетаний, таких как метил, этил, 2-метилпропил, циклобутил и циклопропилметил. Термин "С 1-6-алкиламино", используемый в данном описании, относится к аминогруппе, присоединенной к остальной части молекулы, посредством чего атом азота замещается одним или двумя C1-6 алкилзаместителями, имеющими значения, указанные выше. Термины "гало" или "галоген" сами по себе или как части другого заместителя обозначают, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, термины, такие как "галогеналкил", обозначают моногалогеналкил и полигалогеналкил. Например, термин "С 1-4-галогеналкил" включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п. Термин "фармацевтически приемлемые соли" предназначен для включения солей активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от определенных заместителей, имеющихся в соединениях, описанных в данном описании. Когда соединения по настоящему изобретению содержат относительно кислотные функциональные группы, можно получить соли присоединения оснований путем контактирования нейтральной формы таких соединений с достаточным количеством нужного основания или в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения оснований включают соли, образованные с неорганическими основаниями, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и подобные соли. Особенно предпочтительными являются калиевые и натриевые соли. Соли, образованные с фармацевтически приемлемыми органическими нетоксичными основаниями, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол, таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин,этаноламин, 2-диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин,прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин, теобромин, пурины,пиперазин, пиперидин, N-этилпиперидин, полиаминовые смолы и подобные. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин,триметиламин, триметамин, дициклогексиламин, холин и кофеин. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, можно получить соли присоединения кислот путем контактирования нейтральной формы таких соединений с достаточным количеством нужной кислоты или в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, образованные с неорганическими кислотами, такими как хлороводородная, бромоводородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодоводородная или фосфористая кислоты, а также соли, образованные с относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая, изомасляная, малоновая, бензойная, янтарная, субериновая, фумаровая,миндальная, фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, винная, метансульфоновая-5 017402 кислоты и подобные кислоты. Также включаются соли аминокислот, такие как аргинаты и т.п., и соли органических кислот, подобных глюкуроновой или галактуроновой кислотам и т.п. (см., например, Bergeof Prodrugs (Elsevier Science Publishers, Amsterdam 1985. Некоторые конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, которые позволяют превращать соединения в соли присоединения либо оснований, либо кислот. Нейтральные формы соединений можно регенерировать контактированием соли с основанием или кислотой и выделением исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в иных отношениях соли эквивалентны исходной форме соединения для целей настоящего изобретения."Биологическое свойство" для целей в данном изобретении обозначает in vivo эффекторную или антигенную функцию или активность, которые прямо или косвенно осуществляются соединением по данному изобретению, которые часто показывают анализы in vitro. Эффекторные функции включают связывание лигандов, любую ферментативную активность или ферментативную модулирующую активность,любую активность связывания носителя, любую гормональную активность, любую активность промотирования или ингибирования адгезии клеток к внеклеточному матриксу или молекулам клеточной поверхности или любую структурную роль. Антигенные функции включают обладание эпитопом или антигенным сайтом, который способен взаимодействовать с антителами, появляющимися против него. Используемый в данном описании термин "предупреждение" относится к профилактическому лечению пациента, нуждающегося в этом. Профилактическое лечение можно осуществить, предоставляя соответствующую дозу лечебного средства субъекту, имеющему опасность страдать от заболевания,причем посредством этого, по существу, предотвращается начало заболевания. Используемый в данном описании термин "лечение" относится к предоставлению соответствующей дозы лечебного средства субъекту, страдающему от заболевания. Используемый в данном описании термин "терапевтически эффективное количество" относится к количеству лечебного средства, которое является достаточным для того, чтобы воздействовать на лечение субъекта, страдающего от заболевания. Используемый в данном описании термин "состояние" относится к болезненному состоянию, против которого используют соединения, композиции и способы по настоящему изобретению. Используемый в данном описании термин "АДФ-опосредованное заболевание или состояние" и подобный термин относится к заболеванию или состоянию, характеризующемуся активностью АДФ,меньшей или большей, чем в нормальном состоянии. АДФ-опосредованное заболевание или состояние является заболеванием или состоянием, при котором модуляция АДФ приводит к некоторому влиянию на прежнее состояние или заболевание (например, ингибитор или антагонист АДФ приводит к некоторому улучшению здоровья, по меньшей мере, у некоторых пациентов). Используемый в данном описании термин "образец крови" относится к цельной крови, взятой у субъекта, или к любым фракциям крови, в том числе плазме или сыворотке.II. Воплощения соединений по изобретению. В одном воплощении изобретения соединения формулы I включают соединение формулы Другая группа особенно предпочтительных соединений по изобретению имеет формулуIII. Получение соединений по изобретению. Схема 1 иллюстрирует способ получения некоторых соединений формулы I, в которых Ar представляет собой фенилен и R1 и X имеют значения, указанные выше. Схема 1or - или, Method - способ, or none - или ничего, Coupling - сочетание Соединение формулы I можно получить восстановлением метилового эфира 2-нитробензойной кислоты 1 процедурами, известными специалистам в данной области техники, с образованием анилина 2.(См. также опубликованную заявку на патент US 2002/077486). Например, восстановление нитрогруппы можно осуществить способом гидрирования. Гидрирование осуществляют с подходящим катализатором(например, 10% Pd/C или Pt(s)/C) в атмосфере водорода и в соответствующем растворителе, типично в спирте, предпочтительно этаноле, при комнатной температуре. Обработка соединения 2 соответствующим образом замещенным арилизоцианатом (способ А) дает промежуточное соединение - мочевину 3 а. С другой стороны, мочевину 3 а можно получить обработкой соединения 2 тиофосгеном в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в инертном растворителе, таком как ТГФ,дихлорметан или MeCN, при соответствующей температуре, предпочтительно при 20 С, а затем замещенным анилином (способ В). Затем мочевину 3 а, полученную способом А или В, типично без дополнительной очистки можно подвергнуть вызываемому нагреванием или основанием (таким как Nметилморфолин (NMM) или полистирол-NMM (PS-NMM замыканию цикла и получить хиназолиндион 4 а. Нитрогруппу соединения 4 а можно восстановить процедурами, известными специалистам в данной области техники, и получить свободную аминогруппу. Например, восстановление можно осуществить гидрированием с подходящим катализатором (например, 10% палладием-на-угле) в соответствующем растворителе, типично спирте. Образование сульфонилмочевинной связи можно осуществить обработкой восстановленного продукта анилина 5 а предварительно полученным раствором замещенного тиофен-2-сульфонамида, N,N'-дисукцинимидилкарбоната и тетраметилгуанидина в дихлорметане с последующей обработкой ТФК в дихлорметане при комнатной температуре и получить сульфонилмочевину формулы I. С другой стороны, сульфонилмочевинную связь можно получить взаимодействием анилина 5 а и 5-хлортиофен-2-сульфонилэтилкарбамата в подходящих растворителях, к которым относятся, но не ограничиваются перечисленным, толуол, ацетонитрил, 1,4-диоксан и ДМСО. Схема 2 иллюстрирует другой способ получения соединений формулы I, в которых R1 представляет собой, например, алкиламино и L1 представляет собой галоген, алкилсульфонатную группу, галогеналкилсульфонатную группу и арилсульфонатную группу.Method - способ, dioxane - диоксан, DMSO - ДМСО, THF - ТГФ Мочевину 3b можно получить обработкой соединения 2 трифосгеном или п-нитрофенилхлорформиатом в присутствии основания, такого как триэтиламин и/или диизопропилэтиламин, в инертном растворителе, таком как ТГФ, дихлорметан и/или MeCN, при соответствующей температуре,типично при примерно 20 С, с последующей обработкой соответствующим образом защищенным анилином (способ В). Мочевину 3b типично без дополнительной очистки можно подвергнуть вызываемому основанием замыканию цикла и получить промежуточный хиназолиндион 4b. Защитную группу соединения 4b можно удалить с использованием стандартных методов, подходящих для используемой защитной группы. Например, защитную группу ВОС можно удалить обработкой соединения 4b 4N растворомHCl в диоксане. Затем фтор при С 7 соединения 5b заменяют обработкой метиламином в ДМСО при примерно 120 С и получают анилин 6 а. Получение целевой сульфонилмочевины 7 а можно осуществить обработкой анилина 6 а хлортиофен-2-сульфонилэтилкарбаматом в соответствующем растворителе, таком как диметилсульфоксид, диоксан и/или ацетонитрил, при нагревании. Схема 3 иллюстрирует другой способ получения соединений формулы I, в которыхequiv - экв., Mol. Wt. - мол.масса, DMSO - ДМСО, step - стадия 1 - п-нитрофенилхлорформиат, 2 трет-бутил-4-аминофенилкарбамат, 3 - этил-5-хлортиофен-2-илсульфонилкарбамат Мочевину 3 с можно получить обработкой соединения 2 п-нитрофенилхлорформиатом в инертном растворителе, таком как ТГФ, дихлорметан и/или MeCN, при соответствующей температуре, типично при примерно 20 С, с последующей обработкой соответствующим образом защищенным анилином (способ В). Согласно изобретению соединения формулы (I) можно дополнительно обработать для получения фармацевтически приемлемых солей, например 7 а. Обработка соединения по изобретению кислотой или основанием может дать, соответственно, фармацевтически приемлемую соль присоединения кислоты и фармацевтически приемлемую соль присоединения основания, определения которым даны выше. Различные неорганические и органические кислоты и основания, известные в технике, включая указанные в данном описании, можно использовать для осуществления конверсии в соль. Соединения формулы (I) можно выделить с использованием типичных методов выделения и очистки, известных в технике, включая, например, хроматографические способы и перекристаллизацию. Согласно изобретению соединения формулы (I) можно обработать дополнительно для получения фармацевтически приемлемых солей. Обработка соединения по изобретению кислотой или основанием может дать, соответственно, фармацевтически приемлемую соль присоединения кислоты и фармацевтически приемлемую соль присоединения основания, определения которым даны выше. Различные неорганические и органические кислоты и основания, известные в технике, включая указанные в данном описании, можно использовать для осуществления конверсии в соль.IV. Воплощения кристаллических твердых и аморфных форм по изобретению и их получение. Настоящее изобретение также относится к кристаллическим твердым и/или аморфным формам [4(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, способам их получения и фармацевтическим композициям, содержащим такие формы. Калиевая соль имеет следующую общую формулу: и натриевая соль имеет следующую общую формулу: При разработке способа получения активного фармацевтического ингредиента (API) очень важными являются два фактора: профиль чистоты и морфология кристалла соединения. Результаты начальных работ по выделению и кристаллизации показали профиль [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины 99,6%. ПредпочтительноAPI имеет уровни примесей менее 0,2% и находится в наиболее термодинамически устойчивой кристаллической твердой форме. Работа по выделению и кристаллизации показала, что существуют по меньшей мере две кристаллические твердые формы калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины (обозначенные как форма А и форма В) и аморфная форма натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. Твердые формы по изобретению можно описать одним или несколькими методами, включая порошковую рентгенографию, рамановскую спектроскопию, ИК-спектроскопию и термические методы. Также можно использовать сочетание таких методов для описания форм по изобретению. Например,один или несколько пиков порошковой дифрактограммы в сочетании с одним или несколькими пиками Рамана можно использовать для описания одной или нескольких твердых форм по изобретению, так как это в известной мере отличает такую(ие) форму(ы) от других твердых форм. Хотя это характеризует форму, нет необходимости опираться только на полную картину дифракции или спектр для характеризации твердой формы. Специалисты в области фармации знают, что данные дифрактограммы или спектра можно использовать для характеризации твердой формы при условии, что данные для твердой формы отличны от данных для другой характеризуемой твердой формы. Таким образом, только один или несколько пиков порошковой рентгенограммы можно использовать для характеризации твердой формы. Подобным образом, можно использовать только один или несколько пиков ИКспектра или рамановского спектра для характеризации твердой формы. Такие характеризации осуществляют, сравнивая данные рентгенографии, рамановской и ИК-спектроскопии для форм для определения характеристических пиков. Также при такой характеризации можно сочетать результаты, полученные другими методами. Таким образом, для характеризации формы можно полагаться на один или несколько пиков порошковой дифрактограммы и, например, данные рамановсого или ИК-спектра. Например, если один или несколько рентгеновских пиков характеризуют форму, для характеризации формы можно также рассмотреть данные рамановской или ИК-спектроскопии. Иногда полезно рассмотреть данные рамановской спектроскопии, например, для фармацевтических композиций. Полиморфы идентифицируют, используя два различных типа условий кристаллизации. (1) Кристаллическую форму А выделяют после кристаллизации неочищенного влажного фильтровального остатка из метанола и сушки влажного фильтровального остатка для удаления растворителя, и (2) кристаллическую твердую форму В получают при кристаллизации из EtOH/H2O или растиранием с метанолом. Калиевую соль суспендируют в метаноле и затем греют до тех пор, пока не получат прозрачный раствор. После этого следует охлаждение, и полученное твердое кристаллическое вещество извлекают и сушат при комнатной температуре при пониженном давлении и получают морфологически отчетливую кристаллическую твердую форму А калиевой соли. Фиг. 14 и 2, соответственно, показывают кривую ДСК и порошковую рентгенограмму кристаллического твердого вещества. Дифференциальная сканирующая калориметрия (ДСК) формы А калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро 2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины определяет плавление десольвата при 238 С. Регистрируется большой пик разложения при начальной температуре приблизительно 300 С. На кривой ДСК характерным является резкое завершение плавления при примерно 246 С. На порошковой дифрактограмме пики при примерно 9,5 и 25,5 являются основными особенностями рентгенограммы (обсуждение теории, касающейся порошковых дифрактограмм, см. в "X-ray diffractionprocedures", H.P. Klug and L.E. Alexander, J. Wiley, New York (1974. Пики при примерно 2 9,5 и 2 25,5 характеризуют форму А относительно формы В, поскольку форма В не имеет пиков в пределах 2 0,2 - удвоенной погрешности пиков порошковой дифрактограммы - двух пиков формы А. Поскольку типичное колебание любого данного пика порошковой рентгенографии составляет величину порядка 2 0,2, при выборе пиков для характеризации полиморфа, выбирают пики, которые находятся по меньшей мере на две величины (т.е.0,4) от пика для другого полиморфа. Таким образом, на рентгенограмме определенного полиморфа, который находится по меньшей мере на 0,4 от пика в другом полиморфе,подходит для рассмотрения как пик, который можно или один или вместе с другим пиком использовать для характеризации такого полиморфа. Табл. 1 и 2 идентифицируют основные пики форм А и В. Из приведенного перечня видно, что пик при примерно 2 25,5 (в таблице указан как 2 25,478), когда берется с одним знаком после запятой, более чем на 2 0,2 отстоит от любого пика форм В. Таким образом, пик при примерно 2 25,5 можно использовать для того, чтобы отличить форму А от формы В. Пик при примерно 2 9,5 (2 9,522 в табл. 1) является наиболее интенсивным пиком на порошковой дифрактограмме на фиг. 2 и более чем на 2 0,2 отстоит от любого пика формы В. Таким образом, пики формы А при 2 9,5 и 2 25,5 характеризуют форму А относительно формы В. Твердая форма, выделенная в указанном состоянии в процессе, содержит примерно 2 молекулы воды на 1 молекулу соли. Таблица 1 Пик XRPD (2, ) и % интенсивности формы А калиевой соли,сведенные в таблицу результаты, представленные на фиг. 2b Предпочтительная ориентация может влиять на интенсивность пиков, но не на положение пиков на рентгенограммах. В случае калиевых солей предпочтительная ориентация оказывает наибольшее влияние в области с меньшими углами. Предпочтительная ориентация вызывает уменьшение (или увеличение) некоторых пиков. Отчетливого различия габитуса кристалла между твердыми формами не имеется; разнообразие габитусов наблюдают для каждой формы, включая иглы, пластинки и частицы неправильной формы. Таким образом, в одном воплощении настоящее изобретение относится к калиевой соли [4-(6-фтор- 11017402 7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в новых кристаллических формах, обозначенных как форма А и форма В. Таким образом, в одном воплощении изобретение относится к калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает по меньшей мере одну картину из числа(iii) кривую ДСК, по существу, в соответствии с фиг. 14; обозначенной в данном описании как форма А. В другом воплощении изобретение относится к калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает по меньшей мере одну картину из числа(i) инфракрасного спектра, соответствующего пикам поглощения при примерно 3559, 3389, 3324,1698, 1623, 1563, 1510, 1448, 1431, 1403, 1383, 1308, 1269, 1206, 1174, 1123, 1091, 1072, 1030, 987, 939,909, 871, 842, 787, 780, 769, 747, 718, 701, 690 и 667 см-1;(ii) рентгеновскую дифракторамму, содержащую пики при примерно 2 9,5 и 25,5; и(iii) эндотермический максимум при ДСК при примерно 246 С; обозначенной в данном описании как форма А. В другом воплощении изобретение относится к кристаллическому полиморфу калиевой соли [4-(6 фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, который дает инфракрасный спектр, содержащий пики поглощения при примерно 3559, 3389,3324, 1698, 1623, 1563, 1510, 1448, 1431, 1403, 1383, 1308, 1269, 1206, 1174, 1123, 1091, 1072, 1030, 987,939, 909, 871, 842, 787, 780, 769, 747, 718, 701, 690 и 667 см-1; обозначенному в данном описании как форма А. В другом воплощении изобретение относится к калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает рентгеновскую дифрактограмму,содержащую пики при примерно 2 9,5 и 25,5, обозначенной в данном описании как форма А. В другом воплощении изобретение относится к калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает эндотермический максимум при ДСК при примерно 246 С; обозначенной в данном описании как форма А. В другом воплощении изобретение относится к кристаллическому полиморфу калиевой соли [4-(6 фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, который дает спектр, содержащий по меньшей мере один, но меньший пик, чем в приведенном выше перечне, обозначенному в данном описании как форма А. Фиг. 16 и 3 соответственно показывают кривую ДСК и порошковую рентгенограмму для другого кристаллического твердого вещества. Приведенные результаты получают, когда удаляют оставшуюся воду. На кривой ДСК заметен переход при примерно 293 С, в то время как форма А плавится при 246 С. Пики при примерно 2 20,3 и 2 25,1 на порошковой дифрактограмме также характеризуют форму В,поскольку форма А не имеет пиков в пределах 2 0,2 - приблизительной погрешности пиков порошковой дифракции рентгеновских лучей - от двух характеристических пиков формы В (см. табл. 1 и 2). Из приведенного перечня видно, что пики при примерно 2 10,3 и 2 25,1 (указанные в табл. 2 как 2 20,328 и 2 25,087 соответственно), когда берутся с одним знаком после запятой, находятся в удалении от пиков для формы А более чем на 2 0,2. Таким образом, пики при примерно 2 20,328 и 2 25,087 можно использовать для того, чтобы отличить форму В от формы А. Таким образом, в одном воплощении изобретение относится к калиевой соли [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает по меньшей мере одну картину из числа(iii) кривую ДСК, по существу, в соответствии с фиг. 16; обозначенной в данном описании как форма В. В другом воплощении изобретение относится к калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, которая дает по меньшей мере одну картину из числа (i) инфракрасного спектра, соответствующего пикам поглощения при примерно 3584, 3327, 3189,2935, 2257, 2067, 1979, 1903, 1703, 1654, 1630, 1590, 1557, 1512, 1444, 1429, 1406, 1375, 1346, 1317, 1288,- 12017402 1276, 1243, 1217, 1182, 1133, 1093, 1072, 1033, 987, 943, 907, 883, 845, 831, 805, 776, 727, 694 и 674 см-1;(ii) рентгеновскую дифракторамму, содержащую пики при примерно 2 20,3 и примерно 2 25,1; и(iii) эндотермический максимум при ДСК при примерно 293 С; обозначенной в данном описании как форма В. В другом воплощении изобретение относится к калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме, включающей, по существу, чистую форму, когда соединение дает рентгеновскую дифракторамму, содержащую пики при примерно 2 20,3 и примерно 2 25,1; обозначенной в данном описании как форма В. В другом воплощении изобретение относится к натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в аморфной форме. В одном воплощении изобретение относится к форме натриевой соли [4-(6-фтор-7-метиламино-2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, которая дает по меньшей мере одну картину из числа(iii) кривую ДСК, по существу, в соответствии с фиг. 18; обозначенной в данном описании как аморфная форма. В другом воплощении изобретение относится к форме натриевой соли [4-(6-фтор-7-метиламино 2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, которая дает инфракрасный спектр, содержащий пики поглощения при примерно 3560, 1711, 1632, 1556, 1512, 1445,1407, 1375, 1309, 1280, 1227, 1133, 1092, 1032, 987, 905, 781, 770 и 691 см-1; обозначенной в данном описании как аморфная форма. В другом воплощении изобретение относится к кристаллическому полиморфу солей [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины,который дает спектр, содержащий по меньшей мере один, но меньший пик, чем в приведенных выше перечнях для обозначенных форм. Кристаллическая форма А калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины представляет собой дигидрат, который устойчив до относительной влажности (RH) 15% при 25 С, но который повторно гидратируется при RH 20% при 25 С. Обнаружено, что полиморф А калиевой соли устойчив в равной степени с аморфной формой натриевой соли. Не обнаруживается изменение химической чистоты соли любой формы по истечении недели в условиях ускоренных испытаний на устойчивость при высокой температуре (40 С) и высокой относительной влажности (RH 75%). Преимуществом кристаллической формы калиевой соли А является то, что она менее гигроскопична, чем аморфная форма натриевой соли, которая захватывает 15%, мас./мас. воды при RH 40%. Как форма А, так и форма В являются устойчивыми. Форма В калиевой соли является безводной и негигроскопичной (затруднено образование дегидратированной формы). Форма В калиевой соли сохраняет лучший физический вид и свойства обращения с ней в течение более длительного периода времени. Улучшение внешнего вида лекарственной формы усиливает ее принятие как врачами, так и пациентами и повышает вероятность успеха лечения. Другие воплощения изобретения включают смеси различных кристаллических твердых форм и аморфной формы [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины и ее солей. Такие смеси включают композиции, содержащие по меньшей мере одну твердую форму или по меньшей мере две твердые формы, выбранные из числа формы А,формы В и аморфной формы. Любой из аналитических методов, описанных в данном описании, можно использовать для обнаружения присутствия твердых форм в таких композициях. Детекцию можно осуществить качественно, количественно или полуколичественно в том смысле, как это используют и понимают специалисты в области анализа твердых тел. Для таких анализов можно использовать стандартные аналитические методы, включая использование эталонов. Далее такие способы могут включать применение методов, таких как частичные квадраты,в сочетании с дифракционным или спектроскопическим аналитическим методом. Такие методы также можно использовать для фармацевтических композиций по изобретению.V. Получение кристаллических твердых и аморфных форм по изобретению. Кроме того, настоящее изобретение относится к способам получения кристаллических твердых и аморфных форм калиевой и натриевой солей [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины. Кристаллические твердые и аморфные формы соединений по изобретению можно получить различными способами, описанными ниже. Можно использовать другие хорошо известные процедуры, а также модификацию процедур, описанных выше.- 13017402 В другом воплощении настоящее изобретение относится к калиевой соли [4-(6-фтор-7-метиламино 2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме А, которую получают по меньшей мере одним из способов, заключающихся в(i) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из этанола, метанола и их сочетания, и сушки таким образом, чтобы кристалл содержал некоторое количество растворителя; и(ii) нагревании калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-1 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из этанола, метанола и их сочетания; кристаллизации при температуре от примерно 50 до -10 С и сушки до тех пор, когда кристаллы содержат по меньшей мере примерно 0,05% растворителя. В другом воплощении настоящее изобретение относится к калиевой соли [4-(6-фтор-7-метиламино 2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в кристаллической твердой форме В, которую получают по меньшей мере одним из способов, заключающихся в(i) нагревании калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в сочетании растворителей этанола и воды; кристаллизации при температуре от примерно 50 до -10 С и сушки до тех пор, когда кристаллы содержат менее 0,05% растворителя; и(ii) кристаллизации калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины из сочетания растворителей этанола и воды и сушки таким образом, чтобы кристалл содержал менее 0,05% растворителя. В другом воплощении настоящее изобретение относится к аморфной кристаллической форме калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен 2-илсульфонилмочевины, которую получают порошкованием в изопропаноле и сушкой. В другом воплощении настоящее изобретение относится к аморфной кристаллической форме натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевины, которую получают по меньшей мере одним из способов, заключающихся в(i) нагревании натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере в одном растворителе, выбранном из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и кристаллизации при температуре от примерно 50 до -10 С;(ii) кристаллизации натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины по меньшей мере из одного растворителя, выбранного из группы, состоящей из изопропанола, ацетонитрила, этанола и их сочетания; и(iii) нагревании натриевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины в атмосфере с высокой влажностью. Кроме того, настоящее изобретение относится к описанным выше способам получения кристаллических твердых и аморфных форм калиевой и натриевой солей [4-(6-фтор-7-метиламино-2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины.[4-(6-Фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2 илсульфонилмочевину в кристаллической твердой или аморфной форме можно получить различными способами, которые также описаны ниже в примерах. Примеры иллюстрируют настоящее изобретение,но не ограничивают его объем. [4-(6-Фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевину в кристаллической твердой или аморфной формах можно выделить с использованием типичных методов выделения и очистки, известных в технике, включая, например, хроматографические процедуры, перекристаллизацию и другие процедуры кристаллизации, а также модификацию процедур, описанных выше.VI. Фармацевтические композиции. Соединение формулы (I) по изобретению можно ввести в состав фармацевтических композиций. Соответственно, изобретение также относится к фармацевтической композиции для предупреждения или лечения тромбоза у млекопитающего, в частности патологических состояний, включающих агрегацию тромбоцитов, содержащей терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, описанных выше, и фармацевтически приемлемый носитель или агент. Предпочтительно фармацевтическая композиция по изобретению содержит соединение формулы(I) или его соль в количестве, эффективном для ингибирования агрегации тромбоцитов, предпочтительнее АДФ-зависимой агрегации, у млекопитающего, в частности человека. Фармацевтически приемлемые носители или агенты включают вещества, известные в технике, и описаны ниже. Фармацевтические композиции по изобретению можно получить смешиванием соединения формулы (I) с физиологически приемлемым носителем или агентом. Фармацевтические композиции по изобретению также могут включать эксципиенты, стабилизаторы, разбавители и т.п. и могут предоставляться в препаратах с постепенным высвобождением или отсроченным высвобождением лекарственного средст- 14017402 ва. Приемлемые носители, агенты, эксципиенты, стабилизаторы, разбавители и т.п. для лечебного применения хорошо известны в области фармации и описаны, например, в Remington's Pharmaceutical Sciences, Mack Publishing Co., ed. A.R. Gennaro (1985). Такие материалы являются нетоксичными для реципиентов в используемых дозировках и концентрациях и включают буферные вещества, такие как соли,фосфаты, цитраты, ацетаты и другие органические кислоты, антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные (менее примерно десяти остатков) пептиды, такие как полиаргинин, белки,такие как сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин, моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные,глюкозу, маннозу или декстрины, хелатообразователи, такие как ЭДТК, сахарные спирты, такие как маннит или сорбит, источники противоионов, таких как натрий, и/или неионогенные поверхностноактивные вещества, такие как твин, или полиэтиленгликоль. Другие воплощения изобретения включают фармацевтические композиции с [4-(6-фтор-7 метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевиной, ее солями и формами, в том числе с терапевтически эффективными количествами формы А, формы В и аморфной формы. Указанные количества по меньшей мере одной из указанных форм могут являться количествами терапевтически эффективными или неэффективными. Такие фармацевтические композиции могут находиться в форме пероральной композиции, такой как таблетка или капсула, или в виде сухого порошка для ингаляции.VII. Способы лечения/введения. А. Предупреждение и лечение болезненных состояний, характеризующихся нежелательным тромбозом. Способы предупреждения или лечения тромбоза у млекопитающего, используемые по изобретению, включают введение млекопитающему, в частности человеку, терапевтически эффективного количества соединения формулы (I) одного или как части фармацевтической композиции по изобретению, описанной выше. Соединения формулы (I) и фармацевтические композиции по изобретению, содержащие соединение формулы (I) по изобретению, подходят для применения одни или как части многокомпонентной схемы лечения для предупреждения или лечения сердечно-сосудистых заболеваний, в частности заболеваний, связанных с тромбозом. Например, соединение или фармацевтическую композицию по изобретению можно использовать в качестве лекарственного средства или лечебного средства в случае любого тромбоза, в частности тромбоцитзависимого тромботического показания, включая, но не ограничиваясь перечисленным, острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, преходящее ишемическое нарушение мозгового кровообращения, удары, болезнь периферических кровеносных сосудов, преэклампсию/эклампсию, тромбоз глубоких вен, эмболию, диссеминированное внутрисосудистое свертывание и тромбоцитопеническую пурпуру, тромботические и рестенотические осложнения после инвазивных процедур, например ангиопластики, каротидной эндартерэктомии, после операции CABG (обходное шунтирование коронарной артерии), операции сосудистого шунтирования, постановки стента и внедрения эндоваскулярных устройств и протезов, и состояний возможной гиперкоагуляции, связанных с генетической предрасположенностью или онкозаболеваниями. В других группах воплощений показание выбирают из группы, состоящей из чрескожной коронарной интервенции (PCI), включая ангиопластику и/или постановку стента, острого инфаркта миокарда (AMI),нестабильной стенокардии (USA), ишемической болезни сердца (CAD), преходящего ишемического нарушения мозгового кровообращения (TIA), удара, болезни периферических кровеносных сосудов (PVD),операции коронарного шунтирования, каротидной эндартерэктомии. Соединения и фармацевтические композиции по изобретению также можно использовать как часть многокомпонентной схемы лечения в сочетании с другими лечебными или диагностическими средствами при предупреждении или лечении тромбоза у млекопитающего. В некоторых предпочтительных воплощениях соединения или фармацевтические композиции по изобретению можно вводить совместно с другими соединениями, типично прописываемыми для таких состояний согласно общепринятой медицинской практике, такими как антикоагулянты, тромболитические средства или другие антитромботические средства, в том числе ингибиторы агрегации тромбоцитов, тканевые активаторы плазминогена, урокиназа, проурокиназа, стрептокиназа, гепарин, аспирин или варфарин, или противовоспалительные средства (нестероидные противовоспалительные средства, ингибиторы циклооксигеназы II). Совместное введение также применяют для уменьшения доз как антитромботических, так и тромболитических средств и, следовательно, минимизации возможного геморрагического побочного действия. Соединения и фармацевтические композиции по изобретению также могут действовать синергетически для предотвращения окклюзии после успешной тромболитической терапии и/или уменьшения времени для реперфузии. Соединения и фармацевтические композиции по изобретению можно использовать обыкновенным путем in vivo для таких млекопитающих, как приматы (например, люди), овцы, лошади, крупный рогатый скот, свиньи, собаки, кошки, крысы и мыши, или in vitro. Определенные выше биологические свойства соединения или фармацевтической композиции по изобретению можно легко охарактеризовать способами, которые хорошо известны в технике, такими как, например, исследования in vivo для оценки- 15017402 антитромботической эффективности и влияния на гемостаз и гематологические параметры. Соединения и фармацевтические композиции по изобретению можно использовать в форме растворов или суспензий. При лечении тромботических расстройств соединения и фармацевтические композиции по изобретению также могут находиться в таких формах, как, например, таблетки, капсулы или эликсиры для перорального введения, суппозитории, стерильные растворы или суспензии для введения инъекцией и т.п., или быть включены в сформированные изделия. Субъектам (типично, млекопитающим), нуждающимся в лечении с использованием соединений или фармацевтических композиций по изобретению, можно вводить дозировки, которые будут обеспечивать оптимальную эффективность. Доза и способ введения будут изменяться от субъекта к субъекту и будут зависеть от таких факторов, как тип млекопитающего, которого лечат, его пол, масса, питание, сопутствующее лечение, общее клиническое состояние, определенное используемое соединение формулы (I), конкретное применение, для которого используют определенное соединение или фармацевтическую композицию, и других факторов, которые установят специалисты в области медицины. В. Терапевтически эффективное количество. Дозированные соединения формулы (I) или фармацевтические композиции, содержащие соединение по изобретению, которые используют для лечебного введения, должны быть стерильными. Стерильность легко достигается фильтрацией через стерилизующие мембраны, такие как 0,2-микронные мембраны, или другими обычными способами. Композиции типично будут храниться в твердой форме,предпочтительно в лиофилизованной форме. Хотя предпочтительным способом введения является пероральный способ, лекарственные препараты соединений формулы (I) или фармацевтические композиции по изобретению также можно вводить инъекцией, внутривенно (болюсно и/или инфузией), подкожно,внутримышечно, через толстую кишку, ректально, назально, трансдермально или интраперитонеально. Также можно использовать различные лекарственные формы, в том числе, но не ограничиваясь перечисленным, суппозитории, имплантируемые шарики или небольшие цилиндры, аэрозоли, пероральные лекарственные препараты и местные препараты, такие как мази, капли и дермальные пэтчи. Соединения формулы (I) и фармацевтические композиции по изобретению также можно включать в формы и изделия, такие как имплантаты, в которых могут использоваться инертные материалы, такие как биоразлагаемые полимеры или синтетические силиконы, как, например, силастик, силиконовый каучук или другие полимеры, доступные коммерчески. Соединения и фармацевтические композиции по изобретению также можно вводить в форме систем с липосомной доставкой, таких как небольшие однослойные везикулы, крупные однослойные везикулы и многослойные везикулы. Липосомы можно получить из различных липидов, таких как холестерин, стеариламина или фосфатидилхолинов. Терапевтически эффективные дозировки можно определить способами как in vivo, так и in vitro. Для каждого определенного соединения или фармацевтической композиции по настоящему изобретению можно провести отдельные определения для того, чтобы определить оптимальную требуемую дозировку. На интервал терапевтически эффективных дозировок будет влиять способ введения, цели лечения и состояние пациента. В случае инъекции иглой для подкожных инъекций можно предположить, что дозировка доставляется в жидкости организма. В случае других способов введения эффективность всасывания можно определить отдельно для каждого соединения способами, хорошо известными в фармакологии. Соответственно, для врача может стать необходимым титрование дозировки и модификация способа введения, что потребуется, для того, чтобы получить оптимальный терапевтический эффект. Определение эффективных уровней дозировок, т.е. уровней дозировок, необходимых для достижения желательного результата, будет легко осуществлять специалист в данной области техники. Типично применения соединения начинают при более низких уровнях дозировок, причем уровни повышают до тех пор, пока не достигнут нужного эффекта. Определение эффективных уровней дозировок, т.е. уровней дозировок, необходимых для достижения желательного результата, т.е. ингибирования АДФ-рецепторов тромбоцитов, будет легко осуществлять специалист в данной области техники. Типично применение соединения или фармацевтической композиции начинают при более низких уровнях дозировок, причем уровни повышают до тех пор, пока не достигнут нужного эффекта. Соединения и композиции по изобретению можно вводить перорально в эффективном количестве в интервале дозировок примерно 0,01-1000 мг/кг по схеме приема однократной дозы или нескольких раздельных доз в сутки. Если в фармацевтической композиции по изобретению используют фармацевтически приемлемый носитель, типично примерно 5-500 мг соединения формулы(I) смешивают, как предусмотрено принятой фармацевтической практикой, с фармацевтически приемлемым носителем, включающим физиологически приемлемый разбавитель, носитель, эксципиент, связующее вещество, консервант, стабилизатор, краситель, отдушку и т.д. Количество активного ингредиента в таких композициях является таким, что получают подходящую дозировку в указанном интервале. С. Введение. Лечебные жидкие препараты соединений, как правило, помещают в контейнер, имеющий стерильный ввод, например мешок для внутривенных растворов или флакон с пробкой, протыкаемой иглой для подкожных инъекций. Типичными адъювантами, которые могут быть включены в таблетки, капсулы, лепешки и т.п., яв- 16017402 ляются связующие вещества, такие как аравийская камедь, кукурузный крахмал или желатин, и эксципиенты, такие как микрокристаллическая целлюлоза, вещества, способствующие рассыпанию, подобные кукурузному крахмалу или альгиновой кислоте, смазывающие вещества, такие как стеарат магния, подслащивающие вещества, такие как сахароза или лактоза, или корригенты. Когда лекарственная форма представляет собой капсулу, кроме вышеуказанных веществ она также может содержать жидкие носители, такие как вода, физиологический раствор или нелетучее масло. Другие вещества различных типов могут использоваться в качестве покрытий или в качестве модификаторов физической формы лекарственной единицы. Можно получить стерильные композиции для инъекций согласно обычной фармацевтической практике. Например, может потребоваться раствор или суспензия активного соединения в среде, такой как масло или синтетический разбавитель на основе жирных кислот, подобный этилолеату, или в липосомах. Согласно обычной фармацевтической практике можно включать буферирующие вещества,консерванты, антиоксиданты и т.п.D. Комбинированные терапии. Соединения по настоящему изобретению также можно использовать в сочетании с другими лечебными или диагностическими средствами. В некоторых предпочтительных воплощениях соединения по данному изобретению можно вводить совместно с другими соединениями, типично предписанными для таких состояний согласно общепринятой медицинской практике, такими как антикоагулянты, тромболитические средства или другие антитромботические средства, в том числе ингибиторы агрегации тромбоцитов, тканевые активаторы плазминогена, урокиназа, проурокиназа, стрептокиназа, гепарин, аспирин или варфарин. Соединения по настоящему изобретению также могут действовать синергитически для предотвращения реокклюзии после успешной тромболитической терапии и/или уменьшения времени для реперфузии. Такие соединения также можно использовать для уменьшения доз применяемых тромболитических средств и, следовательно, минимизации возможного геморрагического побочного действия. Соединения по данному изобретению можно использовать in vivo для таких млекопитающих, как приматы (например, люди), овцы, лошади, крупный рогатый скот, свиньи, собаки, кошки, крысы и мыши, илиin vitro. Следует иметь в виду, что приведенные в данном описании обсуждение, воплощения и примеры только представляют подробное описание некоторых предпочтительных воплощений. Для специалистов в данной области техники будет очевидно, что можно осуществить различные модификации и эквиваленты без отхода от сущности и объема изобретения. Все патенты, журнальные статьи и другие документы, обсуждаемые или цитируемые выше, включены в данное описание в качестве ссылок. Приведенные далее примеры даются для того, чтобы помочь специалистам в данной области техники яснее понять и осуществить на практике настоящее изобретение. Их не следует рассматривать как ограничение объема изобретения, но только как иллюстрации и характерные примеры.VIII. Примеры. Общие методы. Исходные вещества и реагенты, используемые для получения указанных соединений, как правило,или являются доступными от коммерческих источников, таких как Aldrich Chemical Co., или их получают способами, известными специалистам в данной области техники, следуя процедурам, указанным в ссылках, таких как Fieser and Fieser's Reagents for Organic Synthesis; WileySons: New York, 1967-2004,Volumes 1-22; Rodd's Chemistry of Carbon Compounds, Elsevier Science Publishers, 1989, Volumes 1-5 andSupplements; и Organic Reactions, WileySons: New York, 2005, Volumes 1-65. Приведенные далее схемы реакций синтеза только иллюстрируют некоторые способы, которыми можно синтезировать соединения по настоящему изобретению, и различные модификации таких схем реакций синтеза могут быть осуществлены и предложены для специалистов при обращении к раскрытию, содержащемуся в данной заявке. Исходные вещества и промежуточные соединения по схемам реакций синтеза можно при необходимости извлекать и очищать с использованием обычных методов, включая фильтрацию, перегонку,кристаллизацию, хроматографию и т.п. и другие методы. Такие материалы можно характеризовать с использованием обычных средств, включая физические постоянные и спектральные данные. Если не указано иное, реакции, описанные в данном описании, предпочтительно проводят в инертной атмосфере при атмосферном давлении при температуре реакции в интервале от примерно -78 до примерно 150 С, предпочтительнее от примерно 0 до примерно 125 С и наиболее предпочтительно и удобно при примерно комнатной температуре (или температуре окружающей среды), например от примерно 20 до примерно 75 С. Что касается примеров, приведенных далее, то соединения по настоящему изобретению синтезируют с использованием способов, описанных в данном описании, или других способов, которые хорошо известны в технике. Соединения и/или промежуточные соединения характеризуют методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Waters Alliance, с модулем разделения 2695 (Milford, Mass.). Аналитическими колонками являются колонки С-18, SpeedROD- 17017402 Используют градиентное элюирование, типично начиная со смеси 5% ацетонитрила/95% воды и достигая смеси с 95% ацетонитрила в течение 5 мин для системы Alliance и 1 мин для системы Acquity. Все растворители содержат 0,1% трифторуксусной кислоты (ТФК). Соединения детектируют при поглощении ультрафиолетового излучения (УФ) или при 220, или 254 нм. Растворители для ВЭЖХ от EMDChemicals, Inc. (Gibbson, N.J.). В некоторых случаях чистоту определяют тонкослойной хроматографией(ТСХ) с использованием стеклянных пластин с силикагелем, таких как, например, пластины EMD SilicaGel 60, 2,57,5 см. ТСХ приводит к очень легкому визуальному обнаружению в ультрафиолетовом свете или с использованием паров йода и других методов окрашивания. Масс-спектрометрический анализ осуществляют на одном из двух приборов ЖХМС серии Agilent 1100 со смесью ацетонитрил/вода в качестве подвижной фазы. В одной системе используется ТФК в качестве модификатора, и измерения осуществляются с положительными ионами [результаты приводятся в виде МН+, (М+1) или (М+Н)+], а в другой используют или муравьиную кислоту, или ацетат аммония и проводят измерения как с положительными ионами [результаты приводятся в виде МН+, (М+1) или(М+Н)+], так и отрицательными ионами [результаты приводятся в виде М-, (М-1) или (М-Н)-]. Анализ методом ядерного магнитного резонанса (ЯМР) осуществляют с некоторыми соединениями на системе ЯМР Varian, 400 МГЦ (Palo Alto, Calif.). Спектральным стандартом является или ТМС, или известный химический сдвиг растворителя. Чистоту некоторых соединений по изобретению оценивают элементным анализом (Robertson Microlit, Madisom, N.J.). Температуры плавления определяют на приборе Mel-Temp, Laboratory Devices (Holliston, Mass.). Препаративное разделение осуществляют с использованием хроматографической системы Sql6x или Sg100c и все предварительно заполненные силикагелем колонки закупают у Teledyne Isco (Lincoln,NE). С другой стороны, соединения и промежуточные соединения очищают колоночной флэшхроматографией с использованием материала для набивки силикагеля (230-400 меш) или ВЭЖХ с использованием колонки для ВЭЖХ с обращенной фазой с С-18. Типичными растворителями, используемыми для систем Isco и колоночной флэш-хроматографии, являются дихлорметан, метанол, этилацетат,гексан, ацетон, водный гидроксиламин и триэтиламин. Типичными растворителями, используемыми для ВЭЖХ с обращенной фазой, являются смеси с изменяющимися концентрациями ацетонитрила и воды с 0,1% трифторуксусной кислоты. Приборы для исследования твердых форм. 1. Инфракрасная спектроскопия с FT (FTIR). Образцы исследуют на Perkin-Elmer Spectrum One, снабженном приспособлением для ввода пробUniversal ATR и рабочим программным обеспечением Spectrum V5.0.1. Разрешение устанавливают на 4 см-1 и получают 16 прогонов в интервале от 4000 до 400 см-1. Программное обеспечение контроля и анализа Spectrum v 5.0.1. 2. Дифференциальная сканирующая калориметрия (ДСК). Данные ДСК (термограммы) получают на приборах ТА Q1000, снабженных 50-позиционным автоматическим устройством для ввода проб. Калибровочным стандартом энергии и температуры является индий. Образцы нагревают со скоростью 10 С/мин от 10 до 250 С. Поддерживают продувку азотом над образцом при 30 мл/мин. Используют образец от 1 до 3 мг, если не указано иное, и все образцы изолируют в алюминиевом резервуаре с отверстием в крышке. Программное обеспечение контроля Advantage for Q series v 2.2.0.248,Thermal Advantage Realease 4.2.1. Программное обеспечение анализа Universal Analysis 2000 v 4.1D Build 4.1.0.16. 3. Термогравиметрический анализ (ТГА). Данные ТГА (термограммы) получают на приборе ТА Q500 TGA с 16-позиционным автоматическим устройством для ввода проб. Образцы нагревают со скоростью 10 С/мин. Поддерживают продувку азотом над образцом 100 мл/мин. Типично образец в 5-20 мг помещают на взвешиваемый открытый алюминиевый лоток. Программное обеспечение контроля Advantage for Q series v 2.2.0.248, Thermal Advantage Realease 4.2.1. Программное обеспечение анализа Universal Analysis 2000 v 4.1D Build 4.1.0.16. 4. XRPD (Порошковая рентгенография). Дифрактометр Bruker AXS C2 GADDS. Рентгеновские дифрактограммы образцов получают на дифрактометре Bruker AXS С 2 GADDS с использованием излучения K Cu (40 кВ, 40 мА), автоматизированной фазы XYZ (XYZ stage), лазерного телевизионного микроскопа для автоматического определения координат образца и 2-мерного детектора площади HiStar. Рентгеновская оптика состоит из многослойного зеркала Gobel, соединенного с точечным коллиматором с отверстием 0,3 мм. Расходимость пучка, т.е. действительный размер рентгеновского пучка на образце, составляет приблизительно 4 мм. Используют режим непрерывного сканирования - с расстоянием от образца до детектора 20 см, что дает диапазон измерений 2 3,2-29,8. Типичное время экспозиции образца составляет- 18017402 120 с. Рабочие образцы в условиях окружающей среды получают в виде плоских пластинчатых образцов с использованием порошка, как полученного без измельчения. Приблизительно 1-2 мг образца слегка прессуют на предметном стекле и получают плоскую поверхность. Программное обеспечение контроляGADDS for WNT v 4.1.16. Программное обеспечение анализа Diffrac Plus Release 3 EVA v 9.0.0.2. 5. Гравиметрические исследования сорбции паров (GVS). Изотермы получают на анализаторе сорбции влаги Hiden IGASorp, работающем по программеCFRSorp. Размер образцов типично составляет са. 10 мг. Изотерму адсорбция/десорбция влаги получают так, как описано ниже. Образцы загружают и выгружают при влажности и температуре помещения (са.RH 40%, 25 С). Стандартное изотермическое испытание представляет один цикл, начиная с RH 40%. Влажность изменяют ступенчато следующим образом: 40, 50, 60, 70, 80, 90, 85, 75, 65, 55, 45, 35, 25, 15,5, 0, 10, 20, 30, 40. Программное обеспечение контроля и анализа IGASorp Controller v 1.10, IGASorp Systems Software v 3.00.23. 6. 1 Н ЯМР. Спектры получают на Bruker 400 МГц, снабженном автоматическим устройством для ввода проб. Образцы получают в d6-ДМСО. 7. Анализ на чистоту. Анализ на чистоту осуществляют на системе Agilent HP 1100, снабженной диодным матричным детектором. Метод: градиент. Характеристики колонки: Betabasic C18, 5 мкм, 1504,6 мм. Температура колонки 25 С. Объем впрыска 5 мкл. Скорость потока, в мл/мин, 0,8 мл/мин. Длина волны детекции 325 нм. Фаза А: 0,1%, об./об., водной муравьиной кислоты. Фаза В: ацетонитрил:вода 90:10, с 0,1%, об./об., муравьиной кислоты. Таблица 3 График изменения подвижной фазы Пример 1. Синтез промежуточного карбамата сульфонилмочевины (8). Описанная далее процедура является адаптированной процедурой из С.A. Hunt et al., J. Med. Chem.,1994, 37, 240-247. В трехгорлую колбу R.B., снабженную механической мешалкой, воздушным холодильником, капельной воронкой и трубкой, защищающей от влаги, помещают хлорсульфоновую кислоту(240 мл, 3,594 моль). При перемешивании добавляют по частям PCl3 (300 г, 1,44 моль, 0,40 экв.) са. в течение 45 мин. Во время добавления происходит энергичное выделение большого объема газообразногоHCl, но температура смеси существенно не повышается (40 С). Ко времени, когда почти весь PCl3 добавлен, получают прозрачный бледно-желтый раствор, причем только несколько кусочков PCl3 плавают в суспензии. Смесь перемешивают до тех пор, пока не прекратится выделение газа (0,5 ч). Затем реакционный сосуд охлаждают на льду и через капельную воронку в течение 1,0 ч добавляют 2-хлортиофен (66,0 мл, 0,715 моль). При добавлении самых первых нескольких капель 2-Cl-тиофена смесь становится темно-фиолетовой и ко времени, когда добавлен весь тиофен, образуется темнофиолетовый раствор. Во время добавления непрерывно выделяется газ HCl с небольшой скоростью. Затем реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь - темно-фиолетовый прозрачный раствор добавляют по каплям в течение 0,5 ч к измельченному льду (3 л). При добавлении ко льду фиолетовый цвет сразу же исчезает; бесцветную эмульсию перемешивают механически при комнатной температуре в течение са. 15 ч. Затем смесь экстрагируют CH2Cl2 (3300 мл). Объединенные CH2Cl2-экстракты промывают водой (1200 мл), насыщенным раствором NaHCO3 (1250 мл) и рассолом (1100 мл), сушат (Na2SO4), концентрируют на роторном испарителе и получают сырой продукт реакции в виде бледно-желтого клея, который показывает склонность к отверждению с образованием полутвердой массы. Затем полученную массу очищают перегонкой в высоком вакууме (т.кип. 110-112/12 мм) и получают 135,20 г (88%) названного в заголовке соединения в виде бесцветного/бледно-желтого полутвердого вещества. Стадия 2. 5-Хлортиофен-2-сульфонамид.Conc. - конц., to = -, THF - ТГФ 1 - (подкисление конц. HCl). Описанная далее процедура является адаптированной процедурой из С.А. Hunt et al., J. Med. Chem.,1994, 37, 240-247. В трехгорлую колбу R.B., снабженную механической мешалкой, помещают конц.NH4OH (500 мл, 148, 50 г NH3, 8,375 моль NH3, 13,07 экв. NH3). Колбу охлаждают на льду и добавляют по частям в течение 0,5 ч 5-хлортиофен-2-сульфонилхлорид (145,0 г, 0,668 моль) (указанное вещество низкоплавкое и затем расплавленное при нагревании добавляется через полиэтиленовую пипетку с широким носиком). Сульфонилхлорид в реакционной колбе сразу же становится твердым. После того как добавлен весь сульфонилхлорид, содержавшую его колбу ополаскивают ТГФ (25 мл), который также переносят в реакционный сосуд. Затем густую суспензию перемешивают при комнатной температуре в течение са. 20 ч. По окончании указанного времени реакционная смесь все еще представляет собой суспензию, но другой текстуры. Затем смесь охлаждают на льду, разбавляют Н 2 О (1,5 л) и подкисляют конц. HCl до рН са. 3. Твердый продукт реакции собирают фильтрацией с использованием воронки Бюхнера, промывают холодной водой, сушат на воздухе и получают названное в заголовке соединение в виде бесцветного твердого вещества, 103,0 г (78%). МС (М-Н): 196,0; 198,0. Стадия 3. Этил-5-хлортиофен-2-сульфонилкарбамат.THF - ТГФ, to = -, h - ч 5-Хлортиофен-2-сульфонамид. В 2-л 3-горлую колбу R.B., снабженную механической мешалкой и капельной воронкой, загружают сульфонамид (60,0 г, 303,79 ммоль) и Cs2CO3 (200 г, 613,83 ммоль, 2,02 экв.) в ТГФ (900 мл). Прозрачный раствор охлаждают на льду и в течение са. 30 мин добавляют этилхлорформиат (70,0 мл, 734,70 ммоль,2,418 экв.). Затем густую суспензию перемешивают при комнатной температуре в течение са. 36 ч. Затем смесь разбавляют водой (200 мл) и получают прозрачный бесцветный раствор, который концентрируют на роторном испарителе до одной трети его объема. Затем полученную смесь разбавляютEtOAc (250 мл), охлаждают на льду и подкисляют 6N HCl до рН са. 1. Двухфазную смесь переносят в делительную воронку, слои разделяют и затем водный слой снова экстрагируют EtOAc 275 мл. Объединенные органические экстракты промывают водой/рассолом (250 мл), рассолом (150 мл), сушат надNa2SO4 и концентрируют, получают названное в заголовке соединение в виде слабоокрашенного масла. Масло очищают фильтрацией через слой силикагеля. Сырой продукт реакции в EtOAc вносят в слой силикагеля на воронке со спеченным фильтром и затем элюируют EtOAc (1 л). Концентрирование фильтрата дает названное в заголовке соединение в виде бесцветного твердого вещества, 71,28 г (87%). МС (М-Н): 268,0; 270,0. 1 Стадия 1. Анилин 1 (1 Н ЯМР (ДМСО):7,58 (дд, 1 Н), 6,72 (дд, 1 Н), 3,77 (с, 3 Н); 6,0 г, 32,085 ммоль) помещают в 500-мл круглодонную колбу и добавляют 20% раствор фосгена в толуоле (175 мл, 332,50 ммоль,10,36 экв.). Затем полученную несколько липкую суспензию перемешивают магнитной мешалкой в течение ночи при комнатной температуре и получают прозрачный бесцветный раствор. Берут аликвоту, сушат, пропуская аргон, гасят МеОН и анализируют ОФ-ВЭЖХ/МС для того, чтобы показать отсутствие непрореагировавшего анилина 1 и отчетливое образование изоцианата 2 а и/или карбамоилхлорида 2b,анализируемый как его метилкарбамат. Смесь концентрируют сначала выпариванием на роторном испарителе, затем в высоком вакууме и получают 6,76 г (выход 99%) изоцианата 2 а и/или карбамоилхлорида 2b в виде свободнотекучего бесцветного твердого вещества.(100 мл). К смеси через шприц добавляют триэтиламин (5,30 мл, 38,025 ммоль, 1,52 экв.). Затем прозрачный темно-коричневый раствор обрабатывают раствором изоцианата 2 а (5,30 г, 24,88 ммоль) и/или карбамоилхлорида 2b в ДМФА (50 мл), добавляя раствор по каплям в течение 15 мин. По завершении добавления получают несколько мутную смесь, которую перемешивают в течение ночи при комнатной температуре. Анализируют аликвоту после гашения МеОН для того, чтобы показать отсутствие непрореагировавшего изоцианата и отчетливое образование мочевины 3 а и хиназолин-1,3-диона 4 а в соотношении са. 2,5:1. МС (М-Н): 388,0. Затем в смесь добавляют через шприц по каплям в течение 5 мин DBU (3,75 мл, 25,07 ммоль, са. 1,0 экв.) и получают прозрачный темно-коричневый раствор. Полученный раствор перемешивают при комнатной температуре в течение 3 ч и получают мутную смесь. Анализ ВЭЖХ показывает отсутствие мочевины 3 а и отчетливое образование хиназолин-1,3-диона 4 а. Реакционную смесь концентрируют на роторном испарителе и получают сырой продукт реакции в виде твердого вещества. Полученный продукт сушат в высоком вакууме и затем обрабатывают смесью CH2Cl2/H2O (5:1), и получают 8,40 г 4 а в виде почти бесцветного твердого вещества (выход 87%). 1N-Boc-анилин 4 а (4,0 г, 10,28 ммоль) помещают в круглодонную колбу и добавляют 4N раствор HCl в диоксане (50,0 мл, 200 ммоль, 19,40 экв.). Густую, почти сольватированную суспензию перемешивают при комнатной температуре в течение 5,0 ч. ВЭЖХ показывает отсутствие исходного вещества и отчетливое образование анилина 5 а. Затем смесь концентрируют на роторном испарителе и получают сырой продукт реакции. Полученное таким образом твердое вещество обрабатывают CH2Cl2 и получают 3,22 г чистого 5 а в виде почти бесцветного твердого вещества (выход 96%). МС (М-Н): 290,3. 1 Н ЯМР (ДМСО):11,75 (с, 1H), 7,88 (дд, 1H), 7,32 (м, 4 Н), 7,21 (дд, 1 Н). Стадия 4. 1 - ДМСО-ТГФ, 110 С, 3 ч 2 - (325,5, включая HCl) (289, мас./об., HCl) Дифторсоединение 5 а (1,0 г, 3,072 ммоль) помещают в пробирку, закрывающуюся завинчивающейся пробкой. Добавляют ДМСО (20 мл), затем метиламин (2,0 М раствор в ТГФ) (15,0 мл, 30 ммоль, 9,76 экв.) и получают прозрачный раствор. Затем полученный раствор греют на масляной бане при 110 С в течение 3 ч. ВЭЖХ показывает отсутствие непрореагировавшего 5 а и отчетливое образование 5b. Затем смесь охлаждают до комнатной температуры, выпаривают весь MeNH2 и ТГФ и остаток разбавляют 100 мл воды для высаживания 5b. После перемешивания в течение са. 2 ч при комнатной температуре собирают фильтрацией через воронку Бюхнера бесцветное твердое вещество, промывают его Н 2 О (100 мл) и сушат на воздухе. Анализ ВЭЖХ полученного твердого вещества показывает, что оно является чистым и не содержит DBU. Затем полученное твердое вещество очищают обработкой Et2O и затем CH2Cl2, как ранее для указанного анилина, и получают 875 мг названного в заголовке соединения (выход 95%). МС (М+Н) 301,2. 1 Н ЯМР (ДМСО):11,10 (с, 1H), 7,36 (д, 1H), 6,78 (д, 1 Н), 6,75 (м, 1H), 6,56 (д, 2 Н), 6,20 (д, 1H),5,18 (д, 2 Н), 2,76 (д, 3 Н). Стадия 5. Синтез 1-(5-хлортиофен-2-илсульфонил)-3-(4-(6-фтор-7-(метиламино)-2,4-диоксо-1,4 дигидрохиназолин-3(4 Н)-ил)фенил)мочевины (7 а). Ацетонитрил/Кипячение с обратным холодильником Реакционную смесь, содержащую анилин (16,0 г, 53,33 ммоль) и этилсульфонилкарбамат (28,77 г,106,66 ммоль, 2,0 экв.) в CH3CN (1300 мл), кипятят с обратным холодильником в течение 36 ч. На протяжении указанного времени реакционная смесь остается густой суспензией. Анализ ВЭЖХ показывает отчетливую реакцию и 1% анилина. Густую суспензию охлаждают до комнатной температуры и фильтруют через воронку Бюхнера. Затем продукт реакции бесцветное твердое вещество промывают CH3CN(340 мл). ВЭЖХ фильтрата показывает присутствие только следового количества нужного продукта,причем большинство составляет избыток карбамата. Затем сырой продукт реакции обрабатывают CH2Cl2(400 мл) и почти бесцветный твердый продукт собирают фильтрацией через воронку Бюхнера. Выход 25,69 г (92%). МС (М+1): 524,0, 526,0. 1 Н ЯМР (ДМСО):11,20 (с, 1 Н), 9,15 (с, 1H), 7,68 (д, 1 Н), 7,36 (д, 1H), 7,26 (м, 1H), 7,16 (д, 2 Н),6,78 (м, 1H), 6,24 (д, 1H), 2,78 (д, 3 Н).- 22017402 Пример 3. Синтез [4-(6-хлор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевины (6b). Соединение примера 3 синтезируют так, как описано в примере 2 (стадии 1-5), за исключением того, что исходят из метил-2-амино-5-хлор-6-фторбензоата, который синтезируют, восстанавливая метил 2-нитро-5-хлор-6-фторбензоат с помощью Pt(S)C. Пример 4. Синтез [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)фенил]-5 хлортиофен-2-илсульфонилмочевины (6 а) и соли (7 а).Step - стадия, Mol. Wt. - мол. масса, equiv - экв. 1 - п-нитрофенилхлорформиат. Метил-2-амино-4,5-дифторбензоат [2] (38 кг, 1,0 экв.) и дихлорметан (560 кг, 8 Х, ACS99,5%) загружают в реактор PP1-R1000 (реактор GL, 2000 л). Реакционную смесь перемешивают в течение 5 мин. В реактор PP1-R2000 (200 л) загружают 4-нитрофенилхлорформиат (49,1 кг, 1,2 экв.), а затем дихлорметан (183 кг) и перемешивают содержимое в течение 5 мин. После повышения давления в 200-л реакторе раствор 4-нитрофенилхлорформиата переносят в 2000-л реактор, содержащий раствор [2] в дихлорметане. Реакционную смесь греют при 405 С (образование флегмы) при продувке газом азотом в течение 3 ч. Характерный анализ ТСХ подтверждает полное протекание реакции (по ТСХ соединения 2 не остается; CHCl3-МеОН 99:1). Раствор охлаждают до 30 С и отгоняют 460 кг дихлорметана в вакууме. В 2000-л- 23017402 реактор загружают 520 кг гексана, охлаждают содержимое реактора до 05 С и перемешивают в течение 4 ч. Полученное твердое вещество отфильтровывают на фильтре Нутча GF фильтровальным листом Т 515 LF Typar и листом фильтровальной бумаги Mel-Tuf 1149-12. Остаток на фильтре промывают 20 кг гексана и сушат в вакууме при 35 С до постоянной массы. Сухой продукт выгружают (70,15 кг) с выходом 98%. Данный продукт подтверждают анализом методом 1 Н ЯМР и ТСХ. Стадия 2. Синтез гидрохлорида 3-(4-аминофенил)-6,7-дифторхиназолин-2,4(1 Н,3 Н)-диона, соединение 5b.equiv - экв., Mol. Wt. - мол. масса, Dioxane - диоксан, step - стадия 1 - трет-бутил-4-аминофенилкарбамат. В реактор PP1-R1000 (реактор GL, 2000 л) загружают 3 а (64,4 кг, 1,0 экв.), безводный тетрагидрофуран (557 кг) и триэтиламин (2,2 кг, 0,1 экв.). Загрузочный трубопровод реактора GL, 2000 л, промывают тетрагидрофураном (10 кг). Содержимое реактора перемешивают в течение 25 мин, причем за указанное время получают полное растворение. В реактор PP1-R2000 (реактор HP, 200 л) загружают N-Bocп-фенилендиамин (38 кг, 1.0 экв.) и тетрагидрофуран (89 кг) и перемешивают в течение 30 мин до полного растворения. Содержимое реактора HP, 200 л, переносят в реактор GL, 2000 л, содержащий соединение 3 а, и затем все греют при 655 С в течение 2 ч. Реакцию считают завершенной, когда контроль ВЭЖХ подтверждает исчезновение исходного вещества 3 а (по техническим условиям процесса 1%). Содержимое реактора GL, 2000 л, охлаждают до 205 С и затем в течение 20 мин загружают метоксид натрия (25% раствор в метаноле, 41,5 кг, 1,05 экв.), поддерживая температуру ниже 30 С. Загрузочные трубопроводы промывают тетрагидрофураном (10 кг). Содержимое перемешивают при 255 С в течение 4 ч. Анализ ВЭЖХ в ходе процесса подтверждает завершение реакции, когда количество соединения 3b,остающегося в реакционной смеси, составляет 1%. К полученной реакционной смеси добавляют фильтрованную технологическую воду (500 кг) и перегоняют в вакууме содержимое реактора GL, 2000 л, в чистый приемник GL, 200 л, до тех пор, пока не отгонят 300 кг растворителя. Полученное твердое вещество отфильтровывают с использованием фильтра Нутча GL и промывают технологической фильтрованной водой до тех пор, пока цвет твердого соединения 4b не станет от белого до сероватого. В реактор GL,2000 л, загружают влажный остаток на фильтре соединения 4b и диоксан (340 кг) и перемешивают содержимое реактора в течение 1 ч. Полученное вещество, поддающееся фильтрации, отфильтровывают через фильтр Нутча GL с листом фильтровальной бумаги Т 515 LF Typar. Твердый остаток на фильтре сушат обдуванием в течение 2 ч и затем в реактор GL, 2000 л, загружают диоксан (200 кг). Содержимое реактора перемешивают в течение 10 мин и затем в течение 3 ч загружают 4N раствор HCl в диоксане(914 кг), поддерживая внутреннюю температуру ниже 30 С. Загрузочный трубопровод промывают дополнительным количеством диоксана (10 кг) и содержимое реактора перемешивают в течение 6 ч при 255 С. Завершение реакции контролируют ВЭЖХ (по ходу контроля соединение 4 в реакционной смеси составляет 1%) по превращению соединения 4b в соединение 5b. Содержимое реактора охлаждают до 55 С в течение 2 ч и полученное твердое вещество отфильтровывают на фильтре Нутча GL с последующей промывкой диоксаном (50 кг). Остаток на фильтре сушат обдуванием азотом при давлении са. 5548 кПа (87 ф/д 2) в течение 30 мин и анализируют ВЭЖХ на чистоту. Отфильтрованное твердое вещество сушат до постоянной массы в вакуумной печи при 45 С в течение 48 ч. Соединение 5b (65,8 кг,фактический выход 110,6%) выгружают и анализируют методами 1 Н ЯМР и ВЭЖХ. 1 Н ЯМР (ДМСО):11,75 (с, 1H), 7,88 (дд, 1H), 7,32 (м, 4 Н), 7,21 (дд, 1H). Стадия 3. Синтез 3-(4-аминофенил)-6-фтор-7-(метиламино)хиназолин-2,4(1 Н,3 Н)-диона, соединение 5 с.equiv - экв., Mol. Wt. - мол. масса, DMSO - ДМСО, step - стадия В реактор PP1-R2000 (реактор HP, 200 л) загружают соединение 5b (18 кг, 1,0 экв.) и создают давление азота са. 689,534,5 кПа (1005 ф/д 2). Удаляют азот из реактора через линию атмосферной продувки, затем открывают клапан холодильника и затем в реактор загружают диметилсульфоксид (99,7%, 105 кг) под слой аргона. Содержимое реактора перемешивают при 22 С (19-25 С) в течение 15 мин, затем создают максимально достижимый вакуум в реакторе HP, 200 л, и закрывают все клапаны. С использованием установленного вакуума загружают в реактор HP, 200 л, метиламин (33 мас.% в абсолютном этаноле, 37,2 кг) со скоростью, при которой сохраняется внутренняя температура 255 С, и во время загрузки поддерживают слой аргона над раствором реагентов. После промывки загрузочной линии диметилсульфоксидом (5 кг) клапан холодильника в реакторе HP, 200 л, закрывают и содержимое реактора нагревают до 1105 С. Содержимое реактора перемешивают по меньшей мере в течение 5 ч при 1105 С. ВЭЖХ по ходу процесса через 5 ч 40 мин показывает содержание соединения 5b 0,09%, что указывает на завершение реакции (по техническим условиям процесса 1%). Содержимое реактора HP, 200 л, охлаждают до 255 С. В то время как 200-л реактор охлаждают, закрывают все клапаны реактора PP1-R1000(реактор GL, 2000 л) и загружают технологическую фильтрованную воду (550 кг). Содержимое реактораHP, 200 л, переносят в реактор GL, 2000 л, в течение 15 мин с последующей промывкой загрузочной линии технологической фильтрованной водой (50 кг). Содержимое реактора GL, 2000 л, перемешивают в течение 2 ч при 55 С. Полученное поддающееся фильтрации твердое вещество отфильтровывают под вакуумом на фильтре PPF200 (нутч-фильтр GL), снабженном фильтровальной бумагой Mel-Tuf 1149-12. Влажный остаток на фильтре выгружают и переносят на тарелки перед вакуумной линией с пленкой из фторуглерода Dupont (тип (Kind) 100 А). Закрепляют специальную бумагу для сушильных печей(KAVON 992) над вакуумными тарелками, содержащими влажное соединение 6, и переносят в вакуумную тарельчатую сушильную печь (vacuum oven tray dryer). Устанавливают температуру в печи 55 С и соединение 6 сушат до постоянной массы в течение 12 ч. Продукт 5 с выгружают (12,70 кг) с выходом 76,5% (в исключительных случаях 85-95%). ВЭЖХ показывает чистоту 98,96%), и 1 Н ЯМР подтверждает структуру соединения 5 с. 1 Н ЯМР (ДМСО):11,10 (с, 1 Н), 7,36 (д, 1H), 6,78 (д, 2 Н), 6,75 (м, 1H), 6,56 (д, 2 Н), 6,20 (д, 1H),5,18 (д, 2 Н), 2,76 (д, 3 Н). Стадия 4. 5-Хлор-N-(4-(6-фтор-7-(метиламино)-2,4-диоксо-1,2-дигидрохиназолин-3(4 Н)-ил)фенилкарбамоил)тиофен-2-сульфонамид.Mol. Wt. - мол. масса, DMSO - ДМСО, step - стадия 1 - этил-5-хлортиофен-2-илсульфонилкарбамат В реактор PP1-R2000 (реактор HP, 200 л) загружают 6 (20,7 кг, 1,0 экв.), этил-5-хлортиофен-2 илсульфонилкарбамат (37,5 кг, 2,0 экв., 95%) и диметилсульфоксид (99%, 75 кг) и перемешивают в течение 15 мин. Поддерживая максимально достижимый вакуум, реактор HP, 200 л, серия PP1-R2000,греют при 655 С в течение 15 ч. Взятый в это время характерный образец из реактора для анализа ВЭЖХ показывает 0,9% соединения 5 с, остающегося в реакционной смеси (технологический показатель завершения реакции соединения 6 1%). В 800-л реактор серии PP5-R1000 загружают технологическую фильтрованную воду (650 кг) и затем в 800-л реактор переносят содержимое 200-л HP, поддерживая внутреннюю температуру ниже 25 С. Промывают 200-л реактор HP диметилсульфоксидом (15 кг) и переносят в 800-л реактор, содержимое которого затем перемешивают в течение 2 ч при 55 С. Полученное твердое вещество отфильтровывают под вакуумом на фильтре Нутча GL, выстланном листом фильтровального материала Т 515 TYPAR. Остаток на фильтре промывают дихлорметаном (50 кг) и сушат остаток обдуванием азотом при давлении са. 5548 кПа (87 ф/д 2) в течение 15 мин. Фильтровальный остаток переносят на тарелки перед вакуумной линией с пленкой из фторуглерода Dupont (тип- 25017402 100 А) и затем на 12 ч в вакуумную тарельчатую сушильную печь, установленную на 60 С. Высушенное соединение 6 а (33,6 кг, выход 93%) извлекают с чистотой по ВЭЖХ 93,5 и 4,3% сульфонамида. 1 Н ЯМР подтверждает структуру соединения 7. 1 Н ЯМР (ДМСО):11,20 (с, 1 Н), 9,15 (с, 1H), 7,68 (д, 1H), 7,42 (д, 2 Н), 7,36 (д, 1 Н), 7,26 (м, 1H),7,16 (д, 2 Н), 6,78 (м, 1H), 6,24 (д, 1H), 2,78 (д, 3 Н). Стадия 5. Калий-(5-хлортиофен-2-илсульфонил)(4-(6-фтор-7-(метиламино)-2,4-диоксо-1,2-дигидрохиназолин-3(4 Н)-ил)фенилкарбамоил) амид, 7 а.Mol. Wt. - мол. масса, step - стадия В реактор GL, 800 л, серии PP5-R1000 загружают ацетонитрил (134 кг) и воду качества WFI (156 кг) и перемешивают содержимое в течение 5 мин. Затем в реактор загружают соединение 6 а (33,6 кг, 1,0 экв.),и в данный момент реакционная смесь представляет собой суспензию. В суспензию загружают водный раствор (вода WFI, 35 кг) гидроксида калия (4,14 кг, 1,15 экв., 85%) со скоростью, при которой внутренняя температура остается ниже 30 С. Загрузочные линии промывают водой качества WFI (2 кг), а затем содержимое реактора GL, 800 л, греют при 505 С в течение 1 ч. Затем содержимое фильтруют горячим через рукавный фильтр и затем фильтруют через фильтр для окончательной очистки из семи картриджей, 0,2 мкм, в чистые бочки HDPE. Систему высокотемпературной очистки в процессе фильтрации поддерживают в таком состоянии, что вещество не выпадает из раствора. Перед промывкой реактора GL, 800 л, его рубашку охлаждают до 255 С. Реактор GL, 800 л, промывают предварительно полученной смесью ацетонитрила (8,5 кг) и воды качества WFI (10 кг) через систему фильтрации в бочки,помеченные как бочки для фильтрации 7 а в горячем состоянии. С использованием давления реактор GL,800 л, промывают водой качества WFI (20 кг), а затем ацетоном (20 кг) и затем обдувают сухим азотом(са. 20,7+13,8 кПа (3+2 ф/д 2. Донную задвижку реактора GL, 800 л, закрывают и создают вакуум 508+ 254 мм (20+10 д) рт.ст., затем вакуум сбрасывают и загружают реактор содержимым бочек, помеченных как бочки для фильтрации 7 а в горячем состоянии. Содержимое реактора GL, 800 л, серии PP5-R1000 охлаждают до 205 С и затем с использованием фильтра для окончательной очистки (PP-PF09) в реактор загружают метанол (373 кг, 99%), поддерживая внутреннюю температуру ниже 30 С. Содержимое реактора GL, 800 л, серии PP5-R1000 охлаждают до 155 С и затем содержимое перемешивают в течение 12 ч при такой температуре. В это время поддающееся фильтрации твердое вещество отфильтровывают на чистой фильтровальной установке (PP-F1000) с чистым приемником фильтрата GL, 200 л (PPR-04) с последующей герметизацией реактора, создают на границе фильтр/приемник вакуум 508+254 мм (20+10 д) рт.ст. и фильтруют содержимое. Остаток на фильтре промывают метанолом (30 кг) и сушат обдуванием азотом при давлении са. 55+48 кПа (8+7 ф/д 2) в течение 10 мин. Устанавливают температуру вакуумной тарельчатой сушильной печи 80 С перед загрузкой фильтровального остатка 7 а. Влажный остаток с фильтра переносят на тарелки перед вакуумной линией с пленкой из фторуглерода Dupont - тип 100 А и закрепляют специальную бумагу для сушильных печей (бумага Kavon Mel Tuf) над вакуумными тарелками, содержащими влажный продукт 7 а, и переносят в вакуумную тарельчатую сушильную печь. Устанавливают температуру печи 80 С и сушат влажный 7 а до постоянной массы (постоянной массу считают тогда, когда тарелка при проверке по меньшей мере спустя 1 ч имеет ту же массу в пределах + 50 г). Характерный образец анализируют на остаточные растворители (технические показатели по остаточным растворителям для API), и они удовлетворяют требованиям технических условий. Конечный API подвергают уравновешиванию водой (5-6%) в течение 12 ч с тарелкой с присутствующей водой качества WFI,затем полностью переворачивают и оставляют стоять еще в течение 12 ч и, наконец, подвергают анализуKF (содержание воды 5,5%). Полученное 7-калиевое соединение (21,80 кг, выход 60,6%) переносят в двойные прочные полимерные мешки, предохраняющие от повторного загрязнения. ВЭЖХ для 7 а показывает чистоту 99,7%, и 1 Н ЯМР подтверждает структуру 7 а. 1 Н ЯМР (ДМСО):11,14 (с, 1H), 8,60 (с, 1 Н), 7,48 (м, 2 Н), 7,35 (д, 1H), 7,22 (д, 1 Н), 6,95 (м, 3 Н),6,75 (м, 1H), 6,22 (д, 1 Н), 2,78 (д, 3 Н). Пример 5. Фармакологические анализы. Фармакологическую активность каждого из соединений по изобретению определяют анализами inI. Ингибирование АДФ-опосредованной агрегации тромбоцитов in vitro. Действие при испытании соединения по изобретению на вызванную АДФ агрегацию тромбоцитов у человека оценивают анализом в титрационном 96-луночном микропланшете (общее о процедурах см. вJantzen H.M. et al. (1999), Thromb. Hemost, 81: 111-117) или стандартной агрегометрией по коэффициенту пропускания света через кювету с использованием или обогащенной тромбоцитами плазмы человека(PRP), или отмытых тромбоцитов человека. Для получения обогащенной тромбоцитами плазмы человека для анализов агрегации собирают венозную кровь здоровых не принимающих лекарственные средства добровольцев в 0,38% растворе цитрата натрия (0,013 М, конечный рН 7,0). Обогащенную тромбоцитами плазму (PRP) получают центрифугированием цельной крови при 160g в течение 20 мин при комнатной температуре. Слой PRP извлекают,переносят в новую пробирку и при необходимости регулируют число тромбоцитов для достижения концентрации тромбоцитов 3108 тромбоцитов/мл с использованием обедненной тромбоцитами плазмы(РРР). РРР получают центрифугированием оставшейся части образца крови (после извлечения PRP) в течение 20 мин при 800g. Затем такой препарат PRP можно использовать для анализов агрегации или в 96-луночном планшете, или стандартной кюветной агрегометрией. Для получения отмытых тромбоцитов собирают венозную кровь здоровых не принимающих лекарственные средства добровольцев в ACD (85 мМ цитрата натрия, 111 мМ глюкозы, 71,4 мМ лимонной кислоты), содержащем PGI2 (1,25 мл ACD, содержащего окончательно 0,2 мкМ PGI2; PGI2 от Sigma, St.Louis, Mo.). Обогащенную тромбоцитами плазму (PRP) получают центрифугированием цельной крови при 160g в течение 20 мин при комнатной температуре. Отмытые тромбоциты получают центрифугированием PRP в течение 10 мин при 730 g и ресуспендированием осадка тромбоцитов в CGS (13 мМ цитрата натрия, 30 мМ глюкозы, 120 мМ NaCl; 2 мл CGS/10 мл первоначального объема крови), содержащем 1 Е/мл апиразы (чистота V, Sigma, St. Louis, Mo.). После инкубации при 37 С в течение 15 мин тромбоциты собирают центрифугированием при 730 g в течение 10 мин и ресуспендируют в концентрации 310 тромбоцитов/мл в буфере Hepes/Tyrode (10 мМ Hepes, 138 мМ NaCl, 5,5 мМ глюкозы, 2,9 мМMgCl2. Такую суспензию тромбоцитов выдерживают 45 мин при 37 С перед применением в анализах агрегации. Для анализов агрегации по коэффициенту пропускания света в кювете получают серийные разведения (1:3) испытываемых соединений в 100% ДМСО в 96-луночном планшете с лунками с V-образным дном (конечная концентрация ДМСО в кювете составляет 0,6%). Испытываемое соединение (3 мкл серийных разведений в ДМСО) предварительно инкубируют с PRP в течение 30-45 с при 37 С перед инициацией реакций агрегации, которую осуществляют в агрегометре ChronoLog, добавляя агонист (5 или 10 мкМ АДФ) к 490 мкл PRP. В некоторых случаях агрегометрию с пропусканием света осуществляют с использованием 490 мкл отмытых тромбоцитов (полученных так, как описано выше) при 37 С и агрегацию инициируют добавлением 5 мкМ АДФ и 0,5 мг/мл человеческого фибриногена (American Diagnostics, Inc., Greenwich, Conn.). Реакцию агрегации регистрируют в течение 5 мин и максимальную степень агрегации определяют по различию в степени агрегации на базовой линии в сравнении с максимальной агрегацией, которая происходит за пятиминутный период анализа. Ингибирование агрегации вычисляют как максимальную агрегацию, наблюдаемую в присутствии ингибитора, в сравнении с агрегацией в отсутствие ингибитора. IC50 получают нелинейным регрессионным анализом с использованием программного обеспечения Prism (GraphPad, San Diego, CA). Ингибирование АДФ-зависимой агрегации также определяют в 96-луночных титрационных микропланшетах с плоскодонными лунками и использованием планшетного шейкера и планшет-ридера, подобно процедуре, описанной в Frantantoni et al., Am. J. Clin. Pathol., 94, 613 (1990). Все стадии осуществляют при комнатной температуре. Для агрегации в 96-луночном планшете с использованием обогащенной тромбоцитами плазмы (PRP) общий объем реакционной смеси 0,2 мл/лунку включает 180 мкл PRP(3108 тромбоцитов/мл, см. выше), 6 мкл любого серийного разведения испытываемых соединений в 20% ДМСО или буфер (для контрольных лунок) и 10 мкл 20 Х раствора агониста АДФ (100 мкл). Затем определяют OD образцов при 450 нм с использованием ридера титрационных микропланшетов (Softmax,Molecular Devices, Menlo Park, Calif.), приводя к прочтению в 0 мин. Затем планшеты встряхивают в течение 5 мин на шейкере для титрационных микропланшетов и проводят 5-минутное прочтение в планшет-ридере. Агрегацию вычисляют из снижения OD при 450 нм при t=5 мин по сравнению с OD при t=0 мин и выражают в виде % снижения в контрольных образцах с АДФ после корректировки изменений в неагрегированных контрольных образцах. IC50 получают нелинейным регрессионным анализом. Для агрегации в 96-луночных планшетах с использованием отмытых тромбоцитов общий объем реакционной смеси 0,2 мл/лунку включает, в буфере Hepes-Tyrode/0,1% BSA, 4,5107 тромбоцитов, отмытых с апиразой, 0,5 мг/мл человеческого фибриногена (American Diagnostics Inc., Greenwich, Conn.), серийные разведения испытываемых соединений (буфер для контрольных лунок) в 0,6% ДМСО. После 5 мин предварительной инкубации при комнатной температуре добавляют АДФ в конечной концентрации 2 мкМ, который индуцирует субмаксимальную агрегацию. В один из наборов контрольных лунок добав- 27017402 ляют буфер вместо АДФ (АДФ-контроль). Затем определяют OD образцов при 450 нм с использованием ридера титрационных микропланшетов (Sofitmax, Molecular Devices, Menlo Park, Calif.), приводя к прочтению в 0 мин. Затем планшеты встряхивают в течение 5 мин на шейкере для титрационных микропланшетов и проводят 5-минутное прочтение в планшет-ридере. Агрегацию вычисляют из снижения OD при 450 нм при t=5 мин по сравнению с OD при t=0 мин и выражают в виде % снижения в контрольных образцах с АДФ после корректировки изменений в неагрегированных контрольных образцах. IC50 получают нелинейным регрессионным анализом.II. Ингибирование связывания [3 Н]2-MeS-АДФ с тромбоцитами. 1. Способность молекул кандидатов ингибировать связывание [3 Н]2-MeS-АДФ с рецептором P2Y12 на тромбоцитах определяют с использованием анализа связывания радиолиганда. С использованием такого анализа определяют возможность ингибирования таких соединений связывания [3 Н]2-MeS-АДФ с цельными тромбоцитами. В условиях, описанных ниже в II(3), связывание[3 Н]2-MeS-АДФ происходит только из-за взаимодействия указанного лиганда с рецептором P2Y12, при этом все специфическое связывание, определенное в данном анализе, может конкурировать с антагонистом P2Y12 (т.е. специфическое связывание снижается до фоновых уровней за счет конкуренции с избытком антагониста P2Y12 при отсутствии конкуренции за связывание, когда антагонист P2Y1 предварительно инкубируют с препаратом тромбоцитов). Эксперименты по связыванию [3 Н]2-MeS-АДФ обычно осуществляют с тромбоцитами человека, собранными ранее стандартными процедурами в больничных банках крови. Промытые с апиразой собранные ранее тромбоциты получают так, как описано далее (все стадии осуществляют при комнатной температуре, если не указано иное). Суспензии собранных ранее тромбоцитов разбавляют 1 об. CGS и тромбоциты осаждают центрифугированием при 1900g в течение 45 мин. Осадок тромбоцитов ресуспендируют при 3-6109 тромбоцитов/мл в CGS, содержащем 1 Е/мл апиразы (чистота V, Sigma, St. Louis, Mo.), и инкубируют в течение 15 мин при 37 С. После центрифугирования при 730g в течение 20 мин тромбоциты ресуспендируют в буфере Hepes-Tyrode, содержащем 0,1% BSA (Sigma, St. Louis, Mo.) в концентрации 6,66108 тромбоцитов/мл. Эксперименты по связыванию осуществляют после 45 мин "отдыха" тромбоцитов. С другой стороны, эксперименты по связыванию осуществляют со свежими тромбоцитами человека, полученными так, как описано выше в разделе I ("Ингибирование АДФ-опосредованной агрегации тромбоцитов in vitro"), за исключением того, что тромбоциты ресуспендируют в буфере Hepes-Tyrode,содержащем 0,1% BSA (Sigma, St. Louis, Mo.), в концентрации 6,66108 тромбоцитов/мл. Получают весьма схожие результаты со свежими и полученными ранее тромбоцитами. 3. Анализ связывания тромбоцитов с АДФ-рецептором (ARB) с использованием третированного возможного лиганда агониста [3 Н]2-MeS-АДФ (Jantzen H.M. et al. (1999), Thromb. Hemost, 81: 111-117) адаптируют к формату 96-луночного титрационного микропланшета. В анализируемом объеме 0,2 мл буфера Hepes-Tyrode с 0,1% BSA и 0,6% ДМСО 1108 промытых с апиразой тромбоцитов предварительно инкубируют в 96-луночных титрационных микропланшетах с плоскодонными лунками в течение 5 мин с серийными разведениями испытываемых соединений перед добавлением 1 нМ [3H]2-MeS-АДФ([3 Н]2-метилтиоаденозин-5'-дифосфат, аммониевая соль; удельная активность 20-50 Ки/ммоль, получен обычным синтезом в Amersham Life Science, Inc., Arlington Heights, I11 или в NEN Life Science Products,Boston, Mass.). Полное связывание определяют в отсутствие испытываемых соединений. Образцы для неспецифического связывания могут содержать 10 нМ немеченного 2-MeS-АДФ (RBI, Natick, Mass.). После инкубации в течение 15 мин при комнатной температуре несвязанный радиолиганд отделяют быстрой фильтрацией и двумя промывками холодным (4-8 С) буфером для промывки в анализе связывания(10 мМ Hepes, pH 7,4, 138 нМ NaCl) с использованием 96-луночного харвестера клеток (Mindisc 96,Skatron Instruments, Sterling, Va.) и стекловолоконных плоских фильтров 812 GF/C (Printed Filtermat D,для 1450 Microbeta, Wallac Inc., Gaithersburg, Md.). Связанную с тромбоцитами радиоактивность на плоских фильтрах определяют в сцинтилляционном счетчике (Microbeta 1450, Wallac Inc., Gaithersburg, Md.). Специфическое связывание определяют, вычитая неспецифическое связывание из полного связывания, и специфическое связывание в присутствии испытываемых соединений выражают в % от специфического связывания в отсутствие разведений испытываемых соединений. IC50 получают нелинейным регрессионным анализом. В приведенной ниже таблице активность в анализе PRP представляют следующим образом:IC50 10 мкМ;- 10 мкМ IC50 30 мкМ. Активность в анализе ARB представляют следующим образом:- IC50 0,05 мкМ;- 0,05 мкМ IC50 0,5 мкМ. Таблица 5 Пример 6. Синтез калиевой соли [4-(6-фтор-7-метиламино-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)фенил]-5-хлортиофен-2-илсульфонилмочевины (9 а) (аморфная форма).equiv. - экв., THF - ТГФ, h - час Сульфонилмочевину в форме свободной кислоты (7,0 г, 13,365 ммоль) суспендируют в смеси ТГФ/Н 2 О (55:22 мл, са. 2,5:1) и обрабатывают 2 М раствором KOH (7,70 мл, 15,40 ммоль, 1,15 экв.), добавляя по каплям в течение са. 5 мин. По окончании времени добавления получают прозрачный раствор. Но затем через некоторое время (5 мин) из реакционной смеси выпадает в осадок твердое вещество и реакционная смесь становится густой суспензией. Суспензию нагревают на масляной бане до 50 С и полученный прозрачный вязкий светло-коричневый раствор выдерживают в таких условиях в течение 0,5 ч. После охлаждения до комнатной температуры в осадок выпадает названное в заголовке соединение. Смесь разбавляют изо-PrOH (250 мл, 3 от начального объема реакционной смеси), перемешивают при комнатной температуре в течение 3 ч и затем фильтруют через воронку Бюхнера и получают названное в заголовке соединение в виде бесцветного твердого вещества. Полученное вещество сушат в вакуумной печи при 80 С и получают 7,20 г (96%) аморфного твердого вещества. МС (отрицательный скан): 521,7; 523,7. Пример 7. Конверсия сульфонилмочевины (7 а) в ее натриевую соль (10 а).equiv. - экв., h - ч 1-(5-Хлортиофен-2-илсульфонил)-3-(4-(6-фтор-7-метиламино-2,4-диоксо-1,2-дигидрохиназолин 3(4 Н)-ил)фенил)мочевину (3,0 г, 5,728 ммоль) 7 а суспендируют в смеси CH3CN/H2O (1:1, 70 мл) и обрабатывают, добавляя по каплям, 2N раствором NaOH (2,90 мл, 5,80 ммоль). В пределах са. 15 мин получают прозрачный раствор. После перемешивания в течение 1,0 ч теперь светло-коричневый раствор лиофилизуют и получают сырой продукт реакции 10 а в виде аморфного твердого вещества. МС (отрицательный скан): 522,0; 524,0. Пример 8. Получение аморфной формы натриевой соли. Натриевую соль 10b суспендируют в изопропаноле (100 мл) и смесь кипятят с обратным холодильником в течение са. 45 мин, затем фильтруют в горячем состоянии и получают 2,54 г названного в заголовке соединения в виде желтовато-коричневого твердого вещества (чистота 99,6887% по аналитической ВЭЖХ, длинная колонка). Фильтрат разбавляют EtOH до тех пор, пока соотношение ACN:EtOH не станет 1:3, и затем оставляют стоять в течение ночи при комнатной температуре, когда названное в заголовке соединение выпадает в осадок, и получают 210 мг названного в заголовке соединения (чистота 99,6685% по аналитической ВЭЖХ, длинная колонка). Пример 9. Получение полиморфной формы А калиевой соли перекристаллизацией. Перекристаллизация. Сырой продукт реакции можно перекристаллизовать из МеОН или смесиMeOH/EtOH (3:1), сначала подвергая смесь кипячению с обратным холодильником для растворения твердого вещества и затем охлаждая раствор до комнатной температуры с выпадением осадка. Перекристаллизация из МеОН. Суспендируют 1,0 г калиевой соли в МеОН (150 мл), кипятят суспензию с обратным холодильником в течение 0,5 ч и получают почти прозрачный раствор. Затем полученный раствор фильтруют горячим через воронку Бюхнера. Из прозрачного фильтрата при стоянии при комнатной температуре выпадает в осадок бесцветное твердое вещество. Смесь перемешивают в течение ночи и затем твердое вещество собирают фильтрацией на воронке Бюхнера. Твердый продукт промывают EtOH (240 мл) и сушат в вакуумном сушильном шкафу при 80 С в течение 20 ч и получают 740 мг бесцветного твердого вещества. Маточная жидкость дает еще некоторое количество названного в заголовке соединения при концентрировании до са. 1/3 первоначального объема. Перекристаллизация из смеси EtOH/MeOH. Суспендируют 1,0 г калиевой соли в смеси растворителей EtOH/MeOH (1:3) (200 мл), кипятят суспензию с обратным холодильником в течение 0,5 ч и получают почти прозрачный раствор. Затем полученный раствор фильтруют горячим через воронку Бюхнера. Из прозрачного фильтрата при стоянии при комнатной температуре выпадает в осадок бесцветное твер- 29
МПК / Метки
МПК: C07D 257/04, A61K 31/44, A61P 7/02, A61K 31/5513
Метки: композиции, соединений, 4-(6-галоген-7-замещенные-2,4-диоксо-1,4-дигидро-2н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, соединения, применение, получения, фармацевтические, эти, содержащие, формы, способы
Код ссылки
<a href="https://eas.patents.su/30-17402-4-6-galogen-7-zameshhennye-24-diokso-14-digidro-2n-hinazolin-3-ilfenil-5-hlortiofen-2-ilsulfonilmocheviny-ih-formy-sposoby-polucheniya-soedinenijj-farmacevticheskie-kompozicii-sode.html" rel="bookmark" title="База патентов Евразийского Союза">[4-(6-галоген-7-замещенные-2,4-диоксо-1,4-дигидро-2н-хиназолин-3-ил)фенил]-5-хлортиофен-2-илсульфонилмочевины, их формы, способы получения соединений, фармацевтические композиции, содержащие эти соединения, и их применение</a>












