1,2,4-оксадиазольные соединения для лечения аутоиммунных заболеваний
Номер патента: 17669
Опубликовано: 28.02.2013
Авторы: Джонсон Кристофер Норберт, Скидмор Джон, Херст Дэвид Нейджел, Хейтман Томас Дэниел, Хир Джаг Пол, Уолл Айан Дэвид
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
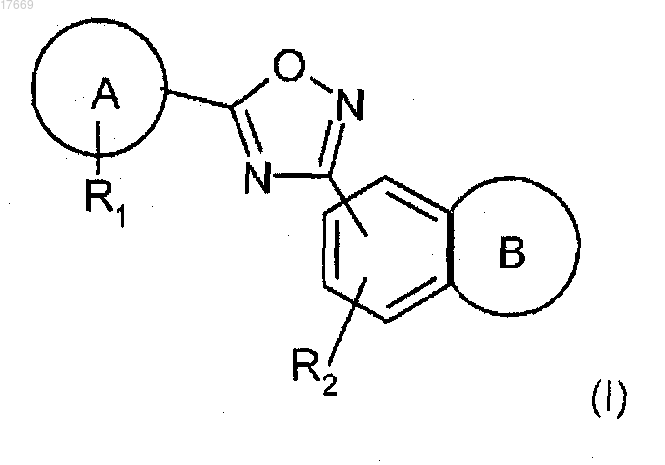
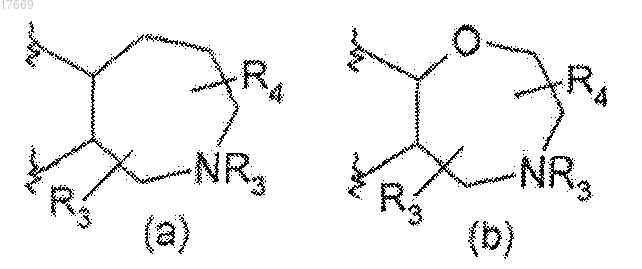
где В представляет 7-членное насыщенное кольцо, выбранное из
А представляет фенил или пиридил;
R1 представляет до двух заместителей, независимо выбранных из хлора, циано и изопропокси;
R2 представляет водород;
R3 представляет водород;
R4 представляет (CH2)2CONH2, (CH2)1-3OH, CO2H или (CH2)1-3CO2H.
2. Соединение, выбранное из
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-1-ил]пропанамида;
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-1-ил]пропановой кислоты;
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1Н-2-бензазепин-1-ил]-1-пропанола;
[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-3-ил]метанола;
[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-3-ил]карбоновой кислоты;
3-[7-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-3-ил]пропановой кислоты;
[9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]уксусной кислоты;
[9-(5-{3-циано-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]уксусной кислоты;
[9-(5-{5-хлор-6-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]уксусной кислоты;
4-[9-(5-{3-циано-4-[(1-метилэтил)окси]-3-пиридинил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]бутановой кислоты;
4-[9-(5-{5-хлор-6-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]бутановой кислоты;
4-[9-(5-{3-хлор-4-[(1-метилэтил)окси]фенил}-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил]бутановой кислоты
и их фармацевтически приемлемых солей.
3. Применение соединения по любому из пп.1, 2 для лечения состояний или расстройств, опосредуемых S1P1 рецепторами.
4. Применение по п.3, при котором состоянием является красная волчанка.
5. Применение соединения согласно любому из пп.1, 2 для получения лекарственного средства для лечения состояний или расстройств, опосредуемых S1P1 рецепторами.
6. Применение по п.5, при котором состоянием является красная волчанка.
7. Фармацевтическая композиция, включающая соединение согласно любому из пп.1, 2 и фармацевтически приемлемый эксципиент.
8. Способ лечения состояний или расстройств у млекопитающих, включая людей, которые могут опосредоваться через S1P1 рецепторы, который предусматривает введение пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
9. Способ лечения по п.8, в котором состоянием является красная волчанка.
Текст
1,2,4-ОКСАДИАЗОЛЬНЫЕ СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ Изобретение относится к новым производным оксадиазола формулы (I) Хир Джаг Пол, Хейтман Томас Дэниел, Херст Дэвид Нейджел,Джонсон Кристофер Норберт,Скидмор Джон, Уолл Айан Дэвид (GB) Медведев В.Н. (RU) или их фармацетически приемлемым солям. Соединения формулы (I) и их фармацевтически приемлемые соли полезны при лечении состояний или расстройств, которые опосредуются через S1P1 рецептор. В частности, соединения формулы (I) и их фармацевтически приемлемые соли полезны при лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных расстройств, астмы, воспалительных нейропатий, артрита, трансплантации,болезни Крона, язвенного колита, красной волчанки, псориаза, ишемии-реперфузионного повреждения, твердых опухолей и метастазов опухоли, расстройств, связанных с ангиогенезом,сосудистых заболеваний, болевых состояний, острых вирусных заболеваний, состояний воспаленного кишечника, инсулин- и неинсулинзависимых диабетов.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 017669 Настоящее изобретение относится к новым производным оксадиазола, обладающим фармакологической активностью, к способам их получения, фармацевтическим композициям, содержащим их, и к их применению при лечении различных расстройств. 1-Фосфат сфингозина (S1P) является биоактивным липидным медиатором, образуемым путем фосфорилирования сфингозина сфингозинкиназами, и обнаруживается при высоких уровнях в крови. Он продуцируется и секретируется рядом типов клеток, включая клетки гематопоэтического происхождения, такие как тромбоциты и тучные клетки (Okamoto et al. 1998, J. Biol. Chem. 273 (42):27104; Sanchezand Hla 2004, J. Cell Biochem. 92:913). Он оказывает широкий ряд биологического действия, включая регуляцию клеточной пролиферации, дифференциации, подвижности, васкуляризации и активации воспалительных клеток и тромбоцитов (Pyne and Pyne 2000, Biochem. J. 349:385). Описано пять подтипов S1P ответных рецепторов, S1P1 (Edg-1), S1P2 (Edg-5), S1P3 (Edg-3), S1P4 (Edg-6) и S1P5 (Edg-8), образующих часть семейства рецепторов гена G-белок сочетаемой эндотелиальной дифференциации (Chun et al. 2002, Pharmacological Reviews 54:265, Sanchez and Hla 2004, J. Cellular Biochemistry, 92:913). Указанные 5 рецепторов показывают дифференциальную мРНК экспрессию, причем S1P1-3 широко экспрессируется,S1P4 экспрессируется в лимфоидных и гематопоэтических тканях, a S1P5 - прежде всего в головном мозге и в меньшей степени в селезенке. Они сигнализируют через различные подгруппы G белков, промотируя множество биологических ответных реакций (Kluk and Hla 2002, Biochem et Biophysica Acta 1582:72,Sanchez and Hla 2004, J. Cellular Biochem 92:913). Предлагаемые роли S1P1 рецептора включают в себя транспортировку лимфоцитов, индукцию/супрессию цитокинов и действия эндотелиальных клеток (Rosen and Goetzl 2005, Nat Rev immunol. 5:560). Агонисты S1P1 рецептора используются в ряде аутоиммунных и трансплантационных животных моделей, включая модели экспериментального аутоиммунного энцефалита (ЕАЕ) MS, для снижения тяжести индуцируемого заболевания (Brinkman et al. 2003, JBC 277:21453; Fujino et al. 2003, J. Pharmacol.Exp. Ther. 305:70; Webb et al. 2004, J. Neuroimmunol. 153:108; Rausch et al. 2004, J. Magn. Reson. Imaging 20:16). Сообщается, что данная активность опосредуется действием агонистов S1P1 на циркуляцию лимфоцитов через лимфатическую систему. Лечение S1P1 агонистами приводит в результате к секвестированию лимфоцитов во вторичных лимфоидных органах, таких как лимфовые узлы, включая обратимую периферическую лимфопению на моделях животных (Chiba et al. 1998, J. Immunology 160:5037, Forrest etal. 2004, J. Pharmacol. Exp. Ther. 309:758; Sanna et al. 2004, JBC 279:13839). Опубликованные данные по агонистам говорят о том, что лечение соединением индуцирует потерю S1P1 рецептора из клеточной поверхности через интернализацию (Graler and Goetzl 2004, FASEB J. 18:551; Matloubian et al. 2004, Nature 427:355; Jo et al. 2005, Chem. Biol. 12:703), и это является данным уменьшением S1P1 рецептора в иммунных клетках, что способствует снижению движения Т клеток из лимфатических узлов обратно в поток крови. Делеция S1P1 гена вызывает смертность эмбрионов. Эксперименты по проверке роли S1P1 рецептора в миграции и транспортировке лимфоцитов включают восприимчивый перенос меченых S1P1 дефицитных Т клеток в облучаемых мышей дикого типа. Данные клетки показали уменьшенный выход из вторичных лимфоидных органов (Matloubian et al. 2004, Nature 427:355).S1P1 приписывается также роль в модуляции соединения эндотелиальных клеток (Allende et al. 2003, 102:3665, Blood Singelton et al. 2005, FASEB J. 19:1646). В отношении данного эндотелиального действия сообщается, что S1P1 агонисты оказывают действие на изолированные лимфатические узлы,что возможно способствует роли в модуляции иммунных расстройств. S1P1 агонисты вызывали закрытие эндотелиальных стромальных "калиток" лимфатических синусов, которые осушают лимфатические узлы и предотвращают выход лимфоцитов (Wei et al. 2005, Nat. Immunology 6:1228). Показано, что соединение FTY720 (JP11080026-A) снижает циркуляцию лимфоцитов у животных и человека, модулируя болезненную активность на животных моделях иммунных расстройств и снижая скорости ремиссии при повторяющейся временной ремиссии рассеянного склероза (Brinkman et al. 2002,JBC 277:21453, Mandala et al. 2002, Science 296:346, Fujino et al. 2003, J. Pharmacology and ExperimentalTherapeutics 305:45658, Brinkman et al. 2004, American J. Transplantation 4:1019, Webb et al. 2004, J. Neuroimmunology 153:108, Morris et al. 2005, Eur. J. Immunol. 35:3570, Chiba 2005, Pharmacology and Therapeutics 108:308, Kahan et al. 2003, Transplantation 76:1079, Kappos et al. 2006, New Eng. J. Medicine 335:1124). Данное соединение является пролекарством, которое фосфорилируется in vivo сфингозинкиназами, давая молекулу, которая обладает агонистической активностью при S1P1, S1P3, S1P4 и S1P5 рецепторах. Клинические исследования продемонстрировали, что лечение соединением FTY720 приводит в результате к брадикардии в первые 24 ч лечения (Kappos et al. 2006, New Eng J. Medicine 335:1124). Полагают, что брадикардия является следствием агонизма у S1P3 рецептора на основе ряда экспериментов, основанных на клетках и животных. Они включают использование S1P3 нокаутированных животных, которые в отличие от мышей дикого типа не демонстрируют брадикардию вследствие введения FTY720 и использования S1P1 селективных соединений (Hale et al. 2004, BioorganicMidicinal Chemistry Letters 14:3501,Sanna et al. 2004, JBC 279:13839, Koyrakh et al. 2005, American J. Transplantation 5:529). Поэтому существует потребность в соединениях агонистах S1P1 с селективностью относительноS1P3, которые, можно было бы ожидать, проявляют пониженную тенденцию вызывать брадикардию.-1 017669 Следующие патентные заявки описывают производные оксадиазола в качестве S1P1 агонистов:WO 03/105771, WO 05/058848, WO 06/047195, WO 06/100633, WO 06/115188, WO 06/131336,WO 07/024922 и WO 07/116866. Следующие патентные заявки описывают производные тетрагидроизохинолинил-оксадиазола в качестве агонистов S1P рецептора: WO 06/064757, WO 06/001463, WO 04/113330.WO 08/064377 описывает бензоциклогептильные аналоги, обладающие активностью S1P1 рецептора. В настоящее время обнаружен структурно новый класс соединений, которые предоставляют S1P1 рецептор. Настоящее изобретение предоставляет соединения формулы (I) или их фармацевтически приемлемые соли А представляет фенил или пиридил;R1 представляет до двух заместителей, независимо выбранных из хлора, циано и изопропокси;R4 представляет (CH2)2CONH2, (CH2)1-3OH, CO2H или (CH2)1-3CO2H. В еще одном воплощении А представляет фенил. В еще одном воплощении А представляет 3,4 дизамещенный фенил. В еще одном воплощении R1 представляет два заместителя, одним из которых является изопропокси, а другой выбран из хлора или циано. В еще одном воплощении R1 представляет два заместителя, выбранных из хлора, изопропокси и циано. В еще одном воплощении R1 представляет хлор и изопропокси. В еще одном воплощении R1 представляет хлор в 3-положении и изопропокси в 4-положении, когда А представляет фенил, или R1 представляет хлор в 5-положении и изопропокси в 6-положении, когда А представляет собой пиридинил. В еще одном воплощении R1 представляет изопропокси и циано. В еще одном воплощении R1 представляет циано в 3-положении и изопропокси в 4-положении, когда А представляет фенил, или R1 представляет хлор в 5-положении и изопропокси в 6-положении, когда А представляет пиридинил. В еще одном воплощении В представляет (а) или (b). В еще одном воплощении В представляет (b). В еще одном воплощении - (СН 2)1-3CO2H. В некоторых из соединений формулы (I), в зависимости от характера заместителя, имеются хиральные атомы углерода, и, следовательно, соединения формулы (I) могут существовать как стереоизомеры. Изобретение распространяется на все оптические изомеры, такие как стереоизомерные формы соединений формулы (I), включая энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Различные стереоизомерные формы могут выделяться или разделяться друг от друга с помощью общепринятых способов, или любой заданный изомер может получаться с помощью обычного стереоселективного или асимметрического синтеза. Некоторые из соединений, предлагаемых в данном изобретении, могут существовать в разнообразных таутомерных формах, и следует понимать, что изобретение охватывает все такие таутомерные формы. Понятно, что некоторые соединения изобретения содержат кислотную и основную группы и могут поэтому существовать в виде цвиттер-ионов при некоторых значениях рН. Подходящими соединениями изобретения являются 3-[7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-1-ил]пропанамид; 3-[7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-1-ил]пропановая кислота; 3-[7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-1-ил]-1-пропанол;[9-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4 бензоксазепин-5-ил]уксусная кислота; 4-[9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4 бензоксазепин-5-ил]бутановая кислота; 4-[9-(5-5-хлор-6-[(1-метилэтил)окси]3-пиридинил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4 бензоксазепин-5-ил]бутановая кислота; 4-[9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4 бензоксазепин-5-ил]бутановая кислота; 3-[7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-2,3,4,5-тетрагидро-1,4 бензоксазепин-3-ил]пропановая кислота или их фармацевтически приемлемые соли. Фармацевтически приемлемые производные соединений формулы (I) включают любую фармацевтически приемлемую соль, сложный эфир или соль такого эфира соединения формулы (I), которые после введения реципиенту способны давать (непосредственно или косвенно) соединение формулы (I) или его активный метаболит либо остаток. Соединения формулы (I) могут образовывать соли. Очевидно, понятно, что для использования в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли, очевидно, понятны специалистам в данной области и включают соли,описываемые в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образуемые с неорганическими кислотами, например соляной, бромисто-водородной, серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной, малеиновой, уксусной, фумаровой, лимонной,винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Некоторые из соединений формулы (I) могут образовывать кислотно-аддитивные соли с одним или более эквивалентами кислоты. Настоящее изобретение охватывает в своем объеме все возможные стехиометрические и не стехиометрические формы. Соли могут также получаться из фармацевтически приемлемых оснований, включая неорганические и органические основания. Соли, производимые из неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, соли трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и аналогичные. Соли, производимые из фармацевтически приемлемых оснований, включают соли первичных, вторичных и третичных аминов; замещенные амины, включая встречающиеся в природе замещенные амины; и циклические амины. Конкретные фармацевтически приемлемые органические основания включают аргинин, бетаин,кафеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол,этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, прокаин, пурины,теобромин, триэтиламин, триметиламин, трипропиламин, трис(гидроксиметил)аминометан (TRIS, трометанол) и аналогичные. Соли могут также образовываться из основных ионообменных смол, например полиаминовых смол. Когда соединение настоящего изобретения является основным, соли могут получаться из фармацевтически приемлемых кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, этандисульфоновую, фумаровую, глюконовую, глутаминовую, бромисто-водородную,соляную, изетионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, слизевую,памовую, пантотеновую, фосфорную, пропионовую, янтарную, серную, винную, п-толуолсульфоновую кислоту и аналогичные. Фармацевтически приемлемые соли могут получаться общепринятым способом с помощью реакции с соответствующей кислотой или производным кислоты. Фармацевтически приемлемые соли с основаниями могут получаться общепринятым способом по реакции с соответствующим неорганическим или органическим основанием. Соединения формулы (I) могут получаться в кристаллической или некристаллической форме и, если они кристаллические, могут необязательно гидратироваться или сольватироваться. Данное изобретение включает в своем объеме стехиометрические гидраты или сольваты, а также соединения, содержащие изменяемые количества воды и/или растворителя. Сила и эффективность соединений данного изобретения в отношении S1P1 рецептора может быть определена с помощью GTPS анализа на клонированном рецепторе человека, как описано в данном описании. Соединения формулы (I) продемонстрировали агонистическую активность у S1P1 рецептора с использованием функциональных анализов, описанных в данном изобретении.-3 017669 Соединения формулы (I) и их фармацевтически приемлемые соли поэтому являются полезными в лечении состояний или расстройств, которые опосредуются через S1P1 рецептор. В частности, соединения формулы (I) и их фармацевтически приемлемые соли полезны в лечении красной волчанки. Следует понимать, что термин "лечение", используемый в описании, включает профилактику, а также смягчение установленных симптомов. Таким образом, изобретение предоставляет также соединения формулы (I) или их фармацевтически приемлемые соли для использования в качестве терапевтических средств, в частности в лечении состояний или расстройств, опосредуемых через S1P1 рецептор. В частности, изобретение предоставляет соединение формулы (I) или его фармацевтически приемлемую соль в качестве терапевтического вещества в лечении красной волчанки. Далее изобретение относится к способу лечения состояний или расстройств у млекопитающих,включая людей, которые опосредуются через S1P1 рецептор, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В частности, изобретение предоставляет способ лечения красной волчанки, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для использования в производстве лекарственного средства для применения в лечении состояний или расстройств, опосредуемых через S1P1 рецептор. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в производстве лекарственного средства для использования в лечении красной волчанки. Чтобы использовать соединения формулы (I) и их фармацевтически приемлемые соли в терапии, их обычно формируют в виде фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Настоящее изобретение предоставляет также фармацевтическую композицию, которая включает соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель (или эксципиент). В дальнейшем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, включающему смешение соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическую композицию согласно изобретению, которая может получаться смешением подходящим образом при температуре окружающей среды и атмосферном давлении, обычно приспосабливают для орального, парентерального или ректального введения, и в качестве таковых могут быть в форме таблеток, капсул, оральных жидких препаратов, порошков, гранул, пастилок, реконституируемых порошков, инъецируемых или вливаемых растворов, или суспензий, или медицинских свечей. Обычно предпочитаются орально вводимые композиции. Таблетки и капсулы для орального введения могут быть в форме дозируемых единиц и могут содержать обычные эксципиенты, такие как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу); наполнители(например, лактозу, микрокристаллическую целлюлозу или дигидрофосфат кальция); таблетирующие смазочные агенты (например, стеарат магния, тальк или диоксид кремния); дезинтеграторы (например,картофельный крахмал или натрий-крахмалгликолят) и приемлемые смачивающие для использования в качестве терапевтических средств, в частности в лечении состояний или расстройств, опосредуемых через S1P1 рецептор. В частности, изобретение предоставляет соединение формулы (I) или его фармацевтически приемлемую соль в качестве терапевтического вещества в лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных расстройств, астмы, воспалительных нейропатий,артрита, трансплантации, болезни Крона, язвенного колита, красной волчанки, псориаза, ишемииреперфузионного повреждения, твердых опухолей и метастазов опухоли, болезней, связанных с ангиогенезом, сосудистых заболеваний, болевых состояний, острых вирусных болезней, воспалительных состояний кишечника, инсулин- и неинсулинзависимых диабетов. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в качестве терапевтических веществ в лечении красной волчанки. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в качестве терапевтических веществ в лечении псориаза. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в качестве терапевтических веществ в лечении рассеянного склероза. Далее изобретение относится к способу лечения состояний или расстройств у млекопитающих,включая людей, которые опосредуются через S1P1 рецептор, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В частности, изобретение предоставляет способ лечения рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных расстройств, астмы,воспалительных нейропатий, артрита, трансплантации, болезни Крона, язвенного колита, красной вол-4 017669 чанки, псориаза, ишемии-реперфузионного повреждения, твердых опухолей и метастазов опухоли, болезней, связанных с ангиогенезом, сосудистых заболеваний, болевых состояний, острых вирусных болезней, воспалительных состояний кишечника, инсулин- и неинсулинзависимых диабетов, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения красной волчанки, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения псориаза, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Изобретение относится к способу лечения рассеянного склероза, который включает введение страдающему заболеванием пациенту терапевтически безопасного и эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для использования в производстве лекарственного средства для применения в лечении состояний или расстройств, опосредуемых через S1P1 рецептор. В частности, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли для использования в производстве лекарственного средства для применения в лечении рассеянного склероза, аутоиммунных заболеваний, хронических воспалительных расстройств, астмы, воспалительных нейропатий, артрита, трансплантации, болезни Крона, язвенного колита, красной волчанки,псориаза, ишемии-реперфузионного повреждения, твердых опухолей и метастазов опухоли, болезней,связанных с ангиогенезом, сосудистых заболеваний, болевых состояний, острых вирусных болезней,воспалительных состояний кишечника, инсулин- и неинсулинзависимых диабетов. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в производстве лекарственного средства для использования в лечении красной волчанки. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в производстве лекарственных средств для использования в лечении псориаза. Соединения формулы (I) и их фармацевтически приемлемые соли полезны в производстве лекарственных средств для использования в лечении рассеянного склероза. Чтобы использовать соединения формулы (I) и их фармацевтически приемлемые соли в терапии, их обычно формируют в виде фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Настоящее изобретение предоставляет также фармацевтическую композицию, которая включает соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или наполнитель (или эксципиент). В дальнейшем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, включающему смешение соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическую композицию согласно изобретению, которая может получаться смешением подходящим образом при температуре окружающей среды и атмосферном давлении, обычно приспосабливают для орального, парентерального или ректального введения, и в качестве таковых могут быть в форме таблеток, капсул, оральных жидких препаратов, порошков, гранул, пастилок, реконституируемых порошков, инъецируемых или вливаемых растворов, или суспензий, или медицинских свечей. Обычно предпочитаются орально вводимые композиции. Таблетки и капсулы для орального введения могут быть в форме дозируемых единиц и могут содержать обычные эксципиенты, такие как связующие агенты (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу); наполнители(например, лактозу, микрокристаллическую целлюлозу или дигидрофосфат кальция); таблетирующие смазочные агенты (например, стеарат магния, тальк или диоксид кремния); дезинтеграторы (например,картофельный крахмал или натрий-крахмалгликолят) и приемлемые смачивающие агенты (например,лаурилсульфат натрия). На таблетки могут наноситься покрытия в соответствии со способами, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть в форме сухого продукта для реконституирования перед использованием с водой или другим подходящим носителем. Такие жидкие препараты могут содержать общепринятые добавки, такие как суспендирующие агенты (например, сироп сорбита, производные целлюлозы или гидрогенированные съедобные жиры), эмульгирующие агенты (например, лецитин или аравийскую камедь), неводные носители (которые могут включать пищевые масла, например,миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла), консерваторы (например, метил или пропил-п-гидроксибензоаты или сорбиновую кислоту), и,при желании, обычные вкусовые или ароматизирующие агенты или окрашивающие агенты, буферные соли и подслащивающие агенты, как это соответствует. Препараты для орального введения могут фор-5 017669 мироваться подходящим образом для обеспечения контролируемого высвобождения активного соединения. Для парентерального введения жидкие формы дозированных единиц приготавливают с использованием соединения изобретения или его фармацевтически приемлемых солей и стерильного носителя. Рецепторные формы для инъекции могут быть представлены в форме дозированных единиц, например, в ампулах или в виде множественных доз с использованием соединения изобретения или его фармацевтически приемлемых производных и стерильного носителя, необязательно с добавлением консерванта. Композиции могут быть представлены в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать рецептурирующие агенты, такие как суспендирующие,стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для рецептурного составления формы с подходящим носителем, например стерильной свободной от пирогенов водой, перед использованием. Соединение в зависимости от используемых носителей и концентрации может или суспендироваться, или растворяться в носителе. При приготовлении растворов соединение может растворяться для инъекций и стерилизоваться на фильтре перед заполнением подходящего сосуда или ампулы и запечатыванием. В носителе преимущественно растворяются адъюванты, такие как местные анестезирующие агенты, консерванты и буферные агенты. Для усиления стабильности композиции могут вымораживаться после заполнения сосуда, и воду удаляют в вакууме. Парентеральные суспензии готовят, по существу, таким же образом, за исключением того, что соединение суспендируют в носителе вместо того, чтобы растворяться, и стерилизация не может достигаться с помощью фильтрования. Соединение можно стерилизовать путем подвергания его действию этиленоксида перед суспендированием в стерильном носителе. Для облегчения равномерного распределения соединения в композицию можно преимущественно включать поверхностно-активный или смачивающий агент. Лосьоны могут составляться в виде рецептурных форм с водным или масляным основанием и обычно содержат также один или более эмульгирующих агентов, стабилизирующих агентов, диспергирующих, суспендирующих агентов, загустителей или окрашивающих агентов. Капли могут формироваться с водным или неводным основанием, включая также один или более диспергирующих, стабилизирующих или суспендирующих агентов. Они могут также содержать консервант. Соединения формулы (I) или их фармацевтически приемлемые соли могут также формироваться в рецепторные препараты в виде ректальных композиций, таких как суппозитории или задерживающие клизмы, например, содержащие общепринятые суппозиторные основания, такие как масло какао или другие глицериды. Соединения формулы (I) или их фармацевтически приемлемые соли могут также формироваться в виде запасных препаратов. Такие долго действующие рецептурные формы могут вводиться с помощью имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так,например, соединения согласно изобретению могут формироваться в рецептурные формы с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами либо в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Для внутриносового введения соединения формулы (I) или их фармацевтически приемлемые соли могут формироваться в виде растворов для введения с помощью подходящего измерительного или дозирующего прибора или, альтернативно, в виде порошковой смеси с подходящим носителем для введения с использованием подходящего доставляющего устройства. Такие соединения формулы (I) или их фармацевтически приемлемые соли могут формироваться для орального, буккального, парентерального, топического (включая офтальмическое и носовое), запасного или ректального введения или в виде формы,подходящей для введения с помощью ингаляции или инсуффляции (вдувания) (через рот или через нос). Соединения формулы (I) или их фармацевтически приемлемые соли могут формироваться в рецептурные препараты для топического введения в форме мазей, кремов, гелей, лосьонов, пессариев или вагинальных суппозиториев, аэрозолей или капель (например, глазных, ушных или носовых капель). Мази и кремы могут, например, формироваться с водным или масляным основанием с добавлением подходящих загущающих и/или гелеобразующих агентов. Мази для введения применительно к глазам могут производиться стерильным способом с использованием стерилизованных компонентов. Композиция может содержать от 0,1 до 99 вес.%, предпочтительно от 10 до 60 вес.% активного материала в зависимости от способа введения. Доза соединения, используемого при лечении упомянутых выше расстройств, варьирует обычно с учетом серьезности расстройств, веса пациента и других аналогичных факторов. Однако в качестве общего руководства подходящими единичными дозами могут быть 0,05-1000, 1,0-500 или 1,0-200 мг и такие единичные дозы могут вводиться более одного раза в день, например два или три раза в день. Соединения формулы (I) или их фармацевтически приемлемые соли могут использоваться в виде комбинационных препаратов, в сочетании с другими активными ингредиентами. Например, соединения изобретения могут использоваться в сочетании с циклоспорином А, метотрексатом, стероидами, рапамицином, ингибиторами провоспалительного цитокина, иммуномодуляторами, включающими биологические агенты или другие терапевтически активные соединения.-6 017669 Изобретение, о котором идет речь, включает меченные изотопом соединения, которые идентичны соединениям, характеризуемым формулами (I) и другими, но у которых один или более атомов заменены атомом, показывающим атомную массу или массовое число, отличные от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, которые могут включаться в соединения изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора,такие как 3 Н, 11C, 14 С, 18F, 123I и 125I. Соединения настоящего изобретения и фармацевтически приемлемые соли указанных соединений,которые содержат упомянутые выше изотопы и/или другие изотопы других атомов, охватываются объемом настоящего изобретения. Изотопно меченные соединения настоящего изобретения, например, соединения, в которые включены радиоактивные изотопы, такие как 3 Н, 14 С, полезны в анализах распределения лекарства и/или субстрата в ткани. Меченные тритием, т.е. 3 Н, и углерод-14, т.е. 14 С, изотопы являются особенно предпочтительными ввиду легкости приготовления и способности к детектированию. 11C и 8F изотопы особенно полезны в PET (томография с эмиссией позитрона), а 125I изотопы особенно полезны в SPECT (компьютерная томография с эмиссией одного фотона), и все это полезно при визуализации головного мозга. Далее, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может давать некоторые терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например, требований увеличенного in vivo срока полужизни или пониженных доз, поэтому могут быть предпочтительными при некоторых обстоятельствах. Меченные изотопом соединения формулы (I) и другие согласно изобретению могут обычно получаться путем осуществления процедур, описанных на схемах и/или в примерах, приведенных ниже, путем замещения не изотопно меченного реагента свободно доступным изотопно меченным реагентом. В дополнительном аспекте данное изобретение раскрывает способы получения соединения формулы (I). Один способ, который может использоваться для получения соединений формулы (I), когда В представляет собой иллюстрируется на схеме 1, где R1, R2 и А имеют значения, определенные для формулы (I), приведенные выше, и боковая цепь R4 расположена в 1-положении, когда n представляет 1-3, R2 представляет водород или С(1-4)алкил, R3 представляет водород, R представляет алкил (например, этил), hal представляет хлор,бром или йод, Р и Р 1 являются защитными группами. Схема 1-7 017669 Соединения формулы (i), которые являются коммерчески доступными (например, Fluorochem), могут превращаться в соединения формулы (ii), где, например, Р 1 представляет защитную группу, такую как бензил, с помощью обработки алкилирующим агентом, таким как бензилбромид, в присутствии основания, такого как карбонат калия, в подходящем растворителе, таком как ДМФ. Соединения формулы(ii) могут превращаться в соединения формулы (iii) с помощью гидролиза с использованием соответствующего основания, такого как водный раствор гидроксида натрия, в подходящем растворителе, таком как этанол, при повышенной температуре, такой как 80 С. Соединения формулы (iii) могут превращаться в соединения формулы (iv) с помощью общепринятых приемов, таких как обработка подходящим амидсочетающим агентом, таким как этилхлорформиат, с последующей реакцией с аммиаком при пониженной температуре, такой как -10 С, и в подходящем растворителе, таком как ТГФ. Соединения формулы(iv) могут превращаться в соединения формулы (v) путем обработки соответствующим восстанавливающим агентом, таким как литийалюминийгидрид, при низкой температуре, такой как ниже 15 С, в растворителе, таком как ТГФ, затем повышения температуры, например, до 80 С. Соединения формулы (v) могут превращаться в соединения формулы (vii) с помощью обработки соответствующим ацилгалогенидом(vi) в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан. Ацилирующие агенты (vi) обычно коммерчески доступны или могут быть получены с использованием стандартных способов. Соединения формулы (vii) могут превращаться в соединения формулы (viii), например, с помощью обработки оксихлоридом фосфора в растворителе, таком как ацетонитрил, при повышенной температуре, такой как температура дефлегмации, с последующим восстановлением с использованием подходящего восстанавливающего агента, такого как боргидрид натрия, в подходящем растворителе, таком как метанол, добавляемый при низкой температуре, такой как 0 С, и подогрева до комнатной температуры. Соединения формулы (viii) могут превращаться в защищенное производное (ix), в котором Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), например, с помощью обработки бис-(1,1-диметилэтил)дикарбонатом в присутствии основания, такого как триэтиламин в подходящем растворителе, таком как дихлорметан (DCM). Соединения формулы (ix), в которой P1 представляет защитную группу, такую как бензил, могут подвергаться снятию защиты, давая соединения формулы (х), например, с помощью гидролиза с использованием подходящего катализатора, такого как палладий. Соединения формулы (х) могут превращаться в соединения формулы (xi) с помощью обработки подходящим реагентом, таким как трифторметансульфоновый ангидрид, с использованием подходящего основания, такого как пиридин. Соединения формулы (xi) могут превращаться в соединения формулы (xii) с помощью обработки подходящим источником цианида, таким как цианид цинка, в присутствии катализатора, такого как тетракис-трифенилфосфинпалладий(0), в подходящем растворителе, таком как диметилформамид (ДМФ), при повышенной температуре, такой как 80 С. Соединения формулы (xii) могут превращаться в соединения формулы (xiii) с помощью обработки гидрохлоридом гидроксиламина и соответствующим основанием, таким как бикарбонат натрия, в растворителе, таком как метанол или этанол, при повышенной температуре, такой как 60 С. Соединения формулы (xiii) могут превращаться в соединения формулы (xvi) с помощью обработки хлорангидридом карбоновой кислоты формулы (xv) в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как ДМФ. Такие реакции в типичном случае проводятся при перемешивании в течение какого-то периода времени при комнатной температуре, затем при повышенных температурах, таких как 120 С. Хлорангидриды кислоты формулы (xv) являются или коммерчески доступными, или могут получаться из соответствующей кислоты (xiv) с помощью обычных средств. Альтернативно, соединения формулы (xiii) могут превращаться в соединения формулы (xvi) с помощью обработки карбоновой кислотой формулы (xiv) в присутствии подходящего амидного агента сочетания, такого как гидрохлорид 1-(3-диметиламинопропил)-3 этилкарбодиимида (EDAC), 1-гидроксибензотриазола (HOBt), в подходящем растворителе, таком как ДМФ. Такие реакции обычно осуществляются при повышенной температуре, такой как 50-80 С. Обычно кислота (xiv), EDAC и HOBt перемешиваются в течение какого-то периода времени при комнатной температуре перед добавлением соединения формулы (xiii). Соединения формулы (xvi) могут превращаться в соединения формулы (xvii) с помощью обработки основанием, таким как водный гидроксид натрия, в спиртовом растворителе, таком как этанол или метанол. Соединения формулы (xvii), в которой Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), могут превращаться в определенные соединения формулы (I) с помощью обработки подходящей кислотой, обычно трифторуксусной кислотой или соляной кислотой. Один из способов, который может использоваться для получения соединений формулы (I), в которой В представляет иллюстрируется на схеме 2, на которой R1, R2 и А имеют значения, определенные для формулы (I), и боковая цепь R4 расположена в 5-положении бензоксазепинового кольца, R3 представляет водород, R4 представляет (CH2)2CO2H, R представляет алкил (например, метил) и Р является защитной группой. Соединения формулы (xviii), которые являются коммерчески доступными (например, Aldrich), могут превращаться в соединения формулы (хх), например, с помощью обработки реагентом Виттига (xix),таким как (карбэтоксиметилен)трифенилфосфоран, в подходящем растворителе, таком как дихлорметан. Соединения формулы (хх) могут превращаться в соединения формулы (xxii) с помощью обработки подходящим N-защищенным (таким как Вос) этаноламином (xxi) в условиях Мицунобу с использованием,например, диизопропилазодикарбоксилата (DIAD) и трифенилфосфина в подходящем растворителе, таком как ТГФ. Соединения формулы (xxii), в которой Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), могут превращаться в соединения формулы (xxiii) с помощью обработки кислотой, обычно трифторуксусной или соляной кислотой. Соединения формулы (xxiii) могут превращаться в соединения формулы (xxiv) с помощью обработки подходящим реагентом, таким как 1,8 диазабицикло[5.4.0]ундец-7-ен (DBU), в подходящем растворителе, таком как ТГФ. Соединения формулы (xxiv) могут превращаться в подходящее N-защищенное производное (xxv), в котором Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), например, с помощью обработки бис-(1,1-диметилэтил)дикарбонатом в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан (DCM). Соединения формулы (xxv) могут превращаться в соединения формулы (xxvi) с помощью обработки подходящим источником цианида, таким как цианид цинка, в присутствии катализатора, такого как тетракис-трифенилфосфинпалладий(0), в подходящем растворителе, таком как диметилформамид (ДМФ), при повышенной температуре, такой как 80 С. Соединения формулы (xxvi) могут превращаться в соединения формулы (xxvii) с помощью обработки гидрохлоридом гидроксиламина, как в случае превращения (xii) в (xiii) на схеме 1. Соединения формулы(xxvii) могут превращаться в соединения формулы (xxviii) с помощью обработки хлорангидридом карбоновой кислоты формулы (xv), как описано для превращения (xiii) в (xvi) на схеме 1. Соединения формулы (xxviii) могут превращаться в соединения формулы (xxix) с помощью обработки основанием, таким как водный гидроксид натрия, в спиртовом растворителе, таком как этанол или метанол. Соединения формулы (xxix), в которых Р представляет (ВОС), могут превращаться в некоторые соединения формулы(I) с помощью обработки кислотой, обычно трифторуксусной или соляной кислотой, как описано на схеме 1. Один из способов, который может использоваться для поучения соединений формулы (I), в которой В представляет иллюстрируется на схеме 3, на которой R1, R2 и А имеют значения, определенные для формулы (I), и боковая цепь R4 расположена в 5-положении бензоксазепинового кольца, R3 представляет водород и R4 представляет (CH2)3CO2H, R представляет алкил (например, метил) и Р является защитной группой. Соединения формулы (ххх), в которой R2 представляет водород, R представляет алкил (например,этил) и Р представляет защитную группу (например, ВОС), могут превращаться в соединения формулы(xxxi) с использованием подходящего восстанавливающего агента, такого как боргидрид лития, в подходящем растворителе, таком как метанол. Соединения формулы (xxxi) могут превращаться в соединения формулы (xxxii) с помощью окисления с использованием подходящих методов, таких как окислениеSwern. Соединения формулы (xxxii) могут превращаться в соединения формулы (xxxiii), например, с помощью обработки реагентом Виттига (xix), таким как (карбэтоксиметилен)трифенилфосфоран, в подходящем растворителе, таком как дихлорметан. Соединения формулы (xxxiii) могут превращаться в соединения формулы (xxxiv) с помощью гидрирования с использованием подходящего катализатора, такого как палладий. Соединения формулы (xxxiv) могут превращаться в соединения формулы (xxxv) с использованием методов, описанных для превращения соединений формулы (xxvi) в некоторые соединения формулы (I) на схеме 2. Один из способов, который может использоваться для получения соединений формулы (I), в которой В представляет иллюстрируется на схеме 4, на которой R1, R2 и А имеют значения, определенные для формулы (I), и боковая цепь R4 расположена в 5-положении бензоксазепинового кольца и представляет (CH2)2CO2H, R3 представляет водород, R представляет алкил (например, метил) и Р является защитной группой. Схема 4 Соединения формулы (xxxii) могут превращаться в соединения формулы (xxxvi), например, с помощью обработки подходящим реагентом, таким как оксид метоксиметилдифенилфосфина (xxxv), в присутствии подходящего основания, такого как диизопропиламид лития (LDA), в подходящем растворителе, таком как ТГФ, с последующим, необязательно, добавлением основания, такого как гидрид натрия. Соединения формулы (xxxvi) могут превращаться в соединения формулы (xxxvii) с помощью окисления с использованием подходящих методов, таких как с использованием хлорформиата пиридиния(РСС), в подходящем растворителе, таком как дихлорметан. Соединения формулы (xxxvii) могут превращаться в соединения формулы (I) с использованием методов, описанных для превращения соединений формулы (xxvi) в некоторые соединения формулы (I) на схеме 2. Один из способов, который может использоваться для получения соединений формулы (I), в которой В представляет иллюстрируется на схеме 5, на которой R1, R2 и А имеют значения, определенные для формулы (I), и боковая цепь R4 расположена в 3-положении бензоксазепинового кольца и представляет (CH2)2CO2H, R3 представляет водород, R представляет алкил (например, метил) и Р является защитной группой. Схема 5 Коммерчески доступные соединения (например, Aldrich, где R=Me) формулы (xxxviii) могут превращаться в соединения формулы (XL) с помощью обработки соединениями формулы (xxxix), в которой Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС) [которые могут быть получены с использованием, например, метода, описанного в Journal of Organic Chemistry(DIAD) и трифенилфосфина в подходящем растворителе, таком как толуол. Соединения формулы (xL), в которой Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС), могут превращаться в соединения формулы (xLi) с помощью обработки кислотой, обычно 4 толуолсульфоновой кислотой, в подходящем растворителе, таком как метанол. Соединения формулы(xLi) могут превращаться в соединения формулы (xLii), например, с помощью обработки соответствующей кислотой, такой как трифторуксусная кислота, при комнатной температуре, затем нагревания при температуре дефлегмации в присутствии подходящего основания, такого как триэтиламин, и в подходящем растворителе, таком как толуол. Соединения формулы (xLii) могут превращаться в соединения формулы (xLiii) с помощью обработки соответствующим восстанавливающим агентом, таким как боранТГФ комплекс, в подходящем растворителе, таком как ТГФ, при подходящей температуре, такой как температура дефлегмации. Соединения формулы (xLiii) могут превращаться в защищенное производное(xLiv), в котором Р представляет подходящую защитную группу, такую как трет-бутилоксикарбонил(ВОС), например, с помощью обработки бис-(1,1-диметилэтил)дикарбонатом в присутствии основания,такого как триэтиламин, в подходящем растворителе, таком как дихлорметан (DCM). Соединения формулы (xLiv) могут превращаться в соединения формулы (xLv) с помощью обработки подходящим источником цианида, таким как цианид цинка, в присутствии катализатора, такого как тетракистрифенилфосфинпалладий(0), в подходящем растворителе, таком как диметилформамид (ДМФ), при повышенной температуре, такой как 80 С. Соединения формулы (xLv) могут превращаться в соединения формулы (xLvi) с помощью обработки гидрохлоридом гидроксиламина и соответствующим основанием,таким как бикарбонат натрия, в растворителе, таком как метанол или этанол, при повышенной температуре, такой как 60 С. Соединения формулы (xLvi) могут превращаться в соединения формулы (xLvii) с помощью обра- 11017669 ботки хлорангидридом карбоновой кислоты формулы (xv), как описано на схеме 1 для превращения соединений (xiii) в соединения формулы (xvi). Соединения формулы (xLvii) могут превращаться в соединения формулы (xLviii) с помощью окисления подходящим агентом окисления, таким как перйодинонDess Martin, в подходящем растворителе, таком как дихлорметан. Соединения формулы (xLviii) могут превращаться в соединения формулы (xLix), например, с помощью обработки реагентом Виттига (xix),таким как (карбэтоксиметилен)трифенилфосфоран, в подходящем растворителе, таком как дихлорметан. Соединения формулы (xLix) могут превращаться в соединения формулы (L) с помощью гидрирования с использованием подходящего катализатора, такого как палладий, в подходящем растворителе, таком как этанол. Соединения формулы (L) могут превращаться в соединения формулы (Li) с помощью обработки основанием, таким как водный гидроксид натрия, в спиртовом растворителе, таком как этанол или метанол. Соединения формулы (Li), в которой, например, Р представляет ВОС, могут превращаться в некоторые соединения формулы (I) с помощью обработки кислотой, обычно трифторуксусной кислотой или соляной кислотой, как описано на схеме 1. Один из способов, который может использоваться для получения соединений формулы (I), в которой В представляет иллюстрируется на схеме 6, на которой R1, R2 и А имеют значения, определенные для формулы (I) выше,и боковая цепь R4 расположена в 3-положении бензоксазепинового кольца и представлена формулой СО 2 Н, R3 представляет водород и Р является защитной группой. Схема 6 Соединения формулы (xLvii) могут превращаться в соединения формулы (Lii) с помощью окисления подходящим окисляющим агентом, таким как триоксид хрома, в серной кислоте в подходящем растворителе, таком как ацетон. Соединения формулы (Lii), в которой, например, Р представляет ВОС, могут превращаться в некоторые соединения формулы (I) с помощью обработки кислотой, обычно трифторуксусной кислотой или соляной кислотой. Все публикации, включающие, но не ограниченные ими, патенты и патентные заявки, цитируемые в данном описании, включены в описание путем ссылки на них, как если бы было указано, что каждая отдельная публикация была конкретно и отдельно включена в описание полностью. Следующие получения и примеры иллюстрируют получение соединений согласно изобретению. Сокращения:MDAP - масс-направленная автоматизированная препаративная жидкостная хроматография; насыщ. - насыщенный. Основной химический раздел Способы, описанные ниже, даются в целях иллюстрации, промежуточные соединения в примерах получения могут необязательно быть получены из описанных конкретных комплектов. Получение 1. Фенилметил 3-3-[(фенилметил)окси]фенилпропаноат(31,1 г, 225 ммоль) и бензилбромида (18,7 мл, 158 ммоль) в DMF (120 мл) перемешивали при 65 С в течение 16 ч. Смесь охлаждали до комнатной температуры, разбавляли простым эфиром (200 мл) и водой(400 мл) и водную фазу реэкстрагировали простым эфиром (100 мл). Объединенные органические экстракты промывали водой (3100 мл), сушили (сульфатом магния) и выпаривали, получая почти бесцветное масло (26,5 г), которое использовали без дальнейшей очистки. 1 Смесь фенилметил 3-3-[(фенилметил)окси]фенилпропаноата (26,5 г, 76 ммоль) и 2 М водного раствора гидроксида натрия (115 мл, 229 ммоль) в этаноле (250 мл) перемешивали при 60 С в течение 30 мин, затем этанол выпаривали. Остаток разбавляли водой (200 мл) и экстрагировали простым эфиром(2150 мл). Водную фазу подкисляли 2 М водным раствором HCl и экстрагировали простым эфиром(250 мл и 100 мл), затем объединенные эфирные экстракты сушили (сульфатом магния) и выпаривали,получая белое твердое вещество (19,6 г). Этилхлорформиат (8,08 мл, 84 ммоль) по каплям добавляли к раствору 3-3[(фенилметил)окси]фенилпропановой кислоты (19,6 г, 76 ммоль) и триэтиламина (11,7 мл, 84 ммоль) вTHF (ТГФ) (250 мл) при -10 С, получая белую суспензию. Смесь перемешивали при -10 С в течение 15 мин, затем одной порцией добавляли аммиак (120 мл, 1830 ммоль), давая возможность нагреться до комнатной температуры в течение 2 ч. THF выпаривали и водную суспензию экстрагировали DCM(200 мл и 250 мл). Объединенные органические вещества сушили (сульфатом магния), выпаривали,суспендировали в простом эфире и отфильтровывали, получая белое твердое вещество (16,2 г). Раствор 3-3-[(фенилметил)окси]фенилпропанамида (16,13 г, 63,2 ммоль) в THF (350 мл) в течение 15 мин добавляли к перемешиваемому раствору LiAlH4 (1 М раствор в THF, 126 мл, 126 ммоль) в атмосфере аргона при охлаждении в ледяной бане. Смесь затем перемешивали при 65 С в течение 2 ч, перед тем как ее охлаждали до 0 С и гасили путем осторожного добавления воды (4,8 мл), 15% водного раствора гидроксида натрия (4,8 мл) и воды (14,4 мл) все при охлаждении льдом. Смесь фильтровали, выпаривали, повторно растворяли в DCM (200 мл), затем промывали водой (100 мл), сушили (сульфатом магния) и выпаривали, получая воскообразное твердое вещество. Его распределяли между этилацетатом(200 мл) и 2 М водным раствором гидроксида натрия (150 мл), затем фильтровали и отделяли. Органическую фазу сушили (сульфатом магния) и выпаривали, получая бесцветное масло (14,1 г). Метил 4-хлор-4-оксобутаноат (1,58 г, 10,5 ммоль) по каплям добавляли к перемешиваемому раствору (3-3-[(фенилметил)окси]фенилпропил)амина (2,41 г, 9,99 ммоль) и триэтиламина (1,53 мл,11,0 ммоль) в DCM (30 мл) при охлаждении ледяной баней. Смесь перемешивали в течение 30 мин, затем промывали 2 М водным раствором соляной кислоты (30 мл), сушили (сульфатом магния), выпаривали и очищали с помощью флэш-хроматографии (этилацетат/изогексан, 1:1), получая смолу, которая кристаллизовалась при поскребывании (1,91 г). Раствор метил 4-оксо-4-[(3-3-[(фенилметил)окси]фенилпропил)амино]бутаноата (10,4 г, 29,3 ммоль) и оксихлорида фосфора (8,95 мл, 96 ммоль) в MeCN (250 мл) перемешивали при температуре кипения с обратным холодильником в атмосфере аргона в течение 2,5 ч, затем охлаждали и выпаривали. Остаток растворяли в метаноле (150 мл), охлаждали до 0 С, затем на протяжении 25 мин, порциями добавляли боргидрид натрия (7,65 г, 202 ммоль) и смесь оставляли стоять в течение 16 ч. Добавляли воду(600 мл), затем смесь экстрагировали DCM (200 мл и 275 мл). Объединенные органические вещества сушили (сульфатом магния), выпаривали и очищали с помощью флэш-хроматографии (3% метанол вDCM (50 мл) и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь промывали водой (50 мл), сушили (сульфатом магния), выпаривали и очищали с помощью флэш-хроматографии дважды (этилацетат/изогексан, 1:4), получая бесцветную смолу (1,81 г). Раствор 1,1-диметилэтил 1-[3-метилокси)-3-оксопропил]-7-[(фенилметил)окси]-1,3,4,5-тетрагидро 2 Н-2-бензазепин-2-карбоксилата (0,088 г, 0,200 ммоль) в метаноле (4 мл) гидрировали при непрерывном режиме потока при 50 С. Выпаривание давало бесцветную смолу (55 мг). Трифторметансульфоновый ангидрид (0,041 мл, 0,240 ммоль) добавляли к раствору 1,1 диметилэтил 7-гидрокси-1-[3-(метилокси)-3-оксопропил]-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2 карбоксилата (0,070 г, 0,200 ммоль) в пиридине (2 мл) и перемешивали при комнатной температуре в течение 30 мин. Добавляли простой эфир (40 мл), затем смесь промывали 2 М водным раствором HCl (20 мл), водой 7-циано-1-[3-(метилокси)-3-оксопропил]-1,3,4,5-тетрагидро-2 Н-2-бензазепин-2 Смесь 1,1-диметилэтил 1-[3-(метилокси)-3-оксопропил]-7-[(трифторметил)сульфонил]окси 1,3,4,5-тетрагидро-2 Н-2-бензазепин-2-карбоксилата (1,8 г, 3,74 ммоль), цианида цинка (0,878 г, 7,48 ммоль) и тетракис-(трифенилфосфин)палладия (0,864 г, 0,748 ммоль) в DMF (15 мл) перемешивали при 90 С в атмосфере аргона в течение 18 ч, затем охлаждали до комнатной температуры и разбавляли водой/этилацетатом (по 60 мл каждого). Органический слой промывали водой (320 мл), сушили (сульфатом магния) и очищали с помощью флэш-хроматографии (этилацетат/изогексан, 1:3), получая бесцветную смолу (608 мг). Смесь 1,1-диметилэтил 7-циано-1-[3-(метилокси)-3-оксопропил]-1,3,4,5-тетрагидро-2H-2 бензазепин-2-карбоксилата (0,072 г, 0,201 ммоль), гидрохлорида гидроксиламина (0,028 г, 0,402 ммоль) и бикарбоната натрия (0,067 г, 0,804 ммоль) в этаноле (4 мл) перемешивали при 60 С в течение 3 ч, затем оставляли при комнатной температуре в течение 64 ч. Добавляли этилацетат (40 мл) и смесь промывали водой (50 мл), сушили (сульфатом магния) и выпаривали, получая бесцветную смолу (80 мг, LCMS: 81% чистоты).DMF (8 мл) перемешивали при комнатной температуре в течение 20 мин, затем нагревали при 120 С в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом/водой(по 80 мл каждого). Органическую фазу промывали насыщенным водным раствором бикарбоната натрия и водой (320 мл), затем сушили (сульфатом магния), выпаривали и очищали с помощью флэшхроматографии (этилацетат/изогексан, 1:3), получая белую пену (515 мг). 2 М Водный раствор гидроксида натрия (0,5 мл, 1,0 ммоль) добавляли к раствору 1,1-диметилэтил 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1-[3-(метилокси)-3-оксопропил]1,3,4,5-тетрагидро-2H-2-бензазепин-2-карбоксилата (0,090 г, 0,16 ммоль) в этаноле (4 мл) и перемешивали при комнатной температуре в течение 17 ч. Смесь выпаривали и остаток распределяли между водой и простым эфиром, затем подкисляли 2 М водным раствором HCl. Органическую фазу сушили (сульфатом магния) и выпаривали, получая белую пену (86 мг). Трифторуксусную кислоту (1 мл, 12,98 ммоль) добавляли к раствору 1,1-диметилэтил 7-(5-3-хлор 4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-1-[3-(метилокси)-3-оксопропил]-1,3,4,5-тетрагидро 2H-2-бензазепин-2-карбоксилата (0,10 г, 0,175 ммоль) в DCM (1 мл) и перемешивали при комнатной температуре в течение 30 мин. Раствор выпаривали, снова растворяли в простом эфире (30 мл), промывали 1 М водным раствором карбоната калия, сушили (сульфатом магния) и выпаривали, получая бесцветную смолу (71 мг).DIAD (6,40 мл, 32,9 ммоль) добавляли к раствору 1,1-диметилэтил 4-(гидроксиметил)-2,2-диметил 1,3-оксазолидин-3-карбоксилата (6,92 г, 29,9 ммоль), метил 5-бром-2-гидроксибензоата (6,91 г,29,9 ммоль) и трифенилфосфина (8,63 г, 32,9 ммоль) в толуоле (70 мл), затем смесь перемешивали при 80 С в течение 18 ч. Раствор охлаждали, выпаривали и очищали с помощью флэш-хроматографии (этилацетат/изогексан, 1:9), получая бесцветное масло (7,56 г). К раствору 1,1-диметилэтил 4-[(4-бром-2-[(метилокси)карбонил]фенилокси)метил]-2,2-диметил 1,3-оксазолидин-3-карбоксилата (7,54 г, 17,0 ммоль) в метаноле (100 мл) добавляли паратолуолсульфоновую кислоту (0,10 г, 0,53 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. Раствор выпаривали досуха и очищали с помощью флэш-хроматографии (этилацетат/изогексан, 2:3), получая бесцветное вязкое масло (5,55 г).(5,52 г, 13,7 ммоль) растворяли в DCM (15 мл) и TFA (15 мл, 195 ммоль) и перемешивали при комнатной температуре в течение 1 ч. Раствор выпаривали, затем остаток снова растворяли в толуоле (60 мл) и триэтиламине (8 мл, 57,4 ммоль) перед тем, как его нагревали в условиях дефлегмации в течение 2 ч. Смесь выпаривали досуха, снова растворяли в этилацетате (100 мл), промывали водой (20 мл), сушили (сульфатом магния) и выпаривали. Остаток растворяли в 2 М аммиаке в метаноле (50 мл) и перемешивали при комнатной температуре в течение 5 дней. Выпаривание и очистка с помощью флэш-хроматографии(3,5% метанол в DCM) давали белое твердое вещество (2,71 г). 1 М Борановый-THF комплекс в THF (26,0 мл, 26,0 ммоль) добавляли к суспензии 7-бром-3(гидроксиметил)-3,4-дигидро-1,4-бензоксазепин-5(2H)-она (2,36 г, 8,67 ммоль) в THF (5 мл) и смесь нагревали в условиях дефлегмации в течение 5 ч, затем охлаждали до комнатной температуры. Добавляли 5 М водный раствор HCl (50 мл) и смесь нагревали в условиях дефлегмации в течение 1 ч, затем охлаждали до комнатной температуры. Выпаривание и азеотропная дистилляция остаточного растворителя этанолом (100 мл) оставляли остаток, который снова растворяли в этаноле (100 мл) и триэтиламине(20 мл), затем снова концентрировали. Очистка с помощью флэш-хроматографии (5% метанол в DCM) давала сырой продукт, который распределяли между этилацетатом (300 мл) и водой (100 мл). Данную смесь превращали в основание 2 М водным раствором гидроксида натрия, затем органические вещества сушили (сульфатом магния) и выпаривали, получая белое твердое вещество (1,93 г). Смесь (7-бром-2,3,4,5-тетрагидро-1,4-бензоксазепин-3-ил)метанола (1,93 г, 7,48 ммоль) и ВОСангидрида (2,08 мл, 8,97 ммоль) в THF (30 мл) и насыщенного водного раствора бикарбоната натрия(30 мл) перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли этилацетатом (100 мл), промывали водой (50 мл), сушили (сульфатом магния), выпаривали и очищали с помощью флэшхроматографии (этилацетат/изогексан, 2:3), получая белое твердое вещество (2,36 г). Смесь 1,1-диметилэтил 7-бром-3-(гидроксиметил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (2,05 г, 5,72 ммоль), цианида цинка (1,34 г, 11,5 ммоль) и тетракис(трифенилфосфин)палладия (0,992 г, 0,858 ммоль) в DMF (20 мл) перемешивали при 80 С в атмосфере аргона в течение 3 ч. Смесь охлаждали, разбавляли этилацетатом/водой (по 150 мл каждого) и слои разделяли. Органическую фазу промывали водой (330 мл), сушили (сульфатом магния), выпаривали и- 18017669 очищали с помощью флэш-хроматографии (этилацетат/изогексан, 1:1), получая белое твердое вещество Смесь 1,1-диметилэтил 7-циано-3-(гидроксиметил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (1,43 г, 4,70 ммоль), гидрохлорида гидроксиламина (0,653 г, 9,40 ммоль) и бикарбоната натрия (1,974 г, 23,5 ммоль) в этаноле (20 мл) перемешивали при 50 С в течение 15 ч, затем охлаждали и разбавляли смесью этилацетат/вода (по 100 мл каждого). Водную фазу повторно экстрагировали этилацетатом (50 мл), затем объединенные органические вещества сушили (сульфатом магния) и выпаривали,получая белую пену (1,60 г).(20 мл) перемешивали при комнатной температуре в течение 30 мин, затем нагревали при 100 С в течение 5 ч. Смесь охлаждали, разбавляли этилацетатом (150 мл), затем промывали водой (100 мл), насыщенным водным раствором бикарбоната натрия и водой (350 мл). Выпаривание, а затем очистка с помощью флэш-хроматографии (этилацетат/изогексан, 45:55) давали белое твердое вещество (673 мг). Реагент Джонса [полученный из триоксида хрома (0,213 г, 2,13 ммоль) и серной кислоты (184 мкл,3,45 ммоль), доведенный до 0,8 мл водой] добавляли к охлажденному льдом раствору 1,1-диметилэтил 7(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-3-(гидроксиметил)-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-карбоксилата (0,103 г, 0,2 ммоль) в ацетоне (4 мл) и получающуюся смесь перемешивали на льду в течение 2 ч. Добавляли IPA (0,5 мл) с последующим добавлением воды (20 мл) и этилацетата (40 мл). Органическую фазу сушили (сульфатом магния), выпаривали и очищали с помощью флэш-хроматографии (этилацетат/изогексан 1:1, затем 1% уксусная кислота в смеси этилацетат/изогексан, 1:1), получая белое твердое вещество (72 мг).- 19017669 Перйодинан Десс-Мартина (0,127 г, 0,300 ммоль) добавляли к раствору 1,1-диметилэтил 7-(5-3 хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-3-(гидроксиметил)-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-карбоксилата (0,155 г, 0,30 ммоль) в DCM (5 мл) в атмосфере аргона и получающуюся смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли DCM (30 мл), затем смесь промывали раствором тиосульфата натрия (3 г) в насыщенном водном бикарбонате натрия (20 мл). Органическую фазу сушили (сульфатом магния), выпаривали и очищали с помощью флэшхроматографии (этилацетат/изогексан, 2:3), получая камедь, которую растирали с эфиром, получая белое твердое вещество (136 мг). Смесь 1,1-диметилэтил 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-3 формил-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (0,136 г, 0,265 ммоль) и этил (трифенил-5 фосфанилиден) ацетата (0,101 г, 0,291 ммоль) в ТГФ (4 мл) перемешивали при 40 С в атмосфере аргона в течение 1 ч. Выпаривание и очистка с помощью флэш-хроматографии (этилацетат/изогексан, 1:4) давали бесцветную камедь (109 мг). Раствор 1,1-диметилэтил 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-3-[(1E)-3(этилокси)-3-оксо-1-пропен-1-ил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (0,109 г, 0,187 ммоль) в этаноле (20 мл) гидрировали 10% Pd/C (0,030 г, 0,282 ммоль, 50% вода) в течение 45 мин, затем фильтровали, выпаривали и очищали с помощью флэш-хроматографии (этилацетат/изогексан, 1:4), получая бесцветную камедь (59 мг). 2 М Водный раствор гидроксида натрия (1,0 мл, 2,0 ммоль) добавляли к раствору 1,1-диметилэтил 7-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-3-[3-(этилокси)-3-оксопропил]-2,3 дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (0,059 г, 0,101 ммоль) в этаноле (4 мл) и перемешивали при комнатной температуре в течение 2 ч. Смесь выпаривали, затем распределяли между водой и этилацетатом (25 мл каждый) и подкисляли 2 М водным HCl. Органическую фазу сушили (сульфатом магния) и выпаривали, получая бесцветную камедь (55 мг).(20 мл) при комнатной температуре добавляли (карбоксиметилен)трифенилфосфоран (Aldrich; 2,09 г,- 20017669 6,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем растворитель выпаривали. Очистка остатка с помощью хроматографии с элюированием 20% этилацетатом в циклогексане давала указанное в заголовке соединение в виде белого твердого вещества (1,2 г). МС (ES) C11H11BrO3 вычислено 270, 272; найдено 271, 273 [М+Н]+. Получение 29. Этил(714 мг, 3,53 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали, а остаток растворяли в этилацетате, затем промывали дважды солевым раствором. Органическую фазу сушили и выпаривали. Очистка с помощью хроматографии с элюированием 20% этилацетатом в циклогексане давала продукт в виде бесцветного масла (1,23 г). МС (ES) C18H24BrNO5 вычислено 413, 415; найдено 414, 416 [М+Н]+. Получение 30. Этил (2 Е)-3-2-[(2-аминоэтил)окси]-3-бромфенил-2-пропеноат соль трифторуксусной кислоты К раствору этил (2 Е)-3-(3-бром-2-[2-([(1,1-диметилэтил)окси]карбониламино)этил]оксифенил)2-пропеноата (получение 29) (0,207 г, 0,5 ммоль) в дихлорметане (4 мл) на ледяной бане медленно добавляли трифторуксусную кислоту (1 мл). Спустя 1 ч реакционную смесь концентрировали досуха и остаток перегоняли азеотропно с диэтиловым эфиром. Остаток сушили в вакууме, получая сырой или неочищенный продукт в виде масла (0,214 г). МС (ES) C13H16BrNO3 вычислено 313, 315; найдено 314, 316 [М+Н]+. Получение 31. Этил (9-бром-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил)ацетат К раствору этил (2 Е)-3-2-[(2-аминоэтил)окси]-3-бромфенил-2-пропеноата (получение 30) (1,4 г,4,46 ммоль) в тетрагидрофуране (40 мл) при комнатной температуре в атмосфере азота добавляли 1,8 диазабицикло[5.4.0]ундец-7-ен (0,678 г, 4,46 ммоль) и реакционную смесь перемешивали при комнатной температуре на протяжении ночи. Растворитель выпаривали, а остаток очищали с помощью хроматографии при элюировании 0-2% метанолом в дихлорметане, получая указанное в заголовке соединение в виде бесцветного масла (1,31 г). МС (ES) C13H16BrNO3 вычислено 313, 315; найдено 314, 316 [М+Н]+. Получение 32. 1,1-Диметилэтил К раствору этил (9-бром-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил)ацетата (получение 31) (12,3 г,39,2 ммоль) в тетрагидрофуране (200 мл) при 0 С добавляли триэтиламин (4,77 г, 47,1 ммоль), затем ди- 21017669 трет-бутилдикарбонат (9,42 г, 43,2 ммоль). Через 2 мин ледяную баню удаляли и реакционную смесь оставляли стоять при комнатной температуре на протяжении конца недели (выходных). Растворитель выпаривали и остаток очищали с помощью хроматографии при элюировании 3-15% этилацетатом в циклогексане, получая продукт в виде бесцветного масла (15,7 г). МС (ES) C18H24BrNO5 вычислено 413, 415/ найдено 414, 416 [М+Н]+. Получение 33. 1,1-Диметилэтил 9-циано-5-[2-(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилат Раствор 1,1-диметилэтил 9-бром-5-[2-(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (получение 32) (1,02 г, 2,47 ммоль) в N,N-диметилформамиде (ДМФ) (7 мл) дегазировали в вакууме в течение 15 мин, затем добавляли цианид цинка (348 мг, 2,98 ммоль) и тетракис(трифенилфосфин)палладий(0) (285 мг, 0,247 ммоль), получающуюся желтую смесь перемешивали в атмосфере азота при 100 С в течение 5 ч. Охлажденную смесь фильтровали и промывали ДМФ. Фильтрат выпаривали и остаток распределяли между этилацетатом и солевым раствором. Объединенные органические экстракты промывали солевым раствором и органическую фазу сушили и выпаривали. Очистка с помощью флэш-хроматографии при элюировании 20% этилацетатом в циклогексане давала указанное в заголовке соединение в виде бесцветного твердого вещества (760 мг). МС (ES) C19H24N2O5 вычислено 360; найдено 361 [М+Н]+. Получение 34. 1,1-Диметилэтил 5-[2-(этилокси)-2-оксоэтил]-9-[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-карбоксилат Смесь 1,1-диметилэтил 9-циано-5-[2-(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (получение 33) (1,08 г, 3,0 ммоль), гидрохлорида гидроксиламина (521 мг, 7,5 ммоль) и бикарбоната натрия (630 мг, 7,5 ммоль) в этаноле (15 мл) нагревали с обратным холодильником в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры, фильтровали через целит и растворитель выпаривали. Остаток очищали с помощью хроматографии при элюировании 0-5% метанолом в дихлорметане, получая указанное в заголовке соединение в виде бесцветной пены (0,968 г). МС (ES) C19H27N3O6 вычислено 393; найдено 394 [М+Н]+. Получение 35. 1,1-Диметилэтил 9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[2-(этилокси)2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилат(21 мл) добавляли 3-хлор-4-[(1 метилэтил)окси]бензоилхлорид (получение 41) (401 мг, 2,09 ммоль) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 10 мин, затем при 120 С в течение 20 мин. Спустя 20 мин добавляли еще триэтиламин (51 мг, 0,504 ммоль) и 3-хлор-4-[(1-метилэтил)окси]бензоилхлорид (80,2 мг,0,418 ммоль) и смесь перемешивали при 120 С в течение 6 ч. Смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток растворяли в этилацетате и раствор промывали 2 н. гидроксидом натрия, затем солевым раствором, сушили (сульфатом натрия) и выпаривали. Очистка остатка с помощью хроматографии при элюировании 20% этилацетатом в циклогексане давала указанное в заголовке соединение в виде пены (740 мг). МС (ES) C29H3435ClN3O7 вычислено 571; найдено 572 [М+Н]+. Получение 36. Натриевая соль Смесь 1,1-диметилэтил 9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[2(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 35) (120 мг,0,21 ммоль), этанола (1 мл) и 2 М гидроксида натрия (2 мл) перемешивали при 60 С в течение 1 ч. Реакционную смесь охлаждали и растворитель выпаривали. Остаток суспендировали в воде (2 мл) и экстрагировали этилацетатом (22 мл). Объединенные экстракты сушили (сульфатом натрия) и выпаривали. Растирание остатка с диэтиловым эфиром давало указанное в заголовке соединение в виде бесцветного твердого вещества (90 мг). МС (ES) C27H30ClN3O7 вычислено 543; найдено 544 [М+Н]+. Получение 37. 1,1-Диметилэтил 9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[2(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилатi) Оксалилхлорид (152 мг, 105 мкл, 1,2 ммоль) добавляли к перемешиваемому раствору 3-циано-4[(1-метилэтил)окси]бензойной кислоты (WO 2001002355; 205 мг, 1 ммоль) в сухом дихлорметане (5 мл) с последующим добавлением N,N-диметилформамида (1 капля, катализатор) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель затем выпаривали, а остаток сушили в вакууме в течение 30 мин.ii) Раствор неочищенного хлорангидрида кислоты (стадия i) (1 ммоль) в ацетонитриле (5 мл) добавляли по каплям к перемешиваемому раствору 1,1-диметилэтил 5-[2-(этилокси)-2-оксоэтил]-9[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата(393 мг, 1 ммоль) и триэтиламина (121 мг, 167 мкл, 1,2 ммоль) в ацетонитриле (5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч, затем нагревали при температуре кипения с обратным холодильником в течение 72 ч. Реакционную смесь охлаждали и растворитель выпаривали. Остаток очищали с помощью хроматографии при элюировании 15-25% этилацетатом в циклогексане, получая ука- 23017669 занное в заголовке соединение в виде бесцветного масла (180 мг). МС (ES) C30H34N4O7 вычислено 562; найдено 563 [М+Н]+. Получение 38. Смесь 1,1-диметилэтил 9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[2(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 37) (170 мг,0,30 ммоль), 2 М гидроксида натрия (2 мл) и этанола (4 мл) перемешивали при 60 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и этанол выпаривали. Остаток разбавляли водой(5 мл) и подкисляли ледяной уксусной кислотой. Смесь экстрагировали этилацетатом (35 мл). Объединенные экстракты сушили (сульфатом натрия) и выпаривали. Остаток сушили в условиях высокого вакуума, получая указанное в заголовке соединение в виде бесцветной пены (150 мг). МС (ES) C28H30N4O7 вычислено 534; найдено 535 [М+Н]+. Получение 39. 1,1-Диметилэтил 9-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-5-[2(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилатi) Оксалилхлорид (152 мг, 105 мкл, 1,2 ммоль) добавляли к перемешиваемому раствору 5-хлор-6[(1-метилэтил)окси]-3-пиридинкарбоновой кислоты (WO 9702244; 215 мг, 1 ммоль) в сухом дихлорметане (5 мл) с последующим добавлением ДМФ (1 капля, катализатор) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель затем выпаривали, а остаток сушили в вакууме в течение 30 мин.ii) Раствор неочищенного хлорангидрида кислоты (стадия i) (1 ммоль) в ацетонитриле (5 мл) добавляли по каплям к перемешиваемому раствору 1,1-диметилэтил 5-[2-(этилокси)-2-оксоэтил]-9[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата(393 мг, 1 ммоль) и триэтиламина (121 мг, 167 мкл, 1,2 ммоль) в ацетонитриле (5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч, затем нагревали при температуре кипения с обратным холодильником в течение 72 ч. Реакционную смесь охлаждали и растворитель выпаривали, а остаток очищали с помощью хроматографии. Элюирование 15-25% этилацетатом в циклогексане давало указанное в заголовке соединение в виде бледно-желтого масла (180 мг). МС (ES) C28H3335ClN4O7 вычислено 572; найдено 573 [М+Н]+. Смесь 1,1-диметилэтил 9-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-5[2-(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 39) (170 мг,0,30 ммоль), 2 М гидроксида натрия (5 мл) и этанола (8 мл) перемешивали при 60 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и этанол выпаривали. Остаток разбавляли водой (10 мл) и подкисляли ледяной уксусной кислотой. Смесь экстрагировали этилацетатом(35 мл). Объединенные экстракты сушили (сульфатом натрия) и выпаривали. Остаток сушили в условиях высокого вакуума, получая указанное в заголовке соединение в виде бесцветной пены (150 мг). МС (ES) C26H2935ClN4O7 вычислено 544; найдено 545 [М+Н]+. Получение 41. 3-Хлор-4-[(1-метилэтил)окси]бензоилхлорид Круглодонную колбу загружали 3-хлор-4-[(1-метилэтил)окси]бензойной кислотой (Paragos ProductList, 10,2 г, 47,5 ммоль), дихлорметаном (158 мл) и оксалилхлоридом (8,29 мл, 95 ммоль). Реакционную смесь охлаждали до 0 С на бане лед/вода перед добавлением N,N-диметилформамида (0,158 мл). Раствору давали возможность подогреться до температуры окружающей среды на протяжении ночи. Растворитель выпаривали, получая указанное в заголовке соединение в виде кремового твердого вещества (11,4 г). 1 К раствору 1,1-диметилэтил 9-циано-5-[2-(этилокси)-2-оксоэтил]-2,3-дигидро-1,4-бензоксазепин 4(5 Н)-карбоксилата (получение 33) (282 мг, 0,78 ммоль) в этаноле (5 мл) добавляли боргидрид лития,2 М раствор в ТГФ (0,587 мл, 1,17 ммоль). После перемешивания при комнатной температуре в течение 1 ч добавляли диэтиловый эфир(5 мл). Через 30 мин добавляли боргидрид лития, 2 М раствор в ТГФ (0,500 мл, 1,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Суспензию растворяли в метаноле (40 мл) и гасили при 0 С 2 М соляной кислотой. Большинство растворителя выпаривали. Остаток разбавляли этилацетатом и промывали солевым раствором. Органическую фазу сушили и выпаривали, получая указанное в заголовке соединение (224 мг). МС (ES) C17H22N2O4 вычислено 318, найдено 319 [М+Н]+. К раствору оксалилхлорида (777 мг, 0,54 мл, 6,12 ммоль) в дихлорметане (25 мл) при -78 С в атмосфере азота добавляли раствор диметилсульфоксида (552 мг, 0,50 мл, 7,07 ммоль) в дихлорметане (5 мл) на протяжении 5 мин. Через 10 мин добавляли раствор 1,1-диметилэтил 9-циано-5-(2-гидроксиэтил)-2,3 дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 42) (1,50 г, 4,71 ммоль) в дихлорметане(10 мл). Реакционную смесь перемешивали при -78 С в течение 70 мин, затем по каплям на протяжении 2 мин добавляли триэтиламин (1,43 г, 1,97 мл, 14,1 ммоль). Смеси давали возможность подогреться до комнатной температуры. Через 40 мин добавляли раствор тилтрифенилфосфорилиденацетата (1,97 г,5,65 ммоль) в дихлорметане (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали и остаток распределяли между этилацетатом и солевым раствором. Органическую фазу отделяли, сушили и выпаривали. Очистка с помощью хроматографии, элюирование 0-50% этилацетатом в циклогексане давали указанное в заголовке соединение в виде бесцветного масла (1,76 г). МС (ES) C21H26N2O5 вычислено 386, найдено 387 [М+Н]+. Получение 44. 1,1-Диметилэтил 9-циано-5-[4-(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилат Смесь 1,1-диметилэтил 9-циано-5-[(2 Е)-4-(этилокси)-4-оксо-2-бутен-1-ил]-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-карбоксилата (получение 43) (780 мг, 2,02 ммоль) и 10% палладия-на-угле, 50% водной пасты (430 мг) в этаноле (30 мл) перемешивали в атмосфере водорода в течение 90 мин. Реакционную смесь фильтровали через целит и фильтрат выпаривали, получая указанное в заголовке соединение (680 мг). МС (ES) C21H28N2O5 вычислено 388, найдено 389 [М+Н]+. Получение 45. 1,1-Диметилэтил 5-[4-(этилокси)-4-оксобутил]-9-[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4 бензоксазепин-4(5 Н)-карбоксилат Смесь 1,1-диметилэтил 9-циано-5-[4-(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)карбоксилата (получение 44) (750 мг, 1,93 ммоль), гидрохлорида гидроксиламина (335 мг, 4,83 ммоль) и бикарбоната натрия (405 мг, 4,83 ммоль) в этаноле (10 мл) перемешивали при 70 С в течение 24 ч. Реакционную смесь охлаждали и фильтровали через целит. Фильтрат выпаривали, получая бесцветную ка- 26017669 медь (смолу) (814 мг), которую использовали в получении 46 без дополнительной очистки. МС (ES) C21H31N3O6 вычислено 421, найдено 422 [М+Н]+. Получение 46. 1,1-Диметилэтил 9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[4-(этилокси)4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилат(10 мл) с последующим добавлением ДМФ (1 капля). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем растворитель выпаривали, а остаток сушили в вакууме в течение 30 мин. Раствор неочищенного хлорангидрида кислоты (1,00 ммоль) в ацетонитриле (5 мл) добавляли по каплям к перемешиваемому раствору 1,1-диметилэтил 5-[4-(этилокси)-4-оксобутил]-9[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата(270 мг, 0,64 ммоль) и триэтиламина (121 мг, 167 мкл, 1,2 ммоль) в ацетонитриле (5 мл) и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь нагревали в условиях дефлегмации в течение 72 ч, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток очищали с помощью хроматографии при элюировании с 15-25% этилацетатом в циклогексане, получая указанное в заголовке соединение в виде бесцветного масла (70 мг). МС (ES) C31H3835ClN3O7 вычислено 599, найдено 600 [М+Н]+. Получение 47. 1,1-Диметилэтил 9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[4(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилат(10 мл) с последующим добавлением ДМФ (1 капля). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали, а остаток сушили в вакууме в течение 3,0 мин. К перемешиваемому раствору 1,1-диметилэтил 5-[4-(этилокси)-4-оксобутил]-9-[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 45) (270 мг, 0,64 ммоль) и триэтиламина (121 мг, 167 мкл, 1,20 ммоль) в ацетонитриле (5 мл) добавляли по каплям раствор неочищенного хлорангидрида кислоты (1,00 ммоль) в ацетонитриле (5 мл) и перемешивали при комнатной температуре в течение 1 ч. Затем реакционную смесь нагревали в условиях дефлегмации в течение 72 ч, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток очищали с помощью хроматографии, элюируя 15-25% этилацетатом в циклогексане, получая указанное в заголовке соединение в виде бесцветного масла (120 мг). Оксалилхлорид (152 мг, 105 мкл, 1,20 ммоль) добавляли к перемешиваемому раствору 5-хлор-6-[(1 метилэтил)окси]-3-пиридинкарбоновой кислоты (WO 97/02244; 215 мг, 1,00 ммоль) в сухом дихлорметане (10 мл) с последующим добавлением ДМФ (1 капля). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали, а остаток сушили в вакууме в течение 30 мин. К перемешиваемому раствору 1,1-диметилэтил 5-[4-(этилокси)-4-оксобутил]-9-[(гидроксиамино)(имино)метил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 45) (270 мг, 0,64 ммоль) и триэтиламина (121 мг, 167 мкл, 1,20 ммоль) в ацетонитриле (5 мл) добавляли по каплям раствор неочищенного хлорангидрида кислоты (1,00 ммоль) в ацетонитриле (5 мл) и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь нагревали в условиях дефлегмации в течение 72 ч, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток очищали с помощью хроматографии, элюируя 15-25% этилацетатом в циклогексане, получая указанное в заголовке соединение в виде бесцветного масла, которое затвердевало при стоянии (147 мг). Смесь 1,1-диметилэтил 9-(5-3-циано-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[4(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 47) (120 мг,0,20 ммоль), 2 М гидроксида натрия (2 мл) и этанола (2 мл) перемешивали при 50 С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток разбавляли водой (10 мл) и подкисляли ледяной уксусной кислотой. Смесь экстрагировали этилацетатом (35 мл) и объединенные органические вещества сушили и выпаривали. Растирание остатка со смесью изогексан/диэтиловый эфир давало указанное в заголовке соединение в виде твердого вещества (80 мг). Смесь 1,1-диметилэтил 9-(5-3-хлор-4-[(1-метилэтил)окси]фенил-1,2,4-оксадиазол-3-ил)-5-[4(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 46) (70 мг, 0,12 ммоль), 2 М гидроксида натрия (2 мл) и этанола (2 мл) перемешивали при 50 С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток разбавляли водой(10 мл) и подкисляли ледяной уксусной кислотой. Смесь экстрагировали этилацетатом (35 мл) и объединенные органические вещества сушили и выпаривали. Растирание остатка со смесью изогексан/диэтиловый эфир давало указанное в заголовке соединение в виде твердого вещества (63 мг). МС (ES) C29H3435ClN3O7, вычислено 571, найдено 572 [М+Н]+. Получение 51. 4-(9-(5-5-Хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-4-[(1,1 диметилэтил)окси]карбонил-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-ил)бутановая кислота Смесь 1,1-диметилэтил 9-(5-5-хлор-6-[(1-метилэтил)окси]-3-пиридинил-1,2,4-оксадиазол-3-ил)-5[4-(этилокси)-4-оксобутил]-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилата (получение 48) (145 мг,0,24 ммоль), 2 М гидроксида натрия (2 мл) и этанола (2 мл) перемешивали при 50 С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток разбавляли водой (10 мл) и подкисляли ледяной уксусной кислотой. Смесь экстрагировали этилацетатом (35 мл) и объединенные органические вещества сушили и выпаривали. Растирание остатка с изогексаном давало указанное в заголовке соединение в виде твердого вещества (147 мг). МС (ES) C28H3335ClH4O7, вычислено 572, найдено 573 [М+Н]+. Получение 52. 1,1-Диметилэтил 9-циано-5-(2-оксоэтил)-2,3-дигидро-1,4-бензоксазепин-4(5 Н)-карбоксилат Диметилсульфоксид (0,504 г, 6,45 ммоль) в дихлорметане (3 мл) добавляли по каплям к раствору оксалилхлорида (710 мг, 5,59 ммоль) в дихлорметане (40 мл) при -78 С. Через 15 мин на протяжении 5 мин добавляли раствор 1,1-диметилэтил 9-циано-5-(2-гидроксиэтил)-2,3-дигидро-1,4-бензоксазепин 4(5 Н)-карбоксилата (получение 42) (1,37 г, 4,30 ммоль) в дихлорметане (20 мл) и смесь перемешивали на протяжении 1 ч при -78 С, затем добавляли триэтиламин (1,31 г, 12,91 ммоль) и смесь перемешивали в течение дополнительных 5 мин. Смеси давали возможность подогреться до комнатной температуры на
МПК / Метки
МПК: C07D 413/04, C07D 413/14, A61K 31/553, A61P 37/00
Метки: аутоиммунных, лечения, заболеваний, соединения, 1,2,4-оксадиазольные
Код ссылки
<a href="https://eas.patents.su/30-17669-124-oksadiazolnye-soedineniya-dlya-lecheniya-autoimmunnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">1,2,4-оксадиазольные соединения для лечения аутоиммунных заболеваний</a>
Предыдущий патент: Производные 6н-дибензо[b,e]оксепина в качестве нестероидных антагонистов минералокортикоидных рецепторов
Следующий патент: Кристаллические формы диметоксидоцетаксела и способы их получения
Случайный патент: Производные 4-(3-трифторметилпиридин-5-ил)пиперазина, фармацевтическая композиция, способы их получения и применение.












