Новые эритромицины и способы их получения
Номер патента: 1744
Опубликовано: 27.08.2001
Авторы: Пэйси Майкл Стефен, Лидлей Питер Фрэнсис, Кортес Хесус, Стаунтон Джеймс
Формула / Реферат
1. Соединение формулы 1
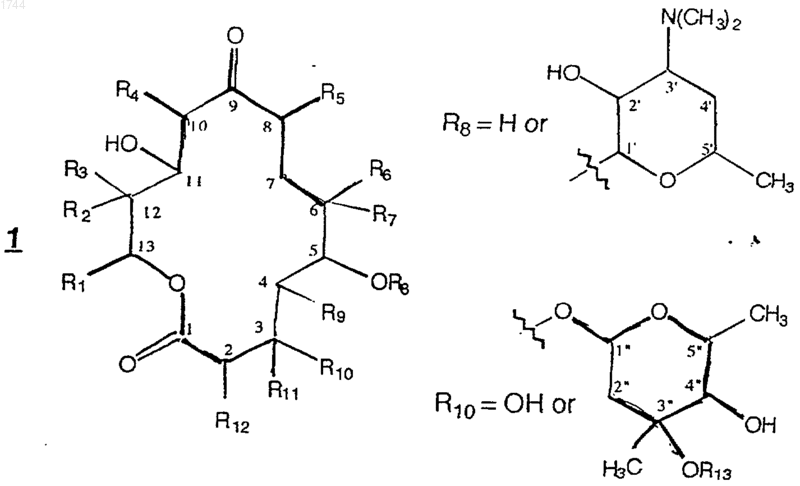
и его фармацевтически приемлемые соли,
где R1 представляет a -разветвленную С3-С8-алкильную, алкенильную, алкинильную, алкоксиалкильную или алкилтиоалкильную группу, каждая из которых может быть необязательно замещена одной или несколькими гидроксильными группами; С5-С8-циклоалкилалкильную группу, где указанная алкильная группа является a -разветвленной С2-С5-алкильной группой; С3-С8-циклоалкильную или С5-С8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой, или одной или несколькими гидроксильными группами, или одной или несколькими С1-С4-алкильными группами или атомами галогена; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным или полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С1-С4-алкильными группами или атомами галогена; или R1 представляет фенил, который может быть необязательно замещен, по крайней мере, одним заместителем, выбранным из С1-С4-алкильной, С1-С4-алкокси- и С1-С4-алкилтио-групп, атомов галогена, гидроксильных групп, трифторметила и циано; или R1 может представлять группу формулы
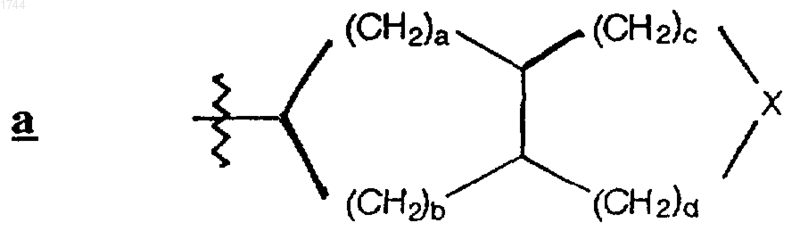
где Х обозначает О, S, или -СН2-, а каждый из а, b, с и d независимо представляет 0-2, и a+b+c+d _ 5;
R2 представляет Н или ОН;
каждый из R3-R5 независимо представляет Н, СН3 или СН2СН3;
R6 представляет Н или ОН; а
R7 представляет Н, СН3 или СН2СН3;
R8 представляет Н или дезозамин;
R9 представляет Н, СН3 или СН2СН3;
R10 представляет ОН, микарозу (R13 = Н) или кладинозу (R13 = СН3);
R11 представляет Н, или R10=R11=0; и
R12 представляет Н, СН3 или СН2СН3;
или любое из определенных выше соединений, модифицированное заменой одной или нескольких групп -СНОН или -CHOR кетогруппой.
2. Соединение формулы

и его фармацевтически приемлемые соли,
где R1 представляет Н, C1-C8-алкильную, С2-С8-алкенильную, C2-C8-алкинильную, алкоксиалкильную или алкилтиоалкильную группу, содержащую 1-6 атомов углерода в каждой алкильной или алкоксигруппе, где каждая из указанных алкильной, алкокси-, алкенильной или алкинильной групп может быть замещена одной или несколькими гидроксильными группами, или одним или несколькими атомами галогена; или С3-С8-циклоалкильную или С5-С8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой, либо одной или несколькими C1-C4-алкильными группами или атомами галогена; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С1-С4-алкильными группами или атомами галогена; или группу формулы SR14, где R14 представляет C1-C8-алкильную, C2-C8-алкенильную, С2-С8-алкинильную, С3-С8-циклоалкильную, C5-C8-циклоалкенильную, фенильную или замещенную фенильную группу, где заместителем является С1-С4-алкил, С1-С4-алкокси или галоген;
или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным, либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С1-С4-алкильными группами или атомами галогена;
R2 представляет Н или ОН;
каждый из R3-R5 независимо представляют Н, СН3, или СН2СН3;
R6 представляет Н или ОН;
R7 представляет Н, СН3 или СН2СН3;
R8 представляет Н или дезозамин;
R9 представляет Н, СН3 или СН2СН3;
R10 представляет ОН, микарозу (R13=Н) или кладинозу (R13=СН3);
R11 представляет Н; или R10=R11=0; и
R12 представляет Н, СН3 или СН2СН3,
при условии, что если R3-R5 представляют СН3, R7 представляет СН3, R9 представляет СН3 и R12 представляет СН3, то R1 не является Н или C1-алкилом, или любое из определенных выше соединений, модифицированное заменой одной или нескольких групп -СНОН или -CHOR кетогруппой.
3. Соединение формулы 1 по п.1, где R1 представляет С3-С6-циклоалкильную или циклоалкенильную группу, которая может быть необязательно замещена одной или несколькими гидроксильными группами или одной или несколькими С1-С4-алкильными группами.
4. Соединение по п.3, где R1 представляет циклопропил.
5. Соединение по п.3, где R1 представляет циклобутил.
6. Соединение по п.3, где R1 представляет циклопентил.
7. Соединение по п.3, где R1 представляет циклогексил.
8. Соединение по п.1, где R1 представляет a -разветвленную С3-С8-алкильную, алкенильную, алкинильную, алкоксиалкильную или алкилтиоалкильную группу.
9. Соединение по п.8, где R1 представляет изопропил.
10. Соединение по п.8, где R1 представляет втор-бутил.
11. Соединение по п.8, где R1 представляет 2-бутен-2-ил, 2-пентен-2-ил, или 4-метил-2-пентен-2-ил.
12 Соединение по п.8, где R1 представляет 1-метилтиоэтил.
13. Соединение по п.1, где R1 представляет 5- или 6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть необязательно замещено одной или несколькими гидроксильными группами, или С1-С4-алкильными группами, или атомами галогена.
14. Соединение по п.13, где R1 представляет 3-тиенил.
15. Соединение по п.13, где R1 представляет 3-фуранил.
16. Соединение по п.1, где R1 представляет фенил.
17. Соединение по п.1, где R1 представляет группу формулы (а), где а и b=0, с и d = 1, a X представляет -CH2-.
18. Соединение по п.1, где R1 представляет группу формулы (а), где а и b=0, с=1, d=2, a X представляет -СН2-.
19. Соединение по п.1, где R1 представляет группу формулы (а), где а и b=0, с и d=1, а Х=0.
20. Соединение по п.2, где R1 представляет SR14, a R14 представляет метил или этил.
21. Соединение по п.2, где R1 представляет этил, пропил, бутил, изопропил или втор-бутил.
22. Соединение по п.2, где R1 представляет 1-(трифторметил)этил.
23. Способ получения соединения формулы 1 по п.1 или формулы 2 по п.2, который включрхт ферментацию микроорганизма, способного продуцировать эритромицин в присутствии карбоновой кислоты формулы R1CO2H, где R1 является таким, как он был определен в п.1 или в п.2, или ее соли, сложного эфира или амида или ее окисленного предшественника и выделения соединения формулы 1 или 2.
24. Способ по п.23, где указанным микроорганизмом является Saccharopolyspora erythraea, который может необязательно содержать эффективно интегрированную плазмиду, способную регулировать биосинтез соединения формулы 1, где указанная плазмида может необязательно содержать промотор/ген-активатор PKS типа II.
25. Способ по п.24, где указанный микроорганизм Saccharopolyspora erythraea выбирают из штаммов NRRL 2338, 18643 или 21484, которые могут необязательно содержать эффективно интегрированную плазмиду, способную регулировать биосинтез соединения формулы 1, где указанная плазмида может необязательно содержать actI-промотор и соответствующий ему ген-активатор actII-orf 4.
26. Способ по п.25, где указанной необязательно интегрированной плазмидой является pAVLD, pIG1, pND30, pCJR26, pCJR49, pc-AT12, pc-ATX или другие аналогичные конструкции.
27. Способ по п.25, где указанным микроорганизмом является S.erythraea ERMD1, S.erythraea NRRL 2338/pIG1, S.erythraea NRRL 2338/pND30 или другие аналогичные трансформанты.
28. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 или 2 в сочетании с фармацевтически приемлемым носителем.
29. Способ лечения бактериальной инфекции или нарушения, связанного с бактериальной инфекцией, или протозойной инфекции у млекопитающего, рыбы или птицы, включающий введение указанному млекопитающему, рыбе или птице терапевтически эффективного количества соединения по п.1 или 2.
30. Использование соединения по п.1 или 2 для получения лекарственного средства для лечения бактериальной инфекции у млекопитающего, рыбы или птицы.
31. Использование соединения по п.1 или 2 для улучшения показателей продуктивности (таких как прирост массы, эффективность усвоения пищи, увеличение удоев и т.п.) у млекопитающего, рыбы или птицы.
Текст
1 Предпосылки создания изобретения Настоящее изобретение относится к новым поликетидам, а также к способам и средствам для их получения; а более конкретно, к новым эритромицинам, которые могут быть использованы в качестве антибактериальных средств,антипротозойных средств и других средств (например, в качестве противораковых средств,средств против атеросклероза и средств, улучшающих двигательную функцию желудка и т.п.) для лечения млекопитающих, включая человека, а также рыб и птиц. Настоящее изобретение также относится к фармацевтическим композициям, содержащим новые соединения, и к способам лечения бактериальных и протозойных инфекций у млекопитающих, рыб и птиц путем введения указанных новых соединений млекопитающим, рыбам и птицам, нуждающимся в таком лечении. Биосинтетические гены поликетидов или их фрагменты, которые могут быть получены от различных кластеров биосинтетических генов поликетидов, были подвергнуты различным превращениям, позволяющим получить новые эритромицины. Поликетиды представляют собой большой и структурно разнообразный класс природных продуктов, который включает многие соединения, обладающие антибиотическими или другими фармакологическими свойствами, такие как эритромицин, тетрациклины, рапамицин, авермектин, полиэфирные ионофоры и FK506. В частности, поликетиды в большом количестве продуцируются стрептомицетами (Streptomyces) и родственными бактериями актиномицетами. Их синтезируют повторной постадийной конденсацией сложных ацилтиоэфиров методом,аналогичным методу биосинтеза жирных кислот. Большое структурное разнообразие, обнаруженное среди природных поликетидов, обусловлено выбором (обычно) ацетата или пропионата в качестве "исходных" или "удлиняющих" звеньев и различной степенью обработки-кетогруппы, наблюдаемой после каждой конденсации. Примерами стадий такой обработки являются восстановление до -гидроксиацила-,восстановление с последующей дегидратацией до 2-еноила- и полное восстановление до насыщенного сложного ацилтиоэфира. Стереохимический выход продукта на этих стадиях обработки является также определенным для каждого цикла наращивания цепи. Биосинтез поликетидов инициируется группой цепь-образующих ферментов, известных как поликетид-синтазы. Для актиномицетов описаны два класса поликетид-синтаз (PKS). Однако новые поликетиды и способы их синтеза, которые являются целью настоящего изобретения, были получены с использованием поликетид-синтаз (PKS) Типа I,которые представлены поликетид-синтазами 2 авермектин и рапамицин (фиг. 1), и которые состоят из различного набора или "модуля" ферментов для каждого цикла наращивания цепи поликетидов (фиг. 2) (Cortes, J. et al., Nature(1992), 115:119-125; Schwecke, Т. et al.,Proc.Natl.Acad.Sci. USA, (1995) 92:7839-7843. Следует отметить, что термин "природный модуль", используемый в настоящем описании,означает набор смежных доменов, начиная от гена , -кетоацилсинтазы ("KS") и кончая следующим геном ацил-переносящего белка("АСР"), и осуществляющих один цикл наращивания поликетидной цепи. Используемый термин "комбинаторный модуль" относится к любой группе смежных доменов (и фрагментов доменов), простирающихся от первой точки в первом природном модуле до второй эквивалентной точки во втором природном модуле. Первая и вторая точки находятся, обычно, в центре доменов, присутствующих во всех модулях, т.е. они представляют собой эквивалентные точки, находящиеся в соответствующих доменах KS, AT (ацилтрансферазы), АСР или в линкерных областях между доменами. На фиг. 2 показана организация генов эритромицин-продуцирующей PKS (известной также как 6-дезоксиэритронолид-В-синтаза,DEBS). Три открытые рамки считывания (ОРС) кодируют полипептиды DEBS. Эти гены организованы в шесть повторяющихся звеньев, называемых модулями. Первая открытая рамка считывания кодирует первый мультифермент или кассету (DEBS1), которая состоит из трех модулей: модуля загрузки (еrу-загрузка) и двух модулей наращивания (модули 1 и 2). Модуль загрузки включает ацил-трансферазу и ацилпереносящий белок. Он может отличаться от модуля, показанного на фиг. 1 WO 93/13663 (см. ниже). Это указывает на то, что ОРС 1 состоит лишь из двух модулей, первый из которых является в действительности как модулем загрузки,так и первым модулем наращивания. Показано, что деления в рамке считывания ДНК, кодирующей часть домена кеторедуктазы модуля 5 в DEBS, приводит к образованию аналогов эритромицина: 5,6-дидезокси-3-микарозил-5-оксоэритронолида В; 5,6-дидезокси-5 оксоэритронолида В; и 5,6-дидезокси-6,6 эпокси-5-оксоэритронолида В (Donadio, S. et al.,Science, (1991) 252:675-679). Аналогичным образом, модификация остатков активного сайта в домене еноилредуктазы модуля 4 в DEBS, проводимая методами генной инженерии путем модификации соответствующейPKSкодирующей ДНК, и ее введение в Saccharopolyspora erythraea приводит к продуцированию 6,7-ангидроэритромицина С (Donadio, S. et al.,Proc. Natl. Acad. Sci. USA, (1993) 90:7119-7123). В международной патентной заявкеWO 93/13663, которая в полном объеме включена 3 сюда в качестве ссылки, описаны дополнительные типы генетической модификации геновDEBS, способных продуцировать модифицированные поликетиды. Однако сообщалось, что многие такие попытки оказались непродуктивнымиAnnu.Rev.Microbiol. (1995) 49:201-238, р. 231). Описана полная ДНК-последовательность генов, происходящих от Streptomyces hygroscopicus, кодирующих модульную PKS типа I,регулирующую биосинтез макроциклического иммуносуппрессорного поликетида рапамицинаUSA, 92:7839-7843) (фиг. 3). Эта ДНКпоследовательность депонирована в банке геновEMBL/Genbank Database под номером допуска Х 86780. Хотя идентифицировано большое количество терапевтически эффективных поликетидов,однако необходимость в получении новых поликетидов, которые обладали бы улучшенными свойствами или абсолютно новой биологической активностью, остается актуальной. Комплексные поликетиды, продуцированные модульной PKS типа I, имеют особенно важное значение, поскольку они включают соединения,которые, как известно, являются эффективными противогельминтными средствами, инсектицидами, иммуносупрессантами, противогрибковыми средствами и/или антибактериальными средствами. Из-за своей сложной структуры эти новые поликетиды не могут быть легко получены обычными методами химического синтеза или методами химической модификации известных поликетидов. Один из аспектов настоящего изобретения основан на том обнаруженном факте, что набор генов PKS типа I кодирует модуль загрузки, за которым следуют модули наращивания. Это имеет особенно важное значение для получения набора гибридных генов PKS, в котором модуль загрузки гетерологичен модулям наращивания, что позволяет продуцировать поликетид, имеющий модифицированное исходное звено. Эта идея была ранее абсолютно неизвестна, поскольку не было выявлено существование модулей загрузки. ВWO 93/13663 описана модификация генов PKS путем инактивации одной функции (т.е. одного фермента) или воздействия на "весь модуль",путем его делеции, включения или его замены. В этом смысле этот загрузочный набор не является модулем. Если модулем загрузки является модуль,который акцептирует множество различных карбоновокислотных звеньев, то этот набор гибридных генов может быть использован для продуцирования множества различных поликетидов. Так, например, в наборе гибридных генов может быть использована нуклеиновая кислота,кодирующая модуль avr-загрузки с еrумодулями-"удлинителями". Модуль загрузки может присоединять неприродные кислотные(Dutton et al., (1991) J.Antibiot., 44:357-365). Кроме того, можно определить специфичность природного модуля загрузки для неприродных исходных звеньев и использовать преимущества ослабленной специфичности модуля загрузки для продуцирования новых поликетидов. Таким образом, другим аспектом настоящего изобретения является неожиданно обнаруженная способность модуля еrу-загрузки включать неприродные карбоновые кислоты и их производные для получения новых эритромицинов в эритромицин-продуцирующих штаммах, содержащих только гены DEBS. Само собой разумеется, что в поликетидный продукт можно также ввести модификации, в частности путем замены модуля наращивания модулем, который дает кетидное звено с другой степенью окисления и/или с другой стереохимической структурой. В основном, предположено, что стереохимия метильных групп в поликетидной цепи определяется ацил-трансферазой, но в действительности она является отличительным признаком других доменов PKS, и, таким образом, она позволяет проводить модификации только путем замены этих доменов отдельно или путем замены модулей. Метил и другие заместители могут быть добавлены или удалены путем замены ацилтрансферазного домена или путем замены всего модуля. Следовательно, для специалистов в этой области также очевидно, что можно комбинировать использование ослабленной субстратной специфичности модуля загрузки эритромицина с заменой модуля наращивания и использование гибридного модуля загрузки с заменой модуля наращивания в качестве механизма, позволяющего продуцировать широкий ряд новых эритромицинов. Таким образом, в настоящем изобретении описано получение новых эритромицинов с использованием нетрансформированных микроорганизмов, а также указанных наборов генов, векторов, содержащих такие наборы генов, и микроорганизмовтрансформантов, которые могут их экспрессировать, с последующим продуцированием новых эритромицинов в трансформированных микроорганизмах. Микроорганизмы-трансформанты могут включать рекомбинантные плазмиды, либо эти плазмиды могут быть интегрированы в их геном. Плазмида, имеющая последовательность int, будет интегрироваться в сайт специфического связывания (atf) хромосомы хозяина. Микроорганизмы-трансформанты могут быть способными к модификации исходных продуктов, например, путем осуществления всех или частичных биосинтетических модификаций, обычно используемых при продуцировании эритромицинов (как показано на фиг. 2 В). Однако могут быть использованы мутантные микроорганизмы, такие, что некоторые из нормальных метаболических реакций будут блоки 5 рованы, например, с продуцированием продуктов без одной или нескольких "природных" гидроксильных групп или сахарных групп, например как описано в работах WO 91/16 334 илиWeber et al., (1985) J.Bacteriol., 164:425-433, которые во всем объеме включены в настоящее описание в качестве ссылки. Альтернативно,могут быть использованы микроорганизмы, в которых некоторые нормальные реакции метаболизма сверхэкспрессированы, что позволит избежать возможных стадий, ограничивающих скорость при продуцировании нужного продукта, как, например, описано в работе WO 97/06266, которая включена в настоящее описание в качестве ссылки. В этом аспекте рассматриваемый способ касается, главным образом, обработки PKSгенных модулей как структурных блоков, которые могут быть использованы для конструирования ферментных систем и, тем самым, новых эритромициновых продуктов нужных типов. Для этого, обычно, эти генные модули вырезают и набор этих модулей группируют с образованием мультимодулей. В этом случае представляется логичным, если участки продуцирования и разрыва междумольных связей находятся в областях соединения модулей. Однако может оказаться предпочтительным делать разрезы и сшивки точно внутри доменов (т.е. в ферменткодирующих областях) вблизи от их концов. ДНК между всеми модульными PKS является высоко сохраненной, и это может оказаться полезным при конструировании гибридов, которые могут быть транскрибированы. Это может быть также полезным для сохранения расположения активных сайтов кодируемых ферментов,что может оказаться крайне важным. Так, например, при продуцировании гибридного гена путем замены модуля еrу-загрузки модулем avrзагрузки еrу-модуль, вместе с небольшим участком следующего за ним домена кетосинтазы(КS), удаляют. Начало домена KS (расположенного от активного центра на значительном расстоянии) является в высокой степени сохранным, а поэтому обеспечивает подходящий сайт сплайсинга в качестве альтернативы для линкерной области, расположенной между доменом загрузки и началом KS-домена. Вырезанный еrу-модуль затем заменяют модулем avrзагрузки. Действительно, при замене модуля загрузки может оказаться предпочтительным заменить не только домены модуля загрузки (обычно ацилтрансферазы (AT) и ацил-переносящего белка (ACP), но также и KS, в начале следующего за ним модуля наращивания. Обычно вырезанный модуль загрузки должен обеспечивать пропионатное исходное звено и его замена приводит к необходимости получения одного или нескольких других исходных звеньев. Однако пропионат может вводиться в KS модуля наращивания из пропионатного пула в клетке 001744 6 хозяине, что будет приводить к разбавлению нужных продуктов. Этого можно избежать,главным образом, путем замены удлиненного модуля загрузки, включающего весь или большую часть KS-домена. (Сайт сплайсинга может находиться в конце гена KS или в начале расположенного за ним гена AT или в линкерной области, соединяющей эти два гена). При замене "модулей" не ограничиваются"природными" модулями. Так, например, "комбинаторный модуль", предназначенный для вырезания и/или замены и/или вставки, может иметь длину от соответствующего домена двух природных модулей, например от AT одного модуля до AT следующего модуля, или от KS доKS. Сайты сплайсинга будут находиться в соответствующих сохранившихся концевых областях или в линкерных областях. Комбинаторный модуль может быть также "двойным" или более крупным мультимодулем, что обеспечивает добавление 2 или более модулей одновременно. В другом своем аспекте настоящее изобретение относится к новым эритромицинам, полученным способами, изложенными выше. Такими эритромицинами являются следующие соединения:(i) Аналог эритромицина (являющийся макролидным соединением с 14-членным кольцом), в котором С-13 имеет боковую цепь, не являющуюся этилом, а, в основном, прямую С 3 С 6-алкильную группу, разветвленную С 3-С 8 алкильную группу, С 3-С 8-циклоалкильную или циклоалкенильную группу (необязательно замещенную, например, одной или несколькими гидроксигруппами, С 1-С 4-алкильными или алкоксигруппами или атомами галогена), или 3-6 членный гетероцикл, содержащий О или S, насыщенный, либо полностью или частично ненасыщенный, и необязательно замещенный (как для циклоалкила), или R1 представляет фенил,который может быть необязательно замещен, по крайней мере, одним заместителем, выбранным из С 1-С 4-алкильной, С 1-С 4-алкокси- и С 1-С 4 алкилтиогрупп, атомов галогена, трифторметила и циано; или R1 может быть группой формулы где Х представляет О, S или -СН 2-, каждый из a,b, с и d независимо представляют 0-2 и a+b+c+d5. Предпочтительными кандидатами на С-13 заместитель R являются группы карбоксилатных звеньев RCOOR', используемых в качестве субстратов для исходного avr-модуля или исходных вариантов рапамицина. Предпочтительными субстратами являются карбоновые кислоты RCOOH. Альтернативными субстратами,которые могут быть эффективно использованы,являются соли карбоновых кислот, сложные эфиры карбоновых кислот или амиды. Предпоч 7 тительными сложными эфирами являются тиоэфиры N-ацетилцистамина, которые могут быть легко использованы в качестве субстратов для исходного avr-модуля, как было проиллюстрировано в работе Dutton et al. в ЕР 0350187, которая в полном объеме включена в настоящее описание в качестве ссылки. Предпочтительными амидами являются N-ацилимидазолы. Другими альтернативными субстратами, которые могут быть использованы, являются производные, которые представляют собой окисленные предшественники карбоновых кислот, например подходящими субстратами являются аминокислоты формулы RCH(NH2)COOH, глиоксиловые кислоты формулы RCOCOOH, метиламиновые производные формулы RCH2NH2, производные метанола формулы RCH2OH, альдегиды формулы RCHO или замещенные алкановые кислоты формулы R(CH2)n-COOH, где n = 2, 4 или 6. Таким образом, примерами предпочтительных субстратов являются изобутират (R=изо-Рr) и 2 метилбутират (R=1-метилпропил). Другими возможными вариантами этих соединений являются н-бутират, циклопропилкарбоксилат,циклобутилкарбоксилат, циклопентилкарбоксилат, циклогексилкарбоксилат, циклогептанилкарбоксилат, циклогексенилкарбоксилаты, циклогептенилкарбоксилаты и метилированные в кольце производные циклических карбоксилатов и их вышеупомянутые производные. Аналог эритромицина может соответствовать исходному продукту PKS (6-дезоксиэритронолиду) или продукту, полученному после одной или нескольких стандартных стадий биосинтеза. Эти стадии, как показано на фиг. 2b,включают 6-гидроксилирование, 3-O-гликозилирование, 5-O-гликозилирование, 12-гидроксилирование и специфическое метилирование сахара. Таким образом, аналоги могут включать соединения, которые соответствуют 6-дезоксиэритронолиду В, эритромицину А и различные промежуточные соединения и альтернативные соединения (но не ограничиваются ими), показанные на фиг. 2b.(ii) Аналоги эритромицина, отличающиеся от соответствующего "природного" соединения(фиг. 2b) степенью окисления одной или нескольких кетидных единиц (т.е. альтернативно выбранных из группы, включающей -СО-,-СН(ОН)-, =СН- и -СН 2-). Стереохимию любого -СН(ОН)- также выбирают независимо.(iii) Аналоги эритромицина, отличающиеся от соответствующего "природного" соединения отсутствием "природной" метильной боковой цепи. (Это может быть достигнуто с использованием варианта AT). В нормальных модулях наращивания используются либо С 2 или С 3 единицы для получения неметилированных и метилированных кетидных единиц. Могут быть получены неметилированные единицы, где ме 001744 8 тилированные единицы являются природными(и наоборот, могут быть получены метилированные единицы в системах, где имеются природные неметилированные единицы), а также более крупные единицы, например С 4, для получения этиловых заместителей.(iv) Аналоги эритромицина, отличающиеся от соответствующего "природного" соединения стереохимией "природного" метила; и/или кольцевых заместителей, не являющихся метилом.(v) Аналоги эритромицина, имеющие отличительные признаки одного или более пунктов (i)-(iv).(vi) Производные любого из вышеуказанных соединений, которые подвергаются последующей обработке ферментами, не являющимися PKS, например одной или несколькими из таких обработок, как гидроксилирование, эпоксидирование, гликозилирование и метилирование. Далее описаны способы получения новых эритромицинов настоящего изобретения. В наиболее простом способе неприродные исходные звенья (предпочтительно, но не ограничиваясь ими, карбоновокислотные аналоги неприродных исходных звеньев) вводят в нетрансформированные микроорганизмы, способные продуцировать эритромицины. Предпочтительный способ предусматривает введение исходного звена в бульон для ферментации, содержащий эритромицин-продуцирующий микроорганизм, причем указанный способ является более эффективным для трансформированных микроорганизмов, способных к продуцированию эритромицинов. Однако аналог исходного звена может быть также введен в альтернативные препараты эритромицин-продуцирующих микроорганизмов, например в препараты фракционированных или нефракционированных разрушенных клеток. И в этом случае этот способ является в равной мере эффективным для трансформированных микроорганизмов, продуцирующих эритромицины. В другом способе один или несколько сегментов ДНК, кодирующей отдельные модули или домены в гетерологичной PKS типа I("донорной" PKS), были использованы для замены ДНК, кодирующей, соответственно, отдельные модули или домены в генах DEBS эритромицин-продуцирующих микроорганизмов. Подходящими для этой "донорной" PKS являются модули загрузки и модули наращивания, взятые из любой природной или синтетической PKS типа I, a особенно подходящими для этих целей являются компоненты PKS типа I для биосинтеза эритромицина, рапамицина,авермектина, тетроназина, олеандомицина, монензина, амфотерицина и рифамицина, для которых организация гена и модуля, по крайней мере частично, известны на основании анализа последовательности генов. Особенно предпочтительными примерами модулей загрузки до 9 норной PKS являются модули загрузки, обладающие ослабленной специфичностью, например модуль загрузки авермектин(avr)-продуцирующей PKS Streptomyces avermitilis, или модули загрузки, обладающие необычной специфичностью, например модули загрузки рапамицин-,FK506- и аскомицин-продуцирующих PKS, все из которых обычно акцептируют исходное звено, происходящее от шикимата. Неожиданно было обнаружено, что как нетрансформированные, так и генетически сконструированные эритромицин-продуцирующие микроорганизмы,культивированные в подходящих условиях,продуцируют неприродные эритромицины, и эти продукты могут быть подвергнуты, если это необходимо, той же самой обработке, что и природный эритромицин. В другом аспекте настоящего изобретения плазмиду, содержащую ДНК "донорной" PKS,встраивают посредством гомологичной рекомбинации в клетку-хозяина в условиях, при которых плазмида интегрирует в гены DEBS на хромосоме эритромицин-продуцирующего штамма с образованием гибридной PKS. В предпочтительном варианте осуществления настоящего изобретения ДНК "донорной" PKS включает сегмент, кодирующий модуль загрузки так, чтобы этот модуль загрузки становился связанным с генами DEBS на хромосоме. Такая гибриднаяPKS при культивировании в подходящих условиях, описанных в настоящей заявке, продуцирует новые и ценные эритромициновые продукты. В частности, при замене модуля загрузки генов DEBS модулем загрузки авермектин(avr)продуцирующей PKS, новые эритромициновые продукты содержат исходное звено, типичное для тех звеньев, которые используются avr-PKS. Таким образом, при замене модуля загрузки eryPKS модулем avr-загрузки было обнаружено,что штаммы Saccharopolyspora erythrаеа, содержащие такую гибридную PKS, продуцируют 14 членные макролиды, содержащие исходные звенья, обычно используемые avr-PKS. Неожиданно было обнаружено, что 14 членные макролидные поликетиды, продуцируемые такими рекомбинантными клетками S.erythraea, включают производные эритромицина А, что указывает на то, что несколько стадий обработки, необходимых для трансформации продуктов гибридной PKS с получением новых и терапевтически ценных производных эритромицина А, были правильно осуществлены. В еще одном аспекте настоящего изобретения было неожиданно обнаружено, что транскрипция любого из гибридных генов эритромицина может быть специфически усилена в том случае,если эти гибридные гены поместить под контроль промотора гена PKS Типа II, присоединенного к специфическому гену-активатору для этого промотора. Особенно примечательным является тот факт, что, если генетически сконструированную клетку, содержащую гибридные 10 гены эритромицина, помещенные под такой контроль, культивировать в условиях, подходящих для продуцирования эритромицина, то уровень продуцирования нового эритромицина значительно увеличивается. Такое специфическое увеличение выхода ценного эритромицинового продукта также наблюдалось для природной эритромицин-продуцирующей PKS, ген которой был помещен под контроль промотора и генаактиватора PKS типа II. В предпочтительном варианте осуществления изобретения нужные гены, присутствующие на SСР 2-производной плазмиде, помещены под контроль разнонаправленного actI-промотора, производного от биосинтетического кластера генов актинородина Streptomyces coelicolor, причем в указанном варианте вектор также содержит структурный ген, кодирующий специфический белокактиватор ActII-orf 4. Рекомбинантную плазмиду вводят в Saccharopolyspora erythraea в условиях, при которых либо встроенные гены PKS,либо гены pSK, уже присутствующие в штаммехозяине, экспрессируются под контролем actIпромотора. Такие штаммы продуцируют нужный эритромициновый продукт, а ген-активатор требует только присутствия специфического промотора для усиления эффективности транскрипции, обеспечиваемой промотором. Особенно является неожиданным, что активаторы семейства ActII-orf 4 не принадлежат к известному классу ДНК-связывающих белков. Поэтому следует ожидать, что для того, чтобы активация происходила в гетерологичном хозяине, который, как известно, не продуцирует актинородин или родственный изохроманхиноновый пигмент, должны потребоваться вспомогательные белки или другие контролирующие элементы. Неожиданным и важным фактором является также то, что эти рекомбинантные штаммы могут продуцировать более чем в 10 раз большее количество эритромицинового продукта, чем при тех же самых генах PKS под контролем природного промотора, и, кроме того, эритромициновый продукт очень быстро продуцируется в растущей культуре, а не только в процессе перехода этой культуры из фазы роста в стационарную фазу. Такие эритромицины могут быть использованы как антибиотики, а также для многих других целей в медицине и ветеринарии. Таким образом, если генетически сконструированной клеткой является Saccharopolysporaerythraea и если активатор и промотор происходят от кластера генов актинородин-продуцирующейactI/actII-orf4 регулируемых генов ery-PKS находится в хромосоме после сайт-специфической интеграции низкокопийного плазмидного вектора, то культивирование этих клеток в подходящих условиях может обеспечивать продуцирование 14 членного макролидного продукта, которое более чем 10 раз превышает продуцирование этого 11 продукта в таком же штамме, но не находящемся под таким гетерологичным контролем. Если в такой генетически сконструированной клеткеS.erythraea гены PKS, находящиеся под гетерологичным контролем, являются гибридными генами PKS типа II, конструирование которых описано в настоящей заявке, то эта клетка может продуцировать более чем в 10 раз большее количество гибридного поликетидного продукта, чем то, которое может быть получено от тех же самых гибридных генов PKS типа I, но не находящихся под таким контролем. Более конкретно, если гибридными генами PKS типа I являются гены PKS, в которых модуль загрузки заменен модулем avг-загрузки, то наблюдается 10-кратное увеличение общего количества новых 14-членных макролидов, продуцируемых генетически сконструированными клетками,культивированными в подходящих условиях,описанных в настоящей заявке. Подходящие и предпочтительные способы культивирования нетрансформированных и генетически сконструированных эритромицинпродуцирующих клеток и подходящие и предпочтительные способы выделения, идентификации, и практического использования новых эритромицинов более подробно описаны в примерах. Краткое описание изобретения Настоящее изобретение относится к соединениям формулы 1 и к их фармацевтически приемлемым солям,где R1 представляет -разветвленную С 3-С 8 алкильную, алкенильную, алкинильную, алкоксиалкильную или алкилтиоалкильную группу,каждая из которых может быть необязательно замещена одной или несколькими гидроксильными группами; С 5-С 8-циклоалкилалкильную группу, где указанная алкильная группа является -разветвленной С 2-С 5-алкильной группой; С 3-С 8-циклоалкильную или С 5-С 8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой,либо одной или несколькими гидроксильными группами, либо одной или несколькими C1-С 4 алкильными группами или атомами галогена: или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным, либо полностью или частично ненасыщенным и которое может быть необяза 001744 12 тельно замещено одной или несколькими С 1-С 4 алкильными группами или атомами галогена; либо R1 представляет фенил, который может быть необязательно замещен, по крайней мере,одним заместителем, выбранным из С 1-С 4-алкильной, С 1-С 4-алкокси- и C1-C4-алкилтиогрупп,атомов галогена, трифторметила, и циано; либоR1 может представлять группу формулыR12 представляет Н, СН 3, или СН 2 СН 3. В вышеуказанных определениях алкильные группы, содержащие 3 или более атомов углерода, могут иметь прямую или разветвленную цепь. Термин "галоген" означает фтор,хлор, бром или иод. Термин "альфаразветвленный" означает, что атом углерода,присоединенный в положении C-13, является вторичным атомом углерода, связанным с двумя другими атомами углерода, а остальная часть алкильной группы может иметь прямую или разветвленную цепь. Предпочтительными соединениями формулы 1 являются соединения, в которых R3-R5,R7, R9 и R12 представляют СН 3, a R1 представляет изопропил или втор-бутил, 2-бутен-2-ил, 2 пентен-2-ил или 4-метил-2-пентен-2-ил, необязательно замещенный одной или несколькими гидроксильными группами. Предпочтительными также являются соединения формулы 1, в которых R3-R5, R7, R9 и R12 представляют СН 3, аR1 представляет С 3-С 6-циклоалкил или циклоалкенил, который может быть необязательно замещен одной или несколькими гидроксильными группами или одной или несколькими C1-C4 алкильными группами. В другой группе предпочтительных соединений R1 представляет 5 или 6-членное кислород- или серосодержащее гетероциклическое кольцо, а в частности 3 тиениловое или 3-фуриловое кольцо, которое может быть необязательно замещено одной или несколькими гидроксильными группами, либо одной или несколькими С 1-С 4-алкильными группами или атомами галогена. В другой предпочтительной группе соединений R1 представляет С 3-С 8-алкилтиоалкильную группу, в частности, 1-метилтиоэтильную группу. 13 В другом конкретном варианте настоящее изобретение относится к соединениям формулы и к их фармацевтически приемлемым солям,где R1 представляет Н, С 1-С 8-алкильную. С 2-С 8 алкенильную, C2-C8-алкинильную, алкоксиалкильную или алкилтиоалкильную группу, содержащую 1-6 атомов углерода в каждой алкильной или алкоксигруппе, где каждая из указанных алкильной, алкокси-, алкенильной или алкинильной групп может быть замещена одной или несколькими гидроксильными группами,либо одним или несколькими атомами галогена; или С 3-С 8-циклоалкильную или С 5-С 8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой, либо одной или несколькими C1-C4 алкильными группами или атомами галогена; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным, либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С 1-С 4 алкильными группами или атомами галогена; либо группу формулы SR14, где R14 представляет C1-C8-алкильную, С 2-С 8-алкенильную, С 2-С 8 алкинильную, С 3-С 8-циклоалкильную, С 5-С 8 циклоалкенильную, фенильную или замещенную фенильную группу, где заместителем является С 1-С 4-алкил, C1-С 4-алкокси или галоген; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным, либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими C1-C4 алкильными группами или атомами галогена. 14 В вышеприведенных определениях алкильные группы, содержащие 3 или более атомов углерода, могут иметь прямую или разветвленную цепь. "Галоген" означает фтор, хлор,бром или иод. Предпочтительными соединениями формулы 2 являются соединения, в которых R3-R5 представляют СН 3, R7 представляет СН 3, R9 представляет СН 3, R12 представляет СН 3, а R1 представляет SR14, где R14 представляет метил или этил. В другой группе предпочтительных соединений R1 представляет метил, изопропил или втор-бутил, который может быть замещен одной или несколькими гидроксильными группами. В еще одной группе предпочтительных соединений R1 представляет разветвленную С 3 С 8-алкильную группу, замещенную одной или несколькими гидроксильными группами, либо одним или несколькими атомами галогена, в частности, 1-(трифторметил)-этил. Настоящее изобретение также относится к фармацевтической композиции для лечения бактериальных инфекций или протозойных инфекций у млекопитающих, рыб или птиц, где указанная композиция содержит терапевтически эффективное количество соединения формулы 1 или 2, его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Настоящее изобретение также относится к способу лечения бактериальных инфекций или протозойных инфекций у млекопитающих, рыб или птиц путем введения указанному млекопитающему, рыбе или птице терапевтически эффективного количества соединения формулы 1 или формулы 2, или его фармацевтически приемлемой соли. Если это не оговорено особо, то используемый в настоящем описании термин "лечение" означает лечение или предупреждение бактериальной инфекции или протозойной инфекции с использованием способов настоящего изобретения. Если это не оговорено особо, то используемые в настоящем описании термины "бактериальная инфекция" и "протозойная инфекция" означают бактериальные и протозойные инфекции, которые поражают млекопитающих, рыб и птиц, а также нарушения, связанные с бактериальными и протозойными инфекциями, которые могут излечиваться или предупреждаться посредством введения антибиотиков, таких как соединения настоящего изобретения. Такими бактериальными и протозойными инфекциями,а также нарушениями, связанными с указанными инфекциями, являются следующие: пневмония, отит среднего уха, синусит, бронхит, тонзилит и мастоидит, связанные с инфекциями,вызываемыми Streptococcuspneumoniae, Haemophiius influenzae, Moraxella catarrhalis,Staphylococcus aureus или PeptostreptococcusActinobacillus haemolyticum; респираторные инфекции дыхательных путей, вызываемые инфекциями Mycoplasma pneumoniae, Legionellapneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; неосложненные инфекции кожи и мягких тканей,абцессы и остеомиелиты и послеродовая лихорадка, связанная с инфекцией, вызываемойspp. или Bartonella henselae; неосложненные острые инфекции мочеполовых путей, связанные с инфекциями, вызываемыми Staphylococcus saprophyticus или Enterococcus spp, уретрит и цервицит; и заболевания, передаваемые половым путем и связанные с инфекциями, вызываемыми Chlamidia trachomatis, Haemophilusducreyi, Treponema pallidum, Ureaplasma urealyticum или Neisseria gonorrheae, токсикозы, связанные с инфекцией, вызываемой S.aureus (пищевое отравление и синдром токсического шока) или стрептококками групп А, В и С; язвы,вызываемые инфицированием Helicobacter pylori; синдромы системной лихорадки, вызываемые инфицированием Borrelia recurrentis, болезнь Лайма, вызываемая инфицированием Borrelia burgdorferi; конъюктивит, кератит и дакроцистит, связанные с инфицированием Chlamidiaperfringens или Bacteroides spp.; и атеросклероз,связанный с инфицированием Helicobacter pylori или Chlamidia pneumoniae. Бактериальными и протозойными инфекциями, а также нарушениями, вызываемыми у животных такими инфекциями, которые могут подвергаться лечению или предупреждению, являются респираторное заболевание у коров, связанное с инфицированием Р.hаеm., P.multocida, Mycoplasma bovis илиBor-detella spp; кишечное заболевание у коров,связанное с инфицированием Е.соli или инвазией простейших (т.е. кокцидий, криптоспоридий и т.п.), мастит у молочных коров, связанный с инфицированиемbovis; преждевременные роды у коров, связанные с инвазией простейшими (т.е. неоспорами); инфекции мочеполовых путей у собак и кошек,связанные с инфицированием Е.Coli, инфекции мягких тканей и кожи у собак и кошек, связанные с инфицированием Staph.epidermidis.,Staph.intermedis coaqulase neg. Staph. илиP.multocida, и зубные инфекции и инфекции ротовой полости у собак и кошек, вызванные инфицированием Alcaligenes spp., BacteroidesPrevotella. Другими бактериальными или протозойными инфекциями, а также нарушениями,связанными с такими инфекциями и поддающимися лечению и предупреждению способом настоящего изобретения, являются инфекции и нарушения, перечисленные в работе J.P. Sanfordet al., "The Sanford Guide To Antimicrobial Therapy" 26th Edition (Antimicrobial Therapy, Inc.,1996). Соединения настоящего изобретения могут также оказаться полезными для лечения заболеваний (например, рак, СПИД и атеросклероз), которые обычно не связаны с бактериальными или протозойными инфекциями. При использовании для лечения бактериальных инфекций или нарушений, связанных с бактериальной инфекцией или раком у млекопитающих, таких как человек, или у рыб или птиц, соединения формулы 1 или формулы 2 могут быть введены отдельно или в форме фармацевтической композиции, содержащей соединение и фармацевтически приемлемый разбавитель или носитель. Такие композиции могут быть введены перорально, например, в виде таблеток или капсул, или парентерально, например путем подкожных или внутримышечных инъекций. Соединения формулы 1 или формулы 2 могут быть также введены ректально в форме суппозиториев. Выбор фармацевтически приемлемого носителя зависит от способа введения. Так, например, лактоза, цитрат натрия и соли фосфорной кислоты вместе с дезинтегрирующими агентами (такими как крахмал) и смазывающими агентами (такими как стеарат магния, лаурилсульфат натрия и тальк) могут быть использованы в качестве фармацевтически приемлемого носителя в таблетках. Для исполь 17 зования в капсулах подходящими фармацевтически приемлемыми носителями являются лактоза и высокомолекулярные полиэтиленгликоли (например имеющие молекулярную массу от 2000 до 4000). Для парентерального введения могут быть получены стерильные растворы или суспензии, в которых фармацевтически приемлемый носитель является водным (например, вода, изотонический физиологический раствор или изотоническая декстроза) или безводным (например, жирные масла растительного происхождения, такие как масло из семян хлопчатника или арахисовое масло; масла полиолов, такие как глицерин или пропиленгликоль). При использовании in vivo для лечения бактериальной инфекции или состояний, связанных с бактериальными инфекциями у млекопитающих, или для лечения различных видов рака у человека (в частности, немелкоклеточного рака легких) и у других млекопитающих, таких как собаки, путем перорального или парентерального введения лекарственного средства,обычная доза этого лекарственного средства может варьироваться от 0,1 до 100 мг/кг массы тела, а в частности 0,5-25 мг/кг массы тела, и может быть введена в виде одной дозы или в виде раздельных доз. Если это не оговорено особо, используемое в настоящем описании понятие "фармацевтически приемлемые соли" означает соли кислотных или основных групп, которые могут присутствовать в соединениях настоящего изобретения. Соединения настоящего изобретения,которые по своей природе являются основными,способны образовывать широкий ряд солей с различными неорганическими или органическими кислотами. Кислотами, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, являются кислоты,которые образуют нетоксические кислотноаддитивные соли, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат,сульфат, бисульфат, фосфат, кислый фосфат,изоникотинат, ацетат, лактат, салицилат, цитрат,кислый цитрат, тартрат, пантотенат, битартрат,аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формат,бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3 нафтоат)]. Соединения настоящего изобретения, которые по своей природе являются кислотными,способны образовывать основные соли с различными фармакологически приемлемыми катионами. Примерами таких солей являются соли щелочных металлов или щелочно-земельных металлов, а в частности кальциевые, магниевые, 001744 18 натриевые и калиевые соли соединений настоящего изобретения. Некоторые соединения настоящего изобретения могут иметь асимметрические центры,а поэтому они могут существовать в виде различных энантиомерных и диастереомерных форм. Настоящее изобретение относится к использованию оптических изомеров и стереоизомеров соединений настоящего изобретения и их смесей, а также ко всем фармацевтическим композициям и способам лечения, в которых могут быть использованы эти оптические изомеры или стереоизомеры. Настоящее изобретение относится к соединениям, описанным в настоящей заявке, и к их фармацевтически приемлемым солям, где один или несколько атомов водорода, углерода и других атомов заменены их изотопами. Такие соединения могут быть использованы в экспериментах и в качестве диагностических средств при фармокинетических исследованиях метаболизма и в анализах на связывание. Соединения настоящего изобретения получают ферментацией нетрансформированных или трансформированных микроорганизмов,способных продуцировать эритромицины,включая, но не ограничиваясь ими, такие виды,как Saccharopolyspora sp., Streptomyces griseoplanus, Norcardia sр., Micromonospora sp., Arthobacter sp. и Streptomyces antibioticus, но за исключением S.coelicolor. Особенно подходящими для этих целей являются нетрансформированные и трансформированные штаммы Saccharopolyspora erythraea, например NRRL 2338,18643, 21484. Особенно предпочтительными трансформированными штаммами являются штаммы, в которых модуль загрузки эритромицина был заменен модулем загрузки, происходящим от продуцента авермектина, Streptomycesavermitillis или от продуцента рапамицина,Streptomyces hygroscopicus. Предпочтительный способ продуцирования соединений настоящего изобретения предусматривает ферментацию соответствующего микроорганизма в присутствии соответствующей карбоновой кислоты формулы R1COOH, где R1 является таким, как был ранее определен в формулах 1 или 2, или ее соли, сложного эфира (особенно предпочтительно сложного тиоэфира N-ацетилцистамина) или амида, или их окисленных предшественников. Кислоту или ее производное добавляют в ферментер во время инокуляции, либо через определенные интервалы времени в процессе ферментации. Контроль за продуцированием соединений настоящего изобретения может быть осуществлен путем отбора образцов из ферментера, экстракции органическим растворителем и последующей идентификации соединений настоящего изобретения с помощью хроматографии, например жидкостной хроматографии высокого давления. При этом инкубирование продолжают до тех пор, пока выход со 19 единения формулы 1 или 2 не будет максимальным, обычно в течение 4-10 дней. Предпочтительное количество карбоновой кислоты или ее производного при каждом добавлении составляет от 0,05 до 4,0 г/л. Наилучшие выходы соединений формулы 1 или 2 обычно получают путем постепенного добавления кислоты или ее производного в смесь для ферментации, например путем ежедневного добавления в течение нескольких дней. Средой, используемой для ферментации, может быть стандартная комплексная среда, содержащая усвояемые источники углерода, азота и микроэлементов. Подходящие и предпочтительные способы культивирования нетрансформированных и генетически сконструированных эритромицинпродуцирующих клеток, а также подходящие и предпочтительные способы выделения, идентификации и практического применения соединений формулы 1 или 2 более подробно описаны в примерах. Краткое описание чертежей Некоторые варианты осуществления настоящего изобретения описаны со ссылками на прилагаемые к настоящему изобретению чертежи, где на фиг. 1 представлены химические формулы трех известных поликетидов; на фиг. 2 а представлена диаграмма, иллюстрирующая действие 6-дезоксиэритронолидсинтазы В (DEBS); PKS, продуцирующей 6 дезоксиэритронолид В (6-DEB), предшественник эритромицина А; на фиг. 2b показан пост-PKS-биосинтез эритромицинов, включающий превращение 6DEB в эритромицин А; на фиг. 3 а и 3b представлены диаграммы,иллюстрирующие конструирование плазмидыpIG1; на фиг. 4 а, 4b и 4 с представлены диаграммы, иллюстрирующие конструирование плазмиды pNDSO; на фиг. 5 представлена диаграмма, иллюстрирующая конструирование плазмидыpAVLD; на фиг. 6 проиллюстрирована интеграция плазмиды pAVLD в геном S.erythraeaNRRL2338; на фиг. 7 представлена диаграмма, иллюстрирующая биосинтез рапамицина; на фиг. 8 представлена диаграмма, иллюстрирующая конструирование плазмиды рМО 6; на фиг. 9 представлена диаграмма, иллюстрирующая конструирование плазмидыpCJR26; на фиг. 10 представлена диаграмма, иллюстрирующая конструирование плазмиды рСАТХ; на фиг. 11 представлена диаграмма, иллюстрирующая конструирование плазмиды рСАТ 12;pCJR49. Подробное описание изобретения Широкий ряд исходных звеньев, обычно используемых в модуле загрузки avr, был исчерпывающе определен в предшествующих исследованиях (например, в Европейских патентных заявках 0214731, 0350187, 0317148, которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Поэтому необходимо отметить, что настоящее изобретение не ограничивается конкретными деталями представленных примеров, которые просто служат для подтверждения эффективности модуля avrзагрузки. Кроме того, примеры использования конструкций pIG1 или pND30 ясно указывают на способность actI-промотора и его соответствующего гена-активатора actII-orf 4 усиливать экспрессию новых соединений настоящего изобретения при соединении с модулем avrзагрузки. Из этих примеров также очевидно, что нетрансформированные штаммыSaccharopolyspora erythraea также способны легко включать экзогенно введенные субстраты с образованием новых эритромициновых поликетидов. Следовательно, для каждого специалиста также очевидно, что конкретные новые соединения настоящего изобретения могут быть легко получены путем отбора соответствующего эритромицин-продуцирующего штамма (необязательно с включением в нужный штамм плазмиды pIGl или pND30) и добавления в среду ферментации соответствующего исходного звена. Таким образом, 6-дезоксиэритромициновые и 6,12-дидезоксиэритромициновые производные настоящего изобретения могут быть легко получены с использованием Saccharopolysporaerythraea NRRL 18643 или NRRL 21484, как указано в патенте США 5141926 и WO 97/06266. Аналогичным образом штаммы Saccharopolyspora erythraea, описанные Weber et al., вJ.Bacteriol., 164:425-433, 1991, могут быть также легко использованы для получения нужных новых аналогов настоящего изобретения. Так, например, штамм UW24 (необязательно трансформированный плазмидами pIGl или pND30) может быть использован для получения новых аналогов эритронолида В. УФ-спектры были получены с использованием диодно-матричного спектрофотометраHewlett-Packard 1090M. Все ЯМР-спектры, если это не оговорено особо, были получены в CDCl3 на спектрометре Varian Unity 500 МГц, а положения пиков выражены в миллионных долях(мл.д.), где в качестве стандарта был использован тетраметилсилан. Сдвиги пиков обозначены следующим образом: c(s) - синглет; д(d) - дублет; т(t) - триплет; кв.(q) - квартет; м(m) - мультиплет; шир.(br) - широкий. Число атомов, указанных в ЯМР-структурах, не является репрезентативным для стандартной номенклатуры, ноHewlett-Packard 1090 М, подсоединенного к масс-спектрометру VG Platform II, снабженному источником АПХИ (метод А) или с использованием жидкостного хроматографа HewlettPackard 1050, подсоединенного к массспектрометру VG Platform II, снабженному источником АПХИ (метод В и метод С). ЖХВД-метод А: КолонкаMetaChem Intersil (Интерсил): 5 мкм С 8 3 мм 150 мм Поток 0,5 мл/мин Подвижная фаза Изократный раствор: метанол:0,05 М ацетат аммония с 0,1% трифторуксусной кислотой (60:40) ЖХВД-метод С: Колонка Были использованы следующие среды и растворы: Сахарозо-сукцинатная среда: Сахароза 69 г 10 г КNО 3 Янтарная кислота 2,36 г 2,7 г КН 2 РO4 1,2 г МgSO47 Н 2O 10 мгCaCl22 H2O Вода milli-Q до 1,0 л КОН рН до 6-6,4 Среда с водопроводной водой Глюкоза 5 г Триптон 5 г Дрожжевой экстракт 2,5 гEDTA 36 мг Водопроводная вода до 1,0 л КОН до рН 7,1 Среда ERY-P Декстроза 50 г/л Мука Nutrisoy 30 г/л 3 г/лNaCl 5 г/л 6 г/л СаСО 3 Доведение рН до 7,0 Мука Nutrisoy поставляется фирмой British 22 Настоящее изобретение иллюстрируется следующими примерами. Пример 1 а. Конструирование плазмидыpIG1. Плазмида pIG1 состоит из SCP2 производной плазмиды, содержащей гибридный ген PKS Типа I, включающий вместо модуля еrу-загрузки модуль avr-загрузки, первые два модуля наращивания ery-PKS и тиоэстеразы eryPKS. Эту плазмиду конструировали через несколько промежуточных плазмид следующим образом (фиг. 3).(i) Конструирование плазмиды рVЕ 3.4. Плазмиду pVE1446, которая содержала часть генов авермектин(аvг)-продуцирующейPKS, получали из штамма E.coli ATCC 68250(MacNeil, D.J. et al., Ann.N.Y.Acad.Sci. (1994) 721:123-132). Плазмиду pVE1446 гидролизовали ферментом BamHI и 7,6 т.п.о.-фрагмент между координатами 32,15 и 3,40 (MacNeil, D.J. et al.,Ann.N.Y.Acad.Sci. (1994) 721:123-132) очищали с помощью гель-электрофореза и снова восстанавливали в кольцевую структуру. Смесь содержала нужную плазмиду pVE3,4, которая была выделена после трансформации штамма TG1(ii) Конструирование плазмиды pNC012. Плазмиду pBK25 (Bevitt, D.J. et al.,Eur.J.Biochem. (1992) 204:39-49) гидролизовали ферментом NcoI и 12 т.п.о.-фрагмент восстанавливали по концам и лигировали в плазмидуpUC18, которая была линеаризована ферментомSmaI. Лигированную смесь трансформировали в штамм TG1 гес 0 Е.соli, и отдельные колонии тестировали на содержание плазмиды. Нужную плазмиду pNC012 идентифицировали по ее рестрикционной карте.(iii) Конструирование плазмиды pCRabc. Плазмиду pCRabc (фиг. 3) конструировали следующим образом. Проводили три отдельные реакции PCR: в первой реакции 20 пмоль каждого из синтетических олигонуклеотидов A1 (5'CTC GTC GGT GGC ТТТ GCG-3') и А 2 (5'-СССGGA CGG CCG-3') использовали для амплификации 1,0 т.п.о.-продукта из 100 нг pNC012 матрицы. PCR-продукт восстанавливали по концам, фосфорилировали и клонировали вSmaI -разрезанную плазмиду pUC18 с получением плазмиды pCRa. Во второй реакции 20 пмоль каждого из синтетических олигонуклеотидов С 1 (5'-САС GCG CAG CGC GGC GGA-3') и С 2 (5'-С GAA CCG СТА GCG GTC GTC GCGATG GCCT-3') использовали для амплификации 1,5 т.п.о.-продукта из 100 нг рНС 012-матрицы. 23 каждого из синтетических олигонуклеотидов B1CGG TTC GTC CGC CGC TGC CGT GCC-3') использовали для амплификации 1,4 т.п.о.продукта из 100 нг pVE3.4-матрицы. PCRпродукт восстанавливали по концам, фосфорилировали и клонировали в SmaI-разрезанную плазмиду pUC18 с получением плазмиды pCRb. Плазмиду pCRa гидролизовали ферментами HindIII и SpeI и 1,0 т.п.о.-вставку лигировали с плазмидой pCRb, предварительно гидролизованной ферментами HindIII и SpeI, в результате чего получали плазмиду pCRab. Плазмиду pCRc гидролизовали ферментами NheI и EcoRl, и 1,5 т.п.о.-вставку лигировали с плазмидой pCRab,предварительно гидролизованной ферментамиNheI и EcoR1, в результате чего получали плазмиду pCRabc.pNEWAVETE. Плазмиду pCRabc гидролизовали ферментами MfeI и SfiI и ДНК-фрагмент, содержащий домен загрузки avr-PKS, очищали с помощью гель-электрофореза и лигировали с плазмидойpNTEP2, которая была гидролизована ферментами MfeI и SfiI, и более крупный фрагмент очищали с помощью гель-электрофореза. Лигированную смесь трансформировали в штаммTG1 rес 0 Е.соli, и отдельные колонии тестировали на содержание плазмиды. Нужную плазмиду pNEWAVETE (13 т.п.о.) идентифицировали по ее рестрикционной карте.(v) Конструирование плазмиды pRM52. Плазмида pRM52 является производной плазмиды pRM5 (McDaniel, R. et al., Science,(1993) 262:1546-1550). Плазмиду pRM5 сначала линеаризовали путем гидролиза ферментомNdeI, восстанавливали по концам, а затем повторно лигировали с получением плазмидыpRM51. Плазмиду pRM51 разрезали ферментами РасI и NsiI и крупный PacI-NsiI-фрагмент выделяли и лигировали в короткий двухцепочечный олигонуклеотидный линкер, содержащий NdeI-сайт и сконструированный из синтетических олигонуклеотидов 5'-ТААGGАGGАСАСАТАТGСА-3' и 5'-TAATTCCTCCTGTGTAT-3', которые были гибридизированы вместе. Лигированную смесь трансформировали в штамм TG1 rес 0 Е.соli и выделенные колонии скринировали на содержание в них указанной плазмиды. Нужную плазмиду (19,6 т.п.о.) идентифицировали по ее рестрикционной карте и обозначили pRM52.(vi) Конструирование плазмиды pIG1. Плазмиду pNEWAVETE гидролизовали ферментами NdeI и XbaI и вставку очищали путем осаждения в градиенте сахарозы Очищенную вставку лигировали в плазмиду pRM52 (19,6 т.п.о.), которая была гидролизована ферментами NdeI и XbaI, и полученный вектор очищали путем осаждения в градиенте 24 сахарозы. Лигированную смесь использовали для трансформации Е.соli, и отдельные колонии тестировали на содержание в них нужной плазмиды. Нужную плазмиду pIG1 идентифицировали по ее рестрикционной карте. Пример 1b. Конструирование плазмидыpND30. Плазмида pND30 состоит из SCP2 производной плазмиды, содержащей гибридный ген PKS Типа I, включающий вместо модуля еrу-загрузки модуль avr-загрузки, первые два модуля наращивания ery-PKS и тиоэстеразы eryPKS. Эту плазмиду конструировали через несколько промежуточных плазмид следующим образом (фиг. 4).(i) Конструирование рекомбинантного вектора pCJR101.pCJR101 (фиг. 4) представляет собой "челночную" плазмиду, сконструированную в целях ее использования для экспрессии генов PKS в актиномицетах. Эта плазмида включает репликон ColE1, который позволяет ей реплицироваться в Е.соli, низкокопийный репликон SCP2Microbiol., (1981) 126:427) и ген-активатор actIIorf 4 от act-кластера, который активирует транскрипцию от act-промотора во время перехода от фазы роста в стационарную фазу в вегетативном мицелии. Эту плазмиду конструировали следующим образом: приблизительно 970 п.о.ДНК-фрагмент из плазмиды pMF1015 (содержащей ген-активатор actII-orf 4) (FernandezMoreno, М.А. et al., Cell (1991) 66:769-780) амплифицировали с помощью PCR с использованием в качестве праймеров олигонуклеотиды 5'ACT AGT CCA CTG ССТ СТС GGT ААА АТСGCG ТТС ACG GAC 3', которые также вводят фланкирующие рестрикционные SpeI- и AfIIIсайты. Этот фрагмент клонировали в восстановленный по концам AatII-сайт плазмиды pUC19 и получали плазмиду pCJR18. ДНК-фрагмент,размером приблизительно в 215 п.о., амплифицировали из плазмиды pMV400 (которая содержит разнонаправленную промоторную паруPactIII/PactI) (Parro, V. et al., Nucl.Acids Res.,(1991) 19:2623-2627) с использованием в качестве праймеров синтетических олигонуклеотидов 5'-АСА ТТС ТСТ ACG ССТ AAG TGT TCC ССТ ССС TGC СТС-3' и 5'-GTG ATG TAT GCTGCG TTC GTC CGG TG-3', которые также вводят фланкирующие NdeI- и AfIII-сайты. PCRпродукт гидролизовали ферментами NdeI и AfIII и лигировали с плазмидой pCJR18, предварительно разрезанной ферментами NdeI и AfIII, в результате чего получали плазмиду pCJR19. 1,1 т.п.о.-HindIII-SphI-фрагмент, содержащий генtsr, несущий резистентность к тиострептону,получали с помощью PCR, где в качестве матрицы использовали плазмиду pIJ922 (Lydiate,D.J. et al., Gene (1985) 35:223-235), а в качестве 25 праймеров использовали олигонуклеотиды 5'TGA АСА CCA AGC TTG CCA GAG AGC GAC ТТС ССС-3' и 5'-GAC AGA TTG CAT GCC CTTCGA GGA GTG CCC GCC CGG-3', которые также вводят фланкирующие HindIII- и SphIсайты. PCR-продукт гидролизовали ферментамиpCJR19, разрезанной ферментами HindIII и SphI,в результате чего получали плазмиду pCJR24. Плазмиду pIJ922 гидролизовали ферментамиBamHI и SstI, и фрагмент, содержащий часть локуса фертильности и область начала репликации (Lydiate, D.J. et al., Gene (1985) 35:223-235),лигировали в pUC19, гидролизованную ферментами BamHI и SstI, в результате чего получали бифункциональную плазмиду pCJR16 (14,7 т.п.о.). Плазмиду pCJR24 гидролизовали ферментами SaII и SphI, а затем два полученных после гидролиза крупных фрагмента очищали с помощью гель-электрофореза и объединяли путем четырехкомпонентного лигирования с плазмидой pCJR16, которая была гидролизована ферментами XhoI и SphI. Лигированную смесь использовали для трансформации Streptomyceslividans, и полученные колонии отбирали в присутствии тиострептона. Одна колония обнаруживала содержание нужной плазмиды pCJR101(приблизительно 12,4 т.п.о.), идентифицированной по ее рестрикционной карте.(ii) Конструирование плазмиды pCJR29. Конструирование плазмиды pCJR29 проиллюстрировано на фиг. 4. 1,1-т.п.o.-HindIIIXhoI-фрагмент, содержащий ген tsr, который сообщает резистентность к тиострептону, получали с помощью PCR, где в качестве матрицы использовали плазмиду pIJ922, а в качестве праймеров использовали олигонуклеотиды 5'TGA АСА ССА AGC TTG ССА GAG AGC GACCTT CGA GGA GTG CCC GCC CGG-3', которые также вводят фланкирующие HindIII- иXhoI-сайты. PCR-продукт гидролизовали ферментами HindIII и XhoI и лигировали с плазмидой pCJR16, которая была гидролизована ферментами HindIII и XhoI, в результате чего получали плазмиду pCJR25. Плазмиду pCJR25 гидролизовали ферментами HindIII и SphI и лигировали с плазмидой pCJR19, которая была гидролизована ферментами HindIII и SphI, в результате чего продуцировали нужную плазмидуpCJR29 (приблизительно 12,4 т.п.о.), идентифицированную по ее рестрикционной карте. Плазмида pCJR29 отличалась от плазмиды pCJR101 ориентацией гена tsr, гена actII-orf 4 и actI/actIIIпромотора по отношению к области начала репликации, производной от SCP2.(iii) Конструирование плазмиды pND30. Плазмиду pNEWAVETE гидролизовали ферментами NdeI и XbaI, и вставку очищали осаждением в градиенте сахарозы. Очищенную вставку лигировали в плазмиду pCJR18 (приблизительно 12,4 т.п.о.), которая была гидроли 001744 26 зована ферментами NdeI и XbaI, и полученный вектор очищали осаждением в градиенте сахарозы. Смесь, полученную в результате лигирования, использовали для трансформации E.coli,и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду pND30 идентифицировали по ее рестрикционной карте. Пример 1 с. Конструирование плазмидыpCJR26. Плазмида рМО 6 (фиг. 8) вначале была сконструирована с использованием нескольких стадий:(i) Конструирование плазмиды рМO1. ДНК-сегмент (приблизительно 1,3 т. п. о.) гена еryA1 S.еrуthraea, занимающий место от нуклеотида 1948 до нуклеотида 3273 eryAl(Donadio S. et al., Science (1991) 252:675-679),амплифицировали с помощью PCR с использованием в качестве праймеров синтетических олигонуклеотидов 5'-CAT GCT CGA GCT CTCpNTEP2 в качестве матрицы. PCR-продукт восстанавливали по концам и лигировали с плазмидой pUC18, которая была линеаризована путем гидролиза ферментом SmaI, а затем обработана щелочной фосфатазой. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 гес 0 E.coli, и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO1 (3,9 т.п.о.), в которой StuI-сайт, фланкирующий вставку, граничит с HindIII-сайтом в полилинкере, идентифицировали по ее рестрикционной карте.(ii) Конструирование плазмиды рМO2. ДНК-сегмент (приблизительно 0,85 т.п.о.) гена rapA Streptomyces hygroscopicus, занимающий место от нуклеотида 1643 до нуклеотида 2486 rapA, амплифицировали с помощью PCR,где в качестве праймеров использовали синтетические олигонуклеотиды 5'-ТТС ССТ GGCGGA CCG CGG АСС ACT CGAC-3', а в качестве матрицы использовали ДНК от рекомбинантного бактериофага -1 Е (Schwecke Т. et аl., Рrос.Natl.Acad.Sci. USA, (1995) 92:7839-7843). PCRпродукт восстанавливали по концам и лигировали с плазмидой pUC18, которая была линеаризована путем гидролиза ферментом SmaI, а затем обработана щелочной фосфатазой. Смесь,полученную в результате лигирования, использовали для трансформации штамма TG1 rec0E.coli, и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO2 (3,5 т.п.о.) идентифицировали по ее рестрикционной карте.(iii) Конструирование плазмиды рМO3. ДНК-сегмент (приблизительно 1,7 т.п.о.) гена eryAl S.erythraea, занимающий место от нуклеотида 4128 до нуклеотида 5928 eryAl, амплифицировали с помощью PCR, где в качестве 27 праймеров использовали синтетические олигонуклеотиды 5'-TGG CCA GGG AGT CGG TGC АСС TAG GCA-3' и 5'-GCC GAC AGC GAGTCG ACG AGT T-3', a в качестве матрицы использовали плазмиду pNTEP2. PCR-продукт восстанавливали по концам и лигировали с плазмидой pUC18, которая была линеаризована путем гидролиза ферментом SmaI, a затем обработана щелочной фосфатазой. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 E.coli, и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМО 3 (4,4 т.п.о.), в которой BaII- и AvrII-сайты граничат с HindIII-сайтом полилинкера, идентифицировали по ее рестрикционной карте.(iv) Конструирование плазмиды рМO4. Плазмиду рМO1 гидролизовали ферментами HindIII и BaII, и 1,3 т.п.о.-вставку лигировали с плазмидой рМО 3, которая была гидролизована ферментами HindIII и BaII. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 E.coli, и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рМO4(5,6 т.п.о.) идентифицировали по ее рестрикционной карте.(v) Конструирование плазмиды рМO5. Плазмиду рМO4 гидролизовали ферментом StuI, и 3,0 т.п.о.-вставку лигировали с плазмидой pNTEP2, которая была гидролизована ферментом StuI и очищена с помощью электрофореза для удаления 3,8 т.п.о.-вставки. Смесь,полученную в результате лигирования, использовали для трансформации штамма TG1 гес 0 Е.соli, и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO5 (12,8 т.п.о.) идентифицировали по ее рестрикционной карте.(vi) Конструирование плазмиды рМО 6. Плазмиду рМO2 гидролизовали ферментами BaII и AvrII, и вставку лигировали с плазмидой рМO5, которая была гидролизована ферментами BaII и AvrII. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 гес 0 Е.соli, и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рМО 6 (13,5 т.п.о.) идентифицировали по ее рестрикционной карте.(vii) Конструирование плазмиды pCJR26. Плазмида pCJR26 представляет собой плазмиду, полученную на основе SCP2 и содержащую ген PKS, включающий модуль еrузагрузки, первый и второй модули наращиванияery-PKS и тиоэстеразу, обрывающую еrу-цепь,за исключением ДНК-сегмента, кодирующего метилмалонил-СоА:АСР-ацилтрансферазу, где первый модуль наращивания специфически заменен на ДНК, кодирующую малонилСоА:АСР-ацилтрансферазу модуля 2 rap-PKS. Эту плазмиду конструировали следующим образом (фиг. 9): плазмиду рМО 6 гидролизовали 28 ферментами NdeI и XbaI, а вставку лигировали с плазмидой pCJR24, которая бьша гидролизована ферментами NdeI и XbaI и очищена с помощью гель-электрофореза. Смесь, полученную после лигирования, трансформировали в штамм TG1 гес 0 Е.соli, индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмидуpCJR26 идентифицировали по ее рестрикционной карте. Пример 1d. Конструирование S.erythraeaTKL. Плазмиду pCJR26 использовали для трансформации протопластов JC2 S.erythraea. Колонии, резистентные к тиострептону, отбирали на среде R2T20, содержащей 10 мкг/мл тиострептона. Несколько клонов тестировали на присутствие pCJR26, интегрированной в хромосому путем Саузерн-блот-гибридизации их геномной ДНК с DIG-меченным геном DEBS1-ТЕ. Клон с интегрированной копией pCJR26 культивировали в среде SSM, содержащей 5 мкг/мл тиострептона и оставляли на семь дней при температуре 28-30 С для роста. По истечении этого времени, бульон фильтровали для удаления мицелия, и рН доводили до рН 3. Затем бульон два раза экстрагировали двумя объемами этилацетата и объединенные этилацетатные экстракты промывали равным объемом насыщенного хлорида натрия, сушили над безводным сульфатом натрия и этилацетат удаляли при пониженном давлении, в результате чего получали около 500 мг неочищенного продукта. Было установлено, что этими продуктами являютсяNRRL 2338/pCJR26 и ее использование для продуцирования 14-членных макролидов. Приблизительно 5 мг ДНК плазмидыpCJR49 использовали для трансформации протопластов NRRL 2338 S.erythraea, в результате чего получали штамм, в хромосому которого была интегрирована плазмида. Из нескольких колоний была получена полная ДНК, которая была проанализирована с помощью Саузернблот-гибридизации для подтверждения интеграции указанной плазмиды в модуль 2 EryAl, в результате чего был получен способ биосинтеза нового макролида. Осуществляли дальнейшие интеграции для получения плазмидных последовательностей. S.erythraea NRRL 2338/pCJR49 инокулировали в трипсино-соевый бульон, содержащий 5 мг/мл тиострептона и инкубирова 29 ли три дня при 30 С. 100 мл этой посевной культуры использовали для инокуляции 2 л среды, состоящей из сукцината сахарозы и содержащей 5 мг/мл тиострептона в 52 л колбах,каждая из которых содержала 500 мл среды с 2 пружинами (для облегчения диспергирования) и которые встряхивали при 300 об/мин. После культивирования еще в течение 5 дней культуры центрифугировали и рН супернатанта доводили до рН 9. Затем супернатант три раза экстрагировали равным объемом этилацетата и растворитель удаляли выпариванием. Полученные продукты анализировали с помощью ЖХВД/МС и два макролида идентифицировали как аналоги эритромицина Пример If. Конструирование плазмиды рСАТХ. Плазмида рС-АТХ представляет собой плазмиду, полученную на основе SCP2 и содержащую ген PKS, включающий модуль еrузагрузки, первый и второй модули удлиненияery-PKS и тиоэстеразу, обрывающую еrу-цепь,за исключением ДНК-сегмента, кодирующего метилмалонил-СоА:АСР-ацилтрансферазу, где первый модуль наращивания был специфически заменен ДНК, кодирующей малонил- СоА:АСРацилтрансферазу и взятой из соответствующего кластера генов PKS типа I, клонированного изStreptomyces cinnamonensis АТСС 14513 (продуцента полиэфирного поликетида монензина). Эту плазмиду конструировали через несколько промежуточных плазмид (фиг. 10).(i) Выделение космиды pSCINO2. Геномную библиотеку Streptomyces cinnamonensis ATCC 14513 (продуцента монензина) конструировали из фракционированных по размерам 35-45 т.п.о.-Sau3 А-фрагментов хромосомной ДНК, лигированной в BamHI-линеаризованный и обработанный щелочной фосфатазой космидный вектор pWE15. Смесь, полученную в результате лигирования, упаковывали в -частицы с использованием экстрактов для упаковки Gigapack и трансфецировали в штаммNM1blue E.coli. Приблизительно 600 колоний этой библиотеки культивировали на поверхности найлоновой мембраны, лизировали и их ДНК перекрестно сшивали с мембраной путем УФ-облучения. После этого мембрану использовали в методах скрининга. Вставку рМО 8,содержащую домен кетосинтазы из модуля 2DEBS, метили путем рандомизированного праймирования в присутствии 33P АТР и использовали в качестве пробы для ДНКгибридизации. Гибридизацию пробы проводили 30 в течение 16 ч при 68 С в 4,0 х буфере SSC, а затем промывали в течение 1 ч при 68 С в 0,8 х буфере SSC. Три положительных клона выделяли. ДНК вставок от всех трех клонов секвенировали по концам от сайтов праймирования Т 3 и Т 7, присутствующих в векторе pWE15. Область,гомологичную доменам кетосинтазы типа I и малонил-СоА:АСР-ацилтрансферазы, идентифицировали в ДНК-последовательности от сайта праймирования Т 7 с использованием в качестве матрицы клона 2 (названного pSINO2). Частичное ДНК-секвенирование домена малонил-СоА:АСР-ацилтрансферазы (обозначенного АТХ) выявило присутствие необычного мотива последовательности в области узнавания соответствующего субстрата, что значительно отличает этот домен от различных ранее описанных доменов малонат- или метилмалонатспецифических СоА:АСР-ацилтрансфераз (Haydock, S.F. et(ii) Конструирование плазмиды рМO38. ДНК-сегмент (приблизительно 0,9 т.п.о.) домена АТХ амплифицировали с помощьюPCR, где в качестве праймеров использовали синтетические олигонуклеотиды 5'-CTG GCCGGC GCC C-3', а в качестве матрицы использовали ДНК, производную от космиды pSCINO2.PCR-продукт восстанавливали по концам и лигировали с плазмидой pUC18, которая была линеаризована путем гидролиза ферментом SmaI,а затем обработана щелочной фосфатазой. Смесь, полученную в результате лигирования,использовали для трансформации штамма TG1rес 0 Е.соli, и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO38 (3,5 т.п.о.) идентифицировали по ее рестрикционной карте.(iii) Конструирование плазмиды рМO34. Плазмида рМO34 представляет собой производную от плазмиды рМО 6, содержащую сайт поликлонирования, встроенный после стопкодона инсертированного гена D1-AT2. Плазмиду рМО 6 гидролизовали ферментами EcoRI иHindIII и гибридизировали с двумя олигонуклеотидными праймерами, образующими двухцепочечную область сайта поликлонирования: 5'-AAT ТСА ТАА СТА GTA GGA GGT CTGTG1 гес 0 Е.coli. Отдельные колонии тестировали на содержание плазмиды. Нужную плазмиду рМO34 (13,5 т.п.о.) идентифицировали по ее рестрикционной карте.(iv) Конструирование плазмиды рМO35. Плазмида рМO35 представляет собой производную от плазмиды рМO34, содержащую ген TKLS-AT2 и трансляционно-связанный с ним ген кротонил-СоА-редуктазы, производный от Streptomyces collinus (Wallace et al., 31E.J.Biochem., (1995) 233:954-962). Ген кротонилСоА-редуктазы вырезали из плазмиды pZYB3NdeI-BamHI-фрагмента, который для "затупления концов" обрабатывали нуклеазой фасоли золотистой и лигировали в плазмиду рМO34,предварительно разрезанную ферментом SpeI и аналогичным образом "затупленную" по концам с использованием нуклеазы фасоли золотистой. Смесь, полученную в результате лигирования,использовали для трансформации штамма TG1 гес 0 E.соli и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO35 (14,2 т.п.о.) с правильной ориентацией гена кротонил-СоА-кеторедуктазы идентифицировали по ее рестрикционной карте.(v) Конструирование плазмиды рМО 36. Плазмиду рМO38 гидролизовали ферментами BaII и AvrII и вставку лигировали с плазмидой рМO35, которая была гидролизована ферментами BaII и AvrII. Смесь лигирования использовали для трансформации штамма TG1 гес 0 E.coli и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМО 36 (13,5 т.п.о.) идентифицировали по ее рестрикционной карте.(vi) Конструирование плазмиды рС-АТХ. Плазмиду рМО 36 гидролизовали ферментами NdeI и XbaI и вставку лигировали с плазмидой pCJR29, которая была гидролизована ферментами NdeI и XbaI и очищена с помощью гель-электрофореза. Смесь для лигирования использовали для трансформации штамма TG1 гес 0 E.coli и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рС-АТХ идентифицировали по ее рестрикционной карте. Пример 1g. Конструирование S.erythraeaTKL. Плазмиду рС-АТХ использовали для трансформации протопластов JC2 S.erythraea. Колонии, резистентные к тиострептону, отбирали на среде R2T20, содержащей 10 мкг/мл тиострептона. Несколько клонов тестировали на присутствие интегрированной в хромосому плазмиды рС-АТХ путем Саузерн-блотгибридизации их геномной ДНК с DIGмеченной ДНК, кодирующей ген DEBS1-ТЕ. Клон с интегрированной копией рС-АТХ культивировали в среде SSM, содержащей 5 мкг/мл тиострептона, и оставляли на семь дней для роста при температуре 28-30 С. По истечении этого времени бульон фильтровали для удаления мицелия и рН доводили до 3. Затем бульон два раза экстрагировали двумя объемами этилацетата и объединенные этилацетатные экстракты промывали равным объемом насыщенного хлорида натрия, сушили безводным сульфатом натрия и этилацетат удаляли при пониженном давлении, в результате чего получали около 500 мг неочищенного продукта. С помо 001744 32 щью газовой хроматографии,массспектрометрии и ЯМР было установлено, что этими продуктами являютсяNRRL 2338/рС-АТХ и ее использование для продуцирования 14-членных макролидов. Приблизительно 5 мг ДНК рС-АТХ использовали для трансформации протопластовNRRL 2338 S.erythraea, в результате чего получали штамм, в хромосому которого была интегрирована эта плазмида. Из нескольких колоний была получена полная ДНК, которая была проанализирована с помощью Саузерн-блотгибридизации для подтверждения интеграции указанной плазмиды в модуль 2 EryAl, в результате чего был получен способ биосинтеза новых макролидов. Проводили дальнейшие интеграции для получения повторяющихся плазмидных последовательностей.NRRL 2338/рС-АТХ инокулировали в трипсиносоевый бульон, содержащий 5 мг/мл тиострептона, и инкубировали три дня при 30 С. 100 мл этой посевной культуры использовали для инокуляции 2 л среды, состоящей из сукцината сахарозы и содержащей 5 мг/мл тиострептона в 52 л колбах, каждая из которой содержала 500 мл среды с 2 пружинами (для облегчения диспергирования) и которые встряхивали при 300 об/мин. После культивирования еще в течение 5 дней культуры центрифугировали и рН супернатанта доводили до 9. Затем супернатант три раза экстрагировали равным объемом этилацетата и растворитель удаляли выпариванием. Полученные продукты анализировали с помощью ЖХВД/МС и два макролидных продукта были идентифицированы. Пример 1i. Конструирование плазмиды рС-АТ 12. Плазмида рС-АТ 12 представляет собой плазмиду, полученную на основе SCP2 и содержащую ген PKS, включающий модуль еrузагрузки, первый и второй модули наращивания 33 метилмалонил-СоА:АСР-ацилтрансферазу, где второй модуль наращивания специфически заменен ДНК, кодирующей малонил-СоА:АСРацилтрансферазу модуля 2 rap PKS. Эту плазмиду конструировали через несколько промежуточных плазмид (фиг. 11).(i) Конструирование плазмиды рМO25. ДНК-сегмент (приблизительно 1,0 т.п.о.) гена eryAl S.erythraea, занимающий место от нуклеотида 6696 до нуклеотида 7707 eryA1(Donadio S. et al., Science (1991) 252:675-679),амплифицировали с помощью PCR, где в качестве праймеров использовали синтетические олигонуклеотиды 5'-GGC GGG ТСС GGA GGTGAA GAC GAA САС TGA-3', а в качестве матрицы плазмиду pNTEp2. PCR-продукт восстанавливали по концам и лигировали с плазмидойpUC18, которая была линеаризована путем гидролиза ферментом SmaI, а затем обработана щелочной фосфатазой. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 E.coli и индивидуальные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМO25(3,6 т.п.о.), в которой StuI-сайт, фланкирующий вставку, граничит с HindIII-сайтом в полилинкере, идентифицировали по ее рестрикционной карте.(ii) Конструирование плазмиды рМO26. ДНК-сегмент (приблизительно 0,6 т.п.о.) гена eryAl S.erythraea, занимающий место от нуклеотида 8660 до нуклеотида 9258 eryAl, амплифицировали с помощью PCR с использованием в качестве праймеров синтетические олигонуклеотиды 5'-ТСС TAG GCC GGG CCGPCR-продукт восстанавливали по концам и лигировали с плазмидой pUC18, которая была линеаризована путем гидролиза ферментом SmaI,а затем обработана щелочной фосфатазой. Смесь, полученную в результате лигирования,использовали для трансформации штамма TG1rec0 E.coli и отдельные колонии тестировали на содержание в них плазмиды. Нужную плазмиду рМО 26 (3,2 т.п.о.), в которой AvrII-сайт граничит с HindIII-сайтом полилинкера, идентифицировали по ее рестрикционной карте.(iii) Конструирование плазмиды рМO27. Плазмиду рМO25 гидролизовали ферментами EcoRI и BaII и 1,0 т.п.о.-вставку лигировали с плазмидой рМO2, которая была гидролизована ферментами EcoRI и BaII. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 Е.соli и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рМО 27(4,4 т.п.о.) идентифицировали по ее рестрикционной карте. 34 Плазмиду рМO26 гидролизовали ферментами AvrII и HindIII и 0,6 т.п.о.-вставку лигировали с плазмидой рМO27, которая была гидролизована ферментами AvrII и HindIII. Смесь,полученную в результате лигирования, использовали для трансформации штамма TG1 rec0E.coli и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рМO32 (5,1 т.п.о.) идентифицировали по ее рестрикционной карте.(v) Конструирование плазмиды рМО 33. Плазмиду рМO32 гидролизовали ферментами BspE1 и SexA1 и 2,7 т.п.о.-вставку лигировали с плазмидой pNTEP2, которая была гидролизована этими же двумя ферментами и очищена с помощью гель-электрофореза для удаления 2,8 т.п.о.-вставки. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 E.coli и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рМО 33 (12,8 т.п.о.) идентифицировали по ее рестрикционной карте.NdeI и XbaI и очищенной с помощью гельэлектрофореза. Смесь, полученную в результате лигирования, использовали для трансформации штамма TG1 rec0 Е.соli и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду рС-АТ 12 идентифицировали по ее рестрикционной карте. Пример 1j Конструирование S.erythraeaTKL. Плазмиду рС-АТ 12 использовали для трансформации протопластов JC2 S.erythraea. Колонии, резистентные к тиострептону, отбирали на среде R2T20, содержащей 10 мкг/мл тиострептона. Несколько клонов тестировали на присутствие интегрированной в хромосому рСАТ 12 путем Саузерн-блот-гибридизации их геномной ДНК с DIG-меченым геном DEBS1-ТE. Клон с интегрированной копией рС-АТ 12 культивировали в среде SSM, содержащей 5 мкг/мл тиострептона, и оставляли на семь дней для роста при температуре 28-30 С. По истечении этого времени бульон фильтровали для удаления мицелия и рН доводили до рН 3. Затем бульон два раза экстрагировали двумя объемами этилацетата и объединенные этилацетатные экстракты промывали равным объемом насыщенного хлорида натрия, сушили над безводным сульфатом натрия, а этилацетат удаляли при пониженном давлении, в результате чего получали около 500 мг неочищенного продукта. Было установлено, что этими продуктами являютсяNRRL 2338/рС-АТ 12 и ее использование для продуцирования 14-членных макролидов. Приблизительно 5 мкг ДНК рС-АТ 12 использовали для трансформации протопластовNRRL 2338 S.erythraea, в результате чего получали штамм, в хромосому которого была интегрирована эта плазмида. Из нескольких колоний была получена полная ДНК, которая была проанализирована с помощью Саузерн-блотгибридизации для подтверждения интеграции указанной плазмиды в 3'-конец модуля 2 EryAl,в результате чего был получен способ биосинтеза новых макролидов. Последующие интеграции давали повторяющиеся плазмидные последовательности. S.erythraea NRRL 2338/рС-АT2 инокулировали в трипсино-соевый бульон, содержащий 5 мг/мл тиострептона, и инкубировали три дня при 30 С. 100 мл этой посевной культуры использовали для инокуляции 2 л среды,состоящей из сукцината сахарозы и содержащей 5 мкг/мл тиострептона в 52 л колбах, каждая из которой содержала 500 мл среды с 2 пружинами (для облегчения диспергирования) и которые встряхивали при 300 об/мин. После культивирования еще в течение 5 дней культуры центрифугировали и рН супернатанта доводили до 9. Затем супернатант три раза экстрагировали равными объемами этилацетата и растворитель удаляли выпариванием. Полученные продукты анализировали с помощью ЖХВД/МС и два макролидных продукта были идентифицированы.pCJR49. Плазмида представляет собой плазмиду,полученную на основе pCJR24, содержащей мутантный ген DEBS1-ТЕ, который не имеет кеторудуктазы в модуле 2 и в котором домен AT в модуле 2 заменен на RAPS AT2 для того, чтобы вводить малониловый "удлинитель" вместо метилмалонилового "удлинителя" во втором модуле (фиг. 12). рМО 32 гидролизовали ферментами BspEI и SexAI и фрагмент, содержащий AT от модуляRAP 2, клонировали в pUC1-O, предварительно гидролизованную ферментами BspEI и SexAI, в результате чего получали плазмиду pCJR43.DEBS1-TE, клонировали в pCJR24, предварительно гидролизованную ферментами NdeI иXbaI, в результате чего получали плазмидуpCJR49. pCJR49 подтверждали путем рестрикционного ферментативного картирования. Пример 1m. Конструирование S.erythraeaTKL. Приблизительно 5 мкг pCJR49-плaзмиднoй ДНК использовали для трансформации протопластов JC2 S.erythraea, в результате чего получали штамм, в хромосому которого была интегрирована эта плазмида. Из нескольких колоний была получена полная ДНК, которая была проанализирована с помощью Саузерн-блотгибридизации для подтверждения интеграции указанной плазмиды в модуль eryTE. S.erythraeaJC2/pCJR49 инокулировали в трипсино-соевый бульон, содержащий 5 мкг/мл тиострептона, и инкубировали три дня при 30 С. 100 мл этой посевной культуры использовали для инокуляции 2 л среды, состоящей из сукцината сахарозы и содержащей 5 мкг/мл тиострептона в 52 л колбах, каждая из которых содержала 500 мл среды с 2 пружинами для облегчения диспергирования и которые встряхивали при 300 об/мин. После культивирования еще в течение 5 дней культуры центрифугировали и рН супернатанта доводили до 3. Затем супернатант три раза экстрагировали равными объемами этилацетата и растворитель удаляли выпариванием. Продукты растворяли в метаноле и анализировали с использованием системы ГХ-МС Finnegan-MATGCQ. Анализ путем сравнения с синтетическими стандартами указывал на присутствие двух новых лактонов. Было установлено, что этими продуктами являются -лактон (4S,5R)-4-метил 3-кето-5-гидроксигексановой кислоты и лактон (4S,5R)-4-метил-3-кето-3-гидроксигептановой кислотыNRRL 2338/pCJR49 и ее использование для продуцирования 14-членных макролидов. Приблизительно 5 мкс ДНК pCJR49 использовали для трансформации протопластовNRRL 2338 S.erythraea, в результате чего получали штамм, в хромосому которого была интегрирована эта плазмида. Из нескольких колоний была получена полная ДНК, которая была проанализирована с помощью Саузернгибридизации для подтверждения интеграции указанной плазмиды в модуль 2 EryAl, в результате чего был получен способ биосинтеза новых 37 макролидов. Проводили дальнейшие интеграции с получением повторяющихся плазмидных последовательностей. S.erythraea/pCJR49 инокулировали в трипсино-соевый бульон, содержащий 5 мкг/мл тиострептона, и инкубировали три дня при 30 С. 100 мл этой посевной культуры использовали для инокуляции 2 л среды,состоящей из сукцината сахарозы и содержащей 5 мкг/мл тиострептона в 52 л колбах, каждая из которых содержала 500 мл среды с 2 пружинами для облегчения диспергирования и которые встряхивали при 300 об/мин. После культивирования еще в течение 5 дней культуры центрифугировали и рН супернатанта доводили до 9. Затем супернатант три раза экстрагировали равными объемами этилацетата и растворитель удаляли выпариванием. Полученные продукты анализировали с помощью ЖХВД-МС и два макролида были идентифицированы.S.erythraea, несущей гибридный ген PKS, в котором би-домен егу-загрузки S.erythraea NRRL 2338 заменен би-доменом avr-загрузки.pIJ702, предварительно гидролизованную ферментом BgIII. Полученная смесь содержала нужную плазмиду pAVLD (фиг. 5). Лигированную смесь трансформировали в rec0 TG1 Е.coli и индивидуальные колонии тестировали на содержание плазмиды. Нужную плазмиду pAVLD идентифицировали по ее рестрикционной карте(ii) Конструирование S.erythraea ERMD1. Приблизительно 5-10 мкг pAVLD, выделенной из rec0 TG1 E.coli (pAVLD), трансформировали в S.erythraea NRRL 2338 и стабильные колонии, резистентные к тиострептону, выделяли. Одну из этих колоний отбирали и полную ДНК гидролизовали ферментом PstI и анализировали с помощью Саузерн-гибридизации, используя в качестве пробы вставку из плазмидыpCRc, которая содержала фрагмент гена ery-A1,кодирующего кетосинтазный домен KS1. Анализ выявил позитивно гибридизирующиеся PstIфрагменты размерами 8,5 т.п.о., 4,8 т.п.о. и 33 т.п.о., указывая, при этом, на присутствие двух тандемно интегрированных копий pAVLD (фиг. 6). Пример 3. Получение изопропил- и вторбутилэритромицинов с использованием S.erythraea ERMD1. 38 Ферментацию 50 мл S.erythraea ERMD1 осуществляли в среде водопроводной воды и после выдерживания в течение 4 дней при температуре 30 С мицелий собирали и использовали для инокуляции 1,5 л сахарозо-сукцинатной среды, содержащей тиострептон (50 мкг/мл). После культивирования в течение 4 дней при 30 С цельный бульон дважды экстрагировали равными объемами этилацетата. Объединенные экстракты концентрировали при пониженном давлении и дважды подвергали препаративной тонкослойной хроматографии на пластинах с двуокисью кремния (2020 см), элюируя хлороформом/метанолом/88 аммиаком (8:2:0,01) (по объему). Затем продукты разделяли с помощью ЖХВД на обращеннофазовой колонке S5 (4,6 мм 25 см) с дезактивированным основанием С 18 PhaseSep и с ODS(октадецилсиланом) 6, элюируя метанолом/0,5% ацетатом аммония (70:30(об/об при скорости потока 1 мл/мин. Собирали фракции между 7-11 минутами от трех отдельных вводов и объединенные фракции повторно вводили в виде 10 отдельных порций. Аналоги, содержащие изопропиловую боковую цепь (изопропил в R1 формулы 1), полученную в результате включения исходного звена 4-углерода (С-4; изобутирил), элюировались раньше, тогда как аналоги,содержащие втор-бутиловую боковую цепь(втор-бутил в R1 формулы 1), полученную в результате включения исходного звена 5-углерода(С-5; 2-метилбутирил), появлялись на несколько минут позже. МС высокого разрешения давала результаты для С-4 еrуА-, еrуВ- и eryD-аналогов и для С-5 еrуА-, еrуВ-аналогов, которые близко соответствовали вычисленным результатам: Аналог С 5-егуА С 4-егуА С 5-егуВ С 4-егуВ Вычисленная масса Измеренная масса 762,5004 762,5021 748,4847 748,4820 746,4898 748,5077 732,4898 732,4933 В этих экспериментах природные эритромицины присутствовали только в низких или необнаруживаемых количествах и не наблюдалось обнаруживаемых количеств еrуС-аналогов. Отношение полных концентраций С-4/С-5 соединений в бульоне для ферментации, по оценке этилацетатных экстрактов этого бульона методами ЭС-МС, составляло от 4:1 до 6:1 в пользу С-4-соединений. Отношение А:В:Dаналогов варьировалось и составляло около 15:60:25, но по мере прохождения процесса ферментации содержание А-аналога увеличивалось. Общий выход эритромицинов составлял около 400 мкг/л. Каких-либо добавлений изомасляной или 2-метилмасляной кислоты не проводили. Таким образом, очевидно, что исходные звенья изомасляной и 2-метилмасляной кислоты образуются из эндогенно поставляемых предшественников, аналогично синтезу натуральныхNRRL 2338 и выделяли стабильные колонии,резистентные к тиострептону. Из нескольких таких колоний получали полную ДНК и, для подтверждения того, что указанная плазмида была специфически интегрирована в EryAl, эту ДНК анализировали с помощью Саузернгибридизации, которая также показала, что этот сайт интеграции был подходящим для генерирования мутанта, способного продуцировать модифицированные макролиды благодаря модулю ave-загрузки. Пример 4b. Конструирование S.erythraeaNRRL 2338 и выделяли стабильные колонии,резистентные к тиострептону. Из нескольких таких колоний получали полную ДНК и для подтверждения того, что указанная плазмида была специфически интегрирована в EryAl, эту ДНК анализировали с помощью Саузернгибридизации, которая также показала, что этот сайт интеграции был подходящим для генерирования мутанта, способного продуцировать модифицированные макролиды благодаря модулю ave-загрузки. Пример 5 а. Получение 13-изопропил- и 13 втор-бутил-эритромицинов с использованиемS.erythraea NRRL 2338/pIG1 инокулировали в среду с водопроводной водой, содержащую 50 мкг/мл тиострептона, и оставляли для роста на 4 дня при 30 С. По истечении этого времени 20 мл мицелия использовали для засевания в 500 мл сахарозо-сукцинатной среды, содержащей 50 мкг/мл тиострептона в 2-литровой колбе, снабженной одной пружиной (для снижения агглютинации), и встряхивали при 280 об/мин. Через 3,5-6 дней бульон фильтровали для удаления мицелия, а затем три раза экстрагировали четвертью объема этилацетата. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и растворитель удаляли выпариванием. Анализ смеси продуктов, проводимый с использованием ГХ и массспекроскопии методом электронапыления, выявил, что из общего количества 5-6 мг/л 14 членных макролидных продуктов основным компонентом был втор-бутил-эритромицин D(около 1,5 мг/л), а другими присутствующими компонентами были втор-бутил-эритромицин В и втор-бутил-эритромицин А, изопропилэритромицины А, В и D и небольшие количества природных эритромицинов А, В и D.S.erythraea NRRL 2338/pIG1 продуцировала приблизительно в 10-15 раз больше новых изо 001744 40 пропил- и втор-бутил-эритромицинов, чем эквивалентно сконструированная S.erythraea ERMD1(см. пример 2), что ясно указывало на способность actI-промотора и соответствующего ему гена-активатора actII-orf 4 обеспечивать повышенную экспрессию PKS Типа I. Каких-либо дополнительных количеств изомасляной или 2 метилмасляной кислоты не добавлялось. Таким образом, очевидно, что исходные звенья изомасляной и 2-метилмасляной кислоты образуются из эндогенно поставляемых предшественников. Пример 5b. Получение 13-изопропил- и 13 втор-бутил-эритромицинов с использованиемS.erythraea NRRL 2338/pND30 инокулировали в среду с водопроводной водой, содержащую 50 мкг/мл тиострептона, и оставляли для роста на 4 дня при 30 С. По истечении этого времени 20 мл мицелия засевали в 500 мл сахарозо-сукцинатной среды, содержащей 50 мкг/мл тиострептона в 2-литровой колбе, снабженной одной пружиной (для снижения агглютинации),и встряхивали при 280 об/мин. Через 3,5-6 дней бульон фильтровали для удаления мицелия, а затем три раза экстрагировали четвертью объема этилацетата. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и растворитель удаляли выпариванием. Анализ смеси продуктов, проводимый с использованием ГХ и масс-спектроскопии методом электронапыления, показал, что из всего количества 5-6 мг/л 14-членных макролидных продуктов основным компонентом был втор-бутилэтироромицин D (около 1,5 мг/л), а другими присутствующими компонентами были вторбутил-этиромицин В и втор-бутил-эритромицин А, изопропил-эритромицины А, В и D, и небольшие количества природных эритромицинов А, В и D. S.erythraea NRRL 2338/pND30 продуцировала приблизительно в 10-15 раз больше новых изопропил- и втор-бутил-эритромицинов,чем эквивалентно сконструированная S.erythraea ERMD1 (см. пример 2), что ясно указывало на способность actI-промотора и соответствующего ему гена-активатора actII-orf 4 обеспечивать повышенную экспрессию PKS Типа I. И в этом случае каких-либо дополнительных количеств изомасляной или 2-метилмасляной кислоты не добавлялось. Таким образом, очевидно, что исходные звенья изомасляной и 2 метилмасляной кислоты образуются из эндогенно поставляемых предшественников. Пример 6 а. Получение 13-циклопентилэритромицина В с использованием S.erythraeaNRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIGl инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 36-часового инкубирования при 28 С содержимое колбы использовали для инокуляции 3,5 л среды ERY-P в 5 л мини-сосуде. Этот 41 бульон инкубировали при 28 С со скоростью аэрации 1,75 л/мин. Через 24 ч добавляли циклопентанкарбоновую кислоту (1,4 мл) и осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 добавлением водного раствора гидроксида натрия и экстрагировали этилацетатом (10 л). Этилацетатный экстракт концентрировали досуха и получали неочищенный продукт в виде смолы (4,2 г). Один грамм этого экстракта растворяли в этилацетате (5 мл) и помещали в заранее наполненную силикагелем колонку (10 г;International Sorbent Technology), предварительно кондиционированную этилацетатом (10 мл). Колонку последовательно элюировали этилацетатом (410 мл), смесью дихлорметана:метанола (1:1) (210 мл), смесью дихлорметана:метанола:аммиака (90:9:1) (110 мл), смесью дихлорметана:метанола:аммиака (80:19:1)(110 мл); и метанолом (210 мл). Фракции 710 объединяли и выпаривали досуха. Это фракционирование повторяли для оставшихся 3,2 г смолы. Эта стадия обогащения давала примерно 920 мг смолистого твердого вещества, содержащего нужный продукт. Затем это вещество очищали с помощью препаративной обращеннофазовой ЖХВД на колонке (21,2 мм 25 см) с 7 мкм ODS Zorbax с использованием в качестве подвижной фазы смеси ацетонитрила:0,05 М ацетата аммония (7:3) при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, от четырех отдельных вводов объединяли и выпаривали досуха, а затем снова осуществляли препаративную обращенно-фазовую ЖХВД на колонке Beckman (10 мм 25 см) с 5 мкм Ultrasphere ODS с использованием градиента "ацетонитрил:0,05 М ацетат аммония (28:72)ацетонитрил:0,05 М ацетат аммония (50:50)" в качестве подвижной фазы, проходящей за 18 мин (скорость потока 4 мл/мин). Фракции, содержащие нужный продукт, от пяти отдельных вводов объединяли и выпаривали досуха, в результате чего получали очищенный белый твердый продукт (7 мг). Структуру этого продукта подтверждали с помощью масс-спектрометрии(МС) и спектроскопии методом ядерного магнитного резонанса (ЯМР): Время удерживания ЖХВД - Метод А 26,0 мин АПХИ-МС (m/е): (М+Н)+ - наблюдали 758; для C40H72NO12 требуется 758 Сигналы со звездочкой могут быть взаимозаменяемыми.NRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIG1 инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 72 часового инкубирования при 28 С содержимое колбы использовали для инокуляции 3,5 л среды ERY-P в 35 л мини-сосуде. Этот бульон инкубировали при 28 С со скоро 43 стью аэрации 2,0 л/мин и перемешивали при скорости 500 об/мин. Две порции циклобутанкарбоновой кислоты (1,4 мл) добавляли через 24 ч и через 48 ч, после чего осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (20 л). Этилацетатный экстракт концентрировали досуха и получали неочищенный продукт в виде смолы (9,2 г). Часть этого экстракта (2,3 г) растворяли в этилацетате(12,5 мл) и добавляли в заранее наполненную силикагелем колонку (10 г; International SorbentTechnology), предварительно кондиционированную этилацетатом (10 мл). Колонку последовательно элюировали этилацетатом (424 мл),смесью дихлорметана: метанола (9:1) (124 мл), смесью дихлорметана: метанола (8:2) (224 мл), смесью дихлорметана:метанола:аммиака(80:19:1)(124 мл) и метанолом (124 мл). Фракции 6-8 объединяли и выпаривали досуха. Это фракционирование повторяли для оставшегося образца смолы (4,7 г). Эта стадия обогащения давала примерно 415 мг твердого вещества,содержащего нужный продукт. Затем это вещество очищали с помощью препаративной обращенно-фазовой ЖХВД на колонке (21,2 мм 25 см) с 7 мкм ODS Zorbax с использованием в качестве подвижной фазы смеси ацетонитрила:0,05 М ацетата аммония (3:1) при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, от пяти отдельных вводов, объединяли и выпаривали досуха, а затем снова проводили препаративную обращенно-фазовую ЖХВД на колонке Beckman (10 мм 25 см) с 5 мкм Ultrasphere ODS с использованием градиента "ацетонитрил:0,05 М ацетат аммония (28:72)ацетонитрил:0,05 М ацетат аммония (50:50) в качестве подвижной фазы, проходящей за 18 мин(скорость потока 4 мл/мин). Фракции, содержащие нужный продукт, объединяли и выпаривали досуха, в результате чего получали очищенный белый твердый продукт (27 мг). Структуру этого продукта подтверждали с помощью массспектрометрии (МС) и спектроскопии методом ядерного магнитного резонанса (ЯМР): Время удерживания при ЖХВД - Метод АNRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIGl инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 72 часового инкубирования при 28 С содержимое колбы использовали для инокуляции 3,5 л среды ERY-P в 5 л мини-сосуде. Этот бульон инкубировали при 28 С со скоростью аэрации 1,75 л/мин. Через 24 ч через стерилизованный фильтр добавляли 3-фуроновую кислоту 45 ферментацию в течение 138 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (10 л). Этилацетатный экстракт концентрировали досуха и получали неочищенный продукт в виде смолы (3,8 г). Часть этого экстракта (1,9 г) растворяли в этилацетате (10 мл) и добавляли в заранее наполненную силикагелем колонку (10 г; InternationalSorbent Technology), предварительно кондиционированную этилацетатом (10 мл). Колонку последовательно элюировали этилацетатом (424 мл), смесью дихлорметана:метанола (9:1)(124 мл), смесью дихлорметана:метанола (8:2) (224 мл), смесью дихлорметана:метанола: аммиака (80:19:1) (136 мл), метанолом (124 мл). Фракции 8 и 9 объединяли и выпаривали досуха. Это фракционирование повторяли для оставшихся 1,9 г смолы. В этой стадии обогащения получали твердое вещество, содержащее нужный продукт. Затем это вещество очищали с помощью препаративной обращенно-фазовой ЖХВД на колонке (21,2 мм 25 см) с 7 мкмODS Zorbax с использованием в качестве подвижной фазы смеси ацетонитрила:0,05 М ацетата аммония (3:1) при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, от трех отдельных инъекций, объединяли и выпаривали досуха, а затем снова осуществляли препаративную обращенно-фазовую ЖХВД на колонке(скорость потока 4 мл/мин). Фракции, содержащие нужный продукт, от трех отдельных вводов объединяли и выпаривали досуха, в результате получали очищенный 13-(3-фуранил)эритромицин В в виде белого твердого продукта(9 мг). Структуру этого продукта подтверждали с помощью масс-спектрометрии (МС). Время удерживания при ЖХВД - Метод А Сигналы со звездочкой могут быть обратимыми.NRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIG1 инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 72-часового инкубирования при 28 С содержимое колбы использовали для инокуляции 3,5 л среды ERY-P. Сразу после стерилизации добавляли тиострептон (105 мг). Этот бульон инкубировали при 28 С со скоростью аэра 47 ции 2 л/мин и перемешивали при скорости 500 об/мин. Через 24 ч добавляли циклопропанкарбоновую кислоту (1,2 мл), после чего осуществляли ферментацию в течение 144 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (3 л). Этилацетатный экстракт концентрировали досуха и получали неочищенный продукт в виде смолы (1,7 г). Часть этого экстракта (0,85 г) растворяли в этилацетате (10 мл) и добавляли в заранее наполненную силикагелем колонку (10 г, International Sorbent Technology), предварительно кондиционированную этилацетатом (20 мл). Колонку последовательно элюировали этилацетатом (424 мл), смесью дихлорметана:метанола(1 х 24 мл). Фракции 6-9 объединяли и выпаривали досуха. Это фракционирование повторяли для оставшихся 0,85 г смолы. В этой стадии обогащения получали твердое вещество, содержащее нужный продукт. Затем это вещество очищали с помощью препаративной обращеннофазовой ЖХВД на колонке (21,2 мм 25 см) с 7 мкм ODS Zorbax с использованием в качестве подвижной фазы смеси ацетонитрила: 0,05 М ацетата аммония (3:1) при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, от четырех отдельных вводов, объединяли и выпаривали досуха, а затем снова осуществляли препаративную обращенно-фазовую ЖХВД на колонке Beckman (10 мм 25 см) с 5 мкм Ultrasphere ODS с использованием градиента "ацетонитрил:0,05 М ацетат аммония (28:72)ацетонитрил:0,05 М ацетат аммония (50:50)" в качестве подвижной фазы, проходящей за 18 мин (скорость потока 4 мл/мин). Фракции, содержащие нужный продукт, от трех отдельных вводов объединяли и выпаривали досуха, в результате чего получали очищенный 13 циклопропил-эритромицин В в виде белого твердого продукта (9 мг). Структуру этого продукта подтверждали с помощью массспектрометрии (МС). Время удерживания при ЖХВД - Метод А Сигналы со звездочкой могут быть обратимыми.S.erythraea NRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIG1 инокулировали в 1 л среды с водопроводной водой в 2,8 л колбе Фернбаха. Сразу после инокуляции добавляли тиострептон (50 мг). После 84-часового инкубирования при 29 С содержимое колбы использовали для инокуляции 8 л среды ERY-P (содержащей 50 г/л декстрозы, 30 г/л соевой муки Nutrisoy, 3 г/л сульфата аммо 49 ния, 5 г/л NaCl, 6 г/л СаСО 3, 10 г/л сахарозы, 5 г/л замоченных семян кукурузы, 0,5 г/л MgSO4 и 1 мл/л Р 2000) в 14 л ферментере. Этот бульон инкубировали при 28 С со скоростью аэрации 8 л/мин и перемешивали при скорости 800 об/мин, при этом рН поддерживали при 6,9-7,3 добавлением NaOH или H2SO4 (15%). Через 24 ч и через 48 ч добавляли метилтиомолочную кислоту (3,2 мл). Затем через 120 ч добавляли еще 1,6 мл метилтиомолочной кислоты. Ферментацию осуществляли в течение 142 ч. По истечении этого времени весь бульон центрифугировали с получением остатка (34 л), который загружали в колонку со смолой XAD-16 (600 мл;RohmHaas). Затем колонку со смолой промывали водой (1,8 л) и элюировали этилацетатом(до 250 мл), после чего нужный продукт экстрагировали 100 мМ натрийфосфатным буфером,рН 3,5 (1,3 л). Затем этот продукт снова переносили в этилацетат, доводя воду до рН 9 добавлением гидроксида натрия с последующим смешиванием с этилацетатом (450 мл). Обогащенный эритромицином этилацетатный слой отделяли, выпаривали с получением смолы (5,0 г), а затем ресуспендировали в 20% метаноле(120 мл), который загружали в ГХ-колонку со смолой 161 (100 мл; Toso Haas). Колонку со смолой последовательно элюировали 20% метанолом (3100 мл), 40% метанолом (3100 мл),60% метанолом (3100 мл), 80% (3100 мл) и чистым метанолом (4100 мл). Чистые метаноловые фракции 2 и 3, содержащие нужный продукт, выпаривали до получения твердого остатка (220 мг), а затем очищали с помощью обращенно-фазовой ЖХВД на колонке (75 мм 25 см) с 10 мкм С 18 Kromasil с использованием смеси ацетонитрил:0,05 М ацетат аммония с градиентом 0,1% трифторуксусной кислоты (32:68)(38:62) в качестве подвижной фазы, проходящей 60 мин при скорости потока 215 мл/мин. Фракции, содержащие нужный продукт, объединяли (1,7 л), рН доводили до 9 добавлением гидроксида натрия и экстрагировали метиленхлоридом (300 мл). Метиленхлоридный слой отделяли и выпаривали досуха, в результате чего получали частично очищенный продукт. Затем повторяли стадию препаративной ЖХВД и стадию экстракции и получали чистый 13-(1 метилтиоэтил)-эритромицин В (31 мг). Структуру продукта подтверждали с помощью массспектроскопии и ЯМР-спектроскопии (на спектрометре Bruker DMX 500 МГц): Время удерживания при ЖХВД - Метод ВNRRL 2338. Культуру S.erythraea NRRL 2338 инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 48-часового инкубирования при 28 С, содержи 51 мое колбы использовали для инокуляции 50 мл среды ERY-P в 300 мл колбе Эрленмейера. Этот бульон инкубировали при 28 С. Через 24 ч добавляли циклобутанкарбоновую кислоту (20 мл), после чего осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (50 мл). Этилацетат отделяли и концентрировали досуха. Образец снова растворяли в метаноле (1 мл) для ЖХВД-МС-анализа. Этот анализ подтверждал продуцирование 13 циклобутил-эритромицина В нетрансформированным нерекомбинантным штаммом NRRL 2338, описанным в примере 7 для генетически сконструированного штамма, содержащего модульNRRL 2338/pIG1). Время удерживания при ЖХВД - Метод А 22,3 мин АПХИ-МС- (m/е): (М+Н)+ наблюдали 744; для C39H70NO12 требовалось 744. Пример 12. Получение 13-циклопропилэритромицина В с использованием S.erythraeaNRRL 2338. Культуру S.erythraea NRRL 2338 инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 48-часового инкубирования при 28 С, содержимое колбы использовали для инокуляции 50 мл среды ERY-P в 300 мл колбе Эрленмейера. Этот бульон инкубировали при 28 С. Через 24 ч добавляли циклопропанкарбоновую кислоту (20 мл), после чего осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (50 мл). Этилацетат отделяли и концентрировали досуха. Образец снова растворяли в метаноле (1 мл) для ЖХВД-МС-анализа. Этот анализ подтверждал продуцирование 13-циклопропил-эритромицина В нетрансформированным нерекомбинантным штаммомNRRL 2338, описанным в примере 7 для генетически сконструированного штамма, содержащего модуль avr-загрузки (конструкция NRRL 2338/plG1). Время удерживания при ЖХВД - Метод АNRRL 2338/plG1. Культуру S.erythraea NRRL 2338/plGl инокулировали в 50 мл среды с водопроводной водой в 3300-миллилитровой колбе Эрленмейера. После 72-часового инкубирования при 28 С,содержимое колбы использовали для инокуляции 3,5 л среды ERY-P в 35 л мини-сосудах. Этот бульон инкубировали при 28 С со скоро 001744 52 стью аэрации 2,0 л/мин и перемешивали при 500 об/мин. Две порции циклобутанкарбоновой кислоты (1,4 мл) добавляли через 24 ч и через 48 ч,после чего осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (20 л). Этилацетатный экстракт концентрировали досуха и получали неочищенный продукт в виде смолы (9,2 г). Часть этого экстракта(2,3 г) растворяли в этилацетате (12,5 мл) и добавляли в заранее наполненную силикагелем колонку (10 г; International Sorbent Technology),предварительно кондиционированную этилацетатом (10 мл). Колонку последовательно элюировали этилацетатом (424 мл), смесью дихлорметана:метанола (9:1) (124 мл), смесью дихлорметана: метанола (8:2) (224 мл), смесью дихлорметана:метанола:аммиака (80:19:1)(124 мл) и метанолом (124 мл). Фракции 68 объединяли и выпаривали досуха. Это фракционирование повторяли для оставшегося образца смолы (4,7 г). Эта стадия обогащения давала 415 мг твердого вещества, содержащего нужный продукт. Затем это вещество очищали с помощью препаративной обращенно-фазовой ЖХВД на колонке (21,2 мм 25 см) с 7 мкмODS Zorbax с использованием в качестве подвижной фазы смеси ацетонитрила:0,05 М ацетата аммония (3:1) при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, от пяти отдельных вводов объединяли и выпаривали досуха, а затем снова осуществляли препаративную обращенно-фазовую ЖХВД на колонкеODS с использованием градиента "ацетонитрил:0,05 М ацетат аммония (28:72)ацетонитрил:0,05 М ацетат аммония (50:50)" в качестве подвижной фазы, проходящей за 18 мин (скорость потока 4 мл/мин). Фракции, содержащие нужный продукт, объединяли и выпаривали досуха, в результате чего получали очищенный белый твердый продукт (4 мг). Структуру этого продукта подтверждали с помощью массспектрометрии (МС) и спектроскопии методом ядерного магнитного резонанса (ЯМР): Время удерживания при ЖХВД - Метод АNRRL 2338/pIG1. Шесть 2800 мл колб Фернбаха инокулировали культурой S.erythraea NRRL 2338/pIG1. Каждая колба содержала 1 л водопроводной воды с 50 мг тиострептона, добавленного в каждую колбу. Через 24 ч после инкубирования при 26 С в каждую колбу добавляли 200 мл.д. циклопропанкарбоновой кислоты. Колбы инкубировали в течение 90 ч и помещали в стерильные 8-литровые вакуум-колбы. Эти вакуум-колбы использовали для инокуляции 314 галлонов(1193 дм 3) среды ERY-P в сосуде с автоматическим регулированием емкостью в 500 галлонов (2280 дм 3). Этот бульон инкубировали при 27-29 С, при рН 6,7-7,4 и со скоростью аэрации 20 стандартных куб. футов/мин, и размешивали(200 мг/л). Ферментацию осуществляли в течение 198 ч. По истечении этого времени весь бульон фильтровали через керамический 0,2 мкм-фильтр (20 фут 2, фильтр U.S.). Фильтрат загружали на колонку со смолой XAD-16 (12 мл; RohmHaas). Затем колонку со смолой элюировали этилацетатом (60 л). Этилацетат концентрировали с получением смолы (302 г), к которой было добавлено 2 л метиленхлорида. Полученный метиленхлоридный раствор промывали 8 л 250 мМ натрийбикарбонатного буфера, рН 9. Обогащенный эритромицином метиленхлоридный слой отделяли, упаривали с получением смолы (200 г), а затем ресуспендировали в 40% метаноле (10 л), который загружали в ГХ-колонку со смолой 161 (9 л; Toso Haas). Колонку со смолой промывали 40% метанолом(30 л), а затем элюировали 75% метанолом (810 л) и чистым метанолом (310 л). 75% метаноловые фракции 5-8, содержащие нужный продукт, объединяли и выпаривали до получения 3,2 л. Концентрат доводили до рН 9 и добавляли к 0,95 л метиленхлорида. Метиленхлоридный слой отделяли и выпаривали с получением 12,4 г смолы. Затем часть этой смолы(75 мм 25 см) с 10 мкм С 18 Kromasil с использованием в качестве подвижной фазы смеси ацетонитрил:0,05 М ацетат аммония с изократным количеством 0,1% трифторуксусной кислоты (50:50) при скорости потока 215 мл/мин. Фракции, содержащие нужный продукт, объединяли (230 мл), выпаривали с получением концентрата (110 мл), рН доводили до 9 добавленим гидроксида натрия и экстрагировали метиленхлоридом (50 мл). Метиленхлоридный слой отделяли и выпаривали досуха, в результате чего получали 630 мг частично очищенного продукта. Затем другую порцию смолы (один грамм) очищали с помощью препаративной обращенно-фазовой ЖХВД на колонке (50 мм 25 см) с 10 мкм С 8 MetaChem Inertsil с использованием смеси ацетонитрил:0,05 М ацетат аммония в градиенте 0,1% трифторуксусной кислоты(20:80)(25:75) в качестве подвижной фазы,проходящей за 50 мин при скорости потока 125 мл/мин. Фракции, содержащие нужное соединение (28-46 мин), объединяли, насыщали бикарбонатом натрия и экстрагировали метиленхлоридом. Метиленхлорид отделяли и выпаривали досуха с получением 361 мг частично очищенного продукта. Часть этих частично очищенных продуктов снова очищали с помощью обращенно-фазовой ЖХВД, например на колонке (50 мм 250 мм) с 10 мкм С 18 Phenomenex Prodigy с использованием в качестве подвижной фазы смеси метанол:0,05 М ацетат аммония с изократным количеством 0,1% трифторуксусной 55 кислоты (50:50) при скорости потока 100 мл/мин. Фракции, содержащие нужное соединение (27-31 мин), объединяли, насыщали бикарбонатом натрия и экстрагировали метиленхлоридом. Метиленхлорид отделяли и выпаривали досуха с получением частично очищенного продукта. Этот материал снова очищали с помощью обращенно-фазовой ЖХВД, например на колонке (50 мм 25 см) с 10 мкм С 18 PhenomenexProdigy с использованием в качестве подвижной фазы смеси метанол:0,05 М ацетат аммония с изократным количеством 0,1% трифторуксусной кислоты (48:52) при скорости потока 100 мл/мин. Фракции, содержащие нужное соединение, (41-45 мин) объединяли, насыщали бикарбонатом калия и экстрагировали метиленхлоридом. Метиленхлорид отделяли и упаривали досуха с получением 13-циклопропил-эритромицина А в виде твердого продукта (20 мг). Структуру этого продукта подтверждали с помощью масс-спектрометрии и ЯМР-спектроскопии (на спектрометре Brunker DMX 500 МГц). Время удерживания при ЖХВД - Метод ВNRRL 2338/pIG1. Культуру S.erythraea NRRL 2338/pIG1 инокулировали в 50 мл среды с водопроводной водой в 300-миллилитровой колбе Эрленмейера. После 48-часового инкубирования при 28 С содержимое колбы использовали для инокуляции 50 мл среды ERY-P в 300 мл колбе Эрленмейера. Этот бульон инкубировали при 28 С. Через 24 ч через стерилизованный фильтр добавляли N-ацетилцистаминотиоэфир 3-тиофенкарбоновой кислоты (20 мг в 0,5 мл метанола),после чего осуществляли ферментацию в течение 168 ч. По истечении этого времени рН всего бульона доводили до 8,5 водным раствором гидроксида натрия и экстрагировали этилацетатом (50 мл). Этилацетат отделяли и концентрировали досуха. Образец снова растворяли в метаноле (1 мл) для ЖХВД-МС-анализа. Этот анализ подтверждал продуцирование 13-(3 тиенил)-эритромицина В. Время удерживания при ЖХВД - Метод А 57 Культуру S.erythraea NRRL 18643, eryFмутанта S.erythraea (Science, 252:114, 5 April 1991) инокулировали в 1 л водопроводной воды в 2,8 л колбах Фернбаха. После 24-часового инкубирования при 29 С в каждую колбу добавляли циклопропанкарбоновую кислоту (200 мл.д.) с перемешиванием при 200 об/мин. Через полные три (3) дня инкубирования содержимое колбы использовали для инокуляции 8 л средыERY-P (содержащей 60 г/л церелозы, 30 г/л соевой муки Nutrisoy, 3 г/л (NH4)2SO4, 5 г/л NaCl,6 г/л замоченных семян кукурузы, 0,5 г/л MgSO4 и 1 мл/л Р 2000) в 14 л ферментере. Этот бульон инкубировали при 28 С со скоростью аэрации 8 л/мин и перемешивали при 800 об/мин, при этом рН поддерживали 6,9-7,3 добавлением NaOH или H2SO4 (15%). Через 24 и 48 ч добавляли циклопропанкарбоновую кислоту (1,6 мл). Продукт ферментации (полученный в дубликате) собирали после инкубирования в течение полных 163 ч. рН всего бульона доводили до 9 добавлением гидроксида натрия и этот бульон экстрагировали этилацетатом (16 л). Этилацетат концентрировали на 20-литровом роторном испарителе Buchi с получением масла. Это масло снова растворяли в 500 мл метиленхлорида. К полученной жидкости добавляли 500 мл воды и рН водной фазы доводили до 9 путем добавления 10% гидроксида аммония. После интенсивного встряхивания метиленхлоридный слой собирали и упаривали в роторном 1 л испарителе,в результате чего получали 11,0 г маслянистого остатка. Полученное вещество растворяли в 250 мл раствора метанола и воды (4:6) и вводили в 80 мл ГХ-колонку со смолой 161 (Toso Haas). Колонку промывали 350 мл раствора метанола и воды (4:6). Затем колонку быстро промывали при 8 мл/мин раствором метанола и воды (7:3) до тех пор, пока из колонки не начинали элюироваться окрашенные примеси (промывка приблизительно 2 объемами слоя). На этой стадии начинали элюировать градиентом метанола с изменением концентрации от 70 до 100% в течение 1 ч при скорости потока 8 мл/мин. Фракции, содержащие нужный продукт, упаривали досуха, а затем очищали с помощью обращеннофазовой ЖХВД на колонке (50 мм 25 см) с 10 мкм С 18 Kromasil с использованием смеси "ацетонитрил:буфер, состоящий из 0,01 М ацетата аммония, 0,02% трифторуксусной кислоты и 26% ацетонитрила, (5:95)" в качестве подвижной фазы, проходящей за 50 мин при скорости потока 120 мл/мин. Затем использовали линейный градиент от (5:95) до (33:67) в течение еще 40 мин. Фракции, содержащие нужный продукт,объединяли (530 мл), рН доводили до 9 добавлением 10% гидроксида аммония и экстрагировали метиленхлоридом (400 мл). Метиленхлоридный слой отделяли и выпаривали досуха, в результате чего получали очищенный 6 дезокси-13-циклопропил-эритромицин В (12 58 мг). Структуру этого продукта подтверждали с помощью масс-спектрометрии. Время удерживания при ЖХВД - Метод В 21,4 мин АПХИ-МС (m/е); (М+Н)+-наблюдали 714; для C38H68NO12 требовалось 714. Пример 17. Получение 6-дезокси-13 пропил-эритромицина В с использованиемS.erythraea NRRL 18643. Культуру S.erythraea NRRL 18643 инокулировали из трехдневных бляшек, полученных на YPD-агаре (0,5% дрожжевой экстракт Difco,0,5% бакто-пептон Difco, 0,25% декстроза, 0,5%MOPS, 1,7% бакто-агар Difco, pH доводили до 7,0) в 25 мл YPD-бульоне (0,5% дрожжевой экстракт Difco, 0,5% бакто-пептон Difco, 0,25% декстроза, 0,5% MOPS, pH доводили до 7,0) в 250 мл колбе Эрленмейера. Колбу инкубировали при 225 об/мин в течение 48 ч при 29 С. 2,5 мл инокулировали в 25 мл среды ERY-P (содержащей 5% декстрозу, 3% соевую муку Nutrisoy, 0,3% (NH4)2SO4, 0,5% NaCl, 0,6% СаСО 3,pH доводили до 7,0) и инкубировали при 225 об/мин и при 29 С в течение полных 6 дней. Через 24, 72 и 120 ч в колбу добавляли масляную кислоту (400 мл.д., 400 мл.д. и 200 мл.д.,соответственно). pH всего бульона доводили до 9,1 с использованием 1 н. NaOH. Образец два раза экстрагировали равным объемом этилацетата. Этилацетатные фазы концентрировали досуха в присутствии азота (на водяной бане при 50 С), а затем ресуспендировали в 1,0 мл метанола для ЖХВД-анализа. Этот анализ подтвердил получение 6-дезокси-13-пропилэритромицина В. Время удерживания при ЖХВД - Метод С- 23,5 мин АПХИ-МС (m/е); (М+Н)+-наблюдали 716; для C38H70NO11, требовалось 716. Пример 18. Оценка антибактериальной активности. Анализ на антибактериальную активность осуществляли in vitro в планшетах для микротитрования и интерпретировали в соответствии со стандартами Perfomance Standarts for Antimicrobial Disk Susceptibility Tests - Sixth Edition:Approved Standart, опубликованными Национальным комитетом по клиническим лабораторным стандартам (NCCLS). Для различных бактерий были получены минимальные ингибирующие концентрации (MIC). Так, например,штамм 80CR5 Staphylococcus aureus (штамм,восприимчивый к макролиду) давал, в основном, значения в пределах от 0,1 до 1,56 мкг/мл. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1 и его фармацевтически приемлемые соли,где R1 представляет -разветвленную С 3-С 8 алкильную, алкенильную, алкинильную, алкоксиалкильную или алкилтиоалкильную группу,каждая из которых может быть необязательно замещена одной или несколькими гидроксильными группами; С 5-С 8-циклоалкилалкильную группу, где указанная алкильная группа является -разветвленной С 2-С 5-алкильной группой; С 3-С 8-циклоалкильную или С 5-С 8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой,или одной или несколькими гидроксильными группами, или одной или несколькими С 1-С 4 алкильными группами или атомами галогена; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным или полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С 1-С 4 алкильными группами или атомами галогена; или R1 представляет фенил, который может быть необязательно замещен, по крайней мере,одним заместителем, выбранным из С 1-С 4 алкильной, С 1-С 4-алкокси- и С 1-С 4-алкилтиогрупп, атомов галогена, гидроксильных групп,трифторметила и циано; или R1 может представлять группу формулыR12 представляет Н, СН 3 или СН 2 СН 3; или любое из определенных выше соединений,модифицированное заменой одной или нескольких групп -СНОН или -CHOR кетогруппой. 2. Соединение формулы и его фармацевтически приемлемые соли,где R1 представляет Н, C1-C8-алкильную, С 2-С 8 алкенильную, C2-C8-алкинильную, алкоксиалкильную или алкилтиоалкильную группу, содержащую 1-6 атомов углерода в каждой алкильной или алкоксигруппе, где каждая из указанных алкильной, алкокси-, алкенильной или алкинильной групп может быть замещена одной или несколькими гидроксильными группами,или одним или несколькими атомами галогена; или С 3-С 8-циклоалкильную или С 5-С 8-циклоалкенильную группу, каждая из которых может быть необязательно замещена метильной группой, либо одной или несколькими C1-C4 алкильными группами или атомами галогена; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С 1-С 4 алкильными группами или атомами галогена; или группу формулы SR14, где R14 представляетC1-C8-алкильную, C2-C8-алкенильную, С 2-С 8 алкинильную, С 3-С 8-циклоалкильную, C5-C8 циклоалкенильную, фенильную или замещенную фенильную группу, где заместителем является С 1-С 4-алкил, С 1-С 4-алкокси или галоген; или 3-6-членное кислород- или серосодержащее гетероциклическое кольцо, которое может быть насыщенным, либо полностью или частично ненасыщенным и которое может быть необязательно замещено одной или несколькими С 1-С 4-алкильными группами или атомами галогена;R12 представляет Н, СН 3 или СН 2 СН 3,при условии, что если R3-R5 представляют СН 3,R7 представляет СН 3, R9 представляет СН 3 и R12 представляет СН 3, то R1 не является Н или C1 алкилом, или любое из определенных выше соединений, модифицированное заменой одной или нескольких групп -СНОН или -CHOR кетогруппой.
МПК / Метки
МПК: A61K 31/7048, C12N 15/52, A61P 31/04, C07H 17/08, C12P 19/62
Метки: получения, эритромицины, способы, новые
Код ссылки
<a href="https://eas.patents.su/30-1744-novye-eritromiciny-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые эритромицины и способы их получения</a>
Предыдущий патент: Способ и устройство для изготовления пластмассовых фитингов, соединяемых с трубами электросваркой
Следующий патент: Ингибитор вторичной катаракты.
Случайный патент: Устройство подачи цепа и способ его работы


































