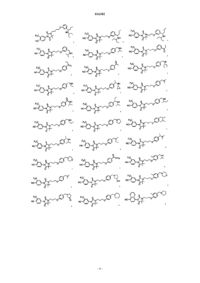
Нестероидные антиандрогены, направленные на 12 спираль (рецептора андрогенов)
Номер патента: 16382
Опубликовано: 30.04.2012
Авторы: Мальтэ Рене, Лабри Фернанд, Сингх Шанкар Мохан, Бретон Рок
Формула / Реферат
1. Соединение или его фармацевтически приемлемая соль формулы
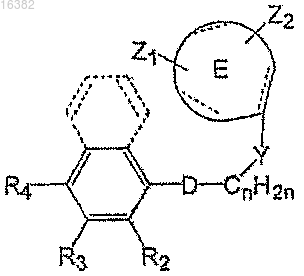
где пунктирная линия означает необязательную связь;
n - целое число, выбранное из 0-3;
R2 выбран из группы, состоящей из Н и C1-C3-алкила;
R3 и R4 независимо выбраны из группы, состоящей из Н, галогена, нитрила, -СОСН3, SO2CH3, -NO2, -ОСН3,
-SCH3, алкилсульфоксида, алкилсульфонила, алкила и галогенированного метила, где по меньшей мере один из R3 и R4 не является водородом;
D выбран из группы, состоящей из
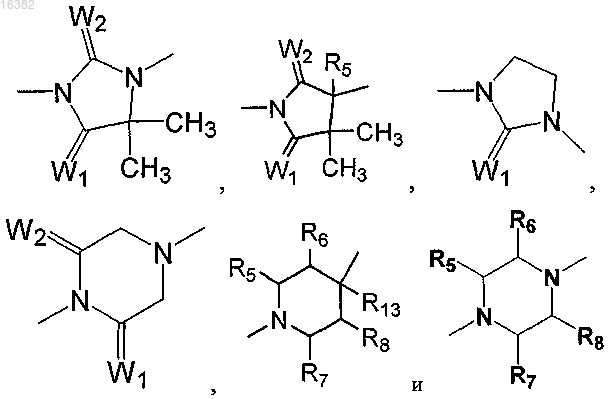
W1 и W2 независимо выбраны из группы, состоящей из -CH2-, О и S;
R5, R6, R7 и R8 независимо выбраны из группы, состоящей из Н и C1-C3-алкила;
R13 выбран из группы, состоящей из Н, ОН, метокси и C1-C6-алкила;
Y выбран из группы, состоящей из -МСН2СН2-, -СН2МСН2- и -СН2СН2М-;
где М выбран из группы, состоящей из -О-, -S-, -SO2- и -CH2-;
Е выбран из группы, состоящей из фенилена и монозамещенного пиридила;
Z1 представляет собой углеводородный фрагмент, дополнительно имеющий по меньшей мере одну карбонильную, сульфоновую или сульфоксидную группу или атом N, отделенный от Е 0-4 промежуточными атомами, причем этот атом N способен образовывать аминную, амидную, N-оксидную или четвертично-аммониевую соль;
Z1 при необходимости может иметь иной чем О, S или N атом;
Z2 выбран из группы, состоящей из Н, F, Cl, Br, I, циано, нитро, трифторметила, алкокси, С1-С5 простого или разветвленного алкила, С2-С5 простого или разветвленного алкенила и С2-С5 простого или разветвленного алкинила.
2. Соединение по п.1, где Y представляет собой -СН2СН2О-.
3. Соединение по п.1 или 2, где Е выбран из группы, состоящей из фенилена и монозамещенного пиридила и где Z1 находится в пара-положении относительно группы Y и атом азота Z1 отделен от фенилена или однозамещенного кольца пиридила одним вставочным атомом.
4. Соединение, имеющее следующую молекулярную формулу, или его фармацевтически приемлемая соль
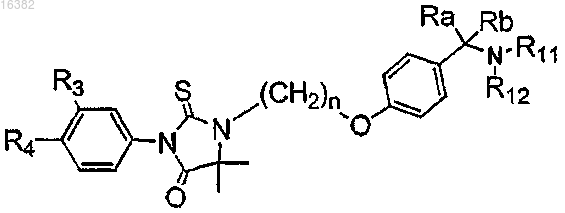
где n представляет собой целое число от 1 до 3;
Ra и Rb независимо выбираются из группы, состоящей из водорода, C1-C6-алкила и C2-C6-алкенила; Ra и Rb вместе могут формировать кольцо;
R3 выбирается из группы, состоящей из водорода, галогена, ОСН3, SCH3, алкилсульфоксида, алкилсульфона, нитрила, NO2, алкила и трифторметила;
R4 выбирается из группы, состоящей из галогена, нитрила, -СОСН3, -SO2CH3 и -NO2;
R11 и R12 независимо выбираются из группы, состоящей из водорода и C1-C6-алкила, или R11 и R12 вместе формируют гетероцикл, необязательно имеющий другой гетероатом, выбираемый из группы, состоящей из азота, кислорода, селена, кремния и серы.
5. Соединение, выбираемое из группы, состоящей из
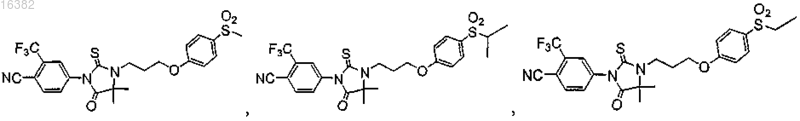
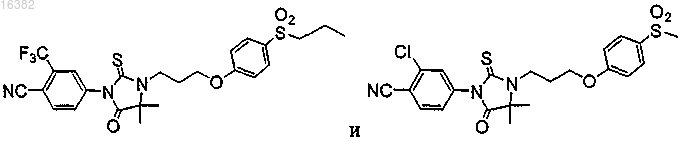
6. Соединение по п.1, где Z1 находится в пара-положении по отношению к группе Y и где атом азота или серы Z1 отделены от фенилена или монозамещенного пиридильного кольца 0-4 промежуточными атомами и где Z1 выбран из группы, состоящей из
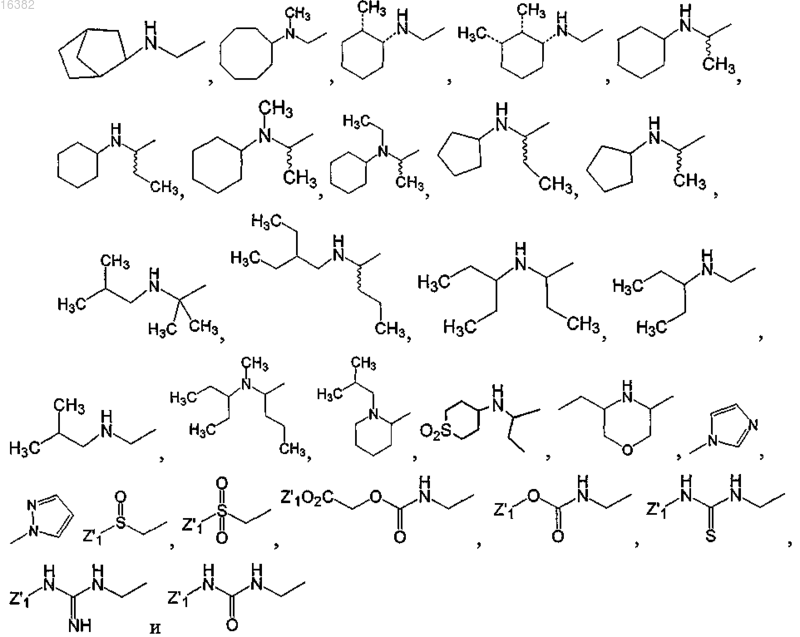
где Z'1 представляет собой Н, C1-C6-алкил, алкилен или арил или Z1, конденсированный с группой Е, образует бициклический фрагмент, выбираемый из группы, состоящей из
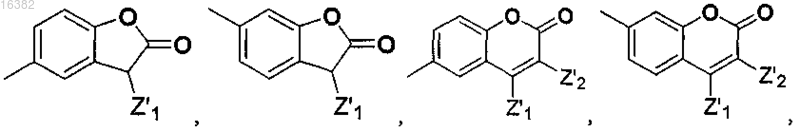
где Z'1 и Z'2 представляют собой Н, C1-C6-алкил, алкилен или арил.
7. Соединение по п.6, где Е представляет собой фенилен.
8. Соединение по п.6, где Y представляет собой -СН2СН2О.
9. Соединение, выбираемое из группы, состоящей из

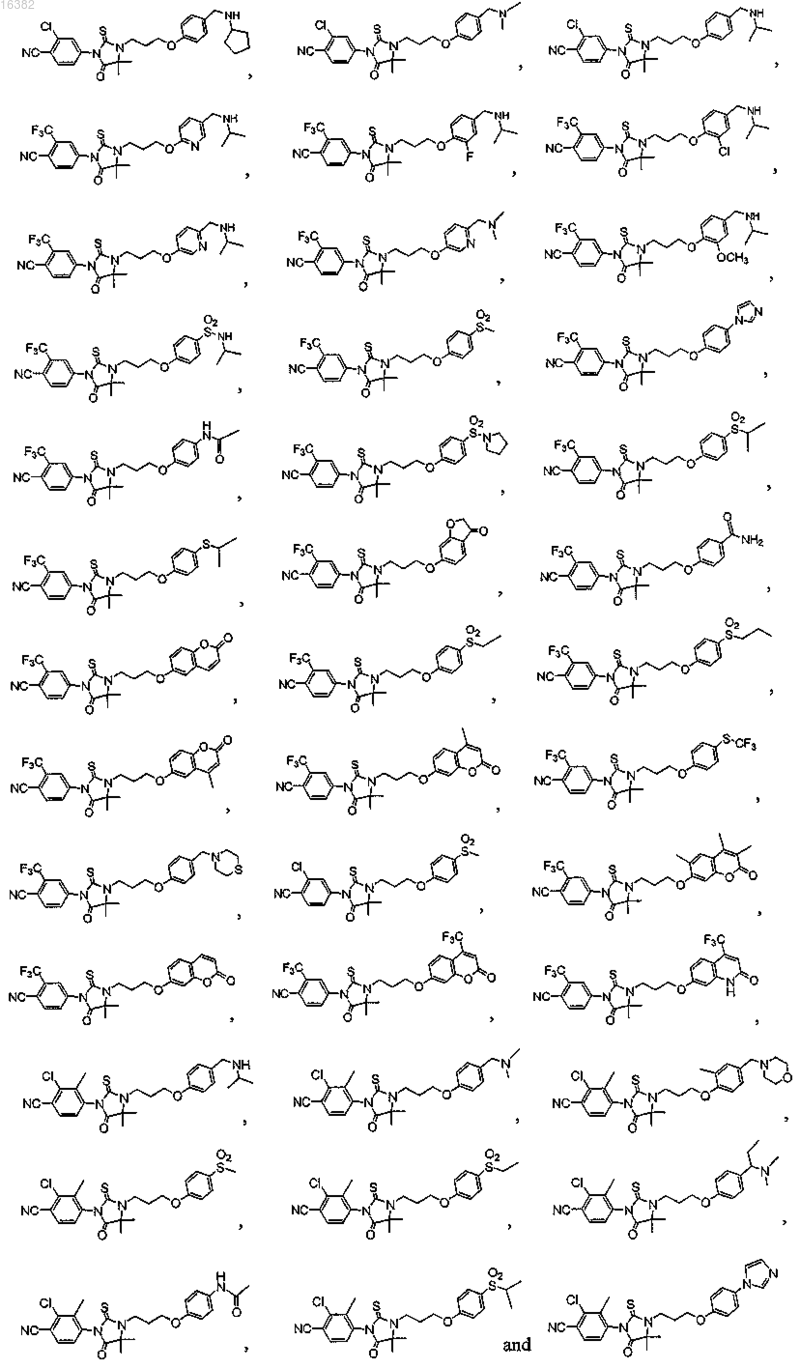
или его фармацевтически приемлемая соль.
10. Соединение, имеющее молекулярную структуру, выбираемую из группы, состоящей из представленных ниже структур, или его фамацевтически приемлемая соль
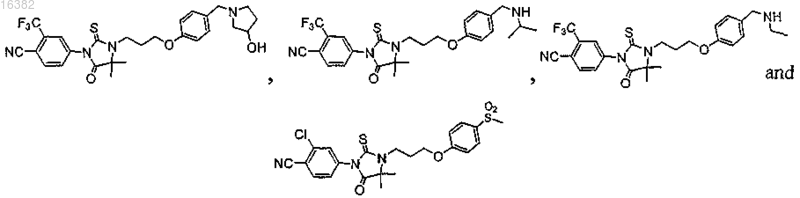
11. Фармацевтическая композиция для лечения андроген-зависимых заболеваний, включающая фармацевтически приемлемый растворитель или носитель и антиандроген эффективное количество соединения по любому из пп.1-10.
12. Фармацевтическая композиция по п.11, в которой активное соединение обладает тканеспецифической антиандрогенной активностью и тканеспецифической андрогенной активностью.
13. Фармацевтическая композиция для лечения или снижения риска развития рака простаты, развития доброкачественной гиперплазии, акне, себореи, гирсутизма, андрогенной алопеции, облысения у мужчин, преждевременного созревания, поликистозного синдрома яичников или гиперандрогенного синдрома, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый разбавитель или носитель.
14. Фармацевтическая композиция для лечения или снижения риска развития заболевания, касающегося утраты андрогенной стимуляции, выбираемого из группы, состоящей из мышечной атрофии и слабости, атрофии кожи, потери костной массы, анемии, атеросклероза, сердечно-сосудистого заболевания, потери энергии, потери хорошего самочувствия, диабетов 2 типа и накопления брюшного жира, содержащая терапевтически эффективное количество соединения по любому из пп.1-10 и фармацевтически приемлемый разбавитель или носитель.
15. Фармацевтическая композиция по любому из пп.13 и 14, в которой указанные разбавитель или носитель являются применимыми для перорального введения.
16. Способ лечения или снижения риска развития рака простаты, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества соединения по любому из пп.1-10.
17. Способ по п.16, дополнительно включающий введение названному пациенту терапевтически эффективного количества по меньшей мере одного ингибитора, выбираемого из группы, состоящей из ингибитора 17β-гидроксистероиддегидрогеназы типа 13, ингибитора 17β-гидроксистероиддегидрогеназы типа 5, ингибитора 5α-редуктазы и ингибитора андроген-синтезирующих ферментов.
18. Способ по п.17, где вводятся ингибитор 5α-редуктазы и ингибитор 17β-гидроксистероиддегидрогеназы типа 13.
19. Способ по п.16, дополнительно включающий орхиэктомию или введение агониста или антагониста LHRH.
20. Способ лечения или снижения риска развития доброкачественной гиперплазии простаты, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества соединения по любому из пп.1-10.
21. Способ по п.20, дополнительно включающий введение названному пациенту терапевтически эффективного количества по меньшей мере одного ингибитора, выбираемого из группы, состоящей из антиэстрогена, ингибитора ароматазы, ингибитора 17β-гидроксистероиддегидрогеназы типа 13 и ингибитора 5α-редуктазы.
22. Способ по п.21, где вводятся ингибитор 5α-редуктазы и ингибитор 17β-гидроксистероиддегидрогеназы типа 13.
23. Способ лечения или снижения риска развития (а) акне, себореи, гирсутизма, андрогенной алопеции или облысения мужчин; или (b) преждевременного созревания, поликистозного синдрома яичников или гиперандрогенного синдрома, или (с) мышечной атрофии и слабости, атрофии кожи, потери костной массы, анемии, атеросклероза, сердечно-сосудистого заболевания, потери энергии, потери хорошего самочувствия, диабетов 2 типа и накопления брюшного жира, включающий введение пациенту терапевтически эффективного количества соединения по любому из пп.1-10.
24. Способ лечения или снижения риска развития поликистозного синдрома яичников, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества соединения по любому из пп.1-10.
25. Способ по п.24, дополнительно включающий введение названному пациенту терапевтически эффективного количества по меньшей мере одного ингибитора, выбираемого из группы, состоящей из ингибитора 17β-гидроксистероиддегидрогеназы типа 13 и ингибитора 5α-редуктазы.
26. Способ по п.25, где вводятся ингибитор 5α-редуктазы и ингибитор 17β-гидроксистероиддегидрогеназы типа 13.
27. Способ лечения или снижения риска развития угревой сыпи (воспаления сальных желез), себореи, гирсутизма (избыточного оволосения), андрогенного облысения или потери волос у мужчин, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества соединения по п.1.
28. Способ по п.27, дополнительно включающий введение названному пациенту терапевтически эффективного количества по меньшей мере одного ингибитора, выбираемого из группы, состоящей из ингибитора 17β-гидроксистероиддегидрогеназы типа 13 и ингибитора 5α-редуктазы.
29. Способ по п.28, где вводятся ингибитор 5α-редуктазы и ингибитор 17β-гидроксистероиддегидрогеназы типа 13.
30. Способ лечения раннего полового созревания, включающий введение пациенту, мужчине или женщине, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по любому из пп.1-10.
31. Способ по п.30, включающий введение пациенту-мужчине терапевтически эффективного количества агониста или антагониста LHRH.
32. Способ по п.30, включающий введение пациенту, мужчине или женщине, терапевтически эффективного количества ингибитора 17β-гидроксистероиддегидрогеназы типа 13.
33. Способ по п.30, включающий введение пациенту-мужчине терапевтически эффективного количества ингибитора 17β-гидроксистероиддегидрогеназы типа 13 и агониста или антагониста LHRH.
34. Способ по п.30, дополнительно включающий введение ингибитора 5α-редуктазы.
35. Соединение по любому из пп.1-10, обладающее тканеспецифичной антиандрогенной активностью и тканеспецифичной андрогенной активностью.
36. Способ лечения или снижения риска развития болезней, связанных с потерей андрогенной стимуляции, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества соединения по п.35.
37. Способ лечения или снижения риска развития по меньшей мере одного из состояний, выбираемого из группы, состоящей из мышечной атрофии и слабости, атрофии кожи, потери костной массы, анемии, атеросклероза, сердечно-сосудистого заболевания, потери энергии, потери хорошего самочувствия, диабета 2 типа и накопления брюшного жира, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества селективного модулятора рецептора андрогенов по любому из пп.1-10.
38. Способ лечения или снижения риска развития рака простаты, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.11, 13 и 15.
39. Способ по п.17, дополнительно включающий орхиэктомию или введение агониста или антагониста LHRH.
40. Способ по п.18, дополнительно включающий орхиэктомию или введение агониста или антагониста LHRH.
41. Способ лечения или снижения риска развития доброкачественной гиперплазии простаты, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.11, 13 и 15.
42. Способ лечения или снижения риска развития поликистозного синдрома яичников, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.11, 13 и 15.
43. Способ лечения или снижения риска развития угревой сыпи (воспаления сальных желез), себореи, гирсутизма (избыточного оволосения), андрогенного облысения или потери волос у мужчин, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.11, 13 и 15.
44. Способ лечения раннего полового созревания, включающий введение пациенту, мужчине или женщине, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции по любому из пп.11, 13 и 15.
45. Способ по п.31, дополнительно включающий введение ингибитора 5α-редуктазы.
46. Способ по п.32, дополнительно включающий введение ингибитора 5α-редуктазы.
47. Способ по п.33, дополнительно включающий введение ингибитора 5α-редуктазы.
48. Способ лечения или снижения риска развития болезней, связанных с потерей андрогенной стимуляции, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.12, 14 и 15.
49. Способ лечения или снижения риска развития по меньшей мере одного из состояний, выбираемого из группы, состоящей из мышечной атрофии и слабости, атрофии кожи, потери костной массы, анемии, атеросклероза, сердечно-сосудистого заболевания, потери энергии, потери хорошего самочувствия, диабетов 2 типа и накопления брюшного жира, включающий введение пациенту, нуждающемуся в таком лечении или снижении риска, терапевтически эффективного количества фармацевтической композиции по любому из пп.12, 14 и 15.
Текст
Соединения, имеющие представленную ниже структуру или их соли применяются для лечения или снижения вероятности возникновения андрогензависимых болезней, таких как рак простаты, доброкачественная гиперплазия простаты,поликистозный синдром яичников, угревая сыпь (воспаление сальных желез), гирсутизм(избыточное оволосение), себорея, андрогенное облысение и мужская плешивость. Соединения готовятся в виде лекарственных форм вместе с фармацевтически приемлемыми растворителями или носителями или в любой другой фармацевтической лекарственной форме. Также раскрываются комбинации с другими активными фармацевтическими агентами. 016382 Перекрестная ссылка на родственные заявки Заявка на данный патент заявляет претензии в пользу приоритета предварительной заявки 60/691391 от 17 июня 2005 г., содержание которой включено в настоящее изобретение во всей своей полноте путем отсылки. Уровень техники Настоящее изобретение касается новых ингибиторов активности половых стероидов, например соединений, обладающих антагонистической активностью по отношению к рецепторам половых стероидов. Более конкретно настоящее изобретение касается определенных соединений, имеющих специфические боковые цепи, взаимодействующие с 12-й спиралью рецептора андрогенов, и их метаболитов, которые блокируют действие андрогенов, действуя, среди других механизмов, через рецепторы андрогенов,хотя они сами не активируют такие рецепторы в некоторых или во всех андроген-чувствительных тканях. Краткое описание предшествующего уровня техники Во время лечения определенных андроген-зависимых болезней важно значительно уменьшить или,если это возможно, устранить андроген-индуцируемые эффекты. С этой целью желательно как заблокировать доступ к рецепторам андрогенов с помощью "антиандрогенов", препятствуя, таким образом, связыванию андрогенов с такими рецепторами и их активации, так и уменьшить концентрацию андрогенов,доступных для активации рецепторов. Возможно, что даже в отсутствие андрогенов незанятые рецепторы андрогенов могут обладать биологической активностью. Следовательно, антиандрогены, которые связываются с рецепторами и блокируют их, могут обеспечить лучшие терапевтические результаты, чем терапия, которая только ингибирует выработку андрогенов. Антиандрогены могут обладать существенным терапевтическим эффектом в замедлении или остановке развития андроген-зависимых болезней, например болезней, в возникновении или развитии которых участвует рецептор андрогенов или активация модуляторов рецептора андрогенов. Желательно, чтобы антиандроген, применяемый в терапии для уменьшения активации рецептора андрогенов, имел как хорошее сродство к рецептору андрогенов, так и не обладал бы в значительной степени собственной андрогенной активностью в интересующей(их) ткани(ях). Первое касается способности антиандрогена связываться с рецептором андрогенов и таким образом блокировать доступ андрогенов к их рецептору. Второе имеет отношение к эффекту, который оказывает антиандроген на рецептор после связывания с ним. Некоторые антиандрогены могут обладать собственной андрогенной активностью ("агонистическая активность"), которая, что нежелательно, активирует те самые рецепторы андрогенов, для предотвращения активации которых они (антиандрогены) и предназначены. Другими словами,антиандроген с такой нежелательной собственной андрогенной активностью может успешно связываться с рецепторами андрогенов, блокируя, что желательно, доступ к этим рецепторам естественных андрогенов, но в то же время, что нежелательно, может сам активировать рецептор в тканях, где желательно исключительно антиандрогенное действие. Известные нестероидные антиандрогены, такие как флутамид (flutamide), казодекс (casodex) и анандрон (anandron), лишены нежелательной андрогенной активности, но могут иметь низкое сродство к рецепторам по сравнению со стероидными антиандрогенами (т.е. производными андрогенов, имеющими стероидное ядро, которое модифицировано, чтобы обеспечить антиандрогенную активность). Однако стероидные антиандрогены, как полагают, более часто проявляют нежелательные агонистические свойства, чем нестероидные антиандрогены. Недавно были описаны некоторые новые нестероидные антиандрогены, обладающие длинными заместителями и имеющие лучшую активность по сравнению с вышеупомянутыми нестероидными антиандрогенами (Kawaminami et al., 2005, Kinoyama et al., 2004, Tucker etWO 01/16108, WO 01/16133, WO 02/24702, WO 2004/099188, WO 2004/111012, WO 2004/113309,WO 2005/040136. Однако стероидные антиандрогены с очень высоким сродством к рецептору андрогенов и лишенные нежелательной агонистической активности были раскрыты в заявке на патент US серийный 11/030850, основанной на предварительной заявке 60/535121. Эти соединения обладают специфическими боковыми цепями в положении 18, которые взаимодействуют со спиралью 12 молекулы рецептора андрогенов. Селективные модуляторы рецептора андрогенов (SARMs), обладающие антагонистической активностью в некоторых тканях, в то же время не проявляющие активности или агонистической активности в других тканях, были описаны в WO 02/00617, WO 2005/120483, US 2005/0033074, US 2005/0250741,US 2006/0014739, US 2006/0009529. Некоторые из этих SARMs проходят клинические испытания в отношении наращивания мышц и стимуляции роста костей (Ostarine, разработанный GTx в Соединенных Штатах), недоразвития половых желез, доброкачественной гиперплазии простаты, остеопороза и женской половой дисфункции (LGD 2226 2941, разработанный Ligand в Соединенных Штатах) или возрастного снижения (половой функции) (BMS 564929, разработанный Bristol-Myers Squibb в Соединенных Штатах).-1 016382 Таким образом, в данной области техники существует потребность в нестероидных антиандрогенах,имеющих высокое сродство к рецептору андрогенов и в то же время в значительной степени лишенных нежелательных агонистических свойств и имеющих хорошую парентеральную или пероральную биодоступность для системного применения. Раскрытие изобретения Цель настоящего изобретения - предоставить антиандрогены, имеющие хорошее сродство к рецептору андрогенов и в то же время в значительной степени лишенные андрогенной активности. Эти антиандрогены могут быть полезны в лечении и предотвращении андроген-зависимьгх болезней, как более подробно описано ниже. Цель настоящего изобретения - обеспечить соединение, которое: а) связывается с рецептором андрогенов; б) взаимодействует прямо или опосредованно со спиралью 12 рецептора андрогенов за счет цепи,достаточно узкой и длинной, чтобы пройти через канал, соединяющий активный центр связывания стероидов со спиралью 12; и в) блокирует нормальное расположение в пространстве спирали 12 после связывания агониста с рецептором андрогенов. В одном воплощении настоящее изобретение представляет соединение со следующей формулой или его соль: где пунктирная линия означает необязательную связь;R3 и R4 независимо выбраны из группы, состоящей из Н, галогена, нитрила, -СОСН 3, SO2CH3, -NO2,-ОСН 3, -SCH3, алкилсульфоксида, алкилсульфонила, алкила и галогенированного метила, где по меньшей мере один из R3 и R4 не является водородом;W1 и W2 независимо выбраны из группы, состоящей из -СН 2-, О и S;R5, R6, R7 и R8 независимо выбраны из группы, состоящей из Н и C1-C3-алкила;Y выбран из группы, состоящей из -МСН 2 СН 2-, -СН 2 МСН 2- и -СН 2 СН 2 М-; где М выбран из группы, состоящей из -О-, -S-, -SO2- и -СН 2-; Е выбран из группы, состоящей из фенилена и монозамещенного пиридила;Z1 представляет собой углеводородный фрагмент, дополнительно имеющий по меньшей мере одну карбонильную, сульфоновую или сульфоксидную группу или атом N, отделенный от Е 0-4 промежуточными атомами, причем этот атом N способен образовывать аминную, амидную, N-оксидную или четвертично-аммониевую соль;Z1 при необходимости может иметь иной чем О, S или N атом;Z2 выбран из группы, состоящей из Н, F, Cl, Br, I, циано, нитро, трифторметила, алкокси, С 1-С 5 простого или разветвленного алкила, С 2-С 5 простого или разветвленного алкенила и С 2-С 5 простого или разветвленного алкинила. В предпочтительном варианте соединение по изобретению или его фармацевтически приемлемая соль имеет следующую молекулярную формулу: где n представляет собой целое число от 1 до 3;Ra и Rb независимо выбираются из группы, состоящей из водорода, C1-C6-алкила и C2-C6-алкенила;Ra и Rb вместе могут формировать кольцо;R11 и R12 независимо выбираются из группы, состоящей из водорода и C1-C6-алкила, или R11 и R12 вместе формируют гетероцикл, необязательно имеющий другой гетероатом, выбираемый из группы, состоящей из азота, кислорода, селена, кремния и серы. Наиболее предпочтительные соединения по изобретению выбирают из группы, состоящей из Предпочтительно в соединении по изобретению Z1 находится в пара-положении по отношению к группе Y, где атом азота или серы Z1 отделены от фенилена или монозамещенного пиридильного кольца 0-4 промежуточными атомами и Z1 выбран из группы, состоящей из где Z'1 представляет собой Н, C1-C6-алкил, алкилен или арил или Z'1, конденсированный с группой Е, образует бициклический фрагмент, выбираемый из группы, состоящей из где Z'1 и Z'2 представляют собой Н, C1-C6-алкил, алкилен или арил. Предпочтительно Е представляет собой фенилен, Y представляет собой -СН 2 СН 2 О. Другими предпочтительными соединениями по изобретению являются или их фармацевтически приемлемые соли, а также соединения, имеющие молекулярную структу-5 016382 ру, выбираемую из группы, состоящей из представленных ниже структур, или их фамацевтически приемлемая соль Другая цель настоящего изобретения - предоставить фармацевтическую композицию, включающую фармацевтически приемлемый растворитель или носитель и терапевтически эффективное количество по меньшей мере одного соединения, которое: а) связывается с рецептором андрогенов; б) взаимодействует прямо или опосредованно со спиралью 12 рецептора андрогенов за счет цепи,достаточно узкой и длинной, чтобы пройти через канал, соединяющий активный центр связывания стероидов со спиралью 12; и в) блокирует нормальное расположение в пространстве спирали 12 после связывания агониста с рецептором андрогенов. В одном воплощении настоящее изобретение представляет фармацевтическую композицию, включающую в себя фармацевтически приемлемый растворитель или носитель и терапевтически эффективное количество по меньшей мере одного соединения молекулярной формулой или его соли. В другом воплощении настоящее изобретение представляет фармацевтическую композицию, включающую в себя фармацевтически приемлемый растворитель или носитель и терапевтически эффективное количество по меньшей мере одного соединения со следующей молекулярной формулой или его соли: где все обозначения, как указано выше. В другом воплощении настоящее изобретение представляет местные или системные фармацевтические композиции, содержащие соединения настоящего изобретения вместе с фармацевтически приемлемыми растворителями или носителями. В другом аспекте соединения настоящего изобретения или содержащие их фармацевтические композиции применяются в лечении или предотвращении усиливаемых андрогенами кожных болезней, таких как угревая сыпь (воспаление сальных желез), гирсутизм (избыточное оволосение), себорея, андрогенное облысение, мужская плешивость и т.п. В другом воплощении соединения настоящего изобретения применяются в лечении или предотвращении усиливаемых андрогенами системных болезней, таких как рак простаты или доброкачественная гиперплазия простаты, раннее половое созревание, поликистозный синдром яичников, гиперандрогенные синдромы и т.п. В другом воплощении способы лечения и предотвращения усиливаемых андрогенами болезней включают в себя применение соединений, раскрытых здесь, как часть комбинированной терапии, которая дополнительно использует другие активные соединения, выбираемые из группы, состоящей из ингибитора 5 редуктазы, ингибиторов 17 гидроксистероиддегидрогеназы типов 5 и 13, простаты и других ингибиторов биосинтеза андрогенов. В другом аспекте соединения настоящего изобретения, имеющие тканеспецифичную антиандрогенную активность и тканеспецифичную андрогенную активность, могут применяться для лечения или уменьшения риска развития болезней, связанных с потерей андрогенной стимуляции. Еще одна цель - предоставить селективные модуляторы рецептора андрогенов для лечения (или уменьшения вероятности возникновения) болезней, связанных с потерей андрогенной симуляции. В другом аспекте соединения настоящего изобретения применяются в изготовлении лекарств для лечения болезней, обсуждаемых здесь. Еще одна цель - предоставить фармацевтические соединения с хорошей системной биодоступностью.-6 016382 Краткое описание чертежей Фиг. 1 показывает схематическое представление принципа действия нестероидных антагонистов рецептора андрогенов настоящего изобретения. Фиг. 2 (А: вид сбоку, В: вид сверху) показывает электронную плотность вокруг молекулы ЕМ-5744. Карта 2Fo-Fc, рассчитанная с разрешением в 1,75 , показана на уровне 1. Фиг. 3 показывает электростатическую поверхность, представляющую собой полость связывания лиганда в структуре комплекса hAR(LBD)-EM-5744. Фиг. 4 показывает взаимодействия антагониста ЕМ-7105 с аминокислотными остатками полости связывания лиганда в структуре комплекса hAR (LBD)-EM-7105. Фиг. 5 показывает взаимодействия боковой цепи антагониста ЕМ-7105 со спиралью 12 рецептора андрогенов. Фиг. 6 показывает электростатическую поверхность, представляющую собой канал, соединяющий полость связывания лиганда и участок, занятый спиралью 12 в структуре комплекса hAR (LBD)-EM7105. Взаимодействие атома азота боковой цепи ЕМ-7105 с остатком глутамина 709 подчеркнуто. Можно видеть, что расположение спирали 12 заблокировано концом боковой цепи. Осуществление предпочтительных воплощений Предыдущие структурные исследования кристаллического комплекса hER (LBD)-ралоксифен выявили структурную основу механизма антагонизма ралоксифена. Тогда было показано, что антагонист связывается на том же самом участке, где связывается агонист, в пределах ядра LBD, но эти два лиганда демонстрируют различные типы связывания. Действительно, каждый класс лигандов индуцирует различные конформации в трансактивационном домене, которые характеризуются различным расположением спирали 12. Работа по молекулярному моделированию, основанная на кристаллографической структуре комплекса hAR (LBD)-R1881 (см. Ishioka et al. Novel Non-Steroidal/Non-Anilide Type AndrogenAntagonists with Isoxazolone Moiety, BioorganicMedicinal Chemistry 10 (2002) 1555-1566; Muddana et al. 11-alkyl-9-19-Nortestosterone Derivatives: High-Affinity Ligands and Potent Partial Agonists of the Androgen Receptor, J. Med, Chem. 2004, 47, 4985-4988), выявила наличие узкого канала между участком связывания стероида и участком, занятым спиралью 12. Обнаружено, что этот узкий канал, главным образом сформированный боковыми цепями 5 остатков (Asn705, Trp741, Met742, Thr877 и Phe891) рецептора андрогенов, может принять боковую цепь, только если она присоединена к углероду 18 стероидного ядра андрогена. Из этого положения стероидного ядра тонкая боковая цепь, проходящая через это отверстие, может достигнуть поверхности рецептора и нарушить расположение спирали 12. С привлечением нестероидных соединений обнаружено, что соединения с ядром, которые способны связываться с некоторыми аминокислотными остатками активного центра связывания стероидов в hAR (LBD) и которые имеют боковую цепь в правильном положении, чтобы быть в состоянии пройти через вышеназванный обнаруженный канал, могут быть хорошими кандидатами на роль хорошего антагониста рецептора андрогенов человека.hER (LBD) и hAR (LBD) обозначают лигандсвязывающий домен рецептора эстрогенов типачеловека и лигандсвязывающий домен рецептора андрогенов человека соответственно. Наше изобретение основано на описанном выше открытии и предоставляет соединения и фармацевтические композиции, содержащие такие соединения. Соответственно этому соединения, которые способны связываться с рецептором андрогенов и которые обладают цепью, достаточно узкой и длинной, чтобы пройти через этот вышеназванный канал, должны взаимодействовать со спиралью 12 и блокировать ее нормальное расположение, т.е. должны быть хорошими антагонистами. Все заявленные здесь предпочтения могут применяться в комбинации. Например, предпочитаемые заместители в любом положении описанных молекулярных структур могут применяться с предпочитаемыми заместителями в любом другом положении. Многие соединения с длинными заместителями были синтезированы в нашей лаборатории и протестированы на их способность связывать рецептор андрогенов и ингибировать DHT-стимулируемый рост андроген-чувствительных клеток карциномы молочной железы мышей линии Shionogi. В большинстве случаев эти молекулы связывают рецептор с высоким сродством, но остаются сильными агонистами. Однако мы также получили много очень сильных антагонистов, имеющих высокое сродство к рецептору, что говорит о том, что структура боковой цепи имеет основное значение. Чтобы понять молекулярную основу агонистических и антагонистических свойств этих различных молекул и убедится в том, что боковая цепь, расположенная в соответствии с предсказаниями, действительно в состоянии пройти через канал и достигнуть спираль 12, попытались закристаллизовать некоторые из этих молекул (андрогены и антиандрогены) в комплексе с лигандсвязывающим доменом рецептора андрогенов человека (hAR(LBD,чтобы определить и сравнить трехмерные структуры этих комплексов. В настоящий момент получили полную структуру для одного из них (hAR (LBD)-EM-5744), определенную с разрешением в 1,75. ЕМ-5744 представляет собой лиганд на основе DHT, обладающий высоким сродством к рецептору андрогенов человека, несмотря на его длинный заместитель в виде боковой цепи, прикрепленной к атому углерода в положении 18 (см. показанную ниже структуру). Действительно, лиганд ЕМ-5744 связывается с относительным сродством 540 к hAR дикого типа по сравнению со значением 180 для DHT и 100 дляR1881. Этот лиганд может рассматриваться как агонист, так как он не в состоянии замедлить DHTстимулируемый рост клеток Shionogi при добавлении к культуральной среде при концентрации 10-6 М и обладает значительной агонистической активностью при 10-7 М. Как показано на фиг. 2 и 3, в кристаллографической структуре, которая была определена, ядро стероида ЕМ-5744 расположено внутри полости связывания лиганда и имеется в общей сложности 18 аминокислотных остатков в hAR LBD, которые взаимодействуют со связанным лигандом (d3,9 ). Большинство из этих остатков являются гидрофобными и взаимодействует, главным образом, со стероидным каркасом, тогда как некоторые являются полярными и могут формировать водородные связи с полярными атомами молекулы лиганда. Атом кислорода (0-3) из А кольцевой группы карбонила формирует водородную связь с Arg752 (2,9 до Arg752 N2). Есть также молекула воды около 0-3 (3,2 ), которая связана водородными связями с двумя другими остатками (Arg752 N2 и Met745 О). 17 гидроксильная группа ЕМ-5744 формирует водородные связи с ASN705 О 1 (2,8 ) и Thr877 О (2,8 ), она имеет такое же расположение, которое наблюдается в структуре комплекса hAR(LBD)-R1881. Наконец, боковая цепь С-18 также хорошо стабилизирована, главным образом, многочисленными контактами с гидрофобными остатками и, как и предсказано, выходит из связывающего стероид кармана через канал. Однако боковая цепь ЕМ-5744 не расположена достаточно хорошо, чтобы достигнуть полости, занятой спиралью 12, и,следовательно, не может нарушить ее расположение. Это наблюдение очень хорошо объясняет, почему это соединение действует как агонист, несмотря на наличие его крупной боковой цепи С-18. Интересно,что неожиданное взаимодействие наблюдалось между одним из атомов фтора в удаленной части боковой цепи ЕМ-5744 и атомом N2 остатка His874. В это взаимодействие также может быть вовлечена молекула воды, обнаруженная в непосредственной близости от этих двух атомов. Это взаимодействие, вероятно,объясняет более высокое сродство ЕМ-5744 к hAR по сравнению с DHT или R1881, которые не имеют этой третьей связи с рецептором. Для того чтобы расположить заместитель С-18 ЕМ-5744 подобным образом, боковая цепь остатка Trp741, остатка, формирующего канал, поворачивается на 180 вокруг его C и принимает конформацию, которая очень отличается от наблюдаемой для того же самого остатка в структуре комплекса hAR(LBD)-R1881. Другие остатки, формирующие полость лиганда, также принимают различные конформации, что, возможно, является следствием движения боковой цепи Trp741. Данные наблюдения иллюстрируют замечательную пластичность обоих - связывающей лиганд полости и узкого канала, через который боковая цепь С-18 ЕМ-5744 выходит из кармана. Как представлено на фиг. 1, связывание рецепторов андрогенов с настоящими соединениями может изменить связывание коактиваторов и корепрессоров с рецептором андрогенов, таким образом, приводя к ускоренному апоптозу в андроген-чувствительных тканях. Антиандрогены могут даже приводить к смерти клеток. Фиг. 4-6 показывают моделирование комплекса hAR(LBD)-EM-7105, где ЕМ-7105 является нестероидным антиандрогеном настоящего изобретения. Ядро ЕМ-7105 расположено в пределах лигандсвязывающей полости, как показано на фиг. 4. Большинство остатков hAR(LBD) в этой области являются гидрофобными и взаимодействуют главным образом с ядром молекулы, присоединенным через D, способным связываться с активным центром связывания стероидов рецептора андрогенов, тогда как азот на боковой цепи может формировать водородную связь с полярными атомами остатка глютамина 709. На фиг. 5 и 6 можно видеть, что перемещение спирали 12 заблокировано, когда возникает эта водородная связь. Антиандрогены настоящего изобретения и фармацевтические композиции, содержащие их, могут применяться в соответствии с настоящим изобретением в лечении андроген-чувствительных болезней, в развитие которых вносит свой вклад активация рецепторов андрогенов. Болезни включают, но ими не ограничиваются, рак простаты, доброкачественную гиперплазию простаты, угревую сыпь, себорею, гирсутизм, андрогенное облысение, мужскую плешивость, раннее половое созревание, поликистозный синдром яичников и т.п. При определенных условиях (например, при определенных концентрациях) соединения настоящего изобретения и содержащие их фармацевтические композиции могут быть андрогенными и могут применяться в соответствии с настоящим изобретением для предотвращения и лечения болезней, в отношении которых андрогены являются полезными, таких как мускульная атрофия, накопление брюшного жира,атрофия кожи, анемия, потеря костной массы, остеопороз, атеросклероз, сердечно-сосудистые заболевания, диабет типа 2, потеря энергии или хорошего самочувствия.-8 016382 Предпочтительно, чтобы ядро выбиралось из следующих остатков: где пунктирные линии представляют собой необязательные связи;R3 и R4 независимо выбираются из группы, состоящей из водорода, галогена, нитрила, -СОСН 3,-SO2CH3, -NO2, -ОСН 3, -SCH3, метила и галогенированного метила; по меньшей мере один из R3 и R4 представляет собой не водород;R9 и R10 независимо выбираются из группы, состоящей из водорода, гидроксила, галогена и метила;-СН 2 СН 2 О-. Предпочтительно, чтобы Е выбирался из группы, состоящей из фенилена и однозамещенного пиридила, и где Z1 расположен в пара-положении относительно группы Y, и атом азота Z1 отделен от фенилена или однозамещенного кольца пиридила одним из вставочных атомов, более предпочтительно, чтобыZ1 выбирался из следующих остатков: где Z'1 и Z'2 независимо представляют собой водород, низший C1-C6-алкил, алкилен или арил. Наиболее предпочтительными являются соединения, имеющие молекулярную структуру, выбираемую из группы, состоящей из представленных ниже структур, или их соли, и включающие их фармацевтические композиции В некоторых воплощениях предпочтительно, чтобы R11 или R12 представляли собой циклопентил,циклогексил или радикал циклогептила. В некоторых воплощениях предпочтительно, чтобы Ra и Rb независимо выбирались из группы, состоящей из водорода, метила и этила. Предпочтительно, чтобы Z2 выбирался из группы, состоящей из водорода, фтора, хлора и цианида. Предпочтительно, чтобы n равнялось 3. В предпочтительных воплощениях два или предпочтительно более из описываемых здесь предпочтительных соединений применяются в комбинации. Антиандрогены настоящего изобретения предпочтительно приготавливаются вместе с фармацевтически приемлемыми растворителями, наполнителями или носителями (включая капсулы) в виде фармацевтических композиций при обычных концентрациях антиандрогенов для антиандрогенов, применяемых в предшествующей области техники. Принимая во внимание более высокую эффективность соединений настоящего изобретения, практикующий клиницист может предпочесть изменять концентрацию и/или дозировку, чтобы приспособить дозу к специфической реакции каждого пациента. Предпочтительно практикующий клиницист будет, особенно в начале лечения, контролировать полностью все реакции индивидуального пациента и уровни антиандрогенов в сыворотке (по сравнению с предпочтительными концентрациями в сыворотке, обсужденными ниже) и контролировать полностью все реакции пациента на лечение, регулируя дозировки по мере необходимости, если метаболизм данных пациентов или реакция на лечение нетипичны. Как обсуждается более подробно ниже, носители, наполнители или растворители включают в себя твердые вещества и жидкости. Консервант (например, бензиловый спирт), признанный в данной области техники, типично включается, если композиция готовится не для немедленного применения. Новые фармацевтические композиции настоящего изобретения могут применяться в лечении андроген-зависимых болезней или уменьшать вероятность возникновения таких болезней. При системном введении (например, для лечения рака простаты, доброкачественной гиперплазии простаты,раннего полового созревания, поликистозного синдрома яичников и других болезней, не затрагивающих в первую очередь кожу) применяются обычные растворители или носители, которые, как известно в данной области техники, являются фармацевтически приемлемыми для системного применения, например солевой раствор, вода, водный этанол, масло и т.д. Носитель часто представляет собой смесь компонентов. Когда разрабатывается рецептура для системного применения, антиандрогены могут быть подготовлены к введению обычными способами, такими как перорально или инъекцией. Антиандроген может быть введен, например, перорально. Соединения настоящего изобретения могут быть приготовлены с обычными фармацевтическими наполнителями, (например высушенная распылением лактоза и стеарат магния) в виде таблеток или капсул для перорального введения. Конечно, могут быть добавлены улучшающие вкус вещества в случае форм для перорального введения. Когда желательны капсулы для перо- 10016382 рального проглатывания, любые фармацевтические капсулы, известные в данной области техники, могут быть заполнены активными компонентами настоящего изобретения, с применением или без применения обсуждаемых здесь дополнительных растворителей и других добавок. Активное вещество может быть переработано в таблетки или ядра драже, будучи смешанным с твердыми, порошковидными веществами носителя, такими как лимонно-кислый натрий, карбонат кальция или дикальцийфосфат, и связующими веществами, такими как поливинилпирролидон, желатин или производные целлюлозы, возможно с добавлением также смазывающих веществ, таких как стеарат магния, лаурилсульфат натрия, "Carbowax" или полиэтиленгликоль. Как дополнительные формы можно применять прессованные капсулы, например, из твердого желатина, так же как закрытые капсулы из мягкого желатина, включающие смягчитель или пластификатор,например глицерин. Прессованные капсулы содержат активное вещество предпочтительно в форме гранулята, например, в смеси с наполнителями, такими как лактоза, сахароза, маннитол, крахмалы, такие как картофельный крахмал или амилопектин, производные целлюлозы или высокодисперсные кремниевые кислоты. В мягких желатиновых капсулах активное вещество предпочтительно растворено или суспендировано в подходящих жидкостях, таких как растительные масла или жидкие полиэтиленгликоли. Может применяться сухая система доставки, как описано в US 3742951, 3797494 или 4568343. Альтернативно, активный компонент может быть помещен в трансдермальный пластырь, имеющий известные в данной области техники структуры, например, такие структуры, как описано в ЕР 0279982. Растворители или устройства, как описано в US 5064654, 5071644 или 5071657, могут также применяться, чтобы облегчить трансдермальное проникновение, когда желательны системные эффекты. При применении для лечения системных болезней участок аппликации на коже должен периодически меняться, чтобы избежать избыточной локальной концентрации антиандрогенов. В некоторых воплощениях антиандрогены настоящего изобретения применяются для лечения связанных с андрогенами болезней кожи, таких как угревая сыпь, себорея, гирсутизм, андрогенное облысение и мужская плешивость. При применении для любой из этих целей антиандрогены предпочтительно вводятся местно вместе с обычным местным носителем или растворителем. При местном применении предпочтительно, чтобы растворитель или носитель не поддерживали трансдермальное проникновение активных компонентов в кровоток или другие ткани, где они могли бы вызвать нежелательные системные эффекты. Когда соединение вводится в переносчике или растворителе для кожного или местного применения,переносчик или растворитель могут быть выбраны из любого известного в косметических и медицинских областях техники, например, может применяться любой гель, крем, лосьон, мазь, жидкий или не жидкий носитель, эмульгатор, растворитель, жидкий растворитель или другой подобный носитель, который не проявляет вредного действия на кожу или другую живую ткань животного. Носитель или растворитель обычно представляют собой смесь нескольких компонентов, включающих, но ими не ограничивающихся, жидкие спирты, жидкие гликоли, жидкие полиалкиленгликоли, воду, жидкие амиды, жидкие эфиры, жидкий ланолин, производные ланолина и подобные материалы. Спирты включают в себя моно и многоатомные спирты, включая этанол, глицерин, сорбитол, изопропиловый спирт, диэтиленгликоль,пропиленгликоль, этиленгликоль, гексиленгликоль, маннитол и метоксиэтанол. Типичные носители могут также включать в себя эфиры, например диэтиловый и дипропиловый эфир, метоксиполиоксиэтилены, карбовоска, полиэтиленглицеролы, полиоксиэтилены и сорбитолы. Обычно, носитель для местного применения включает в себя и воду, и спирт, чтобы максимизировать гидрофильную и липофильную растворимость, например смесь этанола или изопропилового спирта с водой. Носитель для местного применения может также включать в себя различные другие компоненты,обычно применяемые в мазях и лосьонах и хорошо известные в косметических и медицинских областях техники. Могут присутствовать, например, ароматизаторы, антиоксиданты, парфюмерные вещества, желирующие агенты, загустители, такие как карбоксиметилцеллюлоза, сурфактанты, стабилизаторы, смягчители, красители и другие подобные вещества. Концентрация активного компонента в мази, креме, геле или лосьоне типично составляет от приблизительно 0,1 до 20%, предпочтительно между 0,5 и 5% и наиболее предпочтительно 2% (по весу относительно общей массы лосьона, крема, геля или мази). В пределах предпочтительных диапазонов более высокие концентрации позволяют достигать подходящей дозировки, если применять лосьон, мазь,гель или крем в меньшем количестве или с меньшей частотой. Несколько неограничивающих примеров, приведенных ниже, описывают приготовление типичного лосьона и геля соответственно. В дополнение к наполнителям любой специалист в данной области техники может выбрать другие наполнители, чтобы приспособиться к определенным дерматологическим потребностям. Когда антиандрогены вводятся системно, они предпочтительно вводятся перорально или парентерально. Естественно, местное введение предпочтительно, когда целевым участком применения является кожа. Концентрация активных антиандрогенов варьирует в известной степени в зависимости от способа введения фармацевтической композиции. Композиция, пригодная для перорального введения, может- 11016382 предпочтительно включать в себя по меньшей мере один антиандроген, где общая концентрация всех таких антиандрогенов в названной фармацевтической композиции составляет приблизительно от 1 до 95% композиции (по весу) и предпочтительно от приблизительно 5 до приблизительно 20%. Общая суммарная дозировка всех антиандрогенов, если используется комбинация антиандрогенов, должна быть равной диапазону дозировки, названному выше. Уровень антиандрогенов в крови представляет собой предпочтительный критерий адекватной дозировки, который учитывает индивидуальные вариации в поглощении и метаболизме. При приготовлении для парентеральной инъекции антиандрогены предпочтительно добавляют при концентрации между приблизительно 0,1 и приблизительно 100 мг/мл (предпочтительно от приблизительно 2,5 до приблизительно 25 мг/мл). Когда желательна системная активность, необходимо только, чтобы антиандрогены вводились тем способом и в той дозировке, которые достаточны для достижения желательных уровней концентрации в сыворотке крови. Концентрация антиандрогенов в сыворотке должна обычно поддерживаться между 0,1 и 1000 мкг/л, предпочтительно между 50 и 1000 мкг/л и наиболее предпочтительно между 50 и 500 мкг/л. Адекватные уровни в сыворотке могут также определяться исходя из реакции пациента на лечение. Для типичных пациентов подходящая дозировка антиандрогенов для достижения желательной концентрации в сыворотке находится между 10 и 2000 мг активного компонента в день на 50 кг массы тела при пероральном введении. При введении инъекцией рекомендуется приблизительно от 2 до 1500 мг в день на 50 кг массы тела, предпочтительно от 5 до 100. Для местного применения лосьон, мазь, гель или крем должны быть полностью втерты в кожу так,чтобы никакой излишек не был явно заметен, и кожу предпочтительно не мыть в этой области в течение по меньшей мере 30 мин. Примененное количество должно обеспечить поступление по меньшей мере 0,02 мг антиандрогена на 1 см 2 (предпочтительно от 0,1 до 1 мг/см 2) за одно применение. Желательно наносить композицию для местного применения на обрабатываемую область от 1 до 6 раз в день, например, 3 раза в день с приблизительно равными интервалами. В некоторых воплощениях настоящего изобретения антиандрогены настоящего изобретения применяются в комбинации с другим активным компонентом как часть комбинированной терапии. Например, новый антиандроген может быть применен вместе с взятыми по отдельности ингибитором 5 редуктазы, ингибитором 17-гидроксистероиддегидрогеназы типа 5 или типа 3 или ингибитором 1 короткоцепочечной дегидрогеназы редуктазы простаты, который может быть включен в ту же самую фармацевтическую композицию, что и антиандроген, или который можно вводить отдельно. Таким образом,комбинированная терапия может включать в себя лечение с одним или более соединениями, которые ингибируют продукцию дигидротестостерона или его предшественников. В некоторых предпочтительных воплощениях настоящего изобретения фармацевтическая композиция для местного применения дополнительно включает в себя ингибитор активности 5-редуктазы стероидов. Один такой ингибитор("Propecia или Proscar") является коммерчески доступным от Merck Sharp и Dohme. Другой ингибитор"Dutasteride", который ингибирует оба кофермента 5-редуктазы, был зарегистрирован GlaxoSmithKline. Ингибиторы 17-гидроксистероиддегидрогеназы типа 5 (в особенности соединение ЕМ-1404) раскрыты в международной публикации WO 99/46279. Соединение ЕМ-1792, один из нгибиторов 17 гидроксистероиддегидрогеназы типа 13, описан в WO 2005/000011. Когда в комбинированной терапии в соответствии с настоящим изобретением, описанным здесь,применяются ингибиторы 5-редуктазы, пероральная дозировка составляет предпочтительно между 0,1 и 100 мг в день на 50 кг массы тела, более предпочтительно между 0,5 и 10 мг/день, например 5,0 мг в день финастерида. Когда в комбинированной терапии в соответствии с настоящим изобретением, описанным здесь,применяются ингибиторы 17-гидроксистероиддегидрогеназы типа 5, пероральная дозировка составляет предпочтительно между 5 и 500 мг в день на 50 кг массы тела, более предпочтительно между 10 и 400 мг/день, например 300 мг в день ЕМ-1404. Когда в комбинированной терапии в соответствии с настоящим изобретением, описанным здесь,применяются ингибиторы 17-гидроксистероиддегидрогеназы типа 5 или типа 13, пероральная дозировка составляет предпочтительно между 10 и 1000 мг в день на 50 кг массы тела, более предпочтительно между 25 и 1000 мг/день, например 200 мг в день ЕМ-1404 или ЕМ-2881. Пациентом, которому необходимо лечение или снижение риска возникновения данной болезни, является тот, кому поставили диагноз такой болезни или тот, кто восприимчив к возникновению такой болезни. Настоящее изобретение особенно полезно для индивидуумов, которые из-за наследственности,экологических факторов или других признанных факторов риска подвержены большему по сравнению с остальным населением риску возникновения состояний, к которым имеет отношение настоящее изобретение. Кроме тех случаев, где заявлено иначе, предпочтительная дозировка активных соединений настоящего изобретения идентична и для терапевтических, и для профилактических целей. Дозировка для каждого активного компонента, обсужденного здесь, является такой же, независимо от болезни, которую- 12016382 лечат (или предупреждают). Где обсуждаются два или более разных активных агента как часть комбинированной терапии (например, ингибитор фермента и антиандроген), предпочтительно вводится совокупность различных соединений, скорее чем одно соединение, обладающее множественными активностями. Кроме тех мест, где обозначено иначе, термин "соединение" и любая ассоциированная с ним молекулярная структура могут включать в себя любой их возможный стереоизомер, в форме рацемической смеси или в оптически активной форме. Кроме тех мест, где отмечено иначе или где очевидно из контекста, указанные дозировки касаются веса активных соединений без учета фармацевтических наполнителей, растворителей, носителей или других компонентов, хотя включение таких дополнительных компонентов является желательным, как показано в приведенных здесь примерах. Любая лекарственная форма (капсула, таблетка, инъекция или т.п.), обычно применяемая в фармацевтической промышленности, является пригодной для применения здесь, и термины "наполнитель", "растворитель" или "носитель" включают в себя такие неактивные компоненты, которые включаются обычно в промышленности, вместе с активными компонентами в такие лекарственные формы. Все активные компоненты, применяемые в любом из обсуждаемых здесь комбинированных способов лечения, могут быть приготовлены в виде фармацевтических композиций, которые также включают в себя один или более других активных компонентов. Альтернативно этому, их можно вводить каждый по отдельности, но достаточно синхронизированно во времени так, чтобы у пациента в конечном счете поднялись их уровни в крови, или иным способом одновременно достигалось полезное действие каждого из активных компонентов (или стратегий). В некоторых предпочтительных воплощениях настоящего изобретения, например, один или более активных компонентов должны включаться в одну фармацевтическую композицию. В других воплощениях настоящего изобретения предоставлен набор, который включает в себя по меньшей мере два отдельных контейнера, где по меньшей мере один контейнер отличается от другого контейнера по составу содержащихся в нем активных компонентов. Два или больше различных контейнеров применяются в комбинированных способах лечения настоящего изобретения. Также обсуждаемые здесь комбинированные способы лечения включают в себя применение одного активного компонента из комбинации при изготовлении лекарства для лечения (или предупреждения) рассматриваемой болезни, где лечение или предупреждение дополнительно включают в себя другой активный компонент или стратегию из предлагаемой комбинации. Например, в терапии рака простаты могут применяться агонист LHRH или антагонист или ингибитор 17-гидроксистероиддегидрогеназы типа 3. Предпочтительные соединения. Ниже в таблицах представлены списки предпочтительных соединений, их свойства и эффективность. Табл. 1 и 2 включают в себя только определение андрогенной/антиандрогенной активности in vitro с использованием клеток карциномы молочной железы мышей линии Shionogi и определение связывания с рецептором андрогенов человека в трансфецированных клетках и данные определения антиандрогенной активности in vivo у крыс. Детальные объяснения того, как данные были получены и представлены,следуют за таблицами. Таблица 1 Подписи к табл. 1 и 2. В колонке 1 приведено лабораторное название антиандрогенов. В колонке 2 показана молекулярная структура антиандрогенов. Колонка 3 представляет дозу (выраженную в нМ), которая ингибирует на 50% (IC50) число клетокDHT-стимулируемой карциномы молочной железы мышей линии Shionogi. Более низкие значения являются предпочтительными. Колонка 4 представляет относительное сродство связывания (RBA) антиандрогена, выраженное как процент (%), с рецептором андрогенов человека в трансфецированных клетках, по отношению к R1881,которое рассчитано по формуле Более высокие значения являются предпочтительными. Колонка 5 представляет % эффективности антиандрогена в простате крысы, выраженной в процентах ингибирования: где процент ингибирования (% inhib) рассчитывается по следующей формуле:W представляет собой вес простаты. Более высокие значения являются предпочтительными. Колонка 6 представляет собой % антиандрогенной эффективности в семенном пузырьке крысы, выраженной в процентах ингибирования: где процент ингибирования (% inhib) рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более высокие значения являются предпочтительными. Колонка 7 представляет % эффективности антиандрогена в заднем поднимающем мускуле (levatorani muscle) крысы, выраженной в процентах ингибирования: где процент ингибирования (% inhib) рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более высокие значения являются предпочтительными. Подписи к табл. 3. В колонке 1 приведены молекулярная структура и лабораторное название антиандрогенов. В колонке 2 представлена доза (выраженная в нМ), которая ингибирует на 50% (IC50) число клетокDHT-стимулируемой карциномы молочной железы мышей линии Shionogi. Когда соединение стимулирует клетки карциномы молочной железы мышей линии Shionogi, используется термин "Агонист". Более низкие значения являются предпочтительными. Колонка 3 представляет относительное связывающее сродство (RBA) антиандрогена с рецептором андрогенов человека в трансфецированных клетках, выраженное как процент (%), по отношению кR1881, которое рассчитано по формуле: Более высокие значения являются предпочтительными. Колонка 4 представляет % эффективности антиандрогена в простате крысы, выраженной в процен- 22016382 тах ингибирования: где процент ингибирования рассчитывается по следующей формуле:W представляет собой вес простаты. Более высокие значения являются предпочтительными. Колонка 5 представляет % эффективности антиандрогена в семенном пузырьке крысы, выраженной в процентах ингибирования: где процент ингибирования рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более высокие значения являются предпочтительными. Колонка 6 представляет % эффективности антиандрогена в заднем поднимающем мускуле (levatorani muscle) крысы, выраженной в процентах ингибирования: где процент ингибирования рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более низкие значения являются предпочтительными. Колонка 7 представляет % эффективности андрогена в простате крысы, выраженной в процентах стимуляции: где процент стимуляции рассчитывается по следующей формуле:W представляет собой вес простаты. Более низкие значения являются предпочтительными. Колонка 8 представляет % эффективности андрогена в семенном пузырьке крысы, выраженной в процентах стимуляции: где процент стимуляции рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более низкие значения являются предпочтительными. Колонка 9 представляет % эффективности андрогена в заднем поднимающем мускуле (levator animuscle) крысы, выраженной в процентах стимуляции: где процент стимуляции рассчитывается по следующей формуле:W представляет собой вес семенного пузырька. Более высокие значения являются предпочтительными. Таблица 4 Подписи к табл. 4. В колонке 1 приведено лабораторное название антиандрогена. В колонке 2 приведена молекулярная структура антиандрогена. Колонка 3 представляет дозу (выраженную в нМ), которая ингибирует на 50% (IC50) число клетокDHT-стимулируемой карциномы молочной железы мышей линии Shionogi. Более низкие значения являются предпочтительными. Колонка 4 представляет относительное сродство связывания (RBA) антиандрогена с рецептором андрогенов человека в трансфецированных клетках, выраженное как процент (%), по отношению кR1881, которое рассчитано по формуле- 23016382 Более высокие значения являются предпочтительными. Колонка 5 представляет процент ингибирования площади сальных желез левого уха обрабатываемых животных по сравнению с площадью сальных желез левого уха контрольных животных. Доза в 3 мкг в день исследуемого соединения, растворенного в 10 мкл раствора этанол:пропиленгликоль (1:1; по объему), наносилась в течение 14 дней на область между двумя хрящевыми выступами вентральной поверхности левой ушной раковины. Эффективность предпочтительных ингибиторов. А. Анализ андрогенной/антиандрогенной активности антиандрогенов in vitro. Андрогенную/антиандрогенную активность предпочтительных соединений измеряли с использованием клеток карциномы молочной железы мышей линии Shionogi (Shionogi mouse mammary carcinomacells). 1. Материалы. Базовая минимальная среда для культивирования клеток (MEM), заменимые аминокислоты и фетальная сыворотка теленка были куплены у Flow Laboratories. Для удаления эндогенных стероидов среду инкубировали в течение ночи при 4 С в присутствии 1% активированного угля (Norit A, Fisher) и 0,1% Декстрана Т-70 (Pharmacia). Дополнительно проводили адсорбцию в течение 2 ч при 25 С для удаления связанных с белками стероидов. Сыворотку также инактивировали с помощью 20 мин инкубации при 56 С. 5-Дигидротестостерон (DHT) был получен от Steraloids. Антиандроген гидпроксифлутамид(OH-FLU) был любезно предоставлен докторами T.L. Nagabuschan и R. Neri (Schering Corporation,Kenilworth, U S.A.). 2. Дисперсия, культура и клонирование клеток. Самцы мышей линии Shionogi, имеющей андроген-чувствительные опухоли молочной железы, были получены от докторов Keishi Matsumoto (Osaka, Japan) и Yvonne Lefebvre (Ottawa, Canada). Для получения первичной культуры опухоли вырезали и промывали в ледяном стерильном растворе 25 мМ буфера Hepes (137 мМ NaCl; 5 мМ KCl, 0,7 мМ Na2HPO4; 10 мМ глюкоза, рН 7,2). После измельчения ножницами опухоли подвергали перевариванию в течение 2 ч при 37 С в буфере Hepes, содержащем 3,8 мг/мл коллагеназы (Clostridium, Boehrmger), 1,5 мг/мл гиалуронидазы II (Sigma) и 3% бычьего сывороточного альбумина (фракция V, Schwartz-Mann). Диспергированные клетки собирали центрифугированием(500g в течение 10 мин), дважды промывали, суспендируя их в минимальной среде роста (MEM), содержащей 5% фетальной сыворотки теленка, обработанной активированным углем, покрытым декстраном (DCC-FCS), 1% заменимых аминокислот, 10 IU/мг пенициллина, 50 мкг/мл стрептомицина и 100 нМ дигидротестостерона (DHT) (Steraloids). Клетки засевали в ту же среду при плотности 75000 клеток/мл в 75 см 2 колбы и выращивали в атмосфере 5% углекислого газа в воздухе при 37 С. Среда заменялась каждую неделю. Антиандрогены растворяли в этаноле и хранили в виде концентрированных растворов, подобранных таким образом, чтобы конечная концентрация этанола в культуральной среде была меньше 0,01%. Такая концентрация этанола не влияла на рост клеток. Клетки субкультивировали на стадии почти полного слияния посредством мягкого переваривания в 0,1% растворе панкреатина (Flow Laboratories) в буфере Hepes, содержащем 3 мМ этилендиаминтетрауксусной кислоты (EDTA) (рН 7,2). Клетки осаждали центрифугированием, ресуспендировали в среде культивирования, подсчитывали количество клеток на счетчике Coulter counter и повторно засевали, как описано выше. Клонирование на мягком агаре проводили, как описано в работе Stanley et al., Cell 10:35-44,1977 в присутствии 100 нМ DHT. 3. Измерение роста клеток. Клетки засевали в 24-луночные планшеты при плотности 20 000 клеток/лунку. Указанные увеличивающиеся концентрации исследуемых агентов добавляли в трех повторах и клетки растили в течение 1012 дней со сменой среды каждые 3-4 дня. Число клеток определяли прямым подсчетом на счетчикеCoulter counter. 4. Расчеты и статистический анализ. Значения IC50 антиандрогенов рассчитывали согласно регрессии по методу наименьших квадратов,как описано Rodbard, Endocrinology. Статистическую достоверность рассчитывали согласно многофакторному тесту Крамера (Kramer multiple-range test). В. Измерение рецептора андрогенов (AR). 1. Приготовление ткани. Приготовление клеток почек эмбрионов человека (Human Embryonic Kidney, HEK-293), трансфецированных рецептором андрогенов человека (Human Androgen Receptor, hAR). Клетки культивировали в 6-луночных флаконах (Falcon flasks) до приблизительно 3105 клеток/лунку в среде Игла, модифицированной Дульбекко (Dulbecco's modified Eagle's medium, DMEM), в которую добавляли 10% фетальную сыворотку теленка, при 37 С во влажной атмосфере 95% воздуха и 5% CO2. Для трансфекции использовали 5 мкг плазмиды pCMVneo-hAR, трансфекцию осуществляли, используя набор для трансфекции с- 24016382 липофектином (Life Technologies, Ontario, Canada). После 6 ч инкубации при 37 С среду для трансфекции удаляли и добавляли 2 мл среды DMEM. Клетки дополнительно культивировали в течение 48 ч и затем переносили на чашки Петри диаметром 10 см и культивировали их в DMEM, содержащей 700 мкг/мл G418, для того, чтобы ингибировать рост нетрансфецированных клеток. Среду, содержащую G-418, меняли каждые два дня до появления колоний устойчивых клеток. Позитивные клоны отбирали, используя метод PCR. Клетки HEK-293, трансфецированные hAR, размножали и замораживали для дальнейшего использования для определения связывания. Получение препарата цитозоля клеток HEK-293, экспрессирующих hAR. Утром в день определения связывания осадок клеток HEK-293 hAR размораживали и суспендировали в буфере А (25 мМ Tris-HCl,1,5 мМ динатриевой соли ЭДТА, 10 мМ -монотиоглицерол, 10% глицерол и 10 мМ молибдат натрия,рН 7,4; 625000 клеток/0,1 мл). Суспензию клеток обрабатывали ультразвуком три раза по 30 с (с перерывами для охлаждения) и затем центрифугировали при 105000g в течение 90 мин. 2. Измерения рецептора андрогенов. Связывание андрогенов измеряли, используя определение с гидроксилаппатитом (НАР). Кратко,солюбилизированный в этаноле радиоактивный стероид [3H]R1881 разбавляли буфером В (10 мМ TrisHCl, 1,5 мМ динатриевой соли ЭДТА, 10 мМ -монотиоглицерол, рН 7,4). Затем аликвоты препарата цитозоля клеток (0,1 мл) инкубировали с 5 нМ [3H]R1881 (0,1 мл, 100000 расп./мин) в присутствии или в отсутствие указанных концентраций немеченых соединений (0,1 мл, приготовлены в буфере В, содержащем 30% этанола) в течение 16-18 ч при 0-4 С. Триамцинолон ацетонид (ТАС; 100 нМ) добавляли для маскировки рецепторов прогестерона. Несвязавшиеся стероиды отделяли посредством инкубации в течение 40 мин при 0-4 С с 0,3 мл НАР, приготовленным в буфере Р (50 мМ Tris-HCl, 10 мМ KH2PO4, рН 7,4). После инкубации с НАР и центрифугирования в течение 10 мин при 1000g осадок 3 раза промывали 1 мл буфера Р. После этого радиоактивность экстрагировали из осадка посредством инкубации с 1 мл этанола при комнатной температуре в течение 60 мин. После центрифугирования супернатант сливали в сцинтилляционный флакон и осадок снова экстрагировали этанолом. После добавления сцинтилляционной жидкости измеряли радиоактивность в жидкостном сцинтилляционном счетчике. 3. Расчеты и статистический анализ. Значения IC50 антиандрогенов рассчитывали согласно регрессии по методу наименьших квадратов,как описано Rodbard, Endocrinology. Статистическую достоверность рассчитывали согласно многофакторному тесту Крамера (Kramer multiple-range test). Относительное сродство связывания (Relative BindingAffinity, RBA) антиандрогена в процентах относительно R1881 рассчитывали по формуле: С. Системная антиандрогенная/андрогенная активность (неполовозрелые самцы крыс). 1. Животные. Неполовозрелые самцы крыс (Crl:CD(SD)Br) в возрасте от 22 до 24 дней были получены от CharlesRiver, Inc. (St-Constant, Quebec, Canada) и содержались в пластиковых садках до 5 штук на садок при температуре (231 С) и освещенности (12-часовой световой день, свет включали в 7 ч 15 мин) в контролируемых условиях. Крысы получали стандартный комбикорм и воду в поилках ad libitum. На следующий день после получения животные были орхидектомированы (кастрированы) (СХ) с использованием изофлурановой анестезии через мошонку и рассажены случайным образом по группам из 5 особей. Для измерения антиандрогенной активности один силиконовый имплантат с дигидротестостероном (DHT,длина имплантата 1 см) вшивался подкожно на спинную сторону животного во время орхидектомии. Одна группа из 5 животных использовалась только в качестве СХ контроля (имплантант с DHT не вшивался). 2. Обработки. Для оценки антиандрогенной активности тестируемые соединения вводили подкожно или перорально один раз в день при использовании дозы 0,5 мг/животное для определения антиандрогенной активности или 0,2 мг/животное для определения андрогенной активности в течение 7 дней (SD от 1 до 7). Соединения были солюбилизированы (когда возможно) в диметилсульфоксиде (DMSO, конечная концентрация 10%) и вводились в виде суспензии в 0,4% метилцеллюлозе. Крысы в контрольных группах СХ и СХ+DHT получали в течение 7 дней только один носитель. Одна группа животных получала антиандроген флутамид (Flutamide) для сравнения. Животных умерщвляли переломом шейных позвонков с использованием изофлурановой анестезии на 8-е утро после кастрации. Брюшная простата и семенные пузырьки быстро вырезались и взвешивались. 3. Расчеты и статистический анализ. Для оценки антиандрогенной активности процент ингибирования (% ингиб.) рассчитывается по следующей формуле: Для оценки андрогенной активности процент стимуляции рассчитывается по следующей формуле:W представляет собой вес простаты, семенного пузырька или мышцы levator ani.D. Измерение местной антиандрогенной активности in vivo. Антиандрогенная активность соединений при местном применении была определена с использованием модели ушных сальных желез самцов хомячка. 1. Животные. Самцы золотистых сирийских хомячков (SYR) весом 110-120 г были получены из Harlan SpragueDawley (Madison, USA) и содержались по 2 штуки в пластиковых садках при температуре (223 С и освещенности (12-часовой световой день, свет включали в 7 ч 15 мин) в контролируемых условиях. Хомячки получали комбикорм для грызунов Certified Rodent Diet 5002 (гранулы) и имели доступ к поилкам с водой ad libitum. Животные акклиматизировались в течение по меньшей мере пяти дней до начала исследований. Животные были разделены на группы по 8 штук случайным образом. Одна группа хомячков была кастрирована с использованием изофлурановой анестезии в день начала эксперимента (SD1) и использовалась как контрольная группа. 2. Обработки. Для оценки антиандрогенной активности тестируемые соединения наносились местно на внутреннюю часть левого уха один раз в день в течение 14 дней. Десять мкл раствора ацетон:этанол:пропиленгликоль (1:1:2; по объему), содержащего 0,1, 0,3 или 1,0 мг/мл тестируемого соединения, аккуратно наносили на участок между двумя хрящевыми гребнями на вентральной поверхности левой ушной раковины. Для животных из кастрированной и интактной контрольных групп наносили только 10 мкл растворителя на левое ухо. На правое ухо раствор не наносили. 3. Посмертные наблюдения и измерения. На 15 день исследования хомячки умерщвлялись переламыванием шейных позвонков с использованием изофлурановой анестезии. Левое и правое ухо, соединенные кожей головы, собирали, фиксировали плоско на бумаге и погружали в 10% нейтральный раствор формалина. Из плоско фиксированных ушных раковин вырезали кружки диаметров 6 мм в участках, на которые наносились растворы. Такие образцы получали из каждого уха. С помощью лезвия скальпеля эти 6 мм кружки разрезали пополам между двумя хрящевыми гребнями. Обе равные половинки каждого кружка заливали в парафин. После обработки ткани обе половинки располагали вертикально и параллельно друг другу таким образом, чтобы плоская 6-мм область смотрела наружу. Из каждого парафинового блока готовили один срез (толщиной 5 мкм) и помещали на предметное стекло. Таким образом, каждый препарат содержал два длинных среза длиной 6 мм. Срезы окрашивали гематоксилином и эозином. 4. Анализ площади сальных желез. С использованием видеокамеры и 5-кратного объектива светового микроскопа были получены изображения, длина которых в поле зрения составляла 0,953 мм. Когда первый срез длиной 6 мм анализировался слева направо, первое и второе изображения отбрасывались, а третье и четвертое изображения фиксировались для последующего анализа изображений. Каждое поле имело длину 0,953 мм. С помощью компьютерной мышки отмечались сальные железы во всем поле зрения (0,953 мм). Также фиксировалась площадь по всей длине поля зрения и высота между гранулярным слоем (stratum granulosum) и верхним краем хряща. Общая площадь сальных желез (мкм 2) в каждом исследованном поле зрения была рассчитана с помощью Image Analyser. Была также измерена общая площадь по всей длине в 0,953 мм и высота между гранулярным слоем и хрящом. Кроме того, был рассчитан процент площади, занятой сальными железами. Таким образом, для каждого уха было получено два среза и было проанализировано по два поля зрения для каждого среза. Данные этих четырех измерений усреднялись, и были рассчитаны среднее значение и стандартная ошибка среднего значения с использованием Image Analyser. Полученные данные выражали в мкм 2 общей площади сальных желез в поле зрения и также в процентах площади, занятой сальными железами в ткани. Ниже обсуждаются некоторые не ограничивающие примеры предпочтительных активных соединений вместе с предпочтительными способами синтеза. Примеры синтеза предпочтительных ингибиторов. Протонные ЯМР спектры были записаны на приборе Brucker AC-F 300 или на приборе BruckerAvance 400 МГц. Использованы следующие сокращения: s, singlet (синглет); d, doublet (дуплет); dd, doublet of doublet (дуплет дуплетов); t, triplet (триплет); q, quadruplet (квадруплет) и m, multiplet (мультиплет). Химические сдвигирегистрировали относительно хлороформа (7,26 ч/млн для 1 Н и 77,00 ч/млн для С) или ацетона (2,01 ч/млн для 1 Н) и выражали в ч/млн. Тонкослойную хроматографию (TLC) проводили на пластинках 0,25 мм Kieselgel 60F254 (Е. Merck, Darmstadt, FRG). Для флэш-хроматографии использовали Merck-Kieselgel 60 (230-400 меш. A.S.T.M.). Если не отмечено иначе, исходный материал и реагент были куплены и использовались в неизмененном виде или были очищены с применением стандартных методов. Все растворители и очищенные и высушенные реагенты хранили под аргоном. Реакции в безводных условиях проводили в инертной атмосфере, приборы собирали и охлаждали под аргоном. Органические растворы сушили над сульфатом магния, упаривали на роторном испарителе и при сниженном давлении. Исходные материалы и реагенты были получены от Aldrich Chemical Company, Inc.(Milwaukee, Wisconsin). Получение производных тиогидантоинов (табл. 1 и табл. 3). Схема 1 Реагенты и условия: (а) подходящая температура от 0 С до комнатной температуры; (b) CSCl2, H2O,комнатная температура; (с) TEA, THF, с обратным холодильником; (d) 2 М водной HCl, МеОН, с обратным холодильником; (е) фенол-CO-R, DIAD, PPh3, THF; (f) NR1R2, NaBH3CN, AcOH, ACN или EtOH. 5-Амино-2-цианобензотрифторид (1a): коммерчески доступный (Matrix Scientific). 3-Хлор-4-циан-2-метиланилин (1b): синтезирован, как описано в WO 03/096980 А 2. 4-Изотиоцианат-2-трифторметилбензонитрил (2 а). К раствору тиофосгена (203 мг, 1,8 ммоль) в деминерализованной воде (3,0 мл) был добавлен 5-амино-2-цианобензотрифторид (1 а) (300 мг, 1,6 ммоль) небольшими порциями и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Полученный раствор разводили водой (50 мл), экстрагировали хлороформом (320 мл) и затем фильтровали через слой ваты (ватную пробку). Полученный раствор упаривали при пониженном давлении для получения неочищенного бледно-коричневого твердого вещества (334 мг, 90%), которое было непосредственно использовано для следующей стадии. 2-(3-Гидроксипропиламино)-2-метилпроприонитрил (3). К чистому раствору цианогидрина ацетона(930 мг, 10,9 ммоль) при 0 С медленно добавляли 3-амино-1-пропанол (861 мг, 11,5 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 3 ч и затем упаривали при сниженном давлении для получения желаемого соединения 3 (1,1 г, 71%), которое непосредственно без дальнейшей очистки использовали для следующей стадии. 4-[4,4-Диметил-3-(3-гидроксипропил)-5-имино-2-тиоксо-1-имидазолидинил]-2-трифторметилбензонитрил (4 а). К раствору соединения 2 а (500 мг, 2,2 ммоль) в безводном THF (20 мл) под аргоном были добавлены триэтиламин (22 мг, 0,22 ммоль) и 2-пропиламино-2-циан-пропан (3) (328 мг,2,3 ммоль). Затем раствор перемешивали с обратным холодильником в течение 1 ч. Полученный раствор упаривали досуха и очищали методом флэш-хроматографии, используя смесь дихлорметан/ацетон (8:2) в качестве элюента для получения 627 мг (77%) желаемого соединения 4 а. 4-[4,4-Диметил-3-(3-гидроксипропил)-5-оксо-2-тиоксо-1-имидазолидинил]-2-трифторметилбензонитрил (5 а). К раствору соединения 4 а (627 мг, 1,7 ммоль) в метаноле (27 мл) был добавлен 2 N водный HCl (5,2 мл). Раствор выдерживали с обратным холодильником в течение 90 мин и затем выливали в раствор воды со льдом. Раствор экстрагировали этилацетатом (330 мл), промывали солевым раствором и сушили над сульфатом магния для получения 428 мг (68%) желаемого соединения 5 а. 1 Н ЯМР (400 МГц, Ацетон-d6) : 1,65 (s, 6H), 3,67 (q, 2H, J=5,7 Гц), 3,75 (t, 1H, J=5,01 Гц), 3,90 (m,2 Н), 8,03 (d, 1H, J=6,4 Гц), 8,18 (s, 1H), 8,26 (d, 1H, J=8,26 Гц). Общий способ синтеза соединений 6 а. Обычно к перемешиваемому раствору соединения 5 а (0,40 ммоль), трифенилфосфина (0,80 ммоль) и подходящего фенола (0,80 ммоль) в безводном THF (0,05 М) при 0 С медленно добавляли диизопропилазодикарбоксилат (DIAD) (0,80 ммоль) в течение 10 мин. Раствор перемешивали при 0 С в течение 1 ч,выдерживали до повышения температуры раствора до комнатной температуры и затем дополнительно перемешивали в течение 3 ч. Полученный раствор разводили этилацетатом (60 мл), промывали 10% рас- 27016382 твором NaOH (100 мл) и высушивали над сульфатом натрия. Очистка полученного неочищенного соединения методом флэш-хроматографии с использованием смеси CH2Cl2/ацетон (95:5) давала соединения с общей структурой 6 а с выходом от умеренного до высокого (от 30 до 70%). 4-4,4-Диметил-5-оксо-3-[3-(3-пропионилфенокси)пропил]-2-тиоксоимидазолидин-1-ил-2 трифторметилбензонитрил (ЕМ-7113). 1 Н ЯМР (400 МГц, Ацетон-d6) : 1,15 (t, 3 Н, J=7,20 Гц), 1,68 (s, 6 Н), 2,07 (m, 2H), 3,06 (q, 2H, J=7,20 Гц), 4,05 (m, 2 Н), 4,24 (t, 2 Н, 6,13 Гц), 7,22 (m, 1H), 7,45 (t, 1H, J=7,92 Гц), 7,53 (s, 1H), 7,61 (d, 1H, 7,69 Гц), 8,03 (dd, 1H, J1=6,45; J2=1,81 Гц), 8,17 (s, 1H), 8,26 (d, 1H, J=8,27 Гц). Общий способ синтеза соединений 7 а. Обычно к раствору соединения 6 а (0,15 ммоль) в безводном ацетонитриле (1 мл) добавляли подходящий амин (0,60 ммоль), цианборгидрид натрия (0,23 ммоль) и уксусную кислоту (0,75 ммоль). Затем раствор перемешивали в пределах от 4 до 12 ч под аргоном при комнатной температуре. Полученный раствор разводили этилацетатом (15 мл) и последовательно промывали 10% водным бикарбонатом натрия и солевым раствором. Органическую фазу сушили над сульфатом натрия и упаривали при пониженном давлении для получения неочищенного амина. Неочищенное соединение затем очищали методом флэш-хроматографии с использованием в качестве элюента этилацетата или ацетона для получения соединений с общей структурой 7 с выходами в пределах от 35 до 60%. Примечание. Тиогидантоины (1b-7b) получали посредством того же пути синтеза, который был использован для соединений (1 а-7 а). 4-(3-3-[4-Изопропиламинометил]феноксипропил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1 ил-2-трифторметилбензонитрил (ЕМ-7105). 1 Н ЯМР (400 МГц, Ацетон-d6) : 1,04 (d, 6H, J=6,22 Гц), 1,67 (s, 6H), 2,36 (m, 2H), 2,78 (m, 1H), 3,70(m, 2H), 4,30 (t, 2H, J=6,17 Гц), 7,19 (d, 2H, J=8,92 Гц), 7,53 (d, 2H, J=8,32 Гц), 7,88 (m, 3 Н). Получение производных гидантоинов (табл. 1). Реагенты и условия: (а) фосген/толуол, толуол, с обратным холодильником; (b) 9, TEA, 1,2 дихлорэтан, от 0 С до комнатной температуры; (с) 6 N HCl, с обратным холодильником; (d) NaOH, 1 хлорпропил-3-ОТНР, DMF, 50C; (e) p-TSA, MeOH; (f) Фенол-R, PPh3, DEAD, THF, от 0 С до комнатной температуры; (g) NR1R2, NaBH3CN, AcOH, ACN или EtOH. 4-Изоцианато-2-трифторметилбензонитрил (8 а). К раствору 5-амино-2-цианобензотрифторида (1a) (2,0 г, 10,7 ммоль) в этилацетате (6 мл) при 0 С,под аргоном, по каплям добавляли 2,0 М раствор фосгена в толуоле (6,5 мл, 12,9 ммоль). Раствор перемешивали в течение 30 мин при 0 С и оставляли для повышения температуры раствора до комнатной. Затем к этилацетату добавляли толуол (3 мл) и полученный раствор выдерживали с обратным холодильником в течение 3 ч в аппарате Дина-Старка (Dean-Stark apparatus), снабженном ловушкой для HCl(твердый NaOH). Первые 6 мл дистиллированного растворителя удаляли и заменяли толуолом (6 мл). Затем раствор фильтровали и упаривали для получения соединения 8 а (1,6 г) в виде оранжевого масла,которое непосредственно использовали для следующей стадии. IR: 2268 (сильный), 2232 (слабый) см-1. 2-Амино-2-метил-проприонитрил (9). К перемешиваемому раствору водного аммиака (25%) (120 мл, 0,85 моль), NaCN (15,34 г, 0,31 моль) и хлорида аммония (19,75 г, 0,37 моль) по каплям добавляли ацетон (14,52 г, 0,25 моль) при комнатной температуре. Раствор перемешивали в течение 3 дней при комнатной температуре. Полученный раствор экстрагировали дихлорметаном (350 мл) и фильтровали через ватный фильтр. Сульфат натрия добавляли к объединенной органической фазе и перемешивали в течение 3 ч. В заключение раствор фильтровали и упаривали при сниженном давлении для получения желаемого соединения 9 (7,80 г, 45%). 1H ЯМР (400 МГц, CDCl3) : 1,48 (s, 6H), 1,64 (широкий s, 2H). 4-(4,4-Диметил-5-имино-2-оксо-1-имидазолидинил)-2-трифторметилбензонитрил (10 а). К раствору соединения 9 (641 мг, 7,62 ммоль) и триэтиламина (168 мг, 1,66 ммоль) в 1,2 дихлорэтане (8,4 мл) при 0 С под аргоном по каплям добавляли раствор изоцианата 8 а (1,54 г, 7,28 ммоль) в 1,2 дихлорэтане (3,5 мл). Раствор перемешивали при 0 С в течение 35 мин и затем ледяную баню удаляли и перемешивали раствор при комнатной температуре еще в течение 30 мин. Затем раствор упаривали досуха и очищали при помощи флэш-хроматографии, используя в качестве элюента смесь EtOAc/гексан(6:4) для получения чистого соединения 10 а (1,02 г, 47%). 1 Н ЯМР (300 МГц, Ацетон-d6) : 1,54 (m, 6H), 7,45 (широкий s, 1H), 8,12 (d, 1H, J=8,46 Гц), 8,29 (dd,1H, J1=6,90 Гц, J2=1,61 Гц), 8,46 (s,1H), 8,51 (s, 1H). 4-(4,4-Диметил-2,5-диоксо-1-имидазолидинил)-2-трифторметилбензонитрил (11 а). Суспензию соединения 10 а в 6 N HCl (25 мл) выдерживали с обратным холодильником в течение 35 мин. Охлажденный раствор выливали в раствор 10% бикарбоната и экстрагировали, используя этилацетат (325 мл). Органический слой промывали солевым раствором и в завершение сушили над сульфатом магния для получения желаемого соединения 11 а (950 мг, 95%), которое как таковое использовали в
МПК / Метки
МПК: A61K 31/4178, A61K 31/4166, A61K 31/5377, C07D 413/12, C07D 403/12, C07D 233/42
Метки: рецептора, нестероидные, антиандрогены, спираль, направленные, андрогенов
Код ссылки
<a href="https://eas.patents.su/30-16382-nesteroidnye-antiandrogeny-napravlennye-na-12-spiral-receptora-androgenov.html" rel="bookmark" title="База патентов Евразийского Союза">Нестероидные антиандрогены, направленные на 12 спираль (рецептора андрогенов)</a>
Предыдущий патент: Способ сведения и линеаризации амплитудных характеристик мультисенсорных детекторов
Следующий патент: Демонстрационная панель