Оптические изомеры дигидро-2,3-бензодиазепинов и их стереоселективный синтез
Номер патента: 16087
Опубликовано: 28.02.2012
Авторы: Баркоци Йожеф, Гиглер Габор, Кертес Саболч, Вег Миклош, Линг Иштван, Харшинг Ласло Габор, Грефф Зольтан, Альберт Михай, Сенаши Габор, Сабо Геза, Капуш Габор, Леваи Дьёрдь, Мориц Кристина, Сюч Дьюла, Агоштон Марта
Формула / Реферат
1. Энантиомерные дигидро-2,3-бензодиазепиновые производные общей формулы
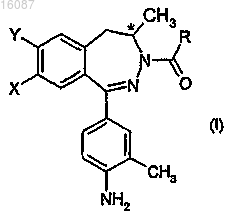
где конфигурация хирального атома углерода представляет собой R;
X представляет собой галоген или C1-4алкоксигруппу;
Y представляет собой водород, или
X и Y вместе обозначают группу метилендиокси;
R обозначает C1-4алкильную группу,
и их фармацевтически приемлемые соли присоединения кислоты.
2. Производные по п.1, где X представляет собой атом хлора и R обозначает метильную или этильную группу.
3. Энантиомерные дигидро-2,3-бензодиазепиновые производные общей формулы
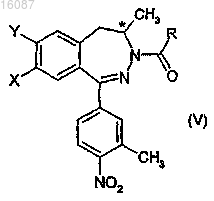
где конфигурация хирального атома углерода представляет собой R;
X, Y и R являются такими, как определено в п.1.
4. Энантиомерные бензо[b]пирановые производные общей формулы
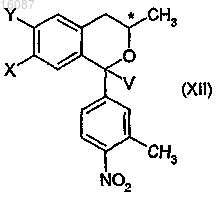
где конфигурация хирального атома представляет собой S;
X представляет собой галоген или C1-4алкоксигруппу;
Y представляет собой водород, или
X и Y вместе могут обозначать группу метилендиокси;
V обозначает атом водорода или гидроксильную группу.
5. Производные по п.4, где X представляет собой атом хлора.
6. Гидразоновые производные общей формулы

где гидразоновые соединения представляют собой смеси E и Z изомеров;
конфигурация хирального атома углерода представляет собой S;
X, Y и R являются такими, как определено в п.1;
L обозначает гидроксильную группу или С1-4алкилсульфонильную группу.
7. Рацемические и энантиомерные дигидро-2,3-бензодиазепиновые производные общей формулы
где X представляет собой галоген или С1-4алкоксигруппу;
Y представляет собой водород, или
X и Y вместе обозначают группу метилендиокси;
R' обозначает цис-этениленовую группу,
и их соли присоединения хиральных оснований.
8. Производные по п.7, где X представляет собой атом хлора.
9. Энантиомерные дигидро-2,3-бензодиазепиновые соединения общей формулы
где X представляет собой галоген или C1-4алкоксигруппу;
Y обозначает водород, или
X и Y вместе обозначают группу метилендиокси.
10. Производные по п.9, где X представляет собой атом хлора.
11. Диастереоизомерные дигидро-2,3-бензодиазепиновые производные, имеющие высокую стереохимическую чистоту, общей формулы
где X обозначает галоген или C1-4алкоксигруппу;
Y обозначает атом водорода, или
X и Y вместе обозначают группу метилендиокси;
R1, R2 и R3 являются разными и R1 обозначает атом водорода, R2 обозначает метильную группу, R3 обозначает фенильную группу;
конфигурация асимметрических атомов водорода представляет собой R,R или S,S.
12. Производные по п.11, где X представляет собой атом хлора.
13. Энантиомерные дигидро-2,3-бензодиазепиновые соединения общей формулы
где конфигурация хирального атома представляет собой R;
X представляет собой галоген или C1-4алкоксигруппу;
Y представляет собой водород, или
X и Y вместе обозначают группу метилендиокси,
и их соли присоединения оптически активных кислот.
14. Производные по п.13, где X представляет собой атом хлора.
15. Соединения, выбранные из следующей группы:
(R)-(-)-5-(4-амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин,
(R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин,
(R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин,
и их фармацевтически приемлемые соли присоединения кислоты.
16. (R)-(-)-8-Метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин,
(R)-(-)-7-ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин,
(R)-(+)-3-ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро-3Н-2,3-бензодиазепин.
17. (5RS,7S)-7-Метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5Н-1,3-диоксоло[4,5-g]изохроман, (1RS,3R)- и (1RS,3S)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман.
18. (5RS,7S)-7-Метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5Н-1,3-диоксоло[4,5-g]изохроман-5-ол, (1RS,3S)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман-1-ол.
19. (S)-Уксусной кислоты [[6-(2-гидроксипропил)-1,3-бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразид,
(S)-пропионовой кислоты [[6-(2-гидроксипропил)-1,3-бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразид,
(S)-уксусной кислоты [[5-хлор-2-(2-гидроксипропил)фенил]-(3-метил-4-нитрофенил)метилен]гидразид.
20. (S)-Уксусной кислоты [[6-[2-[(метилсульфонил)окси]пропил]-1,3-бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразид,
(S)-пропионовой кислоты [[6-[2-[(метилсульфонил)окси]пропил]-1,3-бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразид,
(S)-уксусной кислоты [[2-[2-[(метилсульфонил)окси]пропил]-5-хлорфенил](3-метил-4-нитрофенил)метилен]гидразид.
21. (R)-(+)-8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин.
22. (R)-(-)-4-(8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновая кислота и ее соли присоединения хиральных оснований.
23. (R)-(-)-4-(8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты (S)-(-)-α-метилбензиламмониевая соль.
24. (+)-7-(N-(1-(R)-Фенилэтил)карбамоил)-8(R)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин.
25. (R)-(-)5-(4-Амино-3-метилфенил)-8-метил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин и его соли, образованные с оптически активными карбоновыми кислотами.
26. Фармацевтическая композиция, содержащая энантиомерное дигидро-2,3-бензодиазепиновое соединение общей формулы (I), где
конфигурация хирального атома углерода представляет собой R;
X представляет собой галоген или C1-4алкоксигруппу;
Y представляет собой водород, или
X и Y вместе обозначают группу метилендиокси;
R обозначает метильную или этильную группу,
или его фармацевтически приемлемые соли присоединения кислоты и обычный(ые) носитель(и).
27. Композиция по п.26, где в соединении общей формулы (I) X представляет собой атом хлора.
28. Фармацевтическая композиция по п.26, содержащая в качестве активного ингредиента (R)-(-)-5-(4-амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7H-1,3-диоксоло[4,5-h][2,3]бензодиазепин, или
(R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин, или
(R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин, или
их фармацевтически приемлемые соли присоединения кислоты.
29. Фармацевтическая композиция по любому из пп.26 или 27, содержащая 0,1-95 мас.% активного ингредиента.
30. Фармацевтическая композиция по любому из пп.26 или 27, выполненная для перорального, парентерального, ректального, трансдермального или местного применения.
31. Способ получения дигидро-2,3-бензодиазепиновых производных общей формулы (I) высокой диастереомерной частоты, где значения X, Y и R являются такими, как определено в п.1, включающий восстановление нитрогруппы соответствующего дигидро-2,3-бензодиазепинового соединения общей формулы (V), где значения X, Y и R являются такими, как определено в п.1, и где конфигурация хирального атома углерода представляет собой R.
32. Способ по п.31, где соединение общей формулы (V) получают, осуществляя стадии:
а) реакции фенил-2-пропанольного производного общей формулы
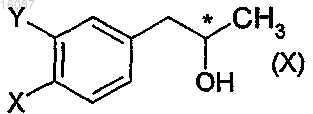
где X и Y являются такими, как определено в п.1, и конфигурация хирального атома углерода представляет собой S, с 4-нитробензальдегидным производным общей формулы
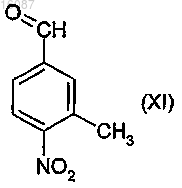
после этого
b) окисления полученного бензо[b]пиранового производного общей формулы (XII), где X и Y являются такими, как определено в п.1, и V обозначает атом водорода, и где конфигурация хирального атома углерода представляет собой S, до полукетального соединения общей формулы
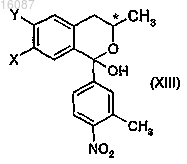
где X и Y являются такими, как определено в п.1,
с) дальнейшей реакции полученного таким образом производного общей формулы (XIII), где конфигурация хирального атома углерода представляет собой S, с гидразидом алифатической карбоновой кислоты,
d) дальнейшей реакции полученного гидразонового производного общей формулы (XIV), где X и Y являются такими, как определено в п.1, L обозначает гидроксильную группу, где конфигурация хирального атома углерода представляет собой S, с C1-4алкилсульфонилгалогенидом с получением C1-4алкилсульфонилированного гидразонового производного общей формулы
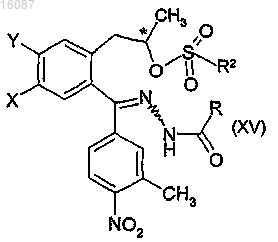
где X и Y являются такими, как определено в п.1, R2 обозначает C1-4алкил и где конфигурация хирального атома углерода представляет собой S,
е) превращения данного сульфонилированного гидразонового производного в дигидро-2,3-бензодиазепиновое производное общей формулы (V), обладающее высокой энантиомерной чистотой, путем реакции внутримолекулярной циклизации.
33. Способ по п.32, где C1-4алкилсульфонилгалогенид на стадии d) представляет собой метансульфонилхлорид.
34. Способ получения (R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина высокой энантиомерной чистоты и его фармацевтически приемлемых солей присоединения кислоты, включающий стадии:
а) реакции (S)-α-метил-1,3-бензодиоксол-5-ола (X) высокой энантиомерной чистоты с 3-метил-4-нитробензальдегидом,
b) окисления полученного бензо[b]пиранового производного общей формулы (XII), которое представляет собой смесь диастереоизомеров, где X и Y вместе обозначают группу метилендиокси, V обозначает атом водорода, с получением полукетального производного общей формулы (XIII), где X и Y вместе обозначают группу метилендиокси, V обозначает гидроксильную группу,
с) реакции полученного таким образом полукетального соединения с гидразидом уксусной кислоты,
d) реакции полученного гидразонового производного общей формулы (XIV), которое представляет собой смесь Е и Z изомеров, где X и Y вместе обозначают группу метилендиокси, L обозначает гидроксильную группу, с C1-4алкилсульфонилгалогенидом с получением C1-4алкилсульфонилированного гидразонового производного общей формулы (XV), которое представляет собой смесь Е и Z изомеров, где X и Y вместе обозначают группу метилендиокси, L обозначает группу С1-4алкилсульфонилокси,
е) превращения данного продукта путем реакции внутримолекулярной циклизации в дигидробензодиазепиновое производное общей формулы (V), где X и Y вместе обозначают группу метилендиокси, с последующим восстановлением нитрогруппы в аминогруппу.
35. Способ по п.34, где С1-4алкилсульфонилгалогенид на стадии d) представляет собой метансульфонилхлорид.
36. Способ получения (R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепина, включающий стадии:
а) реакции (S)-1-(4-хлорфенил)пропанола-2 высокой энантиомерной чистоты с 3-метил-4-нитробензальдегидом с получением бензо[b]пиранового соединения общей формулы (XII), которое представляет собой диастереоизомерную смесь, где X обозначает атом хлора, Y и V обозначают атомы водорода,
b) окисления бензо[b]пиранового соединения до полукетального соединения общей формулы (XIII), где X обозначает атом хлора, Y обозначает атом водорода и V обозначает гидроксильную группу,
с) реакции полученного таким образом продукта с гидразидом уксусной кислоты с получением гидразонового соединения общей формулы (XIV), которое представляет собой смесь E и Z изомеров, где X обозначает атом хлора, Y обозначает атом водорода и L обозначает гидроксильную группу,
d) реакции данного гидразонового соединения с метансульфонилхлоридом,
е) дальнейшей реакции полученного C1-4алкилсульфонилированного гидразонового соединения общей формулы (XV) путем реакции внутримолекулярной циклизации с получением дигидробензодиазепинового соединения, затем
f) восстановления нитрогруппы в данном соединении общей формулы (V) с получением дигидробензодиазепинового соединения высокой энантиомерной чистоты общей формулы (I).
37. Способ по п.31 получения дигидро-2,3-бензодиазепинового соединения высокой энантиомерной чистоты общей формулы (I), включающий стадии:
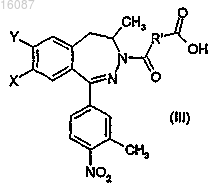
а) ацилирования рацемического дигидро-2,3-бензодиазепинового соединения общей формулы

с получением полукислого-полуамидного соединения общей формулы (III), где R' обозначает цис-этениленовую группу,
b) реакции соединения общей формулы (III) с единичным энантиомером хирального основания с получением пары диастереоизомерных солей общей формулы
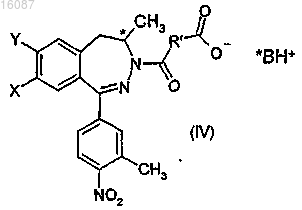
где *ВН+ представляет собой протонированную форму S-(-)метилбензиламина, которые разделяют известным способом, с получением, таким образом, диастереоизомерной соли в желаемой энантиомерной форме, затем
с) высвобождения из диастереоизомерной соли полукислого-полуамидного соединения общей формулы
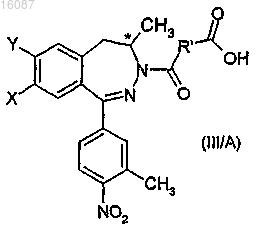
где R1 обозначает цис-этениленовую группу,
d) последующего гидролиза данного соединения известным способом с получением соединения общей формулы
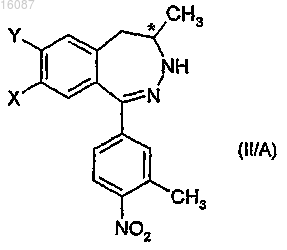
е) ацилирования соединения общей формулы (IIA) известным способом с использованием алифатических карбоксильных производных,
f) последующего восстановления нитрогруппы полученного производного с получением дигидро-2,3-бензодиазепинового соединения общей формулы (I).
38. Способ по п.34 получения дигидро-2,3-бензодиазепиновых производных общей формулы (I) высокой энантиомерной чистоты, включающий стадии:
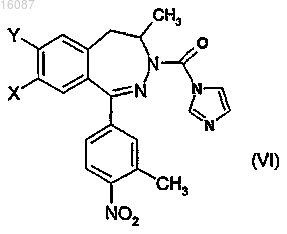
а) реакции рацемического дигидро-2,3-бензодиазепинового производного общей формулы (II) с 1,1'-карбонилдиимидазолом, затем
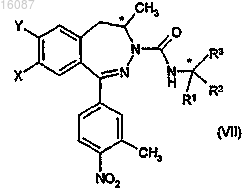
b) реакции полученного рацемического карбонилдиимидазольного производного общей формулы (VI) с энантиомером хирального основания, затем
с) разделения известным способом компонентов полученной диастереоизомерной смеси дигидро-2,3-бензодиазепиновых производных общей формулы (VII), где конфигурация хирального атома углерода дигидро-2,3-бензодиазепина представляет собой R, а конфигурация другого хирального атома углерода зависит от используемого хирального амина, X и Y вместе обозначают группу метилендиокси, R1, R2, R3 отличаются друг от друга, R1 представляет собой атом водорода, R2 представляет собой метильную группу, R3 представляет собой фенильную группу, при необходимости с последующей стадией перекристаллизации,
d) последующего гидролиза данного соединения в кислых условиях и
е) ацилирования энантиомерных дигидро-2,3-бензодиазепиновых производных общей формулы (II/А) производным алифатической карбоновой кислоты, и в итоге
f) восстановления нитрогруппы полученных дигидро-2,3-бензодиазепиновых производных общей формулы (I) высокой энантиомерной чистоты.
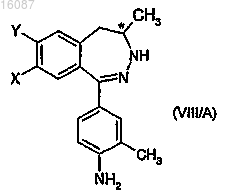
39. Способ по п.38 получения дигидро-2,3-бензодиазепиновых производных общей формулы (I), где значения X, Y и R являются такими, как определено в п.1, который включает ацилирование незамещенного циклического атома азота в позиции 3 соответствующего энантиомерного бензодиазепинового соединения общей формулы (VIII/A), где значения X, Y и R являются такими, как определено в п.1, производным C1-4 карбоновой кислоты.
40. Способ по п.39, включающий стадии:
а) восстановления рацемического дигидро-2,3-бензодиазепина общей формулы (II),
b) превращения полученного рацемического дигидро-2,3-бензодиазепина общей формулы (VIII) в пару диастереоизомерных кислых солей с единичным стереоизомером хиральной карбоновой кислоты,
с) разделения известным способом компонентов диастереоизомерных солей, затем
d) высвобождения из энантиомерной соли, содержащей дигидро-2,3-бензодиазепин, энантиомерного дигидро-2,3-бензодиазепинового основания общей формулы (VIII/A),
е) ацилирования незамещенного циклического атома азота в позиции 3 соответствующего энантиомерного бензодиазепинового основания общей формулы (VIII/А), где значения X, Y и R являются такими, как определено в п.1, с производным C1-4карбоновой кислоты.
41. Способ изготовления фармацевтической композиции, включающий смешивание дигидро-2,3-бензодиазепинового соединения общей формулы (I), где значения X, Y и R являются такими, как определено в п.1, или его фармацевтически приемлемых солей присоединения кислоты с фармацевтически приемлемыми носителями, и, таким образом, приведения смеси в галеновую форму.
42. Применение дигидро-2,3-бензодиазепинового соединения общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты для изготовления фармацевтических композиций, подходящих для лечения инсульта, травмы головного мозга и повреждения спинного мозга, эпилепсии, шизофрении, опухолей в центральной нервной системе, например глиомы, глиобластомы, астроцитомы, олигодендроглиомы; заболеваний, связанных с мышечной спастичностью, и нейродегенеративных заболеваний, в особенности болезни Паркинсона, болезни Пика, болезни Альцгеймера, болезни Гентингтона, рассеянного склероза, синдрома Гийена-Барре, мотонейронального заболевания (ALS); кроме того, подходящих для лечения спазма, боли, тошноты, влияния на рвоту, мигрени, дизурии, уменьшения симптомов отмены лекарства или тревоги.
43. Способ лечения заболеваний, перечисленных в п.42, включающий введение пациенту, нуждающемуся в таком лечении, фармацевтически эффективной дозы дигидро-2,3-бензодиазепинового соединения общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты.
Текст
Настоящее изобретение относится к дигидро-2,3-бензодиазепиновым соединениям общей формулы (I), обладающим высокой энантиомерной чистотой, содержащим центр асимметрии в позиции 4 дигидро-2,3-бензодиазепинового соединения, и их получению, а также применяемым промежуточным соединениям. Эти соединения обладают антиконвульсивным, расслабляющим мышцы и нейропротективным эффектом, благодаря их неконкурентным антагонистическим свойствам в отношении рецепторов АМРА (альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты).(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ (HU) 016087 Область изобретения Настоящее изобретение относится к дигидро-2,3-бензодиазепиновым соединениям общей формулы обладающим высокой энантиомерной чистотой, где в позиции 4 дигидро-2,3-бензодиазепинового кольца присутствуют метильная группа и атом водорода, таким образом, данные соединения имеют в этой позиции центр асимметрии. Кроме того, в настоящем изобретении предложены новые промежуточные соединения, обладающие высокой энантиомерной чистотой. Эти соединения представляют собой антагонисты рецепторов, отличающихся от рецепторов АМРА (альфа-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты), обладающие антиконвульсивным, расслабляющим мышцы и нейропротективным действиями. Более конкретно, настоящее изобретение относится к дигидро-2,3-бензодиазепиновым соединениям общей формулы (I), где конфигурация хирального атома углерода представляет собой R;X и Y вместе могут обозначать группу метилендиокси;R обозначает C1-4 алкильную группу,и их фармацевтически приемлемым солям присоединения кислоты. Кроме того, настоящее изобретение также относится к промежуточным соединениям. Предшествующий уровень техники Синтез рацемических соединений, соответствующих энантиомерным дигидро-2,3-бензодиазепинам,описан в венгерской заявке на патент Р 9902291. Синтез похожих рацемических соединений также описан в венгерской заявке на патент Р 0004994. Американские авторы описали энантиомерно селективный способ синтеза для получения левовращающих дигидро-2,3-бензодиазепиновых соединений, имеющих абсолютную конфигурацию R, в европейской заявке на патент ЕР 699677. В соответствии со способом синтеза, раскрытым в данной европейской заявке на патент, первая стадия представляет собой получение оптически чистого фенилпропанольного соединения, имеющего абсолютную конфигурацию S. Его получают путем микробиологического восстановления соответствующего фенилацетонового производного или путем реакции литиевого производного, полученного из 5-бром-бензо[1,3]диоксола, с оптически активным пропиленоксидом. Полученные таким образом фенилпропанольные соединения, имеющие S конфигурацию, превращают в оптически активные изохромановые соединения, затем проводят стадию окисления в мягких условиях и последующей конденсации с гидразидами уксусной кислоты, получая оптически активные гидразоновые соединения. После реакции мезилирования происходит закрытие кольца в основных условиях, сопровождающееся обращением хирального атома углерода, в результате чего получают дигидро-2,3-бензодиазепиновые соединения,имеющие абсолютную конфигурацию R. Дигидро-2,3-бензодиазепиновые соединения, имеющие абсолютную конфигурацию S, не описаны в области техники. Рацемические дигидро-2,3-бензодиазепиновые соединения и соединения, описанные в венгерских заявках на патенты P 0004994 и Р 9902291, представляют собой неконкурентные ингибиторы рецепторов АМРА. Известно, что глутамат представляет собой наиболее важный стимулирующий нейромедиатор в центральной нервной системе. Действие глутамата, кроме того, передается через рецепторы NMDA (Nметил D-аспартат), АМРА и каинатные рецепторы, которые связаны с ионным каналом. Соединения, упомянутые выше в качестве неконкурентных антагонистов рецепторов АМРА, оказывают значительный эффект, расслабляющий мышцы, нейропротективный и антиконвульсивный эффект и могут применяться при некоторых заболеваниях (например, эпилепсия, клинические картины,сопровождающиеся спазмом мышц, различные нейродегенеративные заболевания, инсульт), при которых ингибирование АМРА/каинатных рецепторов является полезным. С точки зрения терапевтического применения важно разработать такие новые активные фармацевтические ингредиенты, которые обладали бы более высокой терапевтической активностью и были бы эффективны в меньшей терапевтической дозе или обладали бы значительно меньшими терапевтическими побочными эффектами по сравнению с известными активными ингредиентами. Цель изобретения заключается в разработке новых активных фармацевтических ингредиентов, которые имели бы преимущества с терапевтической точки зрения по сравнению с соединениями, извест-1 016087 ными из предшествующего уровня техники. Эту цель достигают путем получения дигидро-2,3-бензодиазепиновых соединений, обладающих высокой энантиомерной чистотой. Краткое изложение сущности изобретения Настоящее изобретение относится к дигидро-2,3-бензодиазепиновым соединениям общей формулы (I) где конфигурация хирального атома углерода представляет собой R;X и Y вместе могут обозначать группу метилендиокси;R обозначает метильную или этильную группу; алкоксигруппы представляют собой C1-4 алкоксигруппы, предпочтительно метоксигруппу,и к их фармацевтически приемлемым солям присоединения кислоты. В случае, когда X и Y вместе обозначают группу метилендиокси, дигидро-2,3-бензодиазепины общей формулы (I) образуют 8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепиновое кольцо. В соответствии с правилами химической номенклатуры позиция для каждого заместителя меняется. Это изменение не влияет на сущность настоящего изобретения, таким образом, эти заместители названы дигидро 2,3-бензодиазепинами. Тем не менее соответствующие соединения определены в примерах как 8,9 дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепиновые производные. Центры асимметрии соединений, имеющих энантиомеры высокой чистоты, обозначены на фигурах звездочками, которые означают, что конфигурация обозначенных атомов углерода представляет собой R или S. В соответствии с настоящим изобретением выражение "энантиомеры, обладающие высокой энантиомерной чистотой" обозначает на практике такие энантиомеры, которые из числа двух возможных энантиомеров содержат только один энантиомер или один энантиомер в очень высокой концентрации. При реализации изобретения в некоторых случаях получают диастереоизомеры, обладающие высокой стереохимической чистотой. Они представляют собой такие диастереоизомеры, которые содержат по меньшей мере 2 центра асимметрии и из числа четырех возможных диастереоизомеров содержат исключительно один энантиомер или только один энантиомер в очень высокой концентрации. Под высокой концентрацией понимают 98%. Авторы изобретения неожиданно обнаружили,что левовращающие дигидро-2,3 бензодиазепиновые производные имеющие абсолютную конфигурацию R (например, (R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил 8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин) представляют собой значительно более эффективные антагонисты рецептора АМРА по сравнению с правовращающими производными(например, (S)-(+)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин), имеющими абсолютную конфигурацию S. Кроме того, весьма неожиданным и удивительным является то, что правовращающие соединения,имеющие абсолютную конфигурацию S, в случае перорального введения бодрствующим крысам вызывают некротические гистологические изменения в тимусе и в костном мозге после обработки в течение одной недели, относящиеся к преобладанию кортикостерона в тимусе и в костном мозге. Соединения-2 016087 общей формулы (I/R), имеющие абсолютную конфигурацию R, затрагивают вышеупомянутую гистологическую картину лишь в малой степени. На основе вышеупомянутых фактов терапевтическое применение левовращающих дигидро-2,3 бензодиазепиновых соединений (I/R), имеющих абсолютную конфигурацию R, является предпочтительным, поскольку ожидаемые терапевтические преимущества не изменяются, в то же время отсутствие соединений кортикостерона общей формулы (I/S), имеющих абсолютную конфигурацию S, значительно уменьшает вероятность токсических побочных эффектов. Подробное описание изобретения Вышеупомянутые неожиданные результаты подтверждаются результатами, полученными с использованием следующих способов. Тест "распространяющейся депрессии" в сетчатке глаза цыпленка. Тест осуществляли в соответствии со способом согласно Sheardown (1993). Использовали глазные впадины, извлеченные у 5-7-суточных цыплят (породы Shaver red-brow). Пол цыплят не определяли. Глаза птиц извлекали под эфирным наркозом, затем готовили срезы задних стенок глаз и помещали в питательный раствор. Состав среды: 100 мМ NaCl, 3 мМ KCl, 1 мМ MgSO4, 1 мМ CaCl2, 30 мМ NaHCO3, 1 мМ NaH2PO4,10 мМ D-глюкоза, рН 7,3. Латентный период распространяющейся депрессии (SD - spreading depression), вызванной 5 мкМ SAMPA, определяют при комнатной температуре после 90-минутного периода стабилизации. Это значение рассматривали как контрольное значение. Затем латентный период, вызванный АМРА, измеряли после 30-минутной инкубации в присутствии тестируемого соединения, затем после дополнительных 60 мин промывки обнаруживали возврат латентного периода к контрольному значению. Удлинение контрольного латентного периода на 30 с соответствует 100% антагонистическому действию. Литература: Sheardown, M.J.: The triggering of spreading depression in the chicken retina: a pharmacological study. Brain Research 1993, 607: 189-194. Тесты на токсичность у крыс. Исследование осуществляли с использованием самок крыс Wistar. За одни сутки до обработки животных распределяли по рандомизированным группам на основе их массы (10 животных/группу). Каждый активный ингредиент суспендировали в растворе 0,4% гидроксипропилметилцеллюлозы (MethocellF4 М, Dow Chemical Company, USA) и вводили один раз в сутки в течение семи суток при помощи желудочного катетера. Суточные дозы составляли 30 мг/кг, животных в контрольной группе обрабатывали растворителем. В конце экспериментов животных умерщвляли путем разреза артерий бедра под эфирным наркозом. После эктомии тимусов их фиксировали в растворе формалина, забуференного фосфатом, затем погружали в парафин, окрашивали гемалауном-эозином. Препараты пленок костного мозга готовили из бедренной кости животных и окрашивали в соответствии с методикой Гимза (Sheenan D.C.-Hrapchak В.В.: Theory and practice of histotechnology (2nd ed) Mosby Company, St. Louis, USA, 1980). Гистологическую атрофию оценивали в соответствии со следующим: 0 - отсутствие изменений,1 - видимые изменения, 2 - слабое изменение, 3 - умеренно-тяжелое изменение, значимое изменение,4 - тяжелое, очевидное, обширное изменение. Оценку осуществляли вслепую без какой-либо информации об обработке. Группы сравнивали при помощи теста ANOVA Крускала-Уоллиса (ранг и медиана). В случае значительного отклонения (р 0,05) для сравнения использовали тест Вальда-Вольфовица. Таблица 1 Антагонистический эффект в отношении AMPA для тестируемых соединений в тесте распространяющейся депрессии (SD) с использованием сетчатки кролика in vitro и гистологический эффект в тимусе и в костном мозге, вызванный пероральным введением самкам крыс Wistar в течение семи суток in vivo Вышеприведенные данные демонстрируют средние значения и среднеквадратическое отклонение.р 0,01 относительно примера 4. В соответствии с результатами, представленными в вышеприведенной табл. 1, соединение (R)-(-)-7 ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-р][2,3]бензодиазепин со-3 016087 гласно примеру 4 представляет собой эффективное соединение-антагонист АМРА, поскольку действие рецептора АМРА блокируется со значением EC50 1,8 мкМ в тесте распространяющейся депрессии, а (S)(+)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин согласно примеру 6 обладает лишь незначительным эффектом в отношении рецепторов АМРА, поскольку его значение EC50 составляет больше 100 мкМ. Соединение (R)-(-)-7-ацетил-5-(4-амино-3 метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин согласно примеру 4 влияет на гистологические картины тимуса и костного мозга крыс в течение семи суток после перорального введения лишь в минимальной степени, тогда как (S)-(+)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил 8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин согласно примеру 6, используемый в той же самой дозе, вызывал значительную гистологическую атрофию в тимусе и костном мозге. Измерение концентрации кортикостерона в плазме крови крыс. Исследования осуществляли, используя самцов крыс Wistar массой 250-300 г. Животных содержат в комнате с кондиционированием воздуха с искусственным освещением продолжительностью 12 ч, сменяющимся 12-ю часами темноты. В течение четырех суток до эксперимента животные ежесуточно получали по 0,5 мл воды через желудочную канюлю. Массу животных измеряли в предшествующий эксперименту вечер, затем животных помещали в отдельные клетки. Эксперименты проводили утром между 9 и 12 ч. Перед обработкой животных случайным образом распределяли по группам (7 животных/группу). Тестируемые соединения вводили в дозе 15 мг/кг массы организма в объеме растворителя 5 мл/кг массы организма с использованием желудочной канюли. Контрольных животных обрабатывали растворителем. Композиция растворителя содержала 0,2 мл 2,5 М HCl и 19,8 мл дистиллированной воды. Через один час после обработки животных декапитировали и собирали приблизительно 2 мл крови в тестовую пробирку температуры льда, содержащую 100 мкл 2% (мас./об.) К-ЭДТК (калиевой соли этилендиаминтетрауксусной кислоты). Радиоиммуноанализ кортикостерона. Для определения концентрации кортикостерона использовали антитело кортикостерон-3-CMO-BSA(бычий сывороточный альбумин), полученное у кроликов, с разведением 1:40000. Перекрестная реакция антитела с дезоксикортикостероном составляла 1,5%; с прогестероном - 2,3%. Отсутствовала перекрестная реакция с кортизолом, кортизоном, кортексолоном, 11 дегидрокортикостероном,20 гидроксипрогестероном,17 гидроксипрогестероном,17-эстрадиолом, эстроном, эстриолом, тестостероном и дегидроэпиандростероном. В качестве меченого соединения использовали I-125 кортикостерон-3-СМО-ТМЕ (Izotop Intezet, Budapest). Концентрацию кортикостерона измеряли в 10 мкл плазмы крови без экстракции. Калибровочная кривая включала 0,027-40 пмоль кортикостерона/тестируемую пробирку. Радиоактивность измеряли при помощи аппарата LKB Clinigamma. При статистическом анализе использовали одноаспектный дисперсионный анализ и post hoc тест согласно Newman-Keuls. Результаты исследования. Таблица 2 Антагонистическое действие в отношении рецепторов АМРА для тестируемых соединений в тесте распространяющейся депрессии (SD) с использованием сетчатки цыпленка in vitro и их действие на концентрацию кортикостероида в плазме крови после перорального введения в течение 1 ч самцам крыс Wistar дозы 15 мг/кг массы организма in vivo Данные демонстрируют средние значения и среднеквадратическое отклонение.р 0,001 относительно контроля. В соответствии с результатами, представленными в вышеприведенной табл. 2, (R)-(-)-3-ацетил-1-(4 амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин согласно примеру 15 представляет собой эффективное соединение-антагонист АМРА, поскольку действие рецептора АМРА блокировалось со значением полумаксимальной эффективной концентрации (ЕС 50) 3,9 мкМ в тесте распространяющейся депрессии, а (S)-(+)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3 бензодиазепин согласно примеру 16 обладает незначительным действием в отношении рецепторов АМРА, поскольку его значение ЕС 50 выше чем 100 мкМ. Наоборот, (R)-(-)-3-ацетил-1-(4-амино-3-4 016087 метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин согласно примеру 15 не оказывает действия на концентрацию кортикостерона в плазме крови после перорального введения крысам, тогда как(S)-(+)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин согласно примеру 16, используемый в той же дозе, увеличивает концентрацию кортикостерона в плазме крови. Вышеупомянутые результаты доказывают то, что левовращающие дигидро-2,3-бензодиазепиновые соединения общей формулы (I/R), имеющие абсолютную конфигурацию R (например, (R)-(-)-7-ацетил-5(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин или (R)-(-)-3 ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин) представляют собой значительно более хорошие антагонисты АМРА по сравнению с правовращающими соединениями общей формулы (I/S), имеющими абсолютную конфигурацию S (например, (S)-(+)-7-ацетил-5-(4-амино 3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин или (S)-(+)-3-ацетил-1-(4 амино-3-метилфенил)-8-хлор-4- метил-4,5-дигидро-3H-2,3-бензодиазепин). Применение дигидро-2,3-бензодиазепиновых соединений общей формулы (I/R) может быть предпочтительным при лечении заболеваний центральной нервной системы, при которых доказана или предполагается патологическая активность или патофизиологическая роль глутаматергической системы, таким образом, требуется антагонистическое действие в отношении рецепторов АМРА. Терапевтическое применение дигидро-2,3-бензодиазепиновых соединений общей формулы (I/R) может быть весьма благоприятным для лечения таких расстройств центральной нервной системы, для которых требуется длительное введение антагонистов рецептора АМРА для достижения и/или поддержания терапевтического эффекта. На основе вышеприведенных фактов дигидро-2,3-бензодиазепиновые соединения общей формулы(I/R) могут быть использованы, по существу, для лечения инсульта, травмы головного мозга и повреждения спинного мозга, эпилепсии, шизофрении, опухолей в центральной нервной системе, например глиомы, глиобластомы, астроцитомы, олигодендроглиомы; заболеваний, связанных с мышечной спастичностью и нейродегенеративных заболеваний, в особенности болезни Паркинсона, болезни Пика, болезни Альцгеймера, болезни Гентингтона, рассеянного склероза, синдрома Гийена-Барре, мотонейронального заболевания (ALS); кроме того, для лечения спазма, боли, тошноты, влияния на рвоту, мигрени, дизурии,уменьшения симптомов отмены лекарства или тревоги. Правовращающее соединение общей формулы (I/S), имеющее абсолютную конфигурацию S, вызывает значительную гистологическую атрофию в тимусе или в костном мозге крыс после перорального введения в течение одной недели, тогда как левовращающие дигидро-2,3-бензодиазепиновые соединения общей формулы (I/R) влияют на гистологическую картину лишь в незначительной степени. Эти гистологические изменения развиваются вследствие длительного увеличения концентрации кортикостерона в плазме крови (Gopinath С. - Prentice D.E. - Lewis D.J.: Atlas of Experimental Toxicological Pathology MTP Press Limited, 1987. Lancaster, England, page 124). На основе вышеупомянутых фактов терапевтическое применение левовращающих дигидро-2,3 бензодиазепиновых соединений (I/R), имеющих абсолютную конфигурацию R, является предпочтительным. Ожидаемые терапевтические преимущества не изменяются, тогда как отсутствие соединений общей формулы (I/S), имеющих абсолютную конфигурацию S, значительно уменьшает вероятность токсических побочных эффектов. Более конкретно, целью настоящего изобретения являются энантиомерные дигидро-2,3 бензодиазепиновые производные общей формулы (I), где конфигурация хирального атома углерода представляет собой R;X обозначает галоген или атом хлора, предпочтительно атом хлора;Y обозначает атом водорода,или X и Y вместе могут обозначать группу метилендиокси;R обозначает C1-4 алкильную группу, предпочтительно метильную или этильную группу,и их фармацевтически приемлемые соли присоединения кислоты. Дополнительной целью настоящего изобретения являются новые промежуточные соединения, обладающие высокой энантиомерной чистотой, служащие для получения дигидро-2,3-бензодиазепиновых производных. Такие промежуточные соединения представляют собой дигидро-2,3-бензодиазепиновые производные, имеющие высокую энантиомерную чистоту, общей формулы-5 016087 где конфигурация хирального атома углерода представляет собой R;X и Y вместе могут обозначать группу метилендиокси;R обозначает C1-4 алкильную группу, предпочтительно метильную или этильную группу. Еще одной целью настоящего изобретения являются бензо[b]пирановые производные общей формулы где конфигурация хирального атома углерода представляет собой S;V обозначает атом водорода или гидроксильную группу;X и Y вместе могут обозначать группу метилендиокси. Еще одной целью настоящего изобретения являются гидразоновые производные общей формулы где гидразоновое производное представляет собой смесь E и Z изомеров; конфигурация хирального атома углерода представляет собой S;L обозначает гидроксил, алкил или арилсульфонильную группу;Y обозначает галоген или атом галогена, илиX и Y вместе могут обозначать группу метилендиокси;R обозначает C1-4 алкильную группу, предпочтительно метильную или этильную группу. Еще одной целью настоящего изобретения являются рацемические или энантиомерные бензодиазепиновые соединения общей формулы и соли, образованные с их хиральными основаниями, где X и Y вместе обозначают группу метилендиокси.R1 обозначает замещенную ариленовую, алкиленовую группу, предпочтительно цис- или трансалкениленовую группу, более предпочтительно цис-этениленовую группу, и соли, образованные с его хиральными основаниями. Еще одной целью настоящего изобретения являются рацемические или энантиомерные бензодиазепиновые соединения общей формулы где X и Y вместе обозначают группу метилендиокси. Энантиомерные бензодиазепиновые соединения проиллюстрированы общей формулой где каждый R1, R2, R3 является различным и обозначает атом водорода, замещенную или незамещенную,прямоцепочечную или разветвленную, насыщенную или ненасыщенную алкильную группу, замещенную или незамещенную арильную или аралкильную группу;R1 предпочтительно обозначает атом водорода;R3 обозначает фенильную группу. Еще одной целью настоящего изобретения являются рацемические бензодиазепиновые соединения общей формулы где X и Y вместе обозначают группу метилендиокси,и их соли присоединения кислоты, образованные с оптически активными кислотами. Еще одной целью настоящего изобретения являются энантиомерные бензодиазепиновые соединения общей формулы дигидро-2,3 где конфигурация хирального атома углерода представляет собой R или S;X и Y вместе обозначают группу метилендиокси,и их соли присоединения кислоты, образованные с оптически активными кислотами. Еще одной целью настоящего изобретения являются следующие группы соединений:(S)-(+)-5-(4-амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(R)-(-)-5-(4-амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(S)-(+)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(S)-(+)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепин и его фармацевтически приемлемые соли присоединения кислоты,(S)-(+)-8-метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин,(R)-(-)-8-метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин,(S)-(+)-7-ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин,(R)-(-)-7-ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин,(R)-(+)-3-ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин,(S)-(-)-3-ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин,(5RS,7R)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5-g]изохроман,-7 016087(R)-(-)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-ен карбоновая кислота,(S)-(+)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-ен карбоновой кислоты (R)-(+)метилбензиламмониевая соль,(R)-(-)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-ен карбоновой кислоты (S)-(-)метилбензиламмониевая соль,-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7 карбоновой кислоты имидазолид,(+)-7-(N-(1(R)фенилэтил)карбамоил)-8(R)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин,(-)-7-(N-(1(S)фенилэтил)-карбамоил)-8(S)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин,-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин,(S)-(-)-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин и его соли, образованные с оптически активными карбоновыми кислотами,(R)-(-)-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин и их соли, образованные с оптически активными карбоновыми кислотами. Еще одной целью настоящего изобретения является фармацевтическая композиция, содержащая в качестве активного ингредиента дигидро-2,3-бензодиазепиновое производное общей формулы (I) или его фармацевтически приемлемые соли присоединения кислоты, где конфигурация хирального атома углерода представляет собой R или S;X обозначает водород, галоген, атом хлора или алкоксигруппу, предпочтительно C1-C4 алкоксигруппу, такую как метокси;Y обозначает галоген или атом хлора, предпочтительно атом водорода, илиX и Y вместе могут обозначать группу метилендиокси;R обозначает C1-4 алкильную группу, предпочтительно метильную или этильную группу,или в смеси с фармацевтически приемлемыми носителями. В соответствии с наиболее предпочтительным воплощением настоящего изобретения активный ин-8 016087 гредиент представляет собой (R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин или (R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5 дигидро-3H-2,3-бензодиазепин или его фармацевтически приемлемые соли присоединения кислоты. Фармацевтические композиции по настоящему изобретению содержат 0,1-95 мас.%, предпочтительно 1-50 мас.%, более предпочтительно 5-30 мас.% активного ингредиента. Фармацевтическая композиция может быть введена пероральным, парентеральным, ректальным,трансдермальным или местным путем. Лекарственная форма композиции может быть твердой или жидкой. Вводимые перорально твердые лекарственные формы могут представлять собой, например, порошки, таблетки, таблетки с пленочным покрытием, микрокапсулы, они могут содержать в качестве носителей связывающие агенты, например сорбит, поливинилпирролидон; наполнители, например лактозу,глюкозу, крахмал, фосфат калия; вспомогательные вещества, например стеарат магния, тальк, полиэтиленгликоль, диоксид кремения; смазывающие вещества, например лаурилсульфат натрия. Вводимые перорально жидкие лекарственные формы представляют собой, например, растворы,суспензии или эмульсии, они могут содержать в качестве носителей суспендирующие агенты, например желатин, карбоксиметилцеллюлозу; эмульгаторы, например сорбитанмоноолеат; растворители, например воду, масла, пропиленгликоль, этанол; консерванты, например метиловый или пропиловый эфир парагидроксибензойной кислоты. Лекарственные формы для парентерального введения, как правило, представляют собой стерильные растворы активных ингредиентов. Вышеупомянутые лекарственные формы известны из предшествующего уровня техники (например,Remington's Pharmaceutical Sciences, 18. edition, Mack Publishing Co., Easton, USA (1990. Фармацевтические композиции, как правило, содержат одну стандартную дозу. Типичная суточная доза дигидро-2,3-бензодиазепиновых соединений общей формулы (I) или их соответствующих солей присоединения кислоты для взрослого человека составляет 0,1-1000 мг/кг массы организма. Суточная доза может быть введена одной или более порцией в сутки. Эффективная доза зависит от нескольких факторов и определяется лечащим врачом. Фармацевтическую композицию готовят путем смешивания дигидро-2,3-бензодиазепинового соединения общей формулы (I) или его соответствующих солей присоединения кислоты с одним или более носителем, и приготовленную таким образом смесь превращают в фармацевтическую композицию известным образом. Применимые способы известны, например, из вышеприведенного руководства (Remington's Pharmaceutical Sciences). Еще одной целью настоящего изобретения является способ получения дигидро-2,3 бензодиазепиновых соединений общей формулы (I), где конфигурация хирального атома углерода представляет собой R или S;X обозначает галоген или атом хлора, предпочтительно атом хлора;X и Y вместе обозначают группу метилендиокси;R обозначает C1-4 алкильную группу, характеризующуюся восстановлением нитрогруппы соответствующего соединения формулы (V). Восстановление осуществляют с помощью хлорида олова(II), дитионита натрия или в каталитических условиях. Каталитические условия означают использование катализатора, такого как никель Ренея, палладий или платина. В случае работы в каталитических условиях в качестве источников водорода может быть использован водород, гидразина гидрат, муравьиная кислота, триалкиламмония формиат или формиаты щелочного металла. Для получения дигидро-2,3-бензодиазепинового производного общей формулы (I), обладающего высокой энантиомерной селективностью, используют дигидро-2,3-бензодиазепиновое соединение общей формулы (V), обладающее высокой энантиомерной чистотой. В случае энантиоселективного синтеза 2,3 бензодиазепина общей формулы (V) фенил-2-пропанольное производное общей формулы (X), обладающее высокой энантиомерной чистотой Полученную таким образом диастереоизомерную смесь бензо[b]пиранового производного общей формулы (XII), где X и Y являются такими, как определено выше, и V обозначает атом водорода, окисляют до полукетального производного общей формулы где X и Y являются такими, как определено выше. Диастереоизомерную смесь полукетального соединения общей формулы (XIII) подвергают реакции с гидразидом карбоновой кислоты, предпочтительно с гидразидом уксусной кислоты. Полученное гидразоновое соединение общей формулы которое представляет собой смесь Е и Z изомеров, где X, Y и R являются такими, как определено выше,и L обозначает гидроксильную группу, подвергают реакции с алкилсульфонилгалогенидом или арилсульфонилгалогенидом, предпочтительно с метансульфонилхлоридом. В ходе этой реакции получают производное арил- или алкилсульфонилгидразонового типа общей формулы которое представляет собой смесь E и Z изомеров, где X, Y и R являются такими, как определено выше,и R2 обозначает арил, C1-4 алкил, предпочтительно метильную группу. Этот продукт превращают в дигидробензодиазепиновое производное общей формулы (V), обладающее высокой энантиомерной чистотой, путем реакции внутримолекулярной циклизации, после чего соединение общей формулы (V) превращают в дигидро-2,3-бензодиазепиновое производное общей формулы (I) или, при необходимости, в его соль присоединения кислоты. Бензо[b]пирановые производные общей формулы (XII), где X и Y являются такими, как определено выше, V обозначает атом водорода, получают путем реакции фенил-2-пропанольного производного общей формулы (X), обладающего высокой энантиомерной чистотой, с 4-нитробензальдегидным производным общей формулы (XI). Реакцию осуществляют в инертном растворителе, предпочтительно в растворителе типа ароматического углеводорода, более предпочтительно в бензоле или толуоле при температуре от -20 до 150 С, предпочтительно при температуре от 20 до 80 С. Бензо[b]пирановое производное общей формулы (XII), где V обозначает атом водорода, X и Y являются такими, как определено выше, окисляют до соответствующего полукетального производного общей формулы (XIII), где X и Y являются такими, как определено выше. Реакцию осуществляют с комбинацией гидроксид натрия/диметилсульфоксид/воздух в биполярном апротонном растворителе, предпочтительно в диметилформамиде, при температуре от -20 до 150 С, предпочтительно при температуре от 0 до 50 С. Диастереоизомерную смесь полукетального типа общей формулы (XIII) подвергают реакции с гидразидом алифатической карбоновой кислоты, предпочтительно гидразидом уксусной кислоты, в ароматическом или протонном растворителе или их смеси при температуре от -20 до 150 С. Реакцию осуществляют предпочтительно при температуре кипения используемого растворителя.- 10016087 Полученное таким образом производное гидразонового типа общей формулы (XIV), которое представляет собой смесь Е и Z изомеров, где X, Y и R являются такими, как определено выше, и L обозначает гидроксильную группу, подвергают реакции с алкилсульфонилгалогенидным или арилсульфонилгалогенидным соединением, предпочтительно с метансульфонилхлоридом, в присутствии третичного амина,предпочтительно триэтиламина, при температуре от -20 до 150 С, в инертном растворителе. В качестве инертного растворителя могут быть использованы менее полярные растворители, предпочтительно хлорированные алифатические или ароматические растворители, наиболее предпочтительно дихлорметан. Полученное производное гидразонового типа общей формулы (VI), которое представляет собой смесь Е и Z изомеров, где X, Y и R являются такими, как определено выше, и R2 обозначает арил,C1-4 алкил, предпочтительно метильную группу, циклизируют в реакции внутримолекулярной циклизации, добавляя основание, предпочтительно гидроксид щелочного металла, карбонат, гидрид или алкоксид, предпочтительно гидроксид натрия. Циклизацию осуществляют в инертном растворителе, предпочтительно в спиртовом или эфирном растворителе, более предпочтительно в метаноле, этаноле, тетрагидрофуране, диэтиловом эфире, диизопропиловом эфире, диоксане или их смесях в диапазоне температур от -20 до 150 С. Полученное таким образом циклизированное производное общей формулы (V), где X, Y и R являются такими, как определено выше, превращают в дигидро-2,3-бензодиазепиновое производное общей формулы (I), имеющее высокую энантиомерную чистоту, и при необходимости полученные продукты превращают в их соли присоединения кислоты. В реакции циклизации сульфонатное соединение общей формулы (XV) превращают в бензодиазепиновое соединение общей формулы (V) и при этом происходит обращение центра хиральности. В соответствии с наиболее предпочтительным воплощением настоящего изобретения для получения (R)-(-)-7-ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина и его фармацевтически приемлемых солей, обладающих высокой энантиомерной чистотой,(S)метил-1,3-бензодиоксол-5-ол, обладающий высокой энантиомерной чистотой, подвергают реакции с 3-метил-4-нитробензальдегидом. Полученную таким образом диастереоизомерную смесь бензо[b]пиранового соединения общей формулы (XII), где X и Y вместе обозначают группу метилендиокси и V обозначает атом водорода, окисляют до производного полукеталевого типа общей формулы (XIII),где X и Y вместе обозначают группу метилендиокси. Полученную диастереоизомерную смесь производного полукеталевого типа общей формулы (XIII) подвергают реакции с гидразидом уксусной кислоты. Затем полученное производное гидразонового типа, которое представляет собой смесь Е и Z изомеров,где X и Y вместе обозначают группу метилендиокси и L обозначает гидроксильную группу, подвергают реакции с алкилсульфонилгалогенидным или арилсульфонилгалогенидным соединением, предпочтительно с метансульфонилхлоридом. Полученное производное типа арил или алкилсульфонилированного гидразона общей формулы (XV), которое представляет собой смесь E и Z изомеров, где R2 обозначает алкил или арил, предпочтительно метильную группу, циклизируют с использованием основания, предпочтительно гидроксида щелочного металла, карбоната щелочного металла, гидрида щелочного металла или алкоголята щелочного металла, более предпочтительно гидроксида натрия в инертном растворителе,предпочтительно в спирте или в растворителе эфирного типа, наиболее предпочтительно в метаноле,этаноле, тетрагидрофуране, диэтиловом эфире, диизопропиловом эфире, диоксане или в их смесях, при температуре от -20 до 150 С. Циклизация сопровождается обращением центра хиральности. Нитрогруппу полученного производного общей формулы (V) восстанавливают. Полученные дигидро-2,3 бензодиазепиновые производные общей формулы (I), обладающие высокой энантиомерной чистотой,при необходимости превращают в их фармацевтически приемлемую соль присоединения кислоты. Другое особенно предпочтительное воплощение настоящего изобретения заключается в получении(R)-(-)-3-ацетил-1-(4-амино-3-метилфенил)-8-хлор-4-метил-4,5-дигидро-3H-2,3-бензодиазепина и его фармацевтически приемлемых солей, обладающих высокой энантиомерной чистотой, с использованием(S)-1-(4-хлорфенил)пропанола-2 высокой энантиомерной чистоты в соответствии с вышеописанным способом синтеза. Дигидро-2,3-бензодиазепиновые производные общей формулы (V), обладающие высокой энантиомерной чистотой, в качестве промежуточных соединений для получения дигидро-2,3-бензодиазепиновых производных общей формулы (I), обладающих высокой энантиомерной чистотой, могут получать следующим образом. Рацемическое дигидро-2,3-бензодиазепиновое производное общей формулы где X, Y и R являются такими, как определено выше, ацилируют алифатической или ароматической дикарбоновой кислотой, предпочтительно малеиновой кислотой. Полученное рацемическое полуамидное- 11016087 полукислотное производное общей формулы (III), где X, Y и R являются такими, как определено выше,R' обозначает замещенный арилен, алкилен или алкенилен, предпочтительно цис- или транс-алкенилен,наиболее предпочтительно цис-этениленовую группу, превращают в пару диастереоизомерных солей общей формулы где ВН+ обозначает протонированную энантиомерную форму хирального аминосоединения, предпочтительно протонированную форму (S)-(-)метилбензиламина или (R)-(+)метилбензиламина. После этого пару диастереоизомерных солей разделяют при помощи известного способа и желаемое энантиомерное полуамидное-полукислотное производное общей формулы высвобождают из его диастереоизомерной соли известным способом. Полученное таким образом энантиомерное бензодиазепиновое производное общей формулы (II/А) ацилируют алифатической карбоновой кислотой с получением соответствующего дигидро-2,3-бензодиазепина общей формулы (V), обладающего высокой энантиомерной чистотой. Для ацилирования рацемического дигидро-2,3-бензодиазепинового производного общей формулы(II) могут использовать производные алифатической или ароматической дикарбоновой кислоты, предпочтительно производные малеиновой кислоты, наиболее предпочтительно кислые ангидриды. Ацилирование могут осуществлять известным способом. В соответствии с наиболее предпочтительным воплощением реакцию осуществляют в инертном растворе. Предпочтительно рацемическое дигидро-2,3 бензодиазепиновое производное ацилируют в дихлорметане с использованием ангидрида дикарбоновой кислоты. Реакцию могут осуществлять при температуре от -20 до 150 С, предпочтительно при температуре от 20 до 80 С, в присутствии органического или неорганического основания или в отсутствие такового. Применение основания триэтиламина является предпочтительным. Энантиомеры полученного рацемического ацилированного дигидро-2,3-бензодиазепинового производного общей формулы (III) разделяют с использованием вышеописанного способа через диастереоизомерные соли общей формулы (IV), где значения X, Y и R' являются такими, как приведено выше. Известно, что расщепление рацемических солей на их энантиомеры могут осуществлять путем образования соли с энантиомерной формой хирального основания, с использованием подходящих растворителя и условий. В этом случае термодинамически более стабильную диастереоизомерную соль кристаллизуют из растворителя. Полученную чистую диастереоизомерную соль, содержащую один энантиомер хиральной кислоты, могут очищать путем перекристаллизации для увеличения энантиомерной чистоты. В качестве хирального основания для получения диастереоизомерных солей могут использовать хиральные основания, предпочтительно хиральные амины, например (R)-(+)метилбензиламин, (S)-(-)-метилбензиламин, (+)-дегидро-абиетил-амин, хинин, (-)-1-(4-нитрофенил)-2-амино-1,3-пропандиол или (S)-(+)-2-бензил-амино-1-бутанол. Наиболее предпочтительно могут использовать (R)-(+)- или(S)-(-)-изомеры -метилбензиламина. Выбор наиболее подходящего хирального основания для получения диастереоизомерной соли зависит от соответствующего дигидро-2,3-бензодиазепинового производного, и этот выбор специалист в данной области техники осуществляет по своему усмотрению. Соли получают в биполярном апротонном растворителе, предпочтительно в этилацетате, при комнатной температуре. Диастереоизомерные соли разделяют известным способом, например путем кристаллизации термодинамически более стабильных кристаллов, после чего полученные кристаллы отделяют от маточной жидкости. Кристаллы, разделенные и энантиомерно обогащенные единичным энантиомером, дополнительно могут очищать путем перекристаллизации(ий). Выделенное дигидро-2,3-бензодиазепиновое производное, содержащее единичный энантиомер общей формулы (IV), могут высвобождать из его диастереоизомерной соли с помощью разбавленных неорганических кислот. Полученную энантиомерную кислоту общей формулы (III/A), где конфигурация хи- 12016087 рального атома углерода представляет собой R или S, гидролизуют в присутствии гидроксида лития и перекиси водорода. Реакцию осуществляют в инертном растворителе, предпочтительно в растворителе эфирного типа, наиболее предпочтительно в тетрагидрофуране, при температуре от -20 до 150 С, предпочтительно при температуре от 20 до 80 С, наиболее предпочтительно при температуре 50 С. В результате гидролиза получают энантиомерный дигидро-2,3-бензодиазепин общей формулы (II/A) из которого после ацилирования могут получать дигидро-2,3-бензодиазепин общей формулы (V). Ацилирование дигидро-2,3-бензодиазепинового производного общей формулы (II/A) могут осуществлять с использованием соответствующей карбоновой кислоты в присутствии дициклогексилкарбодиимида. Более предпочтительно применение производных кислот, таких как, например, галогениды кислот, предпочтительно хлориды кислот или ангидриды кислот. В соответствии с наиболее предпочтительным способом используют ангидрид уксусной кислоты или ангидрид пропионовой кислоты. Ацилирование могут осуществлять в присутствии соединения, связывающего кислоту, или без него. В качестве соединений, связывающих кислоту, могут использовать органические или неорганические соединения. В качестве соединения, связывающего органическую кислоту, подходят третичные амины,предпочтительно триэтиламин. В качестве агентов, связывающих неорганическую кислоту, могут выступать, например, карбонаты щелочного металла или щелочно-земельного металла. Ацилирование могут осуществлять в инертном растворителе или без растворителя при температуре от 20 до 150 С. В качестве инертного растворителя могут использовать менее полярные растворители,растворители эфирного типа, биполярные апротонные растворители. В качестве менее полярных растворителей могут выступать галогенированные алифатические или ароматические растворители, предпочтительно дихлорметан, дихлопентан, хлороформ или ароматические растворители или их смеси, например в качестве растворителя инертного типа - тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, диоксан или их смесь, в качестве диполярного апротонного растворителя - диметилформамид,N-метилпирролидон, ацетонитрил, ацетон или их смеси. В соответствии с изобретением дигидро-2,3-бензодиазепиновое производное общей формулы (V),используемое в качестве промежуточного соединения для получения дигидро-2,3-бензодиазепинового производного общей формулы (I), обладающего высокой энантиомерной чистотой, где X, Y и R являются такими, как определено выше, могут получать путем реакции рацемического дигидро-2,3 бензодиазепинового соединения общей формулы (II), где X, Y и R являются такими, как определено выше, с 1,1'-карбонилдиимидазолом в инертном растворителе. В предпочтительном воплощении эту реакцию осуществляют в растворителе эфирного типа, наиболее предпочтительно в тетрагидрофуране, при температуре от -20 до 150 С, предпочтительно при температуре от 20 до 80 С, наиболее предпочтительно при температуре кипения растворителя. Полученное рацемическое карбонилимидазолидиновое производное общей формулы (VI) подвергают реакции с единичным энантиомером хирального амина в диполярном апротонном растворителе,предпочтительно в диметилформамиде, N-метилпирролидоне, ацетонитриле, ацетоне или их смесях,наиболее предпочтительно в диметилформамиде, при температуре от 20 до 150 С, предпочтительно при температуре от 60 до 120 С. Наиболее предпочтительно, в качестве хирального амина используют (R)-(+)- или (S)(-)-метилбензиламин. Компоненты полученной диастереоизомерной смеси дигидро-2,3-бензодиазепиновых производных общей формулы (VII) разделяют обычным способом. В формуле (VII) конфигурация хирального атома углерода одного диастереоизомерного дигидро-2,3-бензодиазепина представляет собой R, а другого - S,тогда как конфигурация другого хирального атома углерода диастереоизомерного соединения является такой же, как конфигурация используемого хирального амина, X, Y и R являются такими, как определено выше, заместители R1, R2, R3 отличаются друг от друга, и они обозначают атом водорода, замещенный или незамещенный, прямоцепочечный или разветвленный, насыщенный или ненасыщенный алкил, замещенную или незамещенную ариларалкильную группу, предпочтительно R1 обозначает атом водорода,R2 обозначает метильную группу, R3 обозначает фенильную группу. Физические свойства диастереоизомеров, такие как, например, растворимость, существенно различаются. Вследствие термодинамического равновесия в подходящем растворителе из раствора осаждается более стабильный диастереоизомер, тогда как менее стабильный диастереоизомер остается в растворе. Подходящие растворители представляют собой спирты, например изопропанол или этанол. Два диастереоизомера могут отделять друг от друга путем фильтрации, оптическую чистоту фильтрованной соли- 13016087 могут увеличивать путем перекристаллизации. Разделенные дигидро-2,3-бензодиазепиновые производные, обладающие высокой энантиомерной чистотой, общей формулы (VII), где конфигурация одного хирального атома углерода представляет собой R или S, тогда как конфигурация другого хирального атома углерода зависит от используемого хирального амина, возможно, очищают путем перекристаллизации, после чего диастереоизомеры дигидро 2,3-бензодиазепина, обладающего высокой стереохимической чистотой, гидролизуют в кислых условиях,предпочтительно при температуре от 20 до 80 С, наиболее предпочтительно при 25 С, затем полученные дигидро-2,3-бензодиазепиновые производные общей формулы (II/A) ацилируют производными алифатических карбоновых кислот известным способом, получая в результате дигидро-2,3-бензодиазепиновые производные, обладающие высокой энантиомерной чистотой, общей формулы (V). Дигидро-2,3 бензодиазепиновые соединения общей формулы (II/A) могут ацилировать, как упомянуто выше. Ацилированные дигидро-2,3-бензодиазепиновые производные, например (R)-(-)-7-ацетил-8-метил 5-(3-амино-4-метилфенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин или (R)-(-)-5-(4-амино 3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин,которые получают в соответствии с любым из вышеописанных способов, при необходимости превращают в фармацевтически приемлемые соли. Целью настоящего изобретения является еще один способ получения дигидро-2,3 бензодиазепиновых производных общей формулы (I), где конфигурация хирального атома углерода представляет собой R или S, X и Y вместе обозначают группу метилендиокси, R обозначаетC1-4 алкильную группу, который включает ацилирование соответствующего дигидро-2,3 бензодиазепинового производного общей формулы производным алифатической карбоновой кислоты. Ацилирование могут осуществлять с помощью карбоновых кислот с использованием, например, дициклогексилкарбодиимида, или с помощью производных карбоновых кислот, предпочтительно хлоридов кислот, ангидридов кислот, предпочтительно ангидридов кислот, наиболее предпочтительно ангидрида уксусной кислоты или ангидрида пропионовой кислоты, в присутствии или в отсутствие инертного растворителя, возможно в присутствии агентов, связывающих органические или неорганические кислоты, при температуре от -20 до 150 С. В качестве агента, связывающего неорганические кислоты, могут выбирать, например, карбонаты или гидрокарбонаты щелочного металла или щелочно-земельного металла, в качестве соединения, связывающего органические кислоты, могут выбирать третичные амины, пиридин, предпочтительно триэтиламин. Инертные растворители представляют собой менее полярные растворители, растворители эфирного типа или биполярные апротонные растворители. В качестве менее полярных растворителей могут выбирать галогенированные алифатические или ароматические растворители, предпочтительно дихлорметан,дихлорэтан, хлороформ или их смеси. Растворители эфирного типа представляют собой тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, диоксан или их смеси. Биполярные апротонные растворители представляют собой диметилформамид, N-метилпирролидон, ацетонитрил, ацетон или их смеси. В ходе получения дигидро-2,3-бензодиазепинового производного общей формулы (VIII/А), обладающего высокой энантиомерной чистотой, где X, Y и R являются такими, как определено выше, рацемический дигидро-2,3-бензодиазепин общей формулы (II) восстанавливают, затем полученное рацемическое дигидро-2,3-бензодиазепиновое производное общей формулы (VIII) превращают в пару диастереоизомерных солей с использованием единичного энантиомера оптически активной органической кислоты,затем полученную таким образом пару диастереоизомерных солей разделяют известным способом. После разделения полученной диастереоизомерной соли общей формулы где А- представляет собой анион оптически активной кислоты и конфигурация хирального атома углерода бензодиазепинового производного представляет собой R или S,- 14016087 ее могут очищать путем перекристаллизации. Из полученной соли, содержащей дигидро-2,3 бензодиазепиновое производное, которое обладает высокой энантиомерной чистотой, могут выделять основание. Восстановление вышеупомянутого рацемического дигидро-2,3-бензодиазепинового производного общей формулы (II) осуществляют с использованием хлорида олова (II), дитионита натрия или его осуществляют в каталитических условиях. В каталитических условиях используемый катализатор может представлять собой никель Ренея,палладий или платину, тогда как источник водорода может представлять собой водород, гидразина гидрат, муравьиную кислоту, триалкиламмония формиат или формиат щелочного металла. Для получения диастереоизомерных солей энантиомер оптически активных органических кислот,наиболее предпочтительно L- или D-винной кислоты или полу-4-хлоранилид, могут использовать в биполярном апротонном растворителе или в растворителе спиртового типа. Биполярные апротонные растворители представляют собой ацетонитрил, ацетон, этилацетат, а растворители спиртового типа представляют собой этанол или изопропанол. Образование соли осуществляют при температуре от -20 до 150 С, предпочтительно при температуре от 20 до 80 С, наиболее предпочтительно при комнатной температуре. Полученные диастереоизомерные соли разделяют путем фильтрации. Фильтрованную диастереоизомерную соль, которая содержит в основном один энантиомер дигидро-2,3-бензодиазепинового производного, могут очищать путем дополнительных стадий перекристаллизации. Маточный раствор, содержащий другое энантиомерное соединение, могут выпаривать и полученный кристаллический продукт могут перекристаллизовывать с получением соответствующего энантиомера. Диастереоизомерная соль, полученная путем фильтрации или путем перекристаллизации остатка после выпаривания маточной жидкости, содержащей единственный энантиомер соли дигидро-2,3 бензодиазепина, может быть превращена в свободный единственный энантиомер дигидро-2,3 бензодиазепинового основания с использованием основания. Для этой задачи подходят органические или неорганические основания, например триэтиламин, карбонат натрия или гидрокарбонат натрия. Полученные энантиомерно чистые дигидро-2,3-бензодиазепиновые производные общей формулы(VIII/A), где конфигурация хирального атома углерода представляет собой R или S, ацилируют, как описано выше, с получением соответствующих дигидро-2,3-бензодиазепиновых соединений общей формулы(I), обладающих высокой энантиомерной чистотой. Полученные дигидро-2,3-бензодиазепиновые соединения, например (R)-(-)-7-ацетил-8-метил-5-(3 амино-4-метилфенил)-8,9-дигидро-7 Н-1,3-д иоксоло[4,5-h][2,3]бензодиазепин или (R)-(-)-5-(4-амино-3 метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин, при необходимости, могут превращать в фармацевтически приемлемые соли. В соответствии с изобретением для образования соли могут использовать любую фармацевтически приемлемую органическую или неорганическую кислоту, например соляную кислоту, бромоводородную кислоту, серную кислоту, ортофосфорную кислоту. Также могут использовать алифатическую или ароматическую моно-, ди-, три- и поликарбоновую кислоту, кроме того, арил или алкилсульфоновые кислоты, например бензойную кислоту или метансульфоновую кислоту. В случае использования многоосновных кислот предпочтительно могут образовываться кислые соли, такие как гидросульфат, гемифумарат. В еще одном аспекте настоящее изобретение относится к применению дигидро-2,3 бензодиазепинового производного общей формулы (I) или его фармацевтически приемлемых солей присоединения кислоты для изготовления фармацевтических композиций. Эти композиции подходят для лечения инсульта, травмы головного мозга и повреждения спинного мозга, эпилепсии, шизофрении, опухолей в центральной нервной системе, например глиомы, глиобластомы, астроцитомы, олигодендроглиомы; заболеваний, связанных с мышечной спастичностью, и хронических нейродегенеративных заболеваний, в особенности болезни Паркинсона, болезни Пика, болезни Альцгеймера, болезни Гентингтона, рассеянного склероза, синдрома Гийена-Барре, мотонейронального заболевания (ALS); кроме того, для лечения спазма, боли, тошноты, для влияния на рвоту, мигрени, дизурии, для уменьшения симптомов отмены лекарства или тревоги. В еще одном аспекте настоящее изобретение представляет собой способ лечения инсульта, травмы головного мозга и повреждения спинного мозга, эпилепсии, шизофрении, опухолей в центральной нервной системе, например глиомы, глиобластомы, астроцитомы, олигодендроглиомы; заболеваний, связанных с мышечной спастичностью, и хронических нейродегенеративных заболеваний, в особенности болезни Паркинсона, болезни Пика, болезни Альцгеймера, болезни Гентингтона, рассеянного склероза,синдрома Гийена-Барре, мотонейронального заболевания (ALS); кроме того, для лечения спазма, боли,тошноты, для влияния на рвоту, мигрени, дизурии, для уменьшения симптомов отмены лекарства или тревоги путем введения пациенту, нуждающемуся в таком лечении, фармацевтически эффективного количества соединения дигидро-2,3-бензодиазепинового производного общей формулы (I), где конфигурация хирального атома углерода представляет собой R или S, X и Y вместе обозначают группу метилендиокси, R обозначает C1-4 алкильную группу, или его фармацевтически приемлемой соли присоединения кислоты.- 15016087 Новые хиральные дигидро-2,3-бензодиазепиновые производные по настоящему изобретению демонстрируют весьма благоприятное терапевтическое действие и помимо этого они проявляют меньше побочных эффектов по сравнению с известными активными фармацевтическими ингредиентами, что дает возможность увеличивать терапевтическую дозу, без необходимости принимать во внимание опасные побочные эффекты известных активных ингредиентов. Кроме того, в настоящем изобретении предложен экономичный способ синтеза определенных соединений. Арил-2-пропанольные соединения, обладающие высокой энантиомерной чистотой, проиллюстрированные общей формулой (X), могут быть получены, как описано в венгерской заявке на патент Р 041267, и они служат в качестве исходного вещества стереоселективного синтеза. Настоящее изобретение более конкретно представлено в нижеприведенных примерах, однако объем защиты не ограничивается примерами. Последовательность продуктов и промежуточных соединений представлена ниже в соответствии с последовательностью вышеописанных способов синтеза. Номера в общей формуле, представленные специфическим примером, отмечены в заглавиях примеров. Стереоселективный синтез. Пример 1.(5RS,7S)-7-Метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5-g]изохроман (XII). К раствору 20,0 г (110,9 ммоль) (S)метил-1,3-бензодиоксол-5-этанола и 18,31 г (110,9 ммоль) 3 метил-4-нитробензальдегида в 220 мл толуола добавляют 16,2 мл (200 ммоль) концентрированной соляной кислоты. Смесь перемешивают в течение 24 ч при комнатной температуре. Осажденные кристаллы фильтруют и промывают 330 мл толуола, 330 мл воды, затем 20 мл этанола. Фильтрат промывают 200 мл воды, 100 мл насыщенного раствора карбоната натрия, затем 3100 мл воды, сушат над безводным сульфатом натрия, затем упаривают. Остаток объединяют с кристаллами, которые отфильтровывают из реакционной смеси и растворяют в 400 мл горячего этанола, затем кристаллизуют в течение 16 ч при комнатной температуре. Осажденные кристаллы фильтруют и промывают 330 мл этанола. Таким образом, выход составляет 21,35 г (59%) указанного в заголовке продукта. Температура плавления: 150-152 С.(5RS,7R)-7-Метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5-g]изохроман (XII). Реакцию осуществляют в соответствии с примером 1 с исключением того, что в качестве исходного вещества используют (R)метил-1,3-бензодиоксол-5-этанол. Таким образом, выход составляет 84% указанного в заголовке продукта. Температура плавления составляет 151-153 С.(XIII). Раствор 9,82 г (30,0 ммоль) (5RS,7S)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3 диоксоло[4,5-g]изохромана в смеси 23 мл диметилсульфоксида и 83 мл диметилформамида охлаждают в бане лед-вода, затем добавляют 4,2 мл (42,0 ммоль) 10 н. водного гидроксида натрия. Реакционную смесь барботируют воздухом в течение 6 ч при комнатной температуре. Реакционную смесь затем медленно добавляют к раствору 230 мл (230,0 ммоль) 1 н. соляной кислоты и охлаждают смесью лед-вода. Осажденный продукт фильтруют, промывают водой и сушат до постоянной массы (9,15 г). Продукт представляет собой смесь изомеров и может быть использован на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3442, 1521, 1484, 1346, 1238, 1037 см-1.(S)-Уксусной кислоты 6-(2-гидроксипропил)-1,3-бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразид (XIV). К раствору 3,68 г (10,7 ммоль) (5RS,7S)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3 диоксоло[4,5-g]изохроман-5-ола (полученного на стадии А) в 26 мл изопропанола добавляют 1,03 г(13,9 ммоль) гидразида уксусной кислоты и 0,22 мл (2,67 ммоль) концентрированной соляной кислоты. Раствор кипятят в течение 6 ч, затем охлаждают до комнатной температуры и растворитель упаривают при пониженном давлении. Остаток растворяют в 100 мл этилацетата, затем полученный раствор промывают 50 мл насыщенного раствора гидрокарбоната натрия, затем 350 мл насыщенного раствора хлорида натрия и сушат над безводным сульфатом натрия. После отфильтровывания осушителя растворитель упаривают в вакууме. Продукт представляет собой желтое масло (3,78 г, 88%), которое представляет собой смесь Е и Z изомеров в соотношении приблизительно 1:1 и которое может быть использовано на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3420, 1675, 1517, 1485, 1342, 1229, 1037 см-1. 1 Н-ЯМР (CDCl3, 400 МГц): 8.95 (bs, 0.5H), 8.79 (bs, 0.5 Н), 7.94 (d, J=8.4 Гц, 0.5 Н), 7.94 (d, J=9.2 Гц),7.52 (m, 2H), 6.97 (s, 0.5H), 6.94 (s, 0.5H), 6.53 (s, 0.5H), 6.50 (s, 0.5H), 6.07 (d, J=1.2 Гц, 0.5 Н), 6.05 (d,J=1.2 Гц, 0.5 Н), 6.04 (d, J=1.2 Гц, 0.5 Н), 6.02 (d, J=1.2 Гц, 0.5 Н), 3.88 (m, 0.5H), 3.72 (m, 0.5H), 2.59 (s, 3H),2.42 (s, 1.5H), 2.38 (s, 1.5H), 2.20-2.40 (m, 2H), 1.10 (d, J=6.1 Гц, 1.5 Н), 1.10 (d, J=6.1 Гц, 1.5 Н) млн-1. Стадия С.(S)-Уксусной кислоты [6-[2-(метилсульфонил-окси-пропил)-1,3-бензодиоксол-5-ил](3-метил-4 нитрофенил)метилен]гидразид (XV). К раствору 3,78 г (9,5 ммоль) (S)-уксусной кислоты 6-(2-гидроксипропил)-1,3-бензодиоксол-5 ил](3-метил-4-нитрофенил)метилен]гидразида (полученного на стадии В) в 38 мл дихлорметана добавляют 1,94 мл (14 ммоль) триэтиламина, затем реакционную смесь охлаждают до температуры 0-5 С с использованием бани лед-вода. Затем к реакционной смеси по каплям добавляют 0,77 мл (9,9 ммоль) метансульфонилхлорида и реакционную смесь хранят охлажденной и перемешивают в течение еще 3 ч. Смесь разбавляют 30 мл дихлорметана и промывают 30 мл воды, 30 мл 1 н. соляной кислоты, затем 330 мл насыщенного раствора хлорида натрия, сушат с сульфатом натрия и органический слой упаривают при пониженном давлении. Таким образом, выход составляет 4,36 г желтого масла в виде смеси оптически активных гидразидов, которые используют на следующей реакционной стадии без дополнительной очистки. Стадия D. В 90 мл метанола растворяют 4,36 г (S)-уксусной кислоты [6-[2-(метилсульфонил)окси]пропил)-1,3 бензодиоксол-5-ил](3-метил-4-нитрофенил)метилен]гидразида (полученного на стадии С). Раствор охлаждают до температуры 0-5 С с использованием бани лед-вода и добавляют 1,0 мл (10,0 ммоль) 10 н. водного раствора гидроксида натрия. Реакционную смесь перемешивают в течение 3 ч, затем упаривают при пониженном давлении. Остаток затвердевает в результате добавления еще 30 мл воды, его фильтруют и промывают 55 мл воды. Полученный неочищенный продукт подвергают хроматографии на силикагеле с использованием смеси гексана и этилацетата. Продукт перекристаллизовывают из изопропанола. Таким образом, получают 1,93 г (общий выход 30%, рассчитанный по изохромановому соединению) желаемого продукта. Температура плавления продукта составляет 124-127 С.(R)-(-)-7-Ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/R). В смеси 100 мл дихлорметана и 10 мл метанола растворяют 1,91 г (5,0 ммоль) (R)-(-)-7-ацетил-8 метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина и гидрируют при давлении 5,065105 Па при комнатной температуре в присутствии 0,10 г 10% палладия на древесном- 17016087 угле в течение 1,5 ч. Катализатор отфильтровывают после завершения реакции гидрирования, растворитель упаривают и неочищенный продукт перекристаллизовывают из 20 мл метанола. Таким образом,получают 1,41 г (80%) желаемого соединения. Температура плавления: 123-130 С.(S)-(+)-7-Ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). Реакцию осуществляют в соответствии с примером 3 за исключением того, что в качестве исходного вещества используют (5RS,7R)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5g]изохроман (пример 2). Таким образом, рассчитанный выход составляет 30% по указанному в заголовке продукту. Температура плавления: 123-127 С.(S)-(+)-7-Ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/S). Реакцию осуществляют, используя мольные отношения, условия реакции и обработку реакционной смеси, описанные в примере 4, за исключением того, что в качестве исходного вещества используют (S)(+)-7-ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин(пример 5). Указанный в заголовке продукт получают с выходом 80%. Температура плавления: 122-130 С.(R)-(-)-8-Метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). Реакцию осуществляют, используя мольные отношения, условия реакции и обработку реакционной смеси, описанные в примере 3 за исключением того, что в качестве исходного соединения используют(5RS,7S)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5-g]изохроман (пример 1) и в качестве кислого гидразидного соединения на стадии В используют гидразид пропионовой кислоты. Продукт может быть использован без дополнительной очистки. 1 Н ЯМР (CDCl3): 8.00 (1 Н, d, J=9.6 Гц), 7.54 (2 Н, m), 6.77 (1 Н, s), 6.49 (1 Н, s), 6.01 (2 Н, s), 5.37 (1 Н,m), 2.98 (1 Н, dd, J=14.5 es J=3.4 Гц), 2.76 (1H, dd, J=14.6 es J=8.7 Гц), 2.66 (2H, m), 2.64 (3H, s), 1.14 (3H, t,J=7.4 Гц), 1.09 (3H, d, J=6.5 Гц) млн-1. Пример 8.(R)-(-)-5-(4-Амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/R). В смеси 100 мл дихлорметана и 10 мл метанола 1,91 г (5,0 ммоль) (-)-8-метил-5-(3-метил-4 нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина гидрируют при давлении 5,065105 Па при комнатной температуре в присутствии 0,10 г катализатора 10% палладия на древесном угле в течение 1,5 ч. Катализатор отфильтровывают после завершения реакции гидрирования,растворитель упаривают и неочищенный продукт перекристаллизовывают из 20 мл метанола. Таким образом, получают 1,40 г (80%) желаемого продукта.(S)-(+)-8-Метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). Реакцию осуществляют, используя мольные отношения, условия реакции и обработку реакционной смеси, описанные в примере 3, за исключением того, что в качестве исходного соединения используют(5RS,7R)-7-метил-5-(3-метил-4-нитрофенил)-7,8-дигидро-5 Н-1,3-диоксоло[4,5-g]изохроман (пример 2) и в качестве кислого гидразидного соединения на стадии В используют гидразид пропионовой кислоты. Продукт может быть использован без дополнительной очистки. 1 Н-ЯМР (CDCl3): 8.00 (1 Н, d, J=9.6 Гц), 7.54 (2 Н, m), 6.77 (1 Н, s), 6.49 (1 Н, s), 6.01 (2 Н, s), 5.37(S)-(+)-5-(4-Амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/S). В смеси 100 мл дихлорметана и 10 мл метанола 1,91 г (5,0 ммоль) (S)-(+)-8-метил-5-(3-метил-4 нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина гидрируют при давлении 5,065105 Па при комнатной температуре в присутствии 0,10 г катализатора 10% палладия на древесном угле в течение 1,5 ч. Катализатор отфильтровывают после завершения реакции гидрирования,растворитель упаривают и неочищенный продукт перекристаллизовывают из 20 мл метанола. Таким образом, получают 1,40 г (80%) желаемого продукта. Температура плавления: 176-178 С.(1RS,3S)-7-Хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман (XII). К раствору 8,9 г (52,0 ммоль) (S)-(+)-1-(4-хлорфенил)-2-пропанола и 8,58 г (52,0 ммоль) 3-метил-4 нитробензальдегида в 80 мл безводного бензола добавляют 10,63 г (78,0 ммоль) высушенного плавлением измельченного безводного хлорида цинка, затем в реакционную смесь в течение 5 ч при интенсивном перемешивании вводят безводный газообразный хлорид водорода. Затем реакционную смесь кипятят с обратным холодильником в течение 1,5 ч. Органический слой декантируют с растворенного слоя хлорида цинка, затем органический слой перемешивают с 380 мл толуола. Собранные органические слои объединяют и промывают 580 мл 25%-ного водного раствора бисульфита натрия, 80 мл насыщенного раствора гидрокарбоната натрия, 380 мл воды, сушат над сульфатом натрия, затем упаривают. Остаток растворяют в 15 мл горячего этанола и хранят в течение 16 ч в холодильнике. Осажденные кристаллы фильтруют и промывают 35 мл этанола. Таким образом, выход составляет 3,51 г (21,2%) желаемого продукта. Температура плавления составляет 142-147 С.(1RS,3R)-7-Хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман (XII). К раствору 8,53 г (50,0 ммоль) (R)-(-)-1-(4-хлорфенил)-2-пропанола и 8,25 г (50,0 ммоль) 3-метил-4 нитробензальдегида в 80 мл безводного бензола добавляют 10,22 г (75,0 ммоль) измельченного высушенного плавлением безводного хлорида цинка, затем в реакционную смесь в течение 5 ч при интенсивном перемешивании вводят безводный газообразный хлорид цинка. Затем реакционную смесь кипятят с обратным холодильником в течение 1,5 ч. Органический слой декантируют с растворенного слоя хлорида цинка, затем органический слой перемешивают с 380 мл толуола. Собранные органические слои- 19016087 объединяют, промывают 580 мл 25%-ного водного раствора бисульфита натрия, 80 мл насыщенного раствора гидрокарбоната натрия, 380 мл воды, сушат над сульфатом натрия, затем упаривают. Остаток растворяют в 15 мл горячего этанола и хранят в течение 16 ч в холодильнике. Осажденные кристаллы фильтруют и промывают 35 мл этанола. Таким образом, выход составляет 3,42 г (21,5%) желаемого продукта. Температура плавления составляет 141-144 С.(1RS,3S)-7-Хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман-1-ол (XIII). Раствор 3,35 г (10,0 ммоль) (1RS,3S)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохромана в смеси 8 мл диметилсульфоксида и 27 мл диметилформамида охлаждают в бане лед-холодная вода, затем добавляют 1,8 мл (18,0 ммоль) 10 н. водного гидроксида натрия. Реакционную смесь барботируют воздухом в течение 4 ч при комнатной температуре. Реакционную смесь добавляют к раствору 67 мл (67 ммоль) 1 н. соляной кислоты, охлажденной в бане лед-холодная вода. Осажденный продукт фильтруют, промывают водой и сушат до постоянной массы (3,65 г). Продукт представляет собой смесь изомеров и может быть использован на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3333, 1653, 1520, 1347, 1172, 1066 см-1. 1 Н-ЯМР (CDCl3, 500 МГц): 7.96 (d, J=9,2 Гц, 1 Н), 7.56 (m, 2 Н), 7.18 (dd, J1=2.2 Гц, J2=8.3 Гц, 1 Н),7.09 (d, J=8.2 Гц, 1 Н), 6.96 (d, J=2.2 Гц, 1 Н), 4.45 (m, 1 Н), 2.80 (m, 2 Н), 2.61 (s, 3 Н), 1.43 (d, J=6.2 Гц, 3 Н) млн-1. 13 С-ЯМР (CDCl3): 149.38, 138.49, 133.72, 132.33, 132.18, 130.55, 129.97, 128.98, 128.47, 127.88,124.84, 124.79, 97.26, 65.70, 35.55, 21.30, 20.70 млн-1. Стадия В.(S)-Уксусной кислоты 5-хлор-2-(2-гидроксипропил)фенил]-(3-метил-4-нитрофенил)метилен]гидразид (XIV). К раствору 3,52 г (10,0 ммоль) (1RS,3S)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман-1-ола,полученного на стадии А, 1,16 г (15,7 ммоль), добавляют гидразид уксусной кислоты и 0,23 мл(2,8 ммоль) концентрированной соляной кислоты в 15 мл изопропанола. Раствор кипятят в течение 6 ч, затем охлаждают до комнатной температуры и растворитель упаривают в вакууме. Остаток растворяют в 100 мл этилацетата, полученный раствор промывают 50 мл насыщенного раствора гидрокарбоната натрия, 350 насыщенного раствора хлорида натрия и сушат над безводным сульфатом натрия. После того как осушитель отфильтрован, растворитель упаривают в вакууме. Продукт представляет собой желтое масло (3,66 г, 94%), представляющее собой смесь Е и Z изомеров в отношении приблизительно 1:1. Смесь может быть использована на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3423, 1670, 1518, 1339, 732 см-1. 1 Н-ЯМР (CDCl3, 500 МГц): 7.95 (m, 1H), 7.46 (m, 4 Н), 7.15 (m, 0.5 Н), 7.09 (m, 0.5 Н), 3.93 (m, 0.5 Н),3.71 (m, 0.5 Н), 5.59 (s, 3 Н), 2.42 (s, 1.5 Н), 2.39 (m, 2 Н), 2.35 (s, 1.5 Н), 1.14 (d, J=6.1 Гц, 1.5 Н), 1.13 (d,J=6.2 Гц, 1.5 Н) млн-1. Стадия С.(S)-Уксусной кислоты 2-[2-[(метилсульфонил)окси]пропил]-5-хлорфенил](3-метил-4 нитрофенил)метилен]гидразид (XV). К раствору 3,66 г (9,38 ммоль) (S)-уксусной кислоты [5-хлор-2-(2-гидроксипропил)фенил]-(3-метил 4-нитрофенил)метилен]гидразида, полученному в соответствии со стадией В, в 30 мл дихлорметана добавляют 1,93 мл (15 ммоль) триэтиламина, затем реакционную смесь охлаждают при 0-5 С. К реакционной смеси по каплям добавляют 0,6 мл (11,0 ммоль) метансульфонилхлорида и реакционную смесь хранят охлажденной и перемешивают в течение еще 4 ч. Затем смесь разбавляют 30 мл дихлорметана и промывают 25 мл воды, 25 мл 1 н. соляной кислоты, затем 325 мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия, затем упаривают в вакууме. Таким образом, выход составляет 4,14 г(94%) желтого масла, представляющего собой смесь оптически активных гидразидов, которые используют на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3181; 1683, 1520, 1330, 1172 см-1.(R)-(+)-3-Ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин (V). В 62 мл метанола растворяют 4,14 г (8,8 ммоль) (S)-уксусной кислоты 2-[2[(метилсульфонил)окси]пропил]-5-хлорфенил](3-метил-4-нитрофенил)метилен]гидразида. Раствор охлаждают при температуре 0-5 С с баней лед-холодная вода и добавляют 1,0 мл (10,0 ммоль) 10 н. водного гидроксида натрия. Реакционную смесь перемешивают в течение 4 ч, затем упаривают в вакууме. Остаток затвердевает в результате добавления еще 30 мл воды, затем его фильтруют и промывают 55 мл воды. Полученный неочищенный продукт подвергают хроматографии на силикагеле с использованием смеси гексана и этилацетата. Продукт перекристаллизовывают из этанола. Выход 1,25 г (33,6% представляет собой общий рассчитанный выход изохроманового соединения). Температура плавления продукта составляет 165-167 С.(1RS,3R)-7-Хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман-1-ол (XIII). Раствор 3,35 г (10,0 ммоль) (1RS,3R)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохромана растворяют в смеси 8 мл диметилсульфоксида и 27 мл диметилформамида, охлажденного в бане лед-холодная вода, затем добавляют 1,8 мл (18,0 ммоль) 10 н. водного гидроксида натрия. Реакционную смесь барботируют воздухом в течение 4 ч при комнатной температуре. Реакционную смесь добавляют к раствору 67 мл (67 ммоль) 1 н. соляной кислоты, охлажденной в бане лед-холодная вода. Осажденный продукт фильтруют, промывают водой и сушат до постоянной массы (3,59 г). Продукт представляет собой смесь изомеров и может быть использован на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3333, 1653, 1520, 1347, 1172, 1066 см-1. 1 Н-ЯМР (CDCl3, 500 МГц): 7.96 (d, J=9.2 Гц, 1 Н), 7.56 (m, 2 Н), 7.18 (dd, J1=2.2 Гц, J2=8.3 Гц, 1 Н),7.09 (d, J=8.2 Гц, 1 Н), 6.96 (d, J=2.2 Гц, 1 Н), 4.45 (m, 1 Н), 2.80 (m, 2 Н), 2.61 (s, 3 Н), 1.43 (d, J=6.2 Гц, 3 Н) млн-1. 13 С-ЯМР (CDCl3): 149.38, 138.49, 133.72, 132.33, 132.18, 130.55, 129.97, 128.98, 128.47, 127.88,124.84, 124.79, 97.26, 65.70, 35.55, 21.30, 20.70 млн-1. Стадия В.(R)-Уксусной кислоты 5-хлор-2-(2-гидроксипропил)фенил]-(3-метил-4-нитрофенил)метилен]гидразид (XIV). К раствору 3,52 г (10,0 ммоль) (1RS,3R)-7-хлор-3-метил-1-(3-метил-4-нитрофенил)изохроман-1-ола,полученного на стадии А, в 25 мл изопропанола добавляют 1,16 г (15,7 ммоль) гидразида уксусной кислоты и 0,23 мл (2,8 ммоль) концентрированной соляной кислоты. Раствор кипятят в течение 6 ч, затем охлаждают до комнатной температуры и растворитель упаривают в вакууме. Остаток растворяют в 100 мл этилацетата, затем полученный раствор промывают 50 мл насыщенного раствора гидрокарбоната натрия, затем 350 насыщенного раствора хлорида натрия, и сушат с безводным сульфатом натрия. После того как осушитель отфильтрован, растворитель упаривают в вакууме. Продукт представляет собой желтое масло (3,69 г, 95%), которое представляет собой смесь Е и Z изомеров в соотношении приблизительно 1:1. Продукт может быть использован на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3423, 1670, 1518, 1339, 732 см-1. 1 Н-ЯМР (CDCl3, 500 МГц): 7.95 (m, 1H), 7.46 (m, 4 Н), 7.15 (m, 0.5 Н), 7.09 (m, 0.5 Н), 3.93 (m, 0.5 Н),3.71 (m, 0.5 Н), 5.59 (s, 3 Н), 2.42 (s, 1.5H), 2.39 (m, 2H), 2.35 (s, 1.5H), 1.14 (d, J=6.1 Гц, 1.5 Н), 1.13 (d,J=6.2 Гц, 1.5 Н) млн-1. Стадия С.(R)-Уксусной кислоты 2-[2-[(метилсульфонил)окси]пропил]-5-хлорфенил]3-метил-4 нитрофенил)метилен]гидразид (XIV). К раствору 3,69 г (9,46 ммоль) (R) уксусной кислоты 5-хлор-2-(2-гидроксипропил)фенил]-(3- 21016087 метил-4-нитрофенил)метилен]гидразида, полученного на стадии В, в 30 мл дихлорметана добавляют 1,93 мл (15 ммоль) триэтиламина, затем реакционную смесь охлаждают при температуре 0-5 С. К реакционной смеси по каплям добавляют 0,86 мл (11,0 ммоль) метансульфонилхлорида и реакционную смесь хранят охлажденной и перемешивают в течение еще 4 ч. Затем смесь разбавляют 30 мл дихлорметана и промывают 25 мл воды, 25 мл 1 н. соляной кислоты, 325 мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия, затем растворитель упаривают в вакууме. Таким образом, продукт представляет собой 4,12 г (93%) желтого масла в виде смеси оптически активных гидразидов, которые используют на следующей реакционной стадии без дополнительной очистки. ИК (KBr): 3181, 1683, 1520, 1330, 1172 см-1. 1 Н-ЯМР (CDCl3, 500 МГц): 8.33 (bs, 0.41 Н), 8.30 (bs, 0.61 Н), 7.38-7.56 (m, 4 Н), 7.16 (d, J=2.2 Гц,0.41 Н), 7.14 (d, J=2.2 Гц, 0.61H), 4.83 (m, 1H), 2.90 (s, 0.63H), 2.83 (s, 0.41H), 2.65 (m, 2H), 2.60 (s,0.43H), 2.59 (s, 0.63H), 2.48 (s, 0.63H), 2.47 (s, 0.43H), 1.32 (d, J=6.5 Гц, 0.43 Н), 1.31 (d, J=6.3 Гц,0.43 Н) млн-1. Стадия Г.(S)-(-)-3-Ацетил-8-хлор-4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро-3H-2,3-бензодиазепин (V). В 62 мл метанола растворяют 4,12 г (8,8 ммоль) (R) уксусной кислоты 2-[2[(метилсульфонил)окси]пропил]-5-хлорфенил](3-метил-4-нитрофенил)метилен]гидразида. Раствор охлаждают при температуре 0-5 С в бане лед-холодная вода и добавляют 1,0 мл (10,0 ммоль) 10 н. водного гидроксида натрия. Реакционную смесь перемешивают в течение 4 ч, затем упаривают в вакууме. Остаток затвердевает в результате добавления 30 мл воды, затем его фильтруют и промывают 55 мл воды. Полученный неочищенный продукт подвергают хроматографии на силикагеле с использованием смеси гексана и этилацетата. Продукт перекристаллизовывают из этанола. Таким образом, масса продукта составляет 1,28 г (общий выход 34,4% на основе изохроманового соединения). Температура плавления продукта составляет 164-167 С.(I/R). В смеси 20 мл метанола и 6 мл дихлорметана растворяют 1,15 г (3,1 ммоль) (R)-(+)-3-ацетил-8-хлор 4-метил-1-(3-метил-4-нитрофе нил)-4,5-дигидро-3H-2,3-бензодиазепина (в соответствии с примером 3). К реакционной смеси при интенсивном перемешивании добавляют приблизительно 0,5 г влажного катализатора никеля Ренеея, затем 0,54 мл (11,1 ммоль) 98% гидрата гидразина. Восстановление происходит в течение 1 ч, сопровождаясь интенсивным выделением газа и небольшим увеличением температуры реакционной смеси. После завершения восстановления катализатор отфильтровывают от реакционной смеси, реакционную смесь упаривают в вакууме и неочищенный продукт растирают с 20 мл воды и он затвердевает. Таким образом, масса продукта составляет 0,92 г (87%). Температура плавления составляет 100-103 С. Оптическая чистота продукта больше 99,7 е.е. (определенная при помощи хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ.(I/S). В смеси 20 мл метанола и 6 мл дихлорметана растворяют 1,15 г (3,1 ммоль) (S)-(-)-3-ацетил-8-хлор 4-метил-1-(3-метил-4-нитрофенил)-4,5-дигидро -3H-2,3-бензодиазепина (в соответствии с примером 4). К реакционной смеси при интенсивном перемешивании добавляют приблизительно 0,5 г влажного катализатора никеля Ренея, затем 0,54 мл (11,1 ммоль) 98% гидрата гидразина. Восстановление осуществляется- 22016087 в течение одного часа, сопровождаясь интенсивным выделением газа и небольшим увеличением температуры реакционной смеси. После завершения восстановления катализатор отфильтровывают от реакционной смеси, реакционную смесь упаривают в вакууме, и неочищенный продукт растирают с 20 мл воды, и он затвердевает. Таким образом, выход составляет 0,94 г (89%). Температура плавления составляет 100-103 С. Оптическая чистота продукта больше 99,7 е.е. (определенная путем хиральной ВЭЖХ).(bs, 2H), 2.79 (dd, J1=5.5 Гц, J2=13.7 Гц, 1 Н), 2.65 (dd, J1=12.0 Гц, J2=13.6 Гц, 1 Н), 2.20 (s, 3 Н), 1.30 (d,J=6.4 Гц, 3 Н) млн-1. 13 С-ЯМР: 172.14, 169.21, 148.14, 138.46, 135.83, 132.35, 131.43, 130.27, 129.40, 129.24, 128.72, 125.45,121.79, 114.03, 60.47, 38.28, 22.60, 18.32, 17.32 млн-1. В. Способы получения через дигидро-2,3-бензодиазепиновые производные, ацилированные дикарбоновыми кислотами. Пример 17. 4-(8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4.5-h][2,3]бензодиазепин-7-ил)4-оксо-бут-2-ен карбоновая кислота (III). Раствор, содержащий 6,2 г (0,063 ммоль) ангидрида малеиновой кислоты в 50 мл дихлорметана, по каплям добавляют в течение 30 мин к смеси 9,8 г (0,0289 моль) 8-метил-1-(3-метил-4-нитрофенил)-8,9 дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина, 5 мл (0,0357 моль) триэтиламина и 80 мл дихлорметана при температуре 3-6 С. Затем реакционную смесь перемешивают при температуре дефлегмации в течение 3 ч и охлаждают до комнатной температуры. Органический слой экстрагируют с 325 мл 5% водной соляной кислоты и 230 мл воды, затем сушат над сульфатом магния и упаривают в вакууме. Гексан добавляют к остатку и упаривают в вакууме, затем добавляют диизопропиловый эфир и вновь упаривают. К остатку добавляют 80 мл диизопропилового эфира и перемешивают в течение 2 ч. Полученные кристаллы отфильтровывают и промывают диизопропиловым эфиром и сушат под инфракрасной лампой. Таким образом, выход составляет 10,88 г (86,2%) указанного в заголовке продукта. Температура плавления составляет 158-160 С. ИК (KBr): 3450, 3091, 2415, 1720, 1341 см-1. 1 Н-ЯМР (CDCl3, i400): 8.02 (d, J=8.2 Гц, 1 Н), 7.61 (m, 2H), 6.97 (d, J=13.1 Гц, 1 Н), 6.85 (s, 1H), 6.49(S)-(+)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты с R-(+)метилбензиламином (IV). К раствору 5,4 г (0,0123 моль) 4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты (III) в 310 мл этилацетата при комнатной температуре добавляют 1,57 мл R-(+)метилбензиламина. После перемешивания в течение 2 ч при комнатной температуре осажденные кристаллы отфильтровывают, промывают этилацетатом и диэтиловым эфиром. Полученный неочищенный продукт перекристаллизовывают из этилацетата. Таким образом, выход составляет 2,48 г (72%) указанного в заголовке продукта. Температура плавления составляет 148-150 С.(R)-(-)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты с S-(-)метилбензиламином. К раствору 5,4 г (0,0123 моль) 4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты (III) в 310 мл этилацетата при комнатной температуре добавляют 1,57 мл R-(+)- -метилбензиламина. После перемешивания в течение 2 ч при комнатной температуре осажденные кристаллы отфильтровывают, промывают этилацетатом и диэтиловым эфиром. Полученный неочищенный продукт перекристаллизовывают из этилацетата.(S)-(+)-4-(8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4.5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновая кислота (III/A). 9,3 г (0,0167 моль) соли (S)-(+)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензо-диазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты R-(-)метилбензиламина перемешивают в 94 мл дихлорметана и к этой смеси добавляют 94 мл смеси концентрированной соляной кислоты и воды в отношении 1:1. Смесь оставляют перемешиваться в течение еще 15 мин. Органический слой отделяют, промывают 270 мл смеси концентрированной соляной кислоты и воды в отношении 1:1, затем с 2150 мл воды. Органическую фазу сушат над сульфатом магния, упаривают в вакууме, к остатку добавляют 2100 мл гексана и упаривают в вакууме. Остаток перемешивают с 125 мл диизопропилового эфира при комнатной температуре и осажденные кристаллы фильтруют и промывают 330 мл диизопропилового эфира и сушат под инфракрасной лампой. Таким образом, выход составляет 6,13 г (84,2%) указанного в заголовке продукта. Температура плавления: 170-172 С.(R)-(-)-4-(8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4.5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновая кислота (III/A). 9,3 г (0,0167 моль) соли (R)-(-)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты S-(-)метилбензиламина перемешивают в 94 мл дихлорметана и добавляют 94 мл смеси концентрированной соляной кислоты и воды в отношении 1:1, затем смесь перемешивают в течение еще 15 мин. Органический слой отделяют,промывают 270 мл смеси концентрированной соляной кислоты и воды в отношении 1:1, затем 2150 мл воды. Органическую фазу сушат над сульфатом магния, упаривают в вакууме, к остатку добавляют 2100 мл гексана и упаривают в вакууме. Остаток перемешивают с 125 мл диизопропилового эфира при комнатной температуре и осажденные кристаллы фильтруют и промывают 330 мл диизопропилового эфира и сушат под инфракрасной лампой. Таким образом, выход составляет 6,20 г (85,2%) указанного в заголовке продукта. Температура плавления: 170-172 С.(II/А). К раствору 6,0 г (0,0137 моль) (S)-(+)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты в 136 мл тетрагидрофурана добавляют 36 мл воды и 15,2 мл 30% перекиси водорода. Затем к смеси добавляют раствор 4,8 г гидроксида лития в 51 мл воды и выдерживают при 50 С в течение 2 ч. После завершения реакции органическую фазу упаривают в вакууме, затем водную фазу трижды промывают дихлорметаном. Объединенные органические фазы промывают 5% водным раствором карбоната натрия и водой, сушат над сульфатом магния. Фазу, содержащую дихлорметан, упаривают в вакууме, остаток кипятят в течение получаса в метаноле, охлаждают смесью лед-вода и кристаллы отфильтровывают. Таким образом, выход составляет(II/А). К раствору 6,0 г (0,0137 моль) (R)-(-)-4-(8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-ил)-4-оксо-бут-2-енкарбоновой кислоты в 136 мл тетрагидрофурана добавляют 36 мл воды и 15,2 мл 30% перекиси водорода. Затем к смеси добавляют 4,8 г гидроксида лития, растворенного в 51 мл воды, и ее выдерживают при 50 С в течение 2 ч После завершения реакции органическую фазу упаривают в вакууме, затем водную фазу трижды промывают дихлорметаном. Объединенные органические фазы промывают 5% водным раствором карбоната натрия и водой, сушат над сульфатом магния. Фазу, содержащую дихлорметан, упаривают в вакууме, остаток кипятят в течение получаса в метаноле, охлаждают смесью лед-вода и кристаллы отфильтровывают. Таким образом, выход составляет 3,16 г (68,1%) указанного в заголовке продукта. Температура плавления: 152-155 С.(S)-(+)-7-Ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин (V). 1,70 г (5,0 ммоль) (S)-(-)-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепина и 10 мл ангидрида уксусной кислоты перемешивают при комнатной температуре в течение 24 ч. После перемешивания смесь выливают в смесь 100 мл воды и 75 мл дихлорметана. Получающуюся в результате смесь перемешивают в течение часа, затем небольшими порциями добавляют карбонат натрия до увеличения значения рН до 8. Слои разделяют и водный слой дважды экстрагируют 25 мл дихлорметана. Объединенные органические слои промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния, затем упаривают. Полученный неочищенный продукт перекристаллизовывают из 15 мл метанола. Таким образом, выход желаемого перекристаллизованного продукта составляет 1,62 г (85%). Температура плавления: 124-128 С.(R)-(-)-7-Ацетил-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). Смесь 1,70 г (5,0 ммоль) (R)-(+)-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепина и 10 мл ангидрида уксусной кислоты перемешивают при комнатной температуре в течение 24 ч. Затем смесь выливают в смесь 100 мл воды и 75 мл дихлорметана и получающуюся в результате смесь перемешивают в течение часа. Затем небольшими порциями к смеси добавляют карбонат натрия до увеличения значения рН до 8. Слои разделяют и водный слой дважды экстрагируют 25 мл дихлорметана. Объединенные органические слои промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния, затем упаривают Полученный неочищенный продукт перекристаллизовывают из 15 мл метанола. Таким образом, перекристаллизованный указанный в заголовке продукт составляет 1,61 г (85%).(S)-(+)-8-Метил-5-(3-метил-4-нитрофенил)-7-пропионил-8.9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). 1,70 г (5,0 ммоль) (S)-(-)-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-13-диоксоло[4,5h][2,3]бензодиазепина и 10 мл ангидрида пропионовой кислоты перемешивают при комнатной температуре в течение 24 ч. Затем смесь выливают в смесь 100 мл воды и 75 мл дихлорметана и получающуюся в результате смесь перемешивают в течение часа, затем небольшими порциями к смеси добавляют карбонат натрия до увеличения значения рН до 8. Слои разделяют и водный слой дважды экстрагируют 25 мл дихлорметана. Объединенные органические слои промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния, затем упаривают. Полученный неочищенный продукт используют без дополнительной очистки. 1 Н-ЯМР (CDCl3): 8.00 (1 Н, d, J=9.6 Гц), 7.54 (2 Н, m), 6.77 (1 Н, s), 6.49 (1 Н, s), 6.01 (2 Н, s), 5.37 (1 Н,m), 2.98 (1 Н, dd, J=14.5 es J=3.4 Гц), 2.76 (1H, dd, J=14.6 es J=8.7 Гц), 2.66 (2H, m), 2.64 (3H, s), 1.14 (3H, t,J=7.4 Гц), 1.09 (3H, d, J=6.5 Гц) млн-1. Пример 27.(R)-(-)-8-Метил-5-(3-метил-4-нитрофенил)-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (V). 1,70 г (5,0 ммоль) (R)-(+)-8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепина и 10 мл ангидрида пропионовой кислоты перемешивают при комнатной температуре в течение 24 ч. Затем смесь выливают в смесь 100 мл воды и 75 мл дихлорметана и получающуюся в результате смесь перемешивают в течение часа, затем небольшими порциями к смеси добавляют карбонат натрия до увеличения значения рН до 8. Слои разделяют и водный слой дважды экстрагируют 25 мл дихлорметана. Объединенные органические слои промывают 50 мл насыщенного раствора хлорида натрия, сушат над сульфатом магния, затем упаривают. Полученный неочищенный продукт может быть использован без дополнительной очистки. 1 Н-ЯМР (CDCl3): 8.00 (1 Н, d, J=9.6 Гц), 7.54 (2H, m), 6.77 (1 Н, s), 6.49 (1 Н, s), 6.01 (2 Н, s), 5.37(3H, t, J=7.4 Гц), 1.09 (3H, d, J=6.5 Гц) млн-1. Восстановление нитросоединений в соответствии с примерами 19, 18, 20 и 21 может быть осуществлено, как описано в соответствующих примерах (4, 6, 8 и 10). С. Разделение через диастереоизомерную соль, образованную с оптически активными аминами. Пример 28.-8-Метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин-7 карбоновой кислоты имидазолид (VI). Смесь 3,37 г (10,0 ммоль) -8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепина, 1,95 г (12,0 ммоль) 1,1'-карбонилдиимидазола и 20 мл безводного тетрагидрофурана кипятят с обратным холодильником в течение 15 ч. Затем реакционную смесь охлаждают смесью лед-вода, осажденный продукт фильтруют и промывают 10 мл диэтилового эфира. Таким образом, выход составляет 3,90 г (90%) указанного в заголовке продукта. Температура плавления: 223-226 С. 1 Н-ЯМР CD3)2SO): 8.06 (d, J=8.5 Гц, 1 Н), 7.96 (s, 1 Н), 7.57 (s, 1 Н), 7.54 (dd, J=8.5 Гц es J=1.5 Гц,1H), 7.38 (s, 1H), 7.04 (s, 1H), 7.13 (s, 1H), 6.87 (s, 1H), 6.13 (d, J=0.8 Гц, 1H), 6.10 (d, J=0.9 Гц, 1H), 5.08(+)-7-(N-(1(R)-Фенилэтил)карбамоил)-8-(R)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин (VII). К суспензии 11,08 г (25,0 ммоль) -8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин-7-карбоновой кислоты имидазолида в 75 мл безводного диметилформамида добавляют 6,64 г, 3,82 мл (30,0 ммоль) (R)-фенилэтиламина. Реакционную смесь перемешивают в течение 24 ч с использованием масляной бани при 110 С. Затем растворитель упаривают при давлении 55 Па, остаток растворяют в 200 мл дихлорметана. Органическую фазу промывают 75 мл воды,75 мл 6 н. раствора HCl, 75 мл воды, 75 мл насыщенного водного раствора хлорида натрия, затем сушат- 26016087 над сульфатом магния и упаривают в вакууме. Полученный таким образом продукт кипятят в течение 3 ч в 150 мл этанола, дают возможность охладиться и фильтруют. Профильтрованный продукт массой 5,22 г(84%), имеющий температуру плавления 201-204 С, кипятят с обратным холодильником в течение 3 ч в 100 мл этанола, затем охлаждают и фильтруют. Таким образом, выход составляет 5,00 г (82%) указанного в заголовке продукта. Температура плавления: 202-205 С.(-)-7-(N-(1(S)-Фенилэтил)карбамоил)-8(S)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепин (VII). Используя мольные отношения, условия реакции и способ обработки реакционной смеси, описанные в примере 29, и с использованием (S)-фенилэтиламина в качестве хирального основания, получают 5,10 г (82%) указанного в заголовке продукта. Температура плавления: 202-204 С.(II/А). Смесь 12,16 г (25,0 ммоль) (+)-7-(N-(1(R)фенилэтил)карбамоил)-8(R)-метил-5-(3-метил-4 нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина и 10 мл 33% бромида водорода в растворе уксусной кислоты перемешивают при комнатной температуре в течение 24 ч в закрытом сосуде. Затем смесь охлаждают смесью лед-вода, затем добавляют 120 мл насыщенного водного раствора хлорида натрия и 12 мл этилацетата. После перемешивания в течение 20 минут осажденный продукт фильтруют. Полученную соль бромида водорода перемешивают в смеси 150 мл этилацетата и 150 мл насыщенного раствора карбоната натрия. Слои разделяют, водный слой дважды промывают 75 мл этилацетата. Объединенные органические фазы промывают 50 мл насыщенного раствора хлорида натрия,затем сушат над сульфатом магния и растворитель удаляют путем вакуумной перегонки. Полученный неочищенный продукт кипятят в течение получаса в 75 мл метанола и охлаждают водой температуры льда. Полученные кристаллы фильтруют. Таким образом, выход составляет 6,36 г (75%) указанного в заголовке продукта. Температура плавления: 144-147 С.(II/A). Используя мольные отношения, условия реакции и способ обработки реакционной смеси, описанные в примере 31, за исключением того, что в качестве исходного вещества используют (-)-7-(N-(1(S)фенилэтил)карбамоил)-8(S)-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин, указанный в заголовке продукт могут получать с выходом 6,30 г (74%). Температура плавления: 143-147 С.- 27016087 ИК (KBr): 3386, 1504, 1335, 1250, 1035 см-1. Н-ЯМР (CDCl3): 7.96 (d, J=8.5 Гц, 1 Н), 7.53 (m, 1 Н), 7.45 (m, 1H), 6.74 (s, 1H), 6.50 (s, 1H), 5.98 (s,2 Н), 5.59 (bs, 1 Н), 4.09 (m, 1 Н), 2.86 (dd, J1=4.0 Гц, J2=13.9 Гц, 1 Н), 2.64 (dd, J1=6.4 Гц, J2=14.0 Гц, 1 Н),2.61 (s, 3 Н), 1.27 (d, J=6.4 Гц, 3 Н). 13 С-ЯМР: 150.25, 148.28, 145.86, 144.74, 135.57, 133.69, 132.40, 126.83, 126.78, 124.67, 109.05, 108.87,101.35, 63.93, 40.10, 22.00, 20.72 млн-1. Ацилирование продуктов из примеров 31 и 32 представлено, в частности, в примерах 25, 24, 26 и 27, восстановление в этих примерах может быть осуществлено в соответствии с примерами 4, 6, 8 и 10. Разделение и селективное ацилирование дигидро-2,3-бензодиазепиновых соединений, имеющих 4 амино-3-метилфенильный заместитель. Пример 33.(VIII). К раствору 3,39 г (10,0 ммоль) -8-метил-5-(3-метил-4-нитрофенил)-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепина в смеси 50 мл метанола и 100 мл дихлорметана добавляют приблизительно 3,0 г влажного катализатора никеля Ренея, затем при интенсивном перемешивании добавляют 1,7 мл(35,0 ммоль) 98% гидрата гидразина. Спустя 45 мин дополнительного перемешивания катализатор отфильтровывают, промывают дихлорметаном, фильтрат упаривают и остаток растирают с 50 мл воды и он затвердевает. Неочищенный продукт перекристаллизовывают из ацетонитрила. Таким образом, выход указанного в заголовке продукта составляет 2,41 г (78%) оранжевых кристаллов. Температура плавления: 97-100 С. ИК (KBr): 3483, 3344, 2626, 1574, 1316, 1033 см-1. 1 Н-ЯМР (CDCl3, mp200): 7.60 (s, 1H), 7.52 (d, J=8.8 Гц, 1 Н), 6.88 (s, 1H), 6.76 (s, 1H), 6.72 (d, J=8.8 Гц, 1 Н), 6.09 (d, J=1.1 Гц, 1 Н), 6.08 (d, 1H), 4.32 (bm, 3H), 2.93 (dd, J1=5.9 Гц, J2=14.3 Гц, 1H), 2.47 (dd,J1=4.0 Гц, J2=14.7 Гц, 1 Н), 2.20 (s, 1H), 1.29 (d, J=6 2 Гц, 3 Н) млн-1. Пример 34.(VIII/A). Стадия А. В 144 мл безводного этанола при температуре кипения растворителя растворяют 3,09 г (10,0 ммоль)(4,0 ммоль) L-винной кислоты полу-4-хлоранилида. Затем соль кристаллизуют в течение 20 ч при комнатной температуре. Осажденные кристаллы промывают безводным этанолом, затем сушат. Полученные 1,4 г соли перекристаллизовывают из 98 мл безводного этанола. Таким образом, выход указанного в заголовке продукта составляет 1,04 г (36%). Температура плавления: 193-196 С.[]20D=-22,12 (с=1, МеОН). ИК (KBr): 3440, 3347, 3260, 1675, 1647, 1597, 1036 см-1. 1 Н-ЯМР (ДМСО (диметилсульфоксид)-d6): 9.77 (bs, 1 Н), 7.77 (d, J=8.9 Гц, 2 Н), 7.36 (d, J=8.9 Гц, 2 Н),7.13 (s, 1 Н), 7.03 (dd, J1=1.6 Гц, J2=8.3 Гц, 1 Н), 6.90 (s, 1H), 6.76 (d, J=8.3 Гц), 6.48 (s, 1H), 6.03 (s, 2H),4.39 (m, 2H), 3,89 (hz, J=5.0 Гц, 1 Н), 2.67 (dd, J1=6.1 Гц, J2=13.6 Гц, 1 Н), 2.32 (dd, J1=4 3 Гц, J2=13.6 Гц,1 Н), 2.04 (s, 3 Н), 1.06 (d, J=6.3 Гц, 3 Н) млн-1. 13 С-ЯМР (ДМСО-d6): 173.70, 170.92, 159.80, 147.83, 147.28, 145.16, 137.63, 134.76, 130.10, 128.65,127.23, 127.16, 126.24, 121.27, 120.38, 113.30, 108.80, 108.44, 101.20, 73.73, 72.03, 62.76, 20.76, 17.70 млн-1. Стадия Б. Суспензию 1,04 г соли, полученной на стадии А, в 20 мл хлороформа смешивают с 20 мл насыщенного водного раствора гидрокарбоната натрия, затем смесь встряхивают до образования прозрачных фаз. Органический слой промывают 320 мл воды, сушат над сульфатом натрия, затем упаривают. Полученный продукт может быть использован без дополнительной очистки. Пример 35.(VIII/A). Стадия А. В 144 мл кипящего безводного этанола растворяют 3,09 г (10,0 ммоль) (+)-5-(4-амино-3 метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепина и 0,98 г (4,0 ммоль) Dвинной кислоты полу-4-хлоранилида. Затем соль кристаллизуют в течение 20 ч при комнатной температуре. Осажденные кристаллы промывают безводным этанолом, затем сушат. Выход составляет 1,43 г продукта, который перекристаллизовывают из 98 мл безводного этанола. Таким образом, выход составляет 1,06 г (37%) указанного в заголовке продукта. Температура плавления составляет 193-196 С. 1(d, J=6.3 Гц, 3 Н). 13 С-ЯМР (DMSO-d6): 173.70, 170.92, 159.80, 147.83, 147.28, 145.16, 137.63, 134.76, 130.10, 128.65,127.23, 127.16, 126.24, 121.27, 120.38, 113.30, 108.80, 108.44, 101.20, 73.73, 72.03, 62.76, 20.76, 17.70. Стадия Б. Суспензию 1,06 г соли, полученной на стадии А, в 20 мл хлороформа смешивают с 20 мл насыщенного раствора гидрокарбоната натрия, затем смесь встряхивают до образования прозрачных фаз. Органический слой промывают 320 мл воды, сушат с сульфатом натрия, затем упаривают. Полученный продукт может быть использован без дополнительной очистки. Пример 36.(S)-(+)-7-Ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5-h][2,3]бензодиазепин (I/S). К раствору 3,09 г (10,0 ммоль) (S)-(-)-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепина в 10 мл хлороформа добавляют 1,39 мл (10,0 ммоль) триэтиламина. Затем реакционную смесь охлаждают до -10 С и добавляют 0,94 мл (10,0 ммоль) ангидрида уксусной кислоты и перемешивают в течение 1,5 ч. Затем реакционную смесь при перемешивании добавляют к 70 мл насыщенного раствора гидрокарбоната натрия, органический слой отделяют, промывают 515 мл воды, сушат над сульфатом натрия и упаривают. Неочищенный продукт перекристаллизовывают из безводного этанола. Выход составляет 2,12 г (60%) бледно-желтого продукта. Температура плавления составляет 119-122 С.(R)-(-)-7-Ацетил-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/R). К раствору 3,09 г (10,0 ммоль) (R)-(+)-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепина в 10 мл хлороформа добавляют 1,39 мл (10,0 ммоль) триэтиламина. Затем реакционную смесь охлаждают до -10 С и добавляют 0,94 мл (10,0 ммоль) ангидрида уксусной кислоты и перемешивают в течение 1,5 ч. Затем реакционную смесь при перемешивании добавляют к 70 мл насыщенного раствора гидрокарбоната натрия, органический слой отделяют, промывают 515 мл воды, сушат над сульфатом натрия и упаривают. Неочищенный продукт перекристаллизовывают из безводного этанола. Выход составляет 2,14 г (61%) бледно-желтого продукта. Температура плавления составляет 121-124 С.(S)-(+)-5-(4-Амино-3-метилфенил)-8-метил-7-пропионил-8,9-дигидро-7 Н-1,3-диоксоло[4,5h][2,3]бензодиазепин (I/S). К раствору 3,09 г (10,0 ммоль) (S)-(-)-5-(4-амино-3-метилфенил)-8-метил-8,9-дигидро-7 Н-1,3 диоксоло[4,5-h][2,3]бензодиазепина в 10 мл хлороформа добавляют 1,39 мл (10,0 ммоль) триэтиламина. Затем реакционную смесь охлаждают до -10 С и добавляют 1,28 мл (10,0 ммоль) ангидрида пропионовой кислоты и перемешивают в течение 1,5 ч. Затем реакционную смесь при перемешивании добавляют к 70 мл насыщенного раствора гидрокарбоната натрия, органический слой отделяют, промывают 515 мл воды, сушат над сульфатом натрия и упаривают. Неочищенный продукт перекристаллизовывают из безводного этанола. Выход составляет 2,64 г (64%) бледно-желтого продукта. Температура плавления составляет 176-178 С.
МПК / Метки
МПК: C07D 311/58, A61K 31/551, C07C 251/86, C07C 309/66, A61P 25/00, C07D 491/04, C07D 243/02, C07D 317/58, C07D 493/04
Метки: синтез, стереоселективный, оптические, изомеры, дигидро-2,3-бензодиазепинов
Код ссылки
<a href="https://eas.patents.su/30-16087-opticheskie-izomery-digidro-23-benzodiazepinov-i-ih-stereoselektivnyjj-sintez.html" rel="bookmark" title="База патентов Евразийского Союза">Оптические изомеры дигидро-2,3-бензодиазепинов и их стереоселективный синтез</a>












