Соединения, ингибирующие киназы, и фармацевтическая композиция на их основе
Номер патента: 16055
Опубликовано: 30.01.2012
Авторы: Петилло Питер А., Кауфман Майкл Д., Патт Уилльям К., Флинн Дэниел Л.
Формула / Реферат
1. Соединения формулы IIa
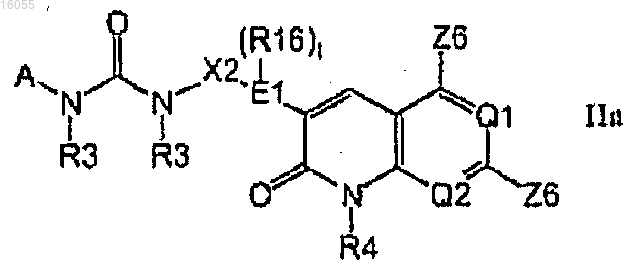
где Q1 представляет собой N, Q2 представляет собой CR3;
Е1 представляет собой фенил;
А выбран из группы, включающей тетралинил, инденил, G1 и G2;
G1 представляет собой гетероарил, выбранный из группы, включающей тиенил, тиазолил, изоксазолил, пиразолил, тиадиазолил и пиримидинил;
G2 представляет собой индазолил, хинолинил и изохинолинил;
кольцо А необязательно замещено одной или несколькими группами -Х1-А1;
X1 выбран из группы, включающей -(СН2)n-(О)r-(CH2)n-, -(CH2)n-(NR3)r-(CH2)n-, -(CH2)n-(S)r-(CH2)n-, -(СН2)n-(C=O)r-(CH2)n-, -(CH2)n-(C(=O)-NR3)r-(CH2)n- и -(CH2)n-(SO2-NR3)r-(CH2)n-, где любой из алкиленов может иметь линейную или разветвленную цепь;
Х2 представляет собой прямую связь, причем Е1 непосредственно связан с группой NR3 формулы Ia;
А1 выбран из группы, включающей водород, арил, G1, G2, С1-С6алкил, разветвленный С3-С8алкил, R19-замещенный С3-С8карбоциклил, С1-С6фторалкил, где алкильная группа может быть частично или полностью фторирована, галоген, циано, гидроксил, -N(R4)2, -R5, -C(O)N(R4)2, C(O)R5, С1-С6алкокси и С1-С6фторалкокси, где алкильная группа может быть частично или полностью фторирована;
если А и А1 имеют один или более подходящих для замещения sp2-гибридизированных атомов углерода, каждый такой sp2-гибридизированный атом необязательно содержит в качестве заместителя Z1 или Z3;
если А и А1 имеют один или более подходящих для замещения sp3-гибридизированных атомов углерода, каждый такой sp3-гибридизированный атом углерода необязательно дополнительно содержит в качестве заместителя Z2 или R3;
если А и А1 имеют один или более подходящих для замещения атомов азота, каждый такой атом азота необязательно содержит в качества заместителя Z4;
каждый Z1 независимо и отдельно выбран из группы, включающей водород, гидрокси-С1-С6алкил, С1-С6алкокси, С1-С6алкокси-С1-С6алкил, (R4)2N-С1-С6алкил, (R4)2N-C2-С6алкил-N(R4)-(CH2)n, (R4)2N-С2-С6алкил-O-(СН2)n, (R3)2N-C(=O)-, (R4)2N-C(=O)-, (R4)2N-СО-С1-С6алкил, C1-С6алкоксикарбонил, карбокси-С1-С6алкил, С1-С6алкоксикарбонил-С1-С6алкил, (R3)2NSO2-, -SOR3, (R4)2NSO2-, -SO2R3, -SOR4, -C(=O)R6,
-C(=NOH)R6, -C(=NOR3)R6, -(CH2)nN(R4)C(O)R8, -(CH2)n-G1, -(CH2)n-G4, фенокси, -(CH2)n-O-(CH2)n-G1,
-(CH2)n-O-(CH2)n-G4, -(CH2)n-NR3-(CH2)n-арил, -(CH2)n-NR3-(CH2)n-G1, -(CH2)n-NR3-(CH2)n-G4, -S(O)2R5,
-N=S(O)R6R8, -S(O)(=NR3)R6, -(CH2)nNHC(O)NHS(O)2R8, -(CH2)nNHS(O)2NHC(O)R8, -C(O)NHS(O)2R8,
-S(O)2NHC(O)R8, -(CH2)nNHC(O)(CH2)nR5, -(CH2)nNHS(O)2(CH2)nR5, -(CH2)nC(O)NH(CH2)qR5,
-(CH2)nC(O)R5, -(CH2)nOC(O)R5, -(CH2)nS(O)2NH(CH2)qR5, -CH(OH)(CH2)pR5, -CH(OH)CH(OH)R4,
-(CH2)nN(R4)2, -(CH2)nR5, -C(=NH)R5, -C(=NH)N(R4)2, -C(=NOR3)R5, -C(=NOR3)N(R4)2 и -NHC(=NH)R8;
в случае, если Z1 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими С1-С6алкилами;
каждый Z2 независимо и отдельно выбран из группы, включающей водород, арил, C1-С6алкил, С3-С8карбоциклил, гидроксил, гидроксиС1-С6алкил-, циано, (R3)2N-, (R4)2N-, (R4)2N-С1-С6алкил-, (R4)2N-С2-С6алкил-N(R4)-(СН2)n-, (R4)2N-C2-С6алкил-О-(CH2)n-, (R3)2N-C(=O)-, (R4)2N-C(=O)-, (R4)2N-CO-C1-С6алкил-, карбоксил, карбокси-С1-С6алкил, C1-С6алкоксикарбонил-, С1-С6алкоксикарбонил-С1-С6алкил, (R3)2NSO2-, (R4)2NSO2-, -SO2R5, -SO2R8, -(CH2)nN(R4)С(O)R8, -C(O)R8, =O, =NOH, =N(OR6), -(CH2)n-G1, -(CH2)n-G4,
-(CH2)n-O-(CH2)n-G1, -(CH2)n-O-(CH2)n-G4, -(CH2)n-NR3-(СН2)n-арил, -(CH2)n-NR3-(CH2)n-G1, -(СН2)n-NR3-(CH2)n-G4, -(CH2)nNHC(O)NHS(O)2R8, -(CH2)nNHS(O)2NHC(O)R8, -C(O)NHS(O)2R8,
-(CH2)NHC(O)(CH2)nR5, -(CH2)nNHS(O)2R5, -(CH2)nC(O)NH(CH2)qR5, -(CH2)nC(O)R5, -(CH2)nOC(O)R5 и
-(CH2)nR5;
в случае, если Z2 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-С6алкилами;
каждый Z3 независимо и отдельно выбран из группы, включающей Н, C1-С6алкил, разветвленный С3-С7алкил, С3-С8карбоциклил, галоген, фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, гидроксил, метокси, оксо, (R3)2N-C(=O)-, (R4)2N-C(=O)-, -N(R4)-С(=O)R8, (R3)2NSO2-, (R4)2NSO2-, -N(R4)SO2R5, -N(R4)SO2R8, -(CH2)n-N(R3)2, -(CH2)n-N(R4)2, -O-(CH2)q-N(R4)2, -O-(CH2)q-O-алкил, -N(R3)-(СН2)q-O-алкил, -N(R3)-(CH2)q-N(R4)2, -O-(CH2)q-R5, -N(R3)-(CH2)q-R5, -C(=O)R5, -C(=O)R8 и нитро;
в случае, если Z3 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-С6алкилами;
каждый Z4 независимо и отдельно выбран из группы, включающей Н, C1-С6алкил, С2-С6гидроксиалкил, С1-С6алкокси-С2-С6алкил, (R4)2N-С2-С6алкил, (R4)2N-С2-С6алкил -N(R4)-С2-С6алкил, (R4)2N-С2-С6алкил-O-С2-С6алкил, (R4)2N-CO-С1-С6алкил, карбокси-С1-С6алкил, С1-С6алкоксикарбонил-С1-С6алкил, -С2-С6алкил-N(R4)C(O)R8, R8-C(=NR3)-, -SO2R8, -COR8, -(CH2)n-G1, -(CH2)n-G4, -(CH2)q-O-(CH2)n-G1, -(CH2)q-O-(CH2)n-G4, -(CH2)q-NR3-(CH2)n-G1, -(CH2)q-NR3-(CH2)n-G4, -(CH2)qNHC(O)(CH2)nR5, -(CH2)qC(O)NH(CH2)qR5,
-(CH2)qC(O)R5, -(CH2)qOC(O)R5, -(CH2)qR5, -(CH2)qNR4(CH2)qR5 и -(CH2)qO(CH2)qR5;
в случае, если Z4 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-С6алкилами;
каждый Z6 независимо и отдельно выбран из группы, включающей Н, С1-С6алкил, разветвленный С3-С7алкил, гидроксил, С1-С6алкокси, -OR4, C1-С6тиоалкил, (R3)2N-, (R4)2N-, -R5, -N(R3)COR8, -N(R4)COR8,
-N(R3)SO2R6-, -CON(R3)2, -CON(R4)2, -COR5, -SO2N(R4)2, галоген, C1-С6фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, C1-С6фторалкокси, где алкильная группа может быть частично или полностью фторирована, -O-(CH2)q-N(R4)2, -N(R3)-(CH2)q-N(R4)2, -О-(СН2)q-O-алкил, N-(R3)-(СН2)q-O-алкил, -O-(СН2)q-R5, -N(R3)-(СН2)q-R5, -(NR3)r-(CH2)n-R17, -(O)r-R17, -(S)r-R17 и -(CH2)r-R17;
в случае, если Z6 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-С6алкилами;
каждый R3 независимо и отдельно выбран из группы, включающей Н, C1-С6алкил, разветвленный С3-С7алкил, С3-С8карбоциклил и Z3-замещенный фенил;
каждый R4 независимо и отдельно выбран из группы, включающей Н, С1-С6алкил, C1-С6гидроксиалкил, C1-С6дигидроксиалкил, С1-С6алкокси-С1-С6алкил, разветвленный С3-С7алкил, разветвленный C1-С6гидроксиалкил, разветвленный С1-С6алкокси-С1-С6алкил, разветвленный С1-С6дигидроксиалкил, -(СН2)p-N(R7)2, -(CH2)p-R5, -(CH2)p-C(O)N(R7)2, -(CH2)nC(O)R5, -(СН2)n-C(O)OR3, С3-С8карбоциклил, замещенный С3-С8гидроксикарбоциклил, замещенный С3-С8алкоксикарбоциклил, замещенный С3-С8дигидроксикарбоциклил и -(СН2)n-R17;
каждый R5 независимо и отдельно выбран из группы, включающей
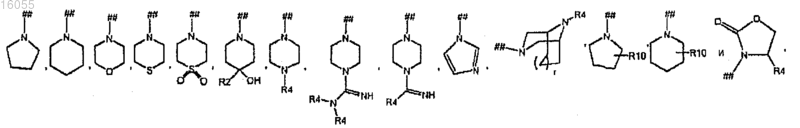
и где символом (##) обозначена точка присоединения группы R5;
каждый R6 независимо и отдельно выбран из группы, включающей C1-С6алкил, разветвленный С3-С7алкил, С3-С8карбоциклил, фенил, G1 и G4;
каждый R7 независимо и отдельно выбран из группы, включающей Н, С1-С6алкил, С2-С6гидроксиалкил, С2-С6дигидроксиалкил, С1-С6алкокси-С2-С6алкил, разветвленный С3-С7алкил, разветвленный С2-С6гидроксиалкил, разветвленный С1-С6алкокси-С2-С6алкил, разветвленный С2-С6дигидроксиалкил, -(CH2)q-R5, -(СН2)n-С(О)R5, -(СН2)n-С(О)OR3, С3-С8карбоциклил, гидроксизамещенный С3-С8карбоциклил, алкоксизамещенный С3-С8карбоциклил, дигидроксизамещенный С3-С8карбоциклил и -(СН2)n-R17;
каждый R8 независимо и отдельно выбран из группы, включающей C1-С6алкил, разветвленный С3-С7алкил, фторалкил, где алкильная группа может быть частично или полностью фторирована, С3-С8карбоциклил, Z3-замещенный фенил, Z3-замещенный фенил-С1-С6алкил, Z3-замещенный G1, Z3-замещенный G1-C1-С6алкил, Z2-замещенный G4, Z2-замещенный G4-С1-С6алкил, ОН, C1-С6алкокси, N(R3)2, N(R4)2 и R5;
каждый R10 независимо и отдельно выбран из группы, включающей СО2Н, СО2С1-С6алкил, CO-N(R4)2, ОН, С1-С6алкокси и -N(R4)2;
R16 независимо и отдельно выбран из группы, включающей водород, C1-С6алкил, разветвленный С3-С7алкил, С3-С8карбоциклил, галоген, фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, гидроксил, С1-С6алкокси, С1-С6фторалкокси, где алкильная группа может быть частично или полностью фторирована, -N(R3)2, -N(R4)2, С2-С3алкинил и нитро;
каждый R17 выбран из группы, включающей фенил, нафтил, пирролил, фурил, тиенил, оксазолил, тиазолил, изоксазолил, изотиазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиразинил, пиридазинил, триазинил, оксетанил, азетадинил, тетрагидрофуранил, оксазолинил, оксазолидинил, пиранил, тиопиранил, тетрагидропиранил, диоксалинил, азепинил, оксепинил, диазепинил, пирролидинил и пиперидинил;
R17 может быть дополнительно замещен одним или несколькими Z2, Z3 или Z4;
R19 представляет собой Н или С1-С6алкил;
два фрагмента R3 или R4 независимо и отдельно выбраны из группы, включающей С1-С6алкил и разветвленный С3-С6алкил, гидроксиалкил и алкоксиалкил, и соединены с одним и тем же атомом азота, причем указанные группы могут быть замкнуты в цикл с образованием С3-С7гетероциклического кольца; и
k равно 1 или 2; n равно 0-6; р равно 1-4; q равно 2-6; r равно 0 или 1; t равно 1-3.
2. Соединение по п.1, имеющее формулу IIb
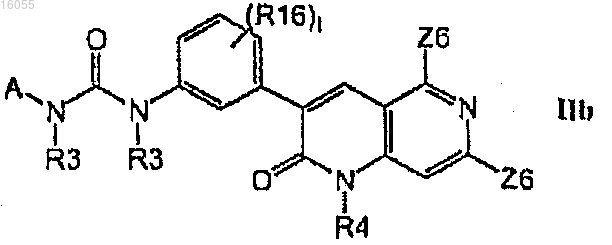
3. Соединение по п.2, имеющее формулу IIm

где А1 выбран из группы, состоящей из водорода, Z2-замещенного разветвленного С3-С8алкила, R19-замещенного С3-С8карбоциклила, Z2-замещенного C1-С6алкила, C1-С6фторалкила, где алкильная группа может быть частично или полностью фторирована, Z3-замещенного фенила и Z3-замещенного G1; и
R16 представляет собой С1-С6алкил, циано, -ССН или галоген.
4. Соединение по п.3, имеющее формулу IIn
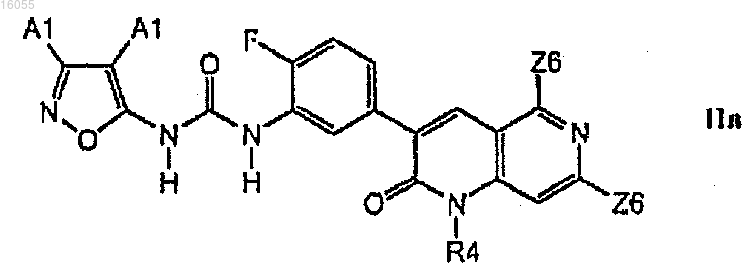
5. Соединение по любому из пп.1-4, выбранное из группы, состоящей из
1-(3-трет-бутилизоксазол-5-ил)-3-(5-(1-этил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(3-трет-бутил-1-фенил-1Н-пиразол-5-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропил-1-фенил-1Н-пиразол-5-ил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(1-фенил-3-(трифторметил)-1Н-пиразол-5-ил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-(трифторметил)фенил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-(трифторметил)изоксазол-5-ил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-(трифторметил)изоксазол-5-ил)мочевины,
1-(5-(7-(2-(диметиламино)этиламино)-1-метил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-(трифторметил)изоксазол-5-ил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-5-(2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-трет-бутилизоксазол-3-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(5-(7-(2-(диметиламино)этиламино)-1-метил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-(трифторметил)фенил)мочевины,
1-(4-хлор-3-(трифторметил)фенил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропил-1-фенил-1Н-пиразол-5-ил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-4-метил-5-(1-метил-2-оксо-7-(фениламино)-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-4-метил-5-(1-метил-2-оксо-7-фенил-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-(7-амино-1-метил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-трет-бутилизоксазол-5-ил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(5-(7-(3-(диметиламино)пропиламино)-1-метил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-трет-бутилизоксазол-3-ил)-3-(2,4-дифтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(2-трет-бутил-4-фенилпиримидин-5-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(4-хлор-5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(5-(7-амино-1-этил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-трет-бутилизоксазол-5-ил)мочевины,
1-(5-трет-бутилизоксазол-3-ил)-3-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-(трифторметил)фенил)мочевины,
1-(5-трет-бутилизоксазол-3-ил)-3-(4-хлор-5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(5-трет-бутилизоксазол-3-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропил-1-фенил-1Н-пиразол-5-ил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-изопропил-1-фенил-1Н-пиразол-5-ил)мочевины,
1-(5-(7-амино-1-этил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(5-трет-бутилизоксазол-3-ил)мочевины,
1-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-5-(трифторметил)-1Н-пиразол-4-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-(1-этил-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)-3-(хинолин-5-ил)мочевины,
1-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-5-(7-(метиламино)-2-оксо-1-фенил-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-циклопентил-1Н-пиразол-4-ил)-3-(2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(2-фтор-5-(1-изопропил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(5-трет-бутил-1,3,4-тиадиазол-2-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевины,
1-(5-трет-бутил-1,3,4-тиадиазол-2-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)мочевины,
1-(3-трет-бутил-1-метил-1Н-пиразол-5-ил)-3-(2-фтор-5-(1-изопропил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-пиразол-4-ил)-3-(2-фтор-5-(7-(метиламино)-2-оксо-1-фенил-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(2-фтор-5-(7-(метиламино)-2-оксо-1-фенил-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропилизоксазол-5-ил)мочевины,
1-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропилизоксазол-5-ил)мочевины,
1-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фтор-4-метилфенил)-3-(3-изопропилизоксазол-5-ил)мочевины,
1-(3-трет-бутилизоксазол-5-ил)-3-(4-хлор-3-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-индазол-3-ил)-3-(2-фтор-4-метил-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-1Н-индазол-3-ил)-3-(4-хлор-2-фтор-5-(1-метил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(1-трет-бутил-5-метил-1Н-пиразол-4-ил)-3-(2-фтор-5-(1-изопропил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)мочевины,
1-(4-хлор-3-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)фенил)-3-(3-изопропилизоксазол-5-ил)мочевины
и их солей.
6. Соединение по п.1, представляющее собой 1-(3-трет-бутилизоксазол-5-ил)-3-(5-(1-этил-7-(метиламино)-2-оксо-1,2-дигидро-1,6-нафтиридин-3-ил)-2-фторфенил)мочевину и его соль.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 вместе с фармацевтически приемлемым носителем.
8. Применение соединения по пп.1-6 для лечения состояния, выбранного из группы, включающей рак, гиперпролиферативные заболевания, вторичный рост опухоли из метастазов, заболевания, характеризующиеся гиперваскуляризацией, воспаление, остеоартрит, респираторные заболевания, паралич, системный шок, иммунные заболевания, сердечно-сосудистые заболевания и связанные с ангиогенезом заболевания, у пациента.
9. Применение соединения по пп.1-6 для лечения хронической миелоидной лейкемии, острой лимфоцитарной лейкемии, опухоли стромы желудочно-кишечного тракта, гиперэозинофильного синдрома, глиобластомы, рака яичников, рака поджелудочной железы, рака простаты, рака легкого, рака груди, рака почек, карциномы шейки матки, вторичных метастазов первичной солидной опухоли, заболеваний глаз, характеризующихся гиперпролиферацией, приводящей к слепоте, включая различные ретинопатии, включающие диабетическую ретинопатию и возрастную дегенерацию желтого пятна, ревматоидного артрита, меланомы, рака кишечника, рака щитовидной железы, заболеваний, вызванных мутацией в RAS-RAF-MEK-ERK-MAP-киназного пути передачи сигнала, воспалений у человека, ревматоидного спондилита, остеоартрита, астмы, артрита при подагре, сепсиса, септического шока, эндотоксического шока, грамотрицательного сепсиса, синдрома токсического шока, респираторного дистресс-синдрома взрослых, паралича, реперфузионного синдрома, травм нервов, ишемии нервов, псориаза, рестеноза, хронического обструктивного заболевания легких, резорбтивных заболеваний костей, отторжения трансплантата, болезни Крона, язвенного колита, воспалительного заболевания кишечника, парезов и их сочетаний у пациента.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ КИНАЗЫ, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ Настоящее изобретение относится к новым ингибиторам киназ и соединениям, модулирующим киназы, которые можно применять для лечения различных заболеваний. В частности, изобретение относится к таким соединениям, киназа/соединениям присоединения, способам лечения заболеваний и способам синтеза соединений. Соединения можно применять преимущественно для модуляции киназной активности киназ Raf и различных полиморфных форм Raf-киназ,встречающихся при заболеваниях. Соединения согласно настоящему изобретению находят применение в лечении различных видов рака млекопитающих и, в частности, человека, включая,но не ограничиваясь, злокачественную меланому, рак кишечника, рак яичника, сосочковую карциному щитовидной железы, немелкоклеточный рак легкого и мезотелиому. Соединения согласно настоящему изобретению также находят применение при лечении ревматоидного артрита и ретинопатии, включая диабетическую нейропатию сетчатки и дегенерацию желтого пятна. 016055 Перекрестные ссылки на родственные заявки Данная заявка устанавливает приоритет предварительной заявки 60/844552, поданной 14 сентября 2006 г., содержание которой полностью включено в настоящую заявку посредством ссылки. Область техники Настоящее изобретение относится к новым ингибиторам киназ и соединениям, модулирующим киназы, которые можно применять при лечении различных заболеваний. В частности, изобретение относится к таким соединениям, киназа/соединениям присоединения, способам лечения заболеваний и способам синтеза соединений. Соединения можно применять преимущественно для модуляции киназной активности Raf-киназ и различных полиморфных форм таких киназ, обнаруживаемых при заболеваниях. Уровень техники Было четко продемонстрировано, что некоторые члены семейства белков-киназ вовлечены в патогенез различных пролиферативных заболеваний и, следовательно, представляют собой важные мишени для лечения этих заболеваний. Некоторые пролиферативные заболевания, имеющие отношение к настоящему изобретению, включают рак, ревматоидный артрит, атеросклероз и ретинопатии. Важные примеры киназ, которые, как показано, вызывают эти заболевания или участвуют в их патогенезе, включают, но не ограничиваются ими: BRaf, CRaf, Abl, KDR(VEGF), EGFR/HER1, HER2, HER3, cMET, FLT-3,PDGFR-a, PDGFR-b, p38, cKIT и JAK2. Основным путем передачи сигнала после активации поверхностного рецептора фактора роста в клетку является сигнальный путь -Ras-RAF-MEK-ERK-MAP (Peyssonnaux, С. et al., Biol. Cell (2001) 93: 53-62). Рак возникает, когда происходят мутации в одном или более из белков, входящих в этот сигнальный каскад. Пролиферация и дифференцировка клеток становятся нерегулируемыми, активируются механизмы выживания клеток, которые позволяют нерегулируемым раковым клеткам избегать защитного механизма программируемой гибели клеток. Показано, что мутации в белке p21-Ras являются основной причиной нарушения регуляции этого сигнального пути, приводящей к развитию рака у человека. Мутации P21-Ras выявлены приблизительно 30% видов рака у человека (Bolton et al., Ann. Rep. Med. Chem.(1994) 29: 165-174). Вызывающие рак мутации в белке P21-Ras порождают конститутивно активный сигнальный каскад, что приводит к нерегулируемой активации следующих компонентов сигнального путиCell (2001) 93: 53-62; Avruch, J., Recent Prog. Horm. Res. (2001) 56: 127-155; Kolch, W., Biochem. J. (2000) 351: 289-305). Все эти изоформы RAF киназ активируются белком Ras и таким образом они активируются при тех видах рака, причиной которых являются мутации и повышение активности белка p21-Ras. Помимо активации этого сигнального каскада при исходном уровне белка p21-Ras, обнаружены также мутации в BRAF-киназе, которые приводят к активации каскада на уровне ниже p21-Ras (Davies, H., etal., Nature (2002) 417: 949-954). Было показано, что одна доминантная мутация в одном сайте в положении 600 BRAF-киназы, особенно агрессивна и связана приблизительно с 80% наблюдаемых злокачественных меланом человека. При этой мутации происходит замена присутствующей в норме нейтральной аминокислоты валина на отрицательно заряженную аминокислоту - глютаминовую кислоту. Такой односайтовой мутации достаточно для того, чтобы обеспечить конститутивную активность мутированнойBRAF, что приводит к потере регуляции сигнального пути и раку человека. Соответственно, небольшие молекулы-ингибиторы BRAF-киназы представляют собой рациональный подход к лечению злокачественных опухолей человека независимо от того, произошла ли мутация в сигнальном каскаде на уровне р 21-белка Ras или на уровне BRAF-киназы. Было показано, что большинство описанных небольших молекул-ингибиторов киназ связываются одним из трех способов. Большинство известных ингибиторов взаимодействуют с АТФ-связывающим доменом активного центра и оказывают свое действие путем конкуренции с АТФ за связывание с сайтом. Показано также, что другие ингибиторы связываются с отдельным гидрофобным участком белка,известным как карман "DFG-в-конформации", а третья группа ингибиторов связывается как с АТФсвязывающим доменом, так и с карманом "DFG-в-конформации". Примеры специфических ингибиторовA1 (2003); Dumas, J., et al., WO 9932455 A1 (1999), Wan, P.T.C., et al., Cell (2004) 116: 855-867. С точки зрения физиологии, регуляция киназ осуществляется по обычному механизму активации/инактивации, в котором последовательность петли специфической активации белка киназы связывается с определенным карманом в таком же белке, который называется "переключающим" карманом (см.WO 200380110049 для дальнейших подробностей). Такое связывание происходит, когда определенные остатки аминокислот петли активации модифицированы, например, путем фосфорилирования, окисления или нитрозилирования. Связывание петли активации с "переключающим" карманом приводит к изменению конформации белка в его активную форму (Huse, M. и Kuriyan, J. Cell (109) 275-282.) Краткое описание Соединения настоящего изобретения находят применение при лечении различных видов рака млекопитающих и, в частности, человека, включая, но не ограничиваясь ими: злокачественную меланому,-1 016055 рак кишечника, рак яичника, сосочковую карциному щитовидной железы, немелкоклеточный рак легкого и мезотелиому. Соединения настоящего изобретения также находят применение при лечении ревматоидного артрита и ретинопатий, включая диабетическую нейропатию сетчатки и дегенерацию желтого пятна, сердечно-сосудистых заболеваний и нарушений метаболизма. Описание предпочтительных вариантов реализации Приведенные ниже описания относятся к различным соединениям и их фрагментам (группам)."Арил" относится к моноциклической или конденсированной бициклической системе колец, характеризующейся делокализованными -электронами (ароматичностью), распределенными среди атомов углерода, образующих по меньшей одно карбоциклическое кольцо; предпочтительными арильными кольцами являются фенил, нафтил, тетрагидронафтил, инденил и инданил."Гетероарил" относится к моноциклической или конденсированной системе колец, характеризующейся делокализованными -электронами (ароматичностью), распределенными среди атомов углерода или гетероатомов кольца, включая азот, кислород или серу по меньшей мере одного карбоциклического или гетероциклического кольца; гетероарильные кольца включают, но не ограничиваются ими: пирролил, фурил, тиенил, оксазолил, тиазолил, изоксазолил, изотиазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил,индолил, индолинил, изоиндолил, изоиндолинил, индазолил, бензофуранил, бензотиенил, бензотиазолил,бензотиазолонил, бензоксазолил, бензоксазолонил, бензизоксазолил, бензизотиазолил, бензимидазолил,бензимидазолонил, бензтриазолил, имидазопиридинил, пиразолопиридинил, имидазолонопиридинил,тиазолопиридинил, тиазолонопиридинил, оксазолопиридинил, оксазолонопиридинил, изоксазолопиридинил, изотиазолопиридинил, триазолопиридинил, имидазопиримидинил, пиразолопиримидинил, имидазолонопиримидинил, тиазолопиридиминил, тиазолонопиримидинил, оксазолопиридиминил, оксазолонопиримидинил, изоксазолопиримидинил, изотиазолопиримидинил, триазолопиримидинил, дигидропуринонил, пирролопиримидинил, пуринил, пиразолопиримидинил, фталимидил, фталимидинил, пиразинилпиридинил, пиридинопиримидинил, пиримидинопиримидинил, циннолинил, хиноксалинил, хиназолинил, хинолинил, изохинолинил, фталазинил, бензодиоксил, бензизотиазолин-1,1,3-трионил, дигидрохинолинил, тетрагидрохинолинил, дигидроизохинолил, тетрагидроизохинолинил, бензоазепинил, бензодиазепинил, бензоксапинил или бензоксазепинил."Гетероциклил" относится к моноциклическим кольцам, содержащим углерод и гетероатомы, выбранные из кислорода, азота или серы, и в которых нет делокализованных -электронов (ароматичности), распределенных среди атомов углерода или гетероатомов кольца; гетероциклические кольца включают, но не ограничиваются ими: оксетанил, азетадинил, тетрагидрофуранил, пирролидинил, оксазолинил, оксазолидинил, тиазолинил, тиазолидинил, пиранил, тиопиранил, тетрагидропиранил, диоксалинил,пиперидинил, морфолинил, тиоморфолинил, тиоморфолинил S-оксид, тиоморфолинил S-диоксид, пиперазинил, азепинил, оксепинил, диазепинил, тропанил и гомотропанил."Полиарил" относится к двум или более моноциклическим или конденсированным бициклическим арильным системам колец, характеризующимися делокализованными -электронами (ароматичностью),распределенными среди атомов углерода по меньшей мере одного карбоциклического кольца; причем кольца, входящие в систему, возможно, соединены друг с другом."Полигетероарил" относится к системе двух или более моноциклических или конденсированных бициклических колец, характеризующейся делокализованными -электронами (ароматичностью), распределенными среди атомов углерода или гетероатомов кольца, включая азот, кислород или серу, по меньшей мере одного карбоциклического или гетероциклического кольца, в которой кольца, входящие в систему, возможно, соединены друг с другом, причем по меньшей мере одно из моноциклических или конденсированных бициклических колец полигетероарильной системы выбрано из определенных в целом выше гетероарилов, и другие кольца выбраны из арилов, гетероарилов или гетероциклов, определенных в целом выше."Полигетероциклил" относится к системе двух или более моноциклических или конденсированных бициклических колец, содержащих углерод и гетероатомы, выбранные из кислорода, азота или серы, и в которых нет делокализованных -электронов (ароматичности), распределенных среди атомов углерода или гетероатомов кольца, причем кольца, входящие в систему, возможно, соединены, причем по меньшей мере одно из моноциклических или конденсированных бициклических колец полигетероарильной системы выбрано из определенных в целом выше гетероциклов, и другие кольца выбраны из арилов, гетероарилов или гетероциклов, определенных в целом выше."Низший алкил" относится к C1-C6-алкилам с линейной или разветвленной цепью."Замещенный" применительно к группе означает, что дополнительный заместитель может быть связан с радикалом в любом приемлемом положении данного радикала.-2 016055 Термин "соль" подразумевает фармацевтически приемлемые соли, обычно используемые с получением солей щелочных металлов и свободных кислот и с получением солей свободных оснований. Природа соли не имеет критического значения при условии, что она будет фармацевтически приемлемой. Подходящие фармацевтически приемлемые кислотно-аддитивные соли могут быть получены из неорганической кислоты или из органической кислоты. Примерами таких неорганических кислот являются соляная, бромисто-водородная, иодисто-водородная, азотная, угольная, серная и фосфорная кислоты. Подходящие органические кислоты можно выбрать из алифатических, циклоалифатических, ароматических,арилалифатических и содержащих гетероциклы карбоксилсодержащих кислот и сульфоновых кислот,примерами которых являются муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая,молочная, яблочная, винно-каменная, лимонная, аскорбиновая, глюкуроновая, малеиновая, фумаровая,пировиноградная, аспарагиновая, глютаминовая, бензоевая, антраниловая, мезиловая, стеариновая, салициловая, п-гидроксибензойная, фенилуксусная, манделовая, эмбоновая (памоевая), метансульфоновая,этансульфоновая, 2-гидроксиэтансульфоновая, бензолсульфоновая, пантотеновая, толуолсульфоновая, 2 гидроксиэтансульфоновая,сульфаниловая,циклогексиламиносульфоновая,альгеновая,3 гидроксимасляная, галактаровая и галактуроновая кислоты. Подходящие фармацевтически приемлемые соли содержащих свободные кислоты соединений согласно настоящему изобретению включают соли металлов и органические соли. Более предпочтительные соли металлов включают, но не ограничиваются ими, подходящие соли щелочных металлов (группы Ia), соли щелочно-земельных металлов (группа IIa) и других физиологически приемлемых металлов. Такие соли могут быть получены для алюминия, кальция,лития, магния, калия, натрия и цинка. Предпочтительные органические соли можно получить из первичных аминов, вторичных аминов, третичных аминов и четверичных солей аммония, включая, среди прочего, трометамин, диэтиламин, тетра-N-метиламмоний, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглюмин (N-метилглюкамин) и прокаин. Термин "пролекарство" относится к производным активных соединений, которые in vivo переходят в активную форму. Например, активное начало в форме карбоновой кислоты можно этерифицировать с получением пролекарства, а затем сложный эфир in vivo преобразуется обратно в форму карбоновой кислоты, см. Ettmayer et al., J. Med. Chem., 2004, 47(10), 2393-2404 и Lorenzi et al., J. Pharm. Exp. Therpeutics,2005, 883-8900 для обзора. 1. Первый аспект изобретения - соединения, способы, препараты и аддукты. 1.1. Соединения формулы IIaG2 представляет собой индазолил, хинолинил и изохинолинил; кольцо А необязательно замещено одной или несколькими группами -Х 1-А 1;X1 выбран из группы, включающей -(СН 2)n-(О)r-(СН 2)n-, (CH2)n-(NR3)r-(CH2)n-, -(CH2)n-(S)r-(CH2)n-,-(СН 2)n-(C=O)r-(CH2)n-, -(CH2)n-(C(=O)-NR3)r-(CH2)n- и -(CH2)n-(SO2-NR3)r-(CH2)n-, где любой из алкиленов может иметь линейную или разветвленную цепь; Х 2 представляет собой прямую связь, причем Е 1 непосредственно связан с группой NR3 формулыIa; А 1 выбран из группы, включающей водород, арил, G1, G2, C1-C6-алкил, разветвленный C3-C8 алкил, R19-замещенный C3-C8-карбоциклил, C1-C6-фторалкил, где алкильная группа может быть частично или полностью фторирована, галоген, циано, гидроксил, -N(R4)2, -R5, -C(O)N(R4)2, C(O)R5, C1-C6 алкокси и C1-C6-фторалкокси, где алкильная группа может быть частично или полностью фторирована; если А и А 1 имеют один или более подходящих для замещения sp2-гибридизированных атомов углерода, каждый такой sp2-гибридизированный атом необязательно содержит в качестве заместителя Z1 или Z3; если А и А 1 имеют один или более подходящих для замещения sp3-гибридизированных атомов углерода, каждый такой sp3-гибридизированный атом углерода необязательно дополнительно содержит в качестве заместителя Z2 или R3; если А и А 1 имеют один или более подходящих для замещения атомов азота, каждый такой атом азота необязательно содержит в качестве заместителя Z4; каждый Z1 независимо и отдельно выбран из группы, включающей водород, гидрокси-C1-C6-алкил,C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкил, (R4)2N-C1-C6-алкил, (R4)2N-C2-C6-алкил-N(R4)-(CH2)n, (R4)2N-3 016055C2-C6-алкил-O-(СН 2)n, (R3)2N-C(=O)-, (R4)2N-C(=O)-, (R4)2N-СО-C1-C6-алкил, C1-C6-алкоксикарбонил,карбокси-C1-C6-алкил, C1-C6-алкоксикарбонил-C1-C6-алкил, (R3)2NSO2-, -SOR3, (R4)2NSO2-, -SO2R3,-SOR4, -C(=O)R6, -C(=NOH)R6, -C(=NOR3)R6, -(CH2)nN(R4)C(O)R8, -(CH2)n-G1, -(CH2)n-G4, фенокси,-(CH2)n-O-(CH2)n-G1, -(CH2)n-O-(CH2)n-G4, -(CH2)n-NR3-(СН 2)n-арил, -(CH2)n-NR3-(CH2)n-G1, -(CH2)nNR3-(GH2)n-G4,-S(O)2R5,-N=S(O)R6R8,-S(O)(=NR3)R6,-(CH2)nNHC(O)NHS(O)2R8,-(CH2)nNHS(O)2NHC(O)R8,-C(O)NHS(O)2R8,-S(O)2NHC(O)R8,-(CH2)nNHC(O)(CH2)nR5,-(CH2)nNHS(O)2(CH2)nR5,-(CH2)nC(O)NH(CH2)qR5,-(CH2)nC(O)R5,-(CH2)nOC(O)R5,-(CH2)nS(O)2NH(CH2)qR5, -CH(OH)(CH2)pR5, -CH(OH)CH(OH)R4, -(CH2)nN(R4)2, -(CH2)nR5, -C(=NH)R5,-C(=NH)N(R4)2, -C(=NOR3)R5, -C(=NOR3)N(R4)2 и -NHC(=NH)R8; в случае, если Z1 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-C6-алкилами; каждый Z2 независимо и отдельно выбран из группы, включающей водород, арил, C1-C6-алкил, C3C8-карбоциклил, гидроксил, гидрокси-C1-C6-алкил-, циано, (R3)2N-, (R4)2N-, (R4)2N-C1-C6-алкил-, (R4)2NC2-C6-алкил-N(R4)-(СН 2)n-, (R4)2N-C2-C6-алкилО-(СН 2)n-, (R3)2N-C(=O)-, (R4)2N-C(=O)-, (R4)2N-CO-C1C6-алкил-, карбоксил, карбокси-C1-C6-алкил, C1-C6-алкоксикарбонил-, C1-C6-алкоксикарбонил-C1-C6 алкил, (R3)2NSO2-, (R4)2NSO2-, -SO2R5, -SO2R8, -(CH2)nN(R4)С(О)R8, -C(O)R8, =O, =NOH, =N(OR6),-(CH2)n-G1, -(CH2)n-G4, -(CH2)n-O-(CH2)n-G1, -(CH2)n-O-(CH2)n-G4, -(CH2)n-NR3-(СН 2)n-арил, -(CH2)n-NR3(CH2)n-G1,-(CH2)n-NR3-(CH2)n-G4,-(CH2)nNHC(O)NHS(O)2R8,-(CH2)nNHS(O)2NHC(O)R8,-C(O)NHS(O)2R8, -(CH2)NHC(O)(CH2)nR5, -(CH2)nNHS(O)2R5, -(CH2)nC(O)NH(CH2)qR5, -(CH2)nC(O)R5,-(CH2)nOC(O)R5 и -(CH2)nR5; в случае, если Z2 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-C6-алкилами; каждый Z3 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, разветвленныйC3-C7-алкил, C3-C8-карбоциклил, галоген, фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, гидроксил, метокси, оксо, (R3)2N-C(=O)-, (R4)2N-C(=O)-, -N(R4)С(=O)R8, (R3)2NSO2-, (R4)2NSO2-, -N(R4)SO2R5, -N(R4)SO2R8, -(CH2)n-N(R3)2, -(CH2)n-N(R4)2, -O-(CH2)qN(R4)2, -О-(СН 2)q-O-алкил, -N(R3)-(СН 2)q-O-алкил, -N(R3)-(CH2)q-N(R4)2, -O-(CH2)q-R5, -N(R3)-(CH2)qR5, -C(=O)R5, -C(=O)R8 и нитро; в случае, если Z3 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-C6-алкилами; каждый Z4 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, C2-C6 гидроксиалкил, C1-C6-алкокси-C2-C6-алкил, (R4)2N-C2-C6-алкил, (R4)2N-C2-C6-алкил -N(R4)-C2-C6-алкил,(R4)2N-C2-C6-алкил-O-C2-C6-алкил,(R4)2N-CO-C1-C6-алкил,карбокси-C1-C6-алкил,C1-C6 алкоксикарбонил-C1-C6-алкил, -C2-C6-алкил-N(R4)C(O)R8, R8-C(=NR3)-, -SO2R8, -COR8, -(CH2)n-G1,-(CH2)n-G4, -(CH2)q-O-(CH2)n-G1, -(CH2)q-O-(CH2)n-G4, -(CH2)q-NR3-(CH2)n-G1, -(CH2)q-NR3-(CH2)n-G4,-(CH2)qNHC(O)(CH2)nR5, -(CH2)qC(O)NH(CH2)qR5, -(CH2)qC(O)R5, -(CH2)qOC(O)R5, -(CH2)qR5,-(CH2)qNR4(CH2)qR5 и -(CH2)qO(CH2)qR5; в случае, если Z4 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-C6-алкилами; каждый Z6 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, разветвленныйC3-C7-алкил, гидроксил, C1-C6-алкокси, -OR4, C1-C6-тиоалкил, (R3)2N-, (R4)2N-, -R5, -N(R3)COR8,-N(R4)COR8, -N(R3)SO2R6-, -CON(R3)2, -CON(R4)2, -COR5, -SO2N(R4)2, галоген, C1-C6-фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, C1-C6-фторалкокси, где алкильная группа может быть частично или полностью фторирована, -О-(CH2)q-N(R4)2, -N(R3)-(CH2)qN(R4)2, -О-(СН 2)q-O-алкил, -N(R3)-(СН 2)q-O-алкил, -О-(CH2)q-R5, -N(R3)-(СН 2)q-R5, -(NR3)r-(CH2)n-R17,-(O)r-R17, -(S)r-R17 и -(CH2)r-R17; в случае, если Z6 содержит алкильную или алкиленильную группу, такая группа может быть дополнительно замещена одним или несколькими C1-C6-алкилами; каждый R3 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, разветвленныйC3-C7-алкил, C3-C8-карбоциклил и Z3-замещенный фенил; каждый R4 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, C1-C6 гидроксиалкил, C1-C6-дигидроксиалкил, C1-C6-алкокси-C1-C6-алкил, разветвленный C3-C7-алкил, разветвленный C1-C6-гидроксиалкил, разветвленный C1-C6-алкокси-C1-C6-алкил, разветвленный C1-C6 дигидроксиалкил, -(СН 2)p-N(R7)2, -(CH2)p-R5, -(CH2)p-C(O)N(R7)2, -(CH2)nC(O)R5, -(СН 2)n-С(О)OR3, C3C8-карбоциклил, замещенный C3-C8-гидроксикарбоциклил, замещенный C3-C8-алкоксикарбоциклил, замещенный C3-C8-дигидроксикарбоциклил и -(CH2)n-R17; каждый R5 независимо и отдельно выбран из группы, включающей-4 016055 и где символомобозначена точка присоединения группы R5; каждый R6 независимо и отдельно выбран из группы, включающей C1-C6-алкил, разветвленный C3C7-алкил, C3-C8-карбоциклил, фенил, G1 и G4; каждый R7 независимо и отдельно выбран из группы, включающей Н, C1-C6-алкил, C2-C6 гидроксиалкил, C2-C6-дигидроксиалкил, C1-C6-алкокси-C2-C6-алкил, разветвленный C3-C7-алкил, разветвленный C2-C6-гидроксиалкил, разветвленный C1-C6-алкокси-C2-C6-алкил, разветвленный C2-C6 дигидроксиалкил, -(CH2)q-R5, -(СН 2)n-C(O)R5, -(CH2)n-C(O)OR3, C3-C8-карбоциклил, гидроксизамещенный C3-C8-карбоциклил, алкоксизамещенный C3-C8-карбоциклил, дигидроксизамещенный C3-C8 карбоциклил и -(CH2)n-R17; каждый R8 независимо и отдельно выбран из группы, включающей C1-C6-алкил, разветвленный C3C7-алкил, фторалкил, где алкильная группа может быть частично или полностью фторирована, C3-C8 карбоциклил, Z3-замещенный фенил, Z3-замещенный фенил-C1-C6-алкил, Z3-замещенный G1, Z3 замещенный G1-C1-C6-алкил, Z2-замещенный G4, Z2-замещенный G4-C1-C6-алкил, ОН, C1-C6-алкокси,N(R3)2, N(R4)2 и R5; каждый R10 независимо и отдельно выбран из группы, включающей СО 2 Н, CO2C1-C6-алкил, CON(R4)2, ОН, C1-C6-алкокси и -N(R4)2;R16 независимо и отдельно выбран из группы, включающей водород, C1-C6-алкил, разветвленныйC3-C7-алкил, C3-C8-карбоциклил, галоген, фторалкил, где алкильная группа может быть частично или полностью фторирована, циано, гидроксил, C1-C6-алкокси, C1-C6-фторалкокси, где алкильная группа может быть частично или полностью фторирована, -N(R3)2, -N(R4)2, C2-C3-алкинил и нитро; каждый R17 выбран из группы, включающей фенил, нафтил, пирролил, фурил, тиенил, оксазолил,тиазолил, изоксазолил, изотиазолил, имидазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиразинил, пиридазинил, триазинил, оксетанил, азетадинил, тетрагидрофуранил, оксазолинил,оксазолидинил, пиранил, тиопиранил, тетрагидропиранил, диоксалинил, азепинил, оксепинил, диазепинил, пирролидинил и пиперидинил; где R17 может быть дополнительно замещена одним или несколькими Z2, Z3 или Z4;R19 представляет собой Н или C1-C6-алкил; где два фрагмента R3 или R4 независимо и отдельно выбраны из группы, включающей C1-C6-алкил и разветвленный C3-C6-алкил, гидроксиалкил и алкоксиалкил, и соединены с одним и тем же атомом азота, причем указанные группы могут быть замкнуты в цикл с образованием C3-C7-гетероциклического кольца; и k равно 1 или 2; n равно 0-6; р равно 1-4; q равно 2-6; r равно 0 или 1; t равно 1-3. 1.1. Соединения формулы IIa, которые содержат примеры предпочтительных групп Е 1-Х 2. В одном варианте реализации раздела 1 предпочтительные соединения имеют структуры формулы 1.2. Соединения формулы IIa, которые содержат дополнительные примеры предпочтительных групп А. В другом варианте реализации раздела 1.1 дополнительные предпочтительные соединения имеют структуры формулы IIm где А 1 выбран из группы, состоящей из водорода, Z2-замещенного разветвленного C3-C8-алкила,R19-замещенного C3-C8-карбоциклила, Z2-замещенного C1-C6-алкила, C1-C6-фторалкила, в котором алкильная группа может быть фторирована частично или полностью, Z3-замещенного фенила и Z3 замещенного G1; и где R16 представляет собой C1-C6-алкил, циано, -ССН или галоген. 1.6 а. Дополнительные соединения формулы IIm, которые содержат примеры более предпочтительных групп Х 2-Е 1. В одном варианте реализации раздела 2. 6, предпочтительные соединения имеют структуры формулы IIn 1.6b. Дополнительные соединения формулы IIm, которые содержат примеры более предпочтитель-5 016055 ных групп Х 2-Е 1. В другом варианте реализации раздела 1.6 предпочтительные соединения имеют структуры формулы IIn 2.17. Способы. 2.17 а. Способы модулирования белков. Настоящее изобретение включает способы модулирования киназной активности RAF-киназ и других киназ сигнального пути RAS-RAF-MEK-ERK-MAP, включая, но не ограничиваясь ими, A-Raf, B-Raf и C-Raf. Киназы могут представлять собой нативные киназы, онкогенные формы киназ, абберантные рекомбинантые белки, включающие киназы, и любые полиморфные формы перечисленных выше вариантов. Способ включает стадию осуществления контакта киназ с соединениями согласно настоящему изобретению и, в частности, с соединениями, описанными в разделах 2.1-2.16. Молекулы киназ можно активировать или инактивировать, а также можно осуществлять модулирование путем фосфорилирования, сульфатирования, ацилирования жирной кислотой, гликозилирования, нитрозилирования, цистинилирования (то есть реакции внутренних остатков цистеина в киназе друг с другом с образованием дисульфидной связи) или окисления. Активность киназы может быть выбрана из группы, состоящей из катализа реакций передачи фосфата, локализации киназы в клетке и вовлечения других белков в комплекс передачи сигнала путем модулирования конформации киназы. 2.17b. Способы лечения. Способы согласно настоящему изобретению, в частности разделам 2.1-1.26, также включают лечение пациентов с состоянием, выбранным из группы, состоящей из хронической миелоидной и острой лимфоцитарной лейкемии, опухоли стромы желудочно-кишечного тракта, гиперэозинофильного синдрома, глиобластомы, рака яичника, рака поджелудочной железы, рака простаты, рака легкого, рака груди, рака почек, карциномы шейки матки, вторичных метастазов первичной солидной опухоли, заболеваний глаз, характеризующихся гиперпролиферацией, которые приводят к слепоте, включая различные ретинопатии, включая диабетическую ретинопатию и возрастную дегенерацию желтого пятна, ревматоидного артрита, меланомы, рака кишечника, рака щитовидной железы, заболеваний, вызванных мутацией в пути передачи сигнала RAS-RAF-MEK-ERK-MAP, воспалений у человека, ревматоидного спондилита, остеоартрита, астмы, артрита при подагре, сепсиса, септического шока, эндотоксического шока,грамотрицательного сепсиса, синдрома токсического шока, респираторного дистресс-синдрома взрослых, паралича, реперфузионных нарушений, травмы нервов, ишемии нервов, псориаза, рестеноза, хронической обструктивной болезни легких, резорбтивных заболеваний костей, отторжения трансплантата,болезни Крона, язвенного колита, воспалительных заболеваний кишечника, пареза и перечисленных заболеваний. 2.18. Фармацевтические препараты. Соединения согласно настоящему изобретению, в частности, из разделов 2.1-2.16 могут составлять часть фармацевтической композиции путем комбинирования одного или нескольких таких соединений вместе с фармацевтически приемлемым носителем. Дополнительно композиция может включать добавки, выбранные из группы, включающей адъюванты, наполнители, растворители и стабилизаторы. 3. Синтез соединений согласно настоящему изобретению. Соединения формулы IIa получают общими способами синтеза, проиллюстрированными в приведенных ниже схемах и сопутствующих примерах. Соединения формулы IIa получают, как показано на схеме 1. На стадии 1 проводят реакцию подходящего хлорпиримидинового эфира 1 с R4-замещенным амином с получением соединения формулы 2. Предпочтительные условия для схемы 1, стадии 1 включают полярные растворители, такие как ДМФ,ТГФ, ацетонитрил, диоксан, вода или их смеси, возможно, в присутствии добавленных оснований, таких как триэтиламин, при температурах от 0 до 100 С. Восстановление эфира 2 дает спирт 3. Предпочтительные реагенты для превращения на стадии 2 включают алюмогидрид лития в ТГФ при температуре в диапазоне от 0 С до комнатной температуры. Как показано на стадии 3, альдегид 4 можно получить путем окисления спирта 3 с использованием окислителей, таких как диоксид марганца. Конденсация альдегида 4 с эфиром 5 (стадия 4) дает пиридопиримидинон 6. Предпочтительные условия для стадии 4 включают нагревание (необязательное, 30-150 С) в ДМФ или диметилацетамиде (DMAc) в присутствии карбоната калия или карбоната цезия на протяжении периода времени от 1 ч до 4 дней. Другие предпочтительные условия для схемы 1, стадии 4 включают объединение 4, сложного эфира 5 и фторида калия на кремнеземе в диметилацетамиде при перемешивании и, возможно, обработке ультразвуком и/или необязательном нагревании (30-150 С) в течение периода от 30 мин до 48 ч. Группа "Р" в формулах 5-8 представляет атом водорода или защитную группу амина (которая может присутствовать или нет), такую как трет-бутилкарбамат (Вос), бензил карбамат (Cbz), ацетамид и т.п. Для специалистов в данной области,очевидно, что фрагмент R3-N-P-X2 в формулах 5-8 может также представлять заменитель аминогруппы,такой как нитро или циано, который можно превратить в аминогруппу на стадии 7 путем восстановления в подходящих условиях. На схеме 1, стадия 5 фрагмент тиометила соединения 6 можно окислить до сульфоксида или сульфона с получением 7. Предпочтительные реагенты для таких превращений включают пероксибензойную кислоту, оксон, оксазиридины и другие окислители, которые специалисты в данной области признают как стандартные окислители атомов серы. На практике смеси сульфоксидов и сульфонов можно использовать на стадии 6 без предварительного разделения. На стадии 6 фрагмент сульфона или сульфоксида соединения 7 можно превратить в фрагмент Z6, связанный с пиридопиримидиноном через гетероатом с получением 8 путем осуществления контакта 7 с Z6-H [например, NH(R4)2, HOR4 или HSR4], возможно,в присутствии основания, такого как калия трет-бутоксида, гидрида натрия и т.д., или в качестве альтернативы в присутствии сильной кислоты, такой как соляная кислота. Предпочтительные растворители для таких превращений включают диоксан, ДМФ, ТГФ, спиртовые растворители или чистый Z6-H при температуре в диапазоне от 0 до 200 С. Специалисты в данной области понимают, что в некоторых случаях соединения формулы 8 можно получить прямо из соединения формулы 6, используя условия стадии 6. В случае, если Z6 представляет собой водород, предпочтительные способы включают осуществление контакта соединений 6 или 7 с газообразным водородом в присутствии подходящего катализатора гидрогенирования, например Raney Nickel (никель Ренея) или Pd на угле в подходящем растворителе, таком как этанол, метанол, этилацетат или ТГФ. На схеме 1, стадия 7 защитную группу Р, которая может присутствовать в соединении формулы 8,можно, при необходимости, удалить путем снятия защиты в подходящих условиях (например, кислотный гидролиз для Вос или гидрогенирование для Cbz) с получением соединения формулы 9. Стадия 7 может также включать превращение заменителей амина (например, нитро) в амины при помощи соответствующих реагентов (например, путем восстановления нитрогруппы Zn/аммония хлоридом или путем гидрогенирования с палладиевым катализатором). Наконец, на стадии 8 можно осуществить превраще-7 016055 ние соединения формулы 9 в соединение формулы 10, которая является примером формулы Ia, путем реакции с изоцианатами формулы A-NCO, 11. Очевидно, что изоцианаты 11 можно либо непосредственно ввести в реакцию, либо приготовить in situ, например, путем разложения ацил азидов (перегруппировка Курциуса) в присутствии 9. Кроме того, для специалиста в данной области очевидно, что некоторые карбаматы, например трихлорэтилкарбаматы (12) и изопропенил карбаматы (13), также действуют как эквиваленты изоцианатов и могут найти применения на стадии 8. Альтернативный способ получения промежуточного соединения 6 показан на схеме 2. Обработка альдегида 4 из схемы 1 этил (трифенилфосфоранилиден)ацетатом дает соединения формулы 14. Бромирование 14N бромсукцинимидом (стадия 2) дает бромид 15. На стадии 3 реакция сочетания типа Сузуки 15 с бороновыми кислотами 16 в присутствии палладиевого катализатора дает соединения формулы 6,которые можно применять с получением соединения формулы 10, как показано на схеме 1. Схема 2 Пиримидины 1, которые нельзя свободно приобрести, можно легко получить из известного промежуточного соединения 17 [см., Seto, et al. Biorg. Med. Chem. Lett., 2005, 15, 1485] (схема 3). Таким образом, литирование 17 под действием LDA с последующим гашением CO2 дает кислоту 18. Превращение кислоты 18 в сложный эфир 19 дает каркас для введения группы Z6 согласно настоящему изобретению. Если фрагмент Z6 связан с пиримидином через атом азота Z6, атом кислорода Z6 или атом серы Z6, соединения формулы 1 можно получить путем осуществления контакта амина Z6-Н, спирта Z6-H или тиола Z6-H с соединением 19, либо чистого (Z6-H как растворитель), либо в подходящем растворителе, таком как ДМФ, ДМСО или спиртовой растворитель в интервале температур от -78 до 200 С в присутствии подходящего основания, такого как триэтиламин, карбонат калия или трет-бутоксид калия. В случае,если Z6 связан с пиримидином через атом углерода Z6, предпочтительный способ включает осуществление контакта соединения 19 с молекулой формулы Z6-M в присутствии палладиевого катализатора, где М - это фрагмент, который участвует в катализируемой переходным металлом реакции перекрестного связывания. Примеры подходящих групп М включают, но не ограничиваются ими: борные кислоты и их сложные эфиры, цинк, медь, олово, кремний, магний, литий и алюминий. Схема 3 Соединения формул IIa можно получить дополнительными способами, показанными на схеме 4 ниже. Как показано на стадии 1, реакция R4-замещенных аминов с 5-бром-2,6-дихлорпиримидином (22,имеется в продаже), 3-бром-2,6-дихлорпиридином (21, который можно получить, следуя процедуре согласно Pierrat et al. J. Comb. Chem. 2005, 7, 879-886) или 5-бром-2,4-дихлорпиридином 20, который можно получить, следуя процедуре согласно Schlosser et al., J. Org. Chem. 2004, 70, 2494-2502) дает соединения 23-25 соответственно. На стадии 2 обработка бромидов 23-25 трибутилвинилом в присутствии палладиевого катализатора дает соединения формул 26-28. На стадии 3 окислительное отщепление фрагмента олефина дает альдегиды формул 29-31. На схеме 4, стадия 4 конденсирование 29-31 с эфиром 5 дает 32-34. Предпочтительные условия для стадии 4 включают нагревание (необязательное, 30-150 С) в ДМФ или DMAc в присутствии карбоната калия или карбоната цезия на протяжении периода времени от 1 ч до 4 дней. Другие предпочтительные условия для схемы 4, стадия 4 включают сочетание альдегида 29-31, эфира 5 и фторида калия на кремнеземе в диметилацетамиде при перемешивании и, возможно, обработке ультразвуком и/или необязательном нагревании (30-150 С) в течение периода от 30 мин до 48 ч. Как описано на схеме 1, группа "Р",присутствующая в формулах 32-37 представляет атом водорода или защитную группу амина (которая может присутствовать или нет), такую как трет-бутилкарбамат (Boc), бензил карбамат (Cbz), ацетамид и т.п. Для специалиста в данной области очевидно, что фрагмент R3-N-P-X2 в формулах 32-37 может также представлять заменитель аминогруппы, такой как нитро или циано, который можно превратить в аминогруппу на стадии 6 путем восстановления в подходящих условиях. Как показано на схеме 4, стадия 5, соединения формул 32-34 можно превратить в соединения формул 35-37 путем замещения фрагмента хлорида 32-34 фрагментом Z6. Существуют несколько способов,которыми можно осуществить такое замещение в зависимости от природы Z6. В случае, если фрагментZ6 связан с кольцом, содержащим Q1 через атом азота Z6, предпочтительные способы включают нагревание соединения формул 32-34 с избытком амина Z6-H с избытком амина Z6-H либо в чистом амине,либо в растворителе, таком как N-метилпирролидон, ДМФ, ДМСО или спиртовой растворитель, в интервале температур от комнатной температуры до 200 С. Для случая арильных и гетероарильных аминовZ6-H дополнительные предпочтительные способы включают нагревание соединений 32-34 с избытком амина Z6-H и кислотным катализатором (например, TsOH, HCl, НОАс или тому подобное) в подходящем растворителе, таком как ДМФ, ДМСО или спиртовой растворитель. Дополнительные предпочтительные способы для арил- и гетероариламинов Z6-H включают нагревание соединений 32-34 в присутствии катализатора на основе переходного металла, такого как палладиевый катализатор в подходящем растворителе, подобном 1,4-диоксану или ДМФ. В случае, когда радикал Z6 связан с кольцом, содержащим Q,через атом кислорода или серы, предпочтительные способы включают нагревание 32-34 со спиртом или триолом Z6-H в присутствии сильного основания (например, NaH или калия трет-бутоксида), либо чистого, с использованием Z6-H в качестве растворителя, или в полярном растворителе, таком как ДМФ или ДМСО при температуре в диапазоне от комнатной температуры до 200 С. В случае, когда фрагмент Z6 связан с пиридопиримидином через атом углерода Z6, предпочтительные способы включают осуществление контакта соединения 32-34 с молекулой формулы Z6-M в присутствии палладиевого катализатора,где М - это фрагмент, который участвует в катализируемой переходным металлом реакции перекрестного связывания. Примеры подходящих групп М включают, но не ограничиваются ими: борные кислоты и их сложные эфиры, цинк, триалкилолово, кремний, магний, литий и алюминий. В случае, когда Z6 - это водород, предпочтительные способы включают выдерживание соединений формул 32-34 в газообразном водороде в присутствии пригодного катализатора гидрирования, например Raney Nickel Pd на угле в подходящем растворителе, таком как этанол, этилацетат или ТГФ. Как показано на схеме 4, стадия 6, удаление защитной группы Р, которая, возможно, присутствует,-9 016055 дает соединения формул 38-40, которые затем можно превратить (стадия 7) в соединения формул 41-43,которые представляют собой примеры формул Ia и IIa, способами, описанными на схеме 1. На схеме 5 показан альтернативный, предпочтительный способ получения хлорпиридин альдегидов 29, которые можно использовать для приготовления аминов 32 и соединений общей формулы IIa. Так, по аналогии со схемой 1 проводят реакцию этил 4,6-дихлороникотината (44) с R4-замещенным амином, в результате чего получают соединение формулы 45. Предпочтительные условия для схемы 5, стадии 1 включают полярные растворители, такие как ДМФ, ТГФ, ацетонитрил, диоксан, воду или их смеси, возможно, в присутствии добавленных оснований, таких как триэтиламин, при температурах от 0 до 100 С. Восстановление эфира 45 дает спирт 46. Предпочтительные реагенты для превращения на стадии 2 включают алюмогидрид лития в ТГФ при температуре в диапазоне от 0 С до комнатной температуры. Как показано на стадии 3, альдегид 29 можно получить путем окисления спирта 46 окислителями, такими как диоксид марганца. Конденсация альдегида 29 с эфиром 5 согласно схеме 4 дает 32, который можно использовать с получением соединения формулы IIa. Схема 5 Очевидно, что в описанных выше схемах некоторые Z6 можно использовать с защитными группами, что потребует дополнительных стадий удаления защитных групп. Например, на схеме 6 показан предпочтительный способ получения пиридопиридина формулы 48, где Z6 представляет собой NHMe. На схеме 6, на стадии 1 проводят реакцию хлорпиридина 32 с (4-метоксибензил)метиламином и получают 47. Стадию 1 можно осуществить в чистом (4-метоксибензил)метиламине при температурах в диапазоне от 150 до 200 С. Либо, в более предпочтительном случае, стадию 1 можно провести с лишь небольшим избытком (4-метоксибензил)метиламина и DBU (1,8-диазабицикло[5.4.0]ундек-7-ена) в Nметилпирролидоне при температурах от 150 до 200 С. На стадии 2, удаление защитной группы 4 метоксибензила из 47 под действием трифторуксусной кислоты дает амин 48. Стадия 6 В дополнении к способам получения мочевины, описанным на схемах 1 и 4 выше, мочевины формул Ia и IIa можно также получить, как показано на схеме 7. На схеме 7, на стадии 1 проводят реакцию аминов формул 49-51 с изопропенилхлорформатом, в результате чего получают соответствующие изопропенил карбаматы 52-54. На стадии 2 проводят реакцию карбаматов с 52-54 с аминами формулы ANHR3 (55) с получением мочевин формул 56-58. В случае, если R3 не является Н, монозамещенные мочевины 56-58 можно (но не обязательно) превратить далее в бис-R3-замещенные мочевины 59-61. Так, на стадии 3 осуществление контакта NH-мочевин 56-58 с алкилгалидами в присутствии основания, например карбоната калия, NaH, калия трет-бутоксида или ВЕМР, в подходящем растворителе, таком как ДМФ, дает мочевины 59-61, в которых новая введенная группа R3 представляет собой алкил. В качестве альтернативы осуществление контакта мочевин 56-58 с ацетатом меди(II) и фенилбороновыми кислотами [см. Chan et al., Tetrahedron Lett. 2003, 44, 3863-3865; Chan et al., Tetrahedron Lett. 1998, 39, 2933-2936; Chan, D.M.T. Tetrahedron Lett. 1996, 37, 9013-9016] дает аналогичные соединения 5961, в которых новый введенный R3 представляет собой фенил. Общий способ А. В раствор исходного пиразоламина (1 экв.) в EtOAc добавили 2,2,2 трихлорэтилхлорформат (1,1 экв.) и насыщенный NaHCO3 (2-3 экв.) при С. Спустя 3 ч перемешивания при комнатной температуре, фазы разделили и водную фазу экстрагировали EtOAc. Смешанные органические экстракты промыли солевым раствором, высушили (Na2SO4) и сконцентрировали под вакуумом с получением сырого карбамата TROC 2,2,2-трихлороэтилоксикарбонил)пиразоламина). К карбамату (1 экв.) в ДМСО добавили диизопропилэтиламин (2 экв.), подходящий амин (2 экв.) и смесь перемешивали при 60 С в течение 16 ч или до полного поглощения исходного карбамата. К смеси добавили воду и продукт экстрагировали EtOAc (225 мл). Смешанные органические экстракты промыли солевым раствором, высушили (Na2SO4) и сконцентрировали под вакуумом с получением сырого продукта, который очистили путем хроматографии на колонках с получением желаемого соединения. Общий способ В. К суспензии амина (обычно 0,67 ммоль) в EtOAc (2 мл) добавили 1 н. водныйNaOH. Реакционную смесь охладили до 0 С и обработали изопропенил хлорформатом (0,1 мл, 0,94 ммоль) более 30 с. Реакционную смесь перемешивали 15 мин при 0 С и 1 ч при комнатной температуре. Реакционную смесь вылили в ТГФ-EtOAc (1:1; 40 мл) и отмыли H2O (210 мл) и солевым раствором(210 мл). Органическую фракцию высушили (Na2SO4), сконцентрировали под вакуумом и остаток очистили на хроматографических колонках с получением желаемого (проп-1-ен-2-ил)карбамата. К карбамату (обычно 0,26 ммоль) добавили подходящий амин (обычно 0,26 ммоль) в ТГФ (2 мл) и 1 метилпирролидин (каталитическое количество) при 60 С в течение 18 ч. Смесь разбавили CH2Cl2 (2 мл) и гексаном (0,5 мл) и перемешивали в течение 10 мин. Полученный осадок отфильтровали и высушили,полученное твердое вещество путем обработки 0,1 н. раствором HCl превратили в гидрохлоридную соль амина и лиофилизировали. Общий способ С. В перемешиваемый раствор амина (2 ммоль, 1,00 экв.) и пиридина (4 ммоль, 2,00 экв.) в CH2Cl2 (18 мл) при комнатной температуре добавили Troc-Cl (1,87 ммоль, 1,05 экв.). Спустя 4 ч реакционную смесь промыли 3 М HCl (1), насыщенным раствором NaHCO3 (1), высушили (Na2SO4),отфильтровали и выпарили с получением желаемого 2,2,2-трихлорэтил карбамата. Продукт использовали в следующей реакции. 2,2,2-Трихлорэтил карбамат (0,7 ммоль, 1,00 экв.), подходящий (0,7 ммоль, 1,00 экв.) и iPr2NEt (1,54 ммоль, 2,20 экв.) смешали в ДМСО (3 мл) и перемешивали при нагревании при 70 С. Спустя 18 ч реакционную смесь разбавили солевым раствором (30 мл) и проэкстрагировали EtOAc (3). Смешанную органическую фракцию промыли солевым раствором (2), высушили (MgSO4), отфильтровали и выпарили с получением сырого продукта, который очистили путем импульсной колоночной хроматографии. Общий способ D. В перемешиваемый раствор карбоновой кислоты (0,50 ммоль, 1,00 экв.) и DPPA(0,75 ммоль, 1,50 экв.) в 1,4-диоксане (5,0 мл) при комнатной температуре добавили Et3N (1,5 ммоль, 3,00 экв.). После помешивания в течение 30 мин при комнатной температуре добавили подходящий амин(0,76 ммоль, 1,50 экв.) и смесь нагрели до 100 С. Спустя 2 ч реакционную смесь охладили при комнатной температуре, разбавили солевым раствором и экстрагировали EtOAc (2). Смешанную органическую фракцию промыли 3 М HCl (1), насыщенным раствором NaHCO3 (2) и солевым раствором (1), высушили (MgSO4), отфильтровали и выпарили с получением сырого продукта, который очистили путем колоночной флэш-хроматографии с получением желаемой мочевины. Общий способ Е. В раствор арилсульфона и/или аирлсульфоксида (0,4 ммоль) в ТГФ добавили подходящий амин (2 ммоль, 5 экв.) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Смесь разбавили EtOAc (3 мл) и полученный осадок отфильтровали, промыли и высушили с получением желаемого продукта ариламина. Общий способ F. В перемешиваемую суспензию изоцианата (0,51 ммоль, 1,00 экв.) и пиридина(0,0418 мл, 0,51 ммоль, 1,00 экв.) в CH2Cl2 (5 мл) при комнатной температуре добавили подходящий амин (0,51 ммоль, 1,00 экв.). Постепенно образовалась густая суспензия. Спустя 3,5 ч осадок отобрали фильтрованием, хорошо прополоскали в CH2Cl2 и высушили на фильтре с получением желаемой мочевины.-78 С в атмосфере Ar. Спустя 20 мин добавили проп-1-ен-2-ил хлорформат (11 ммоль) и реакционную смесь перемешивали 30 мин. Реакцию погасили 2 н. HCl (15 мл) при -78 С и нагрели при комнатной температуре. Реакционную смесь разбавили солевым раствором (50 мл) и EtOAc (50 мл), органическую фазу отделили и промыли солевым раствором, высушили (Na2SO4) и концентрировали под вакуумом. В результате путем хроматографии на силикагеле или перекристаллизации получили соответствующий проп 1-ен-2-ил карбамат. В карбамат (обычно 0,26 ммоль) добавили подходящий амин (обычно 0,26 ммоль) в ТГФ (2 мл) и 1 метилпирролидин (каталитическое количество) при 60 С в течение 18 ч. Смесь разбавили CH2Cl2 (2 мл) и гексаном (0,5 мл) и перемешивали в течение 10 мин. Полученный осадок отфильтровали и высушили,полученное твердое вещество путем обработки 0,1 н. раствором HCl превратили в гидрохлоридную соль амина и лиофилизировали. Пример А 1. К раствору соединения из примера A3 (6,0 г, 19 ммоль) в CH2Cl2 (50 мл) сразу добавили мхлорпероксибензойную кислоту (м-ХПБК, 6,5 г, 38 ммоль). После перемешиваний при комнатной температуре в течение 2 ч добавили насыщенный водный раствор NaHCO3 и водный раствор NaHSO3 и продолжали перемешивание в течение нескольких минут. Объединенные органические фазы промыли солевым раствором, высушили и концентрировали в вакууме. Остаток растворяли в ДМСО (5 мл) и добавили аммиак в диоксане (2 М, 200 мл, 400 ммоль). Полученную реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении, а осадок очищали путем обращенно-фазовой препаративной ВЭЖХ, в результате чего получали 2-амино-6-(3-амино-4 фторфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он (1,9 г, 35% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,63 (с, 1 Н), 7,80 (с, 1 Н), 7,39 (ушир.с, 2 Н), 7,12 (д, J=6,0 Гц, 1 Н), 7,03 (т, J=12,0 Гц, 1 Н), 6,80 (м, 1 Н),3,53 (с, 3 Н); МС (ESI) m/z: 286,2 (М+Н+). Пример А 2. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 9 (3,50 г, 10,6 ммоль) окислили хлорпероксибензойной кислотой (mCPBA, мХПБК) (2,87 г, 11,7 ммоль, 70 вес.%) с получением промежуточного 6-(3-амино-4-фторфенил)-8-этил-2-(метилсульфинил)пиридо[2,3-d]пиримидин-7(8 Н)она (2,35 г, 61% выход). Промежуточное соединение (1,40 г, 3,86 ммоль) и 0,5 М аммиак в диоксане (15,5 мл, 2 экв.) смешивали и очищали путем колоночной хроматографии на силикагеле с получением 2 амино-6-(3-амино-4-фторфенил)-8-этилпиридо[2,3-d]пиримидин-7(8 Н)-она (0,65 г, 56% выход). 1 Н ЯМР(400 МГц, ДМСО-d6):8,63 (с, 1 Н), 7,79 (с, 1 Н), 7,27 (с, 1 Н), 7,10 (дд, J=2,4, 8,8 Гц, 1 Н), 7,00 (дд, J=8,8,11,6 Гц, 1 Н), 6,75 (м, 1 Н), 5,14 (с, 2 Н), 4,31 (кв, J=6,8 Гц, 2 Н), 1,18 (т, J=6,8 Гц, 3 Н); ЖХ-МС (EI) m/z: 300,0 (М+Н+). Пример A3. Смесь соединения из примера C1 (15 г, 82 ммоль), этил 2-(3-амино-4-фторфенил)ацетата (19,4 г, 98 ммоль; получен способом согласно Kuse et al. Tetrahedron (2005), 61, 5754-5762) и K2CO3 (34,0 г, 246 ммоль) в ДМФ (100 мл) нагревали при 110 С в течение ночи. Смесь вливали в воду и экстрагировали продукт этилацетатом (3200 мл). Объединенные органические фазы промывали солевым раствором,сушили (Na2SO4) и концентрировали в вакууме. Очистка путем хроматографии на силикагеле давала 6(3-амино-4-фторфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (13,0 г, 50% выход). 1H ЯМР (300 МГц, ДМСО-d6):8,91 (с, 1 Н), 7,99 (с, 1 Н), 7,15 (дд, J=8,7, 2,1 Гц, 1 Н), 7,04 (дд, J=11,4, 8,4,1H), 6,80 (м, 1H), 5,21 (ушир.с, 2H), 3,65 (с, 3 Н), 2,60 (с, 3 Н); МС (ESI) m/z: 317,2 (М+Н+). Пример А 4. Следуя общему способу Е, 6-(3-амино-4-фторфенил)-8-этил-2-(метилсульфинил)пиридо[2,3d]пиримидин-7(8 Н)-она из примера 2 (0,94 г, 2,73 ммоль) и 2,0 М метиламин/ТГФ (2,73 мл, 5,5 ммоль) перемешивали в течение ночи при комнатной температуре. Добавляли воду (50 мл) и экстрагировали продукт EtOAc (230 мл). Объединенные органические фазы промывали солевым раствором, сушили(Na2SO4) и концентрировали с получением сырого продукта. Полученный сырой продукт перемешивали с раствором 60% CH2Cl2/гексан (10 мл) в течение 10 мин. Полученное в результате твердое вещество фильтровали, промывали раствором 60% CH2Cl2/гексан и сушили с получением 6-(3-амино-4 фторфенил)-8-этил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-она (0,32 г, 37% выход) в форме твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):8,62 (с, 1 Н), 7,82-7,77 (м, 2 Н), 7,11 (дд, J=8,8 Гц, 1,6 Гц,1 Н), 7,00 (дд, J=11,2 Гц, 8,0 Гц, 1 Н), 6,78-6,74 (м, 1 Н), 5,14 (с, 2 Н), 4,39-4,35 (м, 2 Н), 2,89 (д, J=4,4 Гц,3 Н), 1,26-1,22 (м, 3 Н); МС (ESI) m/z: 314,3 (М+Н+). Пример А 5. Следуя двухстадийной процедуре, аналогичной примеру А 27, соединение из примера А 55 (1,3 г, 3,2 моль) и 4-метоксибензиламин (10 мл) превращали в 7-амино-3-(3-амино-4-фторфенил)-1-метил-1,6 нафтиридин-2(1 Н)-он (0,55 г, 54% выход, две стадии). 1 Н ЯМР (400 МГц, ДМСО-d6):8,34 (с, 1 Н), 7,77- 12016055 Пример А 6. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 10 (0,200 г, 0,605 ммоль) иN,N-диметилэтилендиамин (0,334 мл, 3,03 ммоль) смешивали с получением 6-(5-амино-4-фтор-2 метилфенил)-2-(2-(диметиламино)этиламино)-8-метилпиридо[2,3-d]пиримидин-7(8H)-она (0,095 г, 42% выход) в форме желтой пены. 1 Н ЯМР (400 МГц, CDCl3)8,40 (с, 1 Н), 7,36 (с, 1 Н), 6,85 (д, J=11,6 Гц,1 Н), 6,62 (д, J=9,2 Гц, 1 Н), 6,11 (с, 1 Н), 3,79 (с, 3 Н), 3,57 (кв, J=5,6 Гц, 2 Н), 2,56 (т, J=6,0 Гц, 2 Н), 2,29 (с,6 Н), 2,07 (с, 3 Н); МС (ESI) m/z: 371,2 (М+Н+). Пример А 7. Смесь соединения из примера A11 (0,050 г, 0,16 ммоль) и N,N-диметилэтан-1,2-диамина (2,0 мл, 18 ммоль) нагревали при 175 С в атмосфере N2 в течение ночи. Реакционную смесь охлаждали до комнатной температуры и удаляли растворитель при пониженном давлении. Остаток гасили насыщенным раствором NaHCO3 (6 мл) и экстрагировали EtOAc (210 мл). Объединенные органические фазы промывали солевым раствором (6 мл), сушили (MgSO4) и концентрировали, в результате получали 3-(5-амино-4 фтор-2-метилфенил)-7-(2-(диметиламино)этиламино)-1-метил-1,6-нафтиридин-2(1 Н)-он (0,050 г, 86% выход) в форме светло-желтой пены. 1 Н ЯМР (400 МГц, CDCl3):8,28 (с, 1 Н), 7,43 (с, 1 Н), 6,86 (д, J=12,0 Гц, 1 Н), 6,64 (д, J=9,2 Гц, 1 Н), 6,06 (с, 1 Н), 5,58 (м, 1 Н), 3,60 (с, 3 Н), 3,40 (кв, J=5,2 Гц, 2 Н), 2,60 (т, J=6,0 Гц, 2 Н), 2,28 (с, 6 Н), 2,09 (с, 3 Н); МС (ESI) m/z: 370,2 (М+Н+). Пример А 8. Следуя процедурам, аналогичным описанной в примере С 2 и примере А 2, этил 4-хлор-2(метилтио)пиримидин-5-карбоксилат, циклопропиламин, этил 2-(3-амино-4-фторфенил)ацетат (полученный способом по Kuse et al. Tetrahedron (2005), 61, 5754-5762) и 0,5 М аммиак в диоксане (2 мл) смешивали с получением 2-амино-6-(3-амино-4-фторфенил)-8-циклопропилпиридо[2,3-d]пиримидин-7(8 Н)-она в форме грязно-белого твердого вещества (67 мг). 1H ЯМР (400 МГц, ДМСО-d6):8,57 (с, 1 Н), 7,73 (с,1 Н), 7,15 (ушир.с, 1 Н), 7,06 (дд, J=9,2 Гц, 2,4 Гц, 1 Н), 6,99 (дд, J=11,2 Гц, 11,6 Гц, 1 Н), 6,75-6,71 (м, 1 Н),2,88-2,82 (м, 1 Н), 1,18-1,13 (м, 2 Н), 0,83-0,78 (м, 2 Н); МС (ESI) m/z: 312,0 (М+Н+). Пример А 9. Способ 1. К раствору соединения из примера С 2 (8,0 г, 0,041 моль) и этил 2-(3-амино-4-фторфенил)ацетата(8,0 г, 0,041 моль) в диметилацетамиде (200 мл) добавили KF на Al2O3 (40 вес.%, 40 г, 0,275 моль) и перемешивали смесь при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали и концентрировали фильтрат до сухого состояния. Остаток промывали этиловым эфиром с получением 6-(3 амино-4-фторфенил)-8-этил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-она (10,9 г, 81% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,88 (с, 1 Н), 7,96 (с, 1 Н), 7,10 (дд, J=9,2, 2,4 Гц, 1 Н), 7,00 (дд, J=11,4, 8,6 Гц,1 Н), 6,76 (м, 1 Н), 5,17 (с, 2 Н), 4,36 (кв, J=6,8 Гц, 2 Н), 2,57 (с, 3 Н), 1,22 (т, J=6,8 Гц, 3 Н); МС (ESI) m/z: 331,1 [М+Н]+. Способ 2. Соединение из примера С 2 (2,08 г, 10,5 ммоль), этил 2-(3-амино-4-фторфенил)ацетат (2,29 г, 11,6 ммоль) и порошок K2CO3 (4,37 г, 31,6 ммоль) смешивали в ДМФ (15 мл) и тщательно перемешивали при нагревании при 110 С в атмосфере N2. После завершения реакции смесь частично охлаждали и разбавляли H2O (60 мл), в результате чего происходило осаждение продукта. Суспензию тщательно охлаждали во льду. Твердое вещество фильтровали и промывали водой (100 мл), в результате получали сырой продукт,6-(3-амино-4-фторфенил)-8-этил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (3,50 г, 100% выход). Пример А 10. Через раствор соединения из примера D4 (2 г, 8,0 ммоль), 6-бром-8-метил-2-(метилтио)пиридо[2,3d]пиримидин-7(8 Н)-она (2,5 г, 8,8 ммоль) и карбоната калия (3,3 г, 23,9 ммоль) в ДМФ (10 мл) в течение 20 мин барботировали азот, затем добавляли тетракис(трифенилфосфин)палладий (460 мг, 0,4 ммоль) и продолжали обработку азотом в течение 30 мин. Полученную смесь нагревали при 80 С в течение 16 ч. Остаток ДМФ удаляли при пониженном давлении и остаток разделяли между водой и EtOAc. Органическую фазу промывали солевым раствором, сушили, фильтровали, концентрировали и очищали путем колоночной хроматографии на силикагеле, в результате чего получали 6-(5-амино-4-фтор-2 метилфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (1,1 г, 42,3% выход). 1 Н ЯМР (400 МГц, ДМСО-d6:8,86 (с, 1 Н), 7,80 (с, 1 Н), 6,87 (д, J=12,0 Гц, 1 Н), 6,58 (д, J=8,0 Гц, 1 Н), 4,96 (ушир.с,2 Н), 3,62 (с, 3 Н), 2,59 (с, 3 Н), 1,95 (с, 3 Н). МС (ESI) m/z: 331,2 (М+Н+). Способ 2. Соединение из примера С 1 (3 г, 16,4 ммоль) и примера D1 (3,46 г, 16,4 ммоль) объединяли в диметилацетамиде (30 мл). Добавляли KF/Al2O3 (40 вес.%, 19 г, 130 ммоль) и полученную в результате суспензию тщательно перемешивали при комнатной температуре в течение 30 мин. Твердые вещества удаляли фильтрованием и фильтрат промывали диметилацетамидом. Смешанные органические фазы концентрировали в вакууме, в результате чего получали остаток, который разбавляли водой и фильтровали с получением 6-(5-амино-4-фтор-2-метилфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-онаCs2CO3 (40,0 г, 123 ммоль) добавляли к раствору соединение из примера D1 (10,00 г, 47 ммоль, 1 экв.) и соединение из примера С 1 (8,0 г, 44 ммоль, 0,92 экв.) в ДМФ (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение 15 ч. Добавляли воду (800 мл) при перемешивании. Осадок фильтровали и промывали водой, в результате получали сырой продукт. Сырой продукт разбавляли в метаноле при нагревании до 50 С в течение 20 мин. Горячую суспензию фильтровали и собранные твердые вещества сушили в вакууме, в результате получали 6-(5-амино-4-фтор-2-метилфенил)-8 метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (11,4 г, 73% выход). Пример A11. К раствору соединения из примера С 3 (2 г, 11,8 ммоль) в диметилацетамиде (40 мл) добавляли соединение из примера D1 (2,5 г, 11,8 ммоль), а затем KF/Al2O3 (40 вес.%, 10 г, 68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и вливали фильтрат в воду, осадок собирали фильтрованием и сушили с получением 3-(5-амино-4-фтор-2 метилфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-она (2,5 г, 69% выход). 1 Н ЯМР (300 МГц, ДМСОd6):8,72 (с, 1 Н), 7,90 (с, 1 Н), 7,62 (с, 1 Н), 6,88 (д, J=12,3 Гц, 1 Н), 6,60 (д, J=6 Гц, 1 Н), 4,95 (с, 2 Н), 3,60(с, 3 Н), 1,95 (с, 3 Н); МС (ESI) m/z: 318,0 [М+Н]+. Пример А 12. Следуя процедуре, аналогичной примеру А 1, соединение из примера A3 (4,0 г, 12,6 ммоль), мХПБК (3,43 г, 13,9 ммоль) и метиламингидрохлорид (1,73 г, 25,3 ммоль) смешивали с получением 6-(3 амино-4-фторфенил)-8-метил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-она в форме желтого твердого вещества (3,00 г, 79% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,70 и 8,62 (ушир.с, 1 Н), 7,81 (с, 1 Н),7,78 (м, 1 Н), 7,11 (дд, J=8,8, 2,0 Гц, 1 Н), 7,00 (дд, J=11,6, 8,0 Гц, 1 Н), 6,77 (м, 1 Н), 5,13 (с, 2 Н), 3,59 и 3,54(с, 3 Н), 2,91 (д, J=4,4 Гц, 3 Н); МС (ESI) m/z: 300,3 [М+Н]+. Пример А 13. Раствор соединения из примера A3 (2,5 г, 7,9 ммоль) в EtOH (30 мл) обрабатывали Raney Nickel(никель Ренея) (50% суспензия в воде, 10 г, 85 ммоль) и смесь нагревали с обратным холодильником в течение 3 ч. Охлажденную реакционную смесь фильтровали и фильтрат концентрировали, в результате получали сырой продукт, который промывали холодным МеОН (2 мл) с получением 6-(3-амино-4 фторфенил)-8-метил-8 Н-пиридо[2, 3-d] пиримидин-7-она (1,0 г, 47% выход). 1H ЯМР (300 МГц, ДМСОd6):9,10 (с, Н), 9,07 (с, 1 Н), 8,06 (с, 1 Н), 7,14 (дд, J=8,7, 2,1 Гц, 1 Н), 7,05 (дд, J=11,4, 8,4 Гц, 1 Н), 6,82 (м,1 Н), 5,22 (с, 2 Н), 3,68 (с, 3 Н); МС (ESI) m/z: 271,3 (М+Н+). Пример А 14. Раствор соединения из примера А 10 (500 мг, 1,5 ммоль) в диоксане (1 мл) и NH3H2O (5 мл) нагревали до 180 С в стальной бомбе в течение 3 ч. Растворитель удаляли при пониженном давлении, остаток очищали путем колоночной хроматографии на силикагеле, в результате получали 2-амино-6-(5-амино-4 фтор-2-метилфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-она (110 мг, 24% выход). 1 Н ЯМР (300 Гц,ДМСО-d6):8,58 (с, 1 Н), 7,59 (с, 1 Н), 7,25 (с, 2 Н), 6,85 (д, J=12,6 Гц, 1 Н), 6,57 (д, J=9,3 Гц, 1 Н), 4,88 (с,2 Н), 3,53 (с, 3 Н), 1,95 (с, 3 Н); МС (ESI) m/z: 300,3 [М+Н]+. Пример А 15. По аналогии с примером A3, 4-амино-2-(метилтио)пиримидин-5-карбальдегид (1 г, 5,9 ммоль, полученный согласно Barvian et al. J. Med. Chem. (2000), 43, 4606-4616), K2CO3 (2,4 г, 17,4 ммоль) и этиловый эфир (3-амино-4-фторфенил)кислоты (1,4 г, 7,1 ммоль) объединяли с получением 6-(3-амино-4 фторфенил)-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-она (1,1 г, 56% выход). 1 Н ЯМР (300 МГц,ДМСО-d6):12,51 (ушир.с, 1 Н), 8,87 (с, 1 Н), 7,95 (с, 1 Н), 7,12 (дд, J=9,0, 2,1 Гц, 1 Н), 7,02 (дд, J=11,4, 8,4 Гц, 1 Н), 6,80 (м, 1 Н), 5,19 (с, 2 Н), 2,55 (с, 3 Н); МС (ESI) m/z: 303,2 [М+Н]+. Пример А 16. Смесь соединения из примера С 1 (2,4 г, 13 ммоль), соединение из примера D2 (2,8 г, 13 ммоль) иKF/Al2O3 (40 вес.%, 10 г, 69 ммоль) в диметилацетамиде перемешивали при комнатной температуре в течение 10 мин. Реакционную смесь выливали в воду и экстрагировали смесь EtOAc (3). Объединенные органические экстракты промывали солевым раствором, сушили (Na2SO4), концентрировали в вакууме и хроматографировали,в результате получали 6-(5-амино-2,4-дифторфенил)-8-метил-2(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (2,5 г, 58% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,91 (с,1 Н), 7,98 (с, 1 Н), 7,13-7,06 (т, J=10,8 Гц, 1 Н), 6,86-6,80 (т, J=7,8 Гц, 1 Н), 5,10 (с, 2 Н), 3,62 (с, 3 Н), 2,59 (с,3 Н); МС (ESI) m/z: 335,0 [М+Н]+. Пример А 17. К раствору соединения из примера D3 (3 г, 13 ммоль) соединения из примера С 1 (2,4 г, 13 ммоль) в диметилацетамиде (50 мл) добавили KF/Al2O3 (40 вес.%, 10 г, 69 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали, фильтрат концентрировали в вакууме и вливали в воду. Осадок собирали фильтрованием и промывали Et2O, в результате получали 6-(5-амино-2-хлор-4-фторфенил)-8-метил-2-метилсульфанил-8 Н-пиридо[2,3-d]пиримидин-7-онJ=9,2 Гц, 1 Н), 3,75 (с, 3 Н), 3,72 (ушир.с, 2 Н), 2,62 (с, 3 Н); МС (ESI) m/z: 351,2 [М+Н]+. Пример А 18. Раствор соединения из примера С 2 (2,0 г, 10,2 ммоль), примера D3 (2,3 г, 10,2 ммоль) и KF/Al2O3(40 вес.%, 4 г, 27 ммоль) в безводном диметилацетамиде (50 мл) перемешивали при комнатной температуре в течение 10 мин. Реакционную смесь выливали в воду и экстрагировали EtOAc (3100 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4), концентрировали в вакууме и очищали путем хроматографии на силикагеле, в результате чего получали 6-(5-амино-2-хлор-4 фторфенил)-8-этил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (2,5 г, 67,6% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,89 (с, 1 Н), 7,91 (с, 1 Н), 7,23 (д, J=11,1 Гц, 1 Н), 6,75 (д, J=9,3 Гц, 1 Н), 5,40 (с, 2 Н),4,35 (кв, J=6,6 Гц, 2 Н), 2,59 (с, 3 Н), 1,22 (т, J=6,6 Гц, 3 Н); МС (ESI) m/z: 365,2 [М+Н]+. Пример А 19. Соединение из примера С 4 (1 г, 4,2 ммоль) в диметилацетамиде (10 мл), этил (3-амино-4 фторфенил)ацетат (0,83 г, 4,2 ммоль) и KF/Al2O3 (40 вес.%, 2 г, 34 ммоль) в диметилацетамиде (10 мл) объединяли, следуя процедуре примера А 17, в результате получали 6-(3-амино-4-фторфенил)-8 циклопентил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (1 г, 64% выход). 1 Н ЯМР (400 МГц,CDCl3):8,63 (с, 1 Н), 7,60 (с, 1 Н), 7,13 (дд, J=8,4, 2,0 Гц, 1 Н), 7,03 (дд, J=10,8, 8,4 Гц, 1 Н), 6,92 (м, 1 Н),6,05 (м, 1 Н), 2,64 (с, 3 Н), 2,41-2,32 (м, 2 Н), 2,13-2,05 (м, 2 Н), 1,95-1,87 (м, 2 Н), 1,72-1,65 (м, 2 Н); МС (ESI)m/z: 371,0 [М+Н]+. Пример А 20. В раствор соединения из примера А 10 (1,30 г, 3,93 ммоль) в этаноле (20 мл) помещали RaneyNickel (50% суспензия в воде, 5,08 г, 43,3 ммоль). Реакционную смесь нагревали с обратным холодильником в течение ночи. Смесь фильтровали через Celite и промывали EtOH. Объединенные фильтраты упаривали. Остаток обрабатывали EtOAc и фильтровали твердое вещество, в результате чего получали 6(5-амино-4-фтор-2-метилфенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он (0,65 г, 58% выход). 1H ЯМР(400 МГц, ДМСО-d6):9,10 (с, 1 Н), 9,08 (с, 1 Н), 7,91 (с, 1 Н), 6,90 (д, J=12,8 Гц, 1 Н), 6,61 (д, J=9,2 Гц,1 Н), 4,00 (ушир.с, 2 Н), 3,67 (с, 3 Н), 1,97 (с, 3 Н); МС (ESI) m/z: 285,0 (М+Н+). Пример А 21. Соединение из примера С 4 (2 г, 8,4 ммоль) и соединение из примера D1 (1,78 г, 8,4 ммоль) объединяли, следуя процедуре примера А 19, в результате получали 6-(5-амино-4-фтор-2-метилфенил)-8 циклопентил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (0,9 г, 27% выход). 1H ЯМР (400 МГц,CDCl3):8,53 (с, 1 Н), 7,39 (с, 1 Н), 6,82 (д, J=11,6 Гц, 1 Н), 6,59 (д, J=8,8 Гц, 1 Н), 5,98 (м, 1 Н), 2,57 (с, 3 Н),2,26 (м, 2 Н), 2,03-1,97 (м, 5 Н), 1,85-1,83 (м, 2 Н), 1,62-1,60 (м, 2 Н); МС (ESI) m/z: 385,0 [М+Н]+. Пример А 22. Соединение из примера А 25 (2,0 г, 6,3 ммоль) в метаноле (50 мл) гидрогенировали (45 фунт/кв.дюйм) в течение ночи при 50 С в присутствии 10% Pd(OH)2 (катализатор Пирлмана, 0,5 г, 0,35 ммоль). Реакционную смесь фильтровали, концентрировали при пониженном давлении и очищали путем колоночной хроматографии на силикагеле, в результате получали 3-(3-амино-4-фторфенил)-1-этил-1,6 нафтиридин-2(1 Н)-он (0,81 г, 45% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,91 (с, 1 Н), 8,54 (д, J=6,0 Гц,1 Н), 8,06 (с, 1 Н), 7,51 (д, J=6,4 Гц, 1 Н), 7,14 (дд, J=8,8, 2,0 Гц, 1 Н), 7,02 (дд, J=11,6, 8,4 Гц, 1 Н), 6,81 (м,1 Н), 5,18 (с, 2 Н), 4,27 (кв, 7,2 Гц, 2 Н), 1,21 (т, J=7,2 Гц, 3 Н). МС (ESI) m/z (M+H+): 284,2. Пример А 23. В стальную бомбу помещали соединение примера А 25 (2,5 г, 7,8 ммоль) и 4-метоксибензиламин (20 мл). Бомбу закрывали и смесь нагревали до 180 С в течение 6 ч. Охлажденную реакционную смесь вливали в раствор АсОН (15 мл) в ледяной воде(100 мл) и затем экстрагировали EtOAc (3100 мл). Объединенные экстракты промывали солевым раствором (350 мл), сушили (MgSO4) и концентрировали в вакууме. Неочищенный продукт очищали путем колоночной хроматографии на силикагеле, в результате получали 7-(4-метоксибензиламино)-3-(3-амино-4-фторфенил)-1-этил-1,6-нафтиридин-2(1 Н)-он (2,8 г,85% выход). 1H ЯМР (400 МГц, ДМСО-d6):8,39 (с, 1 Н), 7,76 (с, J=6,0 Гц, 1 Н), 7,45 (ушир.с, 1 Н), 7,28 (д,J=7,6 Гц, 2 Н), 7,07 (д, J=8,0 Гц, 1 Н), 6,96 (м, 1 Н), 6,86 (д, J=8,4 Гц, 2 Н), 6,74 (м, 1 Н), 6,27 (с, 1 Н), 5,08 (с,2 Н), 4,46 (д, J=5,6 Гц, 2 Н), 4,08 (кв, J=7,2, 14,0 Гц, 2 Н), 3,69 (с, 3 Н), 1,12 (т, J=7,2 Гц, 3 Н). МС (ESI) m/z: 419,3 (М+Н+). К раствору ТФА в CH2Cl2 (10%, 50 мл) добавляли 3-(3-амино-4-фторфенил)-1-этил-7-(4 метоксибензиламино)-1 Н-[1,6]нафтиридин-2-он (2,0 г, 4,78 ммоль). Полученную смесь перемешивали при 50 С в течение ночи. Реакционную смесь вливали в насыщенный водный раствор NaHCO3 (100 мл) и экстрагировали CH2Cl2 (375 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле, в результате получали 7-амино-3-(3-амино-4-фторфенил)-1-этил-1,6-нафтиридин-2(1 Н)-он (0,45 г, 32% выход). 1H ЯМР (300 МГц, ДМСО-d6):8,35 (с, 1 Н), 7,76 (с, 1 Н), 7,09 (дд, J=9,0, 2,1 Гц, 1 Н), 6,97 (дд, J=11,4, 8,4 Гц, 1 Н), 6,75- 15016055 Пример А 24. Следуя двухстадийной процедуре из примера А 23, соединение из примера А 25 (0,85 г, 2,7 ммоль) и 4-метоксибензилметиламин (10 мл) объединяли с получением 3-(3-амино-4-фторфенил)-1-этил-7(метиламино)-1,6-нафтиридин-2(1 Н)-она (0,45 г, 32% выход, 2 стадии). 1 Н ЯМР (300 МГц, ДМСО-d6):8,40 (с, 1 Н), 7,77 (с, 1 Н), 7,11 (д, J=9,0 Гц, 1 Н), 6,95 (м, 2 Н), 6,76 (м, 1 Н), 6,19 (с, 1 Н), 5,09 (с, 2 Н), 4,14 (м,2 Н), 2,85 (ушир.с, 3 Н), 1,20 (т, J=6,0, 3 Н); МС (ESI) m/z (M+H+): 313,3. Пример А 25. Раствор соединения из примера С 5 (6,0 г, 0,033 моль), этил 2-(3-амино-4-фторфенил)ацетата (6,4 г,0,033 моль) и K2CO3 (9,17 г, 0,066 моль) в ДМФ (100 мл) нагревали до 80 С в течение ночи. Реакционную смесь вливали в воду и экстрагировали EtOAc (3200 мл). Объединенные экстракты промывали насыщенным солевым раствором (3100 мл), сушили (MgSO4), концентрировали в вакууме и очищали путем хроматографии, в результате получали 3-(3-амино-4-фторфенил)-7-хлор-1-этил-1,6-нафтиридин-2(1 Н)-он(7,0 г, 67,9% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,75 (с, 1 Н), 8,07 (с, 1 Н), 7,67 (с, 1 Н), 7,13 (дд, J=8,8,2,0 Гц, 1 Н), 7,02 (дд, J=11,6, 8,4 Гц, 1 Н), 6,80 (м, 1 Н), 5,20 (с, 2 Н), 4,25 (кв, J=6,8 Гц, 2 Н), 1,19 (т, J=6,8 Гц,3 Н); МС (ESI) m/z: 318,2 [М+Н]+. Пример А 26. Соединение из примера A11 (1,36 г, 4,28 ммоль, 1,00 экв.), 4-метокси-N-метилбензиламин (0,971 г,6,42 ммоль, 1,50 экв.) и DBU (1,8-диазобицикло[5,4,0]ундек-7-ен, 0,960 мл, 6,42 ммоль, 1,50 экв.) объединяли в NMP (N-метилпирролидон, 20 мл) и перемешивали при нагревании при 180 С в атмосфере аргона в течение ночи. После завершения реакции реакционную смесь охлаждали до комнатной температуры и выливали на H2O (200 мл). Сразу отделялись твердые вещества, которые собирали фильтрованием и тщательно промывали H2O. Сухое вещество сушили на фильтре до влажного состояния и затем растворяли в EtOAc. Раствор сушили (MgSO4), фильтровали и упаривали, в результате получали 7-4 метоксибензил)(метил)амино)-3-(5-амино-4-фтор-2-метилфенил)-1-метил-1,6-нафтиридин-2(1 Н)-он (1,86 г, 100% выход) в форме ломкой коричневой пены, которую использовали в следующей реакции. 1 Н ЯМР(400 МГц, ДМСО-d6):8,45 (с, 1 Н), 7,63 (с, 1 Н), 7,16 (д, J=8,8 Гц, 2 Н), 6,85 (д, J=8,8 Гц, 2 Н), 6,86-6,82 (м,1 Н), 6,57 (д, J=9,6 Гц, 1 Н), 6,29 (с, 1 Н), 4,88 (ушир.с, 2 Н), 4,85 (с, 2 Н), 3,69 (с, 3 Н), 3,52 (с, 3 Н), 3,07 (с,3 Н), 1,94 (с, 3 Н); МС (ESI) m/z: 433,3 (М+Н+). 7-4-Метоксибензил)(метил)амино)-3-(5-амино-4-фтор-2-метилфенил)-1-метил-1,6-нафтиридин 2(1 Н)-он (1,86 г, 4,3 ммоль, 1,0 экв.) и CF3CO2H (9,5 мл, 13,8 г, 121 ммоль, 28 экв.) объединяли и перемешивали при комнатной температуре в течение ночи. После завершения реакции реакционную смесь медленно обрабатывали 2 М Na2CO3 до тех пор, пока смесь не становилась лишь слабо щелочной. Полученную суспензию перемешивали при комнатной температуре в течение 1 ч. Твердые вещества собирали фильтрованием, тщательно промывали H2O, частично сушили на воздухе, а затем в вакууме при 65 С. Неочищенный продукт очищали путем колоночной хроматографии (100% EtOAc до 25% ТГФ/EtOAc), в результате получали 3-(5-амино-4-фтор-2-метилфенил)-1-метил-7-(метиламино)-1,6-нафтиридин-2(1 Н)он (0,86 г, 64% выход) в форме грязно-белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):8,35 (с,1 Н), 7,58 (с, 1 Н), 6,99 (кв, J=4,8 Гц, 1 Н), 6,56 (д, J=12,0 Гц, 1 Н), 6,56 (д, J=9,2 Гц, 1 Н), 6,15 (с, 1 Н), 4,87(ушир.с, 2 Н), 3,48 (с, 3 Н), 2,84 (д, J=5,2 Гц, 3 Н), 1,94 (с, 3 Н); МС (ESI) m/z: 313,2 (М+Н+). Пример А 27. Раствор соединения из примера A11 (2,2 г, 6,9 ммоль) в 4-метоксибензиламине (30 мл) нагревали с обратным холодильником при 140 С в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь вливали в 20% водный раствор уксусной кислоты и перемешивали в течение 30 мин. Смесь фильтровали, в результате получали 7-(4-метоксибензиламино)-3-(5-амино-4-фтор-2 метилфенил)-1-метил-1,6-нафтиридин-2(1 Н)-он (2,3 г, 79% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,81m/z: 419,1 [М+Н]+. Трифторуксусную кислоту (2 мл, 26,9 ммоль) добавляли к раствору 7-(4-метоксибензиламино)-3-(5 амино-4-фтор-2-метилфенил)-1-метил-1,6-нафтиридин-2(1 Н)-она (0,8 г, 1,9 ммоль) в ДХМ (10 мл) и нагревали реакционную смесь с обратным холодильником при 50 С в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь промывали водой и объединенные водные фазы нейтрализовали насыщенным водным раствором NaHCO3 до рН 7-8. Затем водные фазы экстрагировали EtOAc(350 мл), экстракты сушили (Na2SO4) и концентрировали, в результате получали 7-амино-3-(5-амино-4 фтор-2-метилфенил)-1-метил-1,6-нафтиридин-2(1 Н)-он (0,3 г, 53% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,29 (с, 1 Н), 7,57 (с, 1 Н), 6,83 (д, J=12,4 Гц, 1 Н), 6,56 (д, J=9,6 Гц, 1 Н), 6,48 (с, 2 Н), 6,24 (с, 1 Н), 4,87 (с,2 Н), 3,45 (с, 3 Н), 1,94 (с, 3 Н); МС (ESI) m/z: 299,0 [М+Н]+. Пример А 28. Соединение из примера D3 (3 г, 12,9 ммоль), соединение из примера С 3 (2,2 г, 12,9 ммоль) иKF/Al2O3 (40%, 6 г, 41 ммоль) объединяли в диметилацетамиде (40 мл) и полученную смесь перемешивали при комнатной температуре в течение примерно 1 ч. Реакционную смесь фильтровали и фильтрат(с, 3 Н); МС (ESI) m/z: 338,1 [М+Н]+. Смесь 3-(5-амино-2-хлор-4-фторфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-она (2,5 г, 7,4 ммоль) и 4-метокси-N-метилбензиламида (4 мл) нагревали до 180 С в атмосфере N2 в течение приблизительно 3 ч. После охлаждения реакционную смесь разбавляли Et2O. Осадок фильтровали, промывали водой и сушили с получением 7-4-метоксибензил)(метил)амино)-3-(5-амино-2-хлор-4-фторфенил)-1-метил-1,6 нафтиридин-2(1 Н)-она (3 г, 89% выход). 1H ЯМР (400 МГц, ДМСО-d6):8,47 (с, 1 Н), 7,77 (с, 1 Н), 7,22(с, 1 Н), 3,72 (с, 3 Н), 3,52 (с, 3 Н), 3,09 (с, 3 Н); МС (ESI) m/z: 453,2 [М+Н]+. Раствор 7-4-метоксибензил)(метил)амино)-3-(5-амино-2-хлор-4-фторфенил)-1-метил-1,6-нафтиридин-2(1 Н)-она (3 г, 6,6 ммоль) в CH2Cl2 (50 мл) обрабатывали ТФА (20 мл) и смесь нагревали с обратным холодильником в течение ночи. Смесь концентрировали при пониженном давлении, остаток растворяли в 10% водном растворе HCl (50 мл), водную фазу промывали EtOAc. Водную фазу нейтрализовали водным раствором NaHCO3 до рН 8 и затем экстрагировали EtOAc (350 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме, в результате получали 3-(5-амино-2-хлор-4-фторфенил)-1-метил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-он (1,6 г, 72% выход). 1H ЯМР (300 МГц, ДМСО-d6):8,36 (с, 1 Н), 7,66 (с, 1 Н), 7,17 (д, J=10,8 Гц, 1 Н), 7,05 (м, 1 Н), 6,71(д, J=9,6 Гц, 1), 6,15 (с, 1 Н), 5,30 (с, 2 Н), 3,47 (с, 3 Н), 3,42 (с, 1 Н), 2,84 (д, J=4,4 Гц, 3 Н); МС (ESI) m/z: 333,1 [М+Н]+. Пример А 29. Соединение из примера С 3 (2 г, 9,3 ммоль), соединение из примера D2 (1,6 г, 9,3 ммоль) и KF/Al2O3(40%, 5 г, 34,4 ммоль) объединяли в диметилацетамиде и перемешивали в течение 10 мин. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали путем хроматографии, в результате получали 3-(5-амино-2,4-дифторфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-он (2 г, 68% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,41 (с, 1 Н), 7,73 (с, 1 Н), 7,06-7,03 (м, 1 Н), 6,81-6,75 (м,1 Н), 6,15 (с, 1 Н), 4,98 (с, 2 Н), 3,48 (с, 3 Н); МС (ESI) m/z: 322,7 [М+Н]+. 3-(5-Амино-2,4-дифторфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-он (2,4 г, 7,5 ммоль) и 4 метокси-N-метилбензиламин (10 мл) объединяли в закупоренном сосуде и нагревали до 200 С в течение ночи. Летучие вещества удаляли в вакууме, остаток очищали путем колоночной хроматографии, в результате получали 7-4-метоксибензил)(метил)амино)-3-(5-амино-2,4-дифторфенил)-1-метил-1,6 нафтиридин-2(1 Н)-он (3 г, 91% выход), который использовали на следующей стадии без дополнительной очистки. К раствору 7-4-метоксибензил)(метил)амино)-3-(5-амино-2,4-дифторфенил)-1-метил-1,6 нафтиридин-2(1 Н)-она (3 г, 6,8 ммоль) в ДХМ (100 мл) добавляли CF3COOH (20 мл), полученную в результате смесь перемешивали при 25 С в течение 6 ч. Добавляли воду и экстрагировали смесь водой. Объединенные водные фазы нейтрализовали NH3H2O до рН 7. Осадок собирали фильтрованием и сушили с получением 3-(5-амино-2,4-дифторфенил)-1-метил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-она (661 мг, 30% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,39 (с, 1 Н), 7,78 (с, 1 Н), 7,08-6,93 (м, 2 Н), 6,80 (дд,J=10,2, 8,1 Гц, 1 Н), 6,16 (с, 1 Н), 5,00 (с, 2 Н), 3,50 (с, 3 Н), 2,84 (д, J=4,8 Гц, 3 Н); МС (ESI) m/z: 317,0[М+Н]+. Пример А 30. Способом, аналогичным описанному для примера А 26, соединение из примера А 34 (1,61 г, 4,85 ммоль) превращали в 3-(5-амино-4-фтор-2-метилфенил)-1-этил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-он(1,16 г, 73% выход для двух стадий). 1 Н ЯМР (400 МГц, ДМСО-d6):8,36 (с, 1 Н), 7,58 (с, 1 Н), 6,94-6,92(д, J=4,8 Гц, 3 Н), 1,94 (с, 3 Н), 1,185 (т, J=1,2 Гц, 3 Н); МС (ESI) m/z: 327,2 (М+Н). Пример A31. Соединение из примера А 34 (2,5 г, 7,5 ммоль) и 4-метоксибензиламин (30 мл) объединяли, следуя процедуре 2 стадии примера А 27, в результате получали 7-амино-3-(5-амино-4-фтор-2-метилфенил)-1 этил-1,6-нафтиридин-2(1 Н)-он (0,9 г, 46% выход, 2 стадии). 1H-ЯМР (300 МГц, ДМСО-d6):8,30 (с, 1 Н),7,56 (с, 1 Н), 6,83 (д, J=12,3 Гц, 1 Н), 6,57 (д, J=9,6 Гц, 1 Н), 6,40 (с, 2 Н), 6,32 (с, 1 Н), 4,85 (с, 2 Н), 4,07 (кв,J=6,9 Гц, 2 Н), 1,94 (с, 3 Н), 1,19 (т, J=6,9 Гц, 3 Н); МС (ESI) m/z: 313,3 [М+Н]+. Пример A32. Соединение из примера С 5 (3,5 г, 19 ммоль), соединение из примера D3 (4,4 г, 19 ммоль) и KF/Al2O3(40 вес.%, 10 г, 69 ммоль) объединяли, следуя процедуре примера А 17, в результате получали 3-(5 амино-2-хлор-4-фторфенил)-7-хлор-1-этил-1,6-нафтиридин-2(1 Н)-он (4 г, 60% выход). 1H ЯМР (400 МГц,ДМСО-d6):8,75 (с, 1 Н), 8,01 (с, 1 Н), 7,72 (с, 1 Н), 7,24 (д, J=10,8 Гц, 1 Н), 6,76 (д, J=9,2 Гц, 1 Н), 5,40 (с,2 Н), 4,26-4,24 (м, 2 Н), 1,18 (т, J=6,8 Гц, 3 Н); МС (ESI) m/z: 352,1 [М+Н]+.- 17016055 Пример А 33. Следуя процедуре примера А 28, стадии 2 и 3, соединение из примера А 32 (3 г, 8,5 ммоль) превращали в 3-(5-амино-2-хлор-4-фторфенил)-1-этил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-он (1 г, 32% выход после двух стадий). 1 Н ЯМР (400 МГц, ДМСО-d6):8,46 (с, 1 Н), 7,75 (с, 1 Н), 7,1 (д, J=11,2 Гц, 1 Н),6,73 (д, J=9,6 Гц, 1 Н), 6,43 (с, 1 Н), 4,95 (ушир.с, 1 Н), 4,14 (м, 2 Н), 2,92 (с, 3 Н), 1,14 (т, J=6,8 Гц, 3 Н); МС(ESI) m/z: 347,2 [М+Н]+. Пример A34. Соединение из примера D1 (1,32 г, 6,25 ммоль, 1,00 экв.), соединение из примера С 5 (1,15 г, 6,25 ммоль, 1,00 экв.) и KF/Al2O3 (40,00 вес.%, 9,08 г, 625 ммоль, 10,00 экв.) объединяли в диметилацетамиде(35 мл) и обрабатывали ультразвуком в течение 2 ч. После завершения реакции реакционную смесь фильтровали через Celite с промывкой EtOAc (335 мл). Объединенные фильтраты промывали H2O (3 50-75 мл). Объединенные водные фазы экстрагировали EtOAc (1). Объединенные органические фазы промывали солевым раствором (2), сушили (MgSO4), фильтровали и упаривали. Неочищенный продукт очищали путем колоночной хроматографии (5% EtOAc/гексаны до 100% EtOAc), в результате получали 3-(5-амино-4-фтор-2-метилфенил)-7-хлор-1-этил-1,6-нафтиридин-2(1 Н)-он (1,61 г, 78% выход) в форме хрупкой пленки. МС (ESI) m/z: 332,0 (М+Н), 334,0 (М+2+Н). Пример A35. Раствор этил 4,6-дихлорникотината (16 г, 73 ммоль), анилина (8,2 г, 88 ммоль) и концентрированный HCl (0,5 мл) в EtOH (100 мл) нагревали с обратным холодильником в течение ночи. Растворитель удаляли при пониженном давлении. Добавляли воду, раствор подщелачивали до рН 8 и экстрагировалиEtOAc. Объединенные экстракты промывали солевым раствором, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали путем хроматографии, в результате получали этил 6-хлор-4-(фениламино) никотинат (10 г, 50% выход). 1H ЯМР (40 МГц, ДМСО-d6):9,73 (с, 1 Н), 8,67 (с, 1 Н), 7,50-7,46 (м, 2 Н),7,36-7,31 (м, 3 Н), 6,78 (с, 1 Н), 4,37 (кв, J=7,2 Гц, 2 Н), 1,35 (т, J=7,2 Гц, 3 Н). Раствор этил 6-хлор-4-(фениламино)никотината (19 г, 89 ммоль) в безводном ТГФ (40 мл) добавляли по каплям к суспензии LiAlH4 (8,5 г, 223 ммоль) в безводном ТГФ (80 мл) при 0 С. После завершения добавления реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Смесь гасили путем добавления 10% водного NaOH (8,5 мл) и воды (8,5 мл). Твердые вещества удаляли фильтрованием, органическую фазу концентрировали в вакууме, в результате получали (6-хлор-4(фениламино)пиридин-3-ил)метанол (12 г, 80% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,09 (с, 1 Н), 8,08MnO2 (39 г, 44 8 ммоль) добавляли к раствору (6-хлор-4-фениламинопиридин-3-ил)метанола (13 г,56 ммоль) в CH2Cl2 (100 мл) и перемешивали смесь при комнатной температуре в течение ночи. Твердые вещества удаляли фильтрованием, фильтрат концентрировали, в результате получали 6-хлор-4(фениламино)никотинальдегид (11 г, 86% выход). 1 Н-ЯМР (400 МГц, ДМСО-d6):10,18 (с, 1 Н), 9,99 (с,1 Н), 8,62 (с, 1 Н), 7,49-7,31 (м, 5 Н), 6,80 (с, 1 Н). Смесь 6-хлор-4-(фениламино)никотинальдегида (3 г, 13 ммоль), этил 2-(3-амино-4 фторфенил)ацетата (2,6 г, 13 ммоль) и KF/Al2O3 (40 вес.%, 10 г, 69 ммоль) в диметилацетамиде (30 мл) перемешивали при комнатной температуре в течение 2 ч. Твердые вещества удаляли фильтрованием,фильтрат концентрировали в вакууме. После рекристаллизации (EtOAc) получали 3-(3-амино-4 фторфенил)-7-хлор-1-фенил-1,6-нафтиридин-2(1 Н)-он (2,6 г, 55% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,81 (с, 1 Н), 8,20 (с, 1 Н), 7,62-7,56 (м, 3 Н), 7,40 (д, J=7,2 Гц, 2 Н), 7,13 (д, J=7,6 Гц, 1 Н), 7,02 (т, J=10,0 Гц, 1 Н), 6,82 (м, 1 Н), 6,26 (с, 1 Н), 5,19 (с, 2 Н); МС (ESI) m/z: 366,2 [М+Н]+. Пример A36. Суспензию соединения из примера A35 (2,5 г, 7 ммоль) в 4-метоксибензилметиламине (5 мл) нагревали при 160 С в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли эфиром. Полученный белый осадок собирали фильтрованием и сушили с получением 7-4 метоксибензил)(метил)амино)-3-(3-амино-4-фторфенил)-1-фенил-1,6-нафтиридин-2(1 Н)-она (3 г, 77%),который использовали на следующей стадии без дополнительной очистки. Суспензию 7-4-метоксибензил)(метил)амино)-3-(3-амино-4-фторфенил)-1-фенил-1,6-нафтиридин 2(1 Н)-она (3,0 г, 6 ммоль) в смеси CF3CO2H и CH2Cl2 (3:7, 30 мл) нагревали с обратным холодильником в течение ночи. Затем растворитель удаляли при пониженном давлении, остаток перекристаллизовывали(ESI) m/z: 361,3 [М+Н]+. Пример A37. Смесь соединения из примера А 60 (1,1 г, 3,7 ммоль) и 28% аммония гидрохлорид (6,0 мл) в закупоренном сосуде нагревали при 160 С в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь фильтровали, твердое вещество промывали холодным EtOAc, в результате получали 2 амино-6-(3-аминофенил)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-он (440 мг, 45% выход). 1H ЯМР (300- 18016055 МГц, ДМСО-d6): 8,61 (с, 1 Н), 7,77 (с, 1 Н), 7,24 (ушир.с, 2 Н), 7,02 (т, J=8,0 Гц, 1 Н), 6,84 (с, 1 Н), 6,73 (д,J=7,8 Гц, 1 Н), 6,51 (д, J=8,0 Гц, 1 Н), 5,05 (ушир.с, 2 Н), 3,54 (с, 3 Н). МС (ESI) m/z: 268,1 (М+Н+). Пример A38. Следуя процедуре, аналогичной примеру А 28, соединение из примера А 55 превращали в 3-(3 амино-4-фторфенил)-1-метил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-он (1,6 г, 59% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,39 (с, 1 Н), 7,78 (с, 1 Н), 7,07 (д, J=8,7 Гц, 1 Н), 7,05-6,93 (м, 2 Н), 6,75 (м, 1 Н), 6,13 (с,1 Н), 5,10 (с, 2 Н), 3,50 (с, 3 Н), 2,84 (д, J=4,8 Гц, 3 Н); МС (ESI) m/z: 299,2 (М+Н+). Пример A39. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 10 (1,500 г, 4,54 ммоль, 1,0 экв.), 3-хлорпербензойную кислоту (70 вес.%, 269 мг, 1,090 ммоль, 1,20 экв.) и 2,0 М MeNH2 в ТГФ(11,400 мл, 22,80 ммоль, 5,00 экв.) смешивали с получением сырым 6-(5-амино-4-фтор-2-метилфенил)-8 метил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-она (1,56 г, 105% выход) в форме оранжевой пленки, которую использовали, как есть. МС (ESI) m/z: 314,3 (М+Н). Пример А 40. В диметилацетамид (30 мл) помещали 4-аминоникотинальдегид (1,50 г, 12,3 ммоль) и этил 2-(3 амино-4-фторфенил)ацетат (2,42 г, 12,3 ммоль). К полученной смеси добавляли 40% KF/глинозем (8,92 г,61,4 ммоль) и перемешивали смесь при комнатной температуре в течение 48 ч. Смесь фильтровали через слой Celite, промывали слой этилацетатом (230 мл). Фильтрат разбавляли водой (100 мл) и оставляли двухфазную смесь для осаждения. Твердое вещество собирали фильтрованием, промывали водой (225 мл), сушили в линии высокого вакуума при 65 С в течение 3 ч и полученное вещество идентифицировали как 3-(3-амино-4-фторфенил)-1,6-нафтиридин-2(1 Н)-он (1,55 г, 49% выход). Использовали как есть. МС (ESI) m/z: 256,0 (М+Н+). Пример А 41. Соединение из примера С 2 (5,0 г, 25 ммоль), соединение из примера D1 (5,8 г, 27 ммоль) и Cs2CO3(22,7 г, 70 ммоль) объединяли в ДМФ (150 мл) и перемешивали при 60 С в течение ночи. Полученную смесь концентрировали при пониженном давлении, остаток промывали этиловым эфиром, в результате получали 6-(5-амино-4-фтор-2-метилфенил)-8-этил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (3,59 г, 42% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,88 (с, 1 Н), 7,82 (с, 1 Н), 6,89 (д, J=12,4 Гц, 1 Н), 6,61 (д,J=9,6 Гц, 1 Н), 4,96 (с, 2 Н), 4,38 (кв, J=6,8 Гц, 2 Н), 2,61 (с, 3 Н), 1,96 (с, 3 Н), 1,24 (т, J=6,8 Гц, 3 Н); МС(ESI) m/z: 345,2 [М+Н]+. Пример А 42. Соединение из примера С 6 (4,2 г, 19,9 ммоль), соединение из примера D1 (4,2 г, 20 ммоль) и Cs2CO3(16,86 г, 51,74 ммоль) объединяли в ДМФ (80 мл) и нагревали с обратным холодильником в течение ночи. Реакционную смесь выливали в воду и экстрагировали смесь этилацетатом. Объединенные экстракты промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Очистка путем хроматографии на силикагеле давала 6-(5-амино-4-фтор-2-метилфенил)-8-изопропил-2-(метилтио)пиридо[2,3d]пиримидин-7(8 Н)-он (1,47 г, 20% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,83 (с, 1 Н), 7,75 (с, 1 Н), 6,86(д, J=12,4 Гц, 1 Н), 6,58 (д, J=9,2 Гц, 1 Н), 5,71 (м, 1 Н), 4,92 (с, 2 Н), 2,58 (с, 3 Н), 1,93 (с, 3 Н), 1,53 (д, J=7,2 Гц, 6 Н); МС (ESI) m/z: 359,0 [М+Н ]+. Пример А 43. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 10 (0,200 г, 0,605 ммоль) иN',N'-диметилпропан-1,3-диамин (0,378 мл, 3,03 ммоль) смешивали с получением 6-(5-амино-4-фтор-2 метилфенил)-2-(3-(диметиламино)пропиламино)-8-метилпиридо[2,3-d]пиримидин-7(8 Н)-она (0,076 г,33% выход) в форме желтого твердого вещества. МС (ESI) m/z: 385,2 (М+Н+). Пример А 44. В метиленхлорид (50 мл) помещали 2-метил-5-нитробензойную кислоту (3,00 г, 16,6 ммоль) и 1 микрокаплю диметилформамида. Раствор охлаждали до 0 С и добавляли оксалилхлорид (3,15 г, 24,8 ммоль). Через 15 мин смеси позволяли нагреться до комнатной температуры и перемешивали в течение еще 2 ч. Смесь упаривали при пониженном давлении. Остаток растворяли в ТГФ (60 мл) и охлаждали до 0 С. К полученной смеси добавляли 2,00 н. TMS-диазометан (18,6 мл, 37,3 ммоль), смесь перемешивали при 0 С в течение 5 ч. Раствор упаривали при пониженном давлении, полученный остаток обрабатывали бензиловым спиртом (15 мл) и 2,4,6-коллидином (10 мл) и нагревали до 180 С в течение 15 мин. После охлаждения до комнатной температуры и разбавления этилацетатом (100 мл) полученный раствор промывали последовательно водой (2100 мл), 5% лимонной кислотой (100 мл, до достижения кислотного рН водной фазы), водой (100 мл) и солевым раствором (100 мл). Растворитель удаляли при пониженном давлении и полученное масло сушили на линии высокого вакуума при 65 С до удаления большей части избытка бензилового спирта. Масло очищали путем хроматографии (колонка Biotage Si-40, 10-40% этилацетат/гексан 1398 мл), в результате получали бензил 2-(2-метил-5-нитрофенил)ацетат в форме масла(2,465 г, 52% выход), которое использовали без дополнительной обработки. В раствор ТГФ:этанол (1:1, 100 мл) помещали сырой бензил 2-(2-метил-5-нитрофенил)ацетат (2,46 г, 8,62 ммоль) и аммония хлорид (4,61 г, 86,2 ммоль). К этой смеси добавляли цинковую пыль (5,64 г,- 19016055 86,2 ммоль) и полученную суспензию перемешивали при комнатной температуре в течение 4 ч. Суспензию фильтровали через Celite и промывали этанолом (250 мл). Объединенные фильтраты упаривали при пониженном давлении, в результате получали масляную массу. Массу растворяли в смеси этилацетата(75 мл) и солевого раствора (75 мл). Органическую фазу сушили (Na2SO4) и упаривали при пониженном давлении, в результате получали бензил 2-(5-амино-2-метилфенил)ацетат в форме масла, которое оказалось смесью 6:4 продукта:соединения и неидентифицированного соединения. Использовали без дополнительной обработки. В диметилацетамид (35 мл) помещали соединение из примера С 1 (1,31 г, 7,13 ммоль) и неочищенный бензил 2-(5-амино-2-метилфенил)ацетат (2,00 г, 5,09 ммоль). К полученной смеси добавлялиKF/глинозем (11,1 г, 76,4 ммоль) и смесь обрабатывали ультразвуком при комнатной температуре в течение 1,5 ч. Реакционную смесь разбавляли CH2Cl2 (100 мл) и отфильтровывали нерастворимые вещества. Фильтрат промывали водой (100 мл) и солевым раствором (100 мл), сушили (Na2SO4) и концентрировали в вакууме до удаления диметилацетамида, в результате получали масло. Масло обрабатывали этилацетатом (30 мл), осадок образовывался в течение ночи. Твердое вещество собирали фильтрованием,промывали этилацетатом (210 мл) и затем сушили в вакууме. Выделенное твердое вещество нагревали до температуры дефлегмирования в метаноле (15 мл), фильтровали и сушили на линии высокого вакуума, в результате получали 6-(5-амино-2-метилфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин 7(8 Н)-он (879 мг, 55% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):1,93 (с, 3 Н), 2,48 (с, 3 Н), 2,60 (с, 3 Н), 4,89(ушир.с, 1 Н), 6,39 (с, 1 Н), 6,48-6,50 (м, 1 Н), 6,86-6,88 (м, 1 Н), 7,79 (с, 1 Н), 8,87 (с, 2 Н); МС (ESI) m/z: 313,0 (М+Н+). Пример А 45. Следуя процедуре примера А 60, соединение из примера С 2 (0,42 г, 2,1 ммоль), этил 2-(3 аминофенил)ацетат (0,38 г, 2,1 ммоль) и K2CO3 (0,44 г, 3,2 ммоль) объединяли с получением 6-(3 аминофенил)-8-этил-2-(метилтио)пиридо[2,3-d] пиримидин-7(8 Н)-она (0,44 г, 66% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,93 (с, 1 Н), 7,99 (с, 1 Н), 7,08 (т, J=8,0 Гц, 1 Н), 6,91 (т, J=2,0 Гц, 1 Н), 6,78 (дт, J=7,6,1,2 Гц, 1 Н), 6,60 (м, 1 Н), 5,14 (с, 2 Н), 4,04 (кв, J=7,2 Гц, 2 Н), 2,62 (с, 3 Н), 1,26 (т, J=3H); МС (ESI) m/z: 313,2 [М+Н]+. Пример А 46. К перемешиваемой дымящейся HNO3 (15 мл) при -15 С порциями добавляли 2-бром-4 фторфенилуксусную кислоту (10 г, 43 ммоль) таким образом, чтобы внутренняя температура оставалась ниже -10 С. После завершения добавления реакционную смесь перемешивали при нагревании до +5 С в течение 15 мин. Смесь выливали на лед (500 г). Отделяли продукт в форме слегка липкого твердого вещества, которое после обработки шпателем становилось порошкообразным. Суспензию тщательно перемешивали до полного расплавления льда, пока смесь оставалась очень холодной, твердые вещества собирали фильтрованием, тщательно промывали H2O (1 л). Твердое вещество сушили в вакууме, в результате получали 2-(2-бром-4-фтор-5-нитрофенил)уксусную кислоту (6,04 г, 51% выход) в форме бледножелтого твердого вещества, которое использовали без дополнительной обработки в следующей реакции. 2-(2-Бром-4-фтор-5-нитрофенил)уксусную кислоту (6,04 г, 21,7 ммоль) и концентрированнуюH2SO4 (1,2 мл) объединяли в EtOH (100 мл) и перемешивали при нагревании при 85 С. Через 1,5 ч, после завершения реакции реакционную смесь охлаждали до комнатной температуры и концентрировали максимально полно. Остаток растворяли в МТВЕ (50 мл) и промывали H2O (2) и солевым раствором (2),сушили (MgSO4), фильтровали и упаривали, в результате получали темно-оранжевое масло. Сырой продукт очищали путем колоночной хроматографии на силикагеле с получением этил 2-(2-бром-4-фтор-5 нитрофенил)ацетата (5,8 г, 87% выход). Этил 2-(2-бром-4-фтор-5-нитрофенил)ацетат (1,00 г, 3,27 ммоль), PdCl2(PPh3)2 (115 мг, 0,16 ммоль),CuI (44 мг, 0,23 ммоль) и триметилсилиацетилен (0,7 мл, 4,9 ммоль) растворяли в Et3N (5 мл). Смесь сразу дегазировали в вакууме и в колбу помещали N2. Смесь нагревали в течение ночи при 50 С. Добавляли воду и затем раствор экстрагировали EtOAc (3). Органическую фазу промывали NH4Cl, солевым раствором и сушили (MgSO4). Удаляли растворители, остаток очищали путем колоночной хроматографии на силикагеле с получением этил 2-(4-фтор-5-нитро-2-(2-(триметилсилил)этинил)фенил)ацетата (0,66 г,62% выход). К перемешиваемой суспензии этил 2-(4-фтор-5-нитро-2-(2-(триметилсилил)этинил)фенил)ацетат(0,66 г, 2,04 ммоль) в МеОН/ТГФ (1:1, 20 мл) добавляли NH4Cl (1,09 г, 20,4 ммоль), а затем Zn пыли (1,33 г, 20,4 ммоль). После перемешивания в течение 1,5 ч смесь фильтровали через Celite и промывали МеОН. Объединенные фильтраты концентрировали, разбавляли солевым раствором и экстрагировали ТГФ(2). Объединенные органические фазы промывали солевым раствором (1), сушили (MgSO4), фильтровали и концентрировали,в результате получали этил 2-(5-амино-4-фтор-2-(2(триметилсилил)этинил)фенил)ацетат (0,54 г, 90% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):6,86 (д, J=12,0 Гц, 1 Н), 6,47 (д, J=8,8 Гц, 1 Н), 5,47 (ушир.с, 2 Н), 3,88 (д, J=6,8 Гц, 2 Н), 3,43 (с, 2 Н), 1,00 (д, J=6,8 Гц, 3 Н),0,00 (с, 9 Н); МС (ESI) m/z: 294,0 (М+Н+). К раствору этил 2-(5-амино-4-фтор-2-(2-(триметилсилил)этинил)фенил)ацетата (0,30 г, 1,02 ммоль)- 20016055 и соединение из примера С 1 (0,19 г, 1,02 ммоль) в 4 мл ДМФ добавляли карбонат цезия (0,87 г, 2,66 ммоль), затем реакционную смесь перемешивали в течение ночи при комнатной температуре. Смесь разбавляли водой (50 мл), перемешивали, фильтровали и промывали водой, в результате получали сырой продукт. Сырой продукт фильтровали и сушили в вакууме, в результате получали 6-(5-амино-2-этинил-4 фторфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (300 мг, 71% выход), который использовали в следующей реакции. 1 Н ЯМР (400 МГц, ДМСО-d6):8,87 (с, 1 Н), 7,90 (с, 1 Н), 7,15 (д,J=12,0 Гц, 1 Н), 6,69 (д, J=9,2 Гц, 1 Н), 5,65 (с, 2 Н), 3,77 (с, 1 Н), 3,60 (с, 3 Н), 2,57 (с, 3 Н); МС (ESI) m/z: 341,0 (М+Н+). Следуя процедуре, аналогичной примеру А 1, 6-(5-амино-2-этинил-4-фторфенил)-8-метил-2(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (0,250 г, 0,734 ммоль), м-ХПБК (0,217 г, 0,881 ммоль) и 2 М метиламин (1,5 мл, 2,95 ммоль) объединяли, в результате чего получали 6-(5-амино-2-этинил-4 фторфенил)-8-метил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-он (140 мг, 59% выход). 1 Н ЯМР(400 МГц, ДМСО-d6):8,59 (с, 1 Н), 7,82 (м, 1 Н), 7,73 (с, 1 Н), 7,15 (д, J=12,0 Гц, 1 Н), 6,71 (д, J=9,2 Гц,1 Н), 5,61 (с, 2 Н), 3,78 (с, 1 Н), 3,58 (с, 3 Н), 2,90 (д, J=4,4 Гц, 1 Н); МС (ESI) m/z: 324,2 (М+Н+). Пример А 47. Этил 2-(4-фтор-5-нитро-2-(2-(триметилсилил)этинил)фенил)ацетат (0,85 г, 2,6 ммоль) и K2CO3 (3,6 г) растворяли в ТГФ/МеОН (5:1, 30 мл) и перемешивали смесь в течение ночи при комнатной температуре. Реакционную смесь разбавляли Et2O и промывали насыщенным раствором NH4Cl. Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле с получением этил 2-(2-этинил-4-фтор-5-нитрофенил)уксусной кислоты. Этил 2-(2-этинил-4-фтор-5-нитрофенил)уксусную кислоту и концентрированную H2SO4 объединяли в EtOH (5 мл) и перемешивали при нагревании при 85 С. Через 4 ч, после завершения реакции реакционную смесь охлаждали до комнатной температуры и концентрировали насколько возможно полно. Остаток растворяли в МТВЕ (50 мл) и промывали H2O (2) и солевым раствором (2), сушили (MgSO4),фильтровали и упаривали, в результате получали желаемый продукт в форме темно-оранжевого масла. Сырой продукт очищали путем колоночной хроматографии на силикагеле с получением этил 2-(2 этинил-4-фтор-5-нитрофенил)ацетата (160 мг, 21% выход). МС (ESI) m/z: 252,0 (М+Н+). Этил 2-(2-этинил-4-фтор-5-нитрофенил)ацетат (160 мг, 0,64 ммоль) растворяли в МеОН (5 мл) иEtOAc (5 мл), а затем добавляли Pd-C (20 мг). Реакционную смесь встряхивали в гидрогенаторе Парра(46 фунт/кв.дюйм) в течение ночи при комнатной температуре. Реакционную смесь фильтровали, промывали метанолом и концентрировали, в результате чего получали этил 2-(5-амино-2-этил-4 фторфенил)ацетат (135 мг, 93% выход). МС (ESI) m/z: 226,2 (М+Н+). К раствору этил 2-(5-амино-2-этил-4-фторфенил)ацетата (135 мг, 0,6 ммоль) и соединение из примера С 1 (110 мг, 0,6 ммоль) в ДМФ (2 мл) добавляли карбонат цезия (500 мг, 1,5 ммоль) и перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (50 мл) перемешивали, фильтровали и промывали, в результате получали сырой продукт. Неочищенный продукт перемешивали в EtOH в течение ночи при комнатной температуре. Твердое вещество фильтровали, промывали и сушили, в результате получали 6-(5-амино-2-этил-4-фторфенил)-8-метил-2-(метилтио)пиридо[2,3d]пиримидин-7(8 Н)-он (100 мг, 48% выход). 1 Н ЯМР (400 МГц, ДМСО-d6, основные изомеры):8,87 (с,1 Н), 7,81 (с, 1 Н), 6,91 (д, J=12,8 Гц, 1 Н), 6,54 (д, J=9,2 Гц, 1 Н), 4,98 (с, 2 Н), 3,63 (с, 3 Н), 2,60 (с, 3 Н), 2,26(кв, J=7,2 Гц, 2 Н), 0,97 (т, J=7,2 Гц, 3 Н). МС (ESI) m/z: 345,0 (М+Н+). Пример А 48. Этил 2-(2-бром-4-фтор-5-нитрофенил)ацетат (1,0 г, 3,27 ммоль) и цианид цинка (0,77 г, 6,54 ммоль) объединяли в ДМФ (8 мл), дегазировали в вакууме и заполняли (4). Добавляли палладий тетракис(трифенилфосфин) (380 мг, 0,32 ммоль) и нагревали реакционную смесь при 160 С под действием микроволн в течение 30 мин. Раствор разбавляли EtOAc, затем твердое вещество фильтровали. Фильтрат промывали солевым раствором (3) и сушили (Na2SO4), концентрировали в вакууме и остаток очищали путем колоночной хроматографии на силикагеле с получением этил 2-(2-циано-4-фтор-5 нитрофенил)ацетата (0,3 г, 37% выход). К раствору этил 2-(2-циано-4-фтор-5-нитрофенил)ацетата в метаноле и EtOAc (1:1, 10 мл) добавляли 10% Pd/C. Раствор перемешивали в атмосфере Н 2 (1 атм) при комнатной температуре в течение 3 дней. Раствор фильтровали и упаривали, в результате чего получали этил 2-(5-амино-2-циано-4 фторфенил)ацетат (0,21 г, 81% выход). К раствору этил 2-(5-амино-2-циано-4-фторфенил)ацетата (0,21 г, 0,95 ммоль) и соединению из примера С 1 (0,17 г, 0,95 ммоль) в 4 мл ДМФ добавляли карбонат цезия (0,80 г, 2,46 ммоль), затем реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (50 мл), перемешивали, фильтровали и промывали водой, в результате получали сырой продукт. Сырой продукт фильтровали и сушили в вакууме, в результате получали 4-амино-5-фтор-2-(8 метил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)бензонитрил (125 мг, 39% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,94 (с, 1 Н), 8,07 (с, 1 Н), 7,61 (д, J=11,6 Гц, 1 Н), 6,82 (д, J=8,8 Гц, 1 Н),6,35 (с, 2 Н), 3,65 (с, 3 Н), 2,62 (с, 3 Н); МС (ESI) m/z: 342,0 (М+Н+).- 21016055 Пример А 49. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 59 (0,18 г, 0,52 ммоль), мХПБК (0,1 г, 0,57 ммоль) и 2 М метиламин в ТГФ (1 мл) смешивали с получением 6-(3-амино-4 фторфенил)-8-изопропил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-она в форме светло-желтого твердого вещества (105 мг, 61% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,57 (с, 1 Н), 7,72 (с, 1 Н), 7,06(ушир.с, 2 Н), 2,88 (д, J=4,8 Гц, 3 Н), 1,57-1,51 (м, 6 Н); МС (ESI) m/z: 328,3 (М+Н+). Пример А 50. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 41 (0,6 г, 1,7 ммоль) и 2 М метиламин в ТГФ (3 экв.) смешивали с получением 6-(5-амино-4-фтор-2-метилфенил)-8-этил-2(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-она в форме белого твердого вещества (0,31, 54% выход). 1 Н ЯМР (400 МГц, ацетон-d6):8,53 (с, 1 Н), 7,55 (с, 1 Н), 6,85-6,82 (м, 2 Н), 6,70 (д, J=9,6 Гц, 1 Н), 4,464,43 (м, 2 Н), 3,05 (д, J=4,8 Гц, 3 Н), 1,31-1,27 (м, 3 Н); МС (ESI) m/z: 328,0 (М+Н+). Пример А 51. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 42 (0,5, 1,4 ммоль), м-ХПБК(0,78 г, 2 ммоль; J. Med. Chem., 48, 2371, 2005) в ДМЭ (10 мл) добавляли Pd(PPh3)4 (0,1 г, 5% моль), 4 фтор-3-нитрофенилбороновую кислоту (0,5 г, 3 ммоль) и 2 М раствор Na2CO3 (3 мл, 6 ммоль) и смесь нагревали до 80 С в течение 16 ч. Смесь вливали в воду (40 мл), продукт экстрагировали EtOAc (325 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме, в результате получали сырой продукт. Очистка путем хроматографии на силикагеле давала 6-(4-фтор-3-нитрофенил)-8-изопропил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он в форме грязно-белого твердого вещества (0,82 г, 88% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,94 (с, 1 Н), 8,52(дд, J=7,2 Гц, 2,4 Гц, 1 Н), 8,28 (с, 1 Н), 8,15-8,12 (м, 1 Н), 7,70 (дд, J=11,6 Гц, 8,8 Гц, 1 Н), 5,81-5,78 (м, 1 Н),2,63 (с, 3 Н), 1,60 (д, J=6,8 Гц, 6 Н); МС (ESI) m/z: 375,0 (М+Н+). Следуя процедуре, аналогичной примеру А 1, 6-(4-фтор-3-нитрофенил)-8-изопропил-2(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (0,82 г, 2,2 ммоль), м-ХПБК (0,38 г, 2,2 ммоль) и 0,5 М аммиак в диоксане (8 мл) смешивали с получением 2-амино-6-(4-фтор-3-нитрофенил)-8 изопропилпиридо[2,3-d]пиримидин-7(8 Н)-она в форме желтого твердого вещества (0,52 г, 69% выход). 1 Н ЯМР (400 МГц, MeOH-d4):8,61 (с, 1 Н), 8,44 (дд, J=7,6 Гц, 2,4 Гц, 1 Н), 8,03-8,00 (м, 1 Н), 7,95 (с, 1 Н),7,48 (дд, J=10,8 Гц, 7,6 Гц, 1 Н), 5,96-5,92 (м, 1 Н), 2,63 (с, 3 Н), 1,64 (д, J=6,4 Гц, 6 Н); МС (ESI) m/z: 344,3(М+Н+). К раствору 2-амино-6-(4-фтор-3-нитрофенил)-8-изопропилпиридо[2,3-d]пиримидин-7(8 Н)-она (0,52 г, 1,5 ммоль) в EtOAc и метанола (5:1, 30 мл) добавляли палладий на угле (50 мг, 10 моль %) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 16 ч. Смесь фильтровали на слой Celite и слой промывали EtOAc (210 мл). Объединенный фильтрат концентрировали в вакууме, в результате получали сырой продукт. Очистка путем хроматографии на силикагеле давала 2-амино-6-(3 амино-4-фторфенил)-8-изопропилпиридо[2,3-d]пиримидин-7(8 Н)-он в форме грязно-белого твердого вещества (0,34 г, 72% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,60 (с, 1 Н), 7,73 (с, 1 Н), 7,22 (с, 2 Н), 7,08(дд, J=9,2 Гц, 1,2 Гц, 1 Н), 6,99 (дд, J=10,8 Гц, 8,4 Гц, 1 Н), 6,74-6,70 (м, 1 Н), 5,78-5,76 (м, 1 Н), 5,13 (с, 2 Н),1,53 (д, J=6,8 Гц, 6 Н); МС (ESI) m/z: 314,0 (М+Н+). Пример А 53. Следуя процедуре, аналогичной примеру А 7, N,N-диметилпропан-1,3-диамин (3,27 г, 32 ммоль) и соединение из примера A11 (100 мг, 0,32 ммоль) объединяли с получением 3-(5-амино-4-фтор-2 метилфенил)-7-(3-(диметиламино)пропиламино)-1-метил-1,6-нафтиридин-2(1 Н)-она (93 мг, 77% выход). МС (ESI) m/z: 384,2 (М+Н+). Пример А 54. Раствор соединения из примера A11 (0,200 г, 0,629 ммоль), KOAc (0,093 г, 0,944 ммоль) и 10% Pd/C(0,33 г, 0,031 ммоль) в ТГФ/МеОН (2:1, 15 мл) перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Смесь фильтровали на Celite и промывали МеОН. Объединенные фильтраты концентрировали, разбавляли насыщенным раствором NaHCO3 и экстрагировали EtOAc (2). Объединенные органические фазы промывали солевым раствором (1), сушили (MgSO4), фильтровали и концентрировали, в результате получали 3-(5-амино-4-фтор-2-метилфенил)-1-метил-1,6-нафтиридин-2(1 Н)он (0,161 г, 90%) в форме желтого твердого вещества. МС (ESI) m/z: 284,0 (М+Н+).(20 мл) перемешивали при комнатной температуре в течение 30 мин. Соединение из примера С 3 (2,5 г,14,7 ммоль) добавляли к указанной смеси и полученную смесь перемешивали при 80 С в течение 10 ч. ДМФ удаляли при пониженном давлении и неочищенный остаток суспендировали в H2O и экстрагировали EtOAc (320 мл). Органические фазы промывали солевым раствором, сушили (MgSO4) и концентрировали, в результате получали 3-(3-амино-4-фторфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-он (4 г, 90% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,75 (с, 1 Н), 8,07 (с, 1 Н), 7,61 (с, 1 Н), 7,13-7,00 (м, 2 Н),6,80 (м, 1 Н), 5,21 (с, 2 Н), 3,61 (с, 3 Н). МС (ESI) m/z: 304,2 (М+Н+). Пример А 56. Следуя процедуре, аналогичной примеру А 7, N,N-диметилэтан-1,2-диамин (6,0 мл, 55 ммоль) и соединение из примера А 55 (150 мг, 0,49 ммоль) смешивали с получением 3-(3-амино-4-фторфенил)-7-(2(диметиламино)этиламино)-1-метил-1,6-нафтиридин-2(1 Н)-он (151 мг, 86% выход) в форме желтого твердого вещества. МС (ESI) m/z: 356,3 (М+Н+). Пример А 57. Смесь соединения из примера А 60 (1,1 г, 3,7 ммоль) и 25% раствора CH3NH2/EtOH (10 мл) нагревали при 160 С в стальной бомбе в течение 2 ч. Охлажденную реакционную смесь фильтровали, твердое вещество перекристаллизовывали (EtOH), в результате получали 6-(3-аминофенил)-8-метил-2 метиламино-8 Н-пиридо[2,3-d]пиримидин-7-он (610 мг, 59% выход). 1 Н ЯМР (300 МГц, ДМСО-d6): 8,69 и 8,61 (с, 1 Н), 7,78 (м, 2 Н), 7,01 (т, J=7,8 Гц, 1 Н), 6,85 (ушир.с, 1 Н), 6,73 (д, J=7,8 Гц, 1 Н), 6,51 (д, J=7,8 Гц,1 Н), 5,05 (ушир.с, 2 Н), 3,56 и 3,52 (с, 3 Н), 2,88 (м, 3 Н). МС (ESI) m/z: 282,2. (М+Н+). Пример А 58.KF/Al2O3 (40 вес.%, 10 г, 69 ммоль) добавляли к раствору соединения из примера С 7 (6 г, 30 ммоль) и этил (3-амино-4-фторфенил)ацетата (6 г, 30 ммоль) в диметилацетамиде (80 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь фильтровали и фильтрат концентрировали в вакууме. Остаток вливали в воду, осадок собирали фильтрованием, промывали этиловым эфиром,и сушили в вакууме, в результате получали 3-(3-амино-4-фторфенил)-7-хлор-1-изопропил-1,6 нафтиридин-2(1 Н)-он (7 г, 70% выход). 1 Н ЯМР (400 Гц, ДМСО-d6):8,71 (с, 1 Н), 8,00 (с, 1 Н), 7,76 (с,1 Н), 7,11 (дд, J=9,2, 2,4 Гц, 1 Н), 7,05 (дд, J=11,6, 8,4 Гц, 1 Н), 6,76 (м, 1 Н), 5,18 (с, 2 Н), 5,15 (м, 1 Н), 1,52(4-метоксибензил)метиламина (15 мл) дегазировали при пониженном давлении и нагревали до 180 С в атмосфере N2 в течение 4 ч. После охлаждения реакционную смесь разбавляли Et2O. Осадок фильтровали, промывали эфиром и сушили в вакууме, в результате получали 3-(3-амино-4-фторфенил)-1 изопропил-7-[(4-метоксибензил)метиламино]-1 Н-[1,6]нафтиридин-2-он (5,3 г) в форме твердого вещества, содержащего примесь - соль (4-метоксибензил)метиламина с HCl. Полученный,как описано выше,3-(3-амино-4-фторфенил)-1-изопропил-7-[(4-метоксибензил)метиламино]-1 Н-[1,6]нафтиридин-2-он (5,3 г) объединяли в ДХМ (150 мл) с ТФА (50 мл). Полученную смесь нагревали с обратным холодильником в течение ночи. Летучие вещества удаляли при пониженном давлении, остаток растворяли в 10% водном растворе HCl. Водную фазу промывали EtOAc(3100 мл), затем водную фазу подщелачивали рН 11 и экстрагировали EtOAc. Объединенные экстракты сушили (Na2SO4) и концентрировали, в результате получали 3-(3-амино-4-фторфенил)-1-изопропил-7 метиламино-1 Н-[1,6]нафтиридин-2-он (1,26 г, 32% выход для двух стадий). 1 Н ЯМР (400 МГц, ДМСОd6):8,36 (с, 1 Н), 7,70 (с, 1 Н), 7,06 (дд, J=8,4, 2,0 Гц, 1 Н), 6,94 (дд, J=11,6, 8,4 Гц, 1 Н), 6,88 (м, 1 Н), 6,72(м, 1 Н), 6,39 (с, 1 Н), 5,07 (м, 1 Н), 5,06 (с, 2 Н), 2,83 (д, J=4,8 Гц, 1 Н), 1,51 (д, J=6,8 Гц, 6 Н); МС (ESI) m/z: 327,1 [М+Н]+. Пример А 59. Способ 1. К раствору соединения из примера А 15 (0,5 г, 1,7 ммоль) в ДМФ (5 мл) добавляли NaH (0,048 г, 2,0 ммоль) при комнатной температуре. После перемешивания в течение 30 мин добавляли 2-иодопропан(0,56 г, 3,3 ммоль) и перемешивали смесь в течение 3 ч при комнатной температуре. Добавляли насыщенный раствор NH4Cl и экстрагировали продукт этилацетатом (235 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме, в результате получали сырой остаток. Очистка путем хроматографии на силикагеле давала 6-(3-амино-4-фторфенил)-8 изопропил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он в форме светло-оранжевого твердого вещества (0,18 г, 32% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,88 (с, 1 Н), 7,93 (с, 1 Н), 7,10 (дд, J=8,8 Гц, 2,0 Гц, 1 Н), 7,02 (дд, J=11,2 Гц, 8,4 Гц, 1 Н), 6,77-6,73 (м, 1 Н), 5,78-5,74 (м, 1 Н), 5,19 (ушир.с, 2 Н), 2,60 (с,3 Н), 1,56 (д, J=7,2 Гц, 6 Н); МС (ESI) m/z: 345,2 (М+Н+). Способ 2. Соединение из примера С 6 (3,0 г, 14,2 ммоль), этил 2-(3-амино-4-фторфенил)ацетат (2,8 г, 14,2 ммоль) и KF/Al2O3 (40 вес.%, 9 г, 62 ммоль) объединяли в диметилацетамиде (30 мл) и перемешивали- 23016055 при комнатной температуре в течение 12 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении, промывали этиловым эфиром и сушили в вакууме, в результате получали 6-(3-амино-4-фторфенил)-8-изопропил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (2,1 г, 42,9% выход). Пример А 60. Хлортриметилсилан (13,3 г, 122 ммоль) добавляли к раствору 2-(3-нитрофенил)ацетонитрила (10 г,61,2 ммоль) в EtOH (100 мл), смесь нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Добавляли воду и смесь нейтрализовали до рН 7 насыщенным водным раствором Na2CO3 и экстрагировали EtOAc (370 мл). Объединенные органические фазы промывали солевым раствором, сушили (MgSO4) и концентрировали, в результате получали этил 2(3-нитрофенил)ацетат (12 г, 94% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,15 (с, 1 Н), 8,10 (д, J=8,4 Гц,1 Н), 7,71 (д, J=7,6 Гц, 1 Н), 7,61 (т, J=8,0 Гц, 1 Н), 4,06 (кв, J=7,2 Гц, 2 Н), 3,85 (с, 2 Н), 1,15 (т, J=7,2 Гц, 3 Н). Смесь этил 2-(3-нитрофенил)ацетата (12 г, 57,4 ммоль) и Pd/C (1,2 г, 10%) в метаноле (100 мл) гидрогенировали (45 фунт/кв.дюйм) при комнатной температуре в течение 12 ч. Смесь фильтровали и фильтрат концентрировали, в результате получали этил 2-(3-аминофенил)ацетат (10 г, 97% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):6,91 (т, J=7,6 Гц, 1 Н), 6,42-6,40 (м, 2 Н), 6,35 (д, J=7,6 Гц, 1 Н), 5,00 (с, 2 Н),4,03 (кв, J=7,2 Гц, 2 Н), 3,41 (с, 2 Н), 1,15 (т, J=7,2 Гц, 3 Н). Соединение из примера С 1 (5,1 г, 27,9 ммоль), этил 2-(3-аминофенил)ацетат (5,0 г, 29,3 ммоль) иK2CO3 (7,7 г, 55,8 ммоль) объединяли в ДМФ (60 мл) и полученную смесь перемешивали при 100 С в течение 10 ч. Реакционную смесь концентрировали при пониженном давлении, разбавляли водой (100 мл) и водную фазу экстрагировали EtOAc (370 мл). Объединенные органические фазы промывали солевым раствором, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали путем колоночной хроматографии на силикагеле, в результате получали 6-(3-аминофенил)-8-метил-2-(метилтио)пиридо[2,3d]пиримидин-7(8 Н)-он (5,2 г, 62,7% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,89 (с, 1 Н), 7,97 (с, 1 Н),7,05 (т, J=8,0 Гц, 1 Н), 6,87 (с, 1 Н), 7,76 (д, J=7,6 Гц, 1 Н), 6,57 (д, J=8,4 Гц, 1 Н), 5,11 (с, 2 Н), 3,64 (с, 3 Н),2,59 (с, 3 Н); МС (ESI) m/z: 299,2 [М+Н]+. Пример А 61. Соединение из примера С 3 (3,2 г, 18,8 ммоль), соединение из примера D6 (4,0 г, 18,8 ммоль) иCs2CO3 (12,3 г, 37,6 ммоль) объединяли в ДМФ (80 мл) и нагревали до 80 С при перемешивании в течение 4 ч. Реакционную смесь выливали в воду (600 мл), осадок собирали фильтрованием и сушили при пониженном давлении, в результате получали 3-(5-амино-2-хлорфенил)-7-хлор-1-метил-1,6-нафтиридин 2(1 Н)-он (5,0 г, 83% выход). 1 Н-ЯМР (400 МГц, ДМСО-d6):8,74 (с, 1 Н), 7,97 (с, 1 Н), 7,63 (с, 1 Н), 7,09(д, J=8,4 Гц, 1 Н), 6,57 (дд, J=8,4 Гц, 2,8 Гц, 1 Н), 6,52 (с, 1 Н), 5,31 (с, 2 Н), 3,60 (с, 3 Н). Смесь 3-(5-амино-2-хлорфенил)-7-хлор-1-метил-1,6-нафтиридин-2(1 Н)-она (5 г, 15,67 ммоль), 4 метоксибензилметиламина (3,6 г, 23,5 ммоль) и DBU (3,7 г, 23,5 ммоль) в NMP (80 мл) нагревали при 180 С в атмосфере N2 в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и вливали в воду (600 мл). Осадок собирали фильтрованием и сушили в вакууме, в результате получали 7-4 метоксибензил)(метил)амино)-3-(5-амино-2-хлорфенил)-1-метил-1,6-нафтиридин-2(1 Н)-он (6,5 г, 95% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,46 (с, 1 Н), 7,68 (с, 1 Н), 7,16 (д, J=8,8 Гц, 2 Н), 7,06 (д, J=8,4 Гц,1 Н), 6,85 (д, J=8,8 Гц, 2 Н), 6,54-6,51 (м, 2 Н), 6,29 (с, 1 Н), 5,23 (с, 2 Н), 4,85 (с, 2 Н), 3,69 (с, 3 Н), 3,51 (с,3 Н), 3,07 (с, 3 Н). Трифторуксусную кислоту (10 мл, 134 ммоль) добавляли к раствору 7-4 метоксибензил)(метил)амино)-3-(5-амино-2-хлорфенил)-1-метил-1,6-нафтиридин-2(1 Н)-она (4 г, 9,2 ммоль) в CH2Cl2 (50 мл). Смесь нагревали с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении, растворяли в водном растворе HCl и промывали EtOAc(350 мл). Водную фазу нейтрализовали насыщенным раствором Na2CO3 до рН 8 и экстрагировалиEtOAc (350 мл). Объединенные экстракты промывали солевым раствором, сушили на Na2SO4 и концентрировали при пониженном давлении. Остаток очищали путем хроматографии, в результате получали 3(5-амино-2-хлорфенил)-1-метил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-он (1,7 г, 58% выход). 1 Н ЯМР(400 МГц, ДМСО-d6):8,36 (с, 1 Н), 7,63 (с, 1 Н), 7,06-7,00 (м, 2 Н), 6,54-6,50 (м, 2 Н), 6,14 (с, 1 Н), 5,21 (с,2 Н), 3,48 (с, 3 Н), 2,84 (д, J=4,8 Гц, 3 Н); МС (ESI) m/z: 314,9 [М+Н]+. Пример А 62. Следуя трехстадийной процедуре примера 61, соединение из примера С 5 (3,5 г, 18,8 ммоль), соединение из примера D6 (4,0 г, 18,8 ммоль), Cs2CO3 (12,3 г, 37,6 ммоль), 4-метоксибензилметиламин (3,6 г,23,5 ммоль) и трифторуксусную кислоту (10 мл, 134 ммоль) объединяли с получением 3-(5-амино-2 хлорфенил)-1-этил-7-(метиламино)-1,6-нафтиридин-2(1 Н)-она (1,68 г, 27% выход после 3 стадий). 1H ЯМР (400 МГц, ДМСО-d6):8,36 (с, 1 Н), 7,62 (с, 1 Н), 7,05 (дд, J=7,2, 2,0 Гц, 1 Н), 6,96 (кв, J=4,8 Гц, 1 Н),6,54-6,50 (м, 2 Н), 6,21 (с, 1 Н), 5,21 (с, 2 Н), 4,11 (кв, J=7,2 Гц, 2 Н), 2,84 (д, J=4,8 Гц, 3 Н), 1,18 (т, J=7,2 Гц,3 Н); МС (ESI) m/z: 329,2[М+Н]+. Пример А 63. Следуя процедуре, аналогичной примеру А 1, соединение из примера А 18 (1,01 г, 2,77 ммоль) и 2 М- 24016055 метиламин в ТГФ (6 мл) объединяли, очищали путем хроматографии на силикагеле, в результате получали 6-(5-амино-2-хлор-4-фторфенил)-8-этил-2-(метиламино)пиридо[2,3-d]пиримидин-7(8 Н)-он в форме оранжевого твердого вещества (0,55 г, 57% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):8,59 (с, 1 Н), 7,847,81 (м, 1 Н), 7,67 (с, 1 Н), 6,20 (д, J=11,2 Гц, 1 Н), 6,72 (д, J=9,6 Гц, 1 Н), 5,33 (с, 2 Н), 4,35-4,30 (м, 2 Н), 2,89(д, J=6,0 Гц, 3 Н), 1,21 (т, J=6,8 Гц, 3 Н); МС (ESI) m/z: 348,0 (М+Н+). Пример А 64. Соединение из примера D6 (1,0 г, 4,68 ммоль), соединение из примера С 1 (0,858 г, 4,68 ммоль) иCs2CO3 (3,96 г, 12,2 ммоль) объединяли в ДМФ (18 мл), следуя процедуре примера А 10, способ 3, в результате получали 6-(5-амино-2-хлорфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он(М+Н+). 6-(5-Амино-2-хлорфенил)-8-метил-2-(метилтио)пиридо[2,3-d]пиримидин-7(8 Н)-он (0,500 г, 1,5 ммоль), м-ХПБК (0,481 г, 1,953 ммоль) и метиламин (0,76 мл, 2,0 М в ТГФ, 1,52 ммоль) объединяли по аналогии с примером А 1, в результате получали 6-(5-амино-2-хлорфенил)-8-метил-2(метиламино)пиридо[2,3-d] пиримидин-7(8 Н)-он (0,378 г, 80% выход). МС (ESI) m/z: 316,0 (М+Н+). Пример А 65. Соединение примера С 5 (1,8 г, 10 ммоль), этил 2-(5-амино-2-метилфенил)ацетат (1,9 г, 10 ммоль), иKF/Al2O3 (40%, 5,4 г, 37 ммоль) объединяли в диметилацетамиде (40 мл), следуя процедуре примера A11,в результате получали 3-(5-амино-2-метилфенил)-7-хлор-1-этил-1,6-нафтиридин-2(1 Н)-он (1,9 г, 61% выход). 1H ЯМР (400 МГц, ДМСО-d6):8,73 (с, 1 Н), 7,88 (с, 1 Н), 7,68 (с, 1 Н), 6,87 (д, J=8,4 Гц, 1 Н), 6,49[М+Н]+. Пример В 1. Фенилгидразин и 4,4-диметил-3-оксопентаннитрил объединяли согласно описанным в литературе процедурам, в результате получали 3-трет-бутил-1-фенил-1 Н-пиразол-5-амин, см. WO 2006/071940. Пример В 2. Метилгидразин и 4,4-диметил-3-оксопентаннитрил объединяли согласно описанным в литературе процедурам, в результате получали 3-трет-бутил-1-метил-1 Н-пиразол-5-амин, см. WO 2006/071940. Пример В 3. 3-(2-Амино-2-оксоэтил)фенилгидразин и 4,4-диметил-3-оксопентаннитрил объединяли согласно описанным в литературе процедурам, в результате получали 2-(3-(5-амино-3-трет-бутил-1 Н-пиразол-1 ил)фенил)ацетамид, см. WO 2006/071940. Пример В 4. Смесь 5-нитро-1 Н-индазола (25 г, 0,153 ммоль) и 10% Pd/C (2,0 г) в МеОН перемешивали в атмосфере Н 2 (1 атм) в течение ночи. После фильтрации фильтрат концентрировали, в результате получали 1 Н-индазол-5-иламин (20 г, 97% выход) в форме желтого твердого вещества. 1 Н ЯМР (300 МГц, ДМСОd6):12,50 (ушир.с, 1 Н), 7,70 (с, 1 Н), 7,21 (д, J=8,7 Гц, 1 Н), 6,77 (д, J=8,7 Гц, 1 Н), 6,74 (с, 1 Н), 4,71(ушир.с, 1 Н), 3,15 (д, J=4,8 Гц, 2 Н); МС (ESI) m/z: 134 (М+Н+). К раствору 1 Н-индазол-5-иламина (20 г, 153 ммоль) в концентрированную HCl (50 мл) добавляли водный раствор (50 мл) NaNO2 (19 г, 158 ммоль) при 0 С и полученную смесь перемешивали в течение 1 ч. Затем добавляли раствор SnCl22H2O (90 г, 306 ммоль) в концентрированную HCl (70 мл), предварительно охлажденный до 0 С. Реакционный раствор перемешивали в течение 2 ч при комнатной температуре. Осадок фильтровали и промывали эфиром, в результате получали (1 Н-индазол-5-ил)гидразин гидрохлорид в форме желтого твердого вещества, который использовали в следующей реакции без дополнительной очистки. Смесь (1 Н-индазол-5-ил)гидразина гидрохлорида и 4,4-диметил-3-оксопентанонитрила (19 г, 1,05 экв.) в EtOH (200 мл) нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали, остаток очищали путем колоночной хроматографии, в результате получали 3-трет-бутил-1(1 Н-индазол-5-ил)-1 Н-пиразол-5-амин (23 г, 60% для двух стадий). 1 Н ЯМР (300 МГц, ДМСО-d6):8,24(ESI) m/z: 256 (М+Н+). К раствору 3-трет-бутил-1-(1 Н-индазол-5-ил)-1 Н-пиразол-5-амина (14 г, 48 ммоль) в диоксане (100 мл) добавляли 10% NaOH (50 мл) при комнатной температуре и смесь перемешивали в течение 0,5 ч. К смеси добавляли Вос-ангидрид (12 г, 1,2 экв.) раствор перемешивали в течение 3 ч. Смесь экстрагирова- 25016055 ли CH2Cl2 (3100 мл). Объединенные органические экстракты концентрировали и очищали путем колоночной хроматографии, в результате получали трет-бутил 5-(5-амино-3-трет-бутил-1 Н-пиразол-1-ил)-1 Ниндазол-1-карбоксилат (7,8 г, 46%). 1 Н ЯМР (300 МГц, ДМСО-d6):8,44 (с, 1 Н), 8,10 (д, J=9,0 Гц, 1 Н),8,00 (с, 1 Н), 7,82 (д, J=9,0 Гц, 1 Н), 5,39 (с, 1 Н), 5,24 (ушир.с, 2 Н), 1,65 (с, 9 Н), 1,21 (с, 9 Н); МС (ESI) m/z: 356 (М+Н+). Пример В 5. Фенилгидразин и 3-оксо-3-(тиофен-2-ил)пропанонитрил объединяли согласно описанным в литературе процедурам, в результате получали 1-фенил-3-(тиофен-2-ил)-1 Н-пиразол-5-амин, см. WO 2006/071940. Пример В 6. Метилгидразин (0,35 г, 7,6 ммоль) и 2-тионил ацетонитрил (1,1 г, 7,6 ммоль) нагревали до 80 С в этаноле в присутствии концентрированной HCl (1 капля) в течение 18 ч. Растворители удаляли, добавляли насыщенный раствор NaHCO3 (35 мл) и экстрагировали продукт этилацетатом (230 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали, в результате получали 1-метил-3-(тиофен-2-ил)-1 Н-пиразол-5-амин (1,25 г, 92% выход) в форме твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):7,34 (дд, J=4,8 Гц, 1,2 Гц, 1 Н), 7,19 (дд, J=3,6 Гц, 1,2 Гц, 1 Н), 7,00 (дд,J=4,8 Гц, 3,6 Гц, 1 Н), 5,80 (с, 1 Н), 5,29 (с, 2 Н), 3,51 (с, 3 Н); МС (ESI) m/z: 180,0 (М+Н+). Пример В 7. 3-Фторфенилбороновую кислоту (0,70 г, 5,0 ммоль), этил 3-трет-бутил-1 Н-пиразол-5-карбоксилат(0,981 г, 5,0 ммоль), Cu(OAc)2 (0,908 г, 5,0 ммоль), пиридин (2,45 мл, 30 ммоль) и 4 А MS (1,9 г) объединяли в CH2Cl2 (48 мл) и перемешивали на открытом воздухе при комнатной температуре в течение 4 дней. Реакционную смесь разбавляли EtOAc (150 мл), промывали 3 М HCl (250 мл), H2O (50 мл) и солевым раствором (50 мл), сушили (MgSO4) и концентрировали в вакууме. Неочищенный продукт очищали путем хроматографии, в результате получали этил 3-трет-бутил-1-(3-фторфенил)-1 Н-пиразол-5 карбоксилат (0,786 г, 54% выход) в форме бесцветного масла. МС (ESI) m/z: 291 (М+Н+). К перемешиваемому раствору этил 3-трет-бутил-1-(3-фторфенил)-1 Н-пиразол-5-карбоксилата(0,786 г, 2,71 ммоль) в 1:1:1 ТГФ/EtOH/H2O (36 мл) при комнатной температуре добавляли LiOHH2O(0,568 г, 13,5 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли 3 М HCl (30 мл) и экстрагировали EtOAc (350 мл). Объединенные органические фазы промывали солевым раствором (230 мл), сушили (MgSO4) и концентрировали, в результате получали 3 трет-бутил-1-(3-фторфенил)-1 Н-пиразол-5-карбоновую кислоту (0,602 г, 85% выход) в форме белого твердого вещества. МС (ESI) m/z: 263 (М+Н+). К перемешиваемому раствору 3-трет-бутил-1-(3-фторфенил)-1 Н-пиразол-5-карбоновой кислоты(0,26 г, 0,60 ммоль) и TEA (0,13 мл, 0,90 ммоль) в 1,4-диоксане (9 мл) добавляли DPPA (азид дифенилфосфорил 0,16 мл, 0,75 ммоль). После перемешивания в течение 30 мин при комнатной температуре добавляли 2,2,2-трихлорэтанол (0,58 мл, 6,0 ммоль) и реакционную смесь нагревали при 100 С в течение 2 ч. Реакционную смесь разбавляли солевым раствором (10 мл) и экстрагировали EtOAc (320 мл). Объединенные органические фазы промывали 5% лимонной кислотой (10 мл), насыщенным раствором NaHCO3 (10 мл), сушили (MgSO4), фильтровали и упаривали. Неочищенный продукт очищали путем хроматографии, в результате получали 2,2,2-трихлорэтил 3-трет-бутил-1-(3-фторфенил)-1 Н-пиразол-5 илкарбамат (0,180 г, 73% выход) в форме бесцветного масла. МС (ESI) m/z: 410 (М+Н+). Пример В 8. Способ 1. К раствору хинолин-6-иламина (5 г, 35 ммоль) в концентрированной HCl (12 мл) добавляли по каплям водный раствор (4 мл) NaNO2 (2,42 г, 35 ммоль) при 0 С. Полученную смесь перемешивали в течение 1 ч и затем в нее по каплям добавляли раствор SnCl22H2O (15,8 г, 70 ммоль) в концентрированнуюHCl (15 мл) при 0 С. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Осадок собирали и промывали EtOH и Et2O, в результате получали 1-(хинолин-6-ил)гидразин гидрохлорид(4,3 г, 77% выход) в форме желтого порошка, который использовали в следующей реакции без дополнительной очистки. Смесь 1-(хинолин-6-ил)гидразин гидрохлорид (4,0 г, 20,5 ммоль) и 4,4-диметил-3-оксопентанонитрила (3,6 г, 30 моль) в EtOH (50 мл) и концентрированной HCl (5 мл) нагревали с обратным холодильником в течение ночи. После удаления растворителя остаток очищали путем колоночной хроматографии, в результате получали 3-трет-бутил-1-(хинолин-6-ил)-1H-пиразол-5-амин (2,8 г, 51% выход). 1 Н ЯМР (300 МГц, ДМСО-d6):8,84 (д, J=4,2 Гц, 1 Н), 8,37 (д, J=7,5 Гц, 1 Н), 8,09 (с, 1 Н), 8,04 (с,2 Н), 7,52 (м, 1 Н), 5,46 (с, 1 Н), 5,40 (ушир.с, 2 Н), 1,29 (с, 9 Н). МС (ESI) m/z (M+H+): 267,2. Способ 2. Раствор трифторметансульфонового альдегида (42,8 г, 0,15 моль) в метиленхлориде (100 мл) добавляли по каплям к раствору 6-гидроксихинолина (20,00 г, 0,138 моль) и пиридина (23 г, 0,277 моль) в метиленхлориде (500 мл) при 0 С. Охлаждающую ванну удаляли и полученный раствор перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь промывали водой (3300 мл), органические- 26016055 фазы сушили (MgSO4) и концентрировали в вакууме, в результате получали сырой хинолин-6 илтрифторметансульфонат (40 г, 100% выход) в форме масла. 1 Н-ЯМР (400 МГц, ДМСО-d6):9,00 (д,1 Н, J=2,8 Гц), 8,50 (д, 1 Н, J=8,0 Гц), 8,21 (д, J=2,8 Гц, 1 Н), 8,18 (д, J=9,2 Гц, 1 Н), 7,80 (м, 1 Н), 7,64 (м, 1 Н); МС (ESI) m/z: 277,9 (М+Н+). К суспензии хинолин-6-ил трифторметансульфоната (40 г, 0,14 моль), бензофенон гидразона (35,6 г,0,18 моль), карбоната цезия (74 г, 0,23 моль) и 1,1'-бис-(дифенилфосфино)ферроцена (2,5 г, 4,5 ммоль) в дегазированном толуоле (1 л) добавляли ацетат палладия (0,013 г, 0,058 ммоль). Полученную смесь нагревали до 90 С в атмосфере азота. Через 16 ч смесь концентрировали в вакууме, остаток очищали путем колоночной хроматографии на силикагеле (20-30% EtOAc в петролейном эфире), в результате получали 1-(дифенилметилен)-2-(хинолин-6-ил)гидразин (32 г, 68,6% выход). 1 Н-ЯМР (300 МГц, ДМСО-d6):9,22(м, 4 Н), 7,50 (д, J=3,6 Гц, 2 Н), 7,33-7,39 (м, 6 Н); МС (ESI) m/z: 324 (М+Н+). Раствор 1-(дифенилметилен)-2-(хинолин-6-ил)гидразина (32 г, 99 ммоль) и 4,4-диметил-3-оксопентанонитрила (26 г, 0,15 моль) в этаноле (500 мл) обрабатывали концентрированной HCl (80 мл, 12 н.,0,96 моль) и смесь нагревали с обратным холодильником в течение ночи. Охлажденную реакционную смесь концентрировали в вакууме, остаток промывали Et2O, что обеспечивало удаление дифенилкетона. Неочищенный продукт растворяли в EtOAc и нейтрализовали (рН 8) насыщенным раствором Na2CO3. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме. Остаток затем очищали путем хроматографии на силикагеле, в результате получали 3-трет-бутил-1-(хинолин-6-ил)-1H-пиразол-5-амин (23 г, 87% выход). 1 Н-ЯМР (300 МГц, ДМСО-d6):8,86 (м, 1 Н), 8,39 (д, J=5,7 Гц, 1 Н), 8,11-8,02 (м, 3 Н),7,54,(м, 1 Н), 5,46 (с, 1 Н), 5,42 (ушир.с, 2 Н), 1,23 (с, 9 Н); МС (ESI) m/z (M+H+): 267,2. Пример В 9. Метилгидразид (0,46, 10 ммоль) и 2-фторфенил ацетонитрил (1,63 г, 10 ммоль) нагревали до 80 С в присутствии концентрированной HCl (1 капля) в этаноле (30 мл) в течение 18 ч. Растворители удаляли; добавляли насыщенный раствор NaHCO3 (35 мл) и экстрагировали продукт этилацетатом (230 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали с получением сырого продукта, который очищали путем хроматографии (метанол/CH2Cl2), в результате получали 3-(2-фторфенил)-1-метил-1 Н-пиразол-5-амин (1,25 г, 65% выход) в форме густого остатка. 1 Н ЯМР (400 МГц, ДМСО-d6):7,86 (тд, J=8,8 Гц, 2,4 Гц, 1 Н), 7,28-7,15 (м, 3 Н), 5,71 (д, J=4,4 Гц, 1 Н), 5,28(ушир.с, 2 Н), 3,58 (с, 3 Н); МС (ESI) m/z: 192,0 (М+Н+). К двухфазному раствору 3-(2-фторфенил)-1-метил-1 Н-пиразол-5-амина (1,19 г, 6,22 ммоль) в этилацетате (30 мл) и раствору NaHCO3 (30 мл) добавляли изофенилхлорформат (1,28 г, 10,6 ммоль) и смесь перемешивали при комнатной температуре в течение 24 ч. Разделяли две фазы; водную фазу экстрагировали этилацетатом (130 мл), объединенные органические фазы промывали солевым раствором, сушили(Na2SO4) и концентрировали с получением сырого продукта, который очищали путем хроматографии(ушир.с, 1 Н), 7,90 (тд, J=8,0 Гц, 1,6 Гц, 1 Н), 7,38-7,22 (м, 3 Н), 6,54 (д, J=3, 6 Гц, 1 Н), 4,79-4,77 (м, 2 Н),3,76 (с, 3 Н), 1,96 (м, 3 Н); МС (ESI) m/z: 276,0 (М+Н+). Пример В 10. Смесь 5-гидразинил-2-метилпиридина гидрохлорида из примера В 27 (5,0 г, 31,4 ммоль) и 4,4 диметил-3-оксопентаннитрил (8,3 г, 66,3 ммоль) в EtOH (50 мл) нагревали с обратным холодильником в течение ночи. Реакционную смесь концентрировали, остаток растворяли в EtOAc и нейтрализовали насыщенным раствором Na2CO3. Органическую фазу сушили (Na2SO4), концентрировали в вакууме и очищали путем колоночной хроматографии, в результате получали 3-трет-бутил-1-(6-метилпиридин-3-ил)1 Н-пиразол-5-амин (5,2 г, 71% выход). 1 Н ЯМР (400 МГц, CDCl3):8,72 (с, 1 Н), 7,81 (дд, J=8,0, 2,4 Гц,1 Н), 7,23 (д, J=8,4 Гц, 1 Н), 5,54 (с, 1 Н), 3,71 (ушир.с, 1 Н), 2,58 (с, 3 Н), 1,29 (с, 9 Н); МС (ESI) m/z: 231,2(М+Н+). Пример В 11. К перемешиваемому раствору соединение из примера В 35 (0,240 г, 0,86 ммоль) в сухом ТГФ (8,0 мл) при комнатной температуре добавляли LiAlH4 (1,0 М в ТГФ, 2,6 мл, 2,6 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь осторожно гасили путем добавления H2O (0,10 мл), 3 М NaOH (0,10 мл) и H2O (0,20 мл) и перемешивали смесь при комнатной температуре в течение ночи. Суспензию фильтровали через Celite и промывали EtOAc (20 мл). Фильтрат сушили (MgSO4) и концентрировали, в результате получали 2-(5-амино-1-фенил-1 Н-пиразол-3-ил)-2 метилпропан-1-ол (0,208 г, 105% выход) в форме желого масла. МС (ESI) m/z: 232,2 (М+Н+). К раствору 2-(5-амино-1-фенил-1 Н-пиразол-3-ил)-2-метилпропан-1-ола (0,208 г, 0,85 ммоль) в ДМФ(2,0 мл) добавляли имидазол (0,32 г, 4,7 ммоль) и TBSCl (0,39 г, 2,6 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 ч. Растворитель удаляли при пониженном давлении. Остаток разбавляли H2O (10 мл) и экстрагировали EtOAc (220 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали. Неочищенный продукт очищали путем хроматографии, в результате- 27016055 получали 3-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-1-фенил-1 Н-пиразол-5-амин (0,125 г,42% выход) в форме светло-желтого масла. МС (ESI) m/z: 346,3 (М+Н+). Пример В 12. Следуя процедуре, аналогичной примеру В 11, соединение из примера В 36 превращали в 3-(1-(третбутилдиметилсилилокси)-2-метилпропан-2-ил)-1-метил-1 Н-пиразол-5-амин (42% выход). 1H ЯМР (400 МГц, CDCl3):5,59 (с, 1 Н), 3,69 (с, 3 Н), 3,55 (с, 2 Н), 1,26 (с, 6 Н), 0,89 (с, 9 Н), 0,00 (c, 6 Н); МС (ESI) m/z: 284,2 (М+Н+). Пример В 13. Трет-бутоксид калия (0,51 г, 4,5 ммоль) растворяли в ДМСО (10 мл) и к этому раствору маленькими порциями добавляли этил 3-(тиофен-2-ил)-1 Н-пиразол-5-карбоксилат (1,01 г, 4,5 ммоль) и перемешивали в атмосфере аргона в течение 15 мин. К этому раствору медленно добавляли 2-иодопропан (1,2 г, 6,8 ммоль) и перемешивали в течение 1 ч при комнатной температуре. Добавляли насыщенный растворNH4Cl, продукт экстрагировали EtOAc (240 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Очистка путем хроматографии на силикагеле давала этил 1-изопропил-3-(тиофен-2-ил)-1 Н-пиразол-5-карбоксилат в форме пастообразной массы (0,88 г, 73% выход). 1 Н ЯМР (400 МГц, ацетон-d6):7,47 (дд, J=3,2 Гц, 1,2 Гц, 1 Н), 7,42 (дд, J=4,8 Гц, 1,2 Гц,1 Н), 7,12-7,09 (м, 2 Н), 5,57-5,51 (м, 1 Н), 4,37 (кв, J=7,2 Гц, 2 Н), 1,50 (д, J=6,8 Гц, 6 Н), 1,38 (т, J=7,2 Гц,3 Н); МС (ESI) m/z: 265,0 (М+Н+). К раствору этил 1-изопропил-3-(тиофен-2-ил)-1 Н-пиразол-5-карбоксилата (0,88 г, 3,3 ммоль) в ТГФ(10 мл) добавляли водный раствор LiOH (0,42 г, 10 ммоль, 5 мл) и перемешивали смесь в течение 16 ч при комнатной температуре. Растворители удаляли, густую жидкость разбавляли водой (5 мл) и подкисляли 3 М раствором HCl до рН 4-5. Продукт выпадал в осадок, его фильтровали, промывали водой и сушили, в результате получали 1-изопропил-3-(тиофен-2-ил)-1 Н-пиразол-5-карбоновую кислоту в форме белого твердого вещества (0,69 г, 88% выход). К раствору 1-изопропил-3-(тиофен-2-ил)-1 Н-пиразол-5-карбоновой кислоты (0,68 г, 2,9 ммоль) в диоксане (10 мл) добавляли триэтиламин (0,44 г, 4,3 ммоль), дифенилфосфорилазид (0,95 г, 3,5 ммоль) и трихлорэтанол (0,86 г, 5,8 ммоль) и смесь нагревали до 90 С в течение 4 ч. Смесь вливали в 3 М растворHCl (40 мл) и экстрагировали продукт EtOAc (240 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме. Очистка путем хроматографии на силикагеле давала 2,2,2-трихлорэтил 1-изопропил-3-(тиофен-2-ил)-1 Н-пиразол-5-илкарбамат (0,88 г, 80% выход) в форме белого твердого вещества. 1 Н ЯМР (400 МГц, ацетон-d6):7,36-7,34 (м, 3 Н), 7,07 (дд,J=5,6 Гц, 4,0 Гц, 1 Н), 6,52 (с, 1 Н), 5,83 (т, J=7,2 Гц, 3 Н), 4,95 (с, 2 Н), 4,66-4,62 (м, 1 Н), 1,45 (д, J=6,8 Гц,6 Н); МС (ESI) m/z: 382,0 (М+Н+). Пример В 14. Следуя процедуре, описанной в примере В 8 (способ 1), 2-метилхинолин-6-амин (1,00 г, 6,32 ммоль) и 4,4-диметил-3-оксопентаннитрил (1,03 г, 8,22 ммоль) объединяли с получением 3-трет-бутил-1-(2 метилхинолин-6-ил)-1 Н-пиразол-5-амина (428 мг, 24% выход) в форме твердого вещества. 1 Н ЯМР (300 МГц, ДМСО-d6):1,24 (с, 9 Н), 2,66 (с, 3 Н), 5,37 (с, 2 Н), 5,43 (с, 1 Н), 7,44 (д, J=8,4, 1 Н), 7,97 (с, 2 Н), 8,05(с, 1 Н), 8,28 (д, J=8,4, 1H); МС (ESI) m/z: 281,2 (М+Н+). Пример В 15. К суспензии KCN (1,90 г, 29,1 ммоль) в МеОН (35 мл) добавляли по каплям 3-бром-1,1,1 трифторпропан-2-она оксим (5,00 г, 24,3 ммоль) в МеОН (72 мл) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Раствор упаривали, затем остаток растворяли в EtOAc и перемешивали при комнатной температуре. Твердое вещество фильтровали, и фильтрат упаривали, в результате получали сырой продукт. Неочищенный продукт очищали путем колоночной хроматографии на силикагеле (Biotage: 25 М, 10-60% EtOAc/гексан: 550 мл), в результате чего получали 3-(трифторметил)изоксазол-5-амин (1,38 г, 37% выход). МС (ESI) m/z: 153,0 (М+Н+). Следуя общему способу G, 3-(трифторметил)изоксазол-5-амин (1,38 г, 9,1 ммоль) и изопропенилхлорформат (1,1 г, 9,1 ммоль) в присутствии LiHMDS (1,0 M, 18 мл, 18,2 ммоль) смешивали с получением проп-1-ен-2-ил 3-(трифторметил)изоксазол-5-илкарбамата (0,82 г, 38% выход). 1H ЯМР (400 МГц,ДМСО-d6):12,3 (с, 1 Н), 6,48 (с, 1 Н), 4,83 (м, 1 Н), 4,80 (м, 1 Н), 1,93 (с, 3 Н); МС (ESI) m/z: 237,0 (М+Н+). Пример В 16. Трет-бутоксид калия (0,29 г, 2,5 ммоль) растворяли в ДМСО (5 мл), к этому раствору маленькими порциями добавляли соединение из примера В 37 (0,50 г, 2,5 ммоль) в атмосфере аргона. Через 15 мин медленно добавляли 2-иодоэтан (0,31 мл, 3,8 ммоль) добавляли. После перемешивания в течение 1,5 ч ЖХ-МС показал исчезновение исходного материала и образование продукта. Добавляли насыщенный раствор NH4Cl, продукт экстрагировали этилацетатом (240 мл), объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали с получением сырого продукта. Неочищенный продукт очищали путем колоночной хроматографии на силикагеле (Biotage: 25M, от 5 до 35% EtOAc/гексан: 340 мл, от 35 до 100% EtOAc/гексан: 300 мл), в результате получали этил 3-третбутил-1-этил-1 Н-пиразол-5-карбоксилат (0,35 г, 61% выход). МС (ESI) m/z: 225,3 (М+Н+).- 28016055 К раствору этил 3-трет-бутил-1-этил-1 Н-пиразол-5-карбоксилата (0,35 г, 1,6 ммоль) в смеси этанол:диоксан:вода (1:1:1, 6 мл) добавляли гидроксид лития (0,15 г, 6,2 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Раствор разбавляли EtOAc (50 мл) и 5% лимонной кислотой (50 мл). Органическую фазу отделяли, промывали солевым раствором (20 мл), сушили (Na2SO4) и упаривали при пониженном давлении, в результате получали 3-трет-бутил-1-этил-1 Н-пиразол-5 карбоновую кислоту (0,30 г, 98% выход) в форме желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСОd6):6,64 (с, 1 Н), 4,40 (кв, J=7,2 Гц, 2 Н), 1,27 (т, J=7,2 Гц, 3 Н), 1,22 (с, 9 Н); МС (ESI) m/z: 197,3 (М+Н+). Пример В 17. Калия трет-бутоксид (2,6 г, 23 ммоль) растворяли в ДМСО (10 мл), к этому раствору маленькими порциями добавляли соединение из примера В 37 (4,5 г, 23 ммоль) и перемешивали в атмосфере аргона в течение 15 мин. К этому раствору медленно добавляли трет-бутилбромацетат (5,4 г, 28 ммоль) при 0 С при перемешивании в течение 45 мин при комнатной температуре. Добавляли насыщенный растворNH4Cl, продукт экстрагировали этилацетатом (350 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали, в результате получали (7,0 г) смешанный продукт в форме пастообразной массы. Указанную пастообразную массу растворяли в ТФА (10 мл) и перемешивали в течение 3 ч при комнатной температуре. Растворители удаляли, к остатку добавляли воду(100 мл), продукт экстрагировали ДХМ (350 мл). Объединенные органические экстракты промывали солевым раствором, сушили (Na2SO4) и концентрировали, в результате получали 2-(3-трет-бутил-5(этоксикарбонил)-1 Н-пиразол-1-ил)уксусную кислоту (5,8 г, 100%) в форме пастообразной массы. 1 Н ЯМР (400 МГц, ацетон-d6):6,78 (с, 1 Н), 5,25 (с, 2 Н), 4,30 (кв, J=7,2 Гц, 2 Н), 1,35-1,30 (м, 12 Н); МС (ESI)(диизопропилэтиламин, 0,42 г, 3,2 ммоль) и гидрохлорид диметиламина (0,26 г, 3,2 ммоль). После перемешивания смеси в течение 1 ч при комнатной температуре добавляли воду (50 мл) и экстрагировали продукт этилацетатом (230 мл). Объединенные органические фазы промывали 3 М раствором HCl (130 мл), сушили (Na2SO4) и концентрировали с получением сырого продукта, который очищали путем хроматографии (EtOAc/ДХМ), в результате получали этил 3-трет-бутил-1-(2-(диметиламино)-2-оксоэтил)1 Н-пиразол-5-карбоксилат (0,25 г, 55%) в форме густой пасты. 1 Н ЯМР (400 МГц, ацетон-d6):6,73 (с,1 Н), 5,35 (с, 2 Н), 4,27 (кв, J=7,2 Гц, 2 Н), 3,15 (с, 3 Н), 2,90 (с, 3 Н), 1,33-1,28 (м, 12 Н); МС (ESI) m/z: 282,3(М+Н+). К раствору этил 3-трет-бутил-1-(2-(диметиламино)-2-оксоэтил)-1 Н-пиразол-5-карбоксилата (1,16 г,4 ммоль) в ТГФ (10 мл) добавляли 1 М боран/ТГФ (12 мл, 12 ммоль) при 0 С в атмосфере аргона и продолжали перемешивание в течение 12 ч при 60 С. Смесь охлаждали до 0 С, гасили 3 М раствором HCl и нагревали до 60 С в течение 30 мин. Смесь подщелачивали твердым NaHCO3 до рН около 8 и экстрагировали продукт CHCl3 (230 мл). Объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме с получением сырого продукта. Очистка путем хроматографии на силикагеле давала этил 3-трет-бутил-1-(2-(диметиламино)этил)-1 Н-пиразол-5-карбоксилат в форме пастообразной массы (0,47 г, 43% выход). 1 Н ЯМР (400 МГц, MeOH-d4):6,73 (с, 1 Н), 4,66 (т,J=6,8 Гц, 2 Н), 4,35 (кв, J=7,2 Гц, 2 Н), 2,80 (т, J=7,2 Гц, 2 Н), 2,34 (с, 6 Н), 1,38 (т, J=7,2 Гц, 3 Н), 1,31 (с, 9 Н); МС (ESI) m/z: 268,2 (М+Н+). К раствору этил 3-трет-бутил-1-(2-(диметиламино)этил)-1 Н-пиразол-5-карбоксилата (0,47 г, 1,8 ммоль) в ТГФ (10 мл) добавляли водный LiOH (0,22 г, 5,3 ммоль, 5 мл) и смесь перемешивали в течение 16 ч при комнатной температуре. Растворители удаляли, густую жидкость разбавляли водой (5 мл) и подкисляли 50% водным раствором уксусной кислоты до рН 5-6. Продукт экстрагировали EtOAc (250 мл), объединенные органические фазы промывали солевым раствором, сушили (Na2SO4) и концентрировали в вакууме, в результате получали 3-трет-бутил-1-(2-(диметиламино)этил)-1 Н-пиразол-5-карбоновую кислоту в форме пастообразной массы (0,12 г, 29% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):6,56 (с, 1 Н),4,66 (т, J=6,0 Гц, 2 Н), 3,17 (т, J=6,0 Гц, 2 Н), 2,53 (с, 6 Н), 1,17 (с, 9 Н); МС (ESI) m/z: 240,3 (М+Н+). Пример В 18. 3-трет-Бутилизоксазол-5-амин готовили согласно способу, раскрытому в WO 99/32111, 0,250. Пример В 19. Смесь 1,1,3,3-тетраметоксипропана (37 г, 226 ммоль), трет-бутилгидразин гидрохлорида (28 г, 226 ммоль) и концентрированной HCl (60 мл, 720 ммоль) в EtOH (300 мл) нагревали с обратным холодильником в течение ночи. Смесь вливали в воду и полученную смесь экстрагировали эфиром. Объединенные органические фазы промывали солевым раствором, сушили (MgSO4) и концентрировали в вакууме, в результате получали 1-трет-бутил-1 Н-пиразол (25 г, 89% выход). 1 Н ЯМР (400 МГц, ДМСО-d6):7,73 (с,1 Н), 7,38 (с, 1 Н), 6,17 (с, 1 Н), 1,47 (с, 9 Н); МС (ESI) m/z: 125,1 [М+Н]+.HNO3 (11,7 г, 185 ммоль) добавляли по каплям к смеси 1-трет-бутил-1 Н-пиразола (23 г, 185 ммоль) в концентрированной H2SO4 (30 мл) при 0 С. Полученную смесь перемешивали при 0 С в течение 30 мин и выливали на колотый лед. Водную смесь экстрагировали EtOAc. Объединенные органические фазы промывали солевым раствором, сушили (MgSO4) и концентрировали в вакууме, в результате получа- 29
МПК / Метки
МПК: A61K 39/395, A61K 31/54, A61P 35/00
Метки: фармацевтическая, соединения, композиция, ингибирующие, основе, киназы
Код ссылки
<a href="https://eas.patents.su/30-16055-soedineniya-ingibiruyushhie-kinazy-i-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, ингибирующие киназы, и фармацевтическая композиция на их основе</a>
Следующий патент: Тиофенпиразолопиримидиновые соединения
Случайный патент: Полносборное здание из легких металлических конструкций


































