Модуляторы активности хемокиновых рецепторов, их кристаллические формы и способ их получения
Номер патента: 14960
Опубликовано: 29.04.2011
Авторы: Маслхиддиноглу Джейл, Черни Роберт Дж., Сяо Цили, Истгейт Мартин Г., Прасад Шива Джосиула, Ян Майкл Г.
Формула / Реферат
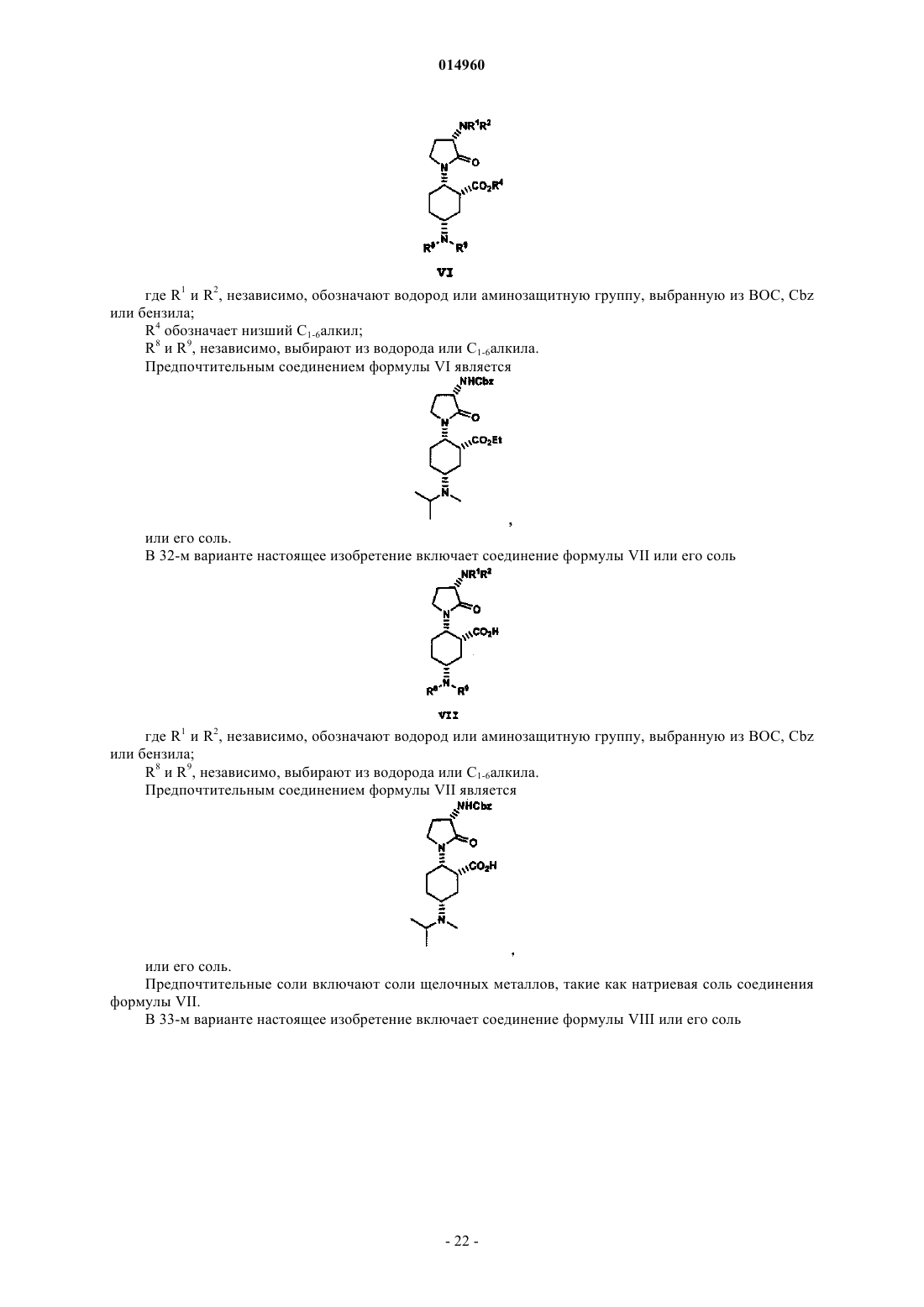
1. Соединение N-((1R,2S,5R)-5-(изопропил(метил)амино)-2-((S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемая соль.
2. Кристаллическая форма N-((1R,2S,5R)-5-(изопропил(метил)амино)-2-((S)-2-оксо-3-(6-(трифторметил) хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида или его фармацевтически приемлемой соли.
3. Кристаллическая форма по п.2, отличающаяся следующими параметрами элементарной ячейки:
размеры ячейки:
а=11,8427(3),
b=18,1503(7),
с=12,7923(4),
a=90,
b=105,362(2),
g=90,
пространственная группа P21,
молекулы/элементарная ячейка 2,
причем указанный кристалл находится при температуре примерно 22°С.
4. Кристаллическая форма по пп.2, 3, отличающаяся тем, что ее порошковая рентгенограмма содержит три или более значений 2q (CuKa l=1,541 Å), выбранных из 7,2; 8,7; 9,7; 12,5; 12,8; 13,3; 16,0; 16,6; 18,2 и 18,8, при температуре примерно 22°С.
5. Кристаллическая форма по пп.2-4, отличающаяся тем, что ее порошковая рентгенограмма содержит четыре или более значений 2q (CuKa l=1,541 Å), выбранных из 7,2; 8,7; 9,7; 12,5; 12,8; 13,3; 16,0; 16,6; 18,2 и 18,8, при температуре примерно 22°С.
6. Кристаллическая форма по пп.2-5, отличающаяся тем, что относительные координаты атомов такие, как приведенные в табл. 7.
7. Кристаллическая форма по пп.2-6, отличающаяся тем, что ее порошковая рентгенограмма находится в соответствии с фиг. 2.
8. Фармацевтическая композиция, содержащая соединение по пп.1-7 и фармацевтически приемлемый носитель или разбавитель.
9. Способ лечения заболевания у млекопитающего, заключающийся во введении этому млекопитающему терапевтически эффективного количества соединения по пп.1-7, причем заболевание выбирают из диабета, ожирения, метаболического синдрома, удара, невропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ассоциированной с ВИЧ деменции, идиопатического легочного фиброза, артериосклероза трансплантата, вызванной физическими или химическими причинами травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, нестабильных атероматозных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, гиперплазии неоинтимы трансплантата при диализе, гиперплазии интимы артериовенозного шунта, трансплантации органа, хронической нефропатии трансплантата и рака.
10. Способ по п.9, отличающийся тем, что заболевание выбирают из диабета, ожирения, болезни Крона, системной красной волчанки, гломерулонефрита, рассеянного склероза, атеросклероза, рестеноза и трансплантации органа.
11. Способ по пп.9, 10, отличающийся тем, что заболевание выбирают из рассеянного склероза, атеросклероза, болезни Крона и диабета.
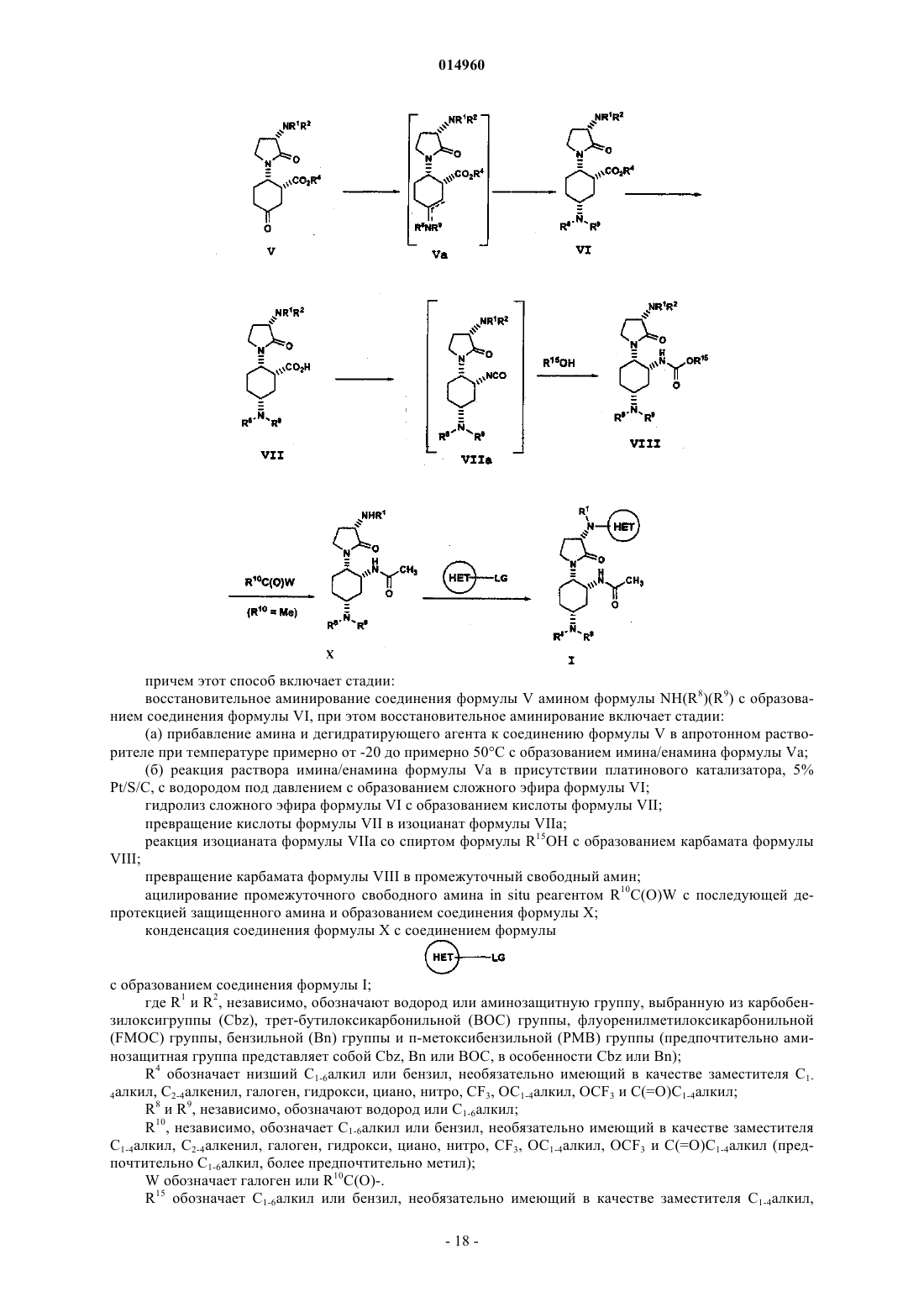
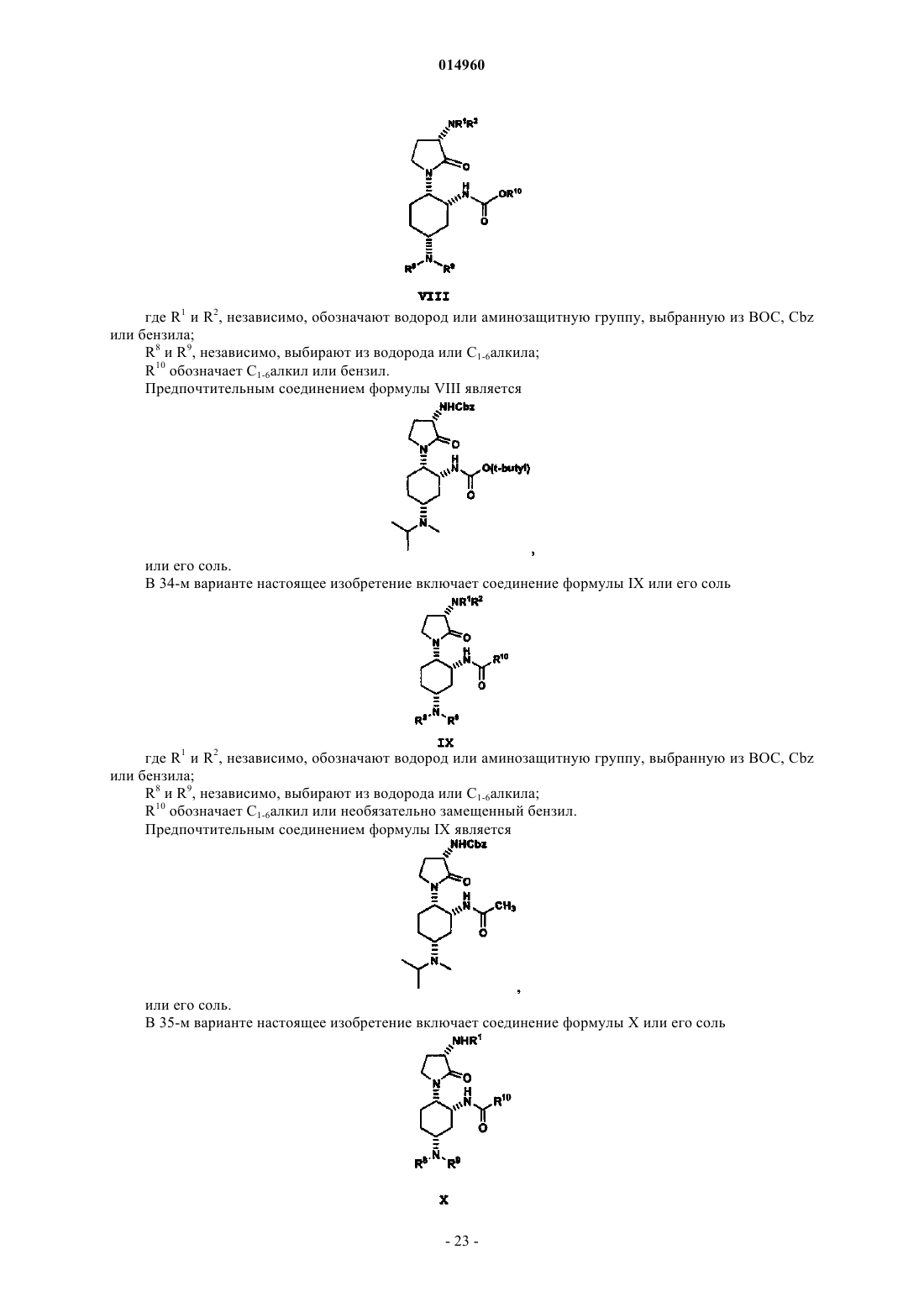
12. Способ получения соединения формулы VI
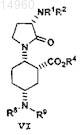
или его соли, который включает
восстановительное аминирование соединения формулы V амином формулы NH(R8)(R9) с образованием соединения формулы VI, при этом восстановительное аминирование включает следующие стадии:
(а) прибавление амина и дегидратирующего агента к соединению формулы V в апротонном растворителе при температуре примерно от -20 до примерно 50°С с образованием имина/енамина формулы Va
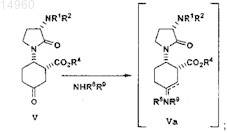
(б) реакция раствора имина/енамина формулы Va в присутствии платинового катализатора, 5% Pt/S/C, с газообразным водородом под давлением с образованием сложного эфира формулы VI;
где R1и R2, независимо, обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензильной группы;
R4 обозначает С1-6алкил и
R8 и R9, независимо, обозначают водород или С1-6алкил.
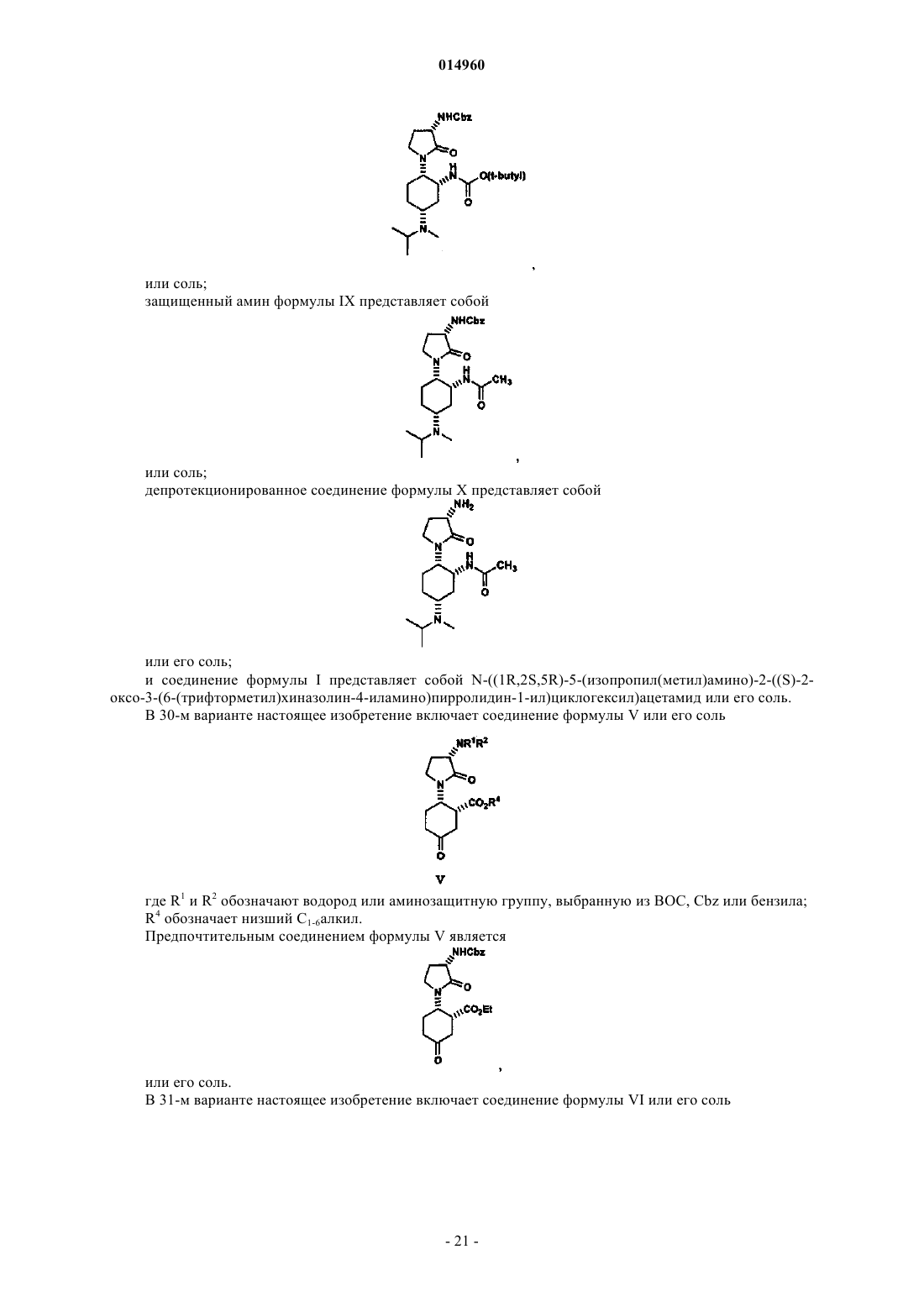
13. Способ по п.12, отличающийся тем, что
соединение формулы V представляет собой
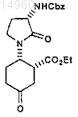
или его соль;
соединение формулы Va представляет собой
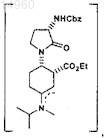
или его соль;
соединение формулы VI представляет собой
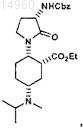
или его соль.
14. Соединение
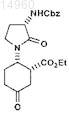
или его соль.
15. Соединение
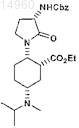
или его соль.
16. Соединение
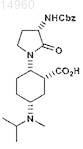
или его соль.
17. Соединение

или его соль.
18. Соединение
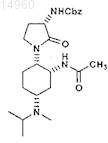
или его соль.
Текст
МОДУЛЯТОРЫ АКТИВНОСТИ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ, ИХ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ Настоящее изобретение включает антагонист или частичные агонисты/антагонисты МСР-1 рецепторной активности:N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль либо сольват, проявляющие неожиданное сочетание фармакологических характеристик. Также охватываются кристаллические формы соединений по настоящему изобретению. Изобретение рассматривает фармацевтические композиции,содержащие эти соединения, и способы их применения для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечнососудистых заболеваний. Рассмотрен способ получения соединений формулы I, включая соединение, указанное выше, где R1 обозначает водород или аминозащитную группу; R8 и R9,независимо, выбирают из водорода и C1-6 алкила; R10 обозначает С 1-6 алкил; НЕТ представляет собой возможно замещенное 3-14-членное гетероциклическое или гетероарильное кольцо,содержащее N, О или S в качестве гетероатомов. Изобретение также относится к соединениям,применимым в способе получения в качестве интермедиатов. 014960 Область, к которой относится изобретение Настоящее изобретение включает N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль, сольват или пролекарство, проявляющие неожиданное сочетание нужных фармакологических характеристик. Также охватываются кристаллические формы соединений по настоящему изобретению. Также объектами данного изобретения являются фармацевтические композиции, содержащие эти соединения, и способы их применения в качестве агентов для лечения воспалительных заболеваний,аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Настоящее изобретения также включает способ получения соединений формулы I, включая N-1R,2S,5R)5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамид представлены в данном описании. где R1, R8, R9, R10 и Также в данное изобретение включаются соединения, применимые в способе получения в качестве интермедиатов. Предпосылки создания изобретения Хемокины представляют собой хемотаксические цитокины с молекулярной массой 6-15 кДа, которые высвобождаются большим числом клеток, чтобы привлекать и активировать, наряду с прочими типами клеток, Т- и В-лимфоциты, эозинофилы, базофилы и нейтрофилы (обзор см. в Charo and Rasonhoff,New Eng. J. Med. 2006, 354, 610-621; Luster, New Eng. J. Med. 1998, 338, 436-445; Rollins, Blood 1997, 90,909-928). Хемокины делятся на два основных класса, СХС и СС, в зависимости от того, разделены первые два цистеиновых остатка в аминокислотной последовательности отдельной аминокислотой (СХС) или прилегают друг к другу (СС). Хемокины СХС, такие как интерлейкин-8 (IL-8), нейтрофилактивирующий белок-2 (NAP-2) и фактор роста меланомы (MGSA), являются хемотаксическими, прежде всего, по отношению к нейтрофилам и Т-лейкоцитам, тогда как СС хемокины, такие как RANTES, MIP1, MIP-1, моноцитарные хемотаксические белки (МСР-1, МСР-2, МСР-3, МСР-4 и МСР-5) и эотаксины (-1 и -2), являются хемотаксическими (наряду с прочими типами клеток) по отношению к макрофагам, Т-лимфоцитам, эозинофилам, дендритным клеткам и базофилам. Существуют хемокины лимфотактин-1, лимфотактин-2 (оба являются С хемокинами) и фракталкин (СХ 3 С хемокин), которые не относятся ни к одному из основных подсемейств хемокинов. Хемокины связываются со специфическими рецепторами клеточной поверхности, принадлежащими к семейству связанных с G-белком белков с семью трансмембранными доменами (см. обзор в Horuk,Trends Pharm. Sci. 1994, 15, 159-165), которые называются "хемокиновыми рецепторами" ("рецепторы хемокинов"). При связывании их родственных лигандов хемокиновые рецепторы трансдуцируют (переносят) внутриклеточный сигнал через ассоциированные G-белки, что приводит, наряду с прочими откликами, к быстрому повышению внутриклеточной концентрации кальция, изменению формы клеток, повышенной экспрессии молекул клеточной адгезии, дегрануляции и стимулированию клеточной миграции. Имеется по меньшей мере десять человеческих хемокиновых рецепторов, которые связываются с СС хемокинами или отвечают на них, со следующими характеристическими паттернами (обзор в Zlotnik(Schweickert, et al., J. Biol. Chem. 2000, 275, 90550). Было показано, что, помимо хемокиновых рецепторов млекопитающих, цитомегаловирусы млекопитающих, герпесвирусы и поксвирусы экспрессируют в инфицированных клетках белки со связывающими свойствами хемокиновых рецепторов (обзор в Wells and Schwartz, Curr. Opin. Biotech. 1997, 8, 741748). Человеческие CC хемокины, такие как RANTES и МСР-3, могут вызывать быструю мобилизацию кальция при посредстве этих кодированных вирусами рецепторов. Экспрессия рецепторов может быть пермиссивной для инфекции за счет того, что учитывается субверсия нормального контроля и ответа иммунной системы на инфекцию. Кроме того, человеческие хемокиновые рецепторы, такие как CXCR4,CCR2, CCR3, CCR5 и CCR8, могут вести себя как корецепторы в случае инфицирования клеток млекопитающих микробами, как, например, в случае вирусов иммунодефицита человека (ВИЧ, HIV). Подразумевается, что хемокины и их родственные (собственные) рецепторы являются важными медиаторами воспалительных, инфекционных и иммунорегуляторных расстройств и заболеваний, включая астму и аллергические заболевания, а также аутоиммунных патологий, таких как ревматоидный артрит и рассеянный склероз, и метаболических заболеваний, таких как атеросклероз и диабет (обзор вCharo and Rasonhoff, New Eng. J. Med. 2006, 354, 610-621; Z. Gao and W.A. Metz, Chem. Rev. 2003, 103,3733; P.H. Carter, Current Opinion in Chemical Biology, 2002, 6, 510; Trivedi, et al., Ann. Reports Med. Chem. 2000, 35, 191; Saunders and Tarby, Drug Disc. Today, 1999, 4, 80; Premack and Schall, Nature Medicine, 1996,2, 1174). Например, хемокин моноцитарный хемоаттрактант-1 (МСР-1) и его рецептор СС хемокиновый рецептор 2 (CCR2) играют главную роль в привлечении лейкоцитов к сайтам воспаления и в последующей активации этих клеток. Когда хемокин МСР-1 связывается с CCR2, он индуцирует быстрое повышение внутриклеточной концентрации калия, повышенную экспрессию молекул клеточной адгезии и стимулирование миграции лейкоцитов. Важность взаимодействия MCP-1/CCR2 была продемонстрирована в экспериментах на генетически модифицированных мышах. Мыши МСР-1-/- были не способны рекрутировать моноциты в очаги воспаления после различного типа иммунизации (Вао Lu, et al., J. Exp.Med. 1998, 187, 601). Аналогично, мыши CCR2-/- были не способны рекрутировать моноциты или продуцировать интерферон- после стимуляции различными экзогенными агентами; более того, лейкоцитыCCR2 нуль мышей не мигрировали в ответ на МСР-1 (Landin Boring, et al., J. Clin. Invest. 1997, 100, 2552),тем самым демонстрируя специфичность взаимодействия MCP-1/CCR2. Две другие группы исследователей независимо сообщали об аналогичных результатах, полученных с различными штаммами мышейMed. 1997, 186, 1757). Жизнеспособность и обычно нормальное здоровье животных МСР-1-/- и CCR2-/примечательны тем, что нарушение взаимодействия MCP-1/CCR2 не вызывает физиологического кризиса. Взятые вместе, эти данные позволяют прийти к единственному выводу, что молекулы, которые блокируют действие MCP-1/CCR2, могут быть полезны при лечении ряда воспалительных и аутоиммунных расстройств (обзор в М. Feria and F. Diaz- Gonzlez, Exp. Opin. Ther. Patents 2006, 16, 49 и J. Dawson, W.Miltz, and С. Wiessner, С. Exp. Opin. Ther. Targets 2003, 7, 35). Достоверность этой гипотезы в настоящее время подтверждена на ряде животных моделей различных заболеваний, как описано ниже. Известно, что МСР-1 активируется (позитивно регулируется) у больных ревматоидным артритом(Alisa Koch, et al., J. Clin. Invest. 1992, 90, 772-779). Более того, в некоторых доклинических исследованиях было показано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении ревматоидного артрита. Недавно показано, что ДНК-вакцина, кодирующая МСР-1, уменьшает интенсивность артрита, вызванного полиадъювантами у крыс (Sawsan Youssef, et al., J. Clin. Invest. 2000, 106, 361). Подобным образом можно контролировать симптомы заболевания с помощью непосредственного введения антител к МСР-1 крысам с артритом, вызванным коллагеном (Hiroomi Ogata, et al., J.Pathol. 1997, 182, 106), или артритом, вызванным клеточными стенками стрептококков (Ralph С. Schimmer, et al., J. Immunol. 1998, 160, 1466). Возможно самым замечательным является то, что было показано,что пептидный антагонист МСР-1, МСР-1 (9-76) и предотвращает начало заболевания, и уменьшает симптомы заболевания (в зависимости от момента введения) на MRL-lpr мышиной модели артрита (JiangHong Gong, et al., J. Exp. Med. 1997, 186, 131). Далее, было показано, что введение низкомолекулярныхCCR2 антагонистов снижает клинические показатели при артрите на моделях грызунов (С.М.Brodmerkel, et al., J. Immunol. 2005, 175, 5370 и М. Xia, et al. патентная заявка США 0069123, 2006). Введение антитела против CCR2 оказывало различное действие на мышиные модели CIA в зависимости от момента введения (Н. Brahl, et al. J. Immunol. 2004, 172, 890). Недавние исследования на мышах CCR2-/позволяют предположить, что делеция CCR2 может ухудшить болезнь у животных моделей артрита в конкретных обстоятельствах эксперимента (М.P. Quinones, et al. J. Clin. Invest. 2004, 113, 856; M.P.Quinones, et al. J. Mol. Med. 2006, 84, 503). Известно, что МСР-1 активируется при атеросклеротическом поражении, и было показано, что уровни циркулирующего МСР-1 снижаются при лечении терапевтическим агентом (Abdolreza RezaieMajd, et al., Arterioscler. Thromb. Vase. Biol. 2002, 22, 1194-1199). В нескольких принципиальных исследованиях показано потенциальное терапевтическое значение антагонизма взаимодействия МСР-1/CCR2 при лечении атеросклероза. Например, когда мышей МСР-1-/- скрещивают с LDL рецептор-дефицитными мышами, наблюдают 83% уменьшение липидных отложений в аорте (Long Gu, et al., Mol. Cell. 1998, 2,-2 014960 275). Аналогично, когда МСР-1 генетическими методами удаляют из организма мышей, уже сверхэкспрессирующих человеческий аполипопротеин В, полученные в результате мыши защищены от образования атеросклеротических поражений по сравнению с контрольными МСР-1+/+ ароВ мышами (Jennifa Gosling, et al., J. Clin. Invest. 1999, 103, 773). Подобным же образом, когда CCR2-/- мышей скрещивают с мышами аполипопротеин Е-/-, наблюдается значительное снижение случаев атеросклеротических поражений (Landin Boring, et al., Nature 1998, 394, 894; Т.С. Dawson, et al. Atherosclerosis, 1999, 143, 205). Наконец, если аполипопротеин Е-/- мышам вводят ген, кодирующий пептидный антагонист CCR2, то размер поражения уменьшается, а устойчивость к бляшкам повышается (W. Ni, et al. Circulation, 2001, 103, 20962101). Трансплантация костного мозга от CCR2-/- мышей мышам АроЕ 3-Leiden ингибирует ранний атерогенез (J. Guo, et al. Arterioscler. Thromb. Vasc. Biol. 2003, 23, 447), но оказывает минимальное воздействие на запущенные поражения (J. Guo, et al. Arterioscler. Thromb. Vasc. Biol. 2005, 25, 1014). У больных сахарным диабетом типа 2 обычно наблюдается устойчивость к инсулину, как один из отличительных признаков заболевания. Устойчивость к инсулину также ассоциируется с группой расстройств, известных как "метаболический синдром" или "синдром X", который включает ожирение, атеросклероз, гипертензию и дислипидемию (обзор в Eckel, et al. Lancet, 2005, 365, 1415). Хорошо известно,что воспаление участвует в развитии заболевания при патологиях диабета типа 2 и "синдрома X" (обзор вand Aljada, Am J. Cardiol. 2002, 90, 27G-33G; Pickup and Crook, Diabetologia, 1998, 41, 1241). Общепризнано, что МСР-1 играет роль в вызванной ожирением устойчивости к инсулину. В культуре человеческие преадипоциты конститутивно экспрессировали МСР-1 (Gerhardt, Mol. Cell. Endocrinology, 2001, 175,81). CCR2 экспрессируется в адипоцитах. Добавление МСР-1 к дифференцирующимся адипоцитам invitro снижает стимулированное инсулином поглощение глюкозы и экспрессию некоторых адипогенных генов (LpL, адипсина, GLU-4, аР 2, Р 3-адренергического рецептора и PPAR) (P. Sartipy and D. Loskutoff,Proc. Natl. Acad. Sci. USA, 1999, 96, 6902). У больных диабетом типа 2 наблюдаются более высокие уровни циркулирующего МСР-1, чем у недиабетических контрольных пациентов (S. Nomura, et al. Clin. Exp.Immunol. 2000, 121, 437), а высвобождение MCP-1 из жировой ткани можно уменьшить с помощью антидиабетических лекарственных препаратов, таких как метформин или тиазолидиндионы (J.M. Bruun, etal. J. Clin. Endocrinol. Metab. 2005, 90, 2282). Аналогично, МСР-1 также сверхэкспрессируется в мышиных экспериментальных моделях ожирения и продуцируется главным образом в жировой ткани (Sartipyand Loskutoff, Proc. Natl. Acad. Sci. USA, 2003, 100, 7265). У мышей, страдающих ожирением, экспрессия МСР-1 и предшествует возникновению устойчивости к инсулину, и происходит одновременно с ее возникновением (Н. Xu, et al. J. Clin. Invest. 2003, 112, 1821). В другом исследовании показано, что экспрессия МСР-1 позитивно коррелирует с массой жировой ткани мыши около половой железы (Weisberg, et al.J. Clin. Invest. 2003, 112, 1796). В соответствии с этими данными развитие устойчивости к инсулину у мышей db/db уменьшалось (улучшалось) либо посредством генетической делеции МСР-1, либо посредством индуцированной генно-инженерным способом экспрессии доминантно-негативного пептида(Н. Kanda, et al. J. Clin. Invest. 2006, 116, 1494). Можно также продемонстрировать закономерное обратное утверждение: сверхэкспрессия МСР-1 в жировой ткани индуцировала устойчивость к инсулину(N. Kamei, et al. J. Biol. Chem. 2006, 281, 26602). Описан также один противоречащий результат, а именно показано, что генетическая делеция МСР-1 не влияет на устойчивость к инсулину у мышей db/db(F.Y. Chow, et al. Diabetologia, 2007, 50, 471). В соответствии с данными, полученными на МСР-1, непосредственные исследования CCR2 (МСР-1 рецептор) показали, что он участвует в развитии ожирения и индуцированной ожирением устойчивости к инсулину. Соблюдение диеты с высоким содержанием жира повышает число циркулирующих CCR2+ воспалительных моноцитов как у мышей дикого типа (С.L.Tsou, et al. J. Clin. Invest. 2007, 117, 902), так и у мышей и АроЕ-/- (F. Tacke, et al. J. Clin. Invest. 2007, 777,185). Генетическая делеция CCR2 снижает число активированных макрофагов в жировой ткани мышей(С.N. Lumeng, et al. Diabetes, 2007, 56, 16), но не влияет на популяцию М 2 адипозных макрофагов, которые, как полагают, поддерживают "тощее" состояние (С.N. Lumeng, et al. J. Clin. Invest. 2007, 777, 175). Генетическая делеция CCR2 уменьшала вызванное диетой ожирение и увеличивала восприимчивость к инсулину на модели вызванного диетой ожирения (S.P. Weisberg, et al. J. Clin. Invest. 2006, 116, 115; P.Cornelius, R.P. Gladue, R.S. Sebastian, патент WO 2006/013427, A2, 2006) в зависимости от условий эксперимента (А. Chen, et al. Obes. Res. 2005, 13, 1311). Введение низкомолекулярного антагониста CCR2 также повышает чувствительность к инсулину у тех же самых моделей (S.P. Weisberg, et al. J. Clin. Invest. 2006, 776, 115). В двух работах описана важная роль, которую играет CCR2 в вызванных гипертензией воспалении,ремоделировании и гипертрофии сосудов (Е. Bush et al., Hypertension, 2000, 36, 360; M. Ishibashi, et al.Circ. Res. 2004, 94, 1203). Известно, что МСР-1 активируется при рассеянном склерозе у человека, и было показано, что эффективная терапия интерфероном -1b снижает экспрессию МСР-1 в мононуклеарных клетках периферической крови, это наводит на мысль, что МСР-1 принимает участие в прогрессировании заболевания(Carla Iarlori, et al., J. Neuroimmunol. 2002, 123, 170-179). В других работах показано потенциальное тера-3 014960 певтическое значение взаимодействие MCP-1/CCR2 при лечении рассеянного склероза; все эти исследования были проведены на модели с экспериментальным аутоиммунным энцефаломиелитом (ЕАЕ), традиционной животной модели рассеянного склероза. Введение антител к МСР-1 животным с ЕАЕ значительно снижает частоту рецидивов заболевания (K.J. Kennedy, et al., J. Neuroimmunol. 1998, 92, 98). Далее, в двух работах показано, что CCR2-/- мыши устойчивы к ЕАЕ (В.Т. Fife, et al., J. Exp. Med. 2000, 192,899; L. Izikson, et al., J. Exp. Med. 2000, 192, 1075). В следующем сообщении продолжены эти первые наблюдения, а именно изучались эффекты делеции CCR2 у мышей различных линий (S. Gaupp, et al. Am. J.Pathol., 2003, 162, 139). Интересно, что низкомолекулярный антагонист CCR2 также "притупляет" прогрессирование болезни у мышей C57BL/6 (С.М. Brodmerkel, et al. J. Immunol. 2005, 175, 5370). Известно, что МСР-1 активируется у пациентов, у которых после трансплантации легкого появляется синдром облитерирующего бронхиолита (Martine Reynaud-Gaubert, et al., J. of Heart and Lung Transplant, 2002, 21, 721-730; John Belperio, et al., J. Clin. Invest. 2001, 108, 547-556). У мышиной модели синдрома облитерирующего бронхиолита введение антитела к МСР-1 привело к уменьшению облитерации дыхательных путей; мыши CCR2-/- также были резистентны к облитерации дыхательных путей на этой же модели (John Belperio, et al., J. Clin. Invest. 2001, 108, 547-556). Эти данные заставляют предположить,что антагонизм МСР-1/CCR2 может быть благотворным при лечении отторжения органов после трансплантации. Кроме того, исследования показали, что нарушение связи MCP-1/CCR2 способно пролонгировать выживаемость трансплантата островков (I. Lee et al. J. Immunol. 2003, 171, 6929; R. Abdi et al., J.Immunol. 2004, 172, 767). На крысиных моделях трансплантатов было показано, что CCR2 и МСР-1 активируются в трансплантатах и развивается васкулопатия трансплантата (K. Horiguchi et al., J. Heart LungTransplant. 2002, 21, 1090). В другом исследовании генная анти-МСР-1 терапия уменьшает васкулопатию трансплантата (А. Saiura et al., Artherioscler. Thromb. Vasc. Biol. 2004, 24, 1886). В одном сообщении описывается ингибирование образования неоинтимы в экспериментальном трансплантате вены с помощью блокады МСР-1 (Н. Tatewaki et al., J. Vasc. Surg. 2007, 45, 1236). В других исследованиях продемонстрировано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении астмы. "Изоляция" МСР-1 с помощью нейтрализующего антитела у мышей, иммунизированных овальбумином, приводит к значительному уменьшению гипервосприимчивости и воспаления бронхов (Jose-Angel Gonzalo, et al., J. Exp. Med. 1998, 188, 157). Оказалось, что возможно уменьшить аллергическое воспаление дыхательных путей у мышей, иммунизированных яйцами Schistosoma mansoni (шистосомы Мансона) с помощью введения антител к МСР-1 (NicholasW. Lukacs, et al., J. Immunol. 1997, 158, 4398). В соответствии с этим у мышей МСР-1-/- наблюдался пониженный отклик на иммунизацию яйцами Schistosoma mansoni (Bao Lu, et al., J. Exp. Med. 1998, 187,601). В других исследованиях продемонстрировано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении заболевания почек. Введение антител к МСР-1 мышиной модели гломерулонефрита приводит к заметному уменьшению гломерулярного серповидного образования и отложения типа I коллагена (Clare M. Lloyd, et al., Exp. Med. 1997, 185, 1371). Кроме того, у мышей МСР-1-/- с индуцированным нефротоксическим сывороточным нефритом наблюдается значительно меньшее поражение канальцев, чем у их МСР-1+/+ аналогов (Gregory H. Tesch, et al., J. Clin. Invest. 1999,103, 73). В некоторых исследованиях продемонстрировано потенциальное терапевтическое значение антагонизма взаимодействия МСР-1/CCR2 при лечении системной красной волчанки. Мыши CCR2-/- проявляют пролонгированную выживаемость и меньшую заболеваемость почек по сравнению с их WT аналогами на мышиной модели системной красной волчанки (G. Perez de Lema, et al. J. Am. Soc. Neph. 2005, 16,3592). Эти данные согласуются с модифицирующей болезнь активностью, обнаруженной в недавних исследованиях генетической делеции МСР-1 (S. Shimizu, et al. Rheumatology (Oxford) 2004, 43, 1121;Gregory H. Tesch, et al., J. Exp. Med. 1999, 190, 1813) или введения пептидного антагониста CCR2(Н. Hasegawa, et al. ArthritisRheumatism, 2003, 48, 2555) на моделях волчанки у грызунов. Поразительное 30-кратное увеличение CCR2+ лимфоцитов собственной пластинки слизистой оболочки наблюдают в тонком кишечнике у пациентов с болезнью Крона по сравнению со здоровой подвздошной кишкой (S.J. Connor, et al. Gut, 2004, 53, 1287). Также следует отметить, что наблюдалось расширение субпопуляции циркулирующих CCR2+/CD14+/CD56+ моноцитов у больных активной формой болезни Крона по сравнению с контрольными. Некоторые исследования на грызунах продемонстрировали потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении болезни Крона/колита. Мыши CCR2-/- не были подвержены колиту, индуцируемому введением декстрана сульфата натрия (Pietro G. Andres, et al., J. Immunol. 2000, 164, 6303). Введение низкомолекулярного антагониста CCR2, CCR5 и CXCR3 (аффинность связывания у мышей 24, 236 и 369 нМ соответственно) также предупреждает заболевание колитом, индуцируемым декстраном сульфатом натрия (Н. Tokuyama,et al. Int. Immunol. 2005, 17, 1023). Наконец, у мышей МСР-1-/- наблюдается заметное меньшее поражение толстой кишки (как при макроскопическом, так и при гистологическом исследовании) на модели колита,вызванного гаптеном (W.I. Khan, et al. Am. J. Physiol. Gastrointest. Liver Physiol. 2006, 291, G803). В двух сообщениях описывается сверхэкспрессия МСР-1 в интестинальных эпителиальных клетках-4 014960 и в слизистой кишечника у пациентов с воспалительным заболеванием кишечника (Н.С. Reinecker, et al.,Gastroenterology 1995, 108, 40, Michael С. Grimm, et al., J. Leukoc. Biol. 1996, 59, 804). В одной работе описана связь полиморфизма промотора в МСР-1 гене со склеродермией (системный склероз) (S. Karrer et al., J. Invest Dermatol. 2005, 124, 92). У родственных моделей фиброза тканей ингибирование взаимодействия (связи) CCR2/MCP-1 снижает фиброз кожи (Т. Yamamoto and K.(S. Hayashidani et al., Circulation, 2003, 108, 2134) и печени (S. Tsurata et al., Int J. Mol. Med. 2004, 74, 837). В одном исследовании продемонстрировано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении альвеолита. Когда крысам с поражением легких, вызванных иммунным комплексом, содержащим IgA, вводят внутривенно антитела, специфические к крысиному МСР-1 (JE), симптомы альвеолита частично смягчаются (Michael L. Jones, et al., J. Immunol. 1992, 149,2147). В некоторых исследованиях продемонстрировано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении рака (обзор в М.J. Craig and R.D. Loberg, Cancer Metastasis Rev. 2006, 25, 611; I. Conti and B. Rollins, Seminars in Cancer Biology 2004, 14, 149; R. Giles and R.D.Loberg, Curr. Cancer Drug Targets, 2006, 6, 659). Когда иммунодефицитным мышам, несущим человеческие клетки карциномы молочной железы, вводят антитело против МСР-1, то наблюдают ингибирование микрометастазов в легких и повышение выживаемости (Rosalba Salcedo, et al., Blood, 2000, 96, 34-40). Используя клинические пробы опухоли, экспрессию CCR2 ассоциировали с прогрессированием рака простаты (Y. Lu, et al. J. Cell. Biochem. 2007, 101, 676). Показано, что экспрессия МСР-1 in vitro опосредует рост и инвазию раковых клеток простаты (Y. Lu, et al. Prostate, 2006, 66, 1311); кроме того, МСР-1,экспрессированный раковыми клетками простаты, индуцировал клетки-предшественники костного мозга человека для резорбции кости (Y. Lu, et al., Cancer Res. 2007, 67, 3646). В многочисленных работах описано потенциальное терапевтическое значение антагонизма взаимодействия MCP-1/CCR2 при лечении рестеноза. У людей уровни МСР-1 прямо коррелируют с риском возникновения рестеноза (F. Cipollone, et al. Arterioscler. Thromb. Vasc. Biol. 2001, 21, 327). У мышей,дефицитных по CCR2 или МСР-1, наблюдается уменьшение площади интимы и соотношение интима/среда (по сравнению с однопометными животными) после артериального поражения (Merce Roque, etBiochem Biophys Res. Commun. 2003, 310, 936). У мышей трансфекция доминантно-негативного ингибитора МСР-1 в скелетной мышце (K. Egashira, et al. Circ. Res. 2002, 90, 1167) также снижает гиперплазию интимы после артериального поражения. Блокада CCR2 с помощью нейтрализующего антитела снижает гиперплазию неоинтимы после стентирования (С. Horvath, et al. Circ. Res. 2002, 90, 488). В двух сообщениях описывается сверхэкспрессия МСР-1 крыс с индуцированной травмой головного мозга (J.S. King, et al., J. Neuroimmunol. 1994, 56, 127 и Joan W. Berman, et al., J. Immunol. 1996, 156,3017). Кроме того, исследования показали, что как мыши CCR2-/- (О.В. Dimitrijevic, et al. Stroke 2007, 38,1345), так и мыши МСР-1-/- (Р.М. Hughes, et al. J. Cereb. Blood Flow Metab. 2002, 22, 308) частично защищены от ишемического/реперфузионного поражения. Известно, что моноциты/макрофаги играют важную роль в появлении невропатической боли (LiuT., van Rooijen N., Tracey D.J., Pain, 2000, 86, 25). Недавно была описана потенциальная роль CCR2 в лечении как боли при воспалении, так и невропатической боли, согласующаяся с этой точкой зрения. У мышей CCR2-/-наблюдаются измененные реакции на боль при воспалении по сравнению с их WT аналогами, включая пониженные характеристики боли после интраплантарной (в подошву) инъекции формалина и немного уменьшенную механическую аллодинию после интраплантарной инъекции CFA (С.Abbadie, et al. Proc. Natl. Acad. Sci, USA 2003, 100, 7947). Кроме того, у мышей CCR2-/- не наблюдается значительной механической аллодинии после поражения седалищного нерва. Также низкомолекулярный антагонист CCR2 после перорального введения уменьшает механическую аллодинию до 80% от уровней перед поражением (С. Abbadie, J.A. Lindia, and H. Wang, Международная заявка PCT WO 110376,2004). В одной работе описана решающая роль МСР-1 при ишемической кардиомиопатии(N.G. Frangogiannis, et al., Circulation 2007, 115, 584). В другом исследовании описано ослабление экспериментальной сердечной недостаточности после ингибирования МСР-1 (S. Hayashidani et al., Circulation 2003, 108, 2134). В других работах приводится доказательство того, что МСР-1 сверхэкспрессируется при различных болезненных состояниях, не указанных выше. В этих сообщениях приводятся коррелятивные свидетельства того, что антагонисты МСР-1 могут применяться в качестве лекарственных препаратов при таких заболеваниях. В другом исследовании показана сверхэкспрессия МСР-1 в аллотрансплантатах сердца у грызунов, что наводит на мысль о роли МСР-1 в патогенезе артериосклероза трансплантата (Mary E. Russell, et al. Proc. Natl. Acad. Sci. USA, 1993, 90, 6086). Сверхэкспрессия МСР-1 отмечена в эндотелиальных клетках легких больных идиопатическим легочным фиброзом (Harry N. Antoniades, et al., Proc. Natl.Acad. Sci. USA, 1992, 89, 5371). Аналогично, сверхэкспрессию МСР-1 отмечают в коже больных псориазом (М. Deleuran, et al., J. Dermatol. Sci. 1996, 13, 228 и R. Gillitzer, et al., J. Invest. Dermatol. 1993, 101,127); также сообщались коррелятивные данные о доминировании CCR2+ клеток (С. Vestergaard, et al.(Alfredo Garzino-Demo, Международная патентная заявка WO 99/46991). Кроме того, было показано, что CCR2 полиморфизм ассоциируется с саркоидозом по меньшей мере в одной субпопуляции пациентов (P. Spagnolo, et al. Am J. Respir Crit Care Medium, 168, 1162). Следует также отметить, что CCR2 причастен как корецептор к некоторым штаммам ВИЧ (HIV)(В.J. Doranz, et al., Cell. 1996, 85, 1149). Также было определено, что применение CCR2 в качестве ВИЧ корецептором может коррелировать с прогрессированием заболевания (Ruth I. Connor, et al., J. Exp. Med. 1997, 185, 621). Это наблюдение согласуется с последними данными, что присутствие мутанта CCR2,CCR2-641, позитивно коррелирует с задержанным началом ВИЧ в человеческой популяции (Michael W.Smith, et al., Science, 1997, 277, 959). Хотя МСР-1 не участвует в этих процессах, может быть именно антагонисты МСР-1, которые действуют посредством связывания с CCR2, могут оказывать благотворное действие на замедление развития СПИДа у ВИЧ-инфицированных больных. Следует отметить, что CCR2 также является рецептором для человеческих хемокинов МСР-2, МСР 3 и МСР-4 (Luster, New Eng. J. Med. 1998, 338, 436-445). Так как соединения формулы I по данному описанию сопротивляются (антагонизируют) МСР-1, связываясь с CCR2 рецептором, вполне возможно, что эти соединения формулы I являются также антагонистами эффектов МСР-2, МСР-3 и МСР-4, которые опосредуется CCR2. Соответственно, когда дается ссылка на "антагонизм МСР-1", следует предположить, что это выражение эквивалентно "антагонизму стимуляции CCR2 хемокинами". Таким образом, показаны широкие возможности применения соединений, которые модулируют активность хемокинов, при лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. В опубликованной патентной заявке СШАWO 2005021500 А 1 (вводимой в данное описание в качестве ссылки и принадлежащей заявителю данной патентной заявки) раскрываются соединения, которые модулируют активность МСР-1, МСР-2, МСР-3 и МСР-4 посредством CCR2. В этом ссылочном материале также раскрываются различные способы получения этих соединений, включая многостадийные синтезы, которые включают введение и последующее снятие защитных групп. Необходимо найти новые соединения с улучшенными фармакологическими характеристиками по сравнению с известными модуляторами хемокинов. Например, желательно найти новые соединения с повышенной CCR2 ингибирующей активностью и селективностью к CCR2 по сравнению с другими сопряженными (связанными) с G-белком рецепторами (т.е. 5 НТ 2 А рецептором). Желательно также найти соединения с полезными и улучшенными характеристиками из одной или более из следующих групп:(а) фармацевтические свойства (т.е. растворимость, проницаемость, "податливость", пригодность для приготовления препаратов пролонгированного действия);(в) факторы, которые понижают характеристики концентрации в крови от максимума до минимума(г) факторы, которые повышают концентрацию активного лекарственного вещества в рецепторе(д) факторы, которые понижают предрасположенность к клиническим взаимодействиям лекарстволекарство (ингибирование или индукция фермента цитохром Р 450, такое как ингибирование CYP 2D6,см. статью G.K. Dresser, J.D. Spence, D.G. Bailey, Clin. Pharmacokinet. 2000, 38, 41-57, которая вводится в данное описание в качестве ссылки);(е) факторы, которые уменьшают возможность побочных эффектов (например, фармакологическая селективность вне связанных с G-белком рецепторов, потенциальная химическая или метаболическая реактивность, ограниченное проникновение в ЦНС (CNS), селективность в отношении ионных каналов). Особенно желательно найти соединения с нужной комбинацией вышеуказанных фармакологических характеристик. Также желательно включить в уровень техники новые и/или усовершенствованные способы получения таких соединений. Эти процессы можно охарактеризовать такими признаками, как, без ограничения, а) простая адаптация к более крупномасштабному производству, например на пилотном заводе или в промышленном масштабе; (б) стадии и/или методы процесса, позволяющие повысить чистоту (включая хиральную чистоту), стабильность и/или простоту обработки промежуточных (интермедиатов) и/или конечных соединений; и/или в) меньшее число стадий процесса.-6 014960 Сущность изобретения Настоящее изобретение включает новый антагонист или частичный агонист/антагонист МСР-1 рецепторной активности N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль, сольват или пролекарство, проявляющие неожиданное сочетание желательных фармакологических характеристик. Также охватываются кристаллические формы (соединений) по настоящему изобретению. Также целью данного изобретения являются фармацевтические композиции, содержащие эти соединения, и способы их применения в качестве агентов для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Настоящее раскрытие также включает способ получения соединений формулы I, включая N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамид представлены в данном описании. где R1, R8, R9, R10 и Также в данное описание включаются соединения, применимые в способе получения в качестве интермедиатов. Настоящее раскрытие включает также применение N-1R,2S,5R)-5-(изопропил(метил)амино)-2S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида или его фармацевтически приемлемой соли, сольвата или пролекарства для получения лекарственного препарата для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Краткое описание чертежей На фиг. 1 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, соли дибензолсульфокислоты, форма N-1. На фиг. 2 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма N-2. На фиг. 3 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма Е-1 (моноэтанолят). На фиг. 4 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, соли HCl, форма Н 4-1 (тетрагидрат). На фиг. 5 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма А-1 (ацетон моносольват). На фиг. 6 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма DC-1 (дихлорметан моносольват). На фиг. 7 представлены экспериментально полученные и моделированные порошковые рентгенограммыN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма AN-3 (ацетонитрил моносольват). На фиг. 8 представлены результаты анализа методом дифференциальной сканирующей калориметрииN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, дибезилата, форма N-1. На фиг. 9 представлены результаты термогравиметрического анализа N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, дибезилата, форма N-1. На фиг. 10 представлены результаты анализа методом дифференциальной сканирующей калори-7 014960 метрииN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма N-2. На фиг. 11 представлены результаты термогравиметрического анализа N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободного основания, форма N-2. На фиг. 12 представлена изотерма сорбции влаги N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания, форма N-2. На фиг. 13 изображена кристаллическая структура трет-бутил-(1R,2R,4S)-3-ацетамида-4-S)-3(бензилоксикарбониламино)-2-оксопирролидин-1-ил)циклогексил)карбамата. Фиг. 14 - модель 48-часового TG перитонита у мышей hCCR2 KI: ингибирование соединением из примера 1 инфильтрации моноцитами/макрофагами брюшной полости (дифференциальный подсчет клеток). Фиг. 15 - модель 48-часового TG перитонита у мышей hCCR2 KI: ингибирование соединением из примера 1 инфильтрации моноцитами/макрофагами брюшной полости (FACS анализ). Фиг. 16 - ЕАЕ у мышей hCCR2 KI: клинические показатели лечения соединением из примера 1. Подробное описание изобретения Настоящее изобретение включает новый антагонист или частичный агонист/антагонист МСР-1 рецепторной активности N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его фармацевтически приемлемую соль, сольват или пролекарство, проявляющие неожиданное сочетание нужных фармакологических характеристик. Также охватываются кристаллические формы (соединений) по настоящему изобретению. Также целью данного изобретения являются фармацевтические композиции, содержащие эти соединения, и способы их применения в качестве агентов для лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний. Настоящее раскрытие также включает способ получения соединений формулы I, включая N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамид где R1, R8, R9, R10 и представлены в данном описании. Также в данное описание включаются соединения, применимые в способе получения в качестве интермедиатов.N-1R,2S,5R)-5-(Изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамид неожиданно демонстрирует нужную комбинацию фармакологических характеристик, включая поразительно высокую степень биодоступности при пероральном введении в сочетании с показаниями, которые являются высокоэффективными и имеют прекрасные критерии безопасности. Известные модуляторы CCR2 рецепторов, такие как модуляторы, раскрываемые в патентной заявкеWO 2005021500 А 1, опубликованной 10 марта 2005 г. (патент США 7163937, выданный 16 января 2007 г., принадлежащий настоящему заявителю), которые показывают достаточную (отвечающую требованиям) мембранную проницаемость (решающий фактор биодоступности при оральном приеме), недостаточно эффективны, как показывает определение их CCR2-связывающей способности (меры эффективности), и/или у них отсутствуют подходящие критерии безопасности, на что указывает селективность ионных каналов, определяемая в исследованиях на hERG и Na+ ионных каналах. Напротив, как иллюстрируется данными, представленными в данном описании в разделе, озаглавленном "Сравнительные фармакологические характеристики", см. далее, относительно полярная молекула N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид демонстрирует поразительно высокую степень проницаемости мембран и в то же время сохраняет высокую CCR2 связывающую способность наряду с прекрасной селективностью ионных каналов. Соответственно настоящее изобретение включает новый модулятор хемокинов, имеющий улучшенные фармакологические характеристики, которые, как предполагают, должны быть пригодны при-8 014960 лечении воспалительных, аллергических, аутоиммунных, метаболических, раковых и/или сердечнососудистых заболеваний. Варианты изобретения В одном варианте изобретения раскрытие относится к N-1R,2S,5R)-5-(изопропил(метил)амино)-2S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамиду и его фармацевтически приемлемым солям. В другом варианте изобретения раскрывается N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2 оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид, свободное основание. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, причем кристаллическая форма представляет собой N2 форму. Другой вариант изобретения включает N-2 форму, характеризующуюся параметрами элементарной ячейки (или имеющую параметры элементарной ячейки), практически равными следующим. Размеры ячейки:a=11,8427(3),b=18,1503(7),с=12,7923(4),=90,=105,362(2),=90. Пространственная группа P21. Молекулы/элементарная ячейка 2,причем указанный кристалл находится при температуре примерно 22 С (RT). Другой вариант изобретения включает N-2 форму, характеризующуюся порошковой рентгенограммой (или имеющую порошковую рентгенограмму), содержащей три или более значений 2 (CuK=1,541 ), выбранных из 7,2; 8,7; 9,7; 12,5; 12,8; 13,3; 16,0; 16,6; 18,2 и 18,8, при температуре примерно 22 С. Другой вариант изобретения включает N-2 форму, характеризующуюся порошковой рентгенограммой (или имеющую порошковую рентгенограмму), дополнительно содержащей четыре или более значений 2 (CuK =1,541 ), выбранных из 7,2; 8,7; 9,7; 12,5; 12,8; 13,3; 16,0; 16,6; 18,2 и 18,8, при температуре примерно 22 С. Другой вариант изобретения включает N-2 форму, характеризующуюся относительными координатами атомов (или имеющую относительные координаты атомов), практически такими, которые приводятся в табл. 7. Другой вариант изобретения включает N-2 форму, характеризующуюся порошковой рентгенограммой (или имеющую порошковую рентгенограмму) практически в соответствии с фиг. 2. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, соль дибензолсульфокислоты, представляющую собой форму N-1, характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие, как приведенные в табл. 2, и/или порошковую рентгенограмму, практически соответствующую фиг. 1. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, представляющую собой форму Е-1 (моноэтанолят),характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4,или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие, как приведенные в табл. 5, и/или порошковую рентгенограмму, практически соответствующую фиг. 3. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, HCl соль, представляющую собой форму Н 4-1 (тетрагидрат), характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие,как приведенные в табл. 9, и/или порошковую рентгенограмму, практически соответствующую фиг. 4. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, представляющую собой форму А-1 (ацетон моносоль-9 014960 ват), характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие, как приведенные в табл. 6, и/или порошковую рентгенограмму практически соответствующую фиг. 5. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, представляющую собой форму DC-1 (дихлорметан моносольват), характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие, как приведенные в табл. 3, и/или порошковую рентгенограмму практически соответствующую фиг. 6. вариант изобретения включает кристаллическую форму(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, представляющую собой форму AN-3 (ацетонитрил моносольват), характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; относительные координаты атомов практически такие, как приведенные в табл. 8, и/или порошковую рентгенограмму, практически соответствующую фиг. 7. Другой вариант изобретения включает кристаллическую формуN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободное основание, представляющую собой форму ТНОО-1 (тетрагидрофуран моносольват), характеризующуюся тем, что имеет параметры элементарной ячейки, приведенные в табл. 1; 3, или 4, или более значений 2 (CuK =1,541 ), выбранных из табл. 10; и/или относительные координаты атомов практически такие, как приведенные в табл. 4. Другой вариант изобретения включает фармацевтическую композицию, содержащую фармацевтически приемлемый носитель и соединение из раздела "Примеры". Другой вариант изобретения включает способ модуляции активности хемокиновых рецепторов, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ модуляции CCR2 рецепторной активности, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ модуляции активности МСР-1, МСР-2, МСР-3, МСР 4 и МСР-5, которая опосредуется CCR2 рецептором, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ модуляции МСР-1 активности, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ лечения расстройств (нарушений), заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры", причем указанные расстройства (нарушения) выбирают из диабета, ожирения, метаболического синдрома, удара, невропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки, сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ассоциированной с ВИЧ деменции, идиопатического легочного фиброза, артериосклероза трансплантата, вызванной физическими или химическими причинами травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза, васкулита, нестабильных атероматозных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, гиперплазии неоинтимы трансплантата при диализе, гиперплазии интимы артериовенозного шунта, трансплантации органов, хронической нефропатии трансплантата и рака. Другой вариант изобретения включает способ лечения расстройств (нарушений), заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры", причем указанные расстройства (нарушения) выбирают из диабета, ожирения, болезни Крона, псориаза, идиопатического легочного фиброза, артериосклероза трансплантата, вызванной физическими или химическими причинами травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита,гломерулонефрита, астмы, рассеянного склероза, атеросклероза и ревматоидного артрита, рестеноза,трансплантации органов и рака. Другой вариант изобретения включает способ лечения расстройств (нарушений), заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из- 10014960 раздела "Примеры", причем указанные расстройства (нарушения) выбирают из диабета, ожирения, болезни Крона, системной красной волчанки, гломерулонефрита, рассеянного склероза, атеросклероза, рестеноза и трансплантации органов. Другой вариант изобретения включает способ лечения расстройств (нарушений), заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры", причем указанные расстройства (нарушения) выбирают из рассеянного склероза,болезни Крона и диабета. Другой вариант изобретения включает способ лечения расстройств (нарушений), заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры", причем указанные расстройства (нарушения) выбирают из рестеноза, трансплантации органов и рака. Другой вариант изобретения включает способ лечения диабета, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ лечения болезни Крона, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ лечения рассеянного склероза, причем способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ атеросклероза, причем способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела"Примеры". Другой вариант изобретения включает способ лечения рестеноза, причем способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из раздела "Примеры". Другой вариант изобретения включает способ лечения при трансплантации органов, причем способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из примера 1. Другой вариант изобретения включает способ лечения рака, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из примера 1. Другой вариант изобретения включает способ лечения рака, причем рак выбирают из рака молочной железы, рака печени, рака простаты и меланомы. Другой вариант изобретения включает способ лечения воспалительных заболеваний, аллергических, аутоиммунных, метаболических, раковых и/или сердечно-сосудистых заболеваний, заключающийся во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из примера 1. Другой вариант изобретения включает способ лечения заболеваний, которые, по меньшей мере,частично опосредуются CCR2, причем этот способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из примера 1. Другой вариант изобретения включает способ модуляции активности CCR2, причем этот способ заключается во введении нуждающемуся в этом пациенту терапевтически эффективного количества соединения из примера 1. Другой вариант изобретения включает соединение из примера 1 для приготовления лекарственного препарата для лечения диабета, ожирения, метаболического синдрома, удара, невропатической боли, ишемической кардиомиопатии, псориаза, гипертензии, склеродермии, остеоартрита, аневризмы, лихорадки,сердечно-сосудистого заболевания, болезни Крона, застойной сердечной недостаточности, аутоиммунных заболеваний, ВИЧ-инфекции, ассоциированной с ВИЧ деменции, идиопатического легочного фиброза, артериосклероза трансплантата, вызванной физическими или химическими причинами травмы головного мозга, воспалительного заболевания кишечника, альвеолита, колита, системной красной волчанки, нефротоксического сывороточного нефрита, гломерулонефрита, астмы, рассеянного склероза, атеросклероза,васкулита, нестабильных атероматозных бляшек, ревматоидного артрита, рестеноза, венозной неоинтимальной гиперплазии, гиперплазии неоинтимы трансплантата при диализе, гиперплазии интимы артериовенозного шунта, трансплантации органов, хронической нефропатии трансплантата и рака. Другой вариант изобретения включает соединение из примеров для применения в терапии. Данное изобретение может быть воплощено в других конкретных формах без отступления от его сущности и существенных особенностей. Данное изобретение также охватывает все комбинации альтернативных аспектов и вариантов изобретения, отмеченных в данном описании. Понятно, что все без исключения варианты изобретения могут применяться в сочетании с любым другим изобретением для описания дополнительных вариантов настоящего изобретения. Кроме того, предполагается, что любые элементы варианта изобретения можно объединять с любыми другими элементами из любых вариантов изобретения для описания дополнительных вариантов изобретения.- 11014960 Варианты способов изобретения В 1-м варианте изобретения раскрытие включает способ получения соединения формулы IV или его соли причем этот способ включает стадии: конденсацию -аминоэфира формулы II или его соли с защищенной соответствующим образом хиральной -аминокислотой формулы III с образованием амида IV (см. международную патентную заявкуWO 2005021500); где Ra и Rb, независимо, обозначают C1-6 алкокси; или Ra и Rb вместе с атомом углерода, с которым они связаны, образуют карбонил, тиокарбонил,циклический ацеталь или циклический тиоацеталь, причем циклический ацеталь или циклический тиоa T1, T2 и Т 3, в ацеталь выбирают из -O-Z-O- и -S-Z-S-, Z обозначает -(CT1T2)2-, -(CT1T2)3- или каждом случае независимо, выбирают из водорода, С 1-4 алкила, С 2-4 алкенила, галогена, гидрокси, циано,нитро, CF3, ОС 1-4 алкила, OCF3, С(=О)С 1-4 алкила и СО 2 С 1-4 алкила (предпочтительно T1, Т 2 и Т 3, каждый,обозначают водород);R1, R2 и R3, независимо, обозначают водород или аминозащитную группу, выбранную из карбобензилоксигруппы (Cbz), трет-бутилоксикарбонильной (ВОС) группы, флуоренилметилоксикарбонильной(FMOC) группы, бензильной (Bn) группы и п-метоксибензильной (РМВ) группы (предпочтительно аминозащитная группа представляет собой Cbz, Bn или ВОС, в особенности Cbz или Bn);R13 в каждом случае обозначает С 1-6 алкил или бензил, необязательно имеющий в качестве заместителя С 1-4 алкил, С 2-4 алкенил, галоген, гидрокси, циано, нитро, CF3, OC1-4 алкил, OCF3 и С(=О)С 1-4 алкил; иR14 в каждом случае обозначает водород, С 1-6 алкил или бензил, необязательно имеющий в качестве заместителя С 1-4 алкил, С 2-4 алкенил, галоген, гидрокси, циано, нитро, CF3, ОС 1-4 алкил, OCF3 и С(=О)С 1-4 алкил. Необязательно замещенный бензил по данному описанию обозначает бензильную группу, которая связана через свою метиленовую группу (-СН 2-) и необязательно имеет заместитель в своем фенильном кольце, связанном с метиленовой группой. Во 2-м варианте изобретения раскрытие включает способ получения продукта формулы IV или его соли, гдеRa и Rb вместе с атомом углерода, с которым они оба связаны, образуют карбонильную группу или 1,3-диоксолановую группу (предпочтительно Ra и Rb вместе с атомом углерода, с которым они оба связаны, образуют 1,3-диоксолановую группу);X обозначает ОН. В 3-м варианте изобретения раскрытие включает способ, отличающийся тем, что -аминоэфир формулы II представляет собой соль толуолсульфонат или гидробромид. Предпочтительной солью аминоэфира формулы II является толуолсульфонат В 4-м варианте изобретение включает способ получения соединения формулы IV или его соли, от- 12014960 личающийся тем, что конденсацию проводят в атмосфере инертного газа, такого как азот или аргон(предпочтительно азот), в апротонном растворителе, таком как пропионитрил, изопропилацетат, нбутилацетат, трет-бутилацетат или ацетонитрил (в особенности ацетонитрил и/или этилацетат). В 5-м варианте изобретение включает способ получения соединения формулы IV или его соли, отличающийся тем, что конденсацию проводят с помощью контактирования -аминоэфира формулы II с конденсирующим агентом диимидом в присутствии активатора, защищенного -аминоэфира формулы II и третичного амина основания. Конденсирующий агент диимид включает, например, такой реагент, какEDAC. Примеры активаторов (активирующих агентов) включают 1-гидроксибензотриазол (HOBt; указанный термин включает его гидраты) и N',N'-4-диметиламинопиридин. Третичный амин, основание,включает, например, триалкиламины, такие как триэтиламин, N-N-диизопропил-N-этиламин и три-нпропиламин. В 6-м варианте изобретение включает способ получения соединения формулы IV или его соли, отличающийся тем, что конденсирующий диимидный реагент представляет собой EDAC, активатор представляет собой HOBt, а третичный амин основание представляет собой триэтиламин или N-Nдиизопропил-N-этиламин. В 7-м варианте изобретение включает способ получения соединения формулы IV или его соли, отличающийся тем, что молярные отношения аминоэфир формулы II:диимидный конденсирующий агент:активатор:третичный амин составляют 1:примерно 0,90-1,50:примерно 0,95-1,50:примерно 2,003,00 соответственно. Предпочтительные указанные молярные отношения равны 1:примерно 0,951,05:примерно 0,95-1,10:примерно 2,10-2,30 соответственно. В 8-м варианте изобретение включает способ получения соединения формулы V или его соли причем способ включает стадии: а) алкилирование соединения формулы IV алкилирующим агентом с образованием активированного соединения и б) циклизация активированного соединения in situ с образованием соединения формулы IVa. В 9-м варианте изобретение включает способ получения соединения формулы V или его соли, отличающийся тем, что алкилирующий агент на стадии а) является агентом, алкилирующим атом серы,таким как C1-6 алкилгалогенид, а активированным соединением является сульфониевая соль соединенияIV, где Y обозначает S(C1-6 алкил)R12. Предпочтительно алкилирующий агент представляет собой метилиодид, а Y обозначает S(CH3)2. В 10-м варианте изобретение включает способ получения соединения формулы V или его соли, отличающийся тем, что стадия циклизации включает смешение активированного агента или его соли с основанием в присутствии растворителя. Основание выбирают из карбоната цезия, бикарбоната цезия, карбоната калия, трет-бутилата натрия или гексаметилдисилазида натрия (предпочтительно основание представляет собой бикарбонат цезия). В 11-м варианте изобретение включает способ получения соединения формулы V или его соли, отличающийся тем, что стадию циклизации проводят в атмосфере инертного газа, такого как азот или аргон, в растворителе, выбранном из ДМСО, ДМФА, ДМАА (DMA), N-метилпирролидон и сульфолан. Предпочтительно инертным газом является азот, а растворитель выбирают из ДМСО и/или ДМФА. В 12-м варианте изобретение, в котором соединение формулы IV содержит ацетальнную группу, а именно Ra и Rb, независимо, обозначают C1-6 алкокси или вместе с атомом углерода, с которым они связаны, Ra и Rb образуют циклический ацеталь или циклический тиоацеталь, включает способ получения соединения формулы V или его соли, дополнительно содержащий стадию гидролиза соединения формулы IVa, содержащего ацетальную группу с образованием соединения формулы V.- 13014960 Стадию гидролиза можно проводить методами гидролиза ацетальных групп, известными специалистам в данной области техники. Например, стадия гидролиза может включать обработку соединения формулы IVa в растворителе, таком как ацетон, бутанон, ацетонитрил или изопропанол или их водных растворах, кислотой. Предпочтительно стадия гидролиза содержит обработку соединения формулы IVa в растворе водного ацетона соляной кислотой. В 13-м варианте изобретение включает способ получения соединения формулы VI, содержащего сложноэфирную группу, или его соли причем этот способ включает стадии: восстановительного аминирования соединения формулы V амином формулы, NH(R8)(R9) с образованием имина/енамина формулы Va, где R8 и R9, независимо, выбирают из водорода и C1-6 алкила. Предпочтительно R8 и R9, независимо, выбирают из С 1-6 алкила. Более предпочтительно амин представляет собой N-метил-N-изопропиламин. В 14-м варианте изобретение включает способ получения продукта формулы VI, содержащий стадии восстановительного аминирования:(а) прибавление амина формулы NH(R8)(R9) и дегидратирующего агента к соединению формулы V в апротонном растворителе при температуре примерно от -20 до примерно 50 С с образованием имина/енамина формулы Va;(б) реакция имина/енамина формулы Va в присутствии платинового катализатора, 5% Pt/S/C, с водородом под давлением с образованием соединения VI. В 15-м варианте изобретение включает способ получения соединения формулы VI или его соли, отличающийся тем, что дегидратирующий агент на стадии а) представляет собой кислоту Льюиса/кислоту Бренстеда (предпочтительно тетраизопропоксид титана), а апротонный растворитель выбирают из дихлорэтана, дихлорметана (хлористого метилена), ацетонитрила, ДМСО, ДМФА и N-метилпирролидона(предпочтительно дихлорметана). В 16-м варианте изобретение включает способ получения соединения формулы VI или его соли, отличающийся тем, что на стадии б) катализатор, 5% Pt/S/C, присутствует в количестве примерно от 0,5 до 50% (вес./вес.) от веса соединения Va. Предпочтительно давление газообразного водорода равно 15-35psig (103,4-241,3 кПа). В 17-м варианте изобретение включает способ получения соединения формулы VII или его соли причем способ включает стадию гидролиза сложного эфира формулы VI с образованием кислоты формулы VII. Интервал температур составляет примерно от 40 до примерно 100 С (наиболее предпочтителен температурный интервал примерно 50-70 С). Кислоты выбирают из серной кислоты, толуолсульфокислоты, азотной кислоты, метансульфоновой кислоты, бромисто-водородной кислоты и хлористоводородной кислоты. Наиболее предпочтительна хлористо-водородная кислота. Предпочтительно стадию гидролиза проводят в водном растворе соляной (хлористо-водородной) кислоты, получая соединение формулы VII. В 18-м варианте изобретение включает способ получения соединения формулы VII, дополнительно содержащий стадию смешивания основания с раствором кислоты формулы VII, необязательно in situ. Предпочтительно основание представляет собой гидроксид щелочного металла, например гидроксид натрия. В 19-м варианте изобретение включает способ получения карбамата формулы VIII или его соли причем способ включает стадии: а) превращение кислоты формулы VII в изоцианат формулы VIIa и б) реакция изоцианата формулы VIIa со спиртом формулы R15OH с образованием карбамата формулы VIII; где R15 обозначает С 1-6 алкил или бензил, необязательно имеющий в качестве заместителя С 1-4 алкил,С 2-4 алкенил, галоген, гидрокси, циано, нитро, CF3, ОС 1-4 алкил, OCF3 и С(=О)С 1-4 алкил. ПредпочтительноR15 обозначает трет-бутил или незамещенный бензил. В 20-м варианте изобретение включает способ получения соединения формулы VIII или его соли перегруппировкой Курциуса, заключающийся в контактировании натриевой соли соединения формулыVII с азидом (предпочтительно дифенилфосфорилазидом) в растворителе (предпочтительно третбутиловом спирте), содержащем толуол, при температуре выше температуры инициации термической перегруппировки. Предпочтительно температура выше 50 С. В 21-м варианте изобретение включает способ получения соединения формулы IX или его соли причем данный способ включает стадии: а) превращение карбамата формулы VIII в промежуточный свободный амин и б) ацилирование промежуточного свободного амина in situ реагентом R10C(O)W с образованием соединения формулы IX; где R10, независимо, обозначает С 1-6 алкил или бензил, необязательно имеющий в качестве заместителя С 1-4 алкил, С 2-4 алкенил, галоген, гидрокси, циано, нитро, CF3, OC1-4 алкил, OCF3 и С(=О)С 1-4 алкил; иW обозначает галоген или R10C(O)-. Предпочтительно R10C(O)W представляет собой уксусный ангидрид. В 22-м варианте изобретение включает способ получения соединения формулы IX или его соли, отличающийся тем, что процесс (стадия) превращения включает стадии:a) обработка раствора соединения VIII кислотой иb) добавление основания к раствору с образованием промежуточного свободного амина. Предпочтительно кислоту выбирают из серной кислоты, толуолсульфокислоты, азотной кислоты,метансульфокислоты, бромисто-водородной кислоты и хлористо-водородной кислоты, более предпочтительно метансульфоновой кислоты. Предпочтительно основание представляет собой триалкиламин,предпочтительно триэтиламин. В 23-м варианте изобретение включает способ получения соединения формулы IX или его соли причем этот процесс включает стадию прибавления изоцианата формулы VIIa, необязательно insitu, к ацилирующему агенту, (R10C(O2O, в присутствии его соответствующей кислоты, R10C(O)OH, гдеR10, независимо, обозначает С 1-6 алкил или бензил, необязательно имеющий в качестве заместителя С 1-4 алкил, С 2-4 алкенил, галоген, гидрокси, циано, нитро, CF3, ОС 1-4 алкил, OCF3 и С(=О)С 1-4 алкил. Предпочтительно R10 обозначает C1-6 алкил, в особенности метил. В 24-м варианте изобретение включает способ получения соединения формулы X или его соли причем этот способ включает депротекцию (снятие защитной группы) защищенного амина формулы IX с образованием соединения формулы X. Предпочтительно, если R2 обозначает Cbz, депротекцию осуществляют гидрированием в присутствии палладиевого катализатора. Палладиевый катализатор предпочтительно представляет собой 10% Pd/C. В 25-м варианте изобретение включает способ получения соединения формулы I причем этот способ включает конденсацию соединения формулы X с соединением формулы получение соединения формулы I,где НЕТ обозначает необязательно замещенный 3-14-членный гетероцикл или гетероарильный цикл, содержащий от одного до четырех гетероатомов, выбранных из N, О или S (предпочтительно от одного до трех гетероатомов, в частности от одного до двух атомов азота), по меньшей мере в одном из циклов (НЕТ предпочтительно обозначает 6-замещенный хиназолин-4-ил, более предпочтительно 6 трифторметилхиназолин-4-ил);LG обозначает уходящую группу, выбранную из галогена или OSO2R16 (LG предпочтительно обозначает галоген, более предпочтительно хлор), где R16 обозначает C1-6 алкил, фенил, 5-7-членный гетероарил, содержащий один или более атомов, выбранных из N, S или О, или 3-7-членный циклоалкил,каждый из которых необязательно является замещенным (предпочтительно необязательные заместители в R16 представляют собой от одной до трех групп, выбранных из галогена, CF3 и C1-6 алкила). В 26-м варианте настоящее изобретение включает новый способ получения соединения формулы причем этот способ включает стадии: восстановительное аминирование соединения формулы V амином формулы NH(R8)(R9) с образованием соединения формулы VI, включающее стадии:(а) прибавление амина и дегидратирующего агента к соединению формулы V в апротонном растворителе при температуре примерно от -20 до примерно 50 С с образованием имина/енамина формулы Va;Pt/S/C, с водородом под давлением с образованием сложного эфира формулы VI; гидролиз сложного эфира формулы VI с образованием кислоты формулы VII; превращение кислоты формулы VII в изоцианат формулы VIIa; реакция изоцианата формулы VIIa со спиртом формулы R15OH с образованием карбамата формулыVIII; где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из карбобензилоксигруппы (Cbz), трет-бутилоксикарбонильной (ВОС) группы, флуоренилметилоксикарбонильной(FMOC) группы, бензильной (Bn) группы и п-метоксибензильной (РМВ) группы (предпочтительно аминозащитная группа представляет собой Cbz, Bn или ВОС, в особенности Cbz или Bn);R8 и R9, независимо, обозначают водород или C1-6 алкил;R15 обозначает трет-бутил или незамещенный бензил, более предпочтительно трет-бутил); НЕТ обозначает необязательно замещенный 3-14-членный гетероцикл или гетероарильный цикл,содержащий от одного до четырех гетероатомов, выбранных из N, О или S (предпочтительно от одного до трех гетероатомов, в частности от одного до двух атомов азота), по меньшей мере в одном из цикловLG обозначает уходящую группу, выбранную из галогена или OSO2R16 (LG предпочтительно обозначает галоген, более предпочтительно хлор), где R16 обозначает C1-6 алкил, фенил, 5-7-членный гетероарил, содержащий один или более атомов, выбранных из N, S или О, или 3-7-членный циклоалкил,каждый из которых необязательно является замещенным (предпочтительно необязательные заместители в R1 представляют собой от одной до трех групп, выбранных из галогена, CF3 и C1-6 алкила). В 27-м варианте настоящее изобретение включает новый способ получения соединения формулы I или его соли причем этот способ включает стадии: восстановительное аминирование соединения формулы V амином формулы NH(R8)(R9) с образованием соединения формулы VI, при этом восстановительное аминирование включает стадии:(а) прибавление амина и дегидратирующего агента к соединению формулы V в апротонном растворителе при температуре примерно от -20 до примерно 50 С с образованием имина/енамина формулы Va;Pt/S/C, с водородом под давлением с образованием сложного эфира формулы VI; гидролиз сложного эфира формулы VI с образованием кислоты формулы VII; превращение кислоты формулы VII в изоцианат формулы VIIa; реакция изоцианата формулы VIIa со спиртом формулы R15OH с образованием карбамата формулыVIII; превращение карбамата формулы VIII в промежуточный свободный амин; ацилирование промежуточного свободного амина in situ реагентом R10C(O)W с последующей депротекцией защищенного амина и образованием соединения формулы X; конденсация соединения формулы X с соединением формулы с образованием соединения формулы I; где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из карбобензилоксигруппы (Cbz), трет-бутилоксикарбонильной (ВОС) группы, флуоренилметилоксикарбонильной(FMOC) группы, бензильной (Bn) группы и п-метоксибензильной (РМВ) группы (предпочтительно аминозащитная группа представляет собой Cbz, Bn или ВОС, в особенности Cbz или Bn);R8 и R9, независимо, обозначают водород или C1-6 алкил;W обозначает галоген или R10C(O)-.R15 обозначает трет-бутил или незамещенный бензил, более предпочтительно трет-бутил); НЕТ обозначает необязательно замещенный 3-14-членный гетероцикл или гетероарильный цикл,содержащий от одного до четырех гетероатомов, выбранных из N, О или S (предпочтительно от одного до трех гетероатомов, в частности от одного до двух атомов азота), по меньшей мере в одном из цикловLG обозначает уходящую группу, выбранную из галогена или OSO2R16 (LG предпочтительно обозначает галоген, более предпочтительно хлор), где R16 обозначает С 1-6 алкил, фенил, 5-7-членный гетероарил, содержащий один или более атомов, выбранных из N, S или О, или 3-7-членный циклоалкил,каждый из которых необязательно является замещенным (предпочтительно необязательные заместители в R16 представляют собой от одной до трех групп, выбранных из галогена, CF3 и С 1-6 алкила). В 28-м варианте настоящее изобретение включает альтернативный новый способ получения соединения формулы I или его соли причем этот способ включает стадии: восстановительное аминирование соединения формулы V амином формулы NH(R8)(R9) с образованием соединения формулы VI, при этом восстановительное аминирование включает стадии:(а) прибавление амина и дегидратирующего агента к соединению формулы V в апротонном растворителе при температуре примерно от -20 до примерно 50 С с образованием имина/енамина формулы Va;Pt/S/C, с газообразным водородом под давлением с образованием сложного эфира формулы VI; гидролиз сложного эфира формулы VI с образованием кислоты формулы VII; превращение кислоты формулы VII в изоцианат формулы VIIa; прибавление изоцианата формулы VIIa, необязательно in situ, к ацилирующему агенту (R10aC(O)2) в присутствии соответствующей кислоты, R10aC(O)OH, с последующей депротекцией защищенного амина и образованием соединения формулы X;- 19014960 конденсация соединения формулы X с соединением формулы с образованием соединения формулы I; где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из карбобензилоксигруппы (Cbz), трет-бутилоксикарбонильной (ВОС) группы, флуоренилметилоксикарбонильной(FMOC) группы, бензильной (Bn) группы и п-метоксибензильной (РМВ) группы (предпочтительно аминозащитная группа представляет собой Cbz, Bn или ВОС, в особенности Cbz или Bn);R8 и R9, независимо, обозначают водород или C1-6 алкил; причем R10a, независимо, обозначает C1-6 алкил или необязательно замещенный бензил (предпочтительно R10a обозначает метил); НЕТ обозначает необязательно замещенный 3-14-членный гетероцикл или гетероарильный цикл,содержащий от одного до четырех гетероатомов, выбранных из N, О или S (предпочтительно от одного до трех гетероатомов, в частности от одного до двух атомов азота), по меньшей мере в одном из цикловLG обозначает уходящую группу, выбранную из галогена или OSO2R16 (LG предпочтительно обозначает галоген, более предпочтительно хлор), где R16 обозначает C1-6 алкил, фенил, 5-7-членный гетероарил, содержащий один или более атомов, выбранных из N, S или О, или 3-7-членный циклоалкил,каждый из которых необязательно является замещенным (предпочтительно необязательные заместители в R16 представляют собой от одной до трех групп, выбранных из галогена, CF3 и C1-6 алкила). В 29-м варианте настоящее изобретение включает способ получения по любому из предыдущих вариантов изобретения, отличающийся тем, что соединение формулы V представляет собой или его соль (предпочтительно натриевую соль); карбамат формулы VIII представляет собой или соль; защищенный амин формулы IX представляет собой или соль; депротекционированное соединение формулы X представляет собой или его соль; и соединение формулы I представляет собой N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2 оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамид или его соль. В 30-м варианте настоящее изобретение включает соединение формулы V или его соль где R1 и R2 обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R4 обозначает низший C1-6 алкил. Предпочтительным соединением формулы V является или его соль. В 31-м варианте настоящее изобретение включает соединение формулы VI или его соль где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R8 и R9, независимо, выбирают из водорода или C1-6 алкила. Предпочтительным соединением формулы VI является или его соль. В 32-м варианте настоящее изобретение включает соединение формулы VII или его соль где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R8 и R9, независимо, выбирают из водорода или C1-6 алкила. Предпочтительным соединением формулы VII является или его соль. Предпочтительные соли включают соли щелочных металлов, такие как натриевая соль соединения формулы VII. В 33-м варианте настоящее изобретение включает соединение формулы VIII или его соль где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R8 и R9, независимо, выбирают из водорода или С 1-6 алкила;R10 обозначает C1-6 алкил или бензил. Предпочтительным соединением формулы VIII является или его соль. В 34-м варианте настоящее изобретение включает соединение формулы IX или его соль где R1 и R2, независимо, обозначают водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R8 и R9, независимо, выбирают из водорода или С 1-6 алкила;R10 обозначает C1-6 алкил или необязательно замещенный бензил. Предпочтительным соединением формулы IX является или его соль. В 35-м варианте настоящее изобретение включает соединение формулы X или его соль- 23014960 где R1 обозначает водород или аминозащитную группу, выбранную из ВОС, Cbz или бензила;R8 и R9, независимо, выбирают из водорода или С 1-6 алкила;R10 обозначает С 1-6 алкил или необязательно замещенный бензил. Предпочтительным соединением формулы X является или его соль. В 36-м варианте настоящее изобретение включает соединение формулы II или его соль где Ra и Rb вместе с атомом углерода, с которым они оба связаны, образуют карбонильную группу или 1,3-диоксолановую группу (предпочтительно Ra и Rb вместе с атомом углерода, с которым они оба связаны, образуют 1,3-диоксолановую группу);R4 обозначает C1-6 алкокси. Предпочтительным соединением формулы II является или его соль. Предпочтительными солями являются толуолсульфонат или гидробромид, в особенности толуолсульфонат. В 46-м варианте настоящее изобретение включает способ получения соединения формулы I N1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида или его соли. Настоящее изобретение может быть воплощено в других конкретных формах, не отступая от его сущности или существенных особенностей. Таким образом, вышеприведенные варианты изобретения не следует рассматривать как ограничивающие. Все без исключения варианты изобретения могут применяться в сочетании с любым другим вариантом или любыми другими вариантами изобретения для описания дополнительных вариантов настоящего изобретения. Каждый отдельный элемент (например,предпочтительные или специальные аспекты) вариантов изобретения является его собственным независимым вариантом изобретения. Кроме того, предполагается, что любые элементы варианта изобретения следует объединять с любыми другими элементами из любых вариантов изобретения для описания дополнительного варианта изобретения. Кроме того, настоящее изобретение охватывает комбинации различных вариантов изобретения, частей вариантов изобретения, определений, описаний и примеров изобретения, отмеченных в данном описании. Определения Ниже приводятся определения терминов, употребляемых в данном описании и прилагаемой формуле изобретения. Если не указано иначе, первое определение, приведенное для группы или термина в данном описании, относится к этой группе в описании в целом и в терминах, индивидуально или как к части другой группы. Термин "алкил" относится к линейным или разветвленным углеводородным группам, содержащим 1-12 углеродных атомов, предпочтительно 1-6 углеродных атомов. Если цифра стоит после символа "С" в виде нижнего индекса, этот нижний индекс более конкретно определяет число углеродных атомов, которое может содержать конкретная группа. Например, "C1-6 алкил" относится к линейным или разветвленным алкильным группам, содержащим от одного до шести углеродных атомов, таким как метил, этил,- 24014960 н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Нижний индекс "0" относится к связи. Так,название гидрокси-С 0-2 алкил или С 0-2 гидроксиалкил включает гидрокси, гидроксиметил и гидроксиэтил. Алкильные группы могут быть замещенными, т.е. включать от одной до трех групп, выбранных из С 1-6 алкила, С 2-6 алкенила, гидрокси, галогена, циано, нитро, CF3, O(C1-6 алкила), OCF3, С(=О)Н,С(=О)(С 1-6 алкила), СО 2 Н, СО 2(С 1-6 алкила), NHCO2(С 1-6 алкила), -S(C1-6 алкила), NH2, NH(C1-6 алкила),N(С 1-6 алкила)2, N(CH3)3+, SO2(C1-6 алкила), C(=O)(С 1-4 алкилен)NH2, C(=O)(С 1-4 алкилен)NH(алкила),С(=О)(С 1-4 алкилен)N(С 1-4 алкила)2, С 3-7 циклоалкила, фенила, бензила, фенилэтила, фенилокси, бензилокси, нафтила, 4-7-членного гетероцикла и/или 5-6-членного гетероарила. Если замещенный алкил имеет в качестве заместителя арильную, гетероциклическую, циклоалкильную или гетероарильную группу, указанные циклические системы являются системами по определению ниже и, таким образом, могут иметь ноль, один, два или три заместителя, также по определению ниже. Если термин "алкил" применяется вместе с другой группой, например "арилалкил", это сочетание более конкретно определяет по меньшей мере один из заместителей, который содержит замещенный алкил. Например, "арилалкил" относится к замещенной алкильной группе по определению выше, в которой по меньшей мере один из заместителей представляет собой арил, такой как бензил. Так, термин"арил-С 0-4 алкил" включает замещенный низший алкил, содержащий по меньшей мере один арильный заместитель, а также включает арил, непосредственно связанный с другой группой, а именно арилС 0 алкил. Термин "алкенил" относится к линейной или разветвленной углеводородным группам, содержащим от 2 до 12 углеродных атомов и по меньшей мере одну двойную связь. Наиболее предпочтительными являются алкенильные группы из 2-6 углеродных атомов и имеющие одну двойную связь. Алкенильные группы могут быть замещенными, как описано выше для алкильных групп. Термин "алкинил" относится к линейной или разветвленной углеводородным группам, содержащим от 2 до 12 углеродных атомов и по меньшей мере одну тройную связь. Наиболее предпочтительными являются алкенильные группы из 2-6 углеродных атомов и имеющие одну тройную связь. Алкинильные группы могут быть замещенными, как описано выше для алкильных групп. Термин "алкилен" относится к двухвалентным линейным или разветвленным углеводородным группам, содержащим 1-12 атомов углерода, предпочтительно 1-8 углеродных атомов, например-СН 2-n, где n обозначает 1-12, предпочтительно 1-8. Наиболее предпочтительными являются алкиленовые группы из 1-2 углеродных атомов. Термины "алкенилен" и "алкинилен" относятся к двухвалентным радикалам алкенильной и алкинильной групп соответственно по определению выше. Алкениленовые группы могут быть замещенными,как определено выше для алкильных групп. Термин "алкокси" относится к атому кислорода, замещенному алкилом, по определению выше. Например, термин "алкокси" включает группу -О-С 1-6 алкил. Когда нижний индекс применяется в отношении алкокси, тиоалкильной или аминоалкильной групп, нижний индекс показывает число углеродных атомов, которые может содержать группа, помимо гетероатомов. Следует понимать, что специалист в данной области техники выбирает все группы, включая, например, алкокси, алкильную и аминоалкильную группу, таким образом, чтобы получить устойчивые соединения. Термин "карбонил" относится к двухвалентной карбонильной группе -С(=О)-. Термин "ацил" относится к карбонильной группе, связанной с органическим радикалом, более конкретно к группе C(=O)Re, а также к двухвалентной группе -C(=O)Re-, которые связаны с органическими радикалами. Группу Re можно выбрать из алкила, алкенила, алкинила, циклоалкила, гетероцикло или гетероарила по данному описанию или, когда это целесообразно, из соответствующей двухвалентной группы, например алкилена. Термин "циклоалкил" относится к полностью насыщенным и частично ненасыщенным углеводородным циклам (и, следовательно, включает "циклоалкенильные кольца") 3-9, предпочтительно 3-7 углеродных атомов. Термин "циклоалкил" включает такие циклы, имеющие ноль, один, два или три заместителя, выбранных из С 1-4 алкила, С 2-4 алкенила, гидрокси, галогена, циано, нитро, CF3, О(С 1-4 алкила),OCF3, С(=О)Н, С(=О)(С 1-4 алкила), СО 2 Н, СО 2(С 1-4 алкила), NHCO2(С 1-4 алкила), S(С 1-4 алкила), NH2,NH(С 1-4 алкила),N(С 1-4 алкил)2,N(С 1-4 алкила)3+,SO2(C1-4 алкила),С(=О)(С 1-4 алкилен)NH2,С(=О)(С 1-4 алкилен)NH(алкила) и/или С(=О)(С 1-4 алкилен)N(С 1-4 алкила)2. Термин "циклоалкил" также включает такие циклы, с которыми конденсирован второй цикл (например, включая бензольный, гетероцикло или гетероарильные циклы), или содержащие углерод-углеродный мостик, включающий 3-4 углеродных атома. Термин "галоид" или "галоген" относится к хлору, брому, фтору и йоду. Термин "галогеналкил" ("галоидалкил") означает замещенный алкил, имеющий один или более галоидных заместителей. Термин "галоидалкокси" или"галогеналкокси" означает алкоксигруппу, имеющую один или более галоидных заместителей. Например, "галоидалкокси" включает OCF3.- 25014960 Термин "гетероатомы" включает атомы кислорода, серы и азота. Термин "арил" относится к фенилу, бифенилу, флуоренилу, 1-нафтилу и 2-нафтилу. Термин "арил" включает такие циклы, имеющие ноль, один, два или три заместителя, выбранных из С 1-4 алкила, С 2-4 алкенила, галогена, гидрокси, циано, нитро, CF3, О(С 1-4 алкила), OCF3, С(=О)Н,С(=О)(С 1-4 алкила), СО 2 Н, СО 2(С 1-4 алкила), NHCO2(С 1-4 алкила), S(C1-4 алкила), NH2, NH(C1-4 алкила),N(С 1-4 алкила)2, N(С 1-4 алкила)3+, SO2(C1-4 алкила), С(=О)(С 1-4 алкилен)NH2, С(=O)(С 1-4 алкилен)NH(алкила) и/или C(=O)(C1-4 алкилен)N(С 1-4 алкила)2. Термины "гетероцикло" или "гетероциклический" относятся к замещенным и незамещенным неароматическим (которые могут быть полностью или частично насыщенными) 3-15-членным циклам, содержащим от одного до четырех гетероатомов. Такие циклы могут представлять собой 3-7-членные моноциклические группы, 7-11-членные бициклические группы и 10-15-членные трициклические группы. Каждый цикл гетероциклической группы, содержащей гетероатом, может содержать один или два атома кислорода или серы и/или от одного до четырех атомов азота при условии, что общее число гетероатомов в каждом цикле равно четырем или менее и что каждый цикл содержит по меньшей мере один углеродный атом. Конденсированные циклы, завершающие бициклическую или трициклическую группы,могут содержать только углеродные атомы и могут быть насыщенными, частично насыщенными или ненасыщенными. Атомы азота и серы могут, необязательно, быть окисленными, а атом азота может, необязательно, быть кватернизован. Гетероциклогруппы могут быть присоединены по любому подходящему азотному или углеродному атому. Гетероциклическое кольцо может содержать ноль, один, два или три заместителя, выбранных из C1-4 алкила, С 2-4 алкенила, галогена, гидрокси, циано, нитро, CF3,О(С 1-4 алкила), OCF3, С(=О)Н, С(=О)(С 1-4 алкила), СО 2 Н, СО 2(С 1-4 алкила), NHCO2(С 1-4 алкила),S(С 1-4 алкила),NH2,NH(С 1-4 алкила),N(С 1-4 алкила)2,N(С 1-4 алкила)3+,SO2(С 1-4 алкила),С(=О)(С 1-4 алкилен)NH2, С(=О)(С 1-4 алкилен)NH(алкила) и/или C(=O)(C1-4 алкилен)N(С 1-4 алкила)2. Примеры гетероциклических групп включают азетинидил, пирролидинил, оксетанил, имидазолинил, оксазолидинил, изоксазолинил, диазолидинил, изотиазолидинил, тетрагидрофуранил, пиперидил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидонил,тетрагидропиранил, морфолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, 1,3-диоксолан, хинуклидинил и тетрагидро-1,1-диоксотиенил и т.п. Термин "гетероарил" относится к замещенным и незамещенным 3-14-членным циклам, имеющим от одного до четырех гетероатомов, выбранных из О, S и N, по меньшей мере в одном цикле. Указанные циклы могут представлять собой 5- или 6-членные моноциклические группы, 9- или 10-членные бициклические группы и 11-14-членные трициклические группы. Каждый цикл гетероарильной группы, содержащей гетероатом, может содержать один или два атома кислорода или серы и/или от одного до четырех атомов азота при условии, что общее число гетероатомов в каждом цикле равно четырем или менее и что каждый цикл содержит по меньшей мере один углеродный атом. Конденсированные циклы,завершающие бициклическую или трициклическую группы, могут содержать только углеродные атомы и могут быть насыщенными, частично насыщенными или ненасыщенными. Атомы азота и серы могут,необязательно, быть окисленными, а атом азота может, необязательно, быть кватернизован. Гетероарильные группы, которые являются бициклическими или трициклическими, должны включать по меньшей мере один полностью ароматический цикл, но другой конденсированный цикл может быть ароматическим или неароматическим. Гетероарильная группа может быть присоединена по любому подходящему азотному или углеродному атому любого цикла. Гетероарильная циклическая система может содержать ноль, один, два или три заместителя, выбранных из C1-4 алкила, С 2-4 алкенила, галогена, гидрокси, циано, нитро, CF3, О(С 1-4 алкила), OCF3, С(=О)Н, С(=О)(С 1-4 алкила), СО 2 Н, СО 2(С 1-4 алкила),NHCO2(C1-4 алкила), S(C1-4 алкила), NH2, NH(C1-4 алкила), N(C1-4 алкила)2, N(С 1-4 алкила)3+, SO2(С 1-4 алкила),С(=О)(С 1-4 алкилен)NH2, С(=О)(С 1-4 алкилен)NH(алкила) и/или C(=O)(C1-4 алкилен)N(C1-4 алкила)2. Примеры гетероарильных групп включают пирролил, пиразолил, пиразолинил, имидазолил, оксахолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиенил, оксадиазолил, пиридил, пиразинил, пиримидинил, пирадазинил, триазинил, индолил, бензотиазолил, бензодиоксолил, бензоксазолил,бензотиенил, хинолинил, тетрагидроизохинолинил изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофуранил, хромонил, кумаринил, бензопиранил, цинналинил, хиноксалинил, индазолил,пирролопиридил, фуропиридил, дигидроизоиндолил, тетрагидрохинолинил и т.п. Особые гетероарильные группы включают, например, 6-замещенный хиназолин-4-ил и 6-трифторметилхиназолин-4-ил. Если группа является необязательно замещенной, она включает замещенные и незамещенные группы. Соединения по данному описанию могут иметь асимметрические центры. Соединения по настоящему изобретению, содержащие асимметрически замещенный атом, можно выделять в оптически активной или в рацемической формах. В уровне техники хорошо известно, как получать оптически активные формы, например, разделением (разрешением) рацемических форм или синтезом из оптически активных исходных. Многие геометрические (пространственные) изомеры олефинов, соединений с C=N двойными связями и т.п. также могут присутствовать в соединениях по данному описанию, и все такие изомеры рассматриваются в данном изобретении. Описаны цис- и трансгеометрические изомеры соединений по- 26014960 настоящему изобретению, и они могут быть выделены в виде смеси изомеров или в виде отдельных изомерных форм. Предполагаются все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы, если особо не указывается конкретная стереохимия или изомерная форма. Один энантиомер соединений по данному описанию может проявлять повышенную активность по сравнению с другими. Таким образом, рассматривается, что все стереоизомеры являются частью настоящего изобретения. При необходимости разделение рацемата можно проводить методом ВЭЖХ с применением хиральной колонки или разделять с применением агента для разделения, такого как хлорангидрид камфоновой кислоты (камфонилхлорид) в статье Steven D. Young et al., Antimicrobial Agents andChemotherapy, 1995, 2602-2605. Выражение "фармацевтически приемлемый" употребляется по данному описанию в отношении тех соединений, материалов, композиций и/или лекарственных форм, которые, по мнению компетентого медика, пригодны для применения в контакте с тканями человека и животных, не вызывая чрезмерной токсичности, раздражения, аллергического ответа или другого затруднения или осложнения, сопоставимых с соотношением польза/риск. Выражение "фармацевтически приемлемые соли" по данному описанию относится к производным раскрытых соединений, причем исходное соединение модифицируется превращением в его кислую или основную соль. Примеры фармацевтически приемлемых солей включают, но без ограничения, соли минеральных или органических солей основных остатков, таких как амины; щелочные или органические соли кислых остатков, такие как карбоновые кислоты, и т.п. Фармацевтически приемлемые соли включают традиционные нетоксические соли или четвертичные аммониевые соли исходного соединения, образующиеся, например, из нетоксических неорганических или органических кислот. Например, такие традиционные (обычные) нетоксические соли включают соли, образующиеся из неорганических кислот,таких как хлористо-водородная, бензолсульфоновая, бромисто-водородная, серная, сульфаминовая, фосфорная, азотная и т.п.; и соли, получающиеся из органических кислот, таких как уксусная, пропионовая,янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая,2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изетионовая и т.п. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, которое содержит основной или кислый фрагмент, обычными химическими методами. Обычно такие соли можно получать реакцией свободной кислой или основной форм этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе или в их смеси; обычно предпочтительными являются неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечень подходящих солей представлен в Remington'sPharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, раскрытие этой монографии вводится в данное описание в качестве ссылки. Так как известно, что пролекарство повышает различные нужные свойства фармацевтических препаратов (например, растворимость, биодоступность, производство), соединения по настоящему изобретению можно доставлять в виде пролекарства. Поэтому предполагается, что настоящее изобретение охватывает пролекарства заявляемых в данном изобретении соединений, способы их доставки и содержащие их композиции. Предполагается, что "пролекарства" включают любые ковалентно связанные носители, которые высвобождают активное исходное пролекарство по настоящему изобретению in vivo, когда такое пролекарство вводят млекопитающему. Пролекарства в настоящем изобретении получают, модифицируя функциональные группы соединения таким образом, что модификации расщепляются либо при обычной обработке, либо in vivo до исходного соединения. Пролекарства включают соединения по настоящему изобретению, в которых гидрокси, амино или сульфгидрильная группа связана с любой группой, когда пролекарство по настоящему изобретению вводят млекопитающему, оно расщепляется с образованием свободной гидроксильной, свободной амино или свободной сульфгидрильной группы соответственно. Примеры пролекарств включают, но без ограничения, ацетат, формиат и бензоат спирта и соединения по изобретению с функциональными аминогруппами."Стабильное соединение" и "стабильная структура" обозначают соединение, которое является достаточно объемным для того, чтобы его можно было подвергать выделению из реакционной смеси с достаточной степенью чистоты и получать на его основе эффективный терапевтический агент. Данное изобретение охватывает стабильные соединения."Терапевтически эффективное количество" обозначает такое количество соединения по изобретению, или такое количество комбинаций заявленных соединений, или такое количество соединения по изобретению в комбинации с другими активными соединениями, которые эффективны для ингибирования МСР-1 или эффективны для лечения или профилактики расстройств, указанных в данном патенте. Используемые в данном изобретении термины " лечение" или "излечение" охватывают лечение болезненного состояния у млекопитающего, особенно у человека, и включают: (а) профилактику болезненного состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к возникновению такого болезненного состояния, но диагноз еще не был установлен; (б) ингибирование болез- 27014960 ненного состояния, т.е. остановку его развития; и/или (в) облегчение болезненного состояния, т.е. регрессию болезненного состояния. Названия, используемые в данном изобретении для указания конкретной формы, например "N-2",не должны рассматриваться как ограничивающие изобретение по отношению к любому другому веществу, имеющему похожие или идентичные физические и химические свойства, их скорее следует понимать как простое указание соединения, которое следует интерпретировать в соответствии с информацией о его характеристике, также данной в описании. Данное изобретение предусматривает кристаллические формы свободного основания N1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида в качестве нового соединения, в особенности в виде фармацевтически приемлемой формы. Согласно некоторым предпочтительным вариантам кристаллические формы свободного основания находятся практически в чистом виде. Предпочтительные варианты свободного основания описаны в примерах как N-2, DC-1, ТНОО-1, Е-1, А-1 и AN-3. Данное изобретение предусматривает также кристаллические формы солей N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида в качестве нового соединения, в особенности в виде фармацевтически приемлемой формы. Согласно некоторым предпочтительным вариантам кристаллические формы солей находятся практически в чистом виде. Предпочтительные варианты солей описаны в примерах как N-1 форма соли дибензосульфокислоты и H4-1 форма гидрохлорида. Используемый в данном патенте термин "полиморф" относится к кристаллическим формам, имеющим один и тот же химический состав, но разное пространственное расположение молекул, атомов и/или ионов, образующих кристалл. Термин "сольват" относится к кристаллической форме молекулы, атома и/или ионов, которая дополнительно содержит молекулы растворителя или растворителей, включенных в кристаллическую структуру. Молекулы растворителя в сольвате могут располагаться упорядоченно и/или хаотично. Сольват может содержать стехиометрическое или нестехиометрическое количество молекул растворителя. Например, сольват с нестехиометрическим количеством молекул растворителя может образоваться в результате частичной потери растворителя сольватом. Используемый термин "аморфная" относится к твердой форме молекулы, атома и/или ионов, которая не является кристаллической. Аморфное твердое вещество не характеризуется определенной рентгеновской дифрактограммой. Термин "практически чистая", когда он используется по отношению к кристаллической форме, означает соединение, имеющее степень чистоты более 90 вес.%, включая степень чистоты более 90, 91, 92,93, 94, 95, 96, 97, 98 и 99 вес.%, а также степень чистоты, равную примерно 100 вес.% (соединения 1) в расчете на вес соединения. Остаток представляет собой другую(ие) форму(ы) соединения и/или примеси,образовавшиеся в процессе реакции, и/или примеси, добавленные в процессе получения соединения. Например,кристаллическая формаN-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6(трифторметил)хиназолин-4-иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания или соли может считаться практически чистой, если степень чистоты составляет более 90 вес.%, при этом она измерена средствами, которые в настоящее время являются известными и общепринятыми, а остаток, составляющий менее 10 вес.%, представляет собой другую(ие) форму(ы) N-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободного основания или соли и/или примеси, образовавшиеся в процессе реакции, и/или примеси, добавленные в процессе получения соединения. Образцы кристаллических форм могут быть получены с практически чистой гомогенной фазой, что указывает на наличие преобладающего количества одной кристаллической формы и, возможно, небольших количеств одной или более других кристаллических форм. Наличие более чем одной кристаллической формы в образце может быть определено такими методами, как порошковая рентгеновская дифракция (PXRD) или ядерно-магнитная резонансная спектроскопия (SSNMR). Например, наличие экстрапиков при сравнении экспериментально полученной PXRD дифрактограммы с моделью PXRD дифрактограммы может показывать на наличие более чем одной кристаллической формы в образце. Имитированная PXRD может быть рассчитана, исходя из данных рентгенограммы единичного кристалла, см. Smith,D.K., "A FORTRAN Program for Calculating X-Ray Powder Diffraction Patterns", Lawrence Radiation Laboratory, Livermore, California, UCRL-7196 (April 1963). Предпочтительно, когда кристаллическая форма обладает практически чистой гомогенной фазой, о чем свидетельствует величина, составляющая менее 10%, предпочтительно менее 5% и более предпочтительно менее 2%, от общей площади пиков на экспериментально полученной PXRD дифрактограмме,получаемая для экстрапиков, которые отсутствуют на модели PXRD дифрактограммы. Более предпочтительной является кристаллическая форма, у которой практически чистая гомогенная фаза составляет менее 1% от общей площади пика на экспериментально полученной PXRD дифрактограмме, рассчитанная для экстрапиков, которые отсутствуют на модели PXRD дифрактограммы. Способы получения кристаллических форм известны из уровня техники. Кристаллические формы- 28014960 могут быть получены различными методами, включая кристаллизацию или перекристаллизацию из подходящего растворителя, возгонку, выращивание из расплава, получение твердой фазы из другой фазы,кристаллизацию из сверхкритической жидкости и струйное распыление. Методы кристаллизации или перекристаллизации кристаллических форм из смеси растворителей включают, например, выпаривание растворителя, уменьшение температуры смеси растворителей, затравку кристаллами соединения и/или его соли в сверхнасыщенной смеси растворителей, сушку при замораживании смеси растворителей и добавление антирастворителей (противорастворителей) к смеси растворителей. Полученные формы могут быть охарактеризованы и определены методом рентгеновской дифракции единичного кристалла, который основан на измерении кристаллической решетки единичного кристалла формы при фиксированной температуре определения. Подробное описание элементарных ячеек приведено в руководстве StoutJensen, X-Ray Structure Determination: A Practical Guide, Macmillan Co.,New York (1968), Chapter 3, которое включено в данное изобретение в качестве ссылки. Альтернативно уникальное расположение атомов в пространстве кристаллической решетки может быть охарактеризовано фракционными атомными координатами. Другим средством характеристики кристаллической структуры является порошковая рентгеновская дифракция, когда экспериментальный или наблюдаемый профиль дифракции сравнивается с имитированным профилем, характеризующим чистый порошковый материал, причем оба профиля получают при одной и той же температуре и данные для кристаллической формы по изобретению получаются в виде ряда величин . Можно также использовать другие средства характеристики формы, такие как ядерно-магнитный резонанс в твердом состоянии (SSNMR), дифференциальная сканирующая калориметрия и термогравиметрический анализ. Эти параметры могут быть также использованы в комбинации для того, чтобы охарактеризовать форму по изобретению. Термин "незначительная потеря веса", применяемый в данном описании при осуществлении TGA,означает наличие чистой (несольватированной) кристаллической формы. Термин "незначительное поглощение воды в %", используемый в данном описании, при описании изотермы влага-сорбция показывает, что испытуемая форма не является гигроскопичной. Согласно одному варианту изобретения кристаллическая формаN-1R,2S,5R)-5(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4-иламино)пирролидин-1 ил)циклогексил)ацетамида, свободного основания или соли получается практически в чистом виде. Эта кристаллическая форма может быть использована в фармацевтических композициях, которые могут включать один или более других компонентов, выбранных, например, из группы, состоящей из эксципиентов, носителей, и одного из других активных фармацевтических ингредиентов или активных химических соединений с другими молекулярными структурами. Предпочтительно, когда кристаллическая форма обладает практически чистой гомогенной фазой, о чем свидетельствует величина, составляющая менее 10%, предпочтительно менее 5% и более предпочтительно менее 2% от общей площади пиков на экспериментально полученной PXRD дифрактограмме,получаемая для экстрапиков, которые отсутствуют на модели PXRD дифрактограммы. Более предпочтительной является кристаллическая форма, у которой практически чистая гомогенная фаза составляет менее 1% от общей площади пика на экспериментально полученной PXRD дифрактограмме, рассчитанная для экстрапиков, которые отсутствуют на модели PXRD дифрактограммы. Согласно другому варианту предусмотрена композиция, практически состоящая из кристаллических форм N-1R,2S,5R)-5-(изопропил(метил)амино)-2-S)-2-оксо-3-(6-(трифторметил)хиназолин-4 иламино)пирролидин-1-ил)циклогексил)ацетамида, свободного основания или соли. Композиция согласно этому варианту может содержать по меньшей мере 90 вес.% формы в расчете на вес композиции. Наличие примесей, образовавшихся в ходе реакции, и/или примесей, добавляемых в процессе получения, может быть определено известными аналитическими методами, такими как, например, хроматография, ядерно-магнитная резонансная спектроскопия, масс-спектрометрия или инфракрасная спектроскопия. Кристаллические формы могут быть получены различными способами, включая кристаллизацию или перекристаллизацию из подходящего растворителя, возгонку, выращивание из расплава, получение твердой фазы из другой фазы, кристаллизацию из сверхкритической жидкости и струйное распыление. Методы кристаллизации или перекристаллизации кристаллических форм из смеси растворителей включают, например, выпаривание растворителя, уменьшение температуры смеси растворителей, затравку кристаллами соединения и/или его соли в сверхнасыщенной смеси растворителей, сушку при замораживании смеси растворителей и добавление антирастворителей (противорастворителей) к смеси растворителей. Для получения кристаллических форм, включая полиморфы, можно применять методы кристаллизации с высоким выходом. Кристаллическая форма лекарств, включая полиморфы, способы получения и характеристика кристаллов обсуждаются в Solid-State Chemistry of Drags, S.R. Byrn, R.R. Pfeiffer, and J.G. Stowell, 2ndEdition, SSCI, West Lafayette, Indiana (1999). В случае методов кристаллизации, которые используют растворители, выбор растворителя или растворителей обычно зависит от одного или более факторов, таких как растворимость соединения, метод
МПК / Метки
МПК: C07D 207/273, C07D 317/72, C07D 403/12, A61K 31/4025
Метки: получения, активности, способ, рецепторов, модуляторы, формы, кристаллические, хемокиновых
Код ссылки
<a href="https://eas.patents.su/30-14960-modulyatory-aktivnosti-hemokinovyh-receptorov-ih-kristallicheskie-formy-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы активности хемокиновых рецепторов, их кристаллические формы и способ их получения</a>
Предыдущий патент: Ингибиторы глицинового переносчика-1
Следующий патент: Фармацевтические композиции, включающие леветирацетам, и способы их получения
Случайный патент: Загрузочное устройство для распределения сыпучего материала