Трициклические соединения, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 14672
Опубликовано: 30.12.2010
Авторы: Ле-Дигаре Тьерри, Хикман Джон, Женесте Оливье, Касара Патрик
Формула / Реферат
1. Соединения формулы (I)
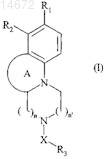
в которой А представляет собой 5-, 6- или 7-членное ароматическое или неароматическое кольцо, которое может содержать 1 или 2 гетероатома, выбранных из кислорода, серы и азота, где атом азота может быть замещен линейной или разветвленной (С1-С6)алкильной группой, причем кольцо А, определенное таким образом, не может содержать 2 атома серы или 2 атома кислорода и одним из кольцевых членов может быть С=О группа,
n и n', которые могут быть одинаковыми или разными, представляют собой 0, 1 или 2, где 0<n+n'<4,
R3 представляет собой арильную или гетероарильную группу,
X представляет собой линейную или разветвленную алкиленовую цепь, содержащую 1-6 атомов углерода, один или два из этих атомов углерода могут быть заменены атомом кислорода, циклоалкиленовой группой, ариленовой группой, гетероариленовой группой или SO2группой,
одна из групп R1 и R2представляет собой атом водорода и другая представляет собой группу формулы (II)
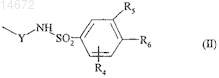
в которой Y представляет собой С=О или CH2 группу,
R5 представляет собой атом водорода, в этом случае R6 представляет собой атом водорода или -NR7R'7 или
-CH2-NR7R'7 группу, где каждый из R7 и R'7, которые могут быть одинаковыми или разными, независимо друг от друга представляют собой атом водорода или линейную или разветвленную (С1-С6)алкильную группу, замещенную одной или несколькими арильными, гетероарильными, арилокси, гетероарилокси, арилтио, гетероарилтио, гетероциклоалкильными или -NR10R'10 группами, где
R10 и R'10, которые могут быть одинаковыми или разными, выбраны из водорода, линейного или разветвленного (С1-С6)алкила, линейного или разветвленного (С1-С6)алкокси, арила и гетероарила или
R10 и R'10 образуют насыщенную или ненасыщенную циклическую или бициклическую группу, которая может быть замещена гетероатомом, выбранным из кислорода, азота и серы, и один или несколько кольцевых членов могут представлять собой С=О группу или могут быть замещены, как указано при определении гетероциклоалкила ниже,
или R5и R6 образуют с двумя атомами углерода, к которым они присоединены, ароматическое или неароматическое кольцо, содержащее 5 или 6 кольцевых членов, один атом азота которого находится в пара-положении по отношению к SO2 группе, и которое может содержать дополнительно к атому азота другой атом азота и/или SO2 группу, причем кольцо замещено R7 группой, как определено выше,
R4 представляет собой атом галогена или NO2, R8, SO2-R9, линейную или разветвленную (С1-С6)алкильную или линейную или разветвленную (C1-С6)алкоксигруппу, где R8 может иметь любые из значений R7, как определено выше,
R9 представляет собой аминогруппу или линейную или разветвленную (С1-С6)алкильную группу, необязательно замещенную одним или несколькими атомами галогена,
где "арил" представляет собой фенильную, нафтильную или бифенильную группу,
"гетероарил" представляет собой любую моно- или бициклическую группу, имеющую по меньшей мере одну ароматическую часть и содержащую от 5 до 10 кольцевых членов, которая может содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, такие группы, как фуран, тиофен, пиррол, имидазолин, пиридин, хинолин, изохинолин, хроман, индол, бензтиофен, бензофуран, 1,3-бенздиоксол и 2,3-дигидро-1,4-бенздиоксин,
"гетероциклоалкил" представляет собой любую моно- или бициклическую неароматическую группу, содержащую от 4 до 10 кольцевых членов, которая может содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота,
"циклоалкил" представляет собой любую моно- или бициклическую неароматическую группу, содержащую от 4 до 10 кольцевых членов,
арильная, гетероарильная, гетероциклоалкильная и циклоалкильная группы, определенные таким образом, могут быть замещены от 1 до 3 групп, выбранных из линейного или разветвленного (С1-С6)алкила, необязательно замещенного гидрокси или аминогруппой, линейного или разветвленного (С1-С6)алкокси, гидрокси, карбокси, формила, нитро, циано, амино, линейного или разветвленного полигало(С1-С6)алкила, алкоксикарбонила и атомов галогена,
"арилен", "гетероарилен" и "циклоалкилен" представляют собой соответственно арильную, гетероарильную или циклоалкильную группы, как определено выше, заменяющие атом углерода алкиленовой цепи,
их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
2. Соединения формулы (I) по п.1, где Y представляет собой С=О группу, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, где n и n' представляют собой 1, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, где R4 представляет собой NO2или SO2-CF3группу, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, где Х-R3 представляет собой ([1,1'-бифенил]-2-ил)метильную группу, необязательно замещенную одной или несколькими группами, выбранными из галогена, циано, амино, аминометила и трифторметила, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, где R5 представляет собой атом водорода, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
7. Соединение формулы (I) по п.1, где R7 представляет собой 1-(N,N-диметиламино)-4-(фенилсульфанил) бутан-3-ильную группу, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, где R7 представляет собой 1-(NR10R'10)-4-(фенилсульфанил)-бутан-3-ильную группу, R10 и R'10 образуют насыщенную или ненасыщенную циклическую или бициклическую группу, необязательно замещенную гетероатомом, выбранным из кислорода, азота и серы, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по п.1, где R'7представляет собой атом водорода, их энантиомеры и диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I), которые представляют собой
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(10аa)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10а-гексагидропиразино[1,2-а]индол-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(10аb)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10а-гексагидропиразино[1,2-а]индол-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(10аa)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10а-гексагидропиразино[1,2-а]индол-8-ил}карбонил)-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(10аa)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10a-гексагидропиразино[1,2-а]индол-8-ил}карбонил)-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-[(трифторметил) сульфонил]бензолсульфонамид,
N-[((4aR)-3-{[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропил} амино)-3-[(трифторметил)сульфонил]бензолсульфонамид,
N-[((10аb)-2-{[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил}-1,2,3,4,10,10а-гексагидропиразино[1,2-а]индол-8-ил)карбонил]-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил) метил]пропил}амино)-3-[(трифторметил)сульфонил]бензолсульфонамид,
N-[((4aR)-3-{[4-(4-хлорфенил)-3-пиридил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-2-(диметиламино)-1-[(фенилсульфанил)метил]этил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4-амино-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-[((4aR)-3-{[4-(аминометил)-4'-хлор-[1,1'-бифенил]-2-ил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид тригидрохлорид,
N-[((4aR)-3-{[3'-фтор-4'-хлор-[1,1'-бифенил]-2-ил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-[((4aR)-3-{[4'-(трифторметил)-[1,1'-бифенил]-2-ил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-[((4aR)-3-{[4'-циано-[1,1'-бифенил]-2-ил]метил}-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[2-(1,3-бенздиоксол-5-ил)бензил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-ил}карбонил)-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-[(трифторметил) сульфонил]бензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(4-метил-1-пиперазинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(1-пиперидил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(1-пирролидинил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-ил}карбонил)-4-({(1R)-3-(3,6-дигидро-1(2H)-пиридил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(1-азепанил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-((1R,5S)-3-азабицикло[3,1,0]гекс-3-ил)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид,
и их соли присоединения с фармацевтически приемлемой кислотой или основанием.
11. Соединение формулы (I) по п.1, которое представляет собой N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид, и его соли присоединения с фармацевтически приемлемой кислотой или основанием.
12. Соединение формулы (I) по п.1, которое представляет собой N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид бис-(гидрохлорид).
13. Соединение формулы (I) по п.1, которое представляет собой N-({(4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил}карбонил)-4-({(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил}амино)-3-нитробензолсульфонамид натрия.
14. Способ получения соединения формулы (I), характеризующийся тем, что в качестве исходного вещества используют соединение формулы (III)
![]()
где Y имеет значение, указанное для формулы (I), и Су представляет собой конденсированную трициклическую систему формулы (IV)
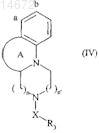
где А, X, n, n' и R3имеют значения, указанные для формулы (I), -Y-Cl группа присоединена в а или b положении трициклической системы,
где соединение формулы (III) конденсируют в щелочной среде в присутствии или отсутствии связующего вещества с соединением формулы (V)
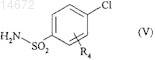
где R4имеет значение, указанное для формулы (I),
c получением соединения формулы (VI)
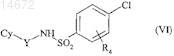
где Су, Y и R4имеют значения, указанные выше,
которое конденсируют с соединением формулы HNR7R'7, где R7и R'7имеют значения, указанные для формулы (I), получая соединение формулы (I/а), частный случай соединения формулы (I)
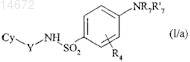
где Су, Y, R4, R7 и R'7 имеют значения, указанные выше,
которое может быть очищено обычными способами разделения, которое превращают, если это желательно, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое необязательно разделяют на его изомеры обычными способами разделения.
15. Способ получения соединения формулы (I), характеризующийся тем, что в качестве исходного вещества используют соединение формулы (III')
![]()
где Y имеет значение, указанное для формулы (I), и Су представляет собой конденсированную трициклическую систему формулы (IV)
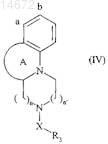
где А, X, R3, n и n' имеют значения, указанные для формулы (I), -Y-OH группа присоединена в а или b положении трициклической системы,
где соединение формулы (III') конденсируют в щелочной среде в присутствии связующего вещества с соединением формулы (VII)
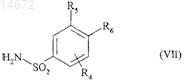
где R4, R5 и R6имеют значения, указанные для формулы (I),
получают соединение формулы (I), которое может быть очищено обычными способами разделения, которое превращают, если это желательно, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое необязательно разделяют на его изомеры обычными способами разделения.
16. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-13 или его соль присоединения с фармацевтически приемлемой кислотой или основанием в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями.
17. Фармацевтическая композиция по п.16 для приготовления лекарственных проапоптотических средств.
18. Фармацевтическая композиция по п.16 для приготовления лекарственных средств для лечения злокачественных новообразований.
19. Фармацевтическая композиция по п.16 для приготовления лекарственных средств для лечения рака мочевого пузыря, головного мозга, молочной железы и матки, хронического лимфолейкоза, рака ободочной кишки, пищевода и печени, лимфобластного лейкоза, фолликулярных лимфом, меланом, злокачественных болезней крови, миелом, рака яичников, немелкоклеточного рака легких, рака предстательной железы и мелкоклеточного рака легких.
20. Комбинация соединения формулы (I) по любому из пп.1-13 с противоопухолевым средством, выбранным из генотоксичных средств, митотических ядов, антиметаболитов, ингибиторов протеасомы и ингибиторов киназы.
21. Применение комбинации по п.20 для приготовления лекарственных средств для лечения злокачественных новообразований.
22. Применение соединения формулы (I) по любому из пп.1-13 в комбинации с лучевой терапией для лечения злокачественных новообразований.
Текст
ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ в которой А представляет собой 5-, 6- или 7-членное (гетеро)ароматическое или неароматическое кольцо, n и n' представляют собой 0, 1 или 2, X представляет собой алкиленовую цепь, как определено в описании, R3 представляет собой арильную или гетероарильную группу, одна из группR1 и R2 представляет собой атом водорода и другая представляет собой группу формулы (II), как определено в описании. Лекарственные средства.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) 014672 Настоящее изобретение относится к новым трициклическим соединениям, к способу их получения и к фармацевтическим композициям, которые их содержат. Соединения согласно настоящему изобретению являются новыми и обладают чрезвычайно ценными фармакологическими характеристиками в области апоптоза и онкологии. Апоптоз или запрограммированная клеточная гибель является ключевым физиологическим процессом при эмбриональном развитии и для поддержания тканевого гомеостаза. Гибель клеток по типу апоптоза вызывает морфологические изменения, такие как конденсация ядра, фрагментация ДНК и биохимический феномен, такой как активация каспаз, которые вызывают повреждение ключевых структурных компонентов клетки, вызывая таким образом ее разборку и смерть. Регуляция процесса апоптоза является комплексной и задействует активацию или репрессию нескольких внутриклеточных путей передачи сигналов (Cory S. и др., Nature Review Cancer, 2002, 2, 647-656). Нарушения апоптоза вовлечены в различные патологии. Повышенный апоптоз связан с нейродегенеративными заболеваниями, такими как болезнь Паркинсона, болезнь Альцгеймера и ишемия. Наоборот, недостаточности осуществления апоптоза играют важную роль в развитии злокачественных новообразований и их резистентности к химиотерапии, в аутоиммунных заболеваниях, воспалительных заболеваниях и вирусных инфекциях. Следовательно, отсутствие апоптоза является одним из характерных фенотипических признаков злокачественного новообразования (Hanahan D. и др., Cell 2000, 100, 57-70). Соединения согласно настоящему изобретению являются новыми, а также обладают проапоптотическими свойствами, что обозначает, что эти соединения могут применяться при патологиях, в которых вовлечен дефект апоптоза, таких как, например, для лечения злокачественного новообразования. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой А представляет собой 5-, 6- или 7-членное ароматическое или неароматическое кольцо,которое может содержать 1 или 2 гетероатома, выбранных из кислорода, серы и азота, где атом азота может быть замещен линейной или разветвленной (С 1-С 6)алкильной группой; подразумевается, что кольцо А, определенное таким образом, не может содержать 2 атома серы или 2 атома кислорода и что одним из кольцевых членов может быть С=О группа,n и n', которые могут быть одинаковыми или разными, представляют собой 0, 1 или 2, где 0n+n'4,R3 представляет собой арильную или гетероарильную группу,X представляет собой линейную или разветвленную алкиленовую цепь, содержащую 1-6 атомов углерода, один или два из этих атомов углерода могут быть заменены атомом кислорода, циклоалкиленовой группой, ариленовой группой, гетероариленовой группой или SO2 группой,одна из групп R1 и R2 представляет собой атом водорода и другая представляет собой группу формулы (II) в которой Y представляет собой С=О или СН 2 группу,R5 представляет собой атом водорода, в этом случае R6 представляет собой атом водорода или-NR7R'7 или -CH2-NR7R'7 группу, где каждый из R7 и R'7, которые могут быть одинаковыми или разными,независимо друг от друга представляет собой атом водорода или линейную или разветвленную (С 1 С 6)алкильную группу, замещенную одной или несколькими арильными, гетероарильными, арилокси,гетероарилокси, арилтио, гетероарилтио, гетероциклоалкильными или -NR10R'10 группами, гдеR10 и R'10, которые могут быть одинаковыми или разными, выбраны из водорода, линейного или разветвленного (С 1-С 6)алкила, линейного или разветвленного (С 1-С 6)алкокси, арила и гетероарила, илиR10 и R'10 образуют насыщенную или ненасыщенную циклическую или бициклическую группу, которая может быть замещена гетероатомом, выбранным из кислорода, азота и серы, и подразумевается,что один или несколько кольцевых членов могут представлять собой С=О группу или могут быть замещены, как указано в определении гетероциклоалкила ниже,или R5 и R6 образуют с двумя атомами углерода, к которым они присоединены, ароматическое или-1 014672 неароматическое кольцо, содержащее 5 или 6 кольцевых членов, один атом азота которого находится в пара-положении по отношению к SO2 группе, и которое может содержать, дополнительно к атому азота,другой атом азота и/или SO2 группу, кольцо, определенное таким образом, замещено R7 группой, как определено выше,R4 представляет собой атом галогена или NO2, R8, SO2-R9, линейную или разветвленную (С 1 С 6)алкильную или линейную или разветвленную (C1-С 6)алкоксигруппу, где R8 может иметь любые из значений R7, как определено выше,R9 представляет собой аминогруппу или линейную или разветвленную (С 1-С 6)алкильную группу,необязательно замещенную одним или несколькими атомами галогена,и подразумевается, что"арил" представляет собой фенильную, нафтильную или бифенильную группу,"гетероарил" представляет собой любую моно- или бициклическую группу, имеющую по меньшей мере одну ароматическую часть и содержащую от 5 до 10 кольцевых членов и которая может содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота, такие группы, как фуран, тиофен, пиррол,имидазолин, пиридин, хинолин, изохинолин, хроман, индол, бензтиофен, бензофуран, 1,3-бенздиоксол и 2,3-дигидро-1,4-бенздиоксин,"гетероциклоалкил" представляет собой любую моно- или бициклическую неароматическую группу, содержащую от 4 до 10 кольцевых членов и которая может содержать от 1 до 3 гетероатомов, выбранных из кислорода, серы и азота,"циклоалкил" представляет собой любую моно- или бициклическую неароматическую группу, содержащую от 4 до 10 кольцевых членов,представляется возможным для арильной, гетероарильной, гетероциклоалкильной и циклоалкильной групп, определенных таким образом, быть замещенными от 1 до 3 групп, выбранных из линейного или разветвленного (С 1-С 6)алкила, необязательно замещенного гидрокси или амино группой, линейного или разветвленного (С 1-С 6)алкокси, гидрокси, карбокси, формила, нитро, циано, амино, линейного или разветвленного полигало(С 1-С 6)алкила, алкоксикарбонила и атомов галогена,"арилен", "гетероарилен" и "циклоалкилен" понимаются в значении соответственно арильной, гетероарильной или циклоалкильной группы, как определено выше, вставленной вместо атома углерода алкиленовой цепи,их энантиомерам и диастереоизомерам и их солям присоединения с фармацевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, камфорную кислоту, лизин и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д.Y благоприятно представляет собой С=О группу. Предпочтительным значением для n и n' является 1. Предпочтительными R4 группами являются группы NO2 и SO2CF3. Предпочтительными X-R3 группами являются ([1,1'-бифенил]-2-ил)метильные группы, необязательно замещенные одной или несколькими группами, выбранными из галогена, циано, амино, аминометила и трифторметила.R5 предпочтительно представляет собой атом водорода. ПредпочтительнымиR7 группами являются группы 1-(N,N-диметиламино)-4(фенилсульфанил)бутан-3-ил и 1-(NR10R'10)-4-(фенилсульфанил)бутан-3-ил, R10 и R'10 являются такими,что они образуют насыщенную или ненасыщенную циклическую или бициклическую группу, необязательно замещенную гетероатомом, выбранным из кислорода, азота и серы.R'7 благоприятно представляет собой атом водорода. Более конкретно, изобретение относится к соединениям формулы (I), которые представляют собойN-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бистрифторацетат,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохло-2 014672 рид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-4-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-4-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид),N-[(4aS,R)-3-(2-бензилбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил]карбонил 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-[(4aS,R)-3-(2-бензилбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил]карбонил 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид,3-нитро-N-4aS,R)-3-[2-(2-фенилэтил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин 8-илкарбонил)-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-3-нитро-4-[(2-феноксиэтил)амино]бензолсульфонамид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 ил]карбонил-3-нитро-4-[(3-фенилпропил)амино]бензолсульфонамид,4-[(2-анилиноэтил)амино]-N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил]карбонил-3-нитробензолсульфонамид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-[3-(диметиламино)пропил][2-(фенилсульфанил)этил]амино-3 нитробензолсульфонамид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-[3-(диметиламино)пропил][2-(фенилсульфанил)этил]амино-3 нитробензолсульфонамид гидрохлорид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-[3-(диметиламино)пропил]амино-3-нитробензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)бензолсульфонамид,4-[(2-аминоэтил)(2-фенилэтил)амино]метил-N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид,4-[(2-аминоэтил)(2-фенилэтил)амино]метил-N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид трис(трифторацетат),N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-7-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-7 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-[2-([1,1'-бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-ил]карбонил-4-1R)3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид,N-[2-([1,1'-бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-ил]карбонил-4-1R)3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис(гидрохлорид),N-(2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-илкарбонил)4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид,N-(2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-илкарбонил)4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис(гидрохлорид),N-10aS,R)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол 8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-3 014672 нитробензолсульфонамид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид),N-4aS)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-4aS)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид),N-[(4aS)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-[(4aS)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид),N-[(4aR)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид,N-[(4aR)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид трис(гидрохлорид),N-[(4aS,R)-3-([1,1'-бифенил]-2-илсульфонил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин 8-ил]карбонил-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил-3,4-дигидро 2H-1,2,4-бензотиадиазин-7-сульфонамид 1,1-диоксид,N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил-4H-1,2,4 бензотиадиазин-7-сульфонамид 1,1-диоксид,N-10 а)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-10 а)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-10 а)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-10 а)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-a]индол-8 илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3[(трифторметил)сульфонил]бензолсульфонамид бис-гидрохлорид,N-[4aR)-3-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид бисгидрохлорид,N-[10 а)-2-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4,10,10 агексагидропиразино[1,2-а]индол-8-ил)карбонил]-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид бисгидрохлорид,N-[4aR)-3-[4-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1 Н-пиразино[1,2 а]хинолин-8-ил)карбонил]-4-1R)-2-(диметиламино)-1-[(фенилсульфанил)метил]этиламино)-3 нитробензолсульфонамид тригидрохлорид,N-4aR)-3-[(4-амино-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитро-бензолсульфонамид тригидрохлорид,N-[4aR)-3-[4-(аминометил)-4'-хлор-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид тригидрохлорид,N-[4aR)-3-[3'-фтор-4'-хлор-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-4 014672 нитробензолсульфонамид бис-гидрохлорид,N-[4aR)-3-[4'-(трифторметил)-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитро-бензолсульфонамид бис-гидрохлорид,N-[4aR)-3-[4'-циано-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[2-(1,3-бенздиоксол-5-ил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3[(трифторметил)сульфонил]бензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(4-метил-1-пиперазинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(1-пиперидил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(1-пирролидинил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(3,6-дигидро-1(2H)-пиридил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-1R)-3-(1-азепанил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-1R,5S)-3-азабицикло-[3,1,0]гекс-3-ил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид,N-4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид натрия. Энантиомеры, диастереоизомеры и их соли присоединения с фармацевтически приемлемой кислотой или основанием предпочтительных соединений по изобретению образуют неотъемлемую часть изобретения. Изобретение также относится к способу получения соединения формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы (III) где Y имеет значение, указанное для формулы (I), и Су представляет собой конденсированную трициклическую систему формулы (IV) где А, X, n, n' и R3 имеют значения, указанные для формулы (I), -Y-Cl группа присоединена в а илиb положении трициклической системы, определенной таким образом,где соединение формулы (III) конденсируют, в щелочной среде в присутствии или отсутствии связующего вещества, с соединением формулы (V) где R4 имеет значение, указанное для формулы (I),получая соединение формулы (VI) где Су, Y и R4 имеют значения, указанные в настоящем изобретении выше,которое конденсируют с соединением формулы HNR7R'7, где R7 и R'7 имеют значения, указанные для формулы (I), получая соединение формулы (I/а), частный случай соединения формулы (I) где Су, Y, R4, R7 и R'7 имеют значения, указанные в настоящем изобретении выше,которое может быть очищено в соответствии с обычной методикой разделения, которое превращают, если это является желательным, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое необязательно разделяют на его изомеры в соответствии с обычной методикой разделения. Соединения формул (III) и (V) являются или коммерческими соединениями, или доступны для специалиста в данной области техники с помощью обычных химических реакций, описанных в литературе. Благоприятный вариант относится к способу получения соединения формулы (I), который характеризуется тем, что в качестве исходного вещества используют соединение формулы (III') где Y имеет значение, указанное для формулы (I), и Су представляет собой конденсированную трициклическую систему формулы (IV) где А, X, R3, n и n' имеют значения, указанные для формулы (I), -Y-OH группа присоединена в а или где R4, R5 и R6 имеют значения, указанные для формулы (I),получая соединение формулы (I), которое может быть очищено в соответствии с обычной методикой разделения, которое превращают, если это является желательным, в его соли присоединения с фармацевтически приемлемой кислотой или основанием и которое необязательно разделяют на его изомеры в соответствии с обычной методикой разделения. Соединения формул (III') и (VII) являются или коммерческими, или доступны для специалиста в данной области техники с помощью обычных химических реакций, описанных в литературе. При осуществлении фармакологических исследований соединений по изобретению было показано,что они обладают проапоптотическими свойствами. Способность реактивировать процесс апоптоза в раковых клетках является основным терапевтическим преимуществом для лечения злокачественных новообразований. Более предпочтительно соединения в соответствии с изобретением будут являться пригодными для-6 014672 лечения злокачественных новообразований, резистентных к химиотерапии и к лучевой терапии, и при злокачественных болезнях крови и при мелкоклеточном раке легких. Среди рассматриваемых лечений злокачественных новообразований можно упомянуть, но не ограничиваясь только ими, рак мочевого пузыря, головного мозга, молочной железы и матки, хронический лимфолейкоз, рак ободочной кишки, пищевода и печени, лимфобластный лейкоз, фолликулярные лимфомы, меланомы, злокачественные болезни крови, миеломы, рак яичников, немелкоклеточный рак легких, рак предстательной железы и мелкоклеточный рак легких. Настоящее изобретение также относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение формулы (I) отдельно или в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. Среди фармацевтических композиций в соответствии с изобретением особенно можно отметить те,которые являются пригодными для перорального, парентерального, назального, через- или транскожного, ректального, подъязычного, глазного или респираторного введения, в особенности таблетки или драже, подъязычные таблетки, саше, пакеты, желатиновые капсулы, таблетки для медленного растворения под языком, пастилки, суппозитории, кремы, мази, кожные гели и ампулы для питья или инъекций. Дозировка изменяется в зависимости от пола, возраста и веса пациента, пути введения, природы терапевтического показания, или любых сопутствующих видов лечения, и находится в интервале от 0,01 мг до 1 г в сутки на одно или больше введений. Кроме того, настоящее изобретение также относится к комбинации соединения формулы (I) с противоопухолевым средством, выбранным из генотоксичных средств, митотических ядов, антиметаболитов, ингибиторов протеасомы и ингибиторов киназы, и к применению комбинации такого типа для приготовления лекарственных средств для применения для лечения злокачественного новообразования. Соединения по изобретению также могут применяться в комбинации с лучевой терапией для лечения злокачественного новообразования. Следующие получения и примеры иллюстрируют изобретение, но никоим образом его не ограничивают. Получение 1. Гидрохлорид (4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Стадия А. 6-Метокси-2-хинолинкарбальдегид. Оксид селена порциями добавляли к раствору 6-метокси-2-метилхинолина (42 г) в 400 мл смеси диоксан/Н 2 О (5%) и затем всю реакционную смесь нагревали в колбе с обратным холодильником в течение ночи. Смесь оставляли охладиться, металл удаляли путем фильтрации и концентрировали насухо. Полученное темно-коричневое твердое вещество очищали путем хроматографии на силикагеле (гептан/AcOEt 80/20), получая указанный в заглавии продукт в виде белого твердого вещества. Стадия В. 2-[(6-Метокси-2-хинолил)метил]аминоэтанол. 9,5 мл 3-аминопропанола добавляли к суспензии соединения, полученного на стадии А (28 г) в 200 мл EtOH, и всю реакционную смесь нагревали в колбе с обратным холодильником, используя аппарат Дина-Старка в течение ночи. После этого реакционную смесь концентрировали насухо и ресуспендировали в объеме 200 мл EtOH при 0 С; затем порциями добавляли 14 г NaBH4. После этого всю реакционную смесь нагревали в колбе с обратным холодильником в течение ночи. После этого реакционную смесь концентрировали насухо, гидролизовали с Н 2 О и экстрагировали с помощью CH2Cl2. При осуществлении высушивания над MgSO4 и концентрирования насухо получали масло, которое постепенно кристаллизовалось. Затем кристаллы растирали в порошок в простом диизопропиловом эфире, фильтровали и высушивали, получая указанный в заглавии продукт в виде бежевых кристаллов. Стадия С. 2-[(6-Метокси-1,2,3,4-тетрагидро-2-хинолил)метил]аминоэтанол. 169 г никеля Ренея порциями добавляли к раствору соединения, полученного на стадии В (33 г) в смеси 50/50 МеОН/KOH 1 М (1,2 л). После этого всю реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Затем металл удаляли путем фильтрации и фильтрат концентрировали насухо. После этого остаток ресуспендировали в CH2Cl2, гидролизовали с Н 2 О и затем несколько раз экстрагировали с помощью CH2Cl2. После этого экстракты объединяли, высушивали над MgSO4, фильтровали и концентрировали насухо. Полученные кристаллы растирали в порошок в простом диизопропиловом эфире, фильтровали и высушивали, получая указанное в заглавии соединение в виде белых кристаллов. Стадия D. (4aS,R)-8-Метокси-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин.P2O5 (18 г) добавляли к суспензии соединения, полученного на стадии С (10 г) в 200 мл о-ксилола. После этого всю реакционную смесь нагревали при 150 С в течение ночи. Смесь оставляли охладиться,концентрировали насухо и затем охлажденной медленно гидролизовали с помощью Н 2 О, после этого медленно добавляли 5 н. NaOH без нагревания и всю реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин. После этого реакционную смесь несколько раз экстрагировали с помощью CH2Cl2, высушивали над MgSO4 и концентрировали насухо, получая коричневое масло, которое соответствует указанному в заглавии продукту и которое использовали непосредственно на следующей стадии без очистки.-7 014672 Стадия Е. (4aS,R)-3-Бензил-8-метокси-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин. Соединение, полученное на стадии D (7 г), растворяли в 100 мл ДМФА, затем последовательно добавляли 8,85 г K2CO3, 4,2 мл бензилбромида и 100 мг NaI и всю реакционную смесь нагревали при 80 С в течение 2 ч. Концентрировали насухо и остаток ресуспендировали в AcOEt. Органическую фазу промывали с помощью Н 2 О, затем насыщенным раствором LiCl и затем насыщенным раствором NaCl. Органическую фазу высушивали над MgSO4 и концентрировали насухо. Остаток очищали путем хроматографии на силикагеле (гептан/AcOEt 95/5), получая указанный в заглавии продукт в виде кремообразного белого твердого вещества. Стадия F. (4aS,R)-3-Бензил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил трифторметансульфонат. Раствор 1 М BBr3/CH2Cl2 добавляли к раствору соединения, полученного на стадии Е (5 г) в 100 млCH2Cl2, при 0 С и после этого всю реакционную смесь перемешивали, при этом температура постепенно возвращалась до температуры окружающей среды. Температуру и перемешивание поддерживали в течение ночи. Затем смесь возвращали до 0 С и медленно добавляли 50 мл МеОН и смесь перемешивали при температуре окружающей среды в течение 30 мин. После этого реакционную смесь концентрировали насухо и несколько раз ресуспендировали с простым диизопропиловым эфиром. После этого полученные бежевые кристаллы отфильтровывали и высушивали. Затем кристаллы растворяли в 100 мл CH2Cl2 и 11,6 мл Et3N, после этого по каплям добавляли трифлатный донор (8,84 г) и всю реакционную смесь перемешивали при температуре окружающей среды. Гидролизовали с помощью Н 2 О и затем два раза экстрагировали с помощью CH2Cl2. Органические экстракты объединяли, высушивали над MgSO4 и концентрировали насухо. После этого остаток очищали путем хроматографии на колонке диоксида кремния(гептан/AcOEt 9/1), получая указанный в заглавии продукт в виде кремообразных белых кристаллов. Стадия(4aS,R)-3-бензил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 карбоксилат. Соединение, полученное на стадии F (3,6 г), растворяли в 100 мл ДМСО/МеОН (3/2) смеси и затем последовательно добавляли 2,6 мл Et3N, 0,19 г Pd(ОАс)2 и 0,935 г лиганда dppf. Смесь дегазировали в атмосфере аргона в течение 20 мин, затем через нее барботировали угарный газ в течение 30 мин и после этого смесь насыщали угарным газом в течение 15 мин. После этого всю реакционную смесь герметично запечатывали и нагревали при 65 С в течение 3 ч. Смеси позволяли охладиться и угарный газ удаляли с помощью аргона. После этого реакционную смесь гидролизовали с помощью Н 2 О и экстрагировали с помощью AcOEt. Органические экстракты объединяли, высушивали над MgSO4 и концентрировали насухо. Остаток очищали путем хроматографии на силикагеле, получая указанный в заглавии продукт в виде масла, которое кристаллизовалось. Стадия Н. Метил (4aS,R)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоксилат. 0,64 г 10% Pd/C и затем 2,4 г NH4COOH последовательно добавляли к раствору соединения, полученного на стадии G (3,2 г) в 100 мл смеси ТГФ/МеОН (50/50), и всю реакционную смесь нагревали при 50 С в течение 4 ч. После этого реакционную смесь охлаждали и фильтровали, фильтрат концентрировали насухо. Полученное твердое вещество ресуспендировали в простом диизопропиловом эфире, растирали в порошок, фильтровали и концентрировали насухо, получая указанный в заглавии продукт в виде белого твердого вещества. Стадия(4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоксилат. Соединение, полученное на стадии Н (7 г), растворяли в 100 мл ДМФА, затем последовательно добавляли 8,85 г K2CO3, 4,2 мл 4-хлор-2'-(хлорметил)-1,1'-бифенил и 100 мг NaI и всю реакционную смесь нагревали при 80 С в течение 2 ч. Концентрировали насухо и после этого остаток ресуспендировали вAcOEt и промывали с помощью Н 2 О, насыщенного раствора LiCl и затем насыщенного раствора NaCl. Органическую фазу высушивали над MgSO4 и концентрировали насухо. Остаток очищали путем хроматографии на силикагеле (гептан/AcOEt 95/5), получая указанный в заглавии продукт в виде кремообразного белого твердого вещества. Стадия J. Гидрохлорид (4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоновой кислоты. 9 мл 6 н. HCl добавляли к раствору 0,5 г соединения, полученного на стадии I в 9 мл диоксана. После этого всю реакционную смесь нагревали в колбе с обратным холодильником в течение 4 ч и затем концентрировали насухо. Полученное твердое вещество растирали в порошок в простом диизопропиловом эфире, фильтровали и высушивали, получая указанное в заглавии соединение в виде бело-голубого твердого вещества. Получение 2.(4aS,R)-3-[2-(2-фенилэтил)бензил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 1, заменяя 4-хлор-2'-(хлорметил)-1,1'-бифенил на стадии I на 1-(хлорметил)-2-(2-фенилэтил)бензол. Получение 7. Гидрохлорид (4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-a]хинолин-7-карбоновой кислоты. Методику осуществляли, как описано в получении 1, заменяя 6-метокси-2-метилхинолин на стадии А на 5-метокси-2-метилхинолин. Получение 8. Гидрохлорид (4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-7-карбоновой кислоты. Методику осуществляли, как описано в получении 1, заменяя 6-метокси-2-метилхинолин на стадии А на 5-метокси-2-метилхинолин и заменяя 4-хлор-2'-(хлорметил)-1,1'-бифенил на стадии I на 2(хлорметил)-1,1'-бифенил. Получение 9. Гидрохлорид 2-([1,1'-бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-a]индол-8 карбоновой кислоты. Стадия А. Этил 5-метокси-1H-индол-2-карбоксилат. 14,5 мл тионилхлорида по каплям добавляли с помощью капельной воронки к суспензии 20 г 5 метокси-1 Н-индол-2-карбоновой кислоты в 100 мл абсолютного этанола при 0 С. Смеси позволяли постепенно возвратиться до температуры окружающей среды после завершения добавления, затем нагревали при щадящей флегме в течение 4 ч. После этого реакционную смесь концентрировали и полученное твердое вещество растирали в порошок в простом диизопропиловом эфире, фильтровали и высушивали. Указанный в заглавии продукт получали в виде темно-коричневого твердого вещества. Стадия В. Этил 1-(цианометил)-5-метокси-1H-индол-2-карбоксилат. 20,8 г соединения, полученного на стадии А, растворенного в 150 мл безводного ДМФА, по каплям добавляли с помощью капельной воронки к суспензии 5,7 г NaH (60%) в 100 мл безводного ДМФА,смесь перемешивали в течение 30 мин при температуре окружающей среды и затем добавляли 12 мл хлорацетонитрила и всю реакционную смесь перемешивали в течение ночи при температуре окружающей среды. После этого реакционную смесь концентрировали насухо, ресуспендировали в AcOEt, гидролизовали с Н 2 О, и затем два раза экстрагировали с помощью AcOEt. После этого органические фазы объединяли, промывали с помощью насыщенного раствора LiCl и затем насыщенного раствора NaCl, высушивали над MgSO4, фильтровали и концентрировали насухо. После этого твердое вещество очищали путем хроматографии на силикагеле (гептан/AcOEt 95/5), получая указанный в заглавии продукт в виде желтоватого твердого вещества. Стадия С. 8-Метокси-1,2,3,4-тетрагидропиразино[1,2-а]индол. 57 мл коммерческого 1 М раствора гидрида алюминия в ТГФ по каплям добавляли с помощью капельной воронки к 7,35 г раствора соединения, полученного на стадии В в 150 мл безводного ТГФ при 0 С. Смеси позволяли постепенно возвратиться до температуры окружающей среды и затем нагревали при щадящей флегме в течение 3 ч. Смеси позволяли охладиться и затем возвращали до 0 С и медленно гидролизовали с помощью насыщенного раствора сегнетовой соли. После этого реакционную смесь экстрагировали с помощью AcOEt. Органические экстракты объединяли, промывали с помощью насыщенного раствора NaCl, высушивали над MgSO4 и концентрировали насухо. Получали 5,7 г коричневого масла, которое соответствует указанному в заглавии продукту. Стадия D. 2-([1,1'-Бифенил]-2-илметил)-8-метокси-1,2,3,4-тетрагидропиразино[1,2-а]индол. Методику осуществляли, как описано на стадии I получения 1, используя в качестве исходного вещества соединение, полученное на стадии С, и, заменяя 4-хлор-2'-(хлорметил)-1,1'-бифенил на 2(хлорметил)-1,1'-бифенил. Указанный в заглавии продукт получали в виде желтоватого твердого вещества. Стадия Е. 2-([1,1'-Бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-ил трифторметансульфонат. Методику осуществляли, как описано на стадии F получения 1. Указанный в заглавии продукт получали в виде желто-оранжевого твердого вещества. СтадияF. Метил 2-([1,1'-бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8-9 014672 карбоксилат. Методику осуществляли, как описано на стадии G получения 1. Указанный в заглавии продукт получали в виде желтоватого твердого вещества. Стадия G. Гидрохлорид 2-([1,1'-бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 карбоновой кислоты. Методику осуществляли, как описано на стадии J получения 1. Указанный в заглавии продукт получали в виде желтоватого твердого вещества. Получение 10. Гидрохлорид 2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2 а]индол-8-карбоновой кислоты. Методику осуществляли, как описано в получении 9, заменяя 2-(хлорметил)-1,1'-бифенил на стадии[1,2-а]индол-8-карбоксилат. 0,158 г NaBH3CN добавляли при температуре окружающей среды к раствору 0,2 г соединения, полученного на стадии А в 5 мл уксусной кислоты. Реакционную смесь перемешивали в течение 48 ч. Смесь гидролизовали с помощью насыщенного раствора NaHCO3 и затем экстрагировали с помощьюAcOEt. Органические фазы объединяли и затем промывали с помощью насыщенного раствора NaCl, после этого высушивали над MgSO4, фильтровали и упаривали насухо. После этого указанное в заглавии соединение очищали путем хроматографии на силикагеле. Стадия С. Гидрохлорид(10aS,R)-2-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 агексагидропиразино[1,2-а]индол-8-карбоновой кислоты. Методику осуществляли, как описано на стадии J получения 1, используя в качестве исходного вещества соединение, полученное на стадии В. Получение 12. Гидрохлорид (4aS)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Стадия А.(4aS)-8-Метокси-3-[(2S)-2-метокси-2-фенилэтаноил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин. В начале 36,5 мл тионилхлорида добавляли к раствору 4,94 г S-метоксифенилуксусной кислоты в 100 мл CH2Cl2. Реакционную смесь нагревали при 40 С в течение половины суток и затем позволяли охладиться до температуры окружающей среды. Упаривали насухо, получая масло. Затем полученное масло в 120 мл CH2Cl2 добавляли к раствору 6,18 г соединения, полученного на стадии D получения 1 в 120 мл CH2Cl2 и 240 мл 1 н. NaOH. Всю реакционную смесь интенсивно перемешивали при температуре окружающей среды в течение 1 ч. Две фазы разделяли и один раз экстрагировали с помощью CH2Cl2. После промывания насыщенным раствором NaCl и высушивания над MgSO4, концентрировали насухо. Смесь очищали путем флэш-хроматографии на силикагеле (петролейный эфир/AcOEt 80/20), получая смесь двух диастереоизомеров в виде масла. После этого диастереоизомеры разделяли с помощью оптической препаративной жидкостной хроматографии на Chiralpak AD, используя EtOH в качестве растворителя и элюента. Стадия В. (4aS)-8-Метокси-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин. 9,6 г KOtBu добавляли к раствору 3,91 г соединения, полученного на стадии А в 150 мл ТГФ. Реакционную смесь перемешивали при температуре окружающей среды в течение половины суток и затем в течение ночи. ТГФ удаляли путем упаривания и затем реакционную смесь гидролизовали с Н 2 О и экстрагировали с помощью AcOEt. После промывания насыщенным раствором NaCl и затем высушивания над MgSO4, концентрировали насухо. Смесь очищали путем флэш-хроматографии на силикагеле(CH2Cl2/MeOH/NH4OH (95/5/0,5, получая указанный в заглавии продукт в виде масла. Стадия С. Гидрохлорид (4aS)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано на стадиях Е-J получения 1, используя в качестве исходного вещества соединение, полученное на стадии В. Получение 13. Гидрохлорид (4aR)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 12, на стадии А, используя другой полученный диастереоизомер. Получение 14. Гидрохлорид(4aR)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 13, заменяя 4-хлор-2'-(хлорметил)-1,1'-бифенил на стадии I получения 1 на 2-(хлорметил)-1,1'-бифенил. Получение 16. Гидрохлорид (4aS,R)-3-([1,1'-бифенил]-2-илсульфонил)-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновой кислоты. Стадия А. 3-([1,1'-Бифенил]-2-илсульфонил)-8-метокси-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин. Методику осуществляли, как описано на стадии Е получения 1, заменяя бензил бромид на [1,1'бифенил]-2-сульфонил хлорид. Стадия В. Гидрохлорид 3-([1,1'-бифенил]-2-илсульфонил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано на стадиях F, G и J получения 1, используя в качестве исходного вещества соединение, полученное на стадии А. Получение 17. 3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2 а][1]бензазепин-9-карбоновая кислота. Стадия А. 6-Метокси-3,4-дигидро-1(2H)-нафталенон О-метил-оксим. 28,93 г Na2HPO4, 2H2O и 27,15 г MeONH2HCl добавляли к раствору 28,64 г 6-метокси-3,4-дигидро 1(2 Н)-нафталенона в 500 мл метанола. После этого реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. После концентрирования остаток ресуспендировали в CH2Cl2/H2O смеси и органическую фазу промывали водой, высушивали над сульфатом магния и концентрировали,получая ожидаемый продукт. Стадия В. N-(6-Метокси-1,2,3,4-тетрагидронафталин-1-ил)-O-метилгидроксиламин. 17,2 мл комплекса ВН 3 пиридин добавляли к раствору 10 г соединения, полученного на стадии А в 100 мл этанола. После доведения температуры реакционной смеси до 0 С по каплям добавляли 200 мл 2,5 н. HCl раствор в течение 3 ч. Смесь возвращали до температуры окружающей среды и перемешивали в течение 1 ч, затем по каплям добавляли насыщенный раствор NaHCO3 при 0 С до достижения значенияpH 5. Водную фазу экстрагировали с помощью CH2Cl2 и затем органическую фазу высушивали над сульфатом магния, концентрировали и очищали путем хроматографии на колонке диоксида кремния(гептан/AcOEt), получая ожидаемый продукт. Стадия С. 7-Метокси-2-винил-2,3,4,5-тетрагидро-1H-1-бензазепин. 145 ммоль бромвинилмагния в 145 мл ТГФ добавляли к раствору 10 г вышеуказанного соединения в 100 мл ТГФ. Добавление осуществляли при 0 С в течение 40 мин и затем реакционную смесь возвращали до температуры окружающей среды. После перемешивания в течение 1 ч смесь гидролизовали водой по каплях при 0 С и затем водную фазу экстрагировали с помощью CH2Cl2. Органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (гептан/AcOEt), получая ожидаемый продукт. Стадия D. трет-Бутил 7-метокси-2-винил-2,3,4,5-тетрагидро-1H-1-бензазепин-1-карбоксилат. 2,45 г Boc2O и 1,55 г K2CO3 добавляли к раствору 1,52 г соединения со стадии С в 15 мл ТГФ. Реакционную смесь нагревали до 60 С и перемешивали в течение 16 ч. После разведения в смеси AcOEt/H2O водную фазу экстрагировали с помощью AcOEt и затем органические фазы объединяли, промывали водой и насыщенным раствором NaCl, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (гептан/AcOEt), получая ожидаемый продукт. Стадия Е. Метил 7-метокси-2,3,4,5-тетрагидро-1H-1-бензазепин-2-карбоксилат. 12 мл 2,5 н. раствора NaOH в метаноле добавляли к раствору 1 г вышеуказанного соединения в 50 мл CH2Cl2. Всю реакционную смесь охлаждали до -78 С и продували потоком озона. После появления характерного синего цвета реакционную смесь гидролизовали и экстрагировали с помощью AcOEt. Органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток растворяли в 4 н. растворе HCl в диоксане. После нейтрализации водную фазу экстрагировали с помощью CH2Cl2 и органические фазы объединяли, высушивали над сульфатом магния,фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле(CH2Cl2/МеОН), получая ожидаемый продукт. Стадия F. Метил 1-([(бензилокси)карбонил]аминоацетил)-7-метокси-2,3,4,5-тетрагидро-1H-1 бензазепин-2-карбоксилат. 14,2 г PCl5 порциями добавляли при 0 С к раствору 14,3 г [(бензилокси)карбонил]аминоуксусной кислоты в 300 мл ТГФ. После этого всю реакционную смесь перемешивали при такой же температуре в течение 2 ч. К реакционной смеси по каплям добавляли раствор 10 г соединения со стадии Е в 100 мл ТГФ и 50 мл пиридина при 0 С в течение 2 ч. После этого смесь доводили до температуры окружающей среды и перемешивали в течение 16 ч. Полученную гетерогенную смесь гидролизовали по каплям при- 11014672 0 С и затем экстрагировали с помощью AcOEt. Органические фазы объединяли, промывали с помощью насыщенного раствора NaHCO3 и насыщенного раствора NaCl, высушивали над сульфатом магния,фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле(гептан/AcOEt), получая ожидаемый продукт. Стадия G. 9-Метокси-2,3,4 а,5,6,7-гексагидропиразино[1,2-а][1]бензазепин-1,4-дион. 2 г 10% Pd/C и 4,1 г NH4COOH последовательно добавляли к раствору 10 г соединения, полученного на стадии F в 400 мл смеси ТГФ/МеОН (1/3). Всю реакционную смесь нагревали при 50 С в течение 10 ч. После этого реакционную смесь охлаждали, фильтровали и концентрировали насухо. Полученное твердое вещество ресуспендировали в простом диизопропиловом эфире, растирали в порошок, фильтровали и концентрировали насухо, получая ожидаемое соединение. Стадия Н. 3-Бензил-9-метокси-2,3,4 а,5,6,7-гексагидропиразино[1,2-а][1]бензазепин-1,4-дион. 7 г соединения со стадии G в 450 мл ДМФА при 0 С по каплям добавляли в течение 2 ч к гетерогенному раствору 1,6 г 60% NaH в 50 мл ДМФА. После возвращения до температуры окружающей среды добавляли 4 мл бензилбромида в течение 30 мин и затем реакционную смесь перемешивали в течение 16 ч. После концентрирования остаток ресуспендировали при 0 С в смеси AcOEt и насыщенного раствора NaHCO3. Водную фазу экстрагировали с помощью AcOEt и затем органические фазы объединяли,промывали с помощью насыщенного раствора LiCl, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (гептан/AcOEt),получая ожидаемое соединение. Стадия I. 3-Бензил-9-метокси-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-а][1]бензазепин. 2,27 г NaBH4 порциями добавляли при 0 С к раствору 7 г соединения со стадии Н в 150 мл ТГФ. После этого реакционную смесь перемешивали при такой же температуре в течение 30 мин. После этого по каплям добавляли 11,4 мл комплекса BF3Et2O при 0 С в течение 1 ч. После возвращения до температуры окружающей среды реакционную смесь нагревали в колбе с обратным холодильником в течение 16 ч и по каплям добавляли 50 мл 5 н. раствора HCl при 0 С. После этого реакционную смесь нагревали в колбе с обратным холодильником в течение 1 ч, после этого гидролизовали с 50 мл 5 н. NaOH до достижения значения pH 5. Водную фазу экстрагировали с помощью AcOEt и затем органические фазы объединяли и промывали с помощью насыщенного раствора NaHCO3, высушивали над сульфатом магния,фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле(гептан/AcOEt), получая ожидаемый продукт. Стадия J. 3-Бензил-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-a][1]бензазепин-9-ил трифторметансульфонат. Методику осуществляли, как описано на стадии F получения 1. Стадия K. Метил 3-бензил-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-a][1]бензазепин-9-карбоксилат. Методику осуществляли, как описано на стадии G получения 1. Стадия L. Метил 1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-а][1]бензазепин-9-карбоксилат гидрохлорид. 300 мг палладиевого катализатора добавляли к раствору 1,5 г вышеуказанного соединения в 35 мл 1 н. раствора HCl в метаноле. После этого гетерогенный раствор гидрировали в течение 48 ч под давлением 2 бар. Реакционную смесь фильтровали и промывали метанолом, получая указанное в заглавии соединение в виде гидрохлорида. Стадия М. Метил 3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2 а][1]бензазепин-9-карбоксилат. Методику осуществляли, как описано на стадии I получения 1. СтадияN. 3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2a][1]бензазепин-9-карбоновая кислота. 387 мг LiOH добавляли к раствору 850 мг соединения со стадии М в 15 мл смеси диоксан/Н 2 О (4/1). После этого всю реакционную смесь перемешивали в течение 4 ч и концентрировали насухо. После разведения в 0,5 н. HCl водную фазу экстрагировали с помощью AcOEt. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaHCO3 и насыщенного раствора NaCl, высушивали над сульфатом магния, фильтровали и концентрировали. Полученное твердое вещество лиофилизовали в смеси ACN/Н 2 О, получая указанное в заглавии соединение. Получение 18. (10 а)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2 а]индол-8-карбоновая кислота (=R или S). Соединение получали путем разделения рацемической смеси, полученной в получении 11 наChiralpak AD, используя метанол, ацетонитрил и диэтиламин в качестве элюентов. Время удерживания: 8,7 мин. Получение 19. (10 а)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2 а]индол-8-карбоновая кислота (=S или R). Соединение получали путем разделения рацемической смеси, полученной в получении 11 наChiralpak AD, используя метанол, ацетонитрил и диэтиламин в качестве элюентов. Время удерживания: 9,6 мин. Получение 20. 6-(трет-Бутоксикарбонил)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хиноксалин-8-карбоновая кислота. Стадия А. 4-[(Бензилокси)карбонил]-1-(2-нитрофенил)-2-пиперазинкарбоновая кислота. 19,5 мл 2,5 н. раствора NaOH и затем раствор 2,07 г сульфата меди в 40 мл воды добавляли к раствору 5 г дигидрохлорида 2-пиперазинкарбоновой кислоты в 20 мл воды. Полученный синий раствор охлаждали до 5 С и затем добавляли все вместе 2,5 г Na2CO3, после этого по каплям раствор 3,85 мл бензилхлорформиата в 20 мл диоксана. После возвращения до температуры окружающей среды реакционную смесь перемешивали в течение 24 ч. Осадок удаляли путем фильтрации, получая 4[(бензилокси)карбонил]-2-пиперазинкарбоновую кислоту, хелатированную медью. Это последнее соединение растворяли в 375 мл воды и затем добавляли 4,5 г EDTA. Реакционную смесь нагревали при 80 С в течение 3 ч и затем концентрировали насухо. Остаток ресуспендировали в 75 мл ДМСО. После этого добавляли 3,43 г 2-фтор-нитробензола и 15 мл Et3N и затем реакционную смесь нагревали при 60 С в течение 48 ч. После возвращения до температуры окружающей среды раствор доводили до pH 3, используя 5 н. HCl, затем разводили в 250 мл воды и экстрагировали с помощью AcOEt. Органические фазы промывали водой, высушивали над сульфатом магния, концентрировали и очищали путем хроматографии на колонке диоксида кремния (CH2Cl2/МеОН), получая ожидаемый продукт. Стадия В. Бензил 5-оксо-1,2,4,4 а,5,6-гексагидро-3H-пиразино[1,2-а]хиноксалин-3-карбоксилат. 8 г железного порошка порциями добавляли к раствору 5,7 г соединения со стадии А в 100 мл уксусной кислоты. Смесь нагревали при 60 С в течение 3 ч и затем после возвращения до температуры окружающей среды добавляли 50 мл 1 н. HCl. Раствор экстрагировали с помощью дихлорметана и органические фазы объединяли, высушивали над сульфатом магния и затем концентрировали. Остаток очищали путем хроматографии на силикагеле (гептан/AcOEt), получая ожидаемый продукт. Стадия С. Бензил 8-бром-5-оксо-1,2,4,4 а,5,6-гексагидро-3H-пиразино[1,2-а]хиноксалин-3 карбоксилат. При 0 С в течение 25 мин раствор 2,55 г N-бромсукцинимида в 30 мл ДМФА добавляли к раствору 4,4 г соединения со стадии В в 40 мл ДМФА. Оранжевый раствор перемешивали при такой же температуре в течение 1,5 ч и затем разводили в смеси H2O/AcOEt (1/1). Водную фазу экстрагировали с помощью AcOEt и затем органические фазы объединяли и промывали водой и после этого насыщенным раствором LiCl, после этого высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (гептан/AcOEt), получая ожидаемый продукт. Стадия D. Бензил 8-бром-1,2,4,4 а,5,6-гексагидро-3H-пиразино[1,2-а]хиноксалин-3-карбоксилат. Методику осуществляли, как описано на стадии I получения 17, используя соединение, полученное на предыдущей стадии. Стадия Е. 3-Бензил 6-трет-бутил 8-бром-4 а,5-дигидро-1H-пиразино[1,2-а]хиноксалин-3,6(2H,4H)дикарбоксилат. Методику осуществляли, как описано на стадии D получения 17, используя соединение, полученное на предыдущей стадии. Стадия F. 3-Бензил 6-трет-бутил 8-метил 4 а,5-дигидро-1H-пиразино[1,2-а]хиноксалин-3,6,8(2H,4H)трикарбоксилат. Методику осуществляли, как описано на стадии G получения 1, используя соединение, полученное на предыдущей стадии. Стадия G. 6-трет-Бутил 8-метил 1,2,3,4,4 а,5-гексагидро-6H-пиразино[1,2-а]хиноксалин-6,8 дикарбоксилат. 0,22 г 10% Pd/C и затем 144 мг NH4COOH последовательно добавляли к раствору 1,1 г соединения,полученного на стадии F в 40 мл смеси ТГФ/МеОН (1/1). Всю реакционную смесь нагревали при 50 С в течение 4 ч. После этого реакционную смесь охлаждали, фильтровали и концентрировали насухо. Полученное твердое вещество ресуспендировали в простом диизопропиловом эфире, растирали в порошок,фильтровали и концентрировали насухо, получая указанное в заглавии соединение. Стадия Н. 6-трет-Бутил 8-метил 3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а, 5-гексагидро-6Hпиразино[1,2-а]хиноксалин-6,8-дикарбоксилат. Методику осуществляли, как описано на стадии I получения 1, используя соединение, полученное на предыдущей стадии. Стадия I. 6-(трет-Бутоксикарбонил)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хиноксалин-8-карбоновая кислота. Методику осуществляли, как описано на стадии N получения 17, используя соединение, полученное на предыдущей стадии. Получение 21. 6-(трет-Бутоксикарбонил)-3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-5-оксо-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хиноксалин-8-карбоновая кислота. Указанное в заглавии соединение получали при осуществлении тех же стадий, что и описанные в получении 20, но с двумя отличиями, а именно стадию D пропускали, тогда как на стадии Е добавлениеBoc группы осуществляли в присутствии HNa (и не K2CO3) в ДМФА (и не ТГФ). Получение 22. 1-Бром-2-(бромметил)-4,4-диметил-1-циклогексен. Стадия А. 4,4-Диметилциклогексанон. 1 г 5% Pd/C порциями добавляли к раствору 4,4-диметил-2-циклогексен-1-она (0,0805 моль,10,6 мл) в 110 мл AcOEt, затем всю реакционную смесь перемешивали в течение 2 ч при температуре окружающей среды при атмосферном давлении водорода. Палладий удаляли путем фильтрации и концентрировали насухо. Полученное масло кристаллизовалось постепенно. Таким образом получали указанное в заглавии соединение в виде белого твердого вещества. Стадия В. 2-Бром-5,5-диметил-1-циклогексен-1-карбальдегид. 20,1 мл трибромида фосфора по каплям добавляли к смеси 110 мл CH2Cl2 и 18,7 мл ДМФА, выдерживали при 0 С на ледяной бане. Всю реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин. После этого реакционную смесь охлаждали до 0 С и добавляли 10,5 г соединения со стадии А, растворенного в 90 мл CH2Cl2. После этого всю реакционную смесь перемешивали в течение 4 ч, постепенно возвращая до температуры окружающей среды, после этого вливали в смесь лед/насыщенный раствор NaHCO3. После этого перемешивали в течение 1 ч и экстрагировали с помощью Et2O. Затем органические фазы объединяли, промывали с помощью насыщенного раствора NaCl,высушивали над сульфатом магния и затем концентрировали насухо. После этого остаток очищали на колонке диоксида кремния (гептан AcOEt градиент от 0 до 5% AcOEt). Указанное в заглавии соединение получали в виде бесцветного масла. Стадия С. (2-Бром-5,5-диметил-1-циклогексен-1-ил)метанол. 3,23 г борогидрида натрия порциями добавляли к раствору 12,48 г соединения со стадии В при 0 С в 120 мл метанола. Всю реакционную смесь перемешивали в течение 5 ч, постепенно возвращая до температуры окружающей среды. После этого реакционную смесь охлаждали до 0 С, затем гидролизовали и экстрагировали с помощью CH2Cl2. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaCl, высушивали над сульфатом магния и в завершение концентрировали насухо. Указанное в заглавии соединение получали в виде бесцветного масла, которое очищали путем хроматографии на силикагеле (гептан/AcOEt). Стадия D. 1-Бром-2-(бромметил)-4,4-диметил-1-циклогексен. 3,96 г соединения со стадии С растворяли в 70 мл Et2O, всю реакционную смесь выдерживали при 0 С. После этого к ней по каплям добавляли 1,7 мл трибромида фосфора. Всю реакционную смесь перемешивали при этой температуре в течение 1 ч 30 мин. После этого реакционную смесь гидролизовали,после этого экстрагировали с помощью Et2O. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaHCO3 и затем насыщенного раствора NaCl, высушивали над сульфатом магния и в завершение концентрировали насухо. Указанное в заглавии соединение получали в виде бесцветного масла, которое очищали путем хроматографии на силикагеле (гептан/AcOEt). Получение 23. Гидрохлорид (4aR)-3-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил 2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Стадия А. Метил (4aR)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат. Методику осуществляли, как описано на стадиях А и В получения 12, выбирая другой диастереоизомер. Полученное соединение затем подвергали такой же обработке, что и описана на стадиях Е, F, G и Н получения 1. Стадия В. Метил (4aR)-3-[(2-бром-5,5-диметил-1-циклогексен-1-ил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-a]хинолин-8-карбоксилат. 0,98 мл Et3N, 0,1 г NaI и 1,06 г соединения из получения 22 последовательно добавляли к раствору 0,76 г соединения со стадии А в 20 мл ДМФА. После этого всю реакционную смесь нагревали при 80 С в течение 3 ч. После охлаждения до температуры окружающей среды, реакционную смесь гидролизовали и затем экстрагировали с помощью AcOEt. Органические фазы объединяли, промывали с помощью насыщенного раствора LiCl и затем насыщенного раствора NaCl, и затем высушивали над сульфатом магния и концентрировали насухо. Затем полученное твердое вещество ресуспендировали в простом диизопропиловом эфире, растирали в порошок и после этого фильтровали. Указанное в заглавии соединение получали в виде белого твердого вещества, которое является достаточно чистым для использования на следующей стадии. Стадия С. Метил (4aR)-3-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-a] хинолин-8-карбоксилат. 0,14 г PdCl2(Ph3)2, и затем 0,697 г 4-хлорфенилбороновой кислоты и 2,4 мл 2 М водного раствораNa2CO3 последовательно добавляли к суспензии 1,33 г соединения со стадии В в смеси DME/H2O/EtOH(15 мл/6 мл/4 мл). Всю реакционную смесь дегазировали в атмосфере аргона в течение 15 мин и затем нагревали при 80 С в течение 16 ч. После этого реакционную смесь фильтровали при температуре окружающей среды. Затем фильтрат гидролизовали и экстрагировали с помощью CH2Cl2. Органические фазы объединяли, промывали с помощью насыщенного раствора NaCl и затем высушивали над сульфатом магния и концентрировали насухо. После этого полученное зеленое масло очищали путем хроматографии на силикагеле (гептан/AcOEt: 95/5), получая указанное в заглавии соединение в виде белого твердо- 14014672 го вещества. Стадия D. Гидрохлорид (4aR)-3-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил 2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоновой кислоты. Суспензию 0,910 г соединения со стадии С в смеси диоксан/6 н. HCl (10 мл/15 мл) нагревали при 70 С в течение 20 ч. После этого смеси позволяли возвратиться до температуры окружающей среды. Полученный осадок отфильтровывали и затем промывали с помощью простого диизопропилового эфира и высушивали. Указанное в заглавии соединение получали в виде светло-зеленого твердого вещества. Получение 24. (10 а)-2-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4,10,10 агексагидропиразино[1,2-а]индол-8-карбоновая кислота (=S или R). Стадия А. 2-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-8-метокси-1,2,3,4 тетрагидропиразино[1,2-a]индол. Соединение, полученное на стадии С получения 9, подвергали методикам, описанным на стадиях В и С получения 23. Стадия В. Метил 2-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4 тетрагидропиразино[1,2-а]индол-8-карбоксилат. Соединение со стадии А подвергали методикам, описанным на стадиях Е и F получения 9. Стадия С. Гидрохлорид 2-[2-(4-хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4,10,10 агексагидропиразино[1,2-а]индол-8-карбоновой кислоты. Соединение с предыдущей стадии подвергали методикам, описанным на стадиях В и С получения 11. Стадия(10 а)-2-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4,10,10 агексагидропиразино[1,2-а]индол-8-карбоновая кислота (=S или R). Соединение получали путем разделения смеси энантиомеров, полученной на стадии С. Получение 25. Трифторацетат (4aR)-3-[4-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Стадия А. (4-Бром-3-пиридил)метанол. 0,2 г борогидрида натрия порциями добавляли к раствору 1 г 4-бромникотинальдегида в 50 мл МеОН при 0 С. После этого всю реакционную смесь перемешивали в течение 6 ч, постепенно возвращая до температуры окружающей среды. Реакционную смесь охлаждали до 0 С, затем гидролизовали с помощью насыщенного раствора NH4Cl и экстрагировали с помощью CH2Cl2. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaCl,высушивали над сульфатом магния и затем концентрировали насухо. Указанное в заглавии соединение получали в виде светло-коричневого геля, который использовали на следующей стадии. Стадия В. [4-(4-Хлорфенил)-3-пиридил]метанол 0,335 г Pd(Ph3)4, 0,453 г 4-хлорфенилбороновой кислоты и затем 2,9 мл 2 М водного раствораNa2CO3 последовательно добавляли к суспензии 0,545 г соединения со стадии А в смеси DME/EtOH(7,5 мл/3 мл). Всю реакционную смесь дегазировали в атмосфере аргона в течение 15 мин и затем нагревали при 80 С в течение 18 ч. После этого реакционную смесь фильтровали при температуре окружающей среды. Затем фильтрат гидролизовали и экстрагировали с помощью CH2Cl2. Органические фазы объединяли, промывали с помощью насыщенного раствора NaCl и затем высушивали над сульфатом магния и концентрировали насухо. Полученное твердое вещество в завершение очищали путем хроматографии на силикагеле (CH2Cl2/МеОН), получая указанное в заглавии соединение. Стадия С. 3-(Хлорметил)-4-(4-хлорфенил)пиридин. Раствор 0,590 мл тионилхлорида (0,008 моль) в 5 мл CH2Cl2 по каплям добавляли к раствору 0,176 г соединения со стадии В в 5 мл CH2Cl2 при 0 С. Всю реакционную смесь перемешивали в течение 2 ч,постепенно возвращая до температуры окружающей среды. После этого реакционную смесь концентрировали насухо. Полученное твердое вещество промывали с помощью гептана и высушивали. Указанное в заглавии соединение получали в виде светло-бежевого твердого вещества, которое использовали на следующей стадии. Стадия(4aR)-3-[4-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоксилат. Методику осуществляли, как описано на стадии В получения 23, подвергая реакции соединение со стадии А получения 23 с соединением с предыдущей стадии С. Стадия Е. Трифторацетат (4aR)-3-[4-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновой кислоты. Предыдущее соединение подвергали методике со стадии N получения 17. Получали некристаллическое соединение, которое очищали путем хроматографии с обращенной фазой (С-18) (градиент Н 2 О,CH3CN, 0,1% ТФУ). После лиофилизации указанный в заглавии продукт получали в виде соли ТФУ. Получение 26. Трифторацетат (4aR)-3-[2-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, заменяя 4-бромникотинальдегид на 2-бром- 15014672 никотинальдегид. Получение 27. Трифторацетат (4aR)-3-[3-(4-хлорфенил)-2-пиридил]метил-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, заменяя 4-бромникотинальдегид на 3-бром 2-пиридинкарбальдегид. Получение 28. Трифторацетат (4aR)-3-[3-(4-хлорфенил)-4-пиридил]метил-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, заменяя 4-бромникотинальдегид на 3-бромизоникотинальдегид. Получение 29.(4aR)-3-[(4-[(трет-Бутоксикарбонил)амино]-4'-хлор-[1,1'-бифенил]-2-ил)метил]2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновая кислота. Стадия А. Метил 4-нитро-4'-хлор-[1,1'-бифенил]-2-карбоксилат. Это соединение получали, используя метод сочетания, описанный на стадии В получения 25, заменяя (4-бром-3-пиридил)метанол на метил 2-бром-5-нитробензоат. Ожидаемый продукт получали после стадии очистки через силикагель (петролейный эфир/AcOEt) в виде желтого твердого вещества. Стадия В. 4-Нитро-4'-хлор-[1,1'-бифен-2-ил]метанол. 0,617 г борогидрида натрия порциями добавляли к раствору 2,38 г соединения со стадии А в 20 мл МеОН при 0 С. Всю реакционную смесь перемешивали в течение 6 ч, постепенно возвращая до температуры окружающей среды, и затем нагревали в колбе с обратным холодильником в течение 24 ч. После этого реакционную смесь охлаждали до 0 С, гидролизовали с помощью насыщенного раствора NH4Cl и экстрагировали с помощью CH2Cl2. После этого органические фазы объединяли и промывали с помощью насыщенного раствора NaCl, высушивали над сульфатом магния и затем концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt), ожидаемое соединение получали в виде желтого твердого вещества. Стадия С. 4-Амино-4'-хлор-[1,1'-бифен-2-ил]метанол. 3,8 г хлорида олова (SnCl2) порциями добавляли к раствору 0,890 г соединения со стадии В в смеси ТГФ (15 мл)/МеОН (20 мл). Всю реакционную смесь перемешивали постепенно в колбе с обратным холодильником в течение 3 ч. После этого реакционную смесь концентрировали насухо, ресуспендировали в CH2Cl2, охлаждали до 0 С, после этого гидролизовали с помощью 5 н. раствора NaOH и экстрагировали с помощью CH2Cl2. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaCl, высушивали над сульфатом магния и затем концентрировали насухо. Ожидаемое соединение получали в виде желтого твердого вещества и использовали на следующей стадии. Стадия D. 4-[(трет-Бутоксикарбонил)амино]-4'-хлор-2-(гидроксиметил)-1,1'-бифенил. 0,71 г Boc2O добавляли к раствору 0,76 г соединения со стадии С в 25 мл этанола. Всю реакционную смесь перемешивали в течение 20 ч, постепенно доводя температуру до 35 С. После этого реакционную смесь концентрировали насухо, ресуспендировали в Et2O, затем гидролизовали и экстрагировали с помощью Et2O. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaCl, высушивали над сульфатом магния и затем концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt) указанное в заглавии соединение получали в виде бежевого твердого вещества. Стадия Е. 4-[(трет-Бутоксикарбонил)амино]-4'-хлор-2-(хлорметил)-1,1'-бифенил. 0,532 мл Et3N и 0,22 мл мезилхлорида (0,00284 моль) последовательно добавляли к раствору 0,634 г соединения со стадии D в 15 мл ТГФ при 0 С. После этого всю реакционную смесь перемешивали в течение 96 ч, постепенно возвращая до температуры окружающей среды. После этого реакционную смесь концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt) ожидаемое соединение получали в виде желтого масла, которое кристаллизовалось. Стадия F. Метил (4aR)-3-(4-[(трет-бутоксикарбонил)амино]-4'-хлор-[1,1'-бифенил]-2-илметил)2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоксилат. Методику осуществляли, как описано на стадии В получения 23, подвергая реакции соединение со стадии А получения 23 с соединением с предыдущей стадии Е. Стадия G. (4aR)-3-[(4-[(трет-Бутоксикарбонил)амино]-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновая кислота. Предыдущее соединение подвергали методике со стадии N получения 17. Получение 30.(4aR)-3-[(4-[(трет-Бутоксикарбонил)амино]метил-4'-хлор-[1,1'-бифенил]-2 ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновая кислота. Стадия А. Метил 4-метокси-4'-хлор-[1,1'-бифенил]-2-карбоксилат. Это соединение получали, используя метод сочетания, описанный на стадии В получения 25, заменяя (4-бром-3-пиридил)метанол на метил 2-бром-5-метоксибензоат. Ожидаемый продукт получали в виде твердого вещества после стадии очистки через силикагель (гептан/AcOEt). Стадия В. Метил 4'-хлор-4-гидрокси-[1,1'-бифенил]-2-карбоксилат. 1 М раствор BBr3 в 42 мл CH2Cl2 медленно добавляли к раствору 1,6 г соединения со стадии А в 20 мл CH2Cl2 при -78 С. Всю реакционную смесь перемешивали при этой температуре в течение 1 ч- 16014672 30 мин. Затем добавляли смесь Н 2 О/МеОН (40 мл/10 мл). Всю реакционную смесь перемешивали в течение 45 мин все еще при -78 С, и затем экстрагировали с помощью CH2Cl2. После этого органические фазы объединяли и высушивали над сульфатом магния, после этого концентрировали насухо. Получали коричневую пену, которую использовали на следующей стадии. Стадия С. Метил 4'-хлор-4-трифторметансульфонил-[1,1'-бифенил]-2-карбоксилат. 4 мл Et3N (0,029 моль) и 3,1 г N-фенил-бис-(трифторметансульфонамида) последовательно добавляли к раствору 1,5 г соединения со стадии В в 20 мл CH2Cl2 при 0 С. После этого всю реакционную смесь перемешивали в течение 20 ч, постепенно возвращая до температуры окружающей среды. После этого реакционную смесь концентрировали насухо, ресуспендировали в AcOEt и промывали последовательно 1 н. раствором HCl, насыщенным раствором NaHCO3 и насыщенным раствором NaCl, затем высушивали над сульфатом магния. После очистки на силикагеле (гептан/AcOEt) ожидаемое соединение получали в виде бесцветного масла. Стадия D. Метил 4'-хлор-4-циано-[1,1'-бифенил]-2-карбоксилат. 0,44 г Pd2(dba)3, 0,066 г dppf и 0,422 г Zn(CN)2 последовательно добавляли к раствору 1,2 г соединения со стадии С в 50 мл ДМФА. После этого всю реакционную смесь перемешивали в течение 3 ч, постепенно доводя температуру до 90 С. После этого реакционную смесь концентрировали, ресуспендировали в AcOEt и промывали последовательно насыщенным раствором LiCl и насыщенным растворомNaCl, после этого высушивали над сульфатом магния. После очистки на силикагеле (гептан/AcOEt) ожидаемое соединение получали в виде бесцветного масла, которое кристаллизовалось постепенно. Стадия Е. Метил 4-аминометил-4'-хлор-[1,1'-бифенил]-2-карбоксилат. 1,68 г NiCl2 и 1,47 г борогидрида натрия порциями добавляли к суспензии 3,52 г соединения со стадии D в 40 мл МеОН при 0 С. После этого всю реакционную смесь перемешивали в течение 6 ч, постепенно возвращая до температуры окружающей среды. После этого реакционную смесь фильтровали и фильтрат разводили AcOEt, затем гидролизовали. После этого органические фазы объединяли, промывали с помощью насыщенного раствора NaCl, высушивали над сульфатом магния и затем концентрировали. Указанное в заглавии соединение получали в виде белой пены, которую использовали на следующей стадии. Стадия F. Метил 4-[(трет-бутоксикарбонил)амино]метил-4'-хлор-[1,1'-бифенил]-2-карбоксилат. 2,82 г Boc2O добавляли к раствору 3,02 г соединения со стадии Е в 60 мл CH2Cl2. После этого всю реакционную смесь перемешивали при температуре окружающей среды в течение 20 ч. После этого реакционную смесь концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt),указанное в заглавии соединение получали в виде белого твердого вещества. Стадия G. 4-[(трет-Бутоксикарбонил)амино]метил-4'-хлор-2-(гидроксиметил)-1,1'-бифенил. 2,4 М раствор LAH в ТГФ по каплям добавляли к раствору 1,6 г соединения со стадии F при 0 С в 60 мл ТГФ. Всю реакционную смесь перемешивали при температуре окружающей среды в течение 2 ч. После этого реакционную смесь гидролизовали с помощью насыщенного раствора сегнетовой соли при температуре окружающей среды в течение 1 ч 30 мин. После этого ее экстрагировали с помощью AcOEt. Затем органические экстракты объединяли, промывали с помощью насыщенного раствора NaCl и высушивали над сульфатом магния, затем концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt), указанное в заглавии соединение получали в виде полупрозрачного масла. Стадия H. 4-[(трет-Бутоксикарбонил)амино]метил-4'-хлор-2-(хлорметил)-1,1'-бифенил. 1,26 мл Et3N (0,00896 моль) и 0,52 мл мезилхлорида (0,00672 моль) последовательно добавляли к раствору 1,56 г соединения со стадии G в 50 мл ТГФ при 0 С. После этого всю реакционную смесь перемешивали в течение 96 ч, постепенно возвращая до температуры окружающей среды. После этого реакционную смесь концентрировали насухо. После очистки на силикагеле (петролейный эфир/AcOEt) ожидаемое соединение получали в виде масла, которое кристаллизовалось. Стадия I. Метил (4aR)-3-[(4-[(трет-бутоксикарбонил)амино]метил-4'-хлор-[1,1'-бифенил]-2 ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат. Методику осуществляли, как описано на стадии В получения 23, подвергая реакции соединение со стадии А получения 23 с соединением с предыдущей стадии Н. Указанное в заглавии соединение получали после стадии очистки через силикагель (гептан/AcOEt). Стадия J. (4aR)-3-[(4-[(трет-Бутоксикарбонил)амино]метил-4'-хлор-[1,1'-бифенил]-2-ил)метил]2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновая кислота. Предыдущее соединение подвергали методике со стадии N получения 17. Ожидаемый продукт получали в виде белого твердого вещества. Получение 31. (4aR)-3-[(3'-Фтор-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоновая кислота. Стадия А. Метил (4aR)-3-(2-бромбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 карбоксилат. Методику осуществляли, как описано на стадии В получения 23, подвергая реакции соединение со стадии А получения 23 с 1-бром-2-(бромметил)бензолом. Стадия В. Метил (4aR)-3-[(3'-фтор-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H- 17014672 пиразино[1,2-a]хинолин-8-карбоксилат. Методику осуществляли, как описано на стадии В получения 25, заменяя 4-хлорфенилбороновую кислоту на 3-фтор-4-хлорфенилбороновую кислоту. Стадия С.(4aR)-3-[(3'-Фтор-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоновая кислота. Предыдущее соединение подвергали методике со стадии N получения 17. Получение 32.(4aR)-3-[(4'-Циано-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоновая кислота. Методику осуществляли, как описано в получении 31, заменяя 3-фтор-4-хлорфенилбороновую кислоту на стадии В на 4-цианобороновую кислоту. Получение 33.(4aR)-3-[(4'-Трифтор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-карбоновая кислота. Методику осуществляли, как описано в получении 31, заменяя 3-фтор-4-хлорфенилбороновую кислоту на стадии В на 4-трифторметилбороновую кислоту. Получение 34. (4aR)-3-[2-(1,3-Бенздиоксол-5-ил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-карбоновая кислота. Методику осуществляли, как описано в получении 31, заменяя 3-фтор-4-хлорфенилбороновую кислоту на стадии В на 1,3-бенздиоксол-5-илбороновую кислоту. Получение 35. (4aR)-3-Бензгидрил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоновая кислота. Стадия А. Метил(4aR)-3-бензгидрил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 карбоксилат. Методику осуществляли, как описано на стадии В получения 23, подвергая реакции соединение со стадии А получения 23 с [бром(фенил)метил]бензолом. Стадия В. (4aR)-3-Бензгидрил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоновая кислота. Предыдущее соединение подвергали методике со стадии N получения 17. Получение 36. Трифторацетат(4aS,R)-3-[4-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-a]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, на стадии D, заменяя соединение со стадии А получения 23 с помощью энантиомерной смеси со стадии Н получения 1. Получение 37. Трифторацетат(4aS,R)-3-[2-(4-хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 26, на стадии D, заменяя соединение со стадии А получения 23 на соединение со стадии Н получения 1. Получение 38. Трифторацетат(4aS,R)-3-[3-(4-хлорфенил)-2-пиридил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 27, на стадии D, заменяя соединение со стадии А получения 23 на соединение со стадии Н получения 1. Получение 39. Трифторацетат(4aS,R)-3-[3-(4-хлорфенил)-4-пиридил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 28, на стадии D, заменяя соединение со стадии А получения 23 на соединение со стадии Н получения 1. Получение 40. Трифторацетат (4aS,R)-3-[(2-(4-пиридил)-3-пиридил)метил]-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, используя 2-бром-никотинальдегид на стадии А, 4-пиридилбороновую кислоту на стадии В, и на стадии D, используя смесь энантиомеров со стадии Н получения 1 в виде трициклического синтона. Получение 41. Трифторацетат (4aS,R)-3-[(2-(6-хлорпирид-3-ил)-3-пиридил)метил]-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, используя 2-бром-никотинальдегид на стадии А, 6-хлор-3-пиридилбороновую кислоту на стадии В, и на стадии D, используя смесь энантиомеров со стадии Н получения 1 в виде трициклического синтона. Получение 42. Трифторацетат (4aS,R)-3-[(2-(6-гидроксипирид-3-ил)-3-пиридил)метил]-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, используя 2-бром-никотинальдегид на стадии А, 6-гидрокси-3-пиридилбороновую кислоту на стадии В, и на стадии D, используя смесь энантиомеров со стадии Н получения 1 в виде трициклического синтона. Получение 43. Трифторацетат 2-[2-(4-хлорфенил)-3-пиридил]метил-1,2,3,4 тетрагидропиразино[1,2-а]индол-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, используя 2-бром-никотинальдегид на стадии А, 4-хлорфенилбороновую кислоту на стадии В, и на стадии D, используя соединение со стадии F- 18014672 получения 9 в виде трициклического синтона. Получение 44. Трифторацетат 2-[2-(6-хлорпирид-3-ил)-3-пиридил]метил-1,2,3,4 тетрагидропиразино[1,2-а]индол-8-карбоновой кислоты. Методику осуществляли, как описано в получении 25, используя 2-бром-никотинальдегид на стадии А, 6-хлор-3-пиридилбороновую кислоту на стадии В, и на стадии D, используя соединение со стадииF получения 9 в виде трициклического синтона. Получение 45. (4aS,R)-3-[(4'-трет-Бутил-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-карбоновая кислота. Методику осуществляли, как описано в получении 31, заменяя 3-фтор-4-хлорфенилбороновую кислоту на стадии В на 4-трет-бутил-фенилбороновую кислоту, и на стадии С, используя смесь метил(4aS,R)-3-[2-(4-Хлорбензил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-карбоновая кислота. Методику осуществляли, как описано в получении 1, на стадии I, заменяя 4-хлор-2'-(хлорметил)1,1'-бифенил на 1-хлор-2-(4-хлорбензил)бензол. Получение 47. 3-(2-Феноксибензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 карбоновая кислота. Стадия А. Метил 3-(2-феноксибензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 карбоксилат. Соединение со стадии Н получения 1 подвергали восстановительному аминированию путем его реакции с 2-феноксибензальдегидом в присутствии NaBH(OAc)3. После этого реакционную смесь подвергали реакции с уксусной кислотой и затем экстрагировали с помощью CH2Cl2. Стадия В. 3-(2-Феноксибензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоновая кислота. Методику осуществляли, как описано на стадии J получения 1. Пример 1. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бистрифторацетат. Стадия А. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. 2,05 мл DIEA и затем 1,5 г 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)3-нитробензолсульфонамида и затем 0,783 г EDC и 0,5 г DMAP добавляли при температуре окружающей среды к раствору 1,26 г соединения, полученного в получении 1 в 50 мл смеси CH2Cl2/ТГФ (1/1). Реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней. Упаривали насухо и затем полученный остаток ресуспендировали в насыщенном растворе NH4Cl и два раза экстрагировали с помощью CH2Cl2. Органическую фазу промывали с помощью насыщенного раствора NaCl и затем высушивали над MgSO4, фильтровали и упаривали насухо. Полученное масло очищали путем флэшхроматографии на силикагеле (CH2Cl2/МеОН/NH4OH 84/16/1,6) и затем лиофилизировали, получая указанный в заглавии продукт в виде желтого твердого вещества. Элементный микроанализ: Стадия В. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бистрифторацетат. Соединение, полученное на стадии А (0,3 г), растворяли в 10 мл CH2Cl2 при 0 С и затем по каплям добавляли трифторуксусную кислоту (56 мкл). После этого всю реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин и затем концентрировали насухо. Затем полученное твердое вещество ресуспендировали в Н 2 О и CH3CN по каплям добавляли до полного растворения реакционной смеси, которую затем лиофилизировали при низкой температуре в течение 24 ч. Получали хлопковое волокнообразное желтое твердое вещество, которое соответствует указанному в заглавии продукту. Пример 2. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Стадия А. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1- 19014672 на соединение из получения 2 и заменяя 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Стадия В. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Соединение, полученное на стадии А (0,3 г), растворяли в 10 мл CH2Cl2 при 0 С и затем по каплям добавляли раствор соляной кислоты в Et2O (2M) (375 мкл). После этого всю реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин и затем концентрировали насухо. Затем полученное твердое вещество ресуспендировали в H2O и CH3CN по каплям добавляли до полного растворения реакционной смеси, которую после этого лиофилизировали при низкой температуре в течение 24 ч. Пример 3. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-4-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Стадия А. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-4-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 3 и заменяя 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Стадия В. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-4-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Методику осуществляли, как описано на стадии В примера 2. Пример 4.N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 4. Элементный микроанализ:N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а)хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Элементный микроанализ: Пример 5. N-[(4aS,R)-3-(2-Бензилбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 ил]карбонил-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Стадия А. N-[(4aS,R)-3-(2-Бензилбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 5 и заменяя 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Стадия В. N-[(4aS,R)-3-(2-Бензилбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 ил]карбонил-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид гидрохлорид. Методику осуществляли, как описано на стадии В примера 2. Пример 6. 3-Нитро-N-4aS,R)-3-[2-(2-фенилэтил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-илкарбонил)-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 6 и заменяя 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Пример 7. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2(фенилсульфанил)этил]аминобензолсульфонамид. Элементный микроанализ:N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)-3-нитро-4-[(2-феноксиэтил)амино]бензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[(2 феноксиэтил)амино]бензолсульфонамид. Элементный микроанализ:N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-3-нитро-4-[(3-фенилпропил)амино]бензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 4, и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[(3-фенилпропил)амино]бензолсульфонамид. Элементный микроанализ: Пример 10. 4-[(2-Анилиноэтил)амино]-N-[(4aS,R)-3-([1,1'-бифенил]-2-илметил)-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-ил]карбонил-3-нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 4, и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-[(2-анилиноэтил)амино]-3 нитробензолсульфонамид. Элементный микроанализ:N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-ил]карбонил-4-[3-(диметиламино)пропил][2-(фенилсульфанил)этил]амино-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 4, и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-[3-(диметиламино)пропил][2-(фенилсульфанил)этил]амино-3-нитробензолсульфонамид. Стадия В.N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-4-[3-(диметиламино)пропил][2-(фенилсульфанил)этил]амино-3 нитробензолсульфонамид гидрохлорид. Методику осуществляли, как описано на стадии В примера 2.N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-илкарбонил)-4-[3-(диметиламино)пропил]амино-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-[3-(диметиламино)пропил]амино-3-нитробензолсульфонамид. Элементный микроанализ:N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на бензолсульфонамид. Элементный микроанализ: Пример 14. 4-[(2-Аминоэтил)(2-фенилэтил)амино]метил-N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2 ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид трис(трифторацетат). Стадия А. 4-[(2-Аминоэтил)(2-фенилэтил)амино]метил-N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2 ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1 на 4-[(2-аминоэтил)(2[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид фенилэтил)амино]метилбензолсульфонамид. Стадия В. 4-[(2-Аминоэтил)(2-фенилэтил)амино]метил-N-4aS,R)-3-[(4'-хлор-[1,1'-бифенил]-2 ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)бензолсульфонамид трис(трифторацетат). Методику осуществляли, как описано на стадии В примера 1. Элементный микроанализ:N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-7-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 7. Элементный микроанализ: Пример 16. N-[(4aS,R)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-7-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 8. Теоретическое m/z: 805,3206. Измеренное m/z: 805,3207. Пример 17.N-[2-([1,1'-Бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3- 22014672 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 9. Стадия В.N-[2-([1,1'-Бифенил]-2-илметил)-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Пример 18. N-(2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Стадия А. N-(2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 10. Стадия В. N-(2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4-тетрагидропиразино[1,2-а]индол-8 илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Пример 19. N-10aS,R)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-a]индол-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 11. Элементный микроанализ:N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-(гидрохлорид). Стадия А. N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 13. Элементный микроанализ:N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Элементный микроанализ: Пример 21. N-4aS)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Стадия А. N-4aS)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 12. Стадия В. N-4aS)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид).- 23014672 Методику осуществляли, как описано на стадии В примера 2. Элементный микроанализ:N-[(4aS)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 14. Стадия В.N-[(4aR)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид трис(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Элементный микроанализ:N-[(4aR)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2a]хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение, полученное в получении 1, на соединение, полученное в получении 15. Стадия В.N-[(4aR)-3-([1,1'-Бифенил]-2-илметил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-(гидрохлорид). Методику осуществляли, как описано на стадии В примера 2. Элементный микроанализ: Пример 24. N-[(4aS,R)-3-([1,1'-Бифенил]-2-илсульфонил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-ил]карбонил-3-нитро-4-[2-(фенилсульфанил)этил]аминобензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 16,и,заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 3-нитро-4-[2(фенилсульфанил)этил]аминобензолсульфонамид. Элементный микроанализ:N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-илкарбонил)-4-(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил 3,4-дигидро-2H-1,2,4-бензотиадиазин-7-сульфонамид 1,1-диоксид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-(1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропил-3,4-дигидро-2H-1,2,4-бензо-тиадиазин-7-сульфонамид 1,1-диоксид. Пример 26.N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-илкарбонил)-4-(1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропил 4H-1,2,4-бензотиадиазин-7-сульфонамид 1,1-диоксид. Методику осуществляли, как описано на стадии А примера 1, заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-(1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропил-4 Н-1,2,4-бензотиадиазин-7-сульфонамид 1,1-диоксид.- 24014672 Пример 27. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-а][1]бензазепин-9-илкарбонил)-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 17. Пример 28. N-4aS)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-а][1]бензазепин-9-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Смесь энантиомеров, описанную в получении 17, разделяли на колонке. Указанное в заглавии соединение получали путем обработки выбранного энантиомера согласно методике со стадии А примера 1. Пример 29. N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-a][1]бензазепин-9-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Методику осуществляли, как описано в примере 28, используя другой энантиомер. Пример 30. N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2-а][1]бензазепин-9-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 17,и,заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Пример 31. N-(3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,4 а,5,6,7-октагидропиразино[1,2a][1]бензазепин-9-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)3-[(трифторметил)сульфонил]бензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 17,и,заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид. Пример 32. N-10 а)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид (=R или S). Указанное в заглавии соединение получали согласно методике со стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 18. Элементный микроанализ: Пример 33. N-(10a)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-a]индол-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид (=S или R). Указанное в заглавии соединение получали согласно методике со стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 19. Элементный микроанализ: Пример 34. N-10a)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а-гексагидропиразино[1,2-а]индол-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид (=R или S). Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 18 и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Элементный микроанализ:N-10 а)-2-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-1,2,3,4,10,10 а- 25014672 гексагидропиразино[1,2-а]индол-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид бисгидрохлорид (=R или S). Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 18,и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид. Элементный микроанализ:N-(3-[(4'-Хлор-[1,1'-бифенил]-3-ил)метил]-5-оксо-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хиноксалин-8-илкарбонил)-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 21. Затем осуществляли стадию снятия защиты, на которой уже выделенный остаток растворяли в 4 н. растворе HCl в диоксане. После нейтрализации водную фазу экстрагировали с помощью CH2Cl2 и органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (CH2Cl2/МеОН),получая ожидаемый продукт. Пример 37. N-(3-[(4'-Хлор-[1,1'-бифенил]-3-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хиноксалин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 20. Затем осуществляли стадию снятия защиты, на которой уже выделенный остаток растворяли в 4 н. растворе HCl в диоксане. После нейтрализации водную фазу экстрагировали с помощью CH2Cl2 и органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (CH2Cl2/МеОН),получая ожидаемый продукт. Пример 38.N-(3-[(4'-Хлор-[1,1'-бифенил]-3-ил)метил]-6-метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хиноксалин-8-илкарбонил)-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. С атома азота в 6-м положении трициклической части соединения со стадии Н получения 20 снимали защиту, используя 4 н. раствор HCl в диоксане. После нейтрализации экстрагирования и очистки, полученный остаток подвергали реакции алкилирования в присутствии метилйодида и K2CO3. После обработки с LiOH, получали 3-[(4'-хлор-[1,1'-бифенил]-2-ил)метил]-6-метил-2,3,4,4 а,5,6-гексагидро-1 Нпиразино[1,2-а]хиноксалин-8-карбоновую кислоту. Это соединение подвергали методике со стадии А примера 1, получая указанное в заглавии соединение. Пример 39. N-[4aR)-3-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-2-(диметиламино)-1[(фенилсульфанил)метил]этиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 23. Элементный микроанализ: Пример 40. N-[4aR)-3-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид бисгидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 23 и заменяя 4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид. Элементный микроанализ: Пример 41. N-[10 а)-2-[2-(4-Хлорфенил)-5,5-диметил-1-циклогексен-1-ил]метил-1,2,3,4,10,10 а- 26014672 гексагидропиразино[1,2-а]индол-8-ил)карбонил]-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид бисгидрохлорид (=S или R). Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 24 и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид. Элементный микроанализ:N-[4aR)-3-[4-(4-Хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-2-(диметиламино)-1[(фенилсульфанил)метил]этиламино)-3-нитробензолсульфонамид тригидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 25. Элементный микроанализ: Пример 43. N-[4aR)-3-[2-(4-Хлорфенил)-3-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 26. Пример 44. N-[4aR)-3-[3-(4-Хлорфенил)-2-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 27. Пример 45. N-[4aR)-3-[3-(4-Хлорфенил)-4-пиридил]метил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 28. Пример 46. N-4aR)-3-[(4-Амино-4'-хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид тригидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 29. Затем осуществляли стадию снятия защиты, на которой уже выделенный остаток растворяли в 4 н. растворе HCl в диоксане. После нейтрализации водную фазу экстрагировали с помощью CH2Cl2 и органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (CH2Cl2/МеОН),получая ожидаемый продукт. Элементный микроанализ:N-[4aR)-3-[4-(Аминометил)-4'-хлор-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид тригидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 30. Затем осуществляли стадию снятия защиты, на которой уже выделенный остаток растворяли в 4 н. растворе HCl в диоксане. После нейтрализации водную фазу экстрагировали с помощью CH2Cl2 и органические фазы объединяли, высушивали над сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали путем хроматографии на силикагеле (CH2Cl2/МеОН),получая ожидаемый продукт. Пример 48. N-[4aR)-3-[3'-Фтор-4'-хлор-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-a]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 31. Элементный микроанализ:N-[4aR)-3-[4'-Циано-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 32. Элементный микроанализ: Пример 50. N-[4aR)-3-[4'-(Трифторметил)-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 33. Элементный микроанализ: Пример 51. N-[4aS,R)-3-[4'-(Трифторметил)-[1,1'-бифенил]-2-ил]метил-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-ил)карбонил]-4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид трифторацетат. Методику осуществляли, как описано в примере 50, заменяя метил (4aR)-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия А получения 23) на смесь метил (4aS,R)-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия Н получения 1). Пример 52. N-4aR)-3-[2-(1,3-Бенздиоксол-5-ил)бензил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2 а]хинолин-8-илкарбонил)-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 34. Элементный микроанализ:N-4aS,R)-3-[2-(1,3-Бенздиоксол-5-ил)бензил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил-4-[2-(фенилсульфанил)этил]амино)-3 нитробензолсульфонамид трифторацетат. Методику осуществляли, как описано в примере 52, заменяя метил (4aR)-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия А получения 23) на смесь метил (4aS,R)-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия Н получения 1) и используя 4-[2 вместо 4-1R)-3-(диметиламино)-1(фенилсульфанил)этил]амино-3-нитробензолсульфонамидN-[(4aR)-3-Бензгидрил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8 ил]карбонил-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 35. Элементный микроанализ: Пример 55. N-[4aR)-3-2-Бромбензил-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 ил)карбонил]-4-1R)-3-(диметиламино)-1-[(фенилсульфанил)метил]пропиламино)-3 нитробензолсульфонамид бис-гидрохлорид. Соединение, полученное на стадии А получения 31, подвергали методике со стадии N получения 17. После этого полученный продукт подвергали методике со стадии А примера 1. Элементный микроанализ: Пример 56. N-[4aS,R)-3-(2-Бромбензил)-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-a]хинолин-8 ил)карбонил]-4-([2-(фенилсульфанил)этил]амино)-3-нитробензолсульфонамид гидрохлорид. Методику осуществляли, как описано в примере 55, заменяя метил (4aR)-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия А получения 23) на смесь метил (4aS,R)-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия Н получения 1) и используя 4-[2(фенилсульфанил)этил]амино 3-нитробензолсульфонамид вместо 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамида. Элементный микроанализ:N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 13 и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид. Элементный микроанализ:N-4aS,R)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1Hпиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано в примере 57, заменяя метил (4aR)-2,3,4,4 а,5,6-гексагидро 1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия А получения 23) на смесь метил (4aS,R)-2,3,4,4 а,5,6 гексагидро-1H-пиразино[1,2-а]хинолин-8-карбоксилат (стадия Н получения 1). Элементный микроанализ: Пример 59. N-4aR)-3-[(4'-Хлор-[1,1'-бифенил]-2-ил)метил]-2,3,4,4 а,5,6-гексагидро-1H-пиразино[1,2-а]хинолин-8-илкарбонил)-4-1R)-3-(4-морфолинил)-1-[(фенилсульфанил)метил]пропиламино)-3[(трифторметил)сульфонил]бензолсульфонамид бис-гидрохлорид. Методику осуществляли, как описано на стадии А примера 1, заменяя соединение из получения 1 на соединение из получения 13 и заменяя 4-1R)-3-(диметиламино)-1[(фенилсульфанил)метил]пропиламино)-3-нитробензолсульфонамид на 4-1R)-3-(4-морфолинил)-1[(фенилсульфанил)метил]пропиламино)-3-[(трифторметил)сульфонил]бензолсульфонамид.
МПК / Метки
МПК: C07D 471/04, A61K 31/55, C07D 487/04, A61P 35/00, A61K 31/4985
Метки: способ, соединения, трициклические, содержат, фармацевтические, получения, которые, композиции
Код ссылки
<a href="https://eas.patents.su/30-14672-triciklicheskie-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические соединения, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Способ повышения выхода ароматических углеводородов из алифатических углеводородов с2-с4
Следующий патент: Водные анестезирующие композиции, содержащие пропофол
Случайный патент: Фармацевтическая композиция


































