Новые соединения 3-(4-оксо-4н-хромен-2-ил)-(1н)-хинолин-4-она, способ их получения и фармацевтические композиции, которые их содержат
Номер патента: 8285
Опубликовано: 27.04.2007
Авторы: Калун Эль Башир, Раби Шериф, Ле Ридан Ален, Арпе Катрин, Исраэль Люсьен, Брион Жан-Даньель
Формула / Реферат
1. Соединение формулы (I)
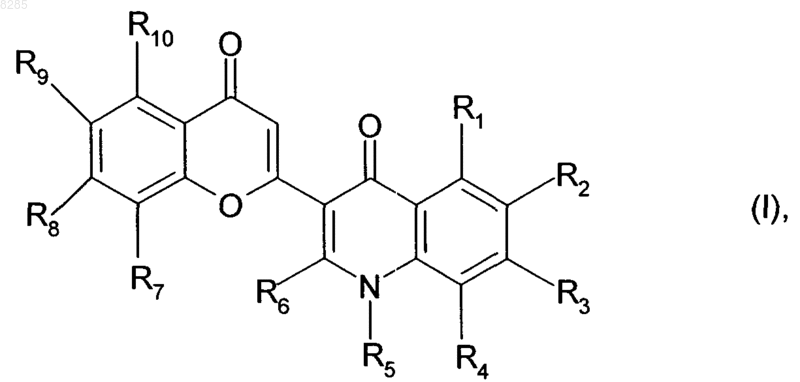
в которой R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и OR', где R' представляет собой фосфатную группу -РО(ОН)2, сульфатную группу -SO3H, карбоксиалкилкарбонил, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6), диалкиламиноалкилкарбонил, в котором каждая алкильная группа представляет собой линейный или разветвленный (C1-C6), или карбоксиалкиламинокарбонил, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6),
R5 представляет собой группу, выбранную из линейного или разветвленного (C1-C6)алкила, арила и гетероарила,
R7 представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила и (C3-С7)циклоалкила, или R7 представляет собой азотсодержащий или кислородсодержащий гетероцикл,
его оптические изомеры, если они существуют, его соли присоединения с фармацевтически приемлемой кислотой, и его гидраты и сольваты,
под арильной группой подразумевают фенил, бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена одним(ой) или несколькими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1-C6)алкоксигрупп, линейных или разветвленных (C1-C6)полигалоалкильных групп, аминогрупп (необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами), нитрогрупп и (C1-C6)алкилендиоксигрупп,
под гетероарильной группой подразумевают 5-12-членную группу, которая является моноциклической и ароматической или бициклической, в которой по крайней мере одно из колец является ароматическим, и которая содержит один, два или три гетероатома, выбранных из кислорода, азота и серы, и подразумевается, что гетероарильная группа необязательно может быть замещена одним(ой) или несколькими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1-C6)алкоксигрупп, линейных или разветвленных (C1-C6)полигалоалкильных групп и аминогрупп (необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами),
под азотсодержащим гетероциклом подразумевают насыщенную или ненасыщенную 5-7-членную моноциклическую группу, содержащую атом азота, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1-C6)алкильными группами,
под кислородсодержащим гетероциклом подразумевают насыщенную или ненасыщенную, 5-7-членную моноциклическую группу, содержащую атом кислорода, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1-C6)алкильными группами.
2. Соединение формулы (I) в соответствии с п.1, в котором R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный (C1-C6).
3. Соединение формулы (I) в соответствии с п.1, в котором R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и OR', где R' представляет собой группу, выбранную из фосфата -РО(ОН)2, сульфата -SO3H, карбоксиалкилкарбонила, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6), диалкиламиноалкилкарбонила, в котором каждая алкильная группа представляет собой линейный или разветвленный (C1-C6), и карбоксиалкиламинокарбонила, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6).
4. Соединение формулы (I) в соответствии с любым из пп.1-3, в котором R5 представляет собой арильную группу.
5. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R7 представляет собой атом водорода.
6. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R7 представляет собой необязательно замещенный азотсодержащий гетероцикл.
7. Соединение формулы (I) в соответствии с любым из пп.1-6, в котором R5 представляет собой фенильную группу и R7 представляет собой атом водорода или замещенную 1,2,3,6-тетрагидро-4-пиридильную группу.
8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5-гидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он.
9. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[5,7-диметокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он.
10. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5,7-дигидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он.
11. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[5,7-дигидрокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он.
12. Способ получения соединений формулы (I) в соответствии с п.1, который характеризуется тем, что соединение формулы (II)
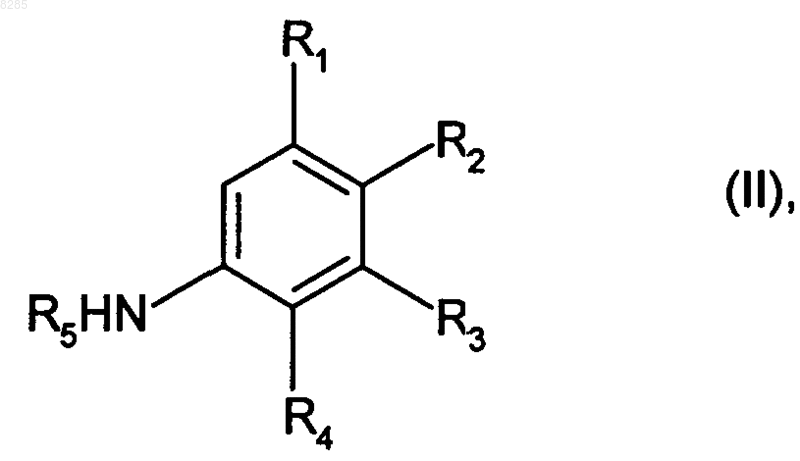
где R1, R2, R3, R4 и R5 имеют значения, приведенные для формулы (I),
подвергают взаимодействию с диэтилэтоксиметиленмалонатом, получая соединение формулы (III)
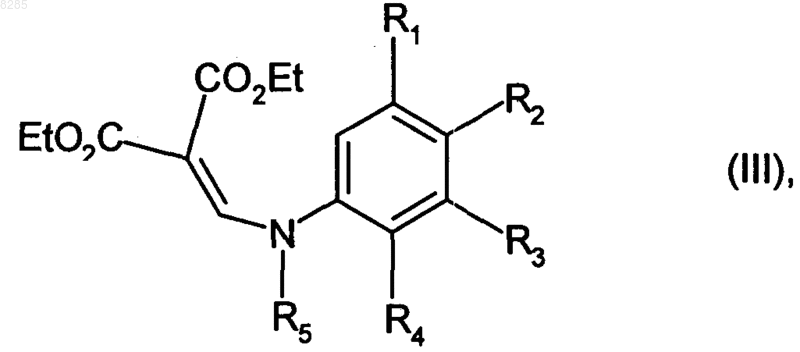
где R1, R2, R3, R4 и R5 имеют значения, указанные выше, и Et представляет собой этильную группу,
которое подвергают реакции замыкания цикла в кислых условиях, получая соединение формулы (IV)
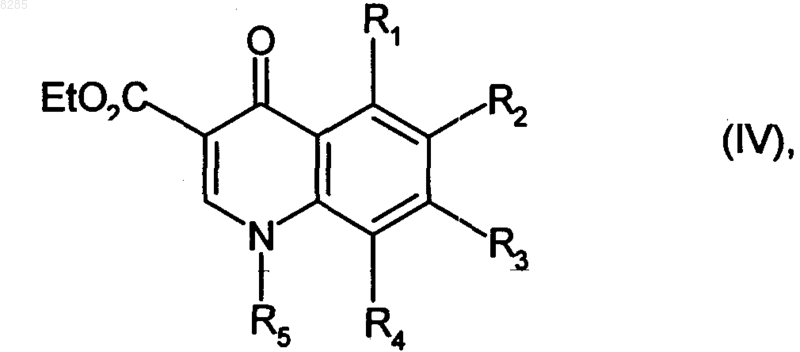
где R1, R2, R3, R4 и R5 и Et имеют значения, указанные выше,
которое подвергают гидролизу, получая соединение формулы (V)
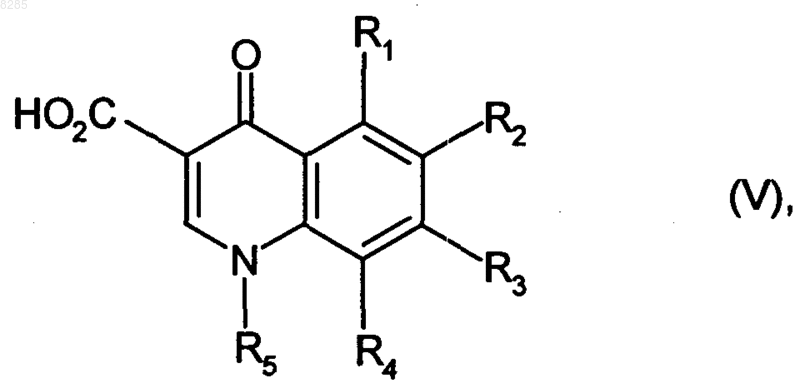
где R1, R2, R3, R4 и R5 имеют значения, указанные выше,
которое превращают в хлорангидрид путем взаимодействия с тионилхлоридом, который затем подвергают реакции с соединением формулы (VI)
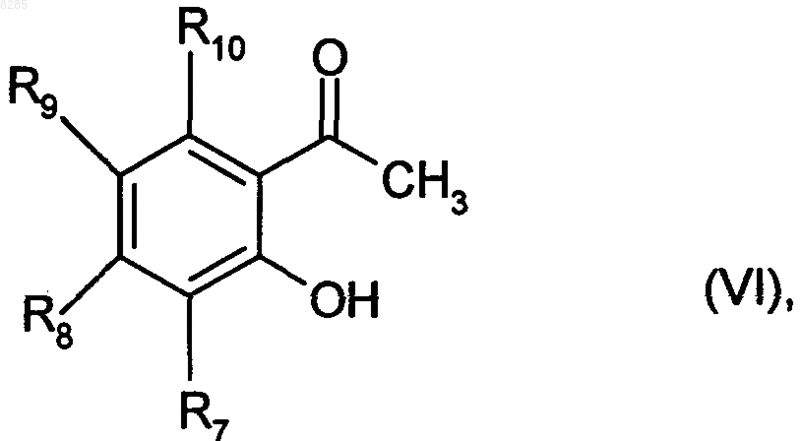
где R7, R8, R9 и R10 имеют значения, приведенные для формулы (I),
получая соединение формулы (VII)

где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше,
которое подвергают воздействию основания, получая соединение формулы (VIII)
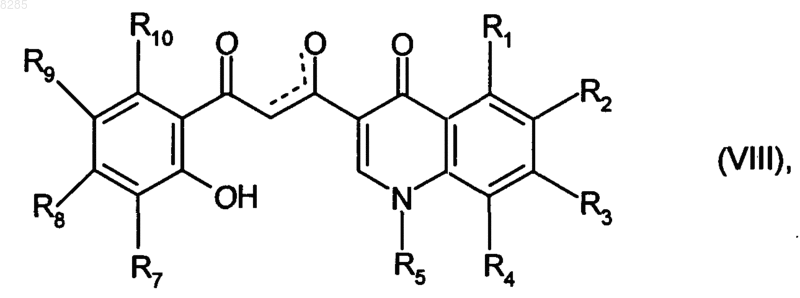
где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше, и
 обозначает, что соединение получают, в зависимости от вовлеченных молекул, в форме кето-енольной смеси,
обозначает, что соединение получают, в зависимости от вовлеченных молекул, в форме кето-енольной смеси,
которое затем подвергают воздействию кислой среды, получая соединение формулы (I), которое очищают, при необходимости, в соответствии с обычными способами очистки, разделяют при необходимости на его оптические изомеры в соответствии с обычными способами разделения и превращают, если это является желательным, в его соли присоединения с фармацевтически приемлемой кислотой.
13. Фармацевтическая композиция, которая содержит в качестве активного компонента соединение в соответствии с любым из пп.1-11 в сочетании с одним или более инертными, нетоксичными, фармацевтически приемлемыми носителями.
14. Фармацевтическая композиция в соответствии с п.13 для применения в качестве противоопухолевого лекарственного средства.
Текст
008285 Настоящее изобретение относится к новым соединениям 3-(4-оксо-4H-хромен-2-ил)-(1H)-хинолин 4-она, к способу их получения, к фармацевтическим композициям, которые их содержат, и к их применению в качестве противоопухолевых средств. В ЕР 0758649 описаны производные хромона, которые ингибируют активность матричной металлопротеиназы, вследствие чего они могут быть пригодными для лечения рака. В патенте JP 07330743 описаны производные хинолинола в качестве противоопухолевых агентов. Необходимость противоопухолевой терапии вызывает постоянную разработку новых противоопухолевых средств с целью получения лекарственных средств, которые одновременно являются более активными и лучше переносимыми. Соединения, раскрытые в настоящем изобретении, кроме того, что являются новыми, обладают чрезвычайно ценными противоопухолевыми свойствами. С одной стороны, они обладают проапоптотическим действием, эффективность которого не зависит от экспрессии р 53, pRb и Вcl-2 и значительным антиангиогенным действием, и, с другой стороны, они обладают синергетическим действием со многими цитостатическими терапевтическими средствами, не обнаруживая при этом дополнительной гемотоксичности, или, в целом, любой заметной непереносимости. Вследствие таких свойств, соединения по изобретению являются высокоэффективными, хорошо переносимыми адъювантами к химиотерапии, и, вместе с тем, средствами, способными поддерживать и пролонгировать действие таких химиотерапевтических средств в тех случаях, когда эти химиотерапевтические средства прекращают применять в связи с непереносимостью, окончанием курса лечения, отменой в связи с хирургическим вмешательством и т.д. Благодаря их свойствам, соединения по изобретению благоприятно могут сочетаться со всеми видами цитотоксического лечения, которые применяются в настоящее время, а также с лучевой терапией(не вызывая при этом повышения их токсичности) и разными видами гормональной терапии для лечения злокачественных новообразований (молочной железы и предстательной железы). В частности, настоящее изобретение относится к соединениям формулы (I) в которой R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси,линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и OR', где R' представляет собой ионизированную или способную к ионизации группу, такую как, например, фосфатная группа -РО(ОН)2, сульфатная группа -SO3H, карбоксиалкилкарбонила, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6), диалкиламиноалкилкарбонила, в котором каждая алкильная группа представляет собой линейный или разветвленный (C1-C6), или карбоксиалкиламинокарбонила, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6),R5 представляет собой группу, выбранную из линейного или разветвленного (C1-C6)алкила, арила и гетероарила,R7 представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного(C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила и (С 3-С 7)циклоалкила, или R7 представляет собой азотсодержащий или кислородсодержащий гетероцикл, к их оптическим изомерам, если они существуют, к их солям присоединения с фармацевтически приемлемой кислотой и к их гидратам и сольватам. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, уксусную кислоту,трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, щавелевую кислоту, метансульфоновую кислоту, бензолсульфоновую кислоту, камфорную кислоту. Под арильной группой подразумевают фенил, бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена одним(ой) или несколькими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1-C6)алкоксигрупп, линейных или разветвленных (C1-1 008285C6)полигалоалкильных групп, аминогрупп (необязательно замещенных одной иди двумя линейными или разветвленными (C1-C6)алкильными группами), нитрогрупп и (C1-C6)алкилендиоксигрупп. Под гетероарильной группой подразумевают 5-12-членную группу, которая является моноциклической и ароматической или бициклической, в которой по крайней мере одно из колец является ароматическим, и которая содержит один, два или три гетероатома, выбранных из кислорода, азота и серы, и подразумевается, что гетероарильная группа необязательно может быть замещена одним(ой) или несколькими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1C6)алкоксигрупп, линейных или разветвленных (C1-C6)полигалоалкильных групп и аминогрупп (необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами). Среди гетероарильных групп можно отметить, но не ограничиваясь только ими, такие группы, как тиенил, пиридил, фурил, пирролил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, хинолил,изохинолил и пиримидинил. Под азотсодержащим гетероциклом подразумевают насыщенную или ненасыщенную, 5-7-членную моноциклическую группу, содержащую атом азота, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1C6)алкильными группами. Предпочтительными азотсодержащими гетероциклами являются необязательно замещенные пиперидильная и тетрагидропиридильная группы. Под кислородсодержащим гетероциклом подразумевают насыщенную или ненасыщенную, 5-7 членную моноциклическую группу, содержащую атом кислорода, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1C6)алкильными группами. Предпочтительный вариант осуществления изобретения относится к соединениям формулы (I), в которых R5 представляет собой арильную группу. Другой предпочтительный вариант осуществления изобретения относится к соединениям формулы(I), в которых R7 представляет собой атом водорода. Другой предпочтительный вариант осуществления изобретения относится к соединениям формулы(I), в которых R7 представляет собой необязательно замещенный азотсодержащий гетероцикл. Предпочтительными являются соединения формулы (I), в которых R5 представляет собой фенильную группу и R7 представляет собой атом водорода или замещенную 1,2,3,6-тетрагидро-4-пиридильную группу. Среди предпочтительных соединений по изобретению более предпочтительными являются: 3-(5-гидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он,3-[5,7-диметокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1 фенил-1H-1,4-дигидрохинолин-4-он,3-(5,7-дигидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он и 3-[5,7-дигидрокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1 фенил-1H-1,4-дигидрохинолин-4-он. Изобретение также относится к способу получения соединений формулы (I), который характеризуется тем, что соединение формулы (II) где R1, R2, R3, R4 и R5 имеют значения, приведенные для формулы (I), подвергают взаимодействию с диэтилэтоксиметиленмалонатом, получая соединение формулы (III)-2 008285 где R1, R2, R3, R4 и R5 имеют значения, указанные выше, и Et представляет собой этильную группу,которое подвергают реакции замыкания цикла в кислых условиях, получая соединение формулы где R1, R2, R3, R4 и R5 и Et имеют значения, указанные выше,которое подвергают гидролизу, получая соединение формулы (V) где R1, R2, R3, R4 и R5 имеют значения, указанные выше,которое превращают в хлорангидрид путем взаимодействия с тионилхлоридом, который затем подвергают реакции с соединением формулы (VI) где R7, R8, R9 и R10 имеют значения, приведенные для формулы (I),получая соединение формулы (VII) где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше,которое подвергают воздействию основания, получая соединение формулы (VIII) обозначает, что где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше, и соединение получают, в зависимости от вовлеченных молекул, в форме кето-енольной смеси. которое затем подвергают воздействию кислой среды, получая соединение формулы (I), которое очищают, при необходимости, в соответствии с обычными способами очистки, разделяют, при необходимости, на его оптические изомеры в соответствии с обычными способами разделения и превращают,если это является желательным, в его соли присоединения с фармацевтически приемлемой кислотой. Соединения формулы (I), в которых один или несколько заместителей R1-R4 и R6-R10 представляет(ют) собой гидроксигруппу, также могут быть получены путем расщепления соединений формулы (I),в которых соответствующий(е) заместитель(и) представляет(ют) собой линейную или разветвленную-3 008285 Соединения формулы (I), в которых один или несколько заместителей R1-R4 и R6-R10 представляет(ют) собой алкоксикарбонилалкокси, арилалкокси или группу OR', также могут быть получены, исходя из соединений формулы (I), в которых соответствующий(е) заместитель(и) представляет(ют) собой гидроксигруппу. Соединения, раскрытые в настоящем изобретении, кроме того, что являются новыми, обладают чрезвычайно ценными противоопухолевыми свойствами, и поэтому являются пригодными для лечения злокачественных новообразований. Среды видов злокачественных новообразований, которые можно лечить при помощи соединений согласно настоящему изобретению, можно отметить, но не ограничиваясь только ими, аденокарциномы,карциномы, саркомы, глиомы и лейкозы. Они также могут применяться для лечения в сочетании с другим противоопухолевым средством,таким как, например, паклитаксел, тамоксифен и его производные, цисплатин и его аналоги, иринотекан и его метаболиты, разнообразные алкилирующие средства, основными представителем которых является циклофосфамид, этопозид, алкалоиды барвинка, доксорубицин и другие антрациклины и нитрозомочевины. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента по крайней мере одно соединение формулы (I) совместно с одним или более подходящими, инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного, внутримышечного или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и т.д. Полезная дозировка может адаптироваться в зависимости от природы и тяжести расстройства, пути введения, возраста и веса пациента и других совместных видов лечения и составляет от 0,5 мг до 2 г в сутки на одно или больше введений. Примеры, представленные далее, приведены только с целью иллюстрации и никоим образом не ограничивают изобретение. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (инфракрасная, ЯМР, масс-спектрометрия). Пример 1. 3-(7-Метокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он. Стадия А. Диэтил N-N-дифениламинометиленмалонат. 10 ммоль диэтилэтоксиметиленмалоната добавляли к 10 ммоль дифениламина и затем смесь нагревали при 140-150 С в течение 5 ч. После возвращения температуры до температуры окружающей среды полученное таким образом твердое вещество промывали 100 мл диэтилового эфира и перекристаллизовывали из гексана, получая требуемый продукт в виде коричневого твердого вещества. Точка плавления: 146-148 С.MS (EI, m/z): 339,9 (М+). Стадия В. Этил 4-оксо-1-фенил-1H-1,4-дигидрохинолин-3-карбоксилат. 13,3 г полифосфорной кислоты добавляли к 10 ммоль соединения, полученного на предыдущей стадии. Затем смесь (которая постепенно становилась жидкой) нагревали при 150-160 С в течение 45 мин и затем охлаждали до 90 С. После гидролиза смесь нейтрализовали, используя 10% раствор NaOH,получая, после выделения, требуемый продукт. ИК (NaCl пластинки, см-1): 1733 (C=O), 1610 (C=C), 1645 (C=O), 690 (C-H(ar.MS (EI, m/z): 293,3 (M+). Стадия С. 4-Оксо-1-фенил-1 Н-1,4-дигидрохинолин-3-карбоновая кислота. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в метаноле, добавляли 38 мл 2 М раствора NaOH. Затем реакционную смесь нагревали в колбе с метанолом с обратным холодильником в течение 10 ч и затем растворитель удаляли в вакууме. К полученному остатку добавляли воду и затем смесь нейтрализовали 4 М раствором НСl. Полученное серое твердое вещество промывали водой и затем высушивали, получая требуемый продукт. Точка плавления: 210-213 С. ИК(KBr, см-1): 3320 (ОН(кислота, 1733 (C=O), 1610 (C=C), 1645 (C=O), 690 (C-H(ar.MS(EI, m/z): 265,3 (M+). Стадия D. (2-Ацетил-5-метокси)фенил 4-оксо-1-фенил-1 Н-1,4-дигидрохинолин-3-карбоксилат. 10 ммоль соединения, полученного на предыдущей стадии, добавляли к 20 ммоль тионилхлорида,растворенного в дихлорэтане. Реакционную смесь нагревали в колбе с растворителем с обратным холодильником в течение 2 ч и затем концентрировали в вакууме, и избыток тионилхлорида удаляли путем перегонки в вакууме с захватом дихлорэтана, повторяя несколько раз. Полученный таким образом хлорангидрид (белое твердое вещество) добавляли небольшими пор-4 008285 циями к 6,7 ммоль коммерческого 2-гидрокси-4-метоксиацетофенона, растворенного в пиридине. После перемешивания в течение 12 ч в инертной атмосфере при температуре окружающей среды реакционную смесь очищали путем хроматографии на силикагелевой колонке (элюент: CH2Cl2/МеОН: 95/5), получая требуемый продукт в виде желтого порошка. Точка плавления: 137-139 С. ИК (KBr, см-1): 2865 (CH из ОСН 3), 1740 (C=O), 1655 (C=O), 1590-1575 (C=C).MS (электрораспыление, m/z): 413,4 (M+). Стадия Е. 3-[3-(2-Гидрокси-4-метоксифенил)-1,3-диоксопроп-1-ил]-1 Н-1-фенил-1,4-дигидрохинолин-4-он. В инертной атмосфере и при температуре окружающей среды 12 ммоль трет-бутанолята калия медленно добавляли к 10 ммоль соединения, полученного на предыдущей стадии, растворенного в смеси диметилформамида и тетрагидрофурана (35/75). Реакционную смесь перемешивали в течение 2 ч и затем вливали в раствор 55 мл воды при 0 С, содержащий 1,3 мл 10% соляной кислоты. Полученный осадок отфильтровывали, промывали большим количеством воды и затем высушивали. Полученное твердое вещество очищали путем хроматографии на силикагелевой колонке (элюент: CH2Cl2), получая требуемый продукт в виде кето-енольной смеси. Точка плавления: 228-230 С. Стадия F. 3-(7-Метокси-4-оксо-4 Н-1-бензопиран-2-ил)-1-фенил-1 Н-1,4-дигидрохинолин-4-он. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в 25 мл ледяной уксусной кислоты, медленно добавляли 25 мл раствора уксусной кислоты, содержащей 20% серную кислоту. Образовывался желтый осадок. Через 2 ч 30 мин при температуре окружающей среды смесь вливали в ледяную воду (4 С). Нерастворимое вещество отфильтровывали и промывали большим количеством воды, получая требуемый продукт в виде белого порошка. Точка плавления: 297 С. ИК (см-1): 2825 (OCH3), 1750 (C=O), 1675 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,63 4,63 3,39 Найдено: 72,46 4,57 3,27 Пример 2. 3-(7-Гидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он. 10 ммоль соединения из примера 1 добавляли, при перемешивании в инертной атмосфере и защищая от воздействия света, к 500 ммоль фенола, растворенного в 214 мл йодисто-водородной кислоты(57% водный раствор). Затем гетерогенную реакционную смесь нагревали при 160 С в течение 15 ч. Изначально желтый раствор становился оранжевым. После возвращения температуры до температуры окружающей среды раствор наливали на лед и полученный осадок промывали водой и затем диэтиловым эфиром для удаления оставшегося фенола, получая, после перекристаллизации, требуемый продукт в виде желтого порошка. Точка плавления: 295-300 С (ацетон) ИК (см-1): 3280 (OH), 1770 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,17 4,29 3,51 Найдено: 72,37 4,37 3,55 Пример 3. 3-(6-Метокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон 2-гидрокси-5-метоксиацетофеноном. Точка плавления: 265 С. ИК (см-1): 2830 (OCH3), 1740 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,63 4,63 3,39 Найдено: 72,74 4,46 3,36 Пример 4. 3-(5-Метокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон 2-гидрокси-6-метоксиацетофеноном. Точка плавления: 271 С. ИК (см-1): 2830 (OCH3), 1744 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,63 4,63 3,39 Найдено: 72,46 4,57 3,27 Пример 5. 3-(5,7-Диметокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1 Н-1,4-дигидрохинолин-4-он. Стадия А. 2,4-Диметокси-6-гидроксиацетофенон. 14,5 ммоль K2CO3 быстро добавляли к 10 ммоль моногидрата флороацетофенона, растворенного в ацетоне. В инертной атмосфере затем добавляли 20 ммоль диметилсульфата в течение 30 мин и реакционную смесь нагревали в колбе с ацетоном с обратным холодильником в течение 12 ч. После возвращения температуры до температуры окружающей среды смесь вливали в воду, получая белую суспензию, которую затем фильтровали. Полученный белый порошок промывали и затем перекристаллизовывали из метанола, получая требуемый продукт. Точка плавления: 80-81 С (метанол). Стадия В. 3-(5,7-Диметокси-4-оксо-4 Н-1-бензопиран-2-ил)-1-фенил-1 Н-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон соединением, полученным на вышеописанной стадии А. Точка плавления: 282 С. ИК (см-1): 2825 (OCH3), 1744 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 70,42 4,77 3,16 Найдено: 70,33 4,76 3,26 Пример 6. 3-(5-Гидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 2, исходя из соединения из примера 4. Точка плавления: 300 С (ацетон) ИК (см-1): 3200 (OH), 1770 (C=O), 1635 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,17 4,29 3,51 Найдено: 72,33 4,40 3,65 Пример 7. 3-(5-Гидрокси-7-метокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он. 11 ммоль BBr3 (в виде 1 М растворе в дихлорметане) добавляли в течение 15 мин в инертной атмосфере и защищали от воздействия света к 10 ммоль соединения из примера 5 в виде суспензии в дихлорметане, вызывая образование желтого осадка. Реакционную смесь интенсивно перемешивали при температуре окружающей среды в течение 6 ч и затем охлаждали до 0 С. Затем добавляли этанол и раствор концентрировали в вакууме. Затем полученный остаток вливали в водный спиртовый раствор (50%) и после этого смесь интенсивно перемешивали в течение 10 мин. Полученный осадок отфильтровывали и промывали водой и затем диэтиловым эфиром, получая, после перекристаллизации, требуемый продукт в виде бежевого порошка. Точка плавления: 295-296 С (ацетон) ИК (см-1): 3224 (OH), 1780 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,99 4,16 3,40 Найдено: 72,70 4,10 3,45 Пример 8. 3-(4-Оксо-4H-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон ацетофеноном. Точка плавления: 327-328 С.%N Рассчитано: 78,89 4,14 3,83 Найдено: 78,60 4,10 3,60 Пример 9. 3-[5,7-Диметокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран 2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Стадия А. 4-(2,4-Диметокси-6-гидрокси-5-метилкарбонилфенил)-1-метил-1,2,5,6-тетрагидропи-6 008285 ридин. К 10 ммоль соединения, полученного на стадии А примера 5, растворенного в ледяной уксусной кислоте, медленно добавляли таким образом, чтоб не превысить 25 С, 11,5 ммоль 1-метилпиперидин-4-она. После завершения добавления барботировали потоком хлористого водорода в течение 1 ч 40 мин и затем реакционную смесь нагревали при температуре в интервале 95-100 С в течение 5 ч. Уксусную кислоту удаляли путем перегонки в вакууме, и затем оставшееся масло ресуспендировали в воде и экстрагировали диэтиловым эфиром. Водную фазу подщелачивали путем добавления 40% раствора NaOH. Полученный осадок отфильтровывали, промывали большим количеством воды и перекристаллизовывали из петролейного эфира, получая требуемый продукт. Точка плавления: 143-144 С. ИК (KBr, см-1): 3400-3200 (OH), 2843 (OCH3), 1680 (C=O), 1655 (C=C).MS(EI, m/z): 291 (M+). Стадия В. 3-[5,7-Диметокси-8-(1-метил-1,2,5,6-тетрагидропиридинил)-4-оксо-4 Н-1-бензопиран-2 ил]-1-фенил-1 Н-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон соединением, полученным на вышеописанной стадии А. Точка плавления: 248-250 С (ацетон). ИК (см-1): 2835 (OCH3), 1755 (C=O), 1675 (CO), 1570-1590 (C=C).%N Рассчитано: 73,28 5,10 5,22 Найдено: 73,83 5,42 5,38 Пример 10. 3-(5,7-Дигидрокси-4-оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4 он. Требуемый продукт получали в соответствии с методикой, описанной в примере 2, исходя из соединения из примера 5. Точка плавления: 365-368 С (ацетон). ИК (см-1): 3224 (OH), 1780 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,54 3,80 3,52 Найдено: 72,20 4,01 3,33 Пример 11. Этил [2-(4-оксо-1-фенил-1H-1,4-дигидрохинолин-3-ил)-4H-1-бензопиран-7-илокси] ацетат. К 10 ммоль соединения из примера 2, суспендированного в ацетоне, медленно добавляли 20 ммоль карбоната калия и затем 20 ммоль этилбромацетата. Смесь нагревали с растворителем в колбе с обратным холодильником в течение 2 ч 30 мин и затем, после возвращения температуры до температуры окружающей среды, вливали в воду. Полученное нерастворимое вещество отфильтровывали и промывали большим количеством воды, получая требуемый продукт в виде белого твердого вещества. Точка плавления: 330 С. ИК (см-1): 1744 (C=O), 1680 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 71,94 4,53 3,00 Найдено: 71,70 4,77 3,40 Пример 12. 3-[5,7-Диметокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран 2-ил]-1-метил-1 Н-1,4-дигидрохинолин-4-он. Стадия А. Диэтил N-фениламинометиленмалонат. Требуемый продукт получали в соответствии с методикой, описанной на стадии А примера 1, но заменяя дифениламин анилином. Точка плавления: 46-48 С (гексан).MS(EI, m/z): 263 (М+). Стадия В. Диэтил N-метил-N-фениламинометиленмалонат. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в тетрагидрофуране,медленно добавляли (небольшими порциями) и в инертной атмосфере 12 ммоль 95% NaH и затем, по каплям, 30 ммоль йодметана. Затем реакционную смесь перемешивали, при температуре окружающей среды и в инертной атмосфере, в течение 12 ч. 1 мл метанола добавляли для нейтрализации избытка гидрида натрия. Затем раствор концентрировали в вакууме и после этого к полученному оставшемуся маслу-7 008285 добавляли воду. После экстрагирования дихлорметаном объединенные органические фазы высушивали,фильтровали и концентрировали при пониженном давлении, получая требуемый продукт в виде бесцветного масла.MS (EI, m/z): 276 (М+). Стадия С. 3-[5,7-Диметокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4 Н-1-бензопиран-2 ил]-1-метил-1 Н-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной на стадиях В-F примера 1, но заменяя на стадии В соединение, полученное на стадии А примера 1 соединением, полученным на вышеописанной стадии В, и заменяя на стадии D 2-гидрокси-4-метоксиацетофенон соединением, полученным на стадии А примера 9. Точка плавления: 289-291 С (ацетон). ИК (см-1): 2835 (OCH3), 1755 (C=O), 1675 (C=O), 1570-1590 (C=C).%N Рассчитано: 70,73 5,72 6,11 Найдено: 70,25 5,48 5,78 Пример 13. 3-[5,7-Диметокси-8-[1-(4-фторбензил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо-4H-1 бензопиран-1-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Стадия А. 1-(4-Фторбензил)пиперидин-4-он. К 10 ммоль моногидрата гидрохлорида пиперидин-4-она и 20 ммоль триэтиламина, растворенного в дихлорметане, медленно добавляли 10 ммоль 4-фторбензилхлорида; затем реакционную смесь нагревали в колбе с растворителем с обратным холодильником в течение 48 ч при интенсивном перемешивании. После возвращения температуры до температуры окружающей среды добавляли воду и затем, после разделения фаз, органическую фазу высушивали, фильтровали и концентрировали в вакууме, получая требуемый продукт в виде оранжевого масла.MS (EI, m/z): 207,2 (М+). Стадия В. 4-(3-Ацетил-4,6-диметокси-2-гидроксифенил)-1-(4-фторбензил)-1,2,5,6-тетрагидропиридин. К 10 ммоль соединения, полученного на стадии А примера 5, растворенного в ледяной уксусной кислоте, медленно добавляли так, чтобы не превысить 25 С, 11 ммоль соединения, полученного на вышеописанной стадии А. После завершения добавления через раствор пропускали поток хлористого водорода в течение 2 ч и затем реакционную смесь нагревали при температуре в интервале 95-100 С в течение 5 ч. Уксусную кислоту удаляли путем перегонки в вакууме и затем к полученному оставшемуся маслу добавляли воду. После экстрагирования диэтиловым эфиром водную фазу подщелачивали, используя 40% раствор NaOH. Полученный осадок отфильтровывали, промывали большим количеством воды и перекристаллизовывали из простого эфира/этилацетата (90/10), получая требуемый продукт в виде бежевого твердого вещества. Точка плавления: 147-150 С. ИК (KBr, см-1): 3400-3200 (OH), 2871 (CH из ОСН 3), 1633 (C=O), 1655 (C=C), 1350-1100 (C-F).MS (EI, m/z): 385,4 (M+). Стадия С. 3-[5,7-Диметокси-8-[1-(4-фторбензил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо-4 Н-1 бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 1, но заменяя на стадии D 2-гидрокси-4-метоксиацетофенон соединением, полученным на вышеописанной стадии В. Точка плавления: 218-219 С (ацетон). ИК(см-1): 2835 (OCH3), 1755 (C=O), 1655 (C=O), 1570-1590 (C=C).MS (электрораспыление, m/z): 614,66 (М+). Пример 14. 3-[5,7-Дигидрокси-8-(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. 10 ммоль соединения из примера 9 диспергировали в хлориде пиридиния; затем смесь нагревали при 180 С в запечатанной трубке в течение 12 ч. После охлаждения до 100 С реакционную смесь затем вливали в воду и значение рН доводили до 7-8, используя 10% раствор гидрокарбоната натрия (изначально значение рН составляло 1). Нерастворимое вещество отделяли путем фильтрации и затем промывали водой, получая требуемый продукт. Точка плавления: 250 С. ИК (см-1): 3330 (OH), 1785 (C=O), 1665 (C=O), 1570-1590 (C=C).%N Рассчитано: 72,94 5,12 5,87 Найдено: 73,16 4,91 5,69 Пример 15. 3-[5,7-Диметокси-8-(1-бензил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примерах В-С пример 13,но заменяя на стадии В соединение, полученное на стадии А примера 13, 1-бензилпиперидин-4-оном. Точка плавления: 248-249 С (ацетон). ИК (см-1): 2830 (CH из ОСН 3), 1765 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 76,49 5,41 4,69 Найдено: 76,06 5,03 4,93 Пример 16. 3-[5,7-Дигидрокси-8-(1-бензил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-бензопиран 2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 14, исходя из соединения из примера 15. Точка плавления: 230-231 С (ацетон). ИК (см-1): 3340 (OH), 1752 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 76,04 4,96 4,93 Найдено: 76,39 5,41 5,22 Пример 17. 3-[5,7-Дигидрокси-8-[1-(4-фторбензил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо-4H-1 бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 14, исходя из соединения из примера 13. Точка плавления: 197-198 С (ацетон). ИК (см-1): 3245 (OH), 1775 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 73,71 4,64 4,78 Найдено: 73,20 4,28 4,34 Пример 18. 3-[5,7-Диметокси-8-[1-(4-метоксибензил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо-4H-1 бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 13, но заменяя на стадии А 4-фторбензилхлорид 4-метоксибензилхлоридом. Точка плавления: 232-235 С (ацетон). ИК (см-1): 2845 (OCH3), 1750 (C=O), 1655 (C=O), 1570-1590 (C=C).MS (электрораспыление, m/z): 626,7 (M+). Пример 19. 3-[5,7-Диметокси-8-(1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1 фенил-1H-1,4-дигидрохинолин-4-он. К 10 ммоль соединения из примера 18, суспендированного в ледяной уксусной кислоте, в инертной атмосфере добавляли 0,9 мг Pd/C (10% по массе). Реакционную смесь нагревали до 70 С и перемешивали в атмосфере водорода при атмосферном давлении в течение 5 ч. Затем реакционную смесь фильтровали через целит и после этого промывали метанолом. Растворители удаляли путем перегонки в вакууме. Значение рН водной среды устанавливали на 8-9 и добавляли к полученному остатку. При экстрагировании смесью CH2Cl2 /МеОН (90/10) получали требуемый продукт в виде белого твердого вещества. Точка плавления: 251-253 С (диэтиловый эфир/ацетон). ИК (см-1): 3387 (N-H), 2880 (OCH3), 1780 (C=O), 1655 (C=O), 1570-1590 (C=C).-9 008285 Требуемый продукт получали в соответствии с методикой, описанной в примерах В-С примера 13,но заменяя на стадии В соединение, полученное на стадии А примера 13, N-изопропилпиперидин-4 оном. Точка плавления: 248-249 С (ацетон). ИК (см-1): 2850 (OCH3), 1755 (C=O), 1650 (C=O), 1570-1590 (C=C).%N Рассчитано: 74,43 5,88 5,11 Найдено: 73,78 5,23 5,78 Пример 21. 3-[7-(4-Бромбензилокси)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-хинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 11, исходя из соединения из примера 2, но заменяя этилбромацетат 4-бромбензилхлоридом. ИК (см-1): 1744 (C=O), 1655 (C=O), 1570-1590 (C=C).%N Рассчитано: 67,65 3,66 2,54 Найдено: 66,95 4,21 2,44 Пример 22. 3-[5,7-Диметокси-8-[1-(2-диметиламиноэтил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо 4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 13, но заменяя на стадии А 4-фторбензилхлорид 2-хлор-N,N-диметилэтиламином. Пример 23. 3-[5,7-Дигидрокси-8-[1-(2-диметиламиноэтил)-1,2,5,6-тетрагидропиридин-4-ил]-4-оксо 4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин-4-он. Требуемый продукт получали в соответствии с методикой, описанной в примере 2, исходя из соединения из примера 22. Фармакологические исследования соединений по изобретению Пример 24. Изучение цитотоксического действия соединений по изобретению в условиях in vitro. Одиннадцать клеточных линий из злокачественных опухолей разного происхождения и локализации (легких, молочной железы, предстательной железы, толстой кишки, крови, мочевого пузыря, кожи,яичника, головного мозга) культивировали для изучения действия различных соединений по сравнению с контрольным веществом. Клетки инкубировали в течение 96 ч с разными концентрациями соединения по изобретению. Цитотоксическое действие в условиях in vitro определяли при помощи МТТ [бромид 3-(4,5 диметилтиазол-2-ил)-2,5-дифенилтетразолия] теста, описанного Carmichael в Cancer Res. - 1987; 47 (4): 936-942. Активность выражали в значениях IC50, т.е. концентрации, которая ингибирует пролиферацию опухолевых клеток на 50%. На этой модели соединения по изобретению обладали значительной цитотоксической активностью по отношению к одной или более линий опухолевых клеток. Например, соединение из примера 9 обладало цитотоксическим действием по отношению к 8 из 11 исследуемых линий (значения IC50 от 2 до 10 мкМ в зависимости от применяемых клеточных линий). Соединение из примера 14 проявляло значения IC50 от 0,05 до 0,25 мкМ по отношению к 5 из 11 исследуемых линий. Пример 25. Синергетическое действие в условиях in vitro соединений по изобретению в сочетании с известными противоопухолевыми средствами. Применяли три клеточные линии, которые чувствительны к трем противоопухолевым средствам: клетки рака молочной железы в сочетании с лечением паклитакселем, клетки рака легкого в сочетании с лечением цисплатином (CDDP) и клетки рака толстой кишки в сочетании с лечением SN38, метаболитом СРТ-11 (иринотекан). Опухолевые клетки инкубировали в течение 96 ч вместе с пятью различными концентрациями каждого из соединений согласно изобретению и пятью различными концентрациями каждого противоопухолевого средства, которое применяется в комбинации. Цитотоксическое действие в условиях in vitro определяли при помощи МТТ теста, описанного в примере 24. Обработку данных осуществляли в соответствии с методом Chou и Talabay, опубликованным вTrends Pharmaceutical Sci. - 1983; 4: 450. Соединения по изобретению обнаруживают синергетическое действие с различными исследуемыми противоопухолевыми средствами, то есть они усиливают цитотоксическое действие противоопухолевого средства при совместном введении.- 10008285 Например, соединения из примеров 14 и 16 обнаруживают синергетическое действие как с паклитакселем, так и с цисплатином. Пример 26. Апоптотическое действие соединения по изобретению. Апоптоз представляет собой естественный механизм, позволяющий организму человека избавляться от атипичных клеток, таких как злокачественных клетки. Изучение проапоптотического действия соединений по изобретению осуществляли на линии рака предстательной железы (LN СаР). Клетки инкубировали в течение периодов в интервале от 8 до 96 ч приIC50 концентрации. Затем проводили исследование TUNEL в соответствии с методом, описанным Sgonc, в Trends Genetics - 1994; 10: 41. Соединения согласно изобретению способны вызывать апоптоз, максимальная интенсивность которого наблюдается в различное время в зависимости от применяемых соединений. Соединения согласно изобретению отличаются от соединений, описанных в уровне техники, по своей способности раньше вызывать апоптоз. Например, наиболее сильный аптопоз вызывается рано (8 ч) при помощи соединения из примера 6. Пример 27. Фармацевтическая композиция. Состав для приготовления 1000 таблеток, каждая из которых содержит 10 мг активного компонента: Соединение из примера 9 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси,линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и OR', где R' представляет собой фосфатную группу -РО(ОН)2, сульфатную группу -SO3H, карбоксиалкилкарбонил, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6), диалкиламиноалкилкарбонил, в котором каждая алкильная группа представляет собой линейный или разветвленный (C1-C6), или карбоксиалкиламинокарбонил, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6),R5 представляет собой группу, выбранную из линейного или разветвленного (C1-C6)алкила, арила и гетероарила,R7 представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного(C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила и (C3-С 7)циклоалкила, или R7 представляет собой азотсодержащий или кислородсодержащий гетероцикл,его оптические изомеры, если они существуют, его соли присоединения с фармацевтически приемлемой кислотой, и его гидраты и сольваты,под арильной группой подразумевают фенил, бифенилил, нафтил или тетрагидронафтил, каждая из этих групп необязательно замещена одним(ой) или несколькими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1-C6)алкоксигрупп, линейных или разветвленных (C1C6)полигалоалкильных групп, аминогрупп (необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами), нитрогрупп и (C1-C6)алкилендиоксигрупп,под гетероарильной группой подразумевают 5-12-членную группу, которая является моноциклической и ароматической или бициклической, в которой по крайней мере одно из колец является ароматическим, и которая содержит один, два или три гетероатома, выбранных из кислорода, азота и серы, и подразумевается, что гетероарильная группа необязательно может быть замещена одним(ой) или несколь- 11008285 кими одинаковыми или разными атомами или группами, выбранными из атомов галогена и линейных или разветвленных (C1-C6)алкильных групп, гидроксигрупп, линейных или разветвленных (C1C6)алкоксигрупп, линейных или разветвленных (C1-C6)полигалоалкильных групп и аминогрупп (необязательно замещенных одной или двумя линейными или разветвленными (C1-C6)алкильными группами),под азотсодержащим гетероциклом подразумевают насыщенную или ненасыщенную 5-7-членную моноциклическую группу, содержащую атом азота, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1C6)алкильными группами,под кислородсодержащим гетероциклом подразумевают насыщенную или ненасыщенную, 5-7 членную моноциклическую группу, содержащую атом кислорода, и необязательно замещенную одной или более группами, выбранными из гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арил-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, и амино-(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной и в котором аминогруппа необязательно замещена одной или двумя линейными или разветвленными (C1C6)алкильными группами. 2. Соединение формулы (I) в соответствии с п.1, в котором R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), и алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный(C1-C6). 3. Соединение формулы (I) в соответствии с п.1, в котором R1, R2, R3, R4, R6, R8, R9 и R10, которые могут быть одинаковыми и разными, каждый представляет собой группу, выбранную из водорода, гидрокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, арилалкокси, в котором алкоксигруппа представляет собой линейный или разветвленный (C1-C6), алкоксикарбонилалкокси, в котором каждая алкоксигруппа представляет собой линейный или разветвленный(C1-C6), и OR', где R' представляет собой группу, выбранную из фосфата -РО(ОН)2, сульфата -SO3H, карбоксиалкилкарбонила, в котором алкильная группа представляет собой линейный или разветвленный(C1-C6), диалкиламиноалкилкарбонила, в котором каждая алкильная группа представляет собой линейный или разветвленный (C1-C6), и карбоксиалкиламинокарбонила, в котором алкильная группа представляет собой линейный или разветвленный (C1-C6). 4. Соединение формулы (I) в соответствии с любым из пп.1-3, в котором R5 представляет собой арильную группу. 5. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R7 представляет собой атом водорода. 6. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором R7 представляет собой необязательно замещенный азотсодержащий гетероцикл. 7. Соединение формулы (I) в соответствии с любым из пп.1-6, в котором R5 представляет собой фенильную группу и R7 представляет собой атом водорода или замещенную 1,2,3,6-тетрагидро-4 пиридильную группу. 8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5-гидрокси-4-оксо 4H-1-бензопиран-2-ил)-1-фенил-1H-хинолин-4-он. 9. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[5,7-диметокси-8-(1 метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4-дигидрохинолин 4-он. 10. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5,7-дигидрокси-4 оксо-4H-1-бензопиран-2-ил)-1-фенил-1H-1,4-дигидрохинолин-4-он. 11. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[5,7-дигидрокси-8(1-метил-1,2,5,6-тетрагидропиридин-4-ил)-4-оксо-4H-1-бензопиран-2-ил]-1-фенил-1H-1,4 дигидрохинолин-4-он. 12. Способ получения соединений формулы (I) в соответствии с п.1, который характеризуется тем,что соединение формулы (II)- 12008285 где R1, R2, R3, R4 и R5 имеют значения, приведенные для формулы (I),подвергают взаимодействию с диэтилэтоксиметиленмалонатом, получая соединение формулы (III) где R1, R2, R3, R4 и R5 имеют значения, указанные выше, и Et представляет собой этильную группу,которое подвергают реакции замыкания цикла в кислых условиях, получая соединение формулы где R1, R2, R3, R4 и R5 и Et имеют значения, указанные выше,которое подвергают гидролизу, получая соединение формулы (V) где R1, R2, R3, R4 и R5 имеют значения, указанные выше,которое превращают в хлорангидрид путем взаимодействия с тионилхлоридом, который затем подвергают реакции с соединением формулы (VI) где R7, R8, R9 и R10 имеют значения, приведенные для формулы (I),получая соединение формулы (VII) где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше,которое подвергают воздействию основания, получая соединение формулы (VIII) где R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 имеют значения, указанные выше, и обозначает, что соединение получают, в зависимости от вовлеченных молекул, в форме кетоенольной смеси,которое затем подвергают воздействию кислой среды, получая соединение формулы (I), которое очищают, при необходимости, в соответствии с обычными способами очистки, разделяют при необхо- 13008285 димости на его оптические изомеры в соответствии с обычными способами разделения и превращают,если это является желательным, в его соли присоединения с фармацевтически приемлемой кислотой. 13. Фармацевтическая композиция, которая содержит в качестве активного компонента соединение в соответствии с любым из пп.1-11 в сочетании с одним или более инертными, нетоксичными, фармацевтически приемлемыми носителями. 14. Фармацевтическая композиция в соответствии с п.13 для применения в качестве противоопухолевого лекарственного средства.
МПК / Метки
МПК: A61K 31/4709, A61P 35/00, C07D 405/14, C07D 405/04
Метки: получения, композиции, 3-(4-оксо-4н-хромен-2-ил)-(1н)-хинолин-4-она, фармацевтические, новые, которые, содержат, способ, соединения
Код ссылки
<a href="https://eas.patents.su/15-8285-novye-soedineniya-3-4-okso-4n-hromen-2-il-1n-hinolin-4-ona-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения 3-(4-оксо-4н-хромен-2-ил)-(1н)-хинолин-4-она, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Пероральные композиции противоопухолевых соединений
Следующий патент: Пероральная лекарственная форма для контролируемого высвобождения лекарственного средства
Случайный патент: Устройство и способ опускания/поднятия объекта в/из текучую среду/текучей среды












