Производные хинолина в качестве антибактериальных агентов
Номер патента: 14163
Опубликовано: 29.10.2010
Авторы: Андрис Кунрад Йозеф Лодевейк Марсель, Мотт Магали Мадлен Симон, Гийемон Жером Эмиль Жорж, Коул Анил
Формула / Реферат
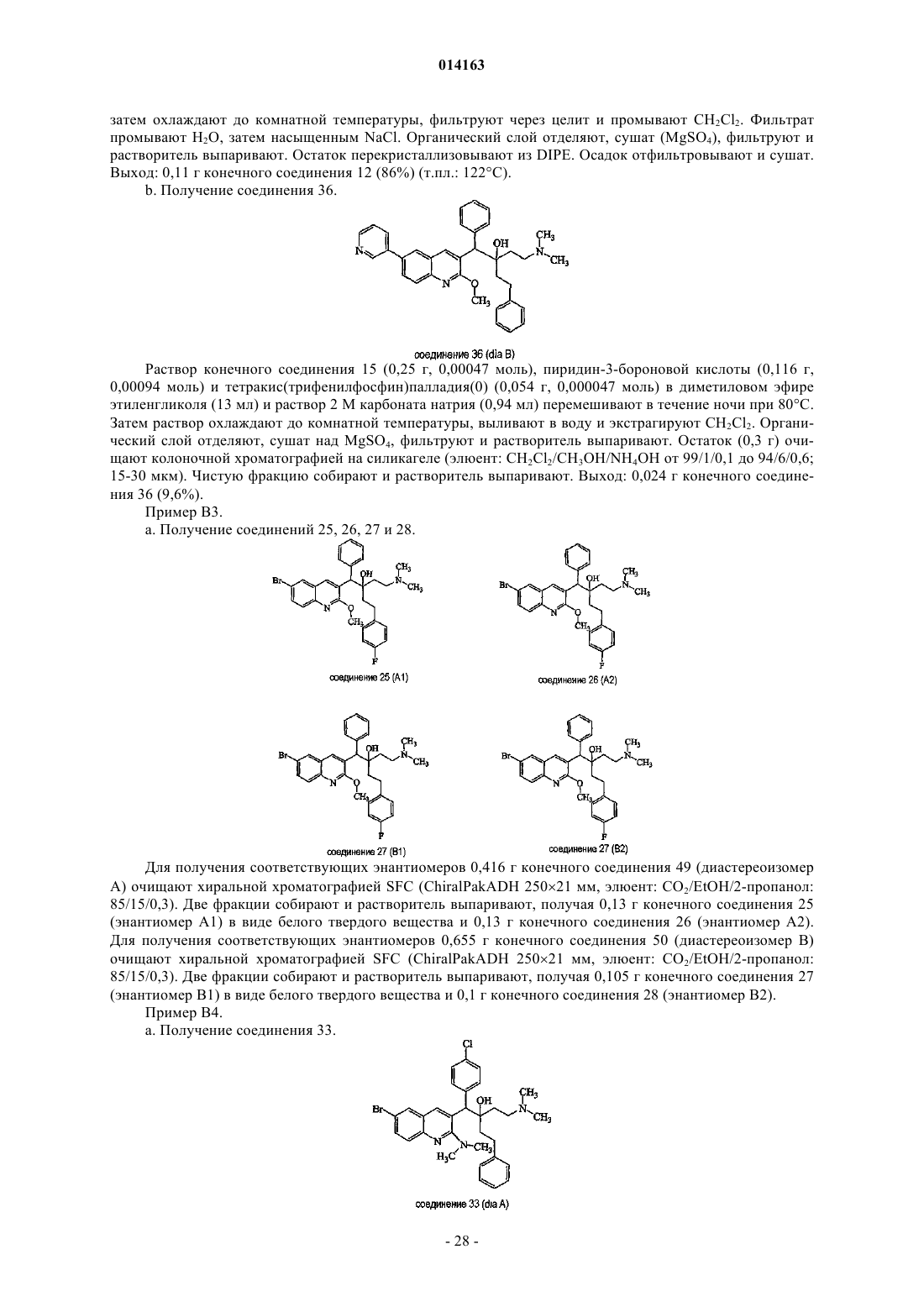
1. Применение соединения для получения лекарственного средства для лечения бактериальной инфекции, причем указанное соединение является соединением формулы (Ia)
его фармацевтически приемлемой аддитивной солью кислоты или основания, его стереохимически изомерной формой или его N-оксидной формой,
где R1означает водород, галоген, фенил, пиридинил, тиенил, фуранил, алкил или алкилокси;
р является целым числом, равным 1, 2, 3 или 4;
R2 означает алкилокси, алкилоксиалкилокси, алкилтио или моно- или ди(алкил)амино;
R3 означает Ar;
R4 и R5, каждый независимо, означают водород, алкил или бензил или
R4 и R5, вместе и включая N, к которому они присоединены, могут образовывать пиперидинил;
R6 означает водород, галоген, алкил или алкилокси;
r является целым числом, равным 1, 2, 3, 4 или 5;
R7 означает водород;
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем каждый атом углерода может быть необязательно замещен гидрокси, алкилокси или оксо;
Alk означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода;
Ar означает фенил или нафтил; указанный фенил необязательно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, алкила, галогеналкила, алкилокси или галогеналкилокси;
галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода; и
галогеналкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; где один или более атомов углерода замещены одним или более атомами галогена; при условии, что бактериальная инфекция отличается от микобактериальной инфекции.
2. Применение по п.1, где R1 означает водород, галоген, алкил или алкилокси.
3. Применение по п.2, где R1 означает водород или галоген.
4. Применение по п.3, где R1 означает галоген.
5. Применение по любому из пп.1-4, где р равно 1.
6. Применение по п.5, где заместитель R1 находится в положении 6 хинолинового кольца.
7. Применение по п.1, где R2 означает С1-4алкилокси.
8. Применение по любому из пп.1-7, где R4 и R5, каждый независимо, означают водород или С1-4алкил.
9. Применение по любому из пп.1-8, где R6 означает водород.
10. Применение по любому из пп.1-9, где Alk означает метилен или этилен.
11. Применение по п.10, где Alk означает этилен.
12. Применение по пп.1-6 и 9-11, в котором алкил представляет собой C1-6алкил.
13. Применение по п.1, в котором соединением является соединение формулы (Ia), где R1означает водород, галоген, C1-4алкил, С1-4алкилокси, фенил, пиридинил, тиенил или фуранил; р равен 1 или 2; R2 означает С1-4 алкилокси, С1-4алкилтио, моно- или ди(С1-4алкил)амино, С1-4алкилокси-С1-4алкилокси-С1-4алкилокси; R3 означает нафтил или фенил, указанный фенил необязательно замещен 1, 2 или 3 заместителями, каждый из которых независимо выбирают из группы, состоящей из галогена, алкила, галогеналкила, алкилокси или галогеналкилокси; R4 и R5, каждый независимо, означают водород или С1-4алкил или R4 и R5, вместе и включая N, к которому они присоединены, образуют пиперидинил; R6 означает водород, галоген, С1-4алкил или С1-4алкилокси; r равен 1; R7 означает водород; Alk означает метилен или этилен.
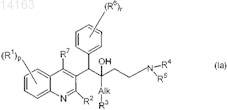
14. Применение по любому из пп.1-13, в котором соединение выбирают из
их фармацевтически приемлемой аддитивной соли кислоты или основания, их стереохимически изомерной формы или их N-оксидной формы.
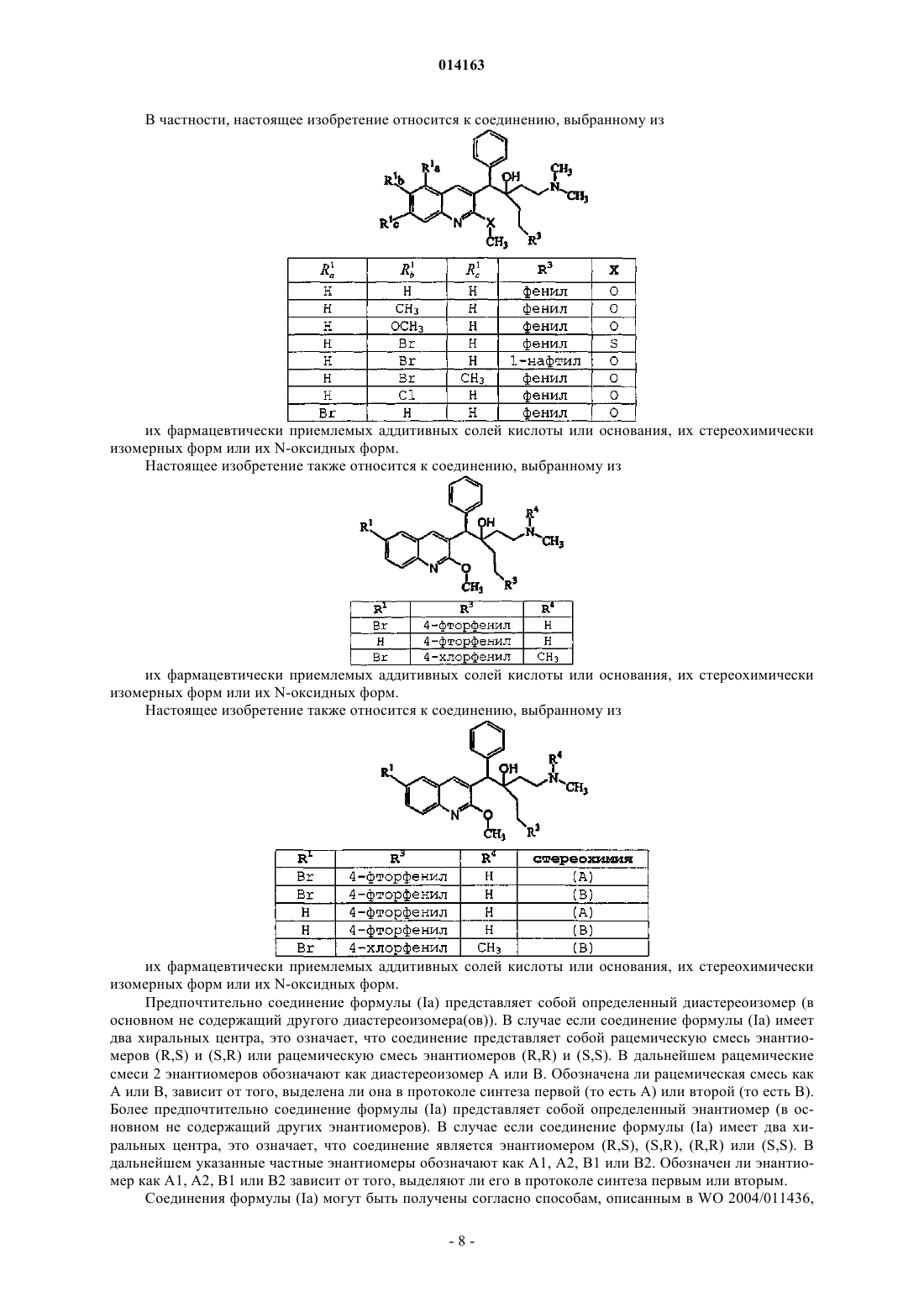
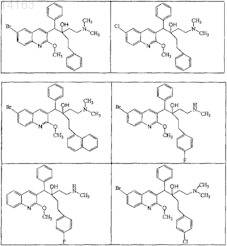
15. Соединение, выбранное из
их фармацевтически приемлемой аддитивной соли кислоты или основания, их стереохимически изомерной формы или их N-оксидной формы.
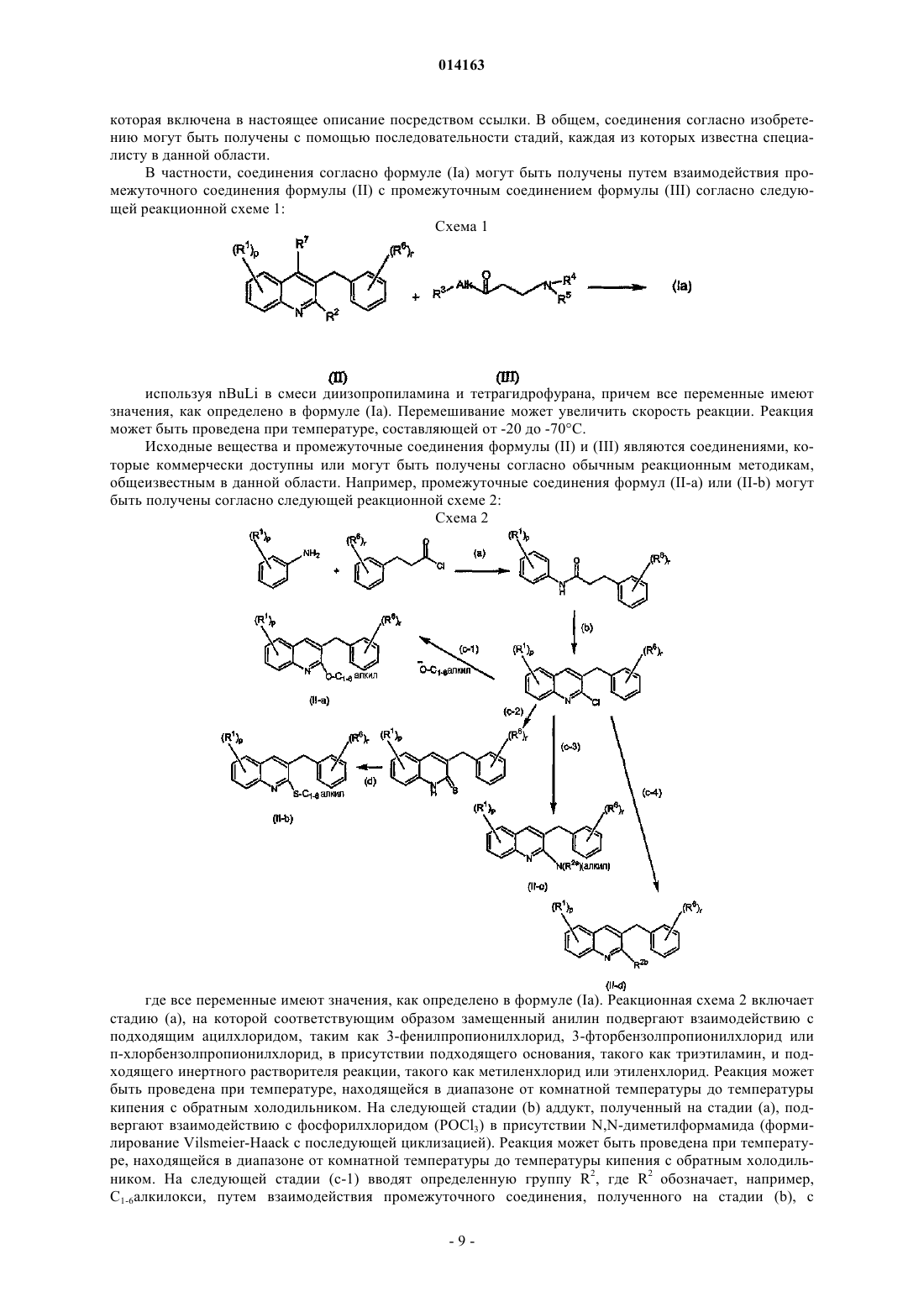
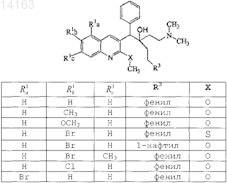
16. Соединение, выбранное из
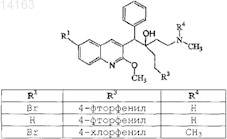
их фармацевтически приемлемой аддитивной соли кислоты или основания, их стереохимически изомерной формы или их N-оксидной формы.
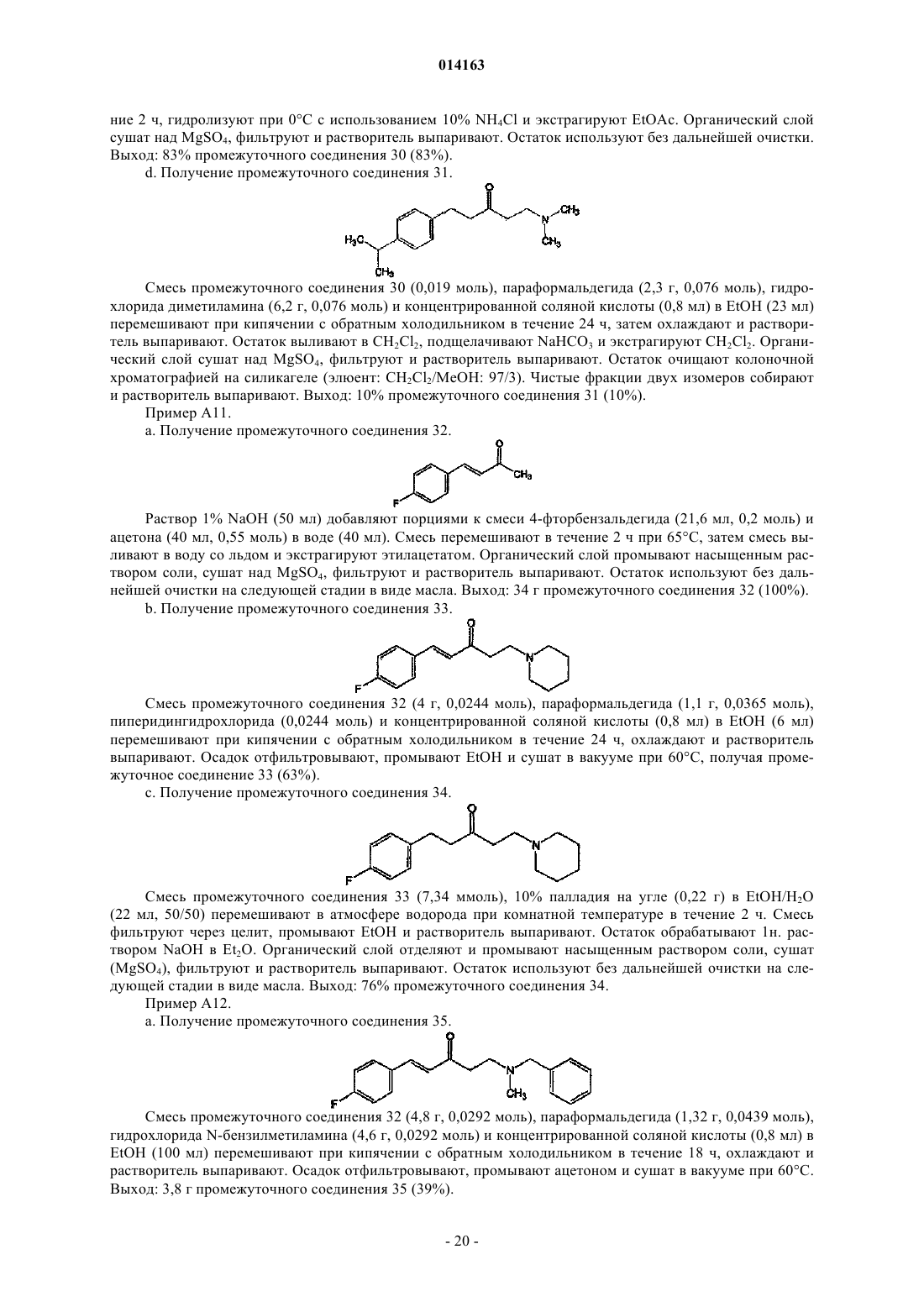
17. Соединение, выбранное из
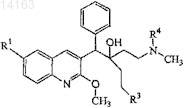

их фармацевтически приемлемой аддитивной соли кислоты или основания, их стереохимически изомерной формы или их N-оксидной формы.
18. Комбинация (а) соединения формулы (Ia) по пп.15, 16 или 17 и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами.
19. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения формулы (Ia) по пп.15, 16 или 17 и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами.
20. Применение комбинации по п.18 или фармацевтической композиции по п.19 для получения лекарственного средства для лечения бактериальной инфекции.
21. Продукт, содержащий (а) соединение формулы (Ia) по пп.15, 16 или 17 и (b) один или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении бактериальной инфекции.
22. Применение по любому из пп.1-14 и 20, где бактериальная инфекция является инфекцией, вызываемой грамположительной бактерией.
23. Применение по любому из пп.1-14, 20 и 22, где бактериальная инфекция является инфекцией, вызываемой стафилококками, энтерококками и стрептококками.
24. Применение по любому из пп.1-14, 20 и 22, где бактериальная инфекция является инфекцией, вызываемой метицилин-резистентным Staphylococcus aureus (MRSA), метицилин-резистентными коагуляза-отрицательными стафилококками (MRCNS), пенициллин-резистентным Streptococcus pneumoniae или мультирезистентным Enterococcus faecium.
25. Применение по любому из пп.1-14, 20 и 22, где бактериальная инфекция является инфекцией, вызываемой Staphylococcus aureus или Streptococcus pneumoniae.
26. Применение по любому из пп.1-14, 20 и 22, где бактериальная инфекция является инфекцией, вызываемой метицилин-резистентным Staphylococcus aureus (MRSA).
Текст
Андрис Кунрад Йозеф Лодевейк Марсель,Коул Анил (BE), Гийемон Жером Эмиль Жорж, Мотт Магали Мадлен Симон (FR) Представитель: Применение соединения для получения лекарственного средства для лечения бактериальной инфекции при условии, что бактериальная инфекция отличается от микобактериальной инфекции, причем указанное соединение является соединением формулы (Iа), его фармацевтически приемлемой аддитивной солью кислоты или основания, его стереохимически изомерной формой или его N-оксидной формой. Некоторые из указанных соединений также заявлены как таковые. Также описана комбинация указанных соединений с другими антибактериальными агентами. 014163 Настоящее изобретение относится к применению производных хинолина для получения лекарственного средства для лечения бактериальной инфекции. В настоящее время встала проблема резистентности к антибиотическим средствам первой линии. Некоторые существенные примеры включают пенициллин-резистентный Streptococcus pneumoniae, ванкомицин-резистентные энтерококки, метицилин-резистентный Staphylococcus aureus, мультирезистентные salraonellae. Последствия резистентности к антибиотическим средствам тяжелы. Инфекции, вызванные резистентными микроорганизмами, не реагируют на лечение, приводя к длительной болезни и повышенному риску летального исхода. Неудачи в лечении также приводят к более длинным инфекционным периодам,которые увеличивают число инфицированных людей, появляющихся в общественных местах, и таким образом подвергают общую популяцию риску инфицирования резистентным штаммом. Больницы представляют собой критический компонент проблемы противомикробной резистентности во всем мире. Комбинация очень восприимчивых пациентов интенсивного и пролонгированного использования противомикробных средств и перекрестной инфекции приводит к инфекциям с очень резистентными бактериальными патогенами. Самолечение с использованием противомикробных средств представляет собой другой ведущий фактор, способствующий возникновению резистентности. Принимаемые в рамках самолечения противомикробные средства могут быть ненужными, часто неправильно принимаются или, возможно, не содержат нужных количеств активного лекарственного средства. Согласие пациента с рекомендованным лечением - другая большая проблема. Пациенты забывают принимать лекарства, прерывают лечение, когда начинают чувствовать себя лучше, или могут быть не в состоянии пройти полный курс лечения, таким образом создавая идеальную среду для адаптации микроорганизмов вместо их уничтожения. Из-за появляющейся проблемы резистентности к множеству антибиотиков врачи сталкиваются с инфекциями, для которых не существует эффективной терапии. Осложненное течение, летальность и финансовые затраты при лечении таких инфекций налагают все более увеличивающееся бремя на системы здравоохранения во всем мире. Поэтому существует высокая потребность в новых соединениях для лечения бактериальных инфекций, особенно для лечения инфекций, вызванных резистентными штаммами. В WO 2004/011436 раскрыты замещенные производных хинолина, обладающие активностью в отношении микобактерий, в особенности против Mycobacterium tuberculosis. Одно конкретное соединение таких замещенных производных хинолина описано в Science (2005), 307, 223-227. В настоящее время обнаружено, что производные хинолина, описанные в WO 2004/011436, также проявляют активность против других бактерий помимо микобактерий. Поэтому настоящее изобретение относится к применению соединения для получения лекарственного средства для лечения бактериальной инфекции, причем указанное соединение является соединением формулы (Ia) его фармацевтически приемлемой аддитивной солью кислоты или основания, его стереохимически изомерной формой или его N-оксидной формой,где R1 означает водород, галоген, Ar, Het, алкил или алкилокси; р является целым числом, равным 1, 2, 3 или 4;R4 и R5, каждый независимо, означают водород, алкил или бензил илиR7 означает водород; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем каждый атом углерода может быть необязательно замещен гидрокси, алкилокси или оксо;Alk означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода;Ar означает гомоциклическое кольцо, выбранное из группы, состоящей из фенила, нафтила, аценафтила и тетрагидронафтила, причем каждое гомоциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, каждый из которых независимо выбирают из группы, состоящей из гидрокси, галогена,циано, нитро, амино, моно- или диалкиламино, алкила, галогеналкила, алкилокси, галогеналкилокси,карбоксила, алкилоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила;Het означает моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила,изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила,бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила,бензотиенила, 2,3-дигидробензо[1,4]диоксинила и бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, гидрокси, алкила, алкилокси и Ar-карбонила; галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода; и галогеналкил означает прямой или разветвленной насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем один или более атомов углерода замещены одним или более атомами галогена; при условии, что бактериальная инфекция отличается от микобактериальной инфекции. Настоящее изобретение также относится к способу лечения бактериальной инфекции у млекопитающего, в частности теплокровного млекопитающего, более конкретно у человека, включающему введение млекопитающему эффективного количества соединения по изобретению. В рамках настоящего описания алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем каждый атом углерода может быть замещен гидрокси, алкилокси или оксо. Предпочтительно алкил является метилом, этилом или циклогексилметилом, более предпочтительно метилом или этилом. Представляющим интерес вариантом осуществления алкила во всех определениях, используемых выше или в дальнейшем, являетсяC1-6 алкил, который представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил, пентил,гексил и т.п. Предпочтительной подгруппой C1-6 алкил является С 1-4 алкил, который представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 4 атомов углерода,такой как, например, метил, этил, пропил, 2-метилэтил и т.п. В рамках данного описания Alk означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, в особенности Alk означает C1-6 алкандиил, который представляет собой двухвалентный прямой и разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, такой как, например, метилен, 1,2-этандиил или этилена, 1,3-пропандиил,1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил и т.п. В рамках данного описания Ar означает гомоциклическое кольцо, выбранное из группы, состоящей из фенила, нафтила, аценафтила, тетрагидронафтила, каждый из которых необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из гидрокси,галогена, циано, нитро, амино, моно- или диалкиламино, алкила, галогеналкила, алкилокси, галогеналкилокси, карбоксила, алкилоксикарбонила, аминокарбонила, морфолинила и моно- или диалкиламинокарбонила. Предпочтительно Ar означает нафтил или фенил, каждый из которых необязательно замещен 1 или 2 заместителями, причем каждый заместитель независимо выбран из галогена или алкилокси. В рамках данного описания Het означает моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила,тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; или бициклический гетероцикл, выбранный из группы, состоящей из хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила и бензо[1,3]диоксолила; каждый моноциклический и бициклический гетероцикл может быть замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, гидрокси, алкила, алкилокси и Ar-карбонила. Предпочтительно Het означает фуранил, пиперидинил, пиридинил или бензо[1,3]диоксолил или Het означает тиенил, фуранил, пиридинил или бензо[1,3]диоксолил.-2 014163 В рамках данного описания галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора, брома и йода, и галогеналкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем один или более атомов углерода замещены одним или более атомами галогена. Предпочтительно галоген представляет собой бром, фтор или хлор и предпочтительно галогеналкил представляет собой полигалогенС 1-6 алкил, который определяют как моно- или полигалогензамещенный С 1-6 алкил, например метил с одним или более атомами фтора, например дифторметил или трифторметил, 1,1-дифторэтил и т.п. В случае если больше чем один атом галогена присоединен к алкильной группе в рамках значения "галогеналкил" или полигалоген-C1-6 алкил, они могут быть одинаковыми или различными. Определение Het включает все возможные изомерные формы гетероциклов, например пирролил включает 1 Н-пирролил и 2 Н-пирролил.Ar или Het, перечисленные в определениях заместителей соединений формулы (Ia) (см., например,R3), как указано выше или в дальнейшем, могут быть присоединены к остатку молекулы формулы (Ia) через любой пригодный для этого кольцевой атом углерода или гетероатом, если не указано иное. Таким образом, например, когда Het означает имидазолил, им может быть 1-имидазолил, 2-имидазолил,4-имидазолил и т.п. Линии, проведенные от заместителей в кольцевые системы, указывают, что соединение может быть присоединено к любому из подходящих кольцевых атомов. Когда два соседних радикала R6 вместе образуют двухвалентный радикал формулы -СН=СН-СН=СН-, это означает, что два соседних радикала R6 вместе с фенильным кольцом, к которому они присоединены, образуют нафтил. Для терапевтического применения солями соединений формулы (Ia) являются соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли как фармацевтически приемлемые, так и не фармацевтически приемлемые, включены в объем настоящего изобретения. Фармацевтически приемлемые аддитивные соли, как указано выше или в дальнейшем, включают терапевтически активные нетоксичные формы аддитивных солей кислоты, которые соединения формулы(Ia) могут образовывать. Последние могут быть легко получены путем обработки формы основания такими подходящими кислотами, как неорганические кислоты, например галогеноводородные, например хлористо-водородная, бромисто-водородная кислоты и т.п.; серная кислота; азотная кислота; фосфорная кислота и т.п.; или органические кислоты, например уксусная, пропионовая, гидроксиуксусная,2-гидроксипропановая, 2-оксопропановая, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфамовая, 2-гидроксибензойная, 4-амино-2 гидроксибензойная и подобные кислоты. Наоборот, форма соли может быть преобразована обработкой щелочью в форму свободного основания. Соединения формулы (Ia), содержащие протоны кислоты, могут быть преобразованы в их терапевтически активные формы аддитивных солей нетоксичного металла или амина путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы соли с основанием включают, например, соли аммония, соли щелочного и щелочно-земельного металла, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например соли с первичными,вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, тетрагидрооксазин,триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин,N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабамин, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Наоборот, форма соли может быть преобразована путем обработки кислотой в форму свободной кислоты. Термин "аддитивная соль" также включает гидраты и формы присоединения с растворителем, которые соединения формулы (Ia) могут образовывать. Примерами таких форм являются, например, гидраты,алкоголяты и т.п.N-оксидные соединения по изобретению включают соединения формулы (Ia), где один или несколько третичных атомов азота окислены до так называемых N-оксидов. Соединения формулы (Ia) могут быть преобразованы в соответствующие N-оксидные формы с помощью известных в данной области методов преобразования трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления обычно может быть осуществлена путем взаимодействия исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочного металла или-3 014163 щелочно-земельного металла, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например 3-хлорбензолкарбопероксовая кислота,пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например третбутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и т.п.,углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Следует понимать, что некоторые из соединений формулы (I) и их N-оксидов или аддитивных солей могут содержать один или более центров хиральности и существовать в стереохимически изомерных формах. Соединения любой формулы (Ia) и некоторые из промежуточных соединений неизменно имеют по меньшей мере два стереогенных центра в своей структуре, которые могут привести по меньшей мере к 4 стереохимически различным структурам. Термин "стереохимически изомерные формы", как он используется выше или в дальнейшем, определяет все возможные стереоизомерные формы, которыми могут обладать соединения формулы (Ia) и ихN-оксиды, аддитивные соли или физиологически функциональные производные. Если не указано или не обозначено иное, химическое обозначение соединения означает смесь всех возможных стереохимически изомерных форм, причем указанная смесь содержит все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь или цис- или трансконфигурацию. Соединения, содержащие двойные связи, могут иметь Е (entgegen)- или Z (zusammen)стереохимию при указанной двойной связи. Термины цис, транс, R, S, Е и Z известны специалистам в данной области. Стереохимически изомерные формы соединений формулы (Ia) очевидно входят в объем данного изобретения. Согласно соглашениям о CAS-номенклатуре, когда два стереогенных центра известной абсолютной конфигурации присутствуют в молекуле, дескриптором R или S (на основании правила последовательности Cahn-Ingold-Prelog) обозначают хиральный центр, имеющий наименьший номер, центр отсчета. Конфигурацию второго стереогенного центра обозначают, используя относительные дескрипторы[R,R] или [R,S], где R всегда определяют как центр отсчета, и [R,R] указывает центры с той же самой хиральностью, и [R,S] указывает центры с разной хиральностью. Например, если имеющий наименьший номер хиральный центр в молекуле имеет конфигурацию S и второй центр - конфигурациюR, стереодескриптор будет определен как S-[R,S]. Если используются и : положение заместителя с самым высоким приоритетом на асимметрическом атоме углерода в кольцевой системе, имеющей самый низкий кольцевой номер, всегда является положением по отношению к срединной плоскости,определяемой кольцевой системой. Положение заместителя с самым высоким приоритетом на другом асимметрическом атоме углерода в кольцевой системе относительно положения заместителя с самым высоким приоритетом на атоме, от которого ведут отсчет, называется , если оно находится на той же самой стороне срединной плоскости, определяемой кольцевой системой, или , если оно находится с другой стороны срединной плоскости, определяемой кольцевой системой. Когда указана определенная стереоизомерная форма, это означает, что указанная форма в основном свободна, то есть связана с меньше чем 50%, предпочтительно меньше чем 20%, более предпочтительно меньше чем 10%, еще более предпочтительно меньше чем 5%, еще более предпочтительно меньше чем 2% и наиболее предпочтительно меньше чем 1% другого изомера(ов). Таким образом, когда соединение формулы (Ia), например, определено как (S, R), это означает, что соединение в основном не содержит(R, S) изомера. Соединения любой формулы (Ia) могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга с помощью известных в данной области методов разделения. Рацемические соединения любой формулы (Ia) могут быть преобразованы в соответствующие диастереомерные формы соли взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные формы соли затем отделяют, например, селективной или фракционной кристаллизацией, и энантиомеры высвобождают оттуда щелочью. Альтернативный метод разделения энантиомерных форм соединений любой формулы (Ia) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. Предпочтительно, если желателен определенный стереоизомер, указанное соединение синтезируют стереоспецифическим способом получения. В таких способах предпочтительно используют энантиомерно чистые исходные вещества. Изобретение также включает производные соединения (обычно называемые "пролекарствами") фармакологически активных соединений согласно изобретению, которые разлагаются in vivo, приводя к-4 014163 соединениям согласно изобретению. Пролекарства обычно (но не всегда) имеют более низкий потенциал в отношении рецептора-мишени, чем соединения, до которых они разлагаются. Пролекарства особенно пригодны, когда желаемое соединение имеет химические или физические свойства, которые делают его введение трудным или неэффективным. Например, желаемое соединение может быть плохо растворимым, оно может плохо транспортироваться через эпителий слизистой оболочки или оно может иметь слишком короткий период полураспада в плазме. Более полное обсуждение по пролекарствам можно найти у Stella V.J. et al., в "Prodrugs", Drug Delivery Systems, 1985, p. 112-176, and Drugs, 1985, 29, p. 455473. Формы пролекарств фармакологически активных соединений согласно изобретению вообще являются соединениями формул (Ia), их фармацевтически приемлемыми аддитивными солями кислоты или основания, их стереохимически изомерными формами и их N-оксидными формами, имеющими кислотную группу, которая этерифицирована или амидирована. В такие этерифицированные кислотные группы включены группы формулы -COORx, где Rx означает C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry означает Н, С 1-6 алкил, фенил или бензил, и Rz означает -ОН, Н, C1-6 алкил, фенил или бензил. Соединения согласно изобретению, имеющие аминогруппу, могут быть дериватизированы с кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Это основание гидролизуется с кинетикой первого порядка в водном растворе. Каждый раз, когда он используется в настоящем описании, термин "соединения формулы (Ia)" также включает их фармацевтически приемлемые аддитивные соли кислоты или основания, их N-оксидные формы или их стереохимически изомерные формы. Особый интерес представляют соединения формулы(Ia), которые являются стереохимически чистыми. Первый представляющий интерес вариант осуществления настоящего изобретения относится к соединению формулы (Ia), где Alk означает метилен или этилен, в частности этилен. Второй представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, гдеR7 означает водород; алкил означает прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода,присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем каждый атом углерода может быть замещен гидрокси;Ar означает гомоциклическое кольцо, выбранное из группы, состоящей из фенила, нафтила, аценафтила и тетрагидронафтила, причем каждое гомоциклическое кольцо необязательно замещено 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из группы, состоящей из галогена, галогеналкила, циано, алкилокси и морфолинила;Het означает моноциклический гетероцикл, выбранный из группы, состоящей из N-феноксипиперидинила, пиперидинила, фуранила, тиенила, пиридинила и пиримидинила; или бициклический гетероцикл, выбранный из группы, состоящей из бензотиенила, 2,3-дигидробензо[1,4]диоксинила и бензо[1,3]диоксолила; причем каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, причем каждый заместитель независимо выбран из алкила илиAr-карбонила; и галоген представляет собой заместитель, выбранный из группы, состоящей из фтора, хлора и брома; галогеналкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, или циклический насыщенный углеводородный радикал,имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; причем один или более атомов углерода замещены-5 014163 одним или более атомами галогена. Третий представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R1 означает водород, галоген, алкил, алкилокси, Ar или Het; предпочтительно R1 означает водород, галоген,алкил или алкилокси; более предпочтительно R1 означает водород или галоген; наиболее предпочтительно R1 означает галоген, например бром или хлор, в частности бром. Четвертый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где р равен 1 или 2; предпочтительно р равен 1; более предпочтительно р равен 1, и R1 отличен от водорода. Пятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где р равен 1 и указанный заместитель R1 находится в положении 5, 6 или 7 кольца хинолина; предпочтительно в положении 6. Шестой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R2 означает алкилокси, алкилтио, алкилоксиалкилокси или моно- или ди(алкил)амино; предпочтительно R2 означает алкилокси или алкилтио; более предпочтительно R2 означает алкилокси или алкилтио; наиболее предпочтительно R2 означает алкилокси, в частности C1-4 алкилокси; более предпочтительно метилокси. Седьмой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R3 означает Ar, необязательно замещенный 1 или 2 заместителями, причем указанный заместитель предпочтительно представляет собой галоген, галогеналкил, алкилокси, галогеналкилокси или алкил; более предпочтительно указанный заместитель представляет собой галоген, галогеналкил или алкилокси; еще более предпочтительно указанный заместитель представляет собой галоген или алкилокси; наиболее предпочтительно указанный заместитель представляет собой галоген; предпочтительно Ar в определенииR3 представляет собой нафтил или фенил, необязательно замещенный 1 или 2 атомами галогена, в особенности 4-галогенфенил; более предпочтительно R3 означает нафтил или фенил; наиболее предпочтительно R3 означает 1-нафтил или фенил. Восьмой представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R4 и R5, каждый независимо, означают водород, алкил или бензил; предпочтительно водород или алкил, в частности водород или С 1-4 алкил; более предпочтительно C1-4 алкил; наиболее предпочтительно метил. Девятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R4 и R5, вместе и включая N, к которому они присоединены, образуют радикал пиперидинил. Десятый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где R6 означает водород, алкил, алкилокси или галоген; предпочтительно R6 означает водород. Одиннадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, гдеr равен 1 или 2; предпочтительно r равен 1. Двенадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, гдеR7 означает водород или метил; предпочтительно R7 является водородом. Тринадцатый представляющий интерес вариант осуществления относится к соединению формулы(Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, где соединением является соединение согласно формуле (Ia). Четырнадцатый представляющий интерес вариант осуществления относится к соединению формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления,к которому применимы одно или более, предпочтительно все из следующих определений:R3 означает нафтил, фенил, причем каждая из указанных кольцевых систем может быть замещена; в частности фенил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, галогеналкила, алкилокси, галогеналкилокси или алкила; или нафтил; более предпочтительно фенил, необязательно замещенный 1 или 2 заместителями, выбранными из галогена, галоген-С 1-4 алкила, С 1-4 алкилокси,галоген-С 1-4 алкилокси или C1-4 алкилом; или нафтил;R4 и R5, каждый независимо, означают водород или алкил; в частности водород или С 1-4 алкил; более предпочтительно водород или метил; или R4 и R5, вместе и включая N, к которому они присоединены,образуют пиперидинил;Alk означает метилен или этилен. Пятнадцатым представляющим интерес вариантом осуществления является применение соединения формулы (Ia) любой его подгруппы, указанной выше как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения инфекции, вызванной грамположительной и/или грамотрицательной бактерией. Шестнадцатым представляющим интерес вариантом осуществления является применение соединения формулы (Ia) любой его подгруппы, указанной выше как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения инфекции, вызванной грамположительной бактерией. Семнадцатым представляющим интерес вариантом осуществления является применение соединения формулы (Ia) любой его подгруппы, указанной выше как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения инфекции, вызванной грамотрицательной бактерией. Восемнадцатым представляющим интерес вариантом осуществления является применение соединения формулы (Ia) или любой его подгруппы, указанной выше как представляющий интерес вариант осуществления, для получения лекарственного средства для лечения бактериальной инфекции, где соединение формулы (Ia) имеет IC9015 мкл/мл против по меньшей мере одной бактерии, в частности грамположительной бактерии; предпочтительно IC9010 мкл/мл; более предпочтительно IC905 мкл/мл; причем значение IC90 определяют, как описано ниже. Предпочтительно в соединениях формулы (Ia) или любой его подгруппе, указанной выше как представляющий интерес вариант осуществления, термин "алкил" означает C1-6 алкил, более предпочтительно С 1-4 алкил. Предпочтительные соединения выбирают из следующих соединений: их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм или их N-оксидных форм. Особенно предпочтительные соединения выбирают из соединений 14, 15, 7, 8, 9, 20, 39, 37, 38, 55 и 40 (см. табл. ниже), их N-оксидов или их стереохимически изомерных форм; в частности предпочтительными соединениями являются соединения 39, 37, 38, 55 и 40, их N-оксиды или их стереохимически изомерные формы. Настоящее изобретение также относится к любому соединению из приведенных ниже табл. 1-5.-7 014163 В частности, настоящее изобретение относится к соединению, выбранному из их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм или их N-оксидных форм. Настоящее изобретение также относится к соединению, выбранному из их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм или их N-оксидных форм. Настоящее изобретение также относится к соединению, выбранному из их фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм или их N-оксидных форм. Предпочтительно соединение формулы (Ia) представляет собой определенный диастереоизомер (в основном не содержащий другого диастереоизомера(ов. В случае если соединение формулы (Ia) имеет два хиральных центра, это означает, что соединение представляет собой рацемическую смесь энантиомеров (R,S) и (S,R) или рацемическую смесь энантиомеров (R,R) и (S,S). В дальнейшем рацемические смеси 2 энантиомеров обозначают как диастереоизомер А или В. Обозначена ли рацемическая смесь как А или В, зависит от того, выделена ли она в протоколе синтеза первой (то есть А) или второй (то есть В). Более предпочтительно соединение формулы (Ia) представляет собой определенный энантиомер (в основном не содержащий других энантиомеров). В случае если соединение формулы (Ia) имеет два хиральных центра, это означает, что соединение является энантиомером (R,S), (S,R), (R,R) или (S,S). В дальнейшем указанные частные энантиомеры обозначают как А 1, А 2, В 1 или В 2. Обозначен ли энантиомер как А 1, А 2, В 1 или В 2 зависит от того, выделяют ли его в протоколе синтеза первым или вторым. Соединения формулы (Ia) могут быть получены согласно способам, описанным в WO 2004/011436,-8 014163 которая включена в настоящее описание посредством ссылки. В общем, соединения согласно изобретению могут быть получены с помощью последовательности стадий, каждая из которых известна специалисту в данной области. В частности, соединения согласно формуле (Ia) могут быть получены путем взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) согласно следующей реакционной схеме 1: Схема 1 используя nBuLi в смеси диизопропиламина и тетрагидрофурана, причем все переменные имеют значения, как определено в формуле (Ia). Перемешивание может увеличить скорость реакции. Реакция может быть проведена при температуре, составляющей от -20 до -70 С. Исходные вещества и промежуточные соединения формулы (II) и (III) являются соединениями, которые коммерчески доступны или могут быть получены согласно обычным реакционным методикам,общеизвестным в данной области. Например, промежуточные соединения формул (II-а) или (II-b) могут быть получены согласно следующей реакционной схеме 2: Схема 2 где все переменные имеют значения, как определено в формуле (Ia). Реакционная схема 2 включает стадию (а), на которой соответствующим образом замещенный анилин подвергают взаимодействию с подходящим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или п-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего инертного растворителя реакции, такого как метиленхлорид или этиленхлорид. Реакция может быть проведена при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения с обратным холодильником. На следующей стадии (b) аддукт, полученный на стадии (а), подвергают взаимодействию с фосфорилхлоридом (POCl3) в присутствии N,N-диметилформамида (формилирование Vilsmeier-Haack с последующей циклизацией). Реакция может быть проведена при температуре, находящейся в диапазоне от комнатной температуры до температуры кипения с обратным холодильником. На следующей стадии (с-1) вводят определенную группу R2, где R2 обозначает, например,C1-6 алкилокси, путем взаимодействия промежуточного соединения, полученного на стадии (b), сO-C1-6 алкилом в присутствии подходящего растворителя, такого как, например, HO-C1-6 алкил. Промежуточное соединение, полученное на стадии (b), также может быть преобразовано в промежуточное соединение, где R2 означает, например, радикал С 1-6 алкилтио взаимодействием с S=C(NH2)2 в присутствии подходящего растворителя, такого как, например, спирт, например этанол (стадия (с-2, с последующим взаимодействием с С 1-6 алкил-I в присутствии подходящего основания, такого как, например, K2CO3, и подходящего растворителя, такого как, например, ацетон. Промежуточное соединение, полученное на стадии (b), также может быть преобразовано в промежуточное соединение, где R2 означает N(R2a)(алкил), где R2a означает водород или алкил, взаимодействием с подходящей солью NH(R2a)(алкил) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя,такого как, например, ацетонитрил (стадия (с-3. Промежуточное соединение, полученное на стадии (b),также может быть преобразовано в промежуточное соединение, где R2 означает алкилоксиалкилокси,необязательно замещенный алкилокси, где указанный R2 соответствует R2b, взаимодействием с алкилоксиалкилОН, необязательно замещенным алкилокси, в присутствии NaH и подходящего растворителя,такого как, например, тетрагидрофуран (стадия (с-4. Промежуточные соединения согласно формуле (II-е) могут быть получены согласно следующей реакционной схеме 3, где на первой стадии (а) замещенный индол-2,3-дион подвергают взаимодействию с необязательно замещенным 3-фенилпропиональдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Pfitzinger), после которой карбоновую кислоту декарбоксилируют на следующей стадии (b) при высокой температуре в присутствии подходящего инертного растворителя реакции, такого как простой дифениловый эфир. Схема 3 Очевидно, что в предшествующих и в последующих реакциях продукты реакции могут быть выделены из реакционной среды и в случае необходимости далее очищены согласно методологиям, общеизвестным в данной области, таким как экстракция, кристаллизация и хроматография. Также очевидно, что продукты реакции, которые существуют в более чем одной энантиомерной форме, могут быть выделены из их смеси известными методами, в частности препаративной хроматографией, такой как препаративная ВЭЖХ, хиральная хроматография. Индивидуальные диастереоизомеры или индивидуальные энантиомеры также могут быть получены суперкритической жидкостной хроматографией (SCF). Промежуточные соединения формулы (III) являются соединениями, которые коммерчески доступны или могут быть получены согласно обычным реакционным методикам, общеизвестным в данной области. Например, промежуточные соединения формулы (III) могут быть получены согласно следующей реакционной схеме 4: Схема 4 Реакционная схема 4 включает стадию (а), на которой, например, подходящую кислоту подвергают взаимодействию с NH(СН 3)(ОСН 3) в присутствии 1,1'-карбонилдиимидазола и подходящего растворителя, такого как, например, CH2Cl2. На следующей стадии (b) продукт, полученный на стадии (а), подвергают взаимодействию с реактивом Гриньяра (CH3MgCl) в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. На следующей стадии (с) вводят аминогруппу (-NR4R5) путем взаимодействия промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии СН 2(=O), подходящей кислоты, такой как, например, соляная кислота и т.п.,и подходящего растворителя, такого как, например, спирт, например этанол. Промежуточные соединения формулы (III), где Alk означает этилен, т.е. указанные промежуточные соединения, представленные формулой (III-а), могут быть, альтернативно, получены согласно следующей реакционной схеме 5: Схема 5 Реакционная схема 5 включает стадию (а), на которой подходящий альдегид подвергают взаимодействию с ацетоном в присутствии подходящего основания, такого как, например, гидроксид натрия. На следующей стадии (b) продукт, полученный на стадии (а), подвергают взаимодействию с первичным или вторичным амином HNR4R5 в присутствии СН 2(=О), подходящей кислоты, такой как, например, соляная кислота и т.п., и подходящего растворителя, такого как, например, спирт, например этанол. На следующей стадии (с) продукт, полученный на стадии (b), гидрируют (Н 2) в присутствии подходящего катализатора, такого как, например, палладий на угле, и подходящего растворителя, такого как, например, вода и спирт, например этанол. Соединения формулы (Ia) также могут быть преобразованы друг в друга согласно известным в данной области реакциям преобразования функциональной группы, включая описанные ниже. Например, соединения формулы (Ia), где R1 означает галоген, в частности бром, могут быть преобразованы в соединение формулы (Ia), где R1 означает водород, взаимодействием с HCOONH4 в присутствии подходящего катализатора, такого как, например, палладий на угле, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Аналогичные условия реакции могут быть использованы для преобразования соединения формулы (Ia), где R4 означает бензил, в соединение формулы (Ia), где R4 означает водород. Соединения формулы (Ia), где R1 означает галоген, в частности бром, также могут быть преобразованы в соединение формулы (Ia), где R1 означает Het, в частности пиридин, взаимодействием с подходящим производным бороновой кислоты и Het, например пиридин-3-бороновой кислотой, в присутствии подходящего катализатора, такого как, например, (трифенилфосфин)палладий(0), в присутствии подходящего растворителя, такого как, например, диметиловый эфир этиленгликоля, и подходящего основания, такого как, например, карбонат натрия. Соединения формулы (Ia), где R1 означает галоген, в частности бром, также могут быть преобразованы в промежуточное соединение, где R1 означает формил, взаимодействием с N,N-диметилформамидом в присутствии nBuLi и подходящего растворителя, такого как, например, тетрагидрофуран. Полученные промежуточные соединения могут быть затем преобразованы в соединение формулы (Ia),где R1 означает -СН 2-ОН, взаимодействием с подходящим восстановителем, таким как, например,NaBH4, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол, и тетрагидрофуран. Как указано выше, соединения формулы (Ia) могут быть использованы в качестве антибактериальных средств. Как правило, бактериальные патогены могут быть классифицированы как грамположительные или грамотрицательные патогены. Антибиотические соединения с активностью как против грамположительных, так и против грамотрицательных патогенов, обычно расцениваются, как обладающие широким спектром активности. Соединения согласно настоящему изобретению расцениваются как активные против грамположительных и/или грамотрицательных бактериальных патогенов. В частности, соединения по изобретению активны против по меньшей мере одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, более предпочтительно против одной или более грамположительных бактерий и/или одной или более грамотрицательных бактерий. Соединения по изобретению обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включают стафилококки, например S. aureus; энтерококки, например E. faecalis; стрептококки, например S. pneumoniae, S. mutans, S. pyogens; бациллы, например Bacillus subtilis; Listeria, например Listeria monocytogenes; Haemophilus, например H. influenza; Moraxella, например М. catarrhalis; Pseudomonas, напримерPseudomonas aeruginosa; и эшерихии, например E. coli. Грамположительные патогены, например стафилококки, энтерококки и стрептококки, имеют особенно важное значение из-за развития резистентных штаммов, которые, однажды появившись, с трудом поддаются лечению и с трудом устраняются из, например, среды стационара. Примерами таких штаммов являются метицилин-резистентный Staphylococcus aureus (MRSA), метицилин-резистентный Staphylococcus aureus (MRCNS), пенициллин-резистентныйStreptococcus pneumoniae и мультирезистентный Enterococcus faecium. Соединения согласно настоящему изобретению также проявляют активность против резистентных бактериальных штаммов. Соединения согласно настоящему изобретению особенно активны против Streptococcus pneumoniae и/или Staphylococcus aureus, включая резистентный Staphylococcus aureus, такой как, например, метицилин-резистентный Staphylococcus aureus (MRSA), особенно против Staphylococcus aureus, включая резистентный Staphylococcus aureus. Соединения по изобретению обладают особенно хорошей активностью против SPN 6305 (Streptococcus pneumoniae (ATCC6305 и/или STA 29213 (Staphylococcus aureus- 11014163 В частности, соединения согласно настоящему изобретению активны в отношении бактерий, чья жизнеспособность зависит от правильного функционирования F1F0 АТФ-синтазы. Без привязки к какойлибо теории сообщается, что активность соединения по изобретению состоит в ингибировании F1F0 АТФ-синтазы, в особенности в ингибировании F0 комплекса F1F0 АТФ-синтазы, более конкретно в ингибировании субъединицы с F0 комплекса F1F0 АТФ-синтазы, приводя к уничтожению бактерий путем исчерпывания клеточных уровней АТФ бактерий. Каждый раз, когда указано выше или в дальнейшем, что соединения могут лечить бактериальную инфекцию, это означает, что соединения могут лечить инфекцию, вызванную одним или более бактериальными штаммами. Каждый раз, когда указано выше или в дальнейшем, что бактериальная инфекция не является микобактериальной инфекцией, это означает, что бактериальная инфекция отличается от инфекции, вызванной одним или более штаммами микобактерий. Соединения согласно настоящему изобретению имеют приемлемое t1/2, то есть период полураспада(t1/2) соединения относится к временному интервалу, необходимому для того, чтобы определенное количество соединения в организме (или плазменная концентрация) уменьшилось до половины от его первоначального уровня в силу действия различных процессов устранения. Точная дозировка и частота введения соединений по изобретению зависят от конкретного используемого соединения формулы (Ia), конкретного подвергаемого лечению состояния, серьезности подвергаемого лечению состояния, возраста, массы тела, пола, режима питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другого лечения, которое человек может получать, как известно специалисту в данной области. Кроме того, очевидно, что эффективные суточные количества могут быть уменьшены или увеличены в зависимости от реакции пациента и/или в зависимости от оценки врача, предписывающего соединения согласно настоящему изобретению. Соединение согласно настоящему изобретению может вводиться в фармацевтически приемлемых формах необязательно в фармацевтически приемлемом носителе. Соединения и композиции, содержащие данные соединения, могут вводиться такими путями, как топический, локальный или системный. Системное применение включает любой способ введения соединения в ткани тела, например внутриоболочковый, эпидуральный, внутримышечный, чрескожный, внутривенный, интраперитонеальный, подкожный, подъязычный, ректальный и пероральный путь введения. Конкретная вводимая дозировка антибактериального средства, а также продолжительность лечения могут быть при необходимости отрегулирована. Бактериальные инфекции, которые могут быть подвержены лечению соединениями по изобретению, включают, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый средний отит, инфекции черепных пазух, инфекции глаза, инфекции полости рта, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхнего респираторного тракта, инфекции нижних дыхательных путей, мочеполовые инфекции, желудочно-кишечные инфекции,гинекологические инфекции, сепсис, инфекции кости и суставов, инфекции структур кожи и кожи, бактериальный эндокардит, ожоги, антибактериальную профилактику в хирургии и антибактериальную профилактику у пациентов с подавленным иммунитетом, таких как пациенты, получающие противораковую химиотерапию, или пациенты, перенесшие трансплантацию органа. Учитывая тот факт, что соединения формулы (Ia) активны против бактериальных инфекций, соединения по изобретению могут быть скомбинированы с другими антибактериальными агентами, чтобы эффективно бороться с бактериальными инфекциями. Поэтому настоящее изобретение также относится к комбинации (а) соединения формулы (Ia) и (b) одного или более других антибактериальных агентов, при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. Настоящее изобретение также относится к комбинации (а) соединения формулы (Ia) и (b) одного или более других антибактериальных агентов, при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами, для применения в качестве лекарственного средства. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения формулы (Ia) и (b) одно или более других антибактериальных агентов, при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами, также находится в соответствии с настоящим изобретением. Настоящее изобретение также относится к применению комбинации или фармацевтической композиции, как определено выше, для лечения бактериальной инфекции. Фармацевтическая композиция по изобретению может иметь различные фармацевтические формы для целей введения. В качестве подходящих композиций могут быть названы все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по изобретению эффективное количество конкретных соединений необязательно в форме аддитивной соли в качестве активного ингредиента комбинируют в тесной смеси с фармацевтически прием- 12014163 лемым носителем, который может иметь разнообразные формы в зависимости от формы получения, желательной для введения. Такие фармацевтические композиции предпочтительно находятся в подходящей лекарственнойформе, в частности для перорального введения или парентеральной инъекции. Например,для получения композиции в пероральной лекарственной форме может использоваться любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахар, каолин, растворители, лубриканты, связующие, дезинтеграторы и т.п., в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения таблетки и капсулы представляют собой самые предпочтительные пероральные лекарственные формы, в которых, разумеется, используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерилизованную воду, составляющую, по меньшей мере, значительную часть, хотя могут быть включены другие ингредиенты, например, для повышения растворимости. Например, могут быть получены растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь раствора глюкозы и солевого раствора. Также могут быть получены суспензии для инъекций, в которых могут использоваться подходящие жидкие носители, суспендирующие агенты и т.п. Также в объем изобретения входят препараты в твердой форме, которые предназначены для преобразования, непосредственно перед применением, в препараты в жидкой форме. В зависимости от способа введения фармацевтическая композиция предпочтительно содержит от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активных ингредиентов, и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.% фармацевтически приемлемого носителя, причем все проценты даны в расчете на общую массу композиции. Массовые соотношения (а) соединения формулы (Ia) и (b) другого антибактериального агента(ов) при введении в форме комбинации могут быть определены специалистом в данной области. Указанное отношение, точная дозировка и частота введения зависят от конкретного соединения формулы (Ia) и другого используемого антибактериального агента(ов), конкретного подвергаемого лечению состояния,серьезности подвергаемого лечению состояния, возраста, массы тела, пола, режима питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другого лечения, которое человек может получать, как известно специалисту в данной области. Кроме того, очевидно, что эффективное суточное количество может быть уменьшено или увеличено в зависимости от реакции пациента и/или в зависимости от оценки врача, предписывающего соединения согласно настоящему изобретению. Соединения формулы (Ia) и один или более других антибактериальных агентов могут быть скомбинированы в одном препарате или они могут быть составлены в отдельных препаратах таким образом,чтобы они могли быть введены одновременно, раздельно или последовательно. Таким образом, настоящее изобретение также относится к продукту или набору, содержащему (а) соединение формулы (Ia) и(b) один или более других антибактериальных агентов, при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении бактериальной инфекции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области техники, например лубрикант, стабилизатор, буферирующий агент, эмульгатор, регулятор вязкости, поверхностно-активное вещество, консервант, ароматизатор или краситель. Особенно предпочтительным является составление указанных фармацевтических композиций в виде единичных дозированных форм для простоты введения и однородности дозировки. Единичная дозированная форма в рамках изобретения относится к физически дискретным единицам, подходящим в качестве разовой дозы, причем каждая форма содержит предопределенное количество активного ингредиента, вычисленное таким образом, чтобы произвести желаемый терапевтический эффект, в комбинации с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая надсеченные, или таблетки, покрытые оболочкой), капсулы, пилюли, пакетики с порошком, пластинки, суппозитории, растворы или суспензии для инъекций и т.п., и их упаковки с множеством отделений. Суточная доза соединения согласно изобретению, конечно, варьирует в зависимости от используемого соединения, способа введения, желаемого лечения и обозначенного бактериального заболевания. Другими антибактериальными агентами, которые могут быть скомбинированы с соединениями формулы (Ia), являются антибактериальные агенты, известные в данной области техники. Другие антибактериальные агенты включают антибиотики группы -лактама, такие как натуральные пенициллины,полусинтетические пенициллины, натуральные цефалоспорины, полусинтетические цефалоспорины,цефамицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как N-нуклеозиды, С-нуклеозиды, карбоциклические нуклеозиды, бластицидин S; вещества с макроциклическим лактонным кольцом, такие как 12-членные кольцевые макролиды, 14-членные кольцевые макролиды,16-членные кольцевые макролиды; ансамицины; пептиды, такие как блеомицины, грамицидины, поли- 13014163 миксины, бацитрацины, антибиотики с большим пептидным кольцом, содержащие лактоновые связи,актиномицины, амфомицины, капреомицин, дистамицин, эндурацидины, микамицин, неокарциностатин,стендомицин, виомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин А; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; монензины; пирролнитрин; фосфомицин; фузидовая кислота; D-(п-гидроксифенил)глицин; D-фенилглицин; энедиин. Конкретные антибиотики, которые могут быть скомбинированы с соединениями по изобретению формулы (Ia), например бензилпенициллин (калия, прокаина, бензатина), феноксиметилпенициллин (калия), фенетициллин калия, пропициллин, карбенициллин (динатрия, фенилнатрия, инданилнатрия),сульбенициллин, тикарциллин динатрия, метицилин натрия, оксациллин натрия, клоксациллин натрия,диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрия, амфоксициллин,циклациллин, гектациллин, сульбактам натрия, талампициллин гидрохлорид, бакампициллин гидрохлорид, пивмециллинам, цефалексин, цефаклор, цефалоглицин, цефадроксил, цефрадин, цефроксадин, цефапирин натрия, цефалотин натрия, цефацетрил натрия, цефсулодин натрия, цефалоридин, цефатризин,цефоперазон натрия, цефамандол, вефотиам гидрохлорид, цефазолин натрия, цефтизоксим натрия, цефотаксим натрия, цефменоксим гидрохлорид, цефуроксим, цефтриаксон натрия, цефтазидим, цефокситин,цефметазол, цефотетан, латамоксеф, клавулановая кислота, имипенем, ацтреонам, тетрациклин, хлортетрациклин гидрохлорид, деметилхлортетрациклин, окситетрациклин, метациклин, доксициклин, ролитетрациклин, миноциклин, даунорубицин гидрохлорид, доксорубицин, акларубицин, канамицин сульфат,беканамицин, тобрамицин, гентамицин сульфат, дибекацин, амикацин, микрономицин, рибостамицин,неомицин сульфат, паромомицин сульфат, стрептомицин сульфат, дигидрострептомицин, дестомицин А,гигромицин В, апрамицин, сисомицин, нетилмицин сульфат, спектиномицин гидрохлорид, астромицин сульфат, валидамицин, касугамицин, пориоксин, бластицидин S, эритромицин, эритромицин эстолат,олеандомицин фосфат, трацетилолеандомицин, китазамицин, йозамицин, спирамицин, тилозин, ивермектин, мидекамицин, блеомицин сульфат, пепломицин сульфат, грамицидин S, полимиксин В, бацитрацин, колистин сульфат, колистинметансульфонат натрия, энрамицин, микамицин, виргиниамицин, капреомицин сульфат, виомицин, енвиомицин, ванкомицин, актиномицин D, неокарциностатин, бестатин,пепстатин, монензин, лазалоцид, салиномицин, амфотерицин В, нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицин пальмитат гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникол пальмитат, митомицин С, пирролнитрин, фосфомицин, фузидовая кислота, бикозамицин, тиамулин, сикканин. Экспериментальная часть Абсолютная стереохимическая конфигурация стереогенного(ых) атома(ов) углерода некоторых соединений не была экспериментально определена. В этих случаях стереохимически изомерная форма,которая была выделена первой, определяется как "А", и вторая - как "В", без дальнейшей ссылки на фактическую стереохимическую конфигурацию. Однако указанные изомерные формы "А" и "В" могут быть однозначно охарактеризованы специалистом в данной области с использованием общеизвестных способов, таких как, например, дифракция рентгеновских лучей. В случае если "А" и "В" представляют собой смеси стереоизомеров, в частности смеси диастереоизомеров, они могут быть далее разделены, в соответствии с чем соответствующие первые выделенные фракции обозначаются "А 1", соответственно "В 1", и вторые - как "А 2", соответственно "В 2", без дальнейшей ссылки на фактическую стереохимическую конфигурацию. Однако указанные изомерные формы"А 1", "А 2" и "В 1", "В 2", в частности указанные энантиомерные формы "A1", "A2" и "B1", "В 2", могут быть однозначно охарактеризованы специалистом в данной области с использованием общеизвестных способов, таких как, например, дифракция рентгеновских лучей. В дальнейшем "ТГФ" определяют как тетрагидрофуран, "ДМФА" определен как N,N-диметилформамид, "DIPE" определяют как диизопропиловый эфир и "CDF" определяют как 1,1'-карбонилдиимидазол. А. Получение промежуточных соединений. Пример А 1. а. Получение промежуточного соединения 1.POCl3 (327 мл) медленно добавляют при 5 С к ДМФА (120 мл). После полного добавления добавляют N-(4-метилфенил)бензолпропанамид (0,501 моль). Смесь перемешивают при 80 С в течение ночи,затем охлаждают до комнатной температуры и выливают на лед. Добавляют EtOAc. Смесь перемешивают в течение 1 ч, в это время добавляют лед и затем экстрагируют EtOAc. Органический слой отделяют,промывают Н 2 О, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 182,2 г промежуточного соединения 1.b. Получение промежуточного соединения 2. Смесь промежуточного соединения 1 (0,5 моль) в CH3ONa (30%) (300 мл) и СН 3 ОН (300 мл) перемешивают при 70 С в течение 48 ч. Смесь охлаждают до комнатной температуры, выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, промывают Н 2 О, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (120 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/циклогексан 30/70; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 64 г промежуточного соединения 2. Пример А 2. а. Получение промежуточного соединения 3.POCl3 (2,74 моль) добавляют по каплям при 5 С/10 С к ДМФА (94 мл). Добавляют N-(4-метоксифенил)бензолпропанамид (0,38 моль). Смесь перемешивают при 80 С в течение ночи, затем охлаждают до комнатной температуры и выливают на лед. Осадок отфильтровывают, промывают Н 2 О и сушат в вакууме. Выход: 41,5 г промежуточного соединения 3 (37%).b. Получение промежуточного соединения 4. Смесь промежуточного соединения 3 (0,14 моль) в 30% CH3ONa (90 мл) и СН 3 ОН (400 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры, выливают на лед и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (38 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 65/35; 35-70 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 30 г промежуточного соединения 4 (73%). Пример A3. а. Получение промежуточного соединения 5. Бензолпропаноилхлорид (0,67 моль) добавляют по каплям при 5 С к смеси 3-бромбензоламина(0,58 моль) и Et3N (0,72 моль) в CH2Cl2 (1000 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, выливают в воду со льдом и NH4OH. Органический слой промывают 1 н. HCl, затем 10%b. Получение промежуточных соединений 6 и 7.POCl3 (2,3 моль) добавляют по каплям при 5 С к ДМФА (0,98 моль). Смесь охлаждают до комнатной температуры. Добавляют промежуточное соединение 5 (0,33 моль). Смесь перемешивают при 85 С в течение 6 ч, затем охлаждают до комнатной температуры, выливают в воду со льдом. Добавляют CH2Cl2. Оба слоя перемешивают в течение 2 ч. Смесь экстрагируют CH2Cl2. Органический слой промывают 10%K2CO3, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (84 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 30/70; 20-45 мкм). Желаемые фракции собирают и растворитель выпаривают. Выход: 34,1 г (31%) промежуточного соединения 6 и 9 г (8%) промежуточного соединения 7.- 15014163 с. Получение промежуточного соединения 8. Смесь промежуточного соединения 6 (0,1 моль) и NaOCH3 (0,53 моль) в метаноле (340 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч, затем охлаждают до комнатной температуры, выливают в воду со льдом и экстрагируют СН 2 С 12. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Выход: 79% промежуточного соединения 8 (т.пл.: 100 С). Пример А 4. а. Получение промежуточного соединения 9. Бензолпропаноилхлорид (0,488 моль) добавляют по каплям при комнатной температуре к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) и смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и концентрированный NH4OH и экстрагируютCH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток перекристаллизовывают из простого диэтилового эфира. Остаток (119,67 г) суспендируют в CH2Cl2 и промывают 1 н. HCl. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 107,67 г промежуточного соединения 9.b. Получение промежуточного соединения 10. Реакцию проводят дважды. POCl3 (1,225 моль) добавляют по каплям при 10 С к ДМФА(0,525 моль). Затем при комнатной температуре добавляют промежуточное соединение 9 (0,175 моль). Смесь перемешивают в течение ночи при 80 С, выливают на лед и экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 77,62 г промежуточного соединения 10 (67%). с. Получение промежуточного соединения 11. Смесь промежуточного соединения 10 (0,233 моль) в CH3ONa (30%) в метаноле (222,32 мл) и метаноле (776 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 20/80 и затем 100/0; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 25 г промежуточного соединения 11 (33%) (т.пл.: 84 С). Пример А 5. а. Получение промежуточного соединения 12. Бензолпропаноилхлорид (0,17 моль) добавляют по каплям при 5 С к смеси 4-бром-3-метилбензоламина (0,13 моль) и Et3N (0,18 моль) в CH2Cl2 (250 мл). Смесь нагревают до комнатной температуры, перемешивают в течение 16 ч, выливают в воду со льдом и 30% NH4OH и экстрагируют CH2Cl2. Органический слой промывают 1 н. HCl, Н 2 О и 10% K2CO3, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток суспендируют в простом диэтиловом эфире. Осадок отфильтровывают и сушат. Выход: 39 г промежуточного соединения 12 (91%).b. Получение промежуточного соединения 13.POCl3 (0,8 моль) добавляют по каплям при 5 С к ДМФА (0,34 моль). Смесь нагревают до комнатной температуры. Добавляют промежуточное соединение 12 (0,11 моль). Смесь перемешивают при 85 С в течение 7 ч, затем охлаждают до комнатной температуры, выливают в воду со льдом и экстрагируютCH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Остаток перекристаллизовывают из iPrOH. Осадок отфильтровывают, промывают iPrOH и сушат. Выход: 13,9 г промежуточного соединения 13 (35%). с. Получение промежуточного соединения 14. Смесь промежуточного соединения 13 (0,04 моль) и CH3ONa (0,2 моль) в СН 3 ОН (140 мл) перемешивают и кипятят с обратным холодильником в течение 16 ч, затем охлаждают до комнатной температуры, выливают в воду со льдом и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Выход: 13,5 г промежуточного соединения 14 (98%). Пример А 6 А. а. Получение промежуточного соединения 15. Смесь промежуточного соединения 10 (полученного согласно А 4.b) (0,045 моль) и тиомочевины(0,05 моль) в этаноле (150 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч и затем охлаждают до комнатной температуры. Добавляют раствор KOH (0,068 моль) в Н 2 О (15 мл). Смесь перемешивают, кипятят с обратным холодильником в течение 1 ч и выливают на лед. Осадок отфильтровывают, промывают Н 2 О и сушат. Выход: 11 г промежуточного соединения 15 (74%).b. Получение промежуточного соединения 16.CH3I (0,037 моль) медленно добавляют при комнатной температуре к смеси промежуточного соединения 15 (0,033 моль) и K2CO3 (0,037 моль) в ацетоне (150 мл). Смесь перемешивают при комнатной температуре в течение 8 ч, выливают в Н 2 О и экстрагируют CH2Cl2. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Выход: 11,2 г (97%). Часть полученной фракции (2 г) перекристаллизовывают из простого диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 1,45 г промежуточного соединения 16 (70%). Пример А 6 В. а. Получение промежуточного соединения 17. Раствор промежуточного соединения 1 (8 г, 0,03 моль) и тиомочевины (2,5 г, 0,033 моль) в этаноле(100 мл) перемешивают при 80 С в течение 4 ч и затем охлаждают до комнатной температуры. Добавляют раствор гидроксида калия (2,5 г, 0,045 моль) в воде (10 мл), смесь нагревают в течение 1 ч при 80 С,затем охлаждают до комнатной температуры и выливают в воду. Осадок отфильтровывают, промывают водой и сушат. Выход: 1,6 г промежуточного соединения 17 (95%).b. Получение промежуточного соединения 18. Раствор промежуточного соединения 17 (7,6 г, 0,029 моль), метилйодида (1,9 мл, 0,031 моль) и карбоната калия (4,3 г, 0,031 моль) в ацетоне (170 мл) перемешивают в течение 4 ч при комнатной температуре, выливают в воду и экстрагируют CH2Cl2. Органический слой промывают водой, сушат над MgSO4,фильтруют и растворитель выпаривают. Остаток перекристаллизовывают из простого этилового эфира. Осадок отфильтровывают и сушат. Выход: 5,83 г промежуточного соединения 18 (73%) (т.пл.: 82 С). Промежуточное соединение 19.- 17014163 Получают из промежуточного соединения 20(полученного согласно примеру А 2 в WO 2004/011436, исходя из 3-(4-хлорфенил)пропионовой кислоты; выход: 88 г промежуточного соединения 20 (70,7%, следуя аналогичной методике, как описано выше в примере А 6 А и А 6 В. Выход: 94% промежуточного соединения 19. Пример А 7. а. Получение промежуточного соединения 21.POCl3 (3,234 моль) медленно добавляют при 5 С к ДМФА (111 мл). После полного добавления добавляют N-(4-хлорфенил)бензолпропанамид (0,462 моль). Смесь перемешивают при 80 С в течение ночи, затем охлаждают до комнатной температуры и выливают на лед. Добавляют EtOAc. Смесь перемешивают в течение 1 ч, в это время добавляют лед и затем экстрагируют EtOAc. Органический слой отделяют, промывают Н 2 О, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 129 г промежуточного соединения 21 (97%).b. Получение промежуточного соединения 22. Смесь промежуточного соединения 21 (0,447 моль) в 30% CH3ONa (300 мл) и СН 3 ОН (300 мл) перемешивают при 80 С в течение ночи. Смесь охлаждают до комнатной температуры, выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, промывают Н 2 О, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (82 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/CH2Cl2 70/30; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 45 г промежуточного соединения 22 (35%). Пример А 8. а. Получение промежуточного соединения 23. Раствор промежуточного соединения 20 (1,5 г, 0,00409 моль), гидрохлорида диметиламина (1,33 г,0,001636 моль), карбоната калия (2,83 г, 0,002045 моль) в ацетонитриле (15 мл) перемешивают в течение 20 ч при 80 С, выливают в воду и экстрагируют простым диэтиловым эфиром. Органический слой сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток (1,5 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/AcOEt: 97/3). Чистые фракции собирают и растворитель выпаривают. Выход: 0,7 г промежуточного соединения 23 (47%). Пример А 9. а. Получение промежуточного соединения 24.CH2Cl2 (60 мл). Смесь перемешивают при 5 С в течение 1 ч. Добавляют N-метоксиметанамин HCl(0,038 моль). Смесь перемешивают при комнатной температуре в течение ночи. Добавляют 1 н. HCl. Смесь экстрагируют CH2Cl2. Органический слой промывают 10% K2CO3, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2: 100). Чистые фракции собирают и растворитель выпаривают. Выход: 5,4 г промежуточного соединения 24 (94%).b. Получение промежуточного соединения 25.CH3MgCl (0,025 моль) добавляют по каплям при 5 С к раствору промежуточного соединения 24(0,021 моль) в ТГФ (51 мл). Смесь перемешивают при 5 С в течение 2 ч, затем нагревают до комнатной температуры. Добавляют раствор NH4Cl. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 3,7 г промежуточного соединения 25(89%). с. Получение промежуточного соединения 26. Смесь промежуточного соединения 25 (0,019 моль), формальдегида (0,076 моль) и N-метилметанамина (0,076 моль) в концентрированной HCl (0,8 мл) и EtOH (23 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч, затем охлаждают до комнатной температуры. EtOH выпаривают. Остаток суспендируют в EtOAc. Смесь подщелачивают NaHCO3 и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 97/3; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Желаемая фракция привела к 1,17 г промежуточного соединения 26. Промежуточное соединение 27. Получают по аналогичной методике, как промежуточное соединение 26. Выход: 18% промежуточного соединения 27 (масло). Пример А 10. а. Получение промежуточного соединения 28. Муравьиную кислоту (31,5 мл, 0,834 моль) добавляют по каплям к ДМФА (100 мл) при перемешивании и охлаждении ледяной водой. Таким же образом добавляют триэтиламин (50,8 мл, 0,361 моль),затем кислоту Мелдрама (40 г, 0,278 моль). После растворения добавляют куминальдегид (0,278 моль). Смесь нагревают при 80 С в течение 14 ч, затем охлаждают и выливают в 1 л ледяной воды при энергичном перемешивании. Добавляют концентрированную HCl до рН 1-2. Осадок отфильтровывают, промывают водой и сушат на воздухе. Выход: 99% промежуточного соединения 28.b. Получение промежуточного соединения 29. 1,1'-Карбонилдиимидазол (6,6 г, 0,041 моль) добавляют порциями к смеси промежуточного соединения 28 (0,027 моль) в CH2Cl2 (50 мл), охлаждают на бане со льдом при 5 С. Смесь перемешивают 1 ч при 5 С, добавляют гидрохлорид N-метоксиметанамина (4 г, 0,041 моль) и суспензию перемешивают при комнатной температуре в течение 20 ч. Смесь выливают в 1 н. HCl и экстрагируют CH2Cl2. Органический слой промывают 10% K2CO3, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2 100). Чистые фракции собирают и растворитель выпаривают. Выход: 93% промежуточного соединения 29 (93%). с. Получение промежуточного соединения 30. Метилмагнийхлорид (22% в ТГФ, 8,1 мл, 0,023 моль) медленно добавляют при 0 С в токе N2 к раствору промежуточного соединения 29 (0,019 моль) в ТГФ (45 мл). Смесь перемешивают при 0 С в тече- 19014163 ние 2 ч, гидролизуют при 0 С с использованием 10% NH4Cl и экстрагируют EtOAc. Органический слой сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток используют без дальнейшей очистки. Выход: 83% промежуточного соединения 30 (83%).d. Получение промежуточного соединения 31. Смесь промежуточного соединения 30 (0,019 моль), параформальдегида (2,3 г, 0,076 моль), гидрохлорида диметиламина (6,2 г, 0,076 моль) и концентрированной соляной кислоты (0,8 мл) в EtOH (23 мл) перемешивают при кипячении с обратным холодильником в течение 24 ч, затем охлаждают и растворитель выпаривают. Остаток выливают в CH2Cl2, подщелачивают NaHCO3 и экстрагируют CH2Cl2. Органический слой сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH: 97/3). Чистые фракции двух изомеров собирают и растворитель выпаривают. Выход: 10% промежуточного соединения 31 (10%). Пример A11. а. Получение промежуточного соединения 32. Раствор 1% NaOH (50 мл) добавляют порциями к смеси 4-фторбензальдегида (21,6 мл, 0,2 моль) и ацетона (40 мл, 0,55 моль) в воде (40 мл). Смесь перемешивают в течение 2 ч при 65 С, затем смесь выливают в воду со льдом и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток используют без дальнейшей очистки на следующей стадии в виде масла. Выход: 34 г промежуточного соединения 32 (100%).b. Получение промежуточного соединения 33. Смесь промежуточного соединения 32 (4 г, 0,0244 моль), параформальдегида (1,1 г, 0,0365 моль),пиперидингидрохлорида (0,0244 моль) и концентрированной соляной кислоты (0,8 мл) в EtOH (6 мл) перемешивают при кипячении с обратным холодильником в течение 24 ч, охлаждают и растворитель выпаривают. Осадок отфильтровывают, промывают EtOH и сушат в вакууме при 60 С, получая промежуточное соединение 33 (63%). с. Получение промежуточного соединения 34. Смесь промежуточного соединения 33 (7,34 ммоль), 10% палладия на угле (0,22 г) в EtOH/H2O(22 мл, 50/50) перемешивают в атмосфере водорода при комнатной температуре в течение 2 ч. Смесь фильтруют через целит, промывают EtOH и растворитель выпаривают. Остаток обрабатывают 1 н. раствором NaOH в Et2O. Органический слой отделяют и промывают насыщенным раствором соли, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток используют без дальнейшей очистки на следующей стадии в виде масла. Выход: 76% промежуточного соединения 34. Пример А 12. а. Получение промежуточного соединения 35. Смесь промежуточного соединения 32 (4,8 г, 0,0292 моль), параформальдегида (1,32 г, 0,0439 моль),гидрохлорида N-бензилметиламина (4,6 г, 0,0292 моль) и концентрированной соляной кислоты (0,8 мл) вEtOH (100 мл) перемешивают при кипячении с обратным холодильником в течение 18 ч, охлаждают и растворитель выпаривают. Осадок отфильтровывают, промывают ацетоном и сушат в вакууме при 60 С. Выход: 3,8 г промежуточного соединения 35 (39%).b. Получение промежуточного соединения 36. Смесь промежуточного соединения 35 (3,8 г, 0,0114 моль), 10% палладия на угле (0,38 г) вEtOH/H2O (38 мл, 50/50) перемешивают в атмосфере водорода при комнатной температуре в течение 2 ч. Смесь фильтруют через целит, промывают EtOH и растворитель выпаривают. Остаток обрабатывают 1 н. раствором NaOH в Et2O. Органический слой отделяют и промывают насыщенным раствором соли, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (2,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH 99/1; 15-40 мкм). Чистую фракцию собирают и растворитель выпаривают. Выход: 0,75 г промежуточного соединения 36 (22%). Пример А 13. а. Получение промежуточного соединения 37. Смесь промежуточного соединения 35 (2,3 г, 0,00689 моль), 10% палладия на угле (0,23 г) вEtOH/H2O (24 мл, 50/50) перемешивают в атмосфере водорода при комнатной температуре в течение 3 ч. Смесь фильтруют через целит, промывают EtOH и растворитель выпаривают. Остаток обрабатывают 1 н. раствором NaOH в Et2O. Органический слой отделяют и промывают насыщенным раствором соли, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток используют без дальнейшей очистки на следующей стадии в виде масла. Выход: 1,3 г промежуточного соединения 37 (90%). Пример А 14. а. Получение промежуточного соединения 38.NaH (60% в масле; 0,0072 моль) добавляют порциями при 0 С к раствору 2-(2-этоксиэтокси)этанола(0,0072 моль) в ТГФ (12,5 мл) в токе N2. Смесь перемешивают при 0 С в течение 1 ч. Добавляют по каплям раствор промежуточного соединения 10 (0,006 моль) в ТГФ (12,5 мл). Смесь перемешивают, кипятят с обратным холодильником в течение 18 ч и затем охлаждают до комнатной температуры. ДобавляютEtOAc и Н 2 О. Органический слой промывают Н 2 О и затем насыщенным NaCl. Отделенный органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 2,5 г промежуточного соединения 38 (97%). Пример А 15. Получение промежуточного соединения 39. Промежуточное соединение 39 (dia A)nBuLi 1,6 М в гексане (0,0018 моль) добавляют по каплям при -70 С к раствору соединения 14N,N-диметилформамид (0,0037 моль). Смесь перемешивают при -70 С в течение 2 ч, выливают в Н 2 О и экстрагируют EtOAc. Органический слой промывают насыщенным NaCl, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 0,38 г промежуточного соединения 39 (100%).nBuLi 1,6 M (0,0084 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0084 моль) в ТГФ (24 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 2 (полученного согласно A1.b)(0,0076 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,0107 моль) в ТГФ (22 мл). Смесь перемешивают при -70 С в течение 3 ч, выливают при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток (4,3 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток очищают дважды колоночной хроматографией на кромасиле (элюент:CH3CN/NH4HCO3 0,5% 85/15; 10 мкм). Три фракции собирают и растворитель выпаривают. Выход: 0,155 г фракции 1; 0,08 г фракции 2 и 0,1 г фракции 3. Фракции 1 и 3 перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,14 г конечного соединения 1 (8%) (диастереоизомер А; т.пл.: 142 С) и 0,102 г конечного соединения 2 (6%) (диастереоизомер В; т.пл.: 159 С).nBuLi 1,6 М (0,0095 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0095 моль) в ТГФ (26 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 4 (полученного согласно А 2.b)(0,0086 моль) в ТГФ (24 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,012 моль) в ТГФ (25 мл). Смесь перемешивают при -70 С в течение 3 ч, выливают на лед при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (5,2 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,2 г) очищают колоночной хроматографией на кромасиле (элюент: циклогексан/iPrOH/NH4OH 95/5/0,3; 10 мкм). Желаемые фракции собирают и растворитель выпаривают. Выход: 0,035 г конечного соединения 3 (3%) (диастереоизомер А) и 0,03 г конечного соединения 4 (2,8%)nBuLi 1,6 М (0,0118 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0118 моль) в ТГФ (30 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 4 (полученного согласно А 2.b)(0,0107 моль) в ТГФ (35 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,015 моль) в ТГФ (30 мл). Смесь перемешивают при -70 С в течение 3 ч, выливают на лед при -30 С и экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1, затем CH2Cl2/iPrOH/NH4OH 95/5/0,4; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,13 г фракции 1 и 0,12 г фракции 2. Фракцию 1nBuLi 1,6 M (0,0084 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0084 моль) в ТГФ (24 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 8 (полученного согласно A3.с)(0,0076 моль) в ТГФ (25 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,0107 моль) в ТГФ (22 мл). Смесь перемешивают при -70 С в течение 3 ч, выливают на лед при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (5,1 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1, затем толуол/iPrOH/NH4OH 95/5/0,1; 15-40 мкм). Три фракции собирают и растворитель выпаривают. Выход: 0,87 г фракции 1; 0,7 г фракции 2 и 0,4 г фракции 3. Фракцию 3 очищают колоночной хроматографией на кромасиле (элюент: толуол/iPrOH/NH4OH 99/1/0,05; 10 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,15 г фракции А и 0,139 г фракции В. Фракцию В перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,585 г конечного соединения 5 (30%) (диастереоизомер А; т.пл.: 156 С). Фракцию А перекристаллизовывают из Раствор промежуточного соединения 11 (полученного согласно А 4.с) (0,0035 моль) в ТГФ (12 мл) добавляют по каплям при -70 С к раствору литиевой соли N-(1-метилэтил)-2-пропанамина (0,0038 моль) в ТГФ (19 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор промежуточного соединения 26 (полученного согласно А 9.с) (0,004 6 моль) в ТГФ (12 мл). Смесь перемешивают при(MgSO4), фильтруют и растворитель выпаривают. Остаток (2,2 г) очищают дважды колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 15-40 мкм). Три фракции собирают и растворитель выпаривают. Выход: 0,3 г фракции 1 (диастереоизомер А), 0,027 г фракции 2 и 0,242 г фракции 3 (диастереоизомер В). Фракцию 1 перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,26 г конечного соединения 7 (25%) (диастереоизомер А; т.пл.: 206 С). Фракции 3 перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,128 г конечного соединения 8 (12%) (диастереоизомер В; т.пл.: 160 С). е. Получение соединения 9.nBuLi (0,0084 моль) добавляют при -20 С к раствору N-(1-метилэтил)-2-пропанамина (0,0084 моль) в ТГФ (25 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 22 (полученного согласно А 7.b) (0,0076 моль) в ТГФ (26 мл). Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,0107 моль) в ТГФ (24 мл). Смесь перемешивают при -70 С в течение 3 ч, выливают на лед при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хрома- 23014163 тографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 15-40 мкм), затем очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,05). Три фракции собирают и растворитель выпаривают. Выход: 0,44 г фракции 1 (диастереоизомер А), 0,257 г фракции 2 и 0,02 г фракции 3. Фракцию 1 перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,14 г конечного соединения 9 (т.пл.: 172 С).nBuLi 1,6 М (0,0084 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2-пропанамина (0,0084 моль) в ТГФ (24 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 16 (полученного согласно А 6 А.b)(0,0076 моль) в ТГФ (26 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,0107 моль) в ТГФ (22 мл). Смесь перемешивают при -70 С в течение 3 ч, затем выливают на лед при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (4,8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,52 г фракции 1 и 0,42 г фракции 2. Обе фракции перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,47 г конечного соединения 10 (23%) (диастереоизомер А; т.пл.: 191 С) и 0,27 г конечного соединения 11 (7%) (диастереоизомер В; т.пл.: 179 С). 1,6 М nBuLi (0,0114 моль) добавляют по каплям при -20 С к раствору N-(1-метилэтил)-2-пропанамина (0,0114 моль) в ТГФ (32 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до-70 С. Добавляют раствор промежуточного соединения 11 (полученного согласно А 4.с) (0,0104 моль) в ТГФ (34 мл). Смесь перемешивают в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (0,0146 моль) в ТГФ (30 мл). Смесь перемешивают при -70 С в течение 3 ч, затем выливают при -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (5,3 г) очищают дважды колоночной хроматографией на силикагеле(элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,1; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,45 г F1 и 0,22 г F2. Обе фракции перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,154 г F3 (диастереоизомер А) и 0,11 г F4 (диастереоизомер В). F3 разделяют на два энантиомера с помощью ChiralPakAD (элюент: EtOH 100; 20 мкм). Две фракции собирают и растворитель выпаривают. Каждую фракцию перекристаллизовывают отдельно из смеси DIPE/диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,19 г соединения 17 (А 1) и 0,175 г соединения 18 (А 2). F4 разделяют на два энантиомера с помощью ChiralPakAD (элюент: EtOH/iPrOH 90/10; 20 мкм). Две фракции собирают и растворитель выпаривают. Каждую фракцию перекристаллизовывают отдельно из смеси 1,6 M nBuLi в гексане (3,4 мл, 0,0055 моль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (0,78 мл, 0,0055 моль) в ТГФ (8,5 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Медленно добавляют раствор 3-(4-хлорбензил)-6-бром-2-метоксихинолина (1,67 г, 0,0046 моль) в ТГФ (34 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Медленно добавляют раствор 1-(диметиламино)-5-(4-метоксифенил)пентан-3-она (1,13 г, 0,0055 моль) в ТГФ (30 мл). Смесь перемешивают при -70 С в течение 2 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH; 97/3/0,1; 15-40 мкм). Одну фракцию собирают и растворитель выпаривают. Полученную фракцию очищают суперкритической жидкостной хроматографией (SCF) (CO2/MeOH/2-пропанол: 95/5/0,5, цианоколонка). Две фракции собирают и растворитель выпаривают. Фракции отдельно перекристаллизовывают из простого диизопропилового эфира. Выход: 0,220 г конечного соединения 21 (8%) (диастереоизомер А; т.пл.: 142 С) в виде белого твердого вещества и 0,09 г конечного соединения 22 (3,3%) (диастереоизомер В; т.пл.: 160 С) в виде белого твердого вещества. 1. Получение соединений 23 и 24. 1,6 М nBuLi в гексане (3,4 мл, 0,0055 моль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (0,78 мл, 0,0055 моль) в ТГФ (8,5 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 31(0,0046 моль) в ТГФ (34 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Медленно добавляют раствор промежуточного соединения 24 (0,0055 моль) в ТГФ (30 мл). Смесь перемешивают при -70 С в течение 2 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Одну фракцию собирают и растворитель выпаривают. Полученную фракцию очищают SFC (СО 2/МеОН/2-пропанол: 95/5/0,5, цианоколонка). Две фракции собирают и растворитель выпаривают. Фракции отдельно перекристаллизовывают из простого диизопропилового эфира. Выход: конечное соединение 23 (5%) (диастереоизомер А) в виде белой пены и конечное соединение 24 (2,3%) (диастереоизомер В) в виде белой пены. Соединения 29 и 30 получают согласно методике для соединений 14 и 15, но исходя из промежуточного соединения 18 и 1-(диметиламино)-5-фенил-3-пентанона (полученного, как описано в J. Am. Соединения 31 и 32 получают по аналогичной методике для соединения 21 и 22, но исходя из промежуточного соединения 19 и 1-(диметиламино)-5-фенил-3-пентанона (полученного, как описано в J. 1,6 М nBuLi в гексане (2,3 мл, 3,66 ммоль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (0,513 мл, 3,66 ммоль) в ТГФ (8 мл). Смесь перемешивают при -20 С в течение 20 мин и затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 11 (1,0 г,3,05 ммоль) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 1 ч. Медленно добавляют раствор промежуточного соединения 34 (0,96 г, 3,66 ммоль) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 1 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/1/0,05; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Фракции отдельно перекристаллизовывают из метанола. Выход: 0,15 г конечного соединения 34 (8%) (диастереоизомер А, т.пл.: 194 С) в виде белого твердого вещества и 0,13 г конечного соединения 35 (7%) (диастереоизомер В, т.пл.: 170 С) в виде белого твердого вещества. 1,6 М nBuLi в гексане (8,1 мл, 0,013 моль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (1,83 мл, 0,013 моль) в ТГФ (30 мл). Смесь перемешивают при -20 С в течение 20 мин и затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 11 (4,1 г,0,0124 моль) в ТГФ (40 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Медленно добавляют раствор промежуточного соединения 37 (1,3 г, 0,00662 моль) в ТГФ (13 мл). Смесь перемешивают при -70 С в течение 1 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток (5,7 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 94/6/0,1; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Фракции отдельно перекристаллизовывают из DIPE. Выход: 0,106 г конечного соединения 39 (2%) (диастереоизомер А, т.пл.: 140 С) в виде белого твердого вещества и 0,068 г конечного соединения 40 (1%) (диастереоизомер В, т.пл.: 250 С) в виде белого твердого вещества. 1,6 М nBuLi в гексане (3 мл, 0,0048 моль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (0,67 мл, 0,004 8 моль) в ТГФ (14 мл). Смесь перемешивают при -20 С в течение 20 мин,затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 11 (1,44 г,0,0044 моль) в ТГФ (15 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Медленно добавляют раствор промежуточного соединения 27 (1,5 г, 0,0062 моль) в ТГФ (15 мл). Смесь перемешивают при-70 С в течение 3 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток (3,2 г) очищают колоночной хроматографией с С 18 (элюент: CH3OH/NH4HCO3 95/5; Kromasil C18, 10 мкм). Две фракции собирают и растворитель выпаривают. Фракции перекристаллизовывают отдельно из простого диизопропилового эфира и простого диэтилового эфира. Выход: 0,045 г конечного соединения 41 (3%) (диастереоизомер А, т.пл.: 112 С) в виде белого твердого вещества и 0,2 г конечного соединения 42 (12%) (диастереоизомер В, т.пл.: 124 С) в виде белого твердого вещества. о. Получение соединений 43 и 44. 1,6 М nBuLi в гексане (4,1 мл, 0,0066 моль) добавляют по каплям при -20 С в токе N2 к раствору диизопропиламина (0,93 мл, 0,0066 моль) в ТГФ (12 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 38 (2,6 г,0,0060 моль) в ТГФ (27 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор 1-(диметиламино)-5-фенил-3-пентанона (полученного, как описано в J. Am. Chem. Soc, 1950, 72, 718-721)(1,7 г, 0,0084 моль) в ТГФ (20 мл). Смесь перемешивают при -70 С в течение 3 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток (2,5 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH 97/3/0,1; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,15 г фракции 1 и 0,22 г фракции 2. Фракцию 1 перекристаллизовывают из смеси DIPE/простой диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,129 конечного соединения 43 (3,4%) (диастереоизомер А, т.пл.: 94 С). Фракцию 2 снова очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH: 97/3/0,1; 15-40 мкм) и перекристаллизовывают из смеси DIPE/простой диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,05 9 г конечного соединения 44 (2%) (диастереоизомер В, т.пл.: 103 С). Пример В 2. а. Получение соединения 12. Смесь конечного соединения 5 (полученного согласно B1.c) (0,282 моль) и HCOONH4 (1,41 моль) вPd/C (0,15 мл) и СН 3 ОН (3 мл) перемешивают и кипятят с обратным холодильником в течение 30 мин,- 27014163 затем охлаждают до комнатной температуры, фильтруют через целит и промывают CH2Cl2. Фильтрат промывают Н 2 О, затем насыщенным NaCl. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток перекристаллизовывают из DIPE. Осадок отфильтровывают и сушат. Выход: 0,11 г конечного соединения 12 (86%) (т.пл.: 122 С). Раствор конечного соединения 15 (0,25 г, 0,00047 моль), пиридин-3-бороновой кислоты (0,116 г,0,00094 моль) и тетракис(трифенилфосфин)палладия(0) (0,054 г, 0,000047 моль) в диметиловом эфире этиленгликоля (13 мл) и раствор 2 М карбоната натрия (0,94 мл) перемешивают в течение ночи при 80 С. Затем раствор охлаждают до комнатной температуры, выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток (0,3 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH от 99/1/0,1 до 94/6/0,6; 15-30 мкм). Чистую фракцию собирают и растворитель выпаривают. Выход: 0,024 г конечного соединения 36 (9,6%). Пример В 3. а. Получение соединений 25, 26, 27 и 28. Для получения соответствующих энантиомеров 0,416 г конечного соединения 49 (диастереоизомер А) очищают хиральной хроматографией SFC (ChiralPakADH 25021 мм, элюент: CO2/EtOH/2-пропанол: 85/15/0,3). Две фракции собирают и растворитель выпаривают, получая 0,13 г конечного соединения 25(энантиомер А 1) в виде белого твердого вещества и 0,13 г конечного соединения 26 (энантиомер А 2). Для получения соответствующих энантиомеров 0,655 г конечного соединения 50 (диастереоизомер В) очищают хиральной хроматографией SFC (ChiralPakADH 25021 мм, элюент: CO2/EtOH/2-пропанол: 85/15/0,3). Две фракции собирают и растворитель выпаривают, получая 0,105 г конечного соединения 27(энантиомер В 1) в виде белого твердого вещества и 0,1 г конечного соединения 28 (энантиомер В 2). Пример В 4. а. Получение соединения 33.- 28014163 Конечное соединение 33 получают по аналогичной методике для соединения 21, исходя из промежуточного соединения 23 и 1-(диметиламино)-5-фенил-3-пентанона (полученного, как описано в J. Am. 1,6 М nBuLi в гексане (2,5 мл, 0,004 моль) медленно добавляют при -20 С в токе N2 к раствору диизопропиламина (0,562 мл, 0,004 моль) в ТГФ (9 мл). Смесь перемешивают при -20 С в течение 20 мин,затем охлаждают до -70 С. Медленно добавляют раствор промежуточного соединения 11 (1,1 г, 0,00334 моль) в ТГФ (11 мл). Смесь перемешивают при -70 С в течение 1 ч. Медленно добавляют раствор промежуточного соединения 36 (1,0 г, 0,00334 моль) в ТГФ (10 мл). Смесь перемешивают при -70 С в течение 1 ч, гидролизуют при -30 С водой со льдом и экстрагируют EtOAc. Органический слой отделяют, сушат MgSO4,фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(элюент: циклогексан/EtOAc; 83/17; 15-40 мкм). Чистую фракцию собирают и растворитель выпаривают. Выход: 0,75 г промежуточного соединения 36 (смесь диастереоизомеров) (36%). Смесь конечного соединения 92 (0,45 г, 0,72 ммоль) в CH2Cl2 (2 мл), формиата аммония (0,23 г,0,0036 моль), 10% палладия на угле (0,45 г) в метаноле (9 мл) перемешивают в течение 30 мин при 80 С. Затем смесь выливают в воду со льдом и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток(0,45 г) очищают колоночной хроматографией на силикагеле (элюент: толуол/2-пропанол/NH4OH; 90/10/0,5; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Фракции отдельно перекристаллизовывают из DIPE. Выход: 0,102 г конечного соединения 37 (30%) (диастереоизомер А, т.пл.: 134 С) в виде белого твердого вещества и 0,064 г конечного соединения 38 (20%) (диастереоизомер В,т.пл.: 138 С) в виде белого твердого вещества. Пример В 6. Получение соединения 58.NaBH4 (0,0007 моль) добавляют при 0 С к раствору промежуточного соединения 39 (0,0007 моль)(полученного согласно примеру А 15) в МеОН (6 мл) и ТГФ (6 мл). Смесь перемешивают при 0 С в течение 2 ч, выливают в H2O и экстрагируют EtOAc. Органический слой промывают насыщенным NaCl, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,7 г) очищают колоночной хроматографией на кромасиле (элюент: CH2Cl2/CH3OH/NH4OH 98/2/0,2; 3,5 мкм). Чистые фракции собирают и растворитель выпаривают. Полученную фракцию перекристаллизовывают из смеси DIPE/простой диэтиловый эфир. Осадок отфильтровывают и сушат. Выход: 0,05 г соединения 58 (диастереоизомер А). В приведенных ниже табл. 1-5 перечислены соединения, которые были получены согласно одному из приведенных выше примеров (прим. )
МПК / Метки
МПК: C07D 215/227, A61K 31/4353, C07D 215/36, A61P 31/04, C07D 215/22
Метки: хинолина, качестве, агентов, производные, антибактериальных
Код ссылки
<a href="https://eas.patents.su/30-14163-proizvodnye-hinolina-v-kachestve-antibakterialnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве антибактериальных агентов</a>