Сульфонамидные производные и их применение для модулирования металлопротеаз
Формула / Реферат
1. Соединение формулы (Ia)
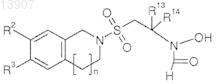
где R2и R3 независимо выбраны из
водорода,
галогена,
линейного или разветвленного C1-С6-алкила, необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-С6-алкилокси, фенокси,
линейного или разветвленного C1-С6-алкилокси,
фенила, необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-С6-алкила,
фенил-линейного или разветвленного С1-С6-алкила, где указанный фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-С6-алкила,
трех-шестичленной гетероциклической группы, имеющей, по меньшей мере, гетероатом, выбранный из группы, состоящей из кислорода, азота и серы;
R13 выбран из Н, линейного или разветвленного C1-С6-алкила,
R14 выбран из
линейного или разветвленного C1-C8-алкила, необязательно замещенного одним или более атомами галогена и/или гидроксигруппами, где указанный C1-C8-алкил в алкильной цепи необязательно содержит одну или более ненасыщенных связей С-С или содержит один или более атомов кислорода или серы,
С3-С8-циклоалкила, необязательно замещенного карбокси или линейной или разветвленной С1-C4-алкоксикарбонильной группой,
фенила,
фенил-линейного или разветвленного C1-С6-алкила, где указанный C1-С6-алкил необязательно содержит один атом кислорода,
гетероциклической или гетероциклоалкильной группы, выбранной из группы, состоящей из 1,3-диоксолана, 2,2-диметил-1,3-диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, где указанный пиридин необязательно замещен гидрокси или C1-С6-алкоксигруппой; пиридинил-линейного или разветвленного С1-C4-алкила; пиперидина, где указанный пиперидин необязательно замещен фенил-С1-С4-алкилом; фурана, тетрагидрофурана; 2-тетрагидрофуран~2-ил-этила, пирролидин N-карбоновой кислоты, С1-С4-линейного или разветвленного N-алкоксикарбонилпирролидин-2-ила; тетрагидропирана; или
R13 и R14, взятые вместе, образуют С3-С8-циклоалкил;
n представляет целое число, выбранное из 0 или 1;
а также его геометрические изомеры, оптически активные формы такие как энантиомеры, диастереомеры, таутомеры, рацемические формы, а также их фармацевтически приемлемые соли.
2. Соединение по п.1, где R2 и R3выбраны независимо из Н и алкокси.
3. Соединение по любому из предшествующих пунктов, где R13 представляет собой Н.
4. Соединение по любому из предшествующих пунктов, где R13 представляет Н; R2выбран из Н и алкокси; R14 и n определены в предшествующих пунктах.
5. Соединение по любому из предшествующих пунктов, где R14 выбран из фенила и гетероциклической или гетероциклоалкильной группы, выбранной из группы, состоящей из 1,3-диоксолана, 2,2-диметил-1,3-диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, где указанный пиридин необязательно замещен гидрокси или C1-С6-алкоксигруппой; пиридинил-линейного или разветвленного С1-С4-алкила; пиперидина, где указанный пиперидин необязательно замещен фенил-С1-C4-алкилом; фурана, тетрагидрофурана; 2-тетрагидрофуран-2-илэтила, пирролидин N-карбоновой кислоты, С1-С4-линейного или разветвленного N-алкоксикарбонилпирролидин-2-ила; тетрагидропирана.
6. Соединение по любому из предшествующих пунктов, где n равно 0.
7. Соединение по любому из предшествующих пунктов, где n равно 1.
8. Соединение по п.1, где R13 выбран из Н, линейного или разветвленного C1-С6-алкила, a R14 представляет линейный или разветвленный C1-C8-алкил, необязательно замещенный одним или несколькими атомами галогена и/или гидроксигруппами, где указанный C1-C8-алкил необязательно содержит в алкильной цепи одну или более ненасыщенных связей С-С или содержит один или более атомов кислорода или серы.
9. Соединение по п.1, где R13 выбран из Н, линейного или разветвленного С1-С6-алкила, a R14 представляет собой С3-С8-циклоалкил, необязательно замещенный карбоксильной или линейной или разветвленной С1-С4-алкоксикарбонильной группой.
10. Соединение по п.1, где R13 выбран из Н, линейного или разветвленного C1-С6-алкила, a R14 представляет собой фенил или фенил-линейный или разветвленный C1-С6-алкил, указанный С1-С6-алкил необязательно содержит один атом кислорода.
11. Соединение по п.1, где R13 выбран из Н, линейного или разветвленного C1-С6-алкила, a R14 представляет собой гетероциклическую или гетероциклоалкильную группу, выбранную из группы, состоящей из 1,3-диоксолана, 2,2-диметил-1,3-диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, где указанный пиридин необязательно замещен гидрокси или C1-С6-алкоксигруппой; пиридинил-линейного или разветвленного С1-С4-алкила; пиперидина, где указанный пиперидин необязательно замещен фенил-С1-C4-алкилом; фурана, тетрагидрофурана; 2-тетрагидрофуран-2-илэтила, пирролидин N-карбоновой кислоты, C1-С4-линейного или разветвленного N-алкоксикарбонилпирролидин-2-ила; тетрагидропирана.
12. Соединение по п.1, где R13 и R14, взятые вместе, образуют циклопентильную группу.
13. Соединение по любому из предшествующих пунктов, выбранное из следующей группы:
N-{1-[(3,4-дигидроизохинолин-2(1Н)-ил)сульфонил)метил]-3-фенилпропил}-N-гидроксиформамид;
N-{2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]этил}-N-гидроксиформамид;
N-{1-[(3,4-дигидроизохинолин-2(1Н)-илсульфонил)метил]гексил}-N-гидроксиформамид;
N-[1-циклопропил-2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)этил]-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1- (2-тиенил)этил]-N-гидроксиформамид;
N-{1-[(1,3-дигидро-2Н-изоиндол-2-илсульфонил)метил]-3-фенилпропил}-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-(3-тиенил)этил]-N-гидроксиформамид;
N-{1-[(3,4-дигидроизохинолин-2(1Н)-илсульфонил)метил]-2-метил-2-морфолинин-4-илпропил}-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-пиримидин-5-илэтил]-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-пиридин-3-илэтил]-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-пиридин-3-илэтил]-N-гидроксиформамид, гидрохлоридная соль;
N-(1-{[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-фенилилпропил)-N-гидроксиформамид;
N-[2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-(6-метоксипиридин-3-ил)этил]-N-гидроксиформамид;
N-{2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]этил}-N-гидроксиформамид;
N-{1-циклопентил-2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{2-[(1,3-дигидро-2Н-изоиндол-2-илсульфонил)-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]этил}-N-гидроксиформамид;
N-(1-{[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2-этилбутил)-N-гидроксиформамид;
N-{1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]-2-[(6-изопропил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]этил}-N-гидроксиформамид;
N-(1-{[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2,2-диметилпропил-N-гидроксиформамид;
N-{2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-циклопентилэтил}-N-гидроксиформамид;
N-{(1R)-2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(2R)-тетрагидрофуран-2-ил]этил}-N-гидроксиформамид;
N-{(1S)-2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(2R)-тетрагидрофуран-2-ил]этил}-N-гидроксиформамид;
N-{(lS,2S)-l-{[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2,3-дигидроксипропил)-N-гидроксиформамид;
N-(1-циклопентил-2-{[(6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-(1-{[(5-фтор-1,3-дигидро-2Н-изоиндол-2-ил)сульфонил]метил}-3,3-диметилбутил)-N-гидроксиформамид;
N-гидрокси-N-((1S)-1-[(2R)-тетрагидрофуран-2-ил]-2-{[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)формамид;
N-(1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]-2-{[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-{(1S)-2-[5-фтор-1,3-дигидро-2Н-изоиндол-2-ил)сульфонил]-1-[(2R)-тетрагидрофуран-2-ил]этил}-N-гидроксиформамид;
N-[2,2-диметил-1-({[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)гепт-4-ин-1-ил]-N-гидроксиформамид;
N-[2,2-диметил-3-фенил-1-({[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)пропил]-N-гидроксиформамид;
N-гидрокси-N-((1R)-1[(2R)-тетрагидрофуран-2-ил]-2-{[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)формамид;
N-гидрокси-N-[1-{[(7-метокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-(тетрагидрофуран-2-ил)пропил]формамид;
N-(1-{[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2-этилбутил)-N-гидроксиформамид;
N-(2-этил-1-{[(6-изопропил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}бутил)-N-гидроксиформамид;
N-(1-{[(7-бром-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2-этилбутил)-N-гидроксиформамид;
N-(2-этил-1-({[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)бутил)-N-гидроксиформамид;
N-(2-этил-1-{[(7-метокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}бутил)-N-гидроксиформамид;
N-(1-{[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2-метилпропил)-N-гидроксиформамид;
N-(3,3-диметил-1-{[(7-пропокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}бутил)-N-гидроксиформамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3,3-диметилбутил)-N-гидроксиформамид;
N-(1-{[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3,3-диметилбутил)-N-гидроксиформамид;
N-[3,3-диметил-1-({[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)бутил]-N-гидроксиформамид;
трет-бутил (2RS)-2-{(1SR)-2-[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[формил(гидрокси)амино]этил}пирролидин-1-карбоксилат;
N-гидрокси-N-{(1S)-2-[(6-изопропил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(2R)-тетрагидрофуран-2-ил]этил}формамид;
трет-бутил (2RS)-2-{(1RS)-2-[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[формил(гидрокси)амино]этил}пирролидин-1-карбоксилат;
N-гидрокси-N-(1-[(2R)-тетрагидрофуран-2-ил]-2-{[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)формамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-гидроксипропил)-N-гидроксиформамид;
N-[2-[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-(гидроксиметил)этил]-N-гидроксиформамид;
N-[1-({[7-(4-фторфенил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)-2-метилпропил]-N-гидроксиформамид;
N-гидрокси-N-(1-{[(7-изопропокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-метилбутил)формамид;
N-[2-[(7-фтор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-(3-фурил)этил]-N-гидроксиформамид;
N-{1-(1-бензилпиперидин-4-ил)-2-[(7-фтор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-[1-{[(7-трет-бутил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-(метилтио)пропил]-N-гидроксиформамид;
N-(1-{[(7-бром-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-метилбутил)-N-гидроксиформамид;
N-{2-[(7-бром-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1,1-диметилэтил}-N-гидроксиформамид;
N-(2-(бензилокси)(1-{[(7-трет-бутил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}этил)-N-гидроксиформамид;
N-(2-(бензилокси)(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}этил)-N-гидроксиформамид;
N-[2-(бензилокси)-1-({[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)этил]-N-гидроксиформамид;
N-{1-циклопентил-2-[(7-фтор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-[2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-(феноксиметил)этил]-N-гидроксиформамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}циклопентил)-N-гидроксиформамид;
N-[2,2-диметил-1-({[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)гептил]-N-гидроксиформамид;
N-{2-[(7-бром-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-циклопентилэтил}-N-гидроксиформамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-2,2-диметилпропил)-N-гидроксиформамид;
N-[2-[(7-трет-бутил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-(тетрагидро-2Н-пиран-4-ил)этил]-N-гидроксиформамид;
этил 2-{2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[формил(гидрокси)амино]этил} циклопропанкарбоксилат;
N-(1-циклопентил-2-{[7-(3-тиенил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-{1-циклопентил-2-[(7-фенил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-(1-циклопентил-2-{[7-(3-гидроксифенил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
2-{2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[формил(гидрокси)амино]этил} циклопропанкарбоновая кислота;
N-[1-циклопропил-2-(1,3-дигидро-2Н-изоиндол-2-илсульфонил)этил]-N-гидроксиформамид;
N-{2-[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-циклопропилэтил}-N-гидроксиформамид;
N-(1-циклопропил-2-{[6-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-(1-циклопропил-2-{[7-(4-фторфенил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-4,4,4-трифторбутил)-N-гидроксиформамид;
N-{1-циклопентил-2-[(6,7-дихлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{1-циклопентил-2-[(7-изопропокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{1-циклопентил-2-[(7-пиридин-4-ил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{1-циклопентил-2-[(5-фтор-1,3-дигидро-2Н-изоиндол-2-ил)сульфонил]этил}-N-гидроксиформамид;
N-{1-циклопентил-2-[(6-изопропил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-(1-циклопентил-2-{[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил}этил)-N-гидроксиформамид;
N-(1-циклопропил-2-{[7-(трифторметил)-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}этил)-N-гидроксиформамид;
N-{1-циклопропил-2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-{1-циклопропил-2-[(6-изопропил-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]этил}-N-гидроксиформамид;
N-(1-{[(7-хлор-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]метил}-3-пиридин-3-илпропил)-N-гидроксиформамид.
14. Применение соединения по любому из пп.1-13 в качестве лекарственного средства.
15. Применение соединения по любому из пп.1-13 в качестве лекарственного средства для профилактики и/или лечения воспалительных заболеваний, нейродегенеративных заболеваний, сердечно-сосудистых заболеваний, удара, рака, преждевременных родов, эндометриоза, фиброза и респираторных расстройств.
16. Применение по п.15, где указанные заболевания выбраны из воспалительных заболеваний, заболеваний кишечника, рассеянного склероза, остеоартрита и ревматоидного артрита.
17. Применение по п.15, где указанные заболевания выбраны из группы, включающей астму, эмфизему и хронические обструктивные заболевания легких.
18. Применение по п.15, где указанные заболевания выбраны из группы, включающей фиброз легких, фиброз поджелудочной железы, псориаз, фиброз кожи и фиброз печени.
19. Применение соединения по любому из пп.1-13 в качестве лекарственного средства для модулирования металлопротеаз и/или ТАСЕ.
20. Применение соединения по любому из пп.1-13 для модулирования металлопротеаз и/или ТАСЕ in vitro.
21. Фармацевтическая композиция, включающая по меньшей мере одно соединение по любому из пп.1-13 и его фармацевтически приемлемый носитель, разбавитель или эксципиент.
22. Способ получения соединения по любому из пп.1-13, включающий стадию взаимодействия соединения формулы (II) с формилирующим агентом формулы (FA)
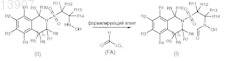
где R1, R4, R5, R6, R7, R8, R9, R10, R11, R12 представляют собой водород, R2, R3, R13, R14 и n определены в предшествующих пунктах и LG1представляет собой уходящую группу, выбранную из -ОН, -ОАс, -OPiv,
-OCH2CN, -OCH2CF3, -OPh и -OPfp.
23. Соединение, соответствующее формуле (II)
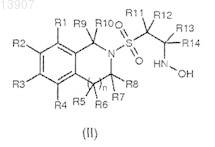
где R1, R4, R5, R6, R7, R8, R9, R10, R11, R12 представляют собой водород, R2, R3, R13, R14 и n определены в предшествующих пунктах.
24. Соединение по п.23, выбранное из следующей группы:
1-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-4-фенилбутан-2-амин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]-N-гидроксиэтанамин;
1-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидроксигептан-2-амин;
1-циклопропил-2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидроксиэтанамин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-1-(2-тиенил)этанамин;
1-(1,3-дигидро-2Н-изоиндол-2-илсульфонил)-N-гидрокси-4-фенилбутан-2-амин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-1-(3-тиенил)этанамин;
1-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-3-метил-3-морфолин-4-илбутан-2-амин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-1-1-пиримидин-2-илэтанамин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-1-пиридин-3-илэтанамин;
1-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-N-гидрокси-4-фенилбутан-2-амин;
2-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)-N-гидрокси-1-(6-метоксипиридин-3-ил)этанамин;
2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]-N-гидроксиэтанамин.
25. Применение соединения по п.23 или 24 в качестве промежуточного соединения в способе по п.22.
Текст
СУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ ДЛЯ МОДУЛИРОВАНИЯ МЕТАЛЛОПРОТЕАЗ Настоящее изобретение относится к сульфонамидным производным формулы (Ia), где группы определены в описании, и к их применению, в частности, для лечения и/или профилактики аутоиммунных заболеваний, воспалительных заболеваний, сердечно-сосудистых заболеваний,нейродегенеративных заболеваний, рака, респираторных заболеваний и фиброза, включая рассеянный склероз, артрит, эмфизему, хроническое обструктивное заболевание легких, фиброз печени и легких. 013907 Область изобретения Настоящее изобретение относится к сульфонамидным производным формулы (I), содержащей их фармацевтической композиции, способам их получения и их применению для лечения и/или профилактики аутоиммунных расстройств и/или воспалительных заболеваний, сердечно-сосудистых заболеваний,нейродегенеративных заболеваний, рака, респираторных заболеваний и фиброза. Особенно настоящее изобретение относится к сульфонамидным производным, пригодным для модулирования, в частности для ингибирования, активности или функции металлопротеаз матрикса. Предпосылки изобретения Металлопротеазы являются особым семейством протеаз (ферментов), названных так вследствие их зависимости от иона металла (цинк) в активном сайте. Металлопротеазы матрикса (ММР) образуют подсемейство металлопротеаз, имеющих в качестве одной из главных биологических функций катализ разрушения соединительной ткани или внеклеточного матрикса за счет своей способности гидролизовывать различные компоненты ткани или матрикса, такие как коллагены, желатины, протеогликаны, фибронектины и эластин. Семейство металлопротеаз матрикса далее подразделяется в соответствии с их функциями и субстратами (Visse et al., 2003, Circ. Res., 92: 827-839) и включает коллагеназы (ММР-1, ММР-8, ММР-13 и ММР-18), желатиназы (ММР-2 и ММР-9), стромелизины (ММР-3, ММР-10 и ММР-11), ММР мембранного типа (от МТ-ММР-1 до МТ-ММР-6 и ММР-14, ММР-15, ММР-16, ММР-17, ММР-24 и ММР-25),матрилизины (ММР-7 и ММР-26) и другие ММР, не отнесенные к какому-либо классу, такие как металлоэластаза (ММР-12), энамелизин (ММР-20), эпилизин (ММР-28), ММР-19, ММР-22 и ММР-23. Помимо своей роли в разрушении соединительной ткани, ММР вовлечены в биосинтез TNF-альфа и в посттрансляционный процессинг протеолиза или отщепления биологически значимых белков мембран (Hooper et al., 1997, Biochem. J., 321: 265-279). Например, ММР вносят вклад в локальный рост и распространение злокачественных образований и поэтому являются мишенями при создании противораковых лекарств (Fingleton et al., 2003, Expert Opin. Ther. Targets, 7(3): 385-391). Было показано, что с экспрессией и/или активностью ММР связаны такие расстройства и явления, как воспалительные расстройства, подобные артриту (Clark et al., 2003, Expert Opin. Ther. Targets, 7(1): 19-34), респираторные расстройства, такие как эмфизема, атеросклероз (Galls et al., 2002, Circ. Res., 90: 251-262), неврологические расстройства, такие как дегенеративные заболевания нервной системы, рассеянный склероз (Leppert etal., 2001, Brain Res. Rev., 36: 249-257), пародонтоз (Ingman et al., 1996, J. Clin. Periodontal., 23: 127-1132),преждевременные роды (Makratis et al., 2003, J. Matern FetalNeonatal Medicine, 14 (3): 170-6) и заживление ран. Недавно обнаруженный подкласс металлопротеаз - семейство клеточно-ассоциированного дезинтегрина А и цинк-металлопротеазы (ADAM) привлекло внимание в качестве перспективной терапевтической мишени, особенно в случае рака. При этом были идентифицированы 23 различных ADAM.ADAM-17, также известный как фермент, конвертирующий раковый некротизирующий фактор альфа(далее "ТАСЕ"), является наиболее известным ADAM. ТАСЕ ответственен за отщепление связанного клеткой ракового некротизирующего фактора альфа(TNF-). TNF- вовлечен во многие инфекционные и аутоиммунные заболевания. Более того, TNFявляется первичным медиатором воспалительного ответа, проявляющегося в виде сепсиса и септического шока. Некоторые ингибиторы ТАСЕ были разработаны и описаны в работе Watson, 2002, IDrugs,5(12): 1151-1161. Было разработано широкое разнообразие ингибиторов металлопротеаз (MMPI) (Skiles et al., 2001,Current Medicinal Chemistry, 8, 425-474; Henrotin et al., 2002, Expert Opin. Ther. Patents, 12(1): 29-43). Однако многие MMPI вызывают скелетно-мышечный синдром (тендонит, фиброплазии, милазию, артралазию) в качестве побочного эффекта, ограничивающего дозировку. Было сделано предположение, что ингибирование ММР-1 или ММР-14 может быть ответственно за указанные эффекты.WO 01/87844 раскрывает производные гидроксамовой кислоты и карбоновой кислоты, обладающие ингибирующим действием в отношении ММР и TNF для применения при лечении рака, воспаления или аутоиммунного, инфекционного или глазного заболевания.WO 2004/006926 раскрывает сульфонилпиперидиновые соединения, содержащие арильную или гетероарильную группу для применения в качестве ингибиторов металлопротеаз матрикса (ММР), в особенности ТАСЕ. Поэтому существует возрастающая потребность в разработке ингибиторов металлопротеаз матрикса с хорошо изученным профилем специфичности. Имеются сообщения о специфичных ингибиторах, в особенности действующих в отношении ММР-1, включая ингибиторы ММР-13 (Stotnicki et al., 2003, Current Opinion in Drug Discovery andDevelopment, 6(5): 742-759), ингибиторы ММР-12 (Expert Opin. Ther. Patents, 2004, 14(11): 1637-1640),ингибиторы ММР-2 и MMP-9 (Wada et al., 2002, J. Biol. Chem. 45: 219-232). Высокая релевантность металлопротеазного пути в случае некоторых широко распространенных заболеваний подчеркивает потребность в разработке ингибиторов, включая селективные ингибиторы ММР, в особенности ММР-12.-1 013907 Поскольку избыточное продуцирование TNF- отмечается при некоторых болезненных состояниях,также характеризуемых разрушением ткани, опосредованным ММР, то соединения, которые ингибируют продуцирование ММР и/или TNF-, также могут иметь особое преимущество в случае заболеваний, в которые вовлечены оба механизма. Краткое описание изобретения Задача настоящего изобретения состоит в обеспечении соединений, которые пригодны для лечения и/или предупреждения расстройств, относящихся к аутоиммунным расстройствам и/или воспалительным расстройствам, сердечно-сосудистым расстройствам, нейродегенеративным расстройствам, удара, рака и злокачественных образований, респираторных заболеваний, метаболических заболеваний, аллергических и дерматологических заболеваний, преждевременных родов, эндометриоза и фиброза. Другая задача настоящего изобретения состоит в обеспечении соединений, которые пригодны для лечения и/или предупреждения рассеянного склероза, артрита, такого как остеоартрит и ревматоидный артрит, эмфиземы, псориаза, обструктивного заболевания легких и фиброза. Важной задачей настоящего изобретения является обеспечение химических соединений, которые способны модулировать, в особенности ингибировать активность или функцию металлопротеаз матрикса, особенно желатиназ и эластаз, у животных, в особенности у человека. Еще одной важной задачей настоящего изобретения является обеспечение химических соединений,которые способны модулировать, в особенности ингибировать активность или функцию ТАСЕ, у млекопитающих, в особенности у человека. Следующим объектом настоящего изобретения является обеспечение новой группы фармацевтических препаратов для лечения опосредованных заболеваний, выбранных из аутоиммунных расстройств и/или воспалительных расстройств, сердечно-сосудистых расстройств, нейродегенеративных расстройств, удара, рака и злокачественных образований, респираторных заболеваний, метаболических заболеваний, аллергических и дерматологических заболеваний, преждевременных родов, эндометриоза и фиброза. Следующим объектом настоящего изобретения является обеспечение способа получения химических соединений в соответствии с изобретением. И, наконец, объектом настоящего изобретения является обеспечение способа лечения и/или профилактики заболеваний, выбранных из аутоиммунных расстройств и/или воспалительных расстройств, сердечно-сосудистых расстройств, нейродегенеративных расстройств, удара, рака и злокачественных образований, респираторных заболеваний, метаболических заболеваний, аллергических и дерматологических заболеваний, преждевременных родов, эндометриоза и фиброза. В первом аспекте изобретение обеспечивает сульфонамидные производные формулы (I) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. Во втором аспекте изобретение обеспечивает соединение, соответствующее формуле (I), для применения в качестве лекарственного средства, в особенности для профилактики и/или лечения заболеваний, перечисленных ниже. В третьем аспекте изобретение обеспечивает применение соединения, соответствующего формуле(I), для получения фармацевтической композиции для лечения заболеваний, выбранных из аутоиммунных расстройств и/или воспалительных расстройств, сердечно-сосудистых расстройств, нейродегенеративных расстройств, удара, рака и злокачественных образований, респираторных заболеваний, метаболических заболеваний, аллергических и дерматологических заболеваний, преждевременных родов, эндометриоза и фиброза. В четвертом аспекте изобретение обеспечивает фармацевтическую композицию, содержащую по меньшей мере одно соединение, соответствующее формуле (I), и его фармацевтически приемлемый носитель, разбавитель или эксципиент. В пятом аспекте изобретение обеспечивает способ лечения, включающий введение соединения, соответствующего формуле (I), пациенту в целях его лечения. В шестом аспекте изобретение обеспечивает способ синтеза соединения, соответствующего формуле (I).-2 013907 В седьмом аспекте изобретение обеспечивает соединения, соответствующие формуле (II) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. В восьмом аспекте изобретение обеспечивает соединения, соответствующие формуле (III) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. В девятом аспекте изобретение обеспечивает соединения, соответствующие формуле (VI) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. В десятом аспекте изобретение обеспечивает соединения, соответствующие формуле (VIII) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. В одиннадцатом аспекте изобретение обеспечивает соединения, соответствующие формуле (IX) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании. Подробное описание изобретения Последующие разделы описания содержат определения различных химических фрагментов, составляющих соединения в соответствии с изобретением, применяемые единообразно по всему тексту описания и формулы изобретения, если иное четко данное определение не имеет более широкого значения. Термин "ММР" относится к "металлопротеазам матрикса". В качестве недавних обзоров см. Visse etTherapeutic Patents, 12(5): 665-707. Иллюстративными, но не ограничивающими примерами таких ММР являются следующие. Коллагеназы, обычно ассоциируемые с заболеваниями, связанными с нарушением основанной на коллагене ткани, такими как ревматоидный артрит и остеоартрит: ММР-1 (также известная как коллагеназа 1 или фибробластная коллагеназа), субстраты - коллаген I,коллаген II, коллаген III, желатин, протеогликаны. Полагают, что сверхэкспрессия этого фермента ассоциирована с эмфиземой, с гиперкератозом и атеросклерозом и, если сверхэкспрессируется в одиночку, с папиллярной карциномой; ММР-8 (также известная как коллагеназа 2 или нейтрофильная коллагеназа), субстраты - коллагенI, коллаген II, коллаген III, коллаген V, коллаген VII, коллаген IX, желатин, сверхэкспрессия которой может приводить к незаживляемым хроническим язвам;-3 013907 ММР-13 (также известная как коллагеназа 3), субстраты - коллаген I, коллаген II, коллаген III, коллаген IV, коллаген IX, коллаген X, коллаген XIV, фибронектин, желатин, недавно установлено, что сверхэкспрессируется в одиночку при карциноме молочной железы и вовлечена в ревматоидный артрит. Стромелизины. ММР-3 (также известная как стромелизин 1), субстраты - коллаген III, коллаген IV, коллаген V,коллаген IX, коллаген X, ларнинин, нидоген, полагают, что сверхэкспрессия вовлечена в атеросклероз,аневризму и рестеноз. Желатиназы - полагают, что способствуют раку, в частности инвазии и метастазированию: ММР-2 (также известная как желатиназа А, желатиназа 72 кДа, коллагеназа мембранной основы или протеогликаназа), субстраты - коллаген I, коллаген II, коллаген IV, коллаген V, коллаген VII, коллаген X, коллаген XI, коллаген XIV, эластин, фибронектин, желатин, нидоген. Полагают, что ассоциирована с ростом раковой опухоли за счет специфичности к коллагену типа IV(высокая экспрессия наблюдается в солидных опухолях и предположительно связана с их способностью к росту, инвазии, развитию новых кровеносных сосудов и метастазированию) и вовлечена в острое воспаление легких и респираторный дистресс-синдром (Krishna et al., 2004, Expert Opin. Invest. Drugs, 13(3): 255-267);MMP-9 (также известная как желатиназа В или желатиназа 92 кДа), субстраты - коллаген I, коллаген III, коллаген IV, коллаген V, коллаген VII, коллаген X, коллаген XIV, эластин, фибронектин, желатин, нидоген. Полагают, что указанный фермент ассоциирован с ростом раковой опухоли за счет специфичности к коллагену типа IV, высвобождается эозинофилами в ответ на экзогенные факторы, такие как загрязняющие вещества, аллергены и вирусы, вовлечен в воспалительный ответ при рассеянном склерозе(Opdenakker et al., 2003, The Lancet Neurology, 2, 747-756) и астме и вовлечен в острое воспаление легких,респираторный дистресс-синдром, хроническое обструктивное заболевание легких (COPD) и/или астму(Krishna et al., 2004, выше). Также считают, что ММР-9 вовлечена в удар (Horstmann et al., 2003, Stroke,34(9): 2165-70). Неклассифицированные ММР. ММР-12 (также известная как металлоэластаза, эластаза макрофагов человека или НМЕ),субстраты - фибронектин, ларнинин. Предполагают, что она играет роль в ингибировании роста раковой опухоли и регуляции воспаления, такого как рассеянный склероз (Vos et al., 2003, Journal of Neuroimmunology, 138, 106-114), и играет патологическую роль при эмфиземе, COPD (Belvisi et al., 2003, Inflamm. Res. 52: 95-100), при атеросклерозе, аневризме и рестенозе. Выражение "расстройство, ассоциированное с ММР" относится к расстройству, которое можно лечить в соответствии с изобретением и которое включает все расстройства, при которых следует снизить экспрессию и/или активность по меньшей мере одной ММР безотносительно к причине таких расстройств. Такие расстройства включают, например, расстройства, вызванные ненормальным разрушением внеклеточного матрикса (ЕСМ). Иллюстративными, но не ограничивающими примерами таких расстройств, ассоциированных с ММР, являются рак, такой как рак молочной железы и солидные опухоли; воспалительные расстройства, такие как, например, воспалительные заболевания кишечника и воспалительные заболевания нервной системы, такие как рассеянный склероз; легочные заболевания, такие как хроническое обструктивное заболевание легких (COPD), эмфизема, астма, острое поражение легкого и острый респираторный дистресс-синдром; стоматологические заболевания, такие как болезнь пародонта и гингивит; заболевания суставов и костей, такие как остеоартрит и ревматоидный артрит; заболевания печени, такие как фиброз печени, цирроз и хронические заболевания печени; фибротические заболевания, такие как фиброз легких, панкреатит, волчанка, гломерулосклероз,системный склероз, фиброз кожи, фиброз после радиационного облучения и фиброз мочевого пузыря; патологии сосудов, такие как аневризма аорты, атеросклероз, гипертензия, кардиомиопатия и инфаркт миокарда; рестеноз; офтальмологические расстройства, такие как диабетическая ретинопатия, синдром сухих глаз, дегенерация желтого пятна и изъязвление роговицы, и дегенеративные заболевания центральной нервной системы, такие как амиотрофический боковой склероз. Ингибиторы ТАСЕ в соответствии с изобретением полезны для лечения различных заболеваний,таких как воспалительные/аутоиммунные заболевания, включая, но без ограничения, ревматоидный артрит,остеоартрит, болезнь Крона и другие воспалительные заболевания кишечника и желудочно-кишечные воспалительные заболевания, системную красную волчанку;-4 013907 реперфузионные повреждения; синдромы системного воспалительного ответа, включая, но без ограничения, сепсис, ожоговые повреждения, панкреатит и респираторный дистресс-синдром у взрослых; аллергические и дерматологические заболевания, включая, но без ограничения, сверхчувствительность отсроченного типа, псориаз, астму, экзему, аллергический ринит и аллергический конъюнктивит; сердечно-сосудистые заболевания, включая, но без ограничения, гиперлипидемию, инфаркт миокарда, атеросклероз, артериосклероз и рестеноз; метаболические заболевания; неврологические заболевания, включая, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз, аневризму и удар; отторжение трансплантата; раковые и злокачественные заболевания, включая, но без ограничения, колоректальный рак и лейкемии; заболевания почек, включая, но без ограничения, нефротические синдромы и гломерулонефрит; инфекционные заболевания, включая, но без ограничения, ВИЧ-инфекцию и нейропатию. Примеры заболеваний, для лечения которых полезны ингибиторы ТАСЕ, приведены в публикацииWatson, 2002, выше. В контексте настоящего изобретения термины "вещество" или "вещества", "соединение" или "соединения" и "сульфонамидное производное" или "сульфонамидные производные" используются как имеющие практически одно и то же значение. Термин "C1-C6-алкил" относится к моновалентным алкильным группам, имеющим от 1 до 6 атомов углерода. Данный термин иллюстрируется группами, такими как метил, этил, н-пропил, изопропил,н-бутил, изобутил, трет-бутил, н-гексил и т.п. По аналогии термин "C1-C12-алкил" относится к моновалентным алкильным группам, имеющим от 1 до 12 атомов углерода, включающим группы "C1-C6-алкил" и группы гептил, октил, нонил, децил, ундецил и додецил; "C1-C10-алкил" относится к моновалентным алкильным группам, имеющим от 1 до 10 атомов углерода; "C1-C8-алкил" относится к моновалентным алкильным группам, имеющим от 1 до 8 атомов углерода и "C1-C5-алкил" относится к моновалентным алкильным группам, имеющим от 1 до 5 атомов углерода. Термин "гетероалкил" относится к C1-C12-алкилу, предпочтительно к C1-C6-алкилу, в котором по меньшей мере один атом углерода заменен на гетероатом, выбранный из О, N или S, включая 2-метоксиэтил. Термин "арил" относится к ненасыщенной ароматической карбоциклической группе, состоящей из от 6 до 14 атомов углерода, имеющей единственный цикл (например, фенил) или несколько конденсированных циклов (например, нафтил). Арил включает фенил, нафтил, фенантренил и т.п. Термин "C1-C6-алкиларил" относится к арильным группам, имеющим C1-C6-алкильный заместитель,включая метилфенил, этилфенил и т.п. Термин "арил-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим арильный заместитель, включая бензил и т.п. Термин "гетероарил" относится к моноциклическим гетероароматическим, или бициклическим, или трициклическим конденсированным гетероароматическим группам. Частные примеры гетероароматических групп включают необязательно замещенные пиридил, пирролил, пиримидинил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил,1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил,изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[2,3-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил, 1,2,3,4-тетрагидрохинолил, 1,2,3,4-тетрагидроизохинолил, пуринил, птеридинил, карбазолил,ксантенил или бензохинолил. Термин "C1-C6-алкилгетероарил" относится к гетероарильным группам, имеющим C1-C6-алкильный заместитель, включая метилфурил и т.п. Термин "гетероарил-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим гетероарильный заместитель, включая фурилметил и т.п. Термин "C2-C6-алкенил" относится к алкенильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющих по меньшей мере 1 или 2 алкенильных ненасыщенных участка. Предпочтительно алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и т.п. Термин "C2-C6-алкениларил" относится к арильным группам, имеющим C2-C6-алкенильный заместитель, включая винилфенил и т.п. Термин "арил-C2-C6-алкенил" относится к C2-C6-алкенильным группам, имеющим арильный заместитель, включая фенилвинил и т.п.C2-C6-алкенильный заместитель, включая винилпиридинил и т.п. Термин "гетероарил-C2-C6-алкенил" относится к C2-C6-алкенильным группам, имеющим гетероарильный заместитель, включая пиридинилвинил и т.п. Термин "C2-C6-алкинил" относится к алкинильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по меньшей мере 1 или 2 алкинильных ненасыщенных участка, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и т.п. Термин "C3-C8-циклоалкил" относится к насыщенным карбоциклическим группам, имеющим от 3 до 8 атомов углерода и имеющим единственный цикл (например, циклогексил) или несколько конденсированных циклов (например, норборнил). C3-C8-циклоалкил включает циклопентил, циклогексил, норборнил и т.п. Термин "гетероциклоалкил" относится к C3-C8-циклоалкильной группе, соответствующей вышеприведенному определению, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R определен как водород или метил. Гетероциклоалкил включает пирролидин, пиперидин, пиперазин, морфолин, тетрагидрофуран и т.п. Термин "C1-C6-алкилциклоалкил" относится к C3-C8-циклоалкильным группам, имеющим"гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил", "гетероциклоалкил-C1-C6-алкил". Термин "ацилокси-C1-C6-алкил" относится к -C1-C6-алкильным группам, имеющим заместитель ацилокси, включая этиловый эфир пропионовой кислоты и т.п. Термин "алкокси" относится к группе -O-R, где R включает "C1-C6-алкил", или "арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил". Предпочтительные алкоксигруппы включают, например, метокси, этокси, фенокси и т.п. Термин "алкокси-C1-C6-алкил" относится к алкоксигруппам, имеющим -C1-C6-алкильный заместитель, включая метокси, метоксиэтил и т.п. Термин "алкоксикарбонил" относится к группе -С(О)OR, где R включает "C1-C6-алкил", или "арил",или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1-C6-алкил", или "гетероалкил". Термин "алкоксикарбонил-C1-C6-алкил" относится к -C1-C5-алкильным группам, имеющим алкоксикарбонильный заместитель, включая 2-(бензилоксикарбонил)этил и т.п. Термин "аминокарбонил" относится к группе -C(O)NRR', где каждый R и R' включает независимо водород, или "C1-C6-алкил", или "арил", или "гетероарил", или "арил-C1-C6-алкил", или "гетероарил-C1C6-алкил", включая N-фенилформамид. Термин "аминокарбонил-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим аминокарбонильный заместитель, включая 2-(диметиламинокарбонил)этил, N-этилацетамид, N,N-диэтилацетамид и т.п. Термин "ациламино" относится к группе -NRC(O)R', где каждый R и R' включает независимо водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил", "арил","гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил", "гетероциклоалкил C1-C6-алкил". Термин "ациламино-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим заместитель ациламино, включая 2-(пропиониламино)этил и т.п.-6 013907 Термин "уреидо" относится к группе -NRC(О)NR'R, где каждый R, R' и R включает независимо водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил C1-C6-алкил", "гетероциклоалкил C1-C6-алкил" и где R' и R вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "уреидо-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим уреидный заместитель, включая 2-(N'-метилуреидо)этил и т.п. Термин "карбамат" относится к группе -NRC(O)OR', где каждый R и R' включает независимо водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил", "арил","гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил-C1-C6-алкил", "гетероциклоалкил C1-C6-алкил". Термин "амино" относится к группе -NRR', где каждый R и R' включает независимо водород, или"циклоалкил", или "гетероциклоалкил" и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "амино-C1-C6-алкил" относится к C1-C5-алкильным группам, имеющим заместитель амино,включая 2-(1-пирролидинил)этил и т.п. Термин "аммоний" относится к положительно заряженной группе -N+RR'R, где каждый R, R' и R включает независимо "C1-C6-алкил", или "C1-C6-алкиларил", или "C1-C6-алкилгетероарил", или "циклоалкил", или "гетероциклоалкил" и где R' и R вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "аммоний-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим аммонийный заместитель, включая 1-этилпирролидиний и т.п. Термин "галоген" относится к атомам фтора, хлора, брома и йода. Термин "сульфонилокси" относится к группе -OSO2-R, где R выбран из Н, "C1-C6-алкила", "C1-C6 алкила", замещенного галогенами, например группы -OSO2-CF3, "C2-C6-алкенила", "C2-C6-алкинила","C3-C8-циклоалкила", "гетероциклоалкила", "арила", "гетероарила", "арил-C1-C6-алкила" или-S-CF3, "C2-C6-алкенила","C2-C6-алкинила","C3-C8-циклоалкила", "гетероциклоалкила", "арила", "гетероарила", "арил-C1-C6-алкила" или "гетероарил-C1-C6-алкила", "арил-C2-C6-алкенила", "гетероарил-C2-C6-алкенила", "арил-C2-C6-алкинила", "гетероарил-C2-C6-алкинила", "циклоалкил-C1-C6-алкила", "гетероциклоалкил-C1-C6-алкила". Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и т.п. Термин "сульфанил-C1-C6-алкил" относится к C1-C5-алкильным группам, имеющим сульфанильный заместитель, включая 2-(этилсульфанил)этил и т.п. Термин "сульфониламино" относится к группе -NRSO2-R', где каждый R и R' включает независимо водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил C1-C6-алкил", "гетероциклоалкил C1-C6-алкил".-7 013907 Термин "сульфониламино C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим заместитель сульфониламино, включая 2-(этилсульфониламино)этил и т.п. Термин "аминосульфонил" относится к группе; -SO2-NRR', где каждый R и R' включает независимо водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "C3-C8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "арил-C1-C6-алкил" или "гетероарил-C1-C6-алкил", "арил-C2-C6-алкенил", "гетероарил-C2-C6-алкенил", "арил-C2-C6-алкинил", "гетероарил-C2-C6-алкинил", "циклоалкил C1-C6-алкил", "гетероциклоалкил C1-C6-алкил". Термин "аминосульфонил-C1-C6-алкил" относится к C1-C6-алкильным группам, имеющим заместитель аминосульфонил, включая 2-(циклогексиламиносульфонил)этил и т.п. Термин "замещенный или незамещенный": определенные выше группы, такие как "алкенил", "алкинил", "арил", "гетероарил", "циклоалкил", "гетероциклоалкил" и т.д., могут быть необязательно замещены заместителями в количестве от 1 до 5, выбранными из группы, состоящей из "C1-C6-алкила","C2-C6-алкенила", "C2-C6-алкинила", "циклоалкила", "гетероциклоалкила", "арил-C1-C6-алкила", "гетероарил-C1-C6-алкила", "циклоалкил-C1-C6-алкила", "гетероциклоалкил C1-C6-алкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила", "уреидо", "арила","карбамата", "гетероарила", "сульфинила", "сульфонила", "алкокси", "сульфанила", "галогена", "карбокси", тригалогенметила, циано, гидрокси, меркапто, нитро и т.п., если иное не ограничено определением индивидуального заместителя. Термин "фармацевтически приемлемые соли или комплексы" относится к солям и комплексам соединений формулы (I), указанных ниже. Примеры таких солей включают, но без ограничения, основноаддитивные соли, полученные в результате реакции соединений формулы (I) с органическими или неорганическими основаниями, такими как гидроксид, карбонат или бикарбонат катиона металла, такого как катион, выбранный из группы, состоящей из щелочных металлов (натрий, калий или литий), щелочноземельных металлов (например, кальций или магний), или с органическим первичным, вторичным или третичным алкиламином. Соли аминов, полученные из метиламина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, морфолина, N-Me-D-глюкамина, N,N'-бис-(фенилметил)-1,2 этандиамина, трометамина, этаноламина, диэтаноламина, этилендиамина, N-метилморфолина, прокаина,пиперидина, пиперазина и т.п., рассматриваются как входящие в объем настоящего изобретения. Также входящими в объем настоящего изобретения являются аддитивные соли, полученные с неорганическими кислотами (например, хлористо-водородной кислотой, бромисто-водородной кислотой,серной кислотой, фосфорной кислотой, азотной кислотой и т.п.), как и соли, полученные с органическими кислотами, такими как уксусная, щавелевая, винная, янтарная, яблочная, фумаровая, малеиновая, аскорбиновая, бензойная, дубильная, пальмовая, альгиновая, полиглутаминовая, нафталинсульфоновая,метансульфоновая, нафталиндисульфоновая и полигалактуроновая кислоты, как и соли, образованные с основными аминокислотами, такими как лизин или аргинин. Термин "фармацевтически активное производное" относится к любому соединению, которое при введении реципиенту способно прямо или косвенно проявлять раскрытую здесь активность. Термин"косвенно" также охватывает пролекарства, которые могут быть превращены в активную форму лекарства эндогенными ферментами или при метаболизме. Указанное пролекарство состоит из собственно активного соединения и химически маскирующей группы. Например, химически маскирующая группа для спиртовых соединений может быть выбрана из эфира карбоновой кислоты (например, ацетата, сложного эфира лизина) или эфиров фосфорной кислоты (например, моноэфира фосфорной кислоты). Термин "энантиомерный избыток (эи)" относится к продуктам, которые получены асимметрическим синтезом, т.е. синтезом, использующим нерацемические исходные вещества и/или реагенты, или синтезом, включающим по меньшей мере одну энантиоселективную стадию, в котором достигается избыток одного энантиомера порядка по меньшей мере 52% эи. Используемый здесь термин "интерферон", или "IFN", предназначен для указания любой молекулы,определенной в этом качестве в литературе, включая, например, любые типы IFN, указанные выше в разделе "Предпосылки изобретения". В частности, IFN-, IFN- и IFN- входят в указанное определение. В соответствии с настоящим изобретением предпочтителен IFN-; IFN-, подходящий в соответствии с настоящим изобретением, доступен для приобретения, например, как Rebif (Serono), Avonex (Biogen) или Betaferon (Schering). Используемый здесь термин "интерферон-бета" (IFN-бета или IFN-) предназначен для указания фибробластного интерферона, в особенности человеческого происхождения, полученного выделением из биологических жидкостей или полученного с помощью методик рекомбинантных ДНК из прокариотических или эукариотических клеток хозяина, как и его солей, функциональных производных, вариант, аналогов и активных фрагментов. Предпочтительно IFN-бета предназначен для указания рекомбинантного интерферона бета-1 а.IFN-, подходящий в соответствии с настоящим изобретением, доступен для приобретения, например, как Rebif (Serono), Avonex (Biogen) или Betaferon (Schering). Применение интерферонов человеческого происхождения также предпочтительно в соответствии с настоящим изобретением. Исполь-8 013907 зуемый здесь термин "интерферон" охватывает его соли, функциональные производные, варианты, аналоги и активные фрагменты.Rebif (рекомбинантный интерферон-) является последним достижением в интерферонной терапии рассеянного склероза (MS) и имеет существенное преимущество при лечении.Rebif представляет интерферон (IFN)-бета 1a, полученный из клеточных линий млекопитающих. Было установлено, что интерферон бета-1 а, вводимый подкожно три раза в неделю, эффективен при лечении возвратного перемежающегося рассеянного склероза (RRMS). Интерферон бета-1a может иметь положительный эффект при длительном течении MS, снижая число и тяжесть возвратных эпизодов и уменьшая нагрузку на организм и активность заболевания, что измеряют MRI. Дозировка IFN- при лечении возвратного перемежающегося MS в соответствии с изобретением зависит от типа применяемого IFN-. В соответствии с настоящим изобретением IFN, представляющий рекомбинантный IFN- 1b, полученный в Е.coli, доступный для приобретения под торговым наименованием Betaseron, можно предпочтительно вводить любому пациенту подкожно через день в дозировке около от 250 до 300 мкг, или от 8,0 до 9,6 MIU. В соответствии с настоящим изобретением IFN, представляющий рекомбинантный IFN- 1a, полученный в клетках яичников китайского хомяка (клетки СНО), доступный для приобретения под торговым наименованием Avonex, можно предпочтительно вводить любому пациенту внутримышечно раз в неделю в дозировке около от 30 до 33 мкг, или от 6, до 6,6 MIU. В соответствии с настоящим изобретением IFN, представляющий рекомбинантный IFN- 1a, полученный в клетках яичников китайского хомяка (клетки СНО), доступный для приобретения под торговым наименованием Rebif, можно предпочтительно вводить любому пациенту подкожно три раза в неделю (TIW) в дозировке около от 22 до 44 мкг, или от 6,0 до 12 MIU. Соединения в соответствии с настоящим изобретением также включают их фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями формулы (I) являются кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. Было обнаружено, что соединения настоящего изобретения являются модуляторами металлопротеаз матрикса, включая ММР-12. Когда металлопротеазный фермент матрикса ингибируют соединениями настоящего изобретения,ингибированные ММР становятся не способны проявлять их ферментативные, биологические и/или фармакологические эффекты. Настоящим было установлено, что соединения данного изобретения являются модуляторами активности или функции ТАСЕ. Поэтому соединения настоящего изобретения полезны для лечения и профилактики аутоиммунных расстройств и/или воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, удара, рака и злокачественных образований, респираторных заболеваний, метаболических заболеваний, аллергических и дерматологических заболеваний, преждевременных родов, эндометриоза и фиброза. В одном из воплощений изобретение обеспечивает производные формулы (I) где R1, R2, R3 и R4 независимо выбраны из Н; галогена; необязательно замещенного C1-C6-алкила; необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенного алкокси, включая метокси; необязательно замещенного арила; необязательно замещенного гетероарила; необязательно замещенного C3-C8-циклоалкила; необязательно замещенного гетероциклоалкила; необязательно замещенного сульфонила; необязательно замещенного аминосульфонила; необязательно замещенного сульфониламино; необязательно замещенного аминокарбонила; необязательно замещенного ациламино; необязательно замещенного амино и необязательно замещенного гидрокси;R5, R6, R7, R8, R9 и R10 независимо выбраны из Н; необязательно замещенного C1-C6-алкила; необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенного C3-C8-циклоалкила; необязательно замещенного гетероциклоалкила; необязательно замещенного арила и необязательно замещенного гетероарила;R11 и R12 независимо выбраны из Н; необязательно замещенного C1-C6-алкила; необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенногоC3-C8-циклоалкила; необязательно замещенного гетероциклоалкила; необязательно замещенного арила и необязательно замещенного гетероарила или R11 и R12, взятые вместе, образуют необязательно замещенный C3-C8 циклоалкил или необязательно замещенный гетероциклоалкил;C3-C8-циклоалкила; необязательно замещенного гетероциклоалкила; необязательно замещенного арила и необязательно замещенного гетероарила или R11 (или R12) и R13, взятые вместе, образуют необязательно замещенный C3-C8-циклоалкил или необязательно замещенный гетероциклоалкил;C3-C6-циклоалкила, включая циклопропил (например, 1-циклопропил); необязательно замещенного гетероциклоалкила, включая необязательно замещенный диоксолан (например, 2,2-диметил-1,3-диоксолан-4 ил); необязательно замещенного арила; необязательно замещенного гетероарила, включая необязательно замещенный тиенил (например, 2-тиенил, 3-тиенил), необязательно замещенный пиримидинил (например, пиримидин-5-ил), необязательно замещенный пиридинил (например, пиридин-3-ил,6-метоксипиридин-3-ил); необязательно замещенного арил-C1-C6-алкила, включая необязательно замещенный фенил-C1-C6-алкил, такой как фенилэтил (например, 2-фенилэтил); необязательно замещенного гетероарил-C1-C6-алкила; необязательно замещенного C3-C8-циклоалкил-C1-C6-алкила и необязательно замещенного гетероциклоалкил-C1-C6-алкила, включая необязательно замещенный морфолин-C1-C6 алкил, такой как морфолинпропил (например, 2-морфолино-2-пропил); или R13 и R14, взятые вместе, образуют необязательно замещенный C3-C8-циклоалкил или необязательно замещенный гетероциклоалкил;n представляет целое число, выбранное из 0 или 1; а также их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, таутомеры, рацемические формы, равно как их фармацевтически приемлемые соли. В первом предпочтительном воплощении изобретение обеспечивает производные формулы (I), гдеR1, R4, R5, R6, R7, R8, R9, R10, R11 и R12 представляют водород, R13 и R14 имеют значения, приведенные ниже. В данном предпочтительном воплощении соединения определены следующей формулой (Ia): где R2 и R3 независимо выбраны из водорода,галогена,линейного или разветвленного C1-C6-алкила, необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленногоC1-C6-алкилокси, фенокси,линейного или разветвленного C1-C6-алкилокси,фенила, необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-C6-алкила,фенил-линейного или разветвленного C1-C6-алкила, указанный фенил необязательно замещен одним или более заместителей, выбранных из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-C6-алкила,3-6-членной гетероциклической группы, имеющей, по меньшей мере, гетероатом, выбранный из группы, состоящей из кислорода, азота и серы;R13 выбран из Н, линейного или разветвленного C1-C6-алкила;R14 выбран из линейного или разветвленного C1-C8-алкила, необязательно замещенного одним или более атомами галогена и/или гидроксигрупп, указанный C1-C8-алкил в алкильной цепи необязательно содержит одну или более ненасыщенных связей С-С или содержит один или более атомов кислорода или серы,C3-C8-циклоалкила, необязательно замещенного карбокси или линейной или разветвленнойC1-C4-алкоксикарбонильной группой,фенила,фенил-линейного или разветвленного C1-C6-алкила, указанный C1-C6-алкил необязательно содержит один атом кислорода,гетероциклической или гетероциклоалкильной группы, выбранной из группы, состоящей из- 10013907 1,3-диоксолана, 2,2-диметил-1,3-диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, указанный пиридин необязательно замещен гидрокси или C1-C6-алкоксигруппой; пиридинил-линейного или разветвленного C1-C4-алкила; пиперидина, указанный пиперидин необязательно замещен фенил-C1-C4-алкилом; фурана, тетрагидрофурана; 2-тетрагидрофуран-2-ил-этила, пирролидин N-карбоновой кислоты, C1-C4-линейного или разветвленного N-алкоксикарбонилпирролидин-2-ила; тетрагидропирана илиn представляет целое число, выбранное из 0 или 1; а также их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, таутомеры, рацемические формы, равно как их фармацевтически приемлемые соли. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR1, R2, R3 и R4 независимо выбраны из Н и необязательно замещенного алкокси, включая метокси. В следующем предпочтительном воплощении изобретение обеспечивает соединения формулы (I),где R1 и R4 представляют Н; R2 и R3 независимо выбразы из Н и необязательно замещенного алкокси,включая метокси. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR5, R6, R7, R8, R9 и R10 представляют Н. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR11 и R12 представляют Н. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR13 представляет Н. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR1, R4, R5, R6, R7, R8, R9, R10, R11, R12 и R13 представляют Н; R2 и R4 независимо выбраны из Н и необязательно замещенного алкокси, включая метокси; R14 и n определены в описании. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR14 выбран из необязательно замещенного C1-C6-алкила; необязательно замещенного C2-C6-алкенила; необязательно замещенного C2-C6-алкинила; необязательно замещенного C3-C6-циклоалкила; необязательно замещенного гетероциклоалкила; необязательно замещенного арил-C1-C6-алкила; необязательно замещенного гетероарил-C1-C6-алкила; необязательно замещенного C3-C6-циклоалкил-C1-C6-алкила и необязательно замещенного гетероциклоалкил-C1-C6-алкила. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), гдеR14 выбран из необязательно замещенного арила и необязательно замещенного гетероарила. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), где n равно 0. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (I), где n равно 1. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR2 и R3 выбраны независимо из Н и алкокси. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 представляет Н. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 представляет Н; R2 выбран из Н и алкокси; R14 и n определены так же, как и в первом предпочтительном воплощении. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR14 выбран из фенила и гетероциклической или гетероциклоалкильной группы, выбранной из группы,состоящей из 1,3-диоксолана, 2,2-диметил-1,3-диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, указанный пиридин необязательно замещен гидрокси или C1-C6-алкоксигруппой; пиридинил-линейного или разветвленного C1-C4-алкила; пиперидина, указанный пиперидин необязательно замещен фенил-C1-C4-алкилом; фурана, тетрагидрофурана; 2-тетрагидрофуран-2-ил-этила, пирролидин N-карбоновой кислоты, C1-C4-линейного или разветвленного N-алкоксикарбонилпирролидин-2 ила; тетрагидропирана. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 выбран из Н, линейного или разветвленного C1-C6-алкила, a R14 представляет линейный или разветвленный C1-C6-алкил, необязательно замещенный одним или несколькими атомами галогена и/или гидроксигруппами, указанный C1-C8-алкил необязательно содержит в алкильной цепи одну или более ненасыщенных связей С-С или содержит один или более атомов кислорода или серы. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 выбран из Н, линейного или разветвленного C1-C6-алкила, a R14 представляет C3-C8-циклоалкил, необязательно замещенный карбоксильной или линейной или разветвленной C1-C4-алкоксикарбонильной группой.- 11013907 В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 выбран из Н, линейного или разветвленного C1-C6-алкила, a R14 представляет фенил или фениллинейный или разветвленный C1-C8-алкил, указанный алкил необязательно содержит один атом кислорода. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 выбран из Н, линейного или разветвленного C1-C6-алкила, a R14 представляет гетероциклическую или гетероциклоалкильную группу, выбранную из группы, состоящей из 1,3-диоксолана, 2,2-диметил-1,3 диоксолана, тиофена, 1-метил-1-морфолин-4-илэтила, пиримидина, пиридина, указанный пиридин необязательно замещен гидрокси или C1-C6-алкоксигруппой; пиридинил-линейного или разветвленногоC1-C4-алкила; пиперидина, указанный пиперидин необязательно замещен фенил-C1-C4-алкилом; фурана,тетрагидрофурана; 2-тетрагидрофуран-2-ил-этила, пирролидин N-карбоновой кислоты, C1-C4-линейного или разветвленного N-алкоксикарбонилпирролидин-2-ила; тетрагидропирана. В другом предпочтительном воплощении изобретение обеспечивает соединения формулы (Ia), гдеR13 и R14, взятые вместе, образуют циклопентильную группу. В предпочтительных воплощениях галоген предпочтительно является фтором, хлором или бромом; линейный или разветвленный C1-C8-алкил, предпочтительно С 7-алкил, более предпочтительно С 8-алкил, необязательно замещенный одним или более атомами галогена и/или гидроксигруппами, линейным или разветвленным C1-C6-алкокси, фенокси, указанный C1-C8-алкил необязательно содержит в алкильной цепи одну или более ненасыщенных связей С-С или содержит один или более атомов кислорода или серы и предпочтительно является метилом, этилом, изопропилом, втор-бутилом, трет-бутилом,втор-пентилом, трифторметилом, 3,3,3-трифторпропилом, 2-метил-гепт-4-ин-2-илом, 1,1-диметилгексилом, 2-гидроксиэтилом; линейный или разветвленный C1-C6-алкокси предпочтительно является метокси, пропокси, изопропокси; фенил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-C6-алкила, предпочтительно является 4-фторфенилом, 3-гидроксифенилом; фенил-линейный или разветвленный C1-C6-алкил, где указанный фенил необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидрокси, линейного или разветвленного C1-C6-алкила, и где указанный C1-C6-алкил необязательно содержит один атом кислорода, предпочтительно является 2-фенилэтилом, 2-фенил-1,1-диметилэтилом, бензилоксиметилом; 3-6-членная гетероциклическая группа, имеющая, по меньшей мере, гетероатом, выбранный из группы, состоящей из кислорода, азота и серы, предпочтительно представляет 1,3-диоксолан,2,2-диметил-1,3-диоксолан, тиофен-2-ил, тиофен-3-ил, 1-метил-1-морфолино-4-илэтил, пиримидин-5-ил,3-пиридил, 2-метокси-5-пиридил, 2-пиридин-3-ил-этил, N-бензил-пиперидин-4-ил, 3-фурил, тетрагидрофуран-2-ил, 2-тетрагидрофуран-2-илэтил, N-трет-бутоксикарбонилпирролидин-2-ил, 4-тетрагидропиранил;C3-C8-циклоалкил, необязательно замещенный карбокси или линейной или разветвленнойC1-C4-алкоксикарбонильной группой, предпочтительно является циклопентилом, циклопропилом, метоксикарбонилциклопропилом. В наиболее предпочтительном воплощении настоящее изобретение обеспечивает соединения формулы (Ia), где R14 представляет 2,2-диметил-1,3-диоксолан, еще более предпочтительно R13 представляет водород, еще более предпочтительно R2 и R3 представляют метокси. Типичным соединением являетсяN-2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-диоксолан-4 ил]этил-N-гидроксиформамид. Соединения настоящего изобретения включают в особенности соединения, выбранные из следующей группы:N-(1-[(7-хлор-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]метил-3-пиридин-3-илпропил)-Nгидроксиформамид. В другом воплощении изобретения предлагаются сульфонамидные производные, соответствующие формуле (I), для применения в качестве лекарственного средства. В другом воплощении изобретения предлагается фармацевтическая композиция, включающая по меньшей мере одно сульфонамидное производное в соответствии с изобретением и его фармацевтически приемлемый носитель, разбавитель или эксципиент. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для изготовления лекарственного средства для профилактики и/или лечения расстройства, выбранного из аутоиммунных расстройств, воспалительных заболеваний, удара, сердечнососудистых заболеваний, нейродегенеративных заболеваний, рака и злокачественных образований, метаболических заболеваний, аллергических и дерматологических заболеваний, респираторных заболеваний и фиброза, включая рассеянный склероз, воспалительные заболевания кишечника, артрит, псориаз, астму, эмфизему, преждевременные роды, эндометриоз, хроническое обструктивное заболевание легких,заболевания печени и легких, фиброз поджелудочной железы, фиброз кожи и фиброз печени. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для изготовления лекарственного средства для профилактики и/или лечения расстройства, выбранного из воспалительных заболеваний кишечника, рассеянного склероза, остеоартрита и ревматоидного артрита. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для изготовления лекарственного средства для профилактики и/или лечения расстройства, выбранного из астмы, эмфиземы и хронического обструктивного заболевания легких. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для изготовления лекарственного средства для профилактики и/или лечения расстройства, выбранного из фиброза легких, кожи и печени. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для изготовления лекарственного средства для профилактики и/или лечения расстройства, которым является рак или злокачественные образования. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для модулирования, в особенности, для ингибирования активности металлопротеазы матрикса. В особенности, предлагается применение в соответствии с изобретением, где указанная металлопротеаза матрикса представляет ММР-12. В другом воплощении изобретения соединения в соответствии с изобретением являются селективными ингибиторами металлопротеаз, выбранных из ММР-2, ММР-9 и/или ММР-12 по сравнению с ММР-1. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для модулирования, в особенности, для ингибирования активности ТАСЕ. Предпочительно соединения в соответствии с изобретением являются селективными ингибиторами- 15013907 ТАСЕ по сравнению с ММР-1. В другом воплощении изобретения предлагается применение сульфонамидных производных, соответствующих формуле (I), для модулирования металлопротеаз или ТАСЕ в условиях in vitro. В другом воплощении изобретения предлагается способ лечения и/или профилактики заболевания,включающий введение соединения, соответствующего формуле (I), пациенту в целях лечения, где заболевание выбрано из аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, удара, аллергических и дерматологических заболеваний,метаболических заболеваний, рака и злокачественных образований, респираторных заболеваний и фиброза, включая рассеянный склероз, артрит, ревматоидный артрит, остеоартрит, астму, эмфизему, преждевременные роды, эндометриоз, хроническое обструктивное заболевание легких (COPD), псориаз, фиброз печени, кожи и легких. В другом воплощении изобретение обеспечивает способ получения сульфонамидного производного, соответствующего формуле (I), включающий стадию взаимодействия соединения формулы (II) с формилирующим агентом формулы (FA)-OPfp. В другом воплощении изобретение обеспечивает способ получения сульфонамидного производного, соответствующего формуле (I), включающий стадию образования соединения формулы (II). Примеры предпочтительного пути образования соединения формулы (II) описаны в примерах, приводимых далее. В другом воплощении изобретение обеспечивает способ получения сульфонамидного производного, соответствующего формуле (I), включающий стадию образования соединения формулы (II), где соединение формулы (II) получают по реакции соединения формулы (III) с гидроксиламином где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в описании. В другом воплощении изобретение обеспечивает соединение, соответствующее формуле (II): где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в описании. В следующем воплощении изобретение обеспечивает соединение, соответствующее формуле (II),выбранное из следующей группы: 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-4-фенилбутан-2-амин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]-Nгидроксиэтанамин; 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидроксигептан-2-амин; 1-циклопропил-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидроксиэтанамин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-1-(2-тиенил)этанамин; 1-(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)-N-гидрокси-4-фенилбутан-2-амин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-(3-тиенил)этанамин; 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-3-метил-3-морфолин-4-илбутан-2 амин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-1-пиримидин-2-илэтанамин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-1-пиридин-3-илэтанамин;- 16013907 1-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-N-гидрокси-4-фенилбутан-2-амин; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-N-гидрокси-1-(6-метоксипиридин-3-ил)этанамин; 2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-диоксолан 4-ил]-N-гидроксиэтанамин. В другом воплощении изобретение обеспечивает соединение, соответствующее формуле (III)(III),не является 1,2,3,4-тетрагидро-2-[(2 фенилэтенил)сульфонил]-изохинолином. В следующем воплощении изобретение обеспечивает соединение, соответствующее формуле (III),выбранное из следующей группы: 2-[4-фенилбут-1-ен-1-ил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-(2-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]винилсульфонил)-1,2,3,4-тетрагидроизохинолин; 2-[гепт-1-ен-1-илсульфонил]-1,2,3,4-тетрагидроизохинолин; 2-[2-циклопропилвинил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[2-(2-тиенил)винил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[4-фенилбут-1-ен-1-ил]сульфонилизоиндолин; 2-[2-(3-тиенил)винил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[3-метил-3-морфолин-4-илбут-1-ен-1-ил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[2-пиримидин-2-илвинил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[2-пиридин-3-илвинил]сульфонил-1,2,3,4-тетрагидроизохинолин; 6,7-диметокси-2-[4-фенилбут-1-ен-1-ил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-[2-(6-метоксипиридин-3-ил)винил]сульфонил-1,2,3,4-тетрагидроизохинолин; 2-(2-[(4S)-2,2-диметил-1,3-диоксолан-4-ил]винилсульфонил)-6,7-диметокси-1,2,3,4 тетрагидроизохинолин. В другом воплощении изобретение обеспечивает соединение, соответствующее формуле (VI) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании при условии, что соединение, соответствующее формуле (VI), не является 2,3-дигидро-2-[(2 гидроксиэтил)сульфонил]-1,1,3,3-тетрамитил-1 Н-изоиндолом. В следующем воплощении изобретение обеспечивает соединение, соответствующее формуле (VI),выбранное из следующей группы: 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)гептан-2-ол; 1-циклопропил-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)этанол; 1-(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)-4-фенилбутан-2-ол; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-(6-метоксипиридин-3-ил)этанол; 2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4R)-2,2-диметил-1,3-диоксолан 4-ил)]этанол. В другом воплощении изобретение обеспечивает соединение, соответствующее формуле (VIII) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены в подробном описании при условии, что соединение, соответствующее формуле (VIII), не является ни 2-2-(4-фторфенил)-2 оксоэтил]сульфонил]-2,3-дигидро-1 Н-изоиндолом, ни 1,2,3,4-тетрагидро-2-[(2-оксо-2-фенилэтил)сульфо- 17013907 ил]изохинолином. В следующем воплощении изобретение обеспечивает соединение, соответствующее формуле (VIII),выбранное из следующей группы: 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)гептан-2-он; 1-циклопропил-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)этанон; 1-(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)-4-фенилбутан-2-он; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-(6-метоксипиридин-3-ил)этанон; 2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4R)-2,2-диметил-1,3-диоксолан 4-ил)]этанон. В другом воплощении изобретение обеспечивает соединение, соответствующее формуле (IX) где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, Ru, R12, R13, R14 и n определены в подробном описании. В следующем воплощении изобретение обеспечивает соединение, соответствующее формуле (IX),выбранное из следующей группы: 1-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)гептан-2-оноксим; 1-циклопропил-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)этаноноксим; 1-(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)-4-фенилбутан-2-оноксим; 2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-(6-метоксипиридин-3-ил)этаноноксим; 2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4S)-2,2-диметил-1,3-дисксолан 4-ил)]этаноноксим. Названия соединениям изобретения были даны в соответствии со стандартами, используемыми программой "ACD/Name" производства Advanced Chemistry Development Inc. из пакета ACD/Labs (версия 7.00). Соединения формулы (I) полезны для лечения и/или профилактики аутоиммунных расстройств,воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний,удара, рака и злокачественных образований, аллергических и дерматологических заболеваний, метаболических заболеваний, респираторных заболеваний, преждевременных родов, эндометриоза и фиброза,включая рассеянный склероз, артрит, ревматоидный артрит, остеоартрит, эмфизему, хроническое обструктивное заболевание легких, псориаз, фиброз печени и легких. В другом воплощении соединения изобретения могут быть использованы при лечении аутоиммунных заболеваний, в особенности, демиелирующих заболеваний, таких как рассеянный склероз, в отдельности, или в комбинации с совместно действующим средством, полезным для лечения аутоиммунных заболеваний, где совместно действующее средство выбирают, например, из следующих соединений:(a) интерферонов, например пегилированных или непегилированных интерферонов, например, вводимых подкожным, внутримышечным или оральным путями, предпочтительно интерферона бета;(e) ингибиторов экспрессии VCAM-1 или антагонистов его лигандов, например антагонистов интегрина 4/1 VLA-4 и/или -47 интегринов, например натализумаба (ANTEGRENO). Другие совместно действующие средства, такие как противовоспалительные средства (в особенности при демиелирующих заболеваниях, таких как рассеянный склероз), описаны ниже: другим противовоспалительным средством является терифлуномид, раскрытый в WO 02080897 еще одним противовоспалительным средством является финголимод, который описан в ЕР 627406,WO 2004/028521 и WO 2004/089341 еще одним противовоспалительным средством является лаквинимод, который описан в еще одним противовоспалительным средством является тенсиролимус, который описан в следующим противовоспалительным средством является ксалипроден, который описан в следующим противовоспалительным средством является дескар пирфенидон, который описан в следующим противовоспалительным средством является бензотиазольное производное, изображенное ниже, которое описано в WO 01/47920 следующим противовоспалительным средством является производное гидроксамовой кислоты, изображенное ниже, которое описано в WO 03070711 следующим противовоспалительным средством является CDP323, который описан в WO 9967230 следующим противовоспалительным средством является симвастатин, который описан в следующим противовоспалительным средством является фампридин, который описан в US 5540938 Соединения в соответствии с настоящим изобретением также включают их таутомеры, их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, и их рацемические формы, так же как и их фармацевтически приемлемые соли. Производные, приведенные в качестве примеров в данном изобретении, могут быть получены из легкодоступных исходных веществ с использованием следующих общих способов и методик. Следует особо отметить, что в том случае, когда приведены типичные или предпочтительные условия эксперимента (т.е. температуры реакций, время, моли реагентов, растворители и др.), также могут быть использованы другие условия эксперимента, если не указано обратное. Оптимальные условия реакции могут изменяться в зависимости от конкретных используемых реагентов и условий, однако такие условия могут быть определены специалистом в данной области с применением рутинных методик оптимизации. При фармацевтическом применении соединения настоящего изобретения обычно вводят в форме фармацевтической композиции. Следовательно, фармацевтические композиции, включающие соединение изобретения и фармацевтически приемлемый носитель, разбавитель или эксципиент, также входят в объем настоящего изобретения. Специалист в данной области имеет представление о полном наборе таких носителей, разбавителей или эксципиентов, подходящих для составления фармацевтической композиции. Соединения изобретения вместе с адъювантом, носителем, разбавителем или эксципиентом, используемыми обычным образом, могут быть представлены в виде фармацевтических композиций и их единичных дозированных форм, и в таких формах могут применяться как твердые препараты, такие как таблетки или заполненные капсулы, так и жидкие препараты, такие как растворы, суспензии, эмульсии,эликсиры, или заполненные ими капсулы, - все для орального введения, или в форме стерильных инъекционных растворов для парентерального (включая подкожное) введения. Такие фармацевтические композиции и их единичные дозированные формы могут включать ингредиенты в обычных соотношениях, с добавлением или без добавления дополнительных активных соединений или действующих начал, и такие единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, согласующееся с диапазоном суточной дозировки, который намереваются использовать. Фармацевтические композиции, содержащие соединения данного изобретения, могут быть получены способами, хорошо известными в области фармации, и содержать по меньшей мере одно активное соединение. Обычно соединения данного изобретения вводят в фармацевтически эффективном количестве. Количество вводимого соединения обычно может быть определено практикующим врачом с учетом влияющих обстоятельств, включая подлежащее лечению состояние, выбранный путь введения, вводимое- 20013907 соединение, возраст, массу, ответную реакцию данного пациента на лечение, тяжесть симптомов у пациента и т.п. Фармацевтические композиции настоящего изобретения могут быть введены различными путями,включая оральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный и интраназальный. Композиции для орального введения могут иметь форму значительного объема жидких растворов, или суспензий, или порошков. Однако чаще композиции представлены в виде единичных дозированных форм для облегчения точного дозирования. Термин "единичные дозированные формы" относится к физически дискретным единицам, подходящим в качестве единичной дозы для человека и других млекопитающих, каждая единица содержит заранее определенное количество активного вещества, вычисленное в расчете на достижение желаемого терапевтического эффекта, в комбинации с подходящим фармацевтическим эксципиентом. Обычно единичные дозированные формы жидких композиций включают ампулы или шприцы, предварительно заполненные предварительно отмеренным количеством, или пилюли, таблетки, капсулы и т.п. в случае твердых композиций. В таких композициях производные изобретения обычно являются минорными компонентами (от примерно 0,1 до примерно 50 мас.% или предпочтительно от примерно 1 до примерно 40 мас.%), остаток составляют различные носители и вспомогательные вещества, облегчающие приготовление желаемой дозированной формы. Жидкие формы для орального введения могут включать подходящие водные или неводные носители с буферными, суспендирующими или диспергирующими агентами, красящими и вкусовыми веществами и т.п. Твердые формы могут включать, например, любые из перечисленных ниже ингредиентов или соединений близкой природы: связующее, такое как микрокристаллическая целлюлоза, трагакант или желанин; эксципиент, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; смазывающий агент, такой как стеарат магния; агент,улучшающий скольжение, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или вкусовой агент, такой как перечная мята, метилсалицилат или апельсиновый вкусовой агент. Инъекционные композиции обычно основаны на стерильных солевых или фосфатно-забуференных солевых носителях или других носителях, известных в данной области. Как указано выше, сульфонамидные производные формулы (I) в таких композициях обычно являются минорными компонентами, часто составляющими от 0,05 до 10 мас.%, остаток составляет инъекционный носитель и т.п. Описанные выше компоненты для орально вводимых или инъецируемых композиций являются только некоторыми представителями. Другие вещества, как и методики приготовления и т.п., приведены в части 5 монографии Remington's Pharmaceutical Sciences, 20th Edition, 2000, Marck Publishing Company,Easton, Pennsylvania, которая включена в описание в виде ссылки. Соединения данного изобретения также можно вводить в виде форм с продолжительным высвобождением или с помощью систем доставки лекарств с продолжительным высвобождением. Описание типичных материалов с продолжительным высвобождением можно найти во включенной в описание монографии Remington's Pharmaceutical Sciences. Синтез соединений изобретения. Новые производные, соответствующие формуле (I), могут быть получены из легкодоступных исходных веществ с помощью некоторых синтетических подходов, использующих как жидкофазные, так и твердофазные химические методики. Примеры синтетических путей будут описаны ниже. Принятые сокращения. М - молярный,Ас - ацетил,ACN - ацетонитрил,Bu - бутил,сНех - циклогексан,DCM - дихлорметан,DIEA - диизопропилэтиламин,DMF - диметилформамид,DMSO - диметилсульфоксид,ESI - ионизация электрораспылением,Et - этил,HPLC - высокоэффективная жидкостная хроматография,iPr - изопропил,LC - жидкостная хроматография,LDA - диизопропиламид лития,LiHMDS - бис-(триметилсилил)амид лития,Me - метил,MS - масс-спектрометрия,МТВЕ - метил-трет-бутиловый эфир,ЯМР - ядерный магнитный резонанс,- 21013907Piv - пивалил,Pfp - пентафторфенил,RT - комнатная температура,Rt - время удерживания,TEA - триэтиламин,THF - тетрагидрофуран,TLC - тонкослойная хроматография,UV - ультрафиолетовый. Синтетические подходы. Обычно соединения формулы (I) могут быть получены формилированием соединений формулы (II),где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены выше (схема 1). Обычные методики такого формилирования приведены ниже в примерах. Применение формилирующих агентов (FA) хорошо известно специалисту в данной области, LG1 представляет уходящую группу, такую как -ОН, -ОАс, -OPiv, -OCH2CN, -OCH2CF3, -OPh и -OPfp. Например, формилирующий агент может быть получен по реакции между муравьиной кислотой и уксусным ангидридом. Схема 1 Предпочтительный синтетический путь для получения соединения формулы (II) состоит в реакции гидроксиламина с соединением формулы (III), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14 и n определены выше, в подходящем растворителе, таком как THF, при температуре от 0 до 100 С (схема 2). Когда R12 представляет атом водорода, соединение формулы (III) может быть получено по реакции между карбонильным производным формулы (V) и сульфонамидом формулы (IV), где R1, R2, R3, R4, R5, R6,R7, R8, R9, R10, R11, R13, R14 и n определены выше. Предпочтительные условия включают депротонирование сульфонамида формулы (IV) основанием,таким как LiHMDS, LDA или BuLi, с последующим взаимодействием с хлорфосфатом, таким как диэтилхлорфосфат, и карбонильным соединением формулы (V), таким как 3-фенилпропионовый альдегид,в подходящем растворителе, таком как THF. Схема 2 Альтернативные пути получения соединения формулы (II) описаны на схеме 3. Первый альтернативный путь состоит в образовании спирта формулы (VI) по реакции между карбонильным соединением формулы (V) и сульфонамидом формулы (IV), где R1, R2, R3, R4, R5, R6, R7, R8,R9, R10, R11, R12, R13, R14 и n определены выше, в присутствии основания, такого как LiHMDS, в подходящем растворителе, таком как THF. Затем спирт формулы (VI) может быть превращен в соединение формулы (III), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R13, R14 и n определены выше, a R12 представляет атом водорода, реакцией отщепления в присутствии или в отсутствие такого реагента, как MsCl, TsCl или Tf2O с добавлением или без добавления такого основания, как Et3N, DIEA. Затем соединение формулы (III) может быть превращено в соединение формулы (II), как указано выше. Как альтернативный путь спирт формулы (VI) может быть превращен в соединение формулы (II),где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены выше, превращая гидроксильный фрагмент в уходящую группу, такую как мезильный или тозильный фрагмент, с последующим замещением гидроксиламином в подходящем растворителе, таком как THF. Альтернативный путь получения соединений формулы (II) может начинаться с реакции сульфонамида формулы (IV), предварительно депротонированного, как описано выше, со сложным эфиром формулы (VII), где R представляет C1-C6-алкил или C3-C8-циклоалкил или бензил, a R14 определен выше, что приводит к кетону формулы (VIII), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R14 и n определены выше (схема 3). Затем кетон формулы (VIII) может быть превращен в оксим формулы (IX), где R1, R2, R3,R4, R5, R6, R7, R8, R9, R10, R11, R12, R14 и n определены выше, по реакции с гидроксиламином. Предыдущий оксим формулы (IX) может быть превращен в соединение формулы (II) с использованием подходящего- 22013907 восстанавливающего агента. Альтернативно, кетон формулы (VIII) может быть превращен в спирт формулы (VI), где R1, R2, R3,4 5R , R , R6, R7, R8, R9, R10, R11, R12, R13, R14 и n определены выше, с использованием подходящего восстанавливающего агента, который может быть превращен в соединение формулы (II), как описано выше. Схема 3 Промежуточные соединения формулы (IV) получают по реакции соединения формулы (X), где R1,R , R , R4, R5, R6, R7, R8, R9, R10 и n определены выше, с сульфонилхлоридом формулы (XI), где R11 и R12 определены выше, в условиях, хорошо известных специалисту в данной области (схема 4). Альтернативный путь получения соединений формулы (IV) может начинаться с реакции между аминами формулы(XII), где R1, R2, R3, R4, R5, R6, R7, R8 и n определены выше, с сульфонилхлоридными производными формулы (XI), определенными выше, с образованием сульфонамидных производных формулы (XIII), гдеR1, R2, R3, R4, R5, R6, R7, R8, R11, R12 и n определены выше. Затем сульфонамидные производные формулы(XIII) могут быть циклизованы в присутствии карбонильных производных формулы (XIV) (или предшественников карбонильных производных, таких как ацеталь), в присутствии кислоты, такой как кислоты Льюиса, с образованием соединений формулы (IV), где R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 R11, R12 и n определены выше (Shin et al., Tetrahedron Lett. 2001, 42, 6251-6253). Схема 4 2- 23013907 Промежуточные соединения формул (V), (VII), (X), (XI) и (XII) доступны для приобретения или могут быть получены в условиях, хорошо известных специалисту в данной области. Например, промежуточное соединение формулы (X) может быть получено, следуя методикам, описанным Cho et al., 2005,Bioorg. Med. Chem. Lett., 185-189 или Bailey et al., 1973, J. Med. Chem., 151-156. В соответствии с другим общим способом соединения формулы (I) можно превратить в альтернативные соединения формулы (I), используя подходящие методики взаимных превращений, хорошо известные специалисту в данной области. Альтернативно, любые соединения формул (II)-(IV), (VI), (VIII) и(IX) могут быть превращены в альтернативные соединения формул (II)-(IV), (VI), (VIII) и (IX) соответственно, используя подходящие методики взаимных превращений, хорошо известные специалисту в данной области. Соединения формулы (I) могут быть получены, выделяя или не выделяя промежуточные соединения формул (II)-(IV), (VI), (VIII) и (IX). Предпочтительный синтетический способ получения соединений формулы (I) исходит из соединений формулы (IV), что имеет преимущество, поскольку синтез соединений формулы (I) может быть проведен без выделения промежуточных соединений, как показано на примерах ниже (схема 2). Соединения формулы (I) и их предшественники формул (II) и (VI) содержат по меньшей мере один хиральный центр, и все индивидуальные оптически активные формы и их комбинации раскрыты как отдельные частные воплощения изобретения, равно как и их соответствующие рацематы. Способы, представленные выше на схемах, в особенности на схемах 1 и 2, позволяют получить соединения формулы (I) и их предшественники формул (II) и (VI) в рацемической форме или в виде смесей диастереомеров в случае, когда присутствуют дополнительные хиральные центры. Чистые стереоизомеры можно получить из смесей стереоизомеров, используя методики, хорошо известные специалисту в данной области, включая, например, разделение энантиомеров хиральной ВЭЖХ, или кристаллизацию и/или хроматографирование смеси диастереомеров. Альтернативно, смесь энантиомеров можно разделить, получая диастереомерные производные, имеющие подходящий оптически активный вспомогательный фрагмент, с последующим разделением образовавшихся диастереомеров и затем с отщеплением хирального вспомогательного фрагмента. Если для получения соединений, соответствующих формуле (I), невозможно использовать набор общих синтетических способов, описанных выше, и/или необходимые промежуточные соединения для синтеза соединений формулы (I), то следует применять подходящие способы получения, известные специалисту в данной области. В общем случае синтетический путь к каждому индивидуальному соединению формулы (I) будет зависеть от частных заместителей в каждой молекуле, а также от легкодоступности необходимых промежуточных соединений; и вновь средний специалист в данной области способен учесть такие факторы. В отношении способов введения и удаления защитных групп см. Philip J.Peter G.M. Wuts в "Protective Groups in Organic Synthesis", Wiley Interscience, 3rd Edition 1999. Специалист в данной области должен понимать, что некоторые реакции лучше проводить, когда потенциально реакционноспособные функциональные группы в молекуле замаскированы или защищены, таким образом избегая побочных реакций и/или увеличивая выход реакции. Примеры защитных групп можно найти вPhilip J. Kocienski, 1994, выше и в Green et al., 1999, выше. Необходимость введения и выбор защитных групп для конкретных реакций известны специалисту в данной области и зависят от природы защищаемой функциональной группы (гидрокси, амино, карбокси и т.д.), структуры и стабильности молекулы, в которой данный заместитель является частью условий реакции. Соединения данного изобретения могут быть выделены как ассоциаты с молекулами растворителя кристаллизацией после выпаривания соответствующего растворителя. Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I), которые содержат основный центр, могут быть получены общепринятым способом. Например, раствор свободного основания можно обработать подходящей кислотой либо в чистом виде, либо в виде подходящего раствора, и полученную соль выделить либо фильтрацией, либо выпариванием использованного растворителя в вакууме. Фармацевтически приемлемые основно-аддитивные соли можно получить аналогичным путем, обрабатывая раствор соединения формулы (I) подходящим основанием. Оба типа солей можно получить или превратить один в другой методами с использованием ионообменных смол. Далее настоящее изобретение будет проиллюстрировано некоторыми примерами, которые не должны рассматриваться как ограничивающие объем изобретения. Были использованы следующие реагенты, доступные для приобретения: 1,2,3,4-тетрагидроизохинолин (Fluka),диизопропилэтиламин или DIEA (Fluka),метансульфонилхлорид (Aldrich),бис-(триметилсилил)амид лития или LiHMDS (Aldrich),диэтилхлорфосфат (Aldrich),3-фенилпропионовый альдегид (Aldrich),гидроксиламин или NH2OH (Fluka),- 24013907 уксусный ангидрид (Fluka),2,3-О-изопропилиден-D-глицеральдегид (Interchim),гексаналь (Aldrich),циклопропанкарбоксальдегид (Aldrich),2-тиофенкарбоксальдегид (Fluka),изоиндолин (Aldrich),3-тиофентарбоксальдегид (Aldrich),2-метил-2-морфолинопропаналь (Bionet),5-пиримидинкарбоксальдегид (Apollo),3-пиридинкарбоксальдегид (Fluka),гидрохлорид 6,7-диметокси-1,2,3,4-тетрагидроизохинолина (Aldrich),6-метокси-3-пиридинкарбоксальдегид (Aldrich),диметилацеталь аминоацетальдегида (Aldrich),1-бензилпиперидин-4-карбальдегид (JW Pharmlab),бензилоксиацетальдегид (Aldrich),комплекс трифторида бора с диэтиловым эфиром (Aldrich),гидрохлорид 7-бром-1,2,3,4-тетрагидроизохинолина (Arch),4-хлорфенетиламин (Aldrich),циклопентанкарбоксальдегид (Aldrich),циклопентанон (Fluka),3,3-диметилбутиральдегид (Fluka),3,4-дихлорфенетиламин (Acros),2-этилбутиральдегид (Aldrich),этилизобутират (Aldrich),этил-2-формил-1-циклопропанкарбоксилат (Aldrich),гидрохлорид 5-фтор-2,3-дигидро-1 Н-изоиндола (Astatech),4-фторфенилбороновая кислота (Aldrich),гидрохлорид 7-фтор-1,2,3,4-тетрагидроизохинолина (Arch),трет-бутиловый эфир 2-формил-пирролидин-1-карбоновой кислоты (Pharmacore),3-(2-фурил)акролеин (Acros),3-фуральдегид (Aldrich),гликолевый альдегид (ICN),3-гидроксифенилбороновая кислота (Aldrich),4-изопропилбензальдегид (Aldrich),изобутиральдегид (Aldrich),изопропилиодид (Aldrich),изовалеральдегид (Aldrich),литийалюмогидрид (Fluka),гидрохлорид 7-метокси-1,2,3,4-тетрагидроизохинолина (Arch),3-(метилтио)пропиональдегид (Aldrich),метилфеноксиацетат (Aldrich),метилтетрагидро-2 Н-пиран-4-карбоксилат (Fluka),метил-3-(3-пиридил)пропионат (Lancaster),оксалилхлорид (Aldrich),2-пентинилхлорид (TCl),фенилбороновая кислота (Aldrich),пропилиодид (Aldrich),пиридин-4-бороновая кислота (Aldrich),боргидрид натрия (Fluka),3-[(трет-бутилдиметилсилил)окси]-1-пропаналь (Toronto),4-(трет-бутил)фенетиламин (Emkachem),3-тиенилбороновая кислота (Aldrich),1,3,5-триоксан (Fluka),триметилацетальдегид (Aldrich),триэтиламин (Fluka),гидрохлорид 7-трифторметил-1,2,3,4-тетрагидроизохинолина (Arch),4,4,4-трифторбутиральдегид (ABCR).DCM (200 мл) охлаждают до 0 С и по каплям прибавляют метансульфонилхлорид (7,0 мл, 90 ммоль). Полученную смесь перемешивают при 0 С в течение 1 ч. Затем реакционную смесь промывают 1N водным раствором HCl (150 мл) и насыщенным водным раствором NaHCO3 (150 мл). Водные слои экстрагируют DCM (2100 мл). Органические слои объединяют, осушают (MgSO4) и объем растворителя уменьшают до 40 мл выпариванием при пониженном давлении. Начинает осаждаться твердая фаза, добавляют пентан для завершения осаждения. Твердую фазу отфильтровывают, промывают пентаном (2) и сушат при пониженном давлении, получают 15,7 г (98%) указанного в заголовке соединения в виде желтого порошка. ВЭЖХ, Rt: 2,6 мин (чистота: 95,3%). ЖХ/МС, M+(ESI): 212,2. Стадия b). Получение N-1-[(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)метил]-3-фенилпропилN-гидроксиформамида Готовят раствор 2-(метилсульфонил)-1,2,3,4-тетрагидроизохинолина (500 мг, 2,37 ммоль) в безводном THF (20 мл) и охлаждают до 0 С. По каплям прибавляют раствор LiHMDS (1 M в THF, 5,2 мл,5,2 ммоль). Через 5 мин добавляют диэтилхлорфосфат (0,34 мл, 2,37 ммоль). Через 5 мин добавляют 3-фенилпропионовый альдегид (0,37 мл, 2,84 ммоль) и реакционную смесь перемешивают при комнатной температуре 40 мин. Затем добавляют 50% водный раствор NH2OH (2,1 мл) и полученную двухфазную систему нагревают при 60 С в течение 2,5 ч. Добавляют насыщенный раствор соли (20 мл) и разделяют слои. Водный слой экстрагируют EtOAc (220 мл). Органические слои объединяют, осушают(MgSO4) и растворители удаляют при пониженном давлении с получением желтого масла. Смесь муравьиной кислоты (7 мл) и уксусного ангидрида (1,7 мл) перемешивают при 0 С в течение 30 мин, затем прибавляют раствор полученного ранее масла в безводном THF (15 мл) и полученную смесь перемешивают при 0 С в течение 30 мин. Смесь выпаривают при пониженном давлении. Остаток растворяют в МеОН (10 мл) и нагревают при 60 С в течение 30 мин. Смесь выпаривают при пониженном давлении с получением желтого масла, которое растворяют в EtOAc (20 мл) и промывают насыщенным водным раствором NaHCO3 (20 мл). Водный слой экстрагируют EtOAc (220 мл). Органические слои объединяют,осушают (MgSO4) и растворитель удаляют при пониженном давлении с получением желтого масла. После очистки флэш-хроматографией на силикагеле (градиент сНех:EtOAc от 4:1 до чистого EtOAc) с последующим осаждением из EtOAc (6 мл), указанное в заголовке соединение (1) получают в виде белого порошка (364 мг, выход 40%). ВЭЖХ, Rt: 3,8 мин (чистота: 100%). ЖХ/МС, M+(ESI): 389,3; M-(ESI): 387,2. Пример 2. Получение N-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-[(4S)-2,2-диметил-1,3 диоксолан-4-ил]этил-N-гидроксиформамида (2) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 2,3-O-изопропилиден-D-глицеральдегида. После очистки осаждением из EtOAc указанное в заголовке соединение (2) получают в виде белого порошка (392 мг, выход 43%). ВЭЖХ, Rt: 3,0 мин (чистота: 95%). ЖХ/МС, M+(ESI): 385,3; M-(ESI): 383,3.N-1-[(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)метил]гексил-N Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из гексаналя. После очистки осаждением из EtOAc указанное в заголовке соединение (3) получают в виде белого порошка (546 мг, выход 65%). ВЭЖХ, Rt: 3,8 мин (чистота: 98,5%). ЖХ/МС, M+(ESI): 355,3; M-(ESI): 353,3. Пример 4. Получение N-[1-циклопропил-2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)этил]-Nгидроксиформамида (4) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из циклопропанкарбоксальдегида. После очистки осаждением из смеси EtOAc:пентан 1:1 указанное в заголовке соединение (4) получают в виде белого порошка (380 мг, выход 50%). ВЭЖХ, Rt: 2,8 мин (чистота: 100%). ЖХ/МС, M+(ESI): 325,2; M-(ESI): 323,2. Пример 5. Получение N-[2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-(2-тиенил)этил]-Nгидроксиформамида (5)cHex:EtOAc от 4:1 до EtOAc) с последующим осаждением из EtOAc/cHex указанное в заголовке соединение (5) получают в виде беловатого порошка (371 мг, выход 43%). ВЭЖХ, Rt: 3,3 мин (чистота: 98,6%). ЖХ/МС, M+(ESI): 367,2; M-(ESI): 365,2. Пример 6. Получение N-1-[(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)метил]-3-фенилпропил-Nгидроксиформамида (6). Стадия а). Получение 2-(метилсульфонил)изоиндолина Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия а), но исходя из изоиндолина. Указанное в заголовке соединение получают в виде серого порошка (2,53 г, выход 76%). ВЭЖХ, Rt: 2,1 мин (чистота: 100%). ЖХ/МС, M+(ESI): 198,1. Стадия b). Получение N-1-[(1,3-дигидро-2 Н-изоиндол-2-илсульфонил)метил]-3-фенилпропил-Nгидроксиформамида Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 2-(метилсульфонил)изоиндолина. После очистки осаждением из EtOAc указанное в заголовке соединение (6) получают в виде белого порошка (448 мг, выход 47%). ВЭЖХ, Rt: 3,7 мин (чистота: 100%). Х/МС, M+(ESI): 375,3; M-(ESI): 373,3.cHex:EtOAc от 4:1 до чистого EtOAc) с последующим осаждением из EtOAc/cHex указанное в заголовке соединение (7) получают в виде беловатого порошка (334 мг, выход 39%). ВЭЖХ, Rt: 3,2 мин (чистота: 95,4%). ЖХ/МС, M+(ESI): 367,2; M-(ESI): 365,2. Пример 8. Получение N-1-[(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)метил]-2-метил-2 морфолинин-4-илпропил-N-гидроксиформамида (8) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 2-метил-2-морфолинопропаналя. После очистки осаждением из EtOAc указанное в заголовке соединение (8) получают в виде белого порошка (294 мг, выход 30%). ВЭЖХ, Rt: 2,1 мин (чистота: 99,9%). ЖХ/МС, M+(ESI): 412,4; M-(ESI): 410,3. Пример 9. Получение N-[2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-пиримидин-5-илэтил]N-гидроксиформамида (9) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 5-пиримидинкарбоксальдегида. После очистки осаждением из смеси EtOAc/cHex с последующей перекристаллизацией из iPrOH указанное в заголовке соединение (9) получают в виде желтого порошка (68 мг, выход 8%). ВЭЖХ, Rt: 2,4 мин (чистота: 90,5%). ЖХ/МС, M+(ESI): 363,2; M-(ESI): 361,1. Пример 10. Получение N-[2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-пиридин-3-илэтил]-Nгидроксиформамида (10) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 3-пиридинкарбоксальдегида. После очистки осаждением из смеси EtOAc/пентан указанное в заголовке соединение (10) получают в виде беловатого порошка (153 мг, выход 1.8%). ВЭЖХ, Rt: 1,9 мин (чистота: 91,6%). ЖХ/МС, M+(ESI): 362,3; M-(ESI): 360,3. Пример 11. Получение гидрохлоридной соли N-[2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1 пиридин-3-илэтил]-N-гидроксиформамида (11) Избыток раствора HCl (4N в 1,4-диоксане) добавляют к раствору N-[2-(3,4-дигидроизохинолин 2(1 Н)-ил)сульфонил)-1-пиридин-3-илэтил]-N-гидроксиформамида (55 мг, чистота 80%) в 1,4-диоксане. Осаждается твердая фаза. Надосадочную жидкость удаляют декантацией, затем твердую фазу промывают декантацией Et2O (2) и сушат при пониженном давлении, получая указанное в заголовке соединение(11) в виде беловатого порошка (25 мг, выход 40%). ВЭЖХ, Rt: 1,9 мин (чистота: 83%). ЖХ/МС, M+(ESI): 362,3; M-(ESI): 360,3. Пример 12. Получение N-(1-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]метил 3-фенилил]пропил)-N-гидроксиформамида (12). Стадия а). Получение 6,7-диметокси-2-(метилсульфонил)-1,2,3,4-тетрагидроизохинолина Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия а), но исходя из гидрохлорида 6,7-диметокси-1,2,3,4-тетрагидроизохинолина и одного дополнительного эквивалента DIEA. Указанное в заголовке соединение получают в виде бледно-желтого порошка (930 мг, выход 79%). ВЭЖХ, Rt: 2,3 мин (чистота: 99,2%). ЖХ/МС, M+(ESI): 272,2. Стадия b). Получение N-(1-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]метил 3-фенилилпропил)-N-гидроксиформамида Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 6,7-диметокси-2-(метилсульфонил)-1,2,3,4-тетрагидроизохинолина. После очистки осаждением из EtOAc/пентан указанное в заголовке соединение (12) получают в виде белого порошка (366 мг,выход 44%). ВЭЖХ, Rt: 3,4 мин (чистота: 99,7%). ЖХ/МС, M+(ESI): 449,4; M-(ESI): 447,4. Пример 13. Получение N-[2-(3,4-дигидроизохинолин-2(1 Н)-илсульфонил)-1-(6-метоксипиридин-3 ил)этил]-N-гидроксиформамида (13) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 6-метокси-3-пиридинкарбоксальдегида. После очистки флэш-хроматографией на силикагеле (градиент cHex:EtOAc от 4:1 до EtOAc) с последующим осаждением из EtOAc/пентана указанное в заголовке соединение (13) получают в виде оранжевого порошка (135 мг, выход 15%). ВЭЖХ, Rt: 2,8 мин (чистота: 98,4%). ЖХ/МС, M+(ESI): 392,4; M-(ESI): 390,3. Пример 14. Получение N-2-[(6,7-диметокси-3,4-дигидроизохинолин-2(1 Н)-ил)сульфонил]-1-[(4S)2,2-диметил-1,3-диоксолан-4-ил]этил-N-гидроксиформамида (14) Указанное в заголовке соединение получают, следуя методике, описанной в примере 1, стадия b),но исходя из 6,7-диметокси-2-(метилсульфонил)-1,2,3,4-тетрагидроизохинолина и 2,3-О-изопропилиденD-глицеральдегида. После очистки кристаллизацией при -20 С из EtOAc/пентана указанное в заголовке соединение (14) получают в виде белого порошка (117 мг, выход 18%). ВЭЖХ, Rt: 2,6 мин (чистота: 97,3%). ЖХ/МС, M+(ESI): 445,4; M-(ESI): 443,3.
МПК / Метки
МПК: A61P 35/00, C07D 401/12, C07D 217/08, A61K 31/5377, C07D 401/04, A61K 31/4035, C07D 409/12, A61K 31/4709, C07D 405/12, C07D 209/44, C07D 413/12
Метки: сульфонамидные, применение, производные, модулирования, металлопротеаз
Код ссылки
<a href="https://eas.patents.su/30-13907-sulfonamidnye-proizvodnye-i-ih-primenenie-dlya-modulirovaniya-metalloproteaz.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонамидные производные и их применение для модулирования металлопротеаз</a>
Предыдущий патент: Полимерные композиции, замедляющие образование древовидного токопроводящего следа под действием воды, изделия и способы их изготовления
Следующий патент: Замещенные соединения миноциклина (варианты), фармацевтическая композиция и способ лечения чувствительного к тетрациклину состояния млекопитающего
Случайный патент: Способ выделения металлического порошка из суспензии и система для его осуществления












