4-замещенные аналоги пиперидина и их использование в качестве подтип-селективных антагонистов рецепторов nmda.
Номер патента: 1323
Опубликовано: 26.02.2001
Авторы: Вудвард Ричард, Вебер Экард, Бидж Кристофер Ф., Кина Джон Ф.В., Зоу Занг-Лин, Лан Нэнси К., Кай Суи Ксионг, Гузиковский Энтони П., Йеун По-Вай
Формула / Реферат
1. Соединение, представленное формулой (I)
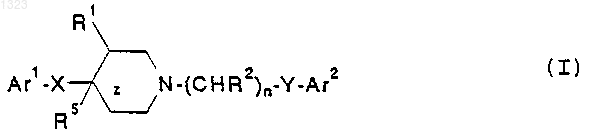
или его фармацевтически приемлемая соль, где
Аr1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6 алкиламино;
z обозначает простую или двойную связь;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2, при условии, что, когда z обозначает двойную связь, X не является О или NR4;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода; n равно 0, 1, 2, 3 или 4;
Y обозначает О, S, NR4 или является простой связью; и
R5 обозначает водород или гидрокси, когда z обозначает простую связь, при условии, что: (i) R2 не может быть гидрокси в a -положении относительно Ar2; (ii) если X представляет собой простую связь, z представляет собой двойную связь или R5 представляет собой гидрокси и Аr2 представляет собой фенил, то Y не может быть О; (iii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, z представляет собой простую связь, R1 и R5 представляют собой водород и Аr2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iv) если X представляет собой -(CHR3)m-, m равно 2 и R3 представляет собой исключительно водород, то Аr1 не может быть замещен имидазолилом; (v) если Y представляет собой О, n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, z представляет собой простую связь, R1 и R3 представляют собой водород и Аr2 представляет собой фенил или замещенный NO2, CN, 1-имидазолилом или 1, 2, 4-триазол-1-илом фенил, то X не может быть метиленом, гидроксиметиленом или О; (vi) если Y представляет собой О или S, R1 и R5 представляют собой водород и R2 представляет собой гидрокси, то X не является метиленом или простой связью; или (vii) если Y представляет собой простую связь, R2 представляет собой исключительно водород и Аr2 представляет собой фенил, то либо R1, либо R5 должен быть гидрокси.
2. Соединение по п.1, где Y представляет собой О или простую связь.
3. Соединение по п.2, где Ar2 представляет собой пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу.
4. Соединение по п.2, где R1 или R5 представляет собой гидрокси.
5. Соединение по п.1, выбранное из группы, включающей:
4-фенокси-1-[(4-фторфенокси)пропил]пиперидин;
1-(3-феноксипропил)-4-фенилпиперидин;
1-(2-феноксиэтил)-4-фенилпиперидин;
1-(4-феноксибутил)-4-фенилпиперидин;
1-(4-(3-(трифторметил)фенокси)бутил)-4-фенилпиперидин;
1-(2-(4-аминофенокси)этил)-4-бензилпиперидин;
3-((2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегид;
3-((2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегид, оксим;
4-бензил-1-(2-(3-(этоксикарбонилметил)фенокси)этил)пиперидин;
4-бензил-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин;
1-(2-(3-(аминокарбонилметил)фенокси)этил)-4-бензилпиперидин;
4-бензил-1-(2-(3-(гидразинокарбонилметил)фенокси)этил)пиперидин;
4-бензил-1-(1-метил-2-феноксиэтил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-хлорфенокси)этил)пиперидин;
1-(2-(4-аминофенокси)этил)-4-(4-хлорбензил)пиперидин;
4-(4-хлорбензил)-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-фторфенокси) этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-хлорфенокси)этил)пиперидин;
1-(2-(4-фторфенокси)этил)-4-(4-метоксибензил)пиперидин;
1-(2-(4-фторфенокси)этил)-4-(4-нитробензил)пиперидин;
4-бензил-1-(1-метил-3-феноксипропил)пиперидин;
1-(2-феноксиэтил)-4-фенилпилеридин;
3-гидрокси-1-(2-феноксиэтил)-4-(3-трифторметилфенил)пиперидин;
3-гидрокси-1-(3-феноксипропил)-4-(3-трифторметилфенил)пиперидин;
4-бензил-1-[2-(6-хинолинокси)этил]пиперидин;
4-бензил-1-[2-(8-хинолинокси)этил]пиперидин;
4-бензил-1-[2-(2-амино-3-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диаминофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диоксохиноксалин-5-окси)этил]пиперидин;
4-бензил-1-[2-(2-оксобензимидазол-4-окси)этил]пиперидин;
4-бензил-1-[2-(4-амино-3-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(3,4-диаминофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диоксохиноксалин-6-окси)этил]пиперидин;
4-бензил-1-[2-(2-оксобензимидазол-5-окси)этил]пиперидин;
4-бензил-1-[2-(2-аминофенокси)этил]пиперидин;
4-бензил-1-[2-(3-аминофенокси)этил]пиперидин;
4-бензил-1-[2-(4-аминофенокси)этил]пиперидин;
4-[2-(4-бензилпиперидино)этокси]хиназолин;
4-[2-(4-бензилпиперидино)этокси]пиразоло[3,4-d]пиримидин;
1-[2-(4-бензилпиперидино)этил]-4-гидроксипиразоло[3,4-d]пиримидин;
4-бензил-1-[2-(2-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(3-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(4-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(3,4-бисацетамидофенокси)этил]пиперидин;
4-бензил-1-[2-(2-метилбензимидазол-6-окси)этил]пиперидин;
4-бензил-1-[2-(2-метилбензимидазол-5-окси)этил]пиперидин;
4-бензил-1-[2-(3-трифторметилфенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-аминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-амино-3-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2,3-диаминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-оксобензимидазол-4-окси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(4-амино-3-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(3,4-диаминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-оксобензимидазол-5-окси)этил]пиперидин;
4-(4-фторбензил)-1-[2-(2-окообензимидазол-5-окси)этил]пиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(3-фенилпропил)пиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(4-фенилбутил)пиперидин;
3-гидрокси-1-(4-фенилбутил)-4-(3-трифторметилфенил)пиперидин;
4-бензил-4-гидрокси-1-(2-фенилэтил)пиперидин;
1,4-дибензил-4-гидроксипиперидин;
1-бензил-4-(4-фторбензил)-4-гидроксипиперидин;
4-(4-фторбензил)-1-[2-(4-фторфенил)этил]-4-гидроксипиперидин;
4-(2-кето-1-бензимидазолинил)-1-(3-феноксипропил)пиперидин;
4-бензил-4-гидрокси-1-(2-феноксиэтил)пиперидин;
4-бензил-4-гидрокси-1-(3-фенилпропил)пиперидин;
4-бензил-4-гидрокси-1-(3-феноксипропил)пиперидин;
4-бензил-1-[(2-гидрокси-4-фенил)бутил]пиперидин;
3-гидрокси-4-(3-трифторметилфенил)-1-[3-(3-аминофенокси)пропил]пиперидин;
3-гидрокси-4-(4-фторфенил)-1-[3-(3-амино-1-нафтилокси)пропил]пиперидин;
4-бензил-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-гидроксибензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-бензил-1-(3-(4-гидроксифенил)пропил)пиперидин;
4-(4-хлорбензил)-1-(3-(4-гидроксифенил)пропил)пиперидин;
4-бензил-1-(2-(4-гидроксифенил)этил)пиперидин;
4-(3-фторбензил)-1-(2-(4-гидроксифекокси)этил)пиперидин;
4-(3-фторбензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-этилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-метоксибензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(3,4-дифторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-4-гидрокси-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-трифторметилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-изопропилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-трет-бутилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(4-гидроксифенокси) этил)пиперидин;
4-((5,6,7,8-тетраrидро-2-нафтил)метил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-((2-нафтил)метил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(N-метиланилино)этил)пиперидин;
4-бензил-1-(2-(тиофенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(2-хлор-4-(2-гидроксиэтил)фенокси)этил)пиперидин;
4-(2,6-дифторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-бензил-1-(2-(3,4-метилендиоксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидрокси-3-метилфекокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-гидрокси-4-(4-метилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-гидрокси-4-(4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-бензил-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(N-метил-4-гидроксианилино)этил)пиперидин;
4-бензил-4-гидрокси-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидрокситиофенокси)этил)пиперидин;
4-(4-гидроксифенил)-1-(4-фенилбутил)пиперидин;
4-бензил-1-(3-(2-оксобензимидазол-5-окси)пропил)пиперидин;
4-бензил-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-иминобензимидазол-5-окси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксобензоксазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксобензоксазол-6-окси)этил)пиперидин;
4-бензил-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-бензил-1-(2-(3-гидроксинафт-6-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-бензил-1-(2-(3-метил-2-оксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин
и фармацевтически приемлемую соль любого из них.
6. Фармацевтическая композиция, применяемая для лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата, таких как кровоизлияние (удар), церебральная ишемия, травмы центральной нервной системы, гипогликемия, нейродегенеративные расстройства, тревога, мигрени, судороги, индуцируемая аминогликовидными антибиотиками потеря слуха, психоз, глаукома, CMV-ретинит, устойчивость к опиоидам или синдром отмены опиоидов, хроническая боль или недержание мочи, причем эти композиции содержат фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество, по меньшей мере, одного соединения по п.1.
7. Соединение, представленное формулой
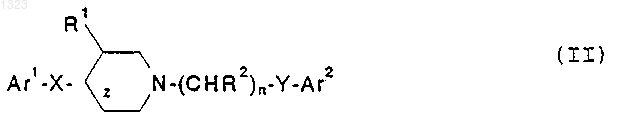
или его фармацевтически приемлемая соль, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, C1-C6 алкиламино, ди-С1-С6 алкиламино;
z обозначает простую или двойную связь;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2, при условии, что когда z обозначает двойную связь, X не является О или NR4;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью, при условии, что: (i) R2 не может быть гидрокси в a -положении относительно Ar2; (ii) если X представляет собой простую связь, z представляет собой двойную связь и Ar2 представляет собой фенил, то Y не может быть О; (iii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, R1 представляет собой водород и Ar2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iv) если X представляет собой -(CHR3)m-, m равно 2 и R3 представляет собой исключительно водород, то Ar1 не может быть замещен имидазолилом; (v) если Y представляет собой О, n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, R1 представляет собой водород и Ar2 представляет собой фенил или замещенный NO2, CN, 1-имидазоилом или 1,2,4-триазол-1-илом фенил, то X не может быть метиленом, гидроксиметиленом или О; (vi) если Y представляет собой О или S, R1 представляет собой водород и R2 представляет собой гидрокси, то X не является метиленом или простой связью; или (vii) если Y представляет собой простую связь, R2 представляет собой исключительно водород и Ar2 представляет собой фенил, то R1 должен быть гидрокси.
8. Соединение, представленное формулой
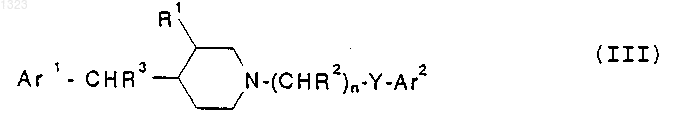
или его фармацевтически приемлемая соль, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6алкиламино;
R1 обозначает водород или гидрокси;
каждый R2 и R3 независимо обозначают водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью, при условии, что (i) R2 не может быть гидрокси в a -положении относительно Ar2; (ii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, R1 представляет собой водород и Ar2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iii) если Y представляет собой О, n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, R1 представляет собой водород и Ar2 представляет собой фенил или замещенный NO2, CN, 1- имидазоилом или 1,2,4-триазол-1-илом фенил, то R3 не может быть водородом; (iv) если Y представляет собой О или S, R1 представляет собой водород и R2 представляет собой гидрокси, то R3 не может быть водородом; или (v) если Y представляет собой простую связь, R2 представляет собой исключительно водород и Ar2 представляет собой фенил, то R1 должен быть гидрокси.
9. Соединение, представленное формулой
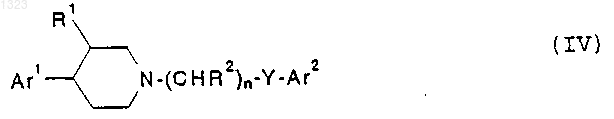
или его фармацевтически приемлемая соль, где
Аr1 и Аr2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью, при условии, что (i) R2 не может быть гидрокси в альфа-положении относительно Аr2; или (ii) если Y представляет собой простую связь, О или S и Аr2 представляет собой фенил, то R2 не является гидрокси.
10. Соединение, представленное формулой

или его фармацевтически приемлемая соль, где
Аr1 и Аr2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью, при условии, что R2 не может быть гидрокси в a -положении относительно Аr2.
11. Соединение, представленное формулой
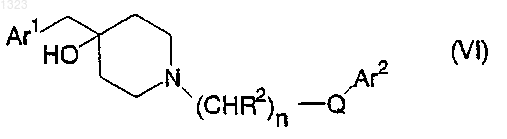
или его фармацевтически приемлемая соль, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода; n равно 0, 1, 2, 3 или 4; и Q обозначает О, S, NR4 или является простой связью.
12. Соединение, представленное формулой
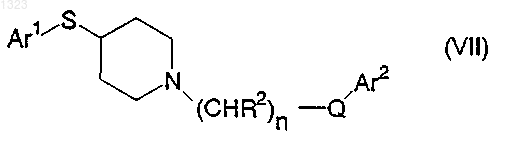
или его фармацевтически приемлемая соль, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Q обозначает О, S, NR4 или является простой связью.
13. Соединение, представленное формулой
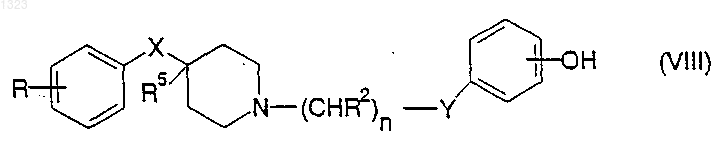
или его фармацевтически приемлемая соль, где
R представляет собой водород, гидрокси, C1-C6 алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, C1-C6 алкоксикарбонилметил, гидрокси-C1-C6 алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную C1-C6алкильную группу, C1-C6 алкиламино, C1-C6 алкоксигруппу а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси- C1-C6 алкила, амино, C1-C6 алкиламино и ди- C1-C6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
R5 обозначает водород или гидрокси;
Y обозначает О, S, NR4 или является простой связью;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода и m равно 0, 1 или 2.
14. Соединение по п.13, где R5 представляет собой гидрокси.
15. Соединение, представленное формулой
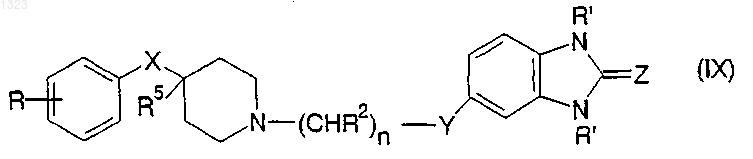
или его фармацевтически приемлемая соль, где
R представляет собой водород, гидрокси, С1-С6алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, С1-C6алкоксикарбонилметил, гидрокси-С1-С6алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную C1-C6алкильную группу, С1-С6алкиламино, С1-С6алкоксигруппу, а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из С1-С6алкила, гидрокси, галогена, нитро, циано, карбоксальдегифр, С1-C6алкоксикарбонилметила, гидрокси-С1-С6алкила, амино, С1-С6алкиламино и ди-C1-C6алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
R5 обозначает водород или гидрокси;
Y обозначает O, S, NR4 или является простой связью;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2.
16. Соединение, представленное формулой
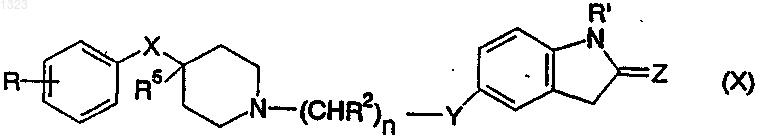
или его фармацевтически приемлемая соль, где
R представляет собой водород, гидрокси, C1-C6алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, С1-C6алкоксикарбонилметил, гидрокси-C1-C6алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную С1-С6алкильную группу, C1-C6алкиламино, C1-C6алкоксигруппу, а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из C1-C6алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино и ди-C1-C6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
X обозначает -(СНR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;
R5 обозначает водород или гидрокси;
R' обозначает водород или C1-C6алкил;
Z обозначает О или S и
Y обозначает О, S, MR4 или является простой связью.
17. Соединение, представленное формулой
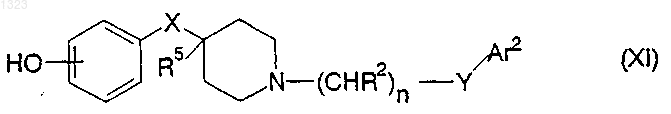
или его фармацевтически приемлемая соль, где
Ar2 представляет фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6алкиламино, ди-C1-C6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
X обозначает -(CHR3)m-, O, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;
R5 обозначает водород или гидрокси и
Y обозначает O, S, NR4 или является простой связью.
18. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антаrониста, представленного формулой
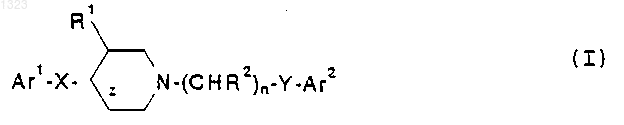
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6 алкиламино;
z обозначает простую или двойную связь;
X обозначает -(CHR3)m-, О, S или NR4, где R3 обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2, при условии, что, когда z обозначает двойную связь, X не является О или NR4;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
Y обозначает О, S, NR4 или является простой связью и
R5 обозначает водород или гидрокси, когда z представляет собой простую связь.
19. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
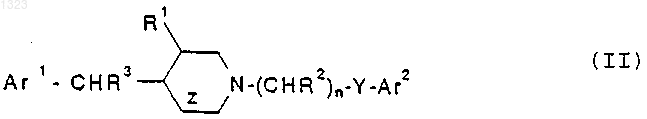
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, C1-C6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-C1-C6 алкиламино;
X обозначает -(CHR3)m-, О, S или NR4, где R3 обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2, при условии, что, когда z обозначает двойную связь, X не является О или NR4;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4; и
Y обозначает О, S, NR4 или является простой связью.
20. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
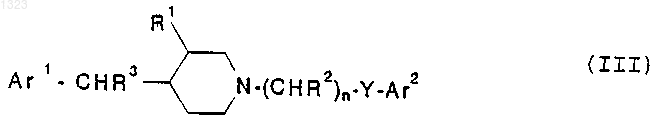
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными шч C1-C6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-C1-C6 алкила, амино, C1-C6 алкиламино, ди-С1-С6 алкиламино;
R1 обозначает водород или гидрокси;
R2 и R3 независимо обозначают водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4; и
Y обозначает О, S, NR4 или является простой связью.
21. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антaгониста, представленного формулой
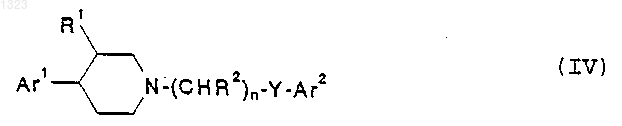
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
R1 обозначает водород или гидрокси;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью.
22. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
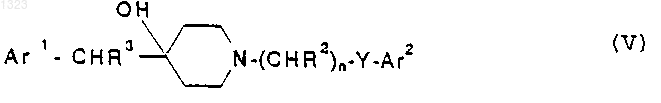
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
каждый R2 и R3 независимо обозначают водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4 и
Y обозначает О, S, NR4 или является простой связью.
23. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
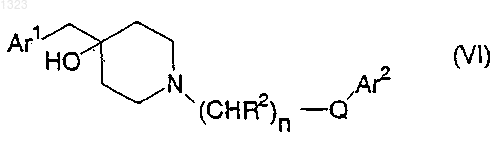
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4; и
Q обозначает О, S, NR4 или является простой связью.
24. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
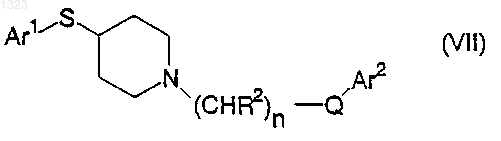
или его фармацевтически приемлемой соли, где
Ar1 и Ar2 независимо обозначают фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4; и
Q обозначает О, S, NR4 или является простой связью.
25. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
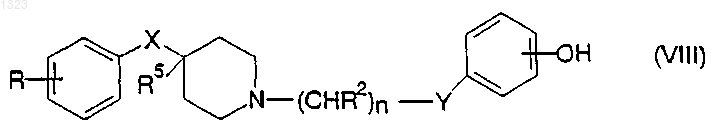
или его фармацевтически приемлемой соли, где
R представляет собой водород, гидрокси, С1-С6 алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, С1-С6 алкоксикарбонилметил, гидрокси- С1-С6 алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную С1-С6 алкильную группу, С1-С6 алкиламино, С1-С6 алкоксигруппу, а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси- С1-С6 алкила, амино, С1-С6 алкиламино и ди- С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
R5 обозначает водород или гидрокси;
Y обозначает О, S, NR4 или является простой связью и
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2.
26. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
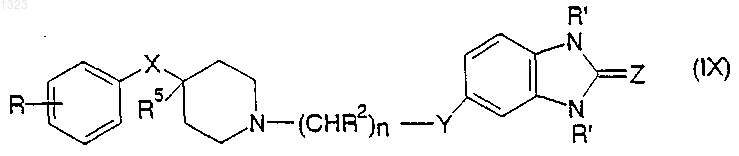
или его фармацевтически приемлемой соли, где
R представляет собой водород, гидрокси, С1-С6 алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, С1-С6 алкоксикарбонилметил, гидрокси- С1-С6 алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную С1-С6 алкильную группу, С1-С6 алкиламино, С1-С6 алкоксигруппу, а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино и ди-С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
R5 обозначает водород или гидрокси;
R' независимо обозначает водород или С1-С6 алкил;
Z обозначает О или S;
Y обозначает О, S, NR4 или является простой связью; и
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2.
27. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антагониста, представленного формулой
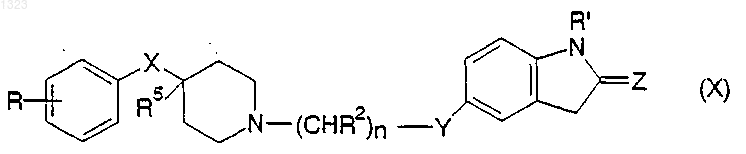
или его фармацевтически приемлемой соли, где
R представляет собой водород, гидрокси, С1-С6 алкил, галоген, нитро, циано, карбоксальдегид, оксим альдегида, С1-С6 алкоксикарбонилметил, гидрокси-С1-С6 алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо, амино, галогенированную С1-С6 алкильную группу, С1-С6 алкиламино, С1-С6 алкоксигруппу, а также фенил или нафтил, каждый из которых может быть независимо замещён одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино и ди-С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;
R5 обозначает водород или гидрокси;
R' обозначает водород или С1-С6 алкил;
Z обозначает О или S; и
Y обозначает О, S, NR4 или является простой связью.
28. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения-антаrониста, представленного формулой

или его фармацевтически приемлемой соли, где
Ar2 представляет фенильную, нафтильную, пиперидинильную, хинолинильную, хиноксалинильную, бензимидазолильную, бензоксазолильную, индолильную, тиофенильную группу, каждая из которых может быть независимо замещена одной или двумя группами, выбранными из С1-С6 алкила, гидрокси, галогена, нитро, циано, карбоксальдегида, С1-С6 алкоксикарбонилметила, гидрокси-С1-С6 алкила, амино, С1-С6 алкиламино, ди-С1-С6 алкиламино;
каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода;
n равно 0, 1, 2, 3 или 4;
X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;
R5 обозначает водород или гидрокси и
Y обозначает О, S, NR4 или является простой связью.
29. Способ лечения нарушений, чувствительных к селективной блокаде подтипов рецептора N-метил-D-аспартата у животного, страдающего от такого нарушения, включающий введение в стандартной дозированной форме, по меньшей мере, одного селективного в отношении подтипа рецептора N-метил-D-аспартата соединения, выбранного из группы, включающей:
1-(2-феноксиэтил)-4-фенилпиперидин;
1-(4-(3-(трифторметил)фенокси)бутил)-4-фенилпиперидин;
4-фенокси-1-[(4-фторфенокси)пропил]пиперидин;
1-(3-феноксипропил)-4-фенилпиперидин;
1-(2-феноксиэтил)-4-фенилпиперидин;
1-(4-феноксибутил)-4-фенилпиперидин;
1-(4-(3-(трифторметил)фенокси)бутил)-4-фенилпиперидин;
1-(2-(4-аминофенокси)этил)-4-бензилпиперидин;
3-((2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегид;
3-( (2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегид, оксим;
4-бензил-1-(2-(3-(этоксикарбонилметил)фенокси)этил)пиперидин;
4-бензил-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин;
1-(2-(3-(аминокарбонилметил)фенокси)этил)-4-бензилпиперидин;
4-бензил-1-(2-(3-(гидразинокарбонилметил)фенокси)этил)пиперидин;
4-бензил-1-(1-метил-2-феноксиэтил)пиперидин;
4-бензил-1-(3-(3-фторфенокси)пропил)пиперидин;
4-бензил-1-(4-(3-фторфенокси)бутил)пиперидин;
4-(4-хлорбензил)-1-(2-феноксиэтил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-хлорфенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-нитрофенокси)этил)пиперидин;
1-(2-(4-аминофенокси)этил-4-(4-хлорбензил)пиперидин;
4-(4-хлорбензил)-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(3-феноксипропил)пиперидин;
4-(4-хлорбензил)-1-(3-(3-фторфенокси)пропил)пиперидин;
4-(4-фторбензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-хлорфенокси)этил)пиперидин;
1-(2-(4-фторфенокси)этил)-4-(4-метоксибензил)пиперидин;
1-(2-(4-фторфенокси)этил)-4-(4-нитробензил)пиперидин;
4-(4-нитробензил)-1-(3-феноксипропил)пиперидин;
4-бензил-1-(1-метил-3-феноксипропил)пиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(2-феноксиэтил)пиперидин;
1-(2-феноксиэтил)-4-фенилпиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(3-феноксипропил)пиперидин;
3-гидрокси-1-(2-феноксиэтил)-4-(3-трифторметилфенил)пиперидин;
3-гидрокси-1-(3-феноксипропил)-4-(3-трифторметилфенил)пиперидин;
4-бензил-1-[2-(6-хинолинокси)этил]пиперидин;
4-бензил-1-[2-(8-хинолинокси)этил]пиперидин;
4-бензил-1-[2-(2-амино-3-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диаминофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диоксохиноксалин-5-окси)этил]пиперидин;
4-бензил-1-[2-(2-оксобензимидазол-4-окси)этил]пиперидин;
4-бензил-1-[2-(4-амино-3-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(3,4-диаминофенокси)этил]пиперидин;
4-бензил-1-[2-(2,3-диоксохиноксалин-6-окси)этил]пиперидин;
4-бензил-1-[2-(2-оксобензимидазол-5-окси)этил]пиперидин;
4-бензил-1-[2-(2-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(2-аминофенокси)этил]пиперидин;
4-бензил-1-[2-(3-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(3-аминофенокси)этил]пиперидин;
4-бензил-1-[2-(4-нитрофенокси)этил]пиперидин;
4-бензил-1-[2-(4-аминофенокси)этил]пиперидин;
4-[2-(4-бензилпиперидино)этокси]хиназолин;
4-[2-(4-бензилпиперидино)этокси]пиразоло[3,4-d]пиримидин;
1-[2-(4-бензилпиперидино)этил]-4-гидроксипиразоло[3,4-d]пиримидин;
4-бензил-1-[2-(2-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(3-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(4-метоксифенокси)этил]пиперидин;
4-бензил-1-[2-(3,4-бисацетамидофенокси)этил]пиперидин;
4-бензил-1-[2-(2-метилбензимидазол-6-окси)этил]пиперидин;
4-бензил-1-[2-(2-метилбензимидазол-5-окси)этил]пиперидин;
4-бензил-1-[2-(3-трифторметилфенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-аминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-амино-3-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2,3-диаминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-оксобензимидазол-4-окси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(4-амино-3-нитрофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(3,4-диаминофенокси)этил]пиперидин;
4-(4-хлорбензил)-1-[2-(2-оксобензимидазол-5-окси)этил]пиперидин;
4-(4-фторбензил)-1-[2-(2-оксобензимидазол-5-окси)этил]пиперидин;
4-бензил-1-(2-фенилэтил)пиперидин;
1,4-дибензилпиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(3-фенилпропил)пиперидин;
4-(4-хлорфенил)-4-гидрокси-1-(4-фенилбутил)пиперидин;
3-гидрокси-1-(4-фенилбутил)-4-(3-трифторметилфенил)пиперидин;
4-бензил-4-гидрокси-1-(2-фенилэтил)пиперидин;
1,4-дибензил-4-гидроксипиперидин;
1-бензил-4-(4-фторбензил)-4-гидроксипиперидин;
4-(4-фторбензил)-1-[2-(4-фторфенил)этил]-4-гидроксипиперидин;
4-(2-кето-1-бензимидазолинил)-1-(3-феноксипропил)пиперидин;
4-бензил-1-(2-феноксиэтил)пиперидин;
4-бензил-1-(3-феноксипропил)пиперидин;
4-бензил-1-(3-фенилпропил)пиперидин;
4-бензил-1-[2-(3-фенокси)пропил]пиперидин;
4-бензил-1-[2-гидрокси-3-(1-нафтилокси)пропил]пиперидин;
4-бензил-4-гидрокси-1-(3-фенилпропил)пиперидин;
4-бензил-4-гидрокси-1-(3-феноксипропил)пиперидин;
4-бензил-1-[2-гидрокси-4-фенил)бутил]пиперидин;
1-(3-феноксипропил)-4-фенилпиперидин;
1-(4-феноксибутил)-4-фенилпиперидин;
4-фенокси-1-[3-(4-фторфенокси)пропил]пиперидин;
4-(2-метоксифенокси)-1-(4-фенилбутил)пиперидин;
4-бензил-1-(4-фенилбутил)пиперидин;
4-[(3-трифторметилфенил)метил]-1-[2-(3-аминофенокси)этил]пиперидин;
4-[(3-трифторметилфенил)метил]-1-[3-(3-аминофенокси)пропил]пиперидин;
3-гидрокси-4-(3-трифторметилфенил)-1-[3-(3-аминофенокси)пропил]пиперидин;
3-гидрокси-4-(4-фторфенил)-1-[3-(3-амино-1-нафтилокси)пропил]пиперидин;
4-бензил-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-гидроксибензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-бензил-1-(3-(4-гидроксифенил)пропил)пиперидин;
4-(4-хлорбензил)-1-(3-(4-гидроксифенил)пропил)пиперидин;
4-бензил-1-(2-(4-гидроксифенил)этил)пиперидин;
4-(3-фторбензил)-1-(2-(4-фторфенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-этилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-метоксибензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(3,4-дифторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-4-гидрокси-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-трифторметилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-изопропилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-трет-бутилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-((5,6,7,8-тетрагидро-2-нафтил)метил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-((2-нафтил)метил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(N-метиланилино)этил)пиперидин;
4-бензил-1-(2-тиофенокси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(2-хлор-4-(2-гидроксиэтил)фенокси)этил)пиперидин;
4-(2,6-дифторбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-бензил-1-(2-(3,4-метилендиоксифенокси)этил)пиперидин;
4-(2-фтор-4-метилбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(3-фтор-4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-гидрокси-4-(4-метилбензил)-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-гидрокси-4-(4-метилбензил)-1-(2-(4-гидрокси-3-метилфенокси)этил)пиперидин;
4-бензил-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-гидроксифенокси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(3-гидроксифенокси)этил)пиперидин;
4-бензил-1-(2-(N-метил-4-гидроксианилино)этил)пиперидин;
4-бензил-4-гидрокси-1-(2-(4-гидроксифенокси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(4-гидрокситиофенокси)этил)пиперидин;
4-(4-гидроксифенил)-1-(4-фенилбутил)пиперидин;
4-бензил-1-(3-(2-оксобензимидазол-5-окси)пропил)пиперидин;
4-бензил-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-иминобензимидазол-5-окси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-(4-хлорбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксобензоксазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксобензоксазол-6-окси)этил)пиперидин;
4-бензил-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-бензил-1-(2-(3-гидроксинафт-6-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-(4-метилбензил)-1-(2-(2-гидроксинафт-6-окси)этил)пиперидин;
4-бензил-1-(2-(3-метил-2-оксобензимидазол-5-окси)этил)пиперидин;
4-бензил-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин;
4-(4-фторбензил)-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин и
фармацевтически приемлемую соль любого из них.
30. Способ по любому из пп.18-29, где указанным нарушением является кровоизлияние (удар), церебральная ишемия, травма центральной нервной системы или гипогликемия.
31. Способ по любому из пп.18-29, где указанным нарушением является психоз, тревога, судороги или хроническая боль.
32. Способ по любому из пп.18-29, где указанным нарушением является нейродегенеративное расстройство.
33. Способ по любому из пп.18-29, где указанным нарушением является мигрень.
34. Способ по любому из пп.18-29, где указанным нарушением является устойчивость к опиоидам или синдром отмены опиоидов.
35. Способ по любому из пп.18-29, где указанным нарушением является глаукома или вызываемый CMV-ретинит.
36. Способ по любому из пп.18-29, где указанным нарушением является болезнь Паркинсона.
37. Способ по любому из пп.18-29, где указанным нарушением является недержание мочи.
38. Способ по любому из пп.18-29, где указанным нарушением является индуцированная аминогликозидными антибиотиками потеря слуха.
Текст
1 Область изобретения Данное изобретение относится к 4 замещенным аналогам пиперидина, в том числе аналогам гидроксипиперидина и тетра-гидропиридина. Эти аналоги избирательно активны в качестве антагонистов подтипов рецептора Nметил-D-аспартата (NMDA). Данное изобретение относится также к использованию 4 замещенных аналогов пиперидина в качестве нейропротективных агентов для лечения таких состояний, как внезапный мозговой удар, церебральная ишемия, травма центральной нервной системы, гипогликемия, тревога, психоз,глаукома, ретинит, вызываемый CMV, недержание мочи, индуцированная аминогликозидными антибиотиками потеря слуха, судороги,мигрень, хроническая боль, устойчивость к опиоидам или синдром отмены опиоидов или нейродегенеративные расстройства, такие как латиризм, болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. Родственные области Избыточное возбуждение нейротрансмиттерами может вызывать дегенерацию и смерть нейронов. Считают, что эта дегенерация отчасти опосредована возбудительно-токсическим действием аминокислот-возбудителей (ЕАА) глутамата и аспартата при рецепторе N-метил-Dаспартата (NMDA). Это возбудительно-токсическое действие считают ответственным за потерю нейронов в цереброваскулярных расстройствах, таких как церебральная ишемия или церебральный инфаркт, возникающих как результат ряда состояний, таких как тромбоэмболический или геморрагический приступ, спазмы сосудов мозга, гипогликемия, остановка сердца,эпилептический статус, перинатальная асфиксия, гипоксия, такая как при утоплении, легочная хирургия и мозговая травма, а также латиризм, болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона. Известны различные классы замещенных аналогов пиперидина. Например, в ЕР 064744 описаны в общем производные фенилалканола,представленные формулой где R обозначает водород, гидрокси или арилнизший алкилокси; X обозначает водород; Y обозначает гидрокси или водород; или оба X иY, взятые вместе, представляют собой кислород; Z обозначает арил-низший алкил; и m равно целому числу от 1 до 4. Указано, что производные фенилалканола этой ссылки являются антагонистами рецептора NMDA, которые применимы для снижения токсического повреждения центральных нейронов и могут быть использованы для лечения ишемии, удара или гипоксии. В этой ссылке не описаны или не предложены 4-замещенные аналоги пиперидина 2 данного изобретения или их использование в качестве селективных антагонистов подтипов рецептора NMDA. Другие производные пиперидина, имеющие арилалканольные функциональные группы,описаны в РСТ International Publication No. WO 93/11107 (для лечения гипоксии и ишемии), International Publication No. WO 94/10166 (для лечения удара, привыкания, боли, эпилепсии, психоза, травматического повреждения мозга и дегенеративных заболеваний ЦНС), ЕР 0398578(для лечения удара или дегенеративных заболеваний ЦНС, болезни Альцгеймера, болезни Хантингтона и болезни Паркинсона) и РСТ International Publication No. WO 93/02052 (для лечения удара, черепно-мозговой травмы и травмы спинного мозга и дегенеративных заболеваний нервной системы). Как и в ЕР 0648744, каждая из этих ссылок описывает производное пиперидина, имеющее алкилгидрокси или кетогруппу в альфа-положении относительно арильной группы N-1 заместителя. 4-Замещенные аналоги пиперидина данного изобретения отличаются по их типу от производных пиперидина этих ссылок. В ЕР 0445701 описаны в общем производные тетрагидропиридина, представленные формулой: где Ar представляет собой фенил или тиенил,который может иметь один или два идентичных или различных заместителя, выбранных из группы, состоящей из низшего алкила, низшего алкокси, галогена, замещенного или незамещенного фенила, трифторметила и гидрокси; n равно целому числу от 2 до 6; R обозначает гидрокси или группу формулы где R1 обозначает водород или низший алкил;R2 и R3, каждый, обозначает водород или низший алкил или, взятые вместе со смежным атомом азота, могут образовать 5- или 6-членную гетероциклическую группу, которая может быть конденсирована с бензольным кольцом, где гетероциклическая группа может иметь идентичные или различные 1-3 заместителя, выбранные из группы, состоящей из низшего алкила, галогена, оксо, пиримидина, или замещенный или незамещенный фенил; R4 обозначает NH, О или ординарную связь; X1 и X2, каждый, обозначает водород, низший алкил, галоген или гидрокси; р и q, каждый, равны целому числу 0 или 1, за исключением того, что р равно 0, когда q равно 1. Указывается, что эти тетрагидропиридины обладают высокой аффинностью и специфичностью в отношении -рецепторов и, следователь 3 но, могут быть эффективными для лечения депрессии, мании и острой и хронической шизофрении и церебрального ишемического заболевания. Нет описания или предположения селективности в отношении подтипов рецептора где R1 и R2 независимо выбраны из водорода,галогена, метокси или трифторметила, n равно 3 или 4, и Y обозначает -СН 2-, - СН 2 СН 2-, -ОСН 2 или -СН 2 О-. Ссылка указывает, что эти производные пиперидина применимы для лечения мозговых расстройств, слабоумия и других нейродегенеративных нарушений. Не описаны или не предложены 4-замещенные аналоги пиперидина данного изобретения или их использование в качестве селективных антагонистов подтипа рецептора NMDA. В РСТ International Publication No. WO 94/18172 описаны в общем производные имидазолилбензола, представленные формулой где R1, R2 и R3 независимо выбраны из водорода, галогена, нитро, циано, амино, алкила, ацила, фенила или алкокси; R4 обозначает водород,алкил или циклоалкил; Z обозначает -СН 2-,-СН(ОН)- или -СО-; кольцо (а) представляет собой пиперидил или 1-пиперазинил; А обозначает водород, гидрокси или алкил; и В обозначает циклоалкил, циклоалкилалкил, ацил, арил,аралкил, гетероарил или гетероарилалкил. Указывается, что производное имидазолилбензола применимо в качестве антагониста NMDA и ингибитора гибели краниальных нервных клеток. Однако, нет описаний селективности в отношении подтипа рецептора NMDA. В РСТ International Publication No. WO 92/02502 описаны в общем N-гидрокарбил 4 замещенные пиперидины, представленные формулойR1 обозначает водород, C1-8 алкил или фенилС 1-4 алкил;m равно 0-3; и Аr обозначает арил или гетероарил, каждый из которых может быть необязательно замещен; и их соли. Эта ссылка приводит примеры 4-арилоксиалкилпиперидинов. Указывается,что замещенные пиперидины являются блокаторами кальциевых каналов, и ожидается, что они являются применимыми в лечении аноксии,ишемий, в том числе мозгового кровоизлияния,мигрени, эпилепсии, травматического повреждения головы, связанного со СПИДом слабоумия, нейродегенеративных расстройств и привыкания к лекарственным средствам. Ссылка не описывает и не предлагает конкретные 4 замещенные аналоги данного изобретения или их использование в качестве селективных в отношении подтипа рецептора NMDA антагонистов для лечения заболеваний, связанных с ним. В РСТ International Publication No. WO 93/15052 описаны в общем соединения, в отношении которых указывается, что они являются антагонистами кальциевых каналов, представленные широко формулой-СН 2-, k может также быть равно 2, и в этом случае пунктирные линии обозначают простые связи; R обозначает С 1-8 алкил(фенил)р, С 2-8 алкенил(фенил)р, С 2-8 алкинил(фенил)р, С 3-8 циклоалкил или С 1-8 алкилС 3-8 циклоалкил, или R может также обозначать водород, когда k равно 2; р равно 0-2;R1 обозначает водород, С 1-8 алкил или фенилС 1-4 алкил; и Аr обозначает арил или гетероарил, каждый из которых может быть необязательно замещен; при условии, что: когда W обозначает связь, боковая цепь находится в -положении относительно атома азота кольца; когда W обозначает СН 2, k равно 0, боковая цепь находится в 3- или 4-положении пиперидинового кольца, и А представляет собой связь, кислород, серу илиNR1, тогда Аr представляет собой арил, замещенный фенокси или замещенным фенокси, или представляет собой трициклическую гетероа 5 рильную группу, описанную ниже; и, когда W обозначает СН 2 и k равно 2, боковая цепь (СН 2)nА(СН 2)mАr не находится в -положении относительно атома азота. Эта ссылка приводит примеры в основном 2- и 3-замещенных пиперидинов. Кроме того, в конкретной группе 3- и 4-замещенных пиперидинов, описанных в этой ссылке, А должно быть -СН=СН- или -СС-. Эта ссылка не описывает или не предлагает 4 замещенные пиперидиновые аналоги данного изобретения. Более того, нет предположений об использовании 4-замещенных аналогов пиперидина в качестве селективных антагонистов подтипа рецептора NMDA. В European Patent Application235 463 описаны в общем антагонисты кальция,представленные формулой:d и n выбраны из 0 или 1 и пунктирные линии обозначают двойные связи, которые могут образоваться в соответствии с валентностью углерода;z равно 1 или 0 при условии, что z не может быть равно 0 в то же самое время, когда n равно 0, когда один из нижеследующих радикалов присутствует в то же самое время, когда D представляет собой фенил или замещенный фенил: (A)d представляет собой водород, (A)d представляет собой циано, (A)d представляет собой аминокарбонил или двойная связь образуется между -углеродом и углеродом центрального гетероциклического аминокольца; R1 выбран из водорода, низшего алкила, фенила или радикала фенил-низший алкил; R2 выбран из низшего алкила, фенила или радикала фенилнизший алкил; М представляет собой фармацевтически приемлемый ион металла и его фармацевтически приемлемые соли, в том числе кислотно-аддитивные соли, четвертичные соли и их гидраты или алкоголяты. В этой ссылке указано, что такие соединения могут быть применимы в качестве коронарных вазодилятаторов,антигипертензивных средств, средств против аритмии, противоаллергических средств, антигистаминных и противосекреторных средств. Нет предположения или описания 4 замещенных пиперидинов данного изобретения или их использования в качестве селективных в отношении подтипа рецептора NMDA антагонистов. В U.S. Patent5 202 346 описано в основном соединение, представленное формулой циклоалкил или низший алкил, иD может дополнительно иметь значения где R1 обозначает алкилсульфонамидо из 1-6 атомов углерода, арилсульфонамид из 6-10 атомов углерода, -NO2-, -CN, 1-имидазолил или 1,2,4-триазол-1-ил; Y обозначаетR2 обозначает водород, когда n равно 0, в других случаях R2 представляет собой водород или -ОН; n равно 0, 1, 2, 3, 4, 5 или 6; А обозначает или Ar(CH2)1-4, X, Y и Z выбраны из группы,состоящей из водорода, низшего алкила, галогена, 7 где R3 обозначает алкилсульфонамид из 1-6 атомов углерода, арилсульфонамидо из 6-10 атомов углерода, -NO2-, -CN, 1-имидазолил или 1, 2, 4-триазол-1-ил. Указывается, что эти соединения являются средствами против аритмии Класса III. JP 61-115068 описывает производные 4-бензилпиперидинилпропоксианилина, такие как 2-(3-(4-бензил-1-пиперидинил)пропокси) анилин, которые, как указывается, обладают действием против аритмии, а также оказывают местное анестезирующее действие. Нет упоминаний об антагонистах рецептора NMDA и тем более о селективных в отношении подтипа рецептора антагонистах. В U. S. Patent No. 5 036 077 описаны в общем производные пиперидина, представленные формулой: где Аr обозначает фенильную группу, замещенную R2, R3 и R4, или нафт-1-ильную или нафт-2-ильную группу, замещенную или незамещенную 1 или 2 атомами галогена; X обозначает атом кислорода или атом серы; R1 обозначает Н или атом галогена; R2 обозначает атом галогена, трифторметильную группу, фенильную группу, которая является незамещенной или замещена 1-3 атомами галогена, феноксигруппу, которая является незамещенной или замещена 1-3 атомами галогена, или С 1 С 4 алкильная группа и бензильная группа являются заместителями пиперидинового радикала в 2-, 3- или 4-положении. Указывается, что эти пиперидины применимы в качестве антимикробных агентов, но нет описания или предположения относительно лечения нарушений, чувствительных к селективным антагонистам подтипа рецептора NMDA. В European patent application No. 649838 описаны в общем циклизованные амины, представленные формулой где гетероциклы с азотом могут быть 3-8 членными кольцами и замещенными в 2-4 положениях. Аr и Аr' являются необязательно моно- или дизамещенным фенилом. Указано,что эти соединения применимы для лечения аритмии и тахикардии. Однако, нет описаний или предположений о лечении нарушений, чувствительных к селективным антагонистам подтипа рецептора NMDA. В DE patent application No. 4410822 описаны в общем циклизованные амины, представленные формулой:R4 обозначает Н, 1-6 С алкил или Ph, бензил, бензоил, -гидроксибензил или пиридин. Указано, что эти соединения применимы в лечении и терапии заболеваний, которые ослабляются вследствие изменения функции комплекса АМРА-рецептор. Однако нет описания или предположения относительно лечения нарушений, чувствительных к избирательным антагонистам подтипа рецептора NMDA. В U.S. patent No.4 942 169 описаны в общем замещенные пиперидины, представленные формулой где R1 представляет собой замещенный или незамещенный Ph или гетероциклы;R2 обозначает Н, низшую алкильную группу, замещенный или незамещенный бензил,бензоил, пиридил, 2-гидроксиэтил и пиридилметил. Указано, что эти соединения обладают анти-ацетилхолин-эстеразными активностями. Но нет описания или предположения относительно лечения нарушений, чувствительных к селективным антагонистам подтипа рецептораNMDA. В U.S. Patent No.5 169 855 описаны в общем дизамещенные производные простого эфира пиперидина для использования в качестве антипсихотических агентов, избирательные в отношении сигма-рецепторов. Подобным образом, РСТ International PublicationWO 9 92/18127 и РСТ International PublicationWO 91/06297 описывают в общем N-фталимидоалкилпиперидины, которые применимы в качестве антипсихотических агентов и которые являются селективными в отношении сигмарецепторов. Однако в этих ссылках не описаны 4-замещенные аналоги пиперидина данного изобретения и нет упоминания об активности против рецептора NMDA. В многочисленных ссылках были описаны дополнительные производные пиперидина, замещенные в 4- и 3-положении, для использования в различных терапевтических способах. Такие ссылки включают, например, U.S. Patent3 255 196 (3- и 4-замещенные пиперидины,которые являются активными противокашлевыми средствами и обладают анальгезирующим, противорвотным и анестезирующим действием); РСТ International Publication No.WO 88/02365 (3- и 4-замещенные пиперидины, которые применимы для лечения психических расстройств, сопровождающих цереброваскулярное заболевание); BE 860701 (4-замещенные пиперидины для использования в качестве вазодилятаторов и -адренергических ингибиторов);JP 04-312572 (4-замещенные пиперидины, такие как 4-(4-(N,N-диметиламинокарбонил)фенилметил)пиперидин, для лечения церебральной ишемии); JP 61-227565 (4-замещенные производные пиперидина для лечения заболеваний,требующих выделения серотонина); ЕР 0449186(4-замещенные N-аралкилпиперидины, которые являются селективными в отношении антагонистов сигма-рецептора, для лечения физиологического или индуцированного лекарственным средством психоза или дискинезии); и DE 2939292 (4-замещенные пиперидины для использования в качестве противоаллергических и противовоспалительных средств). Ни одна из этих ссылок не описывает или не предлагает 4 замещенные аналоги пиперидина данного изобретения или их использование в качестве селективных антагонистов подтипа рецептораNMDA. Антагонисты рецептора возбуждающих аминокислот, которые блокируют рецепторыNMDA, признаны как ценные в лечении ряда расстройств. Рецепторы NMDA тесно связаны с явлением возбуждающей токсичности (excitotoxicity), которая может быть критической детерминантой исхода некоторых неврологических расстройств. Расстройства, о которых известно, что они чувствительны к блокаде рецептора NMDA, включают острую церебральную ишемию (например, кровоизлияние или мозговая травма), мышечный спазм, судорожные синдромы, невропатическая боль и тревога и могут быть значительным причинным фактором в хронических нейродегенеративных расстройствах, таких как болезнь Паркинсона [Т. Klockgether, L. Turski, Ann. Neurol. 34, 585-593 10 русом иммунодефицита человека (ВИЧ), боковой амиотрофический склероз (ALS), болезнь Альцгеймера [Р.Т. Francis, N.R. Sims, A.W. Procter, D.M. Bowen, J. Neurochem. 60 (5), 1589-1604(1994); и C.F. Bigge, Biochem. Pharmacol. 45,1547-1561 (1993) и цитированные в них ссылки]. Антагонисты рецептора NMDA могут также использоваться для предотвращения переносимости опиатной анальгезии или для способствования контроля симптомов отмены вызывающих привыкание лекарственных средств(Eur. Pat. Appl. 488 959 А). Экспрессионное клонирование первой субъединицы рецептора NMDA, NMDAR1(NR1), в лаборатории Наканиши в 1991 году дало первое представление о молекулярной структуре рецептора NMDA [Nature 354, 31-37(1991)]. Имеется несколько других структурно родственных субъединиц(NMDAR2ANMDAR2D), которые соединяют NR1 в гетеромерные ансамбли с образованием функционального комплекса ионного канала этого рецептора[Annu. Rev. Neurosci. 17, 31-108 (1994)]. Молекулярная гетерогенность рецепторов NMDA предполагает дальнейший потенциал для средств с подтип-селективной фармакологией. Многие свойства нативных рецепторовNMDA наблюдаются в рекомбинантных гомомерных рецепторах NR1. Эти свойства изменяются субъединицами NR2. Рекомбинантные рецепторы NMDA, экспрессируемые в ооцитахXenopus, исследовались с записью на самописце с использованием зажима с напряжением (voltage-clamp), а также исследовалась экспрессия,зависимая от стадии развития и места, мРНК,кодирующих субъединицы рецептора NMDA. Электрофизиологические тесты использовали для характеристики действий соединений при рецепторах NMDA, экспрессируемых в ооцитахXenopus. Соединения тестировали при 4 комбинациях субъединиц клонированных крысиных рецепторов NMDA, соответствующих трем предположительным подтипам рецептораet al, Biochem. Biophys. Res. Commun. 1992, 185,826-832]. Целью данного изобретения является обеспечение новых 4-замещенных аналогов пиперидина, которые функционируют в качестве подтип-селективных антагонистов рецептораNMDA. Дальнейшей целью данного изобретения является обеспечение фармацевтической композиции, содержащей эффективное количество 4 замещенных аналогов пиперидина, для лечения цереброваскулярных расстройств, чувствитель 11 ных к селективной блокаде подтипов рецептораNMDA. Другой целью данного изобретения является обеспечение способа лечения нарушений,чувствительных к подтип-селективным антагонистам рецептора NMDA, у животного путем введения фармацевтически эффективного количества 4-замещенных аналогов пиперидина. Сущность изобретения Данное изобретение относится к новым 4 замещенным аналогам пиперидина, представленным формулой (I) или их фармацевтически приемлемой соли, где Аr1 и Аr2 независимо обозначают арильную или гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидрокси, алкилом, галогеном, нитро,циано, карбоксальдегидом, оксимом альдегида,низший алкоксикарбонилметилом, гидроксинизшим алкилом, аминокарбонилметилом, гидразинокарбонилметилом, ацетамидо, арилом,аралкилом, амино, галогенированной алкильной группой, низший алкил-аминогруппой, низшей алкоксигруппой;z обозначает простую или двойную связь;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2,при условии, что, когда z обозначает двойную связь, X не является О или NR4;R1 обозначает водород или гидрокси; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;R5 обозначает водород или гидрокси, когдаz обозначает простую связь, предпочтительно при условии, что (i) R2 не может быть гидрокси в -положении относительно Ar2; (ii) если X представляет собой простую связь, z представляет собой двойную связь или R5 представляет собой гидрокси и Аr2 представляет собой фенил,то Y не может быть О; (iii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, z представляет собой простую связь, R1 и R5 представляют собой водород и Аr2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iv) если X представляет собой-(CHR3)m-, m равно 2 и R3 представляет собой исключительно водород, то Аr1 не может быть замещен имидазолилом; (v) если Y представляет 12 собой О, n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, z представляет собой простую связь, R1 и R5 представляют собой водород и Аr2 представляет собой фенил или замещенный NO2, CN, 1-имидазолилом или 1,2,4-триазол-1-илом фенил, то X не может быть метиленом, гидроксиметиленом или О; (vi) еслиY представляет собой О или S, R1 и R5 представляют собой водород и R2 представляет собой гидрокси, то X не является метиленом или простой связью; или (vii) если Y представляет собой простую связь, R2 представляет собой исключительно водород и Аr2 представляет собой фенил, то либо R1, либо R5 должен быть гидрокси. Соединения данного изобретения могут существовать в виде оптических изомеров, и соединения изобретения включают как рацемические смеси таких оптических изомеров, так и индивидуальные энантиомеры. Примеры фармацевтически приемлемых аддитивных солей включают аддитивные соли неорганических и органических кислот, такие как гидрохлорид, гидробромид, фосфат, сульфат, цитрат, лактат, тартрат, малеат, фумарат,манделат, оксалат и ацетат. Галоген представляет собой фтор, хлор,бром или иод; предпочтительными являются фтор, хлор и бром. Алкил обозначает прямую или разветвленную цепь из 1-6 атомов углерода или циклический алкил из 3-7 атомов углерода, в том числе,но не только, метил, этил, пропил, изопропил,бутил, изобутил, трет-бутил, пентил, гексил,циклопропил, циклобутил, циклопентил и циклогексил. Арил обозначает моноциклическую или бициклическую карбоциклическую ароматическую кольцевую систему, которая может быть замещенной или незамещенной, например, но не только, фенил, нафтил или т.п. Гетероарил обозначает моноциклическую или бициклическую карбоциклическую ароматическую кольцевую систему, замещенную одним или несколькими гетероатомами, которые могут быть одинаковыми или различными, и включает, например, тиенил, бензо[b]тиенил,нафто[2,3[b]тиенил, тиантренил, фурил, пиранил, изобензофуранил, хроменил, ксантенил,феноксантиинил, 2H-пирролил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, 3H-индолил, индолил, индазолил, пуринил,4H-хинолизинил, изохинолил, хинолил, фтализинил, нафтиридинил, хинозалинил, циннолинил, птеридинил, 5 аН-карбозолил, карбозолил,-карболинил, фенантридинил, акридинил, перимидинид, фенантролинил, феназинил, изотиазолил, фенотиазинил, изоксазолил, фуразинил,феноксазинил, хиноксалинил, 2,3-диоксохиноксалинил, бензимидазолил, 2-оксобензимидазолил, 2-оксиндолил, 2-тиоксобензимидазол, 13 пиразоло[3,4-d]пиримидинил, 4-гидроксипиразоло[3,4-d]пиримидинил и 2-метилбензимидазолил. Аралкил обозначает любую из алкильных групп, определенных здесь, замещенную любой из арильных групп, определенных здесь. Галогенированный алкил обозначает любую из алкильных групп, определенных здесь,замещенную одним или несколькими галогенами, определенными здесь. Низший алкиламино обозначает любую из алкильных групп, определенных здесь, замещенную аминогруппой. Низший алкокси обозначает алкоксигруппу, содержащую алкильную группу, определенную здесь. Данное изобретение относится также к фармацевтической композиции, содержащей соединение, определенное формулой I, в количестве, эффективном для лечения цереброваскулярных нарушений, чувствительных к селективной блокаде подтипов рецептора NMDA, и фармацевтически приемлемый носитель. Примеры нарушений, чувствительных к такому лечению, включают церебральную ишемию, вызванную травмой мозга, кровоизлиянием, гипогликемией, сердечным приступом и хирургией; тревожный психоз, шизофрению; глаукому; ретинит CMV; индуцированную аминогликозидными антибиотиками потерю слуха; недержание мочи, устойчивость к опиоидам или синдром отмены опиоидов; и хронические нейродегенеративные расстройства, такие как болезнь Хантингтона, ALS, Паркинсонизм и болезнь Альцгеймера. Фармацевтическая композиция данного изобретения может быть также использована в качестве анальгезирующего средства или для лечения эпилепсии или мигреней. Данное изобретение относится также к способу лечения нарушений, чувствительных к селективной блокаде подтипов рецептора Nметил-D-аспартата, у животного, страдающего от такого нарушения, предусматривающему введение в стандартной дозированной форме, по меньшей мере, одного соединения, представленного формулой (I) или его фармацевтически приемлемой соли, где Аr1 и Аr2 независимо обозначают арильную или гетероарильную группу, каждая из которых может быть независимо замещена водородом, гидрокси, алкилом, галогеном, нитро,циано, карбоксальдегидом, оксимом альдегида,низший алкоксикарбонилметилом, гидроксинизшим алкилом, аминокарбонилметилом, гидразинокарбонилметилом, ацетамидо, арилом,аралкилом, амино, галогенированной алкильной группой, низший алкил-аминогруппой или низшей алкоксигруппой;z обозначает простую или двойную связь;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2,при условии, что, когда z обозначает двойную связь, X не является О или NR4;R1 обозначает водород или гидрокси; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Y обозначает О, S, NR4 или является простой связью; иR5 обозначает водород или гидрокси, когдаz обозначает простую связь. Краткое описание чертежей Фиг. 1 и 2 являются диаграммами в виде столбцов, иллюстрирующими средний объем инфаркта в коре и подкорке после введения invivo соединений данного изобретения грызунам. Подробное описание изобретения Новые 4-замещенные аналоги пиперидина данного изобретения представлены приведенной ранее формулой (I). Как правило, Y обозначает О или простую связь. Предпочтительно, R1 или R5 представляют собой гидрокси. Кроме того, Аr2 предпочтительно представляет собой гетероарильную группу, например, бензимидазол-2-он, индол-2-он или хиноксалин-2,3-дион. Предпочтительные воплощения новых 4 замещенных аналогов пиперидина данного изобретения представлены формулами (II-XI). В частности, первое воплощение представлено формулой (II) или фармацевтически приемлемой солью такого соединения, где Аr1 и Аr2 имеют независимо значения, определенные ранее для формулы (I);z обозначает простую или двойную связь;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2,при условии, что, когда z обозначает двойную связь, X не является О или NR4;R1 обозначает водород или гидрокси; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода; n равно 0, 1, 2, 3 или 4; иY обозначает О, S, NR4 или является простой связью, предпочтительно при условии, что(i) R2 не может быть гидрокси в -положении 15 относительно Ar2; (ii) если X представляет собой простую связь, z представляет собой двойную связь и Аr2 представляет собой фенил, то Y не может быть О; (iii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, R1 представляет собой водород и Аr2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iv) если X представляет собой (CHR3)m-, m равно 2 и R3 представляет собой исключительно водород, то Аr1 не может быть замещен имидазолилом; (v) если Y представляет собой О, n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, R1 представляет собой водород и Аr2 представляет собой фенил или замещенный NO2, CN, 1- имидазоилом или 1,2,4-триазол-1-илом фенил, то X не может быть метиленом, гидроксиметиленом или О; (vi) еслиY представляет собой О или S, R1 представляет собой водород и R2 представляет собой гидрокси, то X не является метиленом или простой связью; или (vii) если Y представляет собой простую связь, R2 представляет собой исключительно водород и Аr2 представляет собой фенил,то R1 должен быть гидрокси. Другое воплощение новых 4-замещенных пиперидинов данного изобретения представлено формулой (III) или его фармацевтически приемлемой солью,где Аr1 и Аr2 имеют независимо значения, определенные ранее для формулы (I);R1 обозначает водород или гидрокси; каждый R2 и R3 независимо обозначают водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода; n равно 0, 1, 2, 3 или 4; иY обозначает О, S, NR4 или является простой связью, предпочтительно при условии, что(i) R2 не может быть гидрокси в -положении относительно Аr2; (ii) если Y представляет собой О, n равно 3 или 4, R2 представляет собой исключительно водород, R1 представляет собой водород и Аr2 представляет собой фенил или замещенный галогеном, метокси или трифторметилом фенил, то X не может быть метиленом или этиленом; (iii) если Y представляет собой О,n равно 2, 3 или 4, R2 представляет собой водород или гидрокси, R1 представляет собой водород и Аr2 представляет собой фенил или замещенный NO2, CN, 1-имидазоилом или 1,2,4 триазол-1-илом фенил, то R3 не может быть водородом; (iv) если Y представляет собой О илиS, R1 представляет собой водород и R2 представляет собой гидрокси, то R3 не может быть водородом; или (v) если Y представляет собой простую связь, R2 представляет собой исключи 001323 16 тельно водород и Аr2 представляет собой фенил,то R1 должен быть гидрокси. Дополнительное воплощение новых 4 замещенных пиперидинов данного изобретения представлено формулой (IV) или его фармацевтически приемлемой солью,где Аr1 и Аr2 имеют независимо значения,определенные ранее для формулы (I);R1 обозначает водород или гидрокси; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Y обозначает О, S, NR4 или является простой связью, предпочтительно при условии, что(i) R2 не может быть гидрокси в альфаположении относительно Аr2; или (ii) если Y представляет собой простую связь, О или S, тоR2 не является гидрокси. Еще одно воплощение данного изобретения представлено формулой (V) или его фармацевтически приемлемой солью, где Аr1 и Аr2 имеют независимо значения, определенные ранее для формулы (I); каждый R2 и R3 независимо обозначают водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода; n равно 0, 1, 2, 3 или 4; иY обозначает О, S, NR4 или является простой связью, предпочтительно при условии, чтоR2 не может быть гидрокси в -положении относительно Аr2. Еще одно воплощение данного изобретения представлено формулой (VI) или его фармацевтически приемлемой солью,где Аr1 и Аr2 имеют независимо значения, определенные ранее для формулы (I); каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Q обозначает О, S, NR4 или является простой связью. Еще одно воплощение данного изобретения представлено формулой (VII) или его фармацевтически приемлемой солью,где 17 Аr1 и Аr2 имеют независимо значения, определенные ранее для формулы (I); каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Q обозначает О, S, NR4 или является простой связью. Еще одно воплощение данного изобретения представлено формулой (VIII) или его фармацевтически приемлемой солью,гдеR5 представляет собой водород или гидрокси;R представляет собой водород, гидрокси,алкил, галоген, нитро, циано, карбоксальдегид,оксим альдегида, низший алкоксикарбонилметил, гидрокси-низший алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо,арил, аралкил, амино, галогенированную алкильную группу, низший алкил-аминогруппу или низшую алкоксигруппу; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Y обозначает О, S, NR4 или является простой связью;R3 независимо обозначает водород, гидрокси или низшую алкильную группу, имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода иR5 обозначает водород или гидрокси. Еще одно воплощение данного изобретения представлено формулой (IX) или его фармацевтически приемлемой солью,гдеR5 представляет собой водород или гидрокси;R представляет собой водород, гидрокси,алкил, галоген, нитро, циано, карбоксальдегид,оксим альдегида, низший алкоксикарбонилметил, гидрокси-низший алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо,арил, аралкил, амино, галогенированную алкильную группу, низший алкил-аминогруппу или низшую алкоксигруппу; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Y обозначает О, S, NR4 или является простой связью;R5 обозначает водород или гидрокси;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2; иR' независимо обозначает водород или алкил. Еще одно воплощение данного изобретения представлено формулой (X) или его фармацевтически приемлемой солью,гдеR5 представляет собой водород или гидрокси;R представляет собой водород, гидрокси,алкил, галоген, нитро, циано, карбоксальдегид,оксим альдегида, низший алкоксикарбонилметил, гидрокси-низший алкил, аминокарбонилметил, гидразинокарбонилметил, ацетамидо,арил, аралкил, амино, галогенированную алкильную группу, низший алкил-аминогруппу или низшую алкоксигруппу; каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;Y обозначает О, S, NR4 или является простой связью;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;R5 обозначает водород или гидрокси; иR' обозначает водород или алкил. Еще одно воплощение данного изобретения представлено формулой (XI) или его фармацевтически приемлемой солью,гдеn равно 0, 1, 2, 3 или 4; Аr2 имеет значение, определенное ранее для формулы (I); каждый R2 независимо обозначает водород, гидрокси или низшую алкильную группу,имеющую 1-6 атомов углерода;X обозначает -(CHR3)m-, О, S или NR4, где каждый R3 независимо обозначает водород,гидрокси или низшую алкильную группу, 19 имеющую 1-6 атомов углерода, R4 обозначает водород или низшую алкильную группу, имеющую 1-6 атомов углерода, и m равно 0, 1 или 2;Y обозначает О, S, NR4 или является простой связью; иR5 обозначает водород или гидрокси. Примеры предпочтительных соединений формулы I включают, без ограничений: 4-фенокси-1-[(4-фторфенокси)пропил]пиперидин; 1-(3-феноксипропил)-4-фенилпиперидин; 1-(2-феноксиэтил)-4-фенилпиперидин; 1-(4-феноксибутил)-4-фенилпиперидин; 1-(4-(3-(трифторметил)фенокси)бутил)-4 фенилпиперидин; 1-(2-(4-аминофенокси)этил)-4 бензилпиперидин; 3-2-(4-бензилпиперидин-1-ил)этил)окси) бензальдегид; 3-2-(4-бензилпиперидин-1-ил)этил)окси) бензальдегид оксим; 4-бензил-1-(2-(3-(этоксикарбонилметил) фенокси)этил)пиперидин; 4-бензил-1-(2-(3-(2-гидроксиэтил)фенокси) этил)пиперидин; 1-(2-(3-(аминокарбонилметил)фенокси) этил)-4-бензилпиперидин; 4-бензил-1-(2-(3(гидразинокарбонилметил)фенокси)этил)пиперидин; 4-бензил-1-(1-метил-2-феноксиэтил)пиперидин; 4-(4-хлорбеызил)-1-(2-(4-фторфенокси) этил)пиперидин; 4-(4-хлорбензил)-1-(2-(4-хлорфенокси) этил)пиперидин; 1-(2-(4-аминофенокси)этил)-4-(4-хлорбензил)пиперидин; 4-(4-хлорбензил)-1-(2-(3-(2-гидроксиэтил) фенокси)этил)пиперидин; 4-(4-фторбензил)-1-(2-(4-фторфенокси) этил)пиперидин; 4-(4-фторбензил)-1-(2-(4-хлорфенокси) этил)пиперидин; 1-(2-(4-фторфенокси)этил)-4-(4-метоксибензил)пиперидин; 1-(2-(4-фторфенокси)этил)-4-(4-нитробензил)пиперидин; 4-бензил-1-(1-метил-3-феноксипропил) пиперидин; 1-(2-феноксиэтил)-4-фенилпиперидин; 3-гидрокси-1-(2-феноксиэтил)-4-(3 трифторметилфенил)пиперидин; 3-гидрокси-1-(3-феноксипропил)-4-(3 трифторметилфенил)пиперидин; 4-бензил-1-[2-(6 хинолинокси)этил]пиперидин; 4-бензил-1-[2-(8 хинолинокси)этил]пиперидин; 4-бензил-1-[2-(2-амино-3-нитрофенокси) этил]пиперидин; 23 4-бензил-1-(2-(2-оксобензоксазол-5-окси) этил)пиперидин; 4-бензил-1-(2-(2-оксобензоксазол-6-окси) этил)пиперидин; 4-бензил-1-(2-(2-гидроксинафт-6-окси) этил)пиперидин; 4-бензил-1-(2-(3-гидроксинафт-6-окси) этил)пиперидин; 4-(4-фторбензил)-1-(2-(2-гидроксинафт-6 окси)этил)пиперидин; 4-(4-метилбензил)-1-(2-(2-гидроксинафт-6 окси)этил)пиперидин; 4-бензил-1-(2-(3-метил-2-оксобензимидазол-5-окси)этил)пиперидин; 4-бензил-1-(2-(2-oкco-l,3-дигидроиндол-5 окси)этил)пиперидин; 4-(4-фторбензил)-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин и их фармацевтически приемлемые соли. Данное изобретение относится также к способу лечения расстройств, чувствительных к селективной блокаде подтипов рецептораNMDA, у животных, страдающих от этих расстройств. Конкретные предпочтительные воплощения 4-замещенных аналогов пиперидина для использования в способе данного изобретения представлены описанными ранее формулами(II-XI). Примеры предпочтительных селективных в отношении подтипа рецептора NMDA антагонистических соединений, которые могут быть использованы в способе данного изобретения,включают, без ограничения: 1-(2-феноксиэтил)-4-фенилпиперидин; 1-(4-(3-(трифторметил)фенокси)бутил)-4 фенилпиперидин; 4-бензил-1-(2-(4-хлорфенокси)этил)пиперидин; 4-бензил-1-(2-(4-нитрофенокси)этил)пиперидин; 1-(2-(4-аминофенокси)этил)-4-бензилпиперидин; 4-бензил-1-(2-(4-цианофенокси)этил)пиперидин; 3-2-(4-бензилпиперидин-1-ил)этил)окси) бензальдегид; 3-2-(4-бензилпиперидин-1-ил)этил)окси) бензальдегидоксим; 4-бензил-1-(2-(3-(этоксикарбонилметил) фенокси)этил)пиперидин; 4-бензил-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин; 1-(2-(3-аминокарбонилметил)фенокси) этил)-4-бензилпиперидин; 4-бензил-1-(2-(3(гидразинокарбонилметил)фенокси)этил)пиперидин; 4-бензил-1-(1-метил-2 феноксиэтил)пиперидин; 4-бензил-1-(3-(3-фторфенокси)пропил)пиперидин; 28 4-бензил-1-(2-(2-иминобензимидазол-5 окси)этил)пиперидин; 4-(4-метилбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин; 4-(4-фторбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин; 4-(4-хлорбензил)-1-(2-(2-тиоксобензимидазол-5-окси)этил)пиперидин; 4-бензил-1-(2-(2-оксобензоксазол-5-окси) этил)пиперидин; 4-бензил-1-(2-(2-оксобензоксазол-6-окси) этил)пиперидин; 4-бензил-1-(2-(2-гидроксинафт-6-окси) этил)пиперидин; 4-бензил-1-(2-(3-гидроксинафт-6-окси) этил)пиперидин; 4-(4-фторбензил)-1-(2-(2-гидроксинафт-6 окси)этил)пиперидин; 4-(4-метилбензил)-1-(2-(2-гидроксинафт-6 окси)этил)пиперидин; 4-бензил-1-(2-(3-метил-2-оксобензимидазол-5-окси)этил)пиперидин; 4-бензил-1-(2-(2-oкco-l,3-дигидроиндол-5 окси)этил)пиперидин; 4-(4-фторбензил)-1-(2-(2-оксо-1,3-дигидроиндол-5-окси)этил)пиперидин и их фармацевтически приемлемые соли. Соединения данного изобретения могут быть получены при помощи способов, хорошо известных специалистам в данной области. Приведенные в качестве примеров схемы реакций I, II и III иллюстрируют способы получения соединений данного изобретения. Исходные материалы, используемые в Схемах I, II и III,являются легкодоступными или могут быть получены известными способами. Схема IR2 и R5 = Н или ОН, но R1 и R5 оба не являются ОН. Схема II Соединения данного изобретения применимы в лечении или профилактике потери нейронов, нейродегенеративных заболеваний и хронической боли. Они также применимы в качестве противосудорожных средств и для анестезии, а также для лечения эпилепсии и психоза. Терапевтические профили и профили побочных действий подтип-селективных антагонистов и агонистов рецептора NMDA должны значительно отличаться от ингибиторов, неселективных в отношении подтипа рецептора NMDA. Ожидается, что подтип-селективные аналоги данного изобретения проявляют мало неблагоприятных побочных действий или вообще не проявляют таких действий, вызываемых неспецифическим связыванием с другими рецепторами, в частности, с РСР- и глутаматсвязывающими сайтами, ассоциированными с рецепторомNMDA. Кроме того, селективность в отношении различных подтипов рецептора NMDA будет уменьшать побочные эффекты, такие как седативный эффект, которые являются обычными для антагонистов, неселективных в отношении подтипа рецептора NMDA. Соединения данного изобретения эффективны в лечении или профилактике неблагоприятных последствий гиперактивности возбуждающих аминокислот, например, аминокислот, которые участвуют в системе рецептора NMDA, путем предотвращения открывания лиганд-воротных катионных каналов и создания возможности избыточного вхождения Са в нейроны, как это имеет место при ишемии. Нейродегенеративные заболевания, которые могут лечиться соединениями данного изобретения, включают заболевания, выбранные из группы, состоящей из болезни Альцгеймера,бокового амиотрофического склероза, болезни Хантингтона, болезни Паркинсона и синдрома Дауна. Соединения данного изобретения находят применение в лечении или профилактике потери нервных клеток, связанной со множественными кровоизлияниями, которые усиливают слабоумие. После установления диагноза, свидетельствующего о том, что пациент страдает от мозгового удара, соединения данного изобрете 001323 30 ния могут вводиться для ослабления немедленной ишемии и для предотвращения дальнейшего повреждения нервных клеток, которое может иметь место вследствие рецидивных кровоизлияний. Кроме того, соединения данного изобретения способны пересекать гематоэнцефалический барьер, что делает их особенно ценными для лечения или профилактики состояний, в которые вовлечена центральная нервная система. Соединения данного изобретения находят применение, в частности, в лечении или профилактике вредных неврологических последствий хирургии. Например, коронарное шунтирование требует применения аппарата "сердце-легкие",который может вводить воздушные пузырьки в кровеносную систему, которые могут застревать в мозгу. Присутствие таких воздушных пузырьков отнимает кислород у нейронной ткани, приводя к аноксии и ишемии. Пред- или постхирургическое введение соединений данного изобретения будет лечить или предотвращать возникающую ишемию. В предпочтительном воплощении соединения данного изобретения вводят пациентам, подвергающимся хирургии с аппаратом искусственного кровообращения или хирургии с эндартерэктомией. Соединения данного изобретения также находят применение в лечении или профилактике хронической боли. Такая хроническая боль может быть результатом хирургии, травмы, головной боли, артрита, боли в конечной стадии рака или дегенеративных заболеваний. Соединения данного изобретения находят также конкретное применение в лечении фантомной боли,которая возникает при ампутации конечности. Ожидается также, что, кроме лечения боли, соединения данного изобретения будут применимы в индуцировании анестезии, общей или местной, например, во время хирургического вмешательства. Селективные антагонисты, агонисты и модуляторы подтипов рецептора NMDA могут тестироваться на противосудорожную активность in vivo после внутрибрюшинной или внутривенной инъекции с применением ряда противосудорожных тестов на мышах (модель рефлекторного слухового эпилептического припадка у мышей DBA-2, индуцированные пентилентетразолом судороги у мышей, тест максимального припадка от электрошока (MES) илиNMDA-индуцированная смерть). Эти соединения могут быть также испытаны в тестах дискриминации лекарственных средств на крысах,обученных отличать РСР от физиологического раствора. Ожидается, что большинство соединений данного изобретения будут отличать РСР при любой дозе. Кроме того, ожидается также,что ни одно из этих соединений не вызовет поведенческого возбуждения в тестах локомоторной активности у грызунов. Ожидается, что та 31 кие результаты позволят предположить, что селективные антагонисты и агонисты подтипа рецептора NMDA не будут проявлять РСРподобных поведенческих побочных действий,которые являются обычными для блокаторов каналов NMDA, таких как МК-801 и РСР, или для конкурентных антагонистов NMDA, таких как CGS 19755. Ожидается также, что селективные антагонисты и агонисты подтипа рецептора NMDA будут проявлять сильную активность in vivo после внутрибрюшинной или внутривенной инъекции, что предполагает, что эти соединения могут проникать через гематоэнцефалический барьер. Повышенные уровни глутамата связаны с глаукомой. Кроме того, было выяснено, что лечение глаукомы, в частности, защита ганглиозных клеток сетчатки, может быть достигнуто введением пациенту соединения, способного уменьшать индуцируемую глутаматом возбуждающую токсичность, в концентрации, эффективной для снижения возбуждающей токсичности. См. WO 94/13275. Таким образом, ожидается, что соединения данного изобретения, которые, как ожидается, пересекают гематоретинальный барьер, могут быть также применимы в лечении глаукомы. Предпочтительно,данное изобретение относится к лечению пациентов, которые имеют первичную открытоугольную глаукому, хроническую закрытоугольную глаукому, псевдоэксфолиацию или другие типы глаукомы или глазного повышенного давления. Предпочтительно, соединение вводят на протяжении длительного периода (например, по меньшей мере, шесть месяцев и предпочтительно, по меньшей мере, один год) ,независимо от изменений во внутриглазном давлении пациента на протяжении периода введения. Соединения данного изобретения применимы также в лечении CMV-ретинита, в частности, в сочетании в антивирусными агентами.CMV (цитомегаловирус) воздействует на слой ганглиозных клеток, что может привести к высоким уровням глутамата. Таким образом, антагонисты рецептора NMDA могли бы блокировать ретинит ингибированием эффекта токсичности высоких уровней глутамата. Аминогликозидные антибиотики успешно использовали в лечении тяжелых инфекций,вызываемых грамотрицательными бактериями. Однако, пролонгированное лечение этими антибиотиками приводит к разрушению сенсорных слуховых клеток внутреннего уха и вследствие этого индуцирует перманентную потерю слуха. Недавнее исследование Basile et al. (NatureMedicine, 2:1338-1344, 1996) показало, что аминогликозиды вызывают полиамин-подобное усиление глутаматной возбуждающей токсичности через их взаимодействие с рецепторомNMDA. Таким образом, соединения данного изобретения с антагонистической в отношении 32 рецептора NMDA активностью будут полезны в профилактике индуцируемой аминогликозидными антибиотиками потери слуха вследствие антагонизма во взаимодействии с рецептором. Соединения данного изобретения применимы в лечении головной боли, в частности,мигреней. Во время приступа мигрени сенсорное нарушение с уникальными изменениями мозгового кровообращения будет приводить к развитию характерной ауры (предвестника) мигрени. Поскольку эти уникальные феномены были воспроизведены в экспериментах на животных с корковым распространением депрессии (CSD) Lea, A.A.P.J., Neurophysiol. 7:359390 (1944), CSD считают важными феноменами в патофизиологии мигрени с предвестником приступа (аурой) (Tepley et al., In: Biomagnetism,eds. S. Williamson, L. Kaufmann, pp. 327-330,Plenum Press, New York (1990. CSD связано с распространением (2 6 мм/с) преходящих изменений в электрической активности, которые связаны с нарушением ионного гомеостаза в мозгу, истечением возбуждающих аминокислот из нейронов и повышенным энергетическим обменом (Lauritzen, M., Acta Neurol. Scand. 76(Suppl. 113):4-40 (1987. Было показано, что инициация CSD у множества животных, в том числе человека, сопровождалась высвобождением глутамата и могла запускаться NMDALauritzen et al., Brain Res. 475:317-327 (1988. Подтип-селективные антагонисты NMDA будут терапевтически ценными для мигреней вследствие их ожидаемых низких побочных эффектов,их способности пересекать гематоэнцефалический барьер и их системной биодоступности. Активность мочевого пузыря контролируется парасимпатическими преганглиозными нейронами в крестцовом спинном мозгу (DeGroat et al., J. Auton Nerv. Sys. 3:135-160 (1981. Было показано, что у человека наивысшая плотность рецепторов NMDA в спинном мозгу локализована на уровне крестца и включает те зоны,которые предположительно содержат парасимпатические преганглиозные нейроны мочевого пузыря (Shaw et al., Brain Research 539:164-168(1991. Поскольку рецепторы NMDA являются возбуждаемыми по их природе, фармакологическая блокада этих рецепторов подавляла бы активность мочевого пузыря. Было показано, что неконкурентный антагонист МК 801 рецептораNMDA увеличивал частоту мочеиспускания у крыс (Vera and Nadelhaft, Neuroscience Letters 134:135-138 (1991. Кроме того, было показано,что конкурентные антагонисты рецептораNMDA вызывают зависимое от дозы ингибирование активности мочевого пузыря и активность сфинктера матки (US Patent 5 192 751). Таким образом, понятно, что подтип-селективные антагонисты рецептора NMDA будут эффективны в лечении недержания мочи, благодаря их модулированию активности рецепторного канала. 33 Было показано, что неконкурентный антагонист МК 801 рецептора NMDA эффективен во многих животных моделях тревоги, которые могут предсказать результаты для действия на тревогу человека (Clineschmidt, B.V. et al., DrugDev. Res. 2:147-163 (1982. Кроме того, было показано, что антагонисты глицинового сайта рецептора NMDA являются эффективными в крысином тесте на испугPharmacol. 250:317-324 (1993, а также в нескольких других животных анксиолитических моделях (Winslow, J. et al., Eur. J. Pharmacol. 190:11-22 (1990); Dunn, R. et al., Eur. J. Pharmacol. 214:207-214 (1992); и Kehne, J.H. et al., Eur.J. Pharmacol. 193:283-292 (1981. Было обнаружено, что антагонисты глицинового сайта, (+)НА-966 и 5,7-дихлоркинуреновая кислота проявляют селективный антагонизм в отношении индуцированной dамфетамином стимуляции при введении в nucleus accumbens крысы, но не в полосатое тело(Hutson, P.H. et al., Br. J. Pharmacol. 103:20372044 (1991. Интересно, что было обнаружено,что (+)НА-966 блокирует индуцированное РСР и МК 801 поведенческое возбуждение (Bristow,L.J. et al., Br. J. Pharmacol. 108:1156-1163(1993. Эти открытия предполагают потенциальное использование модуляторов канала рецептора NMDA, но не блокаторов канала, в качестве атипичных нейролептиков. Было показано, что в животной модели болезни Паркинсона -индуцированное МРР+ или метамфетамином повреждение допаминергических нейронов - может ингибироваться антагонистами рецептора NMDA (Rojas et al., DrugDev. Res. 29:222-226 (1993); и Sonsalla et al., Science 243:398-400 (1989. Кроме того, было показано, что антагонисты рецептора NMDA ингибируют индуцированную галоперидолом каталепсию (Schmidt, W.J. et al., Amino Acids 1:225-237 (1991, увеличивают активность у грызунов с недостатком моноаминов (Carlssonet al., Trends Neurosci. 13:272-276 (1990 и увеличивают ипсилатеральное вращение после одностороннего повреждения substantia nigra у крыс (Snell, L.D. et al., J. Pharmacol. Exp. Ther. 235:50-57 (1985. Существуют также животные модели болезни Паркинсона. В исследованиях на животных средства против болезни Паркинсона амантадин и мемантин обнаружили подобную активность у животных на цитоплазматических уровнях, приводящую к антагонизму в отношении рецептора NMDA (Danysz, W. et al.,J. Neural Trans. 7:155-166 (1994. Таким образом, возможно, что эти средства против болезни Паркинсона действуют терапевтически через антагонизм в отношении рецептора NMDA. Таким образом, баланс активности рецептораNMDA может быть важным для регуляции экстрапирамидальной функции, связанной с возникновением симптомов паркинсонизма. 34 Хорошо известно использование опиатов,например, морфина, в области облегчения боли.(В применении здесь, термин "опиаты" обозначает любой препарат или производное опиума, в частности, алкалоиды, природно содержащиеся в нем, которых имеется приблизительно двадцать, например, морфин, носкапин, кодеин,папаверин и тебаин и их производные). К сожалению, при продолжительном использовании организм вырабатывает устойчивость в отношении опиата и, следовательно, для непрерывного облегчения боли пациент должен получать прогрессивно увеличивающиеся дозы. Устойчивость развивается как после "острого", так и после хронического введения морфина (Kornetsky et al., Science 162:1011-1012 (1968); Way et(1976); Lutfy et al., J. Pharmacol. Exp. Ther. 256:575-580 (1991. Это, само по себе, может быть пагубным для здоровья пациента. Кроме того, может наступить время, когда устойчивость становится по существу полной, и ослабляющие боль свойства лекарственного средства перестают быть эффективными. Кроме того,введение более высоких доз морфина может привести к угнетению дыхания, вызывая остановку дыхания пациента. Поиск альтернативных лекарственных средств для достижения анальгезии без развития устойчивости или в виде дополнительной терапии для блокирования устойчивости без нарушения анальгезии является активной областью исследований. Недавние исследования позволили предположить модуляторную роль рецептора NMDA в устойчивости к морфину. (Trujillo et al., Science 251:85-87 (1991); Marek et al., Brain Res. 547:77-81 (1991; Tiseo et al., J. Pharmacol. Exp.Res. 616:83-88 (1993); Herman et al., Neuropsychopharmacology 12:269-294 (1995. Далее, сообщалось, что антагонисты рецептора NMDA применимы для ингибирования опиоидной устойчивости и симптомов отмены опиоидов. Таким образом, данное изобретение относится также к введению описанных в нем соединений для ингибирования опиатной устойчивости и для лечения или ослабления симптомов опиатной отмены путем блокирования глицинового ко-агонистического сайта, связанного с рецептором NMDA. Таким образом, данное изобретение относится к соединениям, имеющим высокую аффинность в отношении конкретного подтипа рецептора NMDA и низкую аффинность в отношении других сайтов, таких как рецепторы допамина и других катехоламинов. Согласно данному изобретению, соединения, имеющие высокое связывание с конкретной субъединицейNMDA, обнаруживают IC50, равную приблизительно 100 мкМ или менее в тесте связывания субъединицы NMDA (см. таблицу 1). Предпоч 35 тительно, соединения данного изобретения обнаруживают селективную IC50 для субъединицы 10 мкМ или менее. Наиболее предпочтительно,соединения данного изобретения обнаруживают селективную IC50 для субъединицы приблизительно 1,0 мкМ или менее. Композиции в объеме данного изобретения включают все композиции, в которых соединения данного изобретения содержатся в количестве, которое эффективно для достижения намеченной цели. Хотя потребности индивидуума варьируют, определение оптимальных пределов эффективных количеств каждого компонента находится в пределах квалификации в данной области. Как правило, соединения могут вводиться млекопитающим, например, людям,перорально в дозе 0,0025-50 мг/кг или эквивалентного количества их фармацевтически приемлемой соли, в день на вес тела млекопитающего, получающего лечение по поводу нарушений в виде тревоги, например, общих тревожных симптомов, фобий, навязчивых компульсивных расстройств, состояния паники и посттравматических стрессовых состояний. Предпочтительно, от около 0,01 до около 10 мг/кг вводят перорально для лечения или предотвращения таких расстройств или в случае шизофрении или других психозов. Для внутримышечной инъекции доза составляет обычно 1/2 от пероральной дозы. Например, для лечения или предотвращения тревоги подходящей внутримышечной дозой является доза от около 0,0025 до около 15 мг/кг и, наиболее предпочтительно, от около 0,01 до около 10 мг/кг. В способе лечения или предотвращения потери нейронов в случае ишемии, травмы головного или спинного мозга, гипоксии, гипогликемии и хирургии, для лечения или профилактики глаукомы или недержания мочи, а также для лечения болезни Альцгеймера, амиотрофического бокового склероза, болезни Хантингтона, болезни Паркинсона и Синдрома Дауна или в способе лечения заболевания, при котором патофизиология нарушения включает гиперактивность возбуждающих аминокислот или связанную с ионным каналом рецептора NMDA нейротоксичность, фармацевтические композиции данного изобретения могут содержать соединения данного изобретения при уровне стандартной дозы от около 0,01 до около 50 мг/кг веса тела или эквивалентное количество фармацевтически приемлемой соли, либо в виде "острой" (болюсной) внутривенной инъекции, внутривенной инфузии, либо в режиме 1-4 раза в день. При применении для лечения хронической боли, мигрени, для достижения анестезии, для лечения или предотвращения опиатной устойчивости или для лечения синдрома отмены опиата, соединения данного изобретения могут вводиться при уровне стандартной дозы от около 0,01 до около 50 мг/кг веса тела или эквивалентного количества их фармацевтически при 001323 36 емлемой соли, в режиме 1-4 раза в день. Конечно, должно быть понятно, что точный уровень дозы будет зависеть от истории болезни животного, например, человека, подвергаемого лечению. Точный уровень дозы может быть определен специалистом с обычной квалификацией в данной области, внося соответствующие изменения. Пероральная стандартная доза может содержать от около 0,01 до около 50 мг, предпочтительно от около 0,1 до около 10 мг соединения. Эта стандартная доза может вводиться один раз или несколько раз в день в виде одной или нескольких таблеток, каждая из которых содержит от около 0,1 до около 10, предпочтительно от около 0,25 до 50 мг соединения или его сольватов. Кроме введения соединения в виде химиката, соединения данного изобретения могут вводиться как часть фармацевтического препарата, содержащего подходящие фармацевтически приемлемые носители, включающие наполнители и вспомогательные вещества, которые облегчают обработку соединений в препараты,которые могут быть использованы фармацевтически. Предпочтительно, препараты, в частности, препараты, которые могут вводиться перорально и которые могут быть использованы для этого предпочтительного типа введения, такие как таблетки, драже и капсулы, а также препараты, которые могут вводиться ректально, такие как суппозитории, а также подходящие растворы для введения инъекций или перорально, содержат от около 0,01 до 99%, предпочтительно от около 0,25 до 75% активного соединения (соединений), вместе с наполнителем. В объем данного изобретения включены также нетоксичные фармацевтически приемлемые соли соединений данного изобретения. Кислотно-аддитивные соли образованы смешиванием раствора конкретного селективного антагониста или агониста подтипа рецептора NMDA с раствором фармацевтически приемлемой нетоксичной кислоты, такой как соляная кислота,фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, лимонная кислота, винная кислота, угольная кислота, фосфорная кислота, щавелевая кислота и т.п. Фармацевтические композиции данного изобретения могут вводиться любому животному, которое может испытывать благоприятные эффекты соединений данного изобретения. Прежде всего, среди таких животных находятся млекопитающие, например, люди, хотя изобретение не должно ограничиваться таким образом. Фармацевтические композиции данного изобретения могут вводиться любым способом,который позволяет достичь намеченную цель. Например, введение может быть парентеральным, подкожным, внутривенным, внутримышечным, внутрибрюшинным, чрескожным или буккальным. Альтернативно или совместно, 37 введение может осуществляться пероральным путем. Вводимая доза будет зависеть от возраста, здоровья и веса реципиента, типа совместного лечения, если оно предоставляется, частоты введения соединения и природы желаемого эффекта. Фармацевтические препараты данного изобретения готовят известным per se способом,например, общепринятыми способами смешивания, гранулирования, формования драже, растворения или лиофилизации. Так, фармацевтические препараты для перорального введения могут быть приготовлены соединением активных соединений с твердыми наполнителями,необязательным измельчением полученной смеси и обработкой смеси гранул после добавления подходящих добавок, если это желательно или необходимо, с получением таблеток или центральных ядер драже. Подходящими наполнителями, в частности, являются такие наполнители, как сахариды,например, лактоза или сахароза, маннит или сорбит, препараты целлюлозы и/или фосфата кальция, например, трикальциевый фосфат или бифосфат кальция, а также связывающие вещества, такие как крахмальная паста, с использованием, например, кукурузного крахмала, пшеничного крахмала, рисового крахмала, картофельного крахмала, желатина, трагаканта, метилцеллюлозы, гидроксипропилметилцеллюлозы, натриевой карбоксиметилцеллюлозы и/или поливинилпирролидона. Если желательно, могут быть добавлены дезинтегрирующие средства, такие как вышеуказанные крахмалы и также карбоксиметилкрахмал, сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия. Добавки включают, без ограничения, регулирующие сыпучесть агенты и смазывающие вещества, например, диоксид кремния, тальк, стеариновая кислота или ее соли, такие как стеарат магния или стеарат кальция, и/или полиэтиленгликоль. Центральные части драже обеспечены подходящими покрытиями, которые, если желательно, являются устойчивыми к желудочному соку. Для этой цели можно использовать концентрированные растворы сахаридов, которые могут содержать аравийскую камедь, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Для получения покрытий, устойчивых к желудочному соку, используют растворы подходящих целлюлозных препаратов, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. К таблеткам или покрытиям драже могут быть добавлены красители или пигменты, например, для идентификации или для характеристики комбинаций доз активного соединения. Другие фармацевтические препараты, которые могут быть использованы для перораль 001323 38 ного введения, включают "push-fit"-капсулы,изготовленные из желатина, а также мягкие герметизированные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. "Push-fit"-капсулы могут содержать активные соединения в форме гранул,которые могут быть смешаны с наполнителями,такими как лактоза, связывающими веществами,такими как крахмалы, и/или смазывающими веществами, такими как тальк или стеарат магния и, необязательно, стабилизаторами. В мягких капсулах активные соединения предпочтительно растворены или суспендированы в подходящих жидкостях, таких как жирные масла,или в жидком парафине. Кроме того, могут быть добавлены стабилизаторы. Возможные фармацевтические препараты,которые могут использоваться ректально, включают, например, суппозитории, которые состоят из сочетания одного или нескольких активных соединений с основой суппозитория. Подходящими основами суппозиториев являются, например, природные или синтетические триглицериды или парафиновые углеводороды. Кроме того, можно также использовать желатиновые ректальные капсулы, которые состоят из сочетания активных соединений с основой. Возможные материалы основы включают, например,жидкие триглицериды, полиэтиленгликоли или парафиновые углеводороды. Подходящие формы для парентерального введения включают водные растворы активных соединений в водорастворимой форме, например, водорастворимые соли или щелочные растворы. Кроме того, могут вводиться суспензии активных соединений в виде подходящих масляных инъекционных суспензий. Подходящие липофильные растворители или носители включают жирные масла, например, кунжутное масло, или синтетические эфиры жирных кислот,например, этилолеат, или триглицериды или полиэтиленгликоль-400 (эти соединения растворимы в PEG-400). Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, например,натриевая карбоксиметилцеллюлоза, сорбит и/или декстран. Необязательно, суспензии могут также содержать стабилизаторы. Характеристика связывающих сайтов субъединицы NMDA in vitro была трудной вследствие отсутствия селективных лекарственных лигандов. Таким образом, соединения данного изобретения могут быть использованы для характеристики субъединиц NMDA и их распределения. Особенно предпочтительными подтип-селективными антагонистами и агонистами рецептора NMDA данного изобретения, которые могут быть использованы для этой цели,являются меченые радиоактивным изотопом производные, например, в которых один или несколько атомов заменены 3 Н, 11 С, 14 С, 15N или 18 39 Электрофизиологические тесты на уровне субъединиц рецептора NMDA Получение РНК Клоны кДНК, кодирующие подтипы крысиного рецептора NMDA NR1A, NR2A, NR2B,NR2C и NR2D, получены от доктора Р.Н. Seeburg (см. Moriyoshi et al., Nature (Lond.) 354:3137 (1991); Kutsuwada et al., Nature (Lond.) 358:36-41 (1992); Monyer et al., Science (Washington, D.C.) 256:1217-1221 (1992); Ikeda et al.,FEBS Lett. 313:34-38 (1992); Ishii et al., J. Biol.Chem. 268:2836-2843 (1993) относительно деталей этих клонов или их мышиных гомологов). Эти клоны трансформировали в подходящие бактерии-хозяева и препараты плазмид получали общепринятыми способами очистки ДНК. Пробу каждого клона линеаризовали расщеплением рестриктазой и кРНК синтезировали с использованием РНК-полимеразы ТЗ. кРНК разбавляли до 400 нг/мкл и хранили в аликвотах по 1 мкл при 80 С до инъекции. Система экспрессии ооцитов Xenopus Зрелых самок Xenopus laevis анестезировали (20-40 мин) при помощи 0,15% этилового эфира 3-аминобензойной кислоты (MS-222) и хирургически удаляли 2-4 доли яичника. Ооциты в стадиях развития IV-VI (Dumont, J.N., J.Morphol. 136;153-180 (1972 иссекали из яичников, все еще окруженных покрывающими тканями яичников. Заключенные в фолликулы ооциты микроинъецировали смесями 1:1 кPHK:NR1A + NR2A, 2 В, 2 С или 2D; инъецировали около 2,5 или 20 нг РНК, кодирующей каждую субъединицу рецептора. КодирующуюNR1A кРНК инъецировали отдельно при около 20 нг. Ооциты хранили в среде Barth, содержащей (в мМ) : NaCl, 88; КСl, 1; СаСl2 , 0,41;HEPES 5, pH 7,4, с 0,1 мг/мл сульфата гентамицина. Хотя ооциты все еще были окружены покрывающими их тканями яичника, среду Barth дополняли 0,1% бычьей сывороткой. Ооциты дефолликулировали спустя 1-2 дня после инъекций обработкой коллагеназой (0,5 мг/мл(1989 и затем хранили в бессывороточной среде. Электрические записи выполняли с использованием обычного двухэлектродного зажима с напряжением (Dagan TEV-200) на протяжении периодов в пределах 3-21 дней после инъекции. (Woodward et al., Mol. Pharmacol. 41:89-103 (1992. Ooциты помещали в камеру самописца на 0,1 мл, непрерывно перфузируемую (5-15 мл. мин-1) раствором Рингера для лягушек, содержащим (в мМ): NaCl, 115; КСl, 2; СаСl2, 1,8; HEPES, 5; рН 7,4. Лекарственные соединения добавляли перфузией через камеру. С использованием ооцитов, экспрессирующих различные комбинации субъединиц рецептора 40 применением глутамата (100 мкм) и глицина (1100 мкм). Ингибирующую активность новых антагонистов оценивали на ответные реакции,вызываемые фиксированными концентрациями глутамата и глицина, путем измерения уменьшений в токе, индуцированных прогрессивно увеличивающимися концентрациями антагониста. Кривые зависимости ингибирования от концентрации соответствовали уравнению 1.I/Iконтроль=1/(1+([антагонист]/10-pIC50)n) (1),в котором Iконтроль является током, индуцируемым только агонистами, pIC50 = -logIC50, IC50 является концентрацией антагониста, которая дает полумаксимальное ингибирование, и n является фактором градиента. (De Lean et al. , Am.J. Physiol. 235:E97-102 (1978. Для неполных кривых такой анализ был ненадежным и величины IС 50 рассчитывали простой регрессией на линейных частях кривых (Origin: Microcal Software). Индукция локализованной ишемии Крыс интубировали и поддерживали под анестезией 2% галотаном. Температуру тела поддерживали при 37,5 С во время хирургии при помощи согревающей подушки и ректальный зонд соединяли с пунктом управления. Общие сонные артерии (ССА) выделяли и вокруг каждой ССА накладывали нетугую шелковую лигатуру. Между левой глазницей и слуховым каналом делали вертикальный разрез кожи. Заднюю часть скуловой кости удаляли и просверливали небольшое отверстие (2,0-2,5 мм) дорзорострально к овальному отверстию (foramen ovale, лат.) при постоянном омывании физиологическим раствором. Твердую мозговую оболочку открывали микрохирургическим крючком и мозг осторожно извлекали для обнажения раздвоения внутренней сонной артерии и средней мозговой артерии (МСА). Ипсилатеральные ССА лигировали и МСА коагулировали из его источника в обонятельный канал. Контралатеральную ССА пережимали артериальным зажимом. Все разрезы зашивали и линиюi.v. соединяли с инфузионным насосом для доставки соединения данного изобретения. Два часа спустя после пережатия МСА зажим на контралатеральной ССА удаляли. Ректальную температуру измеряли через 2 часа после пережатия МСА (МСА-0). Максимальные индуцированные электрошоком припадки Припадки индуцировали наложением тока(50 мА, 60 импульсов/сек, ширина импульса 0,8 сек, продолжительность 1 сек, постоянный ток) через покрытые физиологическим раствором корнеальные электроды с использованием прибора Ugo Basile ЕСТ (Model 7801). Мышей удерживали захватом за свободно оттягиваемую кожу на их дорзальной поверхности, электроды слегка прислоняли к двум роговицам, затем подавали ток и мышей наблюдали в течение периода до 30 секунд в отношении появления то 41 низирующего ответа экстензора задней конечности. Тонизирующий припадок определяли как вытягивание задней конечности более,чем на 90 от поверхности тела. Результаты обрабатывали с получением результата, который может иметь лишь конечное число возможных значений. Следующие далее примеры предназначены для иллюстрации некоторых предпочтительных вариантов данного изобретения, а не для ограничения изобретения. Пример 1 4-Бензил-1-(2-феноксиэтил)пиперидин 4-Бензилпиперидин обрабатывают 1-бром 2-феноксиэтаном и избытком карбоната калия в виде раствора в метилэтилкетоне и нагревают с обратным холодильником в течение 12 ч. Стандартная обработка и хроматография дают указанное в заголовке соединение. Пример 2 4-Бензил-1-(3-феноксипропил)пиперидин Раствор 4-бензилпиридина и 1-бром-3 феноксипропана в ацетоне перемешивают при комнатной температуре в течение ночи. После удаления растворителя остаток растворяют в этаноле и обрабатывают боргидридом натрия с получением тетрагидропиридинового аддукта. Восстановление двойной связи выполняют в МеОН в атмосфере водорода (50 psi = 344737,85 Па) с использованием 10% Pd-C в качестве катализатора с получением указанного в заголовке соединения. Пример 3 4-Бензил-1-[2-гидрокси-3-(1 нафтилокси)пропил]пиперидин Смесь 1-нафтилового спирта, хлорметилоксирана, карбоната калия и метилэтилкетона нагревают с обратным холодильником в течение 5 ч с получением 2-(1-нафтилокси)метилоксирана. Этот промежуточный продукт обрабатывают 4-бензилпиперидином с получением указанного в заголовке соединения. Пример 4 4-Бензил-1-[(2-гидрокси-4 фенил)бутил]пиперидин 42 перемешивают в течение 1,5 ч. Стандартная обработка и хроматография дают эпоксид. Конденсация эпоксида и 4-бензилпиперидина в нагреваемом с обратным холодильником толуоле дает указанное в заголовке соединение. Пример 5 4-Фенокси-1-[(4 фторфенокси)пропил]пиперидин Смесь 4-феноксипиридина и бензилбромида в ацетоне перемешивают в течение ночи при комнатной температуре. После удаления растворителя остаток растворяют в метаноле, охлаждают до -20 С и обрабатывают порциями боргидрида натрия и нагревают до 0 С. После стандартной обработки и очистки полученный тетрагидропиридиновый аддукт растворяют в метаноле и гидрируют с применением 20% Pd-C в качестве катализатора с получением 4 феноксипиперидина. Смесь 4-феноксипиперидина и 1-бром-3-(4-фторфенокси)пропана в ацетоне с избытком карбоната калия нагревают с обратным холодильником в течение 12 ч с получением указанного в заголовке соединения. Пример 6 4-(2-Метоксифенокси)-1-(4 фенилбутил)пиперидин Раствор 4-(2-метоксифенокси)пиридина обрабатывают 1-бром-4-фенилбутаном в ацетоне с получением соли пиридиния. Последовательное восстановление боргидридом натрия в этаноле и каталитическое гидрирование с применением 10% Pd-C в качестве катализатора в метаноле дают указанное в заголовке соединение. Пример 7 1-(3-Феноксипропил)-4-фенилпиперидинEtOH нагревают с обратным холодильником в атмосфере азота в течение 12 ч. Неорганическую соль удаляют пропусканием через короткую колонку силикагеля и промывают EtOAc (3 х 15 мл). Фильтрат выпаривают в вакууме с получением остатка, который очищают флэшхроматографией с получением указанного в за 43 головке соединения в виде бледно-желтого масла (165 мг, 64%): 1 Н ЯМР (CDCl3) 1,90 (m, 4 Н), 2,10 (m, 4 Н),2,55 (m, 1H), 2,70 (bs, 2 Н), 3,20 (bs, 2 Н), 4,05 (m,2 Н), 6,92 (m, 4 Н), 7,29 (m, 6 Н). Пример 8 1-(2-Феноксиэтил)-4-фенилпиперидин Это соединение получают аналогично примеру 7. Из 2-феноксиэтилтозилата (380 мг,1,30 ммоль) и 4-фенилпиперидина (167 мг, 1,04 ммоль) получают амин в виде бледно-желтого масла (224 мг, 77%). 1 Н ЯМР (CDCl3) 1,91 (m, 4 Н), 2,40 (bs, 2 Н),2,60 (m, 1 Н), 3,00 (bs, 2 Н), 3,25 (bs, 2 Н),4,25 (m, 2 Н), 6,94 (m, 4 Н), 7,30 (m, 6 Н). Пример 9 1-(4-Феноксибутил)-4-фенилпиперидин Это соединение получают аналогично примеру 7. Из 4-феноксибутилбромида (256 мг,1,12 ммоль) и 4-фенилпиперидина (150 мг, 0,930 ммоль) получают амин в виде бледно-желтого масла (отверждаемого после стояния в течение ночи, 196 мг, 68%). 1 Н ЯМР (CDCl3) 1,88 (m, 10 Н), 2,10 (m,1 Н), 3,00 (bs, 2 Н), 3,20 (bs, 2 Н), 4,00 (m, 2 Н),6,91 (m, 4 Н), 7,26 (m, 6 Н). Пример 10 Гидробромид 1-(4-(3(трифторметил)фенокси)бутил)-4 фенилпиперидина Это соединение получают аналогично примеру 7. Из 1-бром-4-(3-(трифторметил) феноксибутана (387 мг, 1,30 ммоль) и 4 фенилпиперидина (140 мг, 0,870 ммоль) получают амин в виде бледно-желтого масла (82 мг,25%). Масло растворяют в 2 мл EtOH. К этому раствору добавляют 4 мл 1,2 М НВr в МеОН. Полученный раствор выпаривают в вакууме досуха. К остатку добавляют эфир (15 мл) и перемешивают в течение ночи. Твердое вещество собирают фильтрованием и сушат с получением продукта (110 мг, 100%): т. пл. 134-136 С. 1 Н ЯМР (CDCl3) 1,94 (m, 2 Н), 2,08 (m, 2 Н),2,22 (bs, 2 Н) , 2,75-2,86 (m, 5 Н), 3,10 (m, 2 Н),3,76 (m, 2 Н) , 4,04 (m, 2 Н), 7,10-7,41 (m, 9 Н),11,52 (bs, 1 Н). Элементный анализ для Это соединение получают аналогично примеру 7. Из 4-бензилпиперидина (500 мг, 2,85 ммоль, Aldrich) и 2-(4-хлорфенокси) этилбромида (704 мг, 2,99 моль) получают амин в виде розового масла, которое отверждается при царапании стеклянной палочкой (835 мг, 89%): т. пл. 72-73 С. Гидрохлоридную соль получают подобно способу, описанному в примере 10, в виде пушистого бесцветного кристаллического твердого вещества, т. пл. 177-178 С. 1 Н ЯМР (CDCl3) 1,55-2,17 (m, 5 Н), 2,502,82 (m, 4 Н), 3,20-3,55 (m, 2 Н), 3,65 (d, J = 12 Hz,2 Н), 4,53 (t, J =4,2 Hz, 2H), 6,80 (d, J = 8,7 Hz,2H), 7,00-7,18 (m,7H), 12, 68 (bs, 1H). Элементный анализ для С 20 Н 25 Сl2NO: вычислено: С 65,57; Н 6,88; N 3,82; найдено: С 65,45; Н 7,08; N 3,80. Пример 12 Гидробромид 4-бензил-1-(2-(4 нитрофенокси)этил)пиперидина Это соединение получают аналогично примеру 10. Из 4-бензилпиперидина (1,00 г, 5,70 ммоль) и 1-бром-2-(4-нитрофенокси)этана (1,47 г, 5,98 ммоль) получают указанное в заголовке соединение в виде бесцветного твердого вещества (1,82 г, 76%): т. пл 155-157 С. 1 Н ЯМР (CDCl3) 1,16-2,21 (m, 5 Н), 2,582,89 (m, 4 Н), 3,25-3,78 (m, 4 Н), 4,74 (t, J = 4,2Hz, 2 Н), 6,90-7,35 (m, 7 Н), 8,20 (d, J = 9,0 Hz,2H). Элементный анализ для C20H25BrN2O3: вычислено: С 57,01; Н 5,98; N 6,65; найдено: С 57,15; Н 6,03; N 6,61. Пример 13 Дигидробромид 1-(2-(4-аминофенокси)этил)-4 бензилпиперидина(137895,14-206842,71 Па) Парр в течение 2,25 ч при 25 С. Катализатор удаляют фильтрованием (целит). Полученный раствор подкисляют разбавленным раствором НВr в МеОН. МеОН удаляют в вакууме (роторный испаритель) с получением сиропа. Добавляют эфир (45 мл) и полученную смесь интенсивно перемешивают при 25 С в течение 48 ч. Получают серую суспензию. Твердое вещество собирают, промывают эфиром (3x3 мл) и сушат в вакууме (0,005 Тор, 56 С) с получением бежевого порошка (606 мг, 60%): т. пл.130 С. Это соединение получают аналогично примеру 7. Из 2-(4-цианофенокси)этилбромида(2,26 г, 10,0 ммоль) и 4-бензил-пиперидина (1,75 г, 10,0 ммоль) получают амин в виде твердого вещества (2,2 г, 69%): т. пл. 83-85 С. 1 Н ЯМР (CDCl3) 1,37 (m, 2 Н), 1,60 (m, 1 Н),1,63 (m, 2 Н), 2,08 (m, 2 Н), 2,53 (d, J = 6,6 Hz,2 Н), 2,81 (m, 2 Н), 3,00 (d, J = 10,8 Hz, 2 H), 4,15A) 3-2-Бромэтил)окси)бензальдегид. Смеси 3-гидрокси-бензальдегида (4,88 г, 40,0 ммоль), 1,2-дибромэтана (75,2 г, 400 ммоль) и К 2 СO3 (13,8 г, 100 ммоль) в 50 мл ацетонитрила дают нагреваться с обратным холодильником в атмосфере азота в течение 2 дней. Неорганическую соль удаляют пропусканием через короткую колонку силикагеля и промывают EtOAc (3 х 50 мл). Выпаривание растворителя дает остаток, который очищают флэш-хроматографией с получением продукта в виде бледно-желтого масла (7,65 г, 84%). 1 Н ЯМР (CDCl3) 3,67 (t, J = 6,3 Hz, 2H), 4,36 (t, J = 6,3 Hz, 2H), 7,20-7,49 (m,4H), 9,98 (s, 1H).B) Этиленацеталь 3-2-бромэтил)окси) бензальдегида. К раствору 3-2-бромэтил)окси) бензальдегида (2,29 г, 10,0 ммоль) в 50 мл сухого бензола добавляют этиленгликоль (1,22 мл,22,0 ммоль) и п-толуолсульфокислоту (50 мг). Полученному раствору дают нагреваться с обратным холодильником в течение 2 дней. Раствор промывают насыщенным раствором NaHCO3 (2 х 20 мл) и сушат над Na2SO4. Выпаривание растворителя дает бледно-желтое маслоC) Этиленацеталь 3-2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегида. Это соединение получают аналогично примеру 7. Из этиленацеталя 3-2-бромэтил)окси)бензальдегида(2,24 г, 8,20 ммоль) и 4-бензилпиперидина (1,75 г, 10,0 ммоль) получают амин в виде бесцветного масла (2,9 г, 94%). 1 Н ЯМР (CDCl3) 1,32 (m, 2H), 1,60 (m, 1H),1,62 (d, J = 12,9 Hz, 2H), 2,05 (m, 2H), 2,53 (d, J = 6,6 Hz, 2H), 2,78 (m, 2H), 2,96 (d, J = 12 Hz, 2H), 001323D) Гидрохлорид 3-2-(4-бензилпиперидин-1-ил)этил)окси)бензальдегида. К раствору этиленацеталя 3-2-(4-бензилпиперидин-1 ил)этил)окси)бензальдегида (1,1 г, 3,0 ммоль) в 10 мл EtOH добавляют 9 мл 2N раствора НСl. Полученному раствору дают перемешиваться при 70 С в течение 3 ч. Раствор нейтрализуют насыщенным раствором NaHCO3 до рН 7 и экстрагируют EtOAc (3 х 30 мл). Объединенные экстракты сушат над Na2SO4. Выпаривание растворителей дает продукт в виде бледно-желтого масла (0,87 г, 90%). К раствору этого масла (200 мг, 0,62 ммоль) в 5 мл МеОН добавляют по каплям 3 мл 1M HCl в МеОН. Полученному раствору дают перемешиваться при комнатной температуре в течение 10 мин. Выпаривание растворителя дает масло, к которому добавляют 45 мл эфира. Смеси дают перемешиваться при комнатной температуре в течение 2 дней. Твердое вещество собирают фильтрованием и сушат в вакууме с получением продукта в виде твердого вещества (110 мг, 50%): т. пл. 145-147 С К раствору 3-2-(4-бензилпиперидин-1 ил)этил)окси)бензальдегида (200 мг, 0,620 ммоль) в 6 мл 50% водного EtOH добавляют раствор гидрохлорида гидроксиламина (110 мг,1,55 ммоль) и ацетата натрия (246 мг, 2,77 ммоль) в 50% водном EtOH (10 мл). Полученному раствору дают перемешиваться при комнатной температуре в течение 3 дней. EtOH выпаривают и бесцветное твердое вещество собирают фильтрованием и сушат с получением продукта (160 мг, 70%): т. пл. 141-143 С. 1 Н ЯМР (CDCl3) 1,40 (m, 2 Н), 1,50 (m, 1H),1,64 (m, 2 Н), 2,12 (m, 2 Н), 2,54 (m, 2 Н), 2,85 (s,2 Н), 3,08 (m, 2 Н), 4,21 (m, 2 Н), 6,88-7,28 (m,9 Н), 8,04 (s, 1 Н), 10,00 (bs, 1 Н). Пример 17 4-Бензил-1-(2-(3(этоксикарбонилметил)фенокси)этил)пиперидин А) Этил 3-гидроксифенилацетат. К раствору 3-гидроксифенилуксусной кислоты (10 г, 66 ммоль) в 200 мл EtOH добавляют 4 мл H2SO4. Полученному раствору дают нагреваться с об 47 ратным холодильником в течение 3 дней. Растворитель выпаривают в вакууме, к остатку добавляют воду (50 мл) и полученную смесь экстрагируют EtOAc (3 х 30 мл). Объединенный органический экстракт сушат над Na2SO4. Растворитель выпаривают в вакууме с получением продукта в виде бесцветного масла (11,5 г,97%). 1 Н ЯМР (CDCl3) 1,26 (t, J = 7,2 Hz, 3 Н),3,57 (s, 3 Н), 4,15 (q, J = 7,2 Hz, 2H), 6,75 (m, 3H),7,16 (m, 1H).C) 4-Бензил-1-(2-(3(этоксикарбонилметил)фенокси)этил)пиперидин. Это соединение получают аналогично примеру 7. Из этил 3-2 бромэтил)окси)фенилацетата (2,18 г, 7,60 ммоль) и 4-бензил-пиперидина (1,58 г, 9,00 ммоль) получают амин в виде бледно-желтого масла (2,32 г, 80%). 1 Н ЯМР (CDCl3) 1,26 (t, J = 7,2 Hz) 1,45 (m,2H), 1,61 (m, 1H), 1,64 (m, 2H), 2,06 (m, 2H), 2,54 К суспензии литийалюминийгидрида (150 мг, 4,0 ммоль) в 10 мл безводного ТГФ добавляют по каплям раствор 4-бензил-1-(2-(3(этоксикарбонилметил)фенокси)этил)пиперидина (0,382 г, 1,00 ммоль) в 2 мл ТГФ при -78 С. Полученной смеси дают нагреться до комнатной температуры и смесь перемешивают в течение 12 ч. Последовательно добавляют воду (0,2 мл), 15% водный раствор NaOH (0,2 мл) и воду(1 мл). Бесцветное твердое вещество удаляют фильтрованием и промывают EtOAc (3 х 20 мл). Фильтрат сушат над Na2SO4. Выпаривание растворителей дает остаток, который очищают флэш-хроматографией с получением указанного в заголовке соединения в виде бесцветного масла (223 мг, 66%). 1 Н ЯМР (CDCl3) 1,37 (m, 2H), 1,60 (m, 1H),1,63 (m, 2H), 2,05 (m, 2H), 2,36 (d, J =6,6 Hz, 2H),2,76 (m, 2H), 2,82 (m, 2H), 2,95 (m, 3 H), 3,81 (t, J К раствору 4-бензил-1-(2-(3-(этоксикарбонилметил)фенокси)этил)пиперидина (0,382 г,1,00 ммоль) в 5 мл МеОН добавляют 5 мл 30% раствора NH4OH. Полученному раствору дают перемешиваться при комнатной температуре в течение 12 ч. МеОН выпаривают в вакууме и добавляют воду (10 мл). Осаждается бесцветное твердое вещество. Твердое вещество собирают фильтрованием и сушат в вакууме с получением указанного в заголовке соединения (218 мг,62%): т. пл. 100-101 С. 1 Н ЯМР (CDCl3) 1,31 (m,2H), 1,60 (m, 1H), 1,609 (m, 2H), 2,04 (m, 2H),2,53 (d, J = 6,6 Hz, 2H), 2,80 (t, J = 4,8 Hz, 2H),2,95 (d, J = 11,4 Hz, 2H), 3,55 (s, 2H), 4,08 (t, J = 6 К раствору 4-бензил-1-(2-(3-(этоксикарбонилметил)фенокси)этил)пиперидина (0,382 г,1,00 ммоль) в 5 мл МеОН добавляют 5 мл гидразингидрата. Полученному раствору дают перемешиваться при комнатной температуре в течение 12 ч. МеОН выпаривают в вакууме и добавляют воду (10 мл). Осаждается бесцветное твердое вещество. Твердое вещество собирают фильтрованием и сушат в вакууме с получением указанного в заголовке соединения (240 мг,65%): т. пл. 89-91 С. 1 Н ЯМР (CDCl3) 1,31 (m,2H), 1,60 (m, 1H), 1,62 (m, 2H), 2,04 (t, J = 11,7A) 1-Феноксипропан-2-ол. К суспензии литийалюминийгидрида (6,0 г, 0,15 моль) в 50 мл ТГФ добавляют по каплям раствор феноксиацетона (15 г, 0,10 моль) в 5 мл ТГФ при -78 С. Смеси дают нагреваться до комнатной температуры и перемешивают еще в течение 2 ч. К реакционной смеси добавляют последовательно воду (6,0 мл), 15% раствор NaOH (6,0 мл) и воду(18 мл). Полученную смесь экстрагируют EtOAc 49 органический экстракт сушат над Na2SO4. Растворитель выпаривают в вакууме с получением остатка, который очищают перегонкой с получением продукта в виде бесцветного масла (12,5 г, 82%): т. кип. 65-67 С, 0,006 Тор. 1 Н ЯМР (CDCl3) 1,28 (d, J = 7,0 Hz, 3H),2,35 (bs, 1H), 3,80 (m, 1H), 3,97 (m, 1H), 4,20 (m,1H), 6,93 (m, 3H), 7,32 (m, 2H).B) 1-Фенокси-2-тозилпропан. К раствору 1-феноксипропан-2-ола (5,0 г, 33 ммоль) в 20 мл СН 2 Сl2 и 25 мл пиридина добавляют тозилхлорид (12,6 г, 66,0 ммоль) в виде одной порции при 0 С. Полученному раствору дают перемешиваться в течение ночи при комнатной температуре. Раствор выливают в смесь воды со льдом (100 г) и органический слой отделяют. Водный слой экстрагируют СН 2 Сl2 (2 х 50 мл). Объединенный органический слой промывают 1,0N НСl (2 х 50 мл) и 0,1 М раствором NaHCO3(30 мл) и сушат. Выпаривание растворителя дает остаток, который перекристаллизовывают из смеси СН 2 Сl2/гексаны с получением продукта в виде бесцветного твердого вещества (7,5 г,74%): т. пл. 92-94 С. 1 Н ЯМР (CDCl3) 1,42 (d, J = 9,6 Hz, 3H),2,44 (s, 3H), 3,90 (m, 1H), 4,04 (m, 1 H), 4,83 (m,1H), 6,68 (d, J = 8,1 Hz, 2H), 6,94 (m, 1H), 7,33(m, 4H), 7,79 (d, J = 8,1 Hz, 2H). С) Гидробромид 4-бензил-1-(1-метил-2 феноксиэтил)пиперидина. Это соединение получают аналогично примеру 10. Из 1-фенокси 2-тозилпропана (550 мг, 1,80 ммоль) и 4 бензилпиперидина (263 мг, 1,50 ммоль) получают гидробромидную соль в виде твердого вещества (290 мг, 50%): т. пл. 151-153 С. 1 Н ЯМР (CDCl3) 1,60 (m, 3H), 1,83 (m, 2H), 2,23 (m,2H), 2,65 (m, 2 H), 2,93 (m, 2H), 3,57 (m, 4H),4,24 (m, 1H), 4,56 (m, 1H), 6,87-7,27 (m, 10H),11,20 (bs, 1H); Элементный анализ для C21H28NBrO: вычислено: С 64,60; H 7,23; N 3,59; найдено: С 64,27; Н 7,37; N 3,58. Пример 22 Гидробромид 4-бензил-1-(3-(3 фторфенокси)пропил)пиперидина Это соединение получают аналогично примеру 10. Из 4-бензилпиперидина (500 мг,2,85 ммоль) и 1-бром-3-(3 фторфенокси)пропана (697 мг, 2,99 ммоль) получают гидробромидную соль в виде бесцветного порошка (838 мг, 72%): т. пл. 155,5-157,5 С. 1 Н ЯМР (CDCl3) 1,60-1,94 (m, 3H), 2,052,25 (m, 2H), 2,41-2,72 (m, 6H), 3,11-3,21 (m,2H), 3,63 (d, J = 11 Hz, 2H), 4,05 (t, J = 5,4 Hz,2H), 6,52-6,71 (m, 3H), 7,09-7,34 (m, 6H), 11,40(bs, 1H). Элементный анализ для C21H27BrFNO: вычислено: С 61,77; H 6,66; N 3,43; Это соединение получают аналогично примеру 10. Из 4-бензилпиперидина (500 мг,2,85 ммоль) и 1-бром-4-(3-фторфенокси)бутана(1,06 г, 4,28 ммоль) получают гидробромидную соль в виде бесцветного порошка (240 мг, 88%): т. пл. 124,5-127,5 С. 1 Н ЯМР (CDCl3) 1,70-1,94 (m, 5 Н), 2,052,23 (m, 4 Н), 2,51-2,60 (m, 4 Н), 2,93-3,08 (m,2 Н), 3,60 (d, J = 11 Hz, 2H), 3,97 (t, J = 5,7 Hz,2H), 6,52-6,70 (m, 3 H), 7,12-7,30 (m, 6H), 11,35(bs, 1H). Элементный анализ для C22H29BrFNO: вычислено: С 62,56; Н 6,92; N 3,32; найдено: С 62,54; Н 7,15; N 3,42. Пример 24 Гидрохлорид 4-(4-хлорбензил)-1-(2 феноксиэтил)пиперидина Это соединение получают аналогично примеру 10. Из гидрохлорида 4-(4-хлорбензил) пиперидина (500 мг, 2,03 ммоль) и 2-феноксиэтилтозилата (623 мг, 2,13 ммоль) получают гидрохлоридную соль в виде бесцветного порошка (455 г, 62%). т. пл. 200-202 С. 1 Н ЯМР (CDCl3) 1,55-1,89 (m, 3 Н), 2,06 (q,J = 12 Hz, 2H), 2,50-2,89 (m, 4H), 3,20-3,55 (m,2H), 3,66 (d, J = 12 Hz, 2H), 4,54 (bd, 2H), 6,86 (d,J = 7,8 Hz, 2H), 6,95-7,09 (m, 3H), 7,22-7,34 (m, 4H), 12,64 (bs, 1H). Элементный анализ для C20H25Cl2NO: вычислено: С 65,57; Н 6,88; N 3,82; найдено: С 65,42; Н 6,65; N 3,57. Пример 25 Гидробромид 4-(4-хлорбензил)-1-(2-(4 фторфенокси)этил)пиперидинаA) 2-(4-Фторфенокси)этилбромид. Из 4 фторфенола (10,0 г, 89,2 ммоль) и 1,2 дибромэтана (38,4 мл, 83,8 г, 446 ммоль) получают бесцветную жидкость (8,90 г, 46%). 1 Н ЯМР (CDCl3) 3,62 (t, J= 6,3 Hz, 2H), 4,25(933 мг, 4,26 ммоль) и К 2 СO3 (1,15 г, 8,32 ммоль) в CH3CN (30 мл) перемешивают при нагревании с обратным холодильником в течение 3 дней. Реакции дают охладиться до 25 С. 51 Затем реакционную смесь добавляют к 10% НСl(100 мл) и экстрагируют СНСl3 (3 х 50 мл). Экстракт промывают 5% NH4OH (2 х 50 мл),фильтруют через хлопчатобумажную ткань и растворитель удаляют роторным испарением с получением бесцветного масла. Продукт очищают хроматографически на силикагеле (2,5 х 30 см). Элюированием СНСl3 удаляют более подвижные примеси. Элюированием смесью 2%EtOH/99% CHCl3 удаляют продукт. Растворитель удаляют из фракций продукта на роторном испарителе с получением бесцветного твердого вещества. Твердое вещество растворяют в теплом МеОН (10 мл), фильтруют через целит и МеОН удаляют на роторном испарителе с получением бесцветного твердого вещества. Твердое вещество сушат в вакууме (0,005 Тор, 25 С) с получением бесцветного твердого веществаHz, 2H); Гидробромидную соль получают согласно следующей процедуре. Раствор свободного основания (1,00 г, 2,87 ммоль) в МеОН (15 мл, полученный с нагреванием) обрабатывают разбавленным раствором НВr в МеОН, пока раствор амина не станет перманентно кислым(по бумаге для определения рН). Растворитель удаляют в вакууме с получением сиропа. Сироп перемешивают интенсивно в эфире (95 мл) в течение 18 ч с получением желтой суспензии. Твердое вещество собирают, промывают эфиром (3 x 3 мл) и сушат в вакууме (0,005 Тор,79 С) с получением бледно-желтого порошкаHz, 2H), 4,53 (t, J = 3,6 Hz, 2H), 6,77-7,10 (m,6H), 7,23 (d, J = 8,4 Hz, 2H), 11,48 (bs 1H). Аналитическую пробу получают кристаллизацией полученного порошка из смеси 2 бутанон/эфир в виде пушистого кристаллического твердого вещества, т. пл. 117-118 С. Элементный анализ для C20H24BrClFNO: вычислено: С 56,03; Н 5,64; N 3,27; найдено: С 56,14; Н 5,46; N 3,28. Пример 26 Гидрохлорид 2-(4-хлорбензил)-1-(2-(4 хлорфеноксиэтил)пиперидина Это соединение получают аналогично примеру 25. Из гидрохлорида 4-(4-хлорбензил) пиперидина (500 мг, 2,03 ммоль) и 2-(4 хлорфенокси)этилбромида (502 мг, 2,13 ммоль) получают гидрохлоридную соль в виде бесцветного порошка (641 г, 81%): т. пл. 167-169 С; Н ЯМР (CDCl3) 1,55-1,89 (m, 3 Н), 2,06 (q,J = 13 Hz, 2H), 2,50-2,82 (m, 4H), 3,20-3,55 (m,2H), 3,65 (d, J = 12 Hz, 2H), 4,53 (t, J = 4,2 Hz,2H), 6,81 (d, J = 8,7 Hz, 2H), 7,04 (d, J = 8,7 Hz,2H), 7,20-7,28 (m, 4H), 12,75 (bs, 1H); Элементный анализ для C20H24Cl3NO: вычислено: С 59,94; Н 6,04; N 3,49; найдено: С 60,05; Н 5,85; N 3,18. Пример 27 Гидробромид 4-(4-хлорбензил)-1-(2-(4 нитрофенокси)этил)пиперидина Это соединение получают аналогично примеру 25. Из гидрохлорида 4-(4-хлорбензил) пиперидина (1,00 г, 4,06 ммоль) и 1-бром-2-(4 нитрофенокси)этана (1,05 г, 4,26 ммоль) получают гидробромидную соль в виде бесцветного твердого вещества (1,27 г, 69%): т. пл. 155158 С. 1 Н ЯМР (CDCl3) 1,55-2,20 (m, 5 Н), 2,522,89 (m, 4 Н), 3,25-3,78 (m, 4 Н), 4,74 (t, J = 4,5Hz, 2H), 11,77 (bs, 1H). Элементный анализ для С 20 Н 24 ВrСlN2 О 3: вычислено: С 52,70; Н 5,31; N 6,15; найдено: С 52,82; Н 5,42; N 6,09. Пример 28 Дигидробромид 1-(2-(4-аминофенокси)этил)-4(4-хлорбензил)пиперидина(137895,14-206842,71 Па), Парр) в течение 2,25 ч и обрабатывают с получением бежевого порошка (350 мг, 63%): т. пл.130 С. 1 Н ЯМР (DMSO-d6) 1,37-1,88 (m, 5 Н), 2,453,75 (m, 8 Н), 4,30-4,42 (m, 2 H), 7,04-7,38 (m, 8A)4-(4-Хлорбензил)-1-(2-(3-(этоксикарбонилметил)фенокси)этил)пиперидин. Это соединение получают аналогично примеру 7. Из этил 3-2-бромэтил)окси)фенилацетата (2,26 г, 7,80 ммоль) и гидрохлорида 4-(4-хлорбензил) пиперидина (2,2 г, 9,0 ммоль) получают амин в виде бледно-желтого масла (1,74 г, 55%): 1 Н ЯМР (CDCl3)1,25 (t, J = 7,2 Hz, 3H),1,50 (m, 3H), 1,61 (m, 2H), 2,09 (m, 2H), 2,50 (d, JB) 4-(4-Хлорбензил)-1-(2-(3-(2-гидроксиэтил)фенокси)этил)пиперидин. К суспензии литийалюминийгидрида (76 мг, 2,0 ммоль) в 10 мл безводного ТГФ добавляют по каплям раствор этил 4-(4-хлор-бензил)-1-(2-(3-этоксикарбонилметил)фенокси)этил)пиперидина (0,435 г, 1,10 ммоль) в 2 мл ТГФ при -78 С. Полученной смеси дают нагреться до комнатной температуры и перемешивают ее еще в течение 12 ч. Последовательно добавляют воду (0,2 мл), 15% водный раствор NaOH (0,2 мл) и воду (1 мл). Бесцветное твердое вещество удаляют фильтрованием и промывают EtOAc (3 х 20 мл). Фильтрат сушат над Na2SO4. Выпаривание растворителя дает остаток,который очищают флэшхроматографией с получением указанного в заголовке продукта в виде бесцветного масла (310 мг, 76%): 1 Н ЯМР (CDCl3) 1,34 (m, 2H), 1,63 (m, 4H),1,90 (m, 1H), 2,07 (m, 2H), 2,43 (m, 2H), 2,83 (m,3H), 2,98 (m, 2H), 3,39 (m, 2H), 4,10 (m, 2 H),6,78 (m, 3H), 7,25 (m, 5H). Пример 30 Гидробромид 4-(4-хлорбензил)-1-(3 феноксипропил)пиперидина Это соединение получают аналогично примеру 25. Из гидрохлорида 4-(4-хлорбензил) пиперидина (1,00 г, 4,06 ммоль) и 3-феноксипропилбромида (916 мг, 4,26 ммоль, Aldrich) получают гидробромидную соль в виде бесцветного порошка (980 мг, 62%), т. пл. 143,5145, 5 С. 1 Н ЯМР (CDCl3) 1,65-1,89 (m, 3 H), 2,15(dd, J1 = 12 Hz, J2 = 13 Hz, 2H), 2,39-2,76 (m, 6H),3,12-3,25 (m, 2H), 3,63 (d, J = 11 Hz, 2H), 4,05 (t,J = 5,1 Hz, 2H), 6,80-7,10 (m, 5H), 7,21-7,31 (m,4Hz), 11,32 (bs, 1H). Элементный анализ для C21H27BrClNO: вычислено: С 59,38; H 6,41; N 3,30; найдено: С 59,01; Н 6,41; N 3,17. Пример 31 Гидробромид 4-(4-хлорбензил)-1-(3-(3 фторфенокси)пропил)пиперидина Это соединение получают аналогично примеру 25. Из гидрохлорида 4-(4-хлорбензил) пиперидина (500 мг, 2,03 ммоль) и 1-бром-3-(3 фторфенокси)пропана (497 мг, 2,13 ммоль) получают гидробромидную соль в виде бесцветного порошка (540 мг, 60%): т. пл. 119-122 С. 1 Н ЯМР (СDСl3) 1,68-2,73 (m, 11 Н), 3,103,23 (m, 2 Н), 3,64 (d, J = 11 Hz, 2 Н) , 4,05 (t, J = 54 5,1 Hz, 2H) , 6,52-6,72 (m, 3 H) , 7,03-7,33 (m,5H) , 11,42 (bs, 1H). Элементный анализ для C21H26ClBrFNO: вычислено: С 56,96; H 5,92; N 3,16; найдено: С 57,08; Н 6,00; N 3,15. Пример 32 Соль малеиновой кислоты 4-(4-хлорбензил)-1(4-феноксибут-2-ен-1 ил)пиперидина(10% СНСl3/90% гексаны) показывает частичное превращение фенола в продукт с более высоким Rf. Добавляют кристалл I2 и реакции дают протекать еще в течение 24 ч. Ее обрабатывают с получением желтой жидкости (1,00 г,10%; смесь цис- и транс-изомеров) согласно ЯМР (приблизительно 9:1, соответственно). 1 Н ЯМР (CDCl3, major isomer) 4,17 (d, J = 6,6 Hz, 2H), 4,66 (d, J = 4,2 Hz, 2H), 5,82-5,98 (m,2H), 6,91-7,05 (m, 3H), 7,27-7,30 (m, 2H).B) Соль малеиновой кислоты 4-(4-хлорбензил)-1-(4-феноксибут-2-ен-1-ил)пиперидина. Это соединение получают аналогично примеру 7. Из гидрохлорида 4-(4-хлорбензил)пиперидина (1,35 г, 5,47 ммоль) и 1-хлор-4-феноксибут-2 ена (1,00 г, 5,47 ммоль) получают прозрачное янтарное масло (933 мг, 48%): 1 Н ЯМР (CDCl3, major isomer) 1,22-1,68 (m,5H), 1,91 (t, J = 8,1 Hz, 2H), 2,50 (d, J = 6,9 Hz,2H), 2,95 (d, J = 11 Hz, 2H), 3,08 (d, J = 6,0 Hz,2H), 4,59 (d, J = 5,4 Hz, 2H), 5,76-5,92 (m, 2H,раздвоение показывает, что 2 олефино-протоны имеют J = 12 Hz), 6,85-7,33 (m, 9H). Соль малеиновой кислоты получают согласно следующей процедуре. Раствор свободного основания (136 мг, 382 ммоль) в эфире (1 мл) добавляют к интенсивно перемешиваемому раствору малеиновой кислоты (250 мг, Aldrich) в эфире (10 мл). Образуется масло. Добавляют еще эфир (общий объем 45 мл) и смесь интенсивно перемешивают в течение 24 ч с получением суспензии. Твердое вещество собирают,промывают эфиром (6 х 1 мл) и сушат в вакууме(0,005 Тор, 56 С) с получением бесцветного порошка (120 мг, 67%; 90% цис-изомера согласно ЯМР): т. пл. 84-85,5 С. 1 Н ЯМР (CDCl3) 1,60-1,89 (m, 5 Н), 2,482,68 (m, 4 Н), 3,58 (d, J = 12 Hz, 2H), 3,80 (d, J = 7,2 Hz, 2H), 4,59 (d, J = 5,4 Hz, 2H), 5,77-5,90 (m,1H), 6,12-6,24 (m, 1H), 6,30 (s, 1H), 6,83-7,36 (m,10H), 12,33 (bs, 1H). Элементный анализ для С 26 Н 30 СlNO5 : вычислено: С 66,16; Н 6,41; N 2,97; найдено: С 65,93; Н 6,28; N 3,21. Пример 33A) N-Ацетилизонипекотиновая кислота. Изонипекотиновую кислоту (25,0 г, 0,190 моль) растворяют в уксусном ангидриде (100 мл) и раствор перемешивают при нагревании с обратным холодильником в течение 8 ч, затем растворитель удаляют при пониженном давлении и неочищенное соединение кристаллизуют из смеси МеОН/эфир с получением указанного в заголовке соединения в виде бесцветного твердого вещества (24,4 г, 74%): т. пл. 171 С. 1 Н ЯМР (DMSO-d6) 1,20-1,50 (m, 2H), 1,651,85 (m, 2 Н), 1,94 (s, 3 Н), 2,35-2,50 (m, 1H), 2,64B) N-Ацетилизонипекотоилхлорид. Nацетилизонипекотиновую кислоту (0,67 г, 3,9 ммоль) добавляют к SOCl2 (4,1 мл). Хлорангидрид осаждают из раствора и добавляют петролейный эфир (60 мл). Смесь фильтруют и остаток промывают несколько раз петролейным эфиром с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,716 г, 97%): т. пл. 133-138 С. 1 Н ЯМР (DMSO-d6) 1,20-1,50 (m, 2H), 1,652,00 (m, 2H), 1,94 (s, 3 Н), 2,30-2,50 (m, 1H), 2,64N-ацетилизонипекотоил-хлорид (2,00 г, 10,5 ммоль) медленно добавляют к перемешиваемой смеси трихлорида алюминия (2,80 г, 21,1 ммоль) во фторбензоле (10 мл). После завершения добавления смесь нагревают с обратным холодильником в течение 1 ч. Смесь выливают на лед и полученные слои разделяют. Водный слой экстрагируют СН 2 Сl2 (2 х 30 мл), объединенную органическую фазу сушат и концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде бледно-желтого масла (1,30 г, 50%). 1 Н ЯМР (CDCl3) 1,50-1,70 (m, 1 Н), 1,702,00 (m, 3 Н), 2,10 (s, 3 Н), 2,81 (t, J= 12,0 Hz, 1H),3,15-3,30 (m, 1H), 3,40-3,55 (m, 1H), 3,90 (d, J = 13,2 Hz, 1H), 4,57 (d, J = 13,2 Hz, 1H), 7,14 (t, J = 8,4 Hz, 2H), 7,97 (dd, J = 5,7 и 8,4 Hz, 2H).D) Гидробромид 4-(4-фторбензоил) пиперидина. Раствор 1-ацетил-4-(4-фторбензоил) пиперидина (1,20 г, 4,80 ммоль) в НСl (6N, 15 мл) нагревают с обратным холодильником в течение 2 ч. Охлажденный раствор подщелачивают (NaOH) и затем экстрагируют бензолом (2 х 40 мл). Собранную органическую фазу промывают насыщенным раствором соли (50 мл),сушат и концентрируют при пониженном давлении. Свободный амин растворяют в НВr (насыщенном растворе в МеОН, 10 мл). Осажден 001323 56 ную гидробромидную соль собирают, промывают эфиром (2 х 4 мл) и сушат в вакууме с получением указанного в заголовке соединения в виде бесцветного твердого вещества (1,54 г,98%): т. пл. 198 С. 1 Н ЯМР (CD3OD) 1,80-2,00 (m, 2 Н), 2,052,18 (m, 2H), 3,12-3,28 (m, 2H), 3,40-3,50 (m,2 Н), 3,70-3,85 (m, 1 Н), 4,85 (s, 2H), 7,24 (t, J= 8,3E) Гидробромид 4-(4-фторбензил) пиперидина. Триэтилсилилгидрид (8,40 мл, 53,0 ммоль) добавляют по каплям к раствору гидробромида 4-(4-фторбензоил)пиперидина (1,52 г, 5,30 ммоль) в трифторуксусной кислоте (30 мл). Полученному раствору дают перемешиваться в течение 4 дней при 25 С, затем растворитель удаляют в вакууме. Органический остаток подщелачивают NaOH (10% раствор) и экстрагируют EtOAc (3 х 50 мл). Собранную органическую фазу сушат и концентрируют при пониженном давлении. Неочищенное соединение растворяют в насыщенном растворе НВr в МеОН (10 мл), затем после 10 мин при 25 С раствор концентрируют при пониженном давлении. Неочищенное соединение очищают растиранием с ацетоном (10 мл) в течение 1 ч. Твердое вещество собирают, промывают ацетоном (2 х 4 мл) и сушат в вакууме с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,65 г, 45%): т. пл. 176180 С. 1 Н ЯМР (DMSO-d6) 1,20-1,45 (m, 2H), 1,571,83 (m, 3 Н), 2,47 (s, 2H), 2,63-2,85 (m, 2H), 3,103,30 (m, 2 Н), 7,03-7,35 (m, 4 Н), 8,30 (bs, 1H),8,55 (bs, 1H).F) Гидрохлорид 4-(4-фторбензил)-1-(2-(4 фторфенокси)этил)пиперидина. Это соединение получают аналогично примеру 20. Из гидробромида 4-(4-фторбензил)пиперидина (600 мг,2,19 ммоль) и 2-(4-фторфенокси)этилбромида(504 мг, 2,30 ммоль) получают гидрохлоридную соль в виде пушистого, бесцветного, кристаллического твердого вещества (315 мг, 40%): т. пл. 153-154 С. 1 Н ЯМР (CDCl3) 1,55-2,15 (m, 5 Н), 2,502,83 (m, 4 Н), 3,20-3,50 (m, 2 Н), 3,66 (d, J = 11 Hz,2 Н), 4,42-4,56 (m, 2 Н), 6,76-7,12 (m, 8 Н), 12,62(bs, 1 Н). Элементный анализ для C20H24ClF2NO: вычислено: С 65,30; Н 6,58; N 3,81; найдено: С 65,08; Н 6,79; N3,78. Пример 34 Гидрохлорид 4-(4-фторбензил)-1-(2-(4 хлорфенокси)этил)пиперидина Это соединение получают аналогично примеру 25. Из гидробромида 4-(4-фторбензил) пиперидина (600 мг, 2,19 ммоль) и 2-(4 хлорфенокси)этилбромида (542 мг, 2,30 ммоль) получают гидрохлоридную соль в виде пуши 57 стого, бесцветного кристаллического твердого вещества (460 мг, 56%): т. пл. 173-174 С. 1 Н ЯМР (CDCl3) 1,55-2,15 (m, 5 Н), 2,502,83 (m,4 Н), 3,20-3,50 (m, 2 Н), 3,66 (d, J = 11 Hz,2 Н), 4,45-4,60 (m, 2 Н), 6,80 (d, J = 9,0 Hz, 2H),6,91-7,12 (m, 4H), 7,24 (d, J = 8,7 Hz, 2H), 12,60(bs, 1H); Элементный анализ для C20H24Cl2FNO : вычислено: С 62,51; Н 6,29; N 3,64; найдено: С 62,53; Н 6,57; N 3,63. Пример 35 Гидрохлорид 1-(2-(4-фторфенокси)этил)-4-(4 метоксибензил)пиперидинаA) 4-(4-Метоксибензил)пиперидин. Это соединение получают согласно Gray, A.P.; Village, В. and Heitmeier, D.E. (US Patent 3 632 767,1972) в виде бесцветного кристаллического твердого вещества, т. пл. 60-61 С (в лит. 5961 С). 1 Н ЯМР (CDCl3) 1,02-1,20 (m, 2 Н), 1,421,68 (m, 4 Н), 2,45 (d, J = 6,6 Hz, 2H), 2,54 (d, J = 12 Hz, 2 H), 3,02 (d, J = 12 Hz, 2H), 3,78 (s, 3H),6,81 (d, J = 8,4 Hz, 2H), 7,05 (d, J = 8,1 Hz, 2H).B) Гидрохлорид 1-(2-(4-фторфенокси) этил)-4-(4-метоксибензил)пиперидина. Это соединение получают аналогично примеру 25. Из 4-(4-метоксибензил)пиперидина (500 мг, 2,44 ммоль) и (2-(4-фторфенокси)этилбромида (561 мг, 2,56 ммоль) получают гидрохлоридную соль в виде бесцветных пластинок: т. пл. 171-172 С; 1 Н ЯМР (CDCl3) 1,55-2,18 (m, 5 Н), 2,502,82 (m, 4 Н), 3,25-3,70 (m, 4 Н), 3,77 (s, 3 Н), 4,50(t, J = 3,6 Hz, 2 Н), 6,75-7,07 (m, 8 Н), 12,56 (bs,1 Н). Элементный анализ для C21H27ClFNO2: вычислено: С 66,39; Н 7,16; N 3,69; найдено: С 66,52; Н 7,29; N 3,68. Пример 36 Гидробромид 1-(2-(4-фторфенокси)этил)-4-(4 нитробензил)пиперидина А) Трифторацетамид 4-(2 и 4 нитробензил)пиперидина. К перемешиваемому,охлажденному на бане со льдом TFAA (5 мл) добавляют по каплям 4-бензилпиперидин (2,00 г, 11,4 ммоль) на протяжении 10 мин. Добавляют дополнительное количество TFAA (5 мл) и реакционную смесь перемешивают в течение 5 мин. Баню со льдом удаляют и реакционной смеси дают перемешиваться еще в течение 1 ч. Ее повторно охлаждают в бане со льдом и добавляют порциями твердый KNO3 (1,21 г, 12,0 ммоль). Баню со льдом удаляют и затем добавляют TFA (10 мл). После перемешивания при 25 С в течение 1 ч реакционную смесь добавляют к воде со льдом (200 мл) с получением смолистой смеси. Ее экстрагируют СНСl3 (3 х 58 75 мл). Экстракт промывают водой (200 мл),насыщенным NаНСО 3 (200 мл) и водой (200 мл), фильтруют через хлопчатобумажную ткань и растворитель удаляют на роторном испарителе с получением желтого масла (3,6 г). Смесь разделяют хроматографией на силикагеле с получением орто-изомера в виде бледно-желтого твердого вещества (371 мг, 11%): т. пл. 74,576,5 С; 1 Н ЯМР (CDCl3) 1,20-1,40 (m, 2 Н), 1,712,05 (m, 3 Н), 2,68 (t, J = 13 Hz, 1 Н), 2,75-2,95 (m,2 Н), 3,05 (t, J1 = 13 Hz, J2 = 14 Hz, 1H), 3,98 (d, JHz, 1H), 7,96 (d, J = 7,8 Hz, 1H); и пара-изомера в виде желтого масла (1,03 г, 29%): 1 Н ЯМР (CDCl3) 1,20-1,40 (m, 2H), 1,711,98 (m, 3H), 2,60-2,75 (m, 3 H), 3,06 (t, J1 = 13B) Гидрохлорид 4-(4-нитробензил) пиперидина. К перемешиваемому раствору трифторацетамида 4-(4-нитробензил)пиперидина (1,00 г,3,16 ммоль) в 95% EtOH добавляют растворNaOH (500 мг) в воде (5 мл). Реакционной смеси дают перемешиваться при 25 С. Спустя 5 мин реакционную смесь добавляют в воду и экстрагируют СНСl3 (3 х 50 мл). Экстракт промывают водой (100 мл), фильтруют через хлопчатобумажную ткань и растворитель удаляют на роторном испарителе с получением желтого масла. Масло растворяют в МеОН (5 мл) и добавляют концентрированную НСl, пока раствор амина не станет перманентно кислым. Растворитель удаляют на роторном испарителе и полученное твердое вещество сушат на роторном испарителе при 70 С (750 мг, 92%): т. пл. 191194 С. 1 Н ЯМР (D2O) 1,35-1,57 (m, 2H), 1,78-2,05C) Гидробромид 1-(2-(4-фторфенокси) этил)-4-(4-нитробензил)пиперидина. Это соединение получают аналогично примеру 25. Из гидрохлорида 4-(4-нитробензил)пиперидина(427 мг, 1,66 ммоль) и 2-(4-фторфенокси) этилбромида (381 мг, 1,74 ммоль) получают гидробромидную соль в виде бледно-бежевого порошка (510 мг, 94%): т. пл. 147-148 С; 1 Н ЯМР (CDCl3) 1,65-1,89 (m, 3H), 2,20 (q,J = 12 Hz, 2H), 2,69-2,90 (m, 4H), 3,35-3,45 (m,2H), 3,73 (d, J = 12 Hz, 2H), 4,55 (t, J = 3,6 Hz,2H), 6,77-7,04 (m, 4 H), 7,30 (d, J = 8,4 Hz, 2H),8,26 (d, J = 8,4 Hz, 2 H), 11,75 (bs, 1H). Элементный анализ для C20H24BrFN2O3: вычислено: С 54,68; Н 5,51; N 6,38; найдено: С 54,67; Н 5,36; N 6,29. Пример 37 Гидробромид 4-(4-нитробензил)-1-(3 феноксипропил)пиперидина Это соединение получают аналогично примеру 10. Из гидрохлорида 4-(4-нитробензил) пиперидина (250 мг, 974 ммоль) и 3 феноксипропилбромида (219 мг, 1,02 ммоль) получают гидробромидную соль в виде бежевого порошка (289 мг, 94%): т. пл. 148-150 С; 1 Н ЯМР (CDCl3) 1,78-2,82 (m, 11 Н), 3,123,26 (m, 2 Н), 3,66 (d, J = 11 Hz, 2 Н), 4,07 (t, J = 5,1 Hz, 2H), 6,84 (d, J = 8,1 Hz, 2H), 6,96 (t, J = 7,5 Hz, 1H), 7,23-7,35 (m, 4H), 8,16 (d, J = 8,4 Hz,2 H), 11,40 (bs, 1H). Элементный анализ для C21H27BrN2O3: вычислено: С 57,94; Н 6,25; N 6,43; найдено: С 57,72; Н 6,11; N 6,15. Пример 38 Дигидрохлорид 4-(4-хлоранилино)-1-(2-(4 фторфенокси)этил)пиперидина А) 1-(2-(4-Фторфенокси)этил)-4-пиперидон. Это соединение получают аналогично примеру 7. Из гидрохлорида моногидрата 4 пиперидона (2,50 г, 16,3 ммоль), 2-(4-фторфенокси)этилбромида (3,74 г, 17,1 ммоль) получают амин в виде бледно-желтой жидкости, которая кристаллизуется при встряхивании (3,39 г,88%): т. пл. 71-73 С; 1 Н ЯМР (CDCl3) 2,48 (t, J= 6,0 Hz, 4H),2,85-2,97 (m, 6 Н), 4,10 (t, J = 5,4 Hz, 2H), 6,807,03 (m, 4H). В) Дигидрохлорид 4-(4-хлоранилино)-1-(2(4-фторфенокси)этил)пиперидина. К перемешиваемому раствору 1-(2-(4-фторфенокси)этил)-4 пиперидона (1,00 г, 4,21 ммоль) в МеОН (10 мл) добавляют 4-хлоранилин (1,61 г, 12,6 ммоль) иNaCNBH3 (787 мг, 12,6 ммоль). Полученному раствору дают перемешиваться при 25 С в атмосфере азота в течение 5 дней. Получают коричневый раствор. Реакционную смесь добавляют к 10% НСl (100 мл) и дают перемешиваться при 25 С в течение 20 мин для разложения избыточного восстановителя. Полученную смесь промывают эфиром (3 х 50 мл). Эфир обратно экстрагируют 10% НСl (25 мл). Объединенную кислую часть подщелачивают (рН 8) раствором NaOH. Щелочной раствор экстрагируют эфиром (3 х 50 мл). Эфирный экстракт промывают насыщенным NaCl (50 мл), фильтруют через хлопчатобумажную ткань и эфир удаляют на роторном испарителе с получением бесцветного масла. Его очищают хроматографически на силикагеле (2,5 х 30 см). Элюированием СНСl3 удаляют непрореагировавший 4 хлоранилин. Элюирование смесью 2%EtOH/98% CHCl3 дает продукт в виде бледнооранжевого твердого вещества (398 мг, 27%): т. пл. 66-71 С. Гидрохлоридную соль получают вH). Элементный анализ для C19H24Cl3FN2O: вычислено: С 54,11; H 5,74; N 6,64; найдено: С 54,21; Н 5,78; N 6,54. Пример 39 Гидрохлорид 1-(2-(4-фторфенокси)этил)-4-(N(4-фторанилино)пиперидина Это соединение получают аналогично примеру 38. Из 1-(2-(4-фторфенокси)этил)-4 пиперидона (2,20 г, 9,27 ммоль), 4-фторанилина(m, 4 Н), 3,18-3,80 (m, 7 Н), 4,39 (t, J =4,5 Hz),6,90-7,32 (m, 8H). Элементный анализ для C19H23ClF2N2O 0,14H2O: вычислено: С 61,45; Н 6,32; N 7,54; найдено: С 61,10; Н 5,92; N 7,36. Пример 40 Гидробромид 4-(N-(4-хлоранилино)-1-(3 феноксипропил)пиперидинаA) 1-(3-Феноксипропил)-4-пиперидон. Это соединение получают аналогично примеру 7. Из гидрохлорида моногидрата 4-пиперидона (3,07 г, 20,0 ммоль) и 3-феноксипропилбромида (4,52 г, 21,0 ммоль) получают амин в виде бледножелтой жидкости (1,48 г, 32%): 1 Н ЯМР (CDCl3) 2,03 (р, J= 6,6 Hz, 2 Н),2,46 (t, J = 5,7 Hz, 4 Н), 2,66 (t, J = 6,9 Hz, 2 Н),2,78 (t, J = 6,0 Hz, 4H), 4,06 (t, J = 6,0 Hz, 2 H),6,88-6,99 (m, 3H), 7,29 (t, J1 = 8,1 Hz, J2 = 7,5 Hz,2H).B) Гидробромид 4-(N-(4-хлоранилино)-1(3-феноксипропил)пиперидина. Это соединение получают аналогично примеру 38. Из 1-(3 феноксипропил)-4-пиперидона (1,47 г, 6,30 ммоль), 4-хлоранилина (804 мг, 6,30 ммоль) иNaCNBH3 (1,31 г, 21 ммоль) получают гидробромидную соль в виде бесцветного твердого вещества (450 мг, 14%), т. пл. 193-195 С (разл.); 1 Н ЯМР (DMSO-d6) 1,60-2,25 (m, 6 Н), 3,003,65 (m, 7 Н), 4,04 (t, J = 5,7 Hz, 2H), 6,62-6,70
МПК / Метки
МПК: A61P 13/00, C07D 211/14, A61K 31/445
Метки: аналоги, подтип-селективных, пиперидина, антагонистов, использование, nmda, качестве, 4-замещенные, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-1323-4-zameshhennye-analogi-piperidina-i-ih-ispolzovanie-v-kachestve-podtip-selektivnyh-antagonistov-receptorov-nmda.html" rel="bookmark" title="База патентов Евразийского Союза">4-замещенные аналоги пиперидина и их использование в качестве подтип-селективных антагонистов рецепторов nmda.</a>
Предыдущий патент: Производные 2-(4-замещенного)-бензиламино-2-метилпропанамида.
Следующий патент: Гетеробициклические производные
Случайный патент: Способ и устройство для различения естественного кожного покрова при бесконтактной биометрической идентификации личности


































