Новые индолиновые соединения
Номер патента: 12971
Опубликовано: 26.02.2010
Авторы: Дюма Кристин, Лебретон Люк, Массардье Кристин, Бонду Мишель
Формула / Реферат
1. Соединение сульфонилиндолина, характеризующееся тем, что оно выбрано из
i) соединений формулы
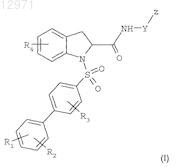
где
R1 представляет собой атом водорода, галоген, группу C1-C4алкил, группу C1-C4 алкокси, группу трифторметил, или полностью, или частично галогенированную группу метокси,
R2 представляет собой атом водорода, галоген, группу C1-C4алкил или группу трифторметил,
R3 представляет собой атом водорода, галоген, группу C1-C4алкил или группу трифторметил, при условии, что R1, R2 и R3 не представляют собой одновременно атом водорода,
R4 представляет собой атом водорода или группу C1-C4алкокси,
Y представляет собой нормальную или разветвленную группу C1-C8алкилен, возможно замещенную группой трифторметил или фенильным кольцом, либо содержащую циклизованную часть, имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, где
W представляет собой атом кислорода, группу -NH- или атом серы,
n равно 2, 3 или 4,
Z представляет собой возможно частично галогенированную группу C1-C4 алкил, трифторметил,
-CORa, -CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, пирролидинила, пирролидинилона, имидазолила, пиридинила, пиридинилоксида, пиперидинила, пиперазинила, пиридазинила, морфолинила и индолинилона, и возможно замещенное одним, двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1-C4 алкокси, трифторметила, нитро, N(R)2, -CH2-N(R)2, -O-(CH2)n-N(R)2, гидроксила, циано, C2-C3 цианоалкила, 5-оксо-1,2,4-оксадиазолидинила и группы формулы -X-[C(R)2]p-CORa,
X представляет собой одинарную связь, атом кислорода, -O-CH2-, атом серы, группу -NR- или группу 1,1-циклопропилен,
R3 представляет собой OR или N(R)2,
R представляет собой атом водорода или группу C1-C4алкил, и
р равно 0, 1, 2, 3 или 4; и
ii) фармацевтически приемлемых солей указанных соединений формулы (I).
2. Соединение формулы (I) по п.1, характеризующееся тем, что асимметрический атом углерода индолиновой группы находится в S конфигурации.
3. Соединение формулы (I) по п.1 или 2, характеризующееся тем, что R1 представляет собой атом фтора или группу трифторметил.
4. Соединение формулы (I) по пп.1, 2 или 3, характеризующееся тем, что Y представляет собой группу -CH2- или группу -(СН2)2-O-, a Z представляет собой ароматическое кольцо, замещенное группой, содержащей группу карбоновой кислоты, где указанное ароматическое кольцо возможно содержит один или два других заместителя, выбранных из галогена, группы C1-C4алкил, предпочтительно метил, группы C1-C4 алкокси, предпочтительно метокси, и группы трифторметил.
5. Применение соединения по любому из пп.1-4 в качестве фармакологически активного вещества.
6. Применение соединения по любому из пп.1-4 для изготовления лекарственного средства для лечения нейродегенерации, сердечно-сосудистого заболевания, воспалительного заболевания, гиперхолестеринемии, дислипидемии, ожирения и диабета.
7. Фармацевтическая композиция, характеризующаяся тем, что она содержит по меньшей мере одно соединение по любому из пп.1-4 в качестве активного вещества.
8. Композиция по п.7 для лечения сердечно-сосудистого заболевания, гиперхолестеринемии, дислипидемии и ожирения.
9. Композиция по п.7 для лечения диабета.
10. Композиция по п.7 для лечения нейродегенерации.
11. Композиция по п.7 для лечения воспалительного заболевания.
12. Способ получения соединения по любому из пп.1-4, характеризующийся тем, что он включает стадии, на которых подвергают взаимодействию бензолсульфонилхлорид формулы
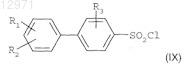
где
R1 представляет собой атом водорода, галоген, группу C1-C4алкил, группу C1-C4 алкокси, группу трифторметил, или полностью, или частично галогенированную группу метокси,
R2 представляет собой атом водорода, галоген, группу C1-C4алкил или группу трифторметил, и
R3 представляет собой атом водорода, галоген, группу C1-C4алкил или группу трифторметил при условии, что R1, R2 и R3одновременно не представляют собой атом водорода,
с производным индолина формулы
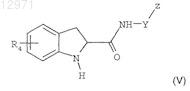
где
R4 представляет собой атом водорода или группу C1-C4алкокси,
Y представляет собой нормальную или разветвленную группу C1-C8алкилен, возможно замещенную трифторметильной группой или фенильным кольцом, либо содержащую циклизованную часть, имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, где
W представляет собой атом кислорода, группу -NH- или атом серы,
n равно 2, 3 или 4,
Z представляет собой возможно частично галогенированную C1-C4 алкильную группу, трифторметил, CORa, CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, 1-пирролидинила, пирролидинилона, 1-имидазолила, пиридинила, 1-пиперидинила, 4-алкил-1-пиперазинила, пиридазинила, 4-морфолинила и индолинилона, и возможно замещенное одним, двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1-C4 алкокси, трифторметила, нитро, N(R)2, -CH2-N(R)2, -O-(CH2)n-N(R)2, гидроксила, циано, C2-C3 цианоалкила и группы формулы -X-[C(R)2]p-CORa,
X представляет собой одинарную связь, атом кислорода, атом серы, группу NH или группу 1,1-циклопропилен,
Raпредставляет собой OR или N(R)2,
R представляет собой C1-C4 алкильную группу, и
р равно 0, 1, 2, 3 или 4,
в безводном растворителе, таком как дихлорметан, при комнатной температуре в течение 2-10 ч с получением соединения формулы
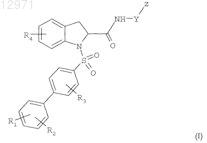
где R1, R2, R3, R4, Y и Z являются такими, как определено в исходных соединениях.
Текст
012971 Настоящее изобретение относится к новым соединениям, способным к модулированию активностиLXR, к способу их получения и к фармацевтическим композициям, содержащим эти соединения. Печеночные рецепторы X (LXR) представляют собой факторы транскрипции, принадлежащие к надсемейству ядерных рецепторов, которое также включает рецепторы ретиноевой кислоты (RXR), рецепторы фарнезоида X (FXR) и рецепторы, активируемые пролифератором пероксисом (PPAR). При связывании с RXR рецепторы LXR образуют гетеродимер, который сам специфично присоединяется к регуляторным элементам ДНК (LXRE), что приводит к трансактивации генов-мишеней (Genes Dev. 1995; 9: 1033-45). Эти рецепторы вовлечены во многие пути метаболизма и, в частности, принимают участие в гомеостазе холестерина, желчных кислот, триглицеридов и глюкозы. Модулирование активности этих ядерных рецепторов оказывает влияние на прогрессирование метаболических расстройств, таких как диабет типа II, дислипидемия, и на развитие атеросклероза. Гетеродимер LXR/RXR может активироваться лигандами LXR и/или RXR. Для трансактивации генов-мишеней требуется рекрутмент соактиваторов, таких как Grip-1 (Nature 1996; 383: 728-31). Два типа LXR, идентифицированные к настоящему времени, а именно LXR и LXR, обладают высокой степенью подобия их аминокислотной последовательности, но различаются по тканевому распределению. LXR сильно экспрессируется в печени и в меньшей степени в почках, тонком кишечнике,жировой ткани и селезенке. LXR распределен повсеместно (Gene 2000; 243: 93-103; N.Y. Acad. Sci 1995; 761:38-49). Хотя LXR не активируются непосредственно холестерином, они активируются моноокисленными производными холестерина (оксистеринами), более конкретно 22(R)-гидроксихолестерином, 24(S)гидроксихолестерином и 24(S),25-эпоксихолестерином. Эти оксистерины считают физиологическими лигандами LXR (Nature 1996; 383: 728-31; J. Biol. Chem. 1997; 272: 3137-40). Также показано, что оксистерин 5,6,24(S),25-диэпоксихолестерин является специфичным лигандом LXR, что позволяет предположить возможность разработки специфичных лигандов LXR и/или LXR (Proc. Natl. Acad. Sci. USA 1999; 96: 26-71; Endocrinology 2000; 141: 4180-4). Другие исследователи смогли продемонстрировать, что в плазме человека содержатся природные антагонисты LXR и(Steroids 2001; 66:473-479). Используя гепатоциты крысы, возможно было показать, что ненасыщенные жирные кислоты существенно повышают экспрессию LXR без воздействия на LXR (Mol. Endocrinol. 2000; 14: 161-171). Кроме того, активаторы PPAR итакже индуцируют экспрессию LXR в первичных макрофагах человека. Высокие концентрации LXR в печени, а также идентификация эндогенных лигандов LXR позволили предположить, что эти рецепторы играют незаменимую роль в метаболизме холестерина. В физиологических условиях гомеостаз холестерина поддерживается посредством регуляции биохимических путей синтеза de novo и катаболизма. Посредством механизма обратной связи, в который вовлечены факторы транскрипции, такие как SREBP-1 и SREBP-2, аккумуляция стеринов в печени приводит к ингибированию биосинтеза холестерина (Cell 1997; 89: 331-40). Избыточный холестерин также активирует другой путь метаболизма, который приводит к превращению холестерина в желчные кислоты. Холестерин превращается в 7-гидроксихолестерин ферментом, локализованным в печени (CYP7A: 7-гидроксилазой) (J. Biol. Chem. 1997; 272:313-40). Вовлеченность LXR в синтез желчных кислот и, следовательно, в регуляцию гомеостаза холестерина продемонстрирована с помощью мышей с дефицитом по LXR, которые при содержании на диете с высоким содержанием жиров аккумулируют большие количества эфиров холестерина в печени (Cell 1998; 93: 693-704). Мыши с дефицитом по LXR обладают такой же физиологической устойчивостью,как нормальные мыши, к диете, обогащенной жирами. Экспрессия неизмененного LXR у мышей с дефицитом по LXR склонна демонстрировать, что LXR сам по себе неспособен к существенному повышению метаболизма холестерина (J. Clin. Invest. 2001; 107:565-573).LXR, экспрессируемые в макрофагах, также играют важную роль в регуляции некоторых функций макрофагов. Более конкретно, они вовлечены в регуляцию обратного транспорта холестерина, которая обеспечивает экспортирование избыточного холестерина из периферических тканей в печень. Холестерин захватывается пре-b-ЛПВП посредством ароА 1 и АВСА 1 для транспортировки в печень, где он претерпевает катаболизм до желчных кислот, а затем элиминируется. АВСА 1 является членом надсемейства транспортных белков (АТФ-связывающей кассеты), значимость которого иллюстрируется тем фактом, что мутация в гене АВСА 1 ответственна за болезнь Танжье(Nat. Genet. 1999; 22:336-45). Экспрессия АВСА 1 и отток холестерина индуцируются нагрузкой макрофагов человека холестерином и активацией LXR (Biochem. Biophys. Res. Comm. 1999; 257: 29-33). Впоследствии также продемонстрировано, что экспрессия ABCG1, ABCG5 и ABCG8, других членов семейства переносчиков ABCтипа, в тонком кишечнике также регулируется гетеродимером RXR/LXR (J. Biol. Chem. 2000; 275: 1470014707; Proc. Natl. Acad. Sci. USA 2000; 97: 817-22; J. Biol. Chem. 2002; 277: 18793-18800; Proc. Natl. Acad.Sci. USA 2002; 99: 16237-16242). Также показано, что агонистические лиганды LXR уменьшают атероматозные повреждения в двух различных мышиных моделях (мышей АроЕ-/- и мышей LDLR-/) (Proc. Natl. Acad. Sci USA 2002; 99: 7604-7609; FEBS Letters 2003; 536: 6-11). Эти результаты позволяют предположить, что лиганды LXR могут составлять терапевтические агенты для лечения атеросклероза. Наконец, известно, что макрофаги играют важную роль при воспалении, в частности, в патогенезе атеросклероза. Показано, что активация LXR ингибирует экспрессию генов, вовлеченных в воспаление, в макрофагах (Nature Medicine 2003; 9: 213-219). In vitro экспрессия медиаторов, таких как синтаза оксида азота, циклооксигеназа-2 (СОХ-2) и интерлейкин-6 (IL-6), ингибируется. In vivo агонисты LXR уменьшают воспаление в модели дерматита и ингибируют экспрессию генов, вовлеченных в воспаление, атероматозных аорт мыши. Поскольку оказывается, что гомеостаз холестерина также играет незаменимую роль в функционировании центральной нервной системы и механизмах нейродегенерации, экспрессия АВСА 1 также исследована в культурах первичных нейронов, астроцитов и микроглии, выделенных из головного мозга эмбрионов крыс. Результаты этих исследований показывают, что активация LXR приводит к снижению секреции амилоидаи, следовательно, к уменьшению амилоидных отложений в головном мозге. Эти исследования позволяют предположить, что активация LXR может составлять новый подход к лечению болезни Альцгеймера (J. Biol. Chem. 2003; 275 (15): 13244-13256; J. Biol. Chem. 2003; 278 (30): 2768827694).LXR также вовлечены в регуляцию экспрессии аполипопротеина E (АроЕ). Этот белок в значительной степени вовлечен в печеночный клиренс липопротеинов и благоприятствует оттоку холестерина из обогащенных липидами макрофагов. Продемонстрировано, что активация LXR приводит к повышению экспрессии АроЕ посредством элемента ответа на LXR (LXRE, LXR response element), расположенного в последовательности промотора АроЕ (Proc. Natl. Acad. Sci USA 2001; 98:507-512). Активация LXR должна также благоприятствовать обратному транспорту холестерина посредством модулирования экспрессии CETP (cholesterol ester transfer protein; транспортного белка эфиров холестерина), который вовлечен в перенос эстерифицированного холестерина из ЛПВП (липопротеинов высокой плотности) в обогащенные триглицеридами липопротеины, элиминируемые печенью (J. Clin. Invest. 2000; 105: 513-520). В кратком изложении, активация LXR приводит к повышению экспрессии различных генов, которые благоприятствуют элиминации избытка холестерина из периферических тканей. В макрофагах, нагруженных холестерином, активация LXR повышает экспрессию АВСА 1, ABCG1, ABCG5, ABCG8 и АроЕ, вызывая усиление оттока холестерина из макрофагов в печень, где он выводится в форме желчных кислот. Индукция экспрессии CETP и CYP7A в печени приводит, соответственно, к повышению печеночного клиренса эфиров холестерина из ЛПВП и к катаболизму холестерина. Другими исследователями также продемонстрировано, что LXR играет важную роль в метаболизме глюкозы. Обработка грызунов с диабетом агонистом LXR приводит к резкому снижению уровней глюкозы в плазме. В частности, у устойчивых к инсулину крыс Zucker (fa/fa) активация LXR ингибирует экспрессию генов, вовлеченных в глюконеогенез, включая более конкретно фосфоенолпируваткарбоксикиназу (PEPCK) (J. Biol. Clem. 2003, 278 (2): 1131-1136). Также показано, что агонист LXR повышает толерантность к глюкозе в мышиной модели устойчивости к инсулину и ожирения (Proa Natl. Acad. Sci. USA 2003; 100: 5419-5424). Анализ экспрессии генов демонстрирует регуляцию генов, вовлеченных в метаболизм глюкозы в печени: снижение экспрессии соактиватора-1 рецептора, активируемого пролифератором пероксисом(PGC-1), фосфоенолпируваткарбоксикиназы (PEPCK) и глюкозо-6-фосфатазы; индукцию экспрессии глюкокиназы, которая благоприятствует утилизации печеночной глюкозы. Также продемонстрирована транскрипционная индукция чувствительного к инсулину переносчика глюкозы (GLUT4) в жировой ткани. Эти результаты подчеркивают важность LXR в координировании метаболизма глюкозы. Также известно, что LXR принимает участие в процессах регуляции воспаления (Nature Medicine 2003, 9:213-219). Соединения, которые модулируют активность LXR, известны из уровня техники, в частности, из документов WO 03/090869, WO 03/90746, WO 03/082192 или WO 03/082802, либо из документов WO 03/043985 и WO 04/005253, в которых описаны соединения типа бензолсульфонамидов, которые являются агонистами PPAR. В данном контексте существует значительный интерес в открытии новых соединений, которые модулируют активность LXR, и которые должны быть полезны при лечении некоторых патологических состояний, таких как сердечно-сосудистое заболевание, гиперхолестеринемия, дислипидемия, инфаркт миокарда, атеросклероз, диабет, ожирение, воспаление и нейродегенеративное заболевание. Настоящее изобретение точно основано на открытии новых соединений, которые модулируют активность LXR.-2 012971 Таким образом, согласно первому признаку, задачей настоящего изобретения является защита в качестве нового промышленного продукта соединения сульфонилиндолина, характеризующегося тем, что оно выбрано из:R1 представляет собой атом водорода, галоген, группу C1-C4 алкил, группу C1-C4 алкокси, группу трифторметил, или полностью, или частично галогенированную группу метокси,R2 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил,R3 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил, при условии, что R1, R2 и R3 не представляют собой одновременно атом водорода,R4 представляет собой атом водорода или группу C1-C4 алкокси,Y представляет собой нормальную или разветвленную группу C1-C8 алкилен, возможно замещенную группой трифторметил или фенильным кольцом, либо содержащую циклизованную часть, имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, гдеW представляет собой атом кислорода, группу -NH- или атом серы,n равно 2, 3 или 4,Z представляет собой возможно частично галогенированную группу C1-C4 алкил, трифторметил,-CORa, -CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, пирролидинила, пирролидинилона, имидазолила, пиридинила, пиридинилоксида, пиперидинила, пиперазинила, пиридазинила, морфолинила и индолинилона, и возможно замещенное одним, двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1-C4 алкокси, трифторметила, нитро, N(R)2, -CH2-N(R)2, -O-(CH2)n-N(R)2, гидроксила, циано,C2-C3 цианоалкила, 5-оксо-1,2,4-оксадиазолидинила и группы формулы -X-[C(R)2]p-CORa,X представляет собой одинарную связь, атом кислорода, -O-CH2-, атом серы, группу -NR- или группу 1,1-циклопропилен,Ra представляет собой OR или N(R)2,R представляет собой атом водорода или группу C1-C4 алкил, и р равно 0, 1, 2, 3 или 4; иii) фармацевтически приемлемых солей указанных соединений формулы (I). Согласно второму признаку изобретение относится к вышеупомянутым соединениям для их применения в качестве фармакологически активных веществ. В частности, изобретение относится к применению по меньшей мере одного соединения формулы(I) или одной из его фармацевтически приемлемых солей в качестве активных веществ для изготовления лекарственного средства для применения в терапии, в частности, для борьбы с гиперхолестеринемией,дислипидемией, гипертриглицеридемией, ожирением и сердечно-сосудистыми заболеваниями, которые являются следствием дисбаланса сывороточного липопротеина. Соединения по изобретению также полезны в качестве активных веществ лекарственных средств для предупреждения или лечения атеросклероза, инфаркта миокарда, определенных воспалительных заболеваний, например дерматита, и нейродегенерации, например болезни Альцгеймера. Соединения по изобретению также полезны в качестве активных веществ лекарственных средств для лечения диабета и гипергликемии. Подробное описание В рамках настоящей патентной заявки: под группой C1-C4 алкил подразумевают насыщенную углеводородную цепь, имеющую от 1 до 4 атомов углерода, которая является нормальной или разветвленной или содержит кольцо, имеющее 3 или 4 атома углерода, например группу метил, этил, пропил, бутил, 1-метилэтил, 1-метилпропил, 2 метилпропил, 1,1-диметилэтил, циклопропил, метилциклопропил или циклопропилметил; под частично галогенированной группой C1-C4 алкил подразумевают группу C1-C4 алкил, как определено выше, в которой один (или более чем один) атом водорода замещен соответствующим числом атомов галогена; под группой C1-C4 алкокси подразумевают группу C1-C4 О-алкил, в которой группа C1-C4 алкил является такой, как определено выше, например, группу метокси, этокси, пропокси, бутокси, 1-метилэтокси, 1-этилэтокси или 1- или 2-метилпропокси; под полностью или частично галогенированной группой метокси подразумевают группу метокси, в-3 012971 которой от 1 до 3 атомов водорода замещены соответствующим числом атомов галогена, например группу -O-CH2F, -O-CHF2 или -O-CF3; под галогеном подразумевают атом фтора, хлора, брома или йода, где атомы фтора и хлора предпочтительны; и под алкиленом подразумевают насыщенную углеводородную цепь. Соединения, в которых Ra представляет собой ОН, представляют собой карбоновые кислоты, которые можно использовать в форме свободных кислот или в форме солей, где указанные соли получают путем взаимодействия кислоты с фармацевтически приемлемым, нетоксичным минеральным или органическим основанием. Примерами используемых минеральных оснований являются гидроксиды натрия, калия, магния и кальция. Примерами используемых органических оснований являются амины, аминоспирты, основные аминокислоты, такие как лизин или аргинин, или соединения, несущие четвертичную аммонийную группу, такие как бетаин или холин. В группе формулы -X-[C(R)2]p-CORa заместители R, которые несет атом углерода, могут быть идентичными или разными. Например, один может представлять собой атом водорода, а другой алкильную группу, причем в этом случае эта группа содержит асимметрический атом углерода, и соединение может представлять собой либо рацемическую смесь, либо один из двух энантиомеров, R или S. Соединения по изобретению содержат асимметрический атом углерода (несущий карбоксамидную группу, связанную с индолиновой группой), который может быть либо рацемическим, либо в Rконфигурации, либо в S-конфигурации (фиг. Ia). Из этих различных конфигураций предпочтительными соединениями формулы (Ia) являются те, в которых асимметрический атом углерода индолиновой группы имеет S-конфигурацию. Другими предпочтительными соединениями формулы (I) являются те, в которых асимметрический атом углерода находится в S-конфигурации и/или R1 представляет собой атом фтора или трифторметильную группу. Другими предпочтительными соединениями являются те, в которых Y представляет собой группу-CH2- или группу -(СН 2)2-O-, a Z представляет собой ароматическое кольцо, замещенное группой, содержащей группу карбоновой кислоты, где указанное ароматическое кольцо возможно содержит один или два других заместителя, выбранных из галогена, группы C1-C4 алкил, предпочтительно метил, группы C1C4 алкокси, предпочтительно метокси, и группы трифторметил. Соединения по изобретению могут быть получены способом, который включает стадии, на которых: а) подвергают взаимодействию кислоту формулы где PG представляет собой аминозащитную группу, например, группу Boc (1,1-диметилэтоксикарбонил), a R4 представляет собой атом водорода или группу C1-C4 алкокси, с амином формулы гдеY представляет собой нормальную или разветвленную C1-C8 алкиленовую группу, возможно замещенную трифторметильной группой или фенильным кольцом, либо содержащую циклизованную часть,имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, где W представляет собой атом кислорода, группу -NH- или атом серы,n равно 2, 3 или 4,Z представляет собой возможно частично галогенированную C1-C4 алкильную группу, трифторметил, COR8, CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, пиридинила, 1-имидазолила, 1-пиперидинила, 4-алкил-1-пиперазинила, 4-морфолинила, 1-пирролидинила, индолинилона и пирролидинилона, и возможно замещенное одним, двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1C4 алкокси, трифторметила, нитро, N(R)2, -O-(CH2)n-N(R)2, гидроксила, циано, C2-C3 цианоалкила, 5-4 012971 оксо-1,2,4-оксадиазолидинила и группы формулы -X-[C(R)2]p-CORa,X представляет собой одинарную связь, -O-CH2-, атом кислорода, атом серы или группу 1,1 циклопропилен,Ra представляет собой OR или N(R)2,R представляет собой C1-C4 алкильную группу, и р равно 0, 1, 2, 3 или 4,в безводном растворителе, таком как дихлорметан, и в присутствии связывающего агента, такого как EDCI (1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид), DCC (дициклогексилкарбодиимид), либо свободного, либо привитого на смоле, либо HOAT (1-гидрокси-7-азабензотриазол), при температуре, близкой к комнатной температуре, в течение 2-20 ч, с получением амида формулы (IV): где Y, Z, R4 и PG являются такими, как определено в исходных соединениях, б) подвергают взаимодействию соединение формулы (IV), полученное выше, с трифторуксусной кислотой в растворителе,таком как дихлорметан, при комнатной температуре в течение 2-20 ч с получением соединения формулы где Y, R4 и Z являются такими, как определено в соединении (IV), в) подвергают взаимодействию соединение формулы (V) с бензолсульфонилхлоридом формулы (VI):R3 представляет собой атом водорода, атом фтора, атом хлора, C1-C4 алкильную группу или трифторметильную группу, иHal представляет собой атом брома или йода,в растворителе, таком как дихлорметан, при комнатной температуре в течение 2-20 ч с получением соединения формулы (VII): где Y, Z, R3, R4 и Hal являются такими, как определено в исходных соединениях,г) подвергают взаимодействию соединение формулы (VII), полученное выше, с фенилбороновой кислотой формулыR1 представляет собой атом водорода, атом фтора или хлора, группу C1-C4 алкил, группу C1-C4 алкокси, группу трифторметил, либо полностью или частично галогенированную группу метокси, иR2 представляет собой атом водорода, атом фтора, атом хлора, группу C1-C4 алкил или группу трифторметил,в так называемой реакции Сузуки (см., например, Chem. Rev. 1995, 95, 2457) в присутствии металлоорганического катализатора, такого как тетракис(трифенилфосфин)палладий, и основания, такого как карбонат натрия, в растворителе, таком как смесь гликолевого эфира и воды, при температуре между 30C и температурой флегмы растворителя в течение 5-24 ч с получением соединения формулы I где R1, R2, R3, R4, Y и Z являются такими, как определено в исходных соединениях,д) если необходимо, если заместитель Z содержит эфирную группу, подвергают гидролизу эту эфирную группу, например, путем взаимодействия с гидроксидом лития или гидроксидом натрия, если гидролиз можно проводить в щелочной среде, либо путем взаимодействия с трифторуксусной кислотой,если эфир представляет собой трет-бутиловый эфир, с получением соответствующего производного карбоновой кислоты, и е) если необходимо, получают соль кислоты, полученной выше, с минеральным или органическим основанием способами, хорошо известными специалистам в данной области техники. В качестве варианта вышеописанного способа соединения формулы I по изобретению могут быть получены способом, при котором: подвергают взаимодействию бензолсульфонилхлорид формулыR1 представляет собой атом водорода, галоген, группу C1-C4 алкил, группу C1-C4 алкокси, группу трифторметил, либо полностью или частично галогенированную группу метокси,R2 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил, иR3 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил при условии, что R1, R2 и R3 одновременно не представляют собой атом водорода,с производным индолина формулыR4 представляет собой атом водорода или группу C1-C4 алкокси,Y представляет собой нормальную или разветвленную C1-C8 алкиленовую группу, возможно замещенную трифторметильной группой или фенильным кольцом, либо содержащую циклизованную часть,имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, гдеW представляет собой атом кислорода, группу -NH- или атом серы,n равно 2, 3 или 4,Z представляет собой возможно частично галогенированную C1-C4 алкильную группу, трифторметил, COR3, CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, 1-пирролидинила, пирролидинилона, 1-имидазолила, пиридинила, 1-пиперидинила,4-алкил-1-пиперазинила, пиридазинила, 4-морфолинила и индолинилона, и возможно замещенное одним, двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1-C4 алкокси, трифторметила, нитро, N(R)2, -CH2-N(R)2, -O-(CH2)n-N(R)2, гидроксила,циано, C2-C3 цианоалкила и группы формулы -X-[C(R)2]p-CORa, гдеX представляет собой одинарную связь, -O-CH2-, атом кислорода, атом серы, группу -NR- или группу 1,1-циклопропилен,R3 представляет собой OR или N(R)2,R представляет собой C1-C4 алкильную группу, и р равно 0, 1, 2, 3 или 4,в безводном растворителе, таком как дихлорметан, при комнатной температуре в течение 2-10 ч с получением соединения формулы где R1, R2, R3, R4, Y и Z являются такими, как определено в исходных соединениях. Другой вариант способа получения соединений формулы (1) включает проведение стадий, на которых: а) подвергают взаимодействию бензолсульфонилхлорид формулыR1 представляет собой атом водорода, галоген, группу C1-C4 алкил, группу C1-C4 алкокси, группу трифторметил, либо полностью или частично галогенированную группу метокси,R2 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил, иR3 представляет собой атом водорода, галоген, группу C1-C4 алкил или группу трифторметил при условии, что R1, R2 и R3 одновременно не представляют собой атом водорода,с эфиром индолина формулы где Rb представляет собой группу C1-C4 алкил, предпочтительно группу метил, a R4 представляет собой атом водорода или группу C1-C4 алкокси,в условиях, аналогичных условиям вышеописанного способа, с получением соединения формулы где R1, R2, R3, R4 и Rb являются такими, как определено в исходных соединениях,б) превращают эфир (XI) в кислоту путем взаимодействия с основанием в водно-спиртовой среде с помощью методик, хорошо известных специалистам в данной области техники, с получением кислоты формулы (XII) где R1, R2, R3 и R4 остаются неизмененными, и в) подвергают взаимодействию кислотное соединение (XII) с первичным амином формулы (III): гдеY представляет собой нормальную или разветвленную C1-C8 алкиленовую группу, возможно замещенную трифторметильной группой или фенильным кольцом, либо содержащую циклизованную часть,имеющую от 3 до 6 атомов углерода, либо представляет собой группу -(CH2)n-W-, гдеW представляет собой атом кислорода, -NH- или атом серы,-7 012971n равно 2, 3 или 4,Z представляет собой возможно частично галогенированную C1-C4 алкильную группу, трифторметил, COR3, CH2-N(R)2, либо ароматическое, гетероароматическое или гетероциклическое кольцо, выбранное из фенила, пиридинила, 1-имидазолила, 1-пиперидинила, 4-алкил-1-пиперазинила, пиридазинила, 4-морфолинила, 1-пирролидинила, пирролидинона и индолинилона, и возможно замещенное одним,двумя или тремя идентичными или разными заместителями, выбранными из галогена, C1-C4 алкильной группы, C1-C4 алкокси, трифторметила, нитро, N(R)2, -CH2-N(R)2, -O-(CH2)n-N(R)2, гидроксила, циано,C2-C3 цианоалкила и группы формулы -X-[C(R)2]p-CORa,X представляет собой одинарную связь, атом кислорода, группу -O-CH2-, атом серы или группу-NR-,Ra представляет собой OR или N(R)2,R представляет собой группу C1-C3 алкил, и р равно 0,1, 2, 3 или 4,с помощью методики, аналогичной описанной для стадии (а) первого вышеописанного способа, с получением соединения формулы (I) где R1, R2, R3, R4, Y и Z являются такими, как определено в исходных соединениях. Соединения формулы (I), в которых Z содержит аминогруппу, могут быть получены из их нитрогомологов путем реакции восстановления или реакции каталитической гидрогенизации общепринятыми способами, хорошо известными специалистам в данной области техники. Эти соединения могут быть также получены из соединений формулы I, содержащих цианогруппу, которые восстанавливают способами, известными специалистам в данной области техники, в частности, путем каталитической гидрогенизации. Соединения, в которых Z содержит свободную группу NH2 или NH, могут быть также получены из аминов азотсодержащих гетероциклов, в которых группу NH2 или NH сначала защищают аминозащитной группой, например, группой Boc (1,1-диметилэтоксикарбонил), затем эту аминозащитную группу удаляют после проведения реакции присоединения с образованием амидной связи -CONH- или сульфонамидной связи -SO2N= соединения формулы I. Соединения формулы I, в которых асимметрический атом углерода находится в определенной конфигурации, R или S, предпочтительно получают из индолин-2-карбоновых кислот R или S конфигурации. Они могут быть также получены путем выделения из рацемического соединения способом, который сам по себе известен, хотя этот второй способ, как правило, менее предпочтителен. Приведенные ниже примеры получения соединений формулы (I) дадут возможность лучше понять изобретение. В этих примерах "Пример получения" означает примеры, в которых описан синтез промежуточных соединений, а "пример" означает такой, в котором описан синтез соединений формулы (I) по изобретению. Среди сокращений "ммоль" означает миллимоль. Точки плавления измеряют на установке Коффлера или в капилляре, а спектральные значения ядерного магнитного резонанса характеризуются химическим сдвигом, вычисленным относительно TMC (триметилсилана), по числу протонов, связанных с сигналом, и по форме сигнала (s для синглета, d для дублета, dd для дублета дублетов, t для триплета, q для квадруплета, m для мультиплета). Используемые рабочая частота и растворитель указаны для каждого соединения. Комнатная температура составляет 202 С. Приведенные ниже сокращения используют в описании этих примеров и примеров получения:PdCl2dppf: дихлор-1,1'-бис(дифенилфосфино)ферроценпалладий (II). Пример получения I. 2-2-(2-Фторфенил)этил]амино]карбонил]-2,3-дигидро-(2S)-1 Н-индол-1-карбоновой кислоты 1,1-диметилэтиловый эфир. Готовят раствор 2 г (7,6 ммоль) 2,3-дигидро-(2S)-1 Н-индол-1,2-дикарбоновой кислоты 1-(1,1-диметилэтил) эфира в 15 мл дихлорметана, а затем добавляют 1,74 г (9,11 ммоль) EDCI (1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида) и 206 мг (1,52 ммоль) HOAT (1-гидрокси-7-азабензотриазола). После перемешивания в течение 10 мин при комнатной температуре добавляют 1,20 мл (9,11 ммоль) 2-фторбензолэтанамина. Затем реакционную смесь перемешивают при комнатной температуре в течение 20 ч. Затем смесь обрабатывают добавлением дихлорметана, и органическую фазу промывают водой. Органическую фазу высушивают над сульфатом магния, а затем концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат (90/10; об./об.) в качестве элюента, с получением ожидаемого продукта в виде белого твердого вещества (выход = 84%). T. пл. = 133 С. Пример получения II. N-[2-(2-Фторфенил)этил]-2,3-дигидро-(2S)-1 Н-индол-2-карбоксамид. Готовят раствор 2,38 г (6,19 ммоль) соединения, полученного согласно примеру получения I, в 25 мл дихлорметана и добавляют 9,3 мл трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, а затем растворитель выпаривают при пониженном давлении. Затем остаток после выпаривания растворяют в воде и смесь нейтрализуют добавлением насыщенного раствора бикарбоната натрия. Образовавшийся белый осадок отфильтровывают и промывают водой. Полученное твердое вещество высушивают над пероксидом фосфора в вакууме с получением ожидаемого соединения в виде белого твердого вещества (выход = 98%). T. пл. = 135 С. Пример получения III. N-[2-(2-Фторфенил)этил]-2,3-дигидро-1-[(4-йодфенил)сульфонил]-(2S)-1 Ниндол-2-карбоксамид. Готовят раствор 100 мг (0,351 ммоль) соединения, полученного согласно примеру получения II, в 2 мл дихлорметана и добавляют 74 мкл триэтиламина и 117 мг (0,386 ммоль) 4-йодбензолсульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем смесь обрабатывают добавлением дихлорметана и органическую фазу промывают водой, высушивают над сульфатом магния, а затем концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (90/10; об./об.) в качестве элюента, с получением ожидаемого продукта в виде бесцветного масла (выход = 57%). 1H ЯМР (ДМСО,300 МГц) : 8.26 (t, NH); 7.92 (d, 2H); 7.50 (d, 2H); 7.25 (d, 1H); 7.3-7 (m, 7H); 4.71 (dd, 1H); 3.5-3.2 (m,2H); 3.1 (dd, 1H); 2.9-2.70 (dd и m, 3H). Пример 1. N-[2-(2-Фторфенил)этил]-2,3-дигидро-1-4'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. 102 мг (0,185 ммоль) соединения, полученного согласно примеру получения III, смешивают с 2 мл ДМЭ в реакционной пробирке для микроволновой печи и добавляют 0,66 мл воды, а затем 30 мг (0,278 ммоль) карбоната натрия, 15 мг (0,0185 ммоль) PdCl2dppf дихлор-1,1'-бис(дифенилфосфино)ферроценпалладия (II) и 71 мг (0,37 ммоль) 4-(трифторметил)фенилбороновой кислоты. Эту реакционную смесь нагревают в течение 10 мин при 110C в микроволновой печи. Добавляют дополнительно 15 мг (0,0185 ммоль) дихлор-1,1'-бис(дифенилфосфино)ферроценпалладия (II), и реакционную смесь снова нагревают в течение 30 мин при 110C в микроволновой печи. После охлаждения к реакционной смеси добавляют дихлорметан, и органическую фазу промывают раствором бикарбоната натрия, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (9/1; об./об.) в качестве элюента, с получением продукта в виде бесцветной пены (выход = 66%). 1(m, 4H); 4.78 (dd, 1H); 3.5-3.2 (m, 2H); 3.1 (dd, 1H); 2.9-2.70 (dd и m, 3H). Пример 2. N-[2-(2-Фторфенил)этил]-2,3-дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. 100 мг (0,181 ммоль) соединения, полученного согласно примеру получения III, смешивают с 2 мл ДМЭ в реакционной пробирке для микроволновой печи и добавляют 0,66 мл воды, а затем 29 мг (0,272 ммоль) карбоната натрия, 15 мг (0,0185 ммоль) PdCl2dppf и 69 мг (0,363 ммоль) 3-(трифторметил)фенилбороновой кислоты. Реакционную смесь нагревают в течение 10 мин при 110C в микроволновой печи. После охлаждения к реакционной смеси добавляют дихлорметан и органическую фазу промывают раствором карбоната натрия, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (9/1; об./об.) в качестве элюента, с получением продукта в виде белой пены (выход = 70%).H ЯМР (ДМСО, 300 МГц) : 8.28 (t, NH); 8.1-8.0 (m, 2H); 7.93 (d, 2H); 7.86 (d, 2H); 7.85-7.60 (m,2H); 7.50 (d, 1H); 7.30-7 (m, 7H); 4.78 (dd, 1H); 3.5-3.2 (m, 2H); 3.08 (dd, 1H); 2.9-2.70 (dd и m, 3H). Пример 3. N-[2-(2-Фторфенил)этил]-2,3-дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 2, начиная с 2-(трифторметил)фенилбороновой кислоты,ожидаемый продукт получили в виде розовой пены (выход = 67%). 1(dd, 1H); 3.5-3.2 (m, 2H); 3.05-2.07 (m, 4H). Пример получения IV. (2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1Hиндол-2-карбоновая кислота. а) (2S)-2,3-Дигидро-1-[(4-йодфенил)сульфонил]индол-2-карбоновая кислота. Готовят смесь 16,18 г (99,2 ммоль) (2S)-2,3-дигидроиндол-2-карбоновой кислоты, 1700 мл ацетонитрила, 400 мл воды и 2,37 г (99,2 ммоль) гидроксида лития. Эту смесь перемешивают, пока твердые вещества не растворятся, и добавляют 30 г (99,2 ммоль) 4-йодбензолсульфонилхлорида при комнатной температуре. Реакционную смесь перемешивают в течение 15 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в растворе карбоната натрия, и полученную водную фазу промывают 200 мл этилацетата, а затем подкисляют до рН 2 соляной кислотой. Полученный осадок отфильтровывают и перекристаллизуют из 500 мл уксусной кислоты с получением 32 г ожидаемой кислоты в виде бежевых кристаллов (выход = 76%). T. пл. = 194-198 С. б) (2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-карбоновая кислота. Готовят смесь 20 г (46,6 ммоль) полученной выше кислоты, 1700 мл ацетонитрила, 9,73 г (51,2 ммоль) 3-(трифторметил)фенилбороновой кислоты, 190 мл воды, 14,81 г (139,8 ммоль) карбоната натрия и 1,04 г (4,6 ммоль) ацетата палладия. Эту смесь перемешивают в течение 3 ч при комнатной температуре. Затем добавляют 400 мл этилацетата и смесь подкисляют до рН 3 нормальным раствором соляной кислоты. Органическую фазу отделяют, промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт растворяют в 200 мл смеси горячей уксусной кислоты/воды. После охлаждения образовавшиеся кристаллы отфильтровывают и высушивают с получением 19,2 г ожидаемой кислоты в виде бежевых кристаллов (выход = 92%). T. пл. = 108-112 С. Пример 4. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]этил]бензойной кислоты метиловый эфир. Следуя методике, аналогичной примеру получения I, начиная с кислоты, полученной согласно примеру получения IV, и метилового эфира 3-(2-аминоэтил)-бензойной кислоты, ожидаемый продукт получили в виде белой пены (выход = 48%). 1(dd, 1H); 3.5-3.2 (m, 2H); 3.07 (dd, 1H); 2.95-2.75 (m, 3H). Пример 5. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]этил]бензойная кислота. 663 мг (1,08 ммоль) эфира, полученного согласно примеру 4, смешивают с 5 мл тетрагидрофурана и 5 мл воды и добавляют 104 мг (4,35 ммоль) гидроксида лития при комнатной температуре при перемешивании. Эту реакционную смесь перемешивают при комнатной температуре в течение 24 ч, а затем подкисляют до рН 3 нормальным раствором уксусной кислоты, разбавляют водой, а затем экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом магния и концентрируют при пониженном давлении с получением ожидаемого продукта в виде белой пены (выход = 75%). 1H ЯМР (ДМСО, 250 МГц) : 13 (bs, CO2H); 8.25 (t, NH); 8.1-7.65 (m, 10 Н); 7.55-7.30 (m, 3H); 7.36.95 (m, 3H); 4.78 (dd, 1H); 3.5-3.2 (m, 2H); 3.08 (dd, 1H); 2.95-2.70 (m, 3H). Пример 6. 2,3-Дигидро-N-[(1-фенилциклогексил)метил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил] сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 4, начиная с 1-фенилциклогексанметанамина, ожидаемый продукт получили в виде белой пены (выход = 33%). 1(m, 1 Н and NH); 7.37-7.30 (m, 4H); 7.28-7.17 (m, 2H); 7.11 (d, 1H); 7.02 (td, 1H); 4.87 (dd, 1H); 3.5-3.1 (m,2H); 3.02 (dd, 1H); 2.73 (dd, 1H); 2.15-2.0 (m, 2H); 1.7-1.1 (m, 8H). Пример получения V. 2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1Hиндол-2-карбоновая кислота. Готовят раствор 2,15 г (4,66 ммоль) 2,3-дигидро-1-[(4-йодфенил)сульфонил]-(2S)-1 Н-индол-2 карбоновой кислоты, полученной согласно примеру получения IV(a), в 40 мл ДМЭ и добавляют 13 мл воды, а затем 1,24 г (11,6 ммоль) карбоната натрия, 380 мг (0,46 ммоль) PdCl2dppf и 1,77 г (9,3 ммоль) 2(трифторметил)фенилбороновой кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин, а затем при 90C в течение 30 мин. После охлаждения добавляют воду и смесь подкисляют нормальной соляной кислотой. Затем смесь экстрагируют этилацетатом. Полученную органиче- 10012971 скую фазу промывают водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией с обращенной фазой на RP18-привитом силикагеле,используя смесь ацетонитрил/вода/трифторуксусная кислота (8/2/0,02; об/об/об) в качестве элюента, с получением продукта в виде оранжевого масла (выход = 80%). 1H ЯМР (CDCl3, 250 МГц) : 7.8-7.7 (m, 3H); 7.65 (d, 1H); 7.65-7.45 (m, 2H); 7.38 (d, 2H); 7.3-7.2 (m,2H); 7.15-7.0 (m, 2H); 4.84 (dd, 1H); 3.23 (dd, 1H); 3.09 (dd, 1H). Пример получения VI. 2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1Hиндол-2-карбоновой кислоты хлорид. 1,57 г (3,5 ммоль) кислоты, полученной согласно примеру получения V, растворяют в 10 мл толуола. Добавляют 1 каплю ДМФ при комнатной температуре, а затем добавляют по каплям раствор 0,603 мл(7,02 ммоль) оксалилхлорида в 5 мл толуола. Реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Добавляют толуол и реакционную смесь концентрируют при пониженном давлении для отгонки избытка оксалилхлорида. Ожидаемый продукт получают, таким образом, в виде коричневого масла (выход = 92%). 1H ЯМР (CDCl3, 250 МГц) : 7.85-7.65 (m, 3H); 7.60-7.45 (m, 3H); 7.45-7.35 (d, 2H); 7.3-7 (m, 4H); 5.11 (dd, 1H); 3.35-3.2 (m, 2H). Пример 7. 2,3-Дигидро-N-[2-(1-пиперидинил)этип]-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. 168 мг (0,644 ммоль) смолы DIEA (полистироловой смолы, привитой группой 4-(диизопропиламинометил)фенил) смешивают с 2 мл дихлорметана в шприце и смолу оставляют для набухания. Смолу отфильтровывают, а затем ополаскивают дихлорметаном. Затем к этой смоле добавляют 1 мл дихлорметана, а затем 27,5 мг (0,214 ммоль) 1-пиперидинэтанамина и 100 мг (0,214 ммоль) хлорангидрида, полученного согласно примеру получения VI, в 2 мл дихлорметана. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре, а затем фильтруют, и смолу промывают дихлорметаном. Фильтраты объединяют и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этанол (95/5; об./об.) в качестве элюента, с получением продукта в виде бесцветного масла (выход = 49%). 1H ЯМР (ДМСО, 300 МГц) : 8.04 (t, NH); 7.95-7.60 (m, 5H); 7.55-7.45 (m, 3H); 7.39 (d, 1H); 7.24 (t,1H); 7.14 (d, 1H); 7.05 (t, 1H); 4.84 (dd, 1H); 3.4-3.05 (m, 2H); 2.98 (d, 2H); 2.45-2.2 (m, 6H); 1.6-1.25 (m,6H). Приведенные ниже соединения получены, следуя методике, аналогичной примеру 7, начиная с известных аминов. Пример 8. 2,3-Дигидро-N-[3-(1-пирролидинил)пропил]-1-2'-(трифторметил)[1,1'-дифенил]-4-ил] сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Выход = 68%; бесцветная пена. 1H ЯМР (ДМСО, 300 МГц) : 8.45 (t, NH); 7.95-7.8 (m, 3H); 7.8-7.6(m, 2H); 7.58 (s, 1H); 7.55-7.45 (m, 3H); 7.40 (d, 1H); 7.25 (t, 1H); 7.2-7.1 (m, 2H); 7.06 (t, 1H); 6.88 (s, 1H); 4.79 (dd, 1H); 3.97 (t, 2H); 3.2-2.9 (m, 4H); 1.88 (quint, 2H). Пример 17. 4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойная кислота. 304 мг (2,01 ммоль) 4-(аминометил)бензойной кислоты смешивают с 25 мл ацетонитрила, 7,3 мл воды и 4,8 мл триэтиламина. Реакционная смесь прозрачна. Затем добавляют 624 мг (1,34 ммоль) хлорангидрида, полученного согласно примеру получения VI, растворенного в 4,8 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, а затем растворители выпаривают при пониженном давлении. Затем остаточный сырой продукт растворяют в этилацетате и органическую фазу промывают водой. Затем добавляют животный уголь и органическую фазу фильтруют на пробке силикагеля. Затем фильтрат концентрируют при пониженном давлении с получением ожидаемого продукта в виде белой пены (выход = 66%). 1H ЯМР (ДМСО, 250 МГц) : 8.85 (t, NH); 7.9-7.8 (m, 5H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.457.35 (m, 3H); 7.26 (t, 1H); 7.15 (d, 1H); 7.07 (t, 1H); 4.91 (dd, 1H); 4.40 (t, 2H); 3.2-2.9 (m, 2H). Приведенные ниже соединения получены, следуя методике, аналогичной примеру 17, начиная с известных аминов. Пример 18. 4-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этокси]бензойная кислота. Выход = 56%; белая пена. T. пл. = образует кек при 94C. Пример 19. 5-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-Дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]пентановая кислота. Выход = 23%; бесцветное масло. 1(m, 2H); 7.55-7.45 (m, 3H); 7.40 (d, 1H); 7.24 (t, 1H); 7.14 (d, 1H); 7.04 (td, 1H); 4.78 (dd, 1H); 3.20 (q, 2H); 3.07 (dd, 1H); 2.94 (dd, 1H); 2.4-2.1 (m, 2H); 1.75-1.60 (m, 2H). Пример 21. 4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты метиловый эфир. Готовят раствор 500 мг (1,11 ммоль) кислоты, полученной согласно примеру получения V, в 6 мл дихлорметана, а затем добавляют 235 мг (1,23 ммоль) EDCI, 167 мг (1,23 ммоль) HOAT и 0,343 мл (2,46 ммоль) триэтиламина. После перемешивания в течение 10 мин при комнатной температуре добавляют 265 мг (1,23 ммоль) метилового эфира 4-(аминометил)бензолуксусной кислоты. Затем реакционную смесь перемешивают при комнатной температуре в течение 2 ч 30 мин. Затем смесь обрабатывают добавлением дихлорметана и органическую фазу промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат (98/2; об./об.) в качестве элюента, с получением ожидаемого продукта в виде бесцветного масла (выход = 59%). 1H ЯМР (ДМСО, 300 МГц) : 8.74 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.40 (d,1H); 7.3-7.1 (m, 6H); 7.05 (t, 1H); 4.89 (dd, 1H); 4.31 (t, 2H); 3.64 (s, CH2); 3.60 (S, CH3); 3.15-2.9 (m, 2H). Пример 22. 4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусная кислота. 379 мг (0,622 ммоль) эфира, полученного согласно примеру 21, смешивают с 5 мл тетрагидрофура- 12012971 на и 2 мл воды и добавляют 60 мг (2,49 ммоль) гидроксида лития при комнатной температуре при перемешивании. Эту реакционную смесь перемешивают при комнатной температуре в течение 4 ч, затем подкисляют до рН 3-4 раствором соляной кислоты, разбавляют водой, а затем экстрагируют этилацетатом. Объединенные органические фазы высушивают над сульфатом магния и концентрируют при пониженном давлении с получением ожидаемого продукта в виде бесцветного масла (выход = 93%). 1H ЯМР (ДМСО, 250 МГц) : 8.72 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.40 (d,1H); 7.3-7.1 (m, 6H); 7.05 (t, 1H); 4.89 (dd, 1H); 4.31 (t, 2H); 3.53 (s, CH2); 3.15-2.9 (m, 2H). Пример 23. 2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-N-3,3,3-трифторпропил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 21, начиная с 3,3,3-трифторпропанамина, ожидаемое соединение получили в виде бесцветного масла (выход = 84%). 1H ЯМР (ДМСО, 250 МГц) : 8.42 (t, NH); 7.9-7.6 (m, 5H); 7.55-7.45 (m, 3H); 7.40 (d, 1H); 7.25 (t,1H); 7.14 (d, 1H); 7.6 (t, 1H); 4.81 (dd, 1H); 3.5-3.25 (m, 2H); 3.15-2.85 (m, 2H); 2.55-2.3 (m, 2H). Пример 24. 4-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этил]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 21, начиная с трет-бутилового эфира 4-(2 аминоэтил)бензолуксусной кислоты, ожидаемое соединение получили в виде белой пены (выход = 60%). 1H ЯМР (ДМСО, 250 МГц) : 8.22 (t, NH); 7.9-7.6 (m, 5H); 7.55-7.45 (m, 3H); 7.39 (d, 1H); 7.25 (t,1H); 7.2-7.0 (m, 6H); 4.78.(dd, 1H); 3.49 (s, 2H); 3.4-3.2 (m, 2H); 3.05-2.8 (m, 2H); 2.71 (t, 2H); 1.39 (s, 9H). Пример 25. 4-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]бензолуксусная кислота. Готовят раствор 541 мг (0,813 ммоль) эфира, полученного согласно примеру 24, в 5 мл дихлорметана. Добавляют 1,2 мл трифторуксусной кислоты при комнатной температуре. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре, а затем концентрируют при пониженном давлении и растворяют в этилацетате. Органическую фазу промывают 10% раствором карбоната натрия, а затем водой. Водные фазы экстрагируют 3 раза дихлорметаном. Объединенные органические фазы высушивают над сульфатом магния и концентрируют при пониженном давлении с получением ожидаемого продукта в виде белого твердого вещества (выход = 89%).T. пл. = 152 С. Пример 26. 3-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этил]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Следуя методике, идентичной примеру 21, начиная с трет-бутилового эфира 3-(2-аминоэтил) бензолуксусной кислоты, ожидаемое соединение получили в виде белой пены (выход = 80%). 1H ЯМР (ДМСО, 300 МГц) : 8.25 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.40 (d,1H); 7.3-7.15 (m, 2H); 7.15-7 (m, 5H); 4.80 (dd, 1H); 3.51 (s, 2H); 3.45-3.20 (m, 2H); 2.98 (dd, 1H); 2.88 (dd,1H); 2.72 (t, 2H); 1.39 (s, 9H). Пример 27. 3-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этил]бензолуксусная кислота. Следуя методике, идентичной примеру 25, начиная с эфира, полученного согласно примеру 26,ожидаемое соединение получили в виде белого твердого вещества (выход = 95%).T. пл. = 78 С. Пример 28. 6-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]гексановой кислоты метил эфир. Следуя методике, аналогичной примеру получения I, начиная с кислоты, полученной согласно примеру получения V, и метилового эфира 6-аминогексановой кислоты, ожидаемое соединение получили в виде бесцветного масла (выход = 83%). 1H ЯМР (ДМСО, 250 МГц) : 8.15 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 755-7.45 (m, 3H); 7.40 (d,1H); 7.24 (t, 1H); 7.14 (d, 1H); 7.05 (t, 1H); 4.79 (dd, 1H); 3.57 (s, CH3); 3.2-2.85 (m, 4H); 2.27 (t, 2H); 1.61.35 (m, 4H); 1.35-1.15 (m, 2H). Пример 29. 6-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]гексановая кислота. Следуя методике, аналогичной примеру 22, начиная с эфира, полученного согласно примеру 28,ожидаемое соединение получили в виде бесцветного масла (выход = 83%). 1H ЯМР (ДМСО, 250 МГц) : 8.15 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.40 (d,1H); 7.24 (t, 1H); 7.14 (d, 1H); 7.05 (t, 1H); 4.79 (dd, 1H); 3.2-2.85 (m, 4H); 2.17 (t, 2H); 1.6-1.1 (m, 6H). Пример 30. 2,3-Дигидро-N-[4-(диметиламино)бутил]-1-2'-(трифторметил)[1,1'-дифенил]-4-ил] сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 28, начиная с N,N-диметилбутандиамина, ожидаемое соединение получили в виде бесцветного масла (выход = 27%). 1(m, 4H). Пример 31. 4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 28, начиная с метилового эфира 4-аминобутановой кислоты, ожидаемое соединение получили в виде бесцветного масла (выход = 33%). 1(quint, 2H). Пример 32. 4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]бутановая кислота. Следуя методике, аналогичной примеру 22, начиная с эфира, полученного согласно примеру 31,ожидаемое соединение получили в виде бесцветного масла (выход = 57%). 1(quint, 2H). Пример получения VIIa. 4-[2-(2S)-2,3-Дигидро-1-[(4-йодфенил)сульфонил]-1H-индол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру получения I, начиная с кислоты, полученной согласно примеру получения IV(a), и метилового эфира 4-(2-аминоэтокси)бензолуксусной кислоты, ожидаемое соединение получили в виде белого масла (выход = 65%). 1(dd, 1H). Пример получения VIIb. 4-[2-(2S)-2,3-Дигидро-1-[(4-йодфенил)сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 22, начиная с эфира, полученного согласно примеру получения VIIa, ожидаемое соединение получили в виде белой пены (выход = 96%). 1H ЯМР (ДМСО, 250 МГц) :12.2 (bs, COOH); 8.41 (t, NH); 7.93 (dd, 2H); 7.54 (dd, 2H); 7.41 (d, 1H); 7.25-7.10 (m, 4H); 7.02 (td, 1H); 6.88 (dd, 2H); 4.82 (dd, 1H); 4.1-3.9 (m, 2H); 3.48 (S, 2H); 3.6-3.2 (m, 2H); 3.13 (dd, 1H); 2.91 (dd, 1H). Пример 33. 4-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 1, начиная с кислоты, полученной согласно примеру получения VIIb, и 2-(трифторметил)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 78%). 1H ЯМР (ДМСО, 300 МГц) : 8.42 (t, NH); 7.9-7.8 (m, 3H); 7.8-7.6 (m, 2H); 7.55-7.45 (m, 3H); 7.39 (d,1H); 7.24 (t, 1H); 7.2-7.1 (m, 3H); 7.05 (t, 1H); 6.87 (d, 2H); 4.88 (dd, 1H); 4.1-3.9 (m, 2H); 3.6-3.15 (m, 2H); 3.45 (s, 2H); 3.2-2.85 (m, 2H). Пример 34. 4-[2-(2S)-1-4'-Хлор-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-2,3-дигидро 1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 4-хлор-3-(трифторметил)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 54%). 1H ЯМР (ДМСО, 300 МГц) : 8.43 (t, NH); 8.10 (d, 1H); 8.02 (dd, 1H); 8.00-7.8 (m, 5H); 7.48 (d, 1H); 7.24 (t, 1H); 7.2-7.1 (m, 3H); 7.03 (t, 1H); 6.89 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.3 (m, 2H); 3.48 (s,2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 35. 4-[2-(2S)-1-2,-Хлор-5-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-2,3-дигидро 1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-хлор-5-(трифторметил)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 37%). 1H ЯМР (ДМСО, 300 МГц) : 8.43 (t, NH); 7.91 (d, 1H); 7.85-7.75 (m, 3H); 7.68 (d, 2H); 7.48 (d, 1H); 7.24 (t, 1H); 7.2-7.1 (m, 3H); 7.04 (t, 1H); 6.88 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.3 (m, 2H); 3.48 (s,2H); 3.16 (dd, 1H); 2.94 (dd, 1H). Пример 36. 4-[2-(2S)-1-3'-Хлор-4'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-2,3-дигидро 1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-хлор-4-(трифторметил)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 60%). 1- 14012971 Следуя методике, аналогичной примеру 33, начиная с 2-(трифторметокси)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 74%). 1H ЯМР (ДМСО, 300 МГц) : 8.42 (t, NH); 7.86 (d, 2H); 7.65-7.45 (m, 7H); 7.24 (t, 1H); 7.2-7.1 (m,3H); 7.03 (t, 1H); 6.88 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.3 (m, 4H); 3.1-2.9 (m, 2H). Пример 38. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметокси)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-(трифторметокси)фенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 71%). 1H ЯМР (ДМСО, 300 МГц) : 12.2 (bs, COOH); 8.43 (t, NH); 7.90 (s, 4H), 7.76 (d, 1H); 7.70 (S, 1H); 7.63 (t, 1H); 7.48 (d, 1H); 7.44 (d, 1H); 7.24 (t, 1H); 7.2-7.1 (m, 3H); 7.02 (t, 1H); 6.89 (d, 2H); 4.89 (dd, 1H); 4.02 (t, 2H); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.16 (dd, 1H); 2.93 (dd, 1H). Пример 39. 4-[2-(2S)-2,3-Дигидро-1-3'-(метокси)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил] карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-(метокси)фенилбороновой кислоты, ожидаемое соединение получили в виде коричневой пены (выход = 69%). 1H ЯМР (ДМСО, 300 МГц) : 12.2 (bs, COOH); 8.42 (t, NH); 7.85 (s, 4H); 7.48 (d, 1H); 7.40 (t, 1H); 7.3-7.1 (m, 6H); 7.1-6.95 (m, 2H); 6.89 (d, 2H); 4.87 (dd, 1H); 4.02 (t, 2H); 3.81 (S, OCH3); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.16 (dd, 1H); 2.92 (dd, 1H). Пример 40. 4-[2-(2S)-2,3-Дигидро-1-2'-фтор[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-фторфенилбороновой кислоты, ожидаемое соединение получили в виде белой пены (выход = 71%). 1H ЯМР (ДМСО, 250 МГц) : 12.2 (bs, COOH); 8.42 (t, NH); 7.90 (d, 2H); 7.72 (d, 2H); 7.60-7.45 (m,3H); 7.40-7.10 (m, 6H); 7.02 (t, 1H); 6.89 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.17 (dd, 1H); 2.93 (dd, 1H). Пример 41. 4-[2-(2S)-2,3-дигидро-1-2'-метил[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил] карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-метилфенилбороновой кислоты, ожидаемое соединение получили в виде белой пены (выход = 78%). 1(s, CH3). Пример 42. 4-[2-(2S)-2,3-Дигидро-1-3'-(1 -метилэтил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-(1-метилэтил)фенилбороновой кислоты,ожидаемое соединение получили в виде бежевой пены (выход = 79%). 1H ЯМР (ДМСО, 250 МГц) : 12.2 (bs, COOH); 8.40 (t, NH); 7.84 (s, 4H); 7.60-7.45 (m, 3H); 7.40 (t,1H); 7.35-7.10 (m, 5H); 7.02 (t, 1H); 6.89 (d, 2H); 4.87 (dd, 1H); 4.01 (t, 2H); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.14 (dd, 1H); 3.05-2.85 (m, 2H); 1.23 (d, 6H). Пример 43. 4-[2-(2S)-2,3-Дигидро-1-2'-(метокси)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2 ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-(метокси)фенилбороновой кислоты, ожидаемое соединение получили в виде белой пены (выход = 63%). 1H ЯМР (ДМСО, 250 МГц) : 12.2 (bs, COOH); 8.41 (t, NH); 7.83 (d, 2H); 7.64 (d, 2H); 7.48 (d, 1H); 7.45-7.1 (m, 7H); 7.1-7.0 (т , 2H); 6.88 (d, 2H); 4.88 (dd, 1H); 4.01 (t, 2H); 3.75 (s, OCH3); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.18 (dd, 1H); 2.93 (dd, 1H). Пример 44. 4-[2-(2S)-2,3-Дигидро-1-3'-хлор[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-хлорфенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 79%). 1(s, 2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 45. 4-[2-(2S)-2,3-Дигидро-1-4'-хлор[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 4-хлорфенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 74%). 1H ЯМР (ДМСО, 250 МГц) : 8.41 (t, NH); 7.86 (s, 4H); 7.74 (dd, 2H); 7.52 (dd, 2H); 7.48 (d, 1H); 7.37.1 (m, 4H); 7.01 (t, 1H); 6.89 (dd, 2H); 4.88 (dd, 1H); 4.01 (t, 2H); 3.65-3.35 (m, 2H); 3.48 (s, 2H); 3.15 (dd,1H); 2.93 (dd, 1H). Пример 46. 4-[2-(2S)-2,3-Дигидро-1-2'-хлор[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]кар- 15012971 бонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-хлорфенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 75%). 1(m, 4H); 7.25 (t, 1H); 7.2-7.1 (m, 3H); 7.03 (t, 1H); 6.89 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.25 (m, 2H); 3.48 (s, 2H); 3.15 (dd, 1H); 2.95 (dd, 1H). Пример 47. 4-[2-(2S)-2,3-Дигидро-1-3'-фтор[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-фторфенилбороновой кислоты, ожидаемое соединение получили в виде бежевой пены (выход = 39%). 1(m, 5H); 7.02 (t, 1H); 6.89 (d, 2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.65-3.25 (m, 2H); 3.48 (s, 2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 48. 4-[2-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 2-(трифторметил)фенилбороновой кислоты,ожидаемое соединение получили в виде бежевой пены (выход = 78%). 1H ЯМР (ДМСО, 300 МГц) : 8.42 (t, NH); 7.9-7.8 (m, 3H), 7.8-7.6 (m, 2H), 7.55-7.45 (m, 3H); 7.39 (d,1H); 7.24 (t, 1H); 7.2-7.1 (m, 3H); 7.04 (td, 1H); 6.87 (dd, 2H); 4.88 (dd, 1H); 4.1-3.9 (m, 2H); 3.45 (s, 2H); 3.63.15 (m, 2H); 3.04 (dd, 1H); 2.95 (dd, 1H). Пример 49. 4-[2-(2S)-2,3-Дигидро-1-3'-метил[1,1'-дифенил]-4-ил]cульфонил]-1H-индол-2-ил] карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 33, начиная с 3-метил-фенилбороновой кислоты, ожидаемое соединение получили в виде белой пены (выход = 85%). 1(m, 2H); 3.13 (dd, 1H); 2.92 (dd, 1H); 2.36 (s, CH3). Пример получения VIII. 1-2'-(Трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1H-индол-2 карбоновой кислоты тетрабутиламмонийная соль. 2,4 г (5,59 ммоль) кислоты, полученной согласно примеру получения V, смешивают с 48 мл воды в пробирке для микроволновой печи и добавляют 1,802 г (5,59 ммоль) тетрабутиламмония бромида, 1,062 г(16,77 ммоль) карбоната натрия. Эту реакционную смесь нагревают в течение 5 мин при 150C в микроволновой печи. После охлаждения в реакционную смесь добавляют дихлорметан, а затем воду и органическую фазу отделяют от водной фазы. Затем органическую фазу дважды промывают водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают кристаллизацией из толуола с получением продукта в виде белого твердого вещества (выход = 100%). T. пл.= 128 С. Пример 50. 2,3-Дигидро-N-[2-(4-пиридинил)этил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1H-индол-2-карбоксамид. Следуя методике, аналогичной примеру 4, начиная с 4-(2-аминоэтил)пиридина, ожидаемое соединение получили в виде бесцветного масла (выход = 76%). 1H ЯМР (ДМСО, 300 МГц) : 8.41 (dd, 2H); 8.29 (t, NH); 8.05-8.0 (m, 2H); 7.95 (d, 2H); 7.86 (d, 2H); 7.83-7.68 (m, 2H); 7.50 (d, 1H); 7.26 (t, 1H); 7.19 (dd, 2H); 7.13 (d, 1H); 7.04 (td, 1H); 4.79 (dd, 1H); 3.40 (dd,2H); 3.06 (dd, 1H); 2.9-2.7 (m, 3H). Пример 51. 2,3-Дигидро-N-[2-(3-пиридинил)этил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 50, начиная с 3-(2-аминоэтил)пиридина, ожидаемое соединение получили в виде желтой пены (выход = 93%). 1H ЯМР (ДМСО, 300 МГц) : 8.5-8.4 (m, 2H); 8.3 (t, NH); 8.05-8.0 (m, 2H); 7.94 (d, 2H); 7.87 (d, 2H); 7.85-7.68 (m, 2H); 7.65-7.55 (m, 1H); 7.50 (d, 1H); 7.3-7.2 (m, 2H); 7.12 (d, 1H); 7.06 (t, 1H); 4.79 (dd, 1H); 3.5-3.3 (m, 2H); 3.2-3 (m, 1H); 2.9-2.7 (m, 3H). Пример 52. 2,3-Дигидро-N-[(4-пиридинил)метил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 50, начиная с 4-(аминометил)пиридина, ожидаемое соединение получили в виде белой пены (выход = 78%). 1- 16012971 Следуя методике, аналогичной примеру 50, начиная с 3-(аминометил)пиридина, ожидаемое соединение получили в виде белой пены (выход = 74%). 1H ЯМР (ДМСО, 250 МГц) : 8.86 (t, NH); 8.51 (d, 1H); 8.46 (dd, 1H); 8.05-8.0 (m, 2H); 7.94 (d, 2H); 7.90 (d, 2H); 7.85-7.65 (m, 3H); 7.52 (d, 1H); 7.36 (dd, 1H); 7.25 (t, 1H); 7.15 (d, 1H); 7.07 (td, 1H); 4.89 (dd,1H); 4.38 (d, 2H); 3.19 (dd, 1H); 2.97 (dd, 1H). Пример 54. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензойной кислоты метиловый эфир. Следуя методике, аналогичной примеру 4, начиная с метилового эфира 3-(2-аминоэтокси)бензойной кислоты, ожидаемое соединение получили в виде розового твердого вещества (выход = 28%). 1H ЯМР (ДМСО, 250 МГц) : 8.43 (t, NH); 8.1-8.0 (m, 2H); 7.94 (d, 2H); 7.89 (d, 2H); 7.85-7.65 (m,2H); 7.6-7.4 (m, 4H); 7.3-7.15 (m, 2H); 7.12 (d, 1H); 7.02 (td, 1H); 4.89 (dd, 1H); 4.10 (t, 2H); 3.85 (s, 3H); 3.73.4 (m, 2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 55. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1Hиндол-2-ил]карбонил]амино]этокси]бензойная кислота. Следуя методике, аналогичной примеру 22, начиная с эфира, полученного согласно примеру 54,ожидаемое соединение получили в виде белого твердого вещества (выход = 60%). T. пл. = 85-92 С. Пример получения IX. 2,3-Дигидро-2-2-[4-(2-метокси-2-оксоэтил)фенокси]этил]амино]карбонил]-(2S)-1 Н-индол-1-карбоновой кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру получения I, начиная с метилового эфира 4-(2 аминоэтокси)бензолуксусной кислоты, ожидаемое соединение получили в виде белой пены (выход = 48%). Пример получения X. 4-[2-(2S)-2,3-Дигидро-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру получения II, начиная с эфира, полученного согласно примеру получения IX, ожидаемое соединение получили в виде бежевого твердого вещества (выход = 89%). 1H ЯМР (ДМСО, 250 МГц) : 8.03 (t, NH); 7.16 (dd, 2H); 7.05-6.80 (m, 4H); 6.65-6.5 (m, 2H); 5.93 (d,NH); 4.22 (ddd, 1H); 3.99 (t, 2H); 3.59 and 3.58 (2d, 5H); 3.55-3.4 (m, 2H); 3.31 (dd, 1H); 2.90 (dd, 1H). Пример получения XI. 4-[2-(2S)-1-4-Бром-3-(трифторметил)фенил]сульфонил]-2,3-дигидро-1 Ниндол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты метил эфир. Готовят раствор 750 мг (2,12 ммоль) соединения, полученного согласно примеру получения X, в 60 мл ацетонитрила и добавляют 512 мкл (4,65 ммоль) N-метилморфолина и 0,486 мл (2,75 ммоль) 4-бром 3-(трифторметил)-бензолсульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем смесь обрабатывают добавлением этилацетата, и органическую фазу промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат (99/1, затем 90/10; об./об.) в качестве элюента, с получением ожидаемого продукта в виде белой пены (выход = 93%). 1H ЯМР (ДМСО, 300 МГц) : 8.46 (t, NH); 8.11 (d, 1H); 8.05-7.95 (m, 2H); 7.43 (d, 1H); 7.25 (td, 1H); 7.2-7.1 (m, 3H); 7.06 (td, 1H); 6.89 (dd, 2H); 4.93 (dd, 1H); 4.0 (t, 2H); 3.60 (S, 5H); 3.6-3.35 (m, 2H); 3.17 (dd,1H); 2.92 (dd, 1H). Пример 56. 4-[2-(2S)-2,3-Дигидро-1-2-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру 2, начиная с соединения, полученного согласно примеру получения XI, и фенилбороновой кислоты, ожидаемое соединение получили в виде полупрозрачного масла (выход = 79%). Пример 57. 4-[2-(2S)-2,3-Дигидро-1-2-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 56, ожидаемое соединение получили в виде белой пены (выход = 36%). 1(s, 2H); 3.20 (dd, 1H); 2.95 (dd, 1H). Пример 58. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру 4, начиная с метилового эфира 3-(2-аминоэтокси)бензолуксусной кислоты, ожидаемое соединение получили в виде бесцветного масла (выход = 33%). 1- 17012971 Следуя методике, аналогичной примеру 5, начиная с эфира, полученного согласно примеру 58,ожидаемое соединение получили в виде белой пены (выход = 85%). 1(s, 2H); 3.65-3.3 (m, 2H); 3.15 (dd, 1H); 2.94 (dd, 1H). Пример 60. 2,3-Дигидро-N-[(2-нитрофенил)метил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1H-индол-2-карбоксамид. Следуя методике, аналогичной примеру 21, начиная с 2-(аминометил)нитробензола, ожидаемое соединение получили в виде белой пены (выход = 71%). 1(dd, 1 H). Пример 61. N-[(2-Аминофенил)метил]-2,3-дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. 683 мг (1,17 ммоль) соединения, полученного согласно примеру 60, растворяют в 10 мл метанола. Добавляют 68 мг 10% палладия на угле. Реакционную смесь перемешивают при комнатной температуре в атмосфере водорода при атмосферном давлении в течение 2 ч. Затем ее фильтруют и фильтрат концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат (98/2; об./об.) в качестве элюента, с получением ожидаемого продукта в виде белой пены (выход = 80%). 1H ЯМР (ДМСО, 300 МГц) : 8.64 (t, NH); 8.08-8 (m, 2H), 7.94 (d, 2H), 7.89 (d, 2H); 7.85-7.65 (m, 2H),7.50 (d, 1H); 7.25 (t, 1H); 7.13 (d, 1H); 7.1-6.9 (m, 3H); 6.63 (dd, 1H); 6.51 (td, 1H); 5.03 (bs, NH2); 4.91 (dd,1H); 4.24 (dd, 1H); 4.14 (dd, 1H); 3.17 (dd, 1H); 2.96 (dd, 1H). Пример получения XII. 2-Цианобензолбутановой кислоты метиловый эфир. Готовят раствор 369 мг (3,02 ммоль) 9-BBN (9-борабицикло[3.3.1]нонан) в 6 мл безводного ТГФ в атмосфере аргона. Затем к этому раствору добавляют 0,32 мл (3,02 ммоль) метилового эфира 3 бутеновой кислоты. Эту смесь перемешивают в течение 3 ч при комнатной температуре. Готовят раствор 500 мг (2,75 ммоль) 2-бромбензонитрила в 8 мл безводного ТГФ во второй круглодонной колбе. 445 мг(8,24 ммоль) метилата натрия, 68 мг (0,08 ммоль) PdCl2dppf и предыдущий раствор последовательно добавляют к этому раствору по каплям в атмосфере аргона. Затем реакционную смесь кипятят с обратным холодильником в течение 2 ч, а затем перемешивают при комнатной температуре в течение 16 ч и, наконец, с обратным холодильником в течение 3 ч. К реакционной смеси добавляют воду и этилацетат и разделяют две фазы. Органическую фазу промывают водой, высушивают над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь метилциклогексан/этилацетат (90/10; об./об.) в качестве элюента, с получением ожидаемого продукта в виде бесцветного масла (выход = 36%). 1H ЯМР (ДМСО, 300 МГц) : 7.78 (dd, 1H); 7.62 (td, 1H); 7.47 (dd, 1H), 7.41 (td, 1H); 3.58 (S, CH3); 2.81 (t, 2H); 2.36 (t, 2H); 1.88 (quint, 2H). Пример получения XIII. 2-(Аминометил)бензолбутановой кислоты метиловый эфир. Готовят раствор 176 мг (0,866 ммоль) эфира, полученного согласно примеру получения XII, в 15 мл метанола и 0,1 мл 10 н. соляной кислоты. Добавляют 20 мг 10% палладия на угле и смесь перемешивают в течение 6 ч при комнатной температуре при атмосферном давлении водорода. Затем реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Затем полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/метанол (95/5; об./об.) в качестве элюента, с получением ожидаемого продукта в виде бесцветного масла (выход = 50%). 1H ЯМР (ДМСО, 250 МГц) : 7.5-7.35 (m, 1H); 7.35-7.1 (m, 3H); 3.97 (s, 2H); 3.60 (s, CH3); 2.64 (t,2H); 2.39 (t, 2H); 1.76 (quint, 2H). Пример 62. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолбутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 21, начиная с эфира, полученного согласно примеру получения XIII, ожидаемое соединение получили в виде бесцветного масла (выход = 48%). 1(t, 1H); 7.51 (d, 1H); 7.3-7.1 (m, 6H); 7.05 (t, 1H); 4.93 (dd, 1H); 4.41 (dd, 1H); 4.33 (dd, 1H); 3.60 (s, CH3); 3.17 (dd, 1H); 2.97 (dd, 1H); 2.64 (t, 2H); 2.38 (t, 2H); 1.80 (quint, 2H). Пример 63. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолбутановая кислота. Следуя методике, аналогичной примеру 5, начиная с метилового эфира, полученного согласно примеру 62, ожидаемое соединение получили в виде белого твердого вещества (выход = 81%). 1- 18012971 Пример 64. 2,3-Дигидро-N-[(2-гидроксифенил)метил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил] сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Готовят раствор 100 мг (0,224 ммоль) кислоты, полученной согласно примеру получения IV, в 2 мл дихлорметана, а затем добавляют 47 мг (0,246 ммоль) EDCl и 33 мг (0,246 ммоль) HOBT. После перемешивания в течение 10 мин при комнатной температуре добавляют 28 мг (0,224 ммоль) 2(аминометил)фенола. Затем эту реакционную смесь перемешивают при комнатной температуре в течение 1 ч 50 мин. Затем ее обрабатывают добавлением дихлорметана и органическую фазу промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении с получением ожидаемого продукта в виде белой пены (выход = 99%). 1H ЯМР (ДМСО, 300 МГц) : 9.55 (s, ОН); 8.54 (t, NH); 8.1-8 (m, 2H); 7.94 (d, 2H); 7.90 (d, 2H); 7.857.65 (m, 2H); 7.51 (d, 1H); 7.25 (t, 1H); 7.2-7.00 (m, 4H); 6.81 (dd, 1H); 6.73 (td, 1H); 4.97 (dd, 1H); 4.33 (dd,1H); 4.23 (dd, 1H); 3.15 (dd, 1H); 2.98 (dd, 1H). Пример 65. 2,3-Дигидро-N-[(2-цианофенил)метил]-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-(2S)-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 21, начиная с 2-(аминометил)-бензонитрила, ожидаемое соединение получили в виде розового твердого вещества (выход = 23%). T. пл. = 70C. Пример получения XIV. (3-Цианофенокси)уксусной кислоты метиловый эфир. Готовят раствор 5,95 г (50 ммоль) 3-гидроксибензонитрила в 60 мл ацетона и добавляют 9,2 г (60 ммоль) метилбромацетата, 6,9 г карбоната калия и 0,15 г йодида натрия. Эту смесь перемешивают при температуре флегмы растворителя в течение 3 ч, а затем концентрируют при пониженном давлении. Остаток растворяют в воде и экстрагируют этилацетатом. Органическую фазу высушивают над сульфатом натрия, а затем концентрируют при пониженном давлении. Сырой продукт перекристаллизуют сначала из изопропилового эфира, а затем из 30 мл смеси этанол/вода (1/1) с получением 6 г ожидаемого эфира в виде белых кристаллов (выход = 62%). T. пл. = 66 С. Пример получения XV. 3-(Аминометил)феноксиуксусной кислоты метилового эфира гидрохлорид. Готовят раствор 1,9 г (10 ммоль) метилового эфира (3-цианофенокси)уксусной кислоты в 60 мл метанола и 1 мл 10 н. соляной кислоты. Добавляют 0,2 г 10% палладия на угле и смесь перемешивают при атмосферном давлении водорода при комнатной температуре в течение 2 ч. Катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении. Сырой продукт растворяют в 10 мл метанола и раствор разбавляют 50 мл этилового эфира. Продукт, который кристаллизуется в результате этого,отфильтровывают и высушивают при пониженном давлении с получением 2 г ожидаемого эфира в виде белых кристаллов (выход = 86%). T. пл. = 118 С. Пример 66. [3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]фенокси]уксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру получения l, начиная с кислоты, полученной в примере получения IV, и амина, полученного согласно примеру получения XV, ожидаемый продукт получают в виде белого твердого вещества (выход = 47%). T. пл. = 50C. Пример 67. [4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]фенокси]уксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с метилового эфира (4-аминометил)феноксиуксусной кислоты, ожидаемый продукт получили в виде белого порошка (выход = 27%). 1(30 ммоль) пропиолактона при температуре флегмы растворителя. Эту смесь перемешивают при температуре флегмы растворителя в течение 18 ч, а затем охлаждают. Остаток растворяют в воде и экстрагируют этилацетатом. Образовавшийся белый осадок отфильтровывают и промывают 5 мл этилового эфира, а затем высушивают с получением 3,4 г ожидаемой кислоты в виде белого твердого вещества (выходT. пл. = 150 С. Пример получения XVII. N-(4-Цианофенил)- -аланина метилового эфира гидрохлорид. Готовят раствор 2 г (10,5 ммоль) кислоты, полученной согласно примеру получения XVI, в 50 мл метанола и добавляют 2,5 г (21 ммоль) тионилхлорида при 0C. Затем эту смесь перемешивали в течение 2 ч при температуре флегмы растворителя, а затем концентрируют при пониженном давлении. Остаток растворяют в толуоле и снова концентрируют при пониженном давлении с получением 2,72 г соли желаемого эфира в виде белого твердого вещества (выход = 76%). T. пл. = 121 С. Пример получения XVIII. N-[4-(Аминометил)фенил]- -аланина метилового эфира дигидрохлорид/ Следуя методике, аналогичной примеру получения XV, начиная с соединения, полученного согласно примеру получения XVII, ожидаемый продукт получили в виде белого твердого вещества (выход =- 19012971 99%). T. пл. = 201C. Пример 68. N-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенил]аланина метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XVIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 57%). T. пл. = 61C. Пример 69. N-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенил]аланин. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 68, ожидаемый продукт получили в виде белого твердого вещества (выход = 62%). T. пл. = 82 С. Пример получения XIX. N-(3-Цианофенил)аланин. Следуя методике, аналогичной примеру получения XVI, начиная с 3-аминобензонитрила, ожидаемый продукт получили в виде беловатого твердого вещества (выход = 14%). Т.пл. = 119 С. Пример получения XX. N-(3-Цианофенил)аланина метилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XVII, начиная с соединения, полученного согласно примеру получения XIX, ожидаемый продукт получили в виде беловатого твердого вещества(выход = 99%). T. пл. = 102C. Пример получения XXI. N-[3-(Аминометил)фенил]аланина метилового эфира дигидрохлорид. Следуя методике, аналогичной примеру получения XVIII, начиная с соединения, полученного согласно примеру получения XX, ожидаемый продукт получили в виде желтого масла (выход = 84%). 1(s, 3H); 3.39 (t, 2H); 2.71 (t, 2H). Пример 70. N-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]метил]фенил]аланина метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXI, ожидаемый продукт получили в виде белого твердого вещества (выход = 25%). T. пл. = 57 С. Пример 71. N-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]метил]фенил]аланин. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 70, ожидаемый продукт получили в виде белого твердого вещества (выход = 94%). T. пл. = 85 С. Пример получения XXII. N-(2-Цианофенил)аланина метиловый эфир. Следуя методике, аналогичной примеру получения XVII, начиная с N-(2-цианофенил)аланина,ожидаемый продукт получили в виде желтого масла (выход = 70%). 1H ЯМР (ДМСО, 250 МГц) : 7.477.39 (m, 2H); 6.80 (d, 1H); 6.66 (t, 1H); 6.05 (t, 1H); 3.66 (S, 3H); 3.44 (q, 2H); 2.63 (t, 2H). Пример получения XXIII. N-[2-(Аминометил)фенил]аланина метилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XV, начиная с соединения, полученного согласно примеру получения XXII, ожидаемый продукт получили в виде бледно-желтого твердого вещества(широкий s, 1H); 3.90 (s, 2H); 3.62 (s, 3H); 3.31 (t, 2H); 2.67 (t, 2H). Пример 72. N-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенил]аланина метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 73%). T. пл. = 60C. Пример 73. N-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенил]аланин. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 72, ожидаемый продукт получили в виде белого твердого вещества (выход = 79%). T. пл. = 94 С. Пример получения XXIV. 3-(2-Цианофенокси)пропановая кислота. Следуя методике, аналогичной примеру получения XVI, начиная с 2-гидроксибензонитрила, ожидаемый продукт получили в виде коричневого твердого вещества (выход = 90%). 1(t, 2H); 2.77 (t, 2H). Пример получения XXV. 3-(2-Цианофенокси)пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения XVII, начиная с соединения, полученного согласно Примеру получения XXIV, ожидаемый продукт получили в виде желтого масла (выход = 50%). 1H ЯМР (ДМСО, 250 МГц) : 7.73-7.63 (m, 2H); 7.29 (d, 1H); 7.10 (t, 1H); 4.36 (t, 2H); 3.64 (s, 3H); 2.86 (t, 2H). Пример получения XXVI. 3-[2-(Аминометил)фенокси]пропановой кислоты метилового эфира гид- 20012971 рохлорид. Следуя методике, аналогичной примеру получения XV, начиная с соединения, полученного согласно примеру получения XXV, ожидаемый продукт получили в виде беловатого твердого вещества (выходH ЯМР (ДМСО, 300 МГц) : 8.2 (широкий s, 3H); 7.41-7.34 (m, 2H); 7.3 (d, 1H); 7.02 (t, 1H); 4.26 (t,2H); 3.91 (s, 2H); 3.65 (s, 3H); 2.88 (t, 2H). Пример 74. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенокси]пропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXVI, ожидаемый продукт получили в виде белого твердого вещества (выход = 25%). T. пл. = 131C. Пример 75. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенокси]пропановая кислота. Готовят смесь 22 мг (0,52 ммоль) гидроксида лития и 53 мг (1,57 ммоль) 30% перекиси водорода в 2 мл ТГФ (тетрагидрофурана) и добавляют раствор 278 мг (0,43 ммоль) соединения, полученного согласно примеру 74, в 2 мл ТГФ. Реакционную смесь перемешивают при комнатной температуре в течение 20 ч,а затем подкисляют разбавленным раствором соляной кислоты и экстрагируют 25 мл дихлорметана. Органическую фазу промывают водой, высушивают над сульфатом натрия и концентрируют при пониженном давлении. Полученный сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/метанол (9/1; об./об.) в качестве элюента, с получением 141 мг ожидаемой кислоты в виде белого порошка (выход = 52%). T. пл. = 100 С. Пример получения XXVII. 3-Бис[(1,1-диметилэтокси)карбонил]амино]метил]фенил]тио]уксусной кислоты метиловый эфир. 44 мг (1,1 ммоль) 60% дисперсии гидрида натрия в масле суспендируют в 8 мл диметилформамида(ДМФ) и добавляют 238 мг (1,1 ммоль) ди-трет-бутилиминодикарбоксилата. Реакционную смесь перемешивают при 60C в течение 30 мин, а затем охлаждают до комнатной температуры. Затем добавляют раствор 230 мг (1 ммоль) метилового эфира [3-(хлорметил)фенилтио]уксусной кислоты в 3 мл ДМФ. Реакционную смесь перемешивают при 50C в течение 90 мин, а затем охлаждают и наливают в 30 мл воды. Полученную водную фазу экстрагируют этилацетатом (дважды), и объединенные органические фазы высушивают над сульфатом натрия и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (95/5; об./об.) в качестве элюента, с получением 300 мг ожидаемого соединения в виде бесцветного масла (выход = 73%). 1H ЯМР(ДМСО, 250 МГц) : 7.34-7.25 (m, 1H); 7.18 (s, 1H); 7.07 (d, 1H); 4.64 (s, 2H); 3.86 (S, 2H); 3.61 (s, 3H); 1.39 (s, 18). Пример получения XXVIII. 3-(Аминометил)фенил]тио]уксусной кислоты метиловый эфир. Готовят раствор 290 мг (0,7 ммоль) соединения, полученного согласно примеру получения XXVII, в 4 мл диоксана, насыщенного хлоридом водорода. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Сырой продукт кристаллизуют путем растирания в этиловом эфире с получением 150 мг ожидаемого соединения в виде белого твердого вещества (выход = 88%). T. пл. = 72 С. Пример 76. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]метил]фенил]тио]уксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXVIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 63%). T. пл.= 51C. Пример 77. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]метил]фенил]тио]уксусная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 76, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). T. пл. = 75 С. Пример 78. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойной кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с гидрохлорида метилового эфира 4(аминометил)бензойной кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход= 51%). T. пл. = 70C. Пример 79. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 78, ожидаемый продукт получили в виде белого твердого вещества (выход = 50%). T. пл. = 120 С. Пример 80. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойной кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с гидрохлорида метилового эфира 3- 21012971(аминометил)бензойной кислоты, ожидаемый продукт получили в виде белого твердого вещества (выходH ЯМР (ДМСО, 300 МГц) : 8.84 (t, NH); 8.03 (m, 2H); 7.96-7.75 (m, 8H); 7.56-7.48 (m, 3H); 7.25 (t,1H); 7.14 (d, 1H); 7.05 (t, 1H); 4.921 (dd, 1H); 4.41 (m, 2H); 3.84 (s, 3H); 3.2-3.1 (m, 1 H); 3.0-2.93 (m, 1 H). Пример 81. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 80, ожидаемый продукт получили в виде белого твердого вещества (выход = 82%). T. пл. = 96 С. Пример получения XXIX. 2-(Аминометил)бензойной кислоты 1,1-диметилэтилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XV, начиная с трет-бутилового эфира 2 цианобензойной кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 87%). T. пл. = 177 С. Пример 82. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойной кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXIX, ожидаемый продукт получили в виде белого твердого вещества (выход = 69%). T. пл. = 68 С. Пример 83. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензойная кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 82, ожидаемый продукт получили в виде белого твердого вещества (выход = 90%). T. пл. = 118 С. Пример 84. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты метил эфир. Следуя методике, аналогичной примеру 66, начиная с гидрохлорида метилового эфира 4(аминометил)бензолуксусной кислоты, ожидаемый продукт получили в виде белого твердого вещества(выход = 83%). T. пл. = 120 С. Пример 85. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 84, ожидаемый продукт получили в виде белого твердого вещества (выход = 56%). T. пл. = 90C. Пример 85 а. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты калийная соль. Готовят раствор 250 мг (0,42 ммоль) кислоты, полученной согласно примеру 85, в 1 мл ацетонитрила и добавляют 0,84 мл 0,5 н. водного раствора гидроксида калия. Смесь перемешивают в течение 1 ч при комнатной температуре, а затем разбавляют 10 мл чистой воды и лиофилизируют с получением ожидаемой соли в виде белого порошка. T. пл. = 150-160C. Пример 85 б. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]бензолуксусной кислоты диэтаноламинная соль. Следуя методике, аналогичной примеру 85 а, с диэтаноламином получили ожидаемую соль в виде белого порошка. T. пл. = 55-60C. Пример 85 в. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты холиновая соль. Следуя методике, аналогичной примеру 85 а, с раствором гидроксида холина в метаноле получили ожидаемую соль в виде белого порошка. T. пл. = 75-80C. Пример 85 г. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]бензолуксусной кислоты ТРИС соль. Следуя методике, аналогичной примеру 85 а, с 2-амино-2-(гидроксиметил)-1,3-пропандиолом получили ожидаемую соль в виде белого порошка. T. пл. = 66-70C. Пример 86. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с гидрохлорида метилового эфира 3(аминометил)бензолуксусной кислоты, ожидаемый продукт получили в виде белого твердого вещества(выход = 66%). T. пл. = 60 С. Пример 87. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолуксусной кислоты. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 86, ожидаемый продукт получили в виде белого твердого вещества (выход = 62%). T. пл. = 80C. Пример получения XXX. 4-(Аминометил)бензолпропановой кислоты метилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XV, начиная с метилового эфира (2S)-3-(4 цианофенил)-2-пропеновой кислоты, ожидаемый продукт получили в виде белого твердого вещества(выход = 72%). T. пл. = 215 С. Пример 88. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXX, ожидаемый продукт получили в виде белого твердого вещества (выход = 91%). T. пл. = 61 С. Пример 89. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 88, ожидаемый продукт получили в виде белого твердого вещества (выход = 53%). T. пл. = 85 С. Пример 90. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 66, начиная с гидрохлорида этилового эфира 3-[3(аминометил)бензол]пропановой кислоты, ожидаемый продукт получили в виде бесцветного масла (выход = 51%). 1H ЯМР (ДМСО, 250 МГц) : 8.73 (t, NH); 8.02 (m, 2H); 7.93 (m, 4H); 7.77-7.72 (m, 2H); 7.50 (d, 1H); 7.25-7.03 (m, 7H); 4.91 (dd, 1H); 4.31 (d, 2H); 4.02 (q, 2H); 3.2-2.9 (m, 2H); 2.81 (t, 2H); 2.58 (t, 2H); 1.14 (t,3H). Пример 91. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 90, ожидаемый продукт получили в виде белого твердого вещества (выход = 81%). T. пл. = 135 С. Пример получения XXXI. 2-(Аминометил)бензолпропановой кислоты этилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XXX, начиная с этилового эфира (2 Е)-3-(2 цианофенил)-2-пропеновой кислоты, ожидаемый продукт получили в виде белого твердого вещества(выход = 40%). T. пл. = 107-110C. Пример 92. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановой кислоты этиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXXI, ожидаемый продукт получили в виде белого твердого вещества (выход = 60%). T. пл. = 48 С. Пример 93. 2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолпропановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 92, ожидаемый продукт получили в виде белого твердого вещества (выход = 77%). T. пл. = 94 С. Пример получения XXXII. 4-[4-Бис[(1,1-диметилэтокси)карбонил]амино]метил]фенил]бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения XXVII, начиная с метилового эфира 4(хлорметил)бензолбутановой кислоты, ожидаемый продукт получили в виде бесцветного масла (выход = 36%). 1H ЯМР (ДМСО, 250 МГц) : 7.14 (s, 4H); 4.66 (s, 2H); 3.56 (s, 3H); 2.56 (t, 2H); 2.27 (t, 2H); 1.79 (q,2H); 1.39 (s, 18H). Пример получения XXXIII. 4-(Аминометил)бензолбутановой кислоты метилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XXVIII, начиная соединения, полученного согласно Примеру получения XXXII, ожидаемый продукт получили в виде белого твердого вещества (выход = 80%). T.пл. = 205C. Пример 94. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолбутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXXIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 71%). T. пл. = 55 С. Пример 95. 4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол 2-ил]карбонил]амино]метил]бензолбутановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 94, ожидаемый продукт получили в виде белого твердого вещества (выход = 91%). T. пл. = 75 С. Пример получения XXXIV. 3-(Аминометил)бензолбутановой кислоты метилового эфира гидрохлорид. Следуя методике, аналогичной примеру получения XV, начиная с метилового эфира 3 цианобензолбутановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход- 23012971 Пример 96. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолбутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 66, начиная с соединения, полученного согласно примеру получения XXXIV, ожидаемый продукт получили в виде бесцветного масла (выход = 81%). 1H ЯМР (ДМСО, 300 МГц) : 8.72 (t, NH); 8.02 (m, 2H); 7.93 (m, 4H); 7.78-7.72 (m, 2H); 7.50 (d, 1H); 7.25-7.03 (m, 7H); 4.91 (dd, 1H); 4.31 (d, 2H); 3.57 (s, 3H); 3.2-3.1 (m, 1H); 3.0-2.94 (m, 1H); 2.55 (t, 2H); 2.32 (t, 2H); 1.80 (m, 2H). Пример 97. 3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]метил]бензолбутановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 96, ожидаемый продукт получили в виде белого твердого вещества (выход = 92%). T. пл. = 76 С. Пример получения XXXV. (2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]1H-индол-2-карбоновой кислоты хлорид. Следуя методике, аналогичной примеру получения VI, начиная с кислоты, полученной согласно примеру получения IV, ожидаемый продукт получили в виде бесцветного масла (выход = 98%). Пример получения XXXVI. 4-[2-(Фенилметокси)карбонил]амино]этокси]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Раствор 3 г (9,1 ммоль) 4-[2-(фенилметокси)карбонил]амино]-этокси]бензолуксусной кислоты в 60 мл хлороформа охлаждают до -30C и добавляют 1,18 г (10,9 ммоль) этилхлорформиата и 1,52 мл (10,9 ммоль)триэтиламина. Эту смесь перемешивают в течение 1 ч при -30C, а затем добавляют 1,63 г (22 ммоль) трет-бутанола и 1,52 мл (10,9 ммоль) триэтиламина. Эту смесь перемешивают в течение 16 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в 100 мл этилацетата, и полученную органическую фазу промывают водой, а затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/метилциклогексан (1/1; об./об.) в качестве элюента, с получением 930 мг ожидаемого соединения (выход = 26%). 1H ЯМР (ДМСО, 300 МГц) : 7.46 (t, 1H); 7.38-7.28 (m, 5H); 7.13 (d, 2H); 6.86 (d, 2H); 5.03 (S, 2H); 3.96 (t, 2H); 3.45 (s, 2H); 3.36 (q, 2H); 1.38 (s, 9H). Пример получения XXXVII. 4-[2-(Амино)этокси]бензолуксусной кислоты 1,1-диметилэтиловый эфир. 91 мг 10% палладия на угле добавляют к раствору 910 мг (2,36 ммоль) соединения, полученного согласно примеру получения XXXVI, в 15 мл ТГФ и 1 мл воды и эту смесь перемешивают при атмосферном давлении водорода при комнатной температуре в течение 1 ч. Затем катализатор отфильтровывают и фильтрат концентрируют при пониженном давлении с получением 575 мг ожидаемого продукта в виде бесцветного масла (выход = 97%). 1H ЯМР (ДМСО, 300 МГц) : 7.15 (d, 2H); 6.93 (d, 2H); 3.91 (t, 2H); 6.89 (d, 2H); 2.85 (t, 2H); 3.45 (s,2H); 1.38 (s, 9H); (NH2 протоны невидимы). Пример 98. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Готовят раствор 1,1 г (2,35 ммоль) хлорангидрида, полученного согласно примеру полученияXXXV, в 15 мл дихлорметана и добавляют 575 мг (4,72 ммоль) амина, полученного согласно примеру получения XXXVII, и 0,658 мл триэтиламина. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (9/1; об./об.) в качестве элюента, с получением 1,2 г ожидаемого соединения в виде бежевого аморфного твердого вещества (выход = 77%). 1H ЯМР (ДМСО, 250 МГц) : 8.42 (t, 1H); 8.02 (m, 2H); 7.95-7.72 (m, 6H); 7.48 (d, 1H); 7.16-7.11 (m,5H); 7.03 (t, 1H); 6.89 (d,2H); 4.89 (dd, 1H); 4.01 (t, 2H); 3.57-3.42 (m, 4H); 3.20-2.89 (m, 2H); 1.38 (s, 9H). Пример 99. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 98, ожидаемый продукт получили в виде белого твердого вещества (выход = 97%). T.пл. = 112-113 С. Пример 100. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]этокси]бензойная кислота. Готовят раствор 233 мг (1,288 ммоль) 4-(2-аминоэтокси)бензойной кислоты в 3,73 мл воды и 2,13 мл триэтиламина. Затем добавляют 12,8 мл ацетонитрила при комнатной температуре, а затем раствор 300 мг (0,644 ммоль) хлорангидрида, полученного согласно примеру получения XXXV, в 2,13 мл дихлорметана. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в дихлорметане и промывают 3% раствором уксусной кислоты. Органическую фазу концентрируют при пониженном давлении, и по- 24012971 лученный сырой продукт очищают хроматографией с обращенной фазой на RP18-привитом силикагеле,используя смесь ацетонитрил/вода (55/45; об./об.) в качестве элюента, с получением 350 мг ожидаемого продукта в виде белого твердого вещества (выход = 89%). T. пл. = 95-100C. Пример 101. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]этил]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Готовят раствор 177 мг (0,75 ммоль) трет-бутилового эфира 4-(2-аминоэтил)-бензолуксусной кислоты в 3 мл дихлорметана. Затем добавляют 385 мг (эквивалент 1 ммоль) морфолина на сополимерном носителе стирол/дивинилбензол при комнатной температуре, а затем раствор 350 мг (0,75 ммоль) хлорангидрида, полученного согласно примеру получения XXXV, в 2,13 мл дихлорметана. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре, а затем фильтруют и концентрируют при пониженном давлении. Полученный сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (8/2; об./об.) в качестве элюента, с получением 430 мг ожидаемого продукта в виде масла (выход = 95%). 1(s, 9H). Пример 102. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]бензолуксусная кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 101, ожидаемый продукт получили в виде белого твердого вещества (выход = 69%). T. пл. = 110 С. Пример 103. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]бензолуксусной кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 98, начиная с трет-бутилового эфира 3-(2-аминоэтил) бензолуксусной кислоты, ожидаемый продукт получили в виде белой пасты (выход = 95%). 1H ЯМР (ДМСО, 300 МГц) : 8.26 (t, 1H); 8.03-7.72 (m, 8H); 7.49 (d, 1H); 7.25-7.03 (m, 7H); 4.81 (dd,1H); 3.51 (s, 2H); 3.36-3.30 (m, 2H); 3.21 (dd, 1H); 2.90 (dd, 1H); 2.73 (t, 2H); 1.38 (s, 9H). Пример 104. 3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]бензолуксусная кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 103, ожидаемый продукт получили в виде белого твердого вещества (выход = 84%). T. пл. = 90C. Пример 105. (2S)-2,3-Дигидро-N-[2-(4-пиридинилокси)этил]-1-3'-(трифторметил)[1,1'-дифенил]-4 ил]сульфонил]-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 98, начиная с 2-(4-пиридинилокси)этанамина, ожидаемый продукт получили в виде белой пасты (выход = 37%). 1H ЯМР (ДМСО, 300 МГц) : 8.45 (t, 1H); 8.39-8.36 (m, 2H); 8.03-7.72 (m, 8H); 7.48 (d, 1H); 7.27 (t,1H); 7.13 (d, 1H); 7.03 (d, 1H); 6.98-6.95 (m, 2H); 4.87 (dd, 1H); 4.13 (t, 2H); 3.61-3.44 (m, 2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 106. (2S)-2,3-Дигидро-N-[2-(3-пиридинилокси)этил]-1-3'-(трифторметил)[1,1'-дифенил]-4 ил]сульфонил]-1 Н-индол-2-карбоксамид. Следуя методике, аналогичной примеру 98, начиная с 2-(3-пиридинилокси)этанамина, ожидаемый продукт получили в виде белой пены (выход = 63%). 1H ЯМР (ДМСО, 300 МГц) : 8.48 (t, 1H); 8.30 (dd, 1H); 8.17 (m, 1H); 8.03-7.65 (m, 8H); 7.50-7.02 (m,6H); 4.89 (dd, 1H); 4.12 (t, 2H); 3.58-3.50 (m, 2H); 3.15 (dd, 1H); 2.93 (dd, 1H). Пример 107. -(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]-(R)-бензолпентановая кислота. Следуя методике, аналогичной примеру 100, начиная с (R)-аминобензолпентановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 50%). T. пл. = 82-84 С. Пример 108.-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]бензолпропановая кислота. Следуя методике, аналогичной примеру 100, начиная с -(аминометил)бензолпропановой кислоты,ожидаемый продукт получили в виде белого твердого вещества (выход = 48%). T. пл. = 85-90C. Пример 109. 7-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]гептановая кислота. Следуя методике, аналогичной примеру 100, начиная с 7-аминогептановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 14%). T. пл. = 65-70C. Пример 110. 9-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]нонановая кислота. Следуя методике, аналогичной примеру 100, начиная с 9-аминононановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 23%). T. пл. = 60C. Пример 111.(0,217 ммоль) карбоната натрия и 0,7 мг (0,02 ммоль) додецилтриметиламмония бромида. Эту смесь перемешивают в течение 5 мин при комнатной температуре и добавляют 100 мг (0,215 ммоль) хлорангидрида, полученного согласно примеру получения XXXV. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем при температуре флегмы растворителя в течение 16 ч, а затем охлаждают и фильтруют. Остаточное твердое вещество промывают 5 мл ТГФ и объединенные фильтраты концентрируют при пониженном давлении. Сырой продукт очищают хроматографией с обращенной фазой на RP18-привитом силикагеле, используя смесь вода/ацетонитрил (45/55; об./об.) в качестве элюента,с получением 26 мг ожидаемого соединения в виде белого твердого вещества (выход = 20%). T. пл. = 90C. Пример 112. -(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол 2-ил]карбонил]амино]-(S)-бензолбутановой кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 98, начиная с трет-бутилового эфира (S)-аминобензолбутановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход= 67%). T. пл. = 50C. Пример 113. -(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол 2-ил]карбонил]амино]-(S)-бензолбутановая кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 112, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). T. пл. = 78-82 С. Пример получения XXXVIII. 5-(4-Цианофенокси)пентановой кислоты метиловый эфир. Готовят раствор 408,6 мг (3,43 ммоль) 4-гидроксибензонитрила в 15 мл ацетонитрила и добавляют 1,12 г (3,43 ммоль) карбоната цезия, а затем 803 мг (4,12 ммоль) метилового эфира 5-бромпентановой кислоты. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в этилацетате, и полученную органическую фазу промывают водой, а затем высушивают и концентрируют. Сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/метилциклогексан (6/4; об./об.) в качестве элюента, с получением ожидаемого продукта в виде пастообразного твердого вещества (выходH ЯМР (ДМСО, 250 МГц) : 7.78-7.72 (m, 2H); 7.12-7.06 (m, 2H); 4.06 (t, 2H); 3.58 (S, 3H); 2.38 (t,2H); 1.78-1.63 (m, 4H). Пример получения XXXIX. 5-[4-(Аминометил)фенокси]пентановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XV (в присутствии соляной кислоты), начиная с соединения, полученного согласно примеру получения XXXVIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 83%). T. пл. = 198-200 С. Пример 114. 5-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенокси]пентановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения XXXIX, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). T. пл.= 50C. Пример 115. 5-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенокси]пентановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 114, ожидаемую кислоту получили в виде белого твердого вещества (выход = 98%). T. пл. = 70C. Пример получения XL. 4-(3-Цианофенокси)бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру получения XXXVIII, начиная с 3-гидроксибензонитрила и метилового эфира 4-бромбутановой кислоты, ожидаемый эфир получили в виде оранжевой жидкостиH ЯМР (ДМСО, 250 МГц) : 7.49 (t, 1H); 7.40-7.37 (m, 2H); 7.29-7.22 (m, 1H); 4.05 (t, 2H); 3.60 (s,3H); 2.51-2.45 (m, 2H); 2.05-1.93 (m, 2H). Пример получения XLI. 4-[3-(Аминометил)фенокси]бутановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XXXIX, начиная с соединения, полученного согласно примеру получения XL, ожидаемый эфир получили в виде белого твердого вещества (выход = 87%). T. пл. = 104 С. Пример 116. 4-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения XLI, ожидаемый продукт получили в виде белого твердого вещества (выход = 96%). T. пл. = 50C. Пример 117. 4-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н- 26012971 индол-2-ил]карбонил]амино]метил]фенокси]бутановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 116, ожидаемую кислоту получили в виде белого твердого вещества (выход = 97%). T. пл. = 70C. Пример получения XLII. 2-(2-Аминоэтокси)бензолуксусной кислоты 1-метилэтиловый эфир (гидрохлорид). Готовят раствор 865 мг (4,45 ммоль) изопропилового эфира 2-гидроксибензолуксусной кислоты в 5 мл ацетонитрила и добавляют 1,45 г (4,45 ммоль) карбоната цезия. Эту смесь перемешивают в течение 10 мин при комнатной температуре, а затем добавляют 500 мг (2,23 ммоль) трет-бутил(2 бромэтил)карбамата. Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, а затем концентрируют при пониженном давлении. Затем остаток после выпаривания обрабатывают 4,7 мл трифторуксусной кислоты в течение 2 ч при комнатной температуре, а затем разбавляют водой и этилацетатом. Смесь нейтрализуют раствором гидроксида натрия и экстрагируют этилацетатом. Полученную органическую фазу высушивают над сульфатом магния и частично концентрируют при пониженном давлении. Сырой продукт фиксируют на силикагеле, привитом сульфоном (Varian Megabond SCX), и высвобождают раствором аммиака в метаноле. Ожидаемый продукт получают в виде основания путем концентрирования элюированной жидкости, а затем высаливают раствором хлорида водорода в этиловом эфире с получением ожидаемой соли в виде желтого масла (выход = 61%). 1H ЯМР (ДМСО, 300 МГц) : 8.21 (s, 3H); 7.28-7.17 (m, 2H); 7.00-6.91 (m, 2H); 4.90 (hep, 1H); 4.17 (t,2H); 3.60 (s, 2H); 3.15 (hex, 2H); 1.18 (d, 6H). Пример 118. 2-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этокси]бензолуксусной кислоты 1-метилэтиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения XLII, ожидаемый продукт получили в виде белого твердого вещества (выход = 92%). 1(m, 2H); 4.01 (t, 2H); 3.57-3.39 (m, 4H); 3.20-2.92 (m, 2H); 1.16 (d, 6H). Пример 119. 2-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этокси]бензолуксусная кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 118, ожидаемый продукт получили в виде белого твердого вещества (выход = 52%). T. пл. = 131-134 С. Пример 120. N-4-[(Диметиламино)карбонил]фенил]метил]-2,3-дигидро-1-3'-(трифторметил)[1,1'дифенил]-4-ил]сульфонил]-(2S)-1H-индол-2-карбоксамид. Следуя методике, аналогичной примеру 98, начиная с 4-(аминометил)-N,N-диметилбензолкарбоксамида, ожидаемый продукт получили в виде белого твердого вещества (выход = 54%). T. пл. = 70C. Пример получения XLIII. 4-(3-Бромфенокси)бутановой кислоты 1,1-диметилэтиловый эфир. 1,3 г 4-(3-Бромфенокси)бутановой кислоты, 8 мл жидкого изобутена и 2 капель серной кислоты помещают в реактор, устойчивый к давлению. Реактор закрывают и перемешивают при комнатной температуре в течение 16 ч. Остаточное давления осторожно выпускают и продукт растворяют в этилацетате и растворе бикарбоната натрия. Органическую фазу промывают водой, а затем высушивают и концентрируют при пониженном давлении с получением ожидаемого эфира в виде бесцветной жидкости (выход = 94%). 1H ЯМР (ДМСО, 250 МГц) : 7.26-7.21 (m, 1H); 7.13-7.09 (m, 2H); 6.96-6.92 (m, 1 H); 3.98 (t, 2H); 2.34 (t, 2H); 1.95-1.86 (m, 2H); 1.41 (s, 9H). Пример получения XLIV. 4-[3-[(Е)-2-(1,3-Дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)этенил]фенокси] бутановой кислоты 1,1-диметилэтиловый эфир. Смесь 342 мг (1,98 ммоль) N-(2-этенил)фталимида, 620 мг (1,98 ммоль) эфира, полученного согласно примеру получения XLIII, 13,3 мг (0,06 ммоль) ацетата палладия, 450 мкл (2,5 ммоль) диизопропилэтиламина и 53 мкл (0,22 ммоль) три-трет-бутилфосфина в 8 мл ацетонитрила готовят и нагревают в микроволновой печи в течение 20 мин при 150C. После отгонки растворителя сырой продукт очищают хроматографией на силикагеле, используя смесь толуол/этилацетат (95/5; об./об.) в качестве элюента, с получением 568 мг ожидаемого соединения в виде желтого твердого вещества (выход = 70%). 1H ЯМР (ДМСО, 300 МГц) : 7.96-7.87 (m, 4H); 7.47-7.06 (m, 5H); 6.85-6.82 (m, 1 H); 4.02 (t, 2H); 2.38 (t, 2H); 1.98-1.92 (m, 2H); 1.42 (s, 9H). Пример получения XLV. 4-[3-[2-(1,3-Дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)этил]фенокси]бутановой кислоты 1,1-диметилэтиловый эфир. Готовят раствор 565 мг (1,38 ммоль) соединения, полученного согласно примеру получения XLIV, в 8 мл ТГФ и 2 мл этанола и добавляют 209 мг 10% палладия на угле. Эту смесь гидрогенизируют при 3500 hPa при комнатной температуре, а затем фильтруют и концентрируют при пониженном давлении с получением 536 мг ожидаемого соединения в виде бежевого твердого вещества (выход = 94%). 1- 27012971 Пример получения XLVI. 4-[3-[2-(Амино)этил]фенокси]бутановой кислоты 1,1-диметилэтиловый эфир. Готовят раствор 250 мг (0,63 ммоль) соединения, полученного согласно примеру получения XLV, в 2,5 мл этанола и добавляют 230 мг (0,46 ммоль) гидрата гидразина. Эту смесь нагревают в течение 30 мин при температуре флегмы растворителя, а затем фильтруют и концентрируют под давлением. Сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/метанол (95/5; об./об.),содержащую 1% аммиака, в качестве элюента, с получением 244 мг ожидаемого соединения в виде маслаH ЯМР (ДМСО, 300 МГц) : 7.20-7.13 (m, 1H); 6.76-6.70 (m, 3H); 3.94 (t, 2H); 2.74 (m, 2H); 2.58 (t,2H); 2.35 (t, 2H); 1.96-1.88 (m, 2H); 1.39 (s, 9H). Пример 121. 4-[3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1Hиндол-2-ил]карбонил]амино]этил]фенокси]бутановой кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения XLVI, ожидаемый продукт получили в виде бежевого твердого вещества (выход = 88%). 1(m, 3H); 4.81 (dd, 1H); 3.94 (t, 2H); 3.42-3.30 (m, 2H); 3.06 (dd, 1H); 2.85 (dd, 1H); 2.71 (t, 2H); 2.35 (t, 2H); 1.93-1.88 (m, 2H); 1.37 (s, 9H). Пример 122. 4-[3-[2-(2H-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]бутановая кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 121, ожидаемый продукт получили в виде белого твердого вещества (выход = 89%). T. пл. = 70C. Следуя методике, аналогичной примерам получения XLIII-XLVI, начиная с 3-(3-бромфенокси) пропановой кислоты, приведенные ниже соединения получили в последовательности. Пример получения XLVII. 3-(3-Бромфенокси)пропановой кислоты 1,1-диметилэтиловый эфир. Бесцветная жидкость (выход = 98%). 1H ЯМР (ДМСО, 300 МГц) : 7.24 (t, 1H); 7.14-7.11 (m, 2H); 6.96-6.92 (m, 1H); 4.17 (t, 2H); 2.65 (t, 2H); 1.40 (s, 9H). Пример получения XLVIII. 3-[3-[(E)-2-(1,3-Дигидро-1,3-диоксо-2 Н-изоиндол-2-ил)этенил]фенокси]пропановой кислоты 1,1-диметилэтиловый эфир. Желтое твердое вещество (выход = 21%). 1H ЯМР (ДМСО, 300 МГц) : 7.96-7.87 (m, 4H); 7.47-7.07H ЯМР (ДМСО, 300 МГц) : 7.20-7.14 (m, 1H); 6.78-6.71 (m, 3H); 4.13 (t, 2H); 2.74 (m, 2H); 2.662.56 (m, 4H); 1.39 (s, 9H). Пример 123. 3-[3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]пропановой кислоты 1,1-диметилэтиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения L, ожидаемый продукт получили в виде бежевого твердого вещества (выход = 81%). 1(m, 4H); 1.39 (s, 9H). Пример 124. 3-[3-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]пропановая кислота. Следуя методике, аналогичной примеру 25, начиная с соединения, полученного согласно примеру 123, ожидаемый продукт получили в виде белого твердого вещества (выход = 45%). T. пл. = 78 С. Пример получения LI. 4-[4-[2-(Амино)этил]фенокси]бутановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с метилового эфира 4-[4(цианометил)фенокси]бутановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 68%). T. пл. = 168-172 С. Пример 125. 4-[4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения LI, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). 1- 28012971 Пример 126. 4-[4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]бутановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 125, ожидаемый продукт получили в виде белого твердого вещества (выход = 75%). T. пл. = 70C. Пример получения LII. 3-[4-[2-(Амино)этил]фенокси]пропановая кислота (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с 3-[4-(цианометил)фенокси]пропановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 23%). T. пл. = 216 С. Пример 127. 3-[4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]-сульфонил]-1 Ниндол-2-ил]карбонил]амино]этил]фенокси]пропановая кислота. Готовят раствор 115 мг (0,47 ммоль) соединения, полученного согласно примеру получения LII, в 1,3 мл воды и добавляют 777 мкл триэтиламина и 4,7 мл ацетонитрила. Наконец, добавляют раствор 240,9 мг (0,51 ммоль) хлорангидрида, полученного согласно примеру получения XXXV, в 2 мл ацетонитрила при комнатной температуре при перемешивании. Реакционную смесь перемешивают в течение 30 мин, а затем концентрируют при пониженном давлении. Остаток после выпаривания растворяют в слегка подкисленной воде и этилацетате. Органическую фазу отделяют, промывают водой, а затем высушивают и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя смесь дихлорметан/этилацетат (95/5; об./об.), содержащей 1% уксусной кислоты, в качестве элюента, с получением 144 мг ожидаемого соединения в виде белого твердого вещества (выход= 48%). T. пл. = 70C. Пример получения LIII. 5-[3-(Аминометил)фенокси]пентановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с метилового эфира 5-(3 цианофенокси)пентановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 94%). T. пл. = 94-98 С. Пример 128. 5-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]пентановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 98, начиная с соединения, полученного согласно примеру получения LHI, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). 1(m, 3H); 4.92 (dd, 1H); 4.32 (d, 2H); 3.90 (t, 2H); 3.56 (s, 3H); 3.18 (dd, 1H); 2.97 (dd, 1H); 2.36 (t, 2H); 1.731.63 (m, 4H). Пример 129. 5-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]пентановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 128, ожидаемый продукт получили в виде белого твердого вещества (выход = 75%). T. пл. = 70C. Пример получения LIV. 4-[4-(Аминометил)фенокси]бутановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с метилового эфира 4-(4 цианофенокси)бутановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 63%). T. пл. = 218 С. Пример 130. 4-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]бутановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 127, начиная с соединения, полученного согласно примеру получения LIV, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). T. пл. = 50C. Пример 131. 4-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]бутановая кислота. Следуя методике, аналогичной примеру 5, начиная с соединения, полученного согласно примеру 130, ожидаемый продукт получили в виде белого твердого вещества (выход = 84%). T. пл. = 78-80C. Пример получения LV. 3-[3-(Аминометил)фенокси]пропановая кислота (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с 3-(3-цианофенокси)пропановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 73%). T. пл. = 134138 С. Пример 132. 3-[3-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]пропановая кислота. Следуя методике, аналогичной примеру 127, начиная с соединения, полученного согласно примеру получения LV, ожидаемый продукт получили в виде белого твердого вещества (выход = 98%). T. пл. = 70 С. Пример получения LVI. 3-[4-(Аминометил)фенокси]пропановая кислота (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с 3-(4-цианофенокси)пропановой кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 78%). T. пл. = 163- 29012971 165 С. Пример 133. 3-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]пропановая кислота. Следуя методике, аналогичной примеру 127, начиная с соединения, полученного согласно примеру получения LVI, ожидаемый продукт получили в виде белого твердого вещества (выход = 76%). T. пл. = 72 С. Пример 134. 4-[2-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1H-индол-2-ил]карбонил]амино]этил]бензойная кислота. Следуя методике, аналогичной примеру 127, начиная с 4-(2-аминоэтил)бензойной кислоты, ожидаемый продукт получили в виде белого твердого вещества (выход = 89%). T. пл. = 106 С. Пример получения LVII. 3-(4-Цианофенокси)-2,2-диметилпропановой кислоты метиловый эфир. Готовят смесь 2,65 г (10,1 ммоль) трифенилфосфина и 20 мл толуола и добавляют 2 мл (10,2 ммоль)DIAD (диизопропилазодикарбоксилата) добавляют при 0C. Полученный раствор добавляют к раствору 1 г (8,4 ммоль) 4-гидроксибензонитрила и 1,30 мл (10,2 ммоль) метил-2,2-диметил-3-гидроксипропаноата в 10 мл толуола при 0C. Затем реакционную смесь перемешивают при 30 мин при 80C, а затем концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на силикагеле, используя толуол в качестве элюента, с получением ожидаемого соединения в виде бесцветного масла (выход = 89%). 1H ЯМР (ДМСО, 250 МГц) : 7.75 (d, 2H); 7.10 (d, 2H); 4.08 (s, 2H); 3.61 (s, 3H); 1.24 (s, 6H). Пример получения LVIII. 3-[4-(Аминометил)фенокси]-2,2-диметилпропановой кислоты метиловый эфир (гидрохлорид). Следуя методике, аналогичной примеру получения XV, начиная с соединения, полученного согласно примеру получения LVII, ожидаемый продукт получили в виде белого твердого вещества (выход = 96%). T. пл. = 140-145 С. Пример 135. 3-[4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Н-индол-2-ил]карбонил]амино]метил]фенокси]-2,2-диметилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 21, начиная с амина, полученного согласно примеру получения LVIII, ожидаемый продукт получили в виде белого твердого вещества (выход = 75%). T. пл. = 6875 С. Пример 136. 3-[4-(2S)-2,3-Дигидро-1-2'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]-2,2-диметилпропановая кислота. Следуя методике, аналогичной примеру 5, начиная с эфира, полученного согласно примеру 135,ожидаемый продукт получили в виде белого твердого вещества (выход = 74%). T. пл. = 98-105C. Пример 137. 3-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]-2,2-диметилпропановой кислоты метиловый эфир. Следуя методике, аналогичной примеру 4, начиная с амина, полученного согласно примеру получения LVIII, ожидаемый продукт получили в виде бесцветного масла (выход = 51%). 1H ЯМР (ДМСО, 300 МГц) : 8.66 (t, 1H); 8.03-7.70 (m, 8H); 7.50 (d, 1H); 7.24-7.12 (m, 4H); 7.03 (t,1H); 6.86 (d, 2H); 4.88 (dd, 1H); 4.33-4.20 (m, 2H); 3.95 (s, 2H); 3.60 (s, 3H); 3.16 (dd, 1H); 2.94 (dd, 1H); 1.23 (s, 6H). Пример 138. 3-[4-(2S)-2,3-Дигидро-1-3'-(трифторметил)[1,1'-дифенил]-4-ил]сульфонил]-1 Ниндол-2-ил]карбонил]амино]метил]фенокси]-2,2-диметилпропановая кислота. Следуя методике, аналогичной примеру 5, начиная с эфира, полученного согласно примеру 137,ожидаемый продукт получили в виде белого твердого вещества (выход = 88%). T. пл. = 95-105C. Пример 139. 2,3-Дигидро-N-2-(метиламино)фенил]метил]-1-3'-(трифторметил)[1,1'-дифенил]-4 ил]сульфонил]-(2S)-1H-индол-2-карбоксамид. 0,028 мл (0,19 ммоль) триэтиламина и 0,018 мл (0,19 ммоль) метилсульфата добавляют к раствору 100 мг (0,18 ммоль) соединения, полученного согласно примеру 61, в 3 мл этилового эфира. Эту смесь кипятят с обратным холодильником в течение 8 ч, а затем концентрируют при пониженном давлении. Сырой продукт очищают хроматографией с обращенной фазой на RP18-привитом силикагеле, используя смесь ацетонитрил/вода (6/4; об./об.) в качестве элюента, с получением ожидаемого продукта в виде белого порошка (выход = 62%). T. пл. = 86 С. Пример 140. 2,3-Дигидро-N-2-(диметиламино)фенил]метил]-1-3'-(трифторметил)[1,1'-дифенил]4-ил]сульфонил]-(2S)-1H-индол-2-карбоксамид. Готовят раствор 100 мг (0,18 ммоль) соединения, полученного согласно примеру 61, в 2 мл ацетонитрила и добавляют 0,07 мл (0,9 ммоль) 36% водного раствора формальдегида при комнатной температуре. Реакционную смесь перемешивают в течение 15 мин при комнатной температуре, а затем добавляют 23 мг (0,36 ммоль) цианоборгидрида натрия. Смесь снова перемешивают в течение 15 мин, добавляют 0,05 мл уксусной кислоты и перемешивание продолжают в течение 2 ч при комнатной температуре. Затем растворитель отгоняют при пониженном давлении и остаток растворяют в дихлорметане. Органическую фазу промывают нормальным раствором гидроксида натрия, а затем водой, высушивают над сульфатом магния и концентрируют при пониженном давлении. Сырой продукт очищают хроматографией на
МПК / Метки
МПК: C07D 413/12, C07D 401/12, C07D 209/42, C07D 403/12, A61K 31/404
Метки: индолиновые, соединения, новые
Код ссылки
<a href="https://eas.patents.su/30-12971-novye-indolinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые индолиновые соединения</a>












