Новые соединения, являющиеся сильнодействующими ингибиторами механизма обмена ионов na+/ca2+ при лечении аритмии
Номер патента: 6580
Опубликовано: 24.02.2006
Авторы: Карьялайнен Арто, Котовуори Пекка, Отсомаа Леена, Коскелайнен Туула, Тиайнен Эйя, Раску Сирпа, Термякангас Олли, Тенхунен Юкка, Норе Пентти
Формула / Реферат
1. Соединения формулы (I)
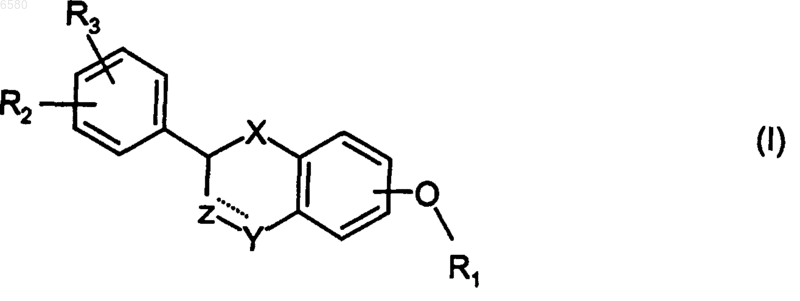
в которой
X представляет собой -O-, -CH2- или -C(O)-;
Z представляет собой -CHR9- или валентную связь;
Y представляет собой -CH2-, -C(O)-, CH(OR10)-, -CH(NR11R12)-, -O-, -S-, -S(O)- или -S(O2)-,
при условии, что в том случае, когда Z представляет собой валентную связь, Y не является C(O);
пунктирная линия представляет собой необязательную двойную связь в том случае, когда Z представляет собой -CR9- и Y представляет собой -CH-, C(OR10)- или -C(NR11R12)-;
R1 представляет собой одну из следующих групп:
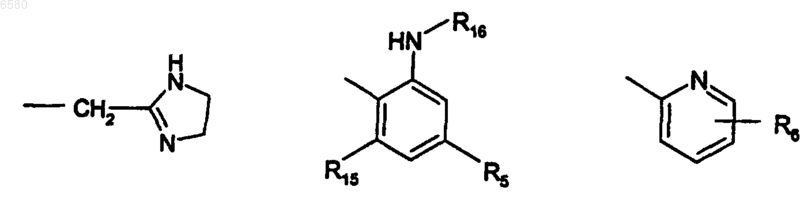
или в том случае, когда X представляет собой -O- и Z представляет -CH2, R1 может также быть -(CH2)nNR4R7;
n равно 1-4,
R2 и R3 независимо представляют собой H, C1-7алкил, C1-7алкокси, -NO2, галоген, -CF3, -OH, -NHR8 или -COOH,
R4 и R7 независимо представляют собой H, C1-7алкил или C1-7гидроксиалкил,
R5 независимо представляет собой H, C1-7алкокси, -CF3, -NH2 или -CN,
R6 представляет собой -NO2, -NR14R19, -CF3 или
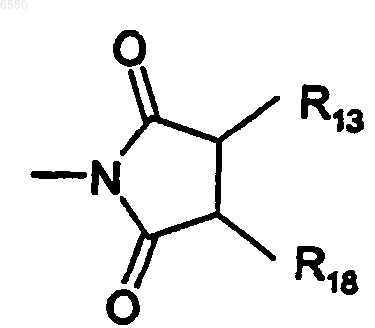
R8 и R16 независимо представляют собой H или C1-7ацил,
R9 представляет собой H или C1-7алкил,
R10 представляет собой H, C1-7алкилсульфонил или C1-7ацил;
R11 и R12 независимо представляют собой H, C1-7алкил или C1-7 ацил,
R13 и R18 независимо представляют собой H или -OR20,
R14 и R19 независимо представляют собой H, C1-7ацил, C1-7 алкилсульфонил, C(S)NHR17 или C(O)NHR17,
R15 представляет собой H или NH2,
R17 представляет собой H или C1-7алкил,
R20 представляет собой H или C1-7ацил,
и их фармацевтически приемлемые соли и сложные эфиры.
2. Соединение по п.1, имеющее структуру
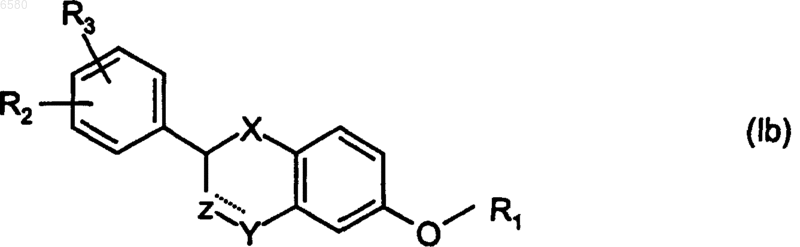
где R2, R3, X, Y и R1 являются такими, как они определены выше.
3. Соединение по п.1 или 2, где X является O, а Z и Y являются -CH2-.
4. Соединение по любому из пп.1 или 2, где X является O, Z является -CH2- и Y является CHOH.
5. Соединение по любому из пп.1-4, где R1 представляет собой одну из следующих групп:
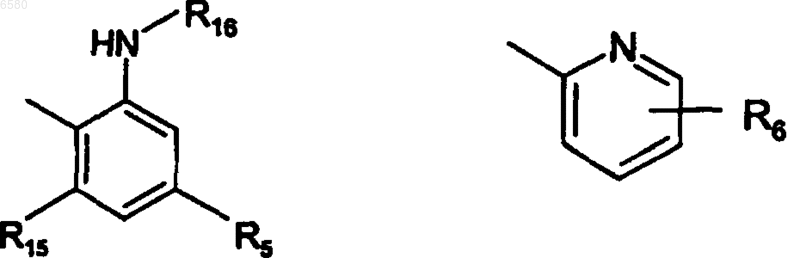
6. Соединение по любому из пп.1-5, где R6 является NO2 или -NR14R19.
7. Соединение по п.6, где R14 и R19 независимо представляют собой H, C1-7ацил или C1-7алкилсульфонил.
8. Соединение по любому из пп.1-7, где R15 и R16 представляют собой H.
9. Соединение по любому из пп.1-8, где R5 представляет собой H или C1-7алкокси.
10. Соединение по любому из пп.1-9, где R2 и R3 независимо представляют H или галоген.
11. Соединение по п.10, где галоген представляет собой фтор.
12. Соединение по любому из пп.1-11, где n=2.
13. Соединение по любому из пп.1-12, где R4 и R7 представляют собой метил.
14. Фармацевтическая композиция, содержащая соединение по п.1 вместе с фармацевтически приемлемым носителем.
15. Способ ингибирования механизма обмена ионов Na+/Ca2+ в клетке, включающий введение субъекту, в случае необходимости, терапевтически эффективного количества соединения по п. 1.
16. Способ лечения аритмии, включающий введению субъекту, в случае необходимости, терапевтически эффективного количества соединения по п.1.
Текст
006580 Настоящее изобретение относится к новым терапевтически активным соединениям и их фармацевтически приемлемым солям и сложным эфирам. Изобретение относится также к фармацевтическим композициям, содержащим данные соединения в качестве активных ингредиентов. Соединения изобретения являются сильнодействующими ингибиторами механизма обмена ионов Na+/Ca2+. Механизм обмена ионов Na+/Ca2+ является одним из механизмов переноса ионов, регулирующих концентрацию ионов натрия и кальция в клетках. Соединения, которые избирательно ингибируют механизм обмена ионов Na+/Ca2+ и вследствие этого предотвращают избыточную нагрузку Са 2+ в клетках,могут применяться для предотвращения механизма повреждения клеток сердечной мышцы и подобных после ишемии и реперфузии. Данные соединения применимы при лечении ишемических заболеваний сердца, ишемических церебральных заболеваний, ишемических почечных заболеваний и при защите клеток во время тромболитической терапии, пластической операции на сосудах, обходной операции коронарной артерии или трансплантации органов и аритмии. Соединения, способные ингибировать систему обмена Na+/Ca2+, были представлены ранее, например, в опубликованных патентах WO 97/09306, ЕР 0978506, ЕР 1031556, JP11049752 и JP 11302235. Было обнаружено, что соединения формулы (I), в частности, являются сильнодействующими ингибиторами механизма обмена ионов Na+/Ca2+ и успешно могут использоваться при лечении аритмии. Соединения настоящего изобретения и их фармацевтически приемлемые соли и сложные эфиры имеют структуру, представленную формулой (I)Y представляет собой -СН 2-, -С(О)-, CH(OR10)-, -СН(NR11R12)-, -O-, -S-, -S(O)- или -S(O2)-, при условии, что в том случае, когда Z представляет собой валентную связь, Y не является С(О); пунктирная линия представляет собой необязательную двойную связь в том случае, когда Z представляет собой -CR9- и Y представляет собой -СН-, С(OR10)-, или -С(NR11R12) -;R1 представляет собой одну из следующих групп: или в том случае, когда X представляет собой -О- и Z представляет -СН 2, R1 может также быть -(CH2)nNR4R7;n равно 1-4,R2 и R3 независимо представляют собой Н, С 1-7 алкил, C1-7 алкокси, -NO2, галоген, -CF3, -ОН, -NHR8 или -СООН,R4 и R7 независимо представляют собой Н, С 1-7 алкил или C1-7 гидроксиалкил,R5 независимо представляет собой Н, С 1-7 алкокси, -CF3, -NH2 или -CN,R6 представляет собой -NO2, -NR14R19, -CF3 илиR8 и R16 независимо представляют собой Н или С 1-7 ацил,R9 представляет собой Н или С 1-7 алкил,R10 представляет собой Н, С 1-7 алкилсульфонил или С 1-7 ацил;R11 и R12 независимо представляют собой Н, С 1-7 алкил или C1-7 ацил,R13 и R18 независимо представляют собой Н или -OR20,R14 и R19 независимо представляют собой Н, С 1-7 ацил, C1-7 алкилсульфонил, C(S)NHR17 илиC(O)NHR17,R15 представляет собой Н или NH2,R17 представляет собой Н или С 1-7 алкил,R20 представляет собой Н или С 1-7 ацил,и его фармацевтически приемлемые соли и сложные эфиры. В одном классе предпочтительных соединений и их фармацевтически приемлемых солей и сложных эфиров находятся соединения формулы в которой R1, R2, R3, X, Y и Z являются такими, как они определены выше. В другом классе предпочтительных соединений и их фармацевтически приемлемых солей и сложных эфиров находятся соединения формулы (I) , в которой X представляет собой О и Z представляет собой -СН 2-. В еще одном другом классе предпочтительных соединений и их фармацевтически приемлемых солей и сложных эфиров находятся соединения формулы (I), в которой X представляет собой О и Z представляет собой -СН 2- и Y представляет собой СНОН. В одном подклассе предпочтительных соединений и их фармацевтически приемлемых солей и сложных эфиров находятся соединения формулы (I), в которой R1 представляет собой одну из следующих групп В другом подклассе предпочтительных соединений находятся соединения, в которых R6 представляет собой -NO2 или -NR14R19. В группе данного подкласса R14 и R19 независимо представляют собой Н,ацил или алкилсульфонил, R15 и R16 предпочтительно представляют собой Н, и R5 представляет собой Н или низший алкокси. В одном подклассе предпочтительных соединений находятся соединения, в которых R2 и R3 независимо представляют Н или галоген. Предпочтительный галоген представляет собой фтор. В одном классе предпочтительных соединений находятся соединения, в которых n=2, R4 и R7 предпочтительно представляют собой метил. В настоящем изобретении предлагается также фармацевтическая композиция, содержащая соединение формулы (I) вместе с фармацевтически приемлемым носителем. В настоящем изобретении предлагается также способ ингибирования механизма обмена ионовNa+/Ca2+ в клетке, включающий введение субъекту, в случае необходимости, терапевтически эффективного количества соединения формулы (I). В настоящем изобретении предлагается также способ предотвращения избыточной нагрузки ионов Са 2+ в клетках, включающий введение субъекту, в случае необходимости, терапевтически эффективного количества соединения формулы (I). В настоящем изобретении предлагается также способ лечения аритмии, включающий введение субъекту, в случае необходимости, терапевтически эффективного количества соединения формулы (I). Фиг. 1 показывает противоаритмические действия соединения примера 27 на послесокращения изолированных сосочковых мышц морской свинки, вызванные уабаином. Фиг. 2 показывает противоаритмические действия соединения примера 67 на послесокращения изолированных сосочковых мышц морской свинки, вызванные уабаином. Соединения изобретения могут быть получены из соответствующих производных фенола (II), гдеR2, R3, X, Z и Y являются такими, как они определены выше. Синтезы показаны на схеме 1, где формула (II) сокращенно представлена как Аr-ОН (II) и R4, R5, R6,R7, R15 и R16 являются такими, как они определены выше, и Hal означает галоген. Соединения формулу (II) могут взаимодействовать с производными 1-хлор-2-нитробензола с образованием нитрофеноксисоединений (10), которые, в свою очередь, в результате гидрирования превращаются в производные фениламина (11). 5-Нитропиридин-2-илоксисоединения (12) получаются путем взаимодействия с 2-хлор-5-нитропиридином. Производные 2-оксиметилимидазолина (14) могут быть синтезированы из производных фенола (II) через промежуточное соединение, представляющее собой простой цианометиловый эфир (13) , который превращается с использованием известного метода (например, J. Med. Chem. 1994, 37(12), 1814) в имидазолин (14). Производные алкоксиазида (16) получают в результате взаимодействия соответствующих галогеналкоксисоединений (15) с азидом натрия. Азиды (16) превращаются в амины (17) путем взаимо-2 006580 действия с трифениламином. 2-(Диметиламино)этоксисоединения (18) получают взаимодействием фенолов формулы (II) с 2-(диметиламино)этилхлоридом. В результате восстановления нитропиридинов (22), последующего ацилирования, мезилирования и т.д. получаются соединения формулы (24), показанные на схеме 2 Схема 2 Как показано на следующей схеме 3, когда R2 и R3 являются такими, как они определены выше,производные 6- и 7-гидроксифлавана получаются из соответствующих флаванонов (1) восстановлением по Клемменсену. 6- и 7-гидроксифлаваноны (1) коммерчески доступны или могут быть синтезированы методами, описанными в литературе, например, в J. Org. Chem., I960, 25, 1247-9 и J. Org. Chem., 1958, 23,1159-61 или как показано далее на схеме 5. Схема 3 Следующая схема 4, где R2 и R3 являются такими, как они определены выше, показывает синтез 2 фенилиндан-5-олов (9). Конденсация р-анисового альдегида (3) с замещенной фенилуксусной кислотой(4) дает смесь цис- и транс-изомеров соответствующей акриловой кислоты (5) . После гидрирования и внутримолекулярной реакции Фриделя-Крафтса функциональная карбонильная группа 1-инданонов (7) может быть восстановлена восстановлением по Клемменсену. И, наконец, метоксииндан (8) нагревают с Схема 4 Производные 6-гидроксифлаванона могут быть синтезированы, как показано на схеме 5. 2',5'Дигидроксиацетофенон или соответствующий пропиофенон конденсируют с соответствующим бензальдегидом с образованием смеси требуемого 6-гидроксифлаванона (36) и соответствующего халкона (35). Халкон может быть циклизован во флаванон. Схема 5 Производные 2-фенилхроман-4,6-диола (37) получают из соответствующих 6-гидроксифлаванонов(36) восстановлением, как показано на схеме 6. Указанные производные диола могут быть затем восстановлены в 6-гидроксифлаваны (38). Схема 6 Как показано на следующей схеме 7, производные 4-амино-2-фенилхроманола (19) могут быть синтезированы из соответствующих флаванонов (1) через гидрокси-2-фенилхроман-4-оноксимы (20). Восстановление производного оксима дает 4-амино-2-фенилхроманолы (21), которые могут быть алкилиро-4 006580 ваны или этилированы общеизвестными методами. Производные 4-гидрокси-2-фенилхроманола могут быть обработаны подобными методами. Схема 7 Следующая схема 8, где R2 и R3 являются такими, как они определены выше, показывает синтез 7 гидроксиизофлавонов (29) и 7-гидроксиизофлаванов (30). Ацилирование 3-метоксифенола замещенными фенилуксусными кислотами дает соответствующие 2-гидроксидезоксибензоины (27), которые могут быть циклизованы с триэтилортоформиатом с получением изофлавонов (28). В результате удаления защиты с использованием бромисто-водородной кислоты и каталитического гидрирования образуются 7 гидроксиизофлаваны (30). Схема 8 Следующая схема 9 показывает синтез 2-фенил-2,3-дигидробензо[1,4]оксатиин-6-ола (34). Реакция 2-меркаптобензол-1,4-диола с эпоксидным полимером стирола в присутствии основания дает сульфид(33). В результате замыкания кольца с использованием катионита в кислой форме получается 2-фенил 2,3-дигидробензо[1,4]оксатиин-6-ол (34). Схема 9 Следующая схема 10 показывает синтез 6-фенил-5,6,7,8-тетрагидронафталин-2-ола (41) и 6 гидрокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-она (40). Катализированное Pd -арилирование 6 метокси-1-тетралона дает 6-метокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-он (39), после деметилирования которого получают феноловое соединение (40). Схема 10 Следующая схема (11), где R2 и R3 являются такими, как они определены выше, показывает синтез 2,3-дигидро-2-фенилбензо[1,4]диоксин-6-олов (45). После защиты гидроксильных групп 2,5 дигидроксиацетофенона указанный кетон перегруппировывается с перкислотами и после гидролиза образуется фенол. Фенол конденсируют с галогенкетоном и после восстановления и удаления защитных групп гидроксифенол (44) циклизуется в 2,3-дигидро-2-фенилбензо[1,4]диоксин-6-ол (45). Соли и сложные эфиры соединений могут быть получены известными методами. Физиологически приемлемые соли используются в качестве активных лекарственных средств. Примерами таких солей являются соли с неорганическими кислотами, такими как хлористо-водородная кислота, бромистоводородная кислота или азотная кислота, и соли с органическими кислотами, такими как метансульфоновая кислота, лимонная кислота или винная кислота. Физиологически приемлемые сложные эфиры также применяются в качестве активных лекарственных средств. Примерами являются сложные эфиры с алифатическими или ароматическими кислотами, такими как уксусная кислота, или с алифатическими или ароматическими спиртами. Использованный в данном описании термин алкил сам по себе или как часть другой группы включает радикалы как с прямой, так и с разветвленной и циклизованной цепью, содержащие до 18 атомов углерода, предпочтительно от 1 до 7 атомов углерода, наиболее предпочтительно от 1 до 4 атомов углерода. Использованный в данном описании термин низший алкил сам по себе или как часть другой группы включает радикалы как с прямой, так и с разветвленной и циклизованной цепью, содержащие от 1 до 7, предпочтительно от 1 до 4, наиболее предпочтительно 1 или 2 атома углерода. Конкретные примеры алкильных и низших алкильных остатков соответственно представляют собой метил, этил, пропил,изопропил, бутил, трет-бутил, пентил, циклопентил, гексил, циклогексил, октил, децил и додецил, включая различные их изомеры с разветвленной цепью. Использованный в данном описании термин алкокси сам по себе или как часть другой группы включает определенную выше алкильную группу, связанную с атомом кислорода. Использованный в данном описании термин ацил сам по себе или как часть другой группы относится к алкилкарбонильной или алкенилкарбонильной группе, при этом алкильная и алкенильная группы определены выше. Соединения изобретения могут быть введены больному в терапевтически эффективных количествах, которые обычно находятся в диапазоне от около 0,05 до 200 мг, предпочтительно от 0,1 до 100 мг,более предпочтительно от 0,5 до 50 мг в день в зависимости от возраста, массы тела, состояния больного,способа введения лекарственного средства и используемого ингибитора обмена Na+/Ca2+. Соединения изобретения могут быть приготовлены в виде лекарственных форм с использованием методик, известных в данной области. Они могут быть введены больному как таковые или в комбинации с подходящими фармацевтическими эксипиентами в форме таблеток, гранул, капсул, суппозиториев, эмульсий, суспен-7 006580 зий или растворов. Выбор подходящих ингредиентов для композиции осуществляется обычным путем специалистом в данной области в соответствии с установившейся практикой. Очевидно, что могут быть также использованы подходящие носители, растворители, гелеобразующие ингредиенты, образующие дисперсию ингредиенты, антиоксиданты, красители, подсластители, смачивающие вещества и другие ингредиенты, обычно используемые в технологии данной области. Композиции, содержащие активное соединение, могут быть введены энтерально или парентерально, при этом пероральный способ введения является предпочтительным. Содержание активного соединения в композиции составляет от около 0,5 до 100%, предпочтительно от около 0,5 до около 20% в расчете на общую массу композиции. Испытывали действие соединений изобретения на аритмию сосочковых мышц морской свинки, вызванную уабаином. Методы Сосочковые мышцы морской свинки помещали в горизонтальную кювету для мышц. К другому концу мышцы прикрепляли крючок, соединенный с датчиком силы сокращений мышцы. Мышечныепрепараты электрически стимулировали полем при частоте 1 Гц через посредство платиновых электродов. Для повышенного слияния мышечных препаратов использовали модифицированный растворTyrode. Состав раствора Tyrode был следующим (мМ): NaCl 135, MgCl2x6H2O 1, KCl 5, СаСl2 х 2 Н 2O 2,NaHCO3 15, Na2HPO4x2H2O 1 и глюкоза 10. Раствор Tyrode газировали карбогеном (95% O2, 5% СO2) для установления рН при значении 7,4. Эксперименты осуществляли при 37 С. Анализ судорожных напряжений мышцы осуществляли с применением системы для измерения потенциала действия и силы сокращений (ACFO v 1,0, Fision Ltd, Финляндия). Ингибирование аритмии, вызванной уабаином Уабаин за счет блокирования натрийкалийаденозинтрифосфатазы повышает содержание внутриклеточного натрия, который заменяется на кальций через посредство NCX. Повышенное содержание внутриклеточного кальция приводит к избыточной нагрузке саркоплазматической сети (SR) и самопроизвольному высвобождению кальция из SR, вызывающему замедленные поляризации последействия(DAD). Эквивалентностью DAD в сигнале силы сокращений мышцы являются послесокращения (АС),которые рассматриваются как самопроизвольные судорожные сокращения после стимуляции регулируемого судорожного сокращения. Соединения изобретения замедляли появление послесокращений и уменьшали их амплитуду. Как показано на фиг. 1, указанное в заголовке примера 27 соединение при концентрации 30 мкМ замедляло появление послесокращений [387,5 мин в сравнении с наполнителем: 258,9 мин (среднийSD),р=0,013, n=5] и уменьшало максимальную амплитуду послесокращений 1 (7416 мг в сравнении с наполнителем: 14354 мг, р=0,008, односторонний ANOVA с последующим LSD; n=5). Как показано на фиг. 2, указанное в заголовке примера 67 соединение при концентрации 10 мкМ уменьшало максимальную амплитуду послесокращений 1 (8820 мг в сравнении с наполнителем: 14354 мг, р=0,027, n=5). Примеры Пример 1. 5-Нитро-2-(2-фенилхроман-6-илокси)пиридин а) 2-фенилхроман-6-ол Цинк (5,4 г, 83,2 ммоль), хлорид ртути (II) (340 мг), концентрированный хлористый водород (0,2) и воду смешивали при комнатной температуре в течение 15 мин и смесь декантировали. В смесь уксусной кислоты (25 мл), концентрированного хлористого водорода (5,2 мл) и воды (2 мл) добавляли 6 гидроксифлаванон (1,0 г) в виде суспензии. Реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. После охлаждения до комнатной температуры реакционную смесь фильтровали и фильтрат экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным растворомNaHCO3, затем водой и сушили над Na2SO4. 2-Фенилхроман-6-ол очищали колоночной хроматографией с использованием в качестве элюента смеси гептан:этилацетат (2:1). 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,78 (с, 1 Н), 7,43-7,31 (м, 5 Н), 6,63 (д, 1 Н, J 8,6 Гц) 6,51 (дд, 1 Н, J 8,6, 2,9 Гц), 6,48 (д, 1 Н, J 2,9 Гц), 4,98 (дд, 1 Н, J 9,9, 2,2 Гц), 2,89 (ддд, 1 Н, J -16,7, 11,3, 6,1 Гц), 2,63 (ддд,1 Н, J -16,7, 5,5, 3,3 Гц) 2,10 (м, 1 Н), 1,94 (м, 1 Н).b) 5-Нитро-2-(2-фенилхроман-6-илокси)пиридин В раствор 2-фенилхроман-6-ола (300 мг) в сухом ДМФА (3 мл) добавляли фторид калия (225 мг). После перемешивания образовавшейся смеси при 120 С в течение 30 мин добавляли 2-хлор-5 нитропиридин (195 мг). Реакционную смесь перемешивали в течение еще 6,5 ч при 120 С. После охлаждения до комнатной температуры добавляли 1 М раствор НСl и смесь экстрагировали этилацетатом. Объединенные органические слои промывали водой, затем насыщенным раствором NaCl и сушили надNa2SO4. 5-Нитро-2-(2-фенилхроман-6-илокси)пиридин перекристаллизовывали из смеси ацетон-2 пропанол (1:5). 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,00 (д, 1 Н, J 2,9 Гц), 8,60 (дд, 1 Н, J 9,2, 2,9 Гц), 7,47-7,32 (м, 5 Н),7,20 (д, 1 Н, J 9,2 Гц), 7,00-6,89 (м, 3 Н), 5,15 (дд, 1 Н, J 10,1, 2,2 Гц), 2,99 (ддд, 1 Н, J -16,8, 11,3, 6,2 Гц),2,75 (ддд, 1 Н, J -16,8, 5,4, 3,3 Гц) 2,18 (м, 1 Н), 2,02 (м, 1 Н).-8 006580 Пример 2. Диметил[2-(2-фенилхроман-6-илокси)этил]амин Карбонат цезия (230 мг) и избыток 2-(диметиламино)этилхлорида в этилацетате добавляли в раствор 2-фенилхроман-6-ола (150 мг) в ацетонитриле (5 мл). Реакционную смесь кипятили с обратным холодильником в течение 30 мин. После удаления растворителей остаток переносили в воду и экстрагировали этилацетатом. Объединенные органические слои промывали водой и затем насыщенным растворомa) 6-(4-Метокси-2-нитрофенокси)-2-фенилхроман 2-Фенилхроман-6-ол (500 мг) и 1-хлор-4-метокси-2-нитробензол (390 мг) растворяли в ДМСО (10 мл). Добавляли гидроксид калия (230 мг) и иодид калия (520 мг) и образовавшуюся смесь перемешивали при 90 С в течение 1 ч. После охлаждения ее вливали в 1 М раствор НСl (20 мл) и экстрагировали дихлорметаном. Объединенные органические слои промывали водой до получения нейтральной среды и затем насыщенным раствором NaCl и сушили над Na2SO4. После выпаривания растворителей получали 6-(4-метокси-2-нитрофенокси)-2-фенилхроман растиранием в метаноле. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,58 (д, 1 Н, J 3,1 Гц), 7,45-7,33 (м, 6 Н), 7,28 (дд, 1 Н, J 9,2 Гц, 3,1 Гц) 7,10 (д, 1 Н, J 9,2 Гц), 6,86-6,78 (м, 3 Н), 5,10 (дд, 1 Н, J 10,0, 1,9 Гц), 3,83 (с, ЗН) 2,92 (ддд, 1 Н, J -16,9, 11,2,5,9 Гц), 2,75 (ддд, 1 Н, J -16,9, 7,9, 4,2 Гц), 2,15 (м, 1 Н), 1,97 (м, 1 Н).b) Гидрохлорид 5-метокси-2-(2-фенилхроман-6-илокси) фениламина 6-(4-Метокси-2-нитрофенокси)-2-фенилхроман (360 мг) растворяли в этилацетате и добавляли 10% палладий на угле (90 мг). Реакционную смесь гидрировали в течение 2 ч при нормальном давлении и комнатной температуре. Затем ее фильтровали через рыхлый слой целлита и промывали этилацетатом. Выделяли 5-метокси-2-(2-фенилхроман-6-илокси)фениламин в виде его хлористо-водородной соли. 1H-ЯМР (400 МГц, d6-ДМСО) : 7,44-7,33 (м, 5 Н), 6,83-6,72 (м, 4 Н), 6,68 (д, 1 Н, J 2,9 Гц), 6,48 (дд,1 Н, J 8,9, 2,8 Гц) 5,07 (дд, 1 Н, J 10,0, 2,2 Гц), 3,70 (с, 3 Н), 2,93 (ддд, 1 Н, J -17,0, 11,1, 6,1 Гц), 2,68 (ддд,1 Н, J -17,0, 8,3, 4,5 Гц), 2,15 (м, 1 Н), 1,97 (м, 1 Н). Пример 4. 2-(2-Фенилхроман-6-илокси)этиламинметансульфонат а) 6-(2-азидоэтокси)-2-фенилхроман 2-Фенилхроман-6-ол (340 мг), 1-бром-2-хлорэтан (1,25 мл) и карбонат цезия (997 мг) растворяли в ацетонитриле (4 мл). Реакционную смесь кипятили с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры ее вливали в 1 М раствор HCl и экстрагировали дихлорметаном. Объединенные дихлорметановые экстракты промывали водой и сушили над Na2SO4. Смесь пропускали через колонку с силикагелем с использованием в качестве элюента смеси этилацетат-гексан (1:7), в результате получали 190 мг производного галогенэтана. Его растворяли в ДМФА (5 мл) и добавляли азид натрия (214 мг). Реакционную смесь кипятили с обратным холодильником в течение 2 ч. Смесь фильтровали. К фильтрату добавляли этилацетат и затем его промывали один раз 1 М раствором HCl и затем несколько раз водой и сушили над Na2SO4. Растворители выпаривали при пониженном давлении с получением при этом 6-(2-азидоэтокси)-2-фенилхромана. 1b) 2-(2-Фенилхроман-6-илокси)этиламинметансульфонат В раствор 6-(2-азидоэтокси)-2-фенилхромана (155 мг) в тетрагидрофуране добавляли трифенилфосфин (165 мг) и 40 мкл воды. Образовавшуюся смесь перемешивали в течение 2 ч при комнатной температуре. Выделяли 2-(2-фенилхроман-6-илокси) этиламин в виде его метансульфонатной соли. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,91 (уш.с, 3H), 7,44-7,32 (м, 5 Н), 6,81-6,75 (м, 3H), 5,05 (дд, 1 Н, J 9,9, 2,3 Гц), 4,08 (т, 2 Н, J 5,1 Гц), 3,19 (м, 2 Н), 2,95 (ддд, 1 Н, J -16,8, 11,0, 5,9, Гц), 2,71 (ддд, 1 Н, J -16,8,5,2, 3,4 Гц), 2,30 (с, 3H), 2,15 (м, 1 Н), 1,97 (м, 1 Н). Пример 5. Гидрохлорид 2-(2-фенилхроман-6-илоксиметил)-4,5-дигидро-1 Н-имидазола а) (2-Фенилхроман-6-илокси)ацетонитрил В раствор 2-фенилхроман-6-ола (200 мг) в ацетонитриле (3 мл) добавляли карбонат цезия (310 мг) и хлорцетонитрил (62 мкл). Образовавшуюся смесь кипятили с обратным холодильником в течение 6 ч. Реакционной смеси давали возможность охлаждаться до комнатной температуры и добавляли 1 М раствор HCl и ее экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором NaCl и сушили над Na2SO4. Растворители выпаривали при пониженном давлении с получением (2-фенилхроман-6-илокси)ацетонитрила. 1-9 006580 В раствор (2-фенилхроман-6-илокси)ацетонитрила (270 мг) в диэтиловом эфире и 90 мкл абсолютного этанола при охлаждении на бане со льдом пропускали сухой HCl. Реакционную смесь выпаривали досуха после образования промежуточного имидата. Остаток растворяли в абсолютном этаноле и к охлажденному раствору добавляли 252 мкл этилендиамина. Реакционной смеси давали возможность нагреваться до комнатной температуры, выпаривали досуха, растворяли в дихлорметане и промывали водой. Объединенные органические слои сушили и обрабатывали углем. Выделяли 2-(2-фенилхроман-6 илоксиметил)-4,5-дигидро-1 Н-имидазол в виде его HCl соли. 1H-ЯМР (d4-МеОН): 7,5-7,2 (м, 5 Н), 6,85-6,75 (м, 3H), 5,01 (д, 1 Н, J 8,8 Гц), 4,97 (с, 2 Н), 4,00 (с, 4 Н),3,02-2,90 (м, 1 Н), 2,80-2,70 (м, 1 Н), 2,21-2,12 (м, 1 Н), 2,05-1,90 (м, 1 Н). (М+) = 308 (100%) Пример 6. 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-он 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-он получали с использованием 200 мг 6 гидроксифлаванона, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. 1H-ЯМР (400 МГц, d6-ДМСО) : 9,03 (уш.с, 1 Н), 8,64 (д, 1 Н, J 9,0 Гц), 7,59-7,41 (м, 7 Н), 7,31 (д, 1 Н,J 9,0 Гц), 7,23 (д, 1 Н, 8,8 Гц), 5,75 (дд, 1 Н, J 12,3, 2,9 Гц), 3,30 (дд, 1 Н, -16,3, 12,3 Гц), 2,87 (дд, 1 Н, -16,3,2,9 Гц). Пример 7. 7-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-он 7-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-он получали с использованием 150 мг 7 гидроксифлаванона, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман- 6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,07 (д, 1 Н, J 2,8 Гц), 8,67 (дд, 1 Н, J 9,0, 2,8 Гц), 7,89 (д, 1 Н, 8,6 Гц),7,60-7,35 (м, 6 Н), 7,04 (д, 1 Н, 2,1 Гц), 6,97 (дд, 1 Н, 8,6, 2,1 Гц), 5,75 (дд, 1 Н, J 13,0, 2,7 Гц), 3,32 (дд, 1 Н,16,9, 13,0 Гц), 2,85 (д, -16,9, 2,7 Гц). Пример 8. 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-ол а) 2-Фенилхроман-4,6-диол В суспензию 6-гидроксифлаванона (1,0 г) в сухом ТГФ (11,5 мл) добавляли по каплям в атмосфере азота раствор комплекса боран-ТГФ (12,5 мл, 1,0 в ТГФ). Реакционную смесь кипятили с обратным холодильником в течение 1 ч. После охлаждения до комнатной температуры ее вливали в смесь льда и раствора 2 М HCl. 2-Фенилхроман-4,6-диол фильтровали. 1(b) 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-ол 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-ол получали из 1,5 г 2-фенилхроман-4,6-диола,следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт пропускали через колонку с силикагелем с использованием в качестве элюента смеси толуолэтилацетат (4:1) и затем кристаллизовали из 2-пропанола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,7 Гц), 8,61 (дд, 1 Н, J 9,1, 2,7 Гц), 7,50-7,36 (м, 5 Н),7,25 (д, 1 Н, J 2,7 Гц), 7,22 (д, 1 Н, 9,1 Гц), 7,00 (дд, 1 Н, J 8,7, 2,7 Гц), 6,88 (д, 1 Н, J 8,7 Гц), 5,65 (д, 1 Н, J 6,3 Гц), 5,30 (дд, 1 Н, J 11,9, 1,3 Гц), 4,99 (м, 1 Н), 2,33 (м, 1 Н), 1,98 (м, 1 Н). Пример. 2-[2-(3-Фторфенил)хроман-6-илокси]-5-нитропиридинa) 2-(3-Фторфенил)-6-гидроксихроман-4-он 2',5'-Дигидроксиацетофенон (1,50 г) растворяли в теплой ледяной уксусной кислоте (26 мл) . Добавляли 3-фторбензальдегид (1,35 г) и ацетат аммония (0,98 г). Реакционную смесь кипятили с обратным холодильником в течение 2 ч. Ей давали охлаждаться до комнатной температуры и вливали на лед. Образовавшийся осадок фильтровали, в результате получали 2,2 г смеси 2-(3-фторфенил)-6-гидроксихроман 4-она и 1-(2,5-дигидроксифенил)-3-(3-фторфенил)пропенона. Полученную смесь растворяли в этаноле(90 мл) и добавляли ацетат натрия (1,75 г). Реакционную смесь кипятили с обратным холодильником в течение 5 ч. Затем ей давали возможность охлаждаться до комнатной температуры, разбавляли водой и фильтровали. 2-(3-Фторфенил)-6-гидроксихроман-4-он перекристаллизовывали из уксусной кислоты. 1b) 2-(3-Фторфенил)хроман-4,6-диол 2-(3-Фторфенил)хроман-4,6-диол получали из 220 мг 2-(3-фторфенил)-6-гидроксихроман-4-она,следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(3-Фторфенил)хроман-6-ол В раствор 2-(3-фторфенил)хроман-4,6-диола (195 мг) в дихлорметане (4 мл) медленно добавляли триэтилсилан (960 мкл). Затем в реакционную смесь добавляли по каплям трифторуксусную кислоту (1,9 мл) и ее перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь вливали в смесь воды со льдом и экстрагировали дихлорметаном. Остаток выпаривали при пониженном давлении с толуолом с получением при этом 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(3-Фторфенил)хроман-6-илокси]-5-нитропиридин 2- [2-(3-Фторфенил)хроман-6-илокси]-5-нитропиридин получали из 210 мг 2-(3-фторфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт перекристаллизовывали из 2-пропанола. 1 Н-ЯМР (400 МГц, CDCl3) : 9,07 (д, 1 Н, J 2,8 Гц), 8,46 (дд, 1 Н, J 9,0, 2,8 Гц), 7,36 (м, 1 Н), 7,21-7,15(м, 2 Н), 7,03 (м, 1 Н), 7,01 (д, 1 Н, J 9,0 Гц), 6,98 (д, 1 Н, J 8,6 Гц), 6,92 (дд, 1 Н, J 8,6, 2,7 Гц), 6,90 (д, 1 Н, J 2,7 Гц), 5,09 (дд, 1 Н, J 10,3, 2,4 Гц), 3,01 (ддд, 1 Н, J -16,9, 11,4, 6,0 Гц), 2,82 (ддд, 1 Н, J -16,9, 5,1, 3,2 Гц),2,24 (м, 1 Н), 2,09 (м, 1 Н). Пример 10. 5-Нитро-2-(2-фенилхроман-7-илокси)пиридин а) 2-Фенилхроман-7-ол 2-Фенилхроман-7-ол получали из 1,0 г 7-гидроксифлаванона, следуя методике примера 1(a), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (2:1). 1 Н-ЯМР (400 МГц, CD3OD) : 7,41-7,28 (м, 5 Н), 6,86 (д, 1 Н, J 8,2 Гц), 6,32 (дд, 1 Н, J 8,2, 2,4 Гц), 6,29b) 5-Нитро-2-(2-фенилхроман-7-илокси)пиридин 5-Нитро-2-(2-фенилхроман-7-илокси)пиридин получали из 115 мг 2-фенилхроман-7-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт очищали препаративной ТСХ (TLC) на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси толуол-этилацетат (15:1). 1a) 2-(2,4-Дихлорфенил)-6-гидроксихроман-4-он 2-(2,4-Дихлорфенил)-6-гидроксихроман-4-он получали из 1,0 г 2',5'-дигидроксиацетофенона и 1,4 г 2,4-дихлорбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,49 (с, 1 Н), 7,78 (д, 1 Н, J 8,5 Гц), 7,71 (д, 1 Н, J 2,0 Гц), 7,57 (дд, 1 Н,J 8,5, 2,0 Гц), 7,14 (д, 1 Н, J 3,0 Гц), 7,06 (дд, 1 Н, J 8,8, 3,0 Гц), 6,97 (д, 1 Н, J 8,8 Гц), 5,77 (дд, 1 Н, J 13,5, 2,7 Гц), 3,18 (дд, 1 Н, J -16,9, 13,5 Гц), 2,78 (дд, 1 Н, J -16,9, 2,7 Гц).b) 2-(2,4-Дихлорфенил)хроман-4,6-диол 2-(2,4-Дихлорфенил)хроман-4,6-диол получали из 1,2 г 2-(2,4-дихлорфенил)-6-гидроксихроман-4 она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (2:1). 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,89 (с, 1 Н), 7,66 (д, 1 Н, J 2,1 Гц), 7,64 (д, 1 Н, J 8,5 Гц), 7,51 (дд, 1 Н,J 2,1, 8,5 Гц), 6,89 (д, 1 Н, J 2,7 Гц), 6,63 (д, 1 Н, J 8,7 Гц), 6,56 (дд, 1 Н, J 2,7, 8,7 Гц), 5,50 (д, 1 Н, J 6,8 Гц),5,37 (д, 1 Н, J 10,4 Гц), 4,90 (м, 1 Н), 2,32 (м, 1 Н), 1,80 (м, 1 Н).c) 2-(2,4-Дихлорфенил)хроман-6-ол 2-(2,4-Дихлорфенил)хроман-6-ол получали из 625 мг 2-(2,4-дихлорфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,85 (с, 1 Н), 7,65 (д, 1 Н, J 2,2 Гц), 7,57 (д, 1 Н, J 8,4 Гц), 7,49 (дд, 1 Н,J 8,4, 2,2 Гц), 6,67-6,51 (м, 3H), 5,21 (дд, 1 Н, J 10,3, 2,1 Гц), 2,91 (м, 1 Н), 2,69 (м, 1 Н), 2,16 (м, 1 Н), 1,85(м,1 Н).d) 2-[2-(2,4-Дихлорфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2,4-Дихлорфенил)хроман-6-илокси]-5-нитропиридин получали из 530 мг 2-(2,4 дихлорфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. Продукт очищали препаративной ТСХ на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси гептан-этилацетат (3:1). 1 Н-ЯМР (400 МГц, CDCl3) : 9,06 (д, 1 Н, J 2,7 Гц), 8,47 (дд, 1 Н, J 9,0, 2,7 Гц), 7,56 (д, 1 Н, J 8,4 Гц),7,41 (д, 1 Н, J 2,0 Гц), 7,33 (дд, 1 Н, J 8,4, 2,0 Гц), 7,02 (д, 1 Н, J 9,0 Гц), 6,99-6,92 (м, 3H), 5,39 (дд, 1 Н, J- 11006580 10,4, 2,2 Гц), 3,06 (ддд, 1 Н, J -16,9, 11,9, 6,0 Гц), 2,83 (ддд, 1 Н, J -16,9, 5,3, 2,7 Гц), 2,34 (м, 1 Н), 1,89 (м,1 Н). Пример 12. 2-[2-(3-Хлорфенил)хроман-6-илокси]-5-нитропиридин а) 2-(3-Хлорфенил)-6-гидроксихроман-4-он 2-(3-Хлорфенил)-6-гидроксихроман-4-он получали из 2,0 г 2',5'-дигидроксиацетофенона и 1,85 г 3 хлорбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,47 (с, 1 Н), 7,62 (с, 1 Н), 7,51-7,45 (м, 3H), 7,12 (д, 1 Н, J 3,0 Гц),7,05 (дд, 1 Н, J 8,8, 3,0 Гц), 6,98 (д, 1 Н, J 8,8 Гц), 5,58 (дд, 1 Н, J 13,1, 2,9 Гц), 3,18 (дд, 1 Н, J -16,9, 13,1 Гц),2,81 (дд, 1 Н, J -16,9, 2,9 Гц).b) 2-(3-Хлорфенил)хроман-4,6-диол 2-(3-Хлорфенил)хроман-4,6-диол получали из 730 мг 2-(3-хлорфенил)-6-гидроксихроман-4-она,следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(3-Хлорфенил)хроман-6-ол 2-(3-Хлорфенил)хроман-6-ол получали из 635 мг 2-(3-хлорфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 8,79 (с, 1 Н), 7,48 (д, 1 Н, J 0,7 Гц), 7,42-7,37 (м, 3H), 6,71-6,49 (м,3H), 5,04 (м, 1 Н), 2,91 (м, 1 Н), 2,65 (м, 1 Н), 2,12 (м, 1 Н), 1,93 (м, 1 Н).d) 2-[2-(3-Хлорфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(3-Хлорфенил)хроман-6-илокси]-5-нитропиридин получали из 590 мг 2-(3-хлорфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт перекристаллизовывали из смеси 2-пропанола и этилацетата (3:1). 1 Н-ЯМР (400 МГц, CDCl3) : 9,04 (д, 1 Н, J 2,9 Гц), 8,60 (дд, 1 Н, J 9,0, 2,9 Гц), 7,53 (с, 1 Н), 7,46-7,42(дд, 1 Н, J 10,2, 2,2 Гц), 2,97 (ддд, 1 Н, J -17,0, 11,5, 5,9 Гц), 2,83 (ддд, 1 Н, J -17,0, 8,1, 4,5 Гц), 2,21 (м, 1 Н),2,00 (м, 1 Н). Пример 13. 2-[2-(3,5-Дифторфенил)хроман-6-илокси]-5-нитропиридин а) 2-(3,5-Дифторфенил)-6-гидроксихроман-4-он 2-(3,5-Дифторфенил)-6-гидроксихроман-4-он получали из 1,0 г 2',5'-дигидроксиацетофенона и 1,12 г 3,5-дифторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,47 (с, 1 Н), 7,30-7,23 (м, 3H), 7,12 (д, 1 Н, J 2,9 Гц), 7,06 (дд, 1 Н, J 8,8, 2,9 Гц), 7,00 (д, 1 Н, J 8,8 Гц), 5,60 (дд, 1 Н, J 13,1, 2,8 Гц), 3,15 (дд, 1 Н, J-16,8, 13,1 Гц), 2,85 (дд, 1 Н, J 16,8, 2,8 Гц).b) 2-(3,5-Дифторфенил)хроман-4,6-диол 2-(3,5-Дифторфенил)хроман-4,6-диол получали из 800 мг 2-(3,5-дифторфенил)-6-гидроксихроман 4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(3,5-Дифторфенил)хроман-6-ол 2-(3,5-Дифторфенил)хроман-6-ол получали из 500 мг 2-(3,5-дифторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(3,5-Дифторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(3,5-Дифторфенил)хроман-6-илокси]-5-нитропиридин получали из 340 мг 2-(3,5 дифторфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. Продукт очищали препаративной ТСХ на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси толуол-этилацетат и затем выкристаллизовывали из 2-пропанола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,60 (дд, 1 Н, J 9,1, 2,9 Гц), 7,23-7,19 (м, 4 Н),7,01-6,95 (м, 3H), 5,18 (дд, 1 Н, J 10,0, 2,1 Гц), 2,97 (ддд, 1 Н, J -16,9, 10,9, 5,7 Гц), 2,76 (ддд, 1 Н, J -16,9, 8,4,4,7 Гц), 2,22 (м, 1 Н), 1,99 (м, 1 Н).a) 2-(2,5-Дифторфенил)-6-гидроксихроман-4-он 2-(2,5-Дифторфенил)-6-гидроксихроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,57 мл 2,5-дифторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)6-гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 9,46 (с, 1 Н) , 7,53 (м, 1 Н) , 7,36-7,30 (м, 2 Н), 7,14 (д, 1 Н, J 3,0 Гц),7,05 (дд, 1 Н, J 8,8, 3,0 Гц), 6,97 (д, 1 Н, J 8,8 Гц), 5,76 (дд, 1 Н, J 13,6, 2,7 Гц), 3,26 (дд, 1 Н, J -16,8, 13,6 Гц),2,76 (дд, 1 Н, J -16,8, 2,7 Гц).b) 2-(2,5-Дифторфенил)хроман-4,6-диол 2-(2,5-Дифторфенил)хроман-4,6-диол получали из 1,0 г 2-(2,5-дифторфенил)-6-гидроксихроман-4 она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(2,5-Дифторфенил)хроман-6-ол 2-(2,5-Дифторфенил)хроман-6-ол получали из 420 мг 2-(2,5-дифторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(2,5-Дифторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2,5-Дифторфенил)хроман-6-илокси]-5-нитропиридин получали из 100 мг 2-(2,5 дифторфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из 2-пропанола. 1a) 2-(3-Бромфенил)-6-гидроксихроман-4-он 2-(3-Бромфенил)-6-гидроксихроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,3 мл 3 бромбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 9,41 (с, 1 Н), 7,50 (м, 1 Н), 7,59-7,53 (м, 2 Н), 7,39 (м, 1 Н), 7,12 (д, 1 Н,J 2,9 Гц), 7,05 (дд, 1 Н, J 8,8, 2,9 Гц), 6,98 (д, 1 Н, J 8,8 Гц), 5,57 (дд, 1 Н, J 13,0, 2,9 Гц), 3,12 (дд, 1 Н, J -16,9,13,0 Гц), 2,81 (дд, 1 Н, J -16,9, 2,9 Гц).b) 2-(3-Бромфенил)хроман-4,6-диол 2-(3-Бромфенил)хроман-4,6-диол получали из 1,0 г 2-(3-бромфенил)-6-гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 8,83 (с, 1 Н), 7,63 (м, 1 Н), 7,53 (м, 1 Н), 7,46 (м, 1 Н), 7,37 (м, 1 Н),6,88 (д, 1 Н, J 2,9 Гц), 6,62 (д, 1 Н, J 8,7 Гц), 6,55 (дд, 1 Н, J 8,7, 2,9 Гц), 5,42 (д, 1 Н, J 7,0 Гц), 5,14 (д, 1 Н, J 10,5 Гц), 4,86 (м, 1 Н), 2,29 (м, 1 Н), 1,84 (м, 1 Н).c) 2-(3-Бромфенил)хроман-6-ол 2-(3-Бромфенил)хроман-6-ол получали из 700 мг 2-(3-бромфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(3-Бромфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(3-Бромфенил)хроман-6-илокси]-5-нитропиридин получали из 339 мг 2-(3-бромфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт фильтровали через силикагель с использованием в качестве элюента смеси толуол-этилацетат и затем кристаллизовали из 2-пропанола. 1a) 2-(4-Этилфенил)-6-гидроксихроман-4-он 2-(4-Этилфенил)-6-гидроксихроман-4-он получали из 1,0 г 2',5'-дигидроксиацетофенона и 0,8 мл 4 этилбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1b) 2-(4-Этилфенил)хроман-4,6-диол 2-(4-Этилфенил)хроман-4,6-диол получали из 474 мг 2-(4-этилфенил)-6-гидроксихроман-4-она, следуя методике, описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(4-Этилфенил)хроман-6-ол 2-(4-Этилфенил)хроман-6-ол получали из 425 мг 2-(4-этилфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. Продукт очищали с использованием в качестве элюента смеси гептан-этилацетат (3:1). 1 Н-ЯМР (400 МГц, CD3OD) : 7,26 (д, 2 Н, J 8,2 Гц) 7,13 (д, 2 Н, J 8,2 Гц), 6,65 (д, 1 Н, J 8,6 Гц), 6,55d) 2-[2-(4-Этилфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(4-Этилфенил)хроман-6-илокси]-5-нитропиридин получали из 205 мг 2-(4-этилфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт перекристаллизовывали из смеси 2-пропанола и ацетона. 1 Н-ЯМР (400 МГц, CDCl3) : 9,04 (д, 1 Н, J 2,8 Гц), 8,60 (дд, 1 Н, J 9,1, 2,8 Гц), 7,36 (д, 2 Н, J 8,1 Гц) 7,24 (д, 2 Н, J 8,1 Гц), 7,20 (д, 1 Н, J 9,1 Гц), 7,00 (д, 1 Н, J 2,7 Гц), 6,96 (дд, 1 Н, J 8,8, 2,7 Гц), 6,89 (д, 1 Н, J 2,7 Гц), 5,11 (дд, 1 Н, J 10,1, 2,2 Гц), 2,98 (м, 1 Н), 2,75 (м, 1 Н), 2,62 (кв, 2 Н, J 7,5 Гц), 2,16 (м, 1 Н), 2,01 (м,1 Н) , 1,19 (т, 3H, J 7,5 Гц). Пример 17. 2-(3-Метил-2-фенилхроман-6-илокси)-5-нитропиридин а) 6-Гидрокси-3-метил-2-фенилхроман-4-он 6-Гидрокси-3-метил-2-фенилхроман-4-он получали из 2,0 г 2,5-дигидроксипропиофенона и 1,63 мл бензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (3:1). 1b) 3-Метил-2-фенилхроман-4,6-диол 3-Метил-2-фенилхроман-4,6-диол получали из 474 мг 6-гидрокси-3-метил-2-фенилхроман-4-она,следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 8,79 (с, 1 Н), 7,42-7,33 (м, 5 Н), 6,88 (уш.с, 1 Н,), 6,53 (м, 2 Н), 5,37 (д,1 Н, J 8,0 Гц), 4,70 (д, 1 Н, J 10,6 Гц), 1,94 (м, 1 Н), 0,73 (д, 3H, J 6,7 Гц).c) 3-Метил-2-фенилхроман-6-ол 3-Метил-2-фенилхроман-6-ол получали из 605 мг 3-метил-2-фенилхроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-(3-Метил-2-фенилхроман-6-илокси)-5-нитропиридин 2-(3-Метил-2-фенилхроман-6-илокси)-5-нитропиридин получали из 600 мг 3-метил-2-фенилхроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-2-пропанол (20:1) . 1H-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,8 Гц), 8,59 (дд, 1 Н, J 9,1, 2,8 Гц), 7,43-7,36 (м, 5 Н),7,19 (д, 1 Н, J 9,1 Гц), 7,00 (д, 1 Н, J 2,6 Гц), 6,95 (дд, 1 Н, J 8,7, 2,6 Гц), 6,86 (д, 1 Н, J 8,7 Гц), 4,73 (д, 1 Н, J 9,3, Гц), 2,85 (дд, 1 Н, J -16,7, 5,0 Гц), 2,64 (дд, 1 Н, J -16,5, 10,9 Гц), 2,18 (м, 1 Н), 0,77 (д, 3H, J 6,7 Гц). Пример 18. 3-Метил-6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-он 3-Метил-6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-он получали из 200 мг 6-гидрокси-3 метил-2-фенилхроман-4-она, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (2:1) и затем кристаллизовали из смеси 2-пропанола и ацетона. 1- 14006580 2-(2-Фторфенил)-6-гидроксихроман-4-он получали из 2,0 г 2',5'-дигидроксиацетофенона и 1,4 мл 2 фторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,45 (с, 1 Н), 7,67 (м, 1 Н), 7,47 (м, 1 Н), 7,32-7,25 (м, 2 Н), 7,14 (д, 1 Н,J 3,0 Гц), 7,04 (дд, 1 Н, J 8,9, 3,0 Гц), 6,95 (д, 1 Н, J 8,9 Гц), 5,77 (дд, 1 Н, J 13,5, 2,8 Гц), 3,26 (дд, 1 Н, J -16,9,13,5 Гц), 2,76 (дд, 1 Н, J -16,9, 2,8 Гц).b) 2-(2-Фторфенил)хроман-4,6-диол 2-(2-Фторфенил)хроман-4,6-диол получали из 1,19 г 2-(2-фторфенил)-6-гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,85 (с, 1 Н), 7,56 (м, 1 Н), 7,40 (м, 1 Н), 7,28-7,21 (м, 2 Н), 6,89 (д, 1 Н,J 2,9 Гц), 6,60 (д, 1 Н, J 8,7 Гц), 6,54 (дд, 1 Н, J 8,7, 2,8 Гц), 5,46 (д, 1 Н, J 6,9 Гц), 5,35 (д, 1 Н, J 10,6 Гц), 4,89c) 2-(2-Фторфенил)хроман-6-ол 2-(2-Фторфенил)хроман-6-ол получали из 800 мг 2-(2-фторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 7,50 (м, 1 Н), 7,39 (м, 1 Н), 7,26-7,19 (м, 2 Н), 6,63 (м, 1 Н), 6,53-6,50d) 2-[2-(2-Фторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2-Фторфенил)хроман-6-илокси]-5-нитропиридин получали из 390 мг 2-(2-фторфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (4:1). 1a) 1-[2,5-Бис (бензилокси)фенил]этанон Смесь 1-(2,5-дигидроксифенил)этанона (3,16 г), бензилхлорида (7,04 г), карбоната калия (12,4 г) и 18-краун-6 (30 мг) в 2-бутаноне (50 мл) кипятили с обратным холодильником в течение 5 ч. После охлаждения отфильтровывали осадок. Фильтрат выпаривали досуха при пониженном давлении и к нему добавляли простой эфир (50 мл). Раствор промывали дважды разбавленным раствором гидроксида натрия,дважды разбавленной хлористо-водородной кислотой, сушили над сульфатом натрия и выпаривали по существу досуха при пониженном давлении. Остаток растирали в холодном н-гептане (30 мл) и осадок отфильтровывали фильтрацией под разрежением с получением после сушки 2,85 г 1-[2,5 бис(бензилокси)фенил]этанона. 1 Н-ЯМР (400 МГц, ДМСО-d6)= 2,50 (с, 3H), 5,08 (с, 2 Н), 5,18 (с, 2 Н), 7,20-7,50 (м, 13 Н).b) 2,5-бис(бензилокси)фениловый эфир уксусной кислоты Раствор 1-[2,5-бис(бензилокси)фенил]этанона (2,25 г) и 40% перуксусной кислоты (1,63 мл) в уксусной кислоте (5,4 мл) перемешивали при 60 С в течение 1 ч. После охлаждения до комнатной температуры осажденный продукт собирали фильтрацией, промывали холодным простым эфиром и сушили при пониженном давлении. 2,5-Бис(бензилокси)фениловый эфир уксусной кислоты перекристаллизовывали из 2-пропанола. Выход составлял 1,87 г. 1 Н-ЯМР (ДМСО-d6)= 2,23 (с, 1 Н), 5,03 (с, 2 Н), 5,05 (с, 2 Н), 6,84-7,44 (м, 13 Н).c) 2,5-Бис(бензилокси)фенол Раствор 2,5-бис(бензилокси)фенилового эфира уксусной кислоты (1,85 г) и 5 М раствора гидроксида натрия (10,6 мл) в этаноле (11 мл) кипятили с обратным холодильником в течение 6,5 ч. После выпаривания этанола при пониженном давлении прозрачный раствор подкисляли разбавленной хлористоводородной кислотой. Осажденный продукт собирали фильтрацией, промывали холодной водой и сушили при пониженном давлении. Выход составлял 0,56 г. 1 Н-ЯМР (ДМСО-d6)= 4,97 (с, 2 Н), 5,01 (с, 2 Н), 6,34 (дд, J=3,l, 8,8 Гц, 1 Н), 6,49 (д, J=3,l Гц, 1 Н),6,85 (д, J=8,8 Гц, 1 Н), 7,28-7,46 (м, 10H), 9,1 (уш.с, 1 Н).(0,25 г) и 18-краун-6 (3 мг) в ацетонитриле (4,2 мл) перемешивали при 22 С в течение одной недели. Смесь фильтровали и выпаривали досуха при пониженном давлении. Остаток растирали в смеси простого эфира (8,2 мл) и воды (1,4 мл) при температуре бани со льдом. Продукт собирали фильтрацией, промывали холодным простым эфиром и сушили при пониженном давлении. Выход составлял 0,14 г. 1 Н-ЯМР (ДМСО-d6)= 4,98 (с, 2 Н), 5,06 (с, 2 Н), 5,58 (с, 2 Н), 6,51 (дд, J=8,9, 2,3 Гц, 1 Н), 6,68 (д,J=2,3 Гц, 1 Н), 6,94 (д, J=8,9 Гц, 1 Н), 7,28-8,03 (м, 15 Н).e) 2-[2,5-Бис(бензилокси)фенокси]-1-фенилэтанол К раствору 2-[2,5-бис(бензилокси)фенокси]-1-фенилэтанона (0,14 г) в метаноле (0,5 мл) и тетрагидрофуране (1,9 мл) добавляли при 0 С боргидрид натрия (6,5 мл). Реакционную смесь перемешивали 15 мин при 0 С и в течение 2 ч при 22 С. После добавления воды (5 мл) выпаривали метанол и тетрагидрофуран. После перемешивания остатка при 22 С в течение 0,5 ч продукт фильтровали, промывали холодной водой и сушили при пониженном давлении. Выход составлял 0,09 г. 1f) 2-(2-Гидрокси-2-фенилэтокси)бензол-1,4-диол Раствор 2-[2,5-бис(бензилокси)фенокси]-1-фенилэтанола (3,9 г) в этаноле (175 мл) гидрировали в присутствии 10% палладия на угле (100 мг) при давлении 30 фунт/дюйм 2. Катализатор удаляли фильтрацией и при пониженном давлении выпаривали растворитель. Остаток перекристаллизовывали из смеси толуол-этилацетат, 8:1 (15 мл). Выход 2-(2-гидрокси-2-фенилэтокси)бензол-1,4-диола составлял 1,2 г. 1g) 2,3-Дигидро-2-фенилбензо[1,4]диоксин-6-ол Раствор 2-(2-гидрокси-2-фенилэтокси)бензол-1,4-диола (1,2 г) в толуоле (75 мл) кипятили с обратным холодильником в течение 7 ч в присутствии катализатора Amberlyst 15 (0,5 г). После фильтрации выпаривали растворитель при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (толуол/этилацетат/уксусная кислота=8:1:1). Выход 2,3-дигидро-2-фенилбензо[1,4]диоксин-6 ола составлял 0,5 г. 1h) 2-(2,3-Дигидро-2-фенилбензо[1,4]диоксин-6-илокси)-5-нитропиридин Раствор 2,3-дигидро-2-фенилбензо[1,4]диоксин-6-ола (80 мг), 2-хлор-5-нитропиридина (56 мг) и карбоната калия (52 мг) в диметилформамиде (1,0 мл) перемешивали при 120 С в течение 2 ч. После охлаждения смеси добавляли воду (10 мл) и осажденный продукт фильтровали, промывали водой и 2 пропанолом и сушили при пониженном давлении. Выход составлял 60 мг и т. пл. 163-170 С. 1 Н-ЯМР (ДМСО-d6)= 4,16 (дд, J=8,5, 11,6 Гц, 1 Н), 4,47 (дд, J=11,6, 2,6 Гц, 1 Н), 5,28 (дд, J=2,6, 8,5 Гц, 1 Н), 6,75 (дд, J=2,6, 8,8 Гц, 1 Н), 6,88 (д, J=2,6 Гц, 1 Н), 7,05 (д, J=8,8 Гц, 1 Н), 7,21 (д, J=9,l Гц, 1 Н),7,39-7,52 (м, 5 Н), 8,60 (дд, J=2,8, 9,1 Гц, 1 Н), 9,05 (д, J=2,8 Гц, 1 Н). Пример 21. 2-(2,3-Дигидро-2-фенилбензо[1,4]диоксин-6-илокси)-3-нитропиридин 2-(2,3-Дигидро-2-фенилбензо[1,4]диоксин-6-илокси)-3-нитропиридин получали из 2,3-дигидро-2 фенилбензо[1,4]диоксин-6-ола (80 мг) и 2-хлор-3-нитропиридина (56 мг) таким же способом, как и указанный выше 2-(2,3-дигидро-2-фенилбензо[1,4]диоксин-6-илокси)-5-нитропиридин. Выход составлял 30 мг и т.пл. 60 С. 1 Н-ЯМР (ДМСО-d6)= 4,16 (дд, J=8,6, 11,4 Гц, 1 Н), 4,46 (дд, J=11,4, 2,5 Гц, 1 Н), 5,27 (дд, J=2,5, 8,6 Гц, 1 Н), 6,73 (дд, J=2,5, 8,6 Гц, 1 Н), 6,85 (д, J=2,5 Гц, 1 Н), 7,03 (д, J=8,6 Гц, 1 Н), 7,34-7,52 (м, 6 Н), 8,43a) 6-Метокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-он Смесь ацетата палладия (II) (0,57 г), рацемического 2,2'-бис(дифенилфосфино)-1,1'-бинафтила (1,91 г) и трет-бутоксида калия (4,15 г) в сухом толуоле перемешивали в атмосфере аргона в течение 10 мин. Добавляли бромбензол (5,34 г) и 6-метокси-1-тетралон (3,0 г), сольватированный в сухом толуоле, и смесь перемешивали при 100 С в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, вливали в насыщенный водный раствор хлорида аммония и экстрагировали этиловым эфиром. Органический экстракт промывали насыщенным раствором соли, сушили и выпаривали. Неочищенный продукт очищали флэш-хроматографией на силикагеле с использованием в качестве элюента толуола и смеси толуол-этилацетат (9:1). 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,87 (д, 1 Н, J 7,8 Гц), 7,16-7,33 (м, 5 Н), 6,91-6,94 (м, 2 Н), 3,85 (с,3H), 3,82-3,88 (м, 1 Н), 3,06-3,14 (м, 1 Н), 2,92-2,98 (м, 1 Н), 2,23-2,38 (м, 2 Н).b) 6-Гидрокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-он 6-Метокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-он (1,0 г) с 47% HBr (20 мл) кипятили с обратным холодильником до исчезновения исходных продуктов. Смесь вливали в воду и экстрагировали этилацетатом. Этилацетат сушили и выпаривали. Продукт перекристаллизовывали из толуола. 1c) 6-Фенил-5,6,7,8-тетрагидронафталин-2-ол К раствору 6-гидрокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-она (50 мг) в трифторуксусной кислоте добавляли триэтиламин (8 мг). Смесь нагревали при 60 С в течение 3 ч. Выпаривали растворитель, к остатку добавляли воду и смесь экстрагировали этилацетатом. Органические экстракты сушили и выпаривали. 1(23 мг) в сухом диметилформамиде нагревали при 120 С до исчезновения исходных продуктов. Добавляли воду и 1 н. HCl и смесь экстрагировали этилацетатом. Этилацетат промывали насыщенным раствором соли и водой, сушили и выпаривали. Продукт перекристаллизовывали из толуола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,4 Гц), 8,61 (дд, 1 Н, J 9,0, 2,5), 7,18-7,35 (м, 7 Н), 6,956,99 (м, 2 Н), 2,83-3,01 (м, 5 Н), 1,87-2,04 (м, 2 Н). Пример 24. 6-(5-Нитропиридин-2-илокси)-2-фенил-3,4-дигидро-2 Н-нафталин-1-он 6-(5-Нитропиридин-2-илокси)-2-фенил-3,4-дигидро-2 Н-нафталин-1-он получали с использованием 50 мг 6-гидрокси-2-фенил-3,4-дигидро-2 Н-нафталин-1-она, 33 мг 2-хлор-5-нитропиридина и 37 мг фторида калия, следуя методике примера 23(d), описанной для получения 5-нитро-2-(6-фенил-5,6,7,8 тетрагидронафталин-2-илокси)пиридина. 1(д, 1 Н, J 9,1 Гц), 7,21-7,38 (м, 7 Н), 3,96-4,04 (м, 1 Н), 3,15-3,23 (м, 1 Н), 2,98-3,04 (м, 1 Н), 2,39-2,48 (м, 1 Н),2,25-2,31 (м, 1 Н). Пример 25. 3-N-Ацетиламино-4-(2-фенилхроман-6-илокси)анизол 3-Амино-4-(2-фенилхроман-6-илокси)анизол примера 3 (0,174 г) растворяли в 2 мл сухого пиридина в атмосфере азота. Добавляли уксусный ангидрид (0,15 мл) и 10 мол.% 4-(N,N-диметиламино)пиридина(DMAP) и реакционный раствор перемешивали в течение 2,5 ч при комнатной температуре и гасили добавлением 1 мл H2O. В реакционную смесь добавляли толуол и выпаривали досуха. Выпаривание толуола повторяли. Продукт очищали колоночной хроматографией (СН 2 Сl2 : EtOAc/ 98:2). 1 Н-ЯМР (400 МГц; d6-ДМСО):9,38 (с, 1 Н), 7,68 (с, 1 Н), 7,47-7,25 (м, 5 Н), 6,85-6,66 (м, 4 Н), 6,63(дд, 1 Н, J=8,8 Гц, J=3,0 Гц), 5,07 (дд, 1 Н, J=9,9 Гц, J=l,9 Гц), 3,71 (с, 3H), 3,0-2,85 (м, 1 Н), 2,75-2,62 (с,1 Н), 2,20-2,10 (м, 1 Н), 2,05 (с, 3H), 2,08-1,90 (м, 1 Н). Пример 26. 5-Амино-2-(2-фенилхроман-6-илокси)пиридин 5-Нитро-2-(2-фенилхроман-6-илокси)пиридин примера 1 (2,26 г) растворяли в 350 мл ледяной уксусной кислоты. Вследствие экзотермической реакции несколькими порциями добавляли цинковый порошок (8,48 г). Смесь перемешивали при комнатной температуре в течение 2 ч и фильтровали. Цинк промывали ледяной уксусной кислотой. Кислоту выпаривали, добавляли толуол и выпаривали опять. Полученную смесь растворяли в СН 2 Сl2 и промывали 1 М NaOH. Затем водную фазу промывали СН 2 Сl2. Обе органические фракции объединяли и сушили над Na2SO4. Продукт очищали колоночной хроматографией. 1H-ЯМР (400 МГц; d6-ДМСО):7,52 (д, 1 Н, J=2,8 Гц), 7,46-7,30 (м, 5 Н), 7,05 (дд, 1 Н, J=8,6 Гц, J=3,0 Гц), 6,82-6,72 (м, 3H), 6,69 (д, 1 Н, J=8,6 Гц), 5,08 (дд, 1 Н, J=10,0 Гц; 7=2,1 Гц), 5,00 (с, 2 Н), 3,00-2,87 (м,1 Н), 2,74-2,64 (м, 1 Н), 2,19-2,10 (м, 1 Н), 2,05-1,91 (м, 1 Н). Пример 27. 5-N-Ацетиламино-2-(2-фенилхроман-6-илокси)пиридин 5-Амино-2-(2-фенилхроман-6-илокси)пиридин примера 26 (0,955 г) растворяли в 8 мл сухого пиридина в атмосфере азота. Добавляли DMAP (0,038 г). Вследствие протекания сильноэкзотермической реакции, в реакционный раствор при комнатной температуре добавляли по каплям АсСl (0,26 мл). Реакционную смесь перемешивали в течение 90 мин при комнатной температуре и гасили медленным добавлением 1 мл Н 2 О. Добавляли 50 мл толуола и выпаривали досуха. Выпаривание толуола повторяли дважды. Полученную коричневатую смесь очищали колоночной хроматографией (EtOAc:CH2Cl2/60:40) с получением кристаллического, чуть желтоватого продукта. Затем продукт очищали перекристаллизацией из смеси МеОН: Н 2 О (71:29). Осадок фильтровали и промывали 2x10 мл охлажденной льдом смесью МеОН: Н 2O (1:1). 1J=2,2 Гц), 3,02-2,90 (м, 1 Н), 2,71 (ддд, 1 Н, J=16,8 Гц, J=5,l Гц, J=l,8 Гц), 2,22-2,11 (м, 1 Н), 2,08-1,92 (м,1 Н). Пример 28. 5-N,N-Диацетиламино-2-(2-фенилхроман-6-илокси)пиридин 5-Амино-2-(2-фенилхроман-6-илокси)пиридин примера 26 (0,40 г) растворяли в 1,5 мл сухого пиридина в атмосфере азота. Добавляли DMAP (10 мол.%) и Ас 2O (1,0 мл) и раствор перемешивали при комнатной температуре в течение 2,5 ч. Добавляли толуол и выпаривали досуха. Выпаривание толуола повторяли дважды. Продукт очищали колоночной хроматографией (EtOAc:CH2Cl2/60:40). 1(0,166 г) и КОН (0,074 г) и раствор перемешивали при комнатной температуре в течение 15 мин. Добавляли 2-хлор-1-нитробензол (0,104 г) и раствор перемешивали при +90 С в течение 2,5 ч. Охлажденный раствор переносили в СН 2 Сl2 и промывали Н 2O и 2 М NaOH. Фазы разделяли и водную фазу промывали СН 2 Сl2. Все органические фазы объединяли и промывали 1 М HCl и затем Н 2O (до рН 7) и насыщенным раствором соли. Раствор сушили над Na2SO4 и очищали фильтрацией в небольшой колонке с силикагелем с использованием в качестве элюента смеси СН 2 Сl2:н-гептан (60:40). 1b) 2-(2-Фенилхроман-6-илокси)анилин 2-Нитро-1-(2-фенилхроман-6-илокси)бензол (0,160 г) как обычно растворяли в 30 мл ледяной уксусной кислоты. Добавляли цинковый порошок (1,190 г) несколькими порциями и смесь перемешивали в течение 90 мин при комнатной температуре. Отфильтровывали цинк и смесь промывали ледяной уксусной кислотой и выпаривали. Остаток от выпаривания переносили в толуол и выпаривали опять. Остаток растворяли в СН 2 Сl2 и промывали 1 М NaOH. Затем раствор NaOH промывали СН 2 Сl2. Обе органические фракции объединяли и сушили над Na2SO4. Очистку сырого продукта осуществляли элюированием в небольшой колонке с силикагелем с использованием в качестве элюента СН 2 Сl2. 1 Н-ЯМР (400 МГц; d6-ДМСО):7,45-7,28 (м, 5 Н), 6,89-6,83 (м, 1 Н), 6,80 (д, 1 Н, J=8,5 Гц), 6,77 (дд,1 Н, J=8,0 Гц; J=l,7 Гц), 6,73-6,67 (м, 3H), 6,54-6,48 (м, 1 Н), 5,06 (дд, 1 Н, J=10,l Гц; J=2,3 Гц), 4,85 (с, 2 Н),2,99-2,87 (м, 1 Н), 2,73-2,61 (м, 1 Н), 2,19-2,09 (м, 1 Н), 2,03-1,90 (м, 1 Н). Пример 30. 5-Трифторметил-2-(2-фенилхроман-6-илокси)анилин а) 2-Нитро-1-(2-фенилхроман-6-илокси)-4-трифторметилбензол 2-Нитро-1-(2-фенилхроман-6-илокси)-4-трифторметилбензол получали, следуя методике примера 29(a), описанной для получения 2-нитро-1-(2-фенилхроман-6-илокси)бензола, за исключением того, что 6-гидроксифлаван (0,339 г) использовали в 7 мл сухого ДМСО в атмосфере азота. Подобным образом добавляли также KI (0,374 г) и КОН (0,168 г) и 4-хлор-3-нитро-1-трифторметилбензол (0,24 мл). Продукт очищали колоночной хроматографией (СН 2Cl2:н-гептан/60:40). 1(1,48 г) в 25 мл ледяной уксусной кислоты, следуя методике примера 29, описанной для получения 2-(2 фенилхроман-6-илокси)анилина. Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь СН 2 Сl2:н-гептан/70:30). 1H-ЯМР (300 МГц; d6-ДМСО):7,48-7,28 (м, 5 Н), 7,06 (д, 1 Н, J=2,2 Гц), 6,86 (дд, 1 Н, J=7,8 Гц, J=l,5 Гц), 6,85-6,56 (м, 3H), 6,72 (д, 1 Н, J=8,4 Гц), 5,40 (с, 2 Н), 5,10 (дд, 1 Н, J=10,0 Гц; J=2,3 Гц), 3,04-2,87 (м,1 Н), 2,78-2,65 (м, 1 Н), 2,24-2,10 (м, 1 Н), 2,08-1,89 (м, 1 Н). Пример 31. 5-Амино-2-(2-фенилхроман-6-илокси)анилин а) 2,4-Динитро-1-(2-фенилхроман-6-илокси)бензол 2,4-Динитро-1-(2-фенилхроман-6-илокси)бензол получали, следуя методике примера 29(a), описанной для получения 2-нитро-1-(2-фенилхроман-6-илокси) бензола, за исключением того, что 6 гидроксифлаван (0,226 г) использовали в 5 мл сухого ДМСО в атмосфере азота. Подобным образом добавляли также KI (0,249 г), КОН (0,112 г) и 2,4-динитрохлорбензол (0,210 мг). Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь СН 2 Сl2:н-гептан/75:25).b) 5-Амино-2-(2-фенилхроман-6-илокси) анилин 2,4-Динитро-1-(2-фенилхроман-6-илокси)бензол (0,04 г) растворяли в 12 мл ледяной уксусной кислоты и добавляли цинк (0,131 г). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Последующую обработку осуществляли, следуя методике примера 29, описанной для получения 2-(2-фенилхроман-6-илокси)анилина. Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь CH2Cl2:Et3N/96:4). 1(м, 1 Н), 2,03-1,86 (м, 1 Н). Пример 32. 5-Циано-2-(2-фенилхроман-6-илокси)анилин а) 4-Циано-2-нитро-1-(2-фенилхроман-6-илокси)бензол 4-Циано-2-нитро-1-(2-фенилхроман-6-илокси)бензол получали, следуя методике примера 29(a),описанной для получения 2-нитро-1-(2-фенилхроман-6-илокси)бензола, за исключением того, что 6 гидроксифлаван (0,453 г) использовали в 10 мл сухого ДМСО в атмосфере азота. Подобным образом добавляли также KI (0,498 г), КОН (0,224 г) и 4-хлор-3-нитробензонитрил (0,365 мг). Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь СН 2 Сl2:н-гептан/90:10). 1b) 5-Циано-2-(2-фенилхроман-6-илокси)анилин 4-Циано-2-нитро-1-(2-фенилхроман-6-илокси)бензол (0,155 г; 0,4 ммоль) восстанавливали до соответствующего анилина, следуя методике примера 29, описанной для получения 2-(2-фенилхроман-6 илокси) анилина, за исключением того, что использовали 40 мл ледяной уксусной кислоты и 0,93 г цинкового порошка. Продукт очищали колоночной хроматографией (в качестве элюента использовали 100%(м, 1 Н), 2,08-1,89 (м, 1 Н). Пример 33. N-Ацетил-2-(2-фенилхроман-6-илокси)анилин 2-(2-фенилхроман-6-илокси)анилин (0,093 г) растворяли в 1 мл сухого пиридина в атмосфере азота. Добавляли DMAP (10 мол.%) и ангидрид уксусной кислоты (0,1 мл) и раствор перемешивали в течение 4 ч при комнатной температуре и затем гасили 0,5 мл Н 2 О. Раствор выпаривали досуха, добавляли толуол и выпаривали опять. Выпаривание толуола повторяли. Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь CH2Cl2: i-PrOH/98:2) и перекристаллизовывали из 0,5 мл нагретого абсолютного этанола охлаждением и добавлением 0,5 мл. 1 Н-ЯМР (400 МГц; d6-ДМСО):9,43 (с, 1 Н), 7,96 (м, 1 Н), 7,48-7,30 (м, 5 Н), 7,08-6,99 (м, 2 Н), 6,896,74 (м, 4 Н), 5,10 (дд, 1 Н, J=9,9, J=2,0), 3,03-2,88 (м, 1 Н), 2,76-2,65 (м, 1 Н), 2,21-2,11 (м, 1 Н), 2,10-1,91 (м,1 Н), 2,06 (с, 3H). Пример 34. 3-Нитро-2-(2-фенилхроман-6-илокси)пиридин 6-Гидроксифлавон (0,150 г) растворяли в 3 мл сухого ДМФА в атмосфере азота. Добавляли KF(0,117 г) и раствор перемешивали в течение 30 мин при 120 С. Раствор немного охлаждали, добавляли 2 хлор-3-нитропиридин (0,212 г) и перемешивали в течение 7 ч при +120 С и всю ночь при комнатной температуре. Реакционную смесь переносили в EtOAc и добавляли 1 М HCl и воду и разделяли фазы. Органическую фазу промывали водой и рН доводили до 7,0 1 М NaOH. Органическую фазу промывали водой, насыщенным раствором соли и сушили над Na2SO4. Продукт очищали колоночной хроматографиейa) 2,6-Динитро-1-(2-фенилхроман-6-илокси)-4-трифторметилбензол 2,6-Динитро-1-(2-фенилхроман-6-илокси)-4-трифторметилбензол получали, следуя методике примера 29(a), описанной для получения 2-нитро-1-(2-фенилхроман-6-илокси)бензола, за исключением того,что 6-гидроксифлаван (0,453 г) использовали в 10 мл сухого ДМСО в атмосфере азота. Подобным образом добавляли также KI (0,498 г), КОН (0,224 г) и 4-хлор-3,5-динитробензотрифторид (0,541 мг). 1 Н-ЯМР (400 МГц; d6-ДМСО):8,87 (с, 2 Н), 7,46-7,29 (м, 5 Н), 6,89-6,75 (м, 4 Н), 5,09 (дд, 1 Н, J=10,3 Гц, J=2,l Гц), 2,98-2,85 (м, 1 Н), 2,75-2,62 (м, 1 Н), 2,19-2,08 (м, 1 Н), 2,03-1,88 (м, 1 Н).b) 3-Амино-5-(трифторметил)-2-(2-фенилхроман-6-илокси)анилин 2,6-Динитро-1-(2-фенилхроман-6-илокси)-4-трифторметилбензол (0,198 г; 0,43 ммоль) восстанавливали до соответствующего диаминосоединения, следуя методике примера 29, описанной для получения 2-(2-фенилхроман-6-илокси)анилина, за исключением того, что использовали 25 мл ледяной уксусной кислоты и 1,525 г металлического цинкового порошка. Продукт очищали колоночной хроматографией (в качестве элюента использовали 100% CH2Cl2). 1H-ЯМР (400 МГц; d6-ДМСО):7,45-7,28 (м, 5 Н), 6,76 (д, 1 Н, J=8,8 Гц), 6,65 (дд, 1 Н, J=8,7 Гц, J=3,0 Гц), 6,62 (д, 1 Н, J=2,8 Гц), 5,04 (дд, 1 Н, J=10,0 Гц, J=2,l Гц), 4,98 (с, 4 Н), 2,98-2,86 (м, 1 Н), 2,70-2,60 (м,1 Н), 2,18-2,09 (м, 1 Н), 2,00-1,88 (м, 1 Н). Пример 36. 5-Сукцинимидо-2-(2-фенилхроман-6-илокси)пиридин 5-Амино-2-(2-фенилхроман-6-илокси)пиридин примера 26 (0,16 г) растворяли в 7,5 мл ледяной уксусной кислоты в атмосфере азота. Добавляли янтарный ангидрид (0,0563 г) и раствор кипятили с обратным холодильником в течение 60 мин и раствор охлаждали и выпаривали досуха. Добавляли толуол (25 мл) и опять выпаривали досуха. Продукт очищали колоночной хроматографией (в качестве элюента использовали смесь CH2Cl2:i-PrOH/95:5). 1 Н-ЯМР (400 МГц; d6-ДМСО):8,03 (д, 1 Н, J=2,6 Гц), 7,73 (дд, 1 Н, J=8,7 Гц, J=2,6 Гц), 7,48-7,31 (м,5 Н), 7,10 (д, 1 Н, J=8,7 Гц), 6,95 (д, 1 Н, J=2,6 Гц), 6,92 (дд, 1 Н, J=8,7 Гц, J=2,7 Гц), 6,88 (д, 1 Н, J=8,6 Гц),5,13 (дд, 1 Н, J=10,2 Гц, J=2,2 Гц), 3,05-2,92 (м, 1 Н), 2,84-6,68 (м, 1 Н), 2,79 (с, 4 Н), 2,22-2,12 (м, 1 Н), 2,081,93 (м, 1 Н). Пример 37. 5-(O,O'-Диацетил-L-тартарикимидо)-2-(2-фенилхроман-6-илокси)пиридин 5-(О,О'-Диацетил-L-тартарикимидо)-2-(2-фенилхроман-6-илокси)пиридин получали, следуя методике примера 36, описанной для получения 5-сукцинимидо-2-(2-фенилхроман-6-илокси)пиридина, за исключением того, что 5-амино-2-(2-фенилхроман-6-илокси)пиридин (0,318 г) и ангидрид (+)-диацетилL-винной кислоты (0,227 г) кипятили с обратным холодильником в 15 мл ледяной уксусной кислоты в течение 60 мин. 1 Н-ЯМР (400 МГц; d6-ДМСО):8,10 (д, 1 Н, J=2,6 Гц), 7,79 (дд, 1 Н, J=8,7 Гц, J=2,6 Гц), 7,49-7,30 (м,5 Н), 7,13 (д, 1 Н, J=8,8 Гц), 6,97 (д, 1 Н, J=2,5 Гц), 6,93 (дд, 1 Н, J=8,7 Гц, J=2,7 Гц), 6,88 (д, 1 Н, J=8,7 Гц),6,08 (с, 2 Н), 5,13 (дд, 1 Н, J=10,l Гц, J=l,9 Гц), 3,06-2,92 (м, 1 Н) , 2,80-2,69 (м, 1 Н), 2,23-2,12 (м, 1 Н), 2,18a) 3-(4-Метоксифенил)-2-фенилакриловая кислота К раствору р-анисового альдегида (10 г) и фенилуксусной кислоты (10 г) в уксусном ангидриде (25 мл) добавляли триэтиламин. Реакционную смесь перемешивали при 90 С в течение 8 ч. Реакционную смесь охлаждали и добавляли водный (600 мл) раствор карбоната калия (81 г). После добавления реакционную смесь нагревали при 60 С в течение часа. Перед нейтрализацией концентрированной хлористоводородной кислотой реакционную смесь охлаждали ниже 10 С. Осадок фильтровали и промывали водой. 1 Н-ЯМР (400 МГц, d6-ДМСО): 12,6 (уш.с, 1 Н), 7,67 (с, 1 Н), 7,4-7,3 (м, 3H), 7,2-7,1 (м, 2 Н), 7,0-6,9 (м,2 Н), 6,8-6,7 (м, 2 Н), 3,70 (с, 3H). (М)+ = 254 (100%).b) 3-(4-Метоксифенил)-2-фенилпропионовая кислота 13 г 3-(4-метоксифенил)-2-фенилакриловой кислоты растворяли в 600 мл этилацетата и в атмосфере азота добавляли 2,6 г 10% палладия на угле. Исходные продукты гидрировали при комнатной температуре с получением 3-(4-метоксифенил)-2-фенилпропионовой кислоты с количественным выходом. 1c) 6-Метокси-2-фенилиндан-1-он К раствору 3-(4-метоксифенил)-2-фенилпропионовой кислоты (4,6 г) в сухом метиленхлориде (26 мл) добавляли две капли сухого ДМФА. Добавляли тионилхлорид (3 мл) и реакционную смесь перемешивали при 40 С в течение 4 ч. В вакууме выпаривали растворитель. Осадок растворяли в метиленхлориде. Раствор охлаждали до 0-3 С. Данный раствор и хлорид алюминия (2,5 г) медленно перемешивали в течение 4 ч при поддержании температуры ниже 4 С. После смешивания реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили вливанием в разбавленную,охлажденную льдом хлористо-водородную кислоту. Слои разделяли и водный раствор экстрагировали метиленхлоридом. Объединенные органические слои промывали водой, сушили и выпаривали. Неочищенный продукт растирали с получением 2,9 г 6-метокси-2-фенилиндан-1-она. 1 Н-ЯМР (400 МГц, d6-ДМСО): 7,56 (д, 1 Н), 7,35-7,23 (м, 4 Н), 7,18-7,13 (м, 3H), 4,02 (дд, 1 Н, J 3,9,8,0 Гц), 3,82 (с, 3H), 3,61 (дд, 1 Н, J 8,0, 17,2 Гц), 3,11 (дд, 1 Н, J 3,9, 17,2 Гц).d) 5-Метокси-2-фенилиндан 5-Метокси-2-фенилиндан получали с использованием 600 мг 6-метокси-2-фенилиндан-1-она, следуя методике примера 1(a), описанной для получения 2-фенилхроман-6-ола.e) 2-Фенилиндан-5-ол Смесь 5-метокси-2-фенилиндана (200 мг) и концентрированной HBr (4 мл) кипятили с обратным холодильником в течение 5,5 ч. Реакционной смеси давали возможность охлаждаться до комнатной температуры, добавляли 20 мл смеси воды со льдом и ее экстрагировали метиленхлоридом. Объединенные органические слои промывали насыщенным раствором соли и сушили над Na2SO4. Растворители выпаривали с получением 2-фенилиндан-5-ола. 1 Н-ЯМР (400 МГц, d6-ДМСО): 9,05 (уш.с, 1 Н), 7,3-7,28 (м, 4 Н), 7,26-7,15 (м, 1 Н), 7,0 (д, 1 Н, J 8,1 Гц), 6,64 (д, 1 Н, J 1,9 Гц), 6,55 (дд, 1 Н, J 1,9, 8,1 Гц), 3,60 (к, 1 Н, J 8,6 Гц), 3,18 (м, 2 Н), 2,86 (дт, 2 Н, J 8,6,16 Гц).f) 5-Нитро-2-(2-фенилиндан-5-илокси)пиридин 5-Нитро-2-(2-фенилиндан-5-илокси)пиридин получали с использованием 107 мг 2-фенилиндан-5 ола, следуя методике примера 1(b), описанной для получения (2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО): 9,04 (д, 1 Н, J 2,9 Гц), 8,61 (дд, 1 Н, J 2,9, 9,1 Гц), 7,38-7,28 (м, 5 Н),7,24-7,20 (м, 2 Н), 7,11 (д, 1 Н, J 2,2 Гц), 7,00 (дд, 1 Н, J 2,2, 8,0 Гц), 3,72 (к, 1 Н, J 8,9 Гц), 3,36-3,28 (м, 2H),3,01 (дд, 2 Н, J 8,9, 15,3 Гц). Пример 39. 5-Метокси-2-(2-фенилиндан-5-илокси)фениламинa) 5-(4-Метокси-2-нитрофенокси)-2-фенилиндан 5-(4-Метокси-2-нитрофенокси)-2-фенилиндан получали с использованием 575 мг 2-фенилиндан-5 ола, следуя методике примера 3(a), описанной для получения 6-(4-метокси-2-нитрофенокси)2 фенилхромана. 1 Н-ЯМР (400 МГц, d6-ДМСО): 7,60 (д, 1 Н, J 3,1 Гц), 7,35-7,28 (м, 5 Н), 7,25-7,16 (м, 3H), 6,86 (д, 1 Н,J 2,3 Гц), 6,78 (дд, 1 Н, J 2,3, 8,2 Гц), 3,84 (с, 3H), 3,67 (к, 1 Н, J 8,3 Гц), 3,25 (дд, 2 Н, J 8,3, 15,7 Гц), 2,95 (м,2 Н). (М)+ = 361 (60%), 209 (100%).b) 5-Метокси-2-(2-фенилиндан-5-илокси)фениламин 5-Метокси-2-(2-фенилиндан-5-илокси)фениламин получали с использованием 200 мг 5-(4-метокси 2-нитрофенокси)-2-фенилиндана, следуя методике примера 3(b), описанной для получения 5-метокси-2(2-фенилхроман-6-илокси)фениламина. 1a) 2-(3-Фторфенил)индан-5-ол 2-(3-Фторфенил)индан-5-ол получали с использованием 5 г 3-фторфенилуксусной кислоты, следуя методике примера 25(а-е), описанной для получения 2-фенилиндан-5-ола. 1 Н-ЯМР (400 МГц, d6-ДМСО): 9,09 (с, 1 Н), 7,37-7,29 (м, 1 Н), 7,14-7,09 (м, 2 Н), 7,02-6,98 (м, 2 Н),6,64 (д, 1 Н, J 1,7 Гц), 6,55 (дд, 1 Н, J 2,3, 8,1 Гц), 3,63 (к, 1 Н, J 8,3 Гц), 3,24-3,12 (м, 2 Н), 2,94-2,79 (м, 2 Н).b) 5-Метокси-2-[2-(3-фторфенил)индан-5-илокси]фениламин 5-Метокси-2-[2-(3-фторфенил)индан-5-илокси]фениламин получали с использованием 500 мг 2-(3 фторфенил)индан-5-ола, следуя методике примера 3(a-b), описанной для получения 5-метокси-2-(2 фенилхроман-6-илокси)фениламина. 1a) 5-(2-Нитрофенокси)-2-фенилиндан 5-(2-Нитрофенокси)-2-фенилиндан получали с использованием 200 мг 2-фенилиндан-5-ола и 150 мг 1 хлор-2-нитробензола, следуя методике примера 3(a), описанной для получения 6-(4-метокси-2 нитрофенокси)-2-фенилхромана. 1 Н-ЯМР (400 МГц, d6-ДМСО): 8,04 (дд, 1 Н, J 1,6, 8,3 Гц), 7,68 (ддд, 1 Н, J 1,6, 7,4, 8,3 Гц), 7,36-7,27b) 2-(2-Фенилиндан-5-илокси)фениламин 2-(2-Фенилиндан-5-илокси)фениламин получали с использованием 170 мг 5-(2-нитрофенокси)-2 фенилиндана, следуя методике примера 29(b), описанной для получения 2-(2-фенилхроман-5 илокси)фениламина. 1- 21006580 Пример 42. 2-(2-Фенилиндан-5-илокси)-5-трифторметилбензол-1,3-диамин а) 5-(2,6-Динитро-4-трифторметилфенокси)-2-фенилиндан В раствор 2-фенилиндан-5-ола (200 мг) в сухом ДМФА (3 мл) добавляли трет-бутоксид калия (117 мг). После перемешивания полученной смеси при комнатной температуре в течение 30 мин добавляли 4 хлор-3,5-динитробензотрифторид (275 мг). Реакционную смесь перемешивали в течение еще 3 ч при 150 С. После охлаждения до комнатной температуры в смесь добавляли воду и этилацетат. В водный слой добавляли 1 М хлористо-водородную кислоту и раствор экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором соли, сушили над Na2SO4 и выпаривали. 5-(2,6-динитро-4-трифторметилфенокси)-2-фенилиндан перекристаллизовывали из этанола. 1 Н-ЯМР (400 МГц, d6-ДМСО): 8,89 (с, 2 Н), 7,33-7,27 (м, 4 Н), 7,23-7,18 (м, 2 Н), 6,96 (д, 1 Н, J 2,5 Гц),6,83 (дд, 1 Н, J 2,5, 8,2 Гц), 3,67 (к, 1 Н, J 8,6 Гц), 3,27-3,19 (м, 2 Н), 2,97-2,89 (м, 2 Н).b) 2-(2-Фенилиндан-5-илокси)-5-трифторметилбензол-1,3-диамин 2-(2-Фенилиндан-5-илокси)-5-трифторметилбензол-1,3-диамин получали с использованием 230 мг 5-(2,6-динитро-4-трифторметилфенокси)-2-фенилиндана, следуя методике примера 35(b), описанной для получения 2-(2-фенилхроман-6-илокси)-5-трифторметилбензол-1,3-диамина. 1H-ЯMP (300 МГц, d6-ДМСО): 7,33-7,27 (м, 4 Н), 7,22-7,18 (м, 1 Н), 7,14 (д, 1 Н, J 8,1 Гц), 6,73-6,69 (м,2 Н), 6,31 (с, 2 Н), 4,98 (с, 4 Н), 3,64 (к, 1 Н, J 8,5 Гц), 3,26-3,18 (м, 2 Н), 2,96-2,86 (м, 2 Н). Пример 43. 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-иламин а) Оксим 6-гидрокси-2-фенилхроман-4-она В охлажденный раствор 6-гидроксифлаванона (2 г), гидрохлорида гидроксиламина (900 мг) в этаноле (5 мл) и воды (2 мл) добавляли гидроксид натрия (122 мг). Образовавшуюся смесь кипятили с обратным холодильником в течение 6 ч и через каждые 45 минт добавляли гидрохлорид гидроксиламина(450 мг) и гидроксид натрия (61 мг). Поле охлаждения до комнатной температуры в смесь добавляли воду (23 мл) и концентрированную хлористо-водородную кислоту (5,6 мл). Осадок фильтровали, промывали водой и сушили в вакууме. 1 Н-ЯМР (400 МГц, d6-ДМСО): 11,3 (с, 1 Н), 9,11 (с, 1 Н), 7,50-7,48 (м, 2 Н), 7,43-7,33 (м, 3H), 7,21 (д,1 Н, J 2,9 Гц), 6,80 (д, 1 Н, J 8,8 Гц), 6,72 (дд, 1 Н, J 2,9, 8,8 Гц), 5,07 (дд, 1 Н, J 3,2, 11,9 Гц), 3,28 (дд, 1 Н, J 3,2, 17,1 Гц), 2,64 (дд, 1 Н, J 11,9, 17,1 Гц).b) 4-Амино-2-фенилхроман-6-ол Раствор оксима 6-гидрокси-2-фенилхроман-4-она (2,07 г) в 1,2-диметоксиэтане (20 мл) добавляли в охлажденный раствор хлорида титана (IV) (1,9 мл) и боргидрида натрия (1,29 г) в 1,2-диметоксиэтане (20 мл). Образовавшуюся смесь перемешивали в течение еще 4 ч при комнатной температуре. Реакционную смесь гасили льдом и рН доводили до 2-3. Полученную смесь экстрагировали толуолом. Водный слой подщелачивали раствором гидроксида натрия. Темный осадок фильтровали и промывали метанолом. Метаноловые промывки выпаривали досуха, растворяли в воде и нейтрализовали, и наконец фильтровали осадок. Выделяли смесь диастереоизомеров 4-амино-2-фенилхроман-6-ола в виде его гидрохлоридной соли. (М)+= 241 (4,4%), 224 (10%), 137 (100%).c) 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-иламин 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-иламин получали с использованием 100 мг гидрохлоридной соли 4-амино-2-фенилхроман-6-ола, следуя методике примера 1(b), описанной для получения 2-(фенилхроман-6-илокси)пиридина. Выделяли смесь диастереоизомеров 6-(5-нитропиридин-2-илокси)2-фенилхроман-4-иламина в виде его гидрохлоридной соли. (М)+ = 363 (22%), 259 (100%), 242 (70%), 224(64%), 223 (62%). Пример 44. N-[6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-ил]ацетамид В охлажденный раствор гидрохлорида 6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-иламина(100 мг) и пиридина (41 мкл) в сухом ДМФА добавляли уксусный ангидрид (60 мкл) . Образовавшуюся смесь перемешивали в течение еще 20 ч при 0 С. Реакционную смесь гасили смесью воды со льдом и нейтрализовали. Полученную смесь экстрагировали дихлорметаном, сушили над Na2SO4 и выпаривали. Смесь диастереоизомеров N-[6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-ил]ацетамида перекристаллизовывали из дихлорметана. (М)+ = 405 (24%), 301 (14%), 259 (100%), 242 (55%), 224 (96%). Пример 45. Диметил-[6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-ил]аминa) 4-N,N-диметиламино-2-фенилхроман-6-ол В раствор свободного основания 4-амино-2-фенилхроман-6-ола (263 мг) и 37% формальдегида (1,4 мл) в ацетонитриле (15 мл) добавляли цианоборгидрид натрия (274 мг). Через 30 мин рН доводили до значения 6-7 уксусной кислотой. Образовавшуюся смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выпаривали досуха, осадок растворяли в 10% растворе гидроксида калия и экстрагировали метиленхлоридом. Объединенные органические слои сушили и выпаривали с получением 4-N,N-диметиламино-2-фенилхроман-6-ола в виде смеси диастереоизомеров. 1N,N-Диметил-[6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-ил]амин получали с использованием 220 мг 4-N,N-диметиламино-2-фенилхроман-6-ола, следуя методике примера 1(b), описанной для получения 2-(фенилхроман-6-илокси)пиридина. N,N-Диметил-[6-(5-нитропиридин-2-илокси)-2-фенилхроман 4-ил]амин выделяли в виде смеси диастереоизомеров. (М)+ = 391 (8%), 347 (8%), 346 (8%), 287 (68%), 147(100%). Пример 46. N-[6-(2-Фенилхроман-6-илокси)пиридин-3-ил]метансульфонамид В охлажденный раствор 6-(2-фенилхроман-6-илокси)пиридин-3-иламина (121 мг) в сухом ТГФ (2 мл) добавляли пиридин (77 мкл) и метансульфонилхлорид (32 мкл). После перемешивания образовавшейся смеси при 0 С в течение еще 2 ч добавляли 1 М хлористо-водородную кислоту. Раствор экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4 и выпаривали. N-[6-(2 фенилхроман-6-илокси)пиридин-3-ил]метансульфонамид перекристаллизовывали из диэтилового эфира. 1 Н-ЯМР (300 МГц, d6-ДМСO) : 9,64 (с, 1 Н), 7,99 (д, 1 Н, J 2,8 Гц), 7,67 (дд, 1 Н, J 2,8, 8,8 Гц), 7,477,31 (м, 5 Н), 6,97 (д, 1 Н, J 8,8 Гц), 6,89-6,82 (м, 3H), 5,12 (дд, 1 Н J 2,2, 10,1 Гц), 3,0-2,9 (м, 1 Н), 2,98 (с,3H), 2,77-2,69 (м, 1 Н), 2,20-2,13 (м, 1 Н), 2,04-1,96 (м, 1 Н). Пример 47. 1-Метил-3-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]тиомочевина Раствор 6-(2-фенилхроман-6-илокси)пиридин-3-иламина (150 мг) и метилизотиоцианата (94 мкл) в этаноле кипятили с обратным холодильником в течение 10 ч. После охлаждения выпаривали растворители. Неочищенный продукт 1-метил-3-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]тиомочевину очищали колоночной хроматографией (5% метанол в дихлорметане). 1(м, 1 Н), 2,90 (д, 3H, J 4,3 Гц), 2,76-2,71 (м, 1 Н), 2,19-2,15 (м, 1 Н), 2,15-1,99 (м, 1 Н). Пример 48. 3-[6-(5-Нитропиридин-2-илокси)хроман-2-ил]фенол а) 6-Гидрокси-2-(3-гидроксифенил)хроман-4-он 6-Гидрокси-2-(3-гидроксифенил)хроман-4-он получали, следуя методике примера 9(a), описанной для получения 6-гидрокси-2-(3-фторфенил)хроман-4-она. Продукт перекристаллизовывали из этанола. 1b) 2-(3-Гидроксифенил)хроман-4,6-диол 2-(3-Гидроксифенил)хроман-4,6-диол получали из 6-гидрокси-2-(3-гидроксифенил)хроман-4-она,следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,43 (уш.с, 1 Н), 8,88 (уш.с, 1 Н), 7,19-7,15 (м, 1 Н), 6,87 (д, 1 Н, J 2,7 Гц), 6,84-6,82 (м, 2 Н), 6,72-6,69 (м, 1 Н), 6,58 (д, 1 Н, J 8,7 Гц), 6,53 (дд, 1 Н, J 2,7, 8,7), 5,01 (д, 1 Н, J 11,3 Гц), 4,86 (дд, 1 Н, J 6,2, 10,8 Гц), 2,25-2,19 (м, 1 Н), 1,88-1,75 (м, 1 Н).c) 2-(3-Гидроксифенил)хроман-6-ол 2-(3-Гидроксифенил)хроман-6-ол получали из 2-(3-гидроксифенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,38 (с, 1 Н), 8,77 (с, 1 Н), 7,17-7,13 (м, 1 Н), 6,82-6,79 (м, 2 Н), 6,706,67 (м, 1 Н), 6,62 (д, 1 Н, J 8,6 Гц), 6,52-6,47 (м, 2 Н), 4,89 (дд, 1 Н, J 2,1, 9,9 Гц), 2,86-2,82 (м, 1 Н), 2,65-2,59d) 3-[6-(5-Нитропиридин-2-илокси)хроман-2-ил]фенол 3-[6-(5-Нитропиридин-2-илокси)хроман-2-ил]фенол получали из 2-(3-гидроксифенил)хроман-6-ола,следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси) пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,44 (с, 1 Н), 9,04 (д, 1 Н, J 2,8 Гц), 8,60 (дд, 1 Н, J 2,8, 9,1 Гц), 7,217,16 (м, 2 Н), 7,00-6,94 (м, 2 Н), 6,91-6,84 (м, 3H), 6,73-6,70 (м, 1 Н), 5,06 (дд, 1 Н, J 2,1, 9,9 Гц), 2,99-2,92 (м,1 Н), 2,75-2,69 (м, 1 Н), 2,17-2,01 (м, 1 Н), 2,00-1,93 (м, 1 Н). Пример 49. 6-[2-(2,5-Дифторфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(2,5-Дифторфенил)хроман-6-илокси]пиридин-3-иламин получали из 830 мг 2-[2-(2,5 дифторфенил)хроман-6-илокси]-5-нитропиридина (пример 14(d, следуя методике примера 26, описанной для получения 5-амино-2-(2-фенилхроман-6-илокси)пиридина. 1N-6-[2-(2,5-Дифторфенил)хроман-6-илокси]пиридин-3-илацетамид получали из 370 мг 6-[2-(2,5 дифторфенил)хроман-6-илокси]пиридин-3-иламина (пример 49), следуя методике примера 27, описанной для получения 5-N'-ацетиламино-2-(2-фенилхроман-6-илокси)пиридина. Продукт очищали препаратив- 23006580 ной ТСХ на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси этилацетатгептан (4:1). 1(ддд, 1 Н, J -16,9, 8,4, 5,1 Гц), 2,26 (м, 1 Н), 2,13 (с, 3H), 1,97 (м, 1 Н). Пример 51. 6-[2-(2-Фторфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(2-Фторфенил)хроман-6-илокси]пиридин-3-иламин получали из 240 мг 2-[2-(2 фторфенил)хроман-6-илокси]-5-нитропиридина (пример 19 (d, следуя методике примера 26, описанной для получения 5-амино-2-(2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,52 (м, 1 Н), 7,51 (д, 1 Н, J 3,0 Гц), 7,41 (м, 1 Н), 7,28-7,24 (м, 2 Н),7,05 (дд, 1 Н, J 8,6, 3,0 Гц), 6,81-6,73 (м, 3H), 6,70 (д, 1 Н, J 8,6 Гц), 5,31 (дд, 1 Н, J 10,3, 2,2 Гц), 5,00 (с, 2 Н),2,98 (м, 1 Н), 2,72 (м, 1 Н), 2,15 (м, 1 Н), 2,06 (м, 1 Н). Пример 52. N-6-[2-(2-Фторфенил)хроман-6-илокси]пиридин-3-илацетамидN-6-[2-(2-Фторфенил)хроман-6-илокси]пиридин-3-илацетамид получали из 220 мг 6-[2-(2 фторфенил)хроман-6-илокси]пиридин-3-иламина (пример 51), следуя методике примера 27, описанной для получения 5-N'-ацетиламино-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из смеси метанола и диэтилового эфира. 1N-6-[2-(2-Фторфенил)хроман-6-илокси]пиридин-3-илметансульфонамид получали из 400 мг 6-[2(2-фторфенил)хроман-6-илокси]пиридин-3-иламина (пример 51), следуя методике примера 46, описанной для получения N-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]метансульфонамида. Продукт кристаллизовали из смеси метанола и диэтилового эфира. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,67 (с, 1 Н), 7,99 (д, 1 Н, J 2,8 Гц), 7,67 (дд, 1 Н, J 8,8, 2,8 Гц), 7,55(м, 1 Н), 7,42 (м, 1 Н), 7,29-7,23 (м, 2 Н), 6,98 (дд, 1 Н, J 8,8 Гц), 6,92-6,84 (м, 3H), 5,35 (дд, 1 Н, J 10,4, 2,3 Гц), 3,01 (м, 1 Н), 2,99 (с, 3H), 2,76 (м, 1 Н), 2,16 (м, 1 Н), 2,04 (м, 1 Н). Пример 54. 6-[2-(3-Фторфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(3-Фторфенил)хроман-6-илокси]пиридин-3-иламин получали из 2,34 г 2-[2-(3 фторфенил)хроман-6-илокси]-5-нитропиридина (пример 9(d, следуя методике примера 26, описанной для получения 5-амино-2-(2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,51 (д, 1 Н, J 3,0 Гц), 7,44 (м, 1 Н) , 7,30-7,25 (м, 2 Н), 7,16 (м, 1 Н),7,05 (дд, 1 Н, J 8,6, 3,0 Гц), 6,83-6,73 (м, 3H), 6,69 (д, 1 Н, J 8,6 Гц), 5,13 (дд, 1 Н, J 10,0, 3,0 Гц), 5,00 (с, 2 Н),2,93 (ддд, 1 Н, -16,8, 10,5, 5,3 Гц), 2,68 (ддд, 1 Н, J -16,8, 8,0, 4,4 Гц), 2,18 (м, 1 Н) , 1,96 (м, 1 Н). Пример 55. N-6-[2-(3-Фторфенил)хроман-6-илокси]пиридин-3-илацетамидN-6-[2-(3-Фторфенил)хроман-6-илокси]пиридин-3-илацетамид получали из 300 мг 6-[2-(3 фторфенил)хроман-6-илокси]пиридин-3-иламина (пример 54), следуя методике примера 27, описанной для получения 5-N'-ацетиламино-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из смеси метанола и диэтилового эфира. 1(м, 1 Н), 7,31-7,27 (м, 2 Н), 7,17 (м, 1 Н), 6,93 (д, 1 Н, J 8,8 Гц) 6,89-6,83 (м, 3H), 5,16 (дд, 1 Н, J 10,1, 2,1 Гц),2,95 (ддд, 1 Н, J -16,5, 11,0, 6,5 Гц), 2,71 (ддд, 1 Н, J -16,5, 8,7, 4,4 Гц), 2,19 (м, 1 Н), 2,04 (с, 3H), 1,96 (м,1 Н). Пример 56. 6-(5-Аминопиридин-2-илокси)-2-фенилхроман-4-он 6-(5-Аминопиридин-2-илокси)-2-фенилхроман-4-он получали из 100 мг 6-(5-нитропиридин-2 илокси)-2-фенилхроман-4-она (пример 6), следуя методике примера 26, описанной для получения 5 амино-2-(2-фенилхроман-6-илокси)пиридина. 1H-ЯМР (400 МГц, CD3OD) : 7,62 (д, 1 Н, J 3,0 Гц), 7,51-7,49 (м, 2 Н), 7,42-7,33 (м, 3H), 7,25-7,18 (м,3H), 7,06 (д, 1 Н, J 8,8 Гц), 6,76 (д, 1 Н, J 8,6 Гц), 5,50 (дд, 1 Н, J 13,0, 2,9 Гц), 3,08 (дд, 1 Н, -17,0, 13,0 Гц),2,82 (дд, 1 Н, J-17,0, 2,9 Гц). Пример 57. 6-(5-Нитропиридин-2-илокси)-2-фенилхроман-4-иловый эфир уксусной кислоты В раствор 100 мг 6-(5-нитропиридин-2-илокси)-2-фенилхроман-4-ола (пример 8(b в сухом пиридине добавляли по каплям ангидрид уксусной кислоты (0,26 мл). Реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. Затем ее вливали в смесь воды со льдом и экстрагировали этилацетатом. Органическую фазу промывали 1 М раствором HCl, водой и насыщенным раствором NaCl. Затем ее сушили над MgSO4 и выпаривали досуха. 1a) 6-(2-Азидоэтокси)-2-фенилхроман-4-он 6-(2-Азидоэтокси)-2-фенилхроман-4-он получали из 1,0 г 6-гидроксифлаванона, следуя методике примера 4(a), описанной для получения 6-(2-азидоэтокси)-2-фенилхромана. 1 Н-ЯМР (400 МГц, CD3OD) : 7,53-7,51 (м, 2 Н), 7,44-7,35 (м, 4 Н), 7,22 (дд, 1 Н, J 9,0, 3,1 Гц), 7,04 (д,1 Н, J 9,0 Гц), 5,51 (дд, 1 Н, J 13,1, 3,0 Гц), 4,17 (т, 2 Н, J 4,9 Гц), 3,60 (т, 2 Н, J 4,9 Гц), 3,11 (дд, 1 Н, J -16,9,13,1 Гц), 2,85 (дд, 1 Н, J -16,9, 3,0 Гц).b) Метансульфонат 6-(2-аминоэтокси)-2-фенилхроман-4-она Метансульфонат 6-(2-аминоэтокси)-2-фенилхроман-4-она получали из 6-(2-азидоэтокси)-2 фенилхроман-4-она, следуя методике примера 4(b), описанной для получения метансульфоната 2-(2 фенилхроман-6-илокси)этиламина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,91 (уш.с, 3H), 7,55-7,54 (м, 2 Н), 7,46-7,37 (м, 3H), 7,31 (д, 1 Н, J 3,1 Гц), 7,28 (дд, 1 Н, 8,8, 3,1 Гц), 7,12 (д, 1 Н, 8,8 Гц), 5,63 (дд, 1 Н, J 13,0, 3,0 Гц), 4,17 (т, 2 Н, J 5,1 Гц), 3,25(дд, 1 Н, J -16,9, 13,0 Гц), 3,23 (м, 2 Н), 2,86 (дд, 1 Н, J -16,9, 3,0 Гц), 2,29 (с, 3H). Пример 59. 2-(3-Бромфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(3-Бромфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 215 мг 2-(3 бромфенил)хроман-4,6-диола (пример 15(b, следуя методике примера 1(b), описанной для получения 5 нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из смеси 2-пропанола и ацетона. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,8 Гц), 8,61 (дд, 1 Н, J 9,1, 2,8 Гц), 7,69 (м, 1 Н), 7,587,50 (м, 2 Н), 7,40 (м, 1 Н), 7,25 (д, 1 Н, J 2,7 Гц), 7,22 (д, 1 Н, 9,1 Гц), 7,02 (дд, 1 Н, J 8,8, 2,7 Гц), 6,91 (д, 1 Н,J 8,8 Гц), 5,65 (д, 1 Н, J 6,4 Гц), 5,33 (д, 1 Н, J 10,8 Гц), 4,97 (м, 1 Н), 2,36 (м, 1 Н), 1,94 (м, 1 Н). Пример 60. 2-(2-Фторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(2-Фторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 315 мг 2-(2 фторфенил)хроман-4,6-диола (пример 19(b, следуя методике примера 1(b), описанной для получения 5 нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из смеси 2-пропанола и ацетона. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,61 (дд, 1 Н, J 9,1, 2,9 Гц), 7,61 (м, 1 Н) , 7,43(м, 1 Н), 7,31-7,24 (м, 3H), 7,23 (д, 1 Н, J 9,1 Гц), 7,02 (дд, 1 Н, J 8,7, 3,1 Гц), 6,89 (д, 1 Н, J 8,7 Гц), 5,69 (д,1 Н, J 6,3 Гц), 5,55 (д, 1 Н, J 11,9 Гц), 5,00 (м, 1 Н), 2,33 (м, 1 Н), 2,07 (м, 1 Н). Пример 61. 2-(2,5-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(2,5-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 200 мг 2-(2,5 дифторфенил)хроман-4,6-диола (пример 14(b, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт очищали препаративной ТСХ на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси толуол-этилацетат (4:1). 1H-ЯМР (400 МГц, CDCl3) : 9,03 (д, 1 Н, J 2,8 Гц), 8,50 (дд, 1 Н, J 9,1, 2,8 Гц), 7,36-7,33 (м, 2 Н), 7,086,95 (м, 5 Н), 5,50 (д, 1 Н, J 11,1 Гц), 5,09 (м, 1 Н), 2,53 (м, 1 Н), 2,05 (м, 1 Н). Пример 62. 2-(3-Фторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(3-Фторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 890 мг 2-(3 фторфенил)хроман-4,6-диола (пример 9(b, следуя методике примера 1(b), описанной для получения 5 нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт очищали колоночной хроматографией с использованием градиентного элюирования смесью этилацетат-гептан (20%33%) и затем кристаллизовали из смеси 2-пропанола и ацетона. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,61 (дд, 1 Н, J 9,1, 2,9 Гц), 7,48 (м, 1 Н), 7,357,31 (м, 2 Н), 7,26-7,19 (м, 3H), 7,02 (дд, 1 Н, J 8,8, 2,9 Гц), 6,91 (д, 1 Н, J 8,8 Гц), 5,67 (д, 1 Н, J 6,4 Гц), 5,34a) 1-Хлор-4-этокси-2-нитробензол 4-Хлор-3-нитробензол (5,0 г) растворяли в ацетоне и добавляли этилиодид (2,5 мл) и карбонат калия (4,4 г). Реакционную смесь перемешивали при 40 С в течение 4,5 ч. После охлаждения до комнатной температуры смесь фильтровали и фильтрат выпаривали досуха. 1 Н-ЯМР (400 МГц, d6-ДМСО)7,64 (м, 2 Н), 7,27 (дд, 1 Н, J 9,0, 3,1 Гц), 4,12 (кв, 2 Н, J 7,0 Гц), 1,34b) 2-(2,5-Дифторфенил)-6-(4-этокси-2-нитрофенокси)хроман 320 мг 2-(2,5-дифторфенил)хроман-6-ола (пример 14(c растворяли в сухом ДМФА и добавляли трет-бутоксид калия (150 мг). Образовавшуюся смесь перемешивали в течение 30 мин и добавляли 1 хлор-4-этокси-2-нитробензол (250 мг). Реакционную смесь кипятили с обратным холодильником в течение 8 ч. После охлаждения до комнатной температуры в реакционную смесь добавляли 1 М раствор HCl и ее экстрагировали этилацетатом. Объединенные органические экстракты промывали водой и насыщенным раствором NaCl. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (3:1). Н-ЯМР (300 МГц, CDCl3) : 7,43 (д, 1 Н, J 2,9 Гц), 7,25 (м, 1 Н), 7,08-6,97 (м, 4 Н), 6,89-6,75 (м, 3H),5,31 (д, 1 Н, J 9,1 Гц), 4,06 (кв, 2 Н, J 7,0 Гц), 2,97 (м, 1 Н), 2,74 (м, 1 Н), 2,26 (м, 1 Н), 1,98 (м, 1 Н), 1,44 (т,3H, 7,0 Гц). с) Гидрохлорид 2-[2-(2,5-дифторфенил)хроман-6-илокси]-5-этоксифениламина Гидрохлорид 2-[2-(2,5-дифторфенил)хроман-6-илокси]-5-этоксифениламина получали из 120 мг 2(2,5-дифторфенил)-6-(4-этокси-2-нитрофенокси)хромана, следуя методике примера 3(b), описанной для получения 5-метокси-2-(2-фенилхроман-6-илокси)фениламина. 1 Н-ЯМР (400 МГц, CDCl3) : 7,26-7,22 (м, 2 Н), 7,01-6,74 (м, 7 Н), 5,22 (д, 1 Н, J 9,1 Гц), 3,90 (кв, 2 Н, J 6,9 Гц), 2,90 (м, 1 Н), 2,68 (м, 1 Н), 2,19 (м, 1 Н), 1,90 (м, 1 Н), 1,34 (т, 3H, 6,9 Гц). Пример 64. 5-Нитро-2-[2-(4-трифторметилфенил)хроман-6-илокси]пиридинa) 6-Гидрокси-2-(4-трифторметилфенил)хроман-4-он 6-Гидрокси-2-(4-трифторметилфенил)хроман-4-он получали из 2,0 г 2'5'-дигидроксиацетофенона и 2,1 мл 4-трифторметилбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3 фторфенил)-6-гидроксихроман-4-она. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (2:1). Дополнительную очистку осуществляли колоночной хроматографией с использованием в качестве элюента смеси толуол-этилацетат (4:1). И наконец, продукт кристаллизовали из этанола. 1b) 2-(4-Трифторметилфенил)хроман-4,6-диол 2-(4-Трифторметилфенил)хроман-4,6-диол получали из 860 мг 2-(4-трифторметилфенил)-6 гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6 диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,86 (с, 1 Н), 7,77 (д, 2 Н, J 8,3 Гц), 7,68 (д, 2 Н, J 8,3 Гц), 6,89 (д, 1 Н,J 2,9 Гц), 6,63 (д, 1 Н, J 8,7 Гц), 6,56 (дд, 1 Н, J 8,7, 2,9 Гц), 5,45 (д, 1 Н, J 7,0 Гц), 5,26 (д, 1 Н, J 11,2 Гц), 4,90c) 2-(4-Трифторметилфенил)хроман-6-ол 2-(4-Трифторметилфенил)хроман-6-ол получали из 730 мг 2-(4-трифторметилфенил)хроман-4,6 диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(4-Трифторметилфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(4-Трифторметилфенил)хроман-6-илокси]-5-нитропиридин получали из 605 мг 2-(4 трифторметилфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2(2-фенилхроман-6-илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента 1,5% этилацетата в толуоле и затем выкристаллизовывали из смеси 2-пропанола и ацетона. 1H-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,60 (дд, 1 Н, J 9,1, 2,9 Гц), 7,79 (д, 2 Н, J 8,2 Гц), 7,70 (д, 1 Н, J 8,2 Гц), 7,21 (д, 1 Н, J 9,1 Гц), 7,01 (дд, 1 Н, J 8,7, 2,7 Гц), 6,98 (д, 1 Н, J 2,7 Гц), 6,95 (д,1 Н, 8,7 Гц), 5,29 (дд, 1 Н, J 10,1, 2,0 Гц), 3,00 (ддд, 1 Н, J -16,9, 10,1, 5,8 Гц), 2,4 (ддд, 1 Н, J -16,9, 8,4, 4,5 Гц), 2,24 (м, 1 Н), 1,99 (м, 1 Н). Пример 65. 6-[2-(4-Трифторметилфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(4-Трифторметилфенил)хроман-6-илокси]пиридин-3-иламин получали из 275 мг 2-[2-(4 трифторметилфенил)хроман-6-илокси]-5-нитропиридина (пример 64 (d, следуя методике примера 26,описанной для получения 5-амино-2-(2-фенилхроман-6-илокси)пиридина. 1N-6-[2-(4-Трифторметилфенил)хроман-6-илокси]пиридин-3-илацетамид получали из 140 мг 6-[2(4-трифторметилфенил)хроман-6-илокси]пиридин-3-иламина (пример 65), следуя методике примера 27,описанной для получения 5-N'-ацетиламино-2-(2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 10,11 (с, 1 Н), 8,29 (д, 1 Н, J 2,7 Гц), 8,02 (дд, 1 Н, J 8,9, 2,7 Гц), 7,78N-6-[2-(3-Фторфенил)хроман-6-илокси]пиридин-3-илметансульфонамид получали из 300 мг 6-[2(3-фторфенил)хроман-6-илокси]пиридин-3-иламина (пример 54), следуя методике примера 46, описан- 26006580 ной для получения N-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]метансульфонамида. Продукт очищали пропусканием через силикагель с использованием в качестве элюента смеси этилацетат-гептан (5:1). 1H-ЯMP (400 МГц, d6-ДМСО) : 9,67 (с, 1 Н), 7,99 (дд, 1 Н, J 2,8, 0,6 Гц), 7,67 (дд, 1 Н, J 8,8, 2,8 Гц),7,46 (м, 1 Н), 7,31-7,27 (м, 2 Н), 7,17 (м, 1 Н), 6,98 (дд, 1 Н, J 8,8, 0,6 Гц) 6,90-6,88 (м, 3H), 5,16 (дд, 1 Н, J 10,0, 2,2 Гц), 2,99 (с, 3H), 2,96 (м, 1 Н), 2,72 (м, 1 Н), 2,20 (м, 1 Н), 1,99 (м, 1 Н). Пример 68. 2-(4-Хлорфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол а) 6-Гидрокси-2-(4-хлорфенил)хроман-4-он 6-Гидрокси-2-(4-хлорфенил)хроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,8 г 4 хлорбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт растирали в этаноле. 1b) 2-(4-Хлорфенил)хроман-4,6-диол 2-(4-Хлорфенил)хроман-4,6-диол получали из 375 мг 2-(4-хлорфенил)-6-гидроксихроман-4-она,следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(4-Хлорфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(4-Хлорфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 330 мг 2-(4 хлорфенил)хроман-4,6-диола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. Продукт очищали колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (2:1). 1H-ЯМР (300 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,61 (дд, 1 Н, J 9,1, 2,9 Гц), 7,54-7,47 (м, 4 Н),7,25 (д, 1 Н, J 2,8 Гц), 7,22 (д, 1 Н, 9,1 Гц), 7,02 (дд, 1 Н, J 8,8, 2,8 Гц), 6,89 (д, 1 Н, J 8,8 Гц), 5,65 (д, 1 Н, J 6,4 Гц), 5,33 (д, 1 Н, J 10,6 Гц), 4,98 (м, 1 Н), 2,34 (м, 1 Н), 1,94 (м, 1 Н). Пример 69. 2-[2-(2,4-Дифторфенил)хроман-6-илокси]-5-нитропиридин а) 2-(2,4-Дифторфенил)-6-гидроксихроман-4-он 2-(2,4-Дифторфенил)-6-гидроксихроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 1,6 мл 2,4-дифторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)6-гидроксихроман-4-она. 1b) 2-(2,4-Дифторфенил)хроман-4,6-диол 2-(2,4-Дифторфенил)хроман-4,6-диол получали из 1,47 г 2-(2,4-дифторфенил)-6-гидроксихроман-4 она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1c) 2-(2,4-Дифторфенил)хроман-6-ол 2-(2,4-Дифторфенил)хроман-6-ол получали из 800 мг 2-(2,4-дифторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(2,4-Дифторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2,4-Дифторфенил)хроман-6-илокси]-5-нитропиридин получали из 720 мг 2-(2,4 дифторфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. 1(м, 1 Н), 7,21 (д, 1 Н, 9,0 Гц), 7,17 (м, 1 Н) 7,02 (д, 1 Н, J 2,9 Гц), 6,97 (дд, 1 Н, J 8,9, 2,9 Гц), 6,91 (д, 1 Н, 8,9 Гц), 5,34 (дд, 1 Н, J 9,9, 2,0 Гц), 3,03 (м, 1 Н), 2,78 (м, 1 Н), 2,17 (м, 1 Н), 2,07 (м, 1 Н). Пример 70. 6-[2-(2,4-Дифторфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(2,4-Дифторфенил)хроман-6-илокси]пиридин-3-иламин получали из 845 мг 2-[2-(2,4 дифторфенил)хроман-6-илокси]-5-нитропиридина (пример 69(d, следуя методике примера 26, описанной для получения 5-амино-2-(2-фенилхроман-6-илокси) пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,58 (м, 1 Н), 7,51 (д, 1 Н, J 3,3 Гц), 7,30 (м, 1 Н), 7,15 (м, 1 Н), 7,05N-6-[2-(2,4-Дифторфенил)хроман-6-илокси]пиридин-3 илметансульфонамид получали из 100 мг 6-[2-(2,4-дифторфенил)хроман-6-илокси]пиридин-3-иламина (пример 70), следуя методике примера 46,описанной для получения N-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]метансульфонамида. Продукт кристаллизовали из смеси метанола и диэтилового эфира. 1(м, 1 Н), 2,98 (с, 3H), 2,76 (м, 1 Н), 2,16 (м, 1 Н), 2,06 (м, 1 Н). Пример 72. 2-(2,4-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(2,4-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 520 мг 2-(2,4 дифторфенил)хроман-4,6-диола (пример 69(b, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из смеси 2-пропанола и диэтилового эфира. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,8 Гц), 8,61 (дд, 1 Н, J 9,1, 2,8 Гц), 7,66 (м, 1 Н), 7,32a) 2-(2-Хлорфенил)-6-гидроксихроман-4-он 2-(2-Хлорфенил)-6-гидроксихроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,8 г 2 хлорбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт пропускали через силикагель с использованием в качестве элюента смеси гептан-этилацетат и затем растирали в этаноле. 1b) 2-(2-Хлорфенил)хроман-4,6-диол 2-(2-Хлорфенил)хроман-4,6-диол получали из 1,12 г 2-(2-хлорфенил)-6-гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,63 (дд, 1 Н, J 7,7, 1,8 Гц), 7,49 (дд, 1 Н, J 7,8, 1,4 Гц), 7,45-7,36 (м,2 Н), 6,89 (д, 1 Н, J 2,9 Гц), 6,63 (д, 1 Н, J 8,8 Гц), 6,56 (дд, 1 Н, J 8,9, 2,9 Гц), 5,39 (дд, 1 Н, J 11,7, 1,5 Гц),4,90 (м, 1 Н), 2,33 (м, 1 Н), 1,82 (м, 1 Н).c) 2-(2-Хлорфенил)хроман-6-ол 2-(2-Хлорфенил)хроман-6-ол получали из 500 мг 2-(2-хлорфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1d) 2-[2-(2-Хлорфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2-Хлорфенил)хроман-6-илокси]-5-нитропиридин получали из 485 мг 2-(2-хлорфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. 1(м, 1 Н), 1,95 (м, 1 Н). Пример 74. 2-(2-Хлорфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(2-Хлорфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 520 мг 2-(2 хлорфенил)хроман-4,6-диола (пример 68(b, следуя методике примера 1(b), описанной для получения 5 нитро-2-(2-фенилхроман-6-илокси)пиридина. Продукт перекристаллизовывали из 2-пропанола. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,9 Гц), 8,61 (дд, 1 Н, J 9,1, 2,9 Гц), 7,68 (дд, 1 Н, J 7,6,1,8 Гц), 7,51-7,40 (м, 3H), 7,27 (д, 1 Н, J 2,9 Гц), 7,23 (д, 1 Н, J 9,1 Гц), 7,04 (дд, 1 Н, J 8,8, 2,9 Гц), 6,92 (д,1 Н, J 8,8 Гц), 5,59 (д, 1 Н, J 10,6 Гц), 5,02 (м, 1 Н), 2,40 (м, 1 Н), 1,93 (м, 1 Н). Пример 75. 5-Нитро-2-[2-(4-Фторфенил)хроман-6-илокси]пиридинa) 6-Гидрокси-2-(4-фторфенил)хроман-4-он 6-Гидрокси-2-(4-фторфенил)хроман-4-он получали из 2,0 г 2',5'-дигидроксиацетофенона и 1,6 мл 4 фторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)-6 гидроксихроман-4-она. Продукт перекристаллизовывали из уксусной кислоты. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,59 (м, 2 Н), 7,27 (м, 2 Н), 7,14 (д, 1 Н, J 3,1 Гц), 7,05 (дд, 1 Н, J 8,9,3,1 Гц), 6,96 (д, 1 Н, J 8,9 Гц), 5,56 (дд, 1 Н, J 13,2, 2,8 Гц), 3,18 (дд, 1 Н, J -16,9, 13,2 Гц), 2,77 (дд, 1 Н, J 16,9, 2,8 Гц).b) 2-(4-фторфенил)хроман-4,6-диол 2-(4-фторфенил)хроман-4,6-диол получали из 1,5 г 2-(4-фторфенил)-6-гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,84 (с, 1 Н), 7,48 (м, 2 Н), 7,21 (м, 2 Н), 6,89 (д, 1 Н, J 2,7 Гц), 6,59 (д,1 Н, J 8,7 Гц), 6,54 (дд, 1 Н, J 8,7, 2,7 Гц), 5,42 (уш.с, 1 Н), 5,12 (д, 1 Н, J 10,7 Гц), 4,87 (м, 1 Н), 2,25 (м, 1 Н),1,89 (м, 1 Н).c) 2-(4-фторфенил)хроман-6-ол 2-(4-фторфенил)хроман-6-ол получали из 480 мг 2-(4-фторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (400 МГц, CDCl3) : 7,38 (м, 2 Н), 7,06 (м, 2 Н), 6,77 (д, 1 Н, J 8,6 Гц), 6,61 (дд, 1 Н, J 8,6, 2,9 Гц) 6,57 (д, 1 Н, 8,6 Гц), 4,97 (дд, 1 Н, J 10,2, 2,4 Гц), 2,95 (ддд, 1 Н, J -16,8, 11,4, 6,2 Гц), 2,74 (ддд, 1 Н, J 16,8, 5,3, 3,1 Гц), 2,15 (м, 1 Н), 2,05 (м, 1 Н).d) 2-[2-(4-Фторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(4-Фторфенил)хроман-6-илокси]-5-нитропиридин получали из 160 мг 2-(4-фторфенил)хроман 6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2-фенилхроман-6 илокси)пиридина. Продукт очищали препаративной ТСХ на пластинке, покрытой силикагелем, с использованием в качестве элюента смеси гептан-этилацетат (4:1). 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (дд, 1 Н, J 2,9, 0,4 Гц), 8,60 (дд, 1 Н, J 9,1, 2,9 Гц), 7,51 (м, 2 Н),7,24 (м, 1 Н) , 7,20 (дд, 1 Н, J 9,1, 0,4 Гц), 7,01 (д, 1 Н, J 2,8 Гц), 6,96 (дд, 1 Н, J 8,7, 2,8 Гц), 6,91 (д, 1 Н, 8,7 Гц), 5,15 (дд, 1 Н, J 10,3, 2,2 Гц), 2,94 (м, 1 Н), 2,76 (м, 1 Н) 2,17 (м, 1 Н), 2,01 (м, 1 Н). Пример 76. 6-[2-(4-Фторфенил)хроман-6-илокси]пиридин-3-иламин 6-[2-(4-Фторфенил)хроман-6-илокси]пиридин-3-иламин получали из 3,04 г 2-[2-(4 фторфенил)хроман-6-илокси]-5-нитропиридина (пример 75 (d, следуя методике примера 26, описанной для получения 5-амино-2-(2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,52-7,47 (м, 3H), 7,24 (м, 2 Н), 7,05 (дд, 1 Н, J 8,6, 3,0 Гц), 6,84-6,68N-6-[2-(4-Фторфенил)хроман-6-илокси]пиридин-3 илметансульфонамид получали из 442 мг 6-[2(4-фторфенил)хроман-6-илокси] пиридин-3-иламина (пример 76), следуя методике примера 46, описанной для получении N-[6-(2-фенилхроман-6-илокси)пиридин-3-ил]метансульфонамида. Продукт пропускали через силикагель с использованием в качестве элюента смеси этилацетат-гептан (10:3) и затем кристаллизовали из диэтилового эфира. 1a) 2-(2,3-Дифторфенил)-6-гидроксихроман-4-он 2-(2,3-Дифторфенил)-6-гидроксихроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,6 мл 2,3-дифторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)6-гидроксихроман-4-она. 1b) 2-(2,3-Дифторфенил)хроман-4,6-диол 2-(2,3-Дифторфенил)хроман-4,6-диол получали из 2,91 г 2-(2,3-дифторфенил)-6-гидроксихроман-4 она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,88 (с, 1 Н), 7,45-7,36 (м, 2 Н), 7,28 (м, 1 Н), 6,89 (д, 1 Н, J 2,8 Гц),6,61 (д, 1 Н, J 8,7 Гц), 6,55 (дд, 1 Н, J 8,7, 2,8 Гц), 5,49 (уш.с, 1 Н), 5,40 (дд, 1 Н, J 11,8, 1,4 Гц), 4,90 (м, 1 Н),2,28 (м, 1 Н), 1,99 (м, 1 Н).c) 2-(2,3-Дифторфенил)хроман-6-ол 2-(2,3-Дифторфенил)хроман-6-ол получали из 1,5 г 2-(2,3-дифторфенил)хроман-4,6-диола, следуя методике примера 9(c), описанной для получения 2-(3-фторфенил)хроман-6-ола. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 8,85 (с, 1 Н), 7,41 (м, 1 Н), 7,33 (м, 1 Н), 7,26 (м, 1 Н), 6,64 (дд, 1 Н, 9,0,2,8 Гц), 6,54-6,51 (м, 2 Н), 5,25 (дд, 1 Н, J 10,2, 2,2 Гц), 2,93 (м, 1 Н), 2,66 (м, 1 Н), 2,14 (м, 1 Н), 2,01 (м, 1 Н).d) 2-[2-(2,3-Дифторфенил)хроман-6-илокси]-5-нитропиридин 2-[2-(2,3-Дифторфенил)хроман-6-илокси]-5-нитропиридин получали из 1,88 г 2-(2,3 дифторфенил)хроман-6-ола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. 1a) 6-Гидрокси-2-(2,6-дифторфенил)хроман-4-он 6-Гидрокси-2-(2,6-дифторфенил)хроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 2,6 мл 2,6-дифторбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3-фторфенил)6-гидроксихроман-4-она. Продукт растирали в этаноле. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 7,55 (м, 1 Н) 7,22-7,18 (м, 2 Н), 7,14 (д, 1 Н, J 3,0 Гц), 7,03 (дд, 1 Н, J 8,9, 3,0 Гц), 6,93 (д, 1 Н, J 8,9 Гц), 5,84 (дд, 1 Н, J 14,0, 3,0 Гц), 3,38 (дд, 1 Н, J -17,0, 14,0 Гц), 2,80 (дд, 1 Н, Jb) 2-(2,6-Дифторфенил)хроман-4,6-диол 2-(2,6-Дифторфенил)хроман-4,6-диол получали из 4,45 г 2-(2,6-дифторфенил)-6-гидроксихроман-4,6-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6-диола. 1H-ЯМР (400 МГц, d6-ДМСО) : 8,87 (с, 1 Н), 7,48 (м, 1 Н), 7,17-7,13 (м, 2 Н), 6,90 (д, 1 Н, J 2,9 Гц),6,55-6,54 (м, 2 Н), 5,46 (дд, 1 Н, J 12,2, 1,8 Гц), 4,87 (м, 1 Н), 2,37 (м, 1 Н), 2,23 (м, 1 Н). с) 2-(2,6-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол 2-(2,6-Дифторфенил)-6-(5-нитропиридин-2-илокси)хроман-4-ол получали из 1,9 г 2-(2,6 дифторфенил)хроман-4,6-диола, следуя методике примера 1(b), описанной для получения 5-нитро-2-(2 фенилхроман-6-илокси)пиридина. 1a) 6-Гидрокси-2-(2-трифторметилфенил)хроман-4-он 6-Гидрокси-2-(2-трифторметилфенил)хроман-4-он получали из 3,0 г 2',5'-дигидроксиацетофенона и 3,0 мл 2-трифторметилбензальдегида, следуя методике примера 9(a), описанной для получения 2-(3 фторфенил)-6-гидроксихроман-4-она. Продукт растирали в этаноле. 1 Н-ЯМР (300 МГц, d6-ДМСО) : 9,48 (с, 1 Н), 8,07 (м, 1 Н, ) 7,86-7,79 (м, 2 Н), 7,66 (м, 1 Н), 7,15 (д,1 Н, J 3,0 Гц), 7,06 (дд, 1 Н, J 8,8, 3,0 Гц), 6,95 (д, 1 Н, J 8,8 Гц), 5,70 (дд, 1 Н, J 13,8, 2,4 Гц), 3,38 (дд, 1 Н, J 16,9, 13,8 Гц), 2,66 (дд, 1 Н, J -16,9, 3,0 Гц).b) 2-(2-Трифторметилфенил)хроман-4,6-диол 2-(2-Трифторметилфенил)хроман-4,6-диол получали из 1,43 г 2-(2-трифторметилфенил)-6 гидроксихроман-4-она, следуя методике примера 8(a), описанной для получения 2-фенилхроман-4,6 диола. 1c) 6-(5-Нитропиридин-2-илокси)-2-(2-трифторметилфенил)хроман-4-ол 6-(5-Нитропиридин-2-илокси)-2-(2-трифторметилфенил)хроман-4-ол получали из 350 мг 2-(2 трифторметилфенил)хроман-4,6-диола, следуя методике примера 1(b), описанной для получения 5 нитро-2-(2-фенилхроман-6-илокси)пиридина. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 9,04 (д, 1 Н, J 2,8 Гц), 8,62 (дд, 1 Н, J 9,1, 2,8 Гц), 7,89 (м, 1 Н), 7,827,78 (м, 2 Н), 7,62 (м, 1 Н), 7,28 (д, 1 Н, J 2,7 Гц), 7,24 (д, 1 Н, 9,1 Гц), 7,04 (дд, 1 Н, J 8,7, 2,7 Гц), 6,90 (д, 1 Н,J 8,7 Гц), 5,7 (уш.с, 1 Н), 5,38 (д, 1 Н, J 11,6 Гц), 5,01 (м, 1 Н), 2,29 (м, 1 Н), 2,05 (м, 1 Н). Пример 81. 2-[3-(3-Фторфенил)хроман-7-илокси]-5-нитропиридин(3-фторфенил)уксусную кислоту (3,7 г) и 3-метоксифенол (3,0 г) растворяли в BF3Et2O (60 мл, 20 экв.) в атмосфере аргона. Смесь перемешивали при 60-70 С до исчезновения исходных продуктов 9 ч и вливали в большой объем смеси воды со льдом. После экстракции этилацетатом объединенные органические слои промывали водой, сушили и выпаривали. Неочищенный продукт очищали колоночной хроматографией с использованием в качестве элюента СН 2 Сl2. 1 Н-ЯМР (400 МГц, d6-ДМСО) : 12,41 (уш.с, 1 Н), 8,02 (д, 1 Н, J 9,0 Гц), 7,34-7,38 (м, 1 Н), 7,09-7,13b) 3-(3-Фторфенил)-7-метоксихромен-4-он 2-(3-Фторфенил)-1-(2-гидрокси-4-метоксифенил)этанон (1,76 г) растворяли в пиридине (88 мл). Добавляли пиперидин (8,8 мл) и триэтилортоформиат (88 мл), и смесь перемешивали при 120 С в течение 3,5 ч. После вливания смеси в воду и подкисления концентрированной HCl неочищенный продукт фильтровали. В результате очистки колоночной хроматографией с использованием в качестве элюента смеси гептан-этилацетат (7:3) получали 3-(3-фторфенил)-7-метоксихромен-4-он. 1
МПК / Метки
МПК: C07C 217/54, C07C 217/14, C07D 311/32, C07D 327/06, C07D 311/04, C07D 405/12, C07C 217/90, A61K 31/135, A61K 31/353, C07D 319/16, C07D 411/12
Метки: аритмии, новые, соединения, механизма, сильнодействующими, ингибиторами, лечении, являющиеся, ионов, обмена
Код ссылки
<a href="https://eas.patents.su/30-6580-novye-soedineniya-yavlyayushhiesya-silnodejjstvuyushhimi-ingibitorami-mehanizma-obmena-ionov-na-ca2-pri-lechenii-aritmii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения, являющиеся сильнодействующими ингибиторами механизма обмена ионов na+/ca2+ при лечении аритмии</a>