Способ выделения промежуточных соединений, которые могут использоваться для получения эсциталопрама
Номер патента: 11762
Опубликовано: 30.06.2009
Авторы: Ямамото Сого, Йосида Такаси, Петерсен Ханс, Такеда Тосихиро, Уеда Ясуйоси, Таока Наоаки, Ахмадиан Халех, Люнгсе Ларс Оле, Като Такахиса, Дансер Роберт
Формула / Реферат
1. Способ получения S- или R-энантиомера диола, имеющего формулу (II)
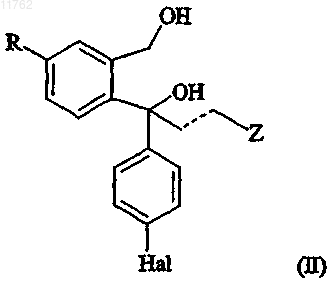
где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, где n равно 0-8, -OH, -CHO,
-CH2OH, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -CH3, -NHR5, -CHNOH, -COOR6, -CONR6R7, где R5 представляет собой водород или C1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
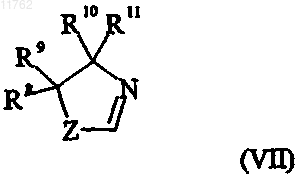
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбраны из водорода и С1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и C1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или
R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо, где переменная Z в формуле (II) представляет собой группу -CH2-N(R'R''), где R' и R'' представляют собой C1-6алкил или R' и R'' соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z в формуле (II) представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из
-СН2-L, -CH2-NO2, -MgHal, цианогруппы, альдегидной группы, -СН2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1,
-CH2-NHCH3, -CH2-NH2, -CO-N(CH3)2, CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из
C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно алкил замещен арильной или аралкильной
группами или R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно C1-6алкила, замещенного арилом или арилС1-6алкилом; R19 представляет собой водород или метил и А1, А2 и А3 выбраны из О и S; L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет собой C1-6алкил,
С2-6алкенил, С2-6алкинил или необязательно C1-6алкил, замещенный арилом или арилС1-6алкилом, пунктирная линия представляет собой двойную или одинарную связь и Hal представляет собой галоген,
или его соли и/или противоположного энантиомера ацилированного диола, имеющего формулу
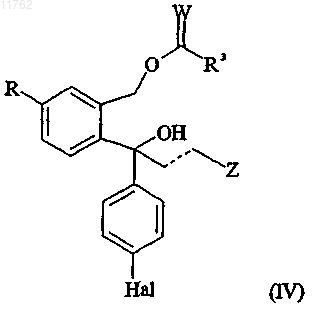
где R, Z, пунктирная линия и Hal имеют значения, определенные выше;
W представляет собой О или S и
R3 представляет собой -Y-R1, где R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино,
ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила, C2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино, и
Y представляет собой связь, О, S или NH,
или его соли, заключающийся в том, что:
а) рацемическое соединение формулы
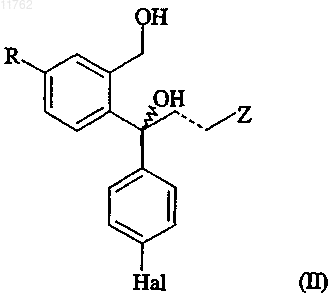
где R, Z, пунктирная линия и Hal имеют значения, определенные выше,
подвергают селективному ферментативному ацилированию с использованием ацилирующего агента, имеющего формулу
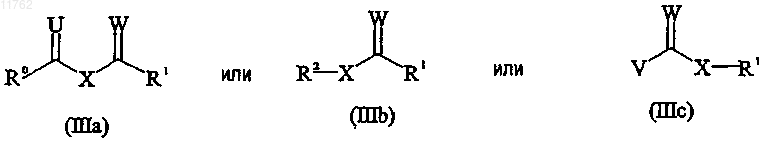
или изоцианата, имеющего формулу R1-N=C=O, или изотиоцианата, имеющего формулу R1-N=C=S;
где X представляет собой О или S;
W представляет собой О или S;
U представляет собой О или S;
V представляет собой галоген;
R0 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси,
С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино, ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R0 представляет собой арил, где любая из арильных и гетероарильных групп может быть необязательно замещена один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила, С2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино;
R1 имеет значения, определенные для R0;
R2 имеет значения, определенные для R0, или R2 выбран из сукцинимидила, гидроксибензотриазола и пентафторфенола;
или R0 и R1 вместе образуют цепь из 3-5 атомов углерода;
при условии, что W и U не являются S, когда X представляет собой S; с образованием смеси исходного соединения формулы (II) или в R-, или в S-форме и противоположного энантиомера соединения, имеющего формулу
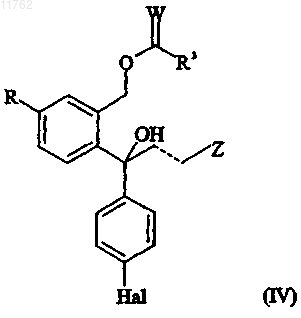
где R, W, Hal, R3, пунктирная линия и Z имеют значения, определенные выше; или
b) рацемическое соединение формулы
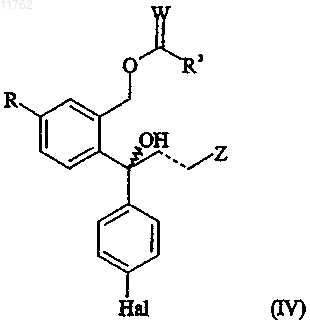
где R, Z, W, Hal, пунктирная линия и R3 имеют значения, определенные выше; подвергают селективному ферментативному деацилированию с получением смеси деацилированного соединения формулы
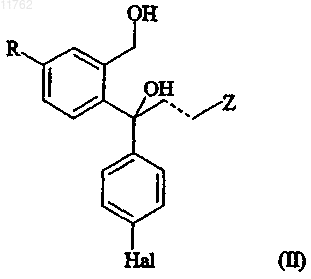
где R, Hal, пунктирная линия и Z имеют значения, определенные выше, или в R-, или в S-форме и ацилированного исходного соединения формулы (IV) в виде противоположного энантиомера; необязательно с последующим, в любом порядке, выделением S- или R-энантиомера соединения формулы (II) и/или противоположного энантиомера соединения формулы (IV),
или его соли.
2. Способ по п.1а).
3. Способ по п.1b).
4. Способ по любому из пп.1, 2, где продуктом ацилирования соединения формулы (II) является смесь, содержащая соединение формулы (II) в S-форме и соединение формулы (IV) в R-форме.
5. Способ по любому из пп.1, 2, где продуктом ацилирования соединения формулы (II) являетёя смесь, содержащая соединение формулы (II) в R-форме и соединение формулы (IV) в S-форме.
6. Способ по любому из пп.1 или 3, где продуктом деацилирования соединения формулы (IV) является смесь, содержащая соединение формулы (IV) в S-форме и соединение формулы (II) в R-форме.
7. Способ по любому из пп.1 или 3, где продуктом деацилирования соединения формулы (IV) является смесь, содержащая соединение формулы (IV) в R-форме и соединение формулы (II) в S-форме.
8. Способ по любому из пп.1-7, где Hal представляет собой фтор и R представляет собой галоген или циано, предпочтительно R представляет собой циано.
9. Способ по любому из пп.1-8, где пунктирная линия представляет собой одинарную связь.
10. Способ по любому из пп.1-9, где Z представляет собой диметиламинометильную группу.
11. Способ по любому из пп.1, 2, 4, 5 и 8-10, где ацилирующим агентом является соединение, выбранное из соединений формул (IIIa), (IIIb) и (IIIc).
12. Способ по п.11, где ацилирующим агентом является соединение, выбранное из соединений формул (IIIa) и (IIIb).
13. Способ по п.12, где ацилирующим агентом является соединение формулы (IIIa).
14. Способ по п.12, где ацилирующим агентом является соединение формулы (IIIb).
15. Способ по п.11, где ацилирующим агентом является соединение формулы (IIIc).
16. Способ по любому из пп.11-13, где U представляет собой О.
17. Способ по любому из пп.11-16, где W представляет собой O.
18. Способ по любому из пп.11-17, где X представляет собой О.
19. Способ по любому из пп.11-18, где R0, R1 и R2 независимо выбраны из C1-4алкила, С2-4алкенила и С2-4алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4алкокси, С1-4алкилтио, гидрокси, галогена, амино, нитро, циано,
C1-4алкиламино и ди(C1-4алкил)амино, или R2 представляет собой уходящую группу, такую как сукцинимидил, HOBt и pfp, или R0 и R1 вместе образуют цепь из 3-5 атомов углерода.
20. Способ по п.19, где R0, R1 и R2 независимо выбраны из C1-3алкила, С2-3алкенила и С2-3алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3алкокси, C1-3алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3алкиламино и
ди(С1-3алкил)амино.
21. Способ по п.20, где R0 и R1 представляют собой C1-3алкил и R2 представляет собой C1-3алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С2-3алкенил.
22. Способ по п.13, где R0 и R1 независимо выбраны из C1-4алкила, С2-4алкенила и С2-4алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4алкокси, C1-4алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4алкиламино и
ди(С1-4алкил)амино.
23. Способ по п.22, где R0 и R1 независимо выбраны из C1-3алкила, С2-3алкенила или С2-3алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3алкокси, С1-3алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3алкиламино и
ди(С1-3алкил)амино.
24. Способ по п.22, где R0 и R1 представляют собой C1-4алкил.
25. Способ по п.24, где R0 и R1 представляют собой C1-3алкил, например метил, этил или пропил, предпочтительно пропил.
26. Способ по п.14, где R1 и R2 независимо выбраны из C1-4алкила, С2-4алкенила и С2-4алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4алкокси, C1-6алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4алкиламино и
ди(С1-4алкил)амино, или R2 представляет собой уходящую группу, такую как сукцинимидил, HOBt и pfp.
27. Способ по п.26, где R1 выбран из C1-3алкила, C2-3алкенила или С2-3алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3алкокси, C1-3алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3алкиламино и ди(C1-3алкил)амино, и R2 представляет собой C1-4алкил, замещенный один или несколько раз галогеном, или R2 представляет собой
С2-4алкенил.
28. Способ по п.27, где R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из
C1-3алкокси, C1-3алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3алкиламино и
ди(C1-3алкил)амино, и R2 представляет собой C1-3алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С2-3алкенил.
29. Способ по п.27, где R1 представляет собой C1-3алкил.
30. Способ по п.29, где R1 представляет собой C1-3алкил, такой как метил, этил или пропил, и
C1-3алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С2-3алкенил.
31. Способ по п.30, где R2 представляет собой винил.
32. Способ по п.31, где R1 представляет собой пропил.
33. Способ по п.15, где R1 представляет собой C1-4алкил, С2-4алкенил или С2-4алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из
C1-4алкокси, C1-4алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4алкиламино и
ди(C1-4алкил)амино.
34. Способ по п.33, где R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил, каждый из которых может быть необязательно замещен один или несколько раз C1-3алкокси, C1-3алкилтио, гидрокси, галогеном, амино, нитро, циано, C1-3алкиламино и ди(C1-3алкил)амино.
35. Способ по п.34, где R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил, предпочтительно R1 представляет собой C1-3алкил, такой как метил, этил или пропил, предпочтительно пропил.
36. Способ по любому из пп.1-2, 4-5 и 8-10, где ацилирующим агентом является изоцианат формулы R1-N=C=O или изотиоцианат формулы R1-N=C=S.
37. Способ по п.36, где ацилирующим агентом является изотиоцианат формулы R1-N=C=S.
38. Способ по п.36, где ацилирующим агентом является изоцианат формулы R1-N=C=O.
39. Способ по любому из пп.36-38, где R1 представляет собой C1-4алкил, С2-4алкенил или
С2-4алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4алкокси, C1-4алкилтио, гидрокси, галогена, амино, нитро, циано,
C1-4алкиламино и ди(С1-4алкил)амино.
40. Способ по п.39, где R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил, каждый из которых может быть необязательно замещен один или несколько раз C1-3алкокси, С1-3алкилтио, гидрокси, галогеном, амино, нитро, циаэю, C1-3алкиламино и ди(C1-3алкил)амино.
41. Способ по п.40, где R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил.
42. Способ по п.41, где R1 представляет собой метил, этил или пропил, предпочтительно пропил.
43. Способ по любому из пп.1, 3 и 6-10, где используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой О или S.
44. Способ по п.43, где используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой О.
45. Способ по п.43, где используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой S.
46. Способ по любому из пп.1, 3 и 6-10, где используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой связь.
47. Способ по любому из пп.1, 3 и 6-10, где используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой NH.
48. Способ по любому из пп.43-47, где R1 представляет собой C1-10алкил, С2-10алкенил или
С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано,
С1-10алкиламино и ди(С1-10алкил)амино.
49. Способ по п.48, где R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано.
50. Способ по п.49, где R1 представляет собой С1-10алкил.
51. Способ по любому из пп.1, 2, 4, 5 и 8-42, где ферментативное ацилирование проводят с гидролазой, такой как липаза, эстераза, ацилаза или протеаза.
52. Способ по любому из пп.1, 3, 6-10 и 40-50, где ферментативное деацилирование проводят с гидролазой, такой как липаза, эстераза, ацилаза или протеаза.
53. Способ по любому из пп.51, 52, где гидролазу используют в виде иммобилизованного фермента или фермента Cross-Linked Enzyme Crystal (CLEC).
54. Способ по любому из пп.51-53, где используемый фермент выбирают из Pseudomonas sp. липопротеиновой липазы, липазы В Candida antartica и липазы Thermomyces lanuginosus или мутанта или варианта данных ферментов, где простые аминокислоты удаляют или заменяют другими аминокислотами, и последовательность аминокислоты варианта или мутанта более чем на 60% идентична, предпочтительно более чем на 80% идентична вышеупомянутым ферментам.
55. Способ по любому из пп.51-54, где ферментом является Pseudomonas sp. липопротеиновая липаза или мутант или вариант Pseudomonas sp. липопротеиновой липазы, где мутант или вариант более чем на 90% идентичен Pseudomonas sp. липопротеиновой липазе.
56. Способ по п.55, где используемым ферментом является Pseudomonas sp. липопротеиновая липаза.
57. Способ по любому из пп.51-54, где используемым ферментом является липаза В Candida antartica или мутант или вариант липазы В Candida antartica, где мутант или вариант более чем на 90% идентичен липазе В Candida antartica.
58. Способ по п.57, где ферментом является липаза В Candida antartica.
59. Способ по п.58, где ферментом является NovozymeТ435.
60. Способ по любому из пп.51-54, где ферментом является липаза Thermomyces lanuginosus или мутант или вариант липазы Thermomyces lanuginosus, где мутант или вариант более чем на 90% идентичен липазе Thermomyces lanuginosus.
61. Способ по п.60, где ферментом является липаза Thermomyces lanuginosus.
62. Способ по п.61, где ферментом является LipozymeФ TL IM.
63. Способ по любому из пп.1-62, где ферментативное ацилирование или ферментативное деацилирование осуществляют в присутствии органического основания или органической кислоты или их смеси.
64. Способ по п.63, где ферментативное ацилирование или ферментативное деацилирование осуществляют в присутствии органической кислоты.
65. Способ по п.64, где ферментативное ацилирование осуществляют в присутствии органической кислоты.
66. Способ по любому из пп.64, 65, где органической кислотой является ароматическая карбоновая кислота или алифатическая карбоновая кислота.
67. Способ по любому из пп.63-66, где органическая кислота выбрана из н-пропионовой кислоты, изопропионовой кислоты, н-масляной кислоты, изомасляной кислоты, изовалериановой кислоты,
2-этилмасляной кислоты, циклогексанкарбоновой кислоты, пивалиновой кислоты, бензойной кислоты,
п-толуиловой кислоты, салициловой кислоты и 3-фенилпропионовой кислоты.
68. Способ по п.67, где в качестве органической кислоты используют пивалиновую кислоту.
69. S- или R-энантиомер соединения, имеющего формулу (IV)

где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, n равно 0-8, -ОН, -СНО, -СН2ОН,
-CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -CH3, -NHR5, -CHNOH, -COOR6, -CONR6R7, R5 представляет собой водород или С1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
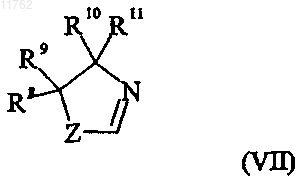
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбраны из водорода и C1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и С1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или
R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо,
где переменная Z в формуле (IV) представляет собой группу -CH2-N(R'R''), где R' и R'' представляют собой C1-6алкил или R' и R'' соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z в формуле (IV) представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из -СН2-L, -CH2-NO2, -MgHal, циано, альдегида, -CH2-O-Pg, -CH2-NPg1Pg2,
-CH2-NMePg1, -CH2-NHCH3, -CH2-NH2, -CO-N(CH3)2, -CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно алкил замещен арильной или аралкильной группами или R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно C1-6алкила, замещенного арилом или арилС1-6алкилом, R19 представляет собой водород шыш метил и А1, А2 и А3 выбраны из О и S;
L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет
собой C1-6алкил, С2-6алкенил, С2-6алкинил или необязательно C1-6алкил, замещенный арилом или
арилС1-6алкилом;
Hal представляет собой галоген;
W представляет собой О или S;
пунктирная линия представляет собой двойную или одинарную связь;
R3 представляет собой -Y-R1, где R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино,
ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила, С2-10алкинила, C1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино, и Y представляет собой связь, О, S или NH,
или его соль.
70. Энантиомер по п.69, где Hal представляет собой фтор, R представляет собой галоген или циано, предпочтительно R представляет собой циано.
71. Энантиомер по любому из пп.69, 70, в котором пунктирная линия представляет собой одинарную связь.
72. Энантиомер по любому из пп.70, 71, в котором Z представляет собой диметиламинометил.
73. Энантиомер по любому из пп.69-72, в котором Y представляет собой О или S.
74. Энантиомер по п.73, в котором Y представляет собой О.
75. Энантиомер по п.73, в котором Y представляет собой S.
76. Энантиомер по любому из пп.69-72, в котором Y представляет собой связь.
77. Энантиомер по любому из пп.69-72, в котором Y представляет собой NH.
78. Энантиомер по любому из пп.69-77, в котором R1 представляет собой C1-4алкил, С2-4алкенил или С2-4алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-4алкокси, С1-4алкилтио, гидрокси, галогена, амино, нитро, циано,
C1-6алкиламино и ди(C1-4алкил)амино.
79. Энантиомер по п.78, в котором R1 представляет собой C1-3алкил, С2-3алкенил или С2-3алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3алкокси, C1-3алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3алкиламино и
ди(С1-3алкил)амино.
80. Энантиомер по п.79, в котором R1 представляет собой C1-3алкил.
81. Энантиомер по любому из пп.69-77, в котором R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано,
C1-6алкиламино и ди(С1-10алкил)амино.
82. Энантиомер по п.81, в котором R1 представляет собой C1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано.
83. Энантиомер по п.82, в котором R1 представляет собой C1-10алкил, предпочтительно неразветвленный С1-10алкил.
84. Способ выделения и очистки соединения, имеющего формулу
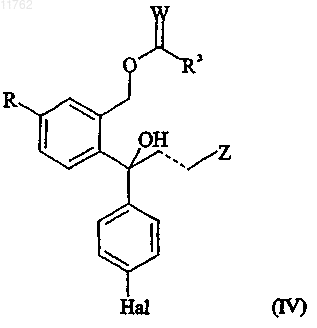
где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, где n равно 0-8, -ОН, -СНО,
-СН2ОН, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -CH3, -NHR5, -CHNOH, -COOR6, -CONR6R7, где R5 представляет собой водород или C1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
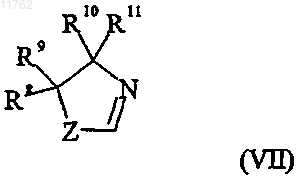
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбраны из водорода и С1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и C1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или
R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо;
пунктирная линия представляет собой двойную или одинарную связь;
Hal представляет собой галоген,
где переменная Z в формуле (IV) представляет собой -CH2-N(R'R''), где R' и R'' представляют собой C1-6алкил или R' и R'' соединены друг с другом с образованием циклической структуры, включающей
N-атом, к которому они присоединены, или Z в формуле (IV) представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из -СН2-L, -CH2-NO2, -MgHal, циано, альдегида, -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CH2-NHCH3, -CH2-NH2, -CO-N(CH3)2, -CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из
С1-6алкила, С2-6алкенила, С2-6алкинила и необязательно алкил замещен арильной или аралкильной группами и R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно C1-6алкила, замещенного арилом или
арилC1-6алкилом, R19 представляет собой водород или метил и А1, А2 и А3 выбраны из О и S;
L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет собой C1-6алкил, С2-6алкенил, С2-6алкинил или необязательно C1-6алкил, замещенный арилом или
арилС1-6алкилом;
W представляет собой О или S и
R3 представляет собой -Y-R1, где Y представляет собой связь, О, S или NH, R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино, ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет сосющ арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила,
С2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино,
или его соли,
и/или диола формулы
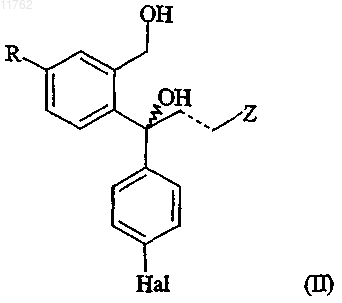
где R, Z, Hal и пунктирная линия имеют значения, определенные выше, или его соли из смеси, содержащей соединение формулы (IV) и диол формулы (II), который включает:
a) обработку указанной смеси, содержащей соединение формулы (IV) и диол формулы (II) в смеси воды и органического растворителя в присутствии кислоты;
b) отделение водной фазы, содержащей диол формулы (II) в виде соли указанной кислоты, от органической фазы с получением органической фазы, содержащей соединение формулы (IV) в виде соли указанной кислоты; и
необязательно выделение соединения формулы (II) в виде основания или его соли и
необязательно выделение соединения формулы (IV) в виде основания или его соли.
85. Способ по п.84, где S-энантиомер диола формулы (II) отделяют от R-энантиомера ацильного производного формулы (IV).
86. Способ по п.84, где S-энантиомер ацильного производного формулы (IV) отделяют от
R-энантиомера диола формулы (II).
87. Способ по любому из пп.84-86, где смесь R- или S-энантиомера ацильного производного формулы (IV) и противоположного энантиомера диола формулы (II), используемую на стадии а), получают согласно способу по пп.1-62.
88. Способ выделения и очистки ацильного производного, имеющего формулу

где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, где n равно 0-8, -ОН, -СНО,
-СН2ОН, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -СН3, -NHR5, -CHNOH, -COOR6, -CONR6R7, где R5 представляет собой водород или С1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
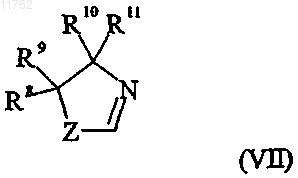
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбран из водорода и C1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и С1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо;
Hal представляет собой галоген;
пунктирная линия представляет собой двойную или одинарную связь, где переменная Z в формуле (IV) представляет собой -СН2-N(R'R''), где R' и R'' представляют собой C1-6алкил или R' и R'' соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z в формуле (IV) представляет собой группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из -CH2-L, -CH2-NO2, -MgHal, циано, альдегида,
-CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CH2-NHCH3, -CH2-NH2, -CO-N(CH3)2, CH(A1R12)(A1R13),
-(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из C1-6алкила, С2-6алкенила, С2-6алкинила, и необязательно алкил замещен арильной или аралкильной группами, и R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно
C1-6алкила, замещенного арилом или арилС1-6алкилом, R19 представляет собой водород или метил и А1, А2 и А3 выбраны из О и S;
L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет
собой C1-6алкил, С2-6алкенил, С2-6алкинил или необязательно C1-6алкил, замещенный арилом или
арилС1-6алкилом;
W представляет собой О или S и
R3 представляет собой -Y-R1, где Y представляет собой связь, О, S или NH и R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, C1-10алкиламино, ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила,
С2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино,
или его соли,
и/или диола формулы
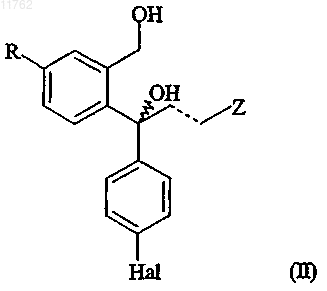
где R, Hal, Z и пунктирная линия имеют значения, определенные выше, из смеси, содержащей ацильное производное формулы (IV) и диол формулы (II), который включает:
a) обработку смеси, содержащей ацильное производное формулы (IV) и диол формулы (II) в смеси воды, протонного органического растворителя и неполярного органического растворителя;
b) отделение водной фазы, содержащей диол формулы (II), от органической фазы с получением органической фазы, содержащей ацильное производное формулы (IV); и
необязательно выделение диола формулы (II) и/или соединения формулы (IV) из водной/органической фазы и необязательно преобразование соединения формулы (II) и/или (IV) в его соль.
89. Способ по п.88, где S-энантиомер диола формулы (II) отделяют от R-энантиомера ацильного производного формулы (IV).
90. Способ по п.88, где S-энантиомер ацильного производного формулы (IV) отделяют от
R-энантиомера диола формулы (II).
91. Способ по любому из пп.88-90, где смесь R- или S-энантиомера соединения формулы (IV) и противоположного соединения формулы (II), используемую на стадии а), получают согласно способу по пп.1-62.
92. Способ получения эсциталопрама, имеющего формулу
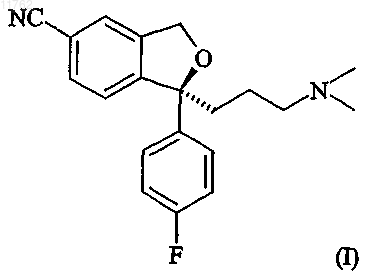
или его фармацевтически приемлемой соли,
включающий получение S-энантиомера диола, имеющего формулу
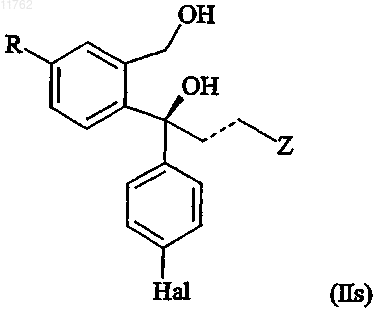
где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, где n равно 0-8, -ОН, -СНО,
-СН2ОН, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -CH3, -NHR5, -CHNOH, -COOR6, -CONR6R7, где R5 представляет собой водород или C1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
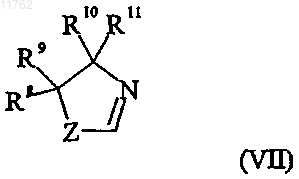
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбран из водорода и C1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и C1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или
R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо;
пунктирная линия представляет собой двойную или одинарную связь,
где переменная Z в формуле (IIs) представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из
-CH2-L, -CH2-NO2, -MgHal, циано, альдегида, -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CH2-NHCH3,
-CH2-NH2, -CO-N(CH3)2, -CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из C1-6алкила,
С2-6алкенила, С2-6алкинила и необязательно C1-6алкил замещен арильной или аралкильной группами и R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из С1-6алкила, С2-6алкенила, C1-6алкинила и необязательно C1-6алкила, замещенного арилом или арилС1-6алкилом, R19 представляет собой водород или метил и А1, А2 и А3 выбраны из О и S;
L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет
собой С1-6алкил, С2-6алкенил, С2-6алкинил или необязательно C1-6алкил, замещенный арилом или
арилС1-6алкилом; и
Hal представляет собой галоген,
или его соли или S-энантиомера ацилированного диола, имеющего формулу
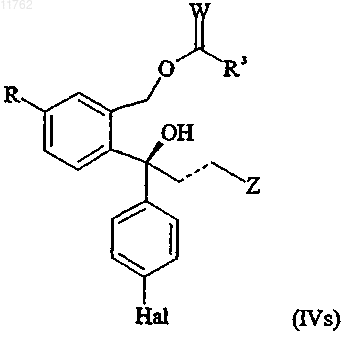
где R, Z, пунктирная линия и Hal имеют значения, определенные выше;
W представляет собой О или S и
R3 представляет собой -Y-R1, где R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино,
ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила, C2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино, и Y представляет собой связь, О, S или NH,
или его соли, способом, описанным в любом из пп.1-62, необязательно с последующим, в любом порядке, преобразованием группы R в цианогруппу, преобразованием группы Z в диметиламинометильную группу, восстановлением двойной связи, представленной пунктирной линией, в одинарную связь и/или преобразованием группы Hal во фторгруппу и затем замыканием кольца в основных условиях
S-энантиомера формулы (IIs) или (IVs) или его лабильного сложноэфирного производного с получением соединения формулы
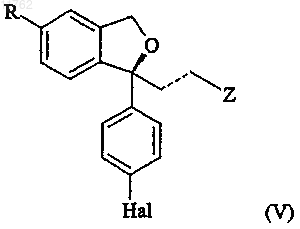
с последующим, в любом порядке, если R не является циано, преобразованием группы R в цианогруппу, если Z не является диметиламинометилом, преобразованием группы Z в диметиламинометильную группу, если пунктирная линия представляет собой двойную связь, восстановлением до одинарной связи и, если Hal не является фтором, последующим преобразованием Hal во фторгруппу, с последующим выделением эсциталопрама или его фармацевтически приемлемой соли.
93. Способ по п.92, где R- или S-энантиомер соединения формулы (II) и противоположный энантиомер соединения формулы (IV), полученный ферментативным ацилированием, отделяют друг от друга согласно способу выделения и очистки по любому из пп.84-87.
94. Способ по п.92, где R- или S-энантиомер соединения формулы (II) и противоположный энантиомер соединения формулы (IV), полученный ферментативным ацилированием, отделяют друг от друга согласно способу выделения и очистки по любому из пп.88-91.
95. Способ получения рацемического циталопрама и/или эсциталопрама или его фармацевтически приемлемой соли, включающий получение R-энантиомера диола, имеющего формулу
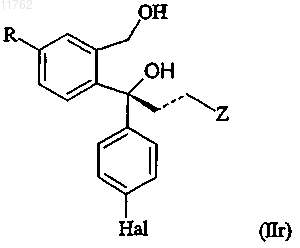
где R представляет собой циано или группу, которая может быть преобразована в цианогруппу, где такая группа выбрана из хлора, брома, йода, фтора, CF3-(CF2)n-SO2-O-, где n равно 0-8, -OH, -CHO,
-CH2OH, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -СН3, -NHR5, -CHNOH, -COOR6, -CONR6R7, где R5 представляет собой водород или C1-6алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6алкилом, арилС1-6алкилом или арилом,
и группа формулы (VII)
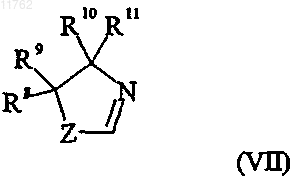
где переменная Z в формуле (VII) представляет собой О или S;
R8 и R9, каждый независимо, выбран из водорода и C1-6алкила или R8 и R9 вместе образуют
С2-5алкиленовую цепь, образуя тем самым спирокольцо;
R10 выбран из водорода и C1-6алкила;
R11 выбран из водорода, C1-6алкила, карбоксигруппы или группы ее предшественника или
R10 и R11 вместе образуют С2-5алкиленовую цепь, образуя тем самым спирокольцо;
пунктирная линия представляет собой двойную или одинарную связь,
где переменная Z в формуле (IIr) представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу, где такая группа выбрана из
-CH2-L, -CH2-NO2, -MgHal, циано, альдегида, -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CH2-NHCH3,
-CH2-NH2, -CO-N(CH3)2, CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2, -CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу фыя спиртовой группы, Pg1 и Pg2 представляют собой защитные группы для аминогруппы, R12 и R13 независимо выбраны из C1-6алкила,
С2-6алкенила, С2-6алкинила и необязательно алкил замещен арильной или аралкильной группами и R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбран из C1-6алкила, С2-6алкенила, С2-6алкинила и необязательно C1-6алкила, замещенного арилом или арилС1-6алкилом, R19 представляет собой водород или метил и А1, А2 и А3 выбраны из О и S;
L представляет собой уходящую группу, такую как галоген или -O-SO2-A, где А представляет
собой C1-6алкил, С2-6алкенил, С2-6алкинил или необязательно С1-6алкил, замещенный арилом или
арилС1-6алкилом; и
Hal представляет собой галоген,
или его соли или R-энантиомера ацилированного диола, имеющего формулу
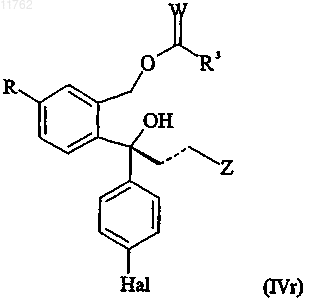
где R, Z, пунктирная линия и Hal имеют значения, определенные выше;
W представляет собой О или S и
R3 представляет собой -Y-R1, где R1 представляет собой С1-10алкил, С2-10алкенил или С2-10алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино,
ди(С1-10алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любые из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С1-10алкила, С2-10алкенила, С2-10алкинила, С1-10алкокси, С1-10алкилтио, гидрокси, галогена, амино, нитро, циано, С1-10алкиламино и ди(С1-10алкил)амино, и Y представляет собой связь, О, S или NH,
или его соли способом по любому из пп.1-62, необязательно с последующим, в любом порядке, преобразованием группы R в цианогруппу, восстановлением двойной связи, представленной пунктирной линией, до одинарной связи, преобразованием группы Z в диметиламинометильную группу и/или преобразованием группы Hal во фторгруппу и затем замыканием кольца в кислых условиях R-энантиомера формулы (IIr) или (IVs) с получением смеси S-энантиомера соединения формулы
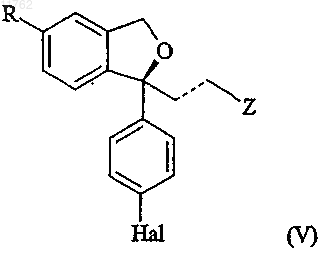
и небольшого количества соответствующего R-энантиомера, с последующим, в любом порядке, если R не является циано, преобразованием группы R в цианогруппу, если Z не является диметиламинометилом, преобразованием группы Z в диметиламинометильную группу, если пунктирная линия представляет собой двойную связь, восстановлением до одинарной связи и, если Hal не является фтором, преобразованием Hal во фторгрупп, с последующим выделением эсциталопрама и/или рацемического циталопрама или его фармацевтически приемлемой соли.
96. Способ по п.95, где рацемический циталопрам отделяют осаждением рацемического циталопрамного свободного основания или его соли и эсциталопрам выделяют из маточной жидкости от осаждения.
97. Способ по п.95, где R- или S-энантиомер соединения формулы (II) и противоположный энантиомер соединения формулы (IV), полученный ферментативным ацилированием, отделяют друг от друга с помощью способа выделения и очистки по любому из пп.84-87.
98. Способ по п.95, где R- или S-энантиомер соединения формулы (II) и противоположный энантиомерсоединения формулы (IV), полученный ферментативным ацилированием, отделяют друг от друга с помощью способа выделения и очистки по любому из пп.88-91.
Текст
011762 Настоящее изобретение относится к новому способу получения оптически активных промежуточных соединений, которые могут использоваться для получения эсциталопрама, включающему селективное ферментативное ацилирование или деацилирование. Предпосылки изобретения Циталопрам является хорошо известным антидепрессантным лекарственным средством, которое в настоящее время находится в продаже уже в течение нескольких лет. Он является селективным центрально действующим ингибитором повторного захвата серотонина (5-гидрокситриптамин, 5-НТ), обладающим, соответственно, антидепрессантной активностью. Циталопрам был впервые описан в DE 2657013, соответствующем патенту США 4136193. В данной патентной публикации описан, наряду с другим, способ получения циталопрама из соответствующего 5-бромпроизводного путем взаимодействия с цианидом меди в подходящем растворителе и путем алкилирования 5-бромфталана. В патенте США 4943590, соответствующем ЕР-В 1-347066, описано два способа получения эсциталопрама (S-энантиомер циталопрама). В обоих способах в качестве исходного материала используется рацемический диол, имеющий формулу По первому способу диол формулы (I) вводится в реакцию с энантиомерно чистым кислотным производным, таким как (+) или (-)метокситрифторметилфенилацетилхлорид с образованием смеси диастереомерных сложных эфиров, которые разделяются с помощью ВЭЖХ или фракционной кристаллизации, после чего сложный эфир с правильной стереохимией энантиоселективно преобразуется в эсциталопрам. По второму способу диол формулы (II) разделяется на энантиомеры с помощью стереоселективной кристаллизации с энантиомерно чистой кислотой, такой как (+)-ди-п-толуоилвинная кислота, после чегоS-энантиомер диола формулы (А) энантиоселективно преобразуется в эсциталопрам. Эсциталопрам в настоящее время разработан как антидепрессант. Вследствие этого существует потребность в улучшенном способе получения эсциталопрама. В настоящее время было найдено, что S-энантиомер диола формулы (I), а также его ацилированные производные могут быть получены с помощью селективного ферментативного ацилирования первичной гидроксильной группы в рацемическом диоле с получением S-диола или его ацилированного производного с высокой оптической чистотой и, далее, что полученные энантиомеры могут быть разделены с помощью ряда операций выделения и очистки. Изобретение Соответственно, настоящее изобретение относится к новому способу получения S- или где R представляет собой циано или группу, которая может быть преобразована в цианогруппу;Z представляет собой группу -CH2-N(R'R), в которой R' и R представляют собой C1-6 алкил, или R' и R соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z представляет собой группу, которая может быть преобразована в диметиламинометильную группу, пунктирная связь представляет собой двойную или одинарную связь и Hal представляет собой галоген,или его соли, и/или противоположного энантиомера ацилированного диола, имеющего формулуR3 представляет собой -Y-R1, где R1 представляет собой C1-10 алкил, С 2-10 алкенил или С 2-10 алкинил,каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино,ди(С 1-10 алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любая из арильных и гетероарильных групп может быть необязательно замещена один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила, С 2-10 алкинила, С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино и ди(С 1-10 алкил)амино, и Y представляет собой связь, О, S или NH, или его соли, заключающийся в том, что: а) рацемическое соединение формулы где R, Z, пунктирная линия и Hal имеют значения, определенные выше, подвергают селективному ферментативному ацилированию с использованием ацилирующего агента, имеющего формулуV представляет собой галоген иR0 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси,С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-10 алкиламино, ди(С 1-10 алкил)амино, арила,арилокси, арилтио и гетероарила, или R0 представляет собой арил; где любая из арильных и гетероарильных групп, может быть необязательно замещена один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила, С 2-10 алкинила, С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро,циано, С 1-10 алкиламино и ди(С 1-10 алкил)амино;R2 имеет значения, определенные для R0, или R2 представляет собой подходящую удаляемую группу; или R0 и R1 вместе образуют цепь из 3-5 атомов углерода; при условии, что W и U не являются S, когда X представляет собой S; с образованием смеси исходного продукта формулы (II) либо в R-, либо в S-форме и противоположного энантиомера ацилированного диола, имеющего формулу где R, Z, W, Hal, пунктирная линия и R3 имеют значения, определенные выше,подвергают селективному ферментативному деацилированию с образованием смеси деацилированного соединения формулы где R, Hal, пунктирная линия и Z имеют значения, определенные выше, либо в R-, либо в S-форме и ацилированного исходного продукта формулы (IV) в виде противоположного энантиомера; необязательно с последующим, в любом порядке, выделением S- или R-энантиомера соединения формулы (II) и/или противоположного энантиомера соединения формулы (IV) или его соли. Изобретение относится также к способам отделения смесей энантиомера формулы (IV) от противоположного энантиомера формулы (II) и к R- и S-энантиомерам соединений формулы (IV), приведенной выше. Наконец, изобретение относится к способу получения эсциталопрама и рацемического циталопрама из энантиомеров соединения формулы (II), полученного с помощью селективного ферментативного ацилирования или деацилирования согласно изобретению, или энантиомеров оптически активного ацильного производного формулы (IV), полученного с помощью селективного ферментативного ацилирования или деацилирования согласно изобретению. Подробное описание изобретения Используемые здесь в отношении соединений формулы (II), (IV) и (V) термины "энантиомер","R-энантиомер, "S-энантиомер", "R-форма", "S-форма", "R-диол" и "S-диол" относятся к ориентации групп вокруг атома углерода, к которому присоединена 4-Hal-фенильная группа. Настоящее изобретение, таким образом, относится согласно одному воплощению к селективному ферментативному ацилированию, описанному выше, и согласно еще одному воплощению - к селективному ферментативному деацилированию, описанному выше. Селективное ферментативное ацилирование означает, что ферментативное ацилирование является предпочтительно эффективным для преобразования одного из энантиомеров соединения формулы (II),предпочтительно оставляя другой энантиомер соединения формулы (II) непреобразованным в реакционной смеси. Селективное ферментативное деацилирование означает, что ферментативное деацилирование является предпочтительно эффективным для преобразования одного из энантиомеров соединения формулы(IV), предпочтительно оставляя другой энантиомер соединения формулы (IV) непреобразованным в реакционной смеси.-3 011762 Селективное ацилирование согласно изобретению дает, таким образом, в результате смесь, содержащую предпочтительно соединение формулы (II) в S-форме и соединение формулы (IV) в R-форме, или оно может давать в результате смесь, содержащую предпочтительно соединение формулы (II) в R-форме и соединение формулы (IV) в S-форме. Аналогичным образом, селективное ферментативное деацилирование может давать в результате смесь, содержащую предпочтительно соединение формулы (IV) в S-форме и соединение формулы (II) вR-форме, или оно может давать в результате смесь, содержащую предпочтительно соединение формулы(IV) в R-форме и соединение формулы (II) в S-форме. Состав смеси, полученной после ацилирования или деацилирования согласно изобретению, зависит от используемой конкретной гидролазы и от условий, в которых осуществляется реакция. Характерной чертой ферментативного процесса ацилирования/деацилирования согласно изобретению является то, что преобразуется гораздо большая часть одного энантиомера, чем другого. Оптическая чистота диола формулы (II) и/или ацилированного соединения формулы (IV), полученного с помощью способа оптического расщепления согласно настоящему изобретению, составляет обычно по крайней мере 90% эи, предпочтительно по крайней мере 95% эи более предпочтительно по крайней мере 97% эи и наиболее предпочтительно по крайней мере 98% эи. Однако приемлемыми являются и более низкие величины оптической чистоты. Исходным соединением для ферментативного способа изобретения является рацемический диол формулы (II) или рацемическое ацильное производное формулы (IV). В предпочтительном воплощении изобретения R представляет собой галоген или циано, наиболее предпочтительно циано. Согласно следующему предпочтительному воплощению изобретения Hal представляет собой фтор. Согласно следующему воплощению изобретения пунктирная линия в формуле (II) и (IV) является одинарной связью. Согласно одному воплощению Z представляет собой диметиламинометил или группу, которая может быть преобразована в диметиламинометил. Согласно подходящему воплощению Z представляет собой диметиламинометил. Наиболее предпочтительно Hal представляет собой фтор, R представляет собой циано, пунктирная линия является одинарной связью и Z представляет собой диметиламинометил. В качестве ацилирующего агента, используемого для ферментативного ацилирования согласно изобретению, может быть предпочтительно использовано одно из соединений формул (IIIa), (IIIb) и (IIIc). Согласно еще одному воплощению ацилирующим агентом, используемым согласно изобретению,является любое из соединений формул (IIIa) и (IIIb). Согласно следующему воплощению изобретения используемым ацилирующим агентом является соединение формулы (IIIa). Согласно еще одному воплощению изобретения используемым ацилирующим агентом является соединение формулы (IIIb). Согласно еще одному воплощению изобретения используемым ацилирующим агентом является соединение формулы (IIIc). Когда ацилирующим агентом является соединение формулы (IIIc), U предпочтительно представляет собой О. Когда ацилирующим агентом является любое из указанных выше соединений, W предпочтительно представляет собой О. Когда ацилирующим агентом является любое из указанных выше соединений, X предпочтительно представляет собой О. Предпочтительными заместителями R0, R1 и R2 в любом из ацилирующих агентов (IIIa), (IIIb) иR0, R1 и R2 независимо выбраны из C1-6 алкила, С 2-6 алкенила и С 2-6 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-6 алкокси,C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-6 алкиламино и ди(C1-6 алкил)амино, или R2 представляет собой подходящую удаляемую группу, такую как сукцинимидил, HOBt и pfp, или R0 и R1 вместе образуют цепь из 3-5 атомов углерода, более предпочтительно R0, R1 и R2 независимо выбраны из С 1-4 алкила, С 2-4 алкенила и С 2-4 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси, С 1-4 алкилтио, гидрокси, галогена, амино,нитро, циано, C1-4 алкиламино и ди(C1-4 алкил)амино, или R2 представляет собой подходящую удаляемую группу, такую как сукцинимидил, HOBt и pfp, или R0 и R1 вместе образуют цепь из 3-5 атомов углерода,более предпочтительно R0, R1 и R2 независимо выбраны из C1-3 алкила, С 2-3 алкенила и С 2-3 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, C1-3 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3 алкиламино и ди(С 1-3 алкил)амино, даже более предпочтительно R0 и R1 представляют собой С 1-3 алкил, в частности неразветвленный C1-3 алкил, и R2 представляет собой C1-3 алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С 2-3 алкенил.-4 011762 Предпочтительными заместителями R0 и R1 в ацилирующих агентах формулы (IIIa), определенных выше в любом из воплощений, являются следующие:R0 и R1 независимо выбраны из C1-6 алкила, С 2-6 алкенила и С 2-6 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси,C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-6 алкиламино и ди(C1-6 алкил)амино, более предпочтительно R0 и R1 независимо выбраны из C1-4 алкила, С 2-4 алкенила и С 2-4 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси,С 1-4 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(C1-4 алкил)амино, предпочтительно R0 и R1 независимо выбраны из C1-3 алкила, С 2-3 алкенила и С 2-3 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси,С 1-3 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3 алкиламино и ди(C1-3 алкил)амино, более предпочтительно R0 и R1 независимо представляют собой C1-4 алкил и наиболее предпочтительно R0 и R1 представляют собой C1-3 алкил, в частности неразветвленный C1-3 алкил, предпочтительно пропил. Предпочтительными заместителями R1 и R2 в ацилирующих реагентах формулы (IIIb), определенной выше в любом из воплощений, являются следующие:R1 и R независимо выбраны из C1-6 алкила, С 2-6 алкенила и С 2-6 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси,C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-6 алкиламино и ди(C1-6 алкил)амино, или R2 представляет иную удаляемую группу, такую как сукцинимидил, HOBt и pfp, более предпочтительно R1 и R2 независимо выбраны из C1-4 алкила, С 2-4 алкенила и С 2-4 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-4 алкокси,С 1-4 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-4 алкиламино и ди(С 1-4 алкил)амино, или R2 представляет собой иную удаляемую группу, такую как сукцинимидил, HOBt и pfp, предпочтительно R1 выбран из C1-3 алкила, С 2-3 алкенила и С 2-3 алкинила, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, C1-3 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3 алкиламино и ди(C1-3 алкил)амино, и R2 представляет собой C1-4 алкил, замещенный один или несколько раз галогеном, R2 представляет собой С 2-4 алкенил, или R2 представляет собой иную удаляемую группу, такую как сукцинимидил, HOBt и pfp, более предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-3 алкокси, C1-3 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-3 алкиламино и ди(С 1-3 алкил)амино, и R2 представляет собой C1-3 алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С 2-3 алкенил и более предпочтительно R1 представляет собой C1-3 алкил, и R2 представляет собой C1-3 алкил, замещенный один или несколько раз галогеном, или R2 представляет собой С 2-3 алкенил и более, предпочтительно R1 представляет собой C1-3 алкил, в частности неразветвленный C1-3 алкил, такой как метил, этил или пропил, и R2 представляет собой С 2-3 алкенил;R2, означающий C1-3 алкил, замещенный один или несколько раз галогеном, представляет собой подходящую удаляемую группу, включающую группы, такие как 2,2,2-трихлорэтил и 2,2,2-трифторэтил,в частности 2,2,2-трифторэтил. В конкретном воплощении изобретения ацилирующим агентом формулы (IIIb), приведенной выше,является соединение, в котором R2 представляет собой винил. Согласно еще одному конкретному воплощению изобретения ацилирующим агентом формулы(IIIb), приведенной выше, является соединение, где R1 представляет собой пропил. Данное конкретное воплощение изобретения охватывает предпочтительный ацилирующий агент изобретения, а именно, винилбутират. Согласно следующему воплощению изобретения ацилирующим агентом является соединение формулы (IIIc). Предпочтительными значениями заместителя R1 в соединении формулы (IIIc), определенной выше в любом из воплощений, являются следующие:R1 представляет собой C1-6 алкил, С 2-6 алкенил и С 2-6 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси, C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(C1-6 алкил)амино, более предпочтительноR1 представляет собой С 1-4 алкил, С 2-4 алкенил и С 2-4 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси, C1-4 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(С 1-4 алкил)амино, предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил и С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз C1-3 алкокси, С 1-3 алкилтио, гидрокси, галогеном, амино, нитро, циано, C11 3 алкиламино и ди(C1-3 алкил)амино, более предпочтительно R представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, более предпочтительно R1 представляет собой C1-3 алкил, в частности неразветвленныйV предпочтительно представляет собой хлор.-5 011762 Ацилирующим агентом, используемым согласно изобретению, может быть также изоцианат формулы R1-N=C=O или изотиоцианат формулы R1-N=C=S. Таким образом, в следующем воплощении изобретения ацилирующим агентом является изотиоцианат формулы R1-N=C=S. Согласно еще одному воплощению изобретения ацилирующим агентом является изоцианат формулы R1-N=C-O. Предпочтительными заместителями R1 в изоцианате и изотиоцианате, определенными выше в любом из воплощений, являются следующие:R1 представляет собой C1-6 алкил, С 2-6 алкенил или С 2-6 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси, C1-6 алкилтио,гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(C1-6 алкил)амино, более предпочтительноR1 представляет собой C1-4 алкил, С 2-4 алкенил или С 2-4 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси, С 1-4 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(C1-4 алкил)амино, предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, C1-3 алкилтио, гидрокси,галогена, амино, нитро, циано, C1-3 алкиламино и ди(С 1-3 алкил)амино, более предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил и более предпочтительно R1 представляет собойC1-3 алкил, в частности неразветвленный C1-3 алкил, такой как метил, этил или пропил. Изобретение охватывает также способ селективного ферментативного деацилирования рацемического соединения формулы (IV), определенной выше. Предпочтительным используемым рацемическим соединением формулы (IV) является соединение,в котором Y представляет собой О или S. Согласно дальнейшему воплощению используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой О. В еще одном воплощении изобретения используемым рацемическим соединением формулы (IV) является соединение, в котором Y представляет собой S. В еще одном воплощении изобретения используемым рацемическим соединением формулы (IV) является соединение, в котором У представляет собой связь. Предпочтительным заместителем R1 в рацемическом соединении (IV), определенном выше в любом из воплощений, является следующий: С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена,амино, нитро, циано, С 1-10 алкиламино и ди(С 1-10 алкил)амино, более предпочтительно R1 представляет собой C1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано, предпочтительно R1 представляет собой С 1-10 алкил, предпочтительно неразветвленный С 1-10 алкил и более предпочтительно R1 представляет собой неразветвленный C4-10 алкил. Согласно изобретению селективное ферментативное ацилирование осуществляют в условиях, по существу подавляющих гидролиз. Гидролиз, который является обратной реакцией реакции ацилирования, происходит, если в реакционной системе присутствует вода. Таким образом, селективное ферментативное ацилирование предпочтительно осуществляют в свободном от воды органическом растворителе или почти безводном органическом растворителе (ферменты обычно требуют присутствия некоторого количества воды, чтобы быть активными). Примеры ниже иллюстрируют, как добавление воды влияет на преобразование. Процентное содержание воды, допустимое в конкретной реакционной системе, может быть определено квалифицированным специалистом в данной области. Органический растворитель, который может использоваться для реакции ацилирования, не является особенно важным до тех пор, пока он не дезактивирует используемый фермент. Подходящие растворители включают углеводороды, такие как гексан, гептан, бензол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 1,4-диоксан, трет-бутилметиловый эфир и диметоксиэтан; кетоны, такие как ацетон, диэтилкетон, бутанон и метилэтилкетон; сложные эфиры, такие как метилацетат, этилацетат, этилбутират, винилбутират и этилбензоат; галогенированные углеводороды, такие как метиленхлорид, хлороформ и 1,1,1-трихлорэтан; вторичные и третичные спирты, такие как трет-бутанол; азотсодержащие растворители, такие как диметилформамид, ацетамид, формамид, ацетонитрил и пропионитрил; и апротонные полярные растворители, такие как диметилсульфоксид,N-метилпирролидон и триамид гексаметилфосфора. Из них предпочтительными являются углеводороды, такие как гексан, гептан, бензол и толуол, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, 1,4-диоксан и трет-бутилметиловый эфир, и сложные эфиры, такие как винилбутират. Для одних ферментов наиболее предпочтительными растворителями могут быть ароматические углеводороды, такие как бензол или толуол, и простые эфиры, наиболее предпочтительно толуол, а для другого фермента наиболее предпочтительными раствори-6 011762 телями могут быть простые эфиры, такие как 1,4-диоксан (см. примеры ниже). Указанные выше растворители могут использоваться сами по себе или в сочетании двух или более растворителей. Концентрация рацемического диола формулы (II) и ацилирующего агента не должна быть слишком высокой, так как высокая концентрация реагентов в растворителе может привести к неселективному ацилированию рацемического диола. Предпочтительно концентрация рацемического диола и ацилирующего реагента составляет, каждая, ниже 1,0 М, более предпочтительно ниже 0,5 М, даже более предпочтительно ниже 0,2 М или даже еще более предпочтительно ниже 0,1 М. Квалифицированный специалист в данной области сможет определить оптимальную концентрацию рацемического диола и ацилирующего агента. Селективное ферментативное деацилирование предпочтительно осуществляют в воде или в смеси воды и органического растворителя предпочтительно в присутствии буфера. Органический растворитель, который может использоваться в реакции, не особенно важен до тех пор, пока он не дезактивирует используемый фермент. Подходящими органическими растворителями являются растворители, смешиваемые с водой, такие как спирты, ацетонитрил, ДМФ, ДМСО, диоксан,ДМЭ и диглим. Квалифицированный специалист может определить другие подходящие растворители. Квалифицированный специалист в данной области может определить оптимальную концентрацию рацемического соединения формулы (IV), используемого в реакции. Стереоселективность используемого фермента может быть увеличена путем осуществления ацилирования или деацилирования в присутствии органической кислоты и/или органического основания. Соответственно, настоящее изобретение относится также к способу, по которому ферментативное ацилирование или ферментативное деацилирование осуществляют в присутствии органического основания или органической кислоты или их смеси. В конкретном воплощении изобретение относится к способу, по которому ферментативное ацилирование или ферментативное деацилирование осуществляют в присутствии органической кислоты предпочтительно органической карбоновой кислоты. Согласно дальнейшему воплощению, ферментативное ацилирование осуществляют в присутствии органической кислоты, предпочтительно органической карбоновой кислоты. Указанной выше органической кислотой предпочтительно является ароматическая карбоновая кислота или алифатическая карбоновая кислота. В качестве органической кислоты, которая может использоваться в реакции, могут быть указаны алкилкарбоновые кислоты, циклоалкилкарбоновые кислоты, циклоалкилалкилкарбоновые кислоты, необязательно замещенные фенилалкилкарбоновые и необязательно замещенные фенилкарбоновые кислоты. Подходящими алифатическими карбоновыми кислотами являются карбоновые кислоты, такие как муравьиная, уксусная, пропионовая, н-масляная, изомасляная кислота, 2-этилмасляная кислота,н-валериановая, изовалериановая, пивалиновая (триметилуксусная), н-капроновая, изокапроновая, декановая, кротоновая, пальмитиновая, циклопентанкарбоновая, циклогексанкарбоновая кислота,фенилС 1-4 алкилкарбоновые кислоты, такие как 3-фенилпропионовая кислота, 4-фенилмасляная, щавелевая, малоновая и винная кислота. Подходящие ароматические карбоновые кислоты включают такие кислоты, как, например, бензойная, п-хлорбензойная, п-нитробензойная, п-метоксибензойная,п-толуиловая, о-толуиловая, м-толуиловая, нафтойная, фталевая и терефталевая кислота, салициловая и гидрокоричная кислота. Таким образом, согласно одному воплощению изобретения органическая кислота, используемая для улучшения стереоселективности фермента, выбрана из н-пропионовой, изопропионовой, н-масляной,изомасляной, изовалериановой, 2-этилмасляной, кротоновой, пальмитиновой, циклогексанкарбоновой,пивалиновой, бензойной и п-толуиловой кислоты, салициловой и 3-фенилпропионовой кислоты. Согласно следующему воплощению изобретения используемой карбоновой кислотой является пивалиновая кислота. Количество используемой органической кислоты особо не ограничивается, но молярное соотношение относительно субстрата составляет обычно 0,1-10, предпочтительно 1,0-3,0 и более предпочтительно 1,0-2,0. Альтернативно, для улучшения селективности фермента может быть использован третичный амин,или один или вместе с какой-либо из указанных выше органических кислот. В качестве подходящего органического основания могут быть указаны триэтиламин, пиридин, 4-диметиламинопиридин и предпочтительным является пиридин. Подходящими сочетаниями органической кислоты и органического основания являются, например, бензойная кислота и пиридин. Количество используемого третичного амина особо не ограничивается, и обычно молярное соотношение относительно субстрата составляет 0,5-3,0 и предпочтительно 0,5-2,0. Ферментативное ацилирование или деацилирование согласно изобретению осуществляют с использованием гидролазы, такой как липаза, эстераза, ацилаза или протеаза. Таким образом, согласно одному воплощению изобретения ферментативное ацилирование проводят с гидролазой, такой как липаза, эстераза, ацилаза или протеаза. Ферментами, используемыми согласно изобретению, являются такие ферменты, которые способны к проведению R-селективного ацилирова-7 011762 ния или Si-селективного ацилирования первичной гидроксигруппы в рацемическом соединении формулы (II). Согласно еще одному воплощению изобретения ферментативное деацилирование проводят с гидролазой, такой как липаза, эстераза, ацилаза или протеаза. Ферментами, используемыми согласно изобретению, являются такие ферменты, которые способны к проведению R-селективного деацилирования или S-селективного деацилирования ацильной группы в рацемическом соединении формулы (IV). Как здесь используется, термин "гидролаза" и "фермент" или вообще, или в отношении к конкретному ферменту означает не только фермент сам по себе, но также культивированные продукты, содержащие фермент, такие как культуральная жидкость, содержащая клеточное тело, или культивированное клеточное тело, и переработанный продукт культурального продукта (например, сырой или неочищенный экстракт, высушенные вымораживанием микроорганизмы или клетки, высушенные ацетоном микроорганизмы или клетки, измельченный продукт таких микроорганизмов или клеток, или аналогичные). Дополнительно, "фермент" или "гидролаза" могут быть иммобилизованы в виде самого фермента или в виде клеточного тела с помощью известных приемов, и может быть использован в иммобилизованном виде. Иммобилизация может быть осуществлена по способам, известным специалистам в данной области, которые включают в себя, например, связывание носителя, поперечное связывание, инкапсулирование и аналогичные. Таким образом, согласно одному воплощению изобретения гидролазу используют в виде иммобилизованного фермента или ферментов Cross-Linked Enzyme Crystal (CLEC) (поперечно-связанный ферментный кристалл). Было обнаружено, что ферментативное ацилирование согласно изобретению может быть осуществлено с использованием Novozyme 435, из Candida antartica, Lipozyme TL IM из Thermomyces lanuginosus или Lipoprotein Lipase (липопротеиновая липаза) pseudomonas sp. (выделенного из Pseudomonas cepacia и полученного из Fluka) и особенно хорошие результаты были получены, когда использовалисьNovozyme 435, из Candida antartica, или Lipoprotein Lipase pseudomonas sp. Таким образом, согласно одному воплощению изобретения используемым ферментом являетсяPseudomonas sp. липопротеиновая липаза, Candida antartica липаза В или Thermomyces lanuginosus липаза. Согласно еще одному воплощению изобретения используемым ферментом является Pseudomonassp. липопротеиновая липаза или Candida antartica липаза В. Как указано выше, использование одного из указанных выше ферментов согласно изобретению охватывает также использование культивированных продуктов, содержащих фермент, таких как культуральная жидкость, содержащая клеточные тела, или культивированные клеточные тела, переработанного продукта культивированного продукта и любых иммобилизованных форм этих ферментов/культивированных продуктов. Использование любого из конкретно указанных выше ферментов согласно изобретению охватывает также использование мутантов, вариантов или любых эквивалентов конкретно указанных выше ферментов, которые способны к проведению селективного ацилирования или деацилирования согласно изобретению. Их варианты или эквиваленты могут быть выделены из разнообразных штаммов Pseudomonas,Candida или Thermomyces, или любого другого источника, или они могут быть получены с помощью мутации ДНК, кодирующей указанные выше ферменты, ведущей к вариациям в аминокислотном составе фермента. Подходящими мутантами или вариантами указанных выше ферментов являются варианты и мутанты, в которых одни аминокислоты удалены или заменены другими аминокислотами, и подходящая аминокислотная последовательность варианта или мутанта является более чем на 60% идентичной,предпочтительно более чем на 80% или наиболее предпочтительно более чем на 90% идентичной вышеуказанным ферментам. Таким образом, согласно одному воплощению изобретения используемым ферментом являетсяPseudomonas sp. липопротеиновая липаза или ее мутант или вариант. Предпочтительно используетсяPseudomonas sp. липопротеиновая липаза. Согласно еще одному воплощению изобретения используемым ферментом является Candida antartica липаза В или ее мутант или вариант. Предпочтительно используют Candida antartica липазу В. Согласно дальнейшему воплощению изобретения ферментом является Novozyme435 (Candidaantartica липаза В, иммобилизованная на акриловой смоле, доступная от компании Novozymes A/S). Согласно еще одному воплощению изобретения используемым ферментом является липазаThermomyces lanuginosus или ее мутант или вариант. Предпочтительно используемым ферментом является липаза Thermomyces lanuginosus. Согласно дальнейшему воплощению изобретения используемым ферментом является LipozymeTL IM, также доступная от компании Novozymes A/S. Предпочтительные реакционные условия для ферментативного ацилирования/деацилирования различаются в зависимости от используемого конкретного фермента, является ли он иммобилизованным или нет, и т.д.-8 011762 Подходящая температура для реакции лежит между 0-80 С, более предпочтительно между 20-60 С или более предпочтительно между 30-50 С. Количество используемого фермента конкретно не ограничивается и обычно оно составляет 0,011,0, предпочтительно 0,02-0,5 и более предпочтительно 0,02-0,3 в виде массового отношения относительно субстрата. Реакция может быть осуществлена в виде периодического процесса или как непрерывный процесс. Фермент может использоваться во множестве порций повторно или непрерывно. Время реакции особо не ограничивается и зависит от используемого фермента и масштаба и типа способа производства (периодического или непрерывного). Настоящее изобретение относится также к S- или R-энантиомеру соединения, имеющего формулу где R, Hal, R3, W, пунктирная линия и Z имеют значения, определенные выше, или его соли. Согласно одному воплощению изобретения оптически активным ацильным производным, указанным выше, является S-энантиомер. Согласно еще одному воплощению изобретения оптически активным ацильным производным, указанным выше, является R-энантиомер. Согласно одному воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где R представляет собой галоген или циано, предпочтительно R представляет собой циано. Согласно дальнейшему воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где Hal представляет собой фтор. Согласно дальнейшему воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где пунктирная линия представляет собой одинарную связь. Согласно еще одному воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где Z представляет собой диметиламинометил или группу, которая может быть преобразована в диметиламинометил, более предпочтительно Z представляет собой диметиламинометил, и другие заместители имеют значения, определенные выше. Согласно еще одному воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где Z представляет собой диметиламинометил, Hal представляет собой фтор, пунктирная линия представляет собой одинарную связь, и R представляет собой циано или галоген, предпочтительно циано. Согласно дальнейшему воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где Y представляет собой О или S, предпочтительно Y представляет собой O, и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретенияR- или S-энантиомером, указанным выше, является соединение, где Y представляет собой S, и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, в котором Y представляет собой связь, и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения R- или S-энантиомером, указанным выше, является соединение, где Y представляет собой NH, и другие заместители имеют значения, определенные выше. Предпочтительным R- или S-энантиомером, определенным в любом из воплощений, описанных выше, является соединение, где R1 представляет собой C1-6 алкил, С 2-6 алкенил или С 2-6 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными изC1-6 алкокси, C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано, C1-4 алкиламино и ди(C1-6 алкил)амино, более предпочтительно R1 представляет собой C1-4 алкил, С 2-4 алкенил или С 2-4 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси, C1-4 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-4 алкиламино и ди(C1-4 алкил)амино, предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, C1-3 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-3 алкиламино и ди(C1-3 алкил)амино, и наиболее предпочтительно R1 представляет собой C1-3 алкил, в частности неразветвленный C1-3 алкил.-9 011762 Согласно еще одному подходящему воплощению изобретения R- или S-энантиомером, определенным в любом из воплощений, описанных выше, является соединение, где R1 имеет следующие значения: С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино,нитро, циано, C1-6 алкиламино и ди(С 1-10 алкил)амино, более предпочтительно R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано, предпочтительно R1 представляет собой С 1-10 алкил, предпочтительно неразветвленный С 1-10 алкил и наиболее предпочтительно R1 представляет собой неразветвленный С 4-10 алкил. После завершения реакции ацилирования или реакции деацилирования энантиомер диольного производного, представленного формулой (II), получают в виде смеси с противоположным энантиомером соединения формулы (IV). Данную реакционную смесь затем необязательно отделяют от фермента. Для того чтобы получить желаемый энантиомер формулы (II) и/или (IV) с высокой химической чистотой, необходимо отделить его от противоположного энантиомера формулы (IV) и (II), соответственно, эффективным образом. Однако трудно эффективно отделить энантиомеры с помощью общеизвестных методов, потому что структура ацильного производного формулы (IV) является близко сходной со структурой диола формулы (II). Изобретатели настоящего изобретения провели интенсивные исследования и в результате обнаружили, что энантиомер соединения формулы (II) в виде соли с кислотой эффективно переходит в водный слой и противоположный энантиомер соединения формулы (IV) в виде соли с кислотой эффективно переходит в органический слой, когда реакционную смесь обрабатывают смешанным растворителем, содержащим органический растворитель и воду, в присутствии кислоты. Таким образом, согласно еще одному воплощению, изобретение относится к способу выделения и очистки ацильного производного, имеющего формулу где R представляет собой циано или группу, которая может быть преобразована в цианогруппу;Hal представляет собой галоген, пунктирная линия означает двойную или одинарную связь;Z представляет собой группу -CH2-N(R'R), в которой R' и R представляют собой C1-6 алкил или R' иR соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z представляет собой группу, которая может быть преобразована в диметиламинометильную группу;R3 представляет собой -Y-R1, где Y представляет собой связь О, S или NH и R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен одним или несколькими заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино,нитро, циано, С 1-10 алкиламино, ди(С 1-10 алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любая из арильных и гетероарильных групп может быть необязательно замещена один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила, С 2-10 алкинила,С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино,ди(С 1-10 алкил)амино,или его соли,и/или диола формулы- 10011762 где R, Hal, пунктирная линия и Z имеют значения, определенные выше, или его соли из смеси, содержащей соединение формулы (IV) и диол формулы (II), который включает:a) обработку смеси, содержащей ацил формулы (IV) и диол формулы (II), в смеси воды и органического растворителя в присутствии кислоты;b) отделение водной фазы, содержащей диол формулы (II) в виде соли указанной кислоты от органической фазы с получением органической фазы, содержащей ацильное производное формулы (IV) в виде соли указанной кислоты; необязательно выделение соединения формулы (II) в виде основания или его соли и необязательно соединения формулы (IV) в виде основания или его соли. Согласно одному воплощению изобретения в способе выделения и очистки, указанном выше, R представляет собой галоген или циано, предпочтительно циано. Согласно еще одному воплощению изобретения в способе выделения и очистки, указанном выше,Hal представляет собой фтор. Согласно предпочтительному воплощению пунктирная линия представляет собой одинарную связь. Согласно еще одному воплощению изобретения Z представляет собой диметиламинометил или группу, которая может быть преобразована в диметиламинометильную группу. Предпочтительно Z представляет собой диметиламинометил. Согласно предпочтительному воплощению изобретения Hal представляет собой фтор, Z представляет собой диметиламинометил, пунктирная линия представляет собой одинарную связь и R представляет собой циано или галоген, предпочтительно циано. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой О или S, предпочтительно Y представляет собой О и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой S. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой связь и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой NH и другие заместители имеют значения, определенные выше. Согласно предпочтительному воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где R1 представляет собой C1-6 алкил,С 2-6 алкенил или С 2-6 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси, C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-6 алкиламино и ди(С 1-6 алкил)амино, более предпочтительно R1 представляет собой C1-4 алкил,С 2-4 алкенил или С 2-4 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-4 алкокси, C1-4 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-4 алкиламино и ди(C1-4 алкил)амино, предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, C1-3 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-3 алкиламино и ди(C1-3 алкил)амино и наиболее предпочтительно R1 представляет собой C1-3 алкил, в частности неразветвленный C1-3 алкил. Согласно еще одному предпочтительному воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, в котором R1 имеет следующие значения: С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси,галогена, амино, нитро, циано, C1-6 алкиламино и ди(С 1-10 алкил)амино, более предпочтительно R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано, предпочтительно R1 представляет собой С 1-10 алкил, предпочтительно неразветвленный С 1-10 алкил и более предпочтительно R1 представляет собой неразветвленный С 4-10 алкил. По описанному выше способу выделения и очистки соль R- или S-энантиомера соединения, имеющего формулу (II), с кислотой может быть селективно экстрагирована в водный слой и соль противоположного энантиомера соединения формулы (IV) с кислотой может быть селективно выделена в органический слой обработкой в присутствии кислоты смеси, включающей энантиомер формулы (II) и противоположный энантиомер формулы (IV), реакционным растворителем и аналогичным органическому растворителем и водой в присутствии кислоты. В данном случае соль энантиомера формулы (IV) и соль энантиомера формулы (II) могут отделяться почти без потерь желаемых энантиомеров. Согласно одному воплощению указанного выше способа отделения и очистки S-энантиомер соединения формулы (IV) отделяют от R-энантиомера соединения формулы (II).- 11011762 Согласно еще одному воплощению указанного выше способа отделения и очистки S-энантиомер соединения формулы (II) отделяют от R-энантиомера ацильного производного формулы (IV). Количество используемой воды составляет 1:2-1:100, предпочтительно 1:5-1:50 как соотношение между соединением формулы (II) и водой. В дополнение к сказанному, перед экстрагированием водой реакционный растворитель может быть выпарен для снижения его количества или может быть заменен другим органическим растворителем. Кислота, которая может использоваться в указанном выше способе отделения и очистки, особо не ограничивается и, например, могут быть указаны минеральные кислоты, такие как хлористо-водородная,серная и фосфорная кислота; органические кислоты, в частности карбоновые кислоты, представленные алифатическими карбоновыми кислотами, такими как муравьиная, уксусная, пропионовая, н-масляная,изомасляная, н-валериановая, изовалериановая, пивалиновая, н-капроновая, изокапроновая, циклопентанкарбоновая, циклогексанкарбоновая, щавелевая, малоновая и винная кислота; или ароматические карбоновые кислоты, такие как бензойная, п-хлорбензойная, п-нитробензойная, п-метоксибензойная,п-толуиловая, о-толуиловая, м-толуиловая, нафтойная, фталевая и терефталевая кислота. Среди них предпочтительными являются органические кислоты, в частности карбоновые кислоты, такие как нмасляная, изовалериановая, циклогексанкарбоновая кислота, пивалиновая, бензойная и о-толуиловая кислота, и особенно предпочтительна пивалиновая кислота. Нет необходимости говорить, что вышеуказанные кислоты могут использоваться по одной или в сочетании двух или более кислот. Количество используемых кислот особо не ограничивается и молярное соотношение суммы соединений формулы (IV) и (II) и кислоты составляет обычно 1:1-1:5 и предпочтительно 1:1-1:3. Кислота, используемая на настоящей стадии отделения и очистки, может быть той же самой, что и органическая кислота, используемая в реакции ацилирования или деацилирования согласно изобретению, или может быть иной кислотой. В качестве органического растворителя, который может быть использован на стадии выделения и очистки, могут быть указаны, например, углеводороды, такие как гексан, гептан, бензол и толуол; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, трет-бутилметиловый эфир и диметоксиэтан; кетоны, такие как ацетон, диэтилкетон и метилэтилкетон; сложные эфиры, такие как метилацетат, этилацетат, этилбутират и этилбензоат; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,1,1-трихлорэтан. Среди них предпочтительны алифатические углеводороды, такие как гексан и гептан, и ароматические углеводороды, такие как бензол и толуол. Наиболее предпочтительными являются ароматические углеводороды и наиболее предпочтительно толуол. Указанные выше растворители могут использоваться по одному или в сочетании двух или более растворителей. Температура стадии выделения и очистки составляет предпочтительно 0-80 С, более предпочтительно 10-40 С и наиболее предпочтительно 20-30 С. После отделения солей соединений формулы (II) и (IV) согласно описанному выше способу отделения и очистки небольшие количества соединения формулы (IV), которое частично смешивается в водном слое соли соединения формулы (II) с кислотой, аналогично могут эффективно удаляться с помощью промывки водного слоя органическим растворителем. Соль диола формулы (II) может использоваться в виде водного раствора соли, и, если необходимо,она может использоваться в виде раствора в другом растворителе или концентрате, полученном с помощью концентрирования, замены растворителя или аналогичной операции. Далее она может использоваться в виде кристаллов, полученных кристаллизацией или аналогичной операцией. Однако обычно диол формулы (II) используется в виде свободного диола, полученного с помощью следующих операций: смесь, содержащую диол формулы (II) и органический растворитель и/или концентрат, получают обработкой водного слоя обычным основанием, таким как гидроксид натрия или гидроксид калия, для доведения рН водного слоя по крайней мере до 9, предпочтительно по крайней мере до 11, затем экстрагирования свободной аминной формы диола формулы (II) органическим растворителем с последующей промывкой и концентрированием экстракта. Химическая чистота диола формулы (II), полученного с помощью ряда методов выделения и очистки, обычно составляет по крайней мере 95%, предпочтительно по крайней мере 97%, более предпочтительно по крайней мере 99% и наиболее предпочтительно по крайней мере 99,5%. С другой стороны, соединение формулы (IV), полученное с помощью описанных выше операций,можно промывать водной фазой для того, чтобы улучшить химическую чистоту продукта. Соединение формулы (IV) может быть получено в виде свободной аминной формы путем обработки аммониевой соли соединения формулы (IV), полученной с помощью описанных выше операций, основанием. Химическая чистота диола формулы (IV), полученного с помощью серий операций выделения и способа очистки, обычно составляет по крайней мере 95%, предпочтительно по крайней мере 97%, более предпочтительно по крайней мере 99% и наиболее предпочтительно по крайней мере 99,5%. Оптическая чистота продукта, полученного после отделения энантиомеров формулы (II) и (IV), как описано выше, может быть улучшена перед дальнейшей переработкой. Улучшение оптической чистоты может быть достигнуто с помощью хроматографии, как описано в WO 03/011278, или с помощью кри- 12011762 сталлизации диастереомерных сложных эфиров или солей с оптически активными кислотами, как описано в патенте США 4943590. Согласно дальнейшему воплощению изобретения смесь соединения формулы (II) и соединения формулы (IV), которую отделяют с помощью указанного выше способа выделения и очистки, получают селективным ацилированием и согласно еще одному воплощению - селективным деацилированием согласно изобретению. Изобретение относится также к другому новому способу отделения R- или S-диола формулы (II) от ацильного производного формулы (IV) другого энантиомера, с помощью которого можно выделять и очищать желаемое соединение. Согласно данному другому способу выделения и очистки ацильное производное, имеющее формулу где R представляет собой циано или группу, которая может быть преобразована в цианогруппу;Hal представляет собой галоген; пунктирная линия означает двойную или одинарную связь;Z представляет собой группу -CH2-N(R',R), в которой R' и R представляют собой C1-6 алкил или R' и R соединены друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, или Z представляет собой группу, которая может быть преобразована в диметиламинометильную группу;R3 представляет собой -Y-R1, где Y представляет собой связь, О, S или NH и R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино,нитро, циано, С 1-10 алкиламино, ди(С 1-10 алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любая из арильных и гетероарильных групп может быть необязательно замещена один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила, С 2-10 алкинила,С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино,ди(С 1-10 алкил)амино,или его соли,и/или диола формулы где R, Hal, пунктирная линия и Z имеют значения, определенные выше, или его соль выделяют из смеси,содержащей соединение формулы (IV) и соединение формулы (II), с помощью способа, включающего:a) обработку указанной смеси, содержащей соединение формулы (IV) и диол формулы (II), в смеси воды, протонного органического растворителя и аполярного органического растворителя;b) отделение водной фазы, содержащей диол формулы (II), от органической фазы с получением органической фазы, содержащей соединение формулы (IV); необязательно выделение диола формулы (II) и/или (IV) в виде основания и необязательно преобразование соединения формулы (II) и/или (IV) в его соль. Любая из указанных выше выделенных фаз (водная и органическая) может быть дополнительно промыта один или несколько раз органическим или водным растворителем, соответственно, для улучшения химической чистоты продукта. Согласно одному воплощению указанного выше способа выделения и очистки S-диол соединения формулы (II) отделяют от R-энантиомера соединения формулы (IV).- 13011762 Согласно еще одному воплощению указанного выше способа выделения и очистки S-энантиомер соединения формулы (IV) отделяют от R-энантиомера соединения формулы (II). Согласно одному воплощению изобретения в способе выделения и очистки, указанном выше, R представляет собой галоген или циано, предпочтительно циано. Согласно еще одному воплощению изобретения в способе выделения и очистки, указанном выше,Hal представляет собой фтор. Согласно предпочтительному воплощению изобретения пунктирная линия представляет собой одинарную связь. Согласно еще одному воплощению изобретения Z представляет собой диметиламинометил или группу, которая может быть преобразована в диметиламинометильную группу. Предпочтительно Z представляет собой диметиламинометил. Согласно предпочтительному воплощению изобретения Hal представляет собой фтор, Z представляет собой диметиламинометил, пунктирная линия представляет собой одинарную связь и R представляет собой циано или галоген, предпочтительно циано. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой О или S, предпочтительно Y представляет собой О и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой S. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой связь и другие заместители имеют значения, определенные выше. Согласно дальнейшему воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где Y представляет собой NH и другие заместители имеют значения, определенные выше. Согласно предпочтительному воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где R1 представляет собой C1-6 алкил,С 2-6 алкенил или С 2-6 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-6 алкокси, C1-6 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-6 алкиламино и ди(C1-6 алкил)амино, более предпочтительно R1 представляет собой C1-4 алкил,С 2-4 алкенил или С 2-4 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-4 алкокси, C1-4 алкилтио, гидрокси, галогена, амино, нитро, циако,C1-4 алкиламино и ди(C1-4 алкил)амино, предпочтительно R1 представляет собой C1-3 алкил, С 2-3 алкенил или С 2-3 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из C1-3 алкокси, С 1-3 алкилтио, гидрокси, галогена, амино, нитро, циано,C1-3 алкиламино и ди(С 1-3 алкил)амино, и наиболее предпочтительно R1 представляет собой C1-3 алкил, в частности неразветвленный C1-3 алкил. Согласно еще одному предпочтительному воплощению изобретения соединением формулы (IV) в способе выделения и очистки, указанном выше, является соединение, где R1 имеет следующие значения: С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, C1-10 алкилтио, гидрокси, галогена, амино,нитро, циано, C1-6 алкиламино и ди(С 1-10 алкил)амино, более предпочтительно R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил, каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из гидрокси, галогена, амино, нитро и циано, предпочтительно R1 представляет собой С 1-10 алкил, предпочтительно неразветвленный С 1-10 алкил и более предпочтительно R1 представляет собой неразветвленный С 4-10 алкил. В качестве протонного органического растворителя, который может использоваться на стадии выделения и очистки, могут быть указаны, например, спирты, такие как метанол, этанол, 1-пропанол,2-пропанол, 1-бутанол, 2-бутанол и трет-бутанол. Указанные выше растворители могут использоваться по одному или в сочетании двух или более растворителей. В качестве аполярных органических растворителей, которые могут использоваться на стадии выделения и очистки, могут быть указаны, например, углеводороды, такие как гексан, гептан, бензол и толуол; простые эфиры, такие как диэтиловый эфир, трет-бутилметиловый эфир и диметоксиэтан; галоидированные углеводороды, такие как метиленхлорид, хлороформ и 1,1,1-трихлорэтан. Среди них предпочтительными являются углеводороды, такие как гексан, гептан, бензол и толуол. Наиболее предпочтительным является гептан. Указанные выше растворители могут использоваться по одному или в сочетании двух или более растворителей. Согласно предпочтительному воплощению изобретения смесь соединения формулы (IV) и диола формулы (II), используемая в указанном выше способе выделения и очистки, получают с помощью ферментативного ацилирования согласно изобретению и согласно другому воплощению - с помощью ферментативного деацилирования согласно изобретению.- 14011762 Оптическая чистота продукта, полученного после отделения энантиомеров формулы (II) и (IV), как описано выше, может быть улучшена перед дальнейшей переработкой. Улучшение оптической чистоты может быть достигнуто с помощью хроматографии, как описано в WO 03/006449, или с помощью кристаллизации диастереомерных сложных эфиров или солей с оптически активными кислотами, как описано в патенте США 4943590. Настоящее изобретение относится также к способу получения эсциталопрама, имеющего формулу или его фармацевтически приемлемой соли, включающему получение где R представляет собой циано или группу, которая может быть преобразована в цианогруппу; пунктирная линия представляет собой двойную или одинарную связь;Z представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу; и где R, Z, пунктирная линия и Hal имеют значения определенные выше;R3 представляет собой -Y-R1, где R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил,каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино,ди(С 1-10 алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любая из арильных и гетероарильных групп может быть необязательно замещена один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила или С 2-10 алкинила, С 1-10 алкокси, С 1-10 алкилтио,гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино и ди(С 1-10 алкил)амино и Y представляет собой связь, О, S или NH или его соли, в одном воплощении способом селективного ферментативного ацилирования согласно изобретению, как определено в любом из описанных выше воплощений, и в другом воплощении способом селективного ферментативного деацилирования согласно изобретению, как определено в любом из описанных выше воплощений, необязательно с последующим, в любом порядке, преобразованием группы R в цианогруппу, восстановлением двойной связи, представленной пунктирной линией, преобразованием группы Z в диметиламинометильную группу и/или преобразованием группыHal во фторгруппу и замыканием кольца в основных условиях S-энантиомера формулы (IIs) или (IVs) или его лабильного сложноэфирного производного с образованием соединения формулы с последующим, в любом порядке, если R не является циано, преобразованием группы R в цианогруппу,если пунктирная линия представляет собой двойную связь, восстановлением в одинарную связь, если Z не является диметиламинометилом, преобразованием группы Z в диметиламинометильную группу и если Hal не является фтором, преобразованием Hal во фторгруппу с последующим отделением эсциталопрама или его фармацевтически приемлемой соли. Согласно одному воплощению изобретения S-энантиомер формулы (IIs), приведенной выше, илиS-энантиомер формулы (IVs), используемый для получения эсциталопрама, отделяют от R-энантиомера формулы (IV) и (II) соответственно перед замыканием кольца. Согласно одному воплощению указанного выше способа получения эсциталопрама смесь R- илиS-энантиомера соединения формулы (II) и противоположного энантиомера соединения формулы (IV),полученную ферментативным ацилированием, разделяют для отделения энантиомеров друг от друга с помощью способа выделения и очистки согласно одному из указанных выше новых методов выделения и очистки. Согласно еще одному воплощению смесь разделяют с помощью другого из указанных выше новых способов выделения и очистки. Согласно еще одному воплощению описанного выше способа получения эсциталопрама смесьR- или S-энантиомера соединения формулы (II) и противоположного энантиомера соединения формулы(IV), полученную ферментативным деацилированием, разделяют для отделения энантиомеров друг от друга с помощью способа выделения и очистки согласно одному из указанных выше новых методов выделения и очистки. Согласно еще одному воплощению смесь разделяют с помощью другого из указанных выше новых способов выделения и очистки. Согласно еще одному воплощению изобретения S-энантиомер формулы (IIs) или S-энантиомер формулы (IVs), используемый для получения эсциталопрама, не отделяют от R-энантиомера формулы(IV) и (II) соответственно перед замыканием кольца. Как указывалось выше, группа R означает циано или любую другую группу, которая может быть преобразована в цианогруппу. Группы, которые могут быть преобразованы в цианогруппу, включают галоген, такой как хлор,бром, йод или фтор, предпочтительно хлор или бром. Другие группы, которые могут быть преобразованы в циано, включают CF3-(CF2)n-SO2-O, где n представляет собой 0-8, -OH, -CHO, -CH2OH, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br, -CH3, -NHR5, -CHNOH,-COOR6, -CONR6R7, где R5 представляет собой водород или C1-6 алкилкарбонил и R6 и R7 выбраны из водорода, необязательно замещенного C1-6 алкила, арилС 1-6 алкила или арила, и группу формулыR8-R9 каждый независимо выбран из водорода и C1-6 алкила, или R8 и R9 вместе образуют С 2-5 алкиленовую цепь, образуя тем самым спирокольцо;R10 выбран из водорода и C1-6 алкила;R11 выбран из водорода, C1-6 алкила, карбоксигруппы или группы ее предшественника, илиR10 и R11 вместе образуют С 2-5 алкиленовую цепь, образуя тем самым спирокольцо. Когда R представляет собой галоген, в частности бром или хлор, преобразование в циано может быть осуществлено, как описано в патентах США 4136193, WO 00/13648, WO 00/11926 и WO 01/02383. Согласно патенту США 4136193 преобразование бромгруппы в цианогруппу осуществляют по реакции с CuCN. В WO 00/13648 и WO 00/11926 описано преобразование галогена или трифлатной (трифторметансульфонатной) группы в цианогруппу с помощью цианирования источником цианида в присутствии Pd или Ni катализатора. Другие способы преобразования бромного соединения в соответствующее цианопроизводное включают реакцию бромного соединения с магнием с образованием реактива Гриньяра с последующей реакцией с формамидом с образованием альдегида. Альдегид преобразуют в оксим или гидразон, который преобразуется в цианогруппу с помощью дегидратации и окисления, соответственно.- 16011762 Альтернативно, бромное соединение подвергают реакции с магнием с образованием реагента Гриньяра с последующей реакцией с соединением, содержащим CN-группу, присоединенную к уходящей группе. Подробное описание указанных выше двух методик можно найти в WO 01/02383. Соединения, в которых R представляет собой -СНО, могут быть преобразованы в соответствующие соединения, в которых R представляет собой циано, способами, аналогичными описанным вWO 00/00210. Соединения, в которых группа R представляет собой NHR12, где R12 представляет собой водород или алкилкарбонил, могут быть преобразованы в соответствующие соединения, в которых группа R представляет собой циано, методами, аналогичными описанным в WO 98/19512. Соединения, в которых R представляет собой -COOR6 группу, могут быть преобразованы в соответствующие соединения, в которых R представляет собой циано, с помощью преобразования в амид через соответствующий хлорангидрид кислоты или его сложный эфир с последующей дегидратацией амида (WO 01/68 632). Альтернативно, соединение, в котором R представляет собой -СООН, может быть подвергнуто реакции с хлорсульфонилизоцианатом для образования нитрила или обработано дегидратирующим агентом и сульфонамидом, как описано в WO 00/44738. Соединения, в которых группа R представляет собой -CONR13R14, где R13 и R14 выбраны из водорода, необязательно замещенного алкилом, аралкилом или арилом, могут быть преобразованы в соответствующее циано соединение по методам, аналогичным описанным в WO 98/00081 и WO 98/19511. Соединения, в которых группа R является группой формулы (VII), могут быть преобразованы в соответствующее цианосоединение методами, аналогичными описанным в WO 00/23431. Соединения, в которых R представляет собой OH, -CH2OH, -CH2NH2, -CH2NO2, -CH2Cl, -CH2Br,-CH3 или любую из групп, указанных выше, могут быть преобразованы в соответствующие цианосоединения методами, аналогичными описанным в WO 01/68632. Рацемические соединения формулы (II) могут быть получены методами, описанными в указанных выше патентах, или методом алкилирования, описанным в патенте США 4136193, или двойной реакцией Гриньяра, описанной в ЕР 171943, или с помощью аналогичных методов. Рацемические соединения формулы (IV) могут быть получены из рацемических соединений формулы (II) с помощью неселективного ацилирования с использованием ангидридов, сложных эфиров, карбонатов, изоцианатов или изотиоцианатов, описанных выше формул (IIIa), (IIIb), (IIIc), R1-N=C=O и R1-N=C=S. В некоторых случаях рацемическое соединение формулы (II) может быть доступно в форме кислотно-аддитивной соли, такой как сульфатная соль, и в данном случае свободное основание соединения формулы (II) может быть получено обработкой соли основанием в смеси воды и органического растворителя для переноса соединения формулы (II) в органическую фазу. Предпочтительно R представляет собой циано в соединениях формулы (II), (IIs), (IIr), (IV), (IVs),(IVr) и (V). Если R не является циано, преобразование группы R в цианогруппу предпочтительно осуществляют после замыкания кольца с образованием соединения формулы (V). Предпочтительно Hal представляет собой фтор в соединениях формулы (II), (IIs), (IIr), (IV), (IVs),(IVr) и (V). Если Hal не является фтором, преобразование группы Hal во фтор предпочтительно осуществляют после замыкания кольца с образованием соединения формулы (V). Способ осуществления данного преобразования описан в Speciality Chemicals Magazine, April 2003, с. 36-38.Z-группами, которые могут быть преобразованы в диметиламинометил, являются такие группы, как-CH2-L, -CH2-NO2, -MgHal, циано, альдегид, -CH2-O-Pg, -CH2-NPg1Pg2, -CH2-NMePg1, -CH2-NHCH3,-CH2-NH2, -CO-N(CH3)2, -CH(A1R12)(A1R13), -(A1R14)(A2R15)(A3R16), -COOR17, -CH2-CO-NH2,-CH=CH-R18 или -CONHR19, где Pg представляет собой защитную группу для спиртовой группы, Pg1 иPg2 являются защитными группами для аминогруппы, R12 и R13 независимо выбраны из С 1-6 алкила,С 2-6 алкенила, С 2-6 алкинила и необязательно алкилзамещенных арильных или аралкильных групп, или R12 и R13 вместе образуют цепь из 2-4 атомов углерода, каждый из R14-R18 независимо выбраны изC1-6 алкила, С 2-6 алкенила, С 2-6 алкинила и необязательно C1-6 алкилзамещенного арила или арилС 1-6 алкила,R19 представляет собой водород или метил, и А 1, А 2 и А 3 выбраны из О и S; L представляет собой удаляемую группу, такую как галоген или -O-SO2-A, где А представляет собой C1-6 алкил, С 2-6 алкенил,С 2-6 алкинил или необязательно C1-6 алкилзамещенный арил или арилС 1-6 алкил. Согласно одному воплощению изобретения Z представляет собой диметиламинометил, -CH2-L,-CH2-NPg1Pg2, -CH2-NMePg1, -СН 2-NHCH3, -CH2-NH2, -CO-N(CH3)2, альдегид или COOR17 в соединениях формулы (II), (IIs), (IIr), (IV), (IVs), (IVr) и (V). Соединения, в которых Z представляет собой -CH2-O-Pg, могут быть преобразованы в соответствующие соединения, в которых Z представляет собой диметиламинометил, с помощью удаления защитной группы с образованием спирта и последующего преобразования спиртовой группы в возможную удаляемую группу и реакции получившегося в результате соединения с:a) диметиламином или его солью,b) метиламином с последующим метилированием или восстановительным аминированием илиc) с азидом с последующим восстановлением с образованием соответствующего амина и затем последующим метилированием или восстановительным аминированием, как описано в WO 01/43525,WO 01/51478 или WO 01/68631, или с помощью аналогичных методов. Соединения, в которых Z представляет собой -CH2-L, где L представляет собой удаляемую группу,могут быть преобразованы в диметиламинометильную группу таким же образом. Соединения, в которых Z представляет собой -СО-N(СН 3)2 и -CONHR19, где R19 представляет собой водород или метил, могут быть преобразованы в соответствующие соединения, в которых Z представляет собой диметиламинометил, с помощью восстановления амида и, если образуется первичный или вторичный амин, с последующим метилированием или восстановительным аминированием с образованием диметиламинометильной группы, как описано в WO 01/43525 или WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -CH2-NMe(Pg1) или -CH2-N(Pg1)(Pg2), могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, удалением защитных групп, т.е. с получением соединений, где Z представляет собой -CH2-NH2 или -CH2-NMe, и последующим метилированием аминогруппы или восстановительным аминированием с образованием диметиламинометильной группы, как описано в WO 01/43525 или WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -CH(A1R12)(A2R13), могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, с помощью снятия защиты с образованием альдегида (соединений, в которых Z представляет собой -СН 2-СА 1 Н), последующим восстановительным аминированием диметиламином с образованием диметиламинометильной группы, как описано в WO 01/43525 или WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -C(A1R14)(A2R15)(A3R16), могут быть преобразованы в соответствующие соединения, в которых Z представляет собой диметиламинометил, с помощью:i) гидролиза с образованием карбоновой кислоты или ее сложного эфира и последующего восстановления с образованием спирта и затем преобразования спиртовой группы в возможную удаляемую группу с последующей заменой уходящей группы диметиламиногруппой, как описано выше, илиii) преобразования карбоновой кислоты или ее сложного эфира в амид по реакции с амином формулы NH(Me)2, NH2Me, NH3 или его солью с последующим, в любом порядке, восстановлением амида и,если необходимо, метилированием или восстановительным аминированием с образованием диметиламиногруппы, как описано в WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -COOR17, могут быть преобразованы в соответствующие соединения, в которых Z представляет собой диметиламинометил, как описано выше, исходя из сложного эфира карбоновой кислоты. Соединения, в которых Z представляет собой -CH2-CONH2, могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, с помощью обработки гипогалогенидом с образованием первичного амина с последующим метилированием свободной аминогруппы или восстановительным аминированием с образованием диметиламинометильной группы, как описано вWO 01/43525 или WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -CH=CHR18, могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, с помощью оксидирования с образованием альдегида, который может быть преобразован в соединение с диметиламинометилом с помощью восстановительного аминирования, как описано в WO 01/43525 или WO 01/68631, или аналогичными методами. Соединения, в которых Z представляет собой -CH2-NO2, могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, с помощью восстановления с последующим метилированием или восстановительным аминированием образовавшейся свободной аминогруппы с образованием диметиламинометильной группы, как описано в WO 01/68629 или аналогичными методами. Соединения, где Z представляет собой -MgHal, могут быть преобразованы в соответствующие соединения, где Z представляет собой диметиламинометил, с помощью реакции с диметиламинометилалкиловым эфиром формулы (CH3)2NCH2O-алкил, как описано в WO 01/68629 или аналогичными методами. Предпочтительно Z представляет собой диметиламинометил. Если Z не является диметиламинометилом, преобразование Z в диметиламинометильную группу предпочтительно осуществляют после замыкания кольца. Предпочтительно Z представляет собой диметиламинометил, -CH2-L, -CH2-NPg1Pg2, -CH2-NMePg1,-CH2-NHCH3, -CH2-NH2, альдегид -CO-N(CH3)2, -COOR17, когда пунктирная линия представляет собой связь. Соединения формулы (II) или (IV), где Z представляет собой диметиламинометил, -CH2-NPg1Pg2,-CH2-NMePg1, -CH2-NHCH3 или -СН 2-NH2, в частности соединения, где Z представляет собой диметиламинометил, -CH2-NHCH3 или -CH2-NH2, особенно хорошо подходят для способа выделения и очистки согласно изобретению, в котором выделяют соединения формулы (II) и (IV).- 18011762 В соединениях формул (II), (IIs), (IIr), (IV), (IVs), (IVr) и (V) пунктирная линия предпочтительно представляет собой одинарную связь. Соединения, в которых пунктирная линия представляет собой двойную связь, могут быть преобразованы в соответствующие соединения, в которых пунктирная линия представляет собой одинарную связь, методами, описанными в WO 01/68630. Восстановление предпочтительно осуществляют после замыкания кольца. Энантиоселективное замыкание кольца соединений формулы (IVs) или (IIs) с образованием соединений формулы (V) может быть предпочтительно осуществлено с помощью обработки лабильного сложноэфирного производного соединения основанием, таким как KOC(CH3)2 и другие алкоксиды, NaH и другие гидриды, триэтиламин, этилдиизопропиламин или пиридин, при низких температурах в инертном органическом растворителе, таком как тетрагидрофуран, толуол, ДМСО, ДМФ, третбутилметиловый эфир, диметоксиэтан, диметоксиметан, диоксан, ацетонитрил или дихлорметан. Данный способ описан в патенте США 4943590. Замыкание кольца соединения формулы (IIs) предпочтительно осуществляют с помощью обработки основанием, как описано выше, в присутствии агента, способного образовывать лабильную группу с первичным спиртом диола,такую как метансульфонилокси,п-толуолсульфонилокси,10-камфорсульфонилокси, трифторацетилокси и трифторметансульфонилокси или галоген. В некоторых случаях может быть предпочтительным заменить группу -W-R3 в соединении формулы (IVs) более лабильной группой перед тем, как осуществлять замыкание кольца. Такими лабильными группами (уходящими группами) могут быть в типичном случае группы, выбранные из метансульфонилокси, п-толуолсульфонилокси, 10-камфорсульфонилокси, трифторацетилокси и трифторметансульфонилокси или галоген. В типичном случае соединение формулы (IVs) подвергают гидролизу, образуя соединение формулы(IIs) с водным основанием, таким как NaOH, KOH или LiOH, в воде или спирте или их смеси, и затем подвергают реакции с активированной уходящей группой, такой как, например, мезилхлорид или тозилхлорид, в органическом растворителе в присутствии органического основания. Оптическую чистоту эсциталопрамного продукта может быть необходимым улучшить после замыкания кольца. Улучшение оптической чистоты может быть достигнуто с помощью хроматографии с хиральной стационарной фазой или кристаллизации рацемического циталопрамного основания или его соли согласно методам, описанным в WO 03/000672.R-энантиомер соединений формулы (II) и (IV), полученный согласно изобретению, может использоваться для получения рацемического циталопрама и эсциталопрама с помощью замыкания кольца в кислой среде согласно способу, описанному в WO 03/000672. Подходящими кислотами для осуществления кислого замыкания кольца являются минеральная кислота, карбоновая кислота, сульфоновая кислота или производное сульфоновой кислоты, более подходящими являются H2SO4 или Н 3 РО 4. Таким образом, согласно еще одному воплощению, изобретение относится к способу получения рацемического циталопрама и/или эсциталопрама или его фармацевтически приемлемой соли, включающему получение R-энантиомера диола, имеющего формулу где R представляет собой циано или группу, которая может быть преобразована в цианогруппу; пунктирная линия представляет собой необязательную связь;Z представляет собой диметиламинометильную группу или группу, которая может быть преобразована в диметиламинометильную группу; иR3 представляет собой -Y-R1, где R1 представляет собой С 1-10 алкил, С 2-10 алкенил или С 2-10 алкинил,каждый из которых может быть необязательно замещен один или несколько раз заместителями, выбранными из С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино,ди(С 1-10 алкил)амино, арила, арилокси, арилтио и гетероарила, или R1 представляет собой арил, где любая из арильных и гетероарильных групп могут быть необязательно замещены один или несколько раз заместителями, выбранными из С 1-10 алкила, С 2-10 алкенила, С 2-10 алкинила, С 1-10 алкокси, С 1-10 алкилтио, гидрокси, галогена, амино, нитро, циано, С 1-10 алкиламино и ди(С 1-10 алкил)амино, и Y представляет собой связь, О, S или NH, или его соли, согласно одному воплощению с помощью метода селективного ферментативного ацилирования согласно изобретению, как определено в любом из воплощений, описанных выше, и согласно еще одному воплощению с помощью метода селективного ферментативного деацилирования согласно изобретению, как определено в любом из воплощений, описанных выше, необязательно с последующим, в любом порядке, преобразованием группы R в цианогруппу, восстановлением двойной связи, представленной пунктирной линией, в одинарную связь, преобразованием группы Z в диметиламинометильную группу и/или преобразованием группы Hal во фторгруппу и замыканием кольца в кислых условиях R-энантиомера формулы (IIr) или (IVs) с образованием смеси соединений формулы где Hal, Z, R и пунктирная линия имеют значения, определенные выше, и небольшого количества соответствующего R-энантиомера, с последующим, в любом порядке, если R не является циано, преобразованием группы R в цианогруппу, если пунктирная линия представляет собой двойную связь, восстановлением в одинарную связь, если Z не является диметиламинометилом, преобразованием группы Z в диметиламинометильную группу и, если Hal не является фтором, преобразованием Hal во фторгруппу, с последующим отделением эсциталопрама и/или рацемического циталопрама или его фармацевтически приемлемой соли осаждением рацемического циталопрамного свободного основания или его соли и выделением эсциталопрама из маточной жидкости от осаждения. Описанный выше способ преобразования R-диола в эсциталопрам используют предпочтительно для получения эсциталопрама. Преобразование группы R в цианогруппу, восстановление двойной связи, представленной пунктирной линией, в одинарную связь, преобразование группы Z в диметиламинометильную группу и преобразование Hal во фторгруппу могут быть осуществлены, как описано выше. Согласно одному воплощению указанного выше способа получения эсциталопрама смесь R- илиS-энантиомера соединения формулы (II) и противоположного энантиомера соединения формулы (IV),полученную ферментативным ацилированием, отделяют друг от друга с помощью способа выделения и очистки согласно одному из описанных выше методов выделения и очистки. Согласно еще одному воплощению смесь разделяют другим из описанных выше методов выделения и очистки. Согласно еще одному воплощению указанного выше способа получения эсциталопрама смесьR- или S-энантиомера соединения формулы (II) и противоположного энантиомера соединения формулы(IV), полученную ферментативным деацилированием, отделяют друг от друга с помощью способа выделения и очистки согласно одному из описанных выше методов выделения и очистки. Согласно еще одному воплощению смесь разделяют другим из описанных выше методов выделения и очистки. Согласно еще одному воплощению изобретения S-энантиомер формулы (IIr), приведенной выше,или S-энантиомер формулы (IVr), используемый для получения эсциталопрама, не отделяют отR-энантиомера формулы (IV) и (II) соответственно перед замыканием кольца. Оптическую чистоту эсциталопрамного продукта может быть необходимо улучшить перед замыканием кольца. Улучшение оптической чистоты может быть получено с помощью хроматографии на хиральной стационарной фазе или кристаллизации рацемического циталопрамного основания или его соли согласно методам, описанным в WO 03/000672. В используемом здесь смысле термин С 1-10 алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до десяти атомов углерода включительно, такой как метил, этил,1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2-метил-1-пропил, пентил, гексил и гептил.C1-6 алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от 1 до 6 атомов углерода включительно, такой как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил,2-метил-2-пропил, 2-метил-1-пропил, пентил и гексил; C1-4 алкил относится к разветвленной или нераз- 20011762 ветвленной алкильной группе, имеющей от 1 до 4 атомов углерода, включительно, такой как метил, этил,1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1-пропил. C1-3 алкил относится к разветвленной или неразветвленной алкильной группе, имеющей от одного до трех атомов углерода включительно, такой как метил, этил, 1-пропил, 2-пропил. Аналогичным образом, С 2-10 алкенил и С 2-10 алкинил означают разветвленные или неразветвленные алкенильные и алкинильные группы соответственно, имеющие от двух до десяти атомов углерода, включающие одну двойную связь и одну тройную связь соответственно, такие как этенил, пропенил, бутенил,этинил, пропинил и бутинил; С 2-6 алкенил и С 2-6 алкинил означают разветвленные или неразветвленные алкенильные и алкинильные группы соответственно, имеющие от двух до шести атомов углерода, включающие одну двойную связь и одну тройную связь соответственно, такие как этенил, пропенил, бутенил,этинил, пропинил и бутинил; С 2-4 алкенил и С 2-4 алкинил означают разветвленные или неразветвленные алкенильные и алкинильные группы соответственно, имеющие от двух до четырех атомов углерода,включающие одну двойную связь и одну тройную связь соответственно, такие как этенил, пропенил,бутенил, этинил, пропинил и бутинил; С 2-3 алкенил и С 2-3 алкинил означают разветвленные или неразветвленные алкенильные и алкинильные группы соответственно, имеющие от двух до трех атомов углерода,включающие одну двойную связь и одну тройную связь, соответственно, такие как этенил, пропенил,этинил и пропинил. Термины С 1-10 алкокси, С 1-10 алкилтио, С 1-10 алкиламино и ди(С 1-10 алкил)амино и др. означают такие группы, в которых алкильной группой является С 1-10 алкил, определенный выше. Термины C1-6 алкокси,C1-6 алкилтио, C1-6 алкиламино и ди(С 1-6 алкил)амино и т.д. означают такие группы, в которых алкильной группой является C1-6 алкил, определенный выше. Термины C1-4 алкокси, C1-4 алкилтио, C1-4 алкиламино и ди(C1-4 алкил)амино и т.д. означают такие группы, в которых алкильной группой является C1-4 алкил, определенный выше. Термины C1-3 алкокси, C1-3 алкилтио, C1-3 алкиламино и ди(C1-3 алкил)амино и др. означают такие группы, в которых алкильной группой является C1-3 алкил, определенный выше. Галогены означают фтор, хлор, бром или йод. Термин арил относится к моно- или бициклической карбоциклической ароматической группе, такой как фенил или нафтил, в частности фенил. Арилокси, арилтио относится к такой группе, в которой арил определен выше. Термин гетероарил относится к 5- или 6-членной моноциклической гетероароматической группе или бициклической гетероароматической группе. Предпочтительно гетероарильная группа содержит 1-3 гетероатома, выбранных из О, S и N.R0 и R1 могут вместе образовывать цепь из 3-5 атомов углерода, образуя таким образом ангидрид. Когда Z представляет собой -CH2-N(R'R), где R' и R связаны друг с другом с образованием циклической структуры, включающей N-атом, к которому они присоединены, циклическая структура образует группы, такие как группы, которые включают пиперидин, пирролидин, морфолинил и пиперазинил.HOBt означает гидроксибензотриазол, и pfp означает пентафторфенол. Экспериментальные данные В следующих примерах % конверсии и оптическая чистота измеряли и вычисляли, как описано ниже. Условия ВЭЖХ анализа (для степени конверсии), используемые для примеров 1-28: Колонка: YMC-Pack ODS-A 0,46 см I.D.25 см (производимая фирмой YMC Co., LTD.). Элюент: 25 мМ фосфатный буфер/ацетонитрил=60/40. Скорость потока: 1,0 мл/мин. Температура: 40 С. Длина волны детектора: 237 нм. Условия ВЭЖХ анализа (для степени конверсии), используемые для примеров 29-42: Колонка: колонка Lichrospher RP-8, 2504 мм (размер частиц 5 мкм). Элюент: забуференный МеОН/вода, полученный следующим образом: 1,1 мл Et3N, добавленный к 150 мл воды, 10% Н 3 РО 4 (водн.) добавляли до рН 7 и добавляли воду до общего объема 200 мл. Смесь добавляли к 1,8 л МеОН. Температура: 35 С. Скорость потока: 1 мл/мин. Давление: 16,0 МПа. Детекция: UV 254 нм. Инжекционный объем: 10 мкл. Степень конверсии (%)=Р/(S+P)100 (P - количество продукта, S - количество остаточного субстрата). Условия ВЭЖХ анализа (для степени конверсии), используемые для примеров 1-28: Колонка: Chiralpak AD 0,46 см I.D.25 см (производимая фирмой DAICEL CHEMICAL INDUSTRIES, LTD.). Элюент: гептан/метанол/этанол/диэтиламин=85/7,5/7,5/0,1. Скорость потока: 1,0 мл/мин. Температура: 30 С.- 21011762 Длина волны детектора: 240 нм. Степень конверсии (%)=Р/(S+P)100 (P - количество продукта, S - количество остаточного субстрата). Суперкритическая жидкостная хроматография: Условия анализа (для оптической чистоты), используемые для примеров 29-42: Колонка: Daicel AD колонка размерами 2504,6 мм (размер частиц 5 мкм). Подвижная фаза: двуокись углерода. Модификатор: метанол с диэтиламином (0,5%) и трифторуксусной кислотой (0,5%). Градиент модификатора: 1-2% за 4 мин 2-4% за 4 мин 4-8% за 4 мин 8-16% за 4 мин 16-32% за 4 мин 32-45% за 1,62 мин Температура: температура окружающей среды. Скорость потока: 2 мл/мин. Давление: 20 МПа. Детекция: UV 230 и 254 нм. Инжекционный объем: 10 мкл. Оптическая чистота (% эи)=(А-В)/(А+В)100 (А и В представляют собой соответствующий стереоизомер, АВ). Е-величина=ln1-c/100)(1-Es/100/ln1-c/100)(1+Es/100 (с - степень конверсии, Es - оптическая чистота остаточного субстрата). Пример 1.(S)-4-[4-Диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрил. Вода (200,7 г) и толуол (440,8 г) добавляли к -4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрилу, 1/2 соли серной кислоты (100,4 г, 0,257 моль), затем смесь перемешивали в течение 15 мин и температуру повышали до 60 С. Далее, по каплям на протяжении 5 мин добавляли 30% NaOH (34,5 г, 0,259 моль) до тех пор, пока рН водного слоя не достигал 11,4 и смесь перемешивали в течение 30 мин. После перемешивания смесь оставляли стоять в течение 5 мин и ее разделяли. Водный слой отбрасывали, полученный таким образом органический слой промывали 220,0 г воды и затем концентрировали при пониженном давлении при 60 С для удаления оставшейся влаги. Концентрацию доводили добавлением толуола и получали, таким образом, 583,1 г раствора 4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле (содержание чистого 4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила: 87,6 г, выход: 99,7%, 0,256 моль). Затем 52,5 г толуола выливали на 17,5 г иммобилизованного фермента(Novozym 435), затем добавляли 583,1 г раствора 4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и температуру смеси доводили до 40 С. Далее,на протяжении 20 мин в полученную выше смесь добавляли смешанный раствор, содержащий пивалиновую кислоту (28,7 г, 0,281 моль), винилбутират (29,2 г, 0,256 моль) и толуол (28,8 г) и смесь перемешивали при 40 С в течение 12 ч в слабом токе азота. После охлаждения смеси в течение 2 ч так, чтобы она достигла 20 С, ее перемешивали в течение 1 ч при той же температуре и перемешивание прекращали. Фермент отфильтровывали и затем промывали дважды 105 г толуола и толуольные слои объединяли. Толуольный слой содержал 583,1 г раствора 4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила в толуоле (содержание чистого (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 36,0 г, выход в результате процесса ферментативного расщепления: 41,1%, 0,105 моль). Смешанный раствор, содержащий супернатант и промывную жидкость, экстрагировали три раза водой (438 г, 263 г 2) и 1005,4 г полученного водного слоя промывали пять раз 79 г толуола. В результате получали 985,2 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила содержание чистого(S)-4-[4 диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила: 32,6 г, выход (в результате экстрагирования водой до промывки толуолом): 90,6%, 0,0952 моль. К полученным таким образом 985,2 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила добавляли 218,2 г толуола. Далее, к смеси при перемешивании медленно добавляли 30% NaOH (13,3 г, 0,0998 моль) до тех пор, пока рН водного слоя не достигал 11,9 и смесь выдерживали при перемешивании в течение 30 мин. После перемешивания смесь оставляли стоять 30 мин, толуольный слой отделяли и оставшийся водный слой повторно экстрагировали 142,5 г толуола. Объединенный толуольный слой промывали дважды 169,0 г воды, концентрировали при 60 С при пониженном давлении, получая таким образом 64,0 г раствора (S)-4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле. Указанный толуольный раствор- 22011762 содержал 32,0 г (0,0935 моль) (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. Общий выход составил 36,4%. Оптическая чистота, определенная с помощью ВЭЖХ, составляла 98,7% эи и химическая чистота составляла 99,9% по площади, (R)-5-циано-2-[диметиламино(4'фторфенил)гидроксибутил]бензилбутират: 0,04% по площади. В описанной выше системе указанная выше "химическая чистота" представлена следующим уравнением:(Химическая чистота)=[Величина площади 4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила]/[(Величина площади всех выявленных соединений)-(Величина площади толуола)-(Величина площади, выведенная из системы)]100 (% площади). Пример 2. В пробирку, оснащенную пробкой, помещали 50 мг (0,146 ммоль) -4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, 25 мг различных видов липаз, 33 мг(0,29 ммоль) винилбутирата и 1 мл толуола и смесь перемешивали при 40 С в течение 16 ч. Для субстрата с оптической чистотой по крайней мере 50% эи вычисляли Е-величины. Результаты представлены в табл. 1 Таблица 1Novozymes, E/S соотношение=1,0), 33-333 мг (10 экв.) винилбутирата и 1 мл толуола и смесь перемешивали при 30 С в течение 16 ч. Результаты представлены в табл. 2. Таблица 2 Пример 4. В пробирку, оснащенную пробкой, помещали 100 мг (0,292 ммоль) -4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, 50 мг Novozym 435 (продукт Novozymes),333 мг (2,92 ммоль) винилбутирата, 0,292 ммоль различных видов добавок и 1 мл толуола и смесь перемешивали при 40 С в течение 16 ч. Результаты представлены в табл. 3. Таблица 3 Пример 5. В четырехгорлой колбе объемом 200 мл, снабженной мешалкой и термометром, в 30 мл толуола растворяли 1,5 г (4,38 ммоль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, затем добавляли 0,45 г Novozym 435 (продукт Novozymes), 0,347 г (4,38 ммоль) пиридина, 4,38 ммоль различного вида кислот и 1,00 г (8,76 ммоль) винилбутирата и смесь перемешивали при 40 С в течение между 16 и 21,5 ч. Результаты представлены в табл. 4. Таблица 4- 24011762 Пример 6. В четырехгорлой колбе объемом 200 мл, снабженной мешалкой и термометром, в 30 мл толуола растворяли 3,0 г (8,76 ммоль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, затем добавляли 0,9 г Novozym 435 (продукт Novozymes), 0,693 г (8,76 ммоль) пиридина, 8,76 ммоль различного вида кислот и 2,00 г (17,52 ммоль) винилбутирата и смесь перемешивали при 40 С в течение 15,5-16,5 ч. Результаты представлены в табл. 5. Таблица 5 Пример 7. В четырехгорлой колбе, объемом 200 мл, снабженной мешалкой и термометром, в 30 мл толуола растворяли 4,5 г (13,1 ммоль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила, затем добавляли 0,90 г Novozym 435 (продукт Novozymes), 2,68 г(26,2 ммоль) пивалиновой кислоты и 0,900-1,500 г (0,6-1,0 экв.) винилбутирата и смесь перемешивали при 40 С в течение 24 ч. Результаты представлены в табл. 6. Таблица 6 Пример 8. В разъемной колбе объемом 500 мл, снабженной мешалкой и термометром, в 144 мл толуола растворяли 20,0 г (58,4 ммоль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, затем добавляли пивалиновую кислоту (1,1-3 экв.), 4,0 г Novozym 435 (продукт Novozymes) и 6,67 г (58,4 ммоль) винилбутирата и смесь перемешивали при 40 С в течение 20-24 ч в токе азота (5 мл/мин). Результаты представлены в табл. 7. Таблица 7 Пример 9. В пробирку, оснащенную пробкой, загружали 10 мг (0,029 ммоль) -4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, 10 мг Novozym 435 (продукт Novozymes),0,29 ммоль различных видов ацильного донора и 1 мл диизопропилового эфира и смесь перемешивали при 30 С в течение 16 ч. Для субстрата с оптической чистотой по крайней мере 30% эи вычисляли Е-величины. Результаты представлены в табл. 8. Пример 10. В пробирку, оснащенную пробкой, загружали 10 мг (0,029 ммоль) -4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила, 10 мг Novozym 435 (продукт Novozymes),33 мг (0,29 ммоль) винилбутирата и 1 мл различных видов растворителей и смесь перемешивали при 30 С в течение 16 ч. После реакции анализировали коэффициенты конверсии и оптические чистоты и вычисляли Е-величины. Результаты представлены в табл. 9. Таблица 9(E/S соотношения составляют 0,2-0,3) Novozym 435 (продукт Novozym). Затем в колбу добавляли раствор 4,5 г (13,1 ммоль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в 30 мл толуола, 2,01 г пивалиновой кислоты (19,7 ммоль) и 1,50 г (13,1 ммоль) винилбутирата и смесь перемешивали при температуре 35-45 С в течение 21 ч. По завершении реакции, реакционную жидкость отделяли декантированием и оставшийся фермент промывали 30 мл толуола и выделя- 26011762 ли. Ту же самую операцию, что описана выше, за исключением использования выделенного фермента,повторяли четыре раза для осуществления реакции рециркуляции. Активности ферментов вычисляли согласно следующему уравнению: Активность фермента (U/g)=(Количество продукта, полученного в минуту (мкмоль/мин/(Вес фермента Пример 12. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. В четырехгорлую колбу, снабженную мешалкой и термометром, загружали 66,6 г раствора 10,0 г(0,029 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составляла 40 С. Затем в указанную смесь добавляли 2,27 г (0,029 моль) пиридина, 2,98 г (0,029 моль) пивалиновой кислоты, 3,35 г (0,029 моль) винилбутирата и 2,0 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 15 ч в слабом токе азота и перемешивание прекращали. Фермент отфильтровывали из реакционной смеси с помощью воронки Kiriyama и промывали 21,6 г толуола. В результате получали соль пивалиновой кислоты и(S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила (3,6 г, 0,011 моль, выход: 36,0%, оптическая чистота: 98,5% эи). Объединенный толуольный слой трижды промывали водой (50, 30, 30 мл) при 20 С и получали водный слой, содержащий соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрил (3,5 г, 0,011 моль, экстракционный выход: 95%). Пример 13. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. В четырехгорлую колбу, снабженную мешалкой и термометром, загружали 66,7 г раствора 20,0 г(0,058 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составила 40 С. Затем в указанную смесь добавляли 5,93 г (0,058 моль) пивалиновой кислоты, 6,62 г (0,058 моль) винилбутирата и 4,1 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 18 ч в слабом токе азота и перемешивание прекращали. Фермент отфильтровывали из реакционной смеси с помощью воронки Kiriyama и промывали 41,3 г толуола. В результате получали 6,7 г (0,020 моль) соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в растворе толуола с выходом 33,5% и оптической чистотой 99,7% эи. Пример 14. Соль циклогексанкарбоновой кислоты и(0,073 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составила 40 С. Затем в указанную смесь добавляли 5,77 г (0,073 моль) пиридина, 8,33 г (0,073 моль) винилбутирата, 9,52 г (0,073 моль) циклогексанкарбоновой кислоты и 5,0 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 17,5 ч в слабом токе азота и перемешивание прекращали. Фермент отфильтровывали и промывали 54,1 г толуола. В результате получали толуольный слой, содержащий соль циклогексанкарбоновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (8,6 г, 0,025 моль, выход: 34,4%, оптическая чистота: 98,7% эи). Объединенный толуольный слой промывали водой пять раз (187,5 мл 5) при 20 С и получали водный слой, содержащий соль циклогексанкарбоновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)1-гидроксибутил]-3-гидроксиметилбензонитрила (7,6 г, 0,0221 моль, экстракционный выход: 89%).- 27011762 Пример 15. Соль о-толуиловой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. В четырехгорлую колбу, снабженную мешалкой и термометром, загружали 250,0 г раствора 25,0 г (0,073 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составляла 40 С. Затем в указанную смесь добавляли 5,77 г (0,073 моль) пиридина, 8,33 г (0,073 моль) винилбутирата, 9,93 г(0,073 моль) о-толуиловой кислоты и 5,0 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 21 ч в слабом токе азота и затем перемешивание прекращали. Фермент отфильтровывали из реакционной смеси с помощью воронки Kiriyama и промывали 54,1 г толуола. В результате получали толуольный слой, содержащий соль о-толуиловой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (9,7 г,0,028 моль, выход: 38,8%, оптическая чистота: 97,8% эи). Объединенный толуольный слой трижды промывали водой (250, 63, 63 мл) при 60 С и получали водный слой, содержащий соль о-толуиловой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила (7,8 г, 0,0228 моль, экстракционный выход: 80%). Пример 16. Соль изомасляной кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. В четырехгорлую колбу, снабженную мешалкой и термометром, загружали 33,3 г раствора 10,0 г(0,029 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составляла 40 С. Затем в указанную смесь добавляли 2,29 г (0,029 моль) пиридина, 2,57 г (0,029 моль) изомасляной кислоты, 3,33 г (0,029 моль) винилбутирата и 2,0 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 24 ч в слабом токе азота и перемешивание прекращали. Фермент отфильтровывали из реакционной смеси с помощью воронки Kiriyama и промывали 21,6 г толуола. В результате получали толуольный слой, содержащий соль изомасляной кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила (3,8 г, 0,011 моль, выход: 38,0%, оптическая чистота: 95,9% эи). Пример 17. Соль бензойной кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. В четырехгорлую колбу, снабженную мешалкой и термометром, загружали 250,0 г раствора 50,0 г(0,146 моль) -4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила в толуоле и его температуру регулировали так, чтобы она составляла 40 С. Затем в указанную смесь добавляли 11,5 г (0,146 моль) пиридина, 33,2 г (0,291 моль) винилбутирата, 17,8 г (0,146 моль) бензойной кислоты и 10,0 г иммобилизованного фермента (Novozym 435). Реакционную смесь перемешивали при 40 С в течение 20 ч в слабом токе азота и перемешивание прекращали. Фермент отфильтровывали из реакционной смеси с помощью воронки Kiriyama и промывали 108 г толуола. В результате получали толуольный слой, содержащий соль бензойной кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила (22,0 г, 0,064 моль, выход: 44,0%, оптическая чистота: 99,0% эи). Объединенный толуольный слой трижды промывали водой (500 мл 3) при 60 С и получали водный слой, содержащий соль бензойной кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]3-гидроксиметилбензонитрила (21,0 г, 0,0614 моль, экстракционный выход: 96%). Следующие примеры 18-28 иллюстрируют выделение S-диола из реакционной смеси. Пример 18. В пробирку, оснащенную пробкой, загружали 4,3 мг (0,0126 ммоль) (S)-4-[4-диметиламино-1-(4'фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (соединение А), 6,8 мг (0,0165 ммоль)(R)-5-циано-2-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]бензилбутирата (соединение В), 1 мл толуола, 1 мл воды и 0,291 ммоль кислот различного вида (в случае двухосновной кислоты используют 0,146 ммоль) и смесь перемешивали при 40 С в течение 1 ч. Полученный таким образом смешанный раствор разделяли на водный и толуольный слои и затем в каждом слое измеряли концентрации соединений А и В. Коэффициенты распределения Ka или Kb вычисляли согласно следующим уравнениям: Пример 19. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. Фермент отфильтровывали из реакционной ферментной смеси, полученной способом согласно примеру 1, и дважды промывали толуолом. В полученные таким образом 1174,3 г толуольного раствора,содержащего соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила (44,8 г, 0,131 ммоль), добавляли 600,3 г воды и смесь экстрагировали. Дальнейшая двукратная экстракция 359,7 г воды давала 1375,9 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила. Водный раствор содержал 43,8 г (0,128 моль, выход: 97,8%) (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила. Оптическая чистота: 98,4% эи, (R)-5-циано-2- 29011762[диметиламино(4'-фторфенил)гидроксибутил]бензилбутират: 10,7% по площади. Пример 20. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. К 12,6 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила содержание (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 0,4 г, 1,168 ммоль, полученной отдельно по способу примера 19, добавляли 1,4 г (0,018 моль) ацетата аммония. Затем туда добавляли 1,0 г толуола и смесь перемешивали 10 мин. После стояния в течение 30 мин органический слой отбрасывали, разделяя раствор смеси, и получали водный слой, содержащий соль пивалиновой кислоты и (S)-4-[4-диметиламино-1(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (0,389 г, 1,136 ммоль, выход: 97,3%). С помощью анализа ВЭЖХ было найдено, что химическая чистота составляла 97,3% по площади и содержалось (R)-5-циано-2-[диметиламино(4'-фторфенил)гидроксибутил]бензилбутирата: 1,5% по площади. Пример 21. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. К 12,6 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила содержание (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 0,4 г, 1,168 ммоль, полученной отдельно по способу примера 19, добавляли 1,4 г (0,013 моль) сульфата лития. Затем добавляли 1,0 г толуола и смесь перемешивали в течение 10 мин. После стояния в течение 30 мин органический слой отбрасывали, разделяя раствор смеси, и получали водный слой, содержащий соль пивалиновой кислоты и (S)-4-[4 диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (0,394 г, 1,151 ммоль,выход: 98,5%). С помощью анализа ВЭЖХ было найдено, что химическая чистота составляла 93,7% по площади, и содержалось (R)-5-циано-2-[диметиламино(4'-фторфенил)гидроксибутил]бензилбутират: 5,5% по площади. Пример 22. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. К 12,6 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила содержание (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 0,4 г, 1,168 ммоль, полученной отдельно по способу примера 19, добавляли 1,4 г (0,011 моль) сульфата аммония. Затем добавляли 1,0 г толуола и смесь перемешивали в течение 10 мин. После стояния в течение 30 мин, органический слой отбрасывали, разделяя раствор смеси, и получали водный слой, содержащий соль пивалиновой кислоты и (S)-4-[4 диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (0,397 г, 1,159 ммоль,выход: 99,3%). С помощью анализа ВЭЖХ было найдено, что химическая чистота составляла 94,7% по площади, и содержалось (R)-5-циано-2-[диметиламино(4'-фторфенил)гидроксибутил]бензилбутирата: 4,5% по площади. Пример 23. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. К 12,6 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила содержание (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 0,4 г, 1,168 ммоль, полученной отдельно по способу примера 19, добавляли 1,4 г (0,0099 моль) сульфата натрия. Затем добавляли 1,0 г толуола и смесь перемешивали в течение 10 мин. После стояния в течение 30 мин органический слой отбрасывался путем разделения раствора смеси и получали водный слой, содержащий соль пивалиновой кислоты и (S)-4-[4 диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3-гидроксиметилбензонитрила (0,391 г, 1,142 ммоль,выход: 97,8%). С помощью анализа ВЭЖХ было найдено, что химическая чистота составляла 94,5% по площади, и содержалось (R)-5-циано-2-[диметиламино(4'-фторфенил)гидроксибутил]бензилбутирата: 4,7% по площади. Пример 24. Соль пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1-гидроксибутил]-3 гидроксиметилбензонитрила. К 12,6 г водного раствора соли пивалиновой кислоты и (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила содержание (S)-4-[4-диметиламино-1-(4'-фторфенил)-1 гидроксибутил]-3-гидроксиметилбензонитрила: 0,4 г, 1,168 ммоль, полученной отдельно по способу примера 19, добавляли 0,7 г (0,012 моль) хлорида натрия. Затем добавляли 1,0 г толуола и смесь перемешивали в течение 10 мин. После стояния в течение 30 мин органический слой отбрасывали, разделяя раствор смеси, и получали водный слой, содержащий соль пивалиновой кислоты и
МПК / Метки
МПК: C07B 57/00, C07D 307/87, C07C 255/53, C07C 253/34
Метки: способ, которые, соединений, эсциталопрама, могут, выделения, промежуточных, использоваться, получения
Код ссылки
<a href="https://eas.patents.su/30-11762-sposob-vydeleniya-promezhutochnyh-soedinenijj-kotorye-mogut-ispolzovatsya-dlya-polucheniya-escitaloprama.html" rel="bookmark" title="База патентов Евразийского Союза">Способ выделения промежуточных соединений, которые могут использоваться для получения эсциталопрама</a>
Предыдущий патент: Способ лечения висцеровертеброгенного болевого синдрома
Следующий патент: Способы получения венлафаксина и формы i венлафаксина гидрохлорида
Случайный патент: Устройство для извлечения клеща












