Препараты бензотиазола и их применение
Номер патента: 11614
Опубликовано: 28.04.2009
Авторы: Грандолини Симоне, Жанклод-Эттер Изабелль, Готтелан Жан-Пьер, Гайяр Паскаль, Бертеро Стефания, Майо Марио, Донати Лука, Леонарди Андреа, Кикко Даниела, Эспозито Пьерандреа
Формула / Реферат
1. Фармацевтическая композиция, содержащая бензотиазол формулы (I)
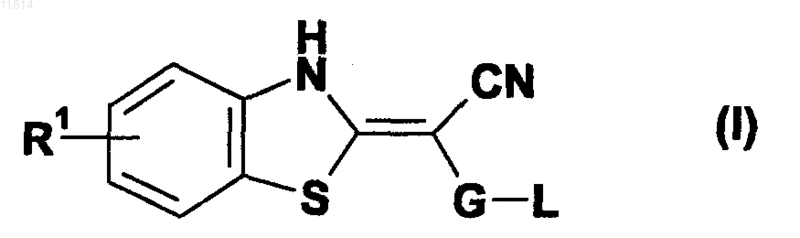
а также его таутомеры, его геометрические изомеры, его оптически активные формы в виде энантиомеров, диастереомеры и рацемические формы, а также их фармацевтически приемлемые соли,
где G представляет собой пиримидинильную группу;
L представляет собой С1-С6-алкокси, или аминогруппу, или 3-8-членный гетероциклоалкил, содержащий по крайней мере один гетероатом, выбранный из N, O и S;
R1 выбран из группы, содержащей или состоящей из водорода, сульфонила, амино, C1-С6-алкила, С2-С6-алкенила, С2-С6-алкинила, C1-С6-алкокси, арила, галогена, циано и гидрокси;
и глицерид макрогола.
2. Композиция по п.1, где глицерид макрогола представляет собой глицерид стеароила.
3. Композиция по п.1 или 2, где глицерид макрогола представляет собой Gelucireв 50/13.
4. Композиция по любому из предшествующих пунктов, которая содержит Gelucireв 50/13 в количестве от 40 до 95% мас./мас. от массы всей композиции.
5. Композиция по любому из предшествующих пунктов, которая содержит Gelucireв 50/13 в количестве от 40 до 60% мас./мас. от массы всей композиции.
6. Композиция по любому из предшествующих пунктов, содержащая бензотиазол в количестве от 5 до 40% мас./мас. от массы всей композиции.
7. Композиция по любому из предшествующих пунктов, содержащая бензотиазол в количестве от 20 до 40% мас./мас. от массы всей композиции.
8. Композиция по любому из предшествующих пунктов, где бензотиазол представляет собой 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрил.
9. Композиция по любому из предшествующих пунктов, где бензотиазол представляет собой мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила.
10. Композиция по любому из предшествующих пунктов, где композиция дополнительно содержит полоксамер.
11. Композиция по любому из предшествующих пунктов, где композиция дополнительно содержит полоксамер и где полоксамер представляет собой полоксамер 188.
12. Композиция по любому из пп.1-9, где композиция дополнительно содержит полиэтиленгликоль (ПЭГ).
13. Композиция по любому из пп.1-9, где указанная композиция содержит по крайней мере 20% мас./мас. мезилата 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила и Gelucireв 50/13 в количестве от 40 до 80% мас./мас. от массы всей композиции.
14. Композиция по любому из предшествующих пунктов, где композиция выбрана из группы
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 80% мас./мас. |
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 60% мас./мас. |
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 70% мас./мас. |
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 40% мас./мас. |
| Lutrolв F68 | 40% мас./мас. |
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 40% мас./мас. |
| Lutrolв E6000 | 40% мас./мас. |
| мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила |
|
| Gelucireв 50/13 | 95% мас./мас. |
15. Применение композиции по пп.1-14 для изготовления фармацевтического препарата для лечения расстройства, выбранного из аутоиммунных расстройств, респираторных расстройств, нейродегенеративных расстройств или расстройств нервной системы, воспалительных заболеваний, склеродермы и склеродермаподобных расстройств, диабета, фиброза, рака и эндометриоза.
16. Применение по п.15, где расстройство выбрано из рассеянного склероза, астмы и ревматоидного артрита.
17. Способ получения композиции по пп.1-14, где указанный способ содержит стадии получения бензотиазола в соответствии с формулой (I) и добавления бензотиазола в соответствии с формулой (I) к расплавленной композиции глицерида макрогола.
18. Способ по п.17, где бензотиазол вводят в расплавленную композицию глицерида макрогола в виде порошка при перемешивании.
19. Способ по п.17 или 18, где бензотиазол вводят в расплавленный глицерид макрогола в виде порошка при перемешивании и где способ дополнительно включает стадии охлаждения гомогенной расплавленной дисперсии; измельчения полученного твердого вещества до частиц.
20. Способ по п.19, где стадия охлаждения представляет собой стадию распыления в атмосфере CO2.
21. Способ по пп.19 и 20, где способ дополнительно включает стадию сушки "до отлипа" после стадии измельчения.
22. Способ по п.17 или 18, где бензотиазол вводят в расплавленный глицерид макрогола в виде порошка при перемешивании и где способ дополнительно включает стадию охлаждения гомогенной расплавленной дисперсии путем охлаждения распылением.
23. Способ по п.17, где бензотиазол вводят в расплавленный глицерид макрогола в виде водного раствора при перемешивании.
Текст
011614 Область изобретения Настоящее изобретение относится к фармацевтическим препаратам на основе глицеридов макроголов, содержащим производные бензотиазола. В частности, изобретение относится к препаратам производных бензотиазола на основе глицеридов стеароилмакроголов, способу их получения и их применению. Уровень техники Глицериды макроголов, т.е. насыщенные полигликолизированные глицериды, представляют собой наполнители типа "Gelucire". Gelucires представляют собой полутвердые наполнители, полученные алкоголизом природных масел с полиэтиленгликолями. Gelucires представляют собой смесь моно-, дии триглицеридов (сложные эфиры жирных кислот глицерина) и эфиров моно- и дижирных кислот и полиэтиленгликоля (ПЭГ или макрогол). Сложные эфиры жирных кислот глицерина и сложные эфиры ПЭГ, присутствующие в Gelucires, получают из жирных кислот с длинными цепями (C12-C18). Большое семейство Gelucires характеризуется широким диапазоном температур плавления от около 33 до около 64C и гидрофильно-липофильным балансом (HLB) от около 1 до около 14. Природа и соотношение каждого компонента являются конкретными для конкретных видов Gelucires. Вид Gelucires обозначается двумя цифрами, разделенными косой чертой, первое число показывает его температуру плавления, а второе HLB.Gelucires использовали ранее в качестве наполнителей в различных препаратах, таких как препараты теофиллин (Theophilline) (США 4988679), каптоприл (Captopril) (США 5433951), или в качестве ингибитора протеазы ВИЧ (Aungst et al., 1994, Bull. Tech. Gattefosse, 87, 49-54). Коммерчески доступный Gelucires содержит Gelucire 44/14, Gelucire 50/13, Gelucire 53/10, Gelucire 50/02, Gelucire 54/02 (также доступный как Precirol), Gelucire 62/05, Gelucire 64/02 (также доступный как Precirol WL 2155). Было обнаружено, что производные бензотиазола могут быть использованы при лечении различных расстройств, например расстройств аутоиммунной и нейрональной систем, а также воспалительных заболеваний (WO 01/47920, WO 03/091249 и WO 03/047570). Пероральный способ введения является предпочтительным, особенно при хронических состояниях. Сущность изобретения Настоящее изобретение относится к фармацевтическим препаратам на основе глицеридов макроголов, содержащим производные бензотиазола. В частности, изобретение относится к композициям производных бензотиазола на основе глицеридов стеароилмакроголов, способу их получения и их применению. В соответствии с одним из вариантов осуществления настоящее изобретение относится к фармацевтическому препарату на основе глицеридов макроголов, содержащему производные бензотиазола. В соответствии с другим вариантом осуществления изобретение относится к фармацевтическому препарату на основе глицеридов макроголов, содержащему, кроме того, по крайней мере один полоксамер в качестве наполнителя. В соответствии с другим вариантом осуществления изобретение относится к фармацевтическому препарату на основе глицеридов макроголов, содержащему дополнительно по крайней мере один полоксамер и один полиэтиленгликоль в качестве наполнителя. В первом аспекте изобретение относится к фармацевтическому препарату на основе глицеридов макроголов, содержащему бензотиазол производное формулы (I) где R1, G И L определены в подробном описании. Во втором аспекте изобретение относится к способу получения фармацевтической композиции на основе глицеридов макроголов, включающему стадии получения производного бензотиазола формулы(I) и добавления бензотиазола формулы (I) в расплавленный препарат на основе глицерида макрогола. Подробное описание изобретения Ниже приводится определение различных химических групп, которые входят в состав соединений по изобретению, и эти определения предназначены для единообразного использования на протяжении всего описания и пунктов формулы изобретения, если в описании специально не указаны более широкие определения. Определения Термин "глицериды макроголов" относится к насыщенным полигликолизированным глицеридам,таким как глицериды стеароил-, лауроил-, олеоил-, линеоил-, каприлокапроилмакроголов. Подходящие глицериды макроголов по изобретению представляют собой Gelucires. Термин "Gelucires" относится к насыщенному полигликолизированному глицериду, который представляет собой смесь моно-, ди- и триглицеридов (эфиры жирных кислот глицерина) и моно- и диэфиров жирной кислоты и полиэтилен-1 011614 гликоля (ПЭГ или макрогол). Примерами Gelucires являются Gelucire 37/02, 37/06, 42/12, 44/14, 46/07, 48/09, 50/13, 53/10, 50/02,54/02, 62/05 и 64/02, предпочтительно 50/13. Термин "поверхностно-активное вещество" относится к растворимому соединению, которое ослабляет поверхностное натяжение жидкостей или ослабляет межфазное натяжение между двумя жидкостями или жидкостью и твердым веществом, при этом поверхностное натяжение является такой силой, действующей на поверхность жидкости, которая стремится минимизировать площадь поверхности. Поверхностно-активные вещества иногда использовали в фармацевтических препаратах, включая доставку лекарственных средств с низкой молекулярной массой и полипептидов, для модификации абсорбции лекарственного средства или его высвобождения в целевых тканях. Хорошо известные поверхностноактивные вещества включают полисорбаты (производные полиоксиэтилена; Tween), а также полоксамеры. Термин "полоксамер" относится к блок-сополимеру поли(этиленоксид) и поли(пропиленоксид), хорошо известным как неионные поверхностно-активные вещества, обозначаемым товарным знаком Pluronics. Примерами полоксамеров являются Полоксамер 407 (Lutrol F127 или Pluronic F127), Полоксамер 338 (Lutrol F108 или Pluronic F108), Полоксамер 108 (Lutrol F-38 или Pluronic F-38) и Полоксамер 188 (Lutrol F68 или Pluronic F68), предпочтительно Полоксамер 188 или Полоксамер 407. Термин "лечение" в контексте данного изобретения относится к любому положительному эффекту в отношении развития заболевания, включая уменьшение, снижение или ослабление развития патологий после начала заболевания. Термин "С 1-С 6-алкил" относится к алкильным группам, содержащим 1-6 атомов углерода. Этот термин иллюстрируется примерами групп, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, н-бутил, н-пентил, н-гексил и тому подобное. Термин "арил" относится к ненасыщенной ароматической карбоциклической группе, содержащей от 6 до 14 атомов углерода, имеющей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительный арил включает фенил, нафтил, фенантренил и тому подобное. Термин "C1-С 6-алкиларил" относится к C1-С 6-алкильным группам, содержащим арильный заместитель, включая бензил, фенетил и тому подобное. Термин "гетероарил" относится к моноциклической гетероароматической или бициклической или трициклической конденсированно-кольцевой гетероароматической группе. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил,пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3 триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4 оксадиазолил, 1,3,4-триазинил, 1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил,бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3H-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил,хинолил, изохинолил, тетразолил, 5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил,птеридинил, карбазолил, ксантенил или бензохинолил. Термин "C1-С 6-алкилгетероарил" относится к С 1-С 6-алкильным группам, имеющим гетероарильный заместитель, включая 2-фурилметил, 2-тиенилметил, 2-(1 Н-индол-3-ил)этил и тому подобное. Термин "С 2-С 6-алкенил" относится к алкенильным группам, предпочтительно содержащим от 2 до 6 атомов углерода и имеющим по крайней мере 1 или 2 участка алкенильной ненасыщенности. Предпочтительные алкенильные группы включают этенил (-CH=CH2), н-2-пропенил (аллил, -CH2CH=CH2) и тому подобное. Термин "С 2-С 6-алкениларил" относится к C2-C6-алкенильным группам, имеющим арильный заместитель, включая 2-фенилвинил и тому подобное. Термин "С 2-С 6-алкенилгетероарил" относится к C2-C6-алкенильным группам, имеющим гетероарильный заместитель, включая 2-(3-пиридинил)винил и тому подобное. Термин "С 2-С 6-алкинил" относится к алкинильным группам, предпочтительно имеющим от 2 до 6 атомов углерода и имеющим по крайней мере 1-2 участка алкинильной ненасыщенности, предпочтительные алкинильные группы включают этинил (-CCH), пропаргил (-CH2CCH) и тому подобное. Термин "С 2-С 6-алкиниларил" относится к C2-C6-алкинильным группам, имеющим арильный заместитель, включая фенилэтинил и тому подобное. Термин "С 2-С 6-алкинилгетероарил" относится к C2-C6-алкинильным группам, имеющим гетероарильный заместитель, включая 2-тиенилэтинил и тому подобное. Термин "С 3-С 8-циклоалкил" относится к насыщенной карбоциклической группе, содержащей от 3 до 8 атомов углерода, имеющей одно кольцо (например, циклогексил) или несколько конденсированных колец (например, норборнил). Предпочтительный циклоалкил включает циклопентил, циклогексил, норборнил и тому подобное.-2 011614 Термин "C1-С 6-алкилциклоалкил" относится к C1-С 6-алкильным группам, имеющим циклоалкильный заместитель, включая циклогексилметил, циклопентилпропил и тому подобное. Термин "гетероциклоалкил" относится к С 3-С 8-циклоалкильной группе в соответствии с вышеуказанным определением, в которой от 1 до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, где R представляет собой водород или C1-С 6-алкил. Предпочтительный гетероциклоалкил включает пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и тому подобное. Термин "C1-С 6-алкилгетероциклоалкил" относится к C1-C6-алкильным группам, имеющим гетероциклоалкильный заместитель, включая 2-(1-пирролидинил)этил, 4-морфолинилметил, (1-метил-4 пиперидинил)метил и тому подобное. Термин "карбокси" относится к группе -C(O)OH. Термин "C1-С 6-алкилкарбокси" относится к C1-С 6-алкильным группам, имеющим карбокси заместитель, включая 2-карбоксиэтил и тому подобное. Термин "ацил" относится к группе -C(O)R, где R включает H, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, C3-C8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-C6-алкиларил или C1-С 6 алкилгетероарил,С 2-С 6-алкениларил,C2-С 6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил. Термин "C1-С 6-алкилацил" относится к C1-С 6-алкильным группам, имеющим ацильный заместитель, включая 2-ацетилэтил и тому подобное. Термин "арилацил" относится к арильным группам, имеющим ацильный заместитель, включая 2 ацетилфенил и тому подобное. Термин "гетероарилацил" относится к гетероарильным группам, имеющим ацильный заместитель,включая 2-ацетилпиридил и тому подобное. Термин "C3-C8-(гетеро)циклоалкилацил" относится к 3-8 членным циклоалкильным или гетероциклоалкильным группам, имеющим ацильный заместитель. Термин "ацилокси" относится к группе -OC(O)R, где R включает H, C1-С 6-алкил, С 2-С 6-алкенил, С 2 С 6-алкинил, C3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6 алкилгетероарил,С 2-С 6-алкениларил,С 2-С 6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил. Термин "C1-С 6-алкилацилокси" относится к C1-С 6-алкильным группам, имеющим ацилокси заместитель, включая 2-(ацетилокси)этил и тому подобное. Термин "алкокси" относится к группе -O-R, где R включает C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, C3-C8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-C6-алкиларил или C1-С 6 алкилгетероарил,С 2-С 6-алкениларил,C2-С 6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил. Термин "C1-С 6-алкилалкокси" относится к C1-С 6-алкильным группам, имеющим алкокси заместитель, включая 2-этоксиэтил и тому подобное. Термин "алкоксикарбонил" относится к группе -C(O)OR, где R включает C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, C3-C8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-C6-алкиларил или C1 С 2-С 6-алкениларил,C2-С 6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 С 6-алкилгетероарил,алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил. Термин "C1-С 6-алкилалкоксикарбонил" относится к C1-C6-алкильным группам, имеющим алкоксикарбонильный заместитель, включая 2-(бензилоксикарбонил)этил и тому подобное. Термин "аминокарбонил" относится к группе -C(O)NRR', где каждый R, R' включает, независимо,водород, C1-С 6-алкил, C2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил, С 2 С 6-алкиниларил, C2-C6-алкинилгетероарил, С 1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил. Термин "C1-С 6-алкиламинокарбонил" относится к C1-C6-алкильным группам, имеющим аминокарбонильный заместитель, включая 2-(диметиламинокарбонил)этил и тому подобное. Термин "ациламино" относится к группе -NRC(O)R', где каждый R, R' представляет собой, независимо, водород, C1-C6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил,гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил,С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкилациламино" относится к C1-С 6-алкильным группам, имеющим ациламино заместитель, включая 2-(пропиониламино)этил и тому подобное. Термин "уреидо" относится к группе -NRC(О)NR'R", где каждый R, R', R" представляет собой, независимо, водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил,арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6 алкенилгетероарил, С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6 алкилгетероциклоалкил и где R' и R" вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "C1-С 6-алкилуреидо" относится к C1-C6-алкильным группам, имеющим уреидозаместитель,-3 011614 включая 2-(N'-метилуреидо)этил и тому подобное. Термин "карбамат" относится к группе -NRC(O)OR', где каждый R, R' представляет собой, независимо, водород, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил,гетероарил, C1-C6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил,С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "амино" относится к группе -NRR', где каждый R, R' представляет собой, независимо, водород, C1-С 6-алкил, C2-C6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил,C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил, С 2-С 6 алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, алкокси и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 38-членное гетероциклоалкильное кольцо. Термин "C1-С 6-алкиламино" относится к C1-C6-алкильным группам, имеющим амино заместитель,включая 2-(1-пирролидинил)этил и тому подобное. Термин "аммоний" относится к положительно заряженной группе -N+RR'R", где каждый R, R', R" представляет собой, независимо, C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, C3-С 8-циклоалкил, гетероциклоалкил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил,С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8 членное гетероциклоалкильное кольцо. Термин "C1-С 6-алкиламмоний" относится к C1-С 6-алкильным группам, имеющим аммониевый заместитель, включая 2-(1-пирролидинил)этил и тому подобное. Термин "галоген" относится к атомам фтора, хлора, брома и йода. Термин "сульфонилокси" относится к группе -OSO2-R, где R выбран из группы, включающей H, C1 С 6-алкил, C1-C6-алкил, замещенный галогенами, например, группа -OSO2-CF3, C2-C6-алкенил, С 2-С 6 алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6 алкилгетероарил,С 2-С 6-алкениларил,C2-C6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 алкинилгетероарил, С 1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкилсульфонилокси" относится к C1-C6-алкильным группам, имеющим сульфонилокси заместитель, включая 2-(метилсульфонилокси)этил и тому подобное. Термин "сульфонил" относится к группе -SO2-R, где R выбран из группы, включающей H, арил, гетероарил, C1-С 6-алкил, C1-С 6-алкил, замещенный галогенами, например, группа -SO2-CF3, С 2-С 6-алкенил,С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6 алкилгетероарил,С 2-С 6-алкениларил,C2-C6-алкенилгетероарил,С 2-С 6-алкиниларил,C2-C6 алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкилсульфонил" относится к C1-С 6-алкильным группам, имеющим сульфонильный заместитель, включая 2-(метилсульфонил)этил и тому подобное. Термин "сульфинил" относится к группе -S(O)-R, где R выбран из группы, включающей H, C1-С 6 алкил, C1-С 6-алкил, замещенный галогенами, например -SO-CF3-группа, C2-C6-алкенил, С 2-С 6-алкинил,С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2 С 6-алкениларил, C2-C6-алкенилгетероарил, С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6 алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкилсульфинил" относится к С 1-С 6-алкильным группам, имеющим сульфинильный заместитель, включая 2-(метилсульфинил)этил и тому подобное. Термин "сульфанил" относится к группам -S-R, где R включает H, C1-С 6-алкил, C1-С 6-алкил, замещенный галогенами, например, группа -SO-CF3, С 2-С 6-алкенил, С 2-С 6-алкинил, C3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, С 2-С 6 алкенилгетероарил, С 2-С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6 алкилгетероциклоалкил. Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и тому подобное. Термин "C1-С 6-алкилсульфанил" относится к C1-С 6-алкильным группам, имеющим сульфанильный заместитель, включая 2-(этилсульфанил)этил и тому подобное. Термин "сульфониламино" относится к группе -NRSO2-R', где каждый R, R' включает, независимо,водород, C1-С 6-алкил, C2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-C6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил, С 2 С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкилсульфониламино" относится к C1-С 6-алкильным группам, имеющим сульфониламино заместитель, включая 2-(этилсульфониламино)этил и тому подобное. Термин "аминосульфонил" относится к группе -SO2-NRR', где каждый R, R' включает, независимо,водород, C1-С 6-алкил, C2-С 6-алкенил, С 2-С 6-алкинил, С 3-С 8-циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил или C1-С 6-алкилгетероарил, С 2-С 6-алкениларил, C2-C6-алкенилгетероарил, С 2 С 6-алкиниларил, C2-C6-алкинилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил. Термин "C1-С 6-алкиламиносульфонил" относится к C1-С 6-алкильным группам, имеющим амино-4 011614 сульфонильный заместитель, включая 2-(циклогексиламиносульфонил)этил и тому подобное."Замещенный или незамещенный": если в определении отдельного заместителя не указано иного,вышеуказанные группы, такие как алкил, алкенил, алкинил, арил и гетероарил и так далее, могут быть необязательно замещены от 1 до 5 заместителями, выбранными из группы, включающей необязательно замещенные C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, циклоалкил, гетероциклоалкил, арил, гетероарил, C1-С 6-алкиларил, C1-С 6-алкилгетероарил, C1-С 6-алкилциклоалкил, C1-С 6-алкилгетероциклоалкил,амино, аммоний, ацил, ацилокси, ациламино, аминокарбонил, алкоксикарбонил, уреидо, карбамат, арил,гетероарил, сульфинил, сульфонил, алкокси, сульфанил, галоген, карбокси, тригалогенметил, циано, гидрокси, меркапто, нитро и тому подобное. Альтернативно, указанное замещение может также включать случаи, когда соседние заместители подвергаются циклизации, особенно когда задействованы вицинальные функциональные заместители, образуя таким образом, например, лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали, аминали, образованные циклизацией, например, для получения защитной группы. Термин "фармацевтически приемлемые соли или комплексы" относится к солям или комплексам указанных далее соединений формулы (I), которые сохраняют желаемую биологическую активность. Примеры таких солей включают, но ими не ограничиваются, соли добавления кислот, образованные с неорганическими кислотами (например, хлористо-водородная кислота, бромисто-водородная кислота,серная кислота, фосфорная кислота, азотная кислота и тому подобное), и соли, образованные с органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота,яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота,дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота, метансульфоновая кислота и полигалактуроновая кислота. Такие соединения могут быть введены в виде фармацевтически приемлемых четвертичных солей,известных специалистам в данной области, которые, в частности, включают четвертичную соль аммония формулы -NR,R',R" + Z-, где R, R', R" представляют собой, независимо, водород, алкил, или бензил, С 1 С 6-алкил, C2-C6-алкенил, С 2-С 6-алкинил, С 1-С 6-алкиларил, C1-С 6-алкилгетероарил, циклоалкил, гетероциклоалкил и Z представляет собой противоион, включая хлорид, бромид, иодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, циннамоат, манделоат и дифенилацетат). Термин "энантиомерный избыток" (эи) относится к продуктам, получаемым путем асимметрического синтеза, то есть синтезом, включающим нерацемические исходные продукты и/или реагенты, или синтезом, включающим по крайней мере одну энантиоселективную стадию, посредством чего получают избыточное количество одного энантиомера порядка, по крайней мере, около 52% эи. Используемый в данном документе термин "интерферон" или "IFN" относится к любой молекуле,описанной по существу в литературе, содержащей, например, любой тип IFN, указанный выше в разделе"Уровень техники". В частности, в вышеуказанное определение включены IFN-, IFN- и IFN-. IFNявляется предпочтительным IFN по настоящему изобретению. Соответствующий настоящему изобретению IFN- коммерчески доступен, например, под товарным знаком Rebif (Serono), Avonex (Biogen) или Betaferon (Schering). Используемый в данном документе термин "интерферон-бета (IFN-бета или IFN-)" относится к интерферону фибробласта, в частности, человека, полученному выделением из биологических жидкостей или полученному способами рекомбинантных ДНК из прокариотических или эукариотических клеток хозяина, а также к его солям, функциональным производным, вариантам, аналогам и активным фрагментам. Предпочтительно IFN-бета используется для обозначения рекомбинантного интерферона бета-1 а. Соответствующий настоящему изобретению IFN- коммерчески доступен, например, под товарным знаком Rebif (Serono), Avonex (Biogen) или Betaferon (Schering). Использование интерферонов человека также является предпочтительным по настоящему изобретению. Используемый в данном документе термин интерферон относится к его солям, функциональным производным, вариантам, аналогам и активным фрагментам.Rebif (рекомбинантный интерферон-) представляет собой новейшую разработку в области терапии интерфероном рассеянного склероза (MS) и существенно способствует лечению. Rebif представляет собой интерферон (IFN)-бета 1a, полученный из клеточной линии млекопитающих. Было установлено,что при введении трижды в неделю интерферон бета-1a является эффективным в лечении рецидивноремиттирующего рассеянного склероза (RRMS). Интерферон бета-1a может иметь положительный эффект при длительном курсе лечения MS, снижая число и тяжесть рецидивов и снижая тяжесть заболевания и активность заболевания, как определено MRI. Дозирование IFN- при лечении рецидивно-ослабевающего MS по изобретению зависит от типа используемого IFN-. В соответствии с настоящим изобретением, когда IFN представляет собой рекомбинантный IFN1b, получаемый в E.coli, коммерчески доступный под товарным знаком Betaseron, его предпочтитель-5 011614 но вводят подкожно каждые два дня дозой от около 250 до 300 мкг или от 8 MIU до 9,6 MIU на человека. В соответствии с настоящим изобретением, когда IFN представляет собой рекомбинантный IFN1a, получаемый в клетках яичника китайского хомячка (CHO клетки), коммерчески доступный под товарным знаком Avonex, его предпочтительно вводят внутримышечно один раз неделю дозой от около 30 до 33 мкг или от 6 до 6,6 MIU на человека. В соответствии с настоящим изобретением, когда IFN представляет собой рекомбинантный IFN1a, получаемый в клетках яичника китайского хомячка (CHO клетки), коммерчески доступный под товарным знаком Rebif, его предпочтительно вводят подкожно три раза в неделю (TIW) дозой от 22 до 44 мкг или от 6 до 12 MIU на человека. Бензотиазолы Используемые в изобретении бензотиазолы представлены формулой (I) и охватывают их таутомеры, их геометрические изомеры, их оптически активные формы в виде энантиомеров, диастереомеров и их рацемические формы, а также их фармацевтически приемлемые соли,где G представляет собой пиримидинильную группу;L представляет собой необязательно замещенный C1-С 6-алкокси, или аминогруппу, или необязательно замещенный 3-8-членный гетероциклоалкил, содержащий по крайней мере один гетероатом, выбранный из N, О, S;R1 выбран из группы, включающей или состоящей из водорода, сульфонила, амино, необязательно замещенного C1-С 6-алкила, необязательно замещенного С 2-С 6-алкенила, необязательно замещенного С 2 С 6-алкинила или необязательно замещенного алкокси, арила, галогена, циано или гидрокси. В соответствии с одним из вариантов осуществления таутомеры бензотиазолов представляют собой соединения формулы (Ia), (Ia') или (Ia) где R1 выбран из группы, включающей или состоящей из водорода, сульфонила, амино, необязательно замещенного C1-С 6-алкила, необязательно замещенного С 2-С 6-алкенила, необязательно замещенного С 2-С 6-алкинила или необязательно замещенного алкокси, необязательно замещенного арила, галогена, циано или гидрокси;L представляет собой аминогруппу формулы -NR3R4, где R3 и R4 представляют собой, независимо друг от друга, H, необязательно замещенный C1-С 6-алкил, необязательно замещенный С 2-С 6-алкенил,необязательно замещенный С 2-С 6-алкинил, необязательно замещенный алкокси, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный насыщенный или ненасыщенной 3-8-членный циклоалкил, необязательно замещенный 3-8-членный гетероциклоалкил (где указанные циклоалкил, гетероциклоалкил, необязательно замещенный арил или необязательно замещенные гетероарильные группы могут быть конденсированы с 1-2 другими необязательно замещенными циклоалкилом, необязательно замещенным гетероциклоалкилом, необязательно замещенным арилом или необязательно замещенной гетероарильной группой), необязательно замещенный С 1-C6-алкиларил, необязательно замещенный C1-С 6-алкилгетероарил, необязательно замещенный С 1-С 6-алкениларил, необязательно замещенный С 1-С 6-алкенилгетероарил, необязательно замещенный C1-С 6-алкиниларил, необязательно замещенный C1-С 6-алкинилгетероарил, необязательно замещенный C1-С 6-алкилциклоалкил, необязательно замещенный C1-С 6-алкилгетероциклоалкил, необязательно замещенный C1-С 6 алкенилциклоалкил, необязательно замещенный C1-С 6-алкенилгетероциклоалкил, необязательно замещенный C1-С 6-алкинилциклоалкил, необязательно замещенный C1-C6-алкинилгетероциклоалкил; или R3 и R4 могут образовывать кольцо вместе с атомом азота, с которым они связаны. В соответствии с одним из вариантов осуществления группа L в бензотиазолах в соответствии с формулой (I) выбрана изR5 и R5', независимо, друг от друга, выбраны из группы, состоящей из H, замещенного или незамещенного C1-С 10-алкила, замещенного или незамещенного арила или гетероарила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного C1-С 6-алкиларила и замещенного или незамещенного C1-С 6-алкилгетероарила. Конкретные ацетонитрилы бензотиазола в соответствии с формулой (I) включают 1,3-бензотиазол-2-ил[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил[2-(2-пиридин-3-илэтокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил[2-(хинолин-6-илокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[(5-морфолин-4-илпиридин-3-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил(2-[4-(3,4-дигидроизохинолин-2(1H)илметил)бензил]оксипиримидин-4 ил)ацетонитрил; 1,3-бензотиазол-2-ил[2-(гексилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(морфолин-4-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(1 Н-имидазол-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(пиперидин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил[2-(4-[(2,6-диметилморфолин-4-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрил;(2Z)-1,3-бензотиазол-2(3H)-илиден[2-(4-[(4-трет-бутоксипиперидин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил[2-(4-[(бензиламино)метил]бензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[(2-морфолин-4-илпиридин-4-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил 2-[(2-пиперидин-1-илпиридин-4-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил[2-(2-морфолин-4-илэтокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2(3H)илиден 2-[(1,4-диметилпиперазин-2-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил 2-[2-(диметиламино)этокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2(3H)-илиден[2-(4-[(4-метилпиперазин-1-ил)карбонил]бензилокси)пиримидин-4 ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[3-(диметиламино)пропокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил(2-2-[2-(диметиламино)этокси]этоксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил 2-[2-(4-метилпиперазин-1-ил)этокси]пиримидин-4-илацетонитрил. В соответствии с другим вариантом осуществления бензотиазолы в соответствии с формулой (I) включают бензотиазолы формулы (Ib) где R в формуле (Ib) выбран из группы, включающей или состоящей из водорода, замещенного или незамещенного C1-С 6-алкила, замещенного или незамещенного С 1-С 6-алкиларила, замещенного или незамещенного гетероарила, замещенного или незамещенного C1-С 6-алкилгетероарила, замещенного или незамещенного С 2-С 6-алкенила, замещенного или незамещенного С 2-С 6-алкениларила, замещенного или незамещенного С 2-С 6-алкенилгетероарила, замещенного или незамещенного С 2-С 6-алкинила, замещенного или незамещенного C2-С 6-алкиниларила, замещенного или незамещенного C2-C6-алкинилгетероарила,замещенного или незамещенного C3-C8-циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного С 1-С 6-алкилциклоалкила, замещенного или незамещенного C1-С 6-7 011614 алкилгетероциклоалкила, замещенного или незамещенного C1-С 6-алкилкарбокси, ацила, замещенного или незамещенного C1-C6-алкилацила, ацилокси, замещенного или незамещенного C1-С 6-алкилацилокси,замещенного или незамещенного C1-C6-алкилалкокси, алкоксикарбонила, замещенного или незамещенного C1-С 6-алкилалкоксикарбонила, аминокарбонила, замещенного или незамещенного C1-С 6 алкиламинокарбонила, ациламино, замещенного или незамещенного C1-C6-алкилациламино, уреидо, замещенного или незамещенного C1-С 6-алкилуреидо, амино, замещенного или незамещенного C1-С 6 алкиламино, сульфонилокси, замещенного или незамещенного C1-С 6-алкилсульфонилокси, сульфонила,замещенного или незамещенного C1-С 6-алкилсульфонила, сульфинила, замещенного или незамещенногоC1-С 6-алкилсульфинила, сульфанила, замещенного или незамещенного C1-С 6-алкилсульфанила, сульфониламино, замещенного или незамещенного C1-C6-алкилсульфониламино;R1 выбран из группы, включающей или состоящей из H, галогена, циано, нитро, амино, замещенного или незамещенного С 1-С 6-алкила, в частности C1-С 3-алкила, такого как метил или этил, или -CF3, замещенного или незамещенного С 2-С 6-алкенила, замещенного или незамещенного С 2-С 6-алкинила, замещенного или незамещенного C1-С 6-алкиларила, замещенного или незамещенного арила или замещенного или незамещенного гетероарила, замещенного или незамещенного C1-С 6-алкилгетероарила, -C(O)-OR2,-C(O)-R2, -C(O)-NR2R2', -(SO2)R2;R2 и R2', независимо, выбраны из группы, включающей или состоящей из водорода, незамещенного или замещенного C1-C6-алкила, незамещенного или замещенного С 2-С 6-алкенила, незамещенного или замещенного С 2-С 6-алкинила, незамещенного или замещенного арила, незамещенного или замещенного гетероарила, незамещенного или замещенного C1-C6-алкиларила, незамещенного или замещенного С 1 С 6-алкилгетероарила. Предпочтительно R1 представляет собой H и n равно целому числу, выбранному из 0, 1, 2 и 3, более предпочтительно 1 или 2. Используемые в изобретении бензотиазолы формулы (Ib) также охватывают соответствующие таутомеры, имеющие следующую формулу (Ib') Конкретные примеры соединений формулы (I) включают следующие: 1,3-бензотиазол-2-ил[2-(4-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил-2-[4-(4-бензилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрил;(3 Н-бензотиазол-2-илиден)-(2-4-[4-(2-гидроксиэтил)пиперазин-1-илметил]бензилоксипиримидин 4-ил)ацетонитрил; метиловый эфир [4-(4-4-[(3 Н-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-ил]уксусной кислоты; 2-[4-(4-4-[(3 Н-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1 ил]ацетамид; 1,3-бензотиазол-2-ил-[2-(3-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]аце-8 011614 тонитрил. Бензотиазолы в соответствии с формулой (I) синтезированы в соответствии со способами, описанными в WO 01/47920, предпочтительно, в соответствии со способами, описанными в WO 03/091249. Бензотиазолы в соответствии с формулой (I) синтезируют в соответствии со способами, описанными на схемах I-VIII ниже. Схема I Как показано на схеме I выше, исходные соединения формулы (III) подвергают взаимодействию с соответствующими замещенными (активированными) пиримидинами, такими как галогенопиримидины,например 2,4-дихлорпиримидин формулы (VI), с получением соединений пиримидинобензотиазола (IV). Предпочтительно, такие взаимодействия выполняют в присутствии подходящих оснований, например гидрида натрия, гидрида калия и тому подобное, в безводной инертной среде, предпочтительно в полярном растворителе, таком как ДМФ, DMA, MeCN или ТГФ, при температуре в пределах от около -78 до 100C (Chabaka et al. , Pol. J. Chem. 1994, 1317-1326). Бензотиазолы формулы (III) можно либо приобрести в компании, например, Maybridge Chemical Co.Ltd., либо получить обычными способами из коммерчески доступных соединений. Галогенированные пиримидины, например, 2,4-дихлорпиримидин формулы (VI), также можно либо приобрести в компании, такой как Aldrich, Fluka, Sigma, и тому подобное, либо получить обычными способами. Для получения конечных бензотиазолов формулы (II), то есть бензотиазолов формулы (Ia), где L представлен формулой (g) ниже и где n и R5 являются такими, как описано выше, промежуточные соединения формулы (IV), предпочтительно, подвергают взаимодействию с подходящими спиртами формулы(V), как показано на схеме II ниже. Взаимодействие предпочтительно выполняют в присутствии растворителей, таких как ДМФ, DMA,NMP, ДМСО или ACN, наиболее предпочтительно в DMA или MeCN, в присутствии подходящего основания, такого как трет-BuOK, CS2CO3, в присутствии или в отсутствие CuI, NaH или тому подобного,наиболее предпочтительно NaH, при температуре в пределах от около 25 до 120C. В предпочтительном способе исходные соединения нагревают при от 25 до 100C в растворе в MeCN в присутствии NaH. Промежуточные соединения формулы (V) могут быть получены из коммерческих источников или путем синтеза, показанным на схемах III-VII. На указанных схемах III и IV исходным строительным звеном является метил-п-толуат (схема III) или его метааналог (схема IV) для получения соответствующих промежуточных производных бензилового спирта, 4-стадийным способом, включая образование сложного эфира, бромирование метильной группы, алкилирование соответствующим амином и восстановление сложного эфира с получением конечных замещенных бензиловых спиртов. где R6 и R7, независимо, могут быть выбраны из R5 и R5' , или R6 и R7 могут образовывать кольцо вместе с атомом азота, к которому они присоединены, с образованием замещенного или незамещенного гетероарила или замещенного или незамещенного гетероцикла. Схема IV На указанной схеме V, ниже, исходным строительным звеном является 2-амино-4-метилпиридин для получения соответствующих 4-гидроксиметилпиридин промежуточных соединений, 5-стадийным способом, включая преобразование 2-аминогруппы в 2-бром, окисление, алкилирование с соответствующим амином, образование метилового сложного эфира и восстановление сложного эфира с получением конечных замещенных 4-гидроксиметилпиридинов. На указанной схеме VI, ниже, исходным строительным звеном является метиловый эфир 5 бромникотиновой кислоты для получения соответствующих 2-гидроксиметилпиридин промежуточных соединений, 2-стадийным способом, включая алкилирование с соответствующим амином, образование метилового эфира и восстановление сложного эфира с получением конечных замещенных 2 гидроксиметилпиридинов. Схема VI На указанной схеме VII, ниже, исходным веществом является 1-(2-гидроксиэтил)пиперазин для получения соответствующего промежуточного спиртового соединения путем восстановительного алкилирования. Схема VII На указанной схеме VIII, ниже, исходным веществом является метиловый эфир 4(гидроксиметил)бензойной кислоты для получения соответствующих промежуточных соединений бензилового спирта, связыванием амина в присутствии триметилалюминия. Схема VIII Наполнители В соответствии с одним из вариантов осуществления изобретения полоксамеры (Pluronics) представляют собой поверхностно-активные вещества, которые предпочтительно используют в препаратах на основе глицеридов по изобретению. Примерами полоксамеров являются Pluronic F77 (Полоксамер 217), Pluronic F87 (Полоксамер 237), Pluronic F88 (Полоксамер 238) и Pluronic F68 (Полоксамер 188), особенно предпочтителен Pluronic F68. В соответствии с одним из вариантов осуществления по изобретению полиэтиленгликоль представляет собой наполнитель, который предпочтительно используют в препаратах на основе глицеридов макроголов по изобретению, предпочтительно полимер полиэтиленоксида, такой как ПЭГ-2000, ПЭГ-4000,ПЭГ-6000, ПЭГ-10 000, ПЭГ-20 000, предпочтительно ПЭГ-6000. Препараты на основе глицеридов макроголов по изобретению В соответствии с одним из вариантов осуществления, изобретение относится к фармацевтической композиции, содержащей бензотиазол формулы (I) а также его таутомеры, его геометрические изомеры, его оптически активные формы в виде энантиомеров, диастереомеров и его рацемические формы, а также его фармацевтически приемлемые соли,где G, L и R1 определены выше; и глицерид макрогола. В следующем варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где глицерид макрогола представляет собой стеароилглицерид. В другом следующем варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где глицерид макрогола представляет собой Gelucire 50/13. В другом следующем варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция содержит Gelucire 50/13 в количестве от 40 до 95% мас./мас. от всей композиции, предпочтительно от 40 до 80% мас./мас. от всей композиции, включая 40, 50, 60, 70 и 80% мас./мас. В другом следующем варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция содержит Gelucire 50/13 в количестве от 40 до 60% мас./мас. от всей композиции. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, содержащей количество бензотиазола от 5 до 40% мас./мас. от всей композиции, предпочтительно от 20 до 40% мас./мас. от всей композиции, включая 20, 30 и 40% мас./мас. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где бензотиазол представляет собой 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрил. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где бензотиазол представляет собой мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрила. В другом варианте осуществления изобретение относится к фармацевтической композиции в соответствии с изобретением, где бензотиазол не является кристаллическим, т.е. кристалличность бензотиазола меньше чем 50%, предпочтительно меньше чем от около 40 до 10%, более предпочтительно меньше чем или около 5%. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция дополнительно содержит полоксамер. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция дополнительно содержит полоксамер и где полоксамер представляет собой Полоксамер 188. В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция дополнительно содержит полиэтиленгликоль (ПЭГ). В другом варианте осуществления изобретение относится к фармацевтической композиции по изобретению, где композиция дополнительно содержит полиэтиленгликоль (ПЭГ) и где полиэтиленгликоль представляет собой ПЭГ-6000. В другом варианте осуществления изобретение относится к фармацевтической композиции, соответственно содержащей по крайней мере 20% мас./мас. мезилата 1,3-бензотиазол-2-ил-[2-(4-морфолин-4 илметилбензилокси)пиримидин-4-ил]ацетонитрила и Gelucire 50/13 в количестве от 40 до 80% мас./мас. от всей композиции. В другом варианте осуществления изобретение относится к фармацевтической композиции, выбранной из группы мезилат 1,3-бензотиазол-2-ил-[2-(4-морфолин-4 илметилбензилокси)пиримидин-4-ил]ацетонитрила Препараты по изобретению повышают как скорость растворения, так и биологическую доступность бензотиазолов по изобретению. В другом варианте осуществления изобретение относится к способу получения композиции по изобретению, где указанный способ включает стадии получения бензотиазола в соответствии с формулой(I), добавления рассчитанного количества бензотиазола в соответствии с формулой (I) к расплавленному препарату на основе глицерида макрогола. Обычно препарат на основе глицерида макрогола нагревают при соответствующей температуре при перемешивании для получения расплавленного препарата на основе глицерида макрогола для применения в способе по изобретению. Например, препараты на основе глицеридов макроголов Gelucire 50/13 расплавляют, нагревая до около 60-80C, например до около 60-70C, в течение от около 30 мин до 1 ч, в частности от около 30 до 40 мин, при перемешивании. В другом варианте осуществления изобретение относится к способу получения композиции, где бензотиазол в виде порошка вводят в расплавленный препарат на основе глицерида макрогола при перемешивании. В другом варианте осуществления изобретение относится к способу получения композиции, где бензотиазол в виде порошка вводят в расплавленный препарат на основе глицерида макрогола при перемешивании и где способ дополнительно включает стадии охлаждения гомогенной расплавленной дисперсии, измельчения полученного твердого вещества до частиц. Обычно стадию охлаждения осуществляют с целью достижения быстрого охлаждения препарата, например на ледяной бане или выливая расплавленный препарат в жидкий азот. Обычно охлаждение на ледяной бане может быть осуществлено в течение от около 1 до 3 ч. Измельчение выполняют до крупных или мелких частиц (порошок) в зависимости от различных видов оборудования для измельчения. Обычно оборудование для измельчения, которое может быть использовано в контексте данного изобретения, представляет собой молотковую дробилку и/или фрезерную мельницу, такую как, например, FitzMill. В другом следующем варианте осуществления изобретение относится к способу получения композиции, где бензотиазол в виде порошка вводят в расплавленный препарат на основе глицерида макрогола при перемешивании и где способ дополнительно включает стадию охлаждения гомогенной расплавленной дисперсии путем распыления или замораживания при распылении. Обычно перед помещением в реактор препарат Gelucire с введенным бензотиазолом перемешивают или гомогенизируют. Наполнитель/суспензию обычно выдерживают в реакторе при перемешивании при температуре между 50 и 80C.Gelucire с введенным бензотиазолом перемещают из реактора в камеру охлаждения путем накачки сосуда (например, при 100 мбар или выше) через подающие трубки, которые поддерживают при температуре, достаточной для предотвращения охлаждения суспензии внутри трубок.Gelucire с введенным бензотиазолом вводят в камеру охлаждения через форсунку в потоке азота(распыление азота) при достаточно высокой температуре, например между 50-80 С. Охлажденным газообразным азотом (азот для замораживания) наполняют камеру охлаждения,обычно при температуре между -50 и +20C, но предпочтительно при температуре между -30 и +10C. Для избежания закупоривания температуру форсунки предпочтительно поддерживают выше 50C. Для снижения вероятности падения давления в подающей линии расстояние между реактором и клапаном делают минимальным. Размер форсунок устанавливают в зависимости от вязкости суспензии, например самые большие форсунки (отверстие 1,4 мм/наконечник 2,2 мм) предпочтительно используют для суспензии с высокой вязкостью. Полученные таким образом частицы или гранулы затем собирают в сборочной камере. Способ охлаждения распылением является эффективным для получения большого выхода продукта(обычно около 55% или выше), для получения частиц с однородными формой и размерами, что проявляется в улучшенных параметрах растворимости по сравнению с основной массой. Таким образом, этот способ обладает дополнительным преимуществом, заключающимся в том, что позволяет миновать стадию измельчения частиц. В другом следующем варианте осуществления изобретение относится к способу получения композиции, где бензотиазол в водном растворе (то есть растворенный) вводят в расплавленный препарат на- 13011614 основе глицерида макрогола при перемешивании. Обычно бензотиазол растворяют в воде и затем добавляют в расплавленный препарат на основе глицерида макрогола при перемешивании с образованием эмульсии (масло/вода или вода/масло). В частности, способ дополнительно включает стадию распыления, где полученную эмульсию распыляют с помощью распылителя или капиллярной форсунки в присутствии жидкого CO2. Пример способа распыления, который может быть использован в стадии распыления выше, описан в WO 2005/049192. В другом следующем варианте осуществления способ получения композиции по изобретению, где бензотиазол вводят в виде водного раствора, необязательно дополнительно включает стадию сушки замораживанием после стадии распыления. Обычно используемые в контексте по изобретению способы перемешивания представляют собой способы перемешивания завихрением. В другом варианте осуществления изобретение относится к применению препарата на основе глицеридов макроголов по изобретению для получения фармацевтической композиции для лечения расстройств, выбранных из аутоиммунных расстройств, таких как рассеянный склероз и ревматоидный артрит, респираторных расстройств, таких как астма, нейродегенеративных расстройств или расстройств нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и судороги, болезнь Хантингтона, заболевания ЦНС, черепно-мозговые травмы, а также ишемические расстройства и геморрагический инсульт, воспалительных заболеваний, склеродермы и склеродермаподобных расстройств,рака, эндометриоза, фиброза, такого как фиброз легкого, и диабета. В другом варианте осуществления изобретение относится к способу лечения расстройств, выбранных из аутоиммунных расстройств, таких как рассеянный склероз и ревматоидный артрит, респираторных расстройств, таких как астма, нейродегенеративных расстройств или расстройств нервной системы,воспалительных заболеваний, рака, эндометриоза, фиброза, такого как фиброз легкого, и диабета, включающему введение нуждающемуся в лечении пациенту препарата бензотиазола на основе глицеридов макроголов. Препараты, описанные в данном документе, могут быть использованы для лечения заболевания, в частности заболевания, выбранного из аутоиммунных расстройств, таких как рассеянный склероз и ревматоидный артрит, респираторных расстройств, таких как астма, нейродегенеративных расстройств или расстройств нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и судороги, болезнь Хантингтона, заболевания ЦНС, черепно-мозговые травмы, а также ишемические расстройства и геморрагический инсульт, воспалительных заболеваний, склеродермы и склеродермаподобных расстройств, рака, эндометриоза, фиброза, такого как фиброз легкого, и диабета. В другом следующем варианте осуществления изобретение относится к препарату Gelucire бензотиазола по изобретению с улучшенной растворимостью и/или биодоступностью по сравнению с основной массой. Бензотиазол в описанных в данном документе препаратах вводят пациенту в соответствии с настоящим изобретением различными способами доставки, включая пероральное введение, через слизистую или другими способами, используемыми специалистами в данной области, а также хорошо известными в данной области. Доза, вводимая человеку, изменяется в зависимости от различных факторов, включая фармакокинетические свойства, способ введения, общее состояние пациента и характеристики (пол, возраст, масса тела, состояние здоровья и размер), продолжительности симптомов, параллельного лечения, частоты лечения и желаемого эффекта. Обычные дозы бензотиазола в препаратах на основе глицеридов макроголов по изобретению составляют от 1 до 3000 мг, предпочтительно от 10 до 1000 мг. Препараты бензотиазола по изобретению могут быть введены пероральным способом в виде порошка и, необязательно, в виде порошковой суспензии для немедленного приема в водной среде. Препараты по настоящему изобретению могут быть получены в виде твердой стандартной дозированной формы (диспергируемый порошок или гранулы в капсулах, саше, таблетки) или в виде порошка или гранул, диспергированных в воде перед введением в виде водной суспензии. Все наполнители, обычно используемые в твердых препаратах, такие как, например, диспергируемые агенты, поверхностно-активные вещества, волокна, смазывающие вещества, связывающие вещества,разрыхлители и так далее, и хорошо известные специалистам в данной области, могут быть использованы в препаратах по настоящему изобретению. Все наполнители, обычно используемые в препаратах водных суспензий, такие как, например, диспергируемые агенты, поверхностно-активное вещество, загустители, увлажняющие агенты, суспендирующие агенты и так далее, и хорошо известные специалистам в данной области, могут использоваться в препаратах по настоящему изобретению. В другом аспекте изобретение относится к следующим новым соединениям: 1,3-бензотиазол-2-ил[2-(2-пиридин-3-илэтокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил[2-(хинолин-6-илокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[(5-морфолин-4-илпиридин-3-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил[2-(3-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацето- 14011614 нитрил; 1,3-бензотиазол-2-ил(2-[4-(3,4-дигидроизохинолин-2(1H)-илметил)бензил]оксипиримидин-4-ил) ацетонитрил; 1,3-бензотиазол-2-ил[2-(гексилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(морфолин-4-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(1 Н-имидазол-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил(2-[3-(пиперидин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил[2-(4-[(2,6-диметилморфолин-4-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрил;(2Z)-1,3-бензотиазол-2(3H)-илиден[2-(4-[(4-трет-бутоксипиперидин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил[2-(4-[(бензиламино)метил]бензилокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[(2-морфолин-4-илпиридин-4-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил 2-[(2-пиперидин-1-илпиридин-4-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил[2-(2-морфолин-4-илэтокси)пиримидин-4-ил]ацетонитрил; 1,3-бензотиазол-2(3H)-илиден 2-[(1,4-диметилпиперазин-2-ил)метокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил 2-[2-(диметиламино)этокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2(3H)-илиден[2-(4-[(4-метилпиперазин-1-ил)карбонил]бензилокси)пиримидин-4 ил]ацетонитрил; 1,3-бензотиазол-2-ил 2-[3-(диметиламино)пропокси]пиримидин-4-илацетонитрил; 1,3-бензотиазол-2-ил(2-2-[2-(диметиламино)этокси]этоксипиримидин-4-ил)ацетонитрил; 1,3-бензотиазол-2-ил 2-[2-(4-метилпиперазин-1-ил)этокси]пиримидин-4-илацетонитрил. Другой аспект по изобретению включает эти соединения для использования в качестве лекарственных средств. Другой аспект по изобретению включает применение описанных в данном документе соединений для получения фармацевтического препарата для лечения аутоиммунных расстройств, включая рассеянный склероз, воспалительных заболеваний, включая ревматоидный артрит, диабета, фиброза, такого как фиброз легкого, респираторных расстройств, таких как астма, рака, нейродегенеративных расстройств или расстройств нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и судороги, болезнь Хантингтона, заболеваний ЦНС, черепно-мозговых травм, а также ишемических расстройств и геморрагического инсульта, склеродермаподобных расстройств, рака, эндометриоза, фиброза,такого как фиброз легкого, и диабета. Соединение по изобретению может быть использовано для лечения аутоиммунных расстройств,включая рассеянный склероз, воспалительных заболеваний, включая ревматоидный артрит, диабета,фиброза, такого как фиброз легкого, респираторных расстройств, таких как астма, рака, нейродегенеративных расстройств или расстройств нервной системы, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и судороги, болезнь Хантингтона, заболевания ЦНС, черепно-мозговых травм, а также ишемических расстройств и геморрагического инсульта, склеродермаподобных расстройств, рака, эндометриоза, фиброза, такого как фиброз легкого, и диабета. В другом варианте осуществления соединения и/или препараты по изобретению могут быть использованы при лечении аутоиммунных заболеваний, в частности демиелинизирующих заболеваний,таких как рассеянный склероз, они могут быть использованы в чистом виде или в сочетании с соагентом,применяемым при лечении аутоиммунных заболеваний, где соагент, например, выбран из следующих соединений:(а) интерфероны, например, пегилированные или непегилированные интерфероны, например, вводимые подкожным, внутримышечным или пероральным путями, предпочтительно, бета-интерферон;(e) ингибиторы экспрессии VCAM-1 или антагонисты его лиганда, например антагонисты 4/1 интегрин VLA-4 и/или альфа-4-бета-7 интегрины, например натализумаб (ANTEGREN). Следующие соагенты, такие как противовоспалительные агенты (в частности, для лечения демиелинизирующих заболеваний, таких как рассеянный склероз) описаны ниже. Добавочным противовоспалительным агентом является терифлуномид, который описан в WO 02/080897. Еще один добавочный противовоспалительный агент представляет собой финголимод, который описан в EP 727406, WO 2004/028251 и WO 2004/028251 Еще один добавочный противовоспалительный агент представляет собой лаквинимод, который описан в WO 99/55678 Еще один добавочный противовоспалительный агент представляет собой Tensirolimus, который описан в WO 02/28866 Еще один добавочный противовоспалительный агент представляет собой ксалипроден, который описан в WO 98/48802 Еще один добавочный противовоспалительный агент представляет собой Deskar Pirfenidone, который описан в WO 03/068230 Еще один добавочный противовоспалительный агент ниже представлен производным бензотиазола,описанным в WO 01/47920 Еще один добавочный противовоспалительный агент представлен ниже производным гидроксамовой кислоты, описанным в WO 03/070711 Еще один добавочный противовоспалительный агент представляет собой MLN3897, который описан в WO 2004/043965 Еще один добавочный противовоспалительный агент представляет собой CDP323, который описан в WO 99/67230 Еще один добавочный противовоспалительный агент представляет собой симвастатин, который описан в WO 01/45698 Еще один добавочный противовоспалительный агент представляет собой фампридин, который описан в US 5540938 Все ссылки, приведенные в данном документе, включая статьи из журналов или рефераты, опубликованные или неопубликованные патентные заявки США или зарубежные патентные заявки, выданные патенты США или патенты зарубежные или любые другие ссылки включены в данный документ полностью, включая все данные, таблицы, фигуры и текст, представленные в приводимых ссылках. Кроме того, полные содержания ссылок, приведенных в изложенных в данном документе ссылках, также включены полностью в качестве ссылки. Отсылка на стадии известных способов, стадии обычных способов, известные способы или обычные способы в любом случае предполагает, что любой аспект, описание или вариант осуществления по настоящему изобретению раскрыт, изучен или предположен в релевантной области. Вышеуказанное описание конкретных вариантов осуществления настолько полно раскрывает основную сущность изобретения, что можно будет, применяя знание в рамках специалиста в данной области (включая содержание изложенных в данном документе ссылок), легко изменить и/или приспособить для различного применения такие конкретные варианты осуществления без большего чем надо экспериментирования, без отхода от общей идеи по настоящему изобретению. Следовательно, такие варианты и модификации находятся в области значений эквивалентов описанных вариантов осуществления, на основе знаний и рекомендаций, представленных в данном документе. Понятно, что выражения или термины используются в данном документе в целях описания, а не ограничения, так что выражения или термины по настоящему описанию воспринимаются квалифицированным специалистом в свете знаний и- 17011614 рекомендаций, представленных в данном документе, в сочетании со знаниями рядового специалиста в данной области. Далее изобретение описывается с помощью следующих примеров, которые в любом случае не должны рассматриваться как ограничивающие настоящее изобретение. Примеры относятся к чертежам,представленным в данном документе ниже. Краткое описание рисунков На фиг. 1 показана кривая солюбилизации (выражена через концентрацию (мкг/мл) относительно времени (мин в перенасыщенных средах, Fed State Simulated Intestinal Fluid (FeSSIF), pH=5 как среда растворения соединения А в различных твердых порошковых (частицы) препаратах в сравнении с основным порошком. Незакрашенные ромбы: соединение А, твердая основная масса; закрашенные прямоугольники: соединение А, твердый порошковый препарат на основе глицерида макрогола (1); незакрашенные треугольники: соединение А, твердый препарат на основе глицерида макрогола (2); закрашенные ромбы: соединение А, твердый препарат на основе глицерида макрогола (3); закрашенные треугольники: соединение А, твердый препарат на основе глицерида макрогола (4). На фиг. 2 показана кривая солюбилизации (выражена через концентрацию (мкг/мл) в зависимости от времени (мин в перенасыщенных средах, Fed State Simulated Intestinal Fluid (FeSSIF), pH=5 как среда растворения соединения А в различных твердых порошковых (частицы) препаратах в сравнении с основным порошком. Незакрашенные ромбы: соединение А, твердая основная масса; закрашенные прямоугольники: соединение А, твердый препарат на основе глицерида макрогола (1); незакрашенные кружки: соединение А, твердый препарат на основе глицерида макрогола (5). На фиг. 3 показана кривая растворимости соединения А из различных твердых порошковых препаратов в сравнении с основным порошком, полученная способом растворения II (Лопасть) согласно ФАРМАКОПЕЕ США, в FeSSIF, рН 5, проточные условия. Незакрашенные ромбы: соединение А, в твердой основной массе; закрашенные ромбы: соединение А, твердый препарат на основе глицерида макрогола (1); незакрашенные треугольники: соединение А, твердый препарат на основе глицерида макрогола (2); незакрашенные кружки: соединение А, твердый препарат на основе глицерида макрогола (3). На фиг. 4 показана концентрация плазмы (нг/мл) соединения А после перорального введения собакам в дозе 10,6 мг/кг, в виде препарата по изобретению по сравнению с твердой основной массой после суспензии, приготовленной для немедленного приема, в PBS. Крестики: соединение А, суспензия основной массы; закрашенные ромбы: соединение А, суспензия препарата на основе глицерида макрогола (1); незакрашенные прямоугольники: соединение А, суспензия препарата на основе глицерида макрогола (2). На фиг. 5 показан узел установки для охлаждения распылением, где (R2) представляет собой термостатированную водяную баню, SD81 представляет собой камеру охлаждения, (А) представляет собой трубки для подачи суспензии, (В) - источник жидкого азота, (С) - газообразный азот, (D) - азот для распыления, (F) - камера сбора первичного продукта, (H) - камера сбора вторичного продукта и (G) - циклон. На фиг. 6 показана кривая солюбилизации (выражена через процентный состав в зависимости от времени (мин в перенасыщенных средах, Fed State Simulated Intestinal Fluid (FeSSIF), без лецитина в качестве среды растворения соединения А в твердом препарате на основе глицерида макрогола (2), полученного путем охлаждения распылением (закрашенные треугольники). На фиг. 7 показаны полученные с помощью стереомикроскопа изображения препаратов (2) и (6),полученных путем охлаждения распылением. ПРИМЕРЫ Следующие сокращения относятся соответственно к следующим определениям: см (сантиметр), ч(дифференциальная сканирующая калориметрия), FeSSIF (Fed State Simulated Intestinal Fluid), HLB (гидрофильно-липофильный баланс), ВЭЖХ (высокоэффективная жидкостная хроматография), MS (массспектрометрия), MM (молекулярная масса), NMP (N-метил-2-пирролидон), PBS (физиологический раствор с фосфатным буфером), RP-ВЭЖХ (высокоэффективная жидкостная хроматография с обращенной фазой), rpm (обороты в минуту), ТГФ (тетрагидрофуран). Макроголглицериды (Gelucires) являются коммерчески доступными, например, от компании Gattefosse. Пример 1. Препарат бензотиазола на основе глицерида макрогола (1). 1.Общий способ получения. Соответствующее количество Gelucire в виде порошка плавили на термостатированной водяной бане. Соответствующее количество бензотиазола в виде порошка (20% мас./мас. рассчитано относительно всей композиции) диспергировали в расплавленном наполнителе. Массу выдерживали, перемешивая,в течение около 30 мин с получением гомогенной дисперсии. Затем Gelucire с добавленным лекарственным препаратом охлаждали на ледяной бане и твердую массу механически размалывали (измельчали)- 18011614 в крупный порошок. Полученные таким образом частицы тонко измельчали с помощью молотковой дробилки и/или фрезерной мельницы, такой как, например, FitzMill. 2. Бензотиазол. 1,3-Бензотиазол-2-ил-[2-(4-морфолин-4-илметилбензилокси)пиримидин-4-ил]ацетонитрил, (соединение А) синтезировали способом, описанным в примере 1 WO 03/047570. Соединение А использовали в виде мезилатной соли, имеющей молекулярную массу 649,75 Da, с соотношением соль/основание 1,42(молекулярная масса соединения А в виде свободного основания составляет 457,55 Da). 3. Наполнители.Gelucire 50/13 (глицериды стеароилмакрогола-32) синтезируют путем реакции алкоголиза/этерификации, используя в качестве исходных веществ гидрированное пальмовое масло и ПЭГ-1500.Gelucire 50/13 является коммерчески доступным от компании Gattefosse. Преимущественной жирной кислотой является пальмитостеариновая кислота (C16-C18). Gelucire 50/13 соответствует Европейской Фармакопее, 4-е издание "Стеароил макроголглицериды". Характерные свойства Gelucire 50/13 перечислены ниже: Интервал расплавления (точка росы): 46,0-51,0C Значение HLB: 13. 4. Композиция макроголглицерида (1). Композиция глицерида стеароилмакрогола (1) имеет следующий состав: Соединение А (мезилат) 20% мас./мас.Gelucire 50/13 80% мас./мас. Композицию (1) получали в соответствии с общим способом, описанным в примере 1, 1, и где использовали 4 г порошка соединения А и 16 г порошка Gelucire 50/13 и выполняли расплавление матрицы Gelucire на термостатированной бане при 60C. 5. Физико-химические характеристики. 5.1 Состав лекарственного препарата. Состав лекарственного препарата композиции (1), определенный с помощью RP-ВЭЖХ анализа,как описано ниже, был 20,11%, CV: 3,49%. Стабильность композиции оценивали путем определения состава лекарственного препарата при хранении либо при 4C, либо при 25C в течение трех месяцев. Композиция (1) была признана стабильной, что подтверждалось составом лекарственного препарата через 3 месяца: 19,39%, cv: 0,35% (хранение при 4 С) и 19,51%, cv: 0,91% (хранение при 25 С). Анализ с помощью RP-ВЭЖХ Липидные матрицы с введенным лекарственным препаратом полностью растворяли в метаноле в ультразвуковой ванне в течение 2 мин при комнатной температуре. Затем образцы центрифугировали при 10000 об/мин в течение 5 мин при 10C. Полученные таким образом прозрачные растворы исследовали с помощью RP-ВЭЖХ. Используемый анализ с помощью RP-ВЭЖХ выполняли на изократической колонке ВЭЖХ: XterraMSC8, 5 мкм, 2504,6 мм (Waters), термостатированной при 30 С; подвижная фаза: H2O KH2PO4 20 мМ ACN 70% (% об./об.) - 30% (% об./об.), при рН 4, установленном с помощью H3PO4 10% при 1,2 мл/мин. Соединение А элюирует в течение около 7 мин. 5.2. Термический анализ.DSC анализ, как описано далее, выполняли для проверки однородности смеси и стабильности лекарственного препарата при введении в матрицу. Термические характеристики "Blanks" (Gelucire матрица отдельно или соединение А отдельно) сравнивали с характеристиками матрицы Gelucire с добавлением бензотиазола (композиция (1. DSC анализ показал, что смесь является в значительной степени гомогенной и что в пике плавления в соединении А не происходит изменений. Это показывает, что соединение А диспергировано в матрице макрогола в значительной степени в кристаллической форме (сохраняется около 85% кристалличности, что подтверждается измерением соотношения значений энтальпии пиков плавления чистого соединения А и соединения А, диспергированного в матрице композиции). Анализ DSC Анализ DSC выполняли как в режиме нагревания, так и в режиме охлаждения, используя Pyris 1Differential Scanning Calorimeter (Perkin Elmer) при следующих режимах работы: масса образца: 1-5 мг; диапазон: 0-250 С; скорость сканирования: 5 С/мин; емкость ванны: 50 мкл (ванна с отверстиями); продувочный поток газа (N2): 20 см 3/мин. Пример 2. Препарат бензотиазола на основе глицерида макрогола (2). 1. Общий способ получения. Композицию (2) получали способом, описанным в примере 1, 1, где соответствующее количество 40% мас./мас. бензотиазола, в расчете на всю композицию, диспергировали в расплавленный наполнитель.- 19011614 2. Бензотиазол. Использовали соединение А, описанное в примере 1, 1. 3. Наполнители. 3.1 Gelucire 50/13 (глицериды стеароилмакрогола-32). Использовали Gelucire 50/13, описанный в примере 1, 1. 4. Композиция макрогола глицерида (2). Композиция глицерида стеароилмакрогола (2) имеет следующий состав: соединение А (мезилат) 40% мас./мас. Gelucire 50/13 60% мас./мас. Композицию (2) получали в соответствии с общим способом, описанным в примере 2, 1, где использовали 2 г порошка соединения А и 3 г порошка Gelucire 50/13 и выполняли расплавление матрицыGelucire на термостатированной бане при 60C. 5. Физико-химические характеристики. 5.1 Состав лекарственного препарата. Состав лекарственного препарата определяли с помощью RP-ВЭЖХ, как описано выше. Состав лекарственного препарата композиции (2) был 39,90%, cv: 1,26%. Стабильность препарата оценивали путем определения состава лекарственного препарата при хранении либо при 4C, либо при 25C в течение двух месяцев. Композиция (2) была признана стабильной,что подтверждалось составом лекарственного препарата через 2 месяца: 39,76%, cv: 2,56% (хранение при 4 С) и 38,56%, cv: 1,09% (хранение при 25 С). 5.2 Термический анализ. Анализ DSC выполняли описанным выше способом и по крайней мере в течение 7 месяцев не наблюдали значительных изменений термических свойств композиции. Пример 3. Препарат бензотиазола на основе глицерида макрогола (3). 1. Общий способ получения. Композицию (3) получали способом, описанным в примере 1, 1, где смесь 50:50 мас./мас. Gelucire и полоксамера плавили на термостатированной водяной бане и соответствующее количество бензотиазола (20% мас./мас. в расчете на всю композицию) диспергировали в расплавленном наполнителе. 2. Бензотиазол. Использовали соединение А, описанное в примере 1, 1. 3. Наполнители. 3.1 Gelucire 50/13 (глицериды стеароилмакрогола-32). Использовали Gelucire 50/13, описанный в примере 1, 1. 3.2. Lutrol F68 (Poloxamer 188, Pluronic, Synperonic).Lutrol F68 (полиоксиэтилен-полиоксипропилен блок-сополимер), коммерчески доступный от компании BASF, представляет собой блок-сополимер полиэтиленоксида и полипропиленоксида. Включен в список неактивных ингредиентов Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA inactive Ingredients Guide) (внутривенные инъекции, ингаляции, офтальмические препараты, порошок для перорального введения, растворы, суспензии и сироп, а также препараты для местного применения). Включен в препараты для непарентерального способа введения, лицензированные в Соединенном Королевстве. Европейская фармакопея 4, стр. 1777; USP 24 NF19 стр. 2492-2493. Процентное содержание полиоксиэтилена (гидрофильный) в Pluronic F68 составляет 80% и молекулярная масса гидрофобного (полиоксипропилена) составляет приблизительно 1,967 Da. Типичные свойства Pluronic F68 перечислены ниже. Средняя молекулярная масса: 8400. Температура плавления/потери текучести: 52C. Физическая форма 20C: твердая. Вязкость (вискозиметр Брукфилда), сантипуазы: 1000 [жидкости при 25C, пастообразные вещества при 60C и твердые вещества при 77 С]. Поверхностное натяжение, дины/см 25C 0,1% конц.: 50,3 0,01% конц.: 51,2 0,001% конц.: 53,6. Поверхностное натяжение, дины/см 25 С относительно Нуйола; 0,1% конц.: 19,8 0,01% конц.: 24,0 0,01% конц.: 26,0 Поглощение влаги, секунды 25C 1,0% конц.: 360 0,1% конц.: 360 Подъем пеныHLB (гидролильно-липофильный баланс): 29. 4. Композиция глицерида макрогола (3). Композиция глицерида стеароилмакрогола (3) имеет следующий состав: Соединение А (мезилат) 20% мас./мас.Lutrol F68 40% мас./мас. Композицию (3) получали в соответствии с общим способом, описанным в примере 2, 1, и где использовали 1,2 г порошка соединения А, 2,4 г порошка Gelucire 50/13 и 2,4 г Lutrol F68 и выполняли расплавление матрицы Gelucire на термостатированной бане при 60C. 5. Физико-химические свойства. 5.1 Состав лекарственного препарата. Состав лекарственного препарата определяли с помощью RP-ВЭЖХ, как описано выше. Состав лекарственного препарата композиции (3) был 18,99%, cv: 2,16%. 5.2 Термический анализ.DSC анализ выполняли описанным выше способом, и были сделаны те же выводы, что и в примере 1. Пример 4. Препарат бензотиазола на основе глицерида макрогола (4). 1. Общий способ получения. Композицию (4) получали способом, описанным в примере 1, 1, где смесь 50:50 мас./мас. смесьGelucire и полиэтилена (ПЭГ) плавили на термостатированной водяной бане и соответствующее количество бензотиазола (20% мас./мас. рассчитанное от всей композиции) диспергировали в расплавленном наполнителе. 2. Бензотиазол. Использовали соединение А, описанное в примере 1, 1. 3. Наполнители. 3.1. Gelucire 50/13 (стеароилмакрогол-32 глицериды). Использовали Gelucire 50/13, описанный в примере 1, 1. 3.2 Lutrol E6000 (полиэтиленгликоль).Lutrol E6000, коммерчески доступный от компании BASF, представляет собой высокомолекулярный полимер этиленоксида и смесь полимеров с различными степенями полимеризации. Типичные свойства Lutrol E6000 перечислены ниже: молекулярная масса: 5400-6600; гидроксильное число: 16-22; точка затвердевания: 55-61 С; вязкость (50% водный раствор; 20C): 200-270 mPas; рН (5% вода): 4,5-7,5; содержание воды по Фишеру (K. Fisher): 0,2%. 4. Композиция глицерида макрогола (4). Композиция глицерида стеароилмакрогола (4) имеет следующий состав: соединение А (мезилат) 20% мас./мас.Lutrol E6000 40% мас./мас. Композицию (4) получали в соответствии с общим способом, описанным в примере 2, 1, где использовали 1,2 г порошка соединения А, 2,4 г порошка Gelucire 50/13 и 2,4 г порошка Lutrol E6000 и выполняли расплавление матрицы Gelucire на термостатированной бане при 60C. 5. Физико-химические характеристики. 5.1. Содержание лекарственного препарата. Содержание лекарственного препарата определяли с помощью RP-ВЭЖХ, как описано выше. Состав лекарственного препарата в композиции (4) был 20,26%, cv: 2,85%. 5.2. Термический анализ.DSC анализ выполняли описанным выше способом, и были сделаны те же выводы, что и в примере 1. Пример 5. Композиция глицерида макрогола (5). 1. Общий способ получения. Получали концентрированный водный раствор бензотиазола в соответствии с формулой (I). Затем при интенсивном перемешивании раствор бензотиазола вводили в расплавленную матрицу Gelucire- 21011614 50/13. Далее полученную таким образом эмульсию распыляли с помощью форсунок различного типа,используя способ распыления жидкости с помощью CO2. В случае необходимости полученные микросферы необязательно подвергают сушке (например, сушка замораживанием) для удаления оставшейся воды из микросферного продукта. 2. Бензотиазол. Использовали соединение А, описанное в примере 1, 1. 3.Наполнители. 3.1. Gelucire 50/13 (глицериды стеароилмакрогола-32). Использовали Gelucire 50/13, описанный в примере 1, 1. 4. Макроголглицерид композиция (5). Композиция глицерида стеароилмакрогола (5) имеет следующий состав: соединение А (мезилат) 5% мас./мас.;Gelucire 50/13 95% мас./мас. Композицию (5) получали в соответствии с общим способом, описанным в примере 5, 1, где получали 5 мл концентрированного водного раствора соединения А (200 мг/мл) и выливали при интенсивном перемешивании (завихрение) в 18 г расплавленного Gelucire 50/13. Расплавление матрицы Gelucire выполняли на термостатированной бане при 70C. Были получены две порции: одна с использованием распыления через форсунку с капиллярным потоком (размер частиц, определенный с помощью оптической микроскопии: 100-200 мкм в диаметре) и другая с использованием распыления через распыляющую форсунку (размер частиц, определенный с помощью оптической микроскопии: 50-100 мкм в диаметре). Применяемый метод распыления представлял собой способ распыления, описанный в WO 2005/049192 в следующих условиях: Порция, полученная с помощью фосунки с капиллярным потоком: диаметр форсунки для продукта (капиллярный поток) = 0,25 мм; диаметр форсунки для жидкого CO2 = 0,25 мм; температура форсунки для продукта = 90C; температура печи = 75C; давление газообразного CO2 в подающем сосуде = 2,7 бар; давление жидкого CO2 = около 60 бар. Порция, полученная с помощью распыляющей форсунки: диаметр форсунки для жидкого CO2 = 0,25 мм; температура форсунки для продукта = 90C; температура печи = 75C; давление газообразного CO2 в подающем сосуде = 2,7 бар; давление газообразного CO2 в форсунке для продукта = 5 бар; давление жидкого CO2 = около 60 бар. 5. Физико-химические характеристики. 5.1. Содержание лекарственного препарата. Содержание лекарственного препарата определяли с помощью RP-ВЭЖХ, как описано выше. Содержание лекарственного препарата композиции (5) было 4,87%. 5.2. Термический анализ. Анализ DSC показал, что соединение А диспергировано в матрице глицерида макрогола в некристаллической форме (аморфная форма или твердый молекулярный раствор), поскольку анализ DSC показал отсутствие или минимальную остаточную степень кристалличности (меньше чем 5%). 5.3. Размер частиц. Изображения оптического микроскопа показали, что лекарственный препарат с добавлением частиц имеет размер частиц около 50-200 мкм в диаметре в зависимости от типа используемой форсунки. Пример 6. Солюбилизация препаратов бензотиазола на основе глицерида макрогола. Препараты бензотиазола на основе глицерида макрогола (1), (2), (3), (4) и основную массу (соединение А) сравнивали по их кривым солюбилизации лекарственного препарата в FeSSIF (Fed State Simulated Intestinal Fluid, pH=5), в перенасыщенных условиях, как описано далее. Кривые солюбилизации в перенасыщенных условиях, представленные на фиг. 1, показывают, что количество соединения А, первоначально растворенного (то есть в течение первых 2 ч) из препаратов на основе глицеридов макроголов по изобретению, является намного большим, чем количество растворенного из основной массы за тот же промежуток времени. Препарат бензотиазола на основе глицерида макрогола (5), полученный распылением, препарат бензотиазола на основе глицерида макрогола (1), полученный криомикронизацией и основную массу(соединение А) сравнивали по их кривым солюбилизации в FeSSIF (Fed State Simulated Intestinal Fluid,pH=5) в перенасыщенных условиях. Кривые солюбилизации, представленные на фиг. 2, показывают, что препарат на основе глицерида- 22011614 макрогола (5) имеет более сильную и более продолжительную солюбилизацию лекарственного препарата, чем криомикронизированный препарат (2), и что оба очень значительно превосходят основную массу. Кривые повышенной солюбилизации препаратов Gelucire (1)-(5) по сравнению с основной массой показывают, что препараты Gelucire повышают солюбилизацию бензотиазолов по изобретению. Кривая повышенной солюбилизации измельченного препарата (5), полученного способом, способствующим дисперсии соединения А в глицериде макрогола в аморфном состоянии, показывает, что может быть достигнута еще более высокая концентрация лекарственного препарата в растворе FeSSIF, и,таким образом, предоставляется возможность для абсорбции большего количества лекарственного препарата. Кинетика солюбилизации в перенасыщенных условиях. Отвешенные количества препаратов на основе глицерида макрогола соединения А, в виде порошка,или соединения А, в виде порошка основной массы, добавляли при перемешивании, с целью постоянного поддержания в среде раствора большого избыточного количества соединения А (намного большего,чем растворимость, достижимая при равновесии). В разные моменты времени извлекали образцы среды растворителя и исследовали концентрацию соединения А. Стеклянный химический стакан с магнитной мешалкой (320 об/мин). Среда: Fed State Simulated Intestinal Fluid pH = 5 (50 мл). Температура: 37C. Перенасыщенные условия: 4 мг/мл (теоретически максимальное количество соединения А, добавленное к среде растворителя, показывающее избыточное количество соединение А). Препараты бензотиазола на основе глицерида макрогола (1), (2), (3) и основную массу (соединение А) сравнивали по их кривым растворения в FeSSIF рН 5, в условиях поглощения (условия погружения), в соответствии со способом растворения лекарственного препарата II по USP XXVII (лопасть), как описано далее. Тест по определению растворимости лекарственного препарата определяет растворенное лекарственное средство, и, таким образом, высвобождение лекарственного препарата из твердой основной массы или из препаратов в среде растворителя, в условиях ниже растворимости при равновесии (условия погружения); количество соединения А выражают в % от всего количества лекарственного препарата,высвобожденного в сосуде для растворения, по сравнению со всем количеством лекарственного препарата, добавленного к нему при t0. Кривая растворения, представленная на фиг. 3, показывает достаточно существенное повышение скорости растворения лекарственного препарата в случае препаратов по изобретению. Две порции препаратов бензотиазола на основе глицеридов макрогола (5): одна полученная с помощью капиллярной форсунки, другая - с помощью распыляющей форсунки; и основную массу (соединение А) сравнивали по их кривым растворения в FeSSIF, рН 5, в условиях погружения, в соответствии со способом растворения лекарственного препарата II (лопасть) по USP XXVII, как описано далее. Скорость растворения лекарственного препарата из препарата бензотиазола на основе глицерида макрогола (5) была значительно выше по сравнению с основной массой лекарственного препарата. Кроме того, различия в кривой растворения лекарственного препарата являются определимыми между микросферами, полученными с помощью различных форсунок, при этом более эффективное растворение лекарственного препарата достигается при более меньшем размере микросфер, полученных с помощью распыляющей форсунки. Скорости растворения в условиях погружения. Отмеренные количества препаратов соединения А на основе глицеридов макрогола в виде порошка или соединения А в виде основной массы добавляли в отмеренный объем среды растворителя, содержащейся в сосуде аппарата для растворения лекарственного препарата, тип II (лопасть), по USP XXVII. Условия погружения были вычислены, как изложено ниже. Способ растворения лекарственного препарата II (лопасть) USP XXVII. Скорость вращения лопасти: 100 об./мин. Среда: Fed State Simulated Intestinal Fluid pH=5 (200 мл). Температура: 37 С. Условия погружения: 0,2 cs (cs = концентрация раствора лекарственного препарата в присутствии избыточного количества лекарственного препарата через 24 ч при комнатной температуре). Пример 7. Фармакокинетическая кривая композиций бензотиазол макроголглицерида. Композиции на основе глицеридов макроголов перорально вводили собакам породы гончая в виде приготовленной для немедленного приема суспензии в PBS, дозой 10,6 мг/кг, следуя указанной ниже схеме, путем принудительного питания в объеме, составляющем 2 мл/кг и препарат основной массы путем насильственного введения в горло. Композиции вводили животным, которых перед обработкой не кормили в течение ночи (то есть в течение около 16 ч), пищу снова давали через 4 ч после обработки. Композиции на основе глицеридов макроголов (1) и (2) вводили перорально, как описано выше. Интервал времени для очистки организма между введением препарата (1) и препаратов (2) составлял по- 23011614 крайней мере 1 неделю. Использовали 6 собак породы гончая (3 самца и 3 самки) с массой тела около 10-13 кг и в возрасте 9-12 месяцев. Животных взвешивали натощак перед введением и записывали массу тела. Следовали следующей схеме эксперимента: Отбор крови и плазмы Кровь (по крайней мере 2,5 мл) брали из яремной вены в гепаринизированные пробирки до и после введения лекарственного препарата, за следующие 15 раз: 0 (преддоза), 0, 25, 0,5, 1, 1,5, 2, 3, 4, 5, 6, 8, 12,24, 32 и 48 ч после введения. Кровь центрифугировали в течение 15 мин при около 2500 г при +4C в течение 10 мин. Клетки крови отбрасывали и полученную плазму разделяли на 3 аликвоты (по крайней мере 0,3 мл каждая). Концентрация плазмы соединения А (свободное основание соединения А, мезилат) в образцах плазмы неизвестной собаки определяли с помощью высокоэффективной жидкостной хроматографии/массспектрометрии (ВЭЖХ/MS). Следующие фармакокинетические параметры получали или рассчитывали для отдельных концентраций плазмы соединения А в зависимости от времени, прошедшего после введения, используя версию 3.1 программы WinNonlin (Pharsight Corporation, Palo Alto, CA, USA):Cmax: самое высокое найденное значение концентрации.tmax: время, прошедшее после введения, при котором определяют значение Cmax.tz: время взятия последнего образца, при котором определяют исследуемую концентрацию.Cz: значение концентрации, полученное при времени взятия образца tz.AUCz: площадь под кривой концентрации плазмы в зависимости от времени, вплоть до времени взятия образца tz, вычисленная по правилу трапеций.AUC: площадь под кривой концентрации плазмы в зависимости от времени, экстраполированного до бесконечности.F: абсолютная биодоступность при пероральных путях введения, вычисленная как нормализованный коэффициент AUC. Использовали внутривенную AUC из фармакокинетического исследования на собаке с помощью соединения А основной массы. Фармакокинетические результаты, представленные на фиг. 4, показывают, что пероральное поглощение соединения А значительно повышается при введении с помощью препаратов на основе глицеридов макрогола по изобретению, биодоступность повышается от значений менее 15% (соединение А в воде для инъекций) до около 30% и выше (препараты (1) и (2. Соединения примеров 8-28 синтезировали в соответствии со способами, описанными на схемах IVIII выше. Данные ВЭЖХ, ЯМР и MS, приведенные в описанных ниже примерах, получали следующим образом: ВЭЖХ: колонка Waters Symmetry C8 504,6 мм, условия: а) - MeCN/H2O 0,09% ТФУ, 0-100% (10 мин); b) - MeCN/H2O, 5-100% (8 мин), максимальный участок 230-400 нм; масс-спектр: PE-SCIEX API 150 EX (APCI и ESI), LC/MS спектр: Waters ZMD (ES); 1H-ЯМР: Bruker DPX-300 Мгц. Очистку проводили следующим образом: препаративная ВЭЖХ Waters Prep LC 4000 System, оборудованная колонками Prep Nova-PakHR С 186 мкм 60, 4030 мм (до 100 мг) или 40300 мм (до 1 г). Всю очистку выполняли градиентом MeCN/H2O 0,09% ТФУ. Промежуточное соединение 1. Получение 1,3-бензотиазол-2-ил(2-хлор-4-пиримидинил)ацетонитрила К перемешиваемой суспензии NaH (60% в масле, 9,2 г, 0,23 моль) в сухом ТГФ (200 мл) добавляли по каплям в атмосфере инертного газа раствор 1,3-бензотиазол-2-илацетонитрила (20 г, 0,15 моль) в сухом ТГФ (200 мл). Через 1 ч 30 мин перемешивали при комнатной температуре, добавляли по каплям раствор 2,4-дихлорпиримидина (17,1 г, 0,15 моль) в сухом ТГФ (200 мл). Реакционную смесь оставляли перемешиваться в атмосфере инертного газа при комнатной температуре до полного исчезновения исходного вещества. Реакцию гасили добавлением воды и упаривали ТГФ. Добавляли воду и суспензию немного подкисляли водным 1M раствором HCl. Полученный осадок отфильтровывали и тщательно промывали водой до нейтрального, затем гексаном до удаления масла. Сырое твердое вещество сушили в К раствору м-толуиловой кислоты (175 г, 1,28 моль) в метаноле (2 л) добавляли по каплям тионилхлорид (612 г, 5,14 моль) при перемешивании при 5C. Смесь нагревали с обратным холодильником в течение ночи, затем растворитель упаривали. Полученный остаток обрабатывали 10%-м водным раствором NaHCO3 (рН 8). Продукт экстрагировали этилацетатом, промывали водой и сушили. Растворитель удаляли и сырой продукт счищали хроматографией на колонке (петролейный эфир/этилацетат) с получением метил-м-толуата в виде бесцветной жидкости (180 г, 93%) . Стадия 2. Метил 3-(бромметил)бензоат К смеси метил-м-толуата (180 г, 1,2 моль) и N-бромсукцимида (235 г, 1,32 моль) в CCl4 (2 л) добавляли порциями бензоилпероксид (18 г, по 0,1 части) при 50 С. Смесь нагревали с обратным холодильником в течение 5 ч. Затем смесь оставляли охлаждаться до 40C и твердое вещество отфильтровывали. Фильтрат концентрировали с получением метил 3-(бромметил)бензоата (252 г, 91%) в виде светложелтой жидкости. Стадия 3. Метил 3-(морфолин-4-илметил)бензоат К раствору морфолина (80 г, 0,91 моль) и триэтиламина (232 г, 2,29 моль) в EtOH (1750 мл) добавляли по каплям при 0C раствор метил 3-(бромметил)бензоата (252 г, 1,1034 моль) в абсолютном спирте(250 мл). Смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали и полученный остаток помещали в 1,5 н HCl (3 л), затем промывали диэтиловым эфиром (3 раза) и этилацетатом. Раствор нейтрализовали 10% водным раствором NaOH и подщелачивали до рН=8 10% водным раствором NaHCO3. Продукт экстрагировали CHCl3, промывали водой и солевым раствором,затем сушили над Na2SO4. Растворитель удаляли и сырой продукт очищали на хроматографической колонке с помощью смеси CHCl3/МеОН с получением метил 3-(морфолин-4-илметил)бензоата (150 г, 70%) в виде коричневой жидкости. Стадия 4. (3-Морфолин-4-илметилфенил)метанол К смеси LAH (36 г, 0,957 моль) в сухом ТГФ (1750 мл) добавляли по каплям при 0 С в атмосфереN2 раствор N-(3-метоксикарбонилбензил)бромида (150 г, 0,638 моль) в сухом ТГФ (250 мл). Смесь перемешивали в течение ночи при комнатной температуре в атмосфере N2, затем гасили 10% водным раствором NaOH. Твердое вещество отфильтровывали и фильтрат концентрировали. Остаток помещали в DCMH ЯМР (ДМСО-d6)7,28-7,23 (м, 2H), 7,19-7,13 (м, 2H), 5,14 (т, J=5,65 Гц, 1H), 4,47 (д, J=5,84 Гц,2H), 3,57-3,54 (м, 4H), 3,42 (с, 2H), 2,34-2,31 (м, 4H). При использовании этого описанного выше в примере T способа и соответствующего исходного вещества и реагентов, могут быть получены следующие дополнительные пара- или метазамещенные производные бензилового спирта. Промежуточное соединение 3. (3-Пиперидин-1-илметилфенил)метанол Смесь 4-цианобензойной кислоты (500 г, 3,4 моль) и никеля Ренея (100 г) в метаноле (5 л) гидрировали при давлении 10 кг в течение 16 ч. Катализатор удаляли фильтрованием с последующим удалением растворителя при пониженном давлении с получением 4-(аминометил)бензойной кислоты (430 г, 84%) в виде белого твердого вещества. Стадия 2. Метил-4-(аминометил)бензоат К раствору 4-(аминометил)бензойной кислоты (300 г, 1,98 моль) в метаноле (5 л) добавляли тионилхлорид (473 г, 3,97 моль). Реакционную смесь нагревали с обратным холодильником в течение 6 ч с последующим удалением растворителя при пониженном давлении с получением сырого продукта. Сырое вещество очищали кислотно-щелочной обработкой с получением метил-4-(аминометил)бензоата Смесь метил-4-(аминометил)бензоата (50 г, 0,302 моль) и бензальдегида (32 г, 0,302 моль) в EtOH (1 л) нагревали с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры порциями добавляли NaBH4 (11,5 г, 0,302 моль). Реакционную смесь перемешивали при комнатной температуре в течение 10 ч. Растворитель удаляли при пониженном давлении и соединение очищали кислотно-щелочной обработкой с получением N-(4-метоксикарбонилбензил)бензиламина (25 г, 33%). Стадия 4. 4-Метоксикарбонил-[N-(BOC)]-N-[бензил]бензиламин К смеси N-(4-метоксикарбонилфенил)бензиламина (25 г, 0,098 моль) в CH2Cl2 (500 мл) добавляли диизопропилэтиламин (38 г, 0,294 моль) и (BOC)2O (32 г, 0,147 моль). После перемешивания при комнатной температуре в течение 5 ч растворитель удаляли при пониженном давлении. Затем сырой продукт очищали хроматографией, используя смесь хлороформ/метанол (9/1) с получением 4-метоксикарбонил[N-(BOC)]-N-[бензил]бензиламина (27 г, 78%) в виде жидкости. Стадия 5. трет-Бутил-N-[(4-гидроксиметил)бензил]-N-(бензил)карбамат К суспензии LAH (4 г, 0,105 моль) в сухом ТГФ (150 мл) добавляли раствор 4-метоксикарбонил-N[Boc]-N-[бензил]бензиламина (25 г, 0,070 моль) в сухом ТГФ (25 мл) при перемешивании при -40C. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 2 ч. Затем гасили 20 мл 10% водного раствора NaOH и полученный осадок отфильтровывали. Фильтрат концентрировали и остаток очищали на хроматографической колонке (хлороформ/метанол, 9:1) с получением 16 г К раствору 2-амино-4-метилпиридина (120 г, 1,1 моль) в 48% HBr (1,5 л) при -20C по каплям добавляли бром (160 мл, 3,11 моль). Реакционную смесь перемешивали в течение 3 ч при от -15 до -20C. К вышеуказанной смеси добавляли частями водный раствор NaNO2 (204 г, 2,95 моль). Затем реакционную смесь оставляли нагреваться до комнатной температуры в течение 3 ч. Добавляли 20% водный растворNaOH (1,2 кг NaOH в 2 л воды) и рН доводили до 12, поддерживая температуру при 0C. Реакционную смесь экстрагировали диэтиловым эфиром (3250 мл), промывали водой, солевым раствором и сушили. Растворитель удаляли и очищали фракционной перегонкой с получением 2-бром-4-метилпиридина (164 г, 8 6%) в виде бледно-желтой жидкости. Стадия 2. 2-Бромизоникотиновая кислота К смеси 2-бром-4-пиколина (300 г, 1,74 моль) в смеси пиридин/вода (1 л каждой) при 95 С добавляли KMnO4 (200 г), растворенный в воде (1 л) . Далее порциями добавляли KMnO4 (2 кг) (соответственно,20 мг каждый раз) в течение 4 дней. Реакционную смесь охлаждали до комнатной температуры и отфильтровывали твердый MnO2. Фильтрат упаривали полностью при пониженном давлении и подкисляли 6 н HCl. Полученный твердый продукт фильтровали, промывали водой и сушили с получением 2 бромизоникотиновой кислоты (166 г, 47%). Стадия 3. 2-Пиперидин-1-илизоникотиновая кислота Смесь 2-бромизоникотиновой кислоты (40 г, 0,198 моль) и пиперидина (200 мл) нагревали с обратным холодильником при 105C в течение 24 ч в атмосфере N2. Избыточное количество пиперидина отгоняли в вакууме и неочищенный остаток разбавляли водой (500 мл) и экстрагировали хлороформом(3250 мл), промывали солевым раствором и сушили. Растворитель удаляли в вакууме с получением 2 пиперидин-1-илизоникотиновой кислоты (35 г, 85%) в виде твердого вещества. Стадия 4. Метил 2-пиперидин-1-илизоникотинат Смесь 2-пиперидин-1-илизоникотиновой кислоты (30 г, 0,145 моль) в метаноле (500 мл) охлаждали до 0 С и затем добавляли тионилхлорид (42 мл). Реакционную смесь нагревали с обратным холодильником в течение 20 ч. Растворитель удаляли в вакууме и остаток помещали в EtOAc (500 мл). Органический слой промывали 10% водным раствором NaHCO3, водой, солевым раствором и сушили. Растворитель удаляли в вакууме с получением метил 2-пиперидин-1-илизоникотината (18 г, 56%) в виде жидкости желтого цвета. Стадия 5. (2-Пиперидин-1-илпиридин-4-ил)метанол К суспензии LAH (5,5 г, 0,145 моль) в сухом ТГФ (500 мл) при 0C добавляли метил 2-пиперидин 1-илизоникотинат (18 г, 0,095 моль) в сухом ТГФ (100 мл) в атмосфере N2. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и гасили 10% водным раствором NaOH при -20C. Твердое вещество отфильтровывали, промывали ТГФ и концентрировали. Остаток растворяли в CH2Cl2(250 мл), промывали водой, солевым раствором и сушили. Растворитель удаляли в вакууме и сырой про- 28011614 дукт очищали хроматографией на колонке с силикагелем (CHCl3/MeOH, 9:1) с получением (2 пиперидин-1-илпиридин-4-ил)метанола (12 г, 65%). 1H ЯМР (ДМСО-d6)7,98 (д, J=5,2 Гц, 1H), 6,71 (с, 1H), 6,51 (ушир.д, 1H), 5,24 (т, J=5,2 Гц, 1H),4,41 (д, J=5,2 Гц, 2H), 3,49-3,46 (м, 4H), 1,58-1,50 (м, 6H). Аналогичным образом могут быть получены следующие промежуточные соединения. Промежуточное соединение 12. N-(4-Гидроксиметилпиридин-2-ил)морфолин(100 мл) добавляли расплавленный CsCO3 (30 г, 0,09 моль) при перемешивании в атмосфере аргона. К этой смеси добавляли BINAP (0,45 г, 0,0005 моль), Pd2(dba)3 (0,22 г, 0,00015 моль) и затем реакционную смесь нагревали с обратным холодильником при 110C в течение 50 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли диэтиловым эфиром (400 мл) и фильтровали через целит. Фильтрат концентрировали в вакууме и очищали на хроматографической колонке (CHCl3/MeOH, 4:1) с получением 4,2 г (41%) метил 5-морфолин-4-илникотината в виде жидкости. TCX - хлороформ/метанол (8/2): К суспензии LAH (1 г, 0,027 моль) в сухом ТГФ (70 мл) добавляли метил 5-морфолин-4 илникотинат (4 г, 0,018 моль) в сухом ТГФ (10 мл) при -40C при перемешивании. Реакционную смесь перемешивали при этой температуре в течение 2 ч и затем гасили 6 мл 10% водного раствора NaOH при-40C. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 30 мин,фильтровали через целит, промывали ТГФ и концентрировали с получением 2,8 г (80%) указанного в заголовке соединения в виде жидкости. В ТГФ (30 мл) добавляли N-(2-гидроксиэтил)пиперазин (500 мг, 3,84 ммоль), раствор формальдегида (3117 мг, 38,41 ммоль) и цианоборгидрида натрия (1207 мг, 19,20 ммоль). Смесь нагревали до 50C в течение ночи при перемешивании. После охлаждения добавляли некоторое количество воды и смесь экстрагировали DCM (3). Органические слои сушили над MgSO4 и упаривали. Остаток очищали через слой из силикагеля с помощью DCM/MeOH 9:1 в качестве элюента с получением масла (370 мг, Y=67%). 1 К раствору N-метилпиперазина (3,33 мл, 30,09 ммоль) добавляли раствор триметилалюминия в гептане (15,04 мл, 30,09 ммоль) и смесь перемешивали 10 мин при комнатной температуре. К этому раствору добавляли раствор метилового эфира 4-(гидроксиметил)бензойной кислоты (1000 мг, 6,02 ммоль) вDCE и смесь нагревали с обратным холодильником в атмосфере инертного газа в течение 3 ч. Смесь разбавляли DCM, затем добавляли воду. Суспензию фильтровали через целит. Фильтрат промывали 5% раствором NaHCO3 (2), потом водой и солевым раствором. Органические слои сушили над MgSO4, упаривали и сушили при 40 С в вакууме с получением 307 мг (Y=21%) указанного в заголовке соединения в виде масла. 1 К раствору промежуточного соединения 1 (0,200 г, 0,7 ммоль) в DMA (3 мл) добавляли 3-(2 гидроксиэтил)пиридин (0,172 г, 1,4 ммоль), карбонат цезия (1,14 г, 3,5 ммоль) и иодид меди (0,133 г, 0,7 ммоль) и суспензию встряхивали при 100C в течение 19 дней. После охлаждения до комнатной температуры растворитель упаривали. Остаток промывали несколько раз водой, затем отфильтровывали и сушили при 40C в вакууме. Твердое вещество помещали в смесь DCM/ТФУ и добавляли эфир. Образовавшийся осадок отфильтровывали, промывали эфиром (3). После очистки препаративной ВЭЖХ и сушки в вакууме при 40C получали 121 мг (29%) указанного в заголовке соединения в виде порошка желтого цвета. Указанное в заголовке соединение получали при осуществлении согласно протоколу, описанному в примере 8, где используют 2-нафтол вместо 3-(2-гидроксиэтил)пиридина. Y=16%; M+(ESI): 396,0; ВЭЖХ
МПК / Метки
МПК: A61K 47/10, A61K 47/26, A61K 31/506, A61K 47/14, A61K 31/428
Метки: применение, бензотиазола, препараты
Код ссылки
<a href="https://eas.patents.su/30-11614-preparaty-benzotiazola-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Препараты бензотиазола и их применение</a>
Предыдущий патент: Способ приготовления готового к употреблению продукта из ячменя или перловой крупы
Следующий патент: Композиция ингредиентов для горькой настойки-бальзама
Случайный патент: Мельница с составной футеровкой и способ изготовления составной футеровки












