Производные 1,3-дифенилпроп-2-ен-1-она, способ их получения и применение
Формула / Реферат
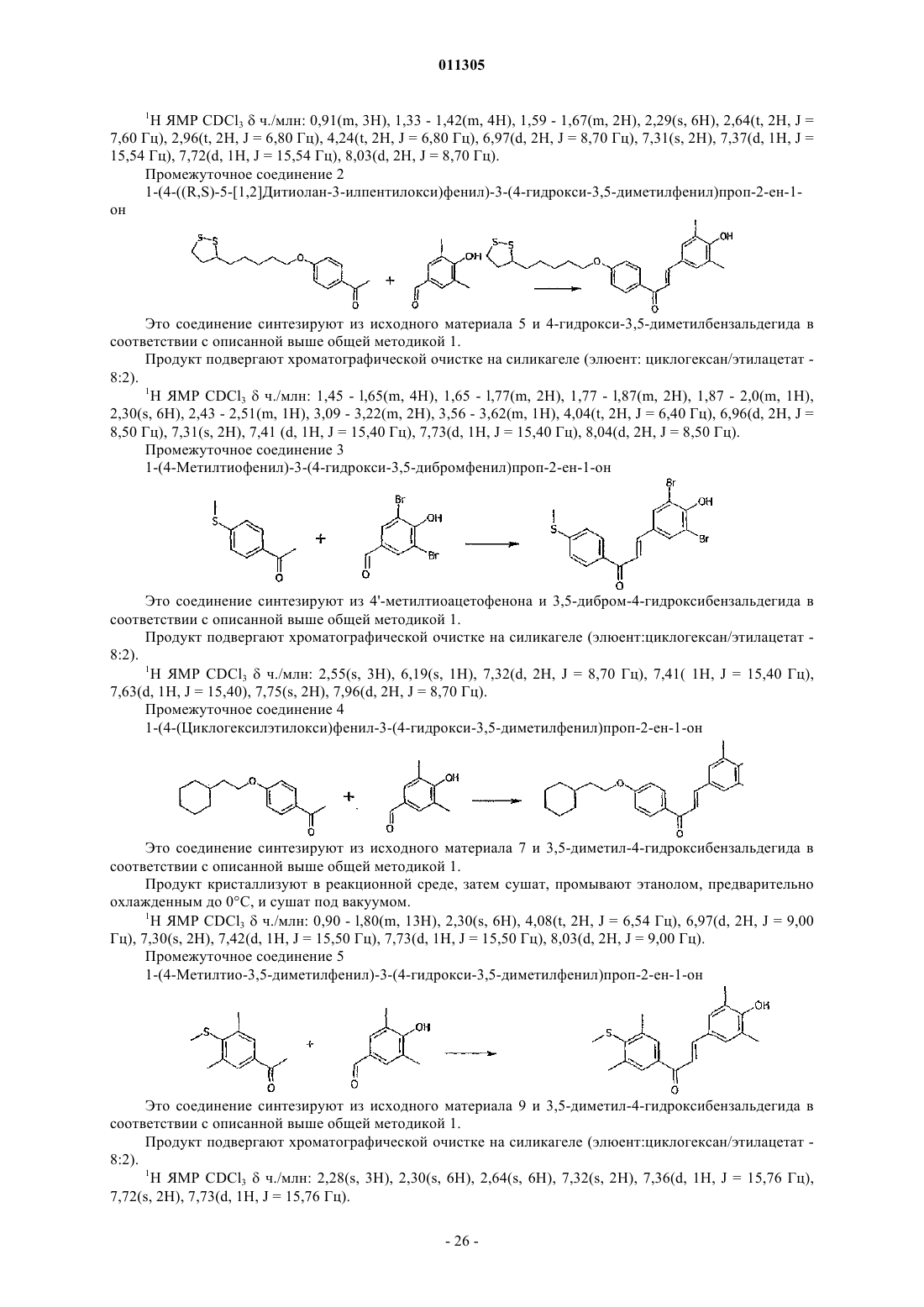
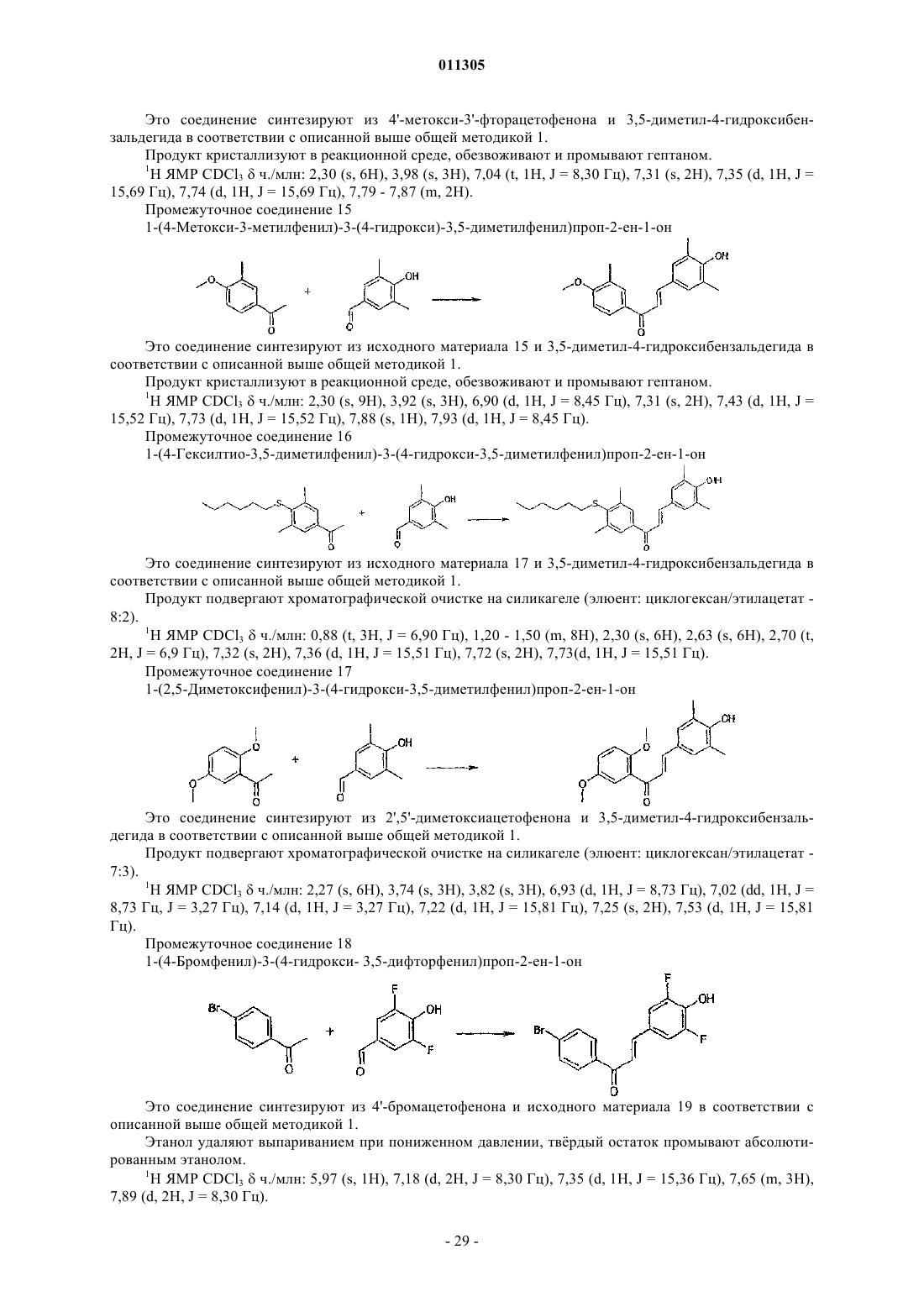
1. Замещённые производные 1,3-дифенилпроп-2-ен-1-она соединения общей формулы (I)
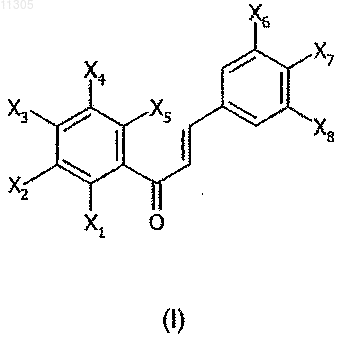
где Х7 означает группу, соответствующую формуле G7-R7, в которой G7 - атом кислорода или серы, R7 представляет собой С1-С7алкил, замещённый группой -COORa, в которой Ra представляет собой водород или С1-С7алкил;
группы X1, в которых i = 1, 2, 3, 4 или 5, одинаковые или разные, означают атом галогена или отвечают, соответственно, формуле (Gi-Ri)n-G'i-R'i, в которой
n может принимать значения 0 или 1,
Gi и G'i, одинаковые или разные, означают простую связь, атом кислорода или атом серы,
R1 и R'i, одинаковые или разные, означают С1-С7алкил, С2-С7алкенил, арил или гетероцикл, выбранный из группы, состоящей из дитиоланов, пурина, фурана, тиофена, морфолина, пиперидина и пиперазина;
R'i может также означать атом водорода,
группы Xi, в которых i=6 или 8, одинаковые или разные, означают атом галогена или соответствуют формуле G'i-R'i, в которой G'i представляет собой простую связь, О или S и
R'i представляет собой Н, С1-С7алкил или С2-С7алкенил;
X6 и X8 одновременно не являются атомом водорода,
Xi, в которых i=1, 2, 3, 4, 5, 6 или 8, не может означать гетероцикл, непосредственно связанный с ароматическим циклом 1,3-дифенилпроп-2-ен-1-она,
за исключением соединений формулы (I), в которых одновременно одна из групп X1 X2, X3, Х4 или Х5 является гидроксильной группой,
G7 - атом кислорода,
одна из групп X6, X8 означает атом водорода или галогена или гидроксил или алкилоксигруппу, за исключением соединений формулы (I), в которых одновременно
группы X1, X2 и Х4 означают одновременно атом водорода,
группы X6 и Х8 означают G'iR'i,
группа Х5 означает галоген или группу G'iR'i,
группа X3 означает галоген или группу G'iR'i, в которой G'i означает атом кислорода, атом серы или простую связь, a R'i означает насыщенную, линейную или разветвлённую или циклическую, алкильную группу, содержащую галоген или не содержащую его или атом водорода.
2. Соединения по п.1, где X1 и Х5 означают атомы водорода.
3. Соединения по п.1 или 2, где X2 и X4 означают алкильные группы.
4. Соединения по п.1, где X1, X3 и Х4 означают алкильные группы.
5. Соединения по п.1, где X1, Х2, Х4 и Х5 означают атомы водорода.
6. Соединения по любому из предыдущих пунктов, где X6 и Х8 означают алкильные группы.
7. Соединения по любому из предыдущих пунктов, где X1 и X5 означают атомы водорода.
8. Соединения по любому из предыдущих пунктов, где X2 и Х4 означают алкильные группы.
9. Соединения по п.1, где X1, X3, Х4, X6 и X8 означают алкильные группы.
10. Соединения по п.1, где X6 и X8 означают алкильные группы, X1, Х2, X4 и X5 означают атомы водорода.
11. Соединения по любому из предыдущих пунктов, где X3 означает атом галогена или отвечает формуле (Gi-Ri)n-G'i-R'i, такой как определено в п.1, где G'i означает атом кислорода или атом серы.
12. Соединения по любому из предыдущих пунктов, где по меньшей мере одна из групп Gi, G'i означает атом серы, при этом i может принимать одно из значений 1, 2, 3, 4, 5, 6, 7 или 8.
13. Соединения по любому из предыдущих пунктов, где их выбирают из группы соединений, состоящей из
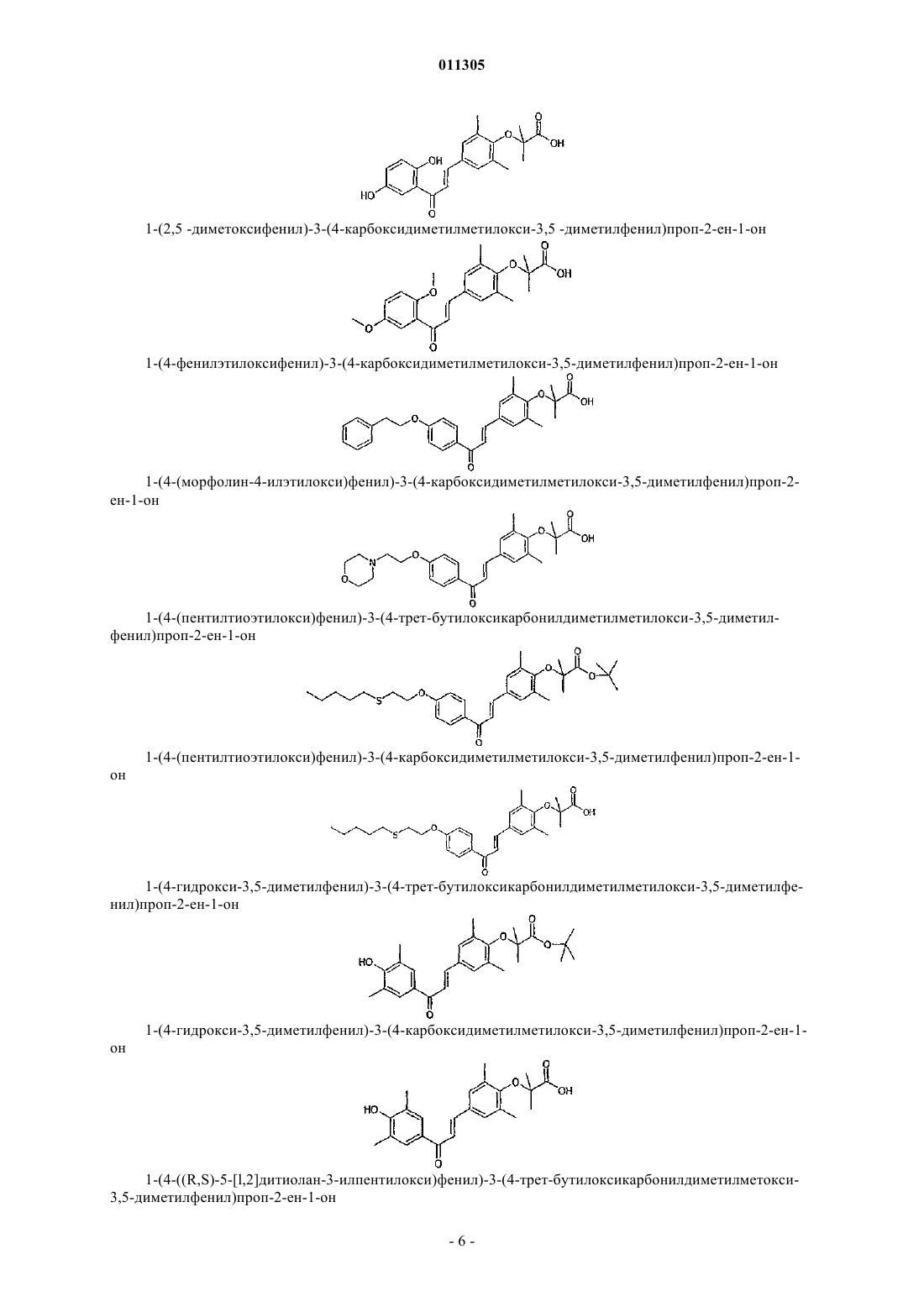
1-(4-((R,S)-5-[1,2]дитиолан-3-илпентилокси)-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-меркапто-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилтио-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил) проп-2-ен-1-он;
1-(2,5-дигидрокси-3,4,6-триметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-диметокси-3,4,6-триметилфенил)-3-(4-карбоксидиметилметокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-дигидроксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-диметоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-фенилэтилоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(морфолин-4-илэтилокси)фенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-пентилтиоэтилокси)фенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(пентилтиоэтилокси)фенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гидрокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гидрокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(R,S)-5-[1,2]дитиолан-3-илпентилокси)фенил-3-(4-трет-бутилоксикарбонилдиметилметокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(R,S)-5-[1,2]дитиолан-3-илпентилокси)фенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
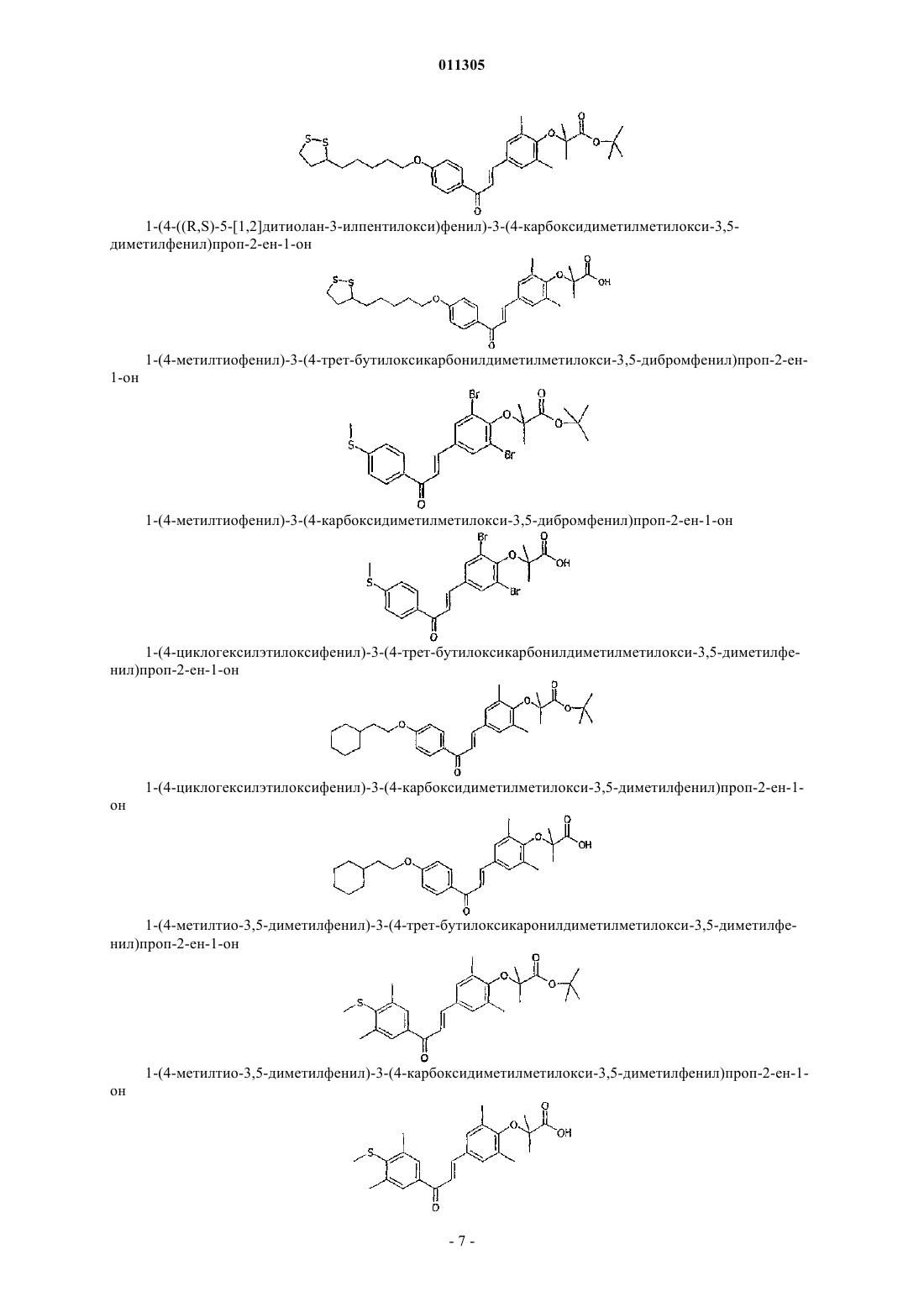
1-(4-метилтиофенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-дибромфенил)проп-2-ен-1-он;
1-(4-метилтиофенил)-3-(4-карбоксидиметилметилокси-3,5-дибромфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилоксифенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метилтио-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метилтио-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-пропилокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-пропилокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гексилокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гексилокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил) проп-2-ен-1-он;
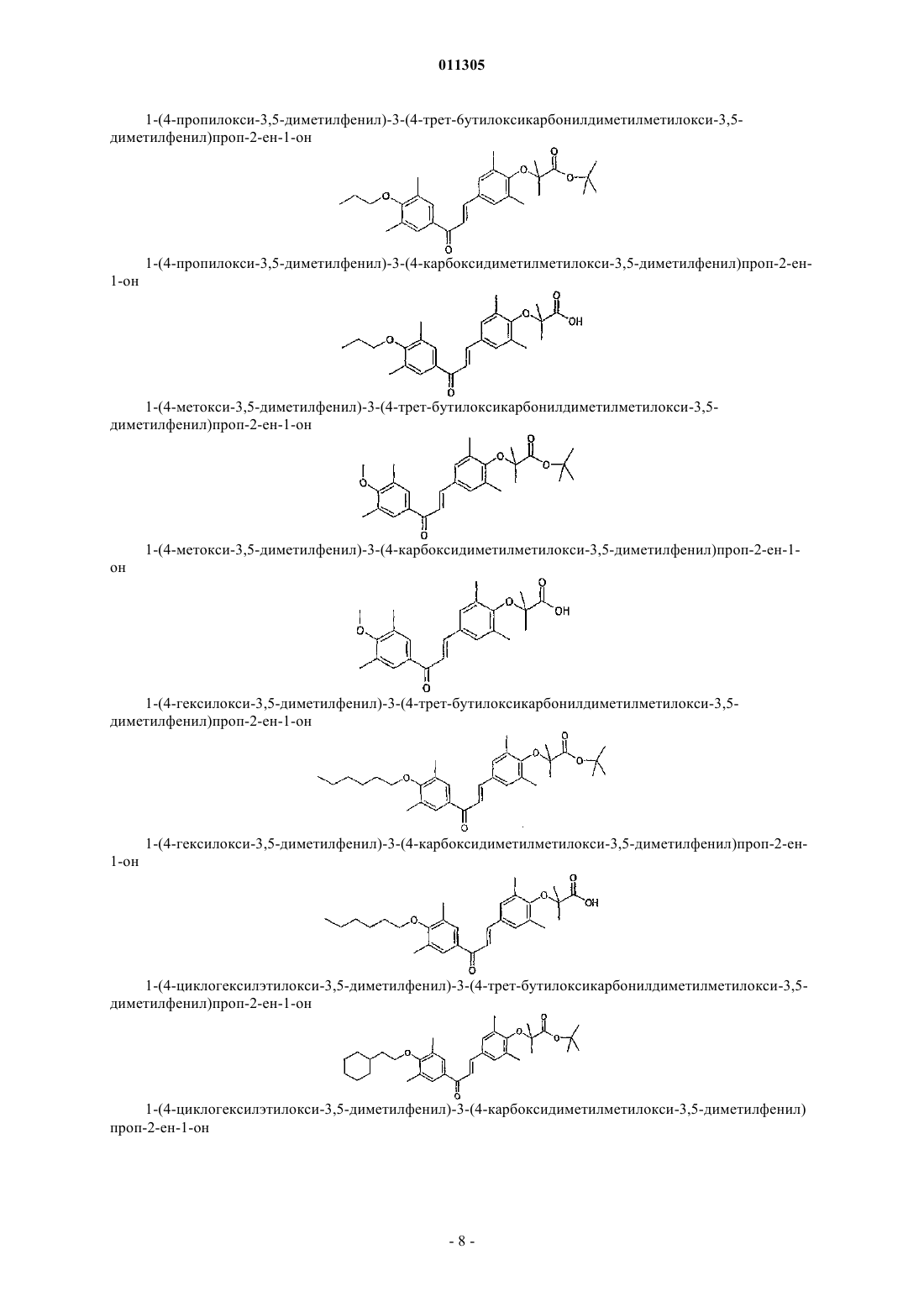
1-(4-циклогексилтиоэтилоксифенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилтиоэтилоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,4,5-триметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,4,5-триметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилтиоэтилокси-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилтиоэтилокси-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метилтиофенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3-фторфенил)проп-2-ен-1-он;
1-(4-метилтиофенил)-3-(4-карбоксидиметилметилокси-3-фторфенил)проп-2-ен-1-он;
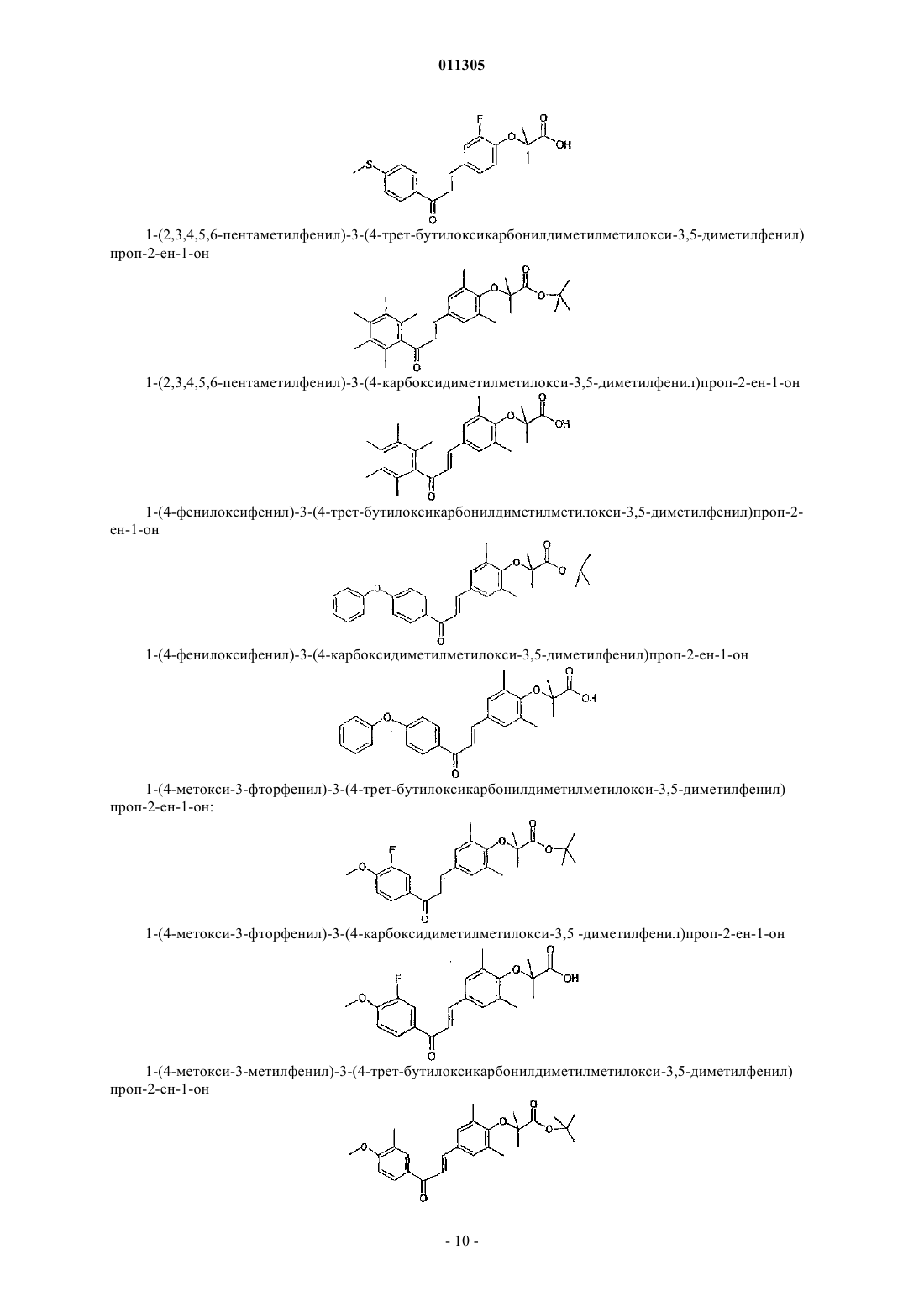
1-(2,3,4,5,6-пентаметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил) проп-2-ен-1-он;
1-(2,3,4,5,6-пентаметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-фенилоксифенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-фенилоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3-фторфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил) проп-2-ен-1-он;
1-(4-метокси-3-фторфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3-метилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил) проп-2-ен-1-он;
1-(4-метокси-3-метилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
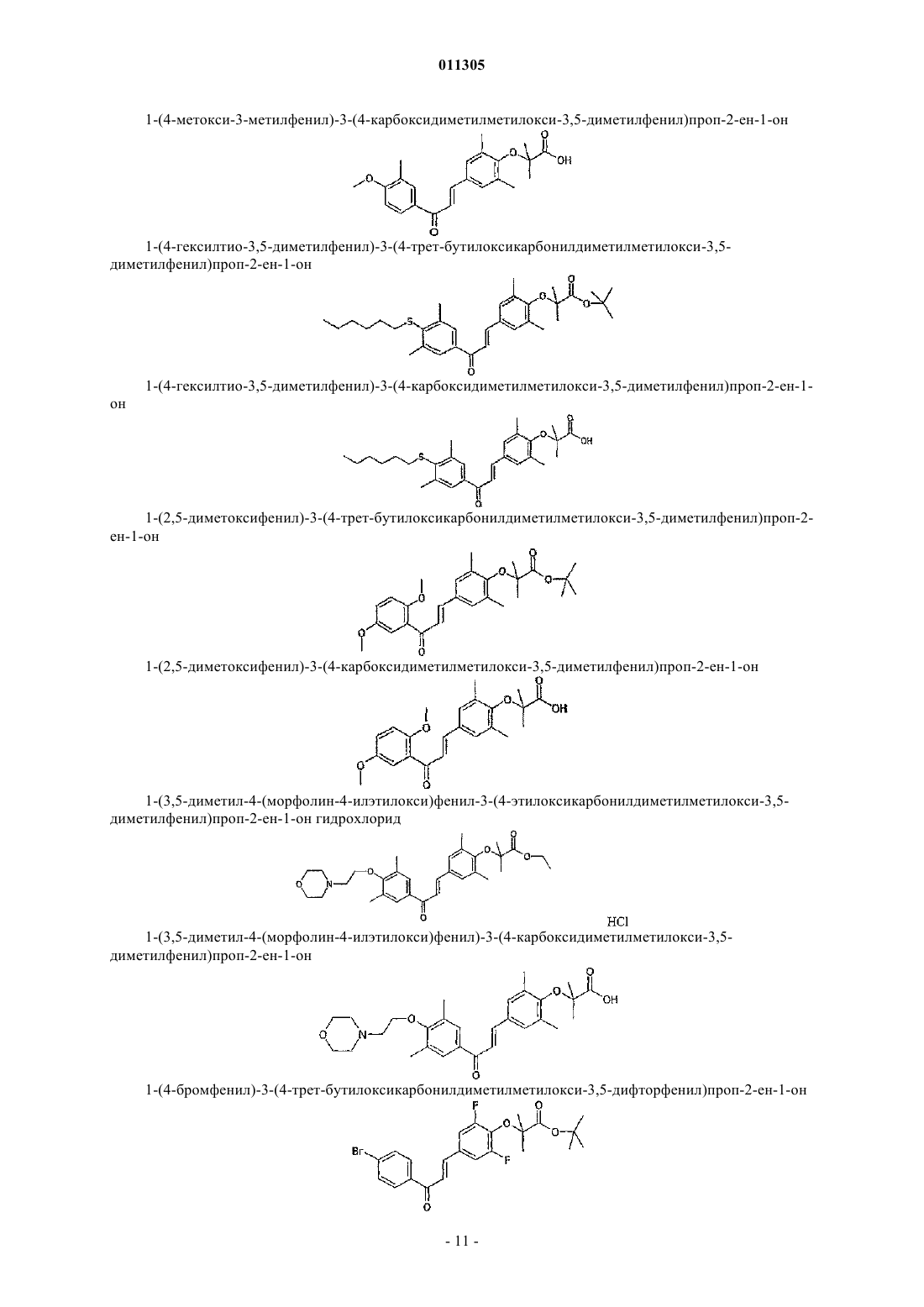
1-(4-гексилтио-3,5-диметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гексилтио-3,5-диметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-диметоксифенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-диметоксифенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
хлоргидрид 1-(3,5-диметил-4-(морфолин-4-илэтилокси)фенил-3-(4-этилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-она;
1-(3,5-диметил-4-(морфолин-4-илэтилокси)фенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-бромфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-дифторфенил)проп-2-ен-1-он;
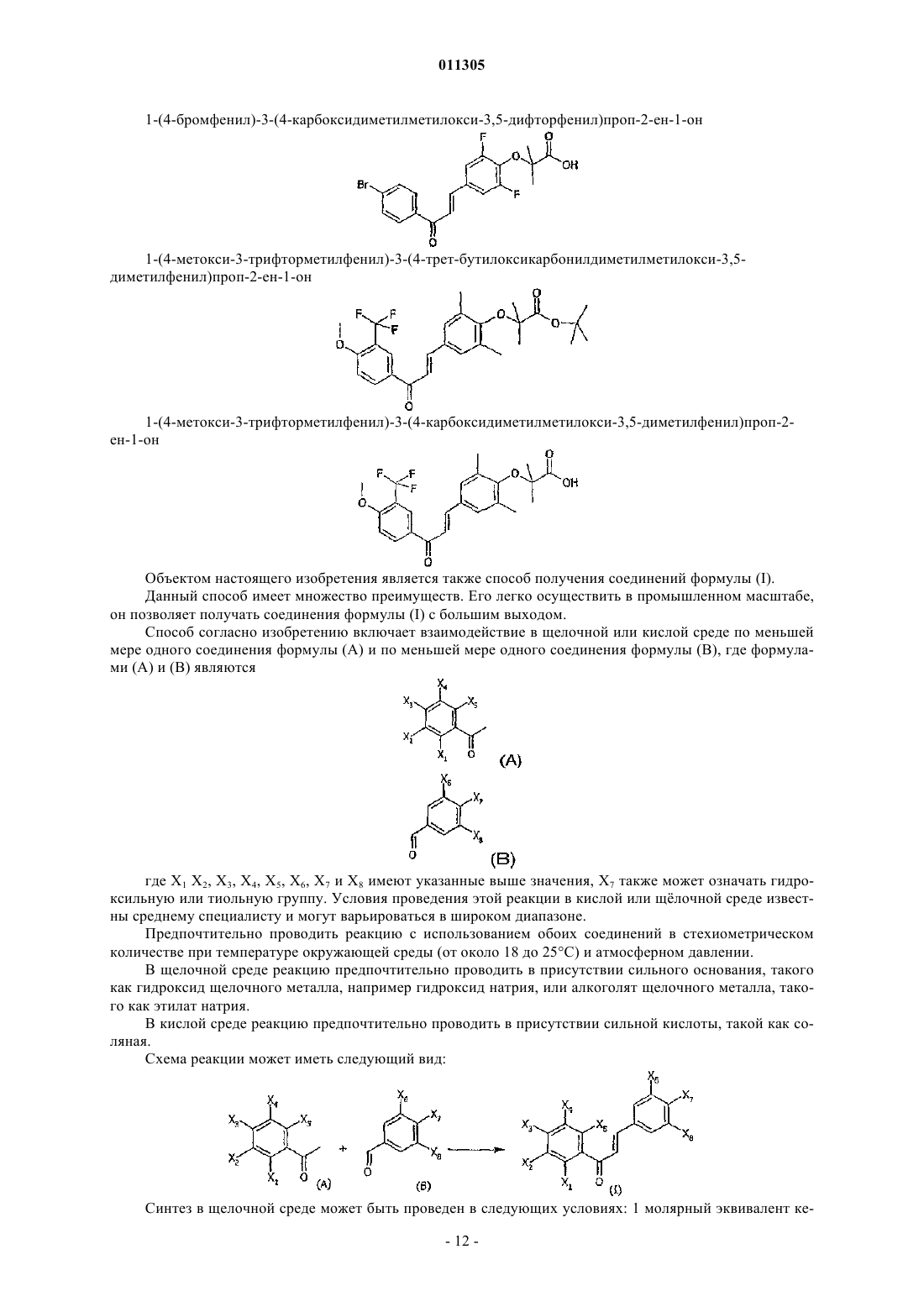
1-(4-бромфенил)-3-(4-карбоксидиметилметилокси-3,5-дифторфенил)проп-2-ен-1-он;
1-(4-метокси-3-трифторметилфенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3-трифторметилфенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он.
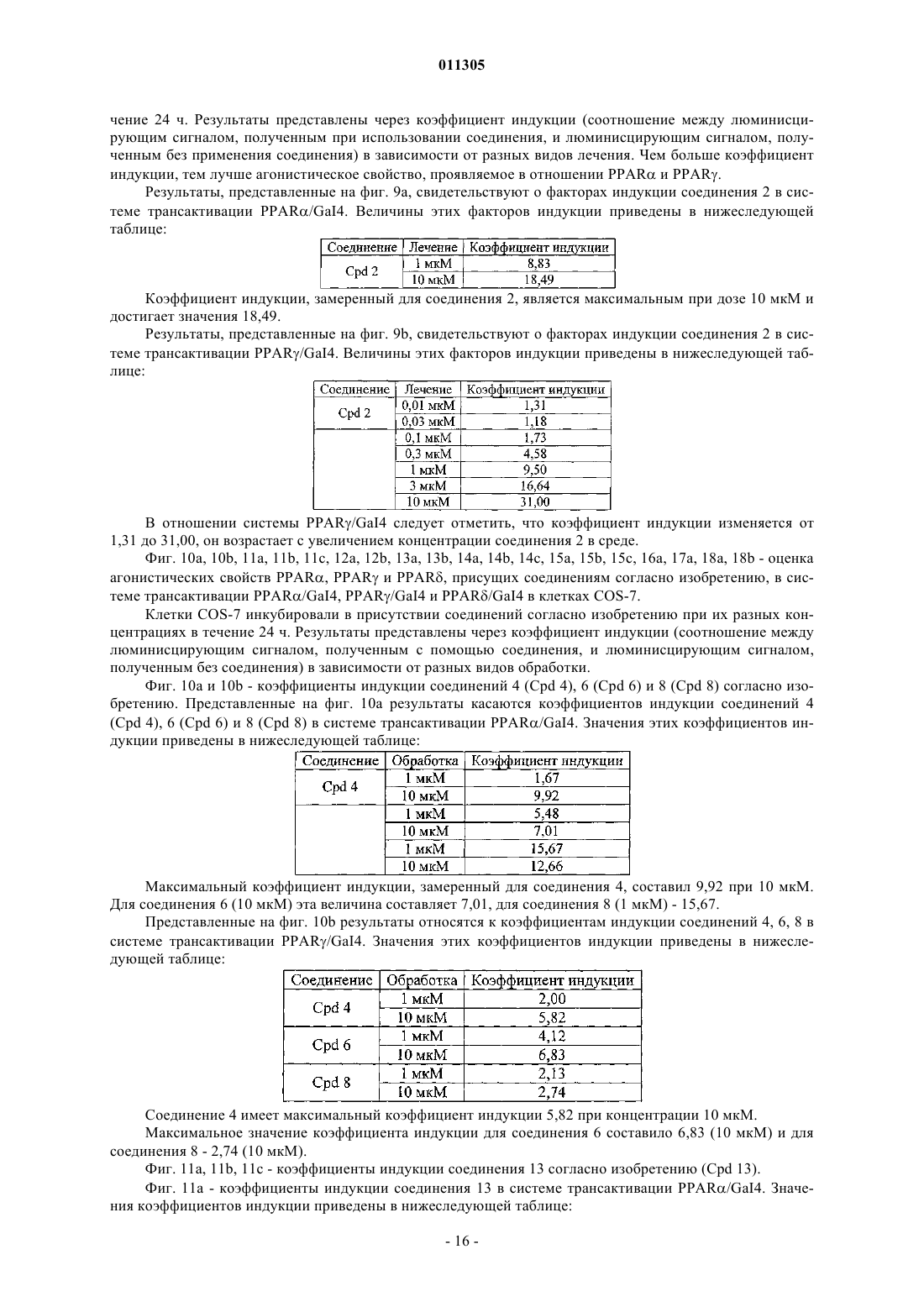
14. Способ получения соединений формулы (I) по любому из предыдущих пунктов, который включает контактирование в основной или кислой среде по меньшей мере одного соединения формулы (А) по меньшей мере с одним соединением формулы (В), при этом формулами (А) и (В) являются
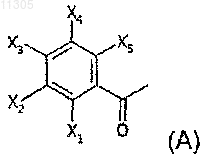
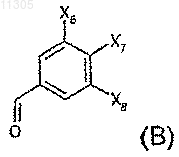
где X1, X2, X3, Х4, X5, X6, Х7 и Х8 имеют значения, указанные в любом из предыдущих пунктов.
15. Промежуточное соединение, которое выбирают из группы, состоящей из
1-(4-(пентилтиоэтилокси)фенил-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(R,S)-5-[1,2]дитиолан-3-илпентилокси)фенил-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метилтиофенил)-3-(4-гидрокси-3,5-дибромфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилэтилокси)-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-циклогексилтиоэтилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,4,5-триметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-(циклогексилтиоэтилокси)-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилтиофенил)проп-2-ен-1-он;
1-(4-метилтиофенил)-3-(4-гидрокси-3-фторфенил)проп-2-ен-1-он;
1-(2,3,4,5,6-пентаметилфенил)-3 -(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-феноксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3-фторфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-метокси-3-метилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-гексилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(2,5-диметоксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он;
1-(4-бромфенил)-3-(4-гидрокси-3,5-дифторфенил)проп-2-ен-1-он;
1-(4-метокси-3-трифторметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он.
16. Фармацевтическая или косметическая композиция, содержащая в фармацевтически приемлемом наполнителе эффективное количество по меньшей мере одного соединения общей формулы (I), по любому из пп.1-13 при необходимости в ассоциации с другим активным терапевтическим и/или косметическим веществом.
17. Композиция по п.16 для лечения сердечно-сосудистых заболеваний, разных форм дислипидемии, патологий, связанных с синдромом X, диабета, ожирения, гипертонии, воспалительных заболеваний, дерматологических болезней (псориаз, атопические виды дерматита, угри и т.д.), астмы, нарушений, вызванных окислительным стрессом, или для лечения явлений старости в общем и старения кожи в частности.
Текст
011305 Область техники, к которой относится изобретение Настоящее изобретение относится к замещнным производным 1,3-дифенилпроп-2-ен-1-она, содержащим их фармацевтическим и/или косметическим композициям, их применению в клинической медицине и/или косметологии, в частности в области охраны здоровья людей и животных. Изобретение также относится к способу получения указанных производных. Уровень техники Соединения согласно изобретению представляют собой эффективное терапевтическое средство,предназначенное для лечения патологий, вызванных нарушением липидного и/или углеводного метаболизма (гиперлипидемия, диабет, ожирение и пр.), и применимы, в частности, для профилактики или лечения сердечно-сосудистых заболеваний (в частности, ишемические заболевания сердца, церебральная ишемия и периферические артериальные заболевания), дислипидемии, паталогий, вызванных синдромомX, диабета, ожирения, гипертонии, воспалительных заболеваний, кожных заболеваний (псориаз, атопические дерматиты, угри и пр.), астмы, нарушений, связанных с окислительным стрессом, общих старческих явлений, например старение кожи, в частности в косметологии (появление морщин и пр.). Соединения согласно изобретению обладают профилактической активностью с точки зрения нейрозащиты и способны также обеспечивать активную нейрозащиту при острых приступах церебральной ишемии, приводящих к серьзным осложнениям при сердечно-сосудистых поражениях. Благодаря одновременному воздействию на несколько факторов риска сердечно-сосудистых заболеваний соединения согласно изобретению позволяют снизить общий риск сердечно-сосудистой болезни. Коронарные заболевания, церебральная ишемия и периферические артериальные заболевания представляют собой главные сердечно-сосудистые заболевания по сведениям Международного общества по атеросклерозу (Harmonized Clinical Guidelines on Prevention of Atherodclerotic Vascular Disease, 2003). Сердечно-сосудистые заболевания являются в настоящее время одной из главных причин смертности взрослого населения в большинстве развитых и в некоторых развивающихся странах. Среди сердечно-сосудистых заболеваний церебрально-сосудистая патология является третьей причиной смертности и первой причиной смертности среди взрослых. Потребность в наличии эффективных стратегий лечения и/или профилактики таких патологий приняла мировой характер. Дислипидемии (гиперхолостеринемия, гипертриглицеридемия), диабет и гипертония входят в число чтко идентифицируемых факторов риска сердечно-сосудистого заболевания (IAS, 2003). Представляется также, что недостаточная защита липопротеинов от окисления является идентифицируемым фактором риска. Эпидемиологические исследования показали, что между этими разными факторами имеется относительный синергический эффект. Одновременное присутствие нескольких из них ведт к драматическому увеличению риска сердечно-сосудистого заболевания. Следовательно, необходимо говорить о глобальном риске (global risk) сердечно-сосудистых заболеваний. Таким образом, присутствует реальная потребность в продуктах, способных одновременно воздействовать на разные факторы риска и тем самым снижать риск сердечно-сосудистых заболеваний, но одновременно и в изучении каждого нарушения и его последствий, взятых в отдельности (дислипидемии, диабет, гипертония, церебральная ишемия, патологии, связанные с синдромом X, ожирение и пр.). Авторы изобретения неожиданно нашли, что соединения согласно изобретению являются активаторами PPAR (Peroxisome ProliferatorActivated Receptor - рецептор активации пролиферации пероксисом) и поэтому являются эффективным терапевтическим средством. Действительно хорошо известно, что PPAR участвуют в метаболизме липидов и глюкозы. Активаторы PPAR, например фибраты, позволяют регулировать плазматический холестерин и содержание триглицеридов посредством активации PPAR (Hourton, Delerive и др., 2001). Лечение с применением фибратов сопровождается повышенным окислением жирных кислот в печени. Также они снижают синтез и экспрессию триглицеридов (Staels and Auwerx, 1998). Активаторы PPAR способны также корректировать гипергликемию и содержание инсулина. Кроме того, фибраты снижают массу ткани благодаря механизму, который не зависит от прима пищи и от экспрессии гена, кодирующего лептин (GuerreMillo, Gervois и др., 2000). Терапевтический эффект агонистов PPAR широко исследовался при лечении диабета II-го типа(Spiegelman, 1998). Было показано, что агонисты PPAR позволяют восстановить чувствительность тканей-мишеней к инсулину, а также снизить плазматический показатель глюкозы, липидов и инсулина как у моделей животных, больных диабетом II-го типа, так и у человека (Ram, 2003). Активация PPAR лигандами также применялась при регулировании экспрессии генов, участвующих в процессах, таких как воспаление, ангиогенез, пролиферация и клеточная дифференциация, апоптоз и активность iNOS, MMPase TIMP. Активация PPAR в кератиноцитах приводит к прекращению их пролиферации и экспрессии генов, участвующих в клеточной дифференциации (Komuves, Hanley и др.,2000). Также было доказано, что активация PPAR интерферирует с дифференциацией, созреванием, ми-1 011305 грацией и иммуногенностью дентритных клеток, которые являются наиболее производительными антигенными клетками (Gosset и др., 2001; Nencioni и др., 2002; Angeli и др., 2003).PPAR обладают противовоспалительными свойствами, так как они характеризуются отрицательной интерференцией в механизмах транскрипции, обладающими другими факторами транскрипции, такими как NF-kB или активаторами транскрипции (STAT) и АР-1 (Desvergne and Wahli, 1999). Такие противовоспалительные и противопролиферативные свойства делают PPAR терапевтическими мишенями при лечении таких заболеваний, как окклюзивные сосудистые заболевания (атеросклероз и др.), церебральная ишемия, гипертония, болезни, связанные с васкуляризацией (разные проявления диабетической ретинопатии и др.), воспалительные заболевания (болезнь Бовеля, псориаз и др.), астма и неопластические заболевания (карциногенез и др.). Кроме того, соединения согласно изобретению имеют то преимущество, что они являются антиоксидантами. В самом деле, на долю свободных радикалов приходится очень широкий диапазон патологий, таких как сердечно-сосудистые (атеросклероз и др.), церебральная ишемия, генетические и метаболические нарушения (диабеты и др.), а также инфекционные и дегенеративные заболевания (болезни Альцгеймера,Паркинсона, Приона и др.), офтальмологические заболевания, старение, разные виды аллергии, начало и развитие канцероматозных заболеваний (Mates, Perez-Gomes и др., 1999). Реакционноспособные окисленные вещества (ROS) являются продуктами нормальной деятельности клетки. ROS включают гидроксильные радикалы (ОН-), супероксидный анион (O2-), пероксид водорода(Н 2 О 2) и оксид азота (NO). Эти вещества являются очень лабильными и опасными для биологических функций клеток по причине своей высокой химической активности, вызывая перокисление некоторых ферментов и очень высокую степень окисления протеинов, приводящих к их деградации.(супероксид дисмутазу, каталазу, пероксидазу глутатион) и не ферментативный компонент, преимущественно каротиноиды, витамины С и Е (GIlgun-Sherki, Melamed и др., 2001). Кроме того, результаты многочисленных исследований in vitro и in vivo свидетельствуют о потенциальном участии окисленных липопротеинов низкой плотности (LDL) в атеросклерозе. Медленно развивающаяся артеросклерозная бляшка содержит ядро с большим содержанием холестерина, окружнное капсулой из фиброзных тканей. Расщепление бляшки вс больше рассматривается как результат хронических воспалительных изменений в зоне фиброзной капсулы. Медиаторы воспаления, такие как цитокины, оказывают влияние на несколько биологических процессов в фиброзной капсуле бляшки, снижая при этом е сопротивление разрушению. Воспалительные цитокины в атероматозной бляшке, в частности интерлейкин I, фактор некроза опухоли (TNF- и поверхностный гомолог TNF, называемый лигандом CD-40), вызывают образование в макрофагах и энзимных клетках гладких мышц, ферментов, способных ослабить внеклеточный матрикс. Разрушение капсулы может служить причиной окклюзивных тромбозов. Также соединения согласно изобретению являются эффективными терапевтическими средствами при лечении и/или профилактике церебральной ишемии благодаря своим фармакологическим и, в частности, противовоспалительным свойствам. Первое проявление церебральной ишемии происходит в первые часы и заключается в массивном высвобождении глютамата, ведущем к нейронной деполяризации и отку клетки. Введение кальция в клетку приводит к митохондриальным нарушениям, способствуя выделению свободных радикалов и индукции ферментов, вызывающих мембранную деградацию нейронов. Введение кальция и образование свободных радикалов активируют в свою очередь некоторые факторы транскрипции, такие как NF-kB. Такая активация вызывает воспалительные процессы, такие как индукция протеинов адгезии в эндотелиальной зоне, инфильтрация ишемического очага нейтрофильными гранулоцитами, микроглиальная активация, индукция ферментов, как, например, оксид азота (NO), синтаза II-го типа или циклооксигеназа IIго типа. Эти воспалительные процессы вызывают высвобождение NO или простаноидов, токсичных для клетки. Совокупность этих процессов приводит к явлению апоптоза, вызывающего необратимые поражения (Dirnagl, Iadecola и др., 1999). Концепция о профилактической нейрозащите покоится на фундаментальных данных, демонстрирующих резистентность к ишемии, полученных на животных моделях. Были выявлены разные механизмы резистентности к церебральной ишемии, это цитокины, воспалительные пути, свободные радикалы,NO, АТФ-зависимые каналы калия, аденозин. Следовательно, соединения согласно изобретению обладают преимуществом, заключающемся в их роли в качестве нейрозащитного средства. Наконец, соединения согласно изобретению представляют собой особый интерес при лечении воспалительных патологий, в частности при лечении астмы. Действительно распространнность аллергических заболеваний, в частности астмы, неуклонно возрастает в промышленно развитых странах, создавая серьзную проблему в здравоохранении. Каким бы не был исследуемый механизм, заболевания аллергического происхождения имеют, в целом, в своей основе воспалительную реакцию, вызванную дендритными клетками, содержащими антиген. Авторы изобретения показали, что соединения согласно настоящему изобретению интерферируют с дифференциацией и созреванием дендритных клеток и задержива-2 011305 ют миграцию этих клеток к вторичным лимфоидным органам. Кроме того, было найдено, что соединения согласно изобретению выполняют роль индукторов пролиферации клеток CD4+Т примитивных клеток. Следовательно, соединения согласно изобретению интерферируют с инициированием иммунной реакции и являются эффективным терапевтическим средством при лечении астмы. Настоящее изобретение касается новых замещнных производных 1,3-дифенилпроп-2-ен-1-она,фармацевтических и/или косметологических соединений с их содержанием, их применения при лечении и/или в косметологии, в частности в области охраны здоровья людей и животных. Также настоящее изобретение касается способа получения производных этих соединений. Сущность изобретения Авторы изобретения неожиданно нашли, что соединения согласно изобретению обладают активностью агониста PPAR и противоокислительными свойствами. Следовательно, соединения согласно изобретению могут интерферировать по меньшей мере с двумя сигнальными путями, которые активируются, в частности, при воспалении продукцией цитокинов и продукцией свободных радикалов. Действуя синергическим образом, соединения согласно изобретению выступают в качестве эффективного терапевтического и/или косметологического средства при лечении сердечно-сосудистых заболеваний, патологий, связанных с синдромом X, дислипидемий, диабета, ожирения, гипертонии, воспалительных заболеваний, дерматологических болезней (псориаз, атопические дерматиты, угри и пр.), астмы, нарушений,вызванных окислительным стрессом, старения в целом, например, старения кожи, в частности, в косметологической области (появление морщин и пр.). С другой стороны, соединения согласно изобретению способны оказывать профилактическое действие с точки зрения нейрозащиты и, кроме того, обеспечивать активную нейрозащиту на стадии острых приступов церебральной ишемии. Наконец, соединения согласно изобретению являются эффективным терапевтическим средством для профилактики и/или лечения многих рискованных сердечно-сосудистых нарушений, обусловленных разрегулированием липидного и/или углеводного метаболизма (гиперлипидемия, диабет, ожирение и пр.). Они обеспечивают снижение общего риска. Настоящее изобретение направлено на создание новых замещнных производных 1,2-дифенилпроп 2-ен-1-она, отвечающих улучшенной формуле и обладающих удовлетворительной лечебной эффективностью. Эта и другие цели достигаются в данном изобретении, объектом которого являются замещнные производные 1,3-дифенилпроп-2-ен-1-она общей формулой где Х 7 означает группу, соответствующую формуле G7R7, в которой G7 - атом кислорода или серы,R7 - алкильная цепь, охарактеризованная ниже, замещнная заместителем из группы 1 или заместителем из группы 2, R7 при необходимости может быть замещн арильной группой,заместители группы 1 выбирают из группы, включающей карбоксильные группы формулы -COORa,карбамоильные группы формулы -CONRbRc или тетразолильной группы,заместители группы 2 выбирают из группы, включающей остаток сульфоновой кислоты (-SO3H) и сульфонамидные группы формулы -SO2NRbRc,где Ra, Rb, Rc являются одинаковыми или различными и означают атом водорода или замещнную или незамещнную алкильную группу,группы Xi, в которых i=1, 2, 3, 4 или 5, являются одинаковыми или различными и означают атом галогена или тионитрозогруппу или соответствуют формуле (Gi-Ri)n-G'i-R'i, в которойn может принимать значения 0 или 1,Gi и G'i являются одинаковыми или различными и означают одинарную связь, атом кислорода или атом серы,Ri и R'i являются одинаковыми или различными и означают алкил, алкенил, арил или гетероцикл,R'i может также означать атом водорода,группы Xi, где i=6 или 8, являются одинаковыми или различными и означают атом галогена или соответствуют формуле Gi-R'i, при этом G'i и R'i имеют вышеуказанные значения,X6 и X8 одновременно не являются атомом водорода,-3 011305Xi, где i=1, 2, 3, 4, 5, 6 или 8, не может означать гетероцикл, непосредственно связанный с ароматическим кольцом 1,3-дифенилпроп-2-ен-1-она,за исключением соединений формулы (I), в которых одновременно одна из групп X1, X2, X3, Х 4 или Х 5 является гидроксильной группой,G7 - атом кислорода,одна из групп X6 или X8 означает атом водорода или галогена, или гидроксил, или алкилоксигруппу,за исключением соединений формулы (I), в которых одновременно группы X1, X2 и Х 4 означают атом водорода,группы X6 и X8 означают G'iR'i,группа Х 5 означает тионитрозогруппу или группу G'iR'i,группа X3 означает галоген или группу G'iR'i,где G'i означает атом кислорода, атом серы или одинарную связь, R'i означает насыщенную, линейную, разветвлнную или циклическую, необязательно замещенную галогеном, алкильную группу или атом водорода. Согласно одному из вариантов выполнения изобретения соединениями формулы (I) являются охарактеризованные выше соединения, за исключением тех из них, в которых одновременно группы X1, X2 и Х 4 означают атом водорода,одна из групп X3 или Х 4 означает атом водорода или галоген, или алкильную группу, или алкилоксигруппу, или алкилтиогруппу, или гидроксильную группу, или тиольную группу, или тионитрозогруппу. В предпочтительном варианте изобретение относится к соединениям общей формулы (Ia), соответствующим соединениям общей формулы (I), в которой X1 и Х 5 означают атомы водорода. В другом предпочтительном варианте изобретение относится к соединениям общей формулы (Ib),соответствующим соединениям общей формулы (I), в которой X2 и Х 4 означают алкильные группы, более предпочтительно, когда X1 и X5 означают атомы водорода. Другим объектом изобретения являются соединения общей формулы (Ic), которые представляют собой соединения общей формулы (I), в которой X1, X3 и Х 4 означают алкильные группы. Следующим объектом изобретения являются соединения общей формулы (Id), которые представляют собой соединения общей формулы (I), в которой X1 Х 2, Х 4 и Х 5 означают атомы водорода. Ещ одним объектом изобретения являются соединения общей формулы (II), которые представляют собой соединения общей формулы (I), в которой X6 и X8 означают алкильные группы. Наиболее предпочтительно, чтобы соединения общей формулы (II) представляли собой соединения формулы (II), в которой X1 и X5 означают атомы водорода и в которой X2 и Х 4 являются преимущественно алкильными группами. Ещ одним объектом изобретения являются соединения общей формулы (II), в которой Х 1, X3, Х 4,X6 и X8 означают алкильные группы. Объектом изобретения являются также соединения общей формулы (II), в которой X6 и X8 означают алкильные группы, X1, X2, X4 и X5 означают атомы водорода. Согласно отдельному аспекту изобретения соединения формулы (I) являются соединениями, которые охарактеризованы выше, в которых X3 означает атом водорода или тионитрозогруппу или отвечает формуле (Gi - Ri)n-G'i-R'i, приведнной выше, в которой G'i означает атом кислорода или атом серы. Настоящее изобретение включает в себя также оптические и геометрические изомеры, рацематы,таутомеры, соли, гидраты и смеси соединений согласно изобретению. Настоящее изобретение включает в себя также пролекарства соединений согласно изобретению, которые после прима пациентом превращаются в соединения согласно изобретению и/или метаболиты соединений согласно изобретению, которые обладают такой же терапевтической активностью, как и соединения согласно изобретению. Предпочтительно, чтобы, по меньшей мере, группы Gi или G'i означали атом серы, при этом i может принимать значения 1, 2, 3, 4, 5, 6, 7 или 8. В рамках настоящего изобретения производные согласно изобретению, такие как описанные выше,могут принимать цис- или транс-конформацию. Согласно настоящему изобретению термин алкил означает углеводородный насыщенный, линейный, разветвлнный или циклический, галогенсодержащий или не содержащий галоген радикал преимущественно с 1 до 24, предпочтительно с 1 до 10 атомами углерода, такой как метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, неопентил, н-гексил или циклогексил. Особо предпочтительными являются группы, содержащие один или два атома углерода или содержащие от 2 до 7 атомов углерода. Метильные и этильные группы являются наиболее предпочтительными. Согласно настоящему изобретению термин алкенил означает углеводородный, ненасыщенный,линейный, разветвлнный или циклический, галогенсодержащий или не содержащий галоген радикал,имеющий предпочтительно 1-24, предпочтительно 1-10 атомов углерода. Согласно настоящему изобретению термин арил означает углеводородную, ароматическую груп-4 011305пу, замещенную или незамещенную, в частности замещенную по меньшей мере одним атомом галогена,алкилом, гидроксилом, тиолом, алкилокси-, алкилтио-, оксимом или тионитрозогруппой. Наиболее предпочтительными являются фенильные группы. Согласно настоящему изобретению термин гетероцикл означает циклическую группу, насыщенную или ненасыщенную или ароматическую, содержащую один или несколько гетероатомов, таких как азот, сера и кислород. Они могут быть замещнными преимущественно по меньшей мере одной алкильной группой, такой как охарактеризованная выше. Наиболее предпочтительными являются гетероциклы,такие как дитиоланы, пиридин, фуран, тиофен и морфолин. Предпочтительно, чтобы гетероциклы, такие как пиперидин и пиперазин, были замещены по меньшей мере одной алкильной группой, такой как охарактеризованная выше. Термин тионитрозо означает нитрозогруппу, связанную с ароматическим кольцом через атом серы. Термин алкилокси означает алкильную цепь, связанную с кольцом атомом кислорода. Алкильная цепь соответствует таковой, которая определена выше. Термин алкилтио означает алкильную цепь, связанную с ароматическим кольцом атомом серы(тиоэфирная связь). Алкильная цепь соответствует таковой, которая определена выше. Атом галогена означает атом хлора, брома, йода или фтора. Согласно одному из воплощений изобретения предпочтительными соединениями являются соединения, приведенные ниже с соответствующими формулами: Объектом настоящего изобретения является также способ получения соединений формулы (I). Данный способ имеет множество преимуществ. Его легко осуществить в промышленном масштабе,он позволяет получать соединения формулы (I) с большим выходом. Способ согласно изобретению включает взаимодействие в щелочной или кислой среде по меньшей мере одного соединения формулы (А) и по меньшей мере одного соединения формулы (В), где формулами (А) и (В) являются где X1 X2, X3, Х 4, X5, X6, Х 7 и X8 имеют указанные выше значения, Х 7 также может означать гидроксильную или тиольную группу. Условия проведения этой реакции в кислой или щлочной среде известны среднему специалисту и могут варьироваться в широком диапазоне. Предпочтительно проводить реакцию с использованием обоих соединений в стехиометрическом количестве при температуре окружающей среды (от около 18 до 25 С) и атмосферном давлении. В щелочной среде реакцию предпочтительно проводить в присутствии сильного основания, такого как гидроксид щелочного металла, например гидроксид натрия, или алкоголят щелочного металла, такого как этилат натрия. В кислой среде реакцию предпочтительно проводить в присутствии сильной кислоты, такой как соляная. Схема реакции может иметь следующий вид: Синтез в щелочной среде может быть проведен в следующих условиях: 1 молярный эквивалент ке- 12011305 тона (соединение (А и 1 молярный эквивалент альдегида (соединение В) растворяют в водно-спиртовом растворе гидроксида натрия с концентрацией, равной 20 молярным эквивалентам. Реакционную массу перемешивают в течение около 18 ч при температуре окружающей среды (18-25 С). Затем реакционную среду подкисляют (для доведения рН до около 2), в частности, соляной кислотой. Требуемый замещнный 1,3-дифенилпроп-2-ен-1-он может быть получен осаждением или тврдой/жидкой экстракцией после выпаривания реакционной среды. Полученный продукт может быть очищен хроматографией на силикагеле или перекристаллизацией. Синтез в кислой среде может быть проведен в следующих условиях: 1 молярный эквивалент кетона(соединение (А и 1 молярный эквивалент альдегида (соединение (В растворяют в растворе этанола,насыщенном газообразным хлористым водородом. Реакционную массу перемешивают при температуре окружающей среды в течение около 6 ч, удаляют растворитель, в частности, выпариванием под пониженным давлением. Замещнный 1,3-дифенилпроп-2-ен-1-он очищают, в частности, хроматографией на силикагеле. Способ получения соединений формулы (I) позволяет получать соединения, называемые ниже промежуточными. Объектом настоящего изобретения являются также определенные исходные материалы и промежуточные соединения, получаемые в рамках настоящего изобретения. Промежуточные соединения наиболее предпочтительно выбирают из группы, содержащей 1-(4-(пентилтиоэтилокси)фенил-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-R,S)-5-[1,2]дитиолан-3-илпентилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1 он; 1-(4-метилтиофенил)-3-(4-гидрокси-3,5-дибромфенил)проп-2-ен-1-он; 1-4-циклогексилэтилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-метилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-метокси-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-4-циклогексилэтилокси)-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-4-циклогексилтиоэтилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(2,4,5-триметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-(циклогексилтиоэтилокси-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-метилтиофенил)-3-(4-гидрокси-3-фторфенил)проп-2-ен-1-он; 1-(2,3,4,5,6-пентаметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-феноксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-метокси-3-фторфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-метокси-3-метилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-гексилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(2,5-диметоксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он; 1-(4-бромфенил)-3-(4-гидрокси-3,5-дифторфенил)проп-2-ен-1-он; 1-(4-метокси-3-трифторметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он. Объектом настоящего изобретения являются, кроме того, соединения общей формулы (I), такие как описанные выше, в качестве лекарственных средств. Объектом настоящего изобретения является также фармацевтическая и/или косметическая композиция, содержащая, при наличии фармацевтически и/или косметически приемлемого носителя, по меньшей мере одно соединение общей формулы (I), такое как описано выше, при необходимости в ассоциации с другим терапевтически и/или косметически активным началом. Имеется в виду фармацевтическая и/или косметическая композиция для лечения сердечнососудистых заболеваний, разных видов дислипидемии, паталогий, связанных с синдромом X, диабета,ожирения, гипертензии, воспалительных заболеваний, дерматологических заболеваний (псориаз, атопические дерматиты, угри и пр.), астмы, нарушений, вызванных окислительным стрессом, старения в целом и, например, старения кожи, в частности в области косметологии (появление морщин и пр.). С другой стороны, фармацевтические и/или косметические композиции согласно изобретению могут оказывать профилактическое действие в виде нейрозащиты, а также они обеспечивают активную нейрозащиту при обострении церебральной ишемии. Наконец, фармацевтическая и/или косметическая композиция является эффективной при профилактике и/или лечении множественных факторов сердечнососудистого риска, обусловленного нарушениями липидного и/или углеводного метаболизма (гиперлипидемия, диабет, ожирение и пр.), при этом достигается общее снижение риска. Также изобретение относится к применению по меньшей мере одного соединения формулы (I) при получении фармацевтической и/или косметической композиции, предназначенной для осуществления способа профилактики или лечения организма человека или животного. Изобретение относится также к способу лечения патологий, вызванных метаболизмом липидов и/или углеводов, при этом предусматривается прим пациентом эффективной дозы соединения или фармацевтической композиции, описанных выше. Предпочтительно, чтобы фармацевтические композиции согласно изобретению содержали одно или несколько инертных веществ или наполнителей, являющихся фармацевтически приемлемыми.- 13011305 Можно указать, например, на солевые, физиологические, изотонические, буферные и другие растворы,приемлемые для фармацевтического применения и известные среднему специалисту. Композиции могут содержать одно или несколько веществ или наполнителей, выбранных из диспергаторов, растворителей,стабилизаторов, консервантов и пр. Веществами или наполнителями, используемыми в таких композициях (жидких, и/или инъецируемых, и/или тврдых), являются, в частности, метилцеллюлоза, гидроксиметилцеллюлоза, карбоксиметилцеллюлоза, полисорбат 80, маннитол, лактоза, растительные масла, масло акации и пр. Композиции могут быть приготовлены в виде инъецируемых суспензий, гелей, масел,таблеток, свечей, порошков, желатиновых и других капсул и пр., при необходимости посредством фармацевтических форм или с применением устройств, обеспечивающих замедленное выделение. Предпочтительно применять для такого типа композиции такое вещество, как целлюлоза, карбонаты или крахмалы. Соединения или композиции согласно изобретению могут назначаться для применения разными способами и в разных формах. Так, они могут инъецироваться орально или системно, например внутривенно, внутримышечно, подкожно, чрезкожно, интраартериально и пр. Для инъекций соединения приготовлены, как правило, в виде жидких суспензий, которые могут вводиться, например, посредством шприцов или перфузией. Само собой разумеется, что вводимая доза определяется специалистом с учтом пациента, патологии, способа введения и пр. Как правило, соединения прописываются в дозах, которые могут варьировать от 1 мкг до 2 г за один прим, предпочтительно 0,1 мг - 1 г за один прим. Прим может назначаться ежедневным или, при необходимости, неоднократным в течение дня. С другой стороны,соединения согласно изобретению могут дополнительно содержать другие вещества или активные начала. Краткое описание фигур Фиг. 1a, 1b, 1c поясняют противоокислительное свойство соединения 2 (Cpd 2) согласно изобретению, тестирование которого проводилось при концентрации 10-4 М. Фиг. 1 а - кинетика во время образования диеновых коньюгатов. Lag-фаза составляет 120 мин в том случае, когда инкубация липопротеинов низкой плотности (LDL) проводилась с применением одной только меди. Эта продолжительность составила 314 мин в том случае, когда в среде содержится также соединение 2. Фиг. 1b - скорость образования диенов. Она составляет 1,8 нмоля/мин/мг LDL в присутствии одной только меди, она не превышает 0,1 нмоля/мин/мг LDL в том случае, когда в среде присутствует соединение 2. Фиг. 1c - максимальное количество диеновых коньюгатов, образовавшихся во время опыта. Одна только медь вызывает образование 372 нмоля/мг сопряжнных диенов, это количество составляет 35 нмолей/мг в том случае, когда среда также содержит соединение 2, что свидетельствует об уменьшении на 90% количества образовавшихся диеновых коньюгатов. Фиг. 2 а, 2b, 2 с - противоокислительные свойства соединений 4 (Cpd 4), 6 (Cpd 6) и 8 (Cpd 8) согласно изобретению, тестирование которых проводилось при концентрации 10-4 M. Фиг. 2 - кинетика образования сопряжнных диенов. Lag-фаза составляет 122 мин в том случае, когда инкубация LDL проводится в присутствии только одной меди. Временное значение Lag-фазы составляет соответственно 401, 205 и 169 мин в присутствии соединений 4, 6 и 8. Фиг. 2b - расчт скорости образования диенов. Скорость образования сопряжнных диенов в присутствии меди составляет 2,2 нмоля/мин/мг LDL. Присутствие соединений 4, 6 и 8 вызывает снижение скорости протекания реакции окисления диенов. Она составляет 0,2 нмоля/мин/мг в присутствии соединения 4 и 1,7 нмоля/мин/мг в присутствии соединения 6 или соединения 8. Общее количество образовавшихся диенов (фиг. 2 с) составляет 511 нмолей/мг LDL в присутствии одной только меди. В присутствии соединений 4, 6, 8 это количество достигает 138, 443 и 474 нмоля/мг соответственно. Фиг. 3a - противоокислительное свойство соединения 11 (Cpd 11) согласно изобретению. Противоокислительное свойство соединения 11 было выявлено при разных концентрациях, составивших 10-6-3,510-5 М. При отсутствии соединения 11 lag-фаза составляет 87,2 мин. Начиная с концентрации 10-6 М, отмечается увеличение lag-фазы по отношению к контрольной: lag-фаза составляет 101,5 мин в присутствии соединения 11 при концентрации 10-6 М. Она возрастает в зависимости от концентрации соединения в среде и достигает наблюдавшегося максимального значения 210 мин при концентрации. Фиг. 4 а, 4b, 4 с - противоокислительное свойство соединений 19 (Cpd 19) и 23 (Cpd 23) согласно изобретению, тестирование которых проводилось при концентрации 10-4 М. Фиг. 4 а - кинетика образования сопряжнных диенов. Lag-фаза длилась 61 мин в присутствии одной только меди. В присутствии соединения 19 lag-фаза составила 92,5 мин. В присутствии соединения 23 она составила 96,4 мин. Противоокислительное свойство соединений 19 и 23 проявляется также в снижении скорости образования диенов, а также в уменьшении общего количества образовавшихся диенов. При отсутствии соединения скорость образования диенов составляет 1,9 нмоля/мин/мг LDL (фиг. 4b). Она составляет соответственно 1,6 и 1,3 нмоля/мин/мг LDL в присутствии соединений 19 и 23. При- 14011305 отсутствии соединения общее количество образовавшихся диенов составляет 370,9 нмоля/мг LDL (фиг. 4 с). Оно составляет соответственно 346,6 и 340,3 нмоля/мг LDL в присутствии соединений 19 и 23. Фиг. 5 а, 5b, 5 с - противоокислительное свойство соединений 25 (Cpd 25), 27 (Cpd 27), 29 (Cpd 29) и 31 (Cpd 31) согласно изобретению, тестирование которых проводилось при концентрации 10-4 М. Фиг. 5 а - кинетика окисления LDL в присутствии разных соединений: она возрастает в присутствии разных противоокислительных соединений и составляет 54,9 мин в присутствии соединения 29. Кинетика составляет 87,6 мин в присутствии соединения 25, 124,5 мин в присутствии соединения 31 и достигает 170,8 мин в присутствии соединения 27. Противоокислительное свойство этих соединений подтверждается скоростью окисления LDL (фиг. 5b), а также замеренным общим количеством образовавшихся диенов (фиг. 5 с). Скорость окисления LDL составляет 2 нмоля/мин/мг при отсутствии соединений (фиг. 5b). Присутствие соединений вызывает снижение скорости окисления. Последняя составляет 1,6 ммоля/мин/мг в присутствии соединения 25 и 1,4 нмоля/мин/мг в присутствии соединения 31. Эта скорость является минимальной в присутствии соединения 27 и составляет 0,8 нмоля/мин/мг. Общее количество образовавшихся диенов составляет 386 нмолей/мг LDL при отсутствии соединений (фиг. 5 с). Оно составляет 374 нмоля/мг в присутствии соединения 27, 365 нмолей/мг в присутствии соединения 25 и 352 нмоля/мг в присутствии соединения 31. Фиг. 6 а, 6b, 6 с - противоокислительное свойство соединения 37 (Cpd 37) согласно изобретению,тестированного при концентрации 10-4 М. Фиг. 6 - кинетика окисления LDL. Присутствие соединения в среде вызывает увеличение lag-фазы. Она достигает 106 мин в присутствии соединения 37, в то время как при отсутствии этого соединения она составляет всего лишь 56 мин. Снижение скорости окисления LDL и уменьшение количества образовавшихся диенов также свидетельствуют о противоокислительном свойстве тестированного соединения. При отсутствии соединения скорость окисления составляет 2 нмоля/мин/мг LDL, в присутствии же соединения она достигает 1,8 нмоля/мин/мг LDL (фиг. 6b). При отсутствии соединения общее количество образовавшихся диенов составляет 360,0 нмолей/мг LDL. В присутствии соединения 37 оно составляет всего лишь 326,9 нмолей/мгLDL (фиг. 6 с). Фиг. 7 а, 7b, 7 с - противоокислительное свойство соединений 13 (Cpd 13), 33 (Cpd 33), 41 (Cpd 41),47 (Cpd 47) согласно изобретению, тестированных при концентрации 10-4 М. Фиг. 7 а - кинетика окисления LDL. При отсутствии противоокислительных соединений lag-фаза составляет 67,3 мин. Эта фаза возрастает в присутствии разных соединений, она составляет 100 мин в присутствии соединения 41, 126,5 мин в присутствии соединения 47, 148 мин в присутствии соединения 33 и 219 мин в присутствии соединения 13. Присутствие соединений в среде сказывается также на скорости окисления LDL и на общем количестве образовавшихся диенов. Соединения 13 и 33 вызывают значительное снижение скорости окисления диенов (фиг. 7b). Скорость окисления диенов составляет 2,5 нмоля/мин/мг LDL при отсутствии соединений. Она составляет соответственно 1,5 и 1,4 нмоля/мин/мг LDL в присутствии соединений 13 и 33. Только соединения 33 и 41 вызывают уменьшение общего количества образовавшихся диенов (фиг. 7 с). Общее количество образовавшихся диенов составляет 432,5 нмоля/мг LDL при отсутствии соединения. Оно составляет 399 нмолей/мг LDL в присутствии соединения 33 и 403 нмоля/мин/мг LDL в присутствии соединения 41. Фиг. 8 а, 8b, 8 с - противоокислительное свойство соединений 17 (Cpd 17), 21 (Cpd 21), 39 (Cpd 39) и 43 (Cpd 43) согласно изобретению, тестированных при концентрации 10-4 М. Кинетика окисления LDL представлена на фиг. 8 а. При отсутствии соединения lag-фаза составляет 67,3 мин. Она возрастает в присутствии соединений 17, 39 и 43. В присутствии соединения 43 фаза lag составила 97 мин. В присутствии соединения 17 она составляет 148 мин, в присутствии соединения 39 133 мин. Фиг. 8b - скорость окисления LDL. При отсутствии соединения эта скорость составляет 2,5 нмоля/мин/мг. В присутствии соединения 17 она составляет 1,8 нмоля/мин/мг. В присутствии соединения 39 скорость окисления составляет 1,2 нмоля/мин/мг, в присутствии соединения 43 - 2,2 нмоля/мин/мг. Фиг. 8 с - общее количество диенов, образовавшихся во время окисления. Только соединение 39 вызывает значительное снижение общего количества образовавшихся диенов. Это количество составляет 432,3 нмоля/мин/мг при отсутствии соединения и 371,2 нмоля/мин/мг в присутствии соединения 39. Удлинение lag-фазы образования сопряженных диенов, снижение скорости образования диенов и уменьшение общего количества образовавшихся диенов - вот три параметра, которые свидетельствуют о противоокислительном свойстве соединений согласно изобретению. Фиг. 9 а, 9b - оценка агонистических свойств PPAR и PPAR, присущих соединениям согласно изобретению, посредством системы трансактивации PPAR/GaI4 и PPARGaI4 в клетках RK13. Клетки RK13 инкубировали в присутствии соединения 2 при его концентрациях 0,01-10 мкМ в те- 15011305 чение 24 ч. Результаты представлены через коэффициент индукции (соотношение между люминисцирующим сигналом, полученным при использовании соединения, и люминисцирующим сигналом, полученным без применения соединения) в зависимости от разных видов лечения. Чем больше коэффициент индукции, тем лучше агонистическое свойство, проявляемое в отношении PPAR и PPAR. Результаты, представленные на фиг. 9 а, свидетельствуют о факторах индукции соединения 2 в системе трансактивации PPAR/GaI4. Величины этих факторов индукции приведены в нижеследующей таблице: Коэффициент индукции, замеренный для соединения 2, является максимальным при дозе 10 мкМ и достигает значения 18,49. Результаты, представленные на фиг. 9b, свидетельствуют о факторах индукции соединения 2 в системе трансактивации PPAR/GaI4. Величины этих факторов индукции приведены в нижеследующей таблице: В отношении системы PPAR/GaI4 следует отметить, что коэффициент индукции изменяется от 1,31 до 31,00, он возрастает с увеличением концентрации соединения 2 в среде. Фиг. 10 а, 10b, 11a, 11b, 11c, 12a, 12b, 13a, 13b, 14a, 14b, 14c, 15a, 15b, 15 с, 16 а, 17 а, 18 а, 18b - оценка агонистических свойств PPAR, PPAR и PPAR, присущих соединениям согласно изобретению, в системе трансактивации PPAR/GaI4, PPAR/GaI4 и PPAR/GaI4 в клетках COS-7. Клетки COS-7 инкубировали в присутствии соединений согласно изобретению при их разных концентрациях в течение 24 ч. Результаты представлены через коэффициент индукции (соотношение между люминисцирующим сигналом, полученным с помощью соединения, и люминисцирующим сигналом,полученным без соединения) в зависимости от разных видов обработки. Фиг. 10 а и 10b - коэффициенты индукции соединений 4 (Cpd 4), 6 (Cpd 6) и 8 (Cpd 8) согласно изобретению. Представленные на фиг. 10 а результаты касаются коэффициентов индукции соединений 4(Cpd 4), 6 (Cpd 6) и 8 (Cpd 8) в системе трансактивации PPAR/GaI4. Значения этих коэффициентов индукции приведены в нижеследующей таблице: Максимальный коэффициент индукции, замеренный для соединения 4, составил 9,92 при 10 мкМ. Для соединения 6 (10 мкМ) эта величина составляет 7,01, для соединения 8 (1 мкМ) - 15,67. Представленные на фиг. 10b результаты относятся к коэффициентам индукции соединений 4, 6, 8 в системе трансактивации PPAR/GaI4. Значения этих коэффициентов индукции приведены в нижеследующей таблице: Соединение 4 имеет максимальный коэффициент индукции 5,82 при концентрации 10 мкМ. Максимальное значение коэффициента индукции для соединения 6 составило 6,83 (10 мкМ) и для соединения 8 - 2,74 (10 мкМ). Фиг. 11a, 11b, 11c - коэффициенты индукции соединения 13 согласно изобретению (Cpd 13). Фиг. 11a - коэффициенты индукции соединения 13 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальная величина составила 17,05 при концентрации 1 мкМ. Фиг. 11b - коэффициенты индукции соединения 13 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальная величина составила 4,03 при концентрации 1 мкМ. Фиг. 11c - коэффициенты индукции соединения 13 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение отмечено при концентрации 1 мкМ, оно составило 28,75. Фиг. 12 а, 12b - коэффициенты индукции соединения 23 согласно изобретению, (Cpd 23). Фиг. 12 а - коэффициенты индукции соединения 23 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 8,35, оно было получено, начиная с концентрации 1 мкМ. Фиг. 12b - коэффициенты индукции соединения 23 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 7,24, оно было получено, начиная с концентрации 1 мкМ. Фиг. 13 а, 13b - коэффициенты индукции соединения согласно изобретению, (Cpd 29). Фиг. 13 а - коэффициенты индукции соединения 29 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 15,75, оно было получено при концентрации 3 мкМ. Фиг. 13b - коэффициенты индукции соединения 29 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 87,56, оно было получено при концентрации 10 мкМ. Фиг. 14 а, 14b, 14 с - коэффициенты индукции соединения 31 согласно изобретению (Cpd31). Фиг. 14 а - коэффициенты индукции соединения 31 в системе трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 6,03, оно было получено при концентрации 10 мкМ. Фиг. 14b - коэффициенты индукции соединения 31 с применением системы трансактивацииPPAR/GaI4. Значения этих коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составило 7,79, оно было получено при концентрации 3 мкМ. Фиг. 14 с - коэффициенты индукции соединения 31 с применением системы трансактивацииPPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице:- 18011305 Максимальное значение составляет 11,70, оно было получено при концентрации 10 мкМ. Фиг. 15 а, 15b, 15 с - коэффициенты индукции соединения 33 согласно изобретению (Cpd 33). Фиг. 15 а - коэффициенты индукции соединения 33 с применением системы трансактивацииPPAR/GaI4. Значения этих коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 20,82, оно было получено при концентрации 0,3 мкМ. Фиг. 15b - коэффициенты индукции соединения 33 с применением системы трансактивацииPPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 7,99, оно было получено при концентрации 3 мкМ. Фиг. 15 с - коэффициенты индукции соединения 33 с применением системы трансактивацииPPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 90,84, оно было получено при концентрации 3 мкМ. Фиг. 16 а - коэффициенты индукции соединения 35 согласно изобретению (Cpd 35). На фиг. 16 а приведены коэффициенты индукции соединения 35 с применением системы трансактивации PPARGaI4. Значения коэффициентов индукции указаны в нижеследующей таблице: Максимальное значение составляет 24,33, оно было получено при концентрации 1 мкМ. Фиг. 17 а - коэффициенты индукции соединения 37 согласно изобретению (Cpd 37) с применением системы трансактивации PPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 19,77, оно было получено при концентрации 1 мкМ. Фиг. 18 а, 18b - коэффициенты индукции соединения 39 согласно изобретению (Cpd 39). Фиг. 18 а - коэффициенты индукции соединения 39 с применением системы трансактивацииPPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 10,42, оно было получено при концентрации 1 мкМ. Фиг. 18b - коэффициенты индукции соединения 39 с применением системы трансактивацииPPAR/GaI4. Значения коэффициентов индукции приведены в нижеследующей таблице: Максимальное значение составляет 4,86, оно было получено при концентрации начиная от 0,3 мкМ. Представленные на фигурах результаты свидетельствуют о том, что тестированные соединения согласно изобретению обладают свойством лиганда по отношению к PPAR, PPAR и/или PPAR. Также они обеспечивают активацию на уровне транскрипции ядерных рецепторов. На фиг. 19 а, 19b, 19c, 19d, 20a, 20b, 20c, 20d показаны результаты воздействия соединений 2 (Cpd 2), 13 (Cpd 13), 33 (Cpd 33) и 39 (Cpd 39) на метаболизм триглицеридов и холестерин у трансгенных мышей Аро Е 2/Е 2. С помощью желудочного зонда животным вводили 50 мг соединения в расчте на 1 кг веса в день в течение 7 суток. Фиг. 19 а, 19b - снижение в плазме уровня триглицеридов и холестерина посредством соединения 2. Фиг. 20 а, 20b - снижение в плазме уровня триглицеридов и холестерина посредством соединений 13, 33 и 39. Фиг. 19 с, 19d - распределение триглицеридов и холестерина в липочастицах, полученное с помощью эксклюзионной хроматографии и вызванное воздействием соединением 2. Фиг. 20 с, 20d - распределение триглицеридов и холестерина в липочастицах, полученное эксклюзионной хроматографией и вызванное воздействием соединениями 13, 33 и 39. Было отмечено типичное распределение триглицеридов и холестерина, локализованное, главным образом, в липочастицах крупного размера. Также наблюдалось снижение триглицеридов и холестерина в указанном классе липочастиц, вызванное воздействием разными, применявшимися при тестировании соединениями. Фиг. 21 - интерференция соединения согласно изобретению с дифференциацией дендритных клеток. Соединение 39 (10-б М) добавляли при DO дифференциации моноцитов в дендритных клетках. Через 6 суток дифференциации (в присутствии цитокинов GM-CSF и IL-4) провели анализ дендритных клеток посредством проточной цитометрии. : флуорохром, связанный с Ab по отношению к контрольному изотопу (в чрном цвете): FITC - флуоресцирующий изотиоцианат, связанный с Ab против CD la,или РЕ (пикоэритрин), связанный с Ab против CD 86. Фиг. 22 - интерференция соединений согласно изобретению с созреванием дендритных клеток, вызванных воздействием LPS (липополисахариды). Эти дендритные клетки инкубировали в течение 4 ч с применением соединений 31, 13 или 39, после- 20011305 этого оказывали стимулирующее воздействие посредством LPS в течение 16 ч. Транскрипты CCR7 иELC анализировали методом количественного RT-PCR, а цитокин TNF-альфа анализировали методомELISA. Фиг. 23 - смешанная лимфоцитарная реакция (MLR), проведнная в присутствии возрастающего количества дентритных клеток после или без воздействия на них соединением 31, инкубированных с применением нативных CD4+Т клеток в течение 7 суток. Пролиферацию Т-клеток измеряли определением включения бромдезоксиуридина (BrdU). Другие аспекты и преимущества настоящего изобретения поясняются ниже с помощью примеров,которые приведены в качестве поясняющих и не являющихся ограничивающими. ПРИМЕРЫ Пример 1. Синтез соединений согласно изобретению. Соединения согласно изобретению получают общими методами, описанными ниже. Описание общих методов синтеза согласно изобретению Синтез 1,3-дифенилпроп-2-ен-1-онов Общий метод 1 Синтез 1,3-дифенилпроп-2-ен-1-онов в кислой среде. Кетон (1 экв.) и альдегид (1 экв.) растворяют в растворе этанола, насыщенном газообразным хлористым водородом. Реакционную массу перемешивают при комнатной температуре в течение 6 ч, затем удаляют растворитель выпариванием при пониженном давлении. 1,3-Дифенилпроп 2-ен-1-он очищают хроматографией на силикагеле или перекристаллизацией. Общий метод 2 Синтез 1,3-дифенилпроп-2-ен-1-онов в присутствии гидроксида натрия. Кетон (1 экв.) и альдегид (1 экв.) растворяют в водно-спиртовом растворе натрия (20 экв.). Реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Среду подкисляют до рН 2 соляной кислотой. 1,3-Дифенилпроп-2-ен-1-он получают осаждением или путем экстракции в системе тврдый/жидкий после выпаривания реакционной среды. Полученный продукт очищают хроматографией на силикагеле или перекристаллизацией. Общий метод 3 Синтез замещенных 1,3-дифенилпроп-2-ен-1-онов в присутствии этилата натрия. Натрий (1 экв.) растворяют в абсолютном этаноле. Добавляют кетон (1 экв.) и альдегид (1 экв.). Реакционную массу перемешивают при комнатной температуре в течение 12 ч, затем добавляют 2N раствор гидроксида натрия (5 экв.). Реакционную массу выдерживают при 100 С в течение 12 ч. Реакционную среду подкисляют добавлением 6N водного раствора соляной кислоты. Растворитель удаляют выпариванием при пониженном давлении. Осадок очищают хроматографией на силикагеле или перекристаллизацией. О-Алкилирование фенолов или тиофенолов Общий метод 4 Фенол (1 экв.) или тиофенол (1 экв.) растворяют в ацетонитриле, добавляют галогенсодержащее производное (1-10 экв.) и карбонат калия (5 экв.). Реакционную смесь выдерживают в течение около 10 ч при интенсивном перемешивании с дефлагматором. Соли удаляют фильтрацией, растворитель и избыток реагента удаляются выпариванием при пониженном давлении, полученный продукт очищается хроматографией на силикагеле. Общий метод 5 Спирт (1 экв.), фенол (1 экв.) и трифенилфосфин растворяют в дихлорметане. Добавляют диизопропилазодикарбоксилат (1 экв.) и реакционную массу выдерживают при перемешивании в течение 12 ч при комнатной температуре. Реакционную смесь промывают водой, сушат над сульфатом магния и выпаривают при пониженном давлении. Остаток после выпаривания очищают хроматографией на силикагеле. Кислотный гидролиз сложных трет-бутиловых эфиров Общая методика 6 Сложный трет-бутиловый эфир (1 экв.) растворяют в дихлорметане, затем добавляют трифторуксусную кислоту (10 экв.). Реакционную массу перемешивают в течение 12 ч при комнатной температуре. Полученный в результате продукт очищают хроматографией на силикагеле или перекристаллизацией. Синтез исходных материалов, используемых для синтеза соединений согласно изобретению. Исходный материал 1 4'-(Бромэтилокси)ацетофенон- 21011305 Это соединение синтезируют из 4'-гидроксиацетофенона и дибромэтана с помощью описанной выше общей методики 4. Очистка производится методом хроматографии на силикагеле (элюент:циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 2,55(s, 3H), 3,66(t, 2H, J = 6,50 Гц), 4,35(t, 2H, J = 6,50 Гц), 6,94(d, 2 Н, J = 7,23 Гц), 7,94(d, 2H, J = 7,23 Гц). Исходный материал 2 4'-(Пентилтиоэтилокси)ацетофенон Исходный материал 1 (1 экв.) и пентантиол (1 экв.) растворяют в метаноле в присутствии триэтиламина (2 экв.). Реакционную смесь кипятят в течение 18 ч с дефлегматором, растворитель удаляют выпариванием при пониженном давлении. Масло экстрагируют этилацетатом, промывают 2N водным раствором соляной кислоты. 4'-(Пентилтиоэтилокси)ацетофенон получают после очистки на силикагеле (элюент:циклогексан/этилацетат - 9:1). 1 Н ЯМР CDCl3 ч./млн: 0,85(m, 3H), 1,24 - 1,39(m, 4 Н), 1,52 - 1,62(m, 2 Н), 2,50(s, 3H), 2,64(t, 2H, J = 7,2 Гц), 2,94(t, 2H, J = 6,8 Гц), 4,14(t, 2H, J = 6,8 Гц), 6,88(d, 2H, J = 8,7 Гц), 7,89(d, 2H, J = 8,7 Гц). Исходный материал 3 3,5-диметил-4-трет-бутилоксикарбонилдиметилметилоксибензальдегид Это соединение синтезируют из 4-гидрокси-3,5-диметилбензальдегида и третбутилбромизобутирата в соответствии с общей методикой 4. Очистку осуществляют методом хроматографии на силикагеле (элюент:циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: l,43(s, 6 Н), l,49(s, 9 Н), 2,28(s, 6 Н), 7,53(s, 2H), 9,88(s, 1H). Исходный материал 4 4'-Гидрокси-3',5'-диметилацетофенон 2,6-Диметилфенол (1 экв.) растворяют в хлорметилене и охлаждают раствор до 0C, затем добавляют хлорид алюминия (3 экв.) и ацетилбромид (2 экв.). Реакционную массу перемешивают в течение 3 ч при комнатной температуре, затем выливают на лд. Водную фазу экстрагируют дихлорметаном, органическую фазу промывают водой до нейтральной среды, сушат над сульфатом магния, растворитель удаляют выпариванием при пониженном давлении. Полученный промежуточный сложный эфир подвергают очистке методом хроматографии на силикагеле (элюент:циклогексан/этилацетат - 9:1), затем экстрагируют 2N водным раствором гидроксида натрия (2,5 экв.). Смесь перемешивают в течение 48 ч при комнатной температуре и подкисляют разбавленной соляной кислотой. Осадок промывают водой до нейтрального состояния рН промывной воды. 1 Н ЯМР CDCl3 ч./млн: 2,30(s, 6H), 2,54(s, 3H), 7,65(s, 2H). Исходный материал 5 4'-R,S)-5-[1,2]дитиолан-3-илпентилокси)ацетофенон Это соединение синтезируют из 4-гидроксиацетофенона и (R,S)-5-[1,2]дитиолан-3-илпентанола в соответствии с общей методикой 5, описанной выше. Полученный продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат - 95:5). 1 Н ЯМР CDCl3 ч./млн: 1,42 - 1,62(m, 4 Н), 1,62 - 1,75(m, 2 Н), 1,75 - 1,89(m, 2 Н), 1,89 -1,98(m, 1H),2,42 - 2,51 (m, 1H), 2,56(s, 3H), 3,08 - 3,21 (m, 2 Н), 3,55 - 3,61 (m, 1H), 4,06(t 2 Н, J = 6,2 Гц), 6,92(d, 2H, J = Это соединение синтезируют из 4-гидрокси-3,5-диметилбензальдегида и 2-гидрокси-2-фенилэтилацетата в соответствии с описанной выше методикой 5. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: l,22(t, 3H, J = 7,35 Гц), 2,20(s, 6H), 4,16 - 4,28(m, 2H), 5,3(s, 1H), 7,38 7,51(m, 7 Н), 9,87(s, 1H). Исходный материал 7 4'-(циклогексилэтил)оксиацетофенон Это соединение синтезируют из 4'-гидроксиацетофенона и 2-циклогексилэтанола в соответствии с описанной выше общей методикой 5. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат) 9:1). 1 Н ЯМР CDCl3 ч./млн: 0,90 - l,80(m, 13 Н), 2,56(s, 3H), 4,07(t, 2 Н, J = 6,45 Гц), 6,92(d, 2 Н, J = 8,80 Гц), 7,93(d, 2H, J = 8,80 Гц). Исходный материал 8 2,6-диметилтиоанизол Это соединение синтезируют из 2,6-диметилтиофенола и метилйодида в соответствии с описанной выше методикой 4. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 2,28 (s, 3H), 2,62(s, 6H), 7,16 (m, 3H). Исходный материал 9 3',5'-диметил-4'-метилтиоацетофенон Исходный материал 8 (1 экв.) растворяют в хлорметилене, раствор охлаждают до 0 С, затем добавляют хлорид алюминия (2,5 экв.) и ацетилбромид (2 экв.). Реакционную смесь перемешивают в течение 72 ч при комнатной температуре, затем выливают на лд. Водную фазу экстрагируют дихлорметаном,органическую фазу промывают водой до нейтральной среды, сушат над сульфатом магния и удаляют растворитель выпариванием при пониженном давлении. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 9 : 1). 1 Это соединение синтезируют из исходного материала 4 и метилйодида в соответствии с описанной выше методикой 4.- 23011305 Сырой продукт, полученный после отфильтровывания карбоната калия и удаления растворителей выпариванием при пониженном давлении используют для синтеза соответствующего промежуточного соединения. 1 Н ЯМР CDCl3 ч./млн: 2,31(s, 6H), 2,54(s, 3H), 3,74(s, 3H), 7,63(s, 2H). Исходный материал 11 4'-циклогексилэтилокси-3',5-диметилацетофенон Это соединение синтезируют из исходного материала 4 и 2-циклогексилэтанола в соответствии с описанной выше общей методикой 5. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 85:15). 1 Н ЯМР CDCl3 ч./млн: 0,92 - l,80(m, 13H), 2,31(s, 6H), 2,55(s, 3H), 3,86(t, 2H, J = 7,05 Гц), 7,63(s,2H). Исходный материал 12 4'-(бромэтилокси)-3',5'-диметилацетофенон Это соединение синтезируют из исходного материала 4 и дибромэтана в соответствии с описанной выше общей методикой 4. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 85:15). 1 Н ЯМР CDCl3 ч./млн: 2,36(s, 6H), 2,56(s, 3H), 3,68(t, 2H, J = 6,21 Гц), 4,14(t, 2H, J = 6,21 Гц),7,65(s, 2H). Исходный материал 13 4'-(циклогексилтиоэтилокси)ацетофенон Это соединение синтезируют из 2,6-диметилтиофенола и гексилбромида в соответствии с описанной выше общей методикой 4. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан). 1 Н ЯМР CDCl3 ч./млн: 0,90(t, 3H, J = 6,57 Гц), 1,27 - l,58(m, 8H), 2,57(s, 6H), 2,66(t, 2H, J = 7,11 Гц),7,12(m, 3H). Исходный материал 17 3',5'-диметил-4'-гексилтиоацетофенон Исходный материал 16 (1 экв.) растворяют в хлорметилене, раствор охлаждают до 0 С, добавляют хлорид алюминия (1 экв.) и ацетилбромид (1 экв.). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем выливают на лд. Водную фазу экстрагируют дихлорметаном, органическую фазу промывают водой до нейтральной среды, сушат над сульфатом магния, затем удаляют растворитель выпариванием при пониженном давлении. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан). 1 Н ЯМР CDCl3 ч./млн: 0,87(t, 3H, J = 6,72 Гц), 1,22 - l,53(m, 8H), 2,58(s, 3H), 2,59(s, 6 Н), 2,68(t, 2H,- 24011305 Исходный материал 12 (1 экв.) и морфолин (0,7 экв.) растворяют в ацетоне и добавляют карбонат калия (1 экв.). Реакционную массу нагревают с обратным холодильником при кипячении в течение 72 ч. Карбонат калия отфильтровывают, растворитель удаляют выпариванием при пониженном давлении. Маслянистый остаток экстрагируют 1N водным раствором соляной кислоты и промывают этилацетатом. Водную фазу подщелачивают (рН 9) добавлением карбоната калия, затем экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния, после чего удаляют растворитель выпариванием при пониженном давлении. 1 Н ЯМР CDCl3 ч./млн: 2,33(s, 6H), 2,54(s, 3H), 2,60(t, 4H, J = 4,70 Гц), 2,81(t, 2H, J = 5,76 Гц),3,76(t, 4H, J = 4,70 Гц), 3,93(t, 2H, J = 5,76 Гц), 7,62(s, 2H). Исходный материал 19 3,5-дифтор-4-гидроксибензальдегид 2,6-дифторфенол (1 экв.) и гексаметилентетрамин (2 экв.) растворяют в смеси вода/уксусная кислота (10:90). Реакционную смесь нагревают при кипении с обратным холодильником в течение 18 ч и затем охлаждают до комнатной температуры. Реакционную смесь экстрагируют дихлорметаном. Органические фазы объединяют и сушат над сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении. 1 Н ЯМР CDCl3 ч./млн: 7,35(dd, 2 Н, J = 6,57 Гц, J = 2,82 Гц), 9,67(s, 1H). Исходный материал 20 4'-Метокси-3'-трифторметилацетофенон 4-Метокси-3-фторметилбензонитрил (1 экв.) растворяют в безводном тетрагидрофуране (ТГФ). Добавляют метилхлорид магния в виде раствора в ТГФ (1 экв.). Реакционную массу перемешивают в течение 16 ч при комнатной температуре, затем после добавления дополнительного количества метилхлорида магния (1 экв.) нагревают при кипении с обратным холодильником в течение 1 ч. Реакционную массу выливают в 1N водный раствор соляной кислоты и экстрагируют дихлорметаном. Органическую фазу нейтрализуют водным раствором бикарбоната калия и промывают водой. Органическую фазу сушат над сульфатом магния, затем удаляют растворитель выпариванием при пониженном давлении. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 2,60(s, 3H), 3,99(s, 3H), 7,07(d, 1H, J = 8,79 Гц), 8,14(d, 1H, J = 8,79 Гц,J=1,77 Гц), 8,19(s, 1H). Синтез промежуточных соединений, используемых для синтеза соединений согласно изобретению. Промежуточное соединение 1 1-(4-(Пентилтиоэтилокси)фенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из исходного материала 2 и 4-гидрокси-3,5-диметилбензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 85:15). Это соединение синтезируют из исходного материала 5 и 4-гидрокси-3,5-диметилбензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: 1,45 - l,65(m, 4H), 1,65 - l,77(m, 2H), 1,77 - l,87(m, 2H), 1,87 - 2,0(m, 1H),2,30(s, 6H), 2,43 - 2,51(m, 1H), 3,09 - 3,22(m, 2H), 3,56 - 3,62(m, 1H), 4,04(t, 2H, J = 6,40 Гц), 6,96(d, 2H, J = 8,50 Гц), 7,31(s, 2H), 7,41 (d, 1H, J = 15,40 Гц), 7,73(d, 1H, J = 15,40 Гц), 8,04(d, 2H, J = 8,50 Гц). Промежуточное соединение 3 1-(4-Метилтиофенил)-3-(4-гидрокси-3,5-дибромфенил)проп-2-ен-1-он Это соединение синтезируют из 4'-метилтиоацетофенона и 3,5-дибром-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: 2,55(s, 3H), 6,19(s, 1 Н), 7,32(d, 2 Н, J = 8,70 Гц), 7,41( 1H, J = 15,40 Гц),7,63(d, 1H, J = 15,40), 7,75(s, 2H), 7,96(d, 2H, J = 8,70 Гц). Промежуточное соединение 4 1-(4-(Циклогексилэтилокси)фенил-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из исходного материала 7 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, затем сушат, промывают этанолом, предварительно охлажденным до 0 С, и сушат под вакуумом. 1 Н ЯМР CDCl3 ч./млн: 0,90 - l,80(m, 13H), 2,30(s, 6H), 4,08(t, 2H, J = 6,54 Гц), 6,97(d, 2 Н, J = 9,00 Гц), 7,30(s, 2 Н), 7,42(d, 1 Н, J = 15,50 Гц), 7,73(d, 1H, J = 15,50 Гц), 8,03(d, 2H, J = 9,00 Гц). Промежуточное соединение 5 1-(4-Метилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из исходного материала 9 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: 2,28(s, 3H), 2,30(s, 6 Н), 2,64(s, 6 Н), 7,32(s, 2H), 7,36(d, 1H, J = 15,76 Гц),7,72(s, 2 Н), 7,73(d, 1H, J = 15,76 Гц). Это соединение синтезируют из исходного материала 10 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают, промывают этанолом, который предварительно охлаждают до 0 С и сушат в вакууме. 1 Н ЯМР CDCl3 ч./млн: 2,28 (s, 6H), 2,35 (s, 6H), 3,77 (s, 3H), 7,30 (s, 2H), 7,35 (d, 1 Н, J = 15,63), 7,70 Это соединение синтезируют из исходного материала 11 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 8:2). 1 Это соединение синтезируют из исходного материала 13 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают и промывают этанолом, предварительно охлажднным до 0 С. 1 Н ЯМР CDCl3 ч./млн: 1,23 - 1,42 (m, 5 Н), 1,63 - 1,65 (m, 1H), 1,79-1,81 (m, 2 Н), 2,01 - 2,08 (m, 2 Н),2,29 (s, 6H), 2,73 - 2,81 (m, 1H), 2,96 (t, 2H, J = 7,08 Гц), 4,20 (t, 2H, J = 7,08 Гц), 6,97 (d, 2 Н, J = 8,73 Гц),7,30 (s, 2 Н), 7,41 (d, 1H, J = 15,53 Гц), 7,73 (d, 1H, J = 15,53 Гц), 8,04 (d, 2H, J = 8,73 Гц). Промежуточное соединение 9 1-(2,4,5-Триметилфенил)-3-(4-гидрокси)- 3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из 2',4',5'-триметилацетофенона и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 7:3). 1 Н ЯМР CDCl3 ч./млн: 2,27 (s, 9H), 2,29 (s, 3H), 2,38 (s, 3H), 7,00 (d, 1H, J = 15,90 Гц), 7,04 (s, 1H),7,23 (s, 2H), 7,27 (s, 1H), 7,39 (d, 1H, J = 15,90 Гц). Промежуточное соединение 10 1-(4-(Циклогексилтиоэтилокси)-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1 он Это соединение синтезируют из исходного материала 14 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 7:3). 1 Н ЯМР CDCl3 ч./млн: 1,32 (m, 5 Н), 1,63 (m, 1H), 1,79 (m, 2 Н), 2,03 (m, 2 Н), 2,29 (s, 6H), 2,37 (s,6H), 2,75 (m, 1H), 2,97 (t, 2H, J = 7,05 Гц), 3,97 (t, 2H, J = 7,05 Гц), 7,30 (s, 2H), 7,37 (d, 1H, J = 15,70 Гц),7,37 (d, 1H, J = 15,70 Гц), 7,70 (d, 1H, J = 15,70 Гц), 7,71 (s, 2H). Промежуточное соединение 11 1-(4-Метилтиофенил)-3-(4-гидрокси-3-фторфенил)проп-2-ен-1-он Это соединение синтезируют из 4'-метилтиоацетофенона и 3-фтор-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают и сушат в вакууме. 1 Н ЯМР CDCl3 ч./млн: 2,55 (s, 3H), 7,04 (t, 1H, J = 8,37 Гц), 7,30 - 7,42 (m, 5H), 7,73 (d, 1H, J = 15,54 Гц), 7,95 (d, 2H, J = 8,40 Гц). Промежуточное соединение 12 1-(2,3,4,5,6-Пентаметилфенил)-3-(4-гидрокси- 3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из пентаметилацетофенона и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают и очищают рекристаллизацией в этаноле. 1 Н ЯМР CDCl3 ч./млн: 2,09 (s, 6 Н), 2,20 (s, 6 Н), 2,22 (s, 6 Н), 2,26 (s, 3H), 6,83 (d, 1H, J = 16,11 Гц),7,05 (d, 1H, J= 16,11 Гц), 7,16 (s, 2H). Промежуточное соединение 13 1-(4-Феноксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из 4'-феноксиацетофенона и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент:циклогексан/этилацетат 7:3). 1 Н ЯМР CDCl3 ч./млн: 2,30 (s, 6 Н), 7,05 (d, 2 Н, J = 8,67 Гц), 7,1 (d, 2H, J = 8,47 Гц), 7,21 (t, 1H, J = 7,30 Гц), 7,31 (s, 2 Н), 7,43 - 7,38 (m, 3H), 7,75 (d, 1H, J = 15,36 Гц), 8,05 (d, 2H, J = 8,47 Гц). Промежуточное соединение 14 1-(4-Метокси-3-фторфенил)-3-(4-гидрокси- 3,5-диметилфенил)проп-2-ен-1-он- 28011305 Это соединение синтезируют из 4'-метокси-3'-фторацетофенона и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают и промывают гептаном. 1 Н ЯМР CDCl3 ч./млн: 2,30 (s, 6H), 3,98 (s, 3H), 7,04 (t, 1H, J = 8,30 Гц), 7,31 (s, 2H), 7,35 (d, 1H, J = 15,69 Гц), 7,74 (d, 1H, J = 15,69 Гц), 7,79 - 7,87 (m, 2H). Промежуточное соединение 15 1-(4-Метокси-3-метилфенил)-3-(4-гидрокси)-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из исходного материала 15 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт кристаллизуют в реакционной среде, обезвоживают и промывают гептаном. 1 Н ЯМР CDCl3 ч./млн: 2,30 (s, 9H), 3,92 (s, 3H), 6,90 (d, 1H, J = 8,45 Гц), 7,31 (s, 2H), 7,43 (d, 1H, J = 15,52 Гц), 7,73 (d, 1H, J = 15,52 Гц), 7,88 (s, 1H), 7,93 (d, 1H, J = 8,45 Гц). Промежуточное соединение 16 1-(4-Гексилтио-3,5-диметилфенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из исходного материала 17 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 8:2). 1 Н ЯМР CDCl3 ч./млн: 0,88 (t, 3H, J = 6,90 Гц), 1,20 - 1,50 (m, 8H), 2,30 (s, 6H), 2,63 (s, 6 Н), 2,70 (t,2 Н, J = 6,9 Гц), 7,32 (s, 2 Н), 7,36 (d, 1H, J = 15,51 Гц), 7,72 (s, 2H), 7,73(d, 1H, J = 15,51 Гц). Промежуточное соединение 17 1-(2,5-Диметоксифенил)-3-(4-гидрокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из 2',5'-диметоксиацетофенона и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 7:3). 1 Н ЯМР CDCl3 ч./млн: 2,27 (s, 6H), 3,74 (s, 3H), 3,82 (s, 3H), 6,93 (d, 1H, J = 8,73 Гц), 7,02 (dd, 1H, J = 8,73 Гц, J = 3,27 Гц), 7,14 (d, 1H, J = 3,27 Гц), 7,22 (d, 1H, J = 15,81 Гц), 7,25 (s, 2H), 7,53 (d, 1H, J = 15,81 Гц). Промежуточное соединение 18 1-(4-Бромфенил)-3-(4-гидрокси- 3,5-дифторфенил)проп-2-ен-1-он Это соединение синтезируют из 4'-бромацетофенона и исходного материала 19 в соответствии с описанной выше общей методикой 1. Этанол удаляют выпариванием при пониженном давлении, тврдый остаток промывают абсолютированным этанолом. 1 Н ЯМР CDCl3 ч./млн: 5,97 (s, 1H), 7,18 (d, 2H, J = 8,30 Гц), 7,35 (d, 1H, J = 15,36 Гц), 7,65 (m, 3H),7,89 (d, 2H, J = 8,30 Гц). Это соединение синтезируют из исходного материала 20 и 3,5-диметил-4-гидроксибензальдегида в соответствии с описанной выше общей методикой 1. Этанол удаляют выпариванием при пониженном давлении, тврдый остаток промывают абсолютированным этанолом. 1 Н ЯМР диметилсульфоксид d6 ч./млн: 2,22 (s, 6H), 4,01 (s, 3H), 7,41 (d, 1H, J = 9,00 Гц), 7,52 (s, 2 Н),7,64 (d, 1 Н, J = 15,40 Гц), 8,96 (s, 1H), 7,76 (d, 1H, J = 15,40 Гц), 8,29 (d, 1H, J = 1,60 Гц), 8,49 (dd, 1H, J = 9,00 Гц, J = 1,60 Гц). Синтез соединений согласно изобретению Соединение 1 1-(4-пентилтиоэтилокси)фенил)-3-(4-трет-бутилоксикарбонилдиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из промежуточного соединения 1 и трет-бутилбромизобутирата в соответствии с описанной выше общей методикой 4. Продукт подвергают хроматографической очистке на силикагеле (элюент: циклогексан/этилацетат 9:1). 1 Н ЯМР CDCl3 ч./млн: 0,91 (t, 3H, J = 7,10 Гц), 1,37 - 1,69 (m, 21H), 2,27 (s, 6H), 2,63 (t, 2 Н, J = 7,10 Гц), 2,93 (t, 2H, J = 7,10 Гц), 4,21 (t, 2H, J = 7,10 Гц), 6,97 (d, 2H, J = 8,70 Гц), 7,28 (s, 2 Н), 7,44 (d, 1H, J = 15,81 Гц), 7,70 (d, 1H, J = 15,81), 8,03 (d, 2H, J = 8,70 Гц). Соединение 2 1-(4-пентилтиоэтилокси)фенил)-3-(4-карбоксидиметилметилокси-3,5-диметилфенил)проп-2-ен-1-он Это соединение синтезируют из соединения 1 в соответствии с описанной выше общей методикой 6. Очистку производят хроматографией на силикагеле (элюирование дихлорметан/метанол - 98:2). 1 Н ЯМР CDCl3 ч./млн: 0,84 - 0,89 (m, 3H), 1,39 - 1,24 (m, 4 Н), l,39(s, 6H), 1,50 - 1,57 (m, 2 Н), 2,22 (s,6H), 2,61 (t, 2H, J = 7,40 Гц), 2,90 (t, 2H, J = 6,20 Гц), 4,26 (t, 2H, J = 6,20 Гц), 7,09 (d, 2 Н, J = 8,50 Гц), 7,57 Это соединение синтезируют из исходных материалов 3 и 4 в соответствии с описанной выше общей методикой 1. Очистку производят хроматографией на силикагеле (элюирование дихлорметан/метанол - 95:5). 1 Н ЯМР CDCl3 ч./млн: 1,46 (s, 6H), 1,53 (s, 9H), 2,27 (s, 6H), 2,33 (s, 6H), 7,28 (s, 2H), 7,43 (d, 1H, J = 15,81 Гц), 7,69 (d, 1H, J = 15,81 Гц), 7,74 (s, 2H).
МПК / Метки
МПК: C07C 323/56, A61K 31/381, C07C 323/61, C07C 59/90, A61K 31/192, C07C 323/62, C07D 339/04
Метки: 1,3-дифенилпроп-2-ен-1-она, применение, получения, способ, производные
Код ссылки
<a href="https://eas.patents.su/30-11305-proizvodnye-13-difenilprop-2-en-1-ona-sposob-ih-polucheniya-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1,3-дифенилпроп-2-ен-1-она, способ их получения и применение</a>
Предыдущий патент: Фосфорсодержащие производные пурина (варианты), лекарственное средство на их основе для воздействия на вирус папилломы человека и на опухолевые клетки (варианты)
Следующий патент: Избирательные модуляторы андрогеновых рецепторов и способы их применения
Случайный патент: Этикетка для стеклянной бутылки и способ ее удаления