Производные бензолсульфонамидов, способ их получения и их применение для лечения боли
Номер патента: 8921
Опубликовано: 31.08.2007
Авторы: Тома Дидье, Массардье Кристин, Бонду Мишель, Доде Пьер, Луккарини Жан-Мишель, Барт Мартин
Формула / Реферат
1. Производное бензолсульфонамида, характеризующееся тем, что оно выбрано из группы, состоящей из:
а) соединений формулы
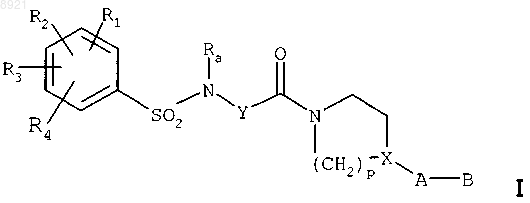
где каждый из радикалов R1, R2, R3, R4 независимо представляет собой один или несколько атомов
или групп атомов, выбранных из атома водорода, атомов галогенов, C1-C3алкильных групп,
С1-С3алкоксильных групп, CF3- или OCF3-групп,
Ra представляет собой С1-С4алкильную группу,
Y представляет собой насыщенную С2-С5алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С2-С4алкиленовую группу или -CH2-CO-NH-CH2-группу,
X представляет собой СН-группу или атом азота,
р равно 2 или 3,
А представляет собой одинарную связь, атом азота, который может быть замещен метильной группой, или линейную или разветвленную С1-С5алкиленовую группу, которая может быть гидроксилирована или в которой один из атомов углерода окислен до кетоновой группы при условии, что А и X не являются одновременно атомами азота,
В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя С1-С4алкильными группами;
б) кислотных аддитивных солей соединений формулы I.
2. Производное по п.1, отличающееся тем, что Y представляет собой С3-С5алкиленовую группу, в цепь которой включен атом кислорода, предпочтительно -СН2-СН2-О-СН2-группу.
3. Производное по п.1 или 2, отличающееся тем, что R2 и R3 представляют собой метильные группы в положении 2,6 ароматического кольца.
4. Способ получения производного бензолсульфонамида формулы I, охарактеризованного в п.1, и его аддитивных солей, включающий в себя:
а) реакцию кислоты формулы
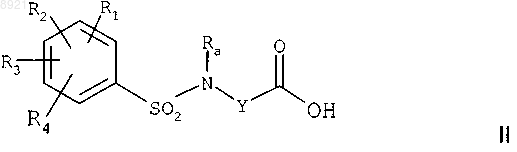
где каждый из радикалов R1, R2, R3, R4 независимо представляет собой один или несколько атомов
или групп атомов, выбранных из атома водорода, атомов галогенов, С1-С3алкильных групп,
С1-С3алкоксильных групп, CF3- или OCF3-групп,
Ra представляет собой С1-С4алкильную группу,
Y представляет собой насыщенную С2-С5алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С2-С4алкиленовую группу или -CH2-CO-NH-CH2-группу,
с азотсодержащим гетероциклом формулы
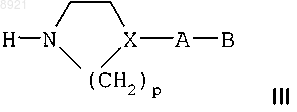
где X представляет собой СН или атом азота,
р равно 2 или 3,
А представляет собой одинарную связь, атом азота, который может быть замещен метильной группой, при условии, что X не является атомом азота, или линейную или разветвленную С1-С5алкиленовую группу, которая может быть гидроксилирована или в которой один из атомов углерода окислен до кетоновой группы,
В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя С1-С4алкильными группами, при условии, что если имеется незамещенный атом азота, этот атом азота защищен аминозащитной группой,
в растворителе, в присутствии активаторов, при температуре, находящейся между температурой окружающей среды и температурой кипения растворителя в течение примерно 2-15 ч, с получением амида формулы
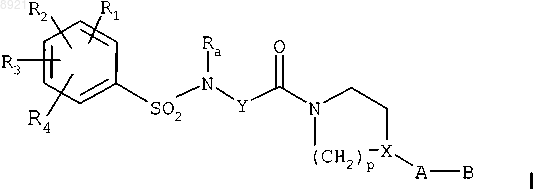
где R1, R2, R3, R4, Ra, Y, p, X, А и В имеют такие же значения, как и у исходных продуктов;
б) при необходимости, удаление аминозащитных групп;
в) при необходимости, получение аддитивной соли с минеральной или органической кислотой соединения формулы I.
5. Способ получения производного бензолсульфонамида формулы I, охарактеризованного в п.1, и его аддитивных солей, включающий в себя:
а) реакцию кислоты формулы
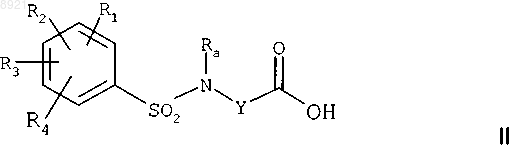
где каждый из радикалов R1, R2, R3, R4 независимо представляет собой атом водорода или атом галогена, С1-С3алкильную группу, С1-С3алкоксильную группу, CF3- или OCF3-группу,
Ra представляет собой С1-С4алкильную группу,
Y представляет собой насыщенную С2-С5алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С2-С4алкиленовую группу или -CH2-CO-NH-CH2-группу,
с хлорирующим агентом с получением хлорангидрида кислоты формулы
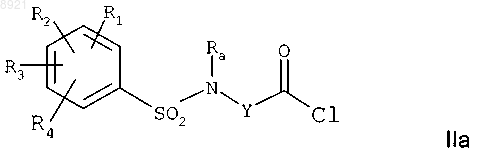
где R1, R2, R3, R4, Ra и Y имеют те же значения, что и в исходном соединении;
б) реакцию хлорангидрида кислоты формулы IIа с амином формулы III, определенной в п.4, с получением соединения формулы I;
в) при необходимости, получение аддитивной соли с минеральной или органической кислотой соединения формулы I.
6. Способ получения производного бензолсульфонамида формулы I, охарактеризованного в п.1, и его аддитивных солей, включающий в себя:
а) реакцию кислотного соединения формулы
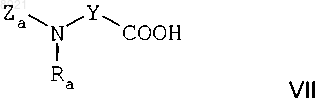
где Ra представляет собой С1-С4алкильную группу,
Y представляет собой насыщенную С2-С5алкиленовую группу, в цепь которой может быть включен атом кислорода, a Za представляет собой аминозащитную группу, с азотсодержащим гетероциклом формулы
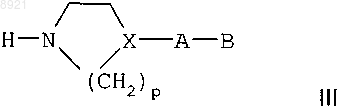
где X представляет собой СН или атом азота,
р равно 2 или 3,
А представляет собой одинарную связь, атом азота, который может быть замещен метильной группой, при условии, что X не является атомом азота, или линейную или разветвленную C1-C5алкиленовую группу, которая может быть гидроксилирована или в которой один из атомов углерода окислен до кетоновой группы,
В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя С1-С4алкильными группами, при условии, что если присутствует незамещенный атом азота, то он защищен аминозащитной группой, отличающейся от аминозащитной группы, использованной для защиты кислотного соединения VII,
в растворителе, в присутствии активаторов, при температуре, находящейся, как правило, между температурой окружающей среды и температурой кипения растворителя, в течение примерно 2-15 ч, с получением амида формулы
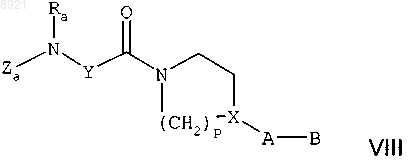
где Za, Ra, Y, p, X, А и В имеют такие же значения, как в исходных соединениях;
б) удаление аминозащитной группы Za с получением вторичного амина формулы
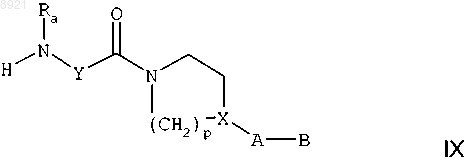
где Ra, Y, р, X, А и В имеют такие же значения, как в предыдущем соединении;
в) реакцию полученного вторичного амина формулы IX с бензолсульфонилхлоридом формулы
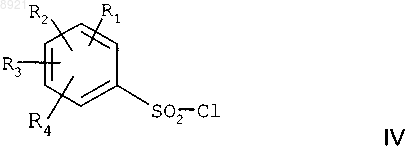
где каждый из радикалов R1, R2, R3, R4 независимо представляет собой атом водорода или галогена, С1-С3алкильную группу или C1-С3алкоксигруппу, CF3- шыш OCF3-группу,
в растворителе, в присутствии апротонного органического основания, при температуре между примерно 0 и 50шС, в течение примерно 1-3 ч, с получением сульфонамида формулы
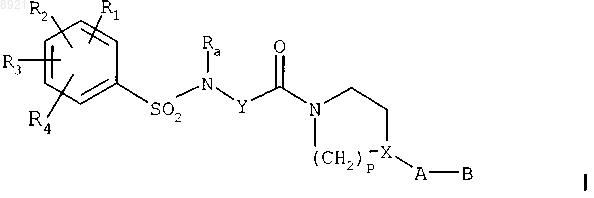
где R1, R2, R3, R4, Ra, Y, p, X, А и В имеют такие же значения, как в исходных соединениях;
г) если необходимо, удаление аминозащитных групп;
д) если необходимо, получение аддитивной соли с минеральной или органической кислотой производного формулы I.
7. Терапевтическая композиция, характеризующаяся тем, что содержит по меньшей мере одно производное бензолсульфонамида формулы I, охарактеризованное в любом из пп.1-3, или по меньшей мере одну из его фармацевтически приемлемых кислотных аддитивных солей, в комбинации по меньшей мере с одним физиологически приемлемым наполнителем.
8. Применение производного бензолсульфонамида формулы I, охарактеризованного в любом из пп.1-3, или одной из его фармацевтически приемлемых кислотных аддитивных солей для приготовления лекарственного средства, предназначенного для лечения боли.
9. Применение производного бензолсульфонамида формулы I, охарактеризованного в любом из пп.1-3, или одной из его фармацевтически приемлемых кислотных аддитивных солей для приготовления лекарственного средства, предназначенного для лечения воспалительных заболеваний.
Текст
008921 Область техники Настоящее изобретение относится к новым соединениям бензолсульфонамидного типа, способу их получения и их применению для получения фармацевтических композиций. Эти новые соединения могут найти терапевтическое применение, в частности, для лечения боли. Предшествующий уровень техники В настоящее время известны соединения, структура которых включает в себя группу бензолсульфонамидного типа. Например, на основании ЕР 236163 и ЕР 236164 можно упомянуть производные N-арилсульфониламиноацил-пара-амидино-фенил-аланинамида, которые являются избирательными ингибиторами тромбина и могут быть использованы в качестве антитромботических средств. Также из ЕР 614911 известны соединения, имеющие структуру, достаточно близкую к структуре вышеупомянутых соединений, одновременно содержащую арилсульфамоильную группу и замещенную фениламидиновую группу, которые обладают способностью к связыванию с рецепторами нейропептида Y и могут быть использованы для лечения гипертонии, стенокардии, атеросклероза, депрессии, тревожных состояний, воспаления, аллергии или ожирения. В ЕР 558961 также предлагается использовать соединения замещенных аминокислот арилсульфонамидного типа для лечения тромбоза на основании их антикоагулянтных свойств. Исследования антитромботических свойств соединений, содержащих в своей структуре арилсульфонамидную и фениламидиновую группы, также опубликованы в журнале Pharmazie, 1984, т. 39 (5),сс. 315-317 и в журнале Pharmazie, 1986, т. 41 (4), сс. 233-235. В той же области фармакологической активности в заявке WO 92/16549 А 1 описаны содержащие арилсульфонамидную группу производные фенилаланина, которые являются ингибиторами протеиназы,более конкретно - ингибиторами тромбина. Также из WO 97/25315 известны соединения, имеющие структуру N-(арилсульфонил)аминокислоты,которые могут быть использованы для лечения воспалительных заболеваний. Среди публикаций предшествующего уровня техники, предлагающих структурные элементы арилсульфонамидного типа, можно указать WO 96/40639, WO 97/24349, WO 98/03503, WO 98/24783 иWO 99/00387, относящиеся к соединениям-антагонистам B1-рецептора брадикинина. Соединенияантагонисты B1-рецептора брадикинина, пептидные или не пептидные, известны также из публикацийWO 01/05783, WO 02/099388 и WO 97/09346. Сущность изобретения Изобретение относится к новым соединениям, содержащим замещенную бензолсульфонамидную цепь; вышеуказанные соединения особенно хорошо подходят для использования в качестве активных ингредиентов в лекарственных средствах, предназначенных для лечения боли, более конкретно - для лечения гипералгезии и большой алгезии. Согласно настоящему изобретению в качестве нового промышленного продукта предлагается соединение бензолсульфонамидного типа, характеризующееся тем, что оно выбрано из группы, состоящей из: а) соединений формулы в которой каждый из радикалов R1, R2, R3, R4 независимо представляет собой один или несколько атомов или групп атомов, выбранных из атома водорода, атомов галогенов, С 1-С 3 алкильных групп,С 1-С 3 алкоксильных групп, CF3- или OCF3-групп,Ra представляет собой С 1-С 4 алкильную группу,Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С 2-С 4 алкиленовую группу или -CH2-CO-NH-CH2- группу,X представляет собой СН-группу или атом азота,р равно 2 или 3,А представляет собой одинарную связь, атом азота, который может быть замещен метильной группой, или линейную или разветвленную С 1-С 5 алкиленовую группу, которая может быть гидроксилирована, или в которой один из атомов углерода окислен до кетоновой группы, при условии, что А и X не являются одновременно атомами азота,В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя C1-C4 алкильными группами; б) кислотных аддитивных солей соединений с вышеуказанной формулой I. Если соединения формулы I имеют центр асимметрии, изобретение также относится ко всем оптическим изомерам, чистым или в виде смесей, и к соответствующим их солям или смесям солей.-1 008921 Согласно изобретению предлагается также способ получения соединений формулы I и их аддитивных солей. Также предлагается применение вещества, выбранного из соединений формулы I и их нетоксичных аддитивных солей, для получения лекарственного средства, которое может быть использовано для лечения людей или животных, и которое предназначено для профилактики или лечения патологий, связанных с болью, более конкретно - гипералгезии, являющейся следствием воспалительного состояния, или тяжелой алгезии, связанной с другими патологическими состояниями, например, такими как рак. Сведения, подтверждающие возможность осуществления изобретения В формуле I под алкильной группой понимают линейную, разветвленную или циклическую углеводородную цепь. С 1-С 3 алкильная группа является прежде всего метильной, этильной, пропильной, циклопропильной или 1-метилэтильной группой. С 1-С 4 алкильная группа, кроме приведенных выше примеров,включает прежде всего бутильную, 1-метилпропильную и 1,1-диметилэтильную группы. Под С 1-С 3 алкоксильной группой подразумевают OR-группу, в которой R является С 1-С 3 алкильной группой, при этом термин алкил имеет значение, указанное выше. Вышеуказанной группой является,например, метокси-, этокси-, пропокси- или 1-метилэтоксигруппа. Под насыщенной С 2-С 5 алкиленовой группой понимают -(СН 2)n-группу, в которой n равно 2, 3, 4 или 5, если она является линейной группой, или, например, -СН(СН 3)-СН 2-СН 2- или -С(СН 3)2-СН 2 группу, если она является разветвленной группой. Под алкиленовой группой, в цепь которой включен атом кислорода, понимают, например, группы -СН 2-СН 2-О-СН 2-, -СН 2-О-СН 2-СН 2- или даже-СН 2-СН 2-О-СН 2-СН 2-. Под ненасыщенной С 2-С 4 алкиленовой группой понимают группу, содержащую 2-4 атома углерода, из которых 2 последовательных атома связаны этиленовой связью, например группы-СН 2-СН=СН-СН 2-, -СН=СН-СН 2-, -СН=С(СН 3)-СН 2- или -СН=СН-СН(СН 3)-. Под атомом галогена подразумевают атом фтора, хлора или брома и предпочтительно атом фтора или хлора. Под алкиламино- или диалкиламиногруппами подразумевают NH(R)- или N(R)2-группы, в которыхR является С 1-С 4 алкильной группой, а термин алкил имеет значение, указанное выше. Под азотсодержащим гетероциклом прежде всего подразумевают азетидиновое, пирролидиновое,морфолиновое, пиперидиновое,пиперазиновое,N-(С 1-С 4)алкилпиперидиновое, N-(С 1-С 4)алкилпиперазиновое, хинуклидиновое, тропановое, N-(C1-С 4)алкилгомопиперазиновое, аминопиридиновое и N(C1-С 4)алкилимидазольное кольцо. Под аддитивными солями понимают соли, полученные посредством реакции соединения формулы I, содержащего по крайней мере одну основную функциональную группу, в его несолевой форме с минеральной или органической кислотой. Предпочтительно эти аддитивные соли являются фармацевтически приемлемыми. Среди минеральных кислот, пригодных для образования соли основного соединения формулы I,предпочтение отдается хлористоводородной, бромистоводородной, фосфорной и серной кислотам. Среди органических кислот, пригодных для получения соли основного соединения формулы I, предпочтение отдается метансульфокислоте, бензолсульфокислоте, толуолсульфокислоте, малеиновой, фумаровой,щавелевой, лимонной, винной, молочной и трифторуксусной кислотам. Среди соединений формулы I предпочтение отдается таким соединениям, которые удовлетворяют по крайней мере одному из следующих условий:R1 представляет собой атом водорода, атом галогена, С 1-С 3 алкильную группу или С 1-С 3 алкоксильную группу;R2 представляет собой атом галогена, С 1-С 3 алкильную группу или CF3-группу;R3 представляет собой атом водорода, атом галогена, С 1-С 3 алкильную группу или С 1-С 3 алкоксильную группу;R4 представляет собой атом водорода или С 1-С 3 алкильную группу;Ra представляет собой метильную группу;Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода; р равно 2; А представляет собой одинарную связь или линейную или разветвленную С 1-С 5 алкиленовую группу; В представляет собой азетидинильную, пирролидинильную, морфолинильную, пиперидинильную,пиперазинильную, N-(C1-С 4)алкилпиперидинильную, N-(С 1-С 4)алкилпиперазинильную, хинуклидинильную, тропанильную, N-(С 1-С 4)алкилгомопиперазинильную группу. Особое предпочтение отдается соединениям формулы I, которые удовлетворяют по крайней мере одному из следующих условий:R1 представляет собой С 1-С 3 алкоксильную группу; каждый из R2 и R3 представляет собой С 1-С 3 алкильную группу, предпочтительно метильную группу в положении 2,6 на ароматическом кольце;R4 представляет собой атом водорода;Y представляет собой С 3-С 5 алкиленовую группу, в цепь которой включен атом кислорода, предпочтительно -СН 2-СН 2-О-СН 2-группу; В представляет собой пиперидинильную, N-(С 1-С 4)алкилпиперидинильную или N-(С 1-С 4)алкилпиперазинильную группу. Предпочтение отдается соединениям формулы Ia в которой каждый из радикалов R1, R2, R3 независимо представляет собой один или несколько атомов или групп атомов, выбранных из атома водорода, атомов галогенов, С 1-С 3 алкильных групп, C1-C3 алкоксильных групп, CF3- или OCF3-групп;Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С 2-С 4 алкиленовую группу или -CH2-CO-NH-CH2- группу; А представляет собой одинарную связь или -(СН 2)m-группу;R представляет собой насыщенный азотсодержащий гетероцикл, преимущественно выбранный из пирролидинового, морфолинового, пиперидинового, хинуклидинового, тропанового колец, или третичную аминогруппу, предпочтительно диалкиламиногруппу;m и р независимо равны 2 или 3. Предпочтение также отдается соединениям формулы Ib в которой каждый из радикалов R1, R2, R3 независимо представляет собой один или несколько атомов или групп атомов, выбранных из атома водорода, атомов галогенов, C1-C3 алкильных групп, С 1-С 3 алкоксильных групп, CF3- или OCF3-групп;Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С 2-С 4 алкиленовую группу или -CH2-CO-NH-CH2-группу; А представляет собой одинарную связь или насыщенную С 1-С 5 алкиленовую группу, которая может быть гидроксилирована;R представляет собой насыщенный азотсодержащий гетероцикл, преимущественно выбранный изN-метилпиперазинового, N-метилпиперидинового колец, или третичную аминогруппу, предпочтительно диалкиламиногруппу. Согласно настоящему изобретению предлагается общий способ получения соединений формулы I или их аддитивных солей, включающий: а) реакцию кислоты формулы в которой каждый из радикалов R1, R2, R3, R4 независимо представляет собой один или несколько атомов или групп атомов, выбранных из атома водорода, атомов галогенов, С 1-С 3 алкильных групп, С 1-С 3 алкоксильных групп, CF3- или OCF3-групп,Ra представляет собой С 1-С 4 алкильную группу,Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода, ненасыщенную С 2-С 4 алкиленовую группу или -CH2-CO-NH-CH2-группу, с азотсодержащим гетероциклом формулы в которой X представляет собой СН или атом азота,р равно 2 или 3,А представляет собой одинарную связь, атом азота, который может быть замещен метильной груп-3 008921 пой (если X не является также атомом азота), или линейную либо разветвленную С 1-С 5 алкиленовую группу, которая может быть гидроксилирована или в которой один из атомов углерода окислен до кетоновой группы,В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя С 1-С 4 алкильными группами, при условии, что если имеется незамещенный атом азота,то он защищен аминозащитной группой, такой как, например, Вос-группа (1,1-диметилэтоксикарбонил) или Cbz-группа (фенилметоксикарбонил),в растворителе, например, таком как тетрагидрофуран, дихлорметан или диметилформамид, в присутствии активаторов, таких как EDCI (1-(3-диметиламинопропил)-3-этилкарбодиимид), DIC (диизопропилкарбодиимид) или НОАТ (1-гидрокси-7-азабензотриазол), при температуре, в общем случае находящейся в диапазоне между температурой окружающей среды и температурой кипения растворителя, в течение примерно 2-15 ч, с получением амида формулы в которой R1, R2, R3, R4, Ra, Y, p, X, А и В имеют такие же значения, как и у исходных продуктов; б) при необходимости, удаление аминозащитных групп, например под действием трифторуксусной кислоты в присутствии анизола, если вышеуказанная аминозащитная группа является Вос-группой, или посредством каталитической гидрогенизации, если защитная группа является Cbz-группой; в) при необходимости, получение аддитивной соли с минеральной или органической кислотой соединения формулы I с использованием стандартных методов, известных специалистам в данной области техники. Этот общий способ получения амида с использованием в качестве исходных веществ карбоновой кислоты и амина можно модифицировать за счет использования активаторов, иммобилизованных на нерастворимой смоле, например на смолах, имеющих полистирольную основу, несущую карбодиимидные функциональные группы. В качестве варианта приведенного выше общего способа кислоту формулы II можно превратить в ее хлорангидрид формулы IIа преимущественно путем взаимодействия с хлорирующим агентом, таким как оксалилхлорид или тионилхлорид, а затем провести реакцию полученного хлорангидрида с азотсодержащим гетероциклом формулы III, используя стандартную реакцию, проводимую в растворителе и предпочтительно в присутствии апротонного органического основания, например, такого как триэтиламин или пиридин, с получением соединения формулы I. Кислоты формулы II, в которой Y обозначает -СН 2-СН 2-О-СН 2-группу, могут быть получены способом, включающим в себя: а) реакцию бензолсульфонилхлорида формулы в которой каждый из радикалов R1, R2, R3 и R4 независимо представляет собой атом водорода или атом галогена, С 1-С 3 алкильную группу, С 1-С 3 алкоксильную группу, CF3-или OCF3-группу с аминоспиртом формулыHN(Ra)-CH2-CH2-OH в которой Ra представляет собой С 1-С 4 алкильную группу в растворителе, например, в таком как дихлорметан, в присутствии апротонного органического основания, например, такого как триэтиламин или пиридин, в течение примерно 1-3 ч с получением сульфонамида формулы в которой R1, R2, R3, R4 и Ra имеют такие же значения, как и у исходных продуктов;-4 008921 б) реакцию полученного соединения формулы V с эфиром бромуксусной кислоты, предпочтительно с трет-бутиловым эфиром, в присутствии основания, такого как, например, гидроксид натрия, и в среде,способствующей фазовому переходу, содержащей соли четвертичного аммония, в смеси растворителей,таких как вода и толуол, в диапазоне температур 0-40 С, в течение примерно 1-5 ч с получением эфира формулы в) гидролиз эфира формулы VI, например, путем взаимодействия с трифторуксусной кислотой, в растворителе, таком как дихлорметан, в диапазоне температур 0-50 С, в течение примерно 1-6 ч с получением кислоты формулы II в которой R1, R2, R3, R4 и Ra имеют такие же значения, как и у исходных продуктов,Y обозначает -СН 2-СН 2-О-СН 2-группу. В качестве варианта общего способа соединения формулы I могут быть получены способом, включающим в себя: а) реакцию кислотного соединения формулы в которой Ra представляет собой С 1-С 4 алкильную группу,Y представляет собой насыщенную С 2-С 5 алкиленовую группу, в цепь которой может быть включен атом кислорода,Za представляет собой аминозащитную группу, такую как, например, бензильная группа, с азотсодержащим гетероциклом формулы в которой X представляет собой СН или атом азота,р равно 2 или 3,А представляет собой одинарную связь, атом азота, который может быть замещен метильной группой (если X не является также атомом азота), или линейную или разветвленную С 1-С 5 алкиленовую группу, которая может быть гидроксилирована или в которой один из атомов углерода окислен до кетоновой группы,В представляет собой азотсодержащий гетероцикл или аминогруппу, которая может быть замещена одной или двумя C1-C4 алкильными группами, при условии, что если присутствует незамещенный атом азота, то он должен быть защищен другой аминозащитной группой, т.е. отличающейся от аминозащитной группы, использованной для кислотного соединения VII, например Вос-группой(1,1-диметилэтоксикарбонилом), в растворителе, например, в таком как тетрагидрофуран или дихлорметан, или диметилформамид, в присутствии активаторов, например, таких как EDCI (1-(3 диметиламинопропил)-3-этилкарбодиимид), DIC (диизопропилкарбодиимид) или НОАТ (1-гидрокси-7 азабензотриазол), при температуре, в типичном случае находящейся между температурой окружающей среды и температурой кипения растворителя, в течение примерно 2-15 ч, с получением амида формулы в которой Za, Ra, Y, p, X, А и В имеют такие же значения, как в исходных соединениях;-5 008921 б) удаление аминозащитной группы Za, например, посредством каталитической гидрогенизации,если Za является бензильной группой, с получением вторичного амина формулы в которой Ra, Y, p, X, А и В имеют такие же значения, как и в предыдущем соединении; в) реакцию полученного вторичного амина IX с бензолсульфонилхлоридом формулы в которой каждый из радикалов R1, R2, R3, R4 независимо представляет собой атом водорода или атом галогена, C1-С 3 алкильную группу или С 1-С 3 алкоксильную группу, CF3- или OCF3-группу, в растворителе,например, таком как дихлорметан, в присутствии апротонного органического основания, например, такого как триэтиламин или пиридин, при температуре, находящейся между примерно 0 и 50 С, в течение примерно 1-3 ч, с получением сульфонамида формулы в которой R1, R2, R3, R4, Ra. Y, p, X, А и В имеют такие же значения, как и в исходных соединениях; г) если необходимо, удаление аминозащитной группы, например, путем взаимодействия с трифторуксусной кислотой в присутствии анизола, если вышеуказанная аминозащитная группа является Восгруппой; д) если необходимо, получение аддитивной соли с минеральной или органической кислотой соединения формулы I. В качестве варианта вышеуказанного способа стадию а) с образованием амидной связи можно провести, вначале получив хлорангидрид кислоты формулы VII, например, путем взаимодействия с оксалилхлоридом или тионилхлоридом в безводном апротонном растворителе, с последующей реакцией полученного хлорангидрида кислоты с амином формулы III, как описано выше, в растворителе и, например, в присутствии апротонного растворителя, такого как триэтиламин. Гетероциклические производные формулы III являются хорошо известными соединениями, имеющимися в продаже или описанными в литературе, или их можно получить с использованием способов,известных специалистам в данной области техники, например посредством реакции восстановительного аминирования между пиперазином или гомопиперазином и кетоном, например, в присутствии изопропоксида титана, с последующей реакцией с восстановителем, таким как цианоборгидрид натрия, или,если используются производные пиперидина, посредством каталитического гидрирования гомологичных пиридину соединений. Изобретение будет более понятным на основании примеров получения соединений и результатов фармакологических испытаний, демонстрирующих терапевтическую применимость этих соединений. Эти примеры не являются ограничивающими, и их нельзя интерпретировать как ограничивающие объем изобретения. Сокращения, используемые в описании изобретения: М означает моль,мМ означает миллимоль (10-3 моль),ТГФ означает тетрагидрофуран,ДХМ означает дихлорметан,ДМФ означает диметилформамид,ТФУК означает трифторуксусная кислота. Для соединений, имеющих центр асимметрии, отсутствие какого-либо особого указания означает,что соединение находится в форме рацемической смеси. В спектральных данных ядерного магнитного резонанса химические сдвиги указаны относительно ТМС (тетраметилсилана). Препарат I.N-(2-Гидроксиэтил)-4-метокси-N,2,6-триметилбензолсульфонамид. Был приготовлен раствор 1,76 г (23,4 мМ) 2-(метиламино)этанола в 100 мл ДХМ, и к раствору было добавлено 5,4 г (53 мМ) триэтиламина. Смесь охладили до 0 С, и к ней постепенно добавили раствор 5 г(21,3 мМ) 2,6-диметил-4-метоксибензолсульфонилхлорида в 50 мл ДХМ. После этого смесь взбалтывали в течение 3 ч при температуре окружающей среды, а затем влили ее в 50 мл 0,5 N хлористоводородной кислоты. Органическую фазу отделили, затем промыли водой, высушили над сульфатом магния и сконцентрировали при пониженном давлении. В результате было получено 5,8 г нужного соединения в виде бесцветного масла (выход = 100%). 1 Н ЯМР (300 МГц, ДМСО) : 6,80 (s, 2H); 4,70 (t, 1H); 3,80 (s, 3H); 3,48 (q, 2H); 3,09 (t, 2H); 2,69 (s,3H); 2,54 (s, 6H). Препарат II.[2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Был приготовлен раствор 4,85 г (17,7 мМ) соединения, полученного в соответствии с процедурой получения препарата I, в 100 мл толуола, и к нему было добавлено 1,62 г тетрабутиламмонийхлорида. Смесь охладили до 0 С и добавили к ней 100 мл 35% раствора гидроксида натрия, затем постепенно добавили 3,95 мл (26,6 мл) трет-бутилбромацетата. Смесь взбалтывали при температуре окружающей среды в течение 2 ч, затем органическую фазу отделили посредством декантирования, промыли водой с нейтральным рН, после чего высушили над сульфатом натрия. После концентрирования при пониженном давлении было получено масло, которое было очищено посредством хроматографии на силикагеле с элюированием смесью циклогексана/этилацетата (75/25; объем/объем). В результате было получено 6,5 г нужного соединения в виде бесцветного масла (выход = 94%). 1 Н ЯМР (250 МГц, ДМСО) : 6,80 (s, 2H); 3,89 (s, 2H); 3,80 (s, 3H); 3,56 (t, 2H); 3,21 (t, 2 Н); 2,71 (s, 3H); 2,53 (s, 3H); 1,41 (s, 9H). Препарат III.[2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]уксусная кислота. 6,4 г (16,5 мМ) эфира, полученного в соответствии с процедурой получения препарата II, растворили в 80 мл ДХМ и добавили 8 мл трифторуксусной кислоты. Смесь взбалтывали при температуре окружающей среды в течение 4 ч, а затем сконцентрировали при пониженном давлении. Остаток от испарения растворили в 100 мл 1N гидроксида натрия, полученный раствор промыли два раза 30 мл этилацетата, после чего подкислили 1N раствором хлористоводородной кислоты и два раза экстрагировали этилацетатом. Органическую фазу промыли водой, высушили над сульфатом натрия и сконцентрировали при пониженном давлени. В результате была получена нужная кислота в виде масла, которое кристаллизовалось (выход = 95%). Температура плавления: 82 С. Пример 1. 1-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-4-[2-(1-пирролидинил)этил]пиперазина бис-трифторацетат. 482 мг полистирольной смолы, привитой циклогексилдиимидом, поместили на 20 мин в 5 мл ТГФ,а затем добавили 100 мг (0,31 мМ) кислоты, полученной в соответствии с процедурой получения препарата III, в виде раствора в 2 мл ТГФ, 37 мг (0,20 мМ) 1-[2-(1-пирролидинил)этил]пиперазина и 2 мг НОАТ (1-гидрокси-7-азабензотриазола). Смесь взбалтывали в течение 4 ч при температуре окружающей среды, а затем профильтровали. Смолу промыли 4 мл ТГФ, который был добавлен к фильтрату. Затем фильтрат взбалтывали с 50 мг смолы Amberlite IRA 400 (в виде основной формы(ОН в течение 3 ч. После фильтрации смолу промыли 3 мл ТГФ, который добавили к фильтрату. Затем этот фильтрат обработали 100 мг полистирольной смолы, привитой изоцианатом, в течение 1 ч. Смолу отделили посредством фильтрации, и раствор сконцентрировали при пониженном давлении. Остаток(63 мг) очистили посредством обратнофазной хроматографии на колонке X Terra Prep MS C18(t = с 0 до 2 мин), 60% В (t = с 2 до 17 мин), 100% В (t = с 17 мин до 18 мин); объемная скорость составляет 25 мл/мин; УФ-детекция в диапазоне 120-260 нм. Очищенный продукт перенесли в 1 мл ацетонитрила и смешали с 6 мл 1% раствора трифторуксусной кислоты в воде. Полученный раствор высушили сублимационной сушкой, и было получено 19 мг требуемой соли в виде желтого масла (выход = 13%). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,09 (s, 2H); 3,96 (s, 3H); 3,70 (m, 1H); 3,59 (t, 2 Н); 3,48 (t, 2 Н); 3,33 (m, 5 Н); 3,19 (t, 2 Н); 3,00 (т, 4 Н); 2,72 (s; 3H); 2,56 (s, 6H); 2,04 (m, 4 Н). Препарат IV.[2-(2,4,6-Триметилфенил)сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения N-(2-гидроксиэтил)-N,2,4,6-тетраметилбензолсульфонамид, был получен требуемый сложный эфир в виде бежевого масла (выход = 98%). 1 Н ЯМР (250 МГц, ДМСО) : 7,06 (s, 2H); 4,01 (s, 2H); 3,58 (t, 2H); 3,25 (t, 2H); 2,72 (s, 3 Н); 2,51 (s, 6H); 2,27 (s, 3H); 1,43 (s, 9H).[2-(2,4,6-Триметилфенил)сульфонил]метиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата IV, был получен требуемый продукт в виде бежевого твердого вещества (выход = 83%). Температура плавления: 58 С. Препарат VI.N-Этил-N-(2-гидроксиэтил)-4-метокси-2,6-диметилбензолсульфонамид. Способом, аналогичным процедуре получения препарата I, используя в качестве исходного соединения 2-(этиламино)этанол, был получен требуемый продукт в виде желтого масла (выход = 99%). 1 Н ЯМР (250 МГц, ДМСО) : 6,80 (s, 2H); 4,69 (t, 1H); 3,80 (s, 3H); 3,38 (m, 2H); 3,14 (s, 2H). Препарат VII.[2-(4-Метокси-2,6-диметилфенил)сульфонил]этиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата VI, был получен требуемый продукт в виде бесцветного масла (выход = 79%). 1 Н ЯМР (250 МГц, ДМСО) : 6,79 (s, 2H); 3,86 (s, 2H); 3,79 (s, 3 Н); 3,47 (t, 2H); 3,24 (m, 4H); 2,53 (s,6H); 1,40 (s, 9H); 1,00 (t, 3 Н). Препарат VIII.[2-(4-Метокси-2,6-диметилфенил)сульфонил]этиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата VII, был получен требуемый продукт в виде белого твердого вещества (выход = 88%). 1 Н ЯМР (250 МГц, ДМСО) : 6,79 (s, 2H); 3,89 (s, 2H); 3,79 (s, 3H); 3,48 (t, 2H); 3,24 (q, 2 Н); 3,21 (t,2H); 2,53 (s, 6H); 1,00 (t, 3 Н). Препарат IX.N-(2-Гидроксиэтил)-4-метокси-2,6-диметил-N-(1-метилэтил)бензолсульфонамид. Способом, аналогичным процедуре получения препарата I, используя в качестве исходного соединения 2-[(1-метилэтил)амино]этанол, был получен требуемый продукт в виде бесцветного масла[2-(4-Метокси-2,6-диметилфенил)сульфонил](1-метилэтил)амино]этокси]уксусной кислоты 1,1 диметиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата IX, был получен требуемый продукт в виде бесцветного масла (выход = 95%). 1 Н ЯМР (250 МГц, ДМСО) : 6,80 (s, 2H); 3,86 (s, 2H); 3,80 (s, 3 Н); 3,74 (quin, 1H); 3,82 (m, 2 Н); 3,26 (m, 2 Н); 2,53 (s, 6H); 1,40 (s, 9H); 1,07 (d, 6H). Препарат XI.[2-(4-Метокси-2,6-диметилфенил)сульфонил]-(1-метилэтил)амино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата X, был получен требуемый продукт в виде белого твердого вещества (выход = 85%). Температура плавления: 96 С. Препарат XII.N-Циклопропил-N-(2-гидроксиэтил)-4-метокси-2,6-диметилбензолсульфонамид. Способом, аналогичным процедуре получения препарата I, используя в качестве исходного соединения 2-(циклопропиламино)этанол, был получен требуемый продукт в виде твердого белого вещества[2-[Циклопропил[(4-метокси-2,6-диметилфенил)сульфонил]амино]этокси]уксусной кислоты 1,1 диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XII, был получен требуемый продукт в виде бесцветного масла (выход = 84%). 1 Н ЯМР (300 МГц, ДМСО) : 6,80 (s, 2H); 3,98 (s, 2H); 3,80 (s, 3H); 3,69 (t, 2H); 3,44 (t, 2 Н); 2,50 (s, 6 Н); 2,47 (m, 1 Н); 1,42 (s, 9 Н); 0,48 (m, 2 Н); 0,16 (m, 2 Н). Препарат XIV.-8 008921 Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XIII, был получен требуемый продукт в виде белого твердого вещества (выход = 85%). Температура плавления: 100 С. Препарат XV. 2,6-Дихлор-4-метоксибензолсульфонилхлорид и 2,4-дихлор-6-метоксибензолсульфонилхлорид. Был приготовлен раствор 15 г (84,7 мМ) 3,5-дихлоранизола в 8 мл тионилхлорида, который был охлажден до -10 С, затем к нему по каплям было добавлено 6 мл (90 мМ) хлорсульфокислоты. После этого реакционную смесь взбалтывали в течение 3 ч при температуре окружающей среды, а затем добавили к смеси льда и этилацетата. Органическую фазу отделили, высушили над сульфатом магния и сконцентрировали при пониженном давлении. Остаток от испарения использовали на следующей стадии без дополнительной очистки. Препарат XVIa. 2,6-Дихлор-N-(2-гидроксиэтил)-4-метокси-N-метилбензолсульфонамид. Препарат XVIб. 2,4-Дихлор-N-(2-гидроксиэтил)-6-метокси-N-метилбензолсульфонамид. Способами, аналогичными процедуре получения препарата I, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XV, требуемые продукты в виде белых твердых веществ были получены после выделения веществ и их очистки посредством хроматографии на силикагеле при элюировании с помощью смеси толуола/изопропанола[2-(2,6-Дихлор-4-метоксифенил)сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XVIa, был получен требуемый продукт в виде бесцветного масла (выход = 52%). 1 Н ЯМР (300 МГц, ДМСО) : 7,24 (s, 2H); 3,94 (s, 2H); 3,87 (s, 3H); 3,60 (t, 2H); 3,39 (t, 2 Н); 2,90[2-2,6-Дихлор-4-метоксифенил)сульфонил]метиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XVII, был получен требуемый продукт в виде белого твердого вещества (выход = 94%). Температура плавления: 95 С. Препарат XIX.[2-(2,4-Дихлор-6-метоксифенил)сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XVIб, был получен требуемый продукт в виде масла, которое без дополнительной очистки было использовано на следующей стадии. Препарат XX.[2-(2,4-Дихлор-6-метоксифенил)сульфонил]метиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XIX, был получен требуемый продукт в виде белого твердого вещества (выход = 76%). Температура плавления: 74 С. Препарат XXI. 2,4-Дихлор-N-(2-гидроксиэтил)-3,N-диметилбензолсульфонамид. Способом, аналогичным процедуре получения препарата I, используя в качестве исходного соединения 2,4-дихлор-3-метилбензолсульфонилхлорид, был получен требуемый продукт в виде бесцветного масла. Препарат XXII.[2-(2,4-Дихлор-3-метилфенил)сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXI, был получен требуемый продукт в виде бесцветного масла (выход = 87%).[2-(2,4-Дихлор-3-метилфенил)сульфонил]метиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXII, был получен требуемый продукт в виде бесцветного масла (выход = 100%). 1 Н ЯМР (300 МГц, ДМСО) : 7,83 (d, 1H); 7,63 (d, 1H); 3,93 (s, 2H); 3,59 (t, 2H); 3,39 (t, 2 Н); 2,91 (s, 3H); 2,49 (s, 3H); 1,41 (s, 9H). Препарат XXIV.N-(2-Гидроксиэтил)-N-метил-2-(трифторметил)бензолсульфонамид. Способом, аналогичным процедуре получения препарата I, используя в качестве исходного соединения 2-(трифторметил)бензолсульфонилхлорид, был получен требуемый продукт в виде желтого масла[2-(2-(Трифторметил)фенил]сульфонил]метиламино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата II, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXIV, был получен требуемый продукт в виде желтого масла (выход = 67%). 1 Н ЯМР (250 МГц, ДМСО) : 8,02 (m, 2 Н); 7,98 (m, 2H); 3,97 (s, 2H); 3,63 (t, 2H); 3,44 (t, 2H); 2,95 (s, 3H); 1,42 (s,9H). Препарат XXVI.[2-(2-(Трифторметил)фенил]сульфонил]метиламино]этокси]уксусная кислота. Способом, аналогичным процедуре получения препарата III, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXV, был получен требуемый продукт в виде бесцветного масла (выход = 78%). 1 Н ЯМР (250 МГц, ДМСО) : 8,02 (m, 2 Н); 7,86 (m, 2 Н); 4,01 (s, 2H); 3,65 (t, 2H); 3,45 (t, 2H); 2,95 (s,3 Н). Препарат XXVII.[2-4-Метокси-2-(трифторметил)фенил 1 сульфонил]метиламино]этокси]уксусная кислота. Была приготовлена суспензия 8 г (60 мМ) 2-(2-метиламиноэтокси)уксусной кислоты в 100 мл хлороформа и 20 мл ацетонитрила, и при температуре окружающей среды к ней было добавлено 17 мл (120 мМ) триэтиламина, а затем, по каплям, 7,63 мл (60 мМ) хлортриметилсилана. Смесь взбалтывали при 60 С в течение 2 ч, а затем охладили до температуры окружающей среды и медленно добавили 17 мл(120 мМ) триэтиламина, а затем 16,48 г (60 мМ) 4-метокси-2-(трифторметил)бензосульфонилхлорида,растворенного в 60 мл хлороформа. Реакционную смесь выдержали при взбалтывании при 5 С в течение 16 ч, а затем сконцентрировали при пониженном давлении. Остаток перенесли в 150 мл дихлорметана и обработали 40 мл 1N раствора хлористоводородной кислоты. Органическую фазу отделили, промыли водой, а затем экстрагировали два раза 120 мл 1N гидроксида натрия. Щелочную водную фазу отделили, промыли 100 мл дихлорметана, а затем подкислили 5N раствором хлористоводородной кислоты. Образовавшийся осадок экстрагировали два раза 80 мл дихлорметана; полученную органическую фазу промыли водой, а затем высушили над сульфатом магния и сконцентрировали при пониженном давлении. Полученный остаток кристаллизовали в изопропиловом эфире, отделили и высушили. В результате было получено 6,32 г нужного соединения в виде белого твердого вещества (выход = 28%). Температура плавления: 60 С. Препарат XXVIII. 4-(3-Хинуклидинил)пиперазин-1-карбоновой кислоты 1,1-диметилэтиловый эфир. 1 г (8 мМ) хинуклидинона, 1,63 г (8,75 мМ) 1-пиперазинкарбоновой кислоты трет-бутилового эфира(1-Вос-пиперазина) и 2,71 мл (9,1 мМ) изопропоксида титана смешали, и эту смесь выдержали при взбалтывании в течение 1 ч. Затем добавили 5 мл этанола, а после этого 460 мг (7,3 мМ) цианоборгидрида натрия, и эту смесь взбалтывали в течение 24 ч при температуре окружающей среды. Добавили 25 мл воды и продолжили взбалтывание в течение 15 мин. Образовавшийся осадок отделили посредством фильтрации, и фильтрат сконцентрировали при пониженном давлении. Остаток очистили посредством хроматографии на NН 2-силикагеле с элюированием смесью толуола/изопропанола (95/5; объем/объем). В результате был получен 1 г нужного соединения в виде белого твердого вещества (выход = 42%). Температура плавления: 174 С.(3RS)-3-(1-Пиперазинил)-1-азабицикло[2.2.2]октан или (3RS)-3-(1-пиперазинил)хинуклидин). Был приготовлен раствор 990 мг (3,35 мМ) соединения, полученного в соответствии с процедурой получения препарата XXVIII, в 10 мл трифторуксусной кислоты, и смесь взбалтывали в течение 30 мин при 10 С. Затем добавили 30 мл толуола и провели концентрирование при пониженном давлении. Остаток перенесли в 25 мл метанола, и раствор взбалтывали с 20 г смолы Amberlite IRA 400 (ОН) в течение 1 ч при температуре окружающей среды. Смолу отделили посредством фильтрации, промыли 15 мл метанола и объединенные фильтраты сконцентрировали при пониженном давлении. В результате было получено 530 мг нужного продукта в виде белой пасты (выход = 80%). 1 Н ЯМР (300 МГц, ДМСО) : 2,79 (m, 1 Н); 2,67 (m, 7 Н); 2,50 (m, 2 Н); 2,22 (m, 4 Н); 1,91 (m, 1 Н); 1,85 (m, 1 Н); 1,58 (m, 2 Н); 1,32 (m, 1 Н); 1,22 (m, 1 Н). Пример 2.N-[2-[2-[4-[(3RS)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-N,2,4,6 тетраметилбензолсульфонамида бис-трифторацетат. 250 мг (0,32 мМ) полистирольной смолы, привитой ТФФ (тетрафторфенолом), поместили в 4 мл ДМФ на 15 мин, а затем добавили 4 мг (0,03 мМ) 4-(диметиламино)пиридина, 103 мг (0,32 мМ) кислоты,полученной в соответствии с процедурой получения препарата V, и 76 мкл (0,48 мМ) диизопропилкарбодиимида. Смесь выдержали при взбалтывании в течение 18 ч, а затем смолу отделили посредством фильтрации, дважды промыли 3 мл ДМФ и провели реакцию с 44 мг (0,225 мМ) амина, полученного в соответствии с процедурой получения препарата XXIX, в 3 мл ДМФ. Смесь взбалтывали в течение 1 ч при температуре окружающей среды, после чего смолу отделили фильтрацией и дважды промыли 3 мл ДМФ. Фильтраты объединили и обработали 20 мг смолы Amberlite IRA 400 (ОН), а затем - 20 мг смолы,привитой изоцианатом, после чего сконцентрировали при пониженном давлении. Остаток очистили посредством полупрепаративной хроматографии (условия аналогичны условиям примера 1). В результате было получено 16 мг нужного соединения в виде белого твердого вещества (выход = 8%). Температура плавления: 78-80 С. Пример 3.N-[2-[2-[4-[(3RS)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксо-токси]этил]-4-метоксиN,2,6-триметилбензолсульфонамид. 500 мг (1,51 мМ) кислоты, полученной согласно процедуре получения препарата III, 319 мг (1,65 мМ) EDCI, 2,26 мг (1,65 мМ) НОАТ и 233 мкл триэтиламина перемешали в 10 мл ДМФ, и эту реакционную смесь выдержали при перемешивании при комнатной температуре в течение 30 мин. Затем добавили 334 мг амина, полученного согласно процедуре получения препарата XXIX, и провели перемешивание в течение 20 ч при комнатной температуре. Реакционную смесь вылили в воду при температуре таяния льда и экстрагировали ДХМ. Органическую фазу высушили над сульфатом магния и сконцентрировали при пониженном давлении. Остаток очистили посредством хроматографии на силикагеле, привитом NH2,с элюированием смесью толуола/изопропанола (95/5; объем/объем). В результате было получено 140 мг нужного продукта в виде бесцветного масла (выход = 18%). 1 Н ЯМР (300 МГц, ДМСО) : 6,80 (s, 2H); 4,05 (s, 2H); 3,80 (s, 3H); 3,53 (t, 2H); 3,41 (m, 2 Н); 3,31 (m, 2 Н); 3,22 (t, 2 Н); 2,85 (m, 1 Н); 2,70 (s, 3 Н); 2,57 (m, 5 Н); 2,53 (s, 6H); 2,27 (m, 4 Н); 1,90 (m, 2 Н); 1,60 (m, 2 Н); 1,35 (m, 1 Н); 1,20 (m, 1 Н). Пример 4.N-[2-[2-[4-[(3RS)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида дифумарат. Был приготовлен раствор 137 мг (0,269 мМ) соединения, полученного согласно примеру 3, в 3 мл метанола, и к раствору было добавлено 62,5 мг (0,538 мМ) фумаровой кислоты. Смесь взбалтывали в течение 30 мин, а затем сконцентрировали при пониженном давлении. Остаток перенесли в 5 мл воды и высушили посредством сублимационной сушки. В результате было получено 200 мг искомой соли в виде белого порошка (количественный выход). Температура плавления: 86-90 С. Пример 5.N-[2-[2-[4-[(3S)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамид. 840 мг (2,53 мМ) кислоты, полученной согласно процедуре получения препарата III, смешали с 8 мл безводного толуола и 0,1 мл ДМФ. Медленно добавили 0,245 мл (2,81 мМ) оксалилхлорида. Реакционную смесь взбалтывали в течение 1 ч при температуре окружающей среды, а затем сконцентрировали при пониженном давлении. Остаток перенесли в 10 мл толуола и по каплям добавили к раствору 0,5 г(2,56 мМ) 3(S)-(1-пиперазинил)хинуклидина и 0,39 мл (2,81 мМ) триэтиламина в 10 мл толуола. Реакционную смесь взбалтывали а течение 1 ч при температуре окружающей среды, после чего добавили 2 мл этанола и 10 г силикагеля для хроматографии. Растворители удалили при пониженном давлении, а продукт, который адсорбировался на силикагель, очистили посредством хроматографии на силикагеле с элюированием смесью этилацетата/этанола/водного раствора аммиака (6/3/1; об./об./об.). Чистые фрак- 11008921 ции сконцентрировали при пониженном давлении, растворили в этилацетате, высушили над сульфатом магния и сконцентрировали. В результате был получен требуемый продукт в виде бесцветного маслаN-[2-[2-[4-[(3S)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида фумарат. 0,84 г (1,65 мМ) соединения, полученного согласно примеру 5, растворили в 50 мл метанола и добавили 0,192 г (1,64 мМ) фумаровой кислоты. Смесь взболтали до полного растворения и сконцентрировали при пониженном давлении. Остаток растворили в 40 мл воды, раствор профильтровали и высушили посредством сублимационной сушки. В результате был получен 1 г искомой соли в виде белого порошкаN-[2-[2-[4-[(3R)-1-Азабицикло[2.2.2]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида фумарат. Рацемическую смесь, полученную согласно примеру 3, разделили посредством хроматографии на колонке с хиральной фазой (колонка Chiralpack AD) при элюировании смесью гексана/этанола/изопропанола/трифторуксусной кислоты (60/25/15/0,05). Используя в качестве исходного соединения 500 мг рацемической смеси, было получено 260 мг энантиомера S и 100 мг энантиомера R. Каждый из энантиомеров растворили в метаноле и обработали 1 г смолы Amberlite IRA 400 (ОН). Обработанный раствор профильтровали и сконцентрировали при пониженном давлении, а из полученных основных соединений получили соли в реакции с фумаровой кислотой, аналогично операции, описанной в примере 6. В результате было получено 143 мг энантиомера S и 68 мг энантиомера R. Температура плавления: 84 С. []25D=7,2 (С=0,31; СН 3 ОН). Препарат XXX. 4-(8-Метил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения 8-метил-8-азабицикло[3.2.1]октан-3-она (тропинона), был получен требуемый сложный эфир в виде белого твердого вещества (выход = 53%). 1 Н ЯМР (300 МГц, ДМСО) : 3,25 (m, 4 Н); 3,15 (m, 2 Н); 2,51 (m, 2 Н); 2,35 (m, 4 Н); 2,20 (s, 3 Н); 1,92 (m, 3 Н); 1,53 (m, 4 Н); 1,38 (s, 9H). Препарат XXXI. 8-Метил-3-(1-пиперазинил)-8-азабицикло[3.2.1]октан. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXX, был получен требуемый продукт в виде желтого масла (выход = 99%). 1 Н ЯМР (300 МГц, ДМСО) : 3,70 (m, 2 Н); 3,03 (m, 4 Н); 2,75 (m, 1 Н); 2,61 (m, 4 Н); 2,53 (s, 3 Н); 2,10 (т, 2 Н); 1,75 (т, 6 Н). Препарат XXXII. 4-(1-Азабицикло[2.2.2]окт-3-ил)гексагидро-1 Н-1,4-диазепин-1-карбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения 11-гомопиперазинкарбоновой кислоты трет-бутиловый эфир, был получен требуемый продукт в виде бесцветной пасты (выход = 67%). 1 Н ЯМР (300 МГц, ДМСО) : 3,34 (m, 4 Н); 2,81-2,35 (m, 11 Н); 1,88 (m, 1 Н); 1,65 (m, 4 Н); 1,39 (s,9 Н); 1,34(m, 1 Н); 1,18 (m,1 Н). Препарат XXXIII. 3-(Гексагидро-1 Н-1,4-диазепин-1-ил)-1-азабицикло[2.2.2]октан. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXXII, был получен требуемый продукт в виде желтого масла (выход = 98%). 1 Н ЯМР (250 МГц, ДМСО) : 3,41 (m, 1 Н); 3,11 (m, 8 Н); 2,96 (m, 1 Н); 2,78 (m, 4 Н); 2,52 (m, 1 Н); 2,24(m, 1 Н); 1,89 (m, 4 Н); 1,85 (m, 1 Н); 1,62 (m, 1 Н). С использованием процедуры, аналогичной примеру 1, применяя в качестве исходных соединений производные пиперазина, известные из литературы или описанные выше, были получены следующие соединения.- 12008921 Пример 8. 1-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-4-[3-(1-пирролидинил)пропил]пиперазина бис-трифторацетат. Выход = 90% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,12 (s, 2H); 3,81 (s, 3H); 3,78 (m, 4H); 3,62 (t, 2 Н); 3,34 (t, 2 Н); 3,27 (m, 12 Н); 2,73 (s, 3 Н); 2,57 (s, 6 Н); 2,22 (m, 2 Н); 2,03 (m, 4 Н). Пример 9. 1-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]-ацетил]-4-[2-(4-морфолинил)этил]пиперазина бис-трифторацетат. Выход = 51% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,75 (s, 2H); 4,11 (s, 2H); 3,92 (m, 4H); 3,81 (s, 3H); 3,76 (m, 4 Н); 3,61 (t, 2 Н); 3,48 (m, 4 Н); 3,35 (t, 2 Н); 3,27 (m, 8 Н); 2,72 (s, 3 Н); 2,57 (s, 6H). Пример 10. 1-2-4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-4-[2-(1-пиперидинил)этил]пиперазина бис-трифторацетат. Выход = 92% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,10 (s, 2H); 3,81 (s, 3H); 3,81 (m, 4H); 3,61 (t, 2 Н); 3,40 (m, 2 Н); 3,34 (m, 4 Н); 3,24 (m, 4 Н); 3,09 (m, 4 Н); 2,74 (s, 3H); 2,57 (s, 6H); 1,90 (m, 4 Н); 1,64 (m, 2 Н). Пример 11. 1-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-4-[3-(1-пиперидинил)пропил]пиперазина бис-трифторацетат. Выход = 85% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,10 (s, 2H); 3,96 (s, 3 Н); 3,80 (m, 2H); 3,60 (t, 2H); 3,50 (m, 4H); 3,30 (t, 2H); 3,15 (m, 2H); 3,10 (m, 4H); 2,80 (m, 4H); 2,75 (s; 3 Н); 2,55 (s, 6H); 2,20 (m, 2H); 1,93 (m, 5H); 1,37 (m, 1H). Пример 12. 1-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-4-[3-(диметиламино)пропил]пиперазина бис-трифторацетат. Выход = 74% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,11 (s, 2H); 3,81 (s, 3 Н); 3,78 (m, 4H); 3,63 (t, 2H); 3,31 (t, 2H); 3,22 (m, 4H); 3,15 (m, 4H); 2,81 (s, 6H); 2,74 (s, 3 Н); 2,57 (s, 6H); 2,23 (m, 2H). С использованием процедуры, аналогичной примерам 3 и 4, применяя в качестве исходных соединений производные пиперазина или гомопиперазина, описанные выше, были получены следующие соединения. Пример 13. 4-Метокси-N,2,6-триметил-N-[2-[2-[4-(1-метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]бензолсульфонамида бис-трифторацетат. Выход = 74% (бесцветная паста). 1 Н ЯМР (300 МГц, CD3CN) : 6,74 (s, 2H); 4,11 (s, 2H); 3,81 (s, 3 Н); 3,80 (m, 4H); 3,77 (d, 2 Н); 3,64 (m, 2 Н); 3,55 (m, 1 Н); 3,34 (t, 2 Н); 3,26 (m, 4 Н); 3,01 (m, 2 Н); 2,79 (s, 3 Н); 2,74 (s, 3 Н); 2,57 (s, 6 Н); 2,29 (m, 4 Н). Пример 14. 4-Метокси-N,2,6-триметил-N-[2-[2-[4-(8-метил-8-азабицикло[3.2.1]-окт-3-ил)-1-пиперазинил]-2 оксоэтокси]этил]бензолсульфонамида фумарат. Выход = 62% (белое твердое вещество). Температура плавления: 88-90 С. Пример 15. 1-(1-Азабицикло[2.2.2]окт-3-ил)гексагидро-4-2-(4-метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-1 Н-1,4-диазепина фумарат. Выход = 47 % (белое твердое вещество). Температура плавления: 90 С Препарат XXXIV. 4-[1-(1,1-диметилэтил)-4-пиперидинил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходных соединений 1-(1,1-диметилэтил)-4-пиперидинон и бензоловый эфир 1-пиперазинкарбоновой кислоты,был получен требуемый продукт в виде белого твердого вещества (выход = 56%). Температура плавления: 70-72 С. Препарат XXXV. 1-[1-(1,1-Диметилэтил)-4-пиперидинил]пиперазин. Был приготовлен раствор 570 мг (1,59 мМ) соединения, полученного согласно процедуре получения препарата XXXIV, в 20 мл метанола, и к нему было добавлено 114 мг 10% палладия на углероде. Смесь- 13008921 взбалтывали в атмосфере азота в течение 2 ч при температуре окружающей среды и атмосферном давлении. Катализатор удалили посредством фильтрации, а фильтрат сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола/водного раствора аммиака (90/10/1; объем/объем/объем). В результате было получено 270 мг нужного вещества в виде белого порошка (выход = 75%). Температура плавления: 106 С. Препарат XXXVI. 4-(9-Метил-9-азабицикло[3.3.1]нон-3-ил)-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходных соединений 9-метил-9-азабицикло[3.3.1]нонан-3-он и бензиловый эфир 1-пиперазинкарбоновой кислоты,был получен требуемый продукт в виде светло-желтого твердого вещества (выход = 18%). Температура плавления: 74 С. Препарат XXXVII. 1-(9-Метил-9-азабицикло[3.3.1]нон-3-ил)пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXXVI, был получен требуемый продукт в виде желтого масла (выход = 100%). 1 Н ЯМР (300 МГц, D2O) : 3,74 (m, 2 Н); 3,59 (m, 1 Н); 3,43 (m, 4 Н); 3,15 (m, 4 Н); 3,01 и 2,97 (2s, 3 Н); 2,46 (dd, 1 Н); 2,30 (m, 2 Н); 2,10 (m, 4 Н); 1,83 (m, 3 Н). Препарат XXXVIII. 4-(1,2,2,6,6-Пентаметил-4-пиперидинил)-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходных соединений 1,2,2,6,6-пентаметил-4-пиперидинон и бензиловый эфир 1-пиперазинкарбоновой кислоты,был получен требуемый продукт в виде бесцветного масла (выход = 52%). 1 Н ЯМР (300 МГц, ДМСО) : 7,36 (m, 5 Н); 5,07 (s, 2 Н); 3,37 (m, 4 Н); 2,85 (m, 1 Н); 2,50 (m, 7 Н); 1,80 (m, 2 Н); 1,48 (m, 2 Н); 1,28 (s, 6H); 1,21 (s, 6H). Препарат XXXIX. 1-(1,2,2,6,6-Пентаметил-4-пиперидинил)пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XXXVIII, был получен требуемый продукт в виде белого твердого вещества (выход = 35%). Температура плавления: 65 С. Препарат XL. 4-[1-(1-Метилэтил)-4-пиперидинил]-1-пиперазинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения 1-(1-метилэтил)-4-пиперидинон, был получен требуемый продукт в виде желтого твердого вещества (выход =31%). Температура плавления: 53 С. Препарат XLI. 1-[1-(1-Метилэтил)-4-пиперидинил]пиперазина тригидрохлорид. Был приготовлен раствор 247 мг (0,79 мМ) соединения, полученного в соответствии с процедурой получения препарата XL, в 1 мл метанола, и к раствору было добавлено 15 мл 2,3 N раствора хлористого водорода в этилацетате. Смесь взбалтывали в течение 4 ч при температуре окружающей среды. Реакционную смесь сконцентрировали при пониженном давлении. В результате было получено 239 мг нужного соединения в виде белого порошка (выход = 75%). Температура плавления: 262 С. Препарат XLII. 4-(1-Циклопропил-4-пиперидинил)-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения 1-циклопропил)-4-пиперидинон, был получен требуемый продукт в виде белого твердого вещества (выход = 67%). Температура плавления: 88 С. Препарат XLIII. 1-(1-Циклопропил-4-пиперидинил)пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XLII, был получен требуемый продукт в виде белого твердого вещества (выход = 92%). Температура плавления: 58 С.- 14008921 Препарат XLIV. 4-(1-Метил-4-пиперидинил)гексагидро-1H-1,4-диазепин-1-карбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата XXXII, используя в качестве исходного соединения 1-метил-4-пиперидинон, был получен требуемый продукт в виде желтого масла (выход = 78%). 1 Н ЯМР (250 МГц, CDCl3) : 3,43 (m, 4 Н); 3,10 (dm, 2 Н); 2,70 (m, 4 Н); 2,61 (m, 1 Н); 2,44 (s, 3 Н); 2,28(m, 2 Н); 1,86 (m, 6 Н); 1,45 (s, 9H). Препарат XLV. 1-(1-Метил-4-пиперидинил)гексагидро-1H-1,4-диазепина тригидрохлорид. Способом, аналогичным процедуре получения препарата XLI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XLIV, был получен требуемый продукт в виде бежевого твердого вещества (выход = 99%). Температура плавления: 186 С. Препарат XLVI. 4-(8-Циклопропил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения 8-циклопропил-8-азабицикло[3.2.1]октан-3-она, был получен требуемый сложный эфир в виде белой пасты (выход = 45%). 1 Н ЯМР (300 МГц, ДМСО) : 3,24 (m, 6 Н); 2,50 (m, 5 Н); 2,34 (t, 4 Н); 1,87 (m, 3 Н); 1,48 (dd, 6 Н); 1,38 (s, 9 Н); 0,36 (m, 2 Н); 0,25 (m, 2 Н). Препарат XLVII. 8-Циклопропил-3-(1-пиперазинил)-8-азабицикло[3.2.1]октан. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XLVI, был получен требуемый продукт в виде белого твердого вещества (выход = 95%). 1 Н ЯМР (250 МГц, CDCl3) : 3,37 (m, 2 Н); 2,94 (t, 2 Н); 2,58 (m, 4 Н); 2,51 (m, 1 Н); 1,96 (m, 3 Н); 1,74 (t, 2 Н); 1,54 (m, 4 Н); 0,43 (d, 4H). Препарат XLVIII. 4-[1-[(1,1-Диметилэтокси)карбонил]-4-пиперидинил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXXIV, используя в качестве исходного соединения трет-бутиловый эфир 4-оксо-1-пиперидинкарбоновой кислоты, был получен требуемый продукт в виде желтого масла (выход = 30%). 1 Н ЯМР (250 МГц, ДМСО) : 7,35 (m, 5 Н); 5,06 (s, 2 Н); 3,93 (d, 2 Н); 3,36 (m, 4 Н); 2,68 (t, 2 Н); 2,44 (t, 4 Н); 2,37 (m, 1 Н); 1,66 (т, 2 Н); 1,38 (s, 9 Н); 1,26 (m, 2 Н). Препарат IL. 4-(4-Пиперидинил)-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XLVIII, был получен требуемый продукт в виде желтого масла (выход = 100%). 1 Н ЯМР (250 МГц, ДМСО) : 8,91 (m широкая, h); 8,63 (m широкая, 1 Н); 7,36 (m, 5 Н); 5,11 (s, 2 Н); 3,80 (m, 2 Н); 3,45 (m, 4 Н); 3,22 (m, 5 Н); 2,92 (q, 2H); 2,20 (d, 2H); 1,82 (dq, 2 Н). Препарат L. 4-(1-Этил-4-пиперидинил)-1-пиперазикарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXXIV, используя в качестве исходных соединений ацетальдегид и соединение, полученное в соответствии с процедурой получения препаратаIL, был получен требуемый продукт в виде бесцветного масла (выход = 72%). 1 Н ЯМР (250 МГц, ДМСО) : 7,34 (m, 5 Н); 5,07 (s, 2 Н); 3,90 (m, 7 Н); 3,02 (q, 2H); 2,84 (m, 2 Н); 2,45 (t, 4 Н); 1,91 (m, 2 Н); 1,63 (m, 2 Н); 1,19 (t, 3 Н). Препарат LI. 1-(1-Этил-4-пиперидинил)пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата L, был получен требуемый продукт в виде желтого масла (выход = 71%). 1 Н ЯМР (250 МГц, ДМСО) : 2,90 (m, 6 Н); 2,52 (m, 4 Н); 2,30 (q, 2H); 2,17 (tt, 1H); 1,85 (dt, 2 Н); 1,69 (m, 2 Н); 1,38 (dq, 2H); 0,97 (t, 3 Н).- 15008921 Препарат LII. 4-[8-[(1,1-Диметилэтокси)карбонил]-8-азабицикло[3.2.1]окт-3-ил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXVIII, используя в качестве исходного соединения трет-бутиловый эфир 3-оксо-8-азабицикло[3.2.1]октан-8-карбоновой кислоты, был получен требуемый эфир в виде белого твердого вещества (выход = 40%). 1 Н ЯМР (250 МГц, CD3CN) : 7,33 (m, 5 Н); 5,07 (s, 2 Н); 4,13 (m, 2 Н); 3,37 (t, 4H); 2,80 (hep, 1 Н); 2,43 (t, 4 Н); 1,87 (m, 2 Н); 1,62 (m, 6 Н); 1,42 (s, 9H). Препарат LIII. 4-(8-Азабицикло[3.2.1]окт-3-ил)-1-пиперазинкарбоновой кислоты фенилметилового эфира гидрохлорид. Способом, аналогичным процедуре получения препарата XLI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LII, был получен требуемый продукт в виде бесцветного масла (выход = 96%). 1 Н ЯМР (250 МГц, ДМСО) : 11,78 (m широкая, 1 Н); 9,45 (s, 2 Н); 7,38 (m, 5 Н); 5,11 (s, 3 Н); 4,09 (m, 4 Н); 3,95 (m, 1 Н); 3,43 (m, 4 Н); 3,07 (m, 2 Н); 2,22 (m, 4 Н); 1,92 (m, 4 Н). Препарат LIV. 4-(8-Этил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXXIV, используя в качестве исходных соединений ацетальдегид и соединение, полученное в соответствии с процедурой получения препаратаLIII, был получен требуемый продукт в виде бесцветного масла (выход = 99%). 1 Н ЯМР (250 МГц, CD3CN) : 7,33 (m, 5 Н); 5,07 (s, 2 Н); 3,39 (m, 6 Н); 2,63 (m, 1 Н); 2,56 (q, 2 Н); 2,42 (t, 4 Н); 1,93 (m, 2 Н); 1,61 (m, 6 Н); 1,06 (t, 3 Н). Препарат LV. 1-(8-Этил-8-азабицикло[3.2.1]окт-3-ил)пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LIV, был получен требуемый продукт в виде бесцветного масла (выход = 78%). 1 Н ЯМР (300 МГц, CDCl3): 3,57 (m, 2H); 2,94 (t, 2H); 2,71 (q, 2H); 2,59 (m, 4H); 2,52 (m, 1 Н); 1,99(m, 4H); 11,64 (m, 4H). Препарат LVI. 4-[8-(1-Метилэтил)-8-азабицикло[3.2.1]окт-3-ил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXXIV, используя в качестве исходных соединений ацетон и соединение, полученное в соответствии с процедурой получения препарата LIII,был получен требуемый продукт в виде бесцветного масла (выход = 77%). 1 Н ЯМР (250 МГц, CDCl3) : 7,32 (m, 5 Н); 5,12 (s, 2 Н); 3,64 (m, 2 Н); 3,49 (t, 4H); 2,92 (quin, 1 Н); 2,59 (hep, 1 Н); 2,47 (m, 4 Н); 1,99 (m, 2 Н); 1,82 (dt, 2 Н); 1,63 (m, 2 Н); 1,48 (m, 2H);1,14(d, 6H). Препарат LVII. 1-[8-(1-Метилэтил)-8-азабицикло[3.2.1]окт-3-ил]-1-пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LVI, был получен требуемый продукт в виде бесцветного масла (выход = 82%). 1 Н ЯМР (250 МГц, CDCl3) : 3,79 (m, 2H); 3,05 (quin, 1H); 2,98 (m, 4H); 2,71 (hep, 1H); 2,61 (m, 4H); 2,13 (m, 2H); 1,95(m, 2H); 1,65 (m, 4H); 1,29 (d, 6H). Препарат LVIII. Гексагидро-1-метил-4-(1-оксо-2-пропенил)-1 Н-1,4-диазепин. Был приготовлен раствор 20 г (175 мМ) N-метилгомопиперазина в 100 мл дихлорметана, к которому по каплям при 0 С добавили раствор 15,85 г (175 мМ) акрилоилхлорида в 20 мл дихлорметана. Реакционную смесь взбалтывали в течение 1 ч при 0 С, а затем в течение 2 ч при температуре окружающей среды, после чего гидролизовали раствором 12 г карбоната натрия в 20 мл воды. Смесь декантировали,органическую фазу один раз промыли водой, а затем высушили над сульфатом магния и сконцентрировали при пониженном давлении. В результате было получено 23 г требуемого соединения в виде оранжевого масла, которое без дополнительной очистки было использовано на следующей стадии. Препарат LIX. 4-[3-(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)-3-оксопропил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Был приготовлен раствор 7 г (41 мМ) соединения, полученного в соответствии с процедурой получения препарата LVIII, в 100 мл толуола, к которому было добавлено 11 г (50 мМ) бензилового эфира 1 пиперазинкарбоновой кислоты. Реакционную смесь взбалтывали в течение 16 ч при кипении растворителя, а затем сконцентрировали при пониженном давлении. Остаток перенесли в этилацетат, а органиче- 16008921 скую фазу один раз промыли водой, затем высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью толуола/изопропанола/водного раствора аммиака (80/20/1; об./об./об.). В результате было получено 4,1 нужного соединения в виде желтого масла (выход = 26%). 1 Н ЯМР (250 МГц, ДМСО) : 7,36 (m, 5 Н); 5,06 (s, 2 Н); 3,47 (m, 4 Н); 3,37 (m, 4 Н); 2,50 (m, 8 Н); 2,35 (m, 4 Н); 2,24 и 2,21 (2s, 3 Н); 1,75 (m, 2 Н). Препарат LX. 1-[3-(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)-3-оксопропил]пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LIX, был получен требуемый продукт в виде бесцветного масла (выход = 65%). 1 Н ЯМР (250 МГц, ДМСО) : 3,48 (m, 4 Н); 2,67 (t, 4 Н); 2,48 (m, 8 Н); 2,30 (t, 4H); 2,25 и 2,22 (2s, 3H); 1,73 (m, 2 Н). Препарат LXI. 1-[3-(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)пропил]пиперазин. Была приготовлена суспензия 120 мг (3,1 мМ) алюмогидрида лития в 3 мл тетрагидрофурана (ТГФ),и к ней был добавлен раствор 800 мг (3,1 мМ) соединения, полученного в соответствии с процедурой получения препарата LX, в 10 мл ТГФ. Реакционную смесь нагревали при слабом кипении растворителя в течение 4 ч, а затем охладили до температуры окружающей среды. К реакционной смеси добавили 200 мг глауберовой соли, а затем, примерно через 15 мин, добавили 50 мл этилацетата. Полученную суспензию профильтровали, а фильтрат сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола/водного раствора аммиака (80/20/1; объем/объем/объем). В результате был получен требуемый продукт в виде бесцветного масла (выход = 34%). 1 Н ЯМР (250 МГц, ДМСО) : 2,64 (t, 4 Н); 2,57 (m, 4 Н); 2,49 (m, 4 Н); 2,38 (t, 2H); 2,23 (m, 6 Н); 2,21 (s, 3H); 1,66 (quin, 2H); 1,52 (quin, 2H). Препарат LXII. 4-[2-(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)-2-оксоэтил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Был приготовлен раствор 10 г (87,5 мМ) N-метилгомопиперазина в 200 мл дихлорметана, к которому добавили 36,6 мл триэтиламина. Смесь охладили до -78 С, и по каплям добавили к ней 6,97 мл хлорацетилхлорида. Реакционную смесь взбалтывали в течение 1,5 ч при -78 С, а затем добавили к ней раствор 19,3 г (87,6 мМ) бензилового эфира 1-пиперазинкарбоновой кислоты в 10 мл дихлорметана. Затем смесь оставили до возвращения к комнатной температуре и продолжили взбалтывание в течение 15 ч. Далее среду гидролизовали раствором карбоната натрия. Смесь декантировали, органическую фазу один раз промыли водой, а затем высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола/водного раствора аммиака (90/10/5; об./об./об.). В результате был получен требуемый продукт в виде желтого масла (выход = 43%). 1 Н ЯМР (250 МГц, ДМСО) : 7,36 (m, 5 Н); 5,07 (s, 2 Н); 3,55 (m, 2 Н); 3,44 (m, 2 Н); 3,38 (m, 4 Н); 3,16 (d, 2 Н); 2,60 (m, 2 Н); 2,44 (m, 6 Н); 2,24 и 2,22 (2s, 3 Н); 1,76 (m, 2 Н). Препарат LXIII. 1-[2-(Гексагидро-4-метил-1 Н-1,4-диазепин-1-ил)-2-оксоэтил]пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXII, был получен требуемый продукт в виде бесцветного масла (выход = 60%). 1 Н ЯМР (250 МГц, ДМСО) :3,56 (m, 2 Н); 3,44 (m, 2 Н); 3,10 (d, 2H); 2,74 (dd, 4H); 2,61 (m, 1 Н); 2,44 (m, 4 Н); 2,39 (m, 3 Н); 2,25 и 2,22 (2s, 3 Н); 1,78 (m, 2 Н). Препарат LXIV. 1-[2-(Гексагидро-4-метил-1 Н-1,4-диазепин-1-ил)этил]пиперазин. Способом, аналогичным процедуре получения препарата LXI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXIII, был получен требуемый продукт в виде желтого масла (выход = 21%). 1 Н ЯМР (300 МГц, ДМСО) : 2,63 (m, 8 Н); 2,49 (m, 5 Н); 2,28 (m, 7 Н); 2,21 (s, 3H); 1,66 (quin, 2H). Препарат LXV. 1-(1-Оксо-2-пропенил)азетидин. Способом, аналогичным процедуре получения препарата LVIII, используя в качестве исходного соединения азетидин, был получен требуемый продукт в виде желтого масла, которое без дальнейшей очистки было использовано в реакции при получении следующего препарата.- 17008921 Препарат LXVI. 4-[3-(1-Азетидинил)-3-оксопропил]-1-пиперазинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата LIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXV, был получен требуемый продукт в виде желтого масла (выход = 14%). 1 Н ЯМР (250 МГц, ДМСО) : 7,34 (m, 5H); 5,06 (s, 2H); 4,09 (t, 2H); 3,80 (t, 2H); 3,35 (m, 4 Н); 2,48 (t, 2 Н); 2,33 (t, 4 Н); 2,16 (m, 4 Н). Препарат LXVII. 1-[3-(1-Азетидинил)-3-оксопропил]пиперазин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXVI, был получен требуемый продукт в виде желтого твердого вещества (выход = 100%). Температура плавления: 50 С. Препарат LXVIII. 1-[3-(1-Азетидинил)пропил]пиперазин. Способом, аналогичным процедуре получения препарата LXI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXVII, был получен требуемый продукт в виде желтого масла (выход = 30%). 1 Н ЯМР (300 МГц, ДМСО) : 3,19 (m широкая, 1 Н); 3,02 (t, 4H); 2,66 (t, 4H); 2,25 (m, 8 Н); 1,93 (quin,2H); 1,36 (quin, 2H). Препарат LXIX.-[(Диметиламино)метил]-4-пиперидинметанол. 20 г (83,6 мМ) 2-[(диметиламино)метил]-4-пиридинметанола дигидрохлорида растворили в 200 мл метанола при 50 С. Затем в атмосфере азота добавили 2 г оксида платины, и смесь взбалтывали в атмосфере азота под давлением 300 гПа (3 бара) при 50 С в течение 7 ч. Затем катализатор удалили посредством фильтрации, а фильтрат сконцентрировали при пониженном давлении. Твердый остаток растворили в 10 мл 10N раствора гидроксида натрия и 150 мл хлороформа. Органическую фазу отделили и промыли раствором хлорида натрия, высушили над сульфатом магния и сконцентрировали при пониженном давлении. В результате был получен требуемый продукт в виде масла, которое кристаллизовалось (выход = 87%). Температура плавления: 98 С. Препарат LXX. 4-(1-Пирролидинилметил)пиперидин. Способом, аналогичным процедуре получения препарата LXIX, используя в качестве исходного соединения 4-(1-пирролидинилметил)пиридин, был получен требуемый продукт в виде желтого масла. Препарат LXXI. 4-[(4-(1-Метилэтил)-1-пиперазинил]-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Приготовили смесь 827 мг (3,54 мМ) бензилового эфира 4-оксо-1-пиперидинкарбоновой кислоты,500 мг (3,9 мМ) N-изопропилпиперазина и 1,2 г (4,25 мМ) изопропоксида титана в 10 мл метанола. При перемешивании при комнатной температуре было добавлено 148 мг борогидрида натрия. Реакционную смесь выдержали при перемешивании в течение 16 ч, а затем разбавили 20 мл воды. Полученную суспензию профильтровали, а осадок промыли 30 мл этилацетата, который затем использовали для экстракции фильтрата. Полученную органическую фазу промыли водой, а затем высушили над сульфатом магния и сконцентрировали при пониженном давлении. Полученное желтое масло очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола(9/1; объем/объем). В результате было получено 235 мг нужного продукта в виде белого твердого вещества (выход = 19%). Температура плавления: 55 С. Препарат LXXII. 4-[4-(1-Метилэтил)-1-пиперазинил]пиперидин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXI, был получен требуемый продукт в виде белого твердого вещества (выход = 98%). Температура плавления: 65 С. Препарат LXXIII. 4-[(4-Метил-1-пиперазинил)метил]-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходных соединений N-метилпиперазин и бензиловый эфир 4-формил-1-пиперидинкарбоновой кислоты, был получен требуемый продукт в виде бесцветного масла (выход = 52%). 1 Н ЯМР (250 МГц, ДМСО) : 7,34 (m, 5 Н); 5,05 (s, 2 Н); 3,98 (m, 2 Н); 2,77 (m, 2 Н); 2,29 (m, 8 Н); 2,19 (s, 3 Н); 2,08 (d, 2 Н); 1,67 (m, 3 Н); 0,95 (m, 2 Н).- 18008921 Препарат LXXIV. 4-[(4-Метил-1-пиперазинил)метил]пиперидин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения сложный эфир, полученный в соответствии с процедурой получения препарата LXXIII, был получен требуемый продукт в виде бесцветного масла (выход = 77%). 1 Н ЯМР (250 МГц, ДМСО) : 2,89 (m, 2 Н); 2,51 (m, 2 Н); 2,28 (m, 8 Н); 2,12 (s, 3H); 2,05 (d, 2 Н); 1,55 (m, 3 Н); 1,02 (m, 2 Н). Препарат LXXV. 4-[(1-Азетидинил)метил]-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения азетидин, был получен требуемый продукт в виде бесцветного масла (выход = 69%). 1 Н ЯМР (300 МГц, ДМСО) : 7,34 (m, 5 Н); 5,04 (s, 2 Н); 3,95 (m, 2 Н); 3,06 (t, 4H); 2,75 (m, 2H);2,18(d, 2H); 1,94 (quin, 2 Н); 1,61 (m, 2 Н); 1,38 (m, 1 Н); 0,94 (m, 2 Н). Препарат LXXVI. 4-[(1-Азетидинил)метил]пиперидин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXV, был получен требуемый продукт в виде бесцветного масла (выход = 93%). 1 Н ЯМР (250 МГц, ДМСО) : 3,06 (t, 4 Н); 2,92 (m, 2 Н); 2,50 (m, 2 Н); 2,15 (d, 2H); 1,91 (quin, 2 Н); 1,59 (m, 2 Н); 1,30 (m, 1 Н); 1,00 (m, 2 Н). Препарат LXXVII. 4-[(Диметиламино)метил]-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата LXXIII, используя в качестве исходного соединения диэтиламин, был получен требуемый продукт в виде бесцветного масла (выход = 78%). 1 Н ЯМР (300 МГц, ДМСО) : 7,35 (m, 5 Н); 5,05 (s, 2 Н); 3,97 (m, 2 Н); 2,79 (m, 2 Н); 2,09 (s, 6 Н); 2,02 (d, 2 Н); 1,68 (d, 2 Н); 1,61 (m, 1H); 0,96 (m, 2 Н). Препарат LXXVIII. 4-[(Диметиламино)метил]пиперидин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата LXXVII, был получен требуемый продукт в виде бесцветного масла (выход = 90%). 1 Н ЯМР (300 МГц, ДМСО) : 2,91 (m, 2H); 2,43 (m, 2H); 2,08 (s, 6H); 2,01 (d, 2H); 1,59 (m, 2 Н); 1,49 (m, 1 Н); 0,96 (dq, 2H). Препарат LXXIX. 4-[(4-Этил-1-пиперазинил)метил]-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXIII, используя в качестве исходных соединений N-этилпиперазин и трет-бутиловый эфир 4-формил-1-пиперидинкарбоновой кислоты, был получен требуемый продукт в виде бесцветного масла (выход = 78%). 1 Н ЯМР (300 МГц, ДМСО) : 3,90 (m, 2 Н); 2,67 (m, 2 Н); 2,29 (m, 10 Н); 2,09 (d, 2H); 1,63 (m, 3 Н); 1,38 (s, 9 Н); 0,96 (t, 3 Н); 0,85 (m, 2 Н). Препарат LXXX. 4-[(4-Этил-1-пиперазинил)метил]пиперидин. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXIX, был получен требуемый продукт в виде бесцветного масла (выход = 76%). 1 Н ЯМР (250 МГц, ДМСО) : 2,95 (m, 2 Н); 2,51 (m, 2 Н); 2,42 (m, 10 Н); 2,05 (d, 2H); 1,54 (m, 3 Н); 1,03 (m, 2 Н); 0,99 (t, 3 Н). Препарат LXXXI. 4-[(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)метил]-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXIX, используя в качестве исходного соединения N-метилгомопиперазин, был получен требуемый продукт в виде бесцветного масла (выход = 83%). 1 Н ЯМР (300 МГц, ДМСО) : нет результатов 1 Н ЯМР. Препарат LXXXII. 4-[(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)метил]пиперидин. Способом, аналогичным процедуре получения препарата XXIX, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXXI, был получен требуемый продукт в виде бесцветного масла (выход = 23%). 1 Н ЯМР (250 МГц, ДМСО): 3,03 (m, 2 Н); 2,57 (m, 5 Н); 2,50 (m, 5 Н); 2,25 (s, 2H); 2,22 (s, 3 Н); 1,68 (m, 4 Н); 1,63 (m, 1 Н); 1,08 (m, 2 Н).- 19008921 Препарат LXXXIII. 4-(Гексагидро-4-метил-1 Н-1,4-диазепин-1-ил)-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходных соединений N-метилгомопиперазин и трет-бутиловый эфир 4-оксо-1-пиперидинкарбоновой кислоты, был получен требуемый продукт в виде желтого масла (выход = 36%). 1 Н ЯМР (250 МГц, CDCl3) : 4,15 (m, 2 Н); 2,82 (m, 4 Н); 2,70 (m, 7 Н); 2,42 (s, 3H); 1,87 (m, 2 Н); 1,98 (m, 2 Н); 1,45 (s, 9 Н); 1,40 (m, 2 Н). Препарат LXXXIV. 4-(Гексагидро-4-метил-1 Н-1,4-диазепин-1-ил)пиперидина тригидрохлорид. 409 мг (1,37 мМ) соединения, полученного в соответствии с процедурой получения препаратаLXXXIII, растворили в 1 мл метанола и добавили 27 мл 2,3 N раствора хлористого водорода в этилацетате. Смесь взбалтывали при температуре окружающей среды в течение 12 ч, а затем сконцентрировали при пониженном давлении. В результате был получен требуемый продукт в виде бежевой пены (выход = 99%). 1 Н ЯМР (250 МГц, ДМСО) : 3,88 (m, 4 Н); 3,62 (m, 1 Н); 3,43 (m, 6 Н); 2,94 (m, 2 Н); 2,82 (s, 3 Н); 2,31 (m, 4 Н); 2,10 (m, 2 Н). Препарат LXXXV. 4-(4-Циклопропил-1-пиперазинил)-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходного соединения N-циклопропилпиперазин, был получен требуемый продукт в виде белого твердого вещества(выход = 62%). Температура плавления: 64 С. Препарат LXXXVI. 4-(4-Циклопропил-1-пиперазинил)пиперидин. Способом, аналогичным процедуре получения препарата LXXII, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXXV, был получен требуемый продукт в виде белого твердого вещества (выход = 90%). Температура плавления: 107 С. Препарат LXXXVII. 4-[4-(1,1-Диметилэтил)-1-пиперазинил]-1-пиперидинкарбоновой кислоты фенилметиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходного соединения N-трет-бутилпиперазин, был получен требуемый продукт в виде белого твердого вещества(выход = 50%). Температура плавления: 84 С. Препарат LXXXVIII. 4-[4-(1,1-Диметилэтил)-1-пиперазинил]пиперидин. Способом, аналогичным процедуре получения препарата LXXII, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата LXXXVII, был получен требуемый продукт в виде белого твердого вещества (выход = 75%). Температура плавления: 82 С. Препарат LXXXIX. 4-(4-Пиперидинил)-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Был приготовлен раствор 41 г (0,17 М) 4,4'-бипиперидина дигидрохлорида в 250 мл этанола и 250 мл 2N раствора гидроксида натрия. Медленно, при 0 С, был добавлен раствор 18,5 г (0,085 М) третбутилдикарбоната в 100 мл этанола. Реакционную смесь взбалтывали в течение 1 ч при 10 С, а затем удалили этанол в испарителе при пониженном давлении. Остаток водной фазы насытили хлоридом натрия и экстрагировали этилацетатом. Полученную органическую фазу высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола/водного раствора аммиака(8/2/0,4; объем/объем/объем). В результате было получено 16,5 г нужного соединения в виде белого твердого вещества (выход = 72%). Температура плавления: 70-71 С. Препарат ХС. 4-(1-Этил-4-пиперидинил)-1-пиперидинкарбоновой кислоты 1,1-диметиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходных соединений эфир, полученный в соответствии с процедурой получения препарата LXXXIX, и ацетальдегид, был получен требуемый продукт в виде белого твердого вещества (выход = 87%). Температура плавления: 68-70 С. Препарат XCI. 4-(1-Этил-4-пиперидинил)пиперидина дигидрохлорид. Способом, аналогичным процедуре получения препарата LXXXIV, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата ХС, был получен требуемый продукт в виде белого твердого вещества (выход = 100%). Температура плавления: 280 С.- 20008921 Препарат ХСII. 4-[1-(1-Метилэтил)-4-пиперидинил]-1-пиперидинкарбоновой кислоты 1,1-диметиловый эфир. Способом, аналогичным процедуре получения препарата ХС, используя в качестве исходных соединений эфир, полученный в соответствии с процедурой получения препарата LXXXIX, и ацетон, был получен требуемый продукт в виде бесцветного масла (выход = 69%). 1 Н ЯМР (250 МГц, CDCl3) : 4,10 (m, 2 Н); 3,52 (m, 1 Н); 3,47 (m, 2 Н); 2,55 (m, 4 Н); 1,88 (m, 4 Н); 1,85 (m, 4 Н); 1,45 (s, 9H); 1,30 (d, 6H); 1,12 (m, 2 Н). Препарат XCIII. 4-[1-(1-Метилэтил)-4-пиперидинил]пиперидина дигидрохлорид. Способом, аналогичным процедуре получения препарата LXXXIV, используя в качестве исходного соединения сложного эфира, полученного в соответствии с процедурой получения препарата ХСII, был получен требуемый продукт в виде белого твердого вещества (выход = 89%). Температура плавления: 250 С. Препарат XCIV. 4-(1-Циклопропил-4-пиперидинил)-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. 150 мг (0,56 мМ) соединения, полученного согласно процедуре получения препарата LXXXIX, растворили в 5 мл метанола и добавили 320 мл уксусной кислоты, 200 мг молекулярного сита (3), а затем 562 мкл (2,79 мМ) 1-этокси-1-(триметилсилилокси)циклопропана и 141 мг (2,23 мМ) борогидрида натрия. Реакционную смесь нагревали при слабом кипении в течение 20 ч, а затем охладили и профильтровали. Фильтрат сконцентрировали при пониженном давлении, а остаток от испарения растворили в 20 мл этилацетата. Эту органическую фазу промыли 2N раствором гидроксида натрия, а затем - насыщенным раствором хлорида натрия, высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола (95/5; объем/объем). В результате было получено 110 мг нужного соединения в виде белого порошка (выход = 64%). 1 Н ЯМР (250 МГц, CDCl3) : 4,10 (m, 2 Н); 3,05 (m, 4 Н); 2,65 (t, 2H); 2,09 (t, 2H); 1,67 (m, 4 Н); 1,55 (m, 1 Н); 1,45 (s, 9 Н); 1,22 (m, 6 Н); 0,47 (m, 4 Н). Препарат XCV. 4-(1-Циклопропил-4-пиперидинил)пиперидина дигидрохлорид. Способом, аналогичным процедуре получения препарата LXXXIV, используя в качестве исходного соединения эфир, полученный в соответствии с процедурой получения препарата XCIV, был получен требуемый продукт в виде белой пасты (выход = 99%). 1 Н ЯМР (250 МГц, ДМСО) : 10,50 (m широкая, 1H); 8,80 (m широкая, 2 Н); 3,45 (m, 2 Н); 3,16 (m, 2 Н); 2,81 (m, 2 Н); 2,73 (m, 3 Н); 1,90 (m, 4 Н); 1,60 (m, 2 Н); 1,35 (m, 4 Н); 1,10 (m, 2 Н); 0,78 (m, 2 Н). Препарат XCVI. 4-[2-(4-Пиперидинил)этил]-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXXIX, используя в качестве исходного соединения 4,4'-этилендипиперидина гидрохлорид, был получен требуемый продукт в виде белого твердого вещества (выход = 39%). Температура плавления: 92-94 С. Препарат XCVII. 4-[2-(1-Метил-4-пиперидинил)этил]пиперидин. Был приготовлен раствор 307 мг (1,04 мМ) сложного эфира, полученного согласно процедуре получения препарата XCVI, в 20 мл безводного тетрагидрофурана (ТГФ), и к нему порциями было добавлено 157 мг (4,14 мМ) алюмогидрида лития. Реакционную смесь взбалтывали в течение 10 ч при 70 С, а затем охладили и разбавили 30 мл ТГФ. Добавили 200 мг глауберовой соли, и смесь оставили в условиях взбалтывания при температуре окружающей среды на ночь, после чего профильтровали. Фильтрат сконцентрировали при пониженном давлении с получением 235 мг нужного продукта в виде белой пасты(выход = 99%). 1 Н ЯМР (300 МГц, ДМСО) : 3,16 (s, 2 Н); 2,80 (m, 2 Н); 2,70 (m, 2 Н); 2,38 (t, 2H); 2,10 (s, 3 Н); 1,76 (m, 2 Н); 1,58 (m, 3 Н); 1,42 (m, 1 Н); 1,11 (m, 8 Н); 0,94 (m, 2 Н). Препарат XCVIII. 4-[2-(4-Метил-1-пиперазинил)этил]пиридин. В пробирке смешали 2 мл (19 мМ) 4-винилпиридина, 3,16 мл (28,5 мМ) N-метилпиперазина и 200 мкл уксусной кислоты с 12 мл этанола. Пробирку закрыли и нагревали в течение 10 мин при 160 С в микроволновой печи. После охлаждения медленно добавили 20 мл 0,5N гидроксида натрия и экстрагировали смесь дихлорметаном. Отделенную органическую фазу высушили над сульфатом магния и сконцентрировали при пониженном давлении. В результате был получен требуемый продукт в виде желтого масла (выход = 86%). 1 Н ЯМР (250 МГц, ДМСО) : 8,43 (dd, 2H); 7,25 (dd, 2H); 2,73 (t, 2H); 2,52 (m, 2H); 2,48 (m, 4 Н); 2,30 (m, 4 Н); 2,13 (s, 3 Н).- 21008921 В ходе выполнения процедур, аналогичных процедуре получения препарата XCVIII, были получены следующие производные пиридина. Препарат IС. 4-[2-(1-Пиперидинил)этил]пиридин. Желтое масло (выход = 52%). 1 Н ЯМР (250 МГц, ДМСО) : 8,43 (dd, 2H); 7,24 (dd, 2H); 2,73 (t, 2H); 2,49 (m, 2H); 37 (t, 2H); 1,43 (m, 6 Н). Препарат С. 4-[2-[(Метил)(1-метилэтил)амино]этил]пиридин. Желтое масло (выход = 10%). 1 Н ЯМР (250 МГц, ДМСО) : 8,49 (d, 2H); 7,16 (d, 2H); 2,76 (hep, 1H); 2,65 (t, 2H); 2,56 (d, 2H); 2,15 (s, 3H); 0,90 (d, 6H). Препарат CI. 4-[2-(4-Морфолин)этил]пиридин. Желтое масло (выход = 72%) 1 Н ЯМР (250 МГц, ДМСО) : 8,44 (dd, 2H); 7,26 (dd, 2H); 3,05 (dd, 4H); 2,75 (t, 2H); 2,53 (m, 2H); 2,41 (dd, 2H). Препарат СII. 4-[2-(1-Ацетинидил)этил]пиридин. Желтое масло (выход = 62%). 1 Н ЯМР (300 МГц, ДМСО) : 8,43 (d, 2H); 7,22 (d, 2H); 3,07 (t, 4H); 2,53 (m, 4H); 1,91 (quin, 2H). Препарат CIII.(Метил)[2-(4-пиридинил)этил]карбаминовой кислоты 1,1-диметилэтиловый эфир. Желтое масло (выход = 83%). 1 Н ЯМР (300 МГц, ДМСО) : 8,45 (d, 2H); 7,21 (d, 2H); 3,42 (t, 2H); 2,76 (t, 2H); 2,75 (s, 3 Н); 1,23 (s, 9H). Препарат CIV. 4-[2-[(Метил)(этил)амино]этил]пиридин. Бесцветное масло (выход = 51%). 1 Н ЯМР (300 МГц, ДМСО) : 8,50 (d, 2H); 7,25 (d, 2H); 2,73 (t, 2H); 2,55 (t, 2H); 2,43 (q, 2 Н); 2,23 (s, 3 Н); 0,90 (t; 3 Н). Препарат СV. 4-[2-(Диэтиламино)этил]пиридин. Желтое масло (выход = 30%). 1 Н ЯМР (250 МГц, ДМСО) : 8,43 (dd, 2H); 7,24 (dd, 2H); 2,65 (m, 4H); 2,40 (q, 4H); 0,93 (t, 6H). Препарат CVI. 4-[2-(Гексагидро-4-метил-1H-1,4-диазепин-1-ил)этил]пиридин. Желтое масло (выход = 52%). 1 Н ЯМР (250 МГц, ДМСО) : 8,43 (d, 2 Н); 7,25 (d, 2 Н); 2,71 (m, 8 Н); 2,50 (m, 4 Н); 2,22 (s, 3H); 1,68 (m, 2 Н). Препарат СVII. 4-[2-(4-Метил-1-пиперазинил)этил]пиперидин. Способом, аналогичным процедуре получения препарата LXIX, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата XCVIII, был получен требуемый продукт в виде желтого твердого вещества (выход = 80%). Температура плавления: 111-112 С. Препарат СVIII. 4-[2-(Диметиламино)этил]пиперидин. Способом, аналогичным процедуре получения препарата CVII, используя в качестве исходного соединения 4-[2-(диметиламино)этил]пиридин, был получен требуемый продукт в виде бесцветного масла(выход = 96%). 1 Н ЯМР (300 МГц, ДМСО) : 2,86 (2 Н); 2,39 (dt, 2H); 2,18 (dd, 2H); 2,08 (s, 6H); 1,54 (dm, 2 Н); 1,27 (m, 3 Н); 0,96 (m, 2 Н). Препарат CIX. 4-[2-(1-Пирролидинил)этил]пиперидин. Способом, аналогичным процедуре получения препарата CVII, используя в качестве исходного соединения 4-[2-(1-пирролидинил)этил]пиридин, был получен требуемый продукт в виде бесцветного масла (выход = 88%). 1 Н ЯМР (300 МГц, ДМСО) : 2,86 (dm, 2 Н); 2,38 (m, 8 Н); 1,64 (m, 4 Н); 1,54 (dm, 2H); 1,32 (m, 3 Н); 0,96 (dq, 2H).- 22008921 Способом, аналогичным процедуре получения препарата CVII, используя в качестве исходных соединений соединения, полученные согласно процедурам получения препаратов IC-CVI, были получены следующие производные пиперидина: Препарат СХ. 4-[2-(1-Пиперидинил)этил]пиперидин. Желтое масло (выход = 92%). 1 Н ЯМР (300 МГц, ДМСО) : 3,10 (dm, 2 Н); 2,67 (dt, 2 Н); 2,27 (m, 6 Н); 1,70 (m, 2 Н); 1,47 (m, 5 Н); 1,35 (m, 4 Н); 1,23 (m, 2 Н). Препарат CXI. 4-[2-[(Метил)(1-метилэтил)амино]этил]пиперидин. Желтое масло (выход = 96%). 1 Н ЯМР (250 МГц, ДМСО) : 3,10 (d, 2 Н); 2,77 (m, 1 Н); 2,60 (m, 2 Н); 2,35 (t, 2H); 2,10 (s, 3 Н); 1,72 (m, 2 Н); 1,34 (m, 1 Н); 1,29 (t, 2 Н); 1,23 (m, 2 Н); 0,91 (d, 6H). Препарат СХII. 4-[2-(4-Морфолинил)этил]пиперидин. Бесцветное масло (выход = 98%). 1 Н ЯМР (300 МГц, ДМСО) : 3,54 (t, 4H); 2,86 (dt, 2H); 2,39 (dt, 2H); 2,28 (m, 4H); 2,25 (t, 2 Н); 1,54 (dm, 2 Н); 1,31 (m, 3 Н); 0,97 (m, 2 Н). Препарат CXIII. 4-[2-(1-Азетидинил)этил]пиперидин. Бесцветное масло (выход = 74%). 1 Н ЯМР (250 МГц, ДМСО) : 3,16 (t, 4 Н); 3,12 (m, 2 Н); 2,65 (m, 2 Н); 2,35 (t, 2H); 1,94 (quin, 2 Н); 1,85 (m, 2 Н); 1,35 (m, 1 Н); 1,23 (t, 2 Н); 1,15 (m, 2 Н). Препарат CXIV.(Метил)[2-(4-пиперидинил)этил]карбаминовой кислоты 1,1-диметилэтиловый эфир. Бесцветное масло (выход = 64%). 1 Н ЯМР (300 МГц, ДМСО) : 3,16 (t, 2H); 2,89 (dm, 2H); 2,73 (s, 3 Н); 2,40 (t, 2H); 1,38 (s, 9 Н); 1,35 (m, 2 Н); 0,96 (m, 2 Н). Препарат CXV. 4-[2-[(Метил)(этил)амино]этил]пиперидин. Бесцветное масло (выход = 98%). 1 Н ЯМР (300 МГц, ДМСО) : 3,13 (m, 2 Н); 2,68 (m, 2 Н); 2,32 (m, 4 Н); 2,11 (s, 3 Н); 1,85 (m, 2 Н); 1,51 (m, 1 Н); 1,34 (t, 2 Н); 1,24 (m, 2 Н); 0,96 (t, 3 Н). Препарат CXVI. 4-[2-(Диэтиламино)этил]пиперидин. Желтое масло (выход = 87%). 1 Н ЯМР (250 МГц, ДМСО) : 2,87 (dm, 2H); 2,40 (m, 8H); 1,54 (dm, 2H); 1,26 (m, 3 Н); 0,98 (m, 2 Н); 0,91 (t, 6H). Препарат CXVII. 4-[2-(Гексагидро-4-метил-1 Н-1,4-диазепин-1-ил)этил]пиперидин. Желтое масло (выход = 79%). 1 Н ЯМР (250 МГц, ДМСО) : 2,89 (d, 2 Н); 3,05 (m, 2 Н); 2,58 (m, 4 Н); 2,49 (m, 4 Н); 2,46 (m, 4 Н); 2,21 (s, 3 Н); 1,66 (m, 2 Н); 1,64 (m, 2 Н); 1,28 (m, 3 Н); 0,99 (m, 2 Н). Препарат CXVIII. 4-(2-Гидрокси-1,1-диметилэтил)-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXXIX, используя в качестве исходного соединения ,-диметил-4-пиперидинэтанол, был получен требуемый продукт в виде бесцветного масла(выход = 96%). 1 Н ЯМР (300 МГц, ДМСО) : 4,41 (t, 1H); 3,98 (d, 2H); 3,13 (d, 2H); 2,51 (m, 2H); 1,50 (d, 2 Н); 1,38 (s, 9 Н); 1,33 (m 1 Н); 1,04 (m, 2 Н); 0,93 (s, 6H). Препарат CXIX. 4-(1,1-Диметил-2-оксоэтил)-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Был приготовлен раствор 68 мкл (0,77 мМ) оксалилхлорида в 6 мл безводного дихлорметана. При 70 С было добавлено 82,5 мкл диметилсульфоксида, а затем, через 15 мин, 100 мг (0,39 мМ) было добавлено 100 мг (0,39 мМ) спирта, полученного в соответствии с процедурой получения препарата CXVIII, растворенного в 4 мл дихлорметана. Затем через 5 мин, добавили 270 мкл триэтиламина. Смесь взбалтывали в течение 5 мин при -70 С, а затем оставили до достижения температуры окружающей среды. После добавления 25 мл этилацетата эту органическую фазу промыли 10% раствором бикарбоната натрия, высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/этилацетата (85/15; об./об.). В результате было получено 80 мг нужного соединения в виде бесцветного масла (выход = 80%). Н ЯМР (250 МГц, ДМСО) : 9,44 (s, 1 Н); 3,96 (d, 2 Н); 2,59 (m, 2 Н); 1,69 (m, 1 Н); 1,50 (m, 2 Н); 1,38 (s, 9 Н); 1,07 (m, 2 Н); 0,93 (s, 6H). Препарат СХХ. 4-[2-(1-Азетидинил)-1,1-диметилэтил]-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата CXIX, и азетидина,был получен требуемый продукт в виде бесцветного масла (выход = 65%). 1 Н ЯМР (300 МГц, ДМСО) : 3,96 (d, 2H); 3,13 (t, 4H); 2,51 (m, 2H); 2,16 (s, 2H); 1,92 (quin, 2 Н); 1,55 (d, 2 Н); 1,39 (s, 9 Н); 1,35 (m, 1 Н); 1,05 (m, 2 Н); 0,70 (s, 6H). Препарат CXXI. 4-[2-(1-Азетидинил)-1,1-диметилэтил]пиперидина бис(трифторацетат). 520 мг (1,75 мМ) соединения, полученного в соответствии с процедурой получения препарата СХХ,смешали с 3 мл трифторуксусной кислоты и 380 мкл анизола в 3 мл дихлорметана. Смесь взбалтывали в течение ночи при температуре окружающей среды, а затем сконцентрировали при пониженном давлении. Остаток растворили в 20 мл толуола и снова сконцентрировали при пониженном давлении. Неочищенный продукт растерли в 4 мл этилового эфира с получением твердого вещества, которое отделили посредством фильтрации и высушили. В результате было получено 683 мг нужного соединения (выход = 92%). Температура плавления: 138-140 С. Препарат СXXII. 4-[2-(4-Морфолинил)-1,1-диметилэтил]-1-пиперидинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным процедуре получения препарата СХХ, используя в качестве исходного соединения морфолин, был получен требуемый продукт в виде бесцветного масла (выход = 12%). 1 Н ЯМР (300 МГц, ДМСО) : 3,97 (d, 2H); 3,53 (t, 4H); 2,57 (m, 2H); 2,41 (t, 4H); 2,10 (s, 2 Н); 1,60 (d, 2 Н); 1,38 (s, 9 Н); 1,29 (m, 1 Н); 1,05 (m, 2 Н); 0,77 (s, 6H). Препарат CXXIII. 4-[2-(4-Морфолинил)-1,1-диметилэтил]пиперидина бис(трифторацетат). Способом, аналогичным процедуре получения препарата CXXI, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата СХХII, был получен требуемый продукт в виде светло-желтого твердого вещества (выход = 69%). Температура плавления: 158-160 С. Препарат CXXIV. 4-[2-(1-Пиперидинил)-1,1-диметилэтил]пиридин. Суспензию 70 г (0,58 М) 4-изопропилпиридина, 250 г (2 М) пиперидина гидрохлорида и 85 г параформальдегида в 600 мл 95%-ного этанола выдерживали при кипячении в течение 48 ч. Затем реакционную смесь сконцентрировали при пониженном давлении, а остаток растворили в 650 мл 3N раствора гидроксида натрия и трижды экстрагировали 250 мл этилацетата. Объединенные органические фазы промыли раствором хлорида натрия, высушили и сконцентрировали при пониженном давлении. Неочищенный продукт перегнали под вакуумом при 1 мм рт. ст., и фракцию, собранную между 80 и 125 С,очистили посредством хроматографии на силикагеле с элюированием смесью толуола/изопропанола(9/1; об./об.). В результате было получено 21,4 г нужного соединения в виде прозрачного желтого масла(выход = 17%). 1 Н ЯМР (300 МГц, ДМСО) : 8,49 (d, 2H); 7,32 (d, 2H); 2,53 (s, 2H); 2,20 (t, 4H); 1,39 (m, 4 Н); 1,36 (m, 2 Н); 1,29 (s, 6H). Препарат CXXV. 4-[2-(1-Пиперидинил)-1,1-диметилэтил]пиперидин. Способом, аналогичным процедуре получения препарата CVII, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата CXXIV, был получен требуемый продукт в виде желтого масла (выход = 33%). 1 Н ЯМР (300 МГц, ДМСО) : 2,94 (dm, 2H); 2,37 (m, 6H); 2,03 (s, 2H); 1,45 (m, 6H); 1,32 (m, 2 Н); 1,18 (m, 1 Н); 1,05 (m, 2 Н); 0,74 (s, 6H). Способом, аналогичным процедуре получения препаратов CXXIV и CXXV, было получено два следующих соединения: Препарат CXXVI. 4-[2-(1-Пирролидинил)-1,1-диметилэтил]пиперидин. Желтое масло (выход = 72%). 1 Н ЯМР (250 МГц, ДМСО) : 2,97 (d, 2 Н); 2,55 (m, 4 Н); 2,48 (m, 2 Н); 2,26 (s, 2H); 1,66 (m, 4 Н); 1,62 (d, 2 Н); 1,29 (m, 1 Н); 1,03 (m, 2 Н); 0,77 (s, 6H). Препарат CXXVII. 4-[2-(Диэтиламино)-1,1-диметилэтил]пиперидин. Бесцветное масло (выход = 79%). 1 Н ЯМР (300 МГц, ДМСО) : нет результатов 1 Н ЯМР.N,1-Диметил-N-[1-(фенил метил)-4-пиперидинил]-4-пиперидинамин. Способом, аналогичным процедуре получения препарата LXXI, используя в качестве исходных соединений N-метил-4-пиперидинон и 1-бензил-4-(метиламино)пиперидин, был получен требуемый продукт в виде желтого масла (выход = 66%). 1 Н ЯМР (300 МГц, ДМСО) : 7,28 (m, 5 Н); 3,41 (s, 2 Н); 2,76 (m, 4 Н); 2,40 (m, 2 Н); 2,12 (s, 3H); 2,10(s, 3H); 1,90 (dt, 2H); 1,81 (dt, 2H); 1,57 (dm, 4H); 1,44 (m, 4 Н). Препарат CXXIX.N,1-Диметил-N-(4-пиперидинил)-4-пиперидинамин. Был приготовлен раствор 980 мг (3,25 мМ) соединения, полученного в соответствии с процедурой получения препарата CXXVIII, в 60 мл метанола и к нему было добавлено 150 мг 10% палладия на углероде. Смесь взбалтывали в атмосфере водорода под давлением 50 фунтов на кв. дюйм (3,5 бара или 3450 гПа) при температуре окружающей среды в течение 10 ч. Катализатор удалили посредством фильтрации, а фильтрат сконцентрировали при пониженном давлении. Полученный неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола/водного раствора аммиака (97/3/0,3; об./об./об.). Требуемый продукт был получен в виде желтого масла (выход = 29%). 1 Н ЯМР (250 МГц, ДМСО) : 2,94 (d, 2H); 2,76 (d, 2H); 2,43 (m, 4H); 2,12 (s, 3H); 2,10 (s, 3 Н); 1,81 (m, 2 Н); 1,76 (m, 4 Н); 1,45 (m, 2 Н); 1,30 (m, 2 Н). Препарат СХХХ. 4-[2-Оксо-2-(4-метил-1-пиперазинил)этил]пиридин. Был приготовлен раствор 3 г (17,3 мМ) (4-пиридинил)уксусной кислоты в 50 мл тетрагидрофурана(ТГФ), и к нему по каплям при температуре окружающей среды добавили раствор 3,4 г (20,7 мМ) карбонилдиимидазола в 50 мл ТГФ. Реакционную смесь взбалтывали в течение 8 ч, после чего добавили раствор 1,73 г (17,3 мМ) N-метилпиперазина в 20 мл ТГФ. Реакционную смесь кипятили в течение 2 ч, а затем сконцентрировали при пониженном давлении. Остаток от испарения растворили в 80 мл 3N раствора гидроксида натрия и экстрагировали этилацетатом. Органическую фазу высушили над сульфатом магния и сконцентрировали при пониженном давлении. Неочищенный продукт очистили посредством хроматографии на силикагеле с элюированием смесью дихлорметана/метанола (99/1; об./об.). Требуемый продукт был получен в виде бесцветного масла (выход = 28%). 1 Н ЯМР (250 МГц, ДМСО) : 8,47 (dd, 2H); 7,23 (dd, 2H); 3,75 (s, 2H); 3,46 (t, 2H); 2,23 (t, 4H); 2,15(3H). Препарат CXXXI. 4-[2-Оксо-2-(4-метил-1-пиперазинил)этил]пиперидин. Способом, аналогичным процедуре получения препарата CVII, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата СХХХ, был получен требуемый продукт в виде бесцветного масла (выход = 59%). 1 Н ЯМР (250 МГц, ДМСО) : 3,42 (t, 4H); 3,28 (m, 2H); 2,87 (dt, 2H); 2,41 (dt, 2H); 2,24 (m, 6H); 2,16(s, 3 Н); 1,71 (m, 1 Н); 1,54 (dm, 2H); 1,06 (dq, 2H). Способами, аналогичными примерам 3 и 4, используя в качестве исходных соединений кислоты и амины, полученные выше (или амины, известные из литературы), были получены следующие соединения согласно настоящему изобретению: Пример 16.N-[2-[2-[4-[3-(1-Азетидинил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида дифумарат. Бежевое твердое вещество (выход = 34%). Температура плавления: 82 С. Пример 17.N-[2-[2-[4-(1-Метил-3-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 36%). Температура плавления: 60-65 С. Пример 18.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nциклопропил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 51%). Температура плавления: 185 С. Пример 19.N-[2-[2-[4-[2-(1-пирролидинил)этил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nциклопропил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 42%). Температура плавления: 141 С.N-[2-[2-[4-[(1-Метил-2-имидазолил)метил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 45%). Температура плавления: 60-65 С. Пример 21.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N-этил-2,6 диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 48%). Температура плавления: 206 С. Пример 22.N-[2-[2-[4-[3-(Диметиламино)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N-этил-2,6 диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 26%). Температура плавления: 60 С. Пример 23.N-[2-[2-[4-(9-Метил-9-азабицикло[3.3.1]нон-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида фумарат. Белое твердое вещество (выход = 73%). Температура плавления: 96 С. Пример 24.N-[2-[2-[4-[3-(1-Пирролидинил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N-этил-2,6 диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 63%). Температура плавления: 65 С. Пример 25.N-[2-[2-[4-[3-(1-Пирролидинил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nциклопропил-2,6-диметилбензолсульфонамида дифумарат. Твердое вещество цвета сурового полотна (выход = 61%). Температура плавления: 55 С. Пример 26.N-[2-[2-[4-(8-Циклопропил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4 метокси-N,2,6-триметилбензолсульфонамида фумарат. Белое твердое вещество (выход = 81%). Температура плавления: 75 С. Пример 27.N-[2-[2-[4-(8-Метил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nэтил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 64%). Температура плавления: 185 С. Пример 28.N-[2-[2-[4-(8-Метил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nциклопропил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 51%). Температура плавления: 160 С. Пример 29.N-[2-[2-[4-(1-Циклопропил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 60%). Температура плавления: 112-114 С. Пример 30. М-[2-[2-[4-(8-Метил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-М(1-метилэтил)-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 60%). Температура плавления: 168 С. Пример 31.N-[2-[2-[4-(1-Этил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида фумарат. Бежевое твердое вещество (выход = 48%). 1 Н ЯМР (250 МГц, ДМСО) : 6,80 (s, 2H); 6,53 (s, 2H); 4,05 (s, 2H); 3,80 (s, 3H); 3,53 (t, 2 Н); 3,39 (m, 2 Н); 3,29 (m, 2 Н); 3,22 (t, 2 Н); 3,12 (m, 2 Н); 2,70 (s, 3H); 2,62 (q, 2H); 2,53 (s, 6 Н); 2,48 (m, 4 Н); 2,29 (m, 3 Н); 1,77 (m, 2 Н); 1,52 (m, 2 Н); 1,07 (t, 2H).N-[2-[2-[4-[1-(1,1-Диметилэтил)-4-пиперидинил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 41%). Температура плавления: 230 С. Пример 33N-[2-[2-[4-[(1-Метил-4-пиперидинил)метил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида фумарат. Желтое твердое вещество (выход = 62%). Температура плавления: 50 С. Пример 34.N-[2-[2-[4-[3-(Диметиламино)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-2,6-дихлор-4-метокси-Nметил-бензолсульфонамида дифумарат. Белое твердое вещество (выход = 78%). Температура плавления: 60 С. Пример 35.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,6-дихлор-4-метокси-Nметил-бензолсульфонамида дифумарат. Белое твердое вещество (выход = 69%). Температура плавления: 125 С. Пример 36.N-[2-[2-[4-[2-(1-Метил-4-пиперидинил)этил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида дифумарат. Твердое вещество цвета сурового полотна (выход = 62%). Температура плавления: 90 С. Пример 37.N-[2-[2-[4-(1-Метил-4-пиперидинил)гексагидро-1 Н-1,4-диазепин-1-ил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида фумарат. Белое твердое вещество (выход = 56%). Температура плавления: 53 С. Пример 38.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N-(1-метилэтил)2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 41%). Температура плавления: 170 С. Пример 39.N-[2-[2-[4-[1-(1-Метилэтил)-4-пиперидинил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6 триметилбензолсульфонамида фумарат. Белое твердое вещество (выход = 81%). Температура плавления: 130 С. Пример 40.N-[2-[2-[4-[3-(1-Пиперидинил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N-этил-2,6 диметилбензолсульфонамида дифумарат. Твердое вещество цвета сурового полотна (выход = 60%). Температура плавления: 65 С. Пример 41.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,4-дихлор-6-метокси-Nметил-бензол-сульфонамида дифумарат. Белое твердое вещество (выход = 46%). Температура плавления: 202 С. Пример 42.N-[2-[2-[4-(1-Этил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,6-дихлор-4-метокси-Nметил-бензол-сульфонамида фумарат. Белое твердое вещество (выход = 68%). Температура плавления: 96-98 С. Пример 43.N-[2-[2-[4-3S)-1-Азабицикло[2.2.2]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nметил-2,6-дихлорбензолсульфонамида фумарат. Белое твердое вещество (выход = 36%). Температура плавления: 75-79 С. Способами, аналогичными примеру 2, используя в качестве исходных соединений кислоты и амины, полученные выше (или амины, известные из литературы), и с использованием кислоты, пригодной- 27008921 для образования соли очищенного основного соединения, были получены следующие соединения согласно настоящему изобретению. Пример 44.N-[2-[2-[4-[3-(4-Метил-1-пиперазинил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 30%). Температура плавления: 204 С. Пример 46.N-[2-[2-[4-(8-Этил-8-азабицикло[3.2.1]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метоксиN,2,6-триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 27%). Температура плавления:132 С. Пример 47.N-[2-[2-[4-[3-(4-Метилгексагидро-1H-1,4-диазепин-1-ил)пропил]-1-пиперазинил]-2-оксоэтокси]этил]4-метокси-N,2,6-триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 45%). Температура плавления: 169 С. Пример 48.N-[2-[2-[4-[8-(1-Метилэтил)-8-азабицикло[3.2.1]окт-3-ил]-1-пиперазинил]-2-оксоэтокси]этил]-4 метокси-N,2,6-триметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 35%). Температура плавления: 132 С. Пример 49.N-[2-[2-[4-[2-(4-Метилгексагидро-1H-1,4-диазепин-1-ил)этил]-1-пиперазинил]-2-оксоэтокси]этил]4-метокси-N,2,6-триметилбензолсульфонамида трифумарат. Белое твердое вещество (выход = 8 %). Температура плавления: 176 С. Способами, аналогичными примерам 5 и 4, используя в качестве исходных соединений кислоты,полученные выше, были получены два следующих соединения согласно настоящему изобретению: Пример 51.N-[2-[2-[4-3S)-1-Азабицикло[2.2.2]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nциклопропил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 37%). Температура плавления: 72 С [D25]=-11,4(c=0,5; CH3OH). Пример 52.N-[2-[2-[4-3S)-1-Азабицикло[2.2.2]окт-3-ил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-Nэтил-2,6-диметилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 32%). Температура плавления: 70 С [D25]=-11 (с=0,5; СН 3 ОН). Способами, аналогичными примеру 1, используя в качестве исходных соединений кислоту, полученную в соответствии с процедурой получения препарата III, и 1-[2-(диэтиламино)этил]пиперазин, было получено следующее соединение согласно настоящему изобретению: Пример 53.N-[2-[2-[4-[2-(Диэтиламино)этил]-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-N,2,6-триметилбензолсульфонамида фумарат. Белое пастообразное твердое вещество (выход = 77%).[2-[Метил(фенилметил)амино]этокси]уксусной кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным способу получения препарата II, используя в качестве исходного соединения 2-[метил(фенилметил)амино]этанол, был получен требуемый продукт в виде бесцветного масла (выход = 35 %). 1 Н ЯМР (250 МГц, ДМСО) : 7,26 (m, 5H); 3,96 (s, 2H); 3,57 (t, 2H); 3,49 (s, 2H); 2,49 (m, 2H); 2,14(s, 3H); 1,40 (s,9H). Препарат CXXXIII.[2-[Метил(фенилметил)амино]этокси]уксусной кислоты литиевая соль. Раствор 1 г (3,58 мМ) соединения, полученного в соответствии с процедурой получения препарата СХХХII, в 10 мл тетрагидрофурана кипятили в присутствии 165 мг литина и 3 мл воды в течение 8 ч. Затем реакционную смесь сконцентрировали при пониженном давлении с получением нужного продукта в виде бесцветной пены (выход = 99%). 1 Н ЯМР (250 МГц, ДМСО) : 7,26 (m, 5H); 3,59 (s, 2H); 3,53 (t, 2H); 3,48 (s, 2H); 2,50 (t, 2H); 2,12 (s, 3 Н). Препарат CXXXIV.N-Метил-N-[2-[2-[4-(1-метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]бензолметанамин. Способом, аналогичным примеру 5, используя в качестве исходного соединения соли, полученной в соответствии с процедурой получения препарата CXXXIII, и 1-(1-метил-4-пиперидинил)пиперазина, было получено искомое соединение в виде желтого масла (выход = 24%). 1 Н ЯМР (250 МГц, ДМСО) : 7,26 (m, 5H); 4,09 (s, 2H); 3,54 (t, 2H); 3,49 (s, 2H); 3,37 (m, 4 Н); 2,78 (m, 2 Н); 2,53 (t, 2 Н); 2,43 (m, 4 Н); 2,41 (s, 3 Н); 2,11 (s, 3 Н); 2,07 (m, 1 Н); 1,80 (dt, 2H); 1,65 (dm, 2H); 1,39 (dq, 2H). Препарат CXXXV.N-Метил-2-[2-[4-(1-метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этанамин. Способом, аналогичным процедуре получения препарата XXXV, используя в качестве исходного соединения соединение, полученное в соответствии с процедурой получения препарата CXXXIV, был получен требуемый продукт в виде желтого масла (выход = 80%). 1 Н ЯМР (300 МГц, ДМСО) : 4,16 (s, 2 Н); 3,55 (t, 2 Н); 3,49 (m, 1 Н); 3,39 (m, 2 Н); 3,33 (m, 2 Н); 2,77 (t, 4 Н); 2,43 (m, 2 Н); 2,38 (s, 3 Н); 2,16 (m, 2 Н); 2,12 (s, 3H); 1,82 (dt, 2H); 1,67 (dm, 2H); 1,38 (dq, 2H). Препарат CXXXVI. 2,6-Дихлор-4-фторбензолсульфонилхлорид. Раствор 4,75 г (25 мМ) 2,6-дихлор-4-фторанилина в 50 мл дихлорметана был добавлен при -15 С к 4,75 мл эфирата трифторида бора. Для растворения образовавшегося осадка было добавлено 5 мл тетрагидрофурана, затем было медленно добавлено 3,6 мл трет-бутилнитрита, растворенного в 25 мл дихлорметана. Реакционную смесь взбалтывали в течение 10 мин при -15 С, а затем - 20 мин при +5 С. Было добавлено 200 мл пентана, взбалтывание продолжили при 0 С в течение 30 мин, после чего осадок отфильтровали. После просушивания было получено 7,2 г диазониевой соли. Эту соль растворили в 30 мл ацетонитрила и добавили при 10 С к смеси раствора диоксида серы в 90 мл уксусной кислоты, к которому было добавлено 1,4 г безводного хлорида меди (II) и 23 мл концентрированной хлористоводородной кислоты. Реакционную смесь взбалтывали в течение 30 мин при температуре окружающей среды, а затем сконцентрировали при пониженном давлении. Остаток от испарения растворили в 60 мл дихлорметана, а нерастворимые соли удалили посредством фильтрации. Фильтрат сконцентрировали при пониженном давлении с получением 4,71 г нужного продукта в виде оранжевых кристалловN-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,6-дихлор-4-фтор-N-метилбензолсульфонамид Способом, аналогичным процедуре получения препарата I, используя в качестве исходных соединений соединения, полученные согласно препаратам CXXXV и CXXXVI, был получен требуемый продукт в виде светло-желтого масла (выход =73%). 1 Н ЯМР (250 МГц, ДМСО) : 7,73 (d, 2H); 4,08 (s, 2H); 3,58 (t, 2H); 3,45 (t, 2H); 3,40 (m, 2 Н); 3,30 (m, 2 Н); 2,93 (s, 3 Н); 2,78 (m, 2 Н); 2,41 (m, 4 Н); 2,13 (m, 1 Н); 2,11 (s, 3 Н); 1,81 (t, 2 Н); 1,75 (m, 2 Н); 1,40 (m, 2 Н). Пример 55.- 29008921 Способом, аналогичным примеру 4, используя в качестве исходного соединения соединение, полученное согласно примеру 54, был получен требуемый продукт в виде белого твердого вещества(выход = 76%). Температура плавления: 152-155 С. Способами, аналогичными примерам 54 и 55, используя в качестве исходных соединений бензолсульфонилхлориды, имеющие различные заместители, были получены следующие соединения согласно настоящему изобретению. Пример 56.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-бром-2,6-дихлор-N-метилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 87%). Температура плавления: 194 С. Пример 58.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,4,6-трихлор-N-метилбензолсульфонамида дифумарат. Белое твердое вещество (выход = 82 %). Температура плавления: 194 С. Пример 60.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-2,4-дихлор-6-метил-Nметил-бензолсульфонамида дифумарат. Белое твердое вещество (выход = 87 %). Температура плавления: 190 С. Пример 62.N-[2-[2-[4-(1-Метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]-4-метокси-2,3,6-триметилN-метилбензолсульфонамид/ Бесцветное масло (выход = 34 %). 1 Н ЯМР (250 МГц, ДМСО) : 6,83 (s, 1H); 4,03 (s, 2H); 3,84 (s, 3H); 3,52 (t, 2H); 3,35 (m, 2 Н); 3,35 (m, 2 Н); 3,18 (t, 2 Н); 2,73 (m, 2 Н); 2,69 (s, 3 Н); 2,57 (s, 3 Н); 2,42 (s, 3 Н); 2,41 (t, 4 Н); 2,12 (s, 3 Н); 2,10 (m, 1 Н); 2,08 (s, 3 Н); 1,81 (m, 2 Н); 1,66 (m, 2 Н); 1,38 (m, 2 Н). Пример 63. 4-Метокси-N,2,3,6-тетраметил-N-[2-[2-[4-(1-метил-4-пиперидинил)-1-пиперазинил]-2-оксоэтокси]этил]бензолсульфонамида дифумарат. Белое твердое вещество (выход = 7%). Температура плавления: 180 С. Препарат CXXXVII. 4-2-(4-Метокси-2,6-диметилфенил)сульфонил]метиламино]этокси]ацетил]-1-пиперазинкарбоновой кислоты 1,1-диметилэтиловый эфир. Способом, аналогичным примеру 5, используя в качестве исходного соединения N-Вос-пиперазин,был получен требуемый продукт, который был использован на следующей стадии без специальной очистки.
МПК / Метки
МПК: A61K 31/44, C07D 453/02, A61K 31/496, C07D 417/04
Метки: лечения, бензолсульфонамидов, способ, применение, боли, получения, производные
Код ссылки
<a href="https://eas.patents.su/30-8921-proizvodnye-benzolsulfonamidov-sposob-ih-polucheniya-i-ih-primenenie-dlya-lecheniya-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензолсульфонамидов, способ их получения и их применение для лечения боли</a>
Предыдущий патент: 7 – алкиниламино – триазолопиримидины, способ их получения и их применение для борьбы с патогенными грибами, а также содержащие их средства
Следующий патент: Фунгицидные смеси
Случайный патент: Термическое осаждение химически активных слоев оксид металла/алюминий и изготовленные из них дисперсно-упрочненные алюминиды












