Замещённые фенилацетамиды и их применение в качестве активаторов глюкокиназы
Номер патента: 11297
Опубликовано: 27.02.2009
Авторы: Рача Ягдиш Кумар, Ван Ка, Гримсби Джозеф Самьюэл, Корбетт Уэнди Ли, Мэхэней Пейж Эрин, Кестер Роберт Франсис, Хейнс Нэнси-Эллен, Сарабу Рамакант
Формула / Реферат
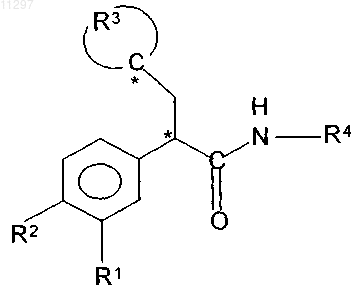
1. Соединение формулы
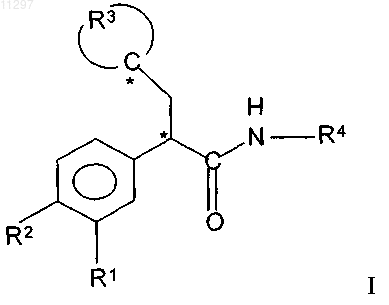
где R1 и R2 независимо означают водород, галоген, перфтор(низш.)алкил или (низш.)алкилсульфонил,
комбинация R3 и атома углерода, к которому присоединен R3, означает незамещенный тетрагидрофуранил, незамещенный тетрагидропиранил, тетрагидротиопиранил, в котором атом S необязательно замещен оксогруппой, или пяти- или шестичленный циклоалкил, который монозамещен по одному атому углерода в цепи одним остатком, выбранным из группы, включающей гидрокси, оксо, гидроксиимино, метоксиимино, галоген, метокси и ацетокси, или дизамещен по одному атому углерода в цепи одной гидроксигруппой и одним (низш.)алкилом, или дизамещен галогеном,
R4 означает -C(O)NHR6 или незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, соединенный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит 1 или 2 гетероатома, выбранных из атомов серы или азота, один гетероатом означает атом азота, соседний с вышеуказанным атомом углерода в цикле, а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле, который не является соседним с вышеуказанным атомом углерода, заместителем, выбранным из группы, включающей (низш.)алкил, галоген, циано, амидооксим, -(CH2)n-OR7 или -(СН2)n-C(O)OR7,
n означает 0, 1, 2, 3 или 4,
R5 означает водород, (низш.)алкил или перфтор(низш.)алкил,
R6 означает (низш.)алкил, а
R7 означает водород или (низш.)алкил,
* означает атом углерода, асимметрический во всех или почти во всех соединениях формулы I,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 означает водород, галоген или перфтор(низш.)алкил.
3. Соединение по п.1 или 2, где R2 означает галоген или (низш.)алкилсульфонил.
4. Соединение по любому из пп.1-3, где комбинация R3 и атома углерода, к которому присоединен R3, означает тетрагидрофуранил, тетрагидропиранил, тетрагидротиопиранил, циклопентил, 2-гидроксициклопентил, 3-гидроксициклопентил, 4-гидроксициклопентил, 2-оксоциклопентил, 3-оксоциклопентил, 4-оксоциклопентил, 2-гидроксииминоциклопентил, 3-гидроксииминоциклопентил, 4-гидроксииминоциклопентил, 2-метоксииминоциклопентил, 3-метоксииминоциклопентил, 4-метоксииминоциклопентил, 2-фторциклопентил, 3-метоксициклопентил, 3-ацетоксициклопентил, 2,2-дифторциклопентил, 3,3-дифторциклопентил или 3-гидрокси-3-метилциклопентил.
5. Соединение по любому из пп.1-4, где R4 означает тиазолил, пиразинил или пиридинил, необязательно монозамещенный по углеродному атому в цикле, который не является соседним с вышеуказанным атомом углерода, заместителем, выбранным из группы, включающей метил, хлор, бром, циано, амидооксим, -(CH2)n-OR7 и -(CH2)n-C(O)OR7.
6. Соединение по любому из пп.1-5, где R5 означает водород, метил или трифторметил.
7. Соединение по любому из пп.1-6, где R6 означает метил.
8. Соединение по любому из пп.1-7, где R7 означает водород или метил.
9. Соединение по любому из пп.1-8, где n равно 0 или 1.
10. Соединение по любому из пп.1-9, выбранное из группы, включающей следующие соединения:
1-[2-(3,4-дихлорфенил)-3-(тетрагидрофуран-2-ил)пропионил]-3-метилмочевина,
1-[2-(3,4-дихлорфенил)-3-(2-гидроксициклопентил)пропионил]-3-метилмочевина,
1-[2-(3,4-дихлорфенил)-3-(2-оксоциклопентил)пропионил]-3-метилмочевина,
1-[2-(3,4-дихлорфенил)-3-(3-гидроксициклопентил)пропионил]-3-метилмочевина,
1-[2-(3,4-дихлорфенил)-3-(3-оксоциклопентил)пропионил]-3-метилмочевина,
1-[2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевина,
1-[2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевина,
2-(3,4-дихлорфенил)-3-(тетрагидрофуран-2-ил)-N-тиазол-2-илпропионамид,
2-(4-метансульфонилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(2-гидроксициклопентил)-N-тиазол-2-илпропионамид,
3-(2-гидроксициклопентил)-2-(4-метансульфонилфенил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(2-оксоциклопентил)-N-тиазол-2-илпропионамид,
2-(4-метансульфонилфенил)-3-(2-оксоциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3-гидроксициклопентил)-N-тиазол-2-илпропионамид,
3-(3-гидроксициклопентил)-2-(4-метансульфонилфенил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3-метоксициклопентил)-N-тиазол-2-илпропионамид,
3-[2-(3,4-дихлорфенил)-2-(тиазол-2-илкарбамоил)этил]циклопентиловый эфир,
2-(3,4-дихлорфенил)-3-(3-оксоциклопентил)-N-тиазол-2-илпропионамид,
2-(4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3-фторциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3-гидроксииминоциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3-метоксииминоциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(2,2-дифторциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(3,3-дифторциклопентил)-N-тиазол-2-илпропионамид,
2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,
2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,
2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,
2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,
метиловый эфир 6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновой кислоты,
6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновая кислота,
N-(5-гидроксиметилпиридин-2-ил)-2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиридин-2-ил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиридин-2-ил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиридин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-(5-метилпиридин-2-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид,
2-(4-метансульфонил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-3-ил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(2-оксоциклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(2-гидроксициклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксициклопентил)-N-пиразин-2-илпропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-((S)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-((R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(2-гидроксииминоциклопентил)-N-пиразин-2-илпропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(2-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(3-гидрокси-3-метилциклопентил)-N-пиразин-2-илпропионамид,
2-(4-метансульфонил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидропиран-2-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидропиран-4-ил)пропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидропиран-4-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-(5-цианопиразин-2-ил)-3-(тетрагидропиран-4-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-[5-(N-гидроксикарбамимидоил)пиразин-2-ил]-3-(тетрагидропиран-4-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидротиопиран-3(R)-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(1-оксогексагидро-1l4-тиопиран-3(R)-ил)-N-пиразин-2-илпропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,
N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксициклогексил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)пропионамид,
N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил) пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-(5-метилпиразин-2-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(4-метоксииминоциклогексил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-метоксииминоциклогексил)пропионамид
и их фармацевтически приемлемые соли.
11. Соединение по любому из пп.1-9, выбранное из группы, включающей
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидропиран-4-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-(5-цианопиразин-2-ил)-3-(тетрагидропиран-4-ил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-N-[5-(N-гидроксикарбамимидоил)пиразин-2-ил]-3-(тетрагидропиран-4-ил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксициклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-3-((R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)пропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил)пропионамид,
2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)пропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,
N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,
N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)пропионамид,
N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил) пропионамид,
2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид
и их фармацевтически приемлемые соли.
12. Соединение по любому из пп.1-9, которое представляет собой 2(R)-(3-хлор-4-метансульфонилфенил)-3-((R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид.
13. Соединения по любому из пп.1-12, предназначенные для применения в качестве терапевтически активных активаторов глюкокиназы.
14. Фармацевтическая композиция, обладающая активностью активатора глюкокиназы, содержащая соединение по любому из пп.1-12 и фармацевтически приемлемый носитель и/или адъювант.
15. Способ получения фармацевтической композиции по п.14, включающий смешивание соединения формулы I по любому из пп.1-12 и фармацевтически приемлемого носителя и/или адъюванта.
16. Способ получения соединения по любому из пп.1-12, включающий взаимодействие соединения формулы VIII
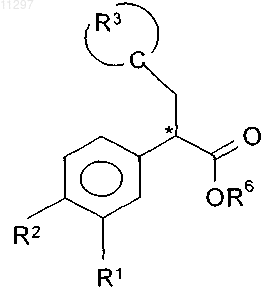
где R1, R2, R3 и R6 имеют значения, указанные в п.1, с соединением формулы X
R4-NH2
с образованием соединения формулы I
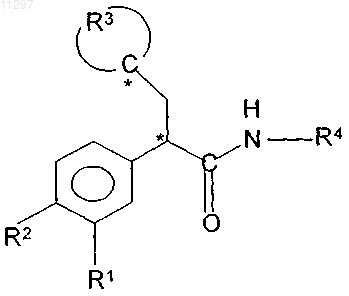
где R1, R2, R3, R4 и * имеют значения, указанные в п.1.
17. Способ получения соединения по любому из пп.1-12, включающий взаимодействие соединения формулы IX
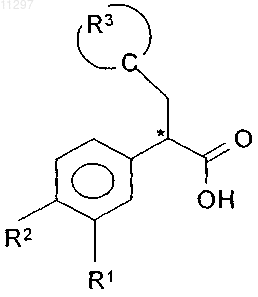
где R1, R2 и R3 имеют значения, указанные в п.1,
с соединением формулы X
R4-NH2
с образованием соединения формулы I
где R1, R2, R3, R4 и * имеют значения, указанные в п.1.
Текст
011297 Глюкокиназа (ГК) является одной из четырех гексокиназ, присутствующих в организме млекопитающих (Colowick S.P., The Enzymes, т. 9, P. Boyer ed., Academic Press, New York, NY, стр. 1-48 (1973. Гексокиназы катализируют первую стадию метаболизма глюкозы, т.е. конверсию глюкозы в глюкозо-6 фосфат. Глюкокиназа присутствует в немногих клетках, в основном этот фермент найден в -клетках поджелудочной железы и паренхимных клетках печени. Кроме того, ГК является ферментом, регулирующим скорость метаболизма глюкозы в этих двух типах клеток, которые, как известно, выполняют ключевые функции в поддержании гомеостаза глюкозы во всем организме (Chipkin S.R., Kelly K.L. и(1994. Концентрация глюкозы, при которой ГК проявляет половину максимальной активности, составляет приблизительно 8 мМ. У остальных трех гексокиназ насыщение глюкозой происходит при значительно более низких концентрациях (1 мМ). Следовательно, интенсивность потока глюкозы в гексокиназном пути растет при увеличении концентрации глюкозы в крови от уровня в голодном состоянии (натощак) (5 мМ) до уровня, который наблюдается после приема углеводсодержащей пищи (10-15 мМ)McCormick, eds., Annual Review, Inc., Palo Alto, CA, стр. 463-496 (1993. Более 10 лет назад на основании этих данные была предложена гипотеза о том, что в -клетках и гепатоцитах ГК является рецептором глюкозы (Meglasson M.D. и Matschinsky F.M., Amer. J. Physiol., 246, E1-E13 (1984. В последнее время исследования с использованием трансгенных животных подтвердили тот факт, что ГК действительно играет решающую роль в поддержании гомеостаза глюкозы во всем организме. Животные, не экспрессирующие ГК, погибают в течение нескольких дней после рождения от острого диабета, в то время, как животные с сверхэкспрессией ГК обладают повышенной толерантностью к глюкозе (Grupe A., Hultgren В., Ryan А. и др., Cell, 83, 69-78 (1995), Ferrie Т., Riu E., Bosch F. и др., FASEB J., 10, 1213-1218 (1996. Благодаря ГК увеличение уровня глюкозы сопряжено с увеличением секреции инсулина -клетками и с увеличением отложения гликогена гепатоцитами, а также с уменьшением продуцирования глюкозы. Тот факт, что юношеский диабет типа II при созревании организма (MODY-2) развивается из-за функциональных мутаций гена ГК, свидетельствует о том, что ГК также функционирует в качестве рецептора глюкозы в организме человека (Liang Y., Kesavan P., Wang L. и др., Biochem. J., 309, 167-173(1995. Дополнительные данные, подтверждающие концепцию о важной роли ГК в регуляции метаболизма глюкозы в организме человека, получены при обнаружении пациентов, экспрессирующих мутантную форму ГК с более высокой ферментативной активностью. У этих пациентов наблюдается гипогликемия натощак, ассоциированная с аномально увеличенным уровнем инсулина в плазме (крови) (Glaser В., Kesavan P., Heyman, M. и др., New England J. Med., 338, 226-230 (1998. Поскольку мутации гена ГК не обнаружены у большинства пациентов с диабетом типа II, соединения, которые активируют ГК, и,следовательно, увеличивают чувствительность ГК рецепторной системы, могут также применяться при лечении гипергликемии, которая наблюдается при всех видах диабета типа II. Активаторы глюкокиназы увеличивают интенсивность метаболизма глюкозы в -клетках и гепатоцитах, сопряженного с увеличением секреции инсулина. Такие агенты применяются для лечения диабета типа II. Изобретение относится к соединению, представляющему собой амид формулы(низш.)алкилсульфонил, (низш.)алкилсульфинил или сульфонамидо,R3 означает неразветвленную алкильную цепь, содержащую 4-5 атомов углерода, или неразветвленную гетероалкильную цепь, содержащую 3-4 атома углерода и один атом кислорода или серы, причем указанная цепь вместе с атомом углерода, к которому она присоединена, образует пяти- или шестичленный цикл, и,если цепь не содержит гетероатомов, то один атом углерода в цепи замещен одним остатком, выбранным из группы, включающей гидрокси, оксо, гидроксиимино, метоксиимино, галоген, метокси и ацетокси, или один атом углерода в цепи дизамещен одной гидроксигруппой и одним (низш.)алкилом или диза-1 011297 мещен галогеном, и если цепь содержит О гетероатом, то цепь незамещена, и если цепь содержит S гетероатом, то цепь незамещена или S гетероатом цепи замещен оксогруппой,R4 означает группу или незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, соединенный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит от 1 до 3 гетероатомов, выбранных из атомов серы, кислорода или азота, причем один из гетероатомов является атомом азота, который является соседним с вышеуказанным атомом углерода в цикле, а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле, который не является соседним с вышеуказанным атомом углерода,заместителем, выбранным из группы, включающей (низш.)алкил, галоген, нитро, циано, перфтор(низш.)алкил, амидооксим или следующие группы:R7 означает водород или (низш.)алкил, означает асимметрический атом углерода,или к его фармацевтически приемлемой соли. Установлено, что соединения формулы I активируют глюкокиназу in vitro. Активаторы глюкокиназы применяются для повышения секреции инсулина при лечении диабета типа II. Настоящее изобретение относится к фармацевтическим композициям, включающим соединение формулы I и фармацевтически приемлемый носитель и/или адъювант. Кроме того, изобретение относится к применению указанных соединений в качестве терапевтически активных веществ, а также к их применению для получения лекарственных средств, предназначенных для лечения и/или профилактики диабета типа II. Настоящее изобретение также относится к способам получения соединений формулы I. Кроме того, настоящее изобретение относится к способу профилактики или терапевтического лечения диабета типа II, причем указанный способ включает введение человеку или животному соединения формулы I. Более конкретно, настоящее изобретение относится к соединению, представляющему собой амид формулы(низш.)алкилсульфонил, (низш.)алкилсульфинил или сульфонамидо,R3 означает неразветвленную алкильную цепь, содержащую 4-5 атомов углерода, или неразветвленную гетероалкильную цепь, содержащую 3-4 атома углерода и один атом кислорода или серы, причем указанная цепь вместе с атомом углерода, к которому она присоединена, образует пяти- или шестичленный цикл, и,-2 011297 если цепь не содержит гетероатомов, то один атом углерода в цепи замещен одним остатком, выбранным из группы, включающей гидрокси, оксо, гидроксиимино, метоксиимино, галоген, метокси и ацетокси, или один атом углерода в цепи дизамещен одной гидроксигруппой и одним (низш.)алкилом,или дизамещен галогеном, и если цепь содержит О гетероатом, то цепь незамещена, и если цепь содержит S гетероатом, то цепь незамещена или S гетероатом цепи замещен оксогруппой,R4 означает группу или незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, соединенный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит от 1 до 3 гетероатомов, выбранных из атомов серы, кислорода или азота, причем один из гетероатомов является атомом азота, который является соседним с вышеуказанным атомом углерода в цикле, а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле, который не является соседним с вышеуказанным атомом углерода,заместителем, выбранным из группы, включающей (низш.)алкил, галоген, нитро, циано, перфтор(низш.)алкил, амидооксим или следующие группы:R7 означает водород или (низш.)алкил, означает атом углерода, асимметричный во всех или почти во всех соединениях формулы I,или к его фармацевтически приемлемой соли. В соединении формулы Iозначает атомы углерода, асимметричные во всех или почти во всех вариантах соединений формулы I. Соединение формулы I может присутствовать в виде рацемата или в виде индивидуальных энантиомеров, в которых асимметричные атомы углерода имеют R или S конфигурацию. Предпочтительны R энантиомеры. Термин (низш.)алкил, используемый в описании, означает алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 7 атомов углерода, такие как метил, этил, пропил, изопропил,предпочтительно метил и этил. Если не указано иное, термин галоген означает все четыре галогена, т.е. фтор, хлор, бром и иод. Термин перфтор(низш.)алкил, используемый в описании, означает любую (низш.)алкильную группу, где все атомы водорода (низш.)алкильной группы заменены фтором. Предпочтительные перфтор(низш.)алкильные группы включают трифторметил, пентафторэтил, гептафторпропил и т.п., предпочтительно прежде всего трифторметил. Термин "арил", используемый в описании, означает арильные моноциклические ароматические углеводородные группы, такие как фенил, толил и т.п., незамещенные или замещенные в одном или более положениях галогеном, нитро, (низш.)алкилом или (низш.)алкокси, или полициклические арильные группы, такие как нафтил, антрил и фенантрил, незамещенные или замещенные одной или более вышеуказанных групп. Предпочтительными арильными группами являются замещенные и незамещенные моноциклические арильные группы, прежде всего фенил. Термин (низш.)алкокси, используемый в описании заявки, означает алкоксигруппы с прямой или разветвленной цепью, содержащие от 1 до 7 атомов углерода, такие как метокси, этокси, пропокси, изопропокси, предпочтительно метокси и этокси. Термин арилалкил означает алкильную группу, предпочтительно (низш.)алкил, в котором один из атомов водорода заменен на арильную группу. Примеры арилалкильных групп включают бензил, 2-фенилэтил, 3-фенилпропил, 4-хлорбензил, 4 метоксибензил и т.п. Термин (низш.)алкановая кислота, используемый в описании, означает (низш.)алкановые кислоты, содержащие от 2 до 7 атомов углерода, такие как пропионовая кислота, уксусная кислота и т.п. Термин (низш.)алканоил означает одновалентные алканоильные группы, содержащие от 2 до 7-3 011297 атомов углерода, такие как пропионил, ацетил и т.п. Термин ароматические кислоты означает арилалкановые кислоты, где арил имеет значения, указанные выше, а алканоил содержит от 1 до 6 атомов углерода. Термин ароил означает ароматические кислоты, где арил имеет значения, указанные выше, а группа СООН не содержит водородной группы. Предпочтительной ароильной группой является бензоил. При синтезе соединений по изобретению различные функциональные группы, такие как свободные карбокси- или гидроксигруппы, защищают соответствующими гидролизуемыми группами в виде сложных или простых эфиров. Термин гидролизуемые защитные группы в виде сложных или простых эфиров, используемый в тексте, означает любую группу сложного или простого эфира, которая обычно применяется для защиты карбоновых кислот и спиртов и которую можно гидролизовать с образованием соответствующей карбокси- или гидроксигруппы. Примерами используемых для этих целей сложноэфирных групп являются такие группы, где ацильные остатки означают остаток (низш.)алкановой,арил(низш.)алкановой или (низш.)алкандикарбоновой кислоты. Активированные производные кислот,которые используются для введения таких групп, включают ангидриды кислот, галоидангидриды, предпочтительно хлорангидриды и бромангидриды арил- или (низш.)алкановых кислот. Примеры ангидридов включают ангидриды монокарбоновых кислот, такие как уксусный ангидрид, бензангидрид, и ангидриды(низш.)алкандикарбоновых кислот, например янтарный ангидрид, а также хлорформиаты, например предпочтительно трихлорметилхлорформиат и этилхлорформиат. Пригодные группы простого эфира для защиты спиртов включают, например, тетрагидропиранильные эфиры, такие как 4-метокси-5,6 дигидрокси-2 Н-пиранильные эфиры, а также ароилметиловые эфиры, такие как бензиловые, бензгидриловые или тритиловые эфиры или -(низш.)алкокси(низш.)алкиловые эфиры, например метоксиметиловые, или аллиловые эфиры или алкилсилиловые эфиры, такие как триметилсилиловый эфир. Термин аминозащитная группа означает соответствующую аминозащитную группу, которая может отщепляться с образованием свободной аминогруппы. Предпочтительными защитными группами являются обычные аминозащитные группы, используемые в пептидном синтезе. Предпочтительны прежде всего такие аминозащитные группы, которые отщепляются в слабокислотных условиях приблизительно при рН от 2 до 3. Более предпочтительные аминозащитные группы включают трет-бутилкарбамат(ВОС), бензилкарбамат (CBZ) и 9-флуоренилметилкарбамат (FMOC). Гетероароматический цикл R4 означает незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, содержащий от 1 до 3 гетероатомов, выбранных из группы, включающей кислород, азот или серу, и соединенный через атом углерода в цикле с указанной аминогруппой в составе амидной группы. Гетероароматический цикл содержит один гетероатом азота, соседний с вышеуказанным атомом углерода в цикле, и необязательно другие гетероатомы в виде атома серы, кислорода или азота. Такие гетероароматические циклы включают, например, пиридазинил, изоксазолил, изотиазолил и пиразолил. Предпочтительными гетероароматическими циклами являются пиридинил, пиразинил, пиримидинил, тиазолил, оксазолил и имидазолил. Указанные гетероароматические циклы R4 присоединены через атом углерода в цикле к амидной группе с образованием амидов формулы I. Указанный атом углерода гетероароматического цикла, который присоединен через амидную связь с образованием соединения формулы I, не может содержать другой заместитель. Если R4 означает незамещенный или монозамещенный пятичленный гетероароматический цикл, то предпочтительны такие циклы, которые содержат гетероатом азота, соседний с указанным атомом углерода в цикле, и второй гетероатом, соседний с указанным атомом углерода в цикле или соседний с указанным первым гетероатомом. Предпочтительные пятичленные гетероароматические циклы содержат 2 или 3 гетероатома и более, прежде всего предпочтительны тиазолил, имидазолил, оксазолил и тиазолил. Если гетероароматический цикл означает шестичленный цикл, то такой цикл соединен через атом углерода в цикле с указанной аминогруппой, а один гетероатом азота является соседним с указанным атомом углерода в цикле. Предпочтительные шестичленные гетероароматические циклы включают, например,пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил. Термин фармацевтически приемлемые соли, используемый в описании заявки, означает соли неорганических или органических фармацевтически приемлемых кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота,метансульфоновая кислота, паратолуолсульфоновая кислота и т.п. Термин фармацевтически приемлемые соли включает также любые фармацевтически приемлемые соли оснований, такие как соли аминов,соли триалкиламинов и т.п. Такие соли получают обычными методами, известными специалисту в данной области. Пяти- или шестичленный цикл, образованный R3 и углеродным атомом, связанным с R3, обозначаемый в описании -CHR3, является полярной группой. Пяти- или шестичленный цикл может состоять из атомов углерода или может включать один гетероатом, выбранный из кислорода или серы. Если пятиили шестичленный цикл содержит гетероатом, то все атомы углерода в цикле замещены атомами водорода (насыщенный цикл). Если гетероатом означает S, то атом S необязательно замещен оксогруппой. Если пяти- или шестичленный цикл не содержит гетероатомов, то один атом углерода замещен остатком,-4 011297 выбранным из группы, включающей гидрокси, оксо, гидроксиимино, метоксиимино, галоген, метокси и ацетокси, или один атом углерода дизамещен одной группой гидрокси и одним (низш.)алкилом или дизамещен галогеном. Такие пяти- или шестичленные циклы включают тетрагидрофураны, тетрагидропираны, тетрагидротиопираны, 1-оксотетрагидро-1-тиопираны, кетоциклоалкилы, гидроксициклоалкилы,метоксициклоалкилы, гидроксииминоциклоалкилы, метоксииминоциклоалкилы, галогенциклоалкилы и дигалогенциклоалкилы. Одним вариантом изобретения является соединение I-A, гдеR1 означает водород, галоген или перфтор(низш.)алкил,R2 означает галоген или (низш.)алкилсульфонил,R3 имеет значения, указанные выше,R4 означает незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, соединенный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит 1 или 2 гетероатома, выбранных из атомов серы или азота, причем один гетероатом означает атом азота, соседний с вышеуказанным атомом углерода в цикле, а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле,который не является соседним с вышеуказанным атомом углерода, заместителем, выбранным из группы,включающей (низш.)алкил, (низш.)алкокси, галоген, нитро, циано, перфтор(низш.)алкил, амидооксим или группыR7 означает водород или (низш.)алкил,или его фармацевтически приемлемая соль. В других предпочтительных вариантах соединения I-A R4 означает -СО-NH-R6, a R3 означает один из следующих вариантов: а) цепь из трех атомов углерода и одного атома кислорода, б) цепь из трех атомов углерода и одного атома серы, в) цепь из 4 атомов углерода, г) цепь из 4 атомов углерода и одного атома кислорода, д) цепь из 4 атомов углерода и одного атома серы или е) цепь из 5 атомов углерода. Кроме того, группы -CHR3 необязательно замещены, как указано выше. В других предпочтительных вариантах соединения I-A R4 означает незамещенный тиазолил, a R3 означает один из следующих вариантов: а) цепь из трех атомов углерода и одного атома кислорода, б) цепь из трех атомов углерода и одного атома серы, в) цепь из 4 атомов углерода, г) цепь из 4 атомов углерода и одного атома кислорода, д) цепь из 4 атомов углерода и одного атома серы или е) цепь из 5 атомов углерода. Кроме того, группы -CHR3 необязательно замещены, как указано выше. В еще одних предпочтительных вариантах соединения I-A R4 означает незамещенный или монозамещенный пиразинил, a R3 означает один из следующих вариантов: а) цепь из трех атомов углерода и одного атома кислорода, б) цепь из трех атомов углерода и одного атома серы, в) цепь из 4 атомов углерода, г) цепь из 4 атомов углерода и одного атома кислорода, д) цепь из 4 атомов углерода и одного атома серы или е) цепь из 5 атомов углерода. Кроме того, группы -CHR3 необязательно замещены, как указано выше. В других предпочтительных вариантах соединения I-A R4 означает замещенный пиридинил, a R3 означает один из следующих вариантов: а) цепь из трех атомов углерода и одного атома кислорода, б) цепь из трех атомов углерода и одного атома серы, в) цепь из 4 атомов углерода, г) цепь из 4 атомов углерода и одного атома кислорода, д) цепь из 4 атомов углерода и одного атома серы или е) цепь из 5 атомов углерода. Кроме того, группы -CHR3 необязательно замещены, как указано выше. В другом предпочтительном варианте настоящее изобретение относится к соединениям формулы I,где R1 и R2 независимо означают водород, галоген, такой как хлор, перфтор(низш.)алкил, такой как трифторметил, или (низш.)алкилсульфонил, такой как метилсульфонил, R3 означает неразветвленную алкильную цепь, содержащую 4-5 атомов углерода, или неразветвленную гетероалкильную цепь, содержащую 3-4 атома углерода и один атом кислорода или серы, причем цепь вместе с атомом углерода, к которому она присоединена, образует пяти- или шестичленный цикл, и (1) если цепь не содержит гетероатомов, то один атом углерода цепи замещен одним остатком, выбранным из группы, включающей гидрокси, оксо, гидроксиимино, метоксиимино, галоген, такой как фтор, метокси и ацетокси, или один атом углерода цепи дизамещен одной гидроксигруппой и одним (низш.)алкилом, таким как метил, или дизамещен галогеном, таким как фтор, (2) если цепь содержит О гетероатом, то цепь незамещена, и (3) если цепь содержит S гетероатом, то цепь незамещена или S гетероатом цепи замещен оксогруппой; R4 означает -C(O)NHR6 или незамещенный или монозамещенный пяти- или шестичленный гетероаромати-5 011297 ческий цикл, присоединенный через атом углерода в цикле к указанной аминогруппе, причем пяти- или шестичленный гетероароматический цикл содержит от 1 до 2 гетероатомов, выбранных из серы и азота,причем один гетероатом означает атом азота, соседний с указанным атомом углерода в цикле; а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле, который не является соседним с указанным атомом углерода, заместителем, выбранным из группы, включающей(низш.)алкил, такой как этил, галоген, такой как хлор или бром, циано, амидооксим или -(CH2)n-OR7 или(низш.)алкил, такой как метил;означает атом углерода, асимметричный во всех или почти во всех соединениях формулы I, или к их фармацевтически приемлемой соли. Предпочтительно R1 и R2, каждый независимо, означают водород, галоген, такой как хлор, перфтор(низш.)алкил, такой как трифторметил, или (низш.)алкилсульфонил, такой как метилсульфонил. Более предпочтительно R1 означает водород, галоген, такой как хлор, или перфтор(низш.)алкил, такой как трифторметил, a R2 означает галоген, такой как хлор, или (низш.)алкилсульфонил, такой как метилсульфонил. Предпочтительные пяти- или шестичленные циклы, образованные R3 и атомом углерода в составе 3R , означают тетрагидрофуранил, такой как тетрагидрофуран-2-ил и тетрагидрофуран-3-ил, тетрагидропиранил, такой как тетрагидропиран-2-ил и тетрагидропиран-3-ил, тетрагидротиопиранил, такой как тетрагидротиопиран-3(R)-ил и 1-оксогексагидро-14-тиопиран-3(R)-ил, и циклоалкил, такой как циклопентил, 2-гидроксициклопентил, 3-гидроксициклопентил, 4-гидроксициклопентил, 2-оксоциклопентил, 3 оксоциклопентил, 4-оксоциклопентил, 2-гидроксииминоциклопентил, 3-гидроксииминоциклопентил, 4 гидроксииминоциклопентил, 2-метоксииминоциклопентил, 3-метоксииминоциклопентил, 4-метоксииминоциклопентил, 2-фторциклопентил, 3-метоксициклопентил, 3-ацетоксициклопентил, 2,2-дифторциклопентил, 3,3-дифторциклопентил, 3-гидрокси-3-метилциклопентил. В предпочтительном варианте R4 означает незамещенный или монозамещенный пяти- или шестичленный гетероароматический цикл, соединенный через атом углерода в цикле с указанной аминогруппой, причем указанный пяти- или шестичленный гетероароматический цикл содержит 1 или 2 гетероатома, выбранных из атомов серы и азота, причем один гетероатом означает атом азота, соседний с вышеуказанным атомом углерода в цикле, а указанный монозамещенный гетероароматический цикл монозамещен по атому углерода в цикле, который не является соседним с вышеуказанным атомом углерода,заместителем, выбранным из группы, включающей (низш.)алкил, такой как метил, галоген, такой как хлор или бром, циано, амидооксим, -(CH2)n-OR7 или -(CH2)n-C(O)OR7. В другом предпочтительном варианте R4 означает группу -C(O)NHR6, где R6 означает (низш.)алкил, такой как метил. Наиболее предпочтительными пяти- или шестичленными гетероароматическими циклами R4 являются тиазолил, такой как тиазол-2-ил, пиразинил, такой как пиразин-2-ил, и пиридинил, такой как пиридин-2-ил. Указанные пяти- или шестичленные гетероароматические циклы необязательно монозамещены по атому углерода в цикле или по другому атому углерода в цикле, который не является соседним с вышеуказанным атомом углерода, заместителем, выбранным из группы, включающей (низш.)алкил, такой как метил, галоген, такой как хлор или бром, циано, амидооксим, -(CH2)n-OR7 или-(CH2)n-C(O)OR7, где n равно 0 или 1, a R7 означает водород или (низш.)алкил, такой как метил, группу-C(O)NHR6, где R6 означает (низш.)алкил, такой как метил. В другом предпочтительном варианте R5 означает водород, (низш.)алкил, такой как метил, или перфтор(низш.)алкил, такой как трифторметил. В другом предпочтительном варианте R6 означает (низш.)алкил, такой как метил. В еще одном предпочтительном варианте R7 означает водород или (низш.)алкил, такой как метил. В другом предпочтительном варианте n равно 0 или 1. Предпочтительные соединения по настоящему изобретению выбирают из группы, включающей 1-[2-(3,4-дихлофенил)-3-(тетрагидрофуран-2-ил)пропионил]-3-метилмочевина,1-[2-(3,4-дихлофенил)-3-(2-гидроксициклопентил)пропионил]-3-метилмочевина,1-[2-(3,4-дихлофенил)-3-(2-оксоциклопентил)пропионил]-3-метилмочевина,1-[2-(3,4-дихлорфенил)-3-(3-гидроксициклопентил)пропионил]-3-метилмочевина,1-[2-(3,4-дихлорфенил)-3-(3-оксоциклопентил)пропионил]-3-метилмочевина,1-[2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевина,1-[2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевина,2-(3,4-дихлорфенил)-3-(тетрагидрофуран-2-ил)-N-тиазол-2-илпропионамид,2-(4-метансульфонилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(2-гидроксициклопентил)-N-тиазол-2-илпропионамид,3-(2-гидроксициклопентил)-2-(4-метансульфонилфенил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(2-оксоциклопентил)-N-тиазол-2-илпропионамид,2-(4-метансульфонилфенил)-3-(2-оксоциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3-гидроксициклопентил)-N-тиазол-2-илпропионамид,3-(3-гидроксициклопентил)-2-(4-метансульфонилфенил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3-метоксициклопентил)-N-тиазол-2-илпропионамид,-6 011297 3-[2-(3,4-дихлорфенил)-2-(тиазол-2-илкарбамоил)этил]циклопентиловый эфир,2-(3,4-дихлорфенил)-3-(3-оксоциклопентил)-N-тиазол-2-илпропионамид,2-(4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3-фторциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3-гидроксииминоциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3-метоксииминоциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(2,2-дифторциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(3,3-дифторциклопентил)-N-тиазол-2-илпропионамид,2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид,метиловый эфир 6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновой кислоты,6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновая кислота,N-(5-гидроксиметилпиридин-2-ил)-2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиридин-2-ил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиридин-2-ил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиридин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-(5-метилпиридин-2 ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид,2-(4-метансульфонил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-3-ил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(2-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(2-гидроксициклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксициклопентил)-N-пиразин-2-илпропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-S)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(2-гидроксииминоциклопентил)-N-пиразин-2-илпропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(2-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил) пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-гидрокси-3-метилциклопентил)-N-пиразин-2-илпропионамид,2-(4-метансульфонил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидропиран-2-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидропиран-4-ил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-(5-цианопиразин-2-ил)-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-[5-(N-гидроксикарбамимидоил)пиразин-2-ил]-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидротиопиран-3(R)-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(1-оксогексагидро-14-тиопиран-3(R)-ил)-N-пиразин-2-7 011297 илпропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксициклогексил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил) пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)-N-(5-метилпиразин-2 ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(4-метоксииминоциклогексил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-метоксииминоциклогексил)пропионамид и их фармацевтически приемлемые соли. Более предпочтительные соединения по настоящему изобретению выбирают из группы, включающейN-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-(5-цианопиразин-2-ил)-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-[5-(N-гидроксикарбамимидоил)пиразин-2-ил]-3-(тетрагидропиран-4-ил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксициклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил) пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-метилпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил) пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид и их фармацевтически приемлемые соли. Наиболее предпочтительными соединениями по настоящему изобретению являются 2(R)-(3-хлор-4 метансульфонилфенил)-3-R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид или 2(R)-(3-хлор-4 метансульфонилфенил)-3-(3-гидроксициклопентил)-N-пиразин-2-илпропионамид и необязательно их фармацевтически приемлемые соли. Соединения формулы I получают из соединения формулы V по следующей последовательности реакций. где R1, R2, R3, R4 и R6 имеют значения, указанные выше. Карбоновые кислоты или их (низш.)алкиловые сложные эфиры формулы V и VI, где один из R1 и 2R означает водород, нитро, меркапто, метилтио, трифторметилтио, метилсульфонил, амино, фтор, хлор,бром, иод, гидрокси, метокси, трифторметокси, метил, трифторметил и карбокси, а другой означает водород, являются коммерческими препаратами. В тех случаях, когда коммерческими препаратами являются только карбоновые кислоты и для последующей химической модификации необходимо получить требуемые заместители R1 и R2, карбоновые кислоты превращают в соответствующие сложные эфиры(низш.)алкиловых спиртов с использованием любых известных методов этерификации. Все реакции, описанные ниже, проводят с использованием (низш.)алкиловых эфиров карбоновых кислот формулы VI или VIII или самих карбоновых кислот формулы V или IX. Соединения формулы V, где один из R1 и R2 означает аминогруппу, можно превратить в соединения с другими заместителями до или после получения соединений формулы I. Для этого аминогруппы можно диазотировать с образованием соответствующего диазониевого соединения, которое in situ вводят в реакцию с соответствующим (низш.)алкилтиолом или перфтор(низш.)алкилтиолом (см., например,Baleja J.D., Synth. Comm., 14, 215 (1984), Giam C.S., Kikukawa K., J. Chem. Soc, Chem. Comm., 756 (1980),Kau D., Krashniski J.H., Robertson D.W., J. Labelled Compd Rad., 22, 1045 (1985), Oade S., Shinhama K.,Kim Y.H., Bull Chem Soc. Jpn., 53, 2023 (1980), Baker B.R. и др., J. Org. Chem., 17, 164 (1952 с образованием соответствующих соединений формулы V, где один из заместителей означает (низш.)алкилтио или перфтор(низш.)алкилтио, а другой означает водород. При необходимости соединения с заместителями(низш.)алкилтио или перфтор(низш.)алкилтио можно затем по реакции окисления превратить в соответствующие соединения формулы V с заместителями (низш.)алкилсульфонил или перфтор(низш.)алкилсульфонил. Для этого можно использовать любой известный метод окисления алкилтиозаместителей с образованием сульфонов. С другой стороны, из (низш.)алкилтиосоединений формулыV по реакции окисления можно получить соответствующие (низш.)алкилсульфинилпроизводные формулы V. Для этого можно использовать любой известный метод окисления алкилтиозаместителей с образованием сульфоксидов. Для получения соединений формулы V, где один из R1 и R2 означает водород, а другой означает сульфонамидо, меркаптогруппу окисляют с образованием группы -SO3H, которую затем превращают в группу -SO2Cl, которую затем по реакции с аммиаком превращают в сульфонамидную группу -SO2NH2. При получении соединений формулы V с заместителями (низш.)алкил или перфтор(низш.)алкил в качестве исходных соединений используют соответствующие галогензамещенные соединения формулыV. Для этого можно использовать любой известный метод превращения галогена ароматической группы в соответствующую алкильную группу (см., например, Katayama Т., Umeno M., Chem. Lett., 2073 (1991),-9 011297Lett., 2133 (1989), Powell R.L., Heaton C.A, US 5113013). Для получения соединений формулы V, где один или оба R1 и R2 означают гидроксиамино, в качестве исходных соединений можно использовать соответствующие нитросоединения, из которых можно получить соответствующие соединения, где R1 и/или R2 означают гидроксиамино. Для этого можно использовать любой известный метод превращения нитрогруппы в соответствующее ароматическое гидроксиаминосоединение. Карбоновые кислоты или их сложные эфиры формулы V или VI, где оба R1 и R2 означают хлор,фтор, гидрокси и метокси, являются коммерческими препаратами. Карбоновые кислоты формулы V, гдеR1 означает трифторметил, а R2 означает фтор, и карбоновые кислоты формулы V, где R1 означает нитро,a R2 - хлор, также являются коммерческими препаратами. В тех случаях, когда коммерческими препаратами являются только карбоновые кислоты, их можно превратить в соответствующие сложные эфиры(низш.)алкилспиртов с использованием любого известного метода этерификации. Для получения соединения формулы V, где оба R1 и R2 означают нитрогруппу, в качестве исходного соединения можно использовать 3,4-динитротолуол. Из указанного соединения получают соответствующую 3,4-динитрофенилуксусную кислоту. При этом можно использовать любой известный метод превращения арилметильной группы в соответствующую арилуксусную кислоту (см., например, ClarkR.D., Muchowski J.M., Fisher L.E., Flippin L.A., Repke D.B., Souchet M., Synthesis, 871 (1991. Соединения формулы V, где оба заместителя R1 и R2 означают аминогруппу, можно получить из соответствующего динитросоединения формулы V, указанного выше. Для этого можно использовать любой известный метод восстановления нитрогруппы до аминогруппы. Соединения формулы V, где R1 и R2 оба означают аминогруппу, можно использовать для получения соответствующего соединения формулы V, где оба R1 и R2 означают иод или бром, с использованием реакции диазотирования. Для этого можно использовать любой известный метод замещения аминогруппы на иод или бром (см., например, Lucas H.J., Kennedy E.R., Org. Synth. Coll., т.II, 351 (1943. Для получения соединений формулы V, где R1 и R2 оба означают (низш.)алкилтио- или перфтор(низш.)алкилтиогруппы, в качестве исходного материала используют соединение формулы V, где R1 и R2 оба означают аминогруппу. При этом можно использовать любой известный метод превращения ариламиногруппы в арил(низш.)алкилтио- или перфтор(низш.)алкилтиогруппу. Для получения соединений формулы V, где R1 и R2 означают (низш.)алкилсульфонил или перфтор(низш.)алкилсульфонил, в качестве исходного материала используют соответствующие соединения формулы V, где R1 и R2 означают (низш.)алкилтио или перфтор(низш.)алкилтио. При этом можно использовать любой известный метод окисления алкилтиозаместителей с образованием сульфонов. С другой стороны, для получения соединений формулы V, где R1 и R2 означают (низш.)алкилсульфинил, в качестве исходного материала используют соответствующие соединения формулы V, где R1 и R2 означают (низш.)алкилтио. При этом можно использовать любой известный метод окисления алкилтиозаместителей с образованием сульфоксидов. Для получения соединений формулы V, где R1 и R2 оба означают (низш.)алкил- или перфтор(низш.)алкилгруппы, в качестве исходного материала используют соответствующие галогензамещенные соединения формулы V. При этом можно использовать любой известный метод превращения арилгалогена в (низш.)алкил- или перфтор(низш.)алкилгруппу. Карбоновые кислоты, соответствующие соединениям формулы V, где один из R1 и R2 означает нитро, а другой галоген, описаны в литературе (относительно 4-хлор-3-нитрофенилуксусной кислоты см.Chem., 60, 6389 (1995), Beugelmans R., Bourdet S., Zhu J., Tetrahedron Lett., 36, 1279 (1995. Из указанных карбоновых кислот обычными методами этерификации получают соответствующие (низш.)алкиловые эфиры. Таким образом, для получения соединения формулы V, где один из R1 и R2 означает нитро, а другой означает (низш.)алкилтио или перфтор(низш.)алкилтио, в качестве исходного материала используют соответствующее соединение, где один из R1 и R2 означает нитро, а другой означает хлор. В этом случае используют любой соответствующий метод нуклеофильного замещения хлора в ароматическом цикле группой (низш.)алкилтио или перфтор(низш.)алкилтио (см., например, Singh P., Batra M.S., Singh H., J.Chem. Res.-S, (6), S204, (1985), Ono M., Nakamura Y., Sata S., Itoh I., Chem. Lett, 1393 (1988), Wohrle D.,Eskes M., Shigehara K., Yamada A., Synthesis, 194 (1993), Sutter M., Kunz W., US 5169951). Из полученных соединений формулы V, где один из R1 и R2 означает нитро, а другой означает (низш.)алкилтио или перфтор(низш.)алкилтио, по обычным методикам окисления получают соответствующие соединения формулы V, где один из R1 и R2 означает нитро, а другой означает (низш.)алкилсульфонил или перфтор(низш.)алкилсульфонил. Для получения соединений формулы V, где один из R1 и R2 означает амино, а другой означает (низш.)алкилтио или перфтор(низш.)алкилтио, в качестве исходного материала используют соответствующее соединение, где один из R1 и R2 означает нитро, а другой означает(низш.)алкилтио или перфтор(низш.)алкилтио. В этом случае используют любой соответствующий метод восстановления ароматической нитрогруппы до аминогруппы. Для получения соединений формулы V,где один из R1 и R2 означает (низш.)алкилтио, а другой означает перфтор(низш.)алкилтио, в качестве исходного материала используют соответствующее соединение, где один из R1 и R2 означает амино, а другой означает (низш.)алкилтио или перфтор(низш.)алкилтио. В этом случае используют любой соответствующий метод диазотирования ароматической аминогруппы и взаимодействия in situ с требуемым(низш.)алкилтиолом. Для получения соединений формулы V, где один из R1 и R2 означает(низш.)алкилсульфонил, а другой означает перфтор(низш.)алкилсульфонил, в качестве исходного материала используют соответствующие соединения, где один из R1 и R2 означает (низш.)алкилтио, а другой означает перфтор(низш.)алкилтио. В этом случае используют любой соответствующий метод окисления ароматической тиогруппы до соответствующей сульфоновой группы. Для получения соединений формулы V, где один из R1 и R2 означает галоген, а другой означает(низш.)алкилтио или перфтор(низш.)алкилтио, в качестве исходного материала используют соответствующие соединения, где один из R1 и R2 означает амино, а другой означает (низш.)алкилтио или перфтор(низш.)алкилтио. В этом случае используют любой соответствующий метод диазотирования ароматической аминогруппы и последующее ее превращение in situ в ароматический галогенид. Для получения соединений формулы V, где один из R1 и R2 означает галоген, а другой означает(низш.)алкилсульфонил или перфтор(низш.)алкилсульфонил, в качестве исходного материала используют соответствующие соединения, где один из R1 и R2 означает галоген, а другой означает(низш.)алкилтио или перфтор(низш.)алкилтио. В этом случае используют любой соответствующий метод окисления ароматической тиогруппы до соответствующего сульфона. Для получения соединения формулы V, где один из R1 и R2 означает нитро, а другой означает амино, в качестве исходного материала используют соединение формулы V, где один из R1 и R2 означает нитро, а другой означает хлор. Для этого хлор в фенильном цикле заменяют на иод (см., например , Bunnett J.F., Conner R.M., Org. Synth. Coll, т.V, 478 (1973), Clark J.H., Jones C.W., J. Chem. Soc. Chem. Commun., 1409 (1987 и полученное соединение вводят в реакцию с агентом, переносящим азидную группу,с образованием соответствующего азида (см., например, Suzuki H., Miyoshi K., Shinoda M., Bull. Chem.Soc. Jpn, 53, 1765 (1980. Затем указанный азид восстанавливают с использованием обычных восстанавливающих агентов в соответствующий амин (см., например, Soai K., Yokoyama S., Ookawa A., Synthesis,48 (1987. Для получения соединения формулы V, где R1 и R2 оба означают циано, в качестве исходного материала используют соединение формулы V, где R1 и R2 оба означают амино. Для этого исходное соединение диазотируют, как указано выше, с образованием соли диазония, а затем проводят реакцию с агентом,переносящим цианогруппу. Для получения соединений формулы V, где один из R1 и R2 означает циано, а другой не означает циано, в качестве исходного материала используют соединение формулы V, где один из R1 и R2 означает нитро, а другой означает хлор. При этом нитрогруппу восстанавливают любым известным методом с образованием аминогруппы, которую диазотируют и вводят в реакцию с агентом,переносящим цианогруппу. Затем галоген превращают в любой требуемый заместитель R1 и R2, как описано выше. Для получения соединения формулы V, где один из R1 и R2 означает -С(О)-OR6, в качестве исходного материала используют соответствующее соединение, где один из R1 и R2 означает аминогруппу. При этом аминогруппу переводят в соль диазония, которую обрабатывают галогенводородной кислотой с образованием соответствующего галогенпроизводного. Затем из соответствующего галогенпроизводного получают реактив Гриньяра, который обрабатывают карбоксилирующим реагентом и этерифицируют полученную кислоту. С другой стороны, соединение формулы V, где R1 и R2 оба означают -C(O)OR6, получают, как описано выше, из соответствующего соединения, где R1 и R2 оба означают аминогруппу. Аналогичным образом из указанного исходного соединения можно получить соответствующее соединение, где один из R1 и R2 или оба R1 и R2 означают -OR5. Для этого аминогруппу при обработке нитратом натрия в серной кислоте заменяют на гидроксигруппу, которую при необходимости этерифицируют с образованием простого эфира. Для получения соединений формулы V, где R1 означает водород, a R2 означает(низш.)алкилсульфонил, в качестве исходного материала используют известное соединение 4 меркаптофенилуксусную кислоту. Соединение формулы V, где R1 означает водород, a R2 означает меркапто, алкилируют известными методами (например, галогеналкилом) с образованием соответствующих(низш.)алкилтиосоединений формулы V. Затем полученные соединения окисляют с образованием соответствующих (низш.)алкилсульфонилсоединений формулы V. При этом используют любой известный метод окисления (низш.)алкилтиогруппы в (низш.)алкилсульфоновую группу. С другой стороны, для получения соединений формулы V, где R1 означает трифторметил, a R2 означает (низш.)алкилсульфонил, в качестве исходного материала используют известное соединение 4 фтор-3-(трифторметил)фенилуксусную кислоту. В этом случае используют любой соответствующий метод нуклеофильного замещения фтора в ароматическом цикле на группу (низш.)алкилтиола (см., например, Boswell G.E., Licause J.F., J. Org. Chem., 6592 (1995), Sheikh Y.M. и др., J. Org. Chem., 4341 (1982),- 11011297Brown F.C. и др., J. Org. Chem., 4707 (1961. Из полученных соединений формулы V, где R1 означает трифторметил, a R2 означает (низш.)алкилтио, можно получить соответствующие соединения формулыV, где R1 означает трифторметил, a R2 означает (низш.)алкилсульфонил, с использованием обычных методов окисления. Для получения соединений формулы V, где R1 означает галоген, a R2 означает(низш.)алкилсульфонил, в качестве исходного материала можно также использовать известные 2 галогентиофенолы. В этой последовательности реакций меркаптогруппу алкилируют известными методами (например, (низш.)алкилгалогенидом) с образованием 2-галоген-1-(низш.)алкилтиобензолов. Затем из указанных соединений получают соответствующие 3-галоген-4-(низш.)алкилтиофенилуксусные кислоты. 2-Галоген-1-(низш.)алкилтиобензолы сначала ацилируют (низш.)алкилоксалилхлоридом (таким как метилоксалилхлорид или этилоксалилхлорид) в условиях ацилирования по Фриделю-Крафтсу с образованием сложного эфира -кетокарбоновой кислоты в пара-положение к (низш.)алкилтиогруппе. Сложный эфир -кетокарбоновой кислоты гидролизуют любым известным методом с образованием кетокарбоновой кислоты. Затем полученную -кетокарбоновую кислоту восстанавливают по ВольфуКижнеру с образованием соединения формулы V, где R1 означает галоген, a R2 означает (низш.)алкилтио(1972. Затем из соединения с (низш.)алкилтиогруппой с использованием окисления можно получить соответствующее соединение формулы V с (низш.)алкилсульфонилгруппой. При этом можно использовать любой известный метод окисления (низш.)алкилтиогруппы в соответствующую сульфоновую группу. При алкилировании с использованием галоидных алкилов формулы VII непосредственно алкилируют карбоновые кислоты формулы V или их сначала этерифицируют (низш.)алкиловыми спиртами формулы VI обычными методами с образованием сложных эфиров, а затем проводят алкилирование. На стадии алкилирования, как показано на схеме, галогеналкил формулы VII взаимодействует с дианионом формулы V с образованием соединения формулы IX или взаимодействует с анионом формулы VI с образованием соединения формулы VIII. Соединения формулы V и VI представляют собой органическую кислоту или производное органической кислоты, содержащее -углеродный атом, а соединение формулы VII представляет собой галогеналкил, и, следовательно, алкилирование происходит по -углеродному атому указанной карбоновой кислоты. Реакцию проводят любым известным способом алкилирования по-углеродному атому карбоновых кислот или (низш.)алкиловых эфиров карбоновых кислот. В общем случае в этих реакциях алкилирования галогеналкил взаимодействует с дианионом уксусной кислоты или анионом, образованным сложным эфиром уксусной кислоты. Анион образуется при использовании сильного органического основания, такого как диизопропиламид лития или н-бутиллитий, а также другие органические основания лития. Реакцию проводят в низкокипящих простых эфирах, таких как тетрагидрофуран, при низких температурах, предпочтительно от -80 до приблизительно -10 С. Однако реакцию можно проводить при любой температуре в интервале от -80 С до комнатной температуры. При необходимости реакцию алкилирования можно проводить не галогенпрозводным соединения VII, а трифлатом соединения VII. Алкилирование трифлатами проводят по методикам, известным в синтетической органической химии. Для получения соединения формулы I, где R4 означает CONH-R6, a R6 означает (низш.)алкил, метиловый эфир формулы VIII вводят в реакцию с (низш.)алкилмочевиной с образованием соединения формулы I. Указанную реакцию проводят любыми известными методами взаимодействия метилового эфира с (низш.)алкилмочевиной с образованием соответствующего продукта конденсации. Соответствующие(низш.)алкилмочевины являются коммерческими препаратами (например, метилмочевина, этилмочевина, н-пропилмочевина, н-бутилмочевина) или известными соединениями, описанными в литературе. Для получения соединений формулы I, где R4 означает незамещенный или монозамещенный пятиили шестичленный гетероароматический цикл, соединение формулы VIII превращают в соединение формулы IX по любой известной методике получения кислот из сложных эфиров. Затем соединение формулы IX конденсируют с соединениями формулы X по обычной методике, используемой для образования пептидной связи, с получением соединений формулы I. При проведении указанной реакции можно использовать любой известный метод конденсации первичного амина с карбоновой кислотой. С другой стороны, соединение формулы VIII можно также конденсировать с соединением формулы X по обычным методикам с образованием соединения формулы I. При проведении указанной реакции можно использовать любой известный метод конденсации первичного амина с карбоновой кислотой. Аминогетероароматические соединения формулы X являются коммерческими препаратами или известными соединениями, описанными в литературе, или их можно получить по модификации стандартных методов синтеза, описанных в литературе. Например, гетероароматические соединения формулы X,где один из заместителей означает -(CH2)nCOOR7, где n равно 1, 2, 3 или 4, a R7 означает водород или(низш.)алкил, можно получить из соответствующей карбоновой кислоты -(CH2)nCOOR7 (где n равно 0, aR7 означает водород). Для гомологизации низших карбоновых кислот в высшие карбоновые кислоты можно использовать любой известный метод (см., например, Skeean R.W., Goel О.P., Synthesis, 628(1990, причем указанные высшие карбоновые кислоты в свою очередь превращают в соответствующие(низш.)алкиловые эфиры. Гетероароматические соединения формулы X, где один из заместителей означает -(CH2)nC(=O)NHR7, a n равно 0, 1, 2, 3 или 4, a R7 означает водород или (низш.)алкил, можно получить из вышеуказанных карбоновых кислот. При этом можно использовать любой известный метод получения соответствующих амидов карбоновых кислот. Затем из (низш.)алкиламидов с использованием любого пригодного метода восстановления амидов получают соответствующие амины формулы X, где один из заместителей означает -(CH2)nNHR7. Гетероароматические соединения формулы X, где один из заместителей означает -(CH2)nOR7, a n равно 1, 2, 3 или 4, получают из вышеуказанных соответствующих(низш.)алкиловых эфиров, из которых обычным восстановлением можно получить соответствующие спирты. Прежде чем проводить стадию конденсации, вышеуказанные амины и спирты избирательно защищают соответствующими защитными группами, которые легко удаляются в кислотной среде. После проведения конденсации защитные группы удаляют с образованием соединения формулы I. Гетероароматические соединения формулы X, где один из заместителей означает -C(O)C(O)OR7 или -C(O)-OR7, a R7 означает (низш.)алкил, получают из соответствующих галогенпроизводных. При этом для превращения ароматического или гетероароматического галогенпроизводного в(низш.)алкиловый эфир оксоуксусной кислоты или в производное в виде простого эфира можно использовать любой обычный метод ацилирования (см., например, Hayakawa K., Yasukouchi Т., Kanematsu K.,Tetrahedron Lett., 28, 5895 (1987. С другой стороны, для получения соединений формулы X, содержащих (низш.)алкильную или перфтор(низш.)алкильную группы, в качестве исходного материала можно использовать галогенпроизводные соединений формулы X. Для этого можно использовать любой обычный метод превращения ароматического галогена в соответствующую (низш.)алкильную или перфтор(низш.)алкильную группу. Для получения гетероароматических соединений формулы X, где один из заместителей означает циано, или соединения формулы I, где один из заместителей в пяти- или шестичленном гетероароматическом цикле означает циано, в качестве исходного материала используют соответствующее галогенпроизводное (предпочтительно бромпроизводное). Для этого можно использовать любой обычный метод замещения галогена на цианид. С другой стороны, для получения соединения формулы I, где один из заместителей в пяти- или шестичленном гетероароматическом цикле означает амидооксим, наиболее целесообразно получать эту функциональную группу из цианогруппы после стадии конденсации. Для этого можно использовать любой обычный метод образования амидооксима из цианогруппы. Пяти- или шестичленный цикл, образованный R3 и атомом углерода, связанным с R3, обозначаемый в описании -CHR3, означает полярную группу. Пяти- или шестичленный цикл может содержать только атомы углерода или может включать один гетероатом, выбранный из кислорода или серы. Для получения соединения формулы VIII или IX, где -CHR3 означает 2-тетрагидрофуран, в качестве галогеналкила на стадии алкилирования можно использовать 2-бромметилтетрагидрофуран, который является коммерческим препаратом. Для этого можно использовать любой обычный метод алкилирования карбоновой кислоты или сложного эфира карбоновой кислоты по -углеродному атому. Другой способ получения соединения формулы VIII или IX, где -CHR3 означает 2-тетрагидрофуран, включает использование коммерческого препарата (тетрагидрофуран-2-ил)метанола. Из спирта любым известным пособом получают йодистый алкил, который в свою очередь используют на стадии алкилирования, как описано выше. Для получения соединения формулы VIII или IX, где -CHR3 означает 2(R)-тетрагидрофуран, в качестве исходного соединения используют (R)-(+)-тетрагидро-2-фуранкарбоновую кислоту, которая является коммерческим препаратом. В этой последовательности реакций кислоту восстанавливают в соответствующий спирт. При этом используют любой обычный метод получения спирта из карбоновой кислоты. Затем из полученного спирта получают трифлат для проведения стадии алкилирования. При этом используют любой обычный метод получения трифлатов спиртов и любой обычный метод алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому с использованием алкилтрифлата. Для получения соединения формулы VIII или IX, где -CHR3 означает 3-тетрагидрофуран, в качестве исходного соединения используют тетрагидро-3-фуранметанол, который является коммерческим препаратом. В этой последовательности реакций из спирта сначала получают соответствующий тозилат. При этом используют любой обычный метод получения тозилатов спиртов. Затем из тозилата получают соответствующий йодистый алкил. При этом используют любой обычный метод превращения тозилата в йодистый алкил. Последующее алкилирование проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Для получения соединения формулы VIII или IX, где -CHR3 означает 2-теграгидропиран, в качестве галогеналкила используют 2-бромметилтетрагидропиран, который является коммерческим препаратом. Алкилирование проводят любым обычным методом алкилирования карбоновой кислоты или(низш.)алкилового эфира карбоновой кислоты по -углеродному атому.- 13011297 Для получения соединения формулы VIII или IX, где -CHR3 означает 3(R)-тетрагидротиопиран, в качестве исходного материала используют 3,3'-тиодипропионат, который является коммерческим препаратом. В этой последовательности реакций диэфир циклизуют в присутствии основания. При этом используют любой обычный метод циклизации, катализируемой основанием. Полученный тиопиран восстанавливают в присутствии фермента. При этом используют любой пригодный метод хирального восстановления. Полученный спирт восстанавливают с образованием соответствующего углеводорода. При этом используют любой обычный метод восстановления спиртов. Затем восстанавливают оставшуюся сложно-эфирную группу с образованием спирта. При этом используют любой обычный метод восстановления сложного эфира в спирт. Затем из спирта получают йодистый алкил. При этом используют любой обычный метод превращения спирта в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Для получения соединения формулы I, где -CHR3 означает 3-(1-оксогексагидро)-14-тиопиран 3(R)-ил, в качестве исходного материала можно использовать соединение формулы I, содержащее вместо группы -CHR3 остаток 3(R)тетрагидротиопирана. Тиоэфир окисляют в сульфоксид. При этом используют любой обычный метод окисления алкилтиогрупп в сульфоксиды. Для получения соединения формулы VIII или IX, где -CHR3 означает 4-тетрагидропиран, в качестве исходного соединения используют (тетрагидропиран-4-ил)метанол. В этой последовательности реакций из спирта сначала получают тозилат. При этом используют любой пригодный метод получения тозилатов спиртов. Затем из тозилата получают йодистый алкил. При этом используют любой обычный метод превращения тозилата в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по углеродному атому. Для получения соединения формулы VIII или IX, где -CHR3 означает 2-гидроксициклопентил, в качестве исходного соединения используют этиловый эфир 2-оксоциклопентанкарбоновой кислоты, который является коммерческим препаратом. В этой последовательности реакций кетон восстанавливают с образованием спирта. При этом используют любой обычный метод восстановления кетонов в спирты. Затем полученный спирт защищают стандартной гидроксизащитной группой. При этом используют любой обычный метод введения в спирты гидроксизащитной группы. Сложный эфир восстанавливают с образованием первичного спирта. При этом используют любой обычный метод восстановления сложного эфира в спирт. Затем из спирта получают йодистый алкил. При этом используют любой обычный метод превращения спирта в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. В другом варианте для получения соединения формулы I, где -CHR3 означает 2 оксоциклопентил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 2-гидроксициклопентил. Спирт окисляют в кетон. При этом используют любой обычный метод окисления спирта в кетон. Аналогичным способом(а) из этилового эфира 3-оксоциклогексан-1-карбоновой кислоты получают требуемую 3 оксоциклогексиловую -CHR3 группу,(б) из 2-циклогексанонкарбоновой кислоты получают требуемую 2-оксоциклогексиловую -CHR3 группу. Для получения соединения формулы I, где -CHR3 означает 2-гидроксииминоциклопентил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 2-оксоциклопентил. Кетогруппу превращают в гидроксииминогруппу. При этом используют любой обычный метод превращения кетогруппы в гидроксииминогруппу. С другой стороны, для получения соединения формулы I, где -CHR3 означает 2-метоксииминоциклопентил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 2 оксоциклопентил. При этом кетогруппу превращают в метоксииминогруппу любым обычным методом превращения кетогруппы в метоксииминогруппу. Для получения соединения формулы VIII, где -CHR3 означает 2,2-дифторциклопентил, в качестве исходного соединения используют соединение формулы VIII, содержащее вместо группы -CHR3 остаток 2-оксоциклопентил. Затем кетогруппу превращают в дифторгруппу. При этом используют любой обычный метод превращения кетогруппы в дифторгруппу. Для получения соединения формулы I, где -CHR3 означает 3-гидроксициклопентил, в качестве исходного материала используют 3-иодметилциклопентанон (J. Org. Chem., 46, 2412-2414 (1981. Кетогруппу восстанавливают в спиртовую группу. При этом используют любой обычный метод восстановления кетонов в спирты. Затем полученный спирт защищают стандартной гидроксизащитной группой. При этом используют любой обычный метод введения в спирты гидроксизащитной группы. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Соединение формулы VIII конденсируют с соеди- 14011297 нением формулы X по соответствующей методике с образованием соединения формулы I. При проведении указанной реакции используют любой обычный метод конденсации первичного амина с эфиром карбоновой кислоты. Гидроксизащитную группу удаляют любым обычным методом. Для получения соединения формулы I, где -CHR3 означает 3-метоксициклопентил, в качестве исходного материала используют соединение формулы I, содержащее вместо группы -CHR3 остаток 3 гидроксициклопентил. Спиртовую группу превращают в простой метиловый эфир. При этом используют любой обычный метод превращения спиртовой группы в простой метиловый эфир. С другой стороны,для получения соединения формулы I, где -CHR3 означает 3-ацетоксициклопентил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 3 гидроксициклопентил. При этом спиртовую группу превращают в ацетоксигруппу любым обычным методом превращения спиртовой группы в ацетоксигруппу. Для получения соединения формулы VIII, где -CHR3 означает 3-фторциклопентил, в качестве исходного материала используют соединение формулы VIII, содержащее вместо группы -CHR3 остаток 3 гидроксициклопентил. Спиртовую группу заменяют на фторгруппу. При этом используют любой пригодный метод замены спиртовой группы на фторгруппу. Для получения соединения формулы VIII или IX, где -CHR3 означает 3-оксоциклопентил, в качестве исходного материала используют 3-иодметилциклопентанон (J. Org. Chem., 46, 2412-2414 (1981. Кетогруппу защищают стандартной защитной группой. При этом используют любой обычный метод превращения кетона в защищенный кетон. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по углеродному атому. Защитную группу удаляют. При этом используют любой обычный метод удаления кетонзащитной группы. Для получения соединения, содержащего 3-оксопентильный цикл в R или S конфигурации, в качестве исходного материала используют хирально-защищенный 2-циклопентен-1-он. Затем из указанного соединения стандартными методами получают защищенный йодистый алкил. Для получения соединения формулы I, где -CHR3 означает 3-гидроксииминоциклопентил, в качестве исходного материала используют соединение формулы I, содержащее вместо группы -CHR3 остаток 3-оксоциклопентил. Кетогруппу превращают в гидроксииминогруппу. При этом используют любой обычный метод превращения кетогруппы в гидроксииминогруппу. С другой стороны, для получения соединения формулы I, где -CHR3 означает 3-метоксииминоциклопентил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 3 оксоциклопентил. При этом кетогруппу превращают в метоксииминогруппу любым обычным методом превращения кетогруппы в метоксииминогруппу. Для получения соединения формулы VIII, где -CHR3 означает 3,3-дифторциклопентил, в качестве исходного соединения используют соединение формулы VIII, содержащее вместо группы -CHR3 остаток 3-оксоциклопентил. Затем кетогруппу превращают в дифторгруппу. При этом используют любой обычный метод превращения кетогруппы в дифторгруппу. Для получения соединения формулы I, где -CHR3 означает 3-гидрокси-3-метилциклопентил, в качестве исходного материала используют соединение формулы I, содержащее вместо группы -CHR3 остаток 3-оксоциклопентил. Кетогруппу превращают в 3-гидрокси-3-метилгруппу любым обычным методом превращения кетогруппы в (низш.)алкиловый третичный спирт. Для получения соединения формулы VIII или IX, где -CHR3 означает 4-оксоциклогексил, в качестве исходного соединения используют коммерческий препарат этилового эфира 4 циклогексанонкарбоновой кислоты. Кетогруппу защищают стандартной защитной группой. При этом используют любой обычный метод превращения кетона в защищенный кетон. Сложноэфирную группу восстанавливают с образованием спиртовой группы. При этом используют любой обычный метод восстановления сложноэфирной группы с образованием спиртовой группы. Из спирта получают йодистый алкил. При этом используют любой обычный метод превращения спирта в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или(низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Защитную группу удаляют. При этом используют любой пригодный метод удаления кетонзащитной группы. Для получения соединения формулы I, где -CHR3 означает 4-гидроксииминоциклогексил, в качестве исходного материала используют соединение формулы I, содержащее вместо группы -CHR3 остаток 4-оксоциклогексил. Кетогруппу превращают в гидроксииминогруппу. При этом используют любой обычный метод превращения кетогруппы в гидроксииминогруппу. С другой стороны, для получения соединения формулы I, где -CHR3 означает 4-метоксииминоциклогексил, в качестве исходного соединения используют соединение формулы I, содержащее вместо группы -CHR3 остаток 4 оксоциклогексил. Кетогруппу превращают в метоксииминогруппу. При этом используют любой обычный метод превращения кетогруппы в метоксииминогруппу. Для получения соединения формулы I, где -CHR3 означает 4-гидроксициклогексил, в качестве исходного материала используют соединение формулы I, содержащее вместо группы -CHR3 остаток 4 оксоциклогексил. Кетогруппу восстанавливают с образованием спиртовой группы. При этом используют- 15011297 любой обычный метод превращения кетогруппы в спиртовую группу. Для получения соединения формулы VIII или IX, где -CHR3 означает 3-тетрагидропиран, в качестве исходного соединения используют коммерческий препарат дигидропиран-3-она. В этой последовательности реакций кетогруппу восстанавливают с образованием спиртовой группы. При этом используют любой обычный метод превращения кетогруппы в спиртовую группу. Затем спиртовую группу переводят в мезилат. При этом используют любой обычный метод получения мезилатов спиртов. Затем мезилат заменяют на цианогруппу любым обычным методом превращения мезилата в цианогруппу. Цианогруппу превращают в карбоксильную группу. При этом используют любой пригодный метод гидролиза цианогруппы до карбоксильной группы. Карбоксильную группу востанавливают в спиртовую группу. При этом используют любой обычный метод восстановления карбоксильной группы с образованием спиртовой группы. Из спирта получают йодистый алкил. При этом используют любой обычный метод превращения спирта в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Аналогичным способом(а) из 4-бутиротиолактона получают требуемую 2-тетрагидротиофурановую -CHR3 группу,(б) из тетрагидротиофен-3-она получают требуемую 3-тетрагидротиофурановую -CHR3 группу,(в) из тетрагидротиопиран-4-она получают требуемую 4-тетрагидротиопирановую -CHR3 группу. Для получения соединения формулы VIII или IX, где -CHR3 означает 2-тетрагидротиопиран, в качестве исходного соединения используют коммерческий препарат этилового эфира 2-оксотиан-3 карбоновой кислоты. В этой последовательности реакций сложноэфирную группу превращают в карбоксильную группу. При этом используют любой обычный метод превращения сложноэфирной группы в карбоксильную группу. Кислоту декарбоксилируют. При этом используют любой обычный метод декарбоксилирования. Кетогруппу восстанавливают с образованием спиртовой группы. При этом используют любой обычный метод восстановления кетогруппы в спиртовую группу. Спиртовую группу превращают в мезилат. При этом используют любой обычный метод получения мезилатов спиртов. Затем мезилат заменяют на цианогруппу. При этом используют любой обычный метод превращения мезилата в цианогруппу. Цианогруппу превращают в карбоксильную группу. При этом используют любой обычный метод гидролиза цианогруппы до карбоксильной группы. Карбоксильную группу востанавливают в спиртовую группу. При этом используют любой обычный метод восстановления карбоксильной группы до спиртовой группы. Из спирта получают йодистый алкил. При этом используют любой обычный метод превращения спирта в йодистый алкил. Реакцию алкилирования проводят любым обычным методом алкилирования карбоновой кислоты или (низш.)алкилового эфира карбоновой кислоты по -углеродному атому. Соединение формулы I содержит асимметрический атом углерода, через который группа -CH2CHR3 соединена с заместителями в амидной группе. Предпочтительно указанный углеродный атом находится в R конфигурации. Для получения R- или S-изомера соединений формулы I, указанные соединения выделяют в форме требуемого изомера с использованием обычных химических реагентов. В качестве вспомогательного хирального реагента для асимметрического алкилирования фенилуксусной кислоты формулы V предпочтительно используют псевдоэфедрин (см., например, Myers A.G. и др., J. Am. Chem. Soc., 6496(1997. Для получения требуемых R-кислот формулы IX соединения формулы V сначала превращают в амиды псевдоэфедрина с использованием в качестве соответствующего энантиомера 1R,2R-(-)псевдоэфедрин. При этом используют любой обычный метод получения амидов карбоновых кислот. Амиды псевдоэфедрина алкилируют галогеналкилами с высокой степенью диастереоселективности с образованием -замещенных амидов формулы IX. Из этих высококообогащенных в диастереомерном отношении амидов получают высокообогащенные R-энантиомером карбоновые кислоты формулы IX. Кислоты получают из амидов обычными методами кислотного гидролиза. Из указанных R-карбоновых кислот формулы IX получают R-изомеры формулы I. При этом используют любой обычный метод конденсации первичного амина с карбоновой кислотой. Другим химическим методом получения R- или S-изомера соединений формулы I является взаимодействие соединения формулы IX с оптически активным основанием. При этом для разделения изомеров используют любое пригодное оптически активное основание. Предпочтительные оптически активные основания включают оптически активные амины, такие как -метилбензиламин, хинин, дегидроабиетиламин и -метилнафтиламин. При этом используют любые пригодные методики разделения органических кислот с использованием оптически активных оснований. Соединение формулы IX вводят в реакцию с оптически активным основанием в инертном органическом растворителе с образованием солей оптически активного амина с R- и S-изомерами соединения формулы IX. При получении солей температура и давление не имеют решающего значения и соли образуются при комнатной температуре и атмосферном давлении. Соли R- и S-изомеров разделяют любым пригодным методом, таким как фракционная кристаллизация. После кристаллизации каждую из солей гидролизуют кислотой с образованием соответ- 16011297 ствующих соединений формулы IX в R- и S-конфигурации. Предпочтительными кислотами являются разбавленные растворы кислот, т.е. от 0,001 н. до 2 н., таких как серная или соляная кислота. При проведении необходимой последовательности реакций конфигурация полученных соединений формулы IX остается неизменной, при этом получают требуемые R- и S-изомеры соединений формулы I. Рацематы соединений формулы IX также разделяют с использованием стадии получения соответствующих диастереомерных сложных эфиров или амидов. Указаные диастереомерные сложные эфиры или амиды получают конденсацией карбоновых кислот формулы IX с хиральным спиртом или хиральным амином. Реакцию проводят с использованием любого пригодного метода конденсации карбоновой кислоты со спиртом или амином. Соответствующие диастереомеры соединений формулы IX можно разделять любыми пригодными методами разделения. Затем полученные очищенные диастереомерные сложные эфиры или амиды гидролизуют с образованием соответствующих чистых R- и S-изомеров. Гидролиз проводят известными методами гидролиза сложных эфиров или амидов, которые исключают рацемизацию. Наконец, R- и S-изомеры можно разделять с использованием ферментативного гидролиза любых(низш.)алкиловых сложных эфиров соответствующих соединений формулы VIII (см., например, AhmarM., Girard С., Bloch R., Tetrahedron Lett, 7053 (1989 с образованием смеси соответствующей хиральной кислоты и хирального эфира. Сложный эфир и кислоту разделяют любым пригодным методом отделения кислоты от эфира. При проведении необходимой последовательности реакций конфигурация полученных соединений формулы VIII остается неизменной, при этом получают требуемые R- и S-изомеры соединений формулы I. Все соединения формулы I, которые включают соединения, перечисленные в примерах, активировали глюкокиназу in vitro при проведении биологических испытаний по методике, описанной в примере А. Таким образом, эти соединения увеличивают интенсивность метаболизма глюкозы, что вызывает повышенную секрецию инсулина. Следовательно, соединения формулы I являются активаторами глюкокиназы и могут применяться для повышения секреции инсулина. По результатам испытаний, описанным в примере Б, следующие соединения обладают высокой активностью в качестве активаторов глюкокиназы in vivo при пероральном введении:N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидропиран-4-ил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-N-[5-(N-гидроксикарбамимидоил)пиразин-2-ил]-3-(тетрагидропиран-4-ил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)-N-пиразин-2-илпропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-3-R)-3-оксоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-оксоциклопентил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-гидроксииминоциклопентил)пропионамид,2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)-N-пиразин-2-илпропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(3-метоксииминоциклопентил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-оксоциклогексил)пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил)пропионамид,N-(5-бромпиразин-2-ил)-2(R)-(3-хлор-4-метансульфонилфенил)-3-(4-гидроксииминоциклогексил) пропионамид,2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксииминоциклогексил) пропионамид. Благодаря способности активировать глюкокиназу соединения формулы I могут использоваться в качестве лекарственных средств для лечения диабета типа II. Следовательно, как указано выше, лекарственные средства, содержащие соединения формулы I, также являются объектом настоящего изобретения. Объектом изобретения является также способ получения таких лекарственных средств, который включает переработку одного или более соединений формулы I и, при необходимости, одного или более других терапевтически ценных соединений, в готовую галеновую форму, например, при смешивании соединения формулы I с фармацевтически приемлемым носителем и/или адъювантом. Фармацевтические композиции можно вводить перорально, например, в форме таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий. Композиции можно также вводить ректальным способом, например, с использованием суппозиториев; местным или чрескожным способом, например, в форме мазей, кремов, гелей или растворов; или парентеральным способом, например внутривенно, внутримышечно, подкожно, подоболочечно или чрескожно,например, с использованием инъекционных растворов. Кроме того, композиции можно вводить сублин- 17011297 гвальным способом или в виде аэрозоля, например, в форме спрея. При получении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул соединения по настоящему изобретению смешивают с фармацевтически инертными неорганическими или органическими эксципиентами. Примеры пригодных эксципиентов для таблеток, драже или твердых желатиновых капсул включают лактозу, кукурузный крахмал или его производные, тальк или стеариновую кислоту или ее соли. Пригодные носители для мягких желатиновых капсул включают, например, растительные масла, воски, жиры, полутвердые или жидкие полиолы и т.п. В зависимости от природы активного соединения в случае мягких желатиновых капсул обычно не требуется никаких эксципиентов. При получении растворов и сиропов для инъекций в качестве эксципиентов используются вода, полиолы, сахароза,инвертированный сахар и глюкоза. Пригодные эксципиенты для инъекционных растворов включают,например, воду, спирты, полиолы, глицерин и растительные масла. Пригодными носителями для суппозиториев, для местного или чрескожного введения являются, например, твердые или отвержденные масла, воски, жиры и полутвердые или жидкие полиолы. Фармацевтические композиции могут также содержать консерванты, солюбилизирующие агенты, стабилизирующие агенты, смачивающие агенты,эмульгирующие агенты, подсластители, красители, ароматизаторы, соли для регуляции осмотического давления, буферные вещества, обволакивающие агенты или антиоксиданты. Кроме того, они могут содержать другие терапевтически ценные агенты. Предполагается, что все используемые адъюванты являются нетоксичными. Предпочтительными формами введения являются внутривенный, внутримышечный или пероральный способ, наиболее предпочтительно пероральное введение. Дозы введения соединений формулы I в терапевтически эффективных количествах зависят от природы конкретного активного ингредиента, возраста и требований пациента и способа введения. В общем случае, дозы составляют приблизительно 1100 мг/кг массы тела в сутки. Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Примеры Пример 1. 1-[2-(3,4-Дихлорфенил)-3-(тетрагидрофуран-2-ил)пропионил]-3-метилмочевина. К раствору трифенилфосфина (11,90 г, 45,41 ммоль) и имидазола (6,18 г, 90,82 ммоль) в хлористом метилене (80 мл) при 0 С медленно добавляли иод (11,53 г, 45,41 ммоль), а затем добавляли по каплям раствор (тетрагидрофуран-2-ил)метанола (4,0 мл, 41,28 ммоль) в хлористом метилене (5 мл). Полученную реакционную смесь нагревали до 25 С при перемешивании в течение 4 ч. Затем смесь разбавляли водой (25 мл) и экстрагировали хлористым метиленом (320 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме при 25 С. Полученное твердое вещество промывали пентаном (450 мл), экстракт фильтровали через слой силикагеля и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш,элюент: пентан/эфир, 80:20), при этом получали 2-иодметилтетрагидрофуран (2,09 г, 25%) в виде прозрачной бесцветной жидкости. МС-ВР (EI): m/e рассч. для C5H9IO (М+) 211,9698, найд. 211,9708. К раствору (3,4-дихлорфенил)уксусной кислоты (14,0 г, 0,07 моль) в метаноле (71 мл) добавляли каталитическое количество конц. серной кислоты и реакционную смесь кипятили с обратным холодильником в течение 12 ч. Затем смесь концентрировали в вакууме, остаток очищали экспрессхроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, 50:50), при этом получали метиловый эфир (3,4-дихлорфенил)уксусной кислоты (15,0 г, колич.) в виде твердого вещества белого цвета. tпл. 30-32C. MC-BP (EI): m/e рассч. для C9H8Cl2O2 (М+) 217,9901, найд. 217,9907. Раствор диизопропиламина (0,59 мл, 4,51 ммоль) в тетрагидрофуране (30 мл) охлаждали до -78 С в атмосфере аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (1,8 мл, 4,51 ммоль). Реакционную смесь перемешивали при -78 С в течение 15 мин, затем медленно через трубку добавляли раствор метилового эфира (3,4-дихлорфенил)уксусной кислоты (825 мг, 3,76 ммоль) в тетрагидрофуране (3 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (1 мл). Раствор ярко-желтого цвета перемешивали при -78 С в течение 1 ч, а затем медленно через трубку добавляли раствор 2-иодметилтетрагидрофурана(798 мг, 3,76 ммоль) в 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (0,5 мл). Реакционную смесь перемешивали при -78 С в течение 1 ч и нагревали до 25 С при перемешивании в течение 14 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (20 мл) и смесь экстрагировали этилацетатом (320 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк,230-400 меш, элюент: гексан/этилацетат, 90:10), при этом получали метиловый эфир 2-(3,4-дихлофенил)3-(тетрагидрофуран-2-ил)пропионовой кислоты (501 мг, 44%) в виде бесцветного масла. MC-BP (EI): m/e- 18011297 рассч. для C14H16Cl2O3 (M+) 302,0477, найд. 302,0464. Раствор метилового эфира 2-(3,4-дихлорфенил)-3-(тетрагидрофуран-2-ил)пропионовой кислоты(617 мг, 2,04 ммоль), метилмочевины (302 мг, 4,07 ммоль) и раствор метоксида магния в метаноле (7,4 мас.%, 4,63 мл, 3,06 ммоль) нагревали при 100 С в течение 8 ч. Затем смесь концентрировали в вакууме,остаток растворяли в этилацетате (50 мл) и раствор фильтровали через слой силикагеля. Фильтрат концентрировали в вакууме, неочищенный продукт очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, 80:20), при этом получали 1-[2-(3,4-дихлорфенил)-3(тетрагидрофуран-2-ил)пропионил]-3-метилмочевину в виде твердого вещества белого цвета. MC-BP К раствору свежеполученного диизопропиламида лития (23 мл 0,31 М раствора, 7,13 ммоль) при-78 С добавляли (3,4-дихлорфенил)уксусную кислоту (696 мг, 3,39 ммоль) в тетрагидрофуране/1,3 диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (8,5 мл, 3:1). Полученную смесь перемешивали при-78 С в течение 45 мин, при этом к смеси добавляли раствор 2-бромметилтетрагидрофурана (672 мг, 4,07 ммоль) в 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (2 мл). Реакционную смеь перемешивали-78 С в течение 2 ч, а затем смесь нагревали до 25 С и перемешивали при 25 С в течение 18 ч. Реакцию останавливали добавлением по каплям насыщенного раствора хлорида аммония, избыток растворителя удаляли в вакууме, остаток разбавляли водой (50 мл) и подкисляли добавлением 1 н. соляной кислоты. Раствор экстрагировали этилацетатом (350 мл), экстракт промывали насыщенным раствором хлорида лития (1100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, содержащий ледяную уксусную кислоту, 50:50), при этом получали 2-(3,4-дихлофенил)3-(тетрагидрофуран-2-ил)пропионовую кислоту (692,3 мг, 70,8%) в виде твердого вещества белого цвета.N,N-диизопропилэтиламин (260 мкл, 1,49 ммоль) и смесь перемешивали в атмосфере азота при 25 С в течение 18 ч. Затем смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (350 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, 50:50), при этом получали 2-(3,4-дихлорфенил)-3-(тетрагидрофуран-2-ил)-N-тиазол-2 илпропионамид (232,2 мг, 88,4%) в виде твердого вещества белого цвета. tпл. 69-71C. MC-BP (EI): m/e рассч. для C16H16Cl2N2O2S (M+) 370,0309, найд. 370,0309. Пример 3. 2-(4-Метансульфонилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2-илпропионамид. Раствор (R)-(+)-тетрагидро-2-фурановой кислоты (8,0 г, 68,9 ммоль) в сухом тетрагидрофуране (100 мл) в атмосфере аргона охлаждали на ледяной бане и добавляли по каплям борандиметилсульфид (19,6 мл, 207,0 ммоль). Реакционную смесь перемешивали при 25 С в течение 2 ч, а затем вновь охлаждали на ледяной бане до 0 С. Реакцию останавливали добавлением по каплям воды, затем смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (375 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспрессхроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, 25:75), при этом получали (R)-(тетрагидрофуран-2-ил)метанол (5,91 г, 84%) в виде бесцветного масла. []23 589 -16,69 (с 5,2, хлороформ). Раствор (R)-(тетрагидротиопиран-3-ил)метанола (1,0 г, 9,8 ммоль) в хлористом метилене (35 мл) охлаждали до -78 С, а затем добавляли 2,6-лутидин (1,71 мл, 14,7 ммоль) и ангидрид трифторметансульфоновой кислоты (1,98 мл, 11,76 ммоль). Смесь перемешивали при -78 С в течение 40 мин, а затем разбавляли гексаном (40 мл) и промывали насыщенным раствором бикарбоната натрия (125 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали в ва- 19011297 кууме, при этом получали (R)-тетрагидрофуран-2-илметиловый эфир трифторметансульфоновой кислоты в виде неочищенного масла. К раствору 4-(метилтио)фенилуксусной кислоты (6,91 г, 37,9 ммоль) в метаноле (100 мл) медленно добавляли конц. серную кислоту (1 мл) и полученную реакционную смесь кипятили с обратным холодильником в течение 19 ч. Затем реакционную смесь охлаждали до 25 С и концентрировали в вакууме для удаления метанола. Полученную смесь разбавляли этилацетатом (200 мл), органический слой промывали насыщенным раствором бикарбоната натрия (3300 мл) и насыщенным раствором хлорида натрия (1100 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали метиловый эфир (4-метилсульфанилфенил)уксусной кислоты (7,28 г, 98%) в виде жидкости желтого цвета, который использовали без дополнительной очистки. МС-ВР (EI): m/e рассч. для C10H12O2S (M+) 196,0558, найд. 196,0559. Раствор диизопропиламина (1,21 мл, 8,62 ммоль) в сухом тетрагидрофуране (30 мл) охлаждали до-78 С в атмосфере аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (3,3 мл, 8,25 ммоль). Реакционную смесь перемешивали при -78 С в течение 30 мин, а затем добавляли по каплям раствор метилового эфира (4-метилсульфанилфенил)уксусной кислоты (1,47 г, 7,5 ммоль) в сухом тетрагидрофуране (10 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (3,34 мл). Реакционную смесь, которая приобретала золотой цвет, перемешивали при -78 С в течение 1 ч, а затем добавляли раствор (R)тетрагидрофуран-2-илметилового эфира трифторметансульфоновой кислоты (2,30 г, 9,8 ммоль) в сухом тетрагидрофуране (10 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 16 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (30 мл) и концентрировали в вакууме для удаления тетрагидрофурана. Водный слой экстрагировали этилацетатом (375 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40M,диоксид кремния, элюент: гексан/этилацетат, 9:1), при этом получали метиловый эфир 2-(4 метилсульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовой кислоты (0,810 г, 39%) в виде масла светло-желтого цвета. []23589 -10,87 (с 0,46, хлороформ). МС-ВР (EI): m/e рассч. для C15H20O3S (M+) 280,1133, найд. 280,1130. К раствору метилового эфира 2-(4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)ил)пропионовой кислоты (0,693 г, 2,47 ммоль) в метаноле (10 мл) добавляли 0,8 М раствор гидроксида лития (4,01 мл, 4,94 ммоль). Реакционную смесь перемешивали при 25 С в течение 16 ч, а затем концентрировали в вакууме для удаления метанола. Водный слой подкисляли 10% соляной кислотой до рН 2 и экстрагировали этилацетатом (210 мл). Объединенные органические слои промывали насыщенным раствором хлорида аммония (110 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали очищенную 2-(4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)ил)пропионовую кислоту (0,653 г, 99%) в виде светло-желтого масла, которое кристаллизовалось при хранении. tпл. 105-107C. []23589 -14,93 (с 0,75, хлороформ). МС-ВР (EI): m/e рассч. для C14H18O3S (M+) 266,0976, найд. 266,0976. К раствору 2-(4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовой кислоты (0,075 г,0,28 ммоль), гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (0,186 г, 0,42 ммоль) и 2-аминотиазола (0,042 г, 0,42 ммоль) в хлористом метилене (10 мл) при 25 С добавляли триэтиламин(0,12 мл, 0,84 ммоль) и полученную смесь перемешивали при 25 С в течение 16 ч. Затем смесь разбавляли водой (10 мл) и экстрагировали хлористым метиленом (310 мл). Объединенные органические слои последовательно промывали водой (110 мл), 1 н. раствором гидроксида натрия (110 мл), 1 н. соляной кислотой (110 мл) и насыщенным раствором хлорида натрия (110 мл). Затем органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40S, диоксид кремния, элюент: гексан/этилацетат,2:3), при этом получали 2-(4-метансульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2 илпропионамид (0,068 г, 70%) в виде пены светло-желтого цвета. []23589 -32,91 (с 0,24, хлороформ). МС-ВР (EI): m/e рассч. для C17H20N2O2S2 (М+) 348,0966, найд. 348,0968. Раствор 2-(4-метансульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2-илпропионамида(0,061 г, 0,18 ммоль) в муравьиной кислоте (0,20 мл, 5,25 ммоль) охлаждали до 0 С, а затем добавляли 30% раствор пероксида водорода (0,10 мл, 0,875 ммоль). Полученный раствор перемешивали при 0 С в течение 5 мин, а затем нагревали до 25 С при перемешивании в течение 1 ч. Смесь охлаждали до 0 С и реакцию останавливали добавлением 10% раствора бисульфита натрия. Смесь разбавляли водой (5 мл) и экстрагировали этилацетатом (25 мл). Объединенные органические слои сушили над сульфатом натрия,фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40S, диоксид кремния, элюент: гексан/этилацетат, 2:3), при этом получали 2-(4-метансульфонилфенил)-3-(тетрагидрофуран-2(R)-ил)-N-тиазол-2-илпропионамид (0,062 г, 70%) в виде пены белого цвета, []23589 -33,0 (с 0,20, хлороформ). MC-BP (EI): m/e рассч. для C17H20N2O4S2 (М+) 380,0864, найд. 380,0873. Пример 4. 2-(3-Хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропи- 20011297 онамид. Раствор трихлорида алюминия (54,9 г, 412 ммоль) в хлороформе (180 мл) в атмосфере аргона охлаждали до 0 С и добавляли по каплям раствор метилового эфира хлороксоуксусной кислоты (24,3 мл, 264 ммоль) в хлороформе (180 мл). Реакционную смесь перемешивали при 0 С в течение 30 мин, а затем добавляли по каплям раствор 2-хлортиоанизола (39,4 г, 247 ммоль) в хлороформе (180 мл), при этом смесь окрашивалась в красный цвет. Полученную смесь нагревали до 25 С при перемешивании в течение 4 ч. Затем смесь медленно выливали в лед (700 мл), полученную смесь желтого цвета перемешивали в течение 15 мин и фильтровали через целит для удаления солей алюминия. Фильтрат экстрагировали хлористым метиленом (350 мл), объединенные органические слои промывали насыщенным раствором бикарбоната натрия (150 мл), сушили над сульфатом магния, фильтровали и концентрировали в вакууме, при этом получали метиловый эфир (3-хлор-4-метилсульфанилфенил)оксоуксусной кислоты (36,4 г, 60%) в виде масла светло-желтого цвета. МС-ВР (EI): m/e рассч. для C10H9ClO3S (М+) 243,9961, найд. 243,9958. Раствор метилового эфира (3-хлор-4-метилсульфанилфенил)оксоуксусной кислоты (61,7 г, 252 ммоль) в толуоле (120 мл) нагревали до 50 С, а затем через капельную воронку добавляли по каплям 3 М раствор гидроксида натрия (105 мл, 313 ммоль), поддерживая температуру не выше 60 С. После добавления реагента смесь перемешивали при 50 С в течение еще 1,5 ч, при этом наблюдалось образование осадка желтого цвета. Нагревание прекращали и к теплому раствору добавляли по каплям конц. соляную кислоту (10,6 мл, 290 ммоль). Полученный раствор охлаждали до 25 С и перемешивали при указанной температуре в течение 16 ч. Твердое вещество отделяли фильтрованием, промывали водой (50 мл) и толуолом (50 мл). Твердое вещество высушивали в вакууме в течение 1 ч, а затем при высоком вакууме в вакуум-эксикаторе, при этом получали (3-хлор-4-метилсульфанилфенил)оксоуксусную кислоту (57,22 г,98%) в виде твердого вещества белого цвета. tпл. 166C (разл.). МС-ВР (FAB): m/e рассч. для C9H7ClO3S(M+Na)+ 252,9702, найд. 252,9700. В реакционную колбу, снабженную механической мешалкой, помещали гидразингидрат (8,5 мл,273 ммоль), охлаждали до -50 С и одной порцией добавляли (3-хлор-4-метилсульфанилфенил)оксоуксусную кислоту (12,6 г, 54,6 ммоль), при этом происходило выделение тепла и повышение температуры смеси. Полученную смесь белого цвета нагревали до 80 С, после чего нагревание прекращали и одной порцией добавляли гидроксид калия (2,09 г, 31,7 ммоль), при этом налюдалось выделение тепла. Затем смесь перемешивали при 25 С до снижения температуры реакционной смеси до 80 С, после чего добавляли вторую порцию гидроксида калия (2,09 г, 31,7 ммоль), при этом вновь наблюдалось выделение тепла. Смесь вновь охлаждали до 80 С и добавляли третью порцию гидроксида калия (2,09 г, 31,7 ммоль),при этом вновь наблюдалось выделение тепла. Смесь охлаждали до 80 С, добавляли последнюю четвертую порцию гидроксида калия (2,09 г, 31,7 ммоль) и смесь нагревали при 100 С в течение 16 ч. Гомогенную реакционную смесь охлаждали до 25 С и разбавляли водой (12 мл). Затем смесь переносили в делительную воронку, добавляли воду (12 мл) и диэтиловый эфир (40 мл), слои разделяли и водный слой переносили в колбу. Органический слой экстрагировали водой (215 мл), водные экстракты объединяли,добавляли гептан (20 мл) и смесь тщательно перемешивали. Затем к раствору в течение 30 мин добавляли по каплям конц. соляную кислоту (26 мл), поддерживая температуру смеси не выше 50 С на ледяной бане. Опалесцирующую суспензию перемешивали при 25 С в течение 3 ч, твердое вещество отделяли фильтрованием и последовательно промывали 1 н. соляной кислотой (26 мл), гептаном (112 мл) и гептаном/диэтиловым эфиром (15 мл, 4:1). Твердое вещество высушивали в высоком вакууме, при этом получали (3-хлор-4-метилсульфанилфенил)уксусную кислоту (10,48 г, 89%) в виде твердого вещества грязно-белого цвета. tпл. 105,6-108,4C. MC-BP (EI): m/e рассч. для C9H9ClO2S (M+) 216,0012, найд. 216,0022. К раствору (3-хлор-4-метилсульфанилфенил)уксусной кислоты (7,00 г, 32,30 ммоль) в метаноле(150 мл) медленно добавляли конц. серную кислоту (2,8 мл, 52,65 ммоль) и полученную реакционную смесь кипятили с обратным холодильником в течение 1,5 ч. Затем смесь охлаждали до 25 С и концентрировали в вакууме для удаления метанола. Остаток разбавляли этилацетатом (500 мл), органическую фазу последовательно промывали насыщенным раствором бикарбоната натрия (1200 мл) и насыщенным раствором хлорида натрия (1200 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали метиловый эфир (3-хлор-4-метилсульфанилфенил)уксусной кислоты(7,41 г, 99,4%) в виде масла светло-желтого цвета. MC-BP (EI): m/e рассч. для C10H11ClO2S (M+) 230,0168,найд. 230,0166. Раствор (R)-(тетрагидротиопиран-3-ил)метанола (3,0418 г, 4,095 ммоль, полученного, как описано в примере 3) в хлористом метилене (10 мл) охлаждали до -78 С, добавляли 2,4,6-коллидин (830 мкл, 6,3 ммоль), а затем ангидрид трифторметансульфоновой кислоты (830 мкл, 4,91 ммоль). Смесь перемешива- 21011297 ли при -78 С в течение 40 мин, а затем разбавляли гексаном (20 мл) и промывали насыщенным раствором бикарбоната натрия (110 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме, при этом получали (R)-(тетрагидрофуран-2 ил)метиловый эфир трифторметансульфоновой кислоты в виде неочищенного масла. Раствор диизопропиламина (0,55 мл, 3,94 ммоль) в сухом тетрагидрофуране (10 мл) охлаждали до-78 С в атмосфете аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (1,51 мл, 3,78 ммоль). Реакционную смесь перемешивали при -78 С в течение 30 мин, а затем добавляли по каплям раствор метилового эфира (3-хлор-4-метилсульфанилфенил)уксусной кислоты (0,72 г, 3,15 ммоль) в сухом тетрагидрофуране (3,5 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (1,2 мл). Реакционную смесь, которая приобретала золотой цвет, перемешивали при -78 С в течение 1 ч, а затем добавляли раствор (R)-тетрагидрофуран-2-илметилового эфира трифторметансульфоновой кислоты (0,959 г, 4,10 ммоль) в сухом тетрагидрофуране (2 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 52 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (25 мл) и концентрировали в вакууме для удаления тетрагидрофурана. Водный слой экстрагировали этилацетатом (350 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш,элюент: гексан/этилацетат, от 9:1 до 85:15), при этом получали метиловый эфир 2-(3-хлор-4 метилсульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовой кислоты (0,519 г, 52%) в виде масла светло-желтого цвета. []23589 -19,02 (с 0,51, хлороформ). MC-BP (EI): m/e рассч. для C15H19ClO3S (М+) 314,0743, найд. 314,0743. К раствору метилового эфира 2-(3-хлор-4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)ил)пропионовой кислоты (0,519 г, 1,65 ммоль) в метаноле (7 мл) добавляли 0,8 М раствор гидроксида лития (40,7 мл, 33,0 ммоль). Реакционную смесь перемешивали при 25 С в течение 1,5 ч, а затем концентрировали в вакууме для удаления метанола. Водный слой подкисляли 10% соляной кислотой до рН 2 и экстрагировали этилацетатом (2100 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия (1100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали очищенную 2-(3-хлор-4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)ил)пропионовую кислоту (0,495 г, 95,8%) в виде светло-желтого масла, которое кристаллизовалось при хранении. tпл. 93-96C. []23589 -23,7 (с 0,46, хлороформ). МС-ВР (EI): m/e рассч. для C14H17ClO3S (M+) 300,0587, найд. 300,0579. К раствору 2-(3-хлор-4-метилсульфанилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовой кислоты(60 мг, 0,2 ммоль) в хлористом метилене (5 мл) добавляли N,N-диметилформамид (3 капли) и смесь охлаждали до 0 С. Затем к реакционной смеси добавляли 2,0 М раствор оксалилхлорида в хлористом метилене (110 мкл, 0,22 ммоль), смесь перемешивали при 0 С в течение 30 мин, а затем нагревали до 25 С. Смесь концентрировали в вакууме для удаления растворителей и избытка оксалилхлорида. Остаток растворяли в тетрагидрофуране (5 мл) и добавляли по каплям раствор 2-аминопиразина (57 мг, 0,6 ммоль) в тетрагидрофуране (1 мл) и пиридине (65 мкл, 0,8 ммоль). Полученную смесь перемешивали при 0 С в течение 45 мин, затем разбавляли водой (2 мл) и экстрагировали хлористым метиленом (35 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, 1:4), при этом получали 2-(3-хлор-4-метилсульфанилфенил)-Nпиразин-2-ил-3(R)-(тетрагидрофуран-2-ил)пропионамид (50 мг, 66,1%) в виде бесцветной смолы. []23589-43,33 (с 0,45, хлороформ). МС-ВР (EI): m/e рассч. для C18H20ClN2O2S (М+) 377,0965, найд. 377,0979. Раствор 2-(3-хлор-4-метилсульфанилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамида (0,060 г, 0,16 ммоль) в муравьиной кислоте (0,19 мл, 4,8 ммоль) охлаждали до 0 С, а затем добавляли 30% раствор пероксида водорода (0,10 мл, 0,8 ммоль). Полученный раствор перемешивали при 0 С в течение 30 мин, а затем реакцию останавливали добавлением 10% раствора бисульфита натрия. Смесь разбавляли водой (5 мл) и экстрагировали этилацетатом (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток растворяли в метаноле(1 мл) и добавляли по каплям раствор перманганата калия (0,028 г, 0,176 ммоль) в воде (0,5 мл). Раствор темно-коричневого цвета перемешивали при 25 С в течение 30 мин, разбавляли метанолом (10 мл),фильтровали для удаления солей и фильтрат концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, от 1:1 до 1:4), при этом получали 2-(3-хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3(тетрагидрофуран-2(R)-ил)пропионамид (44 мг, 67,1%) в виде бесцветной смолы. MC-BP: m/e рассч. для К раствору (4-фтор-3-трифторметилфенил)уксусной кислоты (4,90 г, 22,06 ммоль) в метаноле (40 мл) добавляли конц. серную кислоту (7 капель) и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Затем смесь концентрировали в вакууме, остаток растворяли в этилацетате (100 мл),промывали насыщенным раствором бикарбоната натрия (150 мл) и насыщенным раствором хлорида натрия (150 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали метиловый эфир (4-фтор-3-трифторметилфенил)уксусной кислоты (5,02 г, 96%) в виде бесцветного масла. Раствор диизопропиламина (1,86 мл, 13,29 ммоль) в сухом тетрагидрофуране (45 мл) охлаждали до-78 С в атмосфере аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (5,10 мл, 12,75 ммоль). Реакционную смесь перемешивали при -78 С в течение 30 мин, а затем добавляли по каплям раствор метилового эфира (4-фтор-3-трифторметилфенил)уксусной кислоты (2,51 г, 10,63 ммоль) в сухом тетрагидрофуране (15 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (6,5 мл). Реакционную смесь,которая приобретала золотой цвет, перемешивали при -78 С в течение 1 ч, при этом к смеси добавляли раствор (R)-тетрагидрофуран-2-илметилового эфира трифторметансульфоновой кислоты (3,23 г, 13,81 ммоль, полученного, как описано в примере 3) в сухом тетрагидрофуране (15 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 16 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (30 мл) и смесь концентрировали в вакууме для удаления тетрагидрофурана. Водный слой экстрагировали этилацетатом (3150 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40M, диоксид кремния, элюент: гексан/этилацетат, 85:15), при этом получали метиловый эфир 2-(4-фтор-3-трифторметилфенил)-3(тетрагидрофуран-2(R)-ил)пропионовой кислоты (2,50 г, 39%) в виде бесцветного масла. []23589 -18,62(с 0,29, хлороформ). МС-ВР (EI): m/e рассч. для C15H20O3S (M+Na)+ 343,0928, найд. 343,0927. К раствору метилового эфира 2-(4-фтор-3-трифторметилфенил)-3-(тетрагидрофуран-2(R)ил)пропионовой кислоты (1,97 г, 6,15 ммоль) в сухом N,N-диметилформамиде (20 мл) при 25 С в атмосфере аргона осторожно добавляли тиометоксид натрия (0,680 г, 9,27 ммоль) и полученную смесь нагревали при 100 С в течение 3 ч. Затем смесь концентрировали в вакууме для удаления N,Nдиметилформамида. Остаток суспендировали в насыщенном растворе хлорида аммония (100 мл) и смесь экстрагировали этилацетатом (2200 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток растворяли в метаноле (40 мл) и добавляли 0,8 М раствор гидроксида лития (20,60 мл, 16,7 ммоль). Реакционную смесь перемешивали при 25 С в течение 16 ч, а затем концентрировали в вакууме для удаления метанола. Водный слой подкисляли 10% соляной кислотой до рН 2 и экстрагировали этилацетатом (2200 мл). Объединенные органические слои промывали насыщенным раствором хлорида натрия (1100 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали очищенную 2-(4-метилсульфанил-3 трифторметилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовую кислоту (1,71 г, 83%) в виде масла светло-желтого цвета. []23589 -23,26 (с 0,49, хлороформ). МС-ВР (EI): m/e рассч. для C15H17F3O3S (M-H2O)+ 316,0744, найд. 316,0749. К раствору 2-(4-метилсульфанил-3-трифторметилфенил)-3-(тетрагидрофуран-2(R)-ил)пропионовой кислоты (67 мг, 0,20 ммоль) в хлористом метилене (5 мл) добавляли N,N-диметилформамид (3 капли) и смесь охлаждали до 0 С. Затем к реакционной смеси добавляли 2,0 М раствор оксалилхлорида в хлористом метилене (0,11 мл, 0,22 ммоль), смесь перемешивали при 0 С в течение 30 мин, нагревали до 25 С,а затем концентрировали в вакууме для удаления растворителей и избытка оксалилхлорида. Остаток растворяли в тетрагидрофуране (5 мл) и добавляли по каплям раствор 2-аминопиразина (57 мг, 0,60 ммоль) в тетрагидрофуране (2 мл) и пиридине (0,065 мл, 0,80 ммоль). Полученную смесь перемешивали при 25 С в течение 1,5 ч, затем разбавляли водой (50 мл) и экстрагировали хлористым метиленом (350 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, 1:1), при этом получали 2-(4-метилсульфанил-3 трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид (51 мг, 61%) в виде бесцветной смолы. MC-BP (EI): m/e рассч. для C19H20F3N3O2S (М+) 411,1228, найд. 411,1229. Раствор 2-(4-метилсульфанил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)ил)пропионамида (0,054 г, 0,13 ммоль) в муравьиной кислоте (0,16 мл, 3,0 ммоль) охлаждали до 0 С, а затем добавляли 30% раствор пероксида водорода (0,08 мл, 0,65 ммоль). Полученный раствор перемешивали при 0 С в течение 30 мин, а затем реакцию останавливали добавлением 10% раствора бисульфита- 23011297 натрия. Смесь разбавляли водой (5 мл) и экстрагировали этилацетатом (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали для удаления твердого вещества и концентрировали в вакууме. Остаток растворяли с метаноле (1 мл) и добавляли по каплям раствор перманганата калия (0,023 г, 0,143 ммоль) в воде (0,5 мл). Раствор темно-коричневого цвета перемешивали при 25 С в течение 30 мин, разбавляли метанолом (10 мл), фильтровали и фильтрат концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, от 7:3 до 1:1), при этом получали 2-(4-метансульфонил-3 трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-2(R)-ил)пропионамид (33 мг, 57,3%) в виде бесцветной смолы. МС-ВР: m/e рассч. для C19H20F3N3O4S (М+) 443,1127, найд. 443,1137. Пример 6. 2-(3-Хлор-4-метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-3-ил)пропионамид. К раствору тетрагидро-3-фуранметанола (3,0 г, 29,4 ммоль) в хлористом метилене (45 мл) при 25 С добавляли 4-(диметиламино)пиридин (3,99 г, 32,31 ммоль) и паратолуолсульфонилхлорид (5,60 г, 29,37 ммоль) и реакционную смесь перемешивали при 25 С в течение ночи. Затем смесь переносили в делительную воронку, промывали 1 н. соляной кислотой (30 мл) и насыщенным раствором бикарбоната натрия (20 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали с использованием системы Biotage (колонка FLASH 40M, диоксид кремния,элюент: гексан/этилацетат, 60:40), при этом получали тетрагидрофуран-3-илметиловый эфир толуол-4 сульфоновой кислоты (6,57 г, 97%) в виде бесцветного масла. МС-ВР (ES)+: m/e рассч. для C12H16O4S(M+Na)+ 279,0661, найд. 279,0664. Раствор тетрагидрофуран-3-илметилового эфира толуол-4-сульфоновой кислоты (6,50 г, 25,36 ммоль) и иодида натрия (11,02 г, 73,54 ммоль) в ацетоне (200 мл) нагревали при 60 С в течение 16 ч. Затем полученную суспензию охлаждали до 10 С и фильтровали. Осадок солей промывали холодным ацетоном(50 мл). Фильтрат и промывные фракции концентрировали в вакууме, при этом получали густую суспензию. К остатку добавляли хлористый метилен (100 мл), осадок отделяли фильтрованием и промывали хлористым метиленом (20 мл). Фильтрат и промывные фракции сушили над сульфатом магния, фильтровали через слой силикагеля и концентрировали в вакууме, при этом получали 3 иодметилтетрагидрофуран в виде масла светло-желтого цвета. Раствор диизопропиламина (0,84 мл, 5,98 ммоль) в тетрагидрофуране (10 мл) охлаждали до -78 С в атмосфете аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (2,29 мл, 5,72 ммоль). Реакционную смесь перемешивали при -78 С в течение 15 мин, при этом медленно добавляли раствор метилового эфира (3-хлор-4-метилсульфанилфенил)уксусной кислоты (1,20 г, 5,20 ммоль, полученный, как описано в примере 4) в тетрагидрофуране (5 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (0,75 мл). Раствор ярко-желтого цвета перемешивали при -78 С в течение 1 ч, при этом через трубку добавляли раствор 3-иодметилтетрагидрофурана (2,21 г, 10,4 ммоль) в 1,3-диметил-3,4,5,6-тетрагидро-2(1H)пиримидиноне (0,69 мл) и тетрагидрофуране (5 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 48 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония(30 мл) и смесь экстрагировали этилацетатом (330 мл). Органические слои объединяли, промывали 10% серной кислотой (25 мл) и насыщенным раствором бикарбоната натрия (25 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40M, диоксид кремния, элюент: гексан/этилацетат, 75:25), при этом получали метиловый эфир 2-(3-хлор-4-метилсульфанилфенил)-3(тетрагидрофуран-3-ил)пропионовой кислоты (663 мг, 41%) в виде масла светло-желтого цвета. МС-ВР(EI): m/e рассч. для C15H19ClO3S (M+) 314,0743, найд. 314,0729. Раствор метилового эфира 2-(3-хлор-4-метилсульфанилфенил)-3-(тетрагидрофуран-3 ил)пропионовой кислоты (663 мг, 2,11 ммоль) в муравьиной кислоте (0,79 мл) и тетрагидрофуране (2,89 мл) охлаждали на ледяной бане до 0 С, а затем добавляли 30% раствор пероксида водорода (1,19 мл,10,53 ммоль). Реакционную смесь медленно нагревали до 25 С и перемешивали при 25 С в течение 16 ч. Затем смесь охлаждали до 0 С и реакцию останавливали добавлением насыщенного раствора сульфита натрия. Раствор экстрагировали этилацетатом (320 мл), объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40S, диоксид кремния, элюент: гексан/этилацетат,50:50), при этом получали метиловый эфир 2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидрофуран-3 ил)пропионовой кислоты (729 мг, 100%) в виде твердого воскообразного вещества белого цвета. MC-BP- 24011297 К раствору метилового эфира 2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидрофуран-3 ил)пропионовой кислоты (729 мг, 2,10 ммоль) в этаноле (20 мл) добавляли раствор гидроксида калия(694 мг, 10,51 ммоль) в воде (7 мл). Реакционную смесь перемешивали при 25 С в течение 3 ч, концентрировали в вакууме для удаления этанола, а затем подкисляли 1 н. соляной кислотой до рН 2. Затем полученную смесь экстрагировали хлористым метиленом (310 мл). Органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали 2-(3-хлор-4 метансульфонилфенил)-3-(тетрагидрофуран-3-ил)пропионовую кислоту (654 мг, 94%) в виде пены белого цвета. МС-ВР (ES): m/e рассч. для C14H17ClO5S (M+Na)+ 355,0377, найд. 355,0382. Раствор трифенилфосфина (118 мг, 0,45 ммоль) в хлористом метилене (5 мл) охлаждали до 0 С и добавляли N-бромсукцинимид (91 мг, 0,51 ммоль). После растворения реагента к охлажденному раствору пурпурного цвета добавляли 2-(3-хлор-4-метансульфонилфенил)-3-(тетрагидрофуран-3-ил)пропионовую кислоту (100 мг, 0,30 ммоль). Полученную реакционную смесь перемешивали при 0 С в течение 20 мин, нагревали до 25 С и перемешивали в течение еще 30 мин. Затем к смеси пурпурного цвета добавляли 2-аминопиразин (43 мг, 0,45 ммоль) и пиридин (0,07 мл, 0,90 ммоль) и перемешивали при 25 С в течение 16 ч. Реакционную смесь разбавляли водой (10 мл) и экстрагировали хлористым метиленом(315 мл). Органический экстракт сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: хлористый метилен/метанол, 1,5:98,5), при этом получали 2-(3-хлор-4 метансульфонилфенил)-N-пиразин-2-ил-3-(тетрагидрофуран-3-ил)пропионамид (46 мг, 37%) в виде пены светло-оранжевого цвета. МС-ВР (ES)+: m/e рассч. для C18H20ClN3O4S (M+H)+ 410,0936, найд. 410,0940. Пример 7. 1-[2-(3,4-Дихлорфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевина. Раствор диизопропиламина (2,63 мл, 18,2 ммоль) в тетрагидрофуране (120 мл) охлаждали до -78 С в атмосфете аргона, а затем добавляли 2,0 М раствор н-бутиллития в гексане (9,1 мл, 18,2 ммоль). Реакционную смесь перемешивали при -78 С в течение 15 мин, а затем медленно через трубку добавляли раствор метилового эфира (3,4-дихлорфенил)уксусной кислоты (3,62 г, 16,5 ммоль, полученный, как описано в примере 1) в тетрагидрофуране (20 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне(6 мл). Раствор ярко-желтого цвета перемешивали при -78 С в течение 1 ч, а затем через трубку добавляли раствор 2-бромметилтетрагидропирана (2,5 мл, 19,8 ммоль) в 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)пиримидиноне (4 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 16 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (30 мл) и смесь экстрагировали этилацетатом (340 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, 90:10), при этом получали метиловый эфир 2-(3,4 дихлофенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (4,68 г, 89%) в виде бесцветного масла. МС-ВР (EI): m/e рассч. для C15H18Cl2O3 (М+) 316,0633, найд. 316,0625. Раствор метилового эфира 2-(3,4-дихлофенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (374 мг, 1,19 ммоль), метилмочевины (176 мг, 2,38 ммоль) и раствор метоксида магния в метаноле (7,4 мас.%,2,5 мл, 1,78 ммоль) нагревали при 100 С в течение 8 ч, при этом реакционная смесь становилась опалесцирующей. Реакционную смесь концентрировали в вакууме, остаток растворяли в этилацетате (10 мл) и фильтровали через слой силикагеля. Фильтрат концентрировали в вакууме, остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, от 95:5 до 60:40), при этом получали две диастереомерных пары 1-[2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионил]-3-метилмочевины (76 мг,19%) в виде тведого вещества белого цвета- 25011297 К раствору 4-(метансульфонил)фенилуксусной кислоты (43,63 г, 0,204 ммоль) в метаноле (509 мл) медленно добавляли конц. серную кислоту (2 мл) и полученную реакционную смесь кипятили с обратным холодильником в течение 19 ч. Затем смесь охлаждали до 25 С и концентрировали в вакууме для удаления метанола. Остаток разбавляли этилацетатом (800 мл), органическую фазу последовательно промывали насыщенным раствором бикарбоната натрия (1200 мл) и насыщенным раствором хлорида натрия (1200 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 70-230 меш, элюент: гексан/этилацетат,1:1), при этом получали метиловый эфир 4-(метансульфонил)фенилуксусной кислоты (45,42 г, 98%) в виде масла желтого цвета, которое затвердевало при хранении при 25 С с образованием твердого вещества кремового цвета. tпл. 78-80C. MC-BP (EI): m/e рассч. для C10H12O4S (М+) 228,0456, найд. 228,0451. Раствор диизопропиламина (0,67 мл, 4,82 ммоль) в тетрагидрофуране (30 мл) охлаждали до -78 С в атмосфете аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (1,93 мл, 4,82 ммоль). Реакционную смесь перемешивали при -78 С в течение 15 мин, при этом добавляли раствор метилового эфира-78 С в течение 1 ч, а затем через трубку добавляли раствор 2-бромметилтетрагидропирана (0,67 мл, 5,26 ммоль) в 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (1 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 16 ч. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (20 мл) и смесь экстрагировали этилацетатом (315 мл). Органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40M, диоксид кремния, элюент: гексан/этилацетат,70:30), при этом получали метиловый эфир 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2 ил)пропионовой кислоты (157 мг, 11%) в виде бесцветного масла. MC-BP (EI): m/e рассч. для C16H22O5S(M+) 326,1188, найд. 326,1189. Раствор метилового эфира 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (75 мг, 0,23 ммоль), метилмочевины (34 мг, 0,46 ммоль), раствор метоксида магния в метаноле (7,4 мас.%, 0,49 мл, 0,35 ммоль) и метанол (0,5 мл) нагревали при 100 С в течение 8 ч, при этом реакционная смесь становилась опалесцирующей. Реакционную смесь концентрировали в вакууме, остаток растворяли в этилацетате (10 мл) и фильтровали через слой силикагеля. Фильтрат концентрировали в вакууме,остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, 30:70), при этом получали 1-[2-(4-метансульфонилфенил)-3(тетрагидропиран-2-ил)пропионил]-3-метилмочевину (5 мг, 6%) в виде бесцветного масла. МС-ВР К раствору метилового эфира 2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты(4,68 г, 14,75 ммоль, полученного, как описано в примере 7) в этаноле (150 мл) добавляли раствор гидроксида калия (1,66 г, 29,50 ммоль) в воде (16 мл) и реакционную смесь перемешивали при 25 С в течение 1 ч. Смесь разбавляли водой (50 мл), концентрировали в вакууме для удаления этанола и подкисляли 1 н. соляной кислотой до рН 2. Продукт экстрагировали хлористым метиленом (320 мл), объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: хлористый метилен/метанол + 1% уксусной кислоы, 90:10), при этом получали 2-(3,4-дихлорфенил)-3-(тетрагидропиран 2-ил)пропионовую кислоту (3,91 г, 87%) в виде прозрачного бесцветного масла. МС-ВР (EI): m/e рассч. для C14H16Cl2O3 (М+) 302,04765, найд. 302,0473. К раствору 2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (81 мг, 0,27 ммоль) в N,N-диметилформамиде (5 мл) добавляли гексафторфосфат О-бензотриазол-1-ил-N,N,N',N'тетраметилурония (112 мг, 0,29 ммоль), N,N-диизопропилэтиламин (0,14 мл, 0,080 ммоль) и 2 аминотиазол (40 мг, 0,40 ммоль) и реакционную смесь перемешивали при 25 С в течение 16 ч. Затем смесь разбавляли водой (10 мл) и экстрагировали этилацетатом (315 мл). Объединенные органические слои промывали водой (110 мл), 1 н. раствором гидроксида натрия (110 мл), 1 н. соляной кислотой(110 мл) и насыщенным раствором хлорида натрия (110 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, от 90:10 до 60:40), при этом получали 2-(3,4 дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид (35 мг, 34%) в виде масла светло- 26011297 желтого цвета. MC-BP (EI): m/e рассч. для C17H18Cl2N2O2S (M+) 384,0466, найд. 384,0468. Пример 10. 2(R)-(3,4-Дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид. Раствор 2-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (2,56 г, 8,44 ммоль,полученной, как описано в примере 9) в тетрагидрофуране (80 мл) охлаждали до -78 С, добавляли триэтиламин (1,30 мл, 9,65 ммоль) и триметилацетилхлорид (1,10 мл, 8,84 ммоль) и полученную суспензию белого цвета перемешивали при -78 С в течение 15 мин, а затем при 0 С в течение 45 мин. В другой колбе к раствору (S)-4-изопропил-2-оксазолидинона (1,04 г, 8,04 ммоль) в тетрагидрофуране (40 мл), охлажденному до -78 С, добавляли 2,5 М раствор н-бутиллития в гексане (3,4 мл, 8,44 ммоль). Раствор перемешивали при -78 С в течение 10 мин, а затем нагревали до 25 С при перемешивании в течение 10 мин. Затем первую реакционную смесь снова охлаждали до -78 С и в течение 5 мин медленно через трубку добавляли вторую реакционную смесь. Объединенную реакционную смесь перемешивали при -78 С в течение 15 мин и нагревали до 25 С при перемешивании в течение 1,5 ч. Реакцию останавливали добавлением насыщенного раствора бисульфита натрия (25 мл) и экстрагировали этилацетатом (330 мл). Объединенные органические слои промывали насыщенным раствором бикарбоната натрия (115 мл) и насыщенным раствором хлорида натрия (115 мл), сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230400 меш, элюент: градиент от гексана до гексана/этилацетата, 80:20), при этом получали два продукта:(506 мг, 15%) в виде прозрачного бесцветного масла; и (2) 3-[2(R)-(3,4-дихлорфенил)-3(тетрагидропиран-2-ил)пропионил]-4(S)-изопропилоксазолидин-2-он (560 мг, 17%) в виде прозрачного бесцветного масла. Раствор 3-[2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионил]-4(S)-изопропилоксазолидин-2-она (560 мг, 1,40 ммоль) в тетрагидрофуране (30 мл) и воде (10 мл) охлаждали до 0 С, добавляли 30% раствор пероксида водорода (0,7 мл), гидроксид лития (117 мг, 2,80 мл) и реакционную смесь перемешивали при 0 С в течение 1 ч. Реакцию останавливали добавлением раствора сульфита натрия(0,71 г, 5,6 ммоль в 4 мл), а затем добавляли 0,5 н. раствор бикарбоната натрия (13 мл). Тетрагидрофуран удаляли в вакууме. Остаток разбавляли водой (60 мл) и экстрагировали хлористым метиленом (320 мл). Водный слой подкисляли 5 н. соляной кислотой до рН 2 и экстрагировали этилацетатом (425 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме,при этом получали 2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионовую кислоту (203 мг, 48%) в виде прозрачного бесцветного масла. К раствору 2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (80 мг, 0,26 ммоль), гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (177 мг, 0,40 ммоль) и 2-аминотиазола (40 мг, 0,40 ммоль) в хлористом метилене (10 мл) при 25 С добавляли триэтиламин (0,11 мл, 0,79 ммоль) и реакционную смесь перемешивали при 25 С в течение 16 ч. Затем смесь разбавляли водой (10 мл) и экстрагировали хлористым метиленом (310 мл). Объединенные органические слои последовательно промывали водой (110 мл), 1 н. раствором гидроксида натрия (110 мл), 1 н. соляной кислотой (110 мл) и насыщенным раствором хлорида натрия (110 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспрессхроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, от 95:5 до 70:30),при этом получали 2(R)-(3,4-дихлорфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид (57 мг,57%) в виде пены белого цвета. MC-BP (EI): m/e рассч. для C17H18Cl2N2O2S (M+) 384,066, найд. 384,1467. Пример 11. 2-(4-Метансульфонилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид. К раствору метилового эфира 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (75 мг, 0,23 ммоль, полученного, как описано в примере 8) в этаноле (5 мл) добавляли раствор гидроксида калия (32 мг, 0,58 ммоль) в воде (1 мл) и реакционную смесь перемешивали при 25 С в течение 3 ч. Затем смесь концентрировали в вакууме для удаления этанола и подкисляли 1 н. соляной кислотой до рН 2. Раствор экстрагировали хлористым метиленом (315 мл), объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс- 27011297 хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: от гексана до гексана/этилацетата+1% уксусной кислоты, 60:40), при этом получали 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2 ил)пропионовую кислоту (60 мг, 85%) в виде твердого вещества белого цвета. МС-ВР (FAB): m/е рассч. для C15H20O5S (M+Н)+ 313,1109, найд. 313,1111. К раствору 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (60 мг, 0,19 ммоль), гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (127 мг, 0,29 ммоль) и 2-аминотиазола (28 мг, 0,29 ммоль) в хлористом метилене (5 мл) при 25 С добавляли триэтиламин (0,08 мл, 0,58 ммоль) и реакционную смесь перемешивали при 25 С в течение 16 ч. Затем смесь разбавляли водой (10 мл) и экстрагировали хлористым метиленом (315 мл). Объединенные органические слои последовательно промывали водой (110 мл), 1 н. раствором гидроксида натрия (110 мл), 1 н. соляной кислотой (110 мл) и насыщенным раствором хлорида натрия (110 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат,20:80),при этом получали 2-(4-метансульфонилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2 илпропионамид (54 мг, 71%) в виде бесцветного масла. MC-BP (EI): m/e рассч. для C18H22N2O4S2 (М+) 394,1021, найд. 394,1021. Пример 12. 2-(4-Метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2 илпропионамид. Раствор (тетрагидропиран-2-ил)метанола (3,4 г, 29,26 ммоль) в сухом хлористом метилене (140 мл) и 2,6-лутидина (5,23 мл, 45,02 ммоль) охлаждали до -78 С в атмосфере аргона, а затем добавляли ангидрид трифторметансульфоновой кислоты (5,78 мл, 35,11 ммоль). Смесь перемешивали при -78 С в течение 1 ч, а затем разбавляли гексаном (200 мл). Затем смесь промывали 50% раствором бикарбоната натрия (150 мл), сушили над сульфатом магния и концентрировали в вакууме, при этом получали тетрагидропиран-2-илметиловый эфир трифторметансульфоновой кислоты в виде неочищенного масла, который использовали без дополнительной очистки. Раствор диизопропиламина (7,04 мл, 49,97 ммоль) в сухом тетрагидрофуране (140 мл) охлаждали до-78 С в атмосфере аргона, а затем добавляли 2,5 М раствор н-бутиллития в гексане (19,8 мл, 49,5 ммоль). Реакционную смесь перемешивали при -78 С в течение 30 мин, а затем добавляли по каплям раствор (4 фтор-3-трифторметилфенил)уксусной кислоты (5,00 г, 22,51 ммоль) в сухом тетрагидрофуране (25 мл) и 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидиноне (8,5 мл). Реакционную смесь, которая приобретала золотой цвет, перемешивали при -78 С в течение 1 ч, при этом к смеси добавляли раствор тетрагидропиран-2-илметилового эфира трифторметансульфоновой кислоты (7,26 г, 29,26 ммоль) в сухом тетрагидрофуране (100 мл). Реакционную смесь нагревали до 25 С при перемешивании в течение 30 мин. Реакцию останавливали добавлением насыщенного раствора хлорида аммония (100 мл) и концентрировали в вакууме для удаления тетрагидрофурана. Водный слой подкисляли 1 н. соляной кислотой до рН 2 и экстрагировали этилацетатом (2250 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: гексан/этилацетат, от 3:7 до 1:1), при этом получали 2-(4 фтор-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовую кислоту (5,20 г, 72%) в виде смолы желтого цвета. MC-BP (EI): m/e рассч. для C15H16F4O3 (M+Na)+ 343,0931, найд. 343,0928. К раствору 2-(4-фтор-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (5,20 г, 16,24 ммоль) в сухом N,N-диметилформамиде (90 мл) при 25 С в атмосфере аргона осторожно добавляли 95% гидрид натрия (410 мг, 17,05 ммоль). Реакционную смесь перемешивали при 25 С в течение 30 мин, а затем добавляли тиометоксид натрия (2,40 г, 32,48 ммоль). Полученную смесь нагревали при 100 С в течение 4,5 ч, а затем концентрировали в вакууме для удаления N,N-диметилформамида. Остаток разбавляли водой (100 мл), раствор подкисляли 1 н. соляной кислотой до рН 2 и экстрагировали этилацетатом (2600 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали экспресс-хроматографией (силикагель 60 фирмы Мерк, 230-400 меш, элюент: хлороформ/метанол, от 98:2 до 9:1), при этом получали 2-(4 метилсульфанил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовую кислоту (5,70 г, 100%) в виде смолы желтого цвета. МС-ВР (EI): m/e рассч. для C16H19F3O3S (M+Na)+ 371,0899, найд. 371,0902. Раствор 2-(4-метилсульфанил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (348 мг, 1,0 ммоль) в муравьиной кислоте (1,20 мл, 30 ммоль) и тетрагидрофуране (1,0 мл) охлаждали до 0 С, а затем добавляли 30% раствор пероксида водорода (1,34 мл, 10 ммоль). Полученный раствор нагревали до 25 С и перемешивали в течение 24 ч. Затем смесь охлаждали до 0 С и реакцию останавли- 28011297 вали добавлением насыщенного раствора бисульфита натрия и экстрагировали этилацетатом (250 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали 2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2 ил)пропионовую кислоту (378 мг, 100%) в виде бесцветной смолы. МС-ВР (EI): m/e рассч. дляC16H19F3O5S (M+Na)+ 403,0797, найд. 403,0803. К раствору 2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (50 мг, 0,13 ммоль) в хлористом метилене (1 мл) добавляли N,N-диметилформамид (3 капли) и смесь охлаждали до 0 С. Затем к реакционной смеси добавляли 2,0 М раствор оксалилхлорида в хлористом метилене (0,08 мл, 0,156 ммоль), смесь перемешивали при 0 С в течение 30 мин, нагревали до 25 С,а затем концентрировали в вакууме для удаления растворителей и избытка оксалилхлорида. Остаток растворяли в сухом тетрагидрофуране (1 мл) и добавляли по каплям раствор 2-аминотиазола (28 мг, 0,27 ммоль) в тетрагидрофуране (1 мл) и 2,6-лутидине (0,08 мл, 0,65 ммоль). Полученную смесь перемешивали при 25 С в течение 16 ч, затем разбавляли водой (50 мл) и экстрагировали хлористым метиленом(350 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, от 7:3 до 6:4 и от 6:4 до 1:1), при этом получали 2-(4 метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)-N-тиазол-2-илпропионамид (37 мг,61%) в виде пены белого цвета. МС-ВР (EI): m/e рассч. для C19H21F3N2O4S2 (М+Н)+ 463,0968, найд. 463,0974. Пример 13. 2(R)-(3-Хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксициклогексил)пропионамид. К раствору 2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-оксоциклогексил) пропионамида (30,0 мг, 0,064 ммоль, полученного, как описано в примере 61) в метаноле (0,5 мл) добавляли боргидрид натрия (6,03 мг, 0,16 ммоль) и реакционную смесь перемешивали при 25 С в течение 5 мин. Затем смесь разбавляли этилацетатом (5 мл) и реакцию останавливали добавлением по каплям воды. Затем добавляли 5 мл воды и смесь концентрировали в вакууме для удаления метанола. Полученную суспензию экстрагировали этилацетатом (35 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12S, диоксид кремния, элюент: гексан/этилацетат, 3:7),при этом получали 2(R)-(3-хлор-4-метансульфонилфенил)-N-(5-хлорпиразин-2-ил)-3-(4-гидроксициклогексил)пропионамид (29,0 мг, 96,3%) в виде пены светло-желтого цвета. MC-BP (EI): m/е рассч. дляN,N-диметилформамид (3 капли) и смесь охлаждали до 0 С. Затем к реакционной смеси добавляли 2,0 М раствор оксалилхлорида в хлористом метилене (0,08 мл, 0,156 ммоль), смесь перемешивали при 0 С в течение 30 мин, нагревали до 25 С и концентрировали в вакууме для удаления растворителей и избытка оксалилхлорида. Остаток растворяли в сухом тетрагидрофуране (1 мл) и добавляли по каплям раствор 2 аминопиразина (15 мг, 0,156 ммоль) в тетрагидрофуране (1 мл) и 2,6-лутидине (0,02 мл, 0,157 ммоль). Полученную смесь перемешивали при 25 С в течение 16 ч, затем разбавляли водой (50 мл) и экстрагировали хлористым метиленом (350 мл). Объединенные органические слои сушили над сульфатом натрия,фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 12M, диоксид кремния, элюент: гексан/этилацетат, от 7:3 до 1:1), при этом получали 2-(4-метансульфонил-3-трифторметилфенил)-N-пиразин-2-ил-3-(тетрагидропиран-2-ил)пропионамид (13 мг, 22%) в виде бесцветной смолы. MC-BP (EI): m/e рассч. для C20H22F3N3O4S (M+Na)+ 480,1175, найд. 480,1177.(4 мл) кипятили с обратным холодильником в течение 16 ч. Затем реакционную смесь охлаждали до 25 С и концентрировали в вакууме для удаления метанола. Полученное твердое вещество обрабатывали водой(20 мл), добавляли бикарбонат натрия до рН 8 и экстрагировали этилацетатом (325 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали метиловый эфир 6-аминоникотиновой кислоты (3,12 г, 71%) в виде пены белого цвета. МС-ВР(EI): m/e рассч. для C7H8N2O2 (M+) 152,0586, найд. 152,0586. К раствору 2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропионовой кислоты (300 мг, 0,79 ммоль, полученной, как описано в примере 12) в хлористом метилене (6 мл) добавляли N,N-диметилформамид (7 капель) и смесь охлаждали до 0 С. Затем к реакционной смеси добавляли 2,0 М раствор оксалилхлорида в хлористом метилене (0,48 мл, 0,95 ммоль), смесь перемешивали при 0 С в течение 30 мин, нагревали до 25 С и концентрировали в вакууме для удаления растворителей и избытка оксалилхлорида. Остаток растворяли в сухом тетрагидрофуране (6 мл) и добавляли по каплям раствор метилового эфира 6-аминоникотиновой кислоты (252 мг, 1,67 ммоль) в тетрагидрофуране (5 мл) и 2,6 лутидине (0,48 мл, 3,95 ммоль). Полученную смесь перемешивали при 25 С в течение 16 ч, затем разбавляли водой (100 мл) и экстрагировали хлористым метиленом (350 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток очищали хроматографией с использованием системы Biotage (колонка FLASH 40S, диоксид кремния, элюент: гексан/этилацетат, от 7:3 до 1:1), при этом получали метиловый эфир 6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновой кислоты (227 мг, 55%) в виде пены белого цвета. МС-ВР (EI): m/e рассч. для C23H25F3N2O6S (M+H)+ 537,1277, найд. 537,1284. Пример 16. 6-[2-(4-Метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновая кислота. К раствору метилового эфира 6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран 2-ил)пропиониламино]никотиновой кислоты (21 мг, 0,04 ммоль, полученного, как описанов примере 15) в метаноле (0,40 мл) добавляли 1 н. раствор гидроксида натрия (90,20 мл, 0,20 ммоль), реакционную смесь перемешивали при 25 С в течение 1 ч, разбавляли водой и концентрировали в вакууме для удаления метанола. Полученный водный раствор подкисляли 1 н. соляной кислотой до рН 2 и экстрагировали этилацетатом (210 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, при этом получали очищенную 6-[2-(4-метилсульфонил-3 трифторметилфенил)-3-(тетрагидропиран-2-ил)пропиониламино]никотиновую кислоту (15 мг, 75%) в виде бесцветной смолы. МС-ВР (EI): m/e рассч. для C22H23F3O6S (M+H)+ 501,1302, найд. 501,1305. Пример 17. N-(5-Гидроксиметилпиридин-2-ил)-2-(4-метилсульфонил-3-трифторметилфенил)-3(тетрагидропиран-2-ил)пропионамид. К раствору метилового эфира 6-[2-(4-метилсульфонил-3-трифторметилфенил)-3-(тетрагидропиран 2-ил)пропиониламино]никотиновой кислоты (129 мг, 0,25 ммоль, полученного, как описано в примере 15) в этиловом эфире (6 мл), охлажденному до 0 С, добавляли 1,0 М раствор литийалюминийгидрида в диэтиловом эфире (0,30 мл, 0,30 ммоль) и реакционную смесь оранжевого цвета перемешивали при 0 С в течение 1 ч. Реакцию останавливали добавлением по каплям воды (10 мл) и смесь экстрагировали этил- 30
МПК / Метки
МПК: C07D 307/16, C07D 405/12, A61K 31/335, C07D 277/46, C07C 275/52, C07D 213/75, C07D 409/12, C07D 241/20, C07D 309/04, A61K 31/38, C07D 417/12
Метки: глюкокиназы, применение, активаторов, фенилацетамиды, качестве, замещённые
Код ссылки
<a href="https://eas.patents.su/30-11297-zameshhyonnye-fenilacetamidy-i-ih-primenenie-v-kachestve-aktivatorov-glyukokinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые фенилацетамиды и их применение в качестве активаторов глюкокиназы</a>
Предыдущий патент: Каталитические реакторы
Следующий патент: Применение бактерицидных пиримидинов для профилактики передачи вич половым путём и фармацевтические композиции на их основе
Случайный патент: Устройство генерации данных, способ генерации данных и базовая станция


































