Способы синтеза 2(s),4(s),5(s),7(s)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов
Номер патента: 23266
Опубликовано: 31.05.2016
Авторы: Кастелейнс Анна Мария Корнелиа Франсиска, Гермсен Петрус Йоханнес, Врис Де Андреас Хендрикус Мария, Верзейл Герард Карел Мария
Формула / Реферат
1. Способ получения соединения формулы (2)
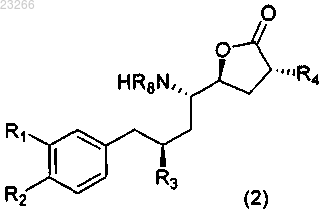
где R1 выбирают из группы, состоящей из C1-6галогеналкила, C1-6алкоксигруппы, C1-6алкокси-C1-6алкилоксигруппы и C1-6алкокси-C1-6алкила;
R2 выбирают из группы, состоящей из C1-4алкила или C1-4алкоксигруппы;
R1 и R2 могут быть связаны друг с другом с образованием кольцевой структуры;
R3 и R4, каждый независимо, представляют собой изопропил;
R8 обозначает Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил, необязательно замещенный C(O)C1-6алкил, необязательно замещенный C(O)OC1-6алкил, необязательно замещенный С(О)NHC1-6алкил или необязательно замещенный С(О)N(C1-6алкил)2; или
R8 обозначает NHR9; S(O)2R9, SOR9, S(O)3R9, S(O)2N(R9); P(O)(R9)2; или
R8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждый R9 независимо представляет собой Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил,
включающий следующие стадии:
а) взаимодействие соединения формулы (4)
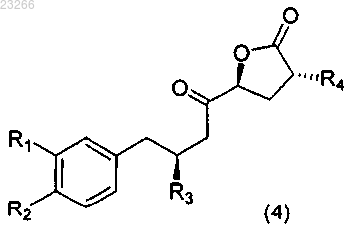
где каждый из R1, R2, R3 и R4 такой же, как описано выше для формулы (2),
с соединением формулы (5)
где R8 такой же, как описано выше для формулы (2),
что приводит к образованию соединения формулы (7)
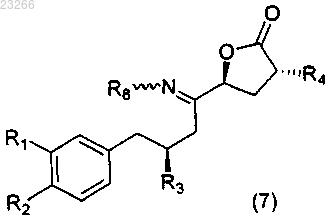
где каждый из R1, R2, R3, R4, R8 такой же, как описано выше для формулы (2);
b) взаимодействие соединения формулы (7) с восстанавливающим реагентом, что приводит к образованию соединения формулы (2), где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном.
2. Способ по п.1, в котором соединение формулы (7) не выделяют из реакционной смеси перед выполнением стадии b).
3. Способ по любому из пп.1, 2, в котором стадию b) проводят в присутствии катализатора.
4. Способ по п.3, в котором указанный катализатор представляет собой катализатор на основе переходного металла.
5. Способ по любому из пп.1-4, в котором стадию b) проводят в присутствии одной или нескольких добавок.
6. Способ по любому из пп.1-5, включающий взаимодействие соединения формулы (4) с соединением формулы (5) в присутствии восстанавливающего агента и катализатора.
7. Способ по п.6, в котором восстанавливающий агент выбирают из следующей группы: молекулярный водород или соединение - донор водорода, и в котором, если применяют молекулярный водород, то в присутствии переходного металла как катализатора, и если применяют соединение - донор водорода, то необязательно в присутствии катализатора.
8. Способ по п.6 или 7, в котором указанный катализатор представляет собой фермент.
9. Способ по п.8, в котором фермент представляет собой аминотрансферазу.
10. Способ по любому из пп.6-9, в котором соединение формулы (5) является также восстанавливающим агентом.
11. Способ получения соединения формулы (13)
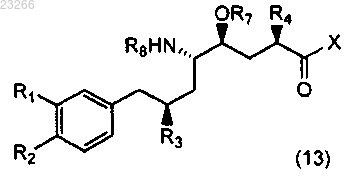
где R1 выбирают из группы, состоящей из C1-6галогеналкила, C1-6алкоксигруппы, C1-6алкокси-C1-6алкилоксигруппы и C1-6алкокси-C1-6алкила;
R2 выбирают из группы, состоящей из C1-4алкила или C1-4алкоксигруппы;
R1 и R2 могут быть связаны друг с другом с образованием кольцевой структуры;
R3 и R4, каждый независимо, представляют собой изопропил;
R7 представляет собой Н или О-защитную группу;
R8 обозначает Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил, необязательно замещенный C(O)C1-6алкил, необязательно замещенный C(O)OC1-6алкил, необязательно замещенный C(O)NHC1-6алкил или необязательно замещенный С(О)Н(C1-6алкил)2; или
R8 обозначает NHR9; S(O)2R9, SOR9, S(O)3R9, S(O)2N(R9); P(O)(R9)2; или
R8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждый R9 независимо представляет собой Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил;
X обозначает NHR5 или OR6, где R5 представляет собой H2N-C(O)-C1-12алкил и R6 представляет собой Н, или необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил,
включающий следующие стадии:
а) взаимодействие соединения формулы (11)
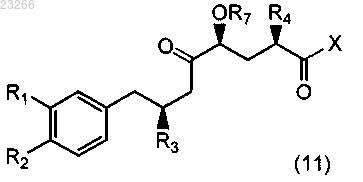
где каждый из R1, R2, R3 и R4, R7 такой же, как описано выше для формулы (13),
с соединением формулы (5)
где R8 такой же, как описано выше для формулы (13),
что приводит к образованию соединения формулы (12)
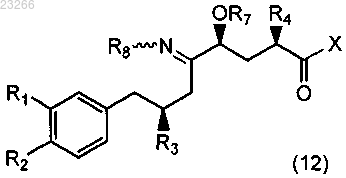
где каждый из R1, R2, R3, R4, R7, R8 и X такой же, как описано выше для формулы (13);
b) взаимодействие соединения формулы (12) с восстанавливающим реагентом, что приводит к образованию соединения формулы (13), где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном.
12. Способ по п.11, в котором X в соединении формулы (11), и также в получаемом соединении формулы (12), если оно образуется, и в соединении формулы (13) соответственно обозначает OR6, где R6 такой же, как описан в п.11.
13. Способ по п.11, в котором X в соединении формулы (11), и также в получаемом соединении формулы (12), если оно образуется, и в соединении формулы (13) соответственно обозначает NHR5, где R5 такой же, как описан в п.11.
14. Способ по любому из пп.11-13, включающий взаимодействие соединения формулы (11) с соединением формулы (5) в присутствии восстанавливающего агента и катализатора.
15. Способ по п.14, в котором восстанавливающий агент выбирают из следующей группы: молекулярный водород или соединение - донор водорода; и в котором, если применяют молекулярный водород, то в присутствии переходного металла как катализатора, и если применяют соединение - донор водорода, то необязательно в присутствии катализатора.
16. Способ по п.14 или 15, в котором указанный катализатор представляет собой фермент.
17. Способ по п.16, в котором фермент представляет собой аминотрансферазу.
18. Способ по любому из пп.1-10, в котором соединение формулы (2) дополнительно вступает в реакцию с 3-амино-2,2-диметилпропанамидом с получением соединения формулы (13), где X=NHR5, R5 представляет собой 2-карбамоил-2-метилпропил, или его фармацевтически приемлемых солей.
19. Способ по п.18, в котором соединение формулы (13) подвергают депротектированию с получением 2(S),4(S),5(S),7(S)-N-(2-карбамоил-2-метилпропил)-5-амино-4-гидрокси-2,7-диизопропил-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамида или любой его фармацевтически приемлемой соли.
20. Соединение формулы (11)
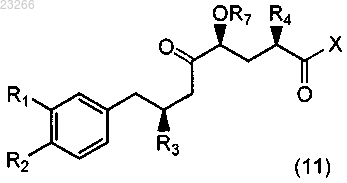
где R1, R2, R3, R4, R7 и X такие, как определено в п.11.
21. Соединение формулы (12)
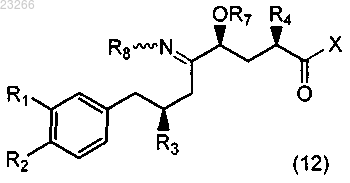
где R1, R2, R3, R4, R7, R8 и X такие, как определено в п.11.
22. Соединение формулы (7)
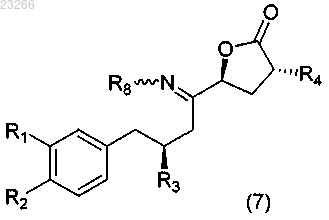
где R1, R2, R3 и R4 такие, как определено в п.1;
R8 обозначает Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил, необязательно замещенный С(О)C1-6алкил, необязательно замещенный C(O)OC1-6алкил, необязательно замещенный С(О)NHC1-6алкил или необязательно замещенный C(O)N(C1-6алкил)2; или
R8 обозначаетNHR9; S(O)2R9, SOR9, S(O)3R9, S(O)2N(R9); P(O)(R9)2; или
R8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждый R9 независимо представляет собой Н, необязательно замещенный C1-12алкил, необязательно замещенный C1-12алкиларил, где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном.
Текст
Врис де Андреас Хендрикус Мария,Верзейл Герард Карел Мария,Гермсен Петрус Йоханнес, Кастелейнс Анна Мария Корнелиа Франсиска Изобретение имеет отношение к способу получения соединений, которые представляют собой важные "строительные блоки" в конвергентных способах синтеза 2(S),4(S),5(S),7(S)-2,7-диалкил-4 гидрокси-5-амино-8-арилоктаноил амидов или их фармацевтически приемлемых солей, таких как соединение алискирен, и к способу получения этих октаноиламидов, включающему взаимодействие указанных "строительных блоков". Область техники, к которой относится изобретение Изобретение имеет отношение к способу получения соединения формулы (13) или его циклической формы, имеющей формулу (2), соединения, которое представляет собой важный "строительный блок" в конвергентных способах синтеза 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов (соединений формулы 13, в которой X обозначает NHR5), или его фармацевтически приемлемых солей, таких как соединение алискирен, и к способу получения этих октаноиламидов, включающему взаимодействие указанных "строительных блоков". Предшествующий уровень техники Из статьи Rueger et al., Tetpahedron letters 41 (2000), p. 10085-10089 известно, что кетон, имеющий формулу (4 а) где R4 - 2-пропил представляет собой потенциально интересный "строительный блок" для применения в конвергентном способе синтеза с получением алискирена. Однако превращение кетона формулы (4 а) в соответствующий обогащенный в отношении определенного энантиомера амин (формулы 2) и затем в соединение алискирен или родственные соединения до сих пор остается неудовлетворительным в отношении выхода и/или стереоселективности. Из статьи Sandham et al., Tetpahedron letters 41 (2000), p. 10091-10094 известно, что соединения формулы (13), где X обозначает NHR5, получают с помощью соответствующего 5(R)-гидроксисоединения, применяя химическое замещение азидом натрия. Соответствующее 5(R)-гидроксисоединение получают в смеси диастереомеров, которую невозможно разделить и которую можно только очистить на конечной стадии синтеза (кристаллизация полуфумарата) или с высоким соотношением диастереомеров, равным 96:4, но за счет низкого выхода (33%). Сущность изобретения Изобретение обеспечивает новый способ превращения кетона формулы (4), или его открытой формы формулы (11), или их смеси в желаемое 5(S)-аминосоединение формулы (2) или в его открытую форму формулы (13). Преимущество нового способа заключается в том, что продукты получают за небольшое число изменяемых стадий, с высоким выходом и с желаемой конфигурацией 5(S)-амина или 5(S)-аминопроизводного. Таким образом, изобретение ставит целью обеспечение альтернативного способа получения соединения формулы (13), или его циклической формы формулы (2), или их смесиR1 и R2 могут быть связаны друг с другом с образованием кольцевой структуры;R7 представляет собой Н или представляет собой О-защитную группу;R8 обозначает (R9)2Y, где Y представляет собой анион, такой как ацетат или галоген; каждая R9 группа независимо представляет собой Н, необязательно замещенный C1-12 алкил, необязательно замещенный C1-12 алкиларил,-1 023266 включающего следующие стадии: а) взаимодействие соединения формулы (11), или его циклической формы формулы (4), или их смеси где R1, R2, R3, R4, R7, и X такие же, как описаны выше для формулы (2) и (13),с соединением формулы (5) где R8, такой же, как описан выше для формулы (2) и (13), что приводит к образованию соединения формулы (7),или соединения формулы (12) или их смеси где R1, R2, R3, R4, R7, R8 и X такие же, как описано выше для формулы (2) и (13);b) дополнительное взаимодействие соединения формулы (7) или (12) или их смеси в присутствии восстанавливающего реагента, и, необязательно, в присутствии катализатора, и, необязательно, в присутствии одной или нескольких добавок, что приводит к образованию соединения формулы (2) или (13), или их смеси. Таким образом, изобретение обеспечивает способ, в котором 5(S)-аминогруппу вводят в соответствующий кетон за меньшее число стадий, чем в известных в настоящее время способах. Предпочтительно в способе получения октаноиламидов формулы (13), где X обозначает NHR5, таких как соединение алискирен; R1 представляет собой 3-метоксипропоксигруппу; R2 представляет собой метоксигруппу и R3 и R4 представляют собой 2-пропил. В рамках этого изобретения О-защитная группа представляет собой такую группу, как описана в работе J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London and New York, 1973 или в работе Т.W. Greene и P.G.M. Wuts, "Protective Groups in Organic Synthesis", Third edition, Wiley,New York 1999; и которую описывают в качестве традиционной группы для защиты атома кислорода,например тозилат, мезилат, бензоилат, бензоат, триалкилсилил или карбоксильная группа, такая как ацетатная группа, и т.п., и все другие защитные группы, принятые для спиртов или атомов кислорода. В рамках этого изобретения термин "необязательно замещенный" означает, что любой водород,присутствующий в описании R8, R9 может быть замещен углеводородной группой или галогенами. В рамках этого изобретения инертный заместитель определяют как заместитель, который сам не вступает в реакцию, если проводят желаемую реакцию в соответствии с изобретением, и который не препятствует каким-либо другим способом проведению желаемой реакции. Например, специалистам в этой области техники известно, что некоторые заместители бывают очень большими и могут создавать препятствия для протекания желаемой реакция, хотя сами заместители не будут вступать в реакцию. Следует понимать, что, где бы арил не был упомянут, эта арильная группа также может представлять собой гетероарил. Для всех структурных формул, приведенных в рамках изобретения, наиболее желаемая конфигурация представляет собой такую конфигурацию, которая в конечном итоге позволяет осуществлять синтез соединения формулы (13), где X представляет собой NHR5, имеющего 2(S)-, 4(S)-, 5(S)-, 7(S)конфигурацию. Однако, за исключением случаев в тексте, в которых особо указано иное, изобретение также имеет отношение к рацемическим смесям или скалемическим смесям желаемого соединения, при этом желаемый изомер представляет собой изомер, присутствующий в избытке по отношению к нежелаемому изомеру. Предпочтительно соотношение желаемого изомера к нежелаемому изомеру для любого индивидуального стереогенного центра составляет по меньшей мере 70:30, более предпочтительно по меньшей мере 90:10 и еще более предпочтительно по меньшей мере 95:5. В одном из аспектов этого изобретения соотношение диастереомеров соединений формулы (2) или(13) может быть улучшено с помощью классических способов очистки, известных специалистам в этой области техники, таких как избирательная кристаллизация, необязательно со вспомогательными вещест-2 023266 вами, перегонка, или хроматографические методики, такие как хроматография с псевдодвижущимися слоями (SMB). Образование соединений формулы (7) или (12) или их смесей из соответствующего кетона формулы (11) или из его циклической формы формулы (4) или из их смеси с помощью соединения формулы (5) проводят с помощью способов, известных специалистам в этой области техники, образования C=N связей из кетона. Подходящие ссылки можно найти в работе March, Jerry, Chapter 6, (1985), AdvancedOrganic Chemistry reactions, mechanisms and structure (3rd ed.), New York: John WileySons или в других общих справочниках по органической химии и во всеобъемлющих обзорах. Более конкретные примеры приведены в работах Organic Syntheses, Coll. Vol. 9, p. 610 (1998); Vol. 70, p. 35 (1992 и OrganicSyntheses, Coll. Vol. 6, p. 818 (1988); Vol. 54, p. 93 (1974). В особенности при получении этих соединений формулы (7) или (12) или их смесей применяют катализ, который осуществляется путем добавления кислоты Брэнстеда или кислоты Льюиса, и применяют условия, в которых реакция образования C=N связи завершается благодаря удалению воды. Конкретнее, получение этих соединений проводят с помощью азеотропной перегонки и/или добавления молекулярных сит и/или добавления тетрахлорида титана. Соединения формулы (7) или (12) или их смеси могут находиться в Z- или Е-конфигурациях или в виде их смеси. Предпочтительно R8 представляет собой группу, которая может быть легко удалена после получения соединения формулы (2) или формулы (13) или их смеси, где R8 эквивалентно Н. Примеры таких соединений формулы (5), где легко удаляемая R8 представляет собой необязательно замещенные бензиламины, богатые электронами анилины, такие как 4-метоксианилин, необязательно замещенные сульфонамиды, гидразоны и фосфинилимины. Предпочтительны такие соединения формулы (5), в которых группа R8 представляет собой легко удаляемые, необязательно замещенные бензиламины, более предпочтительно -метилбензиламины. Альтернативно, R8-группу не удаляют, что приводит к получению соединений формулы (2) или формулы (13) или к их смеси, где R8 эквивалентно R8 в соединении формулы (5). Реакция соединения формулы (7) или (12) или их смеси, приводящая к образованию соединений формулы (2) или формулы (13) или их смесей в присутствии восстанавливающего реагента, и, необязательно, в присутствии катализатора, и, необязательно, в присутствии вспомогательного средства, может быть проведена стереоселективно или нестереоселективно. При образовании обоих изомеров в одинаковом количестве говорят о нестереоселективной реакции. Предпочтительно, чтобы изомеры соединений формулы (2) или формулы (13) или их смеси с (S)-конфигурацией в С-5 стереогенном центре были получены в избытке. По понятным причинам полученные соединения изображают в одной конфигурации(С-5 стереогенный центр), но следует понимать, что также может быть получен и другой изомер С-5 стереогенного центра. Если реакцию соединения формулы (7) или (12) или их смеси, приводящую к образованию соединений формулы (2) или формулы (13) или их смесей в присутствии восстанавливающего реагента, и, необязательно, в присутствии катализатора, и, необязательно, в присутствии одной или нескольких добавок проводят нестереоселективно, то образовавшиеся изомеры могут быть разделены с помощью способов,известных специалистам в этой области техники, таких как кристаллизация; классическое разделение; с помощью хроматографических методик, таких как хроматография с псевдодвижущимися слоями, необязательно, с оптически чистой неподвижной фазой или с помощью энзиматического разделения, например в присутствии липазы или амидазы. Предпочтителен стереоселективный синтез, т.е. синтез с получением избытка (S)-конфигурации в С-5 стереогенном центре, который имеет селективность, по меньшей мере равную 70:30, более предпочтительно селективность, равную по меньшей мере 90:10, наиболее предпочтительно селективность, равную 95:5 или выше, для соединения формулы (2) или формулы (13) или их смеси, который проводят в присутствии восстанавливающего реагента, и, необязательно, в присутствии катализатора, и, необязательно, в присутствии одной или нескольких добавок. Стереоселективность может быть обеспечена: А) благодаря применению соединений формулы (7) или (12) или их смесей с высокой оптической чистотой в С-2, С-4 и С-7 стереогенном центре получение соединения формулы (2) или формулы (13) или их смесей, будет стереоселективно; В) также как в пункте А, но дополнительно путем применения соединения формулы (5), которое представляет собой оптически обогащенное соединение, в результате введения более направленной хиральности в соединение формулы (7) или формулы (12) или их смеси. Подходящие соединения представляют собой любое оптически обогащенное соединение формулы (5), предпочтительно применяют оптически обогащенные амины и фенилглицин-амиды, более предпочтительно применяют оптически обогащенные -метилбензиламины; С.) как описано в пункте А или В, но, дополнительно, в присутствии оптически обогащенного восстанавливающего агента; катализатора. Специалисту в этой области техники понятно, что возможна любая комбинация вышеперечисленных способов проведения стереоселективной реакции. Восстанавливающий агент может представлять собой любой восстановитель, известный специалистам в этой области техники. Восстанавливающий агент, также называемый химический восстановитель или восстановитель,представляет собой элемент или соединение в окислительно-восстановительной реакции, который восстанавливает другие вещества. В этом документе восстановление означает добавление водорода (H2), или перенос гидрида к молекуле. В особенности восстанавливающий агент может представлять собой молекулярный водород в присутствии переходного металла, как катализатора; гидриды щелочных металлов, такие как NaBH4,NaCNBH3, ВН 3 - THF, B2H6, 9-борабицикло[3.3.1]нонан (9-BBN) или лития три-втор-бутилборгидрид(L-селектрид); или соединения, являющиеся донором водорода, такие как спирты и амины, например изопропанол и изопропиламин, или карбоновые кислоты в присутствии триэтиламина, например муравьиная кислота и ее соли, или эфир Ганча; или NADPH (никотинамидадениндинуклеотид фосфат) иNADH (никотинамидадениндинуклеотид); или соединения, являющиеся донором водорода в присутствии катализатора. Предпочтительно применяют молекулярный водород в присутствии переходного металла, как катализатора, или применяют соединения, являющиеся донором водорода, необязательно, в присутствии катализатора. Реакцию восстановления можно проводить в присутствии одной или нескольких добавок. Подходящие добавки представляют собой любое соединение, которые способствуют протеканию реакции восстановления в отношении выхода и/или стереоселективности. Подходящие добавки представляют собой,например, кислоты Льюиса, основания Льюиса, кислоты Брэнстеда, основания Брэнстеда или соли, такие как четвертичные аммониевые соли, например тетрабутиламмония йодид. Восстанавливающие агенты сами также могут быть оптически обогащенными, как таковые способствуя протеканию стереоселективной реакции. Оптически обогащенные восстанавливающие агенты могут быть получены путем комбинирования таких восстанавливающих агентов, как гидриды щелочных металлов, таких как боргидриды, например ВНз, с оптически обогащенным соединением, которое может координировать восстанавливающий агент, таким как необязательно замещенные аминоспирты, и необязательно замещенные диамины,например втор-BuMe2SiOCH(Me)CH(NH2)CPh2OH,PhS(O)2NHCH(Ph)CH(Ph)OH, или путем применения оптически обогащенного гидрида щелочного металла, такого как хиральное соединение боргидрида, такое как, например, описано в работе Е.J. Corey,SShibata, R.K. Bakshi, в J. Org, Chem., 1988, 53, 2861-2863. Количество оптически обогащенного соединения, которое необходимо добавить к восстанавливающему агенту, может быть в избытке, в стехиометрических или в каталитических количествах. Предпочтительно применяют стехиометрические или каталитические количества, более предпочтительно, применяют каталитические количества. В случае молекулярного водорода в качестве восстанавливающего агента добавляют катализатор на основе переходного металла. Эти катализаторы на основе переходного металла могут представлять собой любой источник переходного металла как гомогенного, так и гетерогенного происхождения, и могут быть на подложке и не на подложке, и могут быть нехиральным или оптически обогащенными соединениями. Подходящие катализаторы представляют собой любые катализаторы на основе переходного металла, предпочтительно катализаторы на основе элементов VIII группы, более предпочтительно катализаторы на основе Ni, Pd, Ru, Rh, Ir и Pt. Может быть применена любая подложка, известная в этой области техники. Подходящие катализаторы и условия описаны, например, в работе Larock,R.C. Comprehensive Organic Transformations 2nd ed., Wiley-VCH, NY, 1999, p. 835-840; в работеVol. 3, p. 827 (1955); Vol. 21, p. 108 (1941). Подходящие катализаторы представляют собой, например, RHCl(PPh3)3, Pd/C, PtO2, Никель Ренея,Ru/C, RuCl2(PPh3)2(ampy), где ampy обозначает аминометилпиридин или катализатор Крабтри:[Ir(1,5-циклооктадиен)(трис-циклогексилфосфин)(пиридин)]+ PF6-. В том случае если восстанавливающий агент представляет собой соединение - донор водорода, то присутствие катализатора предпочтительно. Такой катализатор может представлять собой любой металл,например натрий, или магний, или Al(OEt)3; катализатор на основе переходного металла, такой какH2IrCl6; органическое соединение (так называемый органокатализатор), такой как кислота Брэнстеда; или биокатализатор с окислительно-восстановительной активностью (ЕС класс 1). Подходящие катализаторы и условия, например, описаны Klomp, D., Hanefeld, U. и Peters, J. вHandbook of Homogeneous Hydrogenation, de Vries и Elsevier (Eds.); Wiley-VCH, Weinheim, p. 585-632. В случае применения катализатора, являющегося оптически обогащенным соединением, восстановление соединения формулы (7) или (12) или их смеси приводит к образованию соединения формулы (2) или формулы (13) или их смеси, оптически обогащенный катализатор представляет собой катализатор на основе переходного металла, органокатализатор или биокатализатор. Подходящие катализаторы на основе переходного металла представляют собой катализаторы гомогенного или гетерогенного происхождения и могут быть на подложке или не на подложке. Примеры этих катализаторов и условия описаны, например, в работе Spindler, F. и Blaser, H.U. в Handbook ofHomogeneous Hydrogenation, de Vries и Elsevier (Eds.); Wiley-VCH, Weinheim, p. 1193-1214 для случая,когда в качестве восстанавливающего агента применяют молекулярный водород. В случае применения в качестве восстанавливающих агентов соединений - доноров водорода подходящие оптически обогащенные катализаторы на основе переходного металла, а также условия их применения описаны, например, в работе Blacker, A.J. в Handbook of Homogeneous Hydrogenation, J.G. deVries и С. Elsevier (Eds.), Wiley-VCH, Weinheim, p. 1215 и в работе Noyori et al., Org. Biomol. Chem. 2006,4, 393-406. Оптически обогащенные металлоциклы, такие как ирридациклы, и рутенациклы, также представляют собой подходящие соединения. Подходящие оптически обогащенные соединения - органокатализаторы, представляющие собой кислоты Брэнстеда, описаны, например, в работе Rueping, M.,Antonchick, A.P. и Theissmann, Т. в Angew. Chem. Int. Ed. 2006, 45, 3683-3686 и в ссылках в этих работах,и подходящие биокатализаторы представляют собой те, которые обладают окислительновосстановительной активностью (ЕС класс 1), например аминодегидрогеназы. В случае биокатализаторов соединения - доноры водорода представляют собой в особенности NADPH (никотинамидадениндинуклеотид фосфат) и NADH (никотинамидадениндинуклеотид). Катализатор предпочтительно применяют в количестве от 0,0001 до 10 мол.% на основе соединения, которое нужно гидрировать, диапазон от 0,001 до 10 мол.% особенно предпочтителен и диапазон от 0,01 до 5 мол.% в особенности предпочтителен. Если в качестве катализатора применяют фермент, то количество фермента зависит от активности фермента и может варьировать в широких диапазонах. Предпочтительно количество фермента находится на наиболее низком из возможных уровне. Предпочтительно количество фермента равно менее чем 0,1 г на 1 г соединения, которое нужно гидрировать, более предпочтительно количество фермента равно менее чем 0,01 г на 1 г соединения, которое нужно гидрировать, наиболее предпочтительно количество фермента равно менее чем 0,001 г на 1 г соединения, которое нужно гидрировать. Восстановление может быть проведено при низких или повышенных температурах, в особенности при температуре в диапазоне от -20 до 150 С. Предпочтительно температура равна по меньшей мере 10 С, более предпочтительно, по меньшей мере, температура окружающей среды (например, примерно 20 С). Предпочтительно температура равна вплоть до 120 С или менее, более предпочтительно 90 С или менее. Способы в соответствии с изобретением могут быть проведены при атмосферном давлении или при повышенном давлении. В особенности давление водорода, если водород в виде газа применяют в качестве источника водород, может быть в диапазоне от атмосферного до 200 бар водорода, в особенности в диапазоне от атмосферного до 50 бар водорода. Реакция восстановления в соответствии со стадией b) может быть проведена в отсутствие или в присутствии растворителя, в ней может быть применен один растворитель или применена смесь растворителей. Подходящие растворители включают алифатические, циклоалифатические и ароматические углеводороды (пентан, гексан, петролейный эфир, циклогексан, метилциклогексан, бензол, толуол, ксилол), алифатические галогенированные углеводороды (дихлорметан, хлороформ, ди- и тетрахлорэтан),нитрилы (ацетонитрил, пропионитрил, бензонитрил), эфиры (диэтиловый эфир, дибутиловый эфир, вторбутилметиловый эфир, диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля, тетрагидрофуран, диоксан, монометиловый или моноэтиловый эфир диэтиленгликоля), кетоны (ацетон, метилизобутилкетон), эфиры угольной кислоты и лактоны (этил- или метилацетат, валеролактон), N-замещенные лактамы (N-метилпирролидон), карбоксамиды (диметиламид,диметилформамид), ациклический мочевины (диметилимидазолин), и сульфоксиды и сульфоны (диметилсульфоксид, диметилсульфон, тетраметиленсульфоксид, тетраметиленсульфон) и спирты (метанол,этанол, трифторэтанол, пропанол, бутанрл, монометиловый эфир этиленгликоля, моноэтиловый эфир этиленгликоля, монометиловый эфир диэтиленгликоля) и воду. В случае соединения - донора водорода предпочтительно, чтобы в качестве растворителя также применяли соединение, представляющее собой донор водорода. Катализатор на основе переходного металла, необязательно, требуемый для восстановительной реакции молекулярным водородом или соединением - донором водорода, может быть подготовлен заранее и добавлен как таковой (см. выше) или катализатор на основе переходного металла может быть полученin situ, т.е. путем добавления в реакционный сосуд предшественника переходного металла и подходящих лигандов. Подходящие предшественники переходного металла представляют собой любую имеющуюся в наличии соль или комплекс переходного металла. Предпочтительно применяют предшественники переходных металлов группы VIII, такие как производные Ru, Ir, Rh. Примеры подходящих предшественников представляют собой бис-(1,5-циклооктадиен)иридия тетрафторборат, бис-[хлор-1,5-циклооктадиен-5 023266 иридия], бис-(1,5-циклооктадиен)родия тетрафторборат, бис-(2-метилаллил)(1,5-циклооктадиен)рутения,дихлор-бис-[(п-цимол)хлоррутения, дихлор(1,5-циклооктадиен)рутения. Подходящие лиганды представляют собой любое соединение, которое имеет возможность выступать в качестве донора электронов к центру металла, как известно специалистам в этой области техники. Лиганды могут быть монодентантные, бидентантные, тридентантные или тетрадентантные. Может быть применен более чем один лиганд. Лиганды может представлять собой смесь нехиральных и хиральных лигандов. Количество лиганда по отношению к металлу не критично. Предпочтительное количество лиганда равно от 0,1 до 10, более предпочтительно от 0,5 и 5 моль-эквивалент. Подходящие лиганды представляют собой, например, лиганды, описанные в Handbook ofVerlag, 1999. Изобретение также имеет отношение к способу получения соединений формулы (13) или его циклической формы формулы (2) или их смеси путем взаимодействия соединения формулы (11) или его циклической формы формулы (4) или их смеси с соединением формулы (5) в присутствии восстанавливающего реагента, и, необязательно, в присутствии катализатора, и, необязательно, в присутствии добавки, без выделения соединений формулы (7) или (12). Этот способ, приводящий к непосредственному образованию аминогруппы из кетогруппы, часто также называют восстановительным аминированием. Применяют те же соединения формулы (5), условия и катализаторы, как было описано для отдельных реакционных стадий, таких как были описаны выше. В общем, можно сказать, что прямое восстановительное аминирование проводят с восстанавливающими агентами и/или в таких реакционных условиях,которые более реакционноспособны в отношении иминов, чем в отношении кетонов, такими как натрия цианоборгидрид (NaBH3CN) или натрий триацетоксиборгидрид (NaBH(ОСОСН 3)3). В случае применения молекулярного водорода или соединений - доноров водорода в качестве восстанавливающего агента предпочтительно добавляют катализатор. Подходящие катализаторы и условия такие же, как описаны для непрямого восстановительного аминирования. Предпочтительно применяют катализаторы на основе переходного металла и биокатализаторы. В случае биокатализаторов могут быть применены такие ферменты, как аминотрансферазы или аминодегидрогеназы. Эти ферменты, аминотрансферазы, могут быть получены из различных микроорганизмов, например, но, не ограничиваясь, из Vibrio sp., Arthrobacter sp.,Bacillus sp., Pseudomonas sp., Paracoccus sp., Rhodobacter sp Гены для этих ферментов могут быть перенесены и сверхэкспрессированы в таких микроорганизмах-хозяевах, как E.Coli. Условия применения и примеры подходящих аминодегидрогеназ описаны в работе Itoh et al. in J. Mol. Catal. В Enzymatic, 2000,10, 281, в особенности в комбинации с аммонием, применяемым в качестве соединения формулы (5). Если в способах в соответствии с изобретением применяют фермент, то фермент предпочтительно применяют в комбинации с подходящим кофактором в регенерирующей системе для фермента, которая известна специалистам в этой области техники. Примеры представляют собой применение формиатдегидрогеназы в комбинации с формиатом или применение глюкозодегидрогеназа в комбинации с глюкозой. Каталитических количеств кофактора обычно бывает достаточно для этих систем рециклирования кофактора. В качестве восстанавливающих агентов (соединений - доноров водорода) применяют амины, предпочтительно амины формулы (5), растворитель и восстанавливающий агент. Подходящие амины для этого тройного применения представляют собой, например, фенилэтиламин и 2-пропиламин. Когда применяемый амин выполняет тройную функцию (в качестве соединения формулы (5), растворителя и восстанавливающего агента), предпочтительно в качестве соединения формулы (5) применяют фенилэтиламин или 2-пропиламин, в качестве катализатора предпочтительн, применяют фермент и предпочтительноR8-группа в полученных соединениях формулы (2) и (13) обозначает Н. Изобретение также имеет отношение к способу получения соединения формулы (13) или его циклической формы формулы (2) или их смеси путем взаимодействия соединения формулы (11) или его циклической формы формулы (4) или их смесей с амином общей формулы R8-NH2 в присутствии восстанавливающего агента и катализатора, предпочтительно фермента и, необязательно, в присутствии одной или нескольких добавок. Изобретение также имеет отношение к способу получения 2(S),4(S),5(S),7(S)-2,7-диалкил-4 гидрокси-5-амино-8-арилоктаноил амидов (соединений формулы (13), где X обозначает NHR5) или его фармацевтически приемлемых солей, таких как соединение алискирен, включающему взаимодействие соединения формулы (1) или (2) и полученному по способу в соответствии с изобретением с подходящим амином, т.е. амином общей формулы R5-NH2, в условиях, достаточных для формирования амидной связи, необязательно с последующей очисткой с целью получения желаемой конфигурации С-5 стереогенного центра. Подходящие условия для образования амидной связи известны специалистам в этой области техники и описаны, например, в работе Sandham et al. (Tetrahedron Letters, 2000, 41, 10091-10094). Следует понимать, что порядок реакций для получения определенных 2(S),4(S),5(S),7(S)-2,7 диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов или их фармацевтически приемлемых солей, таких как соединение алискирен, не принципиален, поскольку соединение формулы (6) или соединение формулы (7) может вступить в реакцию с подходящим амином, т.е. амином общей формулы H2N-R5, в условиях, достаточных для формирования амидной связи, необязательно с последующей защитой спиртовой группы в С-4 центре, с получением соединения формулы (10) перед реакцией восстановления. Следует также понимать, что взаимодействие соединения формулы (3) или соединения формулы (4) или их смесей по меньшей мере с 2 экв. амина общей формулы R8-NH2 может привести к образованию соединений формулы (10), где в этом случае R5 эквивалентно R8. В этом случае амин общей формулы R8-NH2 предпочтительно представляет собой амин, необходимый для получения определенных 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов или их фармацевтически приемлемых солей, таких как соединение алискирен. Следует также понимать, что соединение формулы (4) может вступать в реакцию со спиртами общей формулы HO-R6 в условиях, известных специалистам в этой области техники, необязательно с последующей защитой спиртовой группы в С-4 центре, с получением соединений формулы (3), перед реакцией или реакциями изобретения. Следует также понимать, что соединение формулы (7) может вступать в реакцию со спиртами общей формулы HO-R6 в условиях, известных специалистам в этой области техники, необязательно с последующей защитой спиртовой группы в С-4 центре, с получением соединений формулы (6), перед реакцией восстановления. Изобретение также имеет отношение к новым способам получения соединений формулы (4) и (11),как описано ниже. Соединение формулы (4), где R1 представляет собой метоксипропоксигруппу, R2 представляет собой метоксигруппу и R3 и R4 представляют собой 2-пропил, может быть получено с помощью способа,известного в литературе, такого как описан в работе Rueger et al., на которую ссылались выше. Этот долгий способ имеет несколько недостатков, среди которых наиболее яркие - это применение хиральных вспомогательных средств в стехиометрических количествах, низкая диастереоселективность и, следовательно, громоздкое выделение. В другом аспекте изобретение представляет собой новый способ получения соединений формулы(3) или формулы (4) или их смесей, который представляет собой относительно короткий способ, с высоким выходом и с высокой селективностью. Удивительно короткий и эффективный синтез соединений формулы (3) и (4), включает следующие стадии:a) реакция присоединения цианида к обогащенному энантиомерами соединению формулы (14), гдеb) гидролизом нитрильной группы и последующим синтезом хлорангидрида;c) реакция сочения хлорангидрида с соединением формулы (19). Для наглядности синтез представлен на схеме I. Реакция сочетания соединений формулы (18) и (19), где R1 представляет собой метоксипропоксигруппу, R2 представляет собой метоксигруппу, R3 и R4 представляют собой 2-пропил иMX представляет собой MgCl, приводит к образованию соединения формулы (4), описанного в работеRueger et al., на которую ссылались ранее. Сходные условия могут быть применены для достижения сочетания соединений формулы (17) и (19), что приводит к образованию соединения формулы (3), где М представляет собой элемент, который выбирают из группы Mg, Li, Се, Ti, Cu, Zn, Mn, Fe, В, Si или Al, иX представляет собой анион, в общем, галоген. Предпочтительно М представляет собой Mg и X представляет собой хлорид. Соединения формулы (17) и (18) или их смеси может быть легко получены из соответствующих нитрилсодержащих соединений формулы (15) и (16) или их смесей с помощью способов, известных специалистам в этой области техники (гидролиз нитрилов и образование хлорангидрида соответственно). Соединения формулы (15) и (16) (такие, как раскрыты в патенте WO 2009/080773) или их смеси получают с помощью взаимодействия хирального альдегида формулы (14) с цианидом, предпочтительно сHCN, NaCN, KCN, (R)3SiCN (где R выбирают из C1-6 алкила, C1-10 алкиларила и C1-10 арила), необязательно,в присутствии хирального катализатора. Указанный катализатор может быть хиральным органическим соединением, хиральным комплексом металла или ферментом, как описано F.X. Chen и Х.М. Feng в работе "Asymmetric synthesis of cyanohydrins", Current Organic Synthesis, 2006, 3, 77-97 и в ссылках в этой работе; и в работе P. Poechlauer, W. Skranc, и М. Wubbolts "The large-scale biocatalytic synthesis ofWiley-VCH, 2004, p. 151-164. Предпочтительно применяют HCN или (R)3SiCN в присутствии подходящего хирального катализатора. Более предпочтительно применяют HCN и фермент HNL (гидроксинитриллиазу). Подходящие условия для синтеза соединения формулы (15) или соединения формулы (16) или их смеси известны специалистам в этой области техники и описаны в приведенных выше ссылках и в ссылках в этих работах. Соединение формулы (15), где R7 эквивалентно Н, относительно легко замыкается в кольцо с образованием соединения формулы (16) в кислых условиях, например в присутствии каталитического количества паратолуолсульфоновой кислоты, все по аналогии со способами образования лактонов, известных специалистам в этой области техники. Для образования лактона R6 представляет собой предпочтительноC1-6 алкил, более предпочтительно R6 представляет собой метил. Соединение формулы (16) может быть получено в желаемой диастереохимической конфигурации путем замыкания в кольцо соединения формулы (15), в желаемой конфигурации или путем замыкания в кольцо обоих диастереомеров соединения формулы (15), с фиксированной конфигурацией в С-2 стереогенном центре, с последующей эпимеризацией С-4 стереогенного центра в термодинамически предпочтительный диастереомер, также представляющий собой желаемый диастереомер. Указанная эпимеризация может быть проведена путем нагревания соединения формулы (16), необязательно в подходящем растворителе и, необязательно, в присутствии основания или других подходящих добавок. Альтернативно, диастереоизомер с желаемой конфигурацией можно отделить от другого диастереоизомера, используя разницу в их физических свойствах (например, с помощью избирательной кристаллизации), или с помощью классической хроматографии или хроматографии с псевдодвижущимися слоями (SMB). Под-8 023266 ходящие примеры SMB хроматографии можно найти в работе Schulte и Strube J. Chromatogr. A 2001, 906,399-416 и в ссылках в этих работах. Предпочтительно соединение формулы (16) в диастереохимически желаемой конфигурации представляет собой полученное путем замыкания в кольцо оптически чистого соединения формулы (15), гдеR7 эквивалентно Н и R6 представляет собой С 1-6 алкил. Альтернативно, диастереомерные смеси соединений формулы (15) или (16) могут быть гидролизованы до соответствующих кислот и затем очищены от нежелаемого диастереомера с помощью способов очистки, известных специалистам в этой области техники, например с помощью избирательной кристаллизации, необязательно, в присутствии хирального вспомогательного вещества, или с помощью хроматографических методик, таких как SMB. В другом аспекте изобретение обеспечивает новые способы получения полезного "строительного блока" формулы (14), раскрытой в патенте WO 2009/080773. Соединение формулы (14) может быть получено различными альтернативными путями, всеми удивительно короткими, и эффективными к атому,как проиллюстрировано на схеме II для соединения формулы (14), где R4 эквивалентен 2-пропилу (пронумерованному как 14 а), где R6 такой, как описан для соединения формулы (13), R' и R" одинаково или независимо означают необязательно замещенный C1-8 алкил или вместе образуют необязательно замещенное кольцо с максимальным числом атомов углерода равным 10 и Hal обозначает галоген. Схема II Новые способы получения соединений формулы (14) раскрыты как часть изобретения. В одном из новых способов соединение формулы (14) получают, применяя способы разделения соответствующего ацеталя, соединения формулы (20) (обозначено на схеме как соединение формулы(20 а, с последующим гидролизом ацетальной группы с образованием альдегидной группы, например,кислотой, такой как водный раствор HCl. Подходящие способы разделения представляют собой способы,известные специалистам в этой области техники, такие как избирательная кристаллизация, необязательно, с помощью хиральных вспомогательных средств; классическое разделение; хроматографические методики, такие как SMB; или энзиматические способы разделения. В особенности применяют энзиматические способы разделения. Подходящие ферменты, которые следует применять в способах разделения,таких как описано выше, представляют собой, например, гидролазы. Примеры подходящих гидролаз представляют собой эстеразы, липазы, протеазы, пептидазы или ацилазы. Эти ферменты могут быть получены из животных, например эстераза печени свиньи, или из микроорганизмов, таких как бактерии или грибы или из растений. Примеры подходящих ферментов раскрыты, например, в патенте WO 2006/117057, в частности, на с. 4, строка 25 - с. 7, строка 6. Предпочтительно применяют ферменты, полученные не из животных. Рацемическое соединение формулы (20) может быть получено несколькими путями, например путем алкилирования замещенного эфира малоната альфа-галогенированным ацеталем, с последующим гидролизом и декарбоксилированием, как показано на правой стороне схемы II. Условия и реагенты для этих стадий известны специалистам в этой области техники. Альфа-алкилирование подходящего слож-9 023266 ного эфира альфа-галогенированным ацеталем, как показано в верхней части схемы II, представляет собой другое целесообразное решение. Другие новые способы, ведущие к соединению формулы (14), основаны на каталитическом асимметричном восстановлении циклических или нециклических предшественников, в которых двойная С=С связь может быть тетразамещенной, или изомеризованной тризамещенной, или их смесей, необязательно, с последующим раскрытием кольца лактона и с последующим окислением. Для циклического соединения формулы (21 а) эта последовательность реакций изображена снизу от центра на схеме II. Для изомеризованных циклических соединений или их смесей с соединением формулы (21 а) это изображено слева от центра на схеме II, для соединения, где R4 представляет собой 2-пропил. Для нециклических предшественников эта последовательность реакций изображена в верхней левой части схемы II (R4 представляет собой 2-пропил). Подходящие условия и реагенты для каталитического асимметричного восстановления С=С связи сходны с теми, что описано выше для восстановления C=N связи. Особые примеры описаны в главах 2331 Handbook of Homogeneous Hydrogenation, de Vries и Elsevier (Eds.); Wiley-VCH, Weinheim, 2007. Предпочтительно для восстановления С=С связи применяют молекулярный водород в комбинации с катализаторами на основе переходного металла, представляющими собой оптически обогащенные соединения. Подходящие условия и реагенты для раскрытия кольца лактона и последующего окисления спиртовой группы известны специалистам в этой области техники. Предпочтительно раскрытие кольца лактона(соединение, где R4 представляет собой 2-пропил, которое обозначено на схеме формулой 22 а) проводят в неспиртовых растворителях. Другой новый способ, приводящий к соединению формулы (14), представляет собой любой способ разделения рацемического лактона (соединения формулы (22, которое само по себе может быть легко получено с помощью восстановления соединения формулы (21), или его изомеризованного соединения или их смеси, как показано в левом нижнем углу схемы II для соединения, где R4 представляет собой 2-пропил. Подходящие способы разделения для этого способа сходны с теми, что описаны выше для соединения формулы (20). Для синтеза соединения формулы (14), предпочтительно применяют:a) способы разделения соединения формулы (20) с последующим гидролизом ацетальной группы с получением альдегидной группы;b) каталитическое асимметричное восстановление соединения формулы (21) с последующим раскрытием кольца и окислением. Особо, и не ограничиваясь этим, синтез алискирена (2(S),4(S),5(S),7(S)-N-(2-карбамоил-2 метилпропил)-5-амино-4-гидрокси-2,7-диизопропил-8-[4-метокси-3-(3 метоксипропокси)фенил]октанамид полуфумарата) с применением реакций изобретения показан на схеме III. Схема III Способы и соединения в соответствии с изобретением особенно пригодны для получения 2(S),4(S),5(S),7(S)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов (соединений формулы 13, гдеX обозначает NHR5) или их фармацевтически приемлемых солей, таких, которые раскрыты в патентахWO 02/02508, WO 2006/061427 и WO 2006/095020, и включенных в настоящий документ путем отсылки. В особенности способы и соединения в соответствии с изобретением пригодны для получения соединений формулы (I), по п.1 формулы изобретения патента WO 02/02508 А 1 и их фармацевтически приемлемых солей. Соли, включая фармацевтически приемлемые соли соединений формулы (13), где X представляет собой HNR5, означают соли, которые, в общем смысле, безопасны, нетоксичны и не представляют собой нежелательные в биологическом смысле или в других отношениях соли и которые обладают желаемой фармакологической активностью исходного соединения. Эти соли получают из неорганических или органических кислот или оснований. Фармацевтически приемлемые соли соединений формулы (13), например, раскрыты в патентеUS 5559111, который включен в настоящий документ путем отсылки, и, в особенности, от колонки 11,строка 50 до колонки 12, строка 33, указанного документа, этот параграф также в явной форме включен путем отсылки. Все соединения в соответствии с изобретением могут быть выделены с помощью способов, известных специалистам в этой области техники, таких как кристаллизация, перегонка или с помощью хроматографических методик. Некоторые особые способы выделения, но не представляющие собой ограничивающие способы, описаны в примерах. Количество реагентов и добавок, примененное в способах изобретения, в основном, известно специалистам в этой области техники и может быть изменено в широких пределах. В зависимости от природы реагента (реакционная способность, стоимость и т.п.), он может быть применен в большом избытке,или в стехиометрических количествах, или в количествах, меньших, чем стехиометрические, например,следует понимать, что катализаторы и определенные добавки могут быть применены только в количествах, меньших, чем стехиометрические, в особенности, в каталитических количествах. Следующие примеры предназначены для иллюстрации изобретения, никоим образом его не ограничивая. Пример 1. Получение 2-изопропилиденбутиролактона из ацетона и -бутиролактона: Диизопропиламин (41,0 мл, 292 ммоль, 1,15 экв.) растворяют в THF (140 мл) и охлаждают до -70 С. н-BuLi (2,9 М в гексанах, 95,8 мл, 278 ммоль, 1,1 экв.) добавляют по каплям при -70 С и полученный желтый раствор перемешивают при 0 С в течение 30 мин. Раствор затем охлаждают до -70 С, после чего раствор -бутиролактона (19,3 мл, 253 ммоль, 1,0 экв.) в THF (100 мл) добавляют по каплям в течение 20 мин. Раствор перемешивают в течение 1 ч при -70 С и затем по каплям в течение 20 мин добавляют ацетон (37,2 мл, 506 ммоль, 2,0 экв.). В дальнейшем реакционную смесь перемешивают в течение 4 ч при-70 С и затем охлаждают до комнатной температуры при перемешивании в течение ночи. Реакцию останавливают водой и разводят МТВЕ. Органический слой экстрагируют с помощью HCl (водн. 1 н., 6) и объединенные водные слои экстрагируют хлороформом (9). Объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением спирта в виде желтой жидкости/масла, которую применяют на следующей стадии без дополнительной очистки. Неочищенный спирт растворяют в толуоле (500 мл) и добавляют H2SO4 (95-97%, 1,75 мл,32,8 ммоль, 13 мол.%). Полученную реакционную смесь нагревают в колбе с обратным холодильником в течение ночи. В дальнейшем реакционную смесь охлаждают до комнатной температуры. Органический слой разводят МТВЕ и промывают HCl (водн. 1 н.), NaHCO3 (насыщ. водн.) и солевым раствором (насыщ. водн.), высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением коричневой жидкости. Водные слои объединяют и рН доводят до 7. Водный слой затем экстрагируют дихлорметаном (3) и объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением желтой жидкости, которую добавляют к полученной ранее коричневой фракции. Продукт очищают с помощью перегонки при пониженном давлении (65 С,1 мбар) и получают бледно-желтую жидкость. После дополнительной очистки с помощью колоночной хроматографии (гептан-EtOAc 7:3) желаемый продукт (21 а) (22,0 г, 174 ммоль, 69%) получают в виде бесцветной жидкости. 1 Тетразамещенный алкен (21 а) (5,0 г, 40 ммоль) растворяют в этаноле (100 мл) и перемешивают в автоклаве под атмосферой водорода (50 бар) в присутствии Pd/C (500 мг) в течение 16 ч при комнатной температуре. В дальнейшем, суспензию фильтруют через Дикалайт, и полученный прозрачный раствор концентрируют при пониженном давлении с получением насыщенного лактона (3,1 г, 24 ммоль, 61%) в виде бесцветной жидкости. 1 К раствору соединения (rac-22 а) (1,5 г, 12 ммоль) в МеОН (10 мл) добавляют раствор NaOH (0,47 г,12 ммоль, 1,0 экв.) в МеОН (20 мл). Полученный раствор перемешивают при комнатной температуре в течение 16 ч, затем концентрируют при пониженном давлении и получают соответствующую рацемическую натриевую соль с количественным выходом в виде грязно-белой пены. 1H-ЯМР натриевой соли (CD3OD, 300 МГц)= 0,94 (d, J=6,4 Гц, 3H, СН 3), 0,98 (d, J=6,4 Гц, 3H,CH3), 1,70-1,87 (m, 3H, С 2-Н и C3-H2), 1,95 (m, 1H, (CH3)2CH), 3,58 (m, 2H, C4-H2) ppm. Пример 4. Раскрытие оптически обогащенного 2-изопропилиденбутиролактона с образованием натриевой соли, с последующим замыканием кольца для определения э.и. (натриевой соли): Оптически обогащенное соединение лактона (22 а) (110 мг, 0,86 ммоль, 84% э.и.) растворяют в D2O(1,0 мл) и добавляют раствор NaOH (34,4 мг, 0,86 ммоль, 1,0 экв.) в D2O (1,0 мл) при 0 С в течение 30 мин тремя порциями. Реакционную смесь перемешивают в течение дополнительных 90 мин при 0 С. 1 Н-ЯМР анализ показал полное превращение в линейное соединение с раскрывшимся кольцом. рН реакционной смеси доводят до 0-1 с помощью водного раствора HCl (1 М) и реакционную смесь перемешивают в течение 1 ч при температуре окружающей среды. Водный слой экстрагируют хлороформом (2) и объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. Хиральная GC показала, что энантиомерный избыток соединения формулы (22 а) равен 83%. Пример 5. Алкилирование натриевой соли с образование метилового эфира: Натриевую соль 4-гидрокси-2-изопропилбутаноата (56 мг, 0,33 ммоль) и NaHCO3 (s, 277 мг,3,3 ммоль, 10 экв.) суспендируют в смеси хлороформа (2,5 мл) и DMF (1,0 мл). Полученную суспензию перемешивают при комнатной температуре в течение 4 ч и затем реакцию останавливают путем добавления воды. Водный слой экстрагируют с помощью хлороформа (3), объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. Остаточный DMF уда- 12023266 ляют путем совместного испарения с толуолом с получением желаемого метилового эфира в виде бесцветного масла (количественно). 1(42 мг, 0,43 ммоль, 1,5 экв.). Полученную суспензию охлаждают до 0 С и затем добавляют TEMPO(1,0 мг, 6,4 мкмоль, 2,2 мол.%) и в конце единой порцией трихлорциануровую кислоту (ТССА, 34 мг,0,15 ммоль, 0,50 экв.). Полученную реакционную смесь перемешивают при 0 С в течение 90 мин и затем реакцию останавливают Na2S2O3 (водн. 10% мас./мас.). Водный слой экстрагируют с помощью дихлорметана, объединенные органические слои промывают NaHCO3 (насыщ. водн.), высушивают (Na2SO4),фильтруют, концентрируют при пониженном давлении и получают соединение (14 а) (30 мг, 0,17 ммоль,61%) в виде желтого масла. 1H-ЯМР соединения (14 а) (CDCl3, 300 МГц)= 0,92 (d, J=6,6 Гц, 3H, СН 3), 0,94 (d, J=6,6 Гц, 3H,CH3), 1,26 (t, J=7,2 Гц, 3H, CH3CH2OCO), 2,03 (m, 1H, (CH3)2CH), 2,53 (m, 1H, C4-H), 2,78 (m, 1H, C2-H),2,88 (m, 1H, C4-H), 4,16 (m, 2H, CH3CH2OCO), 9,79 (s, 1H) ppm. Пример 7. Получение метил-4,4-диэтокси-2-изопропилбутаноата (соединения формулы 20 а). Гидрид натрия (32,0 г 60%-ной дисперсии в минеральном масле; 0,8 моль) суспендируют в 1 л безводного DMF и охлаждают до 0-5 С с помощью наружного охлаждения. Затем в течение 1 ч при 5-10 С добавляют диметил-2-изопропилмалонат (139,2 г; 0,8 моль) и перемешивают в течение следующего часа при 10 С, после чего никакого дополнительное выделения водорода нельзя было зарегистрировать. Затем к реакционной смеси добавляют бромацетальдегида диэтилацеталь (157,6 г; 0,8 моль) и получают красно-коричневый раствор, который затем нагревают до 130 С в течение 18 ч при перемешивании. GC анализ (НР-5, 30 м 0,32 мм 0,25 мкм; Тначал.=80 С (1 мин), скорость 20 С/мин, Тконечн=300 оС(3 мин показал полное превращение малоната. Эту смесь охлаждают до комнатной температуры, добавляют метанол (32 г; 1 моль) и хлорид лития(34 г; 0,8 моль). Смесь перемешивают под азотом и нагревают до 130 С в течение 8 ч. GC-анализ показал полное превращение. Затем реакционную смесь концентрируют при пониженном давлении (70 С,25 мбар, 500 мл дистиллята), охлаждают и после добавления воды (500 мл) и метил-трет-бутилового эфира (300 мл), фильтруют через предварительно покрытый фильтр. Фазы разделяют и водный слой экстрагируют с помощью метил-трет-бутилового эфира (2300 мл). Объединенные органические слои высушивают над Na2SO4 и концентрируют путем отгонки растворителя при пониженном давлении (70 С,25 мбар). Остаточную жидкость подвергают фракционной перегонке (60 С, 1 мбар) и получают 82 г бесцветного масла рацемического соединения формулы (20 а). Общий выход = 45%. 1 В круглодонной колбе, оборудованной устройством pH-STAT, добавляют 47 г очищенного метил 4,4-диэтокси-2-изопропилбутаноата (202,3 ммоль) к 2,265 л фосфатного буфера рН 7,5 (100 мМ). Затем добавляют 85 мл бесклеточного экстракта фермента (Diversa 13665, 5,35 г фермента), и раствор перемешивают при комнатной температуре до тех пор, пока один из энантиомеров не будет полностью превращен (контролируют по поглощению NaOH, поддерживая при этом постоянное значение рН). Через 72 ч (э.и. оставшегося метил-4,4-диэтокси-2-изопропилбутаноата 99%) добавляют МТВЕ руют и водную фазу экстрагируют три раза МТВЕ (3500 мл). Объединенные органические фазы фильтруют через Celite для удаления остаточной биомассы, и органическую фазу высушивают над безводным сульфатом натрия. После фильтрации растворитель отгоняют при пониженном давлении с получением желаемого энантиомера метил-4,4-диэтокси-2-изопропилбутаноата (э.и. 99%) в виде бледно-желтого масла (20,5 г, 88,2 ммоль, 95% чистота - на основе GC анализа). Пример 9. Получение метил 2-(формилметил)-3-метилбутаноата (14 а). Метил-4,4-диэтокси-2-изопропилбутаноат (э.и. 99%, 25,6 г; 110 ммоль) растворяют в 220 мл 0,5 н.HCl и перемешивают в течение 2 ч при комнатной температуре. Смесь экстрагируют метил-вторбутиловым эфиром (2100 мл), концентрируют путем отгонки растворителя при пониженном давлении и получают 16,3 г бесцветного масла. 1H-ЯМР (CDCl3): 0,95 (dd, 6H); 1,85-2,00 (m, 1H); 2,35-2,45 (dd, 1H); 2,65-2,70 (m, 1H); 2,75-2,90 (m,1H); 3,60 (s, 3H); 9,70 (s, 1H). Пример 10. Получение 2-изопропилбутиролактона (соединения формулы 22 а) путем каталитического асимметричного гидрирования дигидро-3-(пропан-2-илиден)фуран-2(3h)-она (21 а). Раствор (R)-1-[(S)-2-(ди-2-фурфурилфосфино)ферросенил]этилди-трет-бутилфосфина 5,7 мг(11 мкмоль) и 250 мкл 0,04 М (10 мкмоль) Ru(COD)(метилаллил)2 в дихлорметане помещают в сосуд,затем добавляют 1,4 мкл (10 мкмоль) HBF4OEt2, 5 мл дихлорметана и 35 мкл (320 мкмоль) дигидро-3(пропан-2-илиден)фуран-2(3H)-она. Этот раствор переносят в аппарат для проведения гидрирования и гидрируют в течение 1 ч 30 мин при 50 С и 25 бар водорода. GC-анализ показал 100%-ное превращение и 93%-ный энантиомерный избыток. Условия проведения gc. Колонка Chiraldex G-TA (30 м 0,25 мм ID0,13 мкм). Температура печи 80 С (1 мин)5 С/мин 180 С (5 мин). Скорость тока газа-носителя Не 1,2 мл/мин. Отношение деления потока 1: 50. Объм введенной пробы 1 мкл. Энантиомер 1: 10,3 мин. Энантиомер 2: 10,8 мин Субстрат: 11,7 мин. Пример 11. Синтез обогащенного энантиомером циангидрина: (S)-метил-2-S)-2-циано-2-гидроксиэтил)-3 метилбутаноата (соединения формулы 15): Смесь 72 мл S-HNL в 18 мл K-фосфатного буфера (20 мМ, рН=5,6) и 360 мл МТВЕ загружают в реактор. Две фазы смешивают путем интенсивного перемешивания и добавляют 20 мл чистого HCN(0,53 моль) при температуре, равной 0 С. Метил 2-(формилметил)-3-метилбутаноат (16,5 г), разведенный в 95 мл МТВЕ, порциями добавляют в реактор в течение 20 мин. Смесь перемешивают в течение 3 ч при 0 С. Превращение альдегида равно 95% и э.и. 95%. Реакционную смесь разводят 200 мл МТВЕ. После разделения фаз водный слой экстрагируют МТВЕ (2100 мл), закисляют 0,2 мл концентрированной Н 3 РО 4 и высушивают над Na2SO4. После фильтрации МТВЕ отгоняют при пониженном давлении, получая 21,0 г циангидрина формулы (15) (э.и. С-4 центра равно 97%). Пример 12. Синтез лактонитрила: (2S,4S)-тетрагидро-4-изопропил-5-оксофуран-2-карбонитрила (соединения формулы 16) Циангидрин по примеру 11 (12,4 г) разводят в 120 мл толуола и добавляют 25 г молекулярного сита с размером пор 5 . К этой смеси добавляют 250 мг п-толуолсульфоновой кислоты и при перемешивании смесь нагревают до 70 С в течение 1 ч. После охлаждения до RT молекулярные сита фильтруют и промывают толуолом. Собранную органическую фазу промывают насыщенным водным раствором бикарбоната натрия и высушивают над Na2SO4. Затем Na2SO4 фильтруют, органическую фазу концентрируют при пониженном давлении, получая 10,7 г неочищенного лактона. Очистка с помощью колоночной флэш-хроматографии на силикагеле дает указанное в подзаголовке соединение с 98% чистотой. К раствору циангидрина (10 г) в DMF (180 мл) добавляют при 0 С имидазол (7,35 г, 108 ммоль), затем добавляют TBDMSiCl (9,77 г, 64,8 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. В дальнейшем реакционную смесь заливают в ледяной водный раствор HCl (1 М, 80 мл). После добавления диэтилового эфира (100 мл) органический слой отделяют и водный слой дополнительно экстрагируют диэтиловым эфиром (2100 мл). Объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия и солевым раствором, высушивают над Na2SO4 и затем удаляют растворитель при пониженном давлении. Неочищенную смесь очищают с помощью колоночной флэш-хроматографии на силикагеле, получая указанное в подзаголовке соединение. 1HCl и перемешивают в колбе с обратным холодильником в течение 18 ч. Смесь охлаждают до комнатной температуры и экстрагируют метил-трет-бутиловым эфиром (3100 мл). Объединенные органические слои высушивают над Na2SO4, фильтруют и концентрируют путем отгонки растворителя при пониженном давлении и получают 16,8 г желтого масла (97,7 ммоль). Очистка через получение дициклогексиламиновой соли. Желтое масло растворяют в 240 мл смеси гептан/метил-трет-бутиловый эфир (1:2 объем/объем). Затем по каплям добавляют дициклогексиламин (17,7 г; 97,7 ммоль). Происходит спонтанная кристаллизация. Осадок отделяют фильтрованием, промывают гептаном, высушивают при пониженном давлении и получают 17,6 г белого твердого вещества. Затем это белое твердое вещество суспендируют в 200 мл метил-трет-бутилового эфира и добавляют по каплям 4,9 мл (58,8 ммоль) конц. HCl при комнатной температуре. Смесь перемешивают в течение дополнительного 0,5 ч. Осадок фильтруют, фильтрат концентрируют при пониженном давлении и получают 9,8 г кислоты (57,0 ммоль) в виде светло-коричневого масла, которое кристаллизуется после нескольких часов стояния. 1H-ЯМР (CDCl3): 0,95 (d, 3H); 1,05 (dd, 3H); 2,2-2,7 (3m, вместе 4 Н); 9,2 (широкая s, 1H). Пример 15. Синтез тетрагидро-4-изопропил-5-оксофуран-2-карбонил хлорида (соединения формулы 18). Сухую и заполненную газообразным азотом 3-горлую круглодонную колбу (250 мл), оборудованную магнитной мешалкой, входным устройством для газообразного азота, перегородкой и термопарой,заполняют 7,12 г (38,08 ммоль, 1,00 экв.) лактона карбоновой кислоты (по примеру 14) и 45 мл толуола(безводного, дегазированного). Добавляют 5 мл (7,5 г, 59,09 ммоль, 1,6 экв.) оксалилхлорида и затем 22 мкл диметилформамида (безводного), что приводит к выделению газа. Раствор перемешивают при комнатной температуре в течение 3,5 ч, после чего в образце реакционной смеси останавливают протекание реакции добавлением этанола и убеждаются в отсутствии исходного материала согласно TLCанализу. Растворитель удаляют при пониженном давлении при комнатной температуре и получают желаемый хлорангидрид. Пример 16. Получение соединения формулы (19 а): Сухую и заполненную газообразным азотом 3-горлую круглодонную колбу (500 мл), оборудованную обратным конденсатором, делительной воронкой, магнитной мешалкой и входным отверстием для газообразного азота, заполняют 4,680 г (192,5 ммоль, 1,1 экв.) порошком Mg, 10 мл тетрагидрофураном 1,2-диброметана в 163 мл THF и 20 мл этого раствора добавляют в кашицу Mg. Эту смесь нагревают до кипения и, нагревая в колбе с обратным холодильником, добавляют по каплям оставшийся раствор в течение примерно 1,5 ч. Смесь затем нагревают в колбе с обратным холодильником в течение дополнительных 3,5 ч, после чего анализ с помощью TLC показал отсутствие исходного материала. Концентрация раствора Гриньяра равна 0,763 М, как было определено с помощью титрования с втор-бутанолом, в присутствии фенантролина в качестве индикатора. Пример 17. Синтез соединения формулы (4 а): сочетание соединения формулы (19 а) с соединением формулы(18 а). Хлорангидрид, полученный в примере 15 (18 а), растворяют в 45 мл THF (сухого, дегазированного) и охлаждают во льдо-водяной бане. К этому добавляют по каплям охлажденный раствор в течение 30 мин, всего 51 мл (38,91 ммоль, 1,02 экв.) раствора Гриньяра по примеру 16, поддерживая температуру снаружи ниже 22 С. Реакционную смесь охлаждают на льду и медленно добавляют 25 мл воды. Образовавшуюся кашицу фильтруют и осадок промывают 50 мл этилацетата. Объединенные фильтраты промывают водой (50 и 100 мл) и солевым раствором (100 мл), высушивают над Na2SO4, фильтруют, отгоняют при пониженном давлении и получают 17,19 г неочищенного продукта в виде масла. Это очищают с помощью колоночной хроматографии и получают соединение формулы (4 а) в виде чистого диастереоизомера. Пример 18. Диизопропиламин (3,56 мл, 25,3 ммоль, 1,05 экв.) растворяют в THF (14 мл) и охлаждают до -70 С. н-BuLi (1,6 М в гексанах, 15,2 мл, 24,2 ммоль, 1,0 экв.) добавляют по каплям при -70 С и полученный желтый раствор перемешивают при 0 С в течение 30 мин. Раствор затем охлаждают до -70 С, после чего добавляют по каплям раствор этилизовалериата (3,65 мл, 24,2 ммоль, 1,0 экв.) в THF (15 мл) в течение 20 мин. Раствор перемешивают в течение 1 ч при -70 С и затем добавляют по каплям бензилоксиацетоальдегид (3,74 мл, 26,6 ммоль, 1,1 экв.). В дальнейшем реакционную смесь перемешивают в течение 3 ч при -70 С и затем охлаждают до комнатной температуры при перемешивании в течение ночи. Реакцию останавливают с помощью NH4Cl (насыщ. водн.) и водный слой экстрагируют с помощью EtOAc (3). Объединенные органические слои промывают солевым раствором (насыщ. водн.), высушивают (Na2SO4),фильтруют и концентрируют при пониженном давлении с получением желаемых продуктов (4,9 г,17,5 ммоль, 72%, смесь диастереомеров) в виде желтого масла, которое применяют на следующей стадии без дополнительной очистки. 1 К раствору соединение спирта по примеру 18 (1,0 г, 3,56 ммоль) в 1,2-дихлорэтане и триэтиламине(5,0 мл, 1:1 объем/объем) при 0 С добавляют N,N-4-диметиламинопиридин (44 мг, 0,36 ммоль, 10 мол.%) и затем по каплям метансульфонилхлорид (0,83 мл, 10,7 ммоль, 3,0 экв.). Полученный раствор перемешивают в течение 48 ч, подогревая его до комнатной температуры. Реакцию останавливают NH4Cl (насыщ. водн.) и разводят водой. Слои разделяют, и водный слой экстрагируют с помощью хлороформа(3). Объединенные органические слои промывают NaHCO3 (насыщ. водн.) и солевым раствором (насыщ. водн.), высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением мезилированного продукта в виде желтого/коричневого масла, который применяют на следующей стадии без дополнительной очистки. Мезилированное соединение растворяют в толуоле (10 мл) и добавляют диазабицикло-ундецен(DBU, 0,64 мл, 4,3 ммоль, 1,2 экв.). Полученный раствор нагревают в колбе с обратным холодильником в течение 2 ч в атмосфере азота. Реакционную смесь оставляют охлаждаться до комнатной температуры и разводят EtOAc. В дальнейшем органический раствор промывают NH4Cl (насыщ. водн.) и солевым рас- 16023266 твором (насыщ. водн.), высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (гептан-EtOAc 95:5 объем/объем) и получают 0,88 г продукта (3,36 ммоль, 94% в течение 2 стадии, 1:1 E/Z-смесь) в виде желтого масла. 1(25 мл) и полученный раствор нагревают в колбе с обратным холодильником в течение ночи в присутствии стехиометрических количеств серной кислоты (96%, 0,74 мл, 14 ммоль). Реакционную смесь оставляют охлаждаться до комнатной температуры, после чего реакцию останавливают NaHCO3 (насыщ. водн.). Водный слой экстрагируют с помощью хлороформа (3) и объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. В дальнейшем продукт разводят пентаном и экстрагируют ацетонитрилом. Ацетонитрильный слой промывают пентаном (2) и затем концентрируют при пониженном давлении. Продукт дополнительное очищают с помощью колоночной хроматографии (гептан-EtOAc 4:1 объем/объем) и перегоняют в установке Кугельрора с получением ненасыщенного лактона (1,3 г, 10 ммоль, 74%) в виде бесцветной жидкости. 1(0,24 мл, 2,9 ммоль, 1,9 экв.) в DCM (7,5 мл) при -78 С в атмосфере азота. Полученный раствор перемешивают при -78 С в течение 20 мин, после чего добавляют первые 250 мг натриевой соли, показанной в уравнении (1,49 ммоль) в DCM (7,5 мл) и затем уксусную кислоту (0,20 мл, 3,5 ммоль, 2,3 экв.). Полученную суспензию перемешивают в течение дополнительных 20 мин при -78 С, после чего добавляют триэтиламин (2,5 мл, 18 ммоль, 12 экв.). Реакционную смесь оставляют охлаждаться до 0 С и перемешивают при этой температуре в течение 4 ч, а затем при комнатной температуре в течение ночи. Реакцию останавливают водой и рН водного слоя доводят до рН 3-4 с помощью HCl (1 М, водн.). Водный слой экстрагируют с помощью DCM (4) и объединенные органические слои высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении. 1H-ЯМР неочищенного продукта показал присутствие смеси продуктов. Желаемый полуацеталь был идентифицирован по характеристическому пику при 5,77ppm (C4-H). Важно отметить, что не было обнаружено никакого сверхокисления с образованием дикарбоновой кислоты или соответствующего ангидрида. Присутствие полуацеталя подтвердили с помощьюTEMPO (1,8 мг, 12 мкмоль, 2 мол.%) добавляют к суспензии натриевой соли 4-гидрокси-2- 17023266 изопропилбутаноата (100 мг, 0,60 ммоль) в DCM (5,0 мл) при 0 С. В дальнейшем добавляют трихлорциануровую кислоту (152 мг, 0,65 ммоль, 1,1 экв.), под действием чего суспензия становится желтого цвета. Реакционную смесь перемешивают при 0 С в течение 2 ч и затем разводят водой. Органический слой высушивают (Na2SO4), фильтруют и концентрируют при пониженном давлении с получением ангидрида как единственный продукт. 1(1,8 г, 44 ммоль, 1,1 экв.). Полученный раствор перемешивают в течение ночи при комнатной температуре и затем концентрируют при пониженном давлении с получением желаемой соли соединения с раскрывшимся кольцом в виде грязно-белого твердого вещества. 1H-ЯМР показал, что желаемое соединение загрязнено побочным продуктом (приблизительно 20%), который был идентифицирован как соль, изображенная в уравнении, образованная добавлением метанола в 1,4-положение. 1H-ЯМР побочного продукта (CD3OD, 300 МГц)= 1,25 (s, 3H, СН 3), 1,28 (s, 3H, СН 3), 2,49 (m, 2 Н,С 3-Н 2), 2,60 (dd, J=3,0, 11,4 Гц, 1H, C2-H), 3,21 (s, 3H, СН 3 О), 3,60 (t, 2H, C4-H2) ppm. Смесь полученных выше солей (4:1 моль/моль, 720 мг, 4,2 ммоль) растворяют в DMF (3,0 мл) и добавляют MeI (0,32 ммоль, 5,0 ммоль, 1,2 экв.). Полученную смесь перемешивают в течение ночи при комнатной температуре в атмосфере азота. Реакцию останавливают водой и полученную гомогенную смесь экстрагируют с помощью хлороформа (2). Объединенные органические слои высушивают(Na2SO4), фильтруют и концентрируют при пониженном давлении. Остаточный DMF удаляют путем совместного испарения с толуолом и получают смесь желаемого сложного эфира и сложного эфира, полученного из побочного продукта (4:1 моль/моль, 600 мг, 3,6 ммоль, 87%) в виде желтого масла. 1H-ЯМР желаемого сложного эфира (CDCl3, 300 МГц)= 1,79 (s, 3H, СН 3), 1,93 (s, 3H, СН 3), 2,51 (t,J=6,3 Гц, 2 Н, С 3-Н 2), 3,62 (m, 2H, С 4-Н 2), 3,67 (s, 3H, CH3) ppm. 1H-ЯМР сложного эфира побочного продукта (CDCl3, 300 МГц)= 1,14 (s, 3H, СН 3), 1,16 (s, 3H,СН 3), 2,51 (m, 2 Н, С 3-Н 2), 2,74 (dd, J=3,3, 10,5 Гц, 1 Н, C2-H), 3,14 (s, 3H, СН 3 О), 3,60 (t, 2H, C4-H2), 3,67(s, 3H, С(О)ОСН 3) ppm. Пример 24. Получение соединения формулы (7): Раствор соединения формулы (4 а) с R4=2-пропил (868 мг) и бензиламин (1,07 г) в диэтиловом эфире(4,4 мл) дегазируют с помощью N2. К раствору при энергичном перемешивании медленно добавляют 1 М раствор TiCl4 в толуоле (1,1 мл). После перемешивания в течение 1 ч при комнатной температуре гетерогенную реакционную смесь разводят диэтиловым эфиром (5,4 мл) и фильтруют. Экстракция фильтрата с помощью 0,5 н. NaOH (250 мл), высушивание раствора над безводным Na2SO4, фильтрация и последующее выпаривание дали соответствующий имин, соединение формулы (7) (R8=бензил) с выходом 0,8 г.GCMS: M/z: 524. Примеры 25-27. Эксперименты по гидрированию соединения формулы (7). Получение соединения формулы (2).[Ir(COD)Cl]2 (0,0016 г) и растворяют. После предварительной подготовки смеси гомогенного катализатора с помощью 5 циклов N2 (3 бар) и с помощью 5 циклов H2 (25 бар), раствор перемешивают в течение 3 ч при 50 С и 25 бар H2. Способ В. Готовят раствор бензиламина (0,021 г) в CH2Cl2 (5 мл). В атмосфере N2 [Ir(COD)Cl]2 (0,0034 г) растворяют в растворе бензиламина (1 мл) и получают раствор катализатора. Раствор катализатора (0,1 мл) помещают в реакционный сосуд и CH2Cl2 удаляют при пониженном давлении, оставшийся комплекс в дальнейшем растворяют в 5 мл 0,01 М раствора соединения имина в метаноле, такого как был получен в примере 24. После предварительной подготовки метанольной реакционной смеси с помощью 5 циклов Было также обнаружено вплоть до около 10% нежелаемых 4(R)-2 стереоизомеров. Пример 28. Получение соединения формулы (2) из соединения формулы (4) - 2 стадии. Раствор кетона (соединение формулы (4 а), где R4=2-пропил) (359 мг) и бензиламина (443 мг) в диэтиловом эфире (2 мл) дегазируют с помощью N2. Затем медленно при комнатной температуре добавляют (0,5 мл) 1 М раствора TiCl4 в толуоле и гетерогенную смесь оставляют перемешиваться в течение 0,1 ч. Реакционную смесь в дальнейшем разводят диэтиловым эфиром (5 мл), затем фильтруют осадки, а остаток промывают 5 порциями по 1 мл диэтилового эфира. Согласно GC-анализу кетон был полностью превращен в имин, а избыток бензиламина остался в растворе диэтилового эфира. Из-за выпаривания диэтилового эфира на стадии фильтрации суммарный объем раствора имина доводят диэтиловым эфиром до общего количества, равного 10 мл. Для гидрирования (2,5 мл) раствора имина в диэтиловом эфире раствор помещают в сосуд и диэтиловый эфир испаряют с помощью тока N2. Остаток в дальнейшем растворяют в метаноле (10 мл). При этом [Ir(COD)Cl]2 (0,0024 г) растворяют в растворе 0,03 М раствора бензиламина в CH2Cl2 (1 мл) и отставляют на 0,25 ч. После удаления CH2Cl2 с помощью тока N2 оставшийся комплекс растворяют в подготовленном ранее растворе имина в метаноле (10 мл) и в дальнейшем реакционную смесь подвергают гидрированию. Перед гидрированием реакционную смесь дегазируют с помощью 5 циклов N2 (3 бар) и с помощью 5 циклов H2 (25 бар) и проводят гидрирование в течение 3 ч при 50 С и 25 бар H2. После гидрирования реакционную смесь фильтруют и обрабатывают в течение ночи 1 н. HCl (1 мл). Метанол удаляют при пониженном давлении и остаток растворяют в изопропаноле (10 мл), затем удаляют воду с помощью азеотропной перегонки досуха. Остаток растворяют в 1:1 смеси гептана и этилацетата, фильтруют через SiO2, и SiO2 промывают 1:1 смесью гептан/этилацетат (315 мл). Затем SiO2 промывают метанолом и получают раствор HCl-соли в метаноле. Метанол отгоняют и остаток растворяют в смеси CH2Cl2 (2 мл) и триэтиламина (0,2 мл), затем экстрагируют насыщ. NaHCO3 (21 мл). CH2Cl2 высушивают над безводным Na2SO4, фильтруют, затем удаляют CH2Cl2 с помощью перегонки. СогласноGC-анализу выход полученного 4(S),5(S)-стереоизомера (R8=бензил) составил 60%. Пример 29. Получение соединения формулы (2), из соединения формулы (4). Протокол восстановительного аминирования - 1-pot. В реакционный сосуд помещают [S)-tol-BINAP)RuCl2(DMF)x] (10 мг), кетон формулы (4 а) (40 мг),формиат аммония (189 мг) и растворяют в 7 н. NH3 в метаноле. Реакционную смесь дегазируют с помощью N2 и нагревают при 85 С. Через 2 ч образец реакционной смеси анализируют с помощью GC и образование продукта (4S,5S)-2 (R8=Н) демонстрируют путем сравнения со стандартом. Пример 30. Получение соединения формулы (2) из соединения формулы (7), применяя NaBH4 в качестве восстанавливающего агента. Образец имина, полученного в примере 24, растворяют в метаноле, обрабатывают избытком NaBH4 в течение 1 ч и в дальнейшем реакцию останавливают 6 н. HCl. Метанол удаляют при пониженном давлении и остаток растворяют в воде. После защелачивания водного слоя до рН 11 32%-ным NaOH в воде продукт экстрагируют с помощью CH2Cl2. Согласно GC выход полученного 4(S),5(S)-стереоизомера соединения формулы (2), где (R8=бензил) составил 60%. Пример 31. Рацемизация 4-(S) центра кетона формулы (4 а). Раствор соединения (4S)-4a, где R4=2-пропил (2,17 г) в изопропаноле (20 мл) перемешивают в течение 2 ч при 70 С в присутствии KHCO3 (0,5 г). Реакционную смесь охлаждают до комнатной температуры, изопропанол удаляют при пониженном давлении при 40 С и остаток растворяют в CH2Cl2 (20 мл). Экстрагируют раствор CH2Cl2 водой (350 мл), высушивают над безводным Na2SO4, фильтруют и выпаривают растворитель и получают вязкое масло. Анализ показал полную рацемизацию 4-С стереогенного центра, тогда как другие стереоцентры (2-(S) и 7-(S были по-прежнему оптически чистыми. Пример 32. Получение соединения формулы (7) с применением (R)метилбензиламина: Раствор кетона (4 а) (178 мг) и (R)метилбензиламина (264 мкл) в эфире (2 мл) дегазируют с помощью N2. К этому раствору медленно при энергичном перемешивании добавляют 1 М раствор TiCl4 в толуоле (0,25 мл). Реакционную смесь оставляют перемешиваться в течение 2 ч, фильтруют и остаток тщательно промывают избыточными количествами эфира. Для того чтобы удалить остаточные количества -метилбензиламина эфирный раствор экстрагируют с помощью разбавленного NaHCO3 (35 мл) и воды (5 мл). Эфирный слой отделяют, высушивают над безводным Na2SO4 и концентрируют. Остаток применяют как таковой в последующих реакциях. Пример 33. Получение соединения формулы (7) с применением (S)метилбензиламина: Раствор кетона (4 а) (178 мг) и (S)метилбензиламина (264 мкл) в эфире (2 мл) дегазируют с помощью N2. К раствору медленно при энергичном перемешивании добавляют 1 М раствор TiCl4 в толуоле(0,25 мл). Реакционную смесь оставляют перемешиваться в течение 2 ч, фильтруют и остаток тщательно промывают избыточными количествами эфира. Для того чтобы удалить остаточные количества-метилбензиламина, эфирный раствор экстрагируют с помощью разбавленного NaHCO3 (35 мл) и воды (5 мл). Эфирный слой отделяют, высушивают над безводным Na2SO4 и концентрируют. Остаток применяют как таковой в последующих реакциях. Пример 34. Получение соединения формулы (7) с применением (R)метилбензиламина и кетона формулы(4 а), где 4-С центр является рацемическим центром: Раствор кетона (4 а) (178 мг) и (R)метилбензиламина (264 мкл) в эфире (2 мл) дегазируют с помощью N2. К раствору при энергичном перемешивании медленно добавляют 1 М раствор TiCl4 в толуоле(0,25 мл). Реакционную смесь оставляют перемешиваться в течение 2 ч, фильтруют и остаток тщательно промывают избыточными количествами, эфира. Для удаления избыточных количеств-метилбензиламина эфирный раствор экстрагируют с помощью разбавленного NaHCO3 (35 мл) и воды(5 мл). Эфирный слой отделяют, высушивают над безводным Na2SO4 и концентрируют. Остаток применяют как таковой в последующих реакциях. Пример 35. Получение соединения формулы (7) с применением (S)метилбензиламина и кетона формулы(4 а), где 4-С центр является рацемическим центром: Раствор кетона (4 а) (178 мг) и (S)метилбензиламина (264 мкл) в эфире (2 мл) дегазируют с помощью N2. К раствору при энергичном перемешивании медленно добавляют 1 М раствор TiCl4 в толуоле(0,25 мл). Реакционную смесь оставляют перемешиваться в течение 2 ч, фильтруют и остаток тщательно промывают избыточными количествами эфира. Для удаления избыточных количеств-метилбензиламина, эфирный раствор экстрагируют с помощью разбавленного NaHCO3 (35 мл) и воды (5 мл). Эфирный слой отделяют, высушивают над Na2SO4 безводным и концентрируют. Остаток применяют как таковой в последующих реакциях. Примеры 36-39. Восстановление иминов по примерам 32-35 с применением NaBH4 и последующим гидрогенолизом(получение соединения формулы (2), где R8=Н). Метанол (5 мл) добавляют к остатку по примерам 32-35. В каждый сосуд добавляют NaBH4 (40 мг) и после полного превращения реакцию останавливают с помощью 1 н. HCl (1 мл), растворители удаляют при пониженном давлении и к остатку добавляют воду (2 мл). В присутствии CH2Cl2 (2 мл), рН доводят до 13 с помощью 32% NaOH при энергичном перемешивании и охлаждении. CH2Cl2 отделяют и водный слой экстрагируют CH2Cl2 (1 мл). Объединенные CH2Cl2 слои высушивают над безводным Na2SO4, фильтруют и CH2Cl2 удаляют. Гидрогенолиз. Для этой цели 45 мг полученных выше аминов растворяют в метаноле (5 мл). Реакционную смесь обрабатывают с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар) в присутствии влажного 10% Pd/C(80 мг). Гидрогенолиз в дальнейшем проводят при 50 С и 25 бар H2 в течение 2 ч. Результаты анализа реакционной смеси, полученные методом GC, см. в приведенной ниже таблице. Примеры 40-43. Синтез соединений формулы (2) (R8 = -метилбензил) путем получения имина соединения (4 а) иTi(OiPr)4 (2,98 г) и смесь оставляют перемешиваться в течение ночи. Фракцию полученного раствора(1,37 г) помещают в 5 мл сосуд, дегазируют с помощью N2 и в дальнейшем вносят 1 экв. источника гидрида. Смесь оставляют перемешиваться в течение 40 ч при комнатной температуре. Для HPLC-анализа образец готовят путем гидролиза реакционной смеси (0,2 мл) в 1 н. HCl (0,3 мл). Экстракцию проводят смесью CH2Cl2 (1 мл) и триэтиламина (0,1 мл) в присутствии дополнительного количества воды (1 мл). Слой CH2Cl2 отделяют и высушивают над безводным Na2SO4, фильтруют и летучие компоненты удаляют и получают остаток, содержащий продукт. Полученный остаток растворяют в HPLC-элюенте и раствор анализируют с помощью HPLC, результаты см. в приведенной ниже таблице. Примеры 44-47. Синтез соединений формулы (2) (R8 = (R)метилбензил) путем получения имина соединения (4 а) и (R)метилбензиламина и последующего гидрирования с применением Pt/C в различных растворителях.(R)метилбензиламин (0,66 г) и Ti(OiPr)4 (2,99 г) медленно добавляют к раствору (4S)-4 (2,17 г) в безводном THF (6,4 мл) и смесь оставляют перемешиваться в течение 40 ч при комнатной температуре. Реакционную смесь разводят раствором воды (1 мл) в THF (50 мл) и после перемешивания в течение одной ночи твердый компонент смеси фильтруют. После удаления THF при пониженном давлении при 30 С остаток немедленно растворяют в EtOAc (35 мл), затем проводят азеотропную отгонку воды и получают неочищенный продукт с выходом 2,48 г. Неочищенный продукт растворяют в МТВЕ (10 мл) и полученные раствор применяют как таковой в реакциях гидрирования. Для гидрирования раствор субстрата в МТВЕ (1,25 мл) испаряют досуха и растворяют в растворителе (5 мл). К полученному раствору субстрата добавляют влажного 5% Pt/C (140 мг) и смесь подготавливают для гидрирования с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар). Гидрирование проводят при комнатной температуре и 25 бар H2 в течение 24 ч. Согласно GC-анализу достигают полного превращения производного имина. Стереометрические соотношения продукта (2) (R8 = (R)-метилбензиламин) определяют с помощью HPLC, см. приведенную ниже таблицу. Примеры 48 и 49. Синтез соединений формулы (2) (R8 = (R)метилбензил) путем получения имина соединения (4 а) и (R)метилбензиламина и последующего гидрирования с применением Pt/C в различных растворителях (R)метилбензиламин (1,21 г) и Ti(OiPr)4 (5,98 г) медленно добавляют к раствору (4S)-4 (4,34 г) в безводном THF (16 мл) и смесь оставляют перемешиваться в течение 40 ч при комнатной температуре. Для гидрирования раствор производного имина в THF (1 мл) помещают в реакционный сосуд, и после удаления растворителя остаток растворяют в растворителе (5 мл), затем добавляют влажный Pt/C(140 мг) и смесь подготавливают для гидрирования с помощью 5 циклов N2 (3 бар) и 5 циклов H2(25 бар). Гидрирование проводят при 50 С и 25 бар H2 в течение ночи. Согласно GC-анализу достигают полного превращения производного имина. Стереометрические соотношения соединения формулы (2) Примеры 50 и 51. Синтез соединений формулы (2) (R8 = H) путем получения имина соединения (4 а) и-метилбензиламина и последующего гидрирования с применением Pd/C. Раствор кетона (4S)-4 (1,09 г), -метилбензиламина (363 мг) и триэтиламина (1,01 г) в эфире (12 мл) дегазируют с помощью N2. Затем медленно добавляют 1 М TiCl4 в толуоле (1,5 мл) при комнатной температуре и смесь оставляют перемешиваться в течение 3 ч. Из полученной реакционной смеси 1,2 мл разводят эфиром (2 мл) и экстрагируют раствором NaHCO3 в воде (31 мл), эфирный слой отделяют, высушивают над Na2SO4, фильтруют и эфир, удаляют. Полученный остаток растворяют в метаноле, и полученный раствор подготавливают для гидрирования с помощью 5 циклов N2 (3 бар) и 5 циклов H2(25 бар). Гидрирование проводят в присутствии влажного 10% Pd/C (80 мг) при 50 С и 25 бар H2 в течение 2 ч. После гидрирования образец фильтруют и стереометрические соотношения соединения формулы 2 (R8 = Н), определяют с помощью GC-анализа, см. приведенную ниже таблицу. Пример 52. Синтез соединения формулы (2) (R8 = H) путем получения имина соединения (4 а) и(R)метилбензиламин (308 мкл) и Ti(OiPr)4 (0,63 мл) и реакционную смесь оставляют перемешиваться в течение 24 ч. Имин изолируют с помощью колоночной хроматографии. Для этой цели колонку загружают SiO2 и гептаном (10 мл). В чистой гептановой фазе растворяют 1 мл реакционной смеси и наслаивают на верхнюю часть SiO2. Проводят элюцию смесью EtOAC/гептан и собирают 3 фракции по 10 мл. Фракции 1 и 2 объединяют и оставшиеся количества TiO2 фильтруют, затем удаляют растворитель при пониженном давлении при 30 С. Остаток (0,14 г) растворяют в изопропаноле и согласно GC-анализу раствор был свободен от (R)метилбензиламина. Для гидрирования 5 мл раствора изопропанола помещают в реакционный сосуд и подготавливают с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар). Гидрирование проводят в присутствии сухого 5%Pd/C (20 мг) при 50 С и 25 бар H2 в течение 20 ч и получают соединение формулы (2) (R8 = Н) в следующем стереометрическом соотношении (4S,5S)-2 (выход 74%), (4S,5R)-2 (выход 6%), (4R)-2 (выход 20%) согласно GC-анализу. Пример 53. Синтез соединения формулы (2) (R8 = Н) путем получения имина соединения (4 а) и(4S)-4 (4,34 г) в безводном THF (13 мл) и смесь оставляют перемешиваться в течение 40 ч при комнатной температуре. Реакционную смесь медленно добавляют к энергично перемешиваемому раствору воды(2 мл) и триэтиламина (305 мг) в THF (100 мл) и через 0,75 ч реакционную смесь фильтруют. Летучие компоненты удаляют при пониженном давлении и при 30 С и полученный остаток растворяют в EtOAc(85 мл) с последующей азеотропной перегонкой остаточных количеств воды при пониженном давлении и при 30 С. Полученные остаток растворяют в МТВЕ (20 мл). Для гидрирования раствор МТВЕ (1 мл) помещают в реакционный сосуд и МТВЕ удаляют. Полученный остаток растворяют в THF (5 мл), затем добавляют сухой 5% Pd/C (200 мг). После подготовки раствора с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар) реакционную смесь подвергают гидрированию в течение ночи при 50 С и 25 бар H2 и получают соединение формулы (2) (R8 = Н) в следующем стереометрическом соотношении: (4S,5S)-2 (выход 72%), (4S,5R)-2 (выход 9,7%), (4R)-2 (выход 18,5%) согласно HPLC-анализу. Пример 54. Синтез соединения формулы (2) (R8 = H) путем получения имина соединения (4 а) и(R)метилбензиламина и последующего гидрирования с применением Pd/C в THF. Исходный раствор имина: раствор имина готовят путем медленного добавления(R)метилбензиламина (3,63 г) и Ti(OiPr)4 (9,38 г) к раствору (4S)-4 (13,02 г) в безводном THF (50 мл). Смесь оставляют перемешиваться при комнатной температуре и протекание реакции контролируют с помощью GC-анализа до тех пор, пока не произойдет полное превращение. 1,18 г этого раствора имина обрабатывают водой (20,6 мг) в течение 0,25 ч при 50 С и осадок удаляют фильтрованием при комнатной температуре. Прозрачный раствор THF разводят с помощью THF до общего объема, равного 5 мл, и после добавления сухого 5% Pd/C (200 мг) подготавливают для гидрирования с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар). Смесь подвергают гидрированию при 50 С и 25 бар H2 до полного превращения исходного материала и получают соединение формулы (2) (R8 = Н) в следующем стереометрическом соотношении: (4S,5S)-2 (выход 78%), (4S,5R)-2 (выход 9,5%), (4R)-2 А(выход 11,9%) согласно HPLC-анализу. Пример 55. Синтез соединения формулы (2) путем получения имина соединения (4 а) и(R)метилбензиламина и последующего гидрирования с применением Pd/C и LiH в качестве добавки 1,18 г раствора имина по примеру 54 помещают в реакционный сосуд и разводят безводным THF (3,3 г) в атмосфере N2. Затем добавляют LiH (8 мг) и сухой 5% Pd/C (200 мг) и после подготовки с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар) смесь подвергают гидрированию при 50 С и 25 бар H2 в течение 20 ч и получают согласно GC смесь соединений формулы (2): соединение (R8 = Н) (выход 23%) и соединение (R8 = (R)метилбензиламин) (выход 49%). Согласно HPLC-анализу оптическая чистота соединения формулы 2 (R8 = Н) была следующей: (4S,5S) (выход 90%), (4S,5R) (выход 4,8%), (4R) (выход 5,5%). Пример 56. Синтез соединения формулы (2) путем получения имина соединения (4 а) и(R)метилбензиламина и последующего гидрирования с применением Pd(OH)2/C 11,8 г раствор имина по примеру 54 помещают в реакционный сосуд, разводят безводным THF (33 г) и нагревают до 50 С. К полученному теплому раствору добавляют воду (200 мкл) и смесь перемешивают в течение 0,25 ч. Затем смесь охлаждают до комнатной температуры и образовавшийся осадок фильтруют. Из полученного прозрачного раствора 4,5 г помещают в реакционный сосуд, содержащий сухой 20% Pd(OH)2/C (75 мг). Реакционную смесь дегазируют с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар), гидрирование проводят при 50 С и 25 бар H2 в течение 38 ч и получают полное превращение согласно GC. СогласноHPLC-анализу стереоизомеры соединения формулы 2 (R8 = Н) получают в следующем соотношении:(4S,5S)-2 (выход 53%), (4S,5R)-2 (выход 22%), (4R)-2 (выход 24%). Пример 57. Крупномасштабный синтез соединения формулы (2) путем получения имина соединения (4 а) и(R)метилбензиламина и последующего гидрирования с применением Pd/C. 23,7 г раствор имина по примеру 54 помещают в реакционный сосуд, разводят THF (52 г) и нагревают до 50 С. К полученному теплому раствору добавляют насыщ. NaHCO3 (400 мкл) и смесь перемешивают в течение 0,25 ч. К гетерогенной смеси при энергичном перемешивании добавляют безводныйNa2SO4 (10 г) и активированный уголь (6,9 г) соответственно. Затем смесь охлаждают до комнатной температуры, реакционную смесь фильтруют под N2 и влажную лепешку промывают THF (48 мл). Полученный прозрачный раствор помещают в автоклав, содержащий сухой 5% Pd/C (4 г). Автоклав дегазируют с помощью 5 циклов N2 (3 бар) и 5 циклов H2 (25 бар), проводят гидрирование при 50 С и 25 бар H2 в течение 15 ч и получают полное превращение согласно GC. Продукт изолируют с помощью фильтрования катализатора и последующего удаления растворителя при пониженном давлении. Остаток обрабатывают 1 н. HCl (20 мл) и водой (50 мл) и водный слой экстрагируют гептаном (350 мл). Водный слой отделяют и рН увеличивают до 13 путем добавления при энергичном перемешивании 32%-ого NaOH (3 г) в присутствии МТВЕ (40 мл). Слой МТВЕ отделяют,затем проводят дополнительную экстракцию оставшегося водного слоя с помощью МТВЕ (40 мл). Объединенные слои МТВЕ высушивают над безводным Na2SO4, фильтруют, МТВЕ отгоняют и получают согласно GC-анализу соединение формулы (2) (R8 = Н), в следующем стереометрическом соотношении:(4S,5S)-2 (выход 82%), (4S,5R)-2 (выход 8,3%) и (4R)-2 (выход 10,2%). Пример 58. Получение соединения формулы 13, где X=NHR5 путем взаимодействия соединения формулы (2) В круглодонную колбу помещают соединение формулы (2) (R8 = Н) (8,8 г),3-амино-2,2-диметилпропанамид (7,08 г) и триэтиламин (3,50 г) и вязкую смесь перемешивают в колбе с обратным холодильником в присутствии МТВЕ с целью получения гомогенной смеси. При медленном нагревании до 65 С МТВЕ удаляют с помощью перегонки и оставшийся остаток оставляют перемешиваться в течение 20 ч при 65 С в присутствии 2-гидроксипиридина (1,94 г). После полного превращения соединения формулы 2 реакционную смесь растворяют в МТВЕ (71 мл) и слой МТВЕ экстрагируют с помощью 5%-ного NaCl в воде (271 мл). Объединенные водные слои промывают МТВЕ (371 мл) и объединенные слои МТВЕ (сумма 4 фракций) высушивают над безводным Na2SO4 и фильтруют, МТВЕ отгоняют при пониженном давлении и получают неочищенный продукт с выходом 10,29 г. Неочищенный продукт растворяют в МТВЕ (71 мл), затем экстрагируют 1 н. HCl (15 мл) и водой (215 мл). Объединенные водные слои промывают МТВЕ (71 мл), а объединенные МТВЕ слои промывают водой(214 мл). При охлаждении и энергичном перемешивании рН объединенных водных слоев доводят до рН 11 с помощью 32% NaOH в присутствии МТВЕ (71 мл), МТВЕ отделяют и оставшийся щелочной водный слой промывают МТВЕ (571 мл). Объединенные слои МТВЕ высушивают над безводным Na2SO4,фильтруют и удаляют МТВЕ при пониженном давлении, получая соединение формулы (13) в следующем стереометрическом соотношении, согласно HPLC: (4S,5S)-13 (выход 71%) и другие стереоизомеры формулы 13 (выход 29%). Пример 59. Очистка соединения формулы (13), полученного в примере 58, с помощью кристаллизации с фумаровой кислотой. Раствор соединения формулы (13), полученного в примере 58 (1,48 г), и фумаровой кислоты(155,4 мг) в EtOH (15 мл) нагревают до 40 С, в дальнейшем этанол удаляют с помощью перегонки при пониженном давлении до суммарной массы, равной 3,21 г. Сконцентрированный раствор этанола растворяют в CH3CN (37 мл) при 37 С. Раствор медленно охлаждают до комнатной температуры, вносят в него несколько кристаллов соли фумарата алискирена и смесь оставляют перемешиваться в течение 19 ч. Осажденную соль фумарата алискирена фильтруют, высушивают и получают продукт. Согласно данным 1 Н ЯМР соединение представляет собой чистое соединение, за исключением остатков следовых количеств ацетонитрила. Все полученные таким образом (S) чистые фумарата алискирена (2,8 г) имеют выход согласноHPLC 93%. Пример 60. Очистка соединения формулы (13), полученного в примере 59, путем двойной перекристаллизации. Фумарат ацетонитрилсодержащего продукта (7) (2,8 г), полученный при первой кристаллизации,растворяют в этаноле (40 мл) и общее количество снижают до 5,8 г путем частичной отгонки этанола. Концентрированный раствор этанол растворяют в CH3CN (80 мл). Раствор медленно охлаждают до комнатной температуры, вносят в него несколько кристаллов соли фумарата алискирена и смесь оставляют перемешиваться в течение 19 ч. Осажденную соль фумарата алискирена фильтруют, высушивают и получают продукт с выходом 2,4 г и стереометрической чистотой, равной 98,2% (4S,5S)-соли фумарата алискирена (выход 98,2%). Эту изолированную соль фумарата алискирена перерастворяют в этаноле и этанол частично отгоняют до общего количества остатка, равного 5,0 г. Полученный остаток растворяют в CH3CN (80 мл) и охлаждают до комнатной температуры. При комнатной температуре в раствор вносят несколько кристаллов соли фумарата алискирена и смесь оставляют перемешиваться в течение 5 ч. Осажденную соль фумарата алискирена фильтруют и высушивают и получают продукт с выходом 2,2 г и стереометрической чистотой согласно HPLC (4S,5S)-7 (выход 98,8%). Регистрируют 1 Н ЯМР-спектр изолированного продукта. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (2)R1 и R2 могут быть связаны друг с другом с образованием кольцевой структуры;R8 обозначает Н, необязательно замещенный C1-12 алкил, необязательно замещенный C1-12 алкиларил,необязательно замещенный C(O)C1-6 алкил, необязательно замещенный C(O)OC1-6 алкил, необязательно замещенный С(О)NHC1-6 алкил или необязательно замещенный С(О)N(C1-6 алкил)2; илиR8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждыйR9 независимо представляет собой Н, необязательно замещенный C1-12 алкил, необязательно замещенныйC1-12 алкиларил,включающий следующие стадии: а) взаимодействие соединения формулы (4) где каждый из R1, R2, R3 и R4 такой же, как описано выше для формулы (2),с соединением формулы (5) где R8 такой же, как описано выше для формулы (2),- 25023266 что приводит к образованию соединения формулы (7) где каждый из R1, R2, R3, R4, R8 такой же, как описано выше для формулы (2);b) взаимодействие соединения формулы (7) с восстанавливающим реагентом, что приводит к образованию соединения формулы (2), где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном. 2. Способ по п.1, в котором соединение формулы (7) не выделяют из реакционной смеси перед выполнением стадии b). 3. Способ по любому из пп.1, 2, в котором стадию b) проводят в присутствии катализатора. 4. Способ по п.3, в котором указанный катализатор представляет собой катализатор на основе переходного металла. 5. Способ по любому из пп.1-4, в котором стадию b) проводят в присутствии одной или нескольких добавок. 6. Способ по любому из пп.1-5, включающий взаимодействие соединения формулы (4) с соединением формулы (5) в присутствии восстанавливающего агента и катализатора. 7. Способ по п.6, в котором восстанавливающий агент выбирают из следующей группы: молекулярный водород или соединение - донор водорода, и в котором, если применяют молекулярный водород,то в присутствии переходного металла как катализатора, и если применяют соединение - донор водорода,то необязательно в присутствии катализатора. 8. Способ по п.6 или 7, в котором указанный катализатор представляет собой фермент. 9. Способ по п.8, в котором фермент представляет собой аминотрансферазу. 10. Способ по любому из пп.6-9, в котором соединение формулы (5) является также восстанавливающим агентом. 11. Способ получения соединения формулы (13)R1 и R2 могут быть связаны друг с другом с образованием кольцевой структуры;R8 обозначает Н, необязательно замещенный C1-12 алкил, необязательно замещенный C1-12 алкиларил,необязательно замещенный C(O)C1-6 алкил, необязательно замещенный C(O)OC1-6 алкил, необязательно замещенный C(O)NHC1-6 алкил или необязательно замещенный С(О)Н(C1-6 алкил)2; илиR8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждыйR9 независимо представляет собой Н, необязательно замещенный C1-12 алкил, необязательно замещенныйX обозначает NHR5 или OR6, где R5 представляет собой H2N-C(O)-C1-12 алкил и R6 представляет собой Н, или необязательно замещенный C1-12 алкил, необязательно замещенный C1-12 алкиларил,включающий следующие стадии: а) взаимодействие соединения формулы (11) где каждый из R1, R2, R3 и R4, R7 такой же, как описано выше для формулы (13),с соединением формулы (5) где R8 такой же, как описано выше для формулы (13),что приводит к образованию соединения формулы (12) где каждый из R1, R2, R3, R4, R7, R8 и X такой же, как описано выше для формулы (13);b) взаимодействие соединения формулы (12) с восстанавливающим реагентом, что приводит к образованию соединения формулы (13), где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном. 12. Способ по п.11, в котором X в соединении формулы (11), и также в получаемом соединении формулы (12), если оно образуется, и в соединении формулы (13) соответственно обозначает OR6, где R6 такой же, как описан в п.11. 13. Способ по п.11, в котором X в соединении формулы (11), и также в получаемом соединении формулы (12), если оно образуется, и в соединении формулы (13) соответственно обозначает NHR5, гдеR5 такой же, как описан в п.11. 14. Способ по любому из пп.11-13, включающий взаимодействие соединения формулы (11) с соединением формулы (5) в присутствии восстанавливающего агента и катализатора. 15. Способ по п.14, в котором восстанавливающий агент выбирают из следующей группы: молекулярный водород или соединение - донор водорода; и в котором, если применяют молекулярный водород,то в присутствии переходного металла как катализатора, и если применяют соединение - донор водорода,то необязательно в присутствии катализатора. 16. Способ по п.14 или 15, в котором указанный катализатор представляет собой фермент. 17. Способ по п.16, в котором фермент представляет собой аминотрансферазу. 18. Способ по любому из пп.1-10, в котором соединение формулы (2) дополнительно вступает в реакцию с 3-амино-2,2-диметилпропанамидом с получением соединения формулы (13), где X=NHR5,R5 представляет собой 2-карбамоил-2-метилпропил, или его фармацевтически приемлемых солей. 19. Способ по п.18, в котором соединение формулы (13) подвергают депротектированию с получением 2(S),4(S),5(S),7(S)-N-(2-карбамоил-2-метилпропил)-5-амино-4-гидрокси-2,7-диизопропил-8-[4 метокси-3-(3-метоксипропокси)фенил]октанамида или любой его фармацевтически приемлемой соли. 20. Соединение формулы (11)R8 обозначает Н, необязательно замещенный C1-12 алкил, необязательно замещенный C1-12 алкиларил,необязательно замещенный С(О)C1-6 алкил, необязательно замещенный C(O)OC1-6 алкил, необязательно замещенный С(О)NHC1-6 алкил или необязательно замещенный C(O)N(C1-6 алкил)2; илиR8 обозначает (R9)2Y, где Y представляет собой анион, выбранный из ацетата или галогена; каждыйR9 независимо представляет собой Н, необязательно замещенный C1-12 алкил, необязательно замещенныйC1-12 алкиларил, где термин "необязательно замещенный" означает, что любой водород, присутствующий в описании, R8, R9 может быть замещен углеводородом или галогеном.
МПК / Метки
МПК: C07D 307/33, C07C 235/02
Метки: 2(s),4(s),5(s),7(s)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил, амидов, способы, синтеза
Код ссылки
<a href="https://eas.patents.su/29-23266-sposoby-sinteza-2s4s5s7s-27-dialkil-4-gidroksi-5-amino-8-ariloktanoil-amidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы синтеза 2(s),4(s),5(s),7(s)-2,7-диалкил-4-гидрокси-5-амино-8-арилоктаноил амидов</a>
Предыдущий патент: Полимерные микросферы в качестве разрушаемых фильтрационных добавок в нефтепромысловых применениях
Следующий патент: Способ для лечения и/или предотвращения мигрени
Случайный патент: Амилин и агонисты амилина для лечения психиатрических заболеваний и расстройств












