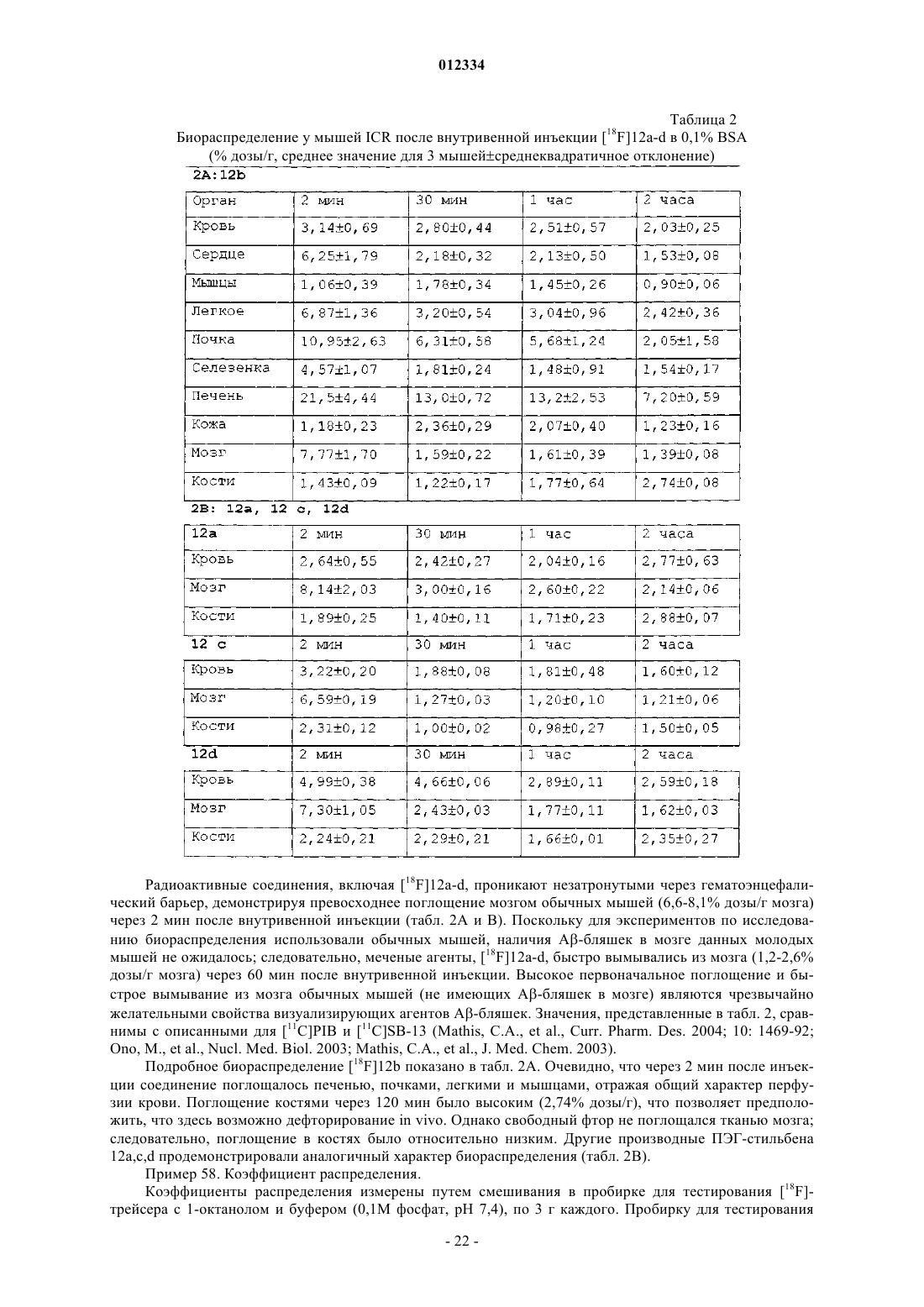
Производные стильбена и их применение для связывания и визуализации амилоидных бляшек
Формула / Реферат
1. Соединение формулы I
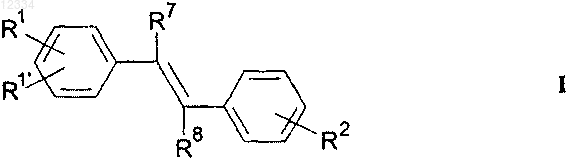
или его фармацевтически приемлемая соль или пролекарство, где
R1 выбирают из группы, состоящей из:
a. NRaRb, где Ra и Rb независимо представляют собой водород, C1-4алкил, (CH2)d18F и d представляет собой целое число от 1 до 4,
b. гидрокси,
c. С1-4алкокси,
d. гидрокси(С1-4)алкила,
e. галогена,
f. циано,
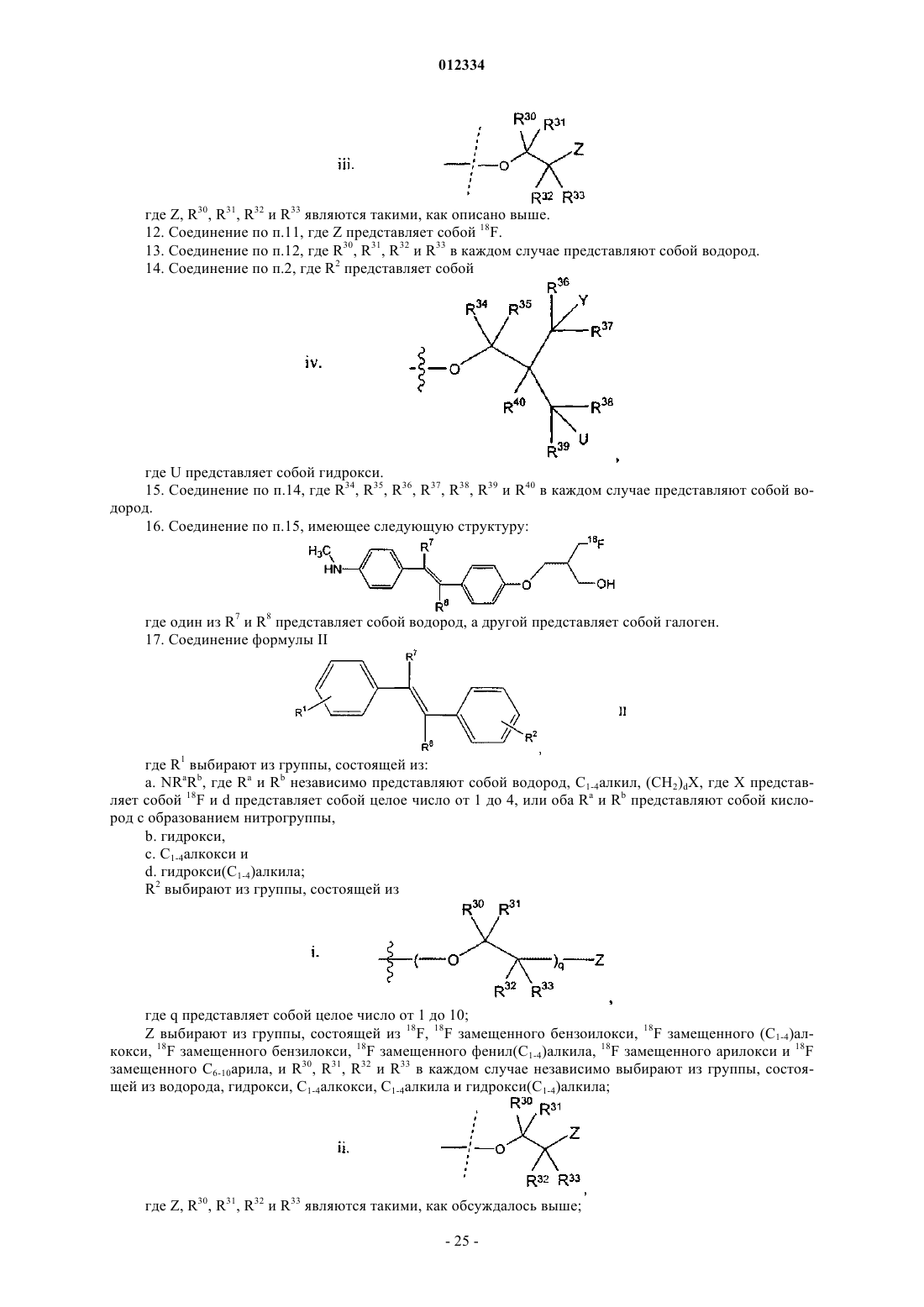
g. водорода,
h. нитро,
i. (C1-C4)алкила,
j. галоген(С1-С4)алкила и
k. формила;
R1' выбирают из группы, состоящей из:
a. 123I, 125I, 131I, 18F, 76Br,
b. водорода,
c. 18F(C1-4)алкила,
d. [18F(C1-4)алкил]амино,
е. [18F(C1-C4)алкил]алкиламино,
f. 18F(C1-C4)алкокси;
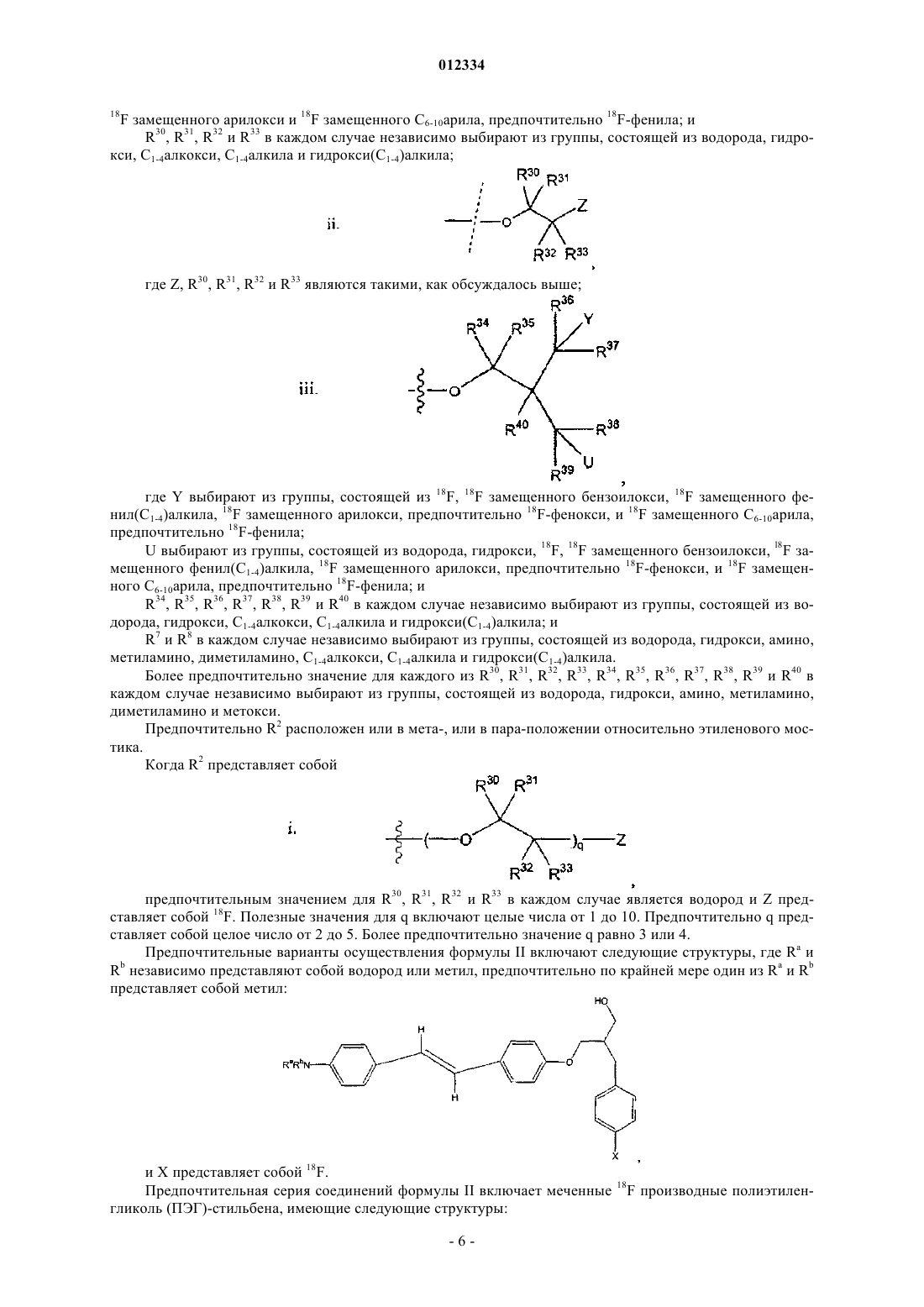
R2 выбирают из группы, состоящей из:
i. гидроксила, С1-4алкокси, (C1-C4)алкилоксоалк(C1-C4)окси, (С1-С4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкокси, (C1-C4)алкилоксо(C1-С4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкокси, карбокси(C1-C4)алкила, галоген(C1-C4)алкокси, галоген(C1-C4)алкилоксо(C1-C4)алкокси, галоген(C1-C4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкилокси, галоген(C1-С4)алкилоксо(С1-С4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкилокси, галоген(C1-C4)алкила, NR6R6', фенил(C1-C4)алкила, 18F(C1-C4)алкокси, 18F(С1-С4)алкилоксо(C1-C4)алкокси, 18F(C1-C4)алкилоксо(С1-С4)алкилоксо(C1-C4)алкилокси, 18F(С1-С4)алкилоксо(C1-C4)алкилоксо(C1-С4)алкилоксо(C1-C4)алкилокси, 18F(C1-C4)алкила,
где R6 и R6' независимо выбирают из группы, состоящей из водорода, гидрокси(C1-C4)алкила и С1-С4алкила;
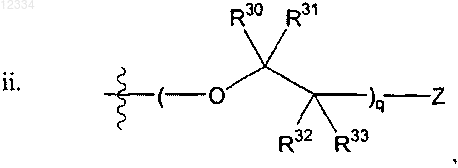
где q представляет собой целое число от 1 до 10;
Z выбирают из группы, состоящей из 18F, 18F замещенного бензоилокси, 18F замещенного (C1-4)алкокси, 18F замещенного бензилокси, необязательно 18F-фенокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси и 18F замещенного С6-10арила, необязательно 18F-фенила; и
R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила;
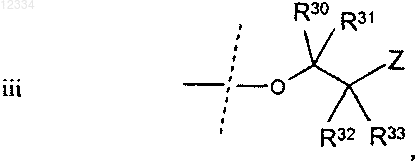
где Z, R30, R31, R32 и R33 являются такими, как описано выше;
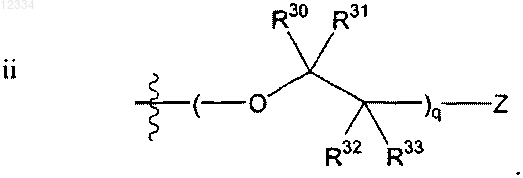
где Y выбирают из группы, состоящей из 18F, 18F замещенного бензоилокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси, необязательно 18F-фенокси и 18F замещенного С6-10арила, необязательно 18F-фенила;
U выбирают из группы, состоящей из водорода, гидрокси, 18F, 18F замещенного бензоилокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси, необязательно 18F-фенокси и 18F замещенного С6-10арила, необязательно F-фенила; и
R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила; и
R7 и R8 в каждом случае независимо выбирают из группы, состоящей из галогена, водорода, гидрокси, амино, метиламино, диметиламино, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила, где по крайней мере один из R7 и R8 представляет собой галоген;
где термин "арилокси" относится к моноциклической или бициклической ароматической группе, содержащей от 6 до 12 углеродов в кольцевой части, соединенной с атомом кислорода.
2. Соединение по п.1, где R' представляет собой водород и R1 представляет собой NRaRb, где Ra и Rb независимо представляют собой водород или C1-4алкил.
3. Соединение по п.1, где R7 и R8 представляют собой водород или фтор, где по крайней мере один из R7 и R8 представляет собой фтор.
4. Соединение по п.2, где R2 представляет собой
где Z, R30, R31, R32 и R33 являются такими, как описано выше.
5. Соединение по п.4, где q представляет собой целое число от 2 до 5.
6. Соединение по п.5, где R30, R31, R32 и R33 представляют собой в каждом случае водород.
7. Соединение по п.4, где q представляет собой целое число от 3 до 4.
8. Соединение по п.7, где Z представляет собой 18F.
9. Соединение по п.8, имеющее следующую формулу:
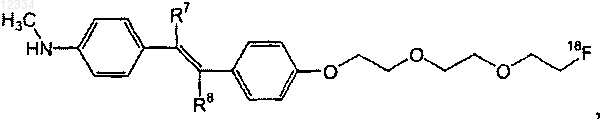
где один из R7 и R8 представляет собой водород, а другой представляет собой галоген.
10. Соединение по п.8, имеющее следующую формулу:
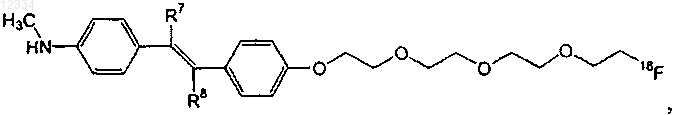
где один из R7 и R8 представляет собой водород, а другой представляет собой галоген.
11. Соединение по п.2, где R2 представляет собой
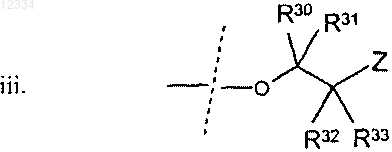
где Z, R30, R31, R32 и R33 являются такими, как описано выше.
12. Соединение по п.11, где Z представляет собой 18F.
13. Соединение по п.12, где R30, R31, R32 и R33 в каждом случае представляют собой водород.
14. Соединение по п.2, где R2 представляет собой
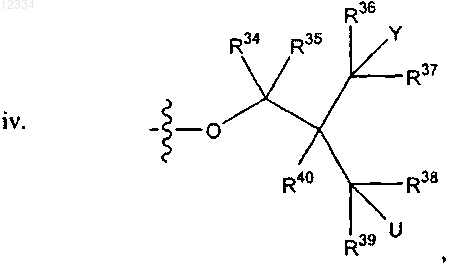
где U представляет собой гидрокси.
15. Соединение по п.14, где R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой водород.
16. Соединение по п.15, имеющее следующую структуру:
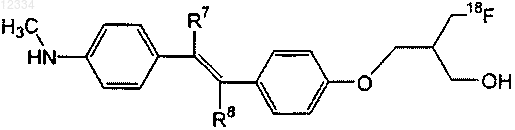
где один из R7 и R8 представляет собой водород, а другой представляет собой галоген.
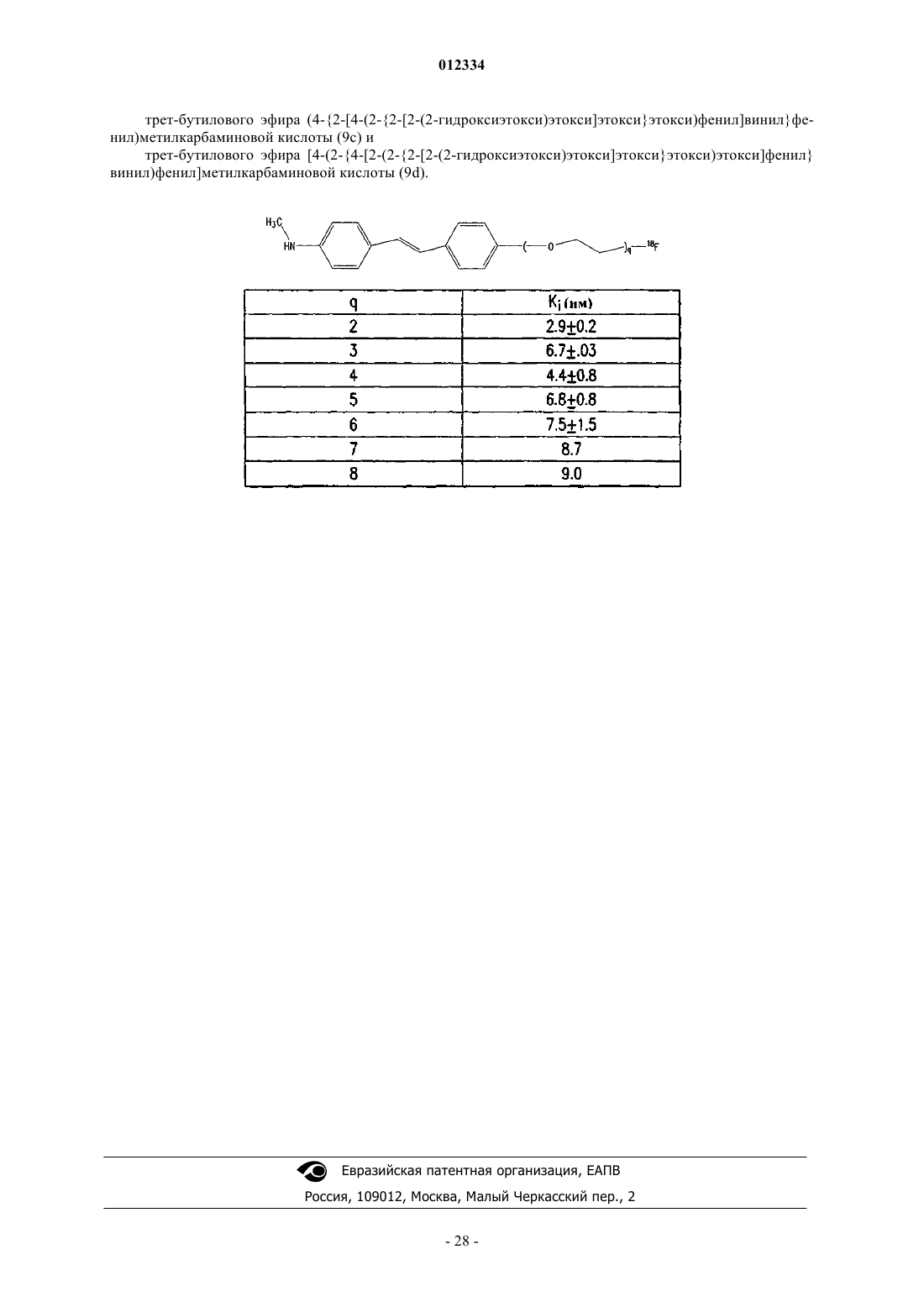
17. Соединение формулы II
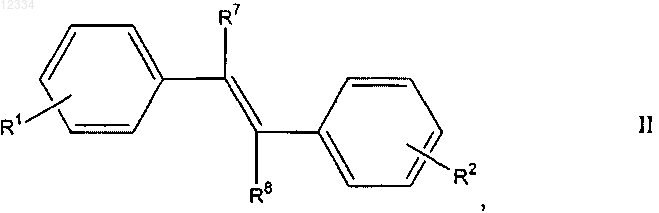
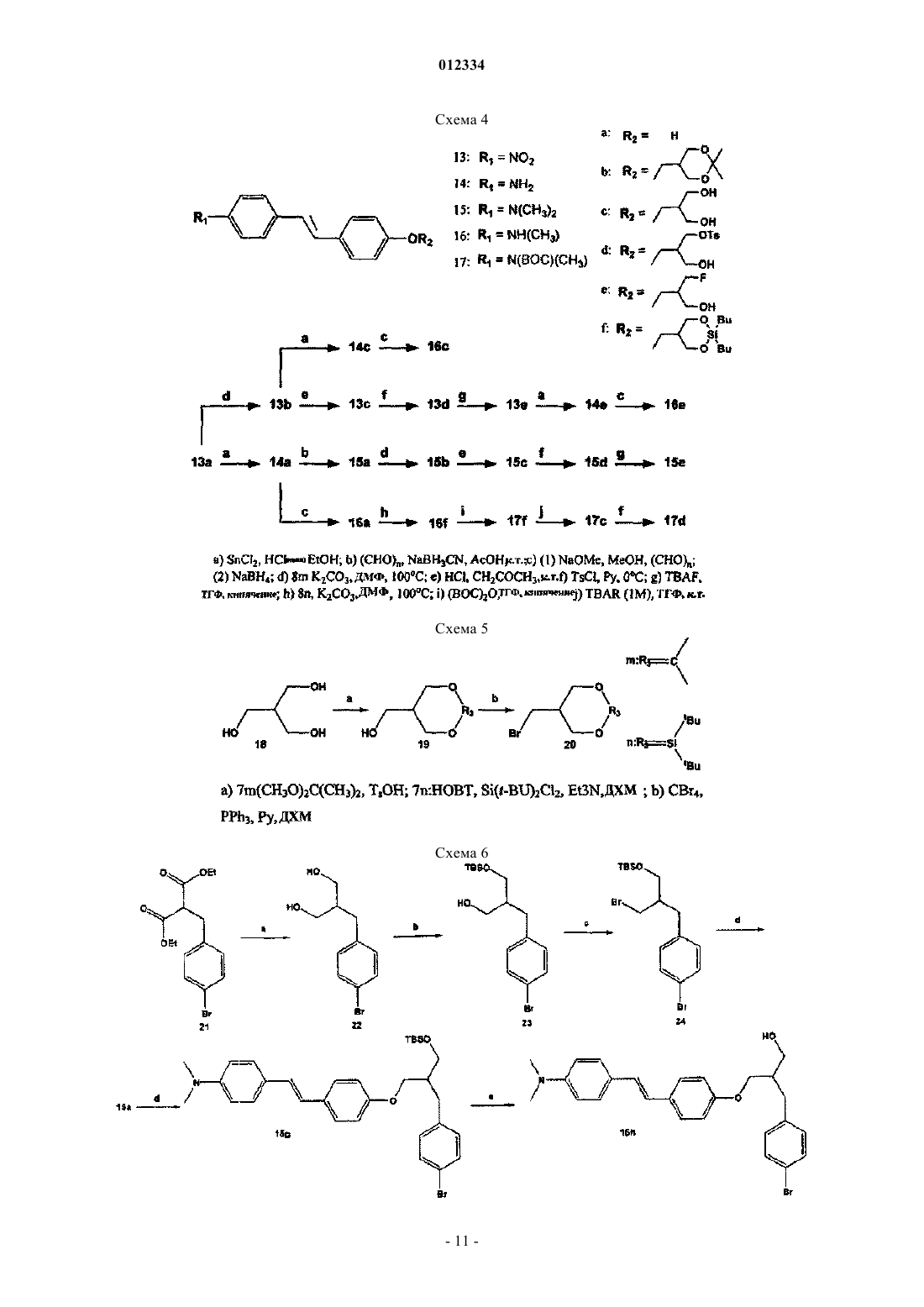
где R1 выбирают из группы, состоящей из:
a. NRaRb, где Ra и Rb независшью представляют собой водород, C1-4алкил, (CH2)dX, где X представляет собой 18F и d представляет собой целое число от 1 до 4, или оба Ra и Rb представляют собой кислород с образованием нитрогруппы,
b. гидрокси,
c. C1-4алкокси и
d. гидрокси(С1-4)алкила;
R2 выбирают из группы, состоящей из
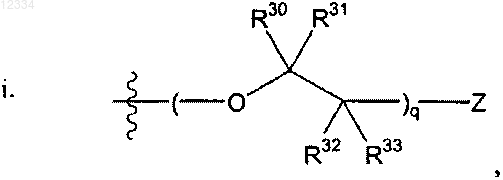
где q представляет собой целое число от 1 до 10;
Z выбирают из группы, состоящей из 18F, 18F замещенного бензоилокси, 18F замещенного (C1-4)алкокси, 18F замещенного бензилокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси и 18F замещенного С6-10арила, и R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила;
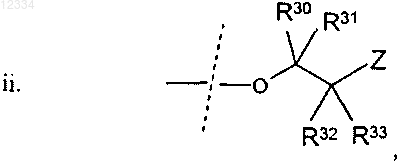
где Z, R30, R31, R32 и R33 являются такими, как обсуждалось выше;

где Y выбирают из группы, состоящей из 18F, 18F замещенного бензоилокси, 18F замещенного фенил(С1-4)алкила, 18F замещенного арилокси и F замещенного С6-10арила;
U выбирают из группы, состоящей из водорода, гидрокси, 18F, 18F замещенного бензоилокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси и F замещенного С6-10арила; и
R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4алкокси, C1-4алкила и гидрокси(С1-4)алкила; и
R7 и R8 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино, метиламино, диметиламино, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила;
где термин "арилокси" относится к моноциклической или бициклической ароматической группе, содержащей от 6 до 12 углеродов в кольцевой части, соединенной с атомом кислорода.
18. Соединение по п.17, где R1 представляет собой NRaRb, где Ra и Rb независимо представляют собой водород или C1-4алкил.
19. Соединение по п.18, где R2 представляет собой
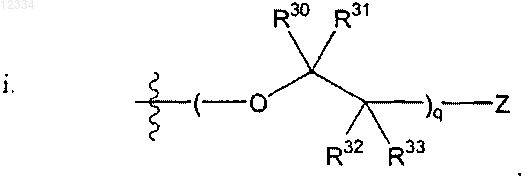
где Z, R30, R31, R32 и R33 являются такими, как описано выше.
20. Соединение по п.19, где q представляет собой целое число от 2 до 5.
21. Соединение по п.19, где каждый из R7 и R8 представляет собой водород.
22. Соединение по п.21, где R30, R31, R32 и R33 представляют собой в каждом случае водород.
23. Соединение по п.22, имеющее следующую формулу:
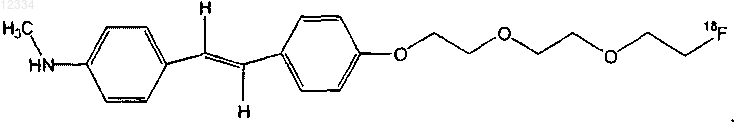
24. Соединение по п.22, имеющее следующую формулу:
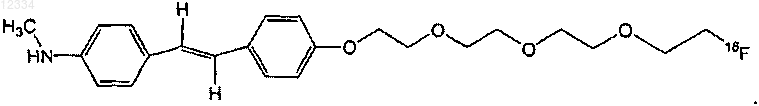
25. Соединение по п.18, где R2 представляет собой

где Z, R30, R31, R32 и R33 являются такими, как описано выше.
26. Соединение по п.25, где Z представляет собой 18F.
27. Соединение по п.26, где каждый из R7 и R8 представляет собой водород.
28. Соединение по п.27, где R30, R31, R32 и R33 представляют собой в каждом случае водород.
29. Соединение по п.18, где R представляет собой
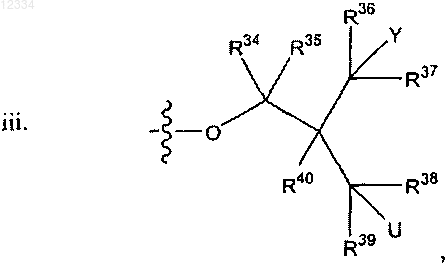
где U представляет собой гидрокси.
30. Соединение по п.29, где R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой водород.
31. Соединение по п.30, имеющее следующую структуру:
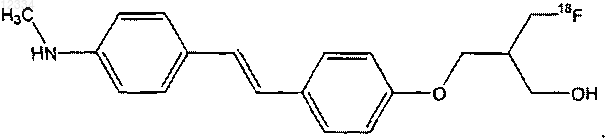
32. Соединение формулы III
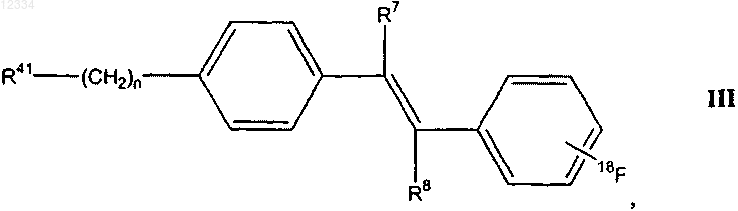
где n представляет собой целое число между 1 и 4;
R7 и R8 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино, метиламино, диметиламино, C1-4алкокси, C1-4алкила и гидрокси(C1-4)алкила; и
R41 выбирают из группы, состоящей из гидрокси и NRaRb, где Ra и Rb независимо представляют собой водород, С1-4алкил или оба Ra и Rb представляют собой кислород с образованием нитрогруппы.
33. Соединение по п.32, где n равно 1 и R41 выбирают из группы, состоящей из гидрокси, метиламмино и диметиламино.
34. Фармацевтическая композиция, содержащая соединение по пп.1, 17 или 32.
35. Диагностическая композиция для визуализации амилоидных отложений, содержащая радиоактивно меченое соединение по пп.1, 17 или 32.
36. Способ визуализации изображения амилоидных отложений, включающий:
a. введение млекопитающему обнаруживаемого количества диагностической композиции по п.35;
b. предоставление времени, достаточного для связывания меченого соединения с амилоидными отложениями; и
c. обнаружение меченого соединения, связанного с одним или несколькими амилоидными отложениями.
37. Способ ингибирования агрегации амилоидных бляшек у млекопитающего, включающий введение композиции по п.34 в количестве, достаточном для ингибирования агрегации амилоидных бляшек.
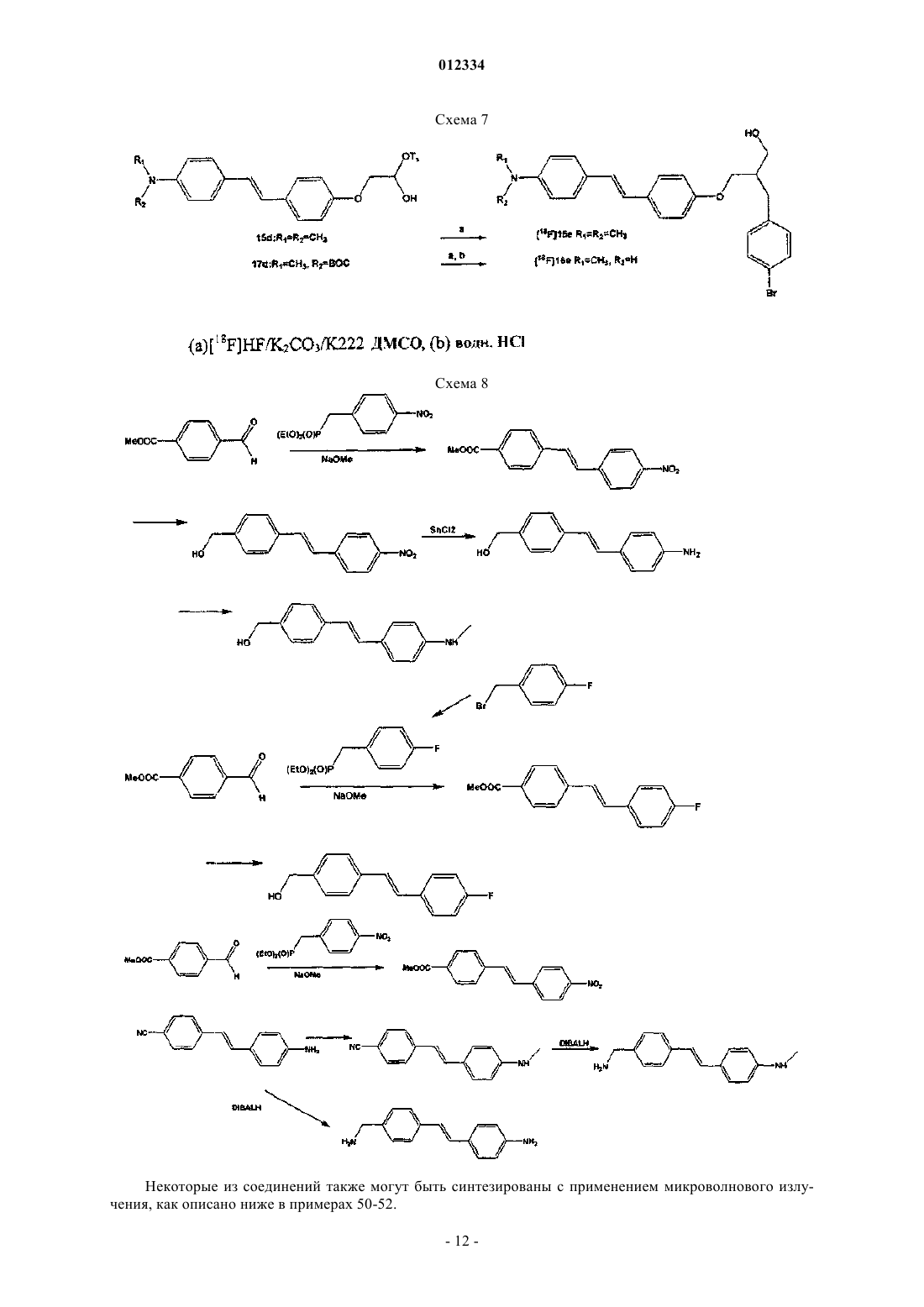
38. Соединение, выбранное из группы, состоящей из
2-[2-(4-{2-[4-(трет-бутоксикарбонилметиламино)фенил]винил}фенокси)этокси]этилового эфира метансульфоновой кислоты (10а);
2-{2-[2-(4-{2-[4-(трет-бутоксикарбонилметиламино)фенил]винил}фенокси)этокси]этокси}этилового эфира метансульфоновой кислоты (10b);
2-(2-{2-[2-(4-{2-[4-(трет-бутоксикарбонилметиламино)фенил]винил}фенокси)этокси]этокси}этокси)
этилового эфира метансульфоновой кислоты (10с) и
2-[2-(2-{2-[2-(4-{2-[4-(трет-бутоксикарбонилметиламино)фенил]винил}фенокси)этокси]этокси}этокси)
этокси]этилового эфира метансульфоновой кислоты (10d).
39. Способ получения соединения формулы [18F]12

где n=2, 3, 4 или 5,
включающий взаимодействие соединения формулы 10
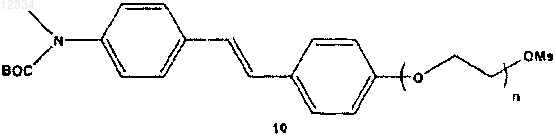
с [18F]F-/Kryptofix 222 ("K222") и K2CO3 в ДМСО и обработку полученной смеси водной HCl.
40. Набор для получения визуализирующих агентов, содержащий пузырек, где пузырек содержит физиологически подходящий раствор промежуточного соединения формулы I в концентрации и при значении рН, подходящих для оптимальных условий комплексообразования.
41. Соединение, выбранное из группы, состоящей из
трет-бутилового эфира [4-(2-{4-[2-(2-гидроксиэтокси)этокси]фенил}винил)фенил]метилкарбаминовой кислоты (9а);
трет-бутилового эфира {4-[2-(4-{2-[2-(2-гидроксиэтокси)этокси]этокси}фенил)винил]фенил}метилкарбаминовой кислоты (9b);
трет-бутилового эфира (4-{2-[4-(2-{2-[2-(2-гидроксиэтокси)этокси]этокси}этокси)фенил]винил}фенил)метилкарбаминовой кислоты (9с) и
трет-бутилового эфира [4-(2-{4-[2-(2-{2-[2-(2-гидроксиэтокси)этокси]этокси}этокси)этокси]фенил}
винил)фенил]метилкарбаминовой кислоты (9d).
Текст
012334 Предпосылки создания изобретения Область изобретения Данное изобретение относится к новым биоактивным соединениям, способам диагностической визуализации с использованием радиоактивно меченых соединений и к способам получения радиоактивно меченых соединений. Предшествующий уровень развития данной области Болезнь Альцгеймера (AD) представляет собой прогрессирующее нейродегенеративное нарушение,характеризуемое ухудшением познавательных способностей, необратимой потерей памяти, нарушением ориентации и ухудшением речи. Посмертное исследование отделов мозга больных AD выявляет имеющиеся в изобилии старческие бляшки, состоящие из (SPs) амилоид- (А) пептидов, и многочисленные нейрофибриллярные клубки (NFTs), образованные волокнами высокофосфорилированных тау-белковDisease, Lippincot, WilliamsWilkins, Philadelphia, PA (1999), pp. 359-372). Амилоидозиз представляет собой состояние, характеризуемое накоплением различных нерастворимых фибриллярных белков в тканях пациента. Амилоидное отложение образуется при агрегации амилоидных белков с последующим дополнительным объединением агрегатов и/или амилоидных белков. Образование и накопление агрегатов -амилоидных (А) пептидов в мозгу являются решающими факторами развития и прогрессирования AD. Помимо роли амилоидных отложений в болезни Альцгеймера было показано присутствие амилоидных отложений при таких заболеваниях, как средиземноморская лихорадка, синдром Макль-Велла,идиопатическая миелома, амилоидная полиневропатия, амилоидная кардиомиопатия, системный старческий амилоидоз, амилоидная полиневропатия, наследственное церебральное кровоизлияние с амилоидозом, синдром Дауна, Скрапье, болезнь Крейтцфельда-Якоба, Куру, синдром Герстамна-ШтрауслераШайнкера, медуллярный рак щитовидной железы, изолированный амилоид предсердия, 2-микроглобулиновый амилоид у пациентов при диализе, миозиты тел включения, 2-амилоидные отложения при изнурительных мышечных заболеваниях и инсулинома островков Лангерганса при диабете типа II. Фибриллярные агрегаты амилоидных пептидов, A1-40 и A1-42, представляют собой основные метаболические пептиды, образующиеся из амилоидного белка-предшественника, выявленного в старческих бляшках и церебрально-васкулярных амилоидных отложениях у пациентов с AD (Xia, W., et al., J. Proc.Natl. Acad. Sci. U.S.A. 97: 9299-9304 (2000. Предотвращение и инверсия образования А-бляшек являются целью лечения данного заболевания (Selkoe, D., J. JAMA 283: 1615-1617 (2000); Wolfe, M.S., et al., J.Med. Chem. 41: 6-9 (1998); Skovronsky, D.M., and Lee, V.M., Trends Pharmacol. Sci. 27: 161-163 (2000. Наследственная AD (FAD) вызвана множественными мутациями генов белка-предшественника Аand Function of Cerebral Cortex, Kluwer Academic/Plenum, NY (1999), pp. 603-654; Vogelsberg-Ragaglia, V.,et al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease", Alzheimer's Disease, Lippincot,WilliamsWilkins, Philadelphia, PA (1999), pp. 359-372). Хотя точный механизм, лежащий в основе AD, не понятен полностью, все до сих пор изученные патогенные мутации увеличивают продуцирование более амилоидогенной 42-43 аминокислотной длинной формы пептида А. Таким образом, по крайней мере, в случае FAD разрегулирование продуцирования А оказывается достаточным, чтобы вызывать каскад случаев, приводящих к нейродегенерации. Действительно, гипотеза амилоидного каскада предполагает, что образование межклеточных фибриллярных А-агрегатов в мозге может быть центральной причиной патогенеза AD (Selkoe, D.J., "Biology ofBiophysica Acta 7502: 172-187 (2000. Различные подходы попытки ингибирования продуцирования и уменьшения накопления фибриллярного А в мозге в настоящее время оцениваются как потенциальное лечение AD (Skovronsky, D.M.Findeis, M.A., Biochimica et Biophysica Acta 1502: 76-84 (2000); Kuner, P., Bohrmann, et al., J. Biol. Chem. 275: 1673-1678 (2000. Поэтому представляет интерес создание лигандов, которые специфически связывают фибриллярные А-агрегаты. Поскольку межклеточные SPs представляют собой доступные мишени, данные новые лиганды могли бы использоваться в качестве in vivo диагностических инструментов и в качестве зондов для визуализации прогрессирующих отложений А при исследовании амилоидогенеза-1 012334 С этой целью сообщалось о разработке нескольких интересных подходов к созданию лигандов,специфических по отношению к фибриллярным А-агрегатам (Ashburn, Т.Т., et al., Chem. Biol. 3: 351-358Abstract 23: 1638 (1997); Mathis, C.A., et al., Proc. XIIth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997); Lorenzo, A. and Yankner, B.A., Proc. Natl. Acad. Sci. U.S.A. 97: 12243-12247 (1994); Zhen, W.,et al., J. Med. Chem. 42: 2805-2815 (1999. Наиболее привлекательный подход основан на высококонъюгированных крисамине-G (CG) и конго красном (CR), где последний используется для флуоресцентного окрашивания SPs и NFTs в отделах мозга больных AD после смерти (Ashburn, Т.Т., et al., Chem. Biol. 3: 351-358 (1996); Klunk, W.E., et al., J. Histochem. Cytochem. 37: 1273-1281 (1989. Константы ингибированияChem., Uppsala, Sweden: 94-95 (1997. Было показано, что данные соединения связываются селективно с агрегатами А (1-40) пептида in vitro, а также с фибриллярными отложениями А в отделах мозга больных AD (Mathis, С.A., et al., Proc. XIIth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997. Имеется несколько потенциальных преимуществ визуализации агрегатов А в мозге. Метод визуализации будет улучшать диагностику за счет идентификации потенциальных пациентов с избыточным количеством бляшек А в мозге; следовательно, у них, вероятно, может развиться болезнь Альцгеймера. Также будет полезно контролирование прогрессирования заболевания. Когда станет доступным лекарственное лечение против бляшек, визуализация бляшек А в мозге может обеспечить необходимый инструмент для обнаружения и количественной оценки амилоидных отложений у пациента для контролирования процесса лечения. Таким образом, простой неинвазивный способ обнаружения и количественной оценки амилоидных отложений у пациента стал чрезвычайно желательным. В настоящее время обнаружение амилоидных отложений включает гистологический анализ биопсийных и аутопсийных материалов. Оба метода обладают недостатками. Например, аутопсию можно использовать только для посмертной диагностики. Непосредственная визуализация изображения амилоидных отложений in vivo затруднительна, поскольку отложения обладают множеством тех же самых физических свойств (например, плотность и содержание воды), что и обычные ткани. Попытки визуализировать амилоидные отложения с использованием магнитно-резонансной визуализации (MRI) и компьютерной томографии (CAT) не оправдали ожиданий и обнаруживали амилоидные отложения только при определенных благоприятных условиях. Кроме того, попытки введения метки в амилоидные отложения с использованием антител, амилоидного белка Р сыворотки крови или других молекул-зондов обеспечивали некоторую селективность на периферии тканей, но оказались слабо визуализирующими внутреннюю часть тканей. Потенциальные лиганды для обнаружения агрегатов А в мозге живого организма должны пересекать гематоэнцефалический барьер в неповрежденном виде. Такое поглощение мозгом можно улучшить при использовании лигандов с относительно небольшим молекулярным размером (по сравнению с конго красным) и повышенной липофильностью. Высококонъюгированные тиофлавины S и Т) обычно используют в качестве красителей для окрашивания агрегатов А в мозге больных AD (Elhaddaoui, A., etal., Biospectroscopy 7: 351-356 (1995. Сообщалось о высоколипофильном трейсере [18F]FDDNP для связывания как клубков (состоящих,главным образом, из гиперфосфорилированного тау-белка), так и бляшек (содержащих агрегаты белка А) (Shoghi-Jadid K., et al., Am. J. Geriatr. Psychiatry 2002; 10: 24-35). С использованием позитрон-эмиссионной томографии (PET), показано, что данный трейсер специфически помечал отложения бляшек и клубков у 9 пациентов, страдающих AD, 7 субъектов, использованных для сравнения (Nordberg, A., LancetNeurol. 2004; 3: 519-27). С помощью нового способа фармакокинетического анализа, называемого относительное время нахождения в представляющей интерес области мозга относительно мостов, была продемонстрирована разница между пациентами, страдающими AD, и субъектами, использованными для сравнения. Относительное время нахождения было существенно выше у пациентов с AD. Это дополнительно осложняется интересным обнаруженным фактом, касающимся того, что FDDNP конкурирует с некоторыми НСПВС при связывании с фибриллами А in vitro и бляшками А ex vivo (Agdeppa, E.D., etal., 2001; Agdeppa, E.D., et al., Neuroscience 2003; 117: 723-30). Недавно сообщалось о визуализации -амилоида в мозге больных AD пациентов с использованием бензотиазоланилинового производного [11 С]О-ОН-ВТА-1 (также упоминается как [11C]PIB) (Mathis, C.A.,et al., Curr. Pharm. Des. 2004; 10: 1469-92; Mathis, C.A., et al., Arch. Neurol. 2005, 62: 196-200). В противоположность наблюдаемому для [18F]FDDNP, [11 С]О-ОН-ВТА-1 специфически связывается с фибриллярными А in vivo. Для пациентов с диагностированной мягкой AD было продемонстрировано заметное удерживание [11 С]О-ОН-ВТА-1 в коре головного мозга, в которой, как известно, содержатся большие количества амилоидных отложений при AD. В группе пациентов, страдающих AD, удерживание [11 С]ООН-ВТА-1 увеличивалось наиболее заметно в лобной коре головного мозга. Большое увеличение также наблюдалось в теменной, височной и затылочной областях коры и в стриатуме. Удерживание [11 С]О-ОН-2 012334 ВТА-1 было эквивалентным у больных AD и субъектов, использованных для сравнения, в тех областях,которые, как известно, являются относительно непораженными амилоидными отложениями (такие, как подкорковое белое вещество, мост и мозжечок). Недавно был исследован другой 11 С-меченный направленный зонд для А-бляшек - производное стильбена [11C]SB-13. Связывание in vitro с использованием[11C]SB-13 позволяет предположить, что соединение проявляет превосходную аффинность связывания и связывание может быть точно измерено в сером веществе коры головного мозга, но не в белом веществе при заболеваниях AD (Kung, М.-Р., et al., Brain Res. 2004; 1025: 98-105). Имеется очень низкое специфическое связывание в гомогенатах тканей коры головного мозга для контрольных образцов мозга. Величины Kd для [11C]SB-13 в гомогенатах коры головного мозга при AD составляли 2,40,2 нМ. Наблюдались высокая способность связывания и сравнительные значения (14-45 пмоль/мг белка) (Id.). Как ожидалось, у пациентов с AD для [11C]SB-13 проявлялось высокое накопление в лобной коре головного мозга (по-видимому, в области, содержащей высокую плотность бляшек А) у пациентов при мягкой до средней AD, но не в случае подходящих по возрасту субъектов (Verhoeff, N.P., et al., Am. J. Geriatr.Psychiatry 2004; 12: 584-95). Было бы полезно иметь неинвазивные методы визуализации и количественной оценки амилоидных отложений у пациента. Кроме того, было бы полезно иметь соединения, которые ингибируют агрегацию амилоидных белков с образованием амилоидных отложений и способ определения способности соединений ингибировать агрегацию амилоидного белка. Краткое изложение сущности изобретения Настоящее изобретение относится к новым соединениям формул I, II и III. Настоящее изобретение также относится к новым диагностическим композициям, содержащим радиоактивно меченые соединения формул I, II и III и фармацевтически приемлемый носитель или разбавитель. Изобретение, кроме того, относится к способу визуализации изображения амилоидных отложений,где способ включает введение пациенту обнаруживаемого количества меченого соединения формул I, II и III или их фармацевтически приемлемой соли, сложного эфира, амида или пролекарства. Настоящее изобретение также относится к способу ингибирования агрегации амилоидных белков,способ включает введение млекопитающему ингибирующего амилоид количества соединения формул I,II и III или его фармацевтически приемлемой соли, сложного эфира, амида или пролекарства. Следующий аспект данного изобретения относится к способам и промежуточным соединениям, используемым для синтеза описанных здесь соединений формул I, II и III, ингибирующих и визуализирующих амилоид. Краткое описание фигур На прилагаемой фигуре представлены данные связывания Ki для нескольких соединений по настоящему изобретению. Подробное описание изобретения В первом аспекте настоящее изобретение относится к соединениям формулы I или их фармацевтически приемлемым солям или пролекарствам, гдеa. NRaRb, где Ra и Rb независимо представляют собой водород, C1-4 алкил, (CH2)d18F и d представляет собой целое число от 1 до 4,b. гидрокси,c. С 1-4 алкокси,d. гидрокси(C1-4)алкила,e. галогена,f. циано,g. водорода,h. нитро,i. (C1-C4)алкила,j. галоген(C1-C4)алкила и(C1-C4)алкила, NR6R6', фенил(C1-C4)алкила, 18F(C1-C4) алкокси, 18F(C1-C4)алкилоксо(C1-C4)алкокси, 18F(C1C4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкилокси, 18F(C1-C4)алкилоксо(C1-C4)алкилоксо(C1-C4)алкилоксо(C1C4)алкилокси, 18F(C1-C4)алкила; где R6 и R6' независимо выбирают из группы, состоящей из водорода, гидрокси(C1-C4)алкила и C1C4 алкила; где q представляет собой целое число от 1 до 10;R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила;R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила; иR7 и R8 в каждом случае независимо выбирают из группы, состоящей из галогена, например F, Cl,Br, водорода, гидрокси, амино, метиламино, диметиламино, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила, где по крайней мере один из R7 и R8 представляет собой галоген, предпочтительно F. В предпочтительном варианте осуществленияR1 независимо выбирают из группы, состоящей из водорода, галогена, например F, Cl, Br, C1-C4 алкила, циано, гидроксила, нитро, (C1-C4)алкиламино, ди(C1-C4)алкиламино, галоген(C1-C4)алкила, формила и алк(C1-C4)окси;R1' независимо выбирают из группы, состоящей из водорода, 123I, 125I, 131I, 18F, 18F(C1-4)алкила,18R2 независимо выбирают из группы, состоящей из гидроксила, С 1-4 алкокси, (C1-C4)алкилоксоалк(C1C4)окси, карбокси(С 1-С 4)алкила, галоген(C1-C4)алкокси, галоген(C1-C4)алкилоксо(C1-С 4)алкокси, галогенR6 и R6' независимо выбирают из группы, состоящей из водорода, гидрокси(С 1-С 4)алкила и С 1-С 4 алкила;R7 и R8 выбирают из Н, F, Cl или Br, где один из R7 и R8 представляет собой галоген. В следующем предпочтительном варианте осуществленияR6 и R6' независимо выбирают из группы, состоящей из водорода, гидрокси(С 1-С 4)алкила и С 1-С 4 алкила;R7 и R8 выбирают из группы, состоящей из водорода и фтора, где один из двух R7 или R8 представляет собой фтор. Неожиданно было установлено, что производные стильбена, содержащие дополнительный галоген,в частности атом фтора при двойной связи, демонстрируют улучшенные фармакокинетические свойства,и/или повышенную метаболическую стабильность, и/или повышенную стабильность и однородность геометрических изомеров. Предпочтительные соединения формулы I имеют следующие структуры: где один из R7 и R8 представляет собой водород, а другой представляет собой галоген. Второй аспект настоящего изобретения относится к соединениям формулы II или их фармацевтически приемлемым солям, гдеa. NRaRb, где Ra и Rb независимо представляют собой водород, С 1-4 алкил, (CH2)d18F и d представляет собой целое число от 1 до 4, или оба Ra и Rb представляют собой кислород с образованием нитрогруппы,b. гидрокси,c. C1-4 алкокси и где q представляет собой целое число от 1 до 10;R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила;R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила; иR7 и R8 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино,метиламино, диметиламино, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила. Более предпочтительно значение для каждого из R30, R31, R32, R33, R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино, метиламино,диметиламино и метокси. Предпочтительно R2 расположен или в мета-, или в пара-положении относительно этиленового мостика. Когда R2 представляет собой предпочтительным значением для R30, R31, R32 и R33 в каждом случае является водород и Z представляет собой 18F. Полезные значения для q включают целые числа от 1 до 10. Предпочтительно q представляет собой целое число от 2 до 5. Более предпочтительно значение q равно 3 или 4. Предпочтительные варианты осуществления формулы II включают следующие структуры, где Ra иR независимо представляют собой водород или метил, предпочтительно по крайней мере один из Ra и Rb представляет собой метил: и X представляет собой 18F. Предпочтительная серия соединений формулы II включает меченные 18F производные полиэтиленгликоль (ПЭГ)-стильбена, имеющие следующие структуры: где q представляет собой целое число от 1 до 10. Более предпочтительные соединения включают те,в которых q равно 2 В данной серии соединений 18F связан со стильбеном через цепь ПЭГ, имеющую переменное число этоксильных групп. Все фторированные стильбены проявляют высокую аффинность связывания в анализе с использованием посмертных гомогенатов мозга больных AD (Ki=2,9-6,7 нМ). Как показано на схемах 1-3 данного описания, введение радиоактивной метки успешно осуществляют путем замещения мезилатной группы в 10 а-d на [18F]фторид, получая целевые соединения [18F]12a-d (EOS, удельная активность 900-1500 Ки/ммоль; радиохимическая чистота 99%). Биораспределение in vivo данных 18F-лигандов у обычных мышей показывало превосходное проникновение в мозг и быстрое вымывание после внутривенной инъекции (6,6-8,1 и 1,2-2,6% дозы/г через 2 и 60 мин, соответственно). Ауторадиография посмертных отделов мозга больных AD с использованием[18F]12a-d подтвердила специфическое связывание, относящееся к присутствию бляшек А. Кроме того,введение метки в бляшки in vivo с использованием данных меченных 18F агентов может быть четко продемонстрировано на трансгенных мышах (Tg2576) - полезной животной модели для болезни Альцгеймера. Настоящее изобретение также относится к соединениям формулы III где n представляет собой целое число от 1 до 4;R41 выбирают из группы, состоящей из гидрокси и NRaRb, где Ra и Rb независимо представляют собой водород, C1-4 алкил или оба Ra и Rb представляют собой кислород, образуя нитрогруппу. Предпочтительно n равно 1 и R41 представляет собой гидрокси, метиламино или диметиламино. Предпочтительные значения в рамках С 6-10 арила включают фенил, нафтил или тетрагидронафтил. Предпочтительные значения в рамках гетероарила включают тиенил, фурил, пиранил, пирролил, пиридинил, индолил и имидазолил. Предпочтительные значения в рамках гетероцикла включают пиперидинил, пирролидинил и морфолинил. Соединения формул I, II и III также могут быть сольватированными, в особенности гидратированными. Гидратирование может происходить во время получения соединений или композиций, включающих соединения, или гидратирование может происходить с течением времени вследствие гигроскопичной природы соединений. Дополнительно соединения по настоящему изобретению могут существовать в несольватированной, а также сольватированной формах вместе с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Обычно в целях настоящего изобретения сольватированные формы рассматриваются как эквивалентные несольватированным формам. Также следует понимать, что настоящее изобретение рассматривается как включающее стереоизо-7 012334 меры, такие как цис- и транс-изомеры соединений стильбенового типа. Дополнительно изобретение включает оптические изомеры, например смеси энантиомеров, а также индивидуальные энантиомеры и диастереомеры, которые возникают как следствие структурной асимметрии выбранных соединений формулы I, II или III. Когда любые переменные возникают более одного раза в любом компоненте или в формуле I, II илиIII, его определение при каждом появлении является независимым от его определения при каждом другом появлении. Также комбинации заместителей и/или переменных являются допустимыми только в том случае, когда такие комбинации приводят к стабильным соединениям. Термин "алкил", как он использован в данном описании сам по себе или как часть другой группы,относится как к линейным, так и к разветвленным радикалам, содержащим до 8 углеродов, предпочтительно до 6 углеродов, более предпочтительно 4 углерода, таким как метил, этил, пропил, изопропил,бутил, трет-бутил и изобутил. Термин "алкокси" использован в данном описании для обозначения линейного или разветвленного алкильного радикала, как определено выше, если длина цепи ограничена для этой цели, связанного с атомом кислорода, включая, но не ограничиваясь указанным, метокси, этокси, н-пропокси, изопропокси и т.п. Предпочтительно алкоксильная цепь имеет в длину от 1 до 6 атомов углерода, более предпочтительно 1-4 атома углерода. Термин "моноалкиламин", как он использован в данном описании сам по себе или как часть другой группы, относится к аминогруппе, которая является замещенной 1 алкильной группой, как определено выше. Термин "диалкиламин", как он использован в данном описании сам по себе или как часть другой группы, относится к аминогруппе, которая является замещенной 2 алкильными группами, как определено выше. Термин "гало" или "галоген", использованный в данном описании сам по себе или как часть другой группы, относится к хлору, брому, фтору или иоду, если не указано другого в конкретных употреблениях в тексте и/или формуле изобретения. Термин "галогеналкил", как он использован в данном описании, относится к любой из вышеуказанных алкильных групп, замещенных 1 или несколькими атомами хлора, брома, фтора или иона, где фтор и иод являются предпочтительными, таким как хлорметил, иодметил, трифторметил, 2,2,2-трифторпентил и 2-хлорэтил. Термин "арил", как он использован в данном описании сам по себе или как часть другой группы,относится к моноциклическим или бициклическим ароматическим группам, содержащим от 6 до 12 углеродов в кольцевой части, предпочтительно 6-10 углеродов в кольцевой части, таким как фенил, нафтил или тетрагидронафтил. Термин "гетероцикл" или "гетероциклическое кольцо", как он использован в данном описании, за исключением отмеченного, представляет собой стабильную 5-7-членную моногетероциклическую кольцевую систему, которая может быть насыщенной или ненасыщенной и которая состоит из атомов углерода и от 1 до 3 гетероатомов, выбранных из группы, состоящей из N, О и S, и где гетероатомы азота и серы необязательно могут быть окисленными. Особенно полезными являются кольца, содержащие 1 азот в сочетании с 1 кислородом или серой или 2 азота в качестве гетероатомов. Примеры таких гетероциклических групп включают пиперидинил, пирролил, пирролидинил, имидазолил, имидазинил, имидазолидинил, пиридил, пиразинил, пиримидинил, оксазолил, оксазолидинил, изоксазолил, изоксазолидинил, тиазолил, тиазолидинил, изотиазолил, гомопиперидинид, гомопиперазинил, пиридазинил, пиразолил и пиразолидинил, наиболее предпочтительно тиаморфолинил, пиперазинил и морфолинил. Термин "гетероатом" использован в данном описании для обозначения атома кислорода ("О"), атома серы ("S") или атома азота ("N"). Будет понятно, что, когда гетероатом представляет собой азот, он может образовывать фрагмент NRaRb, где Ra и Rb представляют собой, независимо друг от друга, водород или C1-4 алкил, С 2-4 аминоалкил, C1-4 галогеналкил, галогенбензил, или R1 и R2, взятые вместе, образуют 5-7-членное гетероциклическое кольцо, необязательно имеющее О, S или NRc в указанном кольце,где Rc представляет собой водород или C1-4 алкил. Термин "гетероарил", как он использован в данном описании, относится к группе, имеющей от 5 до 14 кольцевых атомов; 6, 10 или 14 -электронов, распределенных совместно в циклическом фрагменте, и содержащей атомы углерода и 1, 2, 3 или 4 гетероатома кислорода, серы или азота (где примерами гетероарильных групп являются группы тиенил, бензо[b]тиенил, нафто[2,3-b]тиенил, тиаантренил, фурил,пиранил, изобензофуранил, бензоксазолил, хроменил, ксантенил, феноксантинил, 2 Н-пирролил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, 3 Н-индолил, индолил, индазолил, пуринил, 4 Н-хинолизинил, изохинолил, хинолил, фталазинил,нафтиридинил, хиназолинил, циннолинил, птеридинил, 4 аН-карбазолил, карбазолил, 3-карболинил, фенантридинил, акридинил, перимидинил, фенантролинил, феназинил, изотиазолил, фенотиазинил, изоксазолил, фуразанил и феноксазинил). Термин "аралкил" или "арилалкил", как он использован в данном описании сам по себе или часть другой группы, относится к C1-6 алкильным группам, как обсуждалось выше, имеющим арильный замес-8 012334 титель, таким как бензил, фенилэтил или 2-нафтилметил. Настоящее изобретение дополнительно относится к способам получения соединений вышеуказанных формул I, II или III. Соединения по данному изобретению могут быть получены с использованием реакций, описанных на схемах 1-8. На схеме 1 показан синтетический путь образования тиофенсодержащих производных формулы I, в частности некоторых соединений формулы Ia. Фторированные ПЭГ-стильбены 12a-d получали реакциями, показанными на схеме 1. Для получения соединений с 2 или 3 этоксильными группами в качестве ПЭГ связывающих фрагментов коммерчески доступные хлориды 2 а, b связывали с ОН группой 4-метиламино-4'-гидроксистильбена, 1 (Ono, M., etal., Nucl. Med. Biol. 2003; 30: 565-71; Wilson, A., et al., J. Labelled Cpd. Radiopharm. 2003; 46: S61), получая 3a,b соответственно. Свободные ОН группы 3 а, b впоследствии защищали с использованием TBDMSCl,получая соединения 7 а, b. Для получения соединений с 4 или 5 этоксильными группами в качестве ПЭГсвязывающей группы бромиды 6 с, d были получены по отдельности, как показано на схеме 2, и затем сшиты со стильбеном 1 с получением TBS-защищенных соединений 7c, d. О-TBS защитные группы в соединениях 7 с, d были удалены обработкой TBAF (1M) в ТГФ с получением 3c, d. Соединения 8a-d были получены путем введения защиты в метиламиногруппы в 7a-d с использованием ВОС. После удаленияTBS защитных групп 8a-d с помощью TBAF (1 М)/ТГФ свободные ОН группы были преобразованы в мезилаты путем взаимодействия с MsCl в присутствии триэтиламина с получением 10 а-d. "Холодные" фторированные ПЭГ-стильбены 12a-d с успехом получали нагреванием при кипении с обратным холодильником 10 а-d в смеси безводный TBAF/ТГФ (Сох, D.P., et al., J. Org. Chem. 1984; 49: 3216-19) с последующим перемешиванием с ТФУК для удаления ВОС-защитной группы. Для получения целевых 18F-меченных ПЭГ-стильбенов [18F]12a-d в качестве предшественников использовали N-BOC защищенные мезилаты 10 а-d (схема 3). Каждый из мезилатов, 10 а-d, смешивали со смесью [18F]фторид/карбонат калия и Kryptofix 222 в ДМСО и нагревали при 120 С в течение 4 мин. Смесь затем обрабатывали водной HCl для удаления N-BOC защитной группы. Неочищенный продукт очищали с помощью ВЭЖХ (радиохимическая чистота 99%, радиохимический выход 10-30%, скорректированный распад). Получение каждого из 18F-меченных соединений [18F]12a-d занимало примерно 90 мин, и удельную активность оценивали как составляющую 900-1500 Ки/ммоль в конце синтеза. Схема 1 Синтез соединений 15 е, 16 е и синтез радиоактивно меченых соединений-предшественников 15d,17d для получения [18F]15e и [18F]6 е показаны на схеме 9. Для получения соединения 15 а нитрогруппу в 4-нитро-4'-гидроксистильбене, 13 а, восстанавливают с использованием SnCl2 в этаноле, получая соответствующий амин 14 а. Аминогруппу затем обрабатывают (СНО)n и NaBH3CN, получая диметиламинозамещенное соединение 15 а. Соединение 15b получают при взаимодействии гидроксилстильбена, 15 а, с бромидом (который был отдельно получен, как показано на схеме 10) и карбонатом калия в безводном ДМФ. Соединение 15 с получают при обработке 15b 1 н. HCl в ацетоне. Монотозилат 15d можно выделить из полученной при взаимодействии диола 15 с с 1,5 экв. хлористого тозила в пиридине смеси продуктов. Тозилат 15d преобразовывают во фторид 15 е путем нагревания при кипении с безводным TBAF в ТГФ.TBAF следует высушивать при 58 С в высоком вакууме (0,5 мм Hg) в течение 24 ч перед употреблением. Тозильное соединение 15d использовали в качестве исходного вещества для получения радиоактивно меченого соединения [18F]15e. Нитросоединение 13 е было синтезировано аналогичным образом реакцией конденсации 13 а с 20m с последующим тозилированием и фторированием. Синтез соединения 16 е проводили восстановлением нитрогруппы 13 е с использованием SnCl2/EtOH с последующим монометилированием аминогруппы с использованием (CHO)n, NaOCH3 и NaBH4. Промежуточное соединение, 13b,восстанавливали до амина, 14 с, и затем проводили монометилирование с получением соединения 16 с. Для получения [18F]16e конструировали в качестве предшественника для введения радиоактивной меткиN-защищенный тозилат 17d. Полученный ранее 14 а первоначально подвергали монометилированию с получением 16 а. Соединение 17f затем получали путем конденсации 16 а с 20n (схема 10) и введением ВОС в 2 амин. Ди-трет-бутилсилильную группу 17f удаляли с использованием 1 н. TBAF в ТГФ при комнатной температуре, получая диол 5 с, который подвергали монотозилированию с получением соединения 17d. Родственное соединение 15h также синтезировали, как показано на схеме 4. Замещенный малонат 21 восстанавливали до диола 22 с использованием DIBALH, а затем подвергали взаимодействию с 1 экв.TBSCl, получая 23. Незащищенную ОН группу затем преобразовывали в бромид 24 с использованиемCBr4/PPh3. Соединение 24 подвергали взаимодействию с 15 а, получая 15g, который обрабатывали TBAF для удаления TBS-группы, получая 15h. Также были синтезированы два бензильных производных N,N-диметилстильбена, 14 и 15 (схема 4). Соединение 14 получено восстановлением соответствующего сложного этилового эфира 133 с использованием LiAlH4. Бензиловый спирт затем преобразовывали в высокореакционноспособный промежуточный бензилбромид с использованием смеси HBr/НОАс и затем его без очистки сразу же преобразовывали в простой метиловый эфир 15 путем добавления метанола и карбоната калия. Те производные стильбена, которые содержат атом фтора, непосредственно связанный с двойной связью (формула I: R7 или R8 представляет собой фтор), были синтезированы хорошо известными способами (например, Tetrahedron Lett. 43, (2002), 2877-2879). Для получения [18F]15e соединение-предшественник 15d смешивали со смесью [18F]фторид/карбонат калия и Kryptofix 222 в ДМСО и нагревали при 120 С в течение 4 мин. Неочищенный продукт очищали с помощью ВЭЖХ, достигая 99% радиохимической чистоты с 10% радиохимическим выходом(скорректированный распад). Способ получения занимает 90 мин, а специфическую активность оценивали как равную 70 Ки/ммоль в конце синтеза. Аналогичный способ проводили для получения [18F]16e из соединения-предшественника 17d. После первоначальной реакции в ДМСО смесь обрабатывали воднойHCl для удаления ВОС группы. Радиохимическая чистота составляла 99% после ВЭЖХ очистки, и радиохимический выход составлял 15%. Общее время синтеза оставляло 110 мин, и в конце синтеза специфическая активность была оценена как равная 90 Ки/ммоль. Некоторые из соединений также могут быть синтезированы с применением микроволнового излучения, как описано ниже в примерах 50-52.- 12012334 Радиоактивные галогенированные соединения по данному изобретению легко можно приспособить для получения из материалов, которые могут быть обеспечены в наборе. Наборы для получения визуализирующих агентов могут содержать, например, пузырек, содержащий физиологически подходящий раствор промежуточного соединения формулы I в концентрации и при рН, подходящих для оптимальных условий комплексообразования. Пользователю нужно будет добавить в пузырек подходящее количество радиоактивного изотопа и окислителя, такого как пероксид водорода. Полученный меченый лиганд затем может быть введен внутривенно пациенту, и рецептуры мозга могут быть визуализированы с помощью измерения гамма-излучения или их фотоэмиссии. При желании, радиоактивный диагностический агент может содержать любую вспомогательную добавку, такую как рН контролирующие агенты (например, кислоты, основания, буферы), стабилизаторы(например, аскорбиновая кислота) или изотонические агенты (например, хлорид натрия). Термин "фармацевтически приемлемая соль", как он использован в данном описании, относится к тем карбоксилатным солям или кислотно-аддитивным солям соединений по настоящему изобретению,которые, в рамках действующих медицинских суждений, являются подходящими для применения в контакте с тканями пациентов без чрезмерной токсичности, раздражения, аллергической ответной реакции и т.п., соответствуют разумному соотношению польза/риск и эффективны в целях предназначенного применения, а также к цвиттерионным формам соединений по изобретению, где это возможно. Термин "соли" относится к относительно нетоксичным аддитивным солям соединений по настоящему изобретению с неорганическими и органическими кислотами. Термин также включает соли, полученные из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты, например уксусная кислота, фенилзамещенные алкановые кислоты, гидроксиалкановые и алкандионовые кислоты, ароматические кислоты и алифатические и ароматические сульфоновые кислоты. Данные соли могут быть получены insitu в процессе конечного выделения и очистки соединений или при отдельном взаимодействии очищенного соединения в виде свободного основания с подходящей органической или неорганической кислотой и выделения образовавшейся при этом соли. Далее иллюстративные соли включают гидробромид, гидрохлорид, сульфат, бисульфат нитрат, ацетат, оксалат, валерат, олеат, пальмитат, стеарат, лаурат, борат,бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактиобионатные и лаурилсульфонатные соли, пропионат, пивалат цикламат, изетионат и т.п. Они могут включать катионы, полученные из щелочных и щелочно-земельных металлов, таких как натрий,литий, калий, кальций, магний и т.п., а также нетоксичные катионы аммония, четвертичного аммония и аминов, включая, но не ограничиваясь указанным, аммоний, тетраметиламмоний, тетраэтиламмоний,метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. (см., например, Berge С.М., et al.,Pharmaceutical Salts, J. Pharm. Sci. 66: 1-19 (1977), включенную в данное описание в качестве ссылки). Настоящее изобретение также относится к способу визуализации амилоидных отложений. Одним из ключевых необходимых условий для визуализирующего агента мозга in vivo является способность проходить в неизменном виде через гематоэнцефалический барьер после болюсной внутривенной инъекции. На первой стадии настоящего способа визуализации меченое соединение формулы I, II или III вводят в ткань пациента в обнаруживаемом количестве. Соединение обычно составляет часть фармацевтической композиции, и его вводят в ткань пациента способами, хорошо известными специалистам в данной области. Например, соединение можно вводить или перорально, ректально, парентерально (внутривенно,внутримышечно или подкожно), интрацистенально, внутривлагалищно, внутрибрюшинно, внутрипузырно, местным образом (порошки, мази или капли), или в виде буккального или назального спрея. В предпочтительном варианте осуществления изобретения меченое соединение вводят пациенту в обнаруживаемом количестве и после достаточного промежутка времени, проходящего для связывания соединения с амилоидными отложениями, меченое соединение обнаруживают неинвазивным образом внутри организма пациента. В другом варианте осуществления изобретения 18F-меченное соединение формулы I, II или III вводят в организм пациента, дают возможность пройти промежутку времени, достаточному для связывания соединения с амилоидными отложениями и затем удаляют образец ткани пациента и выявляют меченое соединение в ткани пациента извне организма пациента. В третьем варианте осуществления изобретения удаляют образец ткани пациента и меченое соединение формулы I, II или III вводят в образец ткани. После промежутка времени, достаточного для связывания соединения с амилоидными отложениями, выявляют соединение. Введение меченого соединения пациенту может быть осуществлено с помощью общего или местного пути введения. Например, меченое соединение можно вводить пациенту таким образом, что оно будет доставляться через организм. Альтернативно, меченое соединение можно вводить в определенный представляющий интерес орган или ткань. Например, желательно локализовать и количественно оценить амилоидные отложения в мозге для диагностирования или прослеживания прогрессирования развития болезни Альцгеймера у пациента. Термин "ткань" означает часть организма пациента. Примеры тканей включают мозг, сердце, печень, кровеносные сосуды и артерии. Обнаруживаемое количество представляет собой количество меченого соединения, необходимое для обнаружения выбранным методом. Количество меченого соединения для введения пациенту с целью обеспечения обнаружения легко может быть определено специалистом в- 13012334 данной области. Например, пациенту можно давать увеличивающиеся количества меченого соединения до тех пор, пока соединение не будет обнаруживаться выбранным методом. Метку вводят в соединения для обеспечения обнаружения соединений. Термин "пациент" означает людей и других животных. Специалистам в данной области также известно определение промежутка времени, необходимого для связывания соединения с амилоидными отложениями. Необходимое количество времени легко может быть определено путем введения пациенту обнаруживаемого количества меченого соединения формулы I, II или III и затем обнаружения меченого соединения в различный момент времени после введения. Термин "связанный" означает химическое взаимодйествие между меченым соединением и амилоидным отложением. Примеры связывания включают ковалентные связи, ионные связи, гидрофильногидрофобные взаимодействия и образование комплексов. Специалисты в данной области знакомы с обнаружением позитрон-излучающих атомов, таких как 18F, с помощью позитрон-эмиссионной томографии. Настоящее изобретение также относится к конкретным соединениям, в которых атом 18F заменен нерадиоактивным атомом фтора. Радиоактивный диагностический агент должен обладать достаточной радиоактивностью и радиоактивной концентрацией, которая может гарантировать надежный диагноз. Желательный уровень радиоактивности можно достичь способами, разработанными в данном изобретении для получения соединений формулы I, II или III. Визуализация изображения амилоидных отложений также может быть проведена количественно так, чтобы можно было определить количество амилоидных отложений. Другой аспект изобретения относится к способу ингибирования агрегации амилоидных бляшек. Настоящее изобретение также относится к способу агрегации амилоидных белков, приводящей к образованию амилоидных отложений, путем введения пациенту ингибирующего амилоиды количества соединения вышеуказанных формул I, II или III. Специалисты в данной области легко смогут определить ингибирующее амилоиды количество путем простого введения соединения формулы I, II или III пациенту в увеличивающихся количествах до тех пор, пока рост амилоидных отложений не уменьшится или не остановится. Скорость роста может быть оценена с использованием визуализации изображения, как описано выше, или отбором образца ткани пациента и наблюдения в нем амилоидных отложений. Соединения по настоящему изобретению можно вводить пациенту при уровнях дозировки в диапазоне от примерно 0,1 до примерно 1000 мг в день. Для обычного взрослого человека, имеющего массу тела примерно 70 кг, достаточной является дозировка в диапазоне от примерно 0,01 до примерно 100 мг на килограмм веса тела в день. Однако конкретные использованные дозировки могут изменяться. Например, дозировка может зависеть от ряда факторов, включая требования пациента, тяжесть состояния, подвергаемого лечению и фармакологической активности используемого соединения. Определение оптимальных дозировок для конкретного пациента хорошо известно специалистам в данной области. Радиоактивный диагностический агент должен обладать достаточной радиоактивностью и радиоактивной концентрацией, которая может гарантировать надежный диагноз. Желательный уровень радиоактивности можно достичь способами, разработанными в данном изобретении для получения соединений формулы I, II или III. Визуализация изображения амилоидных отложений также может быть проведена количественно так, чтобы можно было определить количество амилоидных отложений. Следующие примеры являются иллюстративными, а не ограничивающими способ и композиции по настоящему изобретению. Другие, обычно встречающиеся и очевидные для специалистов в данной области, подходящие модификации и адаптации множества условий и параметров входят в рамки сути и объема данного изобретения. Все использованные для синтеза реагенты представляли собой коммерческие продукты и были использованы без дополнительной очистки, если не указано другого. Спектры 1 Н ЯМР были получены на спектрометре Bruker DPX (200 МГц) в CDCl3. Химические сдвиги приведены в виде значений(миллионные доли) относительно внутреннего стандарта ТМС. Константы спин-спинового взаимодействия приведены в герцах. Мультиплетность сигналов определена как с (синглет), д (дублет), т (триплет), ушир.(широкий сигнал), м (мультиплет). Элементный анализ был проведен Atlantic Microlab INC. Для каждой методики выражение "стандартная обработка" относится к следующим стадиям: добавление указанного органического растворителя, промывка органического слоя водой, затем насыщенным раствором соли,отделение органического слоя от водного слоя, высушивание объединенных органических слоев над безводным сульфатом натрия, отфильтровывание сульфата натрия и удаление органического растворителя при пониженном давлении. Пример 1. 2-(2-4-[2-(4-Метиламинофенил)винил]феноксиэтокси)этанол (3 а). В атмосфере азота 4-метиламино-4'-гидроксистильбен 1 (Ono, M., et al., Nucl. Med. Biol. 2003;Wilson, A., et al., J. Labelled Cpd. Radiopharm. 2003) (63 мг, 0,28 ммоль) и 2 а (42 мг, 0,34 ммоль) растворяли в безводном ДМФ (5,0 мл) с последующим добавлением карбоната калия (125 мг, 0,91 ммоль). Суспензию нагревали до 100 С и перемешивали в течение ночи. После охлаждения до комнатной темпера- 14012334 туры использовали стандартную обработку дихлорметаном и остаток очищали препаративной ТСХ на силикагеле (4% метанол в дихлорметане), получая соединение 3 а (67 мг, 76%): 1H ЯМР 7,37 (м, 4 Н),6,89 (м, 4 Н), 6,63 (д, 2 Н, J=8,48 Гц), 4,16 (т, 2 Н), 3,88 (т, 2 Н), 3,78 (т, 2 Н), 3,68 (т, 2 Н), 2,87 (с, 3 Н), 2,20(ушир., 1 Н), 1,55 (ушир., 1 Н). Пример 2. 2-[2-(2-4-[2-(4-Метиламинофенил)винил]феноксиэтокси)этокси]этанол (3b). Соединение 3b получали из 1 (150 мг, 0,67 ммоль), 2b (136 мг, 0,81 ммоль) и карбоната калия (277 мг,2,01 ммоль) в ДМФ (10 мл) с использованием такого же способа, как описано для соединения 3 а. 3b (180 мг,76%): 1H ЯМР 7,37 (м, 4 Н), 6,89 (м, 4 Н), 6,65 (д, 2 Н, J=8,50 Гц), 4,15 (т, 2 Н), 3,87 (т, 2 Н), 3,72 (т, 6 Н),3,62 (т, 2 Н), 2,87 (с, 3 Н), 2,20 (ушир., 1 Н), 1,60 (ушир., 1 Н). Пример 3. 2-2-[2-(2-4-[2-(4-Метиламинофенил)винил]феноксиэтокси)этокси]этоксиэтанол (3 с).TBAF (1M в THF, 0,06 мл) добавляли шприцом к раствору соединения 7 с (12 мг, 0,023 ммоль) в ТГФ (1 мл). Раствор перемешивали при комнатной температуре в течение 2 ч. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (4,5% метанол в дихлорметане), получая 3 с (8,7 мг, 94%): 1H ЯМР 7,36 (м, 4 Н), 6,88 (м, 4 Н), 6,58 (д, 2 Н, J=8,5 Гц),4,15 (т, 2 Н), 3,86 (т, 2 Н), 3,70 (м, 12 Н), 2,86 (с, 3 Н). Пример 4. 2-(2-2-[2-(2-4-[2-(4-Метиламинофенил)винил]феноксиэтокси)этокси]этоксиэтокси) этанол (3d). Соединение 3d получали из 7d (15 мг, 0,027 ммоль) и TBAF (1M в ТГФ, 0,06 мл) в ТГФ (1 мл) с использованием такого же способа, как описано для соединения 3 с. 3d (7,8 мг, 65%): 1 Н ЯМР 7,36 (м, 4 Н),6,87 (м, 4 Н), 6,60 (д, 2 Н, J=8,5 Гц), 4,14 (т, 2 Н), 3,85 (т, 2 Н), 3,66 (м, 16 Н), 2,86 (с, 3 Н). Пример 5. 2-(2-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксиэтокси)этанол (5 с). Тетраэтиленгликоль, 4 с (1,12 г, 5,77 ммоль) и TBDMSCl (0,87 г, 5,77 ммоль) растворяли в дихлорметане (25 мл) с последующим добавлениеим триэтиламина (1,46 г, 14,4 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч. После стандартной обработки с использованием дихлорметана остаток очищали хроматографией на силикагеле (50% этилацетат в гексане), получая 5 с (744 мг, 42%): 1 Н ЯМР 3,66 (м, 16 Н), 2,51 (т, 1 Н, J=5,86 Гц), 0,89 (с, 9 Н), 0,07 (с, 6 Н). Пример 6. 2-[2-(2-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксиэтокси)этокси]этанол (5d). Соединение 5d получали из пентаэтиленгликоля, 4d (1,13 г, 4,72 ммоль), TBDMSCl (0,78 г, 5,19 ммоль) и триэтиламина (1,2 г, 11,8 ммоль) в дихлорметане (25 мл) с использованием такого же способа, как описано для соединения 5 с. 5d (668 мг, 40%): 1 Н ЯМР 3,67 (м, 20 Н), 2,64 (т, 1 Н, J=5, 63 Гц), 0,89 (с, 9 Н), 0,06 (с, 6 Н). Пример 7. (2-2-[2-(2-Бромэтокси)этокси]этоксиэтокси)трет-бутилдиметилсилан (6 с). Соединение 5 с (680 мг, 2,20 ммоль) и четырехбромистый углерод (947 мг, 2,86 мг) растворяли в дихлорметане (20 мл). Раствор охлаждали до 0 С на ледяной бане и добавляли пиридин (2,0 мл), а затем трифенилфосфин (749 мг, 0,286 ммоль). Раствор перемешивали при 0 С в течение получаса и при комнатной температуре в течение 2 ч. После стандартной обработки с использованием дихлорметана остаток очищали хроматографией на силикагеле (20% этилацетат в гексане), получая соединение 6 с (680 мг,79,6%): 1H ЯМР 3,79 (м, 4 Н), 3,66 (м, 8 Н), 3,56 (т, 2 Н), 3,47 (т, 2 Н), 0,89 (с, 9 Н), 0,07 (с, 6 Н). Пример 8. [2-(2-2-[2-(2-Бромэтокси)этокси]этоксиэтокси)этокси]трет-бутилдиметилсилан (6d). Соединение 6d получали из 5d (624 мг, 1,77 ммоль), четырехбромистого углерода (761 мг, 2,30 ммоль),трифенилфосфина (602 мг, 2,30 ммоль), пиридина (2,0 мл) в дихлорметане (20 мл) с использованием такого же способа, как описано для соединения 6 с. 6d (400 мг, 52,3 %): 1 Н ЯМР 3,79 (м, 4 Н), 3,66 (м,12 Н), 3,55 (т, 2 Н), 3,47 (т, 2 Н), 0,89 (с, 9 Н), 0,06 (с, 6 Н). Пример 9. 4-[2-(4-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксифенил)винил]фенилметиламин (7 а). Соединение 3 а (45 мг, 0,14 ммоль) и TBDMSCl (33 мг, 0,22 ммоль) растворяли в дихлорметане (10 мл) с последующим добавлением имидазола (20 мг, 0,29 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч. После стандартной обработки с использованием дихлорметана остаток очищали хроматографией на силикагеле (1,5% метанол в дихлорметане), получая 7 а (56 мг, 91%): 1H ЯМР 7,40(м, 4 Н), 6,90 (м, 4 Н), 6,75 (д, 2 Н, J=7,9 Гц), 4,15 (т, 2 Н), 3,88 (т, 2 Н), 3,82 (т, 2 Н), 3,66 (т, 2 Н), 2,85 (с, 3 Н),0,92 (с, 9 Н), 0,09 (с, 6 Н). Пример 10. (4-2-[4-(2-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксиэтокси)фенил]винил фенил)метиламин (7b). Соединение 7b получали из 3b (136 мг, 0,38 ммоль), TBDMSCl (86 мг, 0,57 ммоль), имидазола (52 мг,0,76 ммоль) в дихлорметане (10 мл) с использованием такого же способа, как описано для соединения 7 а. 7b (170 мг, 95%): 1H ЯМР 7,37 (м, 4 Н), 6,88 (м, 4 Н), 6,66 (д, 2 Н, J=8,6 Гц), 4,14 (т, 2 Н), 3,86 (т, 2 Н), 3,75(м, 6 Н), 3,57 (т, 2 Н), 2,88 (с, 3 Н), 0,90 (с, 9 Н), 0,07 (с, 6 Н). Пример 11. [4-(2-4-[2-(2-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксиэтокси)этокси]фенилвинил)фенил]метиламин (7 с). Соединение 7 с получали из 1 (98 мг, 0,44 ммоль), 6 с (210 мг, 0,57 ммоль), K2CO3 (300 мг, 2,18 ммоль) в ДМФ (10 мл) с использованием такого же способа, как описано для соединения 3 а. 7 с (213 мг, 95%): 1 Н- 15012334 ЯМР 7,36 (м, 4 Н), 6,87 (м, 4 Н), 6,59 (д, 2 Н, J=8,5 Гц), 4,14 (т, 2 Н), 3,86 (т, 2 Н), 3,75 (м, 10 Н), 3,55 (т,2 Н), 2,86 (с, 3 Н), 0,89 (с, 9 Н), 0,06 (с, 6 Н). Пример 12. 4-[2-(4-2-[2-(2-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксиэтокси)этокси] этоксифенил)винил]фенилметиламин (7d). Соединение 7d получали из 1 (97 мг, 0,43 ммоль), 6d (197 мг, 0,47 ммоль), K2CO3 (297 мг, 2,15 ммоль) в ДМФ (10 мл) с использованием такого же способа, как описано для соединения 3 а. 7d (220 мг, 91%): 1 Н ЯМР 7,36 (м, 4 Н), 6,87 (м, 4 Н), 6,59 (д, 2 Н, J=8,5 Гц), 4,14 (т, 2 Н), 3,85 (т, 2 Н), 3,75 (м, 14 Н), 3,55 (т,2 Н), 2,86 (с, 3 Н), 0,89 (с, 9 Н), 0,06 (с, 6 Н). Пример 13. трет-Бутиловый эфир 4-[2-(4-2-[2-(трет-Бутилдиметилсиланилокси)этокси]этоксифенил)винил]фенилметилкарбаминовой кислоты (8 а). В атмосфере азота 7 а (54 мг, 0,13 ммоль) растворяли в безводном ТГФ (5,0 мл) с последующим добавлением Вос-ангидрида (84 мг, 0,25 ммоль). Раствор нагревали при кипении с обратным холодильником в течение ночи. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (2% метанол в дихлорметане), получая 8 а (60 мг, 90%): 1 Н ЯМР 7,43(т, 2 Н), 3,64 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н), 0,90 (с, 9 Н), 0,08 (с, 6 Н). Пример 14. трет-Бутиловый эфир (4-2-[4-(2-2-[2-(трет-бутилдиметилсиланилокси)этокси]этокси этокси)фенил]винилфенил)метилкарбаминовой кислоты (8b). Соединение 8b получали из 7b (124 мг, 0,26 ммоль) и Вос-ангидрида (218 мг, 0,66 ммоль) в ТГФ (10 мл),с использованием такого же способа, как описано для соединения 8 а. 8b (130 мг, 86%): 1 Н ЯМР 7,43 (д,4 Н, J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,15 (т, 2 Н), 3,87 (т, 2 Н), 3,75 (т,6 Н), 3,57 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н), 0,90 (с, 9 Н), 0,07 (с, 6 Н). Пример 15. трет-Бутиловый эфир [4-(2-4-[2-(2-2-[2-(трет-бутилдиметилсиланилокси)этокси]этоксиэтокси)этокси]фенилвинил)фенил]метилкарбаминовой кислоты (8 с). Соединение 8 с получали из 7 с (84 мг, 0,16 ммоль) и Вос-ангидрида (163 мг, 0,49 ммоль) в ТГФ (5 мл),с использованием такого же способа, как описано для соединения 8 а. 8 с (86 мг, 86%): 1H ЯМР 7,42 (д,4 Н, J=7,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,15 (т, 2 Н), 3,87 (т, 2 Н), 3,73 (т,10 Н), 3,57 (т, 2 Н), 3,26 (с, 3 Н), 1,46 (с, 9 Н), 0,89 (с, 9 Н), 0,07 (с, 6 Н). Пример 16. трет-Бутиловый эфир 4-[2-(4-2-[2-(2-2-[2-(трет-бутилдиметилсиланилокси)этокси] этоксиэтокси)этокси]этоксифенил)винил]фенилметилкарбаминовой кислоты (8d). Соединение 8d получали из 7d (210 мг, 0,51 ммоль) и Вос-ангидрида (840 мг, 2,54 ммоль) в ТГФ (10 мл) с использованием такого же способа, как описано для соединения 8 а. 8d (174 мг, 66,7%): 1 Н ЯМР 7,42(т, 14 Н), 3,55 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н), 0,89 (с, 9 Н), 0,06 (с, 6 Н). Пример 17. трет-Бутиловый эфир [4-(2-4-[2-(2-гидроксиэтокси)этокси]фенилвинил)фенил]метилкарбаминовой кислоты (9 а). Соединение 9 а получали из 8 а (56 мг, 0,11 ммоль) и TBAF (1 М в ТГФ, 0,21 мл) в ТГФ (5 мл), с использованием такого же способа, как описано для соединения 3 с. 9 а (36 мг, 82%): 1H ЯМР 7,43 (д, 4 Н,J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,18 (т, 2 Н), 3,88 (т, 2 Н), 3,78 (т, 2 Н),3,68 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 18. трет-Бутиловый эфир 4-[2-(4-2-[2-(2-гидроксиэтокси)этокси]этоксифенил)винил]фенилметилкарбаминовой кислоты (9b). Соединение 9b получали из 8b (118 мг, 0,21 ммоль) и TBAF (1M в ТГФ, 0,42 мл) в ТГФ (10 мл) с использованием такого же способа, как описано для соединения 3 с. 9b (94 мг, 99,7%): 1 Н ЯМР 7,43 (д,4 Н, J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,17 (т, 2 Н), 3,87 (т, 2 Н), 3,74 (т,6 Н), 3,62 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 19. трет-Бутиловый эфир (4-2-[4-(2-2-[2-(2-гидроксиэтокси)этокси]этоксиэтокси)фенил] винилфенил)метилкарбаминовой кислоты (9 с). Соединение 9 с получали из 8b (66 мг, 0,11 ммоль), TBAF (1 М в ТГФ, 0,22 мл) и THF (5 мл) с использованием такого же способа, как описано для соединения 3 с. 9 с (50 мг, 93,0%): 1 Н ЯМР 7,43 (д, 4 Н,J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,16 (т, 2 Н), 3,87 (т, 2 Н), 3,78 (т,10 Н), 3,61 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 20. трет-Бутиловый эфир [4-(2-4-[2-(2-2-[2-(2-гидроксиэтокси)этокси]этоксиэтокси) этокси]фенилвинил)фенил]метилкарбаминовой кислоты (9d). Соединение 9d получали из 8d (76 мг, 0,12 ммоль) и TBAF (1M в ТГФ, 0,24 мл) в ТГФ (5 мл) с использованием такого же способа, как описано для соединения 3 с. 9d (52 мг, 82,7%): 1 Н ЯМР 7,43 (д, 4 Н,J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,7 Гц), 4,16 (т, 2 Н), 3,87 (т, 2 Н), 3,75 (т,14 Н), 3,60 (т, 2 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 21. 2-[2-(4-2-[4-(трет-Бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этиловый эфир метансульфоновой кислоты (10 а). Соединение 9 а (36 мг, 0,087 ммоль) растворяли в дихлорметане (5 мл) с последующим добавлением- 16012334 триэтиламина (44 мг, 0,44 ммоль). Затем с помощью шприца добавляли метансульфонилхлорид (30 мг,0,26 ммоль). Раствор перемешивали при комнатной температуре в течение 4 ч. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (2,0% метанол в дихлорметане), получая 10 а (39 мг, 91%): 1H ЯМР 7,43 (д, 4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц),6,98 (кв, 2 Н), 6,89 (д, 2 Н, J=8,6 Гц), 4,41 (м, 2 Н), 4,16 (м, 2 Н), 3,87 (м, 4 Н), 3,27 (с, 3 Н), 3,05 (с, 3 Н), 1,46(с, 9 Н). Элементный анализ (C25H33NO7S) С. Н. N. Пример 22. 2-2-[2-(4-2-[4-(трет-Бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этоксиэтиловый эфир метансульфоновой кислоты (10b). Соединение 10b получали из 9b (81 мг, 0,18 ммоль), метансульфонилхлорида (62 мг, 0,54 ммоль) и триэтиламина (88 мг, 0,88 ммоль) в дихлорметане (8 мл) с использованием такого же способа, как описано для соединения 10 а. 10b (82 мг, 86,5%): 1 Н ЯМР 7,43 (д, 4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв,2 Н), 6,90 (д, 2 Н, J=8,6 Гц), 4,38 (м, 2 Н), 4,15 (м, 2 Н), 3,85 (м, 2 Н), 3,76 (м, 6 Н), 3,27 (с, 3 Н), 3,05 (с, 3 Н),1,46 (с, 9 Н). Элементный анализ (C27H37NO8S) С. Н. N. Пример 23. 2-(2-2-[2-(4-2-[4-(трет-Бутоксикарбонилметиламино)фенил]винилфенокси)этокси] этоксиэтокси)этиловый эфир метансульфоновой кислоты (10 с). Соединение 10 с получали из 9 с (50 мг, 0,10 ммоль), метансульфонилхлорида (46 мг, 0,40 ммоль) и триэтиламина (50 мг, 0,50 ммоль) в дихлорметане (5 мл) с использованием такого же способа, как описано для соединения 10 а. 10 с (56 мг, 96,9%): 1 Н ЯМР 7,43 (д, 4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв,2 Н), 6,90 (д, 2 Н, J=8,6 Гц), 4,37 (м, 2 Н), 4,16 (м, 2 Н), 3,86 (м, 2 Н), 3,76 (м, 10 Н), 3,27 (с, 3 Н), 3,06 (с, 3 Н),1,46 (с, 9 Н). Элементный анализ (C29H41NO9S) С. Н. N. Пример 24. 2-[2-(2-2-[2-(4-2-[4-(трет-Бутоксикарбонилметиламино)фенил]винилфенокси)этокси] этоксиэтокси]этокси)этиловый эфир метансульфоновой кислоты (10d). Соединение 10d получали из 9d (58 мг, 0,11 ммоль), метансульфонилхлорида (49 мг, 0,43 ммоль) и триэтиламина (54 мг, 0,54 ммоль) в дихлорметане (5 мл) с использованием такого же способа, как описано для соединения 10 а. 10d (63 мг, 95%): 1 Н ЯМР 7,43 (д, 4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв,2 Н), 6,90 (д, 2 Н, J=8,6 Гц), 4,37 (м, 2 Н), 4,18 (м, 2 Н), 3,86 (м, 2 Н), 3,75 (м, 14 Н), 3,27 (с, 3 Н), 3,07 (с, 3 Н),1,46 (с, 9 Н). Элементный анализ (C31H45NO10S) С. Н. N. Пример 25. трет-Бутиловый эфир [4-(2-4-[2-(2-Фторэтокси)этокси]фенилвинил)фенил]метилкарбаминовой кислоты (11 а). Безводный TBAF (Cox, D.P., et al., J. Org. Chem. 1984; 49: 3216-19) (38,5 мг, 0,15 ммоль) добавляли к раствору соединения 10 а (14,5 мг, 0,03 ммоль) в безводном ТГФ (3 мл). Смесь нагревали при кипении с обратным холодильником в течение 4 ч. После охлаждения до комнатной температуры использовали стандартную обработку дихлорметаном и остаток очищали препаративной ТСХ на силикагеле (2% метанол в дихлорметане), получая соединение 11 а (7 мг, 57%): 1 Н ЯМР 7,43 (д, 4 Н, J=8,6 Гц), 7,20 (д, 2 Н,J=8,4 Гц), 6,97 (кв, 2 Н), 6,91 (д, 2 Н, J=8, 6 Гц), 4,60 (д, т, 2 Н, J1=47 Гц, J2=4,0 Гц), 4,17 (т, 2 Н), 3,90 (т, 3 Н),3,75 (т, 1 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 26. трет-Бутиловый эфир 4-[2-(4-2-[2-(2-фторэтокси)этокси]этоксифенил)винил]фенил метилкарбаминовой кислоты (11b). Соединение 11b получали из 10b (21 мг, 0,04 ммоль) и TBAF (52 мг, 0,2 ммоль) в ТГФ (10 мл) с использованием такого же способа, как описано для соединения 11a. 11b (17 мг, 94%): 1 Н ЯМР 7,43 (д,4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,91 (д, 2 Н, J=8,6 Гц), 4,58 (д, т, 2 Н, J1=48 Гц, J2=4,0 Гц),4,16 (т, 2 Н), 3,85 (т, 3 Н), 3,74 (т, 5 Н), 3,26 (с, 3 Н), 1,46 (с, 9 Н). Пример 27. трет-Бутиловый эфир (4-2-[4-(2-2-[2-(2-фторэтокси)этокси]этоксиэтокси)фенил]винилфенил)метилкарбаминовой кислоты (11 с). Соединение 11 с получали из 10 с (18 мг, 0,03 ммоль) и TBAF (42 мг, 0,16 ммоль) в ТГФ (5 мл) с использованием такого же способа, как описано для соединения 11 а. 11 с (12 мг, 77%): 1 Н ЯМР 7,43 (д,4 Н, J=8,6 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,91 (д, 2 Н, J=8,6 Гц), 4,67 (т, 1 Н), 4,55 (д, т, 2 Н, J1=48 Гц,J2=4,0 Гц), 3,85 (т, 3 Н), 3,74 (т, 9 Н), 3,27 (с, 3 Н), 1,46 (с, 9 Н). Пример 28. трет-Бутиловый эфир [4-(2-4-[2-(2-2-[2-(2-фторэтокси)этокси]этоксиэтокси)этокси] фенилвинил)фенил]метилкарбаминовой кислоты (11d). Соединение 11d получали из 10d (15 мг, 0,024 ммоль) и TBAF (32 мг, 0,12 ммоль) в ТГФ (5,0 мл) с использованием такого же способа, как описано для соединения 11a. 11d (11 мг, 84%): 1 Н ЯМР 7,43 (д,4 Н, J=8,4 Гц), 7,20 (д, 2 Н, J=8,4 Гц), 6,97 (кв, 2 Н), 6,90 (д, 2 Н, J=8,6 Гц), 4,55 (д, т, 2 Н, J1=48 Гц, J2=4,0 Гц),4,15 (т, 2 Н), 3,86 (т, 3 Н), 3,72 (т, 13 Н), 3,26 (с, 3 Н), 1,46 (с, 9 Н). Пример 29. [4-(2-4-[2-(2-Фторэтокси)этокси]фенилвинил)фенил]метиламин (12 а). Трифторуксусную кислоту (0,5 мл) добавляли медленно к раствору соединения 11 а (7,0 мг, 0,017 ммоль) в дихлорметане (1 мл). Смесь затем перемешивали при комнатной температуре в течение 1 ч. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (1,0% метанол в дихлорметане), получая 12 а (3 мг, 56%): 1 Н ЯМР 7,37 (м, 4 Н), 6,90 (м, 4 Н), 6,65- 17012334 Пример 30. 4-[2-(4-2-[2-(2-Фторэтокси)этокси]этоксифенил)винил]фенилметиламин (12b). Соединение 12b получали из 11b (17 мг, 0,037 ммоль) в трифторуксусной кислоте (1 мл) и дихлорметане (2 мл) с использованием такого же способа, как описано для соединения 12 а. 12b (9 мг, 68%): 1 Н ЯМР 7,37 (м, 4 Н), 6,88 (м, 4 Н), 6,64 (д, 2 Н, J=8,4 Гц), 4,56 (д, т, 2 Н, J1=46 Гц, J2=4,0 Гц), 4,15 (т, 2 Н),3,87 (м, 3 Н), 3,70 (м, 5 Н), 2,87 (с, 3 Н). Элементный анализ. (C21H26FNO3) С. Н. N. Пример 31. (4-2-[4-(2-2-[2-(2-Фторэтокси)этокси]этоксиэтокси)фенил]винилфенил)метиламин (12 с). Соединение 12 с получали из 11 с (12 мг, 0,024 ммоль) в трифторуксусной кислоте (0,5 мл) и дихлорметане (1 мл) с использованием такого же способа, как описано для соединения 12 а. 12 с (7 мг, 73%): 1 Н ЯМР 7,37 (м, 4 Н), 6,89 (м, 4 Н), 6,62 (д, 2 Н, J=8,4 Гц), 4,55 (д, т, 2 Н, J1=46 Гц, J2=4,0 Гц), 4,15 (т, 2 Н),3,86 (м, 3 Н), 3,71 (м, 9 Н), 2,87 (с, 3 Н). Элементный анализ. (C23H30FNO4) С. Н. N. Пример 32. [4-(2-4-[2-(2-2-[2-(2-Фторэтокси)этокси]этоксиэтокси)этокси]фенилвинил)фенил] метиламин (12d). Соединение 12d получали из 11d (10 мг, 0,018 ммоль) в трифторуксусной кислоте (0,3 мл) и дихлорметане (1 мл) с использованием такого же способа, как описано для соединения 12 а. 12d (6 мг, 73%): 1 Н ЯМР 7,37 (м, 4 Н), 6,88 (м, 4 Н), 6,64 (д, 2 Н, J=8,4 Гц), 4,55 (д, т, 2 Н, J1=4 6 Гц, J2=4,0 Гц), 4,14 (т, 2 Н),3,87 (м, 3 Н), 3,70 (м, 13 Н), 2,87 (с, 3 Н). Элементный анализ. (C25H34FNO5) С. Н. N. Пример 33. [18F][4-(2-4-[2-(2-Фторэтокси)этокси]фенилвинил)фенил]метиламин ([18F]12a).[18F]Фторид, полученный на циклотроне с использованием реакции 18O(p,n)18F, пропускали через картридж Sep-Pak Light QMA в виде водного раствора в обогащенной [18 О] воде. Картридж сушили током воздуха и активный 18F элюировали с использованием 2 мл раствора Kryptofix 222 (K222)/K2CO3 (22 мгK222 и 4,6 мг K2CO3 в смеси CH3CN/H2O 1,77/0,23). Растворитель удаляли при 120 С в токе аргона. Остаток дважды подвергали азеотропной сушке с 1 мл безводного CH3CN при 120 С в токе аргона. Раствор мезилатного предшественника 10 а (4 мг) в ДМСО (0,2 мл) добавляли в реакционный сосуд, содержащий высушенный радиоактивный 18F. Раствор нагревали при 120 С в течение 4 мин. Добавляли воду (2 мл) и раствор охлаждали в течение 1 мин. Затем добавляли HCl (10% водный раствор, 0,5 мл) и смесь опять нагревали при 120 С в течение 5 мин. Добавляли водный раствор NaOH для доведения рН до щелочного(рН 8-9). Смесь экстрагировали этилацетатом (1 мл 2), и объединенный органический слой сушили(Na2SO4), и растворитель удаляли в токе аргона при осторожном нагревании (55-60 С). Остаток растворяли в CH3CN и впрыскивали в ВЭЖХ прибор для очистки (полупрепаративная колонка Hamilton PRP-I(7,0305 мм, 10 мкм), CH3CN/диметилглутаратный буфер (5 мМ, рН 7) 9/1; скорость потока 2 мл/мин). Время удерживания для 12 а составляло 8,9 мин в данной ВЭЖХ системе, и соединение хорошо отделялось от соединения-предшественника 10 а (время удерживания=12 мин), а также побочного продукта гидролиза (время удерживания=6,2 мин). Получение занимало 90 мин, и радиохимический выход составлял 20%(скорректированный распад). Для определения радиохимической чистоты и удельной активности(удел.акт.) использовали аналитическую ВЭЖХ (аналитическая колонка Hamilton PRP-I (4,1250 мм, 10 мкм),CH3CN/диметилглутаратный буфер (5 мМ, рН 7) 9/1; скорость потока 0,5 мл/мин). Время удерживания 12 а в данной системе составляло 10,8 мин, и радиохимическая чистота (РХЧ) превышала 99%. Удельную активность оценивали путем сравнения интенсивности УФ пика очищенного [18F]10 с интенсивностью сравнительного нерадиоактивного соединения известной концентрации. Удельная активность (удел.акт.) составляла 1000-1500 Ки/ммоль после получения. Пример 34. [18F]4-[2-(4-2-[2-(2-Фторэтокси)этокси]этоксифенил)винил]фенилметиламин ([18F]12b). С использованием аналогичной реакции [18F]12b получали из 10b. Радиохимический выход составлял 30% (скорректированный распад), и радиохимическая чистота составляла 99%. Время удерживания 12b в ВЭЖХ составляло 11,7 мин для описанной выше аналитической системы (удельная активность=1300-1500 Ки/ммоль). Пример 35. [18F](4-2-[4-(2-2-[2-(2-Фторэтокси)этокси]этоксиэтокси)фенил]винилфенил)метиламин ([18F]12c). С использованием аналогичной реакции [18F]12c получали из 10 с. Радиохимический выход составлял 10%(скорректированный распад), и радиохимическая чистота составляла 99%. Время удерживания 12 с в ВЭЖХ составляло 11,7 мин для описанной выше аналитической системы (удельная активность=900 Ки/ммоль). Пример 36. [18F][4-(2-4-[2-(2-2-[2-(2-Фторэтокси)этокси]этоксиэтокси)этокси]фенилвинил)фенил]метиламин ([18F]12d). С использованием аналогичной реакции [18F]12d получали из 10b. Радиохимический выход составлял 20% (скорректированный распад), и радиохимическая чистота составляла 99%. Время удерживания 12d в ВЭЖХ составляло 10,7 мин для описанной выше аналитической системы (удельная активность=1000-1500 Ки/ммоль). Пример 37. 4-Амино-4'-гидроксилстильбен (14 а). Хлорид двухвалентного олова (11,8 г, 0,062 моль) добавляли к раствору соединения 13 а (FrintonLab) (3,0 г, 0,012 моль) в этаноле (100 мл) с последующим добавлением концентрированной соляной кислоты (5,0 мл). Раствор нагревали при кипении с обратным холодильником в течение 3 ч, и охлаждали до комнатной температуры, и перемешивали в течение ночи. Добавляли водный раствор гидроксида натрия(1 н.) для доведения рН до 8,5-9. После стандартной обработки с использованием дихлорметана получали неочищенный продукт 14 а (2,6 г, 100%). Продукт использовали на следующей стадии без дополнительной очистки: 1 Н ЯМР(ДМСО-d6) 9,39 (с, 1 Н), 7,30 (д, 2 Н, J=8,5 Гц), 7,20 (д, 2 Н, J=8,5 Гц), 6,80 (м, 2 Н),6,72 (д, 2 Н, J=8,5 Гц), 6,53 (д, 2 Н, J=8,5 Гц), 5,19 (с, 2 Н). Пример 38. 4-N,N'-Диметиламино-4'-гидроксилстильбен (15 а). К смеси 14 а (211 мг, 1,0 ммоль), параформальдегида (300 мг, 10 ммоль) и цианоборгидрида натрия(189 мг, 3,0 ммоль) добавляли уксусную кислоту (10 мл). Общую смесь перемешивали при комнатной температуре в течение ночи и затем выливали в 100 мл воды. Добавляли карбонат натрия для доведения до рН 8-9. После стандартной обработки с использованием 5%-ного метанола в дихлорметане остаток очищали хроматографией на силикагеле (2,5%-ный метанол в дихлорметане), получая 15 а в виде белого твердого вещества (214 мг, 89,5%): 1 Н ЯМР 7,37 (м, 4 Н), 6,87 (с, 2 Н), 6,75 (м, 4 Н), 4,68 (с, 1 Н), 2,98 (с, 6 Н). Пример 39. 4-N,N'-Диметиламино-4'-(2,2-диметил-[1,3]диоксан-5-илметокси)стильбен (15b). В атмосфере азота 15 а (100 мг, 0,38 ммоль) растворяли в безводном ДМФ (5,0 мл). К данному раствору добавляли карбонат калия (140 мг, 1,0 ммоль) с последующим добавлением 5-бромметил-2,2-диметил[1,3]диоксана 20m1 (105 мг, 0,5 ммоль). Смесь нагревали до 100 С и перемешивали в течение ночи. После охлаждения до комнатной температуры применяли стандартную обработку с использованием дихлорметана и остаток очищали препаративной ТСХ на силикагеле (1% метанол в дихлорметане), получая соединение 15b (100 мг, 72%): 1H ЯМР 7,38 (м, 4 Н), 6,88 (м, 4 Н), 6,70 (д, 2 Н, J=8,7 Гц), 4,08 (м, 4 Н),3,87 (м, 2 Н), 2,96 (с, 6 Н), 2,13 (м, 1 Н), 1,46 (с, 3 Н), 1,42 (с, 3 Н). Элементный анализ (C23H29NO3) С. Н. N. Пример 40. 4-N,N'-Диметиламино-4'-(1,3-дигидроксипропан-2-илметокси)стильбен (15 с). Соединение 15b (180 мг, 0,49 ммоль) суспендировали в ацетоне (5,0 мл) и охлаждали до 0 С на ледяной бане. Медленно добавляли в течение 20 мин 1 н. HCl (5,0 мл, 5,0 ммоль). Во время добавления суспензия превращалась в прозрачный раствор. Раствор перемешивали при 0 С дополнительно в течение получаса и затем нагревали до комнатной температуры в течение получаса. Добавляли насыщенный раствор бикарбоната натрия для доведения рН до 8,5-9. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (5% метанол в дихлорметане), получая соединение 15 с в виде белого твердого вещества (140 мг, 87%): 1H ЯМР 7,40 (м, 4 Н), 6,88 (м, 4 Н),6,74 (м, 2 Н), 4,10 (д, 2 Н, J=5,47 Гц), 3,89 (д, 4 Н, J=5,28 Гц), 2,98 (с, 6 Н), 2,22 (м, 1 Н). Элементный анализ(C20H25NO3) С. Н. N. Пример 41. 4-N,N'-Диметиламино-4'-(1-тозил-3-гидроксипропан-2-илметокси)стильбен (15d). Соединение 15 с (158 мг, 0,49 ммоль) растворяли в безводном пиридине (15 мл) и охлаждали до 0 С на ледяной бане. Добавляли тозилхлорид (137 мг, 0,72 ммоль) и раствор перемешивали при 0 С в течение 2 ч. После стандартной обработки с использованием дихлорметана остаток очищали препаративной ТСХ на силикагеле (5% метанол в дихлорметане), получая соединение монотозилата 15d в виде белого твердого вещества (95 мг, 41%): 1H ЯМР 7,75 (д, 2 Н, J=8,26 Гц), 7,37 (м, 4 Н), 7,26 (м, 2 Н), 6,88 (м, 2 Н),6,72 (м, 4 Н), 4,26 (д, 2 Н, J=5,66 Гц), 3,97 (д, 2 Н, J=5,96 Гц), 3,79 (д, 2 Н, J=5,24 Гц), 2,95 (с, 6 Н), 2,38 (м,4 Н). Элементный анализ (C27H31NO5S) С. Н. N. Пример 42. 4-N,N'-Диметиламино-4'-(1-фтор-3-гидроксипропан-2-илметокси)стильбен (15 е). Соединение 15d (40 мг, 0,083 ммоль) растворяли в безводном ТГФ (5,0 мл). В атмосфере азота медленно добавляли безводный TBAF (150 мг, 0,5 ммоль) в безводном ТГФ (1,0 мл). Раствор затем нагревали при кипении с обратным холодильником в течение 3 ч. После охлаждения до комнатной температуры проводили стандартную обработку с использованием дихлорметана и остаток подвергали препаративной ТСХ на силикагеле (5% метанол в дихлорметане), получая продукт 15 е (17 мг, 62%): 1 Н ЯМР 7,40 (м,4 Н), 6,89 (м, 4 Н), 6,70 (д, 2 Н, J=8,82 Гц), 4,67 (дд, 2 Н, J1=47,l Гц, J2=5,46 Гц), 4,10 (д, 2 Н, J=5,86 Гц), 3,88(д, 2 Н, J=5,24 Гц), 2,97 (с, 6 Н), 2,40 (м, 1 Н), 1,76 (с, 1 Н). Элементный анализ (C20H24FNO2) С. Н. N. Пример 43. 4-Нитро-4'-(2,2-диметил[1,3]диоксан-5-илметокси)стильбен (13b). Соединение 13b получали из 13 а (241 мг, 1,0 ммоль) с использованием такого же способа, как описано для соединения 15b. 13b (260 мг, 70%): 1 Н ЯМР 8,19 (д, 2 Н, J=8,80 Гц), 7,49 (м, 4 Н), 7,07 (м, 2 Н),6,90 (д, 2 Н, J=8,80 Гц), 4,12 (м, 4 Н), 3,89 (д, 2 Н), 2,10 (м, 1 Н), 1,48 (с, 3 Н), 1,43 (с, 3 Н). Элементный анализ, вычислено для (C21H23NO5) С. Н. N. Пример 44. 4-Нитро-4'-(1,3-дигидроксипропан-2-илметокси)стильбен (13 с). Соединение 13 с получали из 13b (260 мг, 0,7 ммоль) с использованием такого же способа, как описано для соединения 15 с. 13 с (190 мг, 82%): 1 Н ЯМР (CD3OD)8,19 (д, 2 Н, J=8,80 Гц), 7,72 (д, 2 Н, J=8,80 Гц),7,55 (д, 2 Н, J=8,70 Гц), 7,24 (кв, 2 Н), 6,96 (д, 2 Н, J=8,70 Гц), 4,09 (д, 2 Н, J=5,78 Гц), 3,74 (д, 4 Н, J=5,94 Гц),2,14 (м, 1 Н). Элементный анализ (C18H19NO5) С. Н. N. Пример 45. 4-Нитро-4'-(1-тозил-3-гидроксипропан-2-илметокси)стильбен (13d). Соединение 13d получали из 13 с (80 мг, 0,24 ммоль) с использованием такого же способа, как описано для соединения 15d. 13d (66 мг, 56%): 1 Н ЯМР 8,18 (д, 2 Н, J=8,82 Гц), 7,77 (д, 2 Н, J=8,32 Гц), 7,58- 19012334 Пример 46. 4-Нитро-4'-(1-фтор-3-гидроксипропан-2-илметокси)стильбен (13 е). Соединение 13 е получали из 13d (33 мг, 0,069 ммоль) с использованием такого же способа, как описано для соединения 15 е. 13 е (20 мг, 88%): 1H ЯМР 8,19 (д, 2 Н, J=8,83 Гц), 7,58 (д, 2 Н, J=8,84 Гц), 7,48(д, 2 Н, J=8,74 Гц), 7,10 (кв, 2 Н), 6,94 (д, 2H, J=8,68 Гц), 4,69 (д д, 2 Н, J1=47,1 Гц, J2=5,36 Гц), 4,15 (д, 2 Н,J=5,89 Гц), 3,90 (д, 2 Н, J=5,43 Гц), 2,43 (м, 1 Н), 1,74 (с, 1H). Элементный анализ. (C18H18FNO4) С. Н. N. Пример 47. 4-Амино-4'-(1-фтор-3-гидроксипропан-2-илметокси)стильбен (14 е). Соединение 14 е получали из 13 е (37 мг, 0,11 ммоль) с использованием такого же способа, как описано для соединения 14 а. 14 е (24 мг, 71%): 1 Н ЯМР 7,35 (м, 4 Н), 6,90 (м, 4 Н), 6,66 (д, 2 Н, J=8,54 Гц),4,69 (д д, 2 Н, J1=47,1 Гц, J2=5,46 Гц), 4,12 (д, 2 Н, J=5,84 Гц), 3,90 (д, 2 Н, J=5,56 Гц), 3,70 (с, 2 Н), 2,39 (м,1 Н), 1,71 (с, 1 Н). Элементный анализ (C18H20FNO2) С. Н. N. Пример 48. 4-N-Метиламино-4'-(1-фтор-3-гидроксипропан-2-илметокси)стильбен (16 е). В атмосфере азота метоксид натрия (22 мг, 0,4 ммоль) добавляли к суспензии соединения 14 е (24 мг,0,08 ммоль) в метаноле (6 мл) с последующим добавлением параформальдегида (12 мг, 0,4 ммоль). Раствор нагревали при кипении с обратным холодильником в течение 2 ч и охлаждали до 0 С на ледяной бане. Добавляли порциями боргидрид натрия (15 мг, 0,4 ммоль). Реакционную смесь опять нагревали при кипении с обратным холодильником в течение 1 ч и выливали на дробленный лед. После стандартной обработки с использованием дихлорметана остаток подвергали препаративной ТСХ на силикагеле (4,5% метанол в дихлорметане), получая продукт 16 е (23 мг, 92%): 1 Н ЯМР 7,37 (м, 4 Н), 6,87 (м, 4 Н), 6,59 (д, 2 Н, J=8,56 Гц), 4,69 (д, д, 2 Н, J1=47,1 Гц, J2=5,44 Гц),4,12 (д, 2 Н, J=5,86 Гц), 4,00 (с, 1 Н), 3,89, (д, 2 Н, J=5,52 Гц), 2,86 (с, 3 Н), 2,41 (м, 1 Н), 1,75 (с, 1 Н). Элементный анализ (C19H22FNO2) С. Н. N. Пример 49. 4-N-Метиламино-4'-гидроксистильбен (16 а). Соединение 16 а получали из 14 а (105 мг, 0,5 ммоль) с использованием такого же способа, как описано для соединения 16 е. 16 а (100 мг, 89%): 1 Н ЯМР 7,34 (м, 4 Н), 6,86 (с, 2 Н), 6,79 (д, 2H, J=8,58 Гц),6,60 (д, 2 Н, J=8,58 Гц), 2,85 (с, 3 Н). Пример 50. Общий способ получения стильбена 12 (n=6, 8) под действием микроволнового облучения. Синтез под действием микроволнового облучения. Смесь 16 а, алкилирующего агента (1 экв.),K2CO3 (3 экв.) в ДМФ (1 мл/0,05 ммоль SB-13) помещали в герметически закрытую пробирку и нагревали в микроволновой печи при следующих условиях: 180 С, 10 мин, высокий уровень поглощения. Затем растворитель удаляли, и препаративная тонкослойная хроматография (ПТСХ, CH2Cl2-MeOH (97:3) в качестве проявляющего раствора) давала целевой продукт (выход: 42-60% в зависимости от использованного алкилирующего агента). Пример 51. (4-(2-(4-(2-(2-(2-(2-(2-(2-Фторэтокси)этокси)этокси)этокси)этокси)этокси)фенил)винил) фенил)метиламин (12, n=6). Выход=60%. 1 Н ЯМР (200 МГц, CDCl3)7,2-7,5 (4 Н, м), 6,8-7,0 (4 Н, м), 6,59 (2 Н, д, J=8,4 Гц), 4,55(2 Н, д, т, J1=46 Гц, J2=4,0 Гц), 4,14 (2 Н, т), 3,8-3,9 (3 Н, м), 3,5-3,8 (25 Н, м), 2,89 (3 Н, с). HRMS (EI) m/z вычислено для [C31H46FNO8]+ 579,3207, найдено 579,3192. Пример 53. Получение гомогенатов ткани мозга. Посмертные ткани мозга получали при аутопсии пациентов с AD, и нейропатологический диагноз был подтвержден современными критериями (NIA-Reagan Institute Consensus Group, 1997). Затем получали гомогенаты из иссеченного серого вещества, полученного у пациентов с AD, в забуференном фосфатом физиологическом растворе (PBS, рН 7,4) при концентрации приблизительно 100 мг сырой ткани/мл (стеклянный гомогенизатор с моторным приводом с установкой на 6 для 30 с). Гомогенаты делили на аликвоты порциями по 1 мл и хранили при -70 С в течение 6-12 месяцев без утраты сигнала связывания. Пример 54. Исследование связывания. Как сообщалось ранее, [125I]IMPY с удельной активностью 2200 Ки/ммоль и радиохимической чистотой более 95% получали с использованием стандартной реакции иоддестаннилирования и очищали на упрощенной С-4 мини-колонке (Kung, М.-Р., et al., Euro. J. Nucl. Med. Mol. Imag. 2004; 31: 1136-45). Анализы связывания проводили в борсиликатных стеклянных пробирках размером 1275 мм. Реакционная смесь содержала 50 мкл гомогенатов мозга (20-50 мкг), 50 мкл [125I]IMPY (0,04-0,06 нМ, разведенного вPBS), и 50 мкл ингибиторов (10-5-10-10 М, разведенные серийно в PBS, содержащем 0,1% бычьего сывороточного альбумина, БСА) в конечном объеме 1 мл. Неспецифическое связывание определяли в присутствии IMPY (600 нМ) в таких же пробирках для анализа. Смесь инкубировали при 37 С в течение 2 ч и связанную и свободную радиоактивность отделяли фильтрованием в вакууме через фильтры WhatmanGF/B с использованием харвестера для клеток Brandel M-24R, с последующим промыванием 23 мл PBS при комнатной температуре. Фильтры, содержащие связанный 125I, анализировали на содержание радио- 20012334 активности с использованием гамма-счетчика (Packard 5000) с 70% эффективностью подсчета. В условиях анализа специфически связанные фракции составляли менее 15% общей радиоактивности. Результаты экспериментов по ингибированию анализировали методом нелинейной регрессии с использованиемEBDA, с помощью чего рассчитывали величины Ki. Результаты представлены в табл. 1. Таблица 1 Каждое значение получали по трем независимым измерениям, проведенным в двукратной повторности. Фторированные ПЭН-стильбены (12a-d) продемонстрировали превосходную аффинность связывания (Ki=2,9-6,7 нМ), тогда как соответствующие гидроксилзамещенные аналоги (3 а-d) также проявляли очень высокую аффинность связывания (Ki=2,8-5,2 нМ) (табл. 1). Липофильность данной серии меченых агентов [18F]12a-d находилась в подходящем диапазоне (значения logP составляли 2,52, 2,41, 2,05 и 2,28 для n=2-5, соответственно). Группа ПЭГ способна модулировать молекулярный размер и расстояние между атомом фтора и структурой ядром стильбена, не оказывая влияния на специфическую аффинность связывания с А-бляшками. Пример 55. Пленочная ауторадиография. Срезы головного мозга субъектов с AD получали, замораживая мозг в порошкообразном сухом льде и нарезая его на срезы толщиной 20 мкм. Срезы инкубировали с меченными [18F] атомами (200000250000 импульсов в минуту/200 мкл) в течение 1 ч при комнатной температуре. Два среза затем погружали в насыщенный раствор Li2CO3 в 40% EtOH (две промывки по 2 мин) и промывали 40% EtOH (одна 2-минутная промывка) с последущим промыванием водой в течение 30 с. После высушивания пленкуKodak MR подвергали воздействию 18F-меченных срезов в течение ночи. Пример 56. Введение метки в бляшки in vivo с использованием [18F]12b и [18F]12d. Оценку in vivo проводили с использованием или дважды трансгенных APP/PS1, или однократно трансгенных АРР 2576 мышей, которые были любезно предоставлены AstraZeneca. После анестезии с использованием 1% изофлурана 250-300 мкКи [18F]12b или [18F]12d в 200 мкл 0,1% раствора BSA вводили в виде инъекции в хвостовую вену. Животным давали возможность прийти в себя в течение 60 мин и затем убивали их путем обезглавливания. Мозг сразу же удаляли и замораживали в порошкообразном сухом льде. Нарезали 20 мкм срезы и пленку Kodak MR подвергали воздействию в течение ночи. Таким образом получали ex vivo пленочные ауторадиограммы. Пример 57. Распределение в органах у нормальных мышей. При анестезии изофлураном 0,15 мл 0,1% раствора бычьего сывороточного альбумина, содержащего [18F]-трейсеры (5-10 мкКи), вводили непосредственно в хвостовую вену мышей ICR (22-25 г, самцы). Мышей (n=3 для каждой временной точки) умерщвляли путем смещения шеи через 120 мин после инъекции. Представляющие интерес органы удаляли и взвешивали и анализировали радиоактивность на содержание радиоактивности с помощью автоматического счетчика гамма-излучения. Рассчитывали процент дозы на орган путем сравнения числа импульсов для тканей и разбавленными подходящим образом аликвотами вещества, введенного в виде инъекции. Рассчитывали общую активность крови, исходя из предположения, что она составляет 7% от общей массы тела. Для образцов рассчитывали % дозы/г путем сравнения числа импульсов для образца с числом импульсов разведенной первоначальной дозы.- 21012334 Таблица 2 Биораспределение у мышей ICR после внутривенной инъекции [18F]12a-d в 0,1% BSA(% дозы/г, среднее значение для 3 мышейсреднеквадратичное отклонение) Радиоактивные соединения, включая [18F]12a-d, проникают незатронутыми через гематоэнцефалический барьер, демонстрируя превосходнее поглощение мозгом обычных мышей (6,6-8,1% дозы/г мозга) через 2 мин после внутривенной инъекции (табл. 2 А и В). Поскольку для экспериментов по исследованию биораспределения использовали обычных мышей, наличия А-бляшек в мозге данных молодых мышей не ожидалось; следовательно, меченые агенты, [18F]12a-d, быстро вымывались из мозга (1,2-2,6% дозы/г мозга) через 60 мин после внутривенной инъекции. Высокое первоначальное поглощение и быстрое вымывание из мозга обычных мышей (не имеющих А-бляшек в мозге) являются чрезвычайно желательными свойства визуализирующих агентов А-бляшек. Значения, представленные в табл. 2, сравнимы с описанными для [11C]PIB и [11C]SB-13 (Mathis, C.A., et al., Curr. Pharm. Des. 2004; 10: 1469-92;Ono, M., et al., Nucl. Med. Biol. 2003; Mathis, C.A., et al., J. Med. Chem. 2003). Подробное биораспределение [18F]12b показано в табл. 2 А. Очевидно, что через 2 мин после инъекции соединение поглощалось печенью, почками, легкими и мышцами, отражая общий характер перфузии крови. Поглощение костями через 120 мин было высоким (2,74% дозы/г), что позволяет предположить, что здесь возможно дефторирование in vivo. Однако свободный фтор не поглощался тканью мозга; следовательно, поглощение в костях было относительно низким. Другие производные ПЭГ-стильбена 12 а,с,d продемонстрировали аналогичный характер биораспределения (табл. 2 В). Пример 58. Коэффициент распределения. Коэффициенты распределения измерены путем смешивания в пробирке для тестирования [18F]трейсера с 1-октанолом и буфером (0,1 М фосфат, рН 7,4), по 3 г каждого. Пробирку для тестирования- 22012334 подвергали вихревому встряхиванию в течение 3 мин при комнатной температуре с последующим центрифугированием в течение 5 мин. С помощью луночного счетчика проводили считывание показаний для двух взвешенных образцов (по 0,5 каждого), отобранных из фаз 1-октанола и буфера. Коэффициент распределения определяли, рассчитывая соотношение числа импульсов в минуту/г для 1-октанола к такому же значению для буфера. Для образцов, полученных из слоя 1-октанола, проводили повторное перераспределение до получения устойчивых величин коэффициентов распределения (обычно 3-е или 4-е распределение). Измерения проводили в трехкратной повторности и повторяли трижды. Обычным специалистам в данной области будет понятно, что то же самое может быть осуществлено в широком и эквивалентном диапазоне условий, препаратов и других параметров, не выходя за рамки объема изобретения или любого варианта его осуществления. Все процитированные в данном описании патенты, патентные заявки и публикации полностью включены в него в качестве ссылки во всей своей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль или пролекарство, гдеa. NRaRb, где Ra и Rb независимо представляют собой водород, C1-4 алкил, (CH2)d18F и d представляет собой целое число от 1 до 4,b. гидрокси,c. С 1-4 алкокси,d. гидрокси(С 1-4)алкила,e. галогена,f. циано,g. водорода,h. нитро,i. (C1-C4)алкила,j. галоген(С 1-С 4)алкила иF(C1-C4)алкилоксо(С 1-С 4)алкилоксо(C1-C4)алкилокси, 18F(С 1-С 4)алкилоксо(C1-C4)алкилоксо(C1-С 4)алкилоксо(C1-C4)алкилокси, 18F(C1-C4)алкила,где R6 и R6' независимо выбирают из группы, состоящей из водорода, гидрокси(C1-C4)алкила и С 1 С 4 алкила; где q представляет собой целое число от 1 до 10;R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила;R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила; иR7 и R8 в каждом случае независимо выбирают из группы, состоящей из галогена, водорода, гидрокси, амино, метиламино, диметиламино, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила, где по крайней мере один из R7 и R8 представляет собой галоген; где термин "арилокси" относится к моноциклической или бициклической ароматической группе,содержащей от 6 до 12 углеродов в кольцевой части, соединенной с атомом кислорода. 2. Соединение по п.1, где R' представляет собой водород и R1 представляет собой NRaRb, где Ra и Rb независимо представляют собой водород или C1-4 алкил. 3. Соединение по п.1, где R7 и R8 представляют собой водород или фтор, где по крайней мере один 7 из R и R8 представляет собой фтор. 4. Соединение по п.2, где R2 представляет собой где Z, R30, R31, R32 и R33 являются такими, как описано выше. 5. Соединение по п.4, где q представляет собой целое число от 2 до 5. 6. Соединение по п.5, где R30, R31, R32 и R33 представляют собой в каждом случае водород. 7. Соединение по п.4, где q представляет собой целое число от 3 до 4. 8. Соединение по п.7, где Z представляет собой 18F. 9. Соединение по п.8, имеющее следующую формулу: где один из R7 и R8 представляет собой водород, а другой представляет собой галоген. 10. Соединение по п.8, имеющее следующую формулу: где один из R7 и R8 представляет собой водород, а другой представляет собой галоген. 11. Соединение по п.2, где R2 представляет собой где Z, R30, R31, R32 и R33 являются такими, как описано выше. 12. Соединение по п.11, где Z представляет собой 18F. 13. Соединение по п.12, где R30, R31, R32 и R33 в каждом случае представляют собой водород. 14. Соединение по п.2, где R2 представляет собой где U представляет собой гидрокси. 15. Соединение по п.14, где R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой водород. 16. Соединение по п.15, имеющее следующую структуру: где один из R7 и R8 представляет собой водород, а другой представляет собой галоген. 17. Соединение формулы IIa. NRaRb, где Ra и Rb независимо представляют собой водород, C1-4 алкил, (CH2)dX, где X представляет собой 18F и d представляет собой целое число от 1 до 4, или оба Ra и Rb представляют собой кислород с образованием нитрогруппы,b. гидрокси,c. C1-4 алкокси и где q представляет собой целое число от 1 до 10;Z выбирают из группы, состоящей из 18F, 18F замещенного бензоилокси, 18F замещенного (C1-4)алкокси, 18F замещенного бензилокси, 18F замещенного фенил(C1-4)алкила, 18F замещенного арилокси и 18F замещенного С 6-10 арила, и R30, R31, R32 и R33 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила;R34, R35, R36, R37, R38, R39 и R40 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, C1-4 алкокси, C1-4 алкила и гидрокси(С 1-4)алкила; иR7 и R8 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино,метиламино, диметиламино, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила; где термин "арилокси" относится к моноциклической или бициклической ароматической группе,содержащей от 6 до 12 углеродов в кольцевой части, соединенной с атомом кислорода. 18. Соединение по п.17, где R1 представляет собой NRaRb, где Ra и Rb независимо представляют собой водород или C1-4 алкил. 19. Соединение по п.18, где R2 представляет собой где Z, R30, R31, R32 и R33 являются такими, как описано выше. 20. Соединение по п.19, где q представляет собой целое число от 2 до 5. 21. Соединение по п.19, где каждый из R7 и R8 представляет собой водород. 22. Соединение по п.21, где R30, R31, R32 и R33 представляют собой в каждом случае водород. 23. Соединение по п.22, имеющее следующую формулу: где Z, R30, R31, R32 и R33 являются такими, как описано выше. 26. Соединение по п.25, где Z представляет собой 18F. 27. Соединение по п.26, где каждый из R7 и R8 представляет собой водород. 28. Соединение по п.27, где R30, R31, R32 и R33 представляют собой в каждом случае водород. 29. Соединение по п.18, где R представляет собой- 26012334 где U представляет собой гидрокси. 30. Соединение по п.29, где R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой водород. 31. Соединение по п.30, имеющее следующую структуру: где n представляет собой целое число между 1 и 4;R7 и R8 в каждом случае независимо выбирают из группы, состоящей из водорода, гидрокси, амино,метиламино, диметиламино, C1-4 алкокси, C1-4 алкила и гидрокси(C1-4)алкила; иR41 выбирают из группы, состоящей из гидрокси и NRaRb, где Ra и Rb независимо представляют собой водород, С 1-4 алкил или оба Ra и Rb представляют собой кислород с образованием нитрогруппы. 33. Соединение по п.32, где n равно 1 и R41 выбирают из группы, состоящей из гидрокси, метиламмино и диметиламино. 34. Фармацевтическая композиция, содержащая соединение по пп.1, 17 или 32. 35. Диагностическая композиция для визуализации амилоидных отложений, содержащая радиоактивно меченое соединение по пп.1, 17 или 32. 36. Способ визуализации изображения амилоидных отложений, включающий:a. введение млекопитающему обнаруживаемого количества диагностической композиции по п.35;b. предоставление времени, достаточного для связывания меченого соединения с амилоидными отложениями; иc. обнаружение меченого соединения, связанного с одним или несколькими амилоидными отложениями. 37. Способ ингибирования агрегации амилоидных бляшек у млекопитающего, включающий введение композиции по п.34 в количестве, достаточном для ингибирования агрегации амилоидных бляшек. 38. Соединение, выбранное из группы, состоящей из 2-[2-(4-2-[4-(трет-бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этилового эфира метансульфоновой кислоты (10 а); 2-2-[2-(4-2-[4-(трет-бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этоксиэтилового эфира метансульфоновой кислоты (10b); 2-(2-2-[2-(4-2-[4-(трет-бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этоксиэтокси) этилового эфира метансульфоновой кислоты (10 с) и 2-[2-(2-2-[2-(4-2-[4-(трет-бутоксикарбонилметиламино)фенил]винилфенокси)этокси]этоксиэтокси) этокси]этилового эфира метансульфоновой кислоты (10d). 39. Способ получения соединения формулы [18F]12 где n=2, 3, 4 или 5,включающий взаимодействие соединения формулы 10 с [18F]F-/Kryptofix 222 ("K222") и K2CO3 в ДМСО и обработку полученной смеси водной HCl. 40. Набор для получения визуализирующих агентов, содержащий пузырек, где пузырек содержит физиологически подходящий раствор промежуточного соединения формулы I в концентрации и при значении рН, подходящих для оптимальных условий комплексообразования. 41. Соединение, выбранное из группы, состоящей из трет-бутилового эфира [4-(2-4-[2-(2-гидроксиэтокси)этокси]фенилвинил)фенил]метилкарбаминовой кислоты (9 а); трет-бутилового эфира 4-[2-(4-2-[2-(2-гидроксиэтокси)этокси]этоксифенил)винил]фенилметилкарбаминовой кислоты (9b);
МПК / Метки
МПК: C07C 15/52, A61K 49/00, A61P 25/28
Метки: производные, бляшек, применение, связывания, стильбена, визуализации, амилоидных
Код ссылки
<a href="https://eas.patents.su/29-12334-proizvodnye-stilbena-i-ih-primenenie-dlya-svyazyvaniya-i-vizualizacii-amiloidnyh-blyashek.html" rel="bookmark" title="База патентов Евразийского Союза">Производные стильбена и их применение для связывания и визуализации амилоидных бляшек</a>
Предыдущий патент: Аустенитная сталь и стальная продукция
Следующий патент: Снижение расхода извести при обработке тугоплавких золотых руд или концентратов
Случайный патент: Связанные с полиэтиленгликолем соединения гпп-1