Способ ингибирования агрегации амилоидных белков и визуализации амилоидных отложений с использованием производных изоиндолина
Номер патента: 4405
Опубликовано: 29.04.2004
Авторы: Лай Йингджи, Уокер Лари Кразуэлл, Оджелли-Зэфрэн Коринн Элизабет, Сэккэб Аннетт Тереза
Формула / Реферат
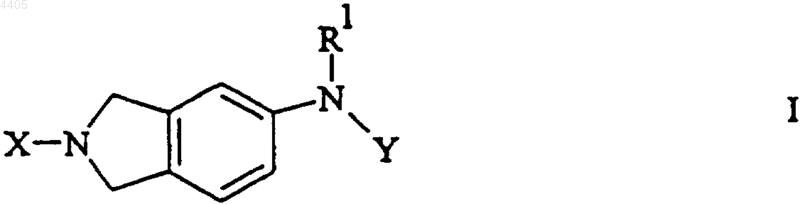
1. Соединения, имеющие формулу I

или их фармацевтически приемлемые соли,
где X представляет собой фенил или замещенный фенил;
Y представляет собой фенил, замещенный фенил, пиридил или замещенный пиридил;
где замещенный фенил и замещенный пиридил могут иметь от 1 до 4 заместителей, каждый из которых независимо выбран из -OC1-C12алкила, галогена, -C1-C6алкила, фенила, 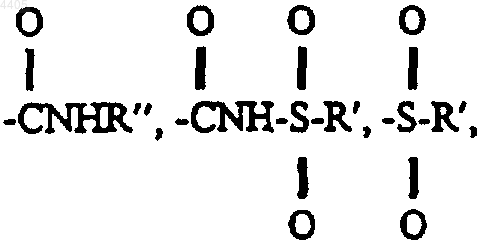 -CO2H, -CO2R1, -NO2, -CF3, -CN, -NR1R2, -(CH2)nCO2H, -(CH2)nCO2R1, -SO2NR1R2, тетразола, -(CH2)n-тетразола, декагидроизохинолина, имидазола, -(CH2)n-имидазола, -CH=CH-тетразола, -CH=CH-имидазола или фенила;
-CO2H, -CO2R1, -NO2, -CF3, -CN, -NR1R2, -(CH2)nCO2H, -(CH2)nCO2R1, -SO2NR1R2, тетразола, -(CH2)n-тетразола, декагидроизохинолина, имидазола, -(CH2)n-имидазола, -CH=CH-тетразола, -CH=CH-имидазола или фенила;
R1 и R2 независимо представляют собой водород или C1-C6алкил и
каждый n независимо равен числу от 0 до 5 включительно;
R" представляет собой водород, C1-C6алкил или фенил и
R' представляет собой водород, C1-C6алкил, -CF3 или фенил,
2. Соединения по п.1, имеющие формулу I
или их фармацевтически приемлемые соли,
где X представляет собой фенил или замещенный фенил, причем когда X представляет собой замещенный фенил, тогда этот замещенный фенил имеет от 1 до 4 заместителей, независимо выбранных из -OC1-C6алкила, галогена, C1-C6алкила, -CF3 или фенила;
Y представляет собой фенил или замещенный фенил, причем когда Y представляет собой замещенный фенил, тогда этот замещенный фенил имеет от 1 до 4 заместителей, независимо выбранных из -CO2H, -NO2, -OC1-C12алкила, -CN, -CF3, -(CH2)nCO2H, -SO2NR1R2, тетразола, -(CH2)n-тетразола, имидазола, -(CH2)n-имидазола, -CH=CH-тетразола или -CH=CH-имидазола;
R1 и R2 независимо представляют собой водород или C1-C6алкил и
каждый n независимо равен числу от 0 до 5 включительно.
3. Соединения по п.1
2-[2-(2,3,4-триметоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
5-нитро-2-[2-(3,4,5-триметоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
4-метокси-5-нитро-2-[2-(3,4,5-триметоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-4-метокси-5-нитробензойная кислота;
2-[2-(3-хлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(4-хлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(3,4-диметилфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(4-хлор-3-трифторметилфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-бифенил-4-ил-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота или
2-[2-(3-хлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота.
4. Соединения по п.1
2-[2-(3,4-диметилфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-(2-фенил-2,3-дигидро-1H-изоиндол-5-иламино)бензойная кислота;
2-[2-(3-хлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-[2-(4-хлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-ил]-[2-(1H-тетразол-5-ил)фенил]амин;
5-амино-2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
5-нитро-2-(2-фенил-2,3-дигидро-1H-изоиндол-5-иламино)бензойная кислота;
2-[2-(4-хлор-3-трифторметилфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-[2-(3-фторфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-[2-(3-метоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-нитробензойная кислота;
2-[2-(3-фторфенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота;
2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]-5-фторбензойная кислота и
2-[2-(3,4-дихлорфенил)-2,3-дигидро-1H-изоиндол-5-иламино]никотиновая кислота.
5. Соединения по п.1
2-[2-(3,4,5-триметоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензонитрил или
2-[2-(3-метоксифенил)-2,3-дигидро-1H-изоиндол-5-иламино]бензойная кислота.
6. Фармацевтическая композиция, содержащая соединение по п.1 вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом для него.
7. Применение соединения по п.1 для изготовления лекарственного средства для лечения болезни Альцгеймера.
8. Применение соединения по п.1 для изготовления лекарственного средства для ингибирования агрегации амилоидных белков с образованием амилоидных отложений.
9. Способ визуализации амилоидных отложений, включающий в себя стадии, на которых
а) пациенту вводят детектируемое количество меченого соединения по п.1;
б) предоставляют достаточно времени для того, чтобы меченое соединение связалось с амилоидными отложениями; и
в) детектируют меченое соединение, связанное с амилоидными отложениями.
Текст
1 Область изобретения Данное изобретение относится к способу ингибирования агрегации амилоидных белков и визуализации амилоидных отложений. Более конкретно данное изобретение относится к способу ингибирования агрегации амилоидных белков с использованием производных изоиндолина для лечения болезни Альцгеймера. Предшествующий уровень техники Амилоидоз представляет собой состояние,характеризующееся аккумуляцией различных нерастворимых фибриллярных белков в тканях пациента. Эти фибриллярные белки, которые образуют скопления или отложения, называют амилоидными белками. Хотя конкретные белки или пептиды, обнаруживаемые в этих отложениях, варьируют, наличие фибриллярной морфологии и большого количества -складчатой вторичной структуры является общим для многих типов амилоидов. Амилоидное отложение образуется посредством агрегации амилоидных белков с последующим дальнейшим объединением агрегатов и/или амилоидных белков. Наличие амилоидных отложений было обнаружено при различных заболеваниях, каждое из которых ассоциировано со своим конкретным белком, таких как средиземноморская лихорадка, синдром Макла-Уэльса (Muckle-Wells),идиопатическая миелома, амилоидная полиневропатия, амилоидная кардиомиопатия, системный сенильный амилоидоз, амилоидная полиневропатия, наследственное мозговое кровоизлияние с амилоидозом, болезнь Альцгеймера,синдром Дауна, скрэпи, болезнь КрейцфельдаЯкоба (Creutzfeldt-Jacob), куру, синдром Герстмана-Штросслера-Шейнкера(GerstmannStraussler-Scheinker), медуллярная карцинома щитовидной железы, изолированный амилоид предсердия, 2-микроглобулиновый амилоид у пациентов с диализом, миозит телец включений,отложения 2-амилоида при болезни мышечного истощения, серповидно-клеточная анемия, болезнь Паркинсона и инсулинома островков Лангерганса при диабете типа II. Болезнь Альцгеймера представляет собой дегенеративное мозговое расстройство, характеризующееся клинически прогрессирующей потерей памяти, познавательной способности,рассудка, рассудительности и эмоциональной стабильности, которая постепенно приводит к умственной деградации и, в конце концов, к смерти. Поскольку болезнь Альцгеймера и родственные дегенеративные мозговые расстройства представляют собой главный медицинский аспект для все более стареющей популяции, то существует необходимость в новых терапиях и способах диагностики этих расстройств. Проведен энергичный поиск простого неинвазивного способа обнаружения и количественного определения амилоидных отложений у пациента. В настоящее время обнаружение ами 004405 2 лоидных отложений включает в себя гистологический анализ материалов биопсии и аутопсии. Оба способа имеют большие недостатки. Например, аутопсию можно использовать только для посмертной диагностики. Прямая визуализация амилоидных отложений in vivo является затруднительной, поскольку эти отложения обладают в большинстве такими же физическими свойствами (например,плотность и содержание воды), как и нормальные ткани. Попытки визуализировать амилоидные отложения, непосредственно используя магнитно-резонансную визуализацию (МРВ) и компьютерную томографию (КТ), возложенные на них надежды не оправдали, поскольку амилоидные отложения обнаруживали только при определенных благоприятных условиях. Кроме того, попытки пометить амилоидные отложения антителами, сывороточным амилоидным белком Р или другими молекулами-зондами обеспечивали некоторую избирательность на периферии тканей, но давали лишь слабую визуализацию внутренних областей тканей. Таким образом, было бы полезно располагать неинвазивной методикой визуализации и количественного определения амилоидных отложений у пациента. Кроме того, было бы полезно располагать соединениями, которые ингибируют агрегацию амилоидных белков с образованием амилоидных отложений. Краткое изложение сущности изобретения В настоящем изобретении предложены соединения, имеющие формулу I: или их фармацевтически приемлемые соли,где Х представляет собой фенил или замещенный фенил;Y представляет собой фенил, замещенный фенил, пиридил или замещенный пиридил; где замещенный фенил и замещенный пиридил могут иметь от 1 до 4 заместителей, каждый из которых независимо выбран из -ОС 1 С 12 алкила, галогена, -С 1-С 6 алкила, фенила,R1 и R2 независимо представляют собой водород или С 1-С 6 алкил; каждый n независимо равен числу от 0 до 5 включительно;R" представляет собой водород, С 1-С 6 алкил или фенил иR' представляет собой водород, С 1-С 6 алкил, -СF3 или фенил. В предпочтительном воплощении соединений формулы I X представляет собой замещенный фенил, и этот замещенный фенил имеет от 1 до 3 заместителей, независимо выбранных из -OC1-С 6 алкила, галогена,-C1-С 6 алкила, -СF3 или фенила. В предпочтительном воплощении соединений формулы I Y представляет собой замещенный фенил, и этот замещенный фенил имеет от 1 до 3 заместителей, независимо выбранных из -СО 2 Н, -NО 2, -ОС 1-С 12 алкила, -CN, тетразола,-(СН 2)nСО 2 Н, -SO2NR1R2, -СF3, имидазола,-(СН 2)n-тетразола, -(СН 2)n-имидазола, -СН=СНтетразола или -СН=СН-имидазола. В предпочтительном воплощении соединений формулы I Y представляет собой замещенный фенил, и этот замещенный фенил имеет от 1 до 3 заместителей, один из которых выбран из -СО 2 Н. В более предпочтительном воплощении соединений формулы I Y представляет собой замещенный фенил, где заместитель представляет собой -СО 2 Н, который находится в положении 2 фенильного кольца. В более предпочтительном воплощении соединений формулы I, где Х представляет собой замещенный фенил, этот замещенный фенил имеет в качестве заместителей два атома хлора, находящихся в положениях 3 и 4 фенильного кольца. Также в настоящем изобретении предложены соединения, имеющие формулу I или их фармацевтически приемлемые соли,где Х представляет собой фенил или замещенный фенил,причем когда Х представляет собой замещенный фенил, тогда этот замещенный фенил имеет от 1 до 4 заместителей, независимо выбранных из -OC1-С 6 алкила, галогена, С 1 С 6 алкила, -СF3 или фенила;Y представляет собой фенил, замещенный фенил, пиридил или замещенный пиридил; причем когда Y представляет собой замещенный фенил или замещенный пиридил, тогда этот замещенный фенил или замещенный пиридил имеет от 1 до 4 заместителей, независимо выбранных из -СО 2 Н, -NO2, -OC1-С 12 алкила,CN, -СF3, -(СН 2)nСО 2 Н, -SO2NR1R2, тетразола,-(СН 2)n-тетразола, декагидроизохинолина, фенила, имидазола, -(СН 2)n-имидазола, -СН=СНтетразола или -СН=СН-имидазола;R1 и R2 независимо представляют собой водород или C1-С 6 алкил; и 4 каждый n независимо равен числу от 0 до 5 включительно. Особенно предпочтительны соединения, имеющие формулу II и их фармацевтически приемлемые соли,где R3 представляет собой галогено;R4 представляет собой водород или галогено и-NR1R2. Другую предпочтительную группу составляют соединения по изобретению, имеющие формулу III и их фармацевтически приемлемые соли,где R3 представляет собой галогено;R4 представляет собой водород или галоген и 6 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-4-гексилоксибензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-4-гептилоксибензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-4-октилоксибензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-4-нонилоксибензойная кислота; 4-децилокси-2-[2-(3,4-дихлорфенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-4-изопропоксибензойная кислота; 2-[2-(4-хлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота; 2-[2-(4-хлор-3-трифторметилфенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота; 2-(2-бифенил-4-ил-2,3-дигидро-1 Н-изоиндол-5-иламино)-5-нитробензойная кислота или 2-[2-(3,4-диметилфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-5-нитробензойная кислота. Предложена также фармацевтическая композиция, содержащая соединение формулы I вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом для него. Предложен также способ лечения болезни Альцгеймера, при котором пациенту с болезнью Альцгеймера вводят терапевтически эффективное количество соединения формулы I. Предложен также способ ингибирования агрегации амилоидных белков с образованием амилоидных отложений, при котором пациенту,нуждающемуся в ингибировании агрегации амилоидных белков, вводят ингибирующее агрегацию амилоидных белков количество соединения формулы I. Предложен также способ визуализации амилоидных отложений, включающий в себя стадии, на которых: а) пациенту вводят детектируемое количество меченого соединения формулы I или его фармацевтически приемлемых солей, где Х представляет собой фенил или замещенный фенил;Y представляет собой фенил или замещенный фенил; где замещенный фенил может иметь от 1 до 5 заместителей, каждый из которых независимо выбран из -ОС 1-С 12 алкила, галогена, -С 1 С 6 алкила, фенила, 7-СН=СН-имидазола; каждый R1 независимо представляет собой водород или C1-С 6 алкил; каждый n независимо равен числу 0 до 5 включительно;R' представляет собой водород, C1 С 6 алкил, -СF3 или фенил. б) предоставляют достаточно времени для того, чтобы меченое соединение связалось с амилоидными отложениями; и в) детектируют меченое соединение, связанное с амилоидными отложениями. В предпочтительном воплощении этого способа пациент страдает болезнью Альцгеймера или у него ее подозревают. В предпочтительном воплощении этого способа меченое соединение представляет собой соединение с радиоактивной меткой. В предпочтительном воплощении этого способа меченое соединение обнаруживают,используя магнитно-резонансную визуализацию(МРВ). Подробное описание изобретения Термин "алкил" означает углеводород с нормальной или разветвленной цепью. Типичными примерами алкильных групп являются метил, этил, пропил, изопропил, изобутил, бутил, тpeт-бутил, втop-бутил, пентил и гексил. Предпочтительными алкильными группами являются C1-С 6 алкильные группы. Термин "алкокси" означает алкильную группу, присоединенную к атому кислорода. Типичные примеры алкоксигрупп включают в себя метокси, этокси, mpem-бутокси, пропокси и изобутокси. Термин "галоген" включает в себя хлор,фтор, бром и йод. Термин "замещенный" означает, что один или более чем один атом водорода в молекуле заменен другим атомом или группой атомов. Например, заместители включают в себя галоген, -ОН, -CF3, -NO2, -NH2, -NН(C1-С 6 алкил),-N(С 1-С 6 алкил)2, C1-С 6 алкил, -OC1-С 6 алкил,-CN, -СF3, -СО 2 Н и -СО 2 С 1-С 6 алкил. Термин "замещенный фенил" означает фенильное кольцо, в котором от 1 до 4 атомов водорода независимо заменены заместителем,предпочтительно заместителем, выбранным из приведенного выше перечня. Примеры включают в себя 3-хлорфенил, 2,6-дибромфенил, 4-нитрофенил, 3,4,5-триметоксифенил и 3-диэтиламинофенил. Символ "-" означает ковалентную связь. 8 Термин "фармацевтически приемлемые соль, сложный эфир, амид и пролекарство", как его используют здесь, относится к тем солям карбоксилатам, солям присоединения аминокислот, сложным эфирам, амидам и пролекарствам соединений по настоящему изобретению,которые в пределах объема правильного медицинского показания являются подходящими для применения в контакте с тканями пациентов без проявления чрезмерной токсичности, раздражения, аллергической реакции и тому подобного, в соответствии с разумным соотношением польза/риск, и являются эффективными для их рекомендованного применения, а также, где возможно, к цвиттерионным формам соединений по изобретению. Термин "соли" относится к относительно нетоксичным солям присоединения неорганических и органических кислот соединений по настоящему изобретению. Эти соли можно получить in situ во время заключительного выделения и очистки соединений, либо путем отдельного взаимодействия очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения образованной таким образом соли. Типичные соли включают в себя соли гидробромид, гидрохлорид, сульфат,бисульфат, нитрат, ацетат, оксалат, валерат,олеат, пальмитат, стеарат, лаурат, борат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат,глюкогептонат, лактобионат и лаурилсульфонат и тому подобные. Они могут включать в себя катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий,калий, кальций, магний и им подобные, а также нетоксичные катионы аммония, четвертичного аммония и аминов, включая, но не ограничиваясь ими, аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и тому подобные (смотри, например, статью Berge S.M. et al.,Pharmaceutical Salts, J. Pharm. Sci., 66: 1-19(1977), которая включена здесь путем ссылки). Примеры фармацевтически приемлемых нетоксичных сложных эфиров соединений по данному изобретению включают в себя С 1-С 6 алкиловые сложные эфиры, где алкильная группа представляет собой нормальную или разветвленную цепь. Приемлемые сложные эфиры также включают в себя C5-С 7 циклоалкиловые сложные эфиры, а также арилалкиловые сложные эфиры, такие как бензиловые эфиры, но не ограничиваются ими. С 1-C4 алкиловые сложные эфиры являются предпочтительными. Сложные эфиры соединений по настоящему изобретению можно получить согласно общепринятым способам. Примеры фармацевтически приемлемых нетоксичных амидов соединений по данному изобретению включают в себя амиды, полученные из аммиака, первичных C1-С 6 алкиламинов и 9 вторичных C1-С 6 диалкиламинов, где алкильные группы представляют собой нормальные или разветвленные цепи. В случае вторичных аминов амин может также находиться в форме 5 или 6-членного гетероцикла, содержащего один атом азота. Амиды, полученные из аммиака,первичных C1-С 3 алкиламидов и вторичных C1 С 2 диалкиламидов, являются предпочтительными. Амиды соединений по изобретению можно получить согласно общепринятым способам. Термин "пролекарство" относится к соединениям, которые быстро превращаются in vivo с образованием исходного соединения приведенных выше формул, например, посредством гидролиза в крови. Подробное обсуждение представлено в статьях Т. Higuchi and V. Stella, Prodrugs as Novel Delivery Systems, Vol. 14 of the A.Pharmaceutical Association and Pergamon Press,1987, причем обе эти статьи включены здесь путем ссылки. Кроме того, соединения по настоящему изобретению могут существовать как в несольватированной, так и в сольватированной форме с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобные. В общем сольватированные формы считают эквивалентными несольватированным формам для целей настоящего изобретения. Соединения по настоящему изобретению могут существовать в различных стереоизомерных формах вследствие наличия центров асимметрии в этих соединениях. Считают, что все стереоизомерные формы соединений, а также их смеси, включая рацемические смеси, составляют часть данного изобретения. На первой стадии настоящего способа визуализации меченое соединение формулы I вводят в ткань или пациенту в детектируемом количестве. Обычно это соединение составляет часть фармацевтической композиции, и его вводят в ткань или пациенту способами, хорошо известными специалистам в данной области техники. В способах по настоящему изобретению соединение можно вводить перорально, ректально, парентерально (внутривенно, внутримышечно или подкожно), интрацистернально,внутривлагалищно, внутрибрюшинно, внутрипузырно, местно (порошки, мази или капли),либо в виде трансбуккального или назального спрея. Композиции, подходящие для парентеральной инъекции, могут представлять собой физиологически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для разведения в стерильных инъекционных растворах или дисперсиях. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают(такие как оливковое масло) и инъекционные органические сложные эфиры, такие как этилолеат. Подходящую текучесть можно поддерживать, например, путем использования покрытия,такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсий и путем использования сурфактантов. Эти композиции могут также содержать адъюванты, такие как консервирующие, смачивающие, эмульгирующие и диспергирующие агенты. Предотвращение действия микроорганизмов можно обеспечивать с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты и тому подобных. Может быть также желательным включение изотонических агентов, например сахаров,хлорида натрия и тому подобных. Пролонгированное всасывание инъекционной фармацевтической формы можно осуществить путем использования агентов, замедляющих всасывание,например моностеарата алюминия и желатина. Твердые лекарственные формы для перорального введения включают в себя капсулы,таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают по меньшей мере с одним обычным инертным эксципиентом (или носителем), таким как цитрат натрия или дикальций фосфат, либо с (а) наполнителями или заменителями, такими как, например, крахмалы, лактоза, сахароза, глюкоза, маннит и кремневая кислота; (б) связывающими агентами, такими как,например, карбоксиметилцеллюлоза, альгинаты,желатин, поливинилпирролидон, сахароза и аравийская камедь; (в) увлажнителями, такими как, например, глицерин; (г) разрыхляющими агентами, такими как, например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые комплексные силикаты и карбонат натрия; (д) замедлителями растворения, такими как, например, парафин; (е) ускорителями всасывания,такими как, например, соединения четвертичного аммония; (ж) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина; (з) адсорбентами, такими как, например, каолин и бентонит; и (и) смазывающими агентами, такими как, например,тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия или их смеси. В случае капсул, таблеток и пилюль эти лекарственные формы могут также содержать забуферивающие агенты. Твердые композиции подобного типа можно также применять в качестве наполнителей в твердых и мягких заполненных желатиновых капсулах, используя такие эксципиенты,как лактоза или молочный сахар, а также высо 11 комолекулярные полиэтиленгликоли и тому подобные. Твердые лекарственные формы, такие как таблетки, драже, капсулы, пилюли и гранулы,можно изготовлять с покрытиями и оболочками,такими как энтеросолюбильные оболочки, и другие, хорошо известные в данной области техники оболочки. Они могут содержать затемняющие агенты, а также могут иметь такой состав, чтобы высвобождать активное соединение или соединения в определенном участке кишечного тракта замедленным образом. Примерами покрывающих композиций, которые можно использовать, являются полимерные вещества и воски. Активные соединения могут также, если это целесообразно, находиться в микроинкапсулированной форме с одним или более чем одним из вышеупомянутых эксципиентов. Жидкие лекарственные формы для перорального введения включают в себя фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активных соединений, эти жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как вода или другие растворители, солюбилизирующие агенты и эмульгирующие агенты, такие как, например, этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3 бутиленгликоль, диметилформамид, масла, в частности, хлопковое масло, арахисовое масло,масло кукурузных проростков, оливковое масло, касторовое масло и кунжутное масло, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и эфиры жирных кислот и сорбитана или смеси этих веществ, и тому подобные. Кроме этих инертных разбавителей, эта композиция может также включать в себя адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подслащивающие, корригирующие и ароматические агенты. Суспензии, кроме активных соединений,могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, либо смеси этих веществ, и тому подобные. Композиции для ректальных введений предпочтительно представляют собой суппозитории, которые можно получить смешиванием соединений по настоящему изобретению с подходящими нераздражающими эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при обычных температурах, но жидкими при температуре тела и,следовательно, плавятся в полости прямой киш 004405 12 ки или влагалища и высвобождают активный компонент. Лекарственные формы для местного введения соединения по данному изобретению включают в себя мази, порошки, спреи и средства для ингаляций. Активный компонент смешивают в стерильных условиях с физиологически приемлемым носителем и любыми консервантами, буферами или пропеллентами, как необходимо. Офтальмологические препараты,глазные мази, порошки и растворы также рассматривают как находящиеся в пределах объема данного изобретения. В предпочтительном воплощении изобретения меченое соединение вводят внутрь пациента в детектируемом количестве, и после того,как пройдет достаточно времени для того, чтобы соединение связалось с амилоидными отложениями, это меченое соединение детектируют неинвазивно внутри пациента. В другом воплощении изобретения меченое соединение формулы I вводят внутрь пациенту, предоставляют достаточно времени для того, чтобы это соединение связалось с амилоидными отложениями, а затем берут образец ткани от пациента и меченое соединение детектируют в этой ткани вне пациента. В третьем воплощении изобретения берут образец ткани от пациента и меченое соединение формулы I вводят в этот образец ткани. После того, как пройдет достаточно времени для того, чтобы соединение связалось с амилоидными отложениями, это соединение детектируют. Введение меченого соединения пациенту можно осуществлять посредством общего или местного пути введения. Например, меченое соединение можно вводить пациенту таким образом, чтобы его доставка осуществлялась по всему организму. Альтернативно меченое соединение можно вводить в конкретные представляющие интерес орган или ткань. Например, желательно локализовать и количественно определить амилоидные отложения в головном мозге для того, чтобы диагностировать болезнь Альцгеймера или прослеживать ее прогрессирование у пациента. Термин "ткань" означает часть организма пациента. Примеры тканей включают в себя головной мозг, сердце, печень, кровеносные сосуды и артерии. Детектируемым количеством является количество меченого соединения, необходимое для того, чтобы быть детектированным с помощью выбранного способа детектирования. Количество меченого соединения, которое следует вводить пациенту, чтобы обеспечить его детектирование, могут легко определить специалисты в данной области техники. Например, пациенту можно давать возрастающие количества меченого соединения до тех пор, пока это соединение не будет детектировано с помощью выбранного способа детектирования. Метку включают в соединения для того, 13 чтобы обеспечить детектирование этих соединений. Термин "пациент" означает людей и других животных. Специалисты в данной области техники также знакомы с определением количества времени, достаточного для того, чтобы соединение связалось с амилоидными отложениями. Необходимое количество времени можно легко определить путем введения детектируемого количества меченого соединения формулыI внутрь пациента с последующим детектированием этого меченого соединения через различные промежутки времени после введения. Меченое соединение формулы I представляет собой любое соединение этой формулы, имеющее по меньшей мере один радиоактивный элемент в качестве части своей структуры. Термин "связанный" означает химическое взаимодействие между меченым соединением и амилоидным отложением. Примеры связей включают в себя ковалентные связи, ионные связи, гидрофильно-гидрофобные взаимодействия, гидрофобно-гидрофильные взаимодействия и комплексы. Специалисты в данной области техники знакомы с различными способами детектирования меченых соединений. Например, для детектирования соединений с радиоактивной меткой можно использовать магнитно-резонансную визуализацию (МРВ), эмиссионную позитронную томографию (ЭПТ) или однофотонную эмиссионную компьютерную томографию(ОЭКТ). Метка, которую включают в соединение, будет зависеть от желаемого способа детектирования. Например, если в качестве способа детектирования выбирают ЭПТ, то соединение должно иметь атом, испускающий позитроны, такой как 11 С или 18F. Другим примером подходящей метки в соединении формулы I является такой атом, как 13 С, 15N или 19F, который можно детектировать,используя магнитно-резонансную визуализацию(МРВ), иногда называемую ядерным магнитным резонансом (ЯМР). Кроме того, меченые соединения формулы I можно также детектировать с помощью МРВ, используя парамагнитные контрастные агенты. Соединения, содержащие радиоактивный элемент как часть их структуры,легко получить с помощью стандартных синтетических способов. Другим примером детектирования является электронный парамагнитный резонанс (ЭПР). В этом случае можно использовать ЭПР зонды,которые хорошо известны в данной области техники, такие как нитроксиды. Визуализацию амилоидных отложений можно также осуществлять количественно, так,чтобы можно было определить количество амилоидных отложений. В настоящем изобретении также предложен способ ингибирования агрегации амилоидных белков с образованием амилоидных отло 004405 14 жений путем введения пациенту, нуждающемуся в ингибировании агрегации амилоидного белка, ингибирующего амилоидный белок количества соединения формулы I. Специалисты в данной области техники способны легко определить ингибирующее амилоиды количество путем простого введения соединения формулы I пациенту в возрастающих количествах до тех пор, пока рост амилоидных отложений не уменьшится или не остановится. Скорость роста можно оценить с помощью визуализации или путем отбора образца ткани у пациента и наблюдения в нем амилоидных отложений. Пациентом, нуждающимся в ингибировании агрегации амилоидных белков, является пациент, страдающий заболеванием или состоянием, при которых амилоидные белки агрегируют. Примеры таких заболеваний и состояний включают в себя средиземноморскую лихорадку, синдром Макла-Уэльса, идиопатическую миелому, амилоидную полиневропатию, амилоидную кардиомиопатию, системный сенильный амилоидоз, амилоидную полиневропатию, наследственное мозговое кровоизлияние с амилоидозом, болезнь Альцгеймера, синдром Дауна, скрэпи, болезнь Крейцфельда-Якоба, куру,синдром Герстмана-Штросслера-Шейнкера,медуллярную карциному щитовидной железы,изолированный амилоид предсердия, 2 микроглобулиновый амилоид у пациентов с диализом, миозит телец включения, отложения 2-амилоида при болезни мышечного истощения, серповидно-клеточную анемию, болезнь Паркинсона и инсулиному островков Лангерганса при диабете типа 2. В настоящем изобретении также предложены меченые соединения формулы I, где один или более чем один атом в этом соединении заменен радиоактивным изотопом. Этот радиоактивный изотоп может представлять собой любой радиоактивный изотоп. Однако предпочтительными являются 3H, 123I, 125I, 131I, 11C и 18F. Специалисты в данной области техники знакомы с методикой, используемой для включения радиоактивного изотопа в соединение. Например, получают соединение формулы I, где один атом углерода представляет собой 11 С или 14 С,и, таким образом, оно является меченым соединением. Соединения по настоящему изобретению можно вводить пациенту при уровнях дозировки в диапазоне от примерно 0,1 до примерно 1000 мг в сутки. Для нормального взрослого человека, имеющего массу тела примерно 70 кг,дозировка в диапазоне от примерно 0,01 до примерно 100 мг на кг массы тела в сутки является достаточной. Однако конкретная применяемая дозировка может варьировать. Например, дозировка может зависеть от ряда факторов, включая потребности пациента, тяжесть состояния, подлежащего лечению, и фармаколо 15 гическую активность соединения, подлежащего применению. Определение оптимальных дозировок для конкретного пациента хорошо известно специалистам в данной области техники. Представленные ниже примеры предназначены для иллюстрации конкретных воплощений изобретения и не предназначены для ограничения каким-либо способом объема описания, включая формулу изобретения. Примеры Соединения формулы I можно получить с помощью путей синтеза, представленных наcхеме 1. Из соответствующим образом замещенного анилина (I) и 5-нитроизобензофуран 1,3-диона (II) или фурана, замещенного аналогичным образом, получают соответствующие фталимиды (III) при нагревании в уксусной кислоте. В стандартных условиях гидрирования,таких как никель Рэнея (Rа-Ni)/ДМФ (диметилформамид), из (III) получают восстановленный фталимид (IV). Восстановлением фталимида(IV) с использованием стандартных восстанавливающих агентов, таких как алюмогидрид лития, получают амин (V). Используя условия реакции Buchwald (J.F. Hartwig, Angew: Chem. Int.Ed. 1998: 37: 2046-2067), (V) можно превратить в (VIII) взаимодействием (V) и различных замещенных метиловых эфиров 2-бромбензойной кислоты (VI) в присутствии карбоната цезия,трис(дибензилиденацетон)дипалладия (0) и (S)(2,2'-бис(ди-паратолилфосфино)-1,1'-бинафтила) (BINAP) (способ А). Кроме того, (VIII) можно также получить взаимодействием (V) с различными замещенными метиловыми эфирами 2 фторбензойной кислоты (VI) в присутствии литийдиметилбис(триметилсилил)амида (LHMDS)(способ Б). Последующим омылением (VIII) в стандартных условиях, таких как водный гидроксид натрия, получают желаемые замещенные изoиндолины формулы I. Кроме того, (V) можно превратить непосредственно в соединение формулы I взаимодействием (V) с 2-фторбензойной кислотой (VII) в присутствии LHMDS. Схема 1(96,56 г, 0,5 моль) в уксусной кислоте (1000 мл) нагревали до флегмообразования в течение 2 ч. После охлаждения осадок отфильтровывали и промывали Н 2 О (1 л), 1 н. NaOH (1,5 л) и Н 2 О(1 л). Полученный в результате осадок растирали с кипящим МеОН, фильтровали и высушивали в вакуумной печи (67 С) в течение 16 ч с получением желтого твердого вещества, 144,0 г(0,40 моль, 80%) желаемого продукта. Точка плавления (т.пл.) 245-247 С. Анализ для С 17 Н 14N2O4: вычислено: С, 56,98; Н, 3,94; N,7,82; обнаружено: С, 56,80; Н, 4,08; N, 7,80. Стадия Б. Получение 5-амино-2-(2,3,4 триметоксифенил)изоиндол-1,3-диона. Образец 5-нитро-2-(2,3,4-триметоксифенил)изоиндол-1,3-диона (89,0 г, 0,25 моль) в ТГФ (1,25 л), МеОН (1,25 л) и ДМФ (100 мл) восстанавливали в присутствии Ra-Ni (12 г) при температуре от 28 до 36 С (Р=7,5 фунт. на кв.дюйм (51,68 кПа. Эту реакционную смесь фильтровали, и фильтрат концентрировали в вакууме и высушивали в вакуумной печи (67 С) в течение 16 ч с получением беловатого твердого вещества, 81,6 г (0,25 моль, 85%) желаемого продукта, т.пл.280 С. Анализ для С 17 Н 16N2 О 5: вычислено: С, 62,09; Н, 4,92; N, 8,52; обнаружено: С, 61,71; Н, 4,94; N, 8,48. Стадия В. Получение 2-(2,3,4-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламина. Раствор АlСl3 (8,12 г, 60,92 ммоль) в ТГФ (200 мл) медленно добавляли к суспензии LiAlH4 (1 М/ТГФ, 183 мл, 182,75 ммоль) в ТГФ (100 мл) при 40 С и оставляли перемешиваться в течение 10 мин. Температуру повышали до 0 С и медленно добавляли порциями суспензию 5-амино-2-(2,3,4 триметоксифенил)изоиндол-1,3-диона (20,0 г, 60,92 ммоль) в ТГФ (500 мл). Эту реакционную смесь перемешивали в течение 3 ч, в то время как температуру повышали до комнатной температуры (кт). Эту смесь снова охлаждали до 0 С и осторожно гасили добавлением 25%-ного NaOH (33 мл), а затем Н 2 О (7,3 мл). Затем эту смесь перемешивали при кт в течение 2 ч, фильтровали через целит, концентрировали и высушивали в вакуумной печи(60 С) в течение 16 ч с получением бледного твердого вещества, 10,8 г (35,96 ммоль, 59%) желаемого продукта,т.пл. 213-215 С. Анализ для С 17 Н 20N2 О 30,14 Н 2 О: вычислено: С, 67,41; Н, 6,75;N, 9,25; обнаружено: С, 67,03; Н, 6,62; N, 8,98. Стадия Г 1. Получение 2-[2-(2,3,4-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты метилового эфира. Смесь 2-(2,3,4-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламина (1,2 г, 4,0 ммоль), 2 17 бромбензойной кислоты метилового эфира (0,72 г,3,3 ммоль), карбоната цезия (1,52 г, 4,7 ммоль),трис(дибензилиденацетон)дипалладия (0) (91 мг,0,1 ммоль) и (S)-(2,2'-бис(ди-паратолилфосфино)1,1'-бинафтила) (98%, (S)-tol-BINAP) (102 мг, 0,15 ммоль) (L/Pd=1,5) в безводном толуоле (30 мл) нагревали до 100 С в течение 24 ч в атмосфере N2. После охлаждения эту реакционную смесь разбавляли диэтиловым эфиром, фильтровали через целит и тщательно промывали диэтиловым эфиром. Фильтрат выпаривали до сухости с получением коричневого остатка. Очисткой флэшхроматографией (силикагель, 10% ЕtOАс/гексан) получили 1,39 г (3,2 ммоль, 80%) желаемого продукта, т.пл. 128-129 С. Анализ для С 25 Н 26N2O5: вычислено: С, 69,11; Н, 6,03; N, 6,45; обнаружено: С,69,39; Н, 5,99; N, 6,13. Стадия Д. Получение 2-[2-(2,3,4-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. Раствор 2-[2-(2,3,4-триметоксифенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты метилового эфира (1,30 г, 2,99 ммоль) и 1 н. NaOH (водн.) (20,0 мл) в ЕtOН (5,0 мл) и ТГФ (20 мл) нагревали до флегмообразования в течение 16 ч. Растворитель удаляли в вакууме. Остаток разбавляли Н 2 О и подкисляли концентрированной HCl до рН 1. Полученный в результате осадок собирали фильтрованием и растирали с кипящей смесью МеОН:Н 2 О (4:1) и высушивали в вакуумной печи в течение 16 ч с получением соединения примера 1, коричневого твердого вещества (0,96 г, 2,28 ммоль, 76%),т.пл. 194-195 С. Анализ для С 24 Н 24N2O5: вычислено: С, 68,56; Н, 5,75; N, 6,66; обнаружено: С,68,19; Н, 5,57; N, 6,47. Пример 2. Получение 5-нитро-2-[2-(3,4,5 триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5 иламино]бензойной кислоты. Смесь 2-(2,3,4-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламина (1,81 г, 6,03 ммоль), 2-бром-5-нитробензойной кислоты метилового эфира (1,49 г, 6,02 ммоль), карбоната цезия (2,75 г, 8,44 ммоль), трис(дибензилиденацетон)дипалладия (0) (166 мг, 0,18 ммоль) и(L/Pd=1,5) в безводном толуоле (30 мл) нагревали до 100 С в течение 48 ч в атмосфере N2. После охлаждения эту реакционную смесь разбавляли диэтиловым эфиром, фильтровали через целит и тщательно промывали диэтиловым эфиром. Фильтрат выпаривали до сухости с получением коричневого остатка (6,3 г). Полученный в результате остаток растворяли в ЕtOН (10 мл) и ТГФ (20 мл), добавляли 5 н. NaOH (водн.)(40 мл) и эту смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удаляли в вакууме. Остаток подкисляли концентрированной HCl до рН 3. Полученный в результате осадок собирали фильтрованием и растирали с кипящей смесью МеОН:Н 2 О (4:1) и высуши 004405 18 вали в вакуумной печи в течение 16 ч с получением соединения примера 2, желтого твердого вещества (1,8 г, 3,87 ммоль, 64%), т.пл.220 С. Анализ для С 24 Н 23N3O70,71 Н 2 О: вычислено: С,60,27; Н, 5,15; N, 8,79; обнаружено: С, 59,88; Н,4,90; N, 8,42. Пример 3. Получение 4-метокси-5-нитро 2-[2-(3,4,5-триметоксифенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензойной кислоты. К охлажденному (-78 С) раствору 2-(2,3,4 триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5 иламина (535 мг, 1,78 ммоль) в ТГФ (15 мл) добавляли по каплям LHMDS (3,56 мл, 1 М в ТГФ,3,56 ммоль). Эту реакционную смесь оставляли перемешиваться при -78 С в течение 10 мин. Добавляли по каплям раствор 2-фтор-4 метокси-5-нитробензойной кислоты метилового эфира (408 г, 1,78 ммоль) в ТГФ (10 мл), и этот раствор перемешивали в течение 30 мин при-78 С. Этой реакционной смеси давали постепенно нагреться до кт и перемешивали в течение 2 ч в атмосфере N2. Эту реакционную смесь разбавляли ЕtOАс и подкисляли 5 н. НСl (рН 3). Органический слой высушивали (Na2SO4),фильтровали и концентрировали в вакууме с получением коричневого остатка. К раствору этого остатка в ЕtOН (20 мл) и ТГФ (40 мл) добавляли 5 н. NaOH (водн., 50 мл), и эту смесь кипятили с обратным холодильником в течение 16 ч. Растворитель удаляли, и остаток подкисляли концентрированной HCl (рН 3). Осадок собирали фильтрованием, растирали с кипящей смесью МеОН:Н 2O (2:1) и высушивали в вакуумной печи в течение 16 ч с получением соединения примера 3, бледного твердого вещества(550 мг, 1,11 ммоль, 62%), т.пл.200 С. Анализ для С 25 Н 25N80,42 Н 2 О: вычислено: С, 59,09; Н,5,18; N, 8,35; обнаружено: С, 59,30; Н, 4,80; N,8,24. Пример 4. Получение 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино] бензойной кислоты. Стадия А. Получение 2-(3,4-дихлорфенил)5-нитроизоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 3,4-дихлорфениламина (48,6 г, 0,3 моль) и 5-нитроизобензофуран-1,3-диона (57,9 г, 0,3 моль) в уксусной кислоте (50 мл), используя методику, описанную в примере 1, стадия А, с получением желтого твердого вещества, 72,6 г(0,8 л) при температуре от 20 до 76 С (Р=9,5 фунт. на кв.дюйм (65,5 кПа, используя мето 19 дику, описанную в примере 1, стадия Б, с получением желтого твердого вещества, 80,0 г (0,26 моль, 81%) желаемого продукта, т.пл. 255257 С. Анализ C14H8N2O2Cl2: вычислено: С,54,74; Н, 2,63; N, 9,12; обнаружено: С, 54,59; Н,2,65; N, 9,57. Стадия Г 1. Получение 2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламина. Соединение, указанное в заголовке, получили из 5-амино-2-(3,4-дихлорфенил)изоиндол 1,3-диона (15,0 г, 0,049 моль), АlСl3 (6,51 г,0,049 моль), LiAlH4 (5,56 г, 0,147 моль) в ТГФ(1000 мл), используя методику, описанную в примере 1, стадия В, с получением желтоватокоричневого твердого вещества, 12,23 г (0,044 моль, 90%) желаемого продукта, т.пл. 207209 С. Анализ C14H12N2Cl2: вычислено: С, 60,23; Н, 4,33; N, 10,03; Обнаружено: С, 59,91; Н, 4,36;N, 9,90. Стадия В. Получение 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино] бензойной кислоты. Соединение, указанное в заголовке, получили из 2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламина (4,04 г, 14,47 ммоль), 2 бромбензойной кислоты метилового эфира (2,59 г, 12,06 ммоль), карбоната цезия (5,50 г, 16,88 ммоль), трис(дибензилиденацетон)дипалладия(0) (331 мг, 0,36 ммоль) и (S)-(2,2'-бис(ди-паратолилфосфино)-1,1'-бинафтила) (98%, (S)-tolBINAP) (368 г, 0,54 ммоль) (L/Pd=1,5) в безводном толуоле (80 мл) и 5 н. NaOH (водн.) (100 мл) в ЕtOН (20 мл) и ТГФ (40 мл), используя методику, описанную в примере 2, с получением коричневого твердого вещества, 3,11 г (7,79 ммоль, 54%) желаемого продукта, т.пл.210 С. Анализ C21H16N2O2Cl2: вычислено: С, 63,17; Н,4,04; N, 7,02; Cl, 17,76; обнаружено: С, 63,31; Н,3,94; N, 6,73; Cl, 17,75. Пример 5. Получение 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5 нитробензойной кислоты. Соединение, указанное в заголовке, получили из 2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол 5-иламина (3,00 г, 10,75 ммоль), 2-бром-5 нитробензойной кислоты метилового эфира (2,67 г,10,75 ммоль), карбоната цезия (4,90 г, 15,04 ммоль),трис(дибензилиденацетон)дипалладия (0) (295 мг,0,32 ммоль) и (S)-(2,2'-бис(ди-паратолилфосфино)1,1'-бинафтила) (98%, (S)-tol-BINAP) (328 г, 0,48 ммоль) (L/Pd=1,5) в безводном толуоле (80 мл) и 5 н. NaOH (водн.) (100 мл) в ЕtOН (40 мл) и ТГФ (100 мл), используя методику, описанную в примере 2, с получением коричневого твердого вещества, 3,64 г 20 Соединение, указанное в заголовке, получили из 2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламина (800 мг, 2,87 ммоль),LHDMS (5,74 мл, 1 М в ТГФ, 5,74 ммоль), 2 фтор-4-метоки-5-нитробензойной кислоты метилового эфира (658 г, 2,87 ммоль) в ТГФ (50 мл) и 5 н. NaOH (водн., 100 мл) в ЕtOН (20 мл) и ТГФ (40 мл), используя методику, описанную в примере 3, с получением коричневого твердого вещества, 1,07 г (2,26 ммоль, 79%) желаемого продукта, т.пл.230 С. Анализ С 22 Н 17N3 О 5 Сl2: вычислено: С, 55,71; Н, 3,61; N, 8,86;oбнаружено: С, 55,43; Н, 3,57; N, 8,80. Пример 7. Получение 2-[2-(3-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. Стадия А. Получение 2-(3-хлорфенил)-5 нитроизоиндол-1,3-диона. Смесь 3-хлоранилина (31,89 г, 0,25 моль) и 5-нитроизобензофуран-1,3-диона (48,28 г, 0,250 моль) в уксусной кислоте (800 мл) нагревали до флегмообразования в течение 4,5 ч (130-140 С). После охлаждения осадок отфильтровывали и промывали водой (650 мл), 1 н. NaOH (330 мл) и водой (500 мл) с получением продукта в виде белого твердого вещества, 61,01 г (0,202 моль,81%), т.пл. 210-212 С. Анализ C14H6N2 О 4Cl2: вычислено: С, 55,56; Н, 2,33; N, 9,26; обнаружено: С, 55,78; Н, 1,69; N, 9,15. Стадия Б. Получение 5-амино-2-(3-хлорфенил)изоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 2-(3-хлорфенил)-5-нитроизоиндол-1,3 диона (60,94 г, 0,20 моль) в ДМФ (1,2 л) и восстанавливали в присутствии Ra-Ni (60 г) при температуре от 22 до 28 С (Р=6,0 фунт. на кв.дюйм (41,34 кПа. Эту реакционную смесь фильтровали, и фильтрат концентрировали в вакууме, а затем высушивали в вакуумной печи(60 С) в течение 18 ч с получением зеленого твердого вещества, 54,31 г (0,20 моль, 99%) желаемого продукта, т.пл. 203-205 С. АнализLiAlH4 (4,17 г, 0,110 моль) в ТГФ (150 мл) при 40 С и оставляли перемешиваться в течение 10 мин. Температуру повышали до 0 С и перемешивали еще в течение 10 мин. Добавляли по каплям раствор 5-амино-2-(3-хлорфенил)изоиндол-1,3-диона (10 г, 0,037 моль) в ТГФ (300 мл). Эту реакционную смесь перемешивали в течение 3 ч, в то время как раствор нагревался до комнатной температуры. Эту реакционную смесь снова охлаждали до 0 С и гасили 30%ным NaOH (20 мл), а затем Н 2 О (40 мл). Этот раствор фильтровали через целит, концентрировали и высушивали в вакуумной печи (60 С) в течение 16 ч с получением продукта в виде(0,021 моль, 58%) желаемого продукта, т.пл. 178-186 С. Анализ C14H12N2Cl20,11 моль H2O: С, 68,16; Н, 5,40; N, 11,36; обнаружено: С, 68,33; Н, 5,46; N, 10,96. Стадия Г 2. Получение 2-[2-(3-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. К 2-(3-хлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламину (3 г, 0,012 моль) в ТГФ (100 мл) добавляли по каплям при -78 С LHDMS(36,78 мл, 1 М в ТГФ, 36,78 ммоль) и оставляли перемешиваться в течение 10 мин при -78 С. Добавляли по каплям 2-фторбензойную кислоту(1,72 г, 0,012 моль) в ТГФ (100 мл) и этот раствор перемешивали в течение 1 ч при -78 С, а затем давали ему постепенно нагреться до комнатной температуры и перемешивали в течение 16 ч. Эту реакционную смесь концентрировали,подкисляли 3 М HCl (100 мл), а затем экстрагировали СН 2 Сl2 (3 х 150 мл). Органический слой высушивали (Na2SO4), фильтровали и концентрировали в вакууме с получением коричневого твердого вещества. Этот продукт растворяли в МеОН (25 мл) и перемешивали при комнатной температуре в течение 10 мин. Добавляли воду,чтобы осадить остаток. Этот продукт отфильтровывали и промывали смесью 1:4 МеОН:Н 2 О(400 мл) с получением коричневого твердого вещества, 1,02 г (2,80 ммоль, 23%) желаемого продукта,т.пл. 209-212 С. Анализ С 22 Н 17N3 О 5 Сl20,29 моль Н 2 О: С, 68,16; Н, 4,79;N, 7,57; обнаружено: С, 67,76; Н, 4,56; N, 7,83. Пример 8. Получение 2-[2-(4-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. Стадия А. Получение 2-(4-хлорфенил)-5 нитроизоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 4-хлорфениламина (19,14 г, 0,150 моль) и 5-нитроизобензофуран-1,3-диона (28,97 г,0,150 моль) в уксусной кислоте (300 мл), используя методику, описанную в примере 1, стадия А, с получением оранжевого твердого вещества, 42,49 г (0,140 моль, 94%) желаемого продукта,т.пл. 198-200 С. Анализ С 14H6N2 О 4 Сl2: вычислено: С, 55,56; Н, 2,33; N,9,26; обнаружено: С, 55,52; Н, 1,74; N, 8,90. Стадия Б. Получение 5-амино-2-(4-хлорфенил)изоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 2-(4-хлорфенил)-5-нитроизоиндол-1,3 диона (41,68 г, 0,138 моль), Ra-Ni (40 г) в ДМФ(1,0 л) при температуре от 20 до 27 С (Р=28,5 фунт. на кв.дюйм (196,4 кПа, используя методику, описанную в примере 1, стадия Б, с получением зеленого твердого вещества, 40,13 г 22 Стадия В. Получение 2-(4-хлорфенил)-2,3 дигидро-1 Н-изоиндол-5-иламина. Соединение, указанное в заголовке, получили из 5-амино-2-(4-хлорфенил)изоиндол-1,3 диона (10,0 г, 0,037 моль), АlСl3 (4,89 г, 0,037 моль), LiAlH4 (4,17 г, 0,110 моль) в ТГФ (650 мл), используя методику, описанную в примере 1, стадия В, с получением коричневого твердого вещества, 6,39 г (0,026 моль, 71%) желаемого продукта, т.пл. 204-210 С. Анализ C14H12N2Cl2: вычислено: С, 68,72; Н, 5,35; N, 11,45; обнаружено: С, 68,54; Н, 5,39; N, 11,16. Стадия Г 2. Получение 2-[2-(4-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. Соединение, указанное в заголовке, получили из 2-(4-хлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламина (3 г, 0,012 моль), LHDMS(36,78 мл, 1 М в ТГФ, 36,78 ммоль), 2 фторбензойной кислоты (1,72 г, 0,012 моль) в ТГФ (200 мл), используя методику, описанную в примере 1, стадия Г 2, с получением коричневого твердого вещества, 1,26 г (0,003 моль, 28%) желаемого продукта, т.пл. 210-212 С. АнализN, 7,64; обнаружено: С, 68,39; Н, 4,47; N, 7,76. Пример 9. Получение 2-[2-(3,4-диметилфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойной кислоты. Стадия А. Получение 2-(3,4-диметилфенил)-5-нитроизоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 3,4-диметиланилина (30,30 г, 0,250 моль) и 5-нитроизобензофуран-1,3-диона (48,28 г, 0,250 моль) в уксусной кислоте (500 мл), используя методику, описанную в примере 7, стадия А, с получением желтого твердого вещества, 63,37 г (0,234 моль, 94%) желаемого продукта, т.пл. 173-174 С. Анализ C14H6N2O4Cl2: вычислено: С, 64,86; Н, 4,08; N, 9,45; обнаружено: С, 64,87; Н, 3,74; N, 9,39. Стадия Б. Получение 5-амино-2-(3,4-диметилфенил)изоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 2-(3,4-диметилфенил)-5-нитроизоиндол 1,3-диона (63,37 г, 0,213 моль), Ra-Ni (50 г) в ДМФ (1,0 л), МеОН (500 мл) при температуре от 22 до 32 С (Р=4,8 фунт. на кв.дюйм (33,1 кПа, используя методику, описанную в примере 7, стадия Б, с получением коричневого твердого вещества, 57,67 г (0,217 моль, 100%) желаемого продукта, т.пл. 215-218 С. Анализ С 14 Н 8N2 О 2Cl20,06 моль Н 2 О: С, 71,87; Н, 5,32; 23 примере 7, стадия В, с получением светлокоричневого твердого вещества, 4,69 г (0,020 моль, 70%) желаемого продукта, т.пл. 152155 С. Анализ С 14 Н 12N2 Сl20,09 моль Н 2 О: С,80,09; Н, 7,64; N, 11,67; обнаружено: С, 79,72; Н, 7,45; N, 11,49. Стадия Г 2. Получение 2-[2-(3,4-диметилфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино] бензойной кислоты. Соединение, указанное в заголовке, получили из 2-(3,4-диметилфенил)-2,3-дигидро-1 Низоиндол-5-иламина (4 г, 0,017 моль), LHDMS(50,34 мл, 1 М в ТГФ, 50,34 ммоль), 2 фторбензойной кислоты (2,35 г, 0,017 моль) в ТГФ (200 мл), используя методику, описанную в примере 7, стадия Г 2, с получением коричневого твердого вещества, 2,95 г (0,008 моль, 49%) желаемого продукта, т.пл. 198-202 С. Анализ С 22H17N3 О 5 Сl20,52 моль H2O: С, 75,11; Н, 6,31;(500 мл), используя методику, описанную в примере 7, стадия А, с получением беловатого твердого вещества, 84,4 г (0,222 моль, 90%) желаемого продукта, т.пл. 165-168 С. Анализ С 14 Н 6N2 О 4Cl2: вычислено: С, 48,61; Н, 1,63; N,7,56; обнаружено: С, 48,50; Н, 1,29; N, 7,37. Стадия Б. Получение 5-амино-2-(4-хлор-3 трифторметилфенил)изоиндол-1,3-диона. Соединение, указанное в заголовке, получили из 2-(4-хлор-3-трифторметилфенил)-5 нитроизоиндол-1,3-диона (55,88 г, 0,150 моль),Ra-Ni (11,5 г) в ДМФ (1,0 л) при 27 С (Р=4,5 фунт. на кв.дюйм (31,01 кПа, используя методику, описанную в примере 7, стадия Б, с получением желтого твердого вещества, 56,60 г(0,166 моль, 100%) желаемого продукта, т.пл. 198-201 С. Анализ C14H8N2O2Cl20,42 моль Н 2 О: С, 51,73; Н, 2,56; N, 8,04; Обнаружено: С, 52,12; Н, 2,70; N, 7,62. Стадия В. Получение 2-(4-хлор-3-трифторметилфенил)-2,3-дигидро-1 Н-изоиндол-5 иламина. Соединение, указанное в заголовке, получили из 5-амино-2-(4-хлор-3-трифторметилфенил)изоиндол-1,3-диона (7,5 г, 0,022 моль),АlСl3 (2,94 г, 0,022 моль), LiAlH4 (2,51 г, 0,066 моль) в ТГФ (700 мл), используя методику, описанную в примере 7, стадия В, с получением желтого твердого вещества, 5,78 г (0,018 моль,84%) желаемого продукта, т.пл. 148-151 С. Анализ C14H12N2Cl20,26 моль Н 2 О: С, 56,76; Н, 004405 24 3,98; N, 8,83; обнаружено: С, 56,42; Н, 3,79; N,8,43. Стадия Г 2. Получение 2-[2-(4-хлор-3-трифторметилфенил)-2,3-дигидро-1 Н-изоиндол-5 иламино]бензойной кислоты. Соединение, указанное в заголовке, получили из 2-(4-хлор-3-трифторметилфенил)-2,3 дигидро-1 Н-изоиндол-5-иламина (1,75 г, 0,006 моль), LHDMS (16,80 мл, 1 М в ТГФ, 16,80 ммоль), 2-фторбензойной кислоты (0,79 г, 0,006 моль) в ТГФ (200 мл), используя методику, описанную в примере 7, стадия Г 2, с получением коричневого твердого вещества, 0,690 г (0,002 моль, 28%) желаемого продукта, т.пл. 229233 С. Анализ C22H17N3O5Cl20,47 моль Н 2 О: С,59,88; Н, 3,87; N, 6,35; обнаружено: С, 59,48; Н,3,81; N, 6,60. Пример 11. Получение 2-[2-(3-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойной кислоты. Стадия Г 2. Получение 2-[2-(3-хлорфенил)2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойной кислоты. К 2-(3-хлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламину из примера 7, стадия В (2 г, 0,008 моль) в ТГФ (100 мл) добавляли по каплям при-78 С LHDMS (24,51 мл, 1 М в ТГФ, 24,15 ммоль) и оставляли перемешиваться в течение 10 мин при -78 С. Добавляли по каплям 2-фтор 5-нитробензойную кислоту (1,51 г, 0,008 моль) в ТГФ (100 мл) и этот раствор перемешивали в течение 1 ч при -78 С, постепенно нагревали до комнатной температуры и перемешивали в течение 16 ч. Эту реакционную смесь концентрировали и подкисляли 3 М HCl (100 мл). Полученное в результате твердое вещество отфильтровывали и промывали 10%-ной HCl, а затем высушивали в вакууме с получением коричневого твердого вещества. Этот продукт перекристаллизовывали, используя МеОН и воду, с получением коричневого твердого вещества, 0,250 г (0,0006 ммоль, 7,5%) желаемого продукта,т.пл.: цвет меняет при 130 С, не плавилось при 260 С. Анализ С 21H16N3 Сl0,24 моль Н 2 О: С,60,90; Н, 4,01; N, 10,15; обнаружено: С, 60,91; Н, 4,01; N, 9,75. Следующие соединения получили общими способами, описанными в приведенных выше примерах. Пример 12. 2-[2-(3,4-Диметилфенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота. Т.пл.280 С. Аналитич. вычислено для С 23 Н 21N3O4: С, 68,26; Н, 5,27; N, 10,38; обнаружено: С, 67,87; Н, 5,17; N, 10,29. Пример 13. 2-(2-Фенил-2,3-дигидро-1 Низоиндол-5-иламино)бензойная кислота. Т.пл. 220-224 С. Аналитич. вычислено для[2-(3,4-Дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-ил]-[2-(1 Н-тетразол-5-ил)фенил]амин синтезировали, как описано в примере 4, используя фторпроизводное тетразола, которое синтезировали из коммерчески доступных 2 фторбензонитрила и азида натрия в стандартных условиях реакции. Т.пл. 203-208 С, МС 423(М-). Пример 17. 5-Амино-2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойную кислоту получили взаимодействием нитропроизводного из примера 5 с газообразным водородом в присутствии никеля Рэнея. Т.пл. 242244 С. Аналитич. вычислено для С 21 Н 17 Сl2N3: теория: С, 60,08; Н, 4,43; N, 9,79; обнаружено: С, 60,44; Н, 4,22; N, 9,40. Пример 18. 5-Нитро-2-(2-фенил-2,3-дигидро-1 Н-изоиндол-5-иламино)бензойная кислота. Т.пл.265 С. Аналитич. вычислено для С 21H17N3O4: С, 67,19; Н, 4,56; N, 11,19; обнаружено: С, 66,98; Н, 4,30; N, 10,86. Пример 19. 2-[2-(4-Хлор-3-трифторметилфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5 нитробензойная кислота. Т.пл.260 С. Аналитич. вычислено для С 22 Н 15 СlF3: С, 51,55; Н, 3,71; N, 8,20; обнаружено: С, 51,15; Н, 3,41; N, 8,17. Пример 20. 2-[2-(3-Фторфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота. Т.пл.265 С, МС 392 (М+). Пример 21. 2-[2-(3-Метоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота. Т.пл.290 С. Аналитич. вычислено для С 22 Н 19N3 О 5: С, 64,52; Н, 4,91; N, 10,12; обнаружено: С, 64,84; Н, 4,90; N, 9,72. Пример 22. 2-[2-(3-Фторфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойная кислота. МС 349 (М+). Аналитич. вычислено для 26 Т.пл. 213-225 С. Аналитич. вычислено для С 20 Н 15 Сl2N3: С, 59.80; Н, 3,80; N, 10,46; обнаружено: С, 59,41; Н, 3,82; N, 10,21. Пример 25. 2-[2-(3,4,5-Триметоксифенил)2,3-дигидро-1 Н-изоиндол-5-иламино]бензонитрил. Т.пл. 129-131 С. Аналитич. вычислено для С 24 Н 23N3 О 3: С, 71,80; Н, 5,77; N, 10,47; обнаружено: С, 72,09; Н, 5,64; N, 10,23. Пример 26. 2-[2-(3-Метоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойная кислота. Т.пл. 206-211 С. Соединения по изобретению формулы I можно также получить, используя комбинаторную методологию. Эта методика дает возможность быстрого синтеза многих аналогов, охватываемых формулой I, в небольших количествах для целей тестирования, а затем наиболее сильнодействующие соединения можно синтезировать в больших количествах общепринятыми способами. Типичную комбинаторную синтетическую методику для соединений формулыII, например, осуществляют путем взаимодействия галогенозамещенных эфиров бензоатов с аминоизоиндолом с образованием соответствующего ариламиноизоиндола с последующим омылением до карбоновой кислоты формулы I(например, где Y представляет собой группировку бензойной кислоты). Эти реакции проводят в масштабе 0,15 ммоль следующим образом. Растворы каждого галогенобензоатного реагента (0,18 М) в толуоле помещают в реакционные флаконы на 2 драхмы. Каждый аминоизоиндольный реагент растворяют в безводном толуоле с получением 0,15 М растворов. Для добавления 1 мл (0,15 ммоль, 1 экв.) каждого галогенобензоатного раствора в соответствующие флаконы, содержащие 1 мл (0,18 ммоль, 1,2 экв.) аминоизоиндольных реагентов, используют пипетку Distriman. Катализаторный раствор готовят растворением 0,025 М Рd2(dbа)3 (дипалладий-тридибензилиденацетон) и 0,075 М BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтил) в толуоле, и 0,25 мл этого катализаторного раствора добавляют в каждый реакционный флакон. Основание, как правило, карбонат цезия (68 мг, 0,21 ммоль, 1,40 экв.) добавляют в каждый реакционный флакон, и эти флаконы закрывают крышками, помещают в карусельную печь и нагревают при 100 С в течение 48 ч. Затем эти реакционные смеси охлаждают и реакционные растворители удаляют выпариванием. Твердый остаток суспендируют в 400 мкл этилацетата и фильтруют, чтобы удалить весь катализатор. Фильтраты концентрируют до сухости выпариванием с получением соединений формулы I,где часть, представляющая собой бензойную кислоту, эстерифицирована (например, бензиловый или метиловый эфир). Эти эфиры растворяют в 500 мкл смеси ТГФ/этанол (1:1 об./об.), в которую добавлено 300 мкл 5 М гид 27 роксида натрия. Эти растворы встряхивают в течение 5 ч при 60 С, а затем охлаждают и концентрируют до сухости выпариванием растворителей с получением желаемых соединений формулы I. Следующие соединения можно также получить в соответствии с методиками, изложенными выше: 2-(2-фенил-2,3-дигидро-1 Н-изоиндол-5-иламино)бензойная кислота; 5-нитро-2-(2-фенил-2,3-дигидро-1 Н-изоиндол-5-иламино)бензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензонитрил; 29 2-[2-(3,4-дигидроксифенил)-2,3-дигидро 1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(3,4-дифторфенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензойная кислота; 2-[2-(3-фтор-4-метилфенил)-2,3-дигидро 1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(3,4,5-тригидроксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(4-метил-3-трифторметилфенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(3,5-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензойная кислота; 2-[2-(2,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензойная кислота или 2-[2-(4-фтор-3-трифторметилфенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]бензойная кислота. Соединения формулы I оценены в стандартных in vitro и in vivo анализах, обычно используемых специалистами в исследованиях амилоида для оценки соединений, находящих применение в предупреждении образования амилоидного белка и его агрегации и в определении их потенциальной полезности в лечении заболеваний, связанных с амилоидом, таких как болезнь Альцгеймера. Следующие анализы разработаны для предсказаний клинической полезности. Биологические примеры Анализы амилоида.Radioassay) Анализ на ингибиторы роста самоагрегируемых амилоидных фибрилл. Материалы: Исходные концентрированные растворы Буфер для анализа - 50 мМ фосфат натрия,рН 7,5, 100 мМ NaCl, 0,02% NaN3, 1 М мочевина(фильтруют и хранят при 4 С). Растворимый А(1-40) пептид (Bachem,Torrance, CA) - 2,2 мг/мл в деионизированной Н 2 О (хранят в аликвотах при -20 С, при оттаивании держат на льду) самоагрегирует после 1 недели хранения. Обычно этот раствор следует хранить, пока в анализе не наблюдается лагфаза. А(1-40), меченый 125I - 150 К-350 К имп/мин/мкл в смеси 100% ацетонитрил - 0,1% трифторуксусная кислота (ТФУ) - 1% меркаптоэтанол (аликвоты хранят при -20 С). А(1-40), меченый 125I, можно изготовить в соответствии с методикой, изложенной Н. LeVine, III в Neurobiol. Aging, 16: 755 (1995), которая включена здесь путем ссылки, либо этот реагент можно покупать у Amersham, ArlingtonHeights, Illinois. Конечные условия анализа: 30 мкМ растворимого А(1-40) в деионизированной воде в буфере для анализа + 20-50 К имп/мин А(1-40), 004405 30 меченого 125I, на анализ. Соединение, которое нужно тестировать, растворяют в диметилсульфоксиде (ДМСО), обычно 5-50 мМ исходный концентрированный раствор, так что конечная концентрация ДМСО в анализе составляет менее 1% об./об. Анализ: Реакционная смесь на 50 анализов(на льду) состоит из 0,1-0,2 мкл А, меченого 125I,A(1-40), меченого 125I + 1 мкл растворимого А(1-40) + 13,5 мкл буфера для анализа на анализ. Далее представлены количества компонентов реакционной смеси, достаточные на 50 лунок для анализа. 5-10 мкл высушенного А(1-40), меченого 125I 675 мкл буфера для анализа 50 мкл растворимого А(1-40) Метод анализа 1) Готовят вышеуказанную реакционную смесь путем смешивания компонентов и хранения на льду. 2) Вносят пипеткой по 14,5 мкл реакционной смеси в каждую из 50 лунок на полипропиленовом 96-луночном титрационном микропланшете с U-образными лунками (Costar 3794) на льду. 3) Добавляют 1,7 мкл разбавленного соединения, которое нужно тестировать, в каждую лунку в колонке из 8 лунок, включая контрольрастворитель. Серийные 3-кратные разведения из 1 мМ (конечное 100 мкМ) в буфере для анализа - мочевине = 7 разведений + ноль. В каждом 96-луночном планшете, таким образом,можно разместить 11 образцов + 1 контроль Конго красный (конечная концентрация 0,039-5 мкМ в 2-кратных стадиях). 4) Планшет герметично закрывают алюминиевой пленкой (Beckman 538619) и инкубируют в течение 10 мин на льду. 5) Повышают температуру до 37 С и инкубируют от 3 до 5 ч (в зависимости от партии пептида). 6) Удаляют алюминиевую пленку и добавляют 200 мкл/лунку охлажденного во льду буфера для анализа с мочевиной, собирая фибриллы с радиоактивной меткой вакуумфильтрацией через фильтры GVWP с размером пор 0,2 мкм в 96-луночных планшетах (MilliporeMAGV N22, Bedford, MA). Определяют радиоактивность фильтров, используя стандартные способы, хорошо известные специалистам в данной области техники.BASST (самоагрегация бета-амилоида ТиофлавинТ. Beta-Amyloid Self-Seeding, ThioflavinT) Анализ на ингибиторы роста самоагрегирующих амилоидных фибрилл. Материалы: Исходные концентрированные растворы Буфер для анализа - 50 мМ фосфат натрия,рН 7,5, 100 мМ NaCl, 0,02% NаN3, 1 М мочевина-20 С, при оттаивании держат на льду) будет претерпевать самоагрегацию после 1 недели хранения. Обычно этот раствор следует хранить, пока в анализе не наблюдается лаг-фаза. Конечные условия анализа: 30 мкМ растворимого А(1-40) в деионизированной воде в буфере для анализа. Соединение, которое нужно тестировать, растворяют в ДМСО, обычно 5-50 мМ исходный концентрированный раствор, так что конечная концентрация ДМСО в анализе составляет менее 1% об./об. Анализ: Реакционная смесь на 50 анализов(на льду) состоит из 1 мкл растворимого А(140) + 13,5 мкл буфера для анализа на анализ. Далее представлены количества компонентов реакционной смеси, которые получаются в результате в каждой из 50 лунок для анализа. 50 мкл растворимого А(1-40) 675 мкл буфера для анализа Метод анализа 1) Готовят вышеуказанную реакционную смесь путем смешивания компонентов и хранения на льду. 2) Вносят пипеткой 14,5 мкл реакционной смеси в каждую из 50 лунок на полистирольном 96-луночном титрационном микропланшете с Uобразными лунками (Corning 25881-96) на льду. 3) Добавляют 1,7 мкл разбавленного соединения, которое нужно тестировать, в каждую лунку в колонке из 8 лунок, включая контрольрастворитель. Серийные 3-кратные разведения из 1 мМ (конечное 100 мкМ) в буфере для анализа - мочевине = 7 разведений + ноль. В каждом 96-луночном планшете, таким образом,можно разместить 11 образцов + 1 контроль Конго красный (конечная концентрация 0,039-5 мкМ в 2-кратных стадиях). 4) Планшет герметично закрывают алюминиевой пленкой и инкубируют в течение 10 мин на льду. 5) Повышают температуру до 37 С и инкубируют от 3 до 5 ч (в зависимости от партии пептида). 6) Удаляют алюминиевую пленку и добавляют 250 мкл/лунку 5 мкМ тиофлавина Т (ТhТ)[T-3516, Sigma-Aldrich] в 50 мМ глицине-NaOH,рН 8,5. Считывают флуоресценцию на считывающем устройстве для планшетов (экстинкция= 440 нм/20 нм; эмиссия = 485 нм/20 нм) в течение 5 мин. ВАРА (агрегация бета-амилоидного пептида, Beta-Amyloid Peptide Aggregation) Данный анализ используют, чтобы определить степень ингибирования соединением агрегационного поведения бета-амилоидного пептида. Целью данного анализа является обеспечение высокообъемного метода анализа количества агрегации бета-амилоида с использованием 32 граничного анализа, основанного на фильтрации. В данном анализе используют гексафторизопропанол (ГФИП), чтобы разрушить исходный амилоидный пептид до мономерного состояния, и используют концентрацию 33 мкМ,которая является достаточно высокой для того,чтобы агрегация произошла при рН 6,0 в течение нескольких часов. Методы Агрегация -амилоидного пептида, рН 6,0(ВАРА). В 96-луночный планшет (Costar 3794) авторы изобретения добавляют 25 мкл 50 мМ фосфатного буфера, рН 6,0, 10 мкл 0,5 мг/мл пептида А(1-40) в 20% ГФИП +0,1 мкл/анализ меченого радиоактивным иодом 125I А(1-40)[125I А(1-40)] и 1 мкл соединения, которое нужно тестировать, начиная с 50 мМ с концентрацией ДМСО менее 1%. Затем авторы изобретения инкубируют планшеты от 2 до 4 ч при комнатной температуре. Реакцию останавливают 200 мкл 50 мМ фосфатного буфера, рН 6,0, и фильтруют реакционную смесь через 0,2 мкм 96-луночный фильтровальный планшет (Millipore MAGU N22). Авторы изобретения промывают фильтровальный планшет 100 мкл того же фосфатного буфера. Агрегацию определяли на счетчике Microbeta после пропитывания фильтров Meltilex (1450-441) и проводили коррекцию по отношению к фону.BATYM анализ Методы Необходимый А(1-42) (California Peptide) высушивали из его исходного концентрированного раствора в гексафторизопропаноле(ГФИП). Этот А(1-42) растворяли в диметилсульфоксиде (ДМСО), а затем смешивали с забуференным фосфатом физиологическим раствором (ЗФР) (рН 7,4). Этот смешанный раствор А(1-42) фильтровали через мембранный шприцевый фильтр 0,2 мкм Omnipore (Millipore,Bedford, MA). Соединение, которое нужно тестировать, в ДМСО (50-кратный концентрат) наносили в каждую лунку (0,5 мкл/лунку) 96 луночного планшета. Раствор А(1-42) добавляли в каждую лунку (24,5 мкл/лунку). Планшет центрифугировали при 1000 g в течение 5 мин и инкубировали при 37 С в течение 1 суток (A142; конечная концентрация 100 мкМ). После инкубации в каждую лунку добавляли раствор Тиофлавина Т (ThT) в буфере глицин-NaOH (рН 8,5, 50 мМ) (250 мкл/лунку),измеряли флуоресценцию (экстинкция 440/20 нм; эмиссия 485/20 нм), используя считывающее устройство флуоресценции для планшетов. Ингибиторную активность вычисляли как снижение флуоресценции по следующей формуле: Ингибирование (%)=(F(A)-F(A+соединение)/F(А)-F(растворитель+соединение)х 100 Концентрации IC50 (концентрация тестируемого соединения, необходимая, чтобы вы 33 звать 50% ингибирование агрегации) вычисляли с помощью программы аппроксимации кривых,используя следующее уравнение. Данные были получены из двух различных экспериментов в трех повторах. Ингибирование (х)=100-100/1+(х/IC50)n,х = концентрация тестируемого соединения (М),IC50 = (М),n = коэффициент Хилла (Hill). Репрезентативные соединения формулы I проявили ингибиторные активности (IC50), находящиеся в диапазоне от примерно 1 мкМ до более чем 100 мкМ в вышеописанных анализах. Результаты этих анализов для конкретных репрезентативных соединений по настоящему изобретению показаны в приведенной ниже таблице. Ингибиторная активность по отношению к амилоиду Пример Буква в круглых скобках после конкретного значения указывает партию тестируемого соединения. Например, 10 (Р) указывает на то,что тестируемое соединение было из партии Р. Если партия не указана, партией соединения была партия Р. Р, Q, R, S и Т представляют собой различные партии соединения. 34 Соединения по изобретению также проявили хорошую активность в стандартных invivo анализах, обычно используемых для оценки агентов на их способность лечить заболевания, связанные с агрегацией амилоидных белков, особенно болезнь Альцгеймера и другие амилоидозы. В одном из анализов амилоидный белок индуцируют в селезенке мышей путем подкожных инъекций нитрата серебра, полного адъюванта Фрейнда и внутривенной инъекции фактора, усиливающего амилоид. Нитрат серебра вводят каждые сутки вплоть до суток 11. Тестируемые соединения вводят мышам ежесуточно, начиная с суток 1 вплоть до суток 11. На сутки 12 животных умерщвляют и извлекают селезенки, готовят гистологические препараты,окрашивают Конго красным и под микроскопом количественно анализируют процент площади селезенки, занятой двоякопреломляющим окрашенным Конго красным амилоидом. В другом in vivo анализе, в котором оценивали соединения по изобретению, используют трансгенных мышей. Эти мыши несут трансген белка-предшественника -амилоида человека с находящимся перед ним промотором, как описано Hsiao et al., "Correlative memoryTransgenic Mice", Science, 1966: 274: 99-102. У этих трансгенных мышей развиваются отложения -амилоида примерно к 9-месячному возрасту. К 15 месяцам диффузные и компактные сенильные бляшки являются обильными, прежде всего в новой коре головного мозга, обонятельной луковице и гиппокампе. Соединения по изобретению вводят мышам перорально, начиная с 8-месячного возраста (непосредственно перед началом амилоидных отложений) и продолжая в течение нескольких месяцев (вплоть до примерно 14-18-месячного возраста). Затем этих животных умерщвляют и извлекают головной мозг. Количество амилоида в головном мозге определяют количественно как гистологическим, так и биохимическим путем. Приведенные выше данные устанавливают, что репрезентативные соединения по изобретению являются активными в стандартных анализах, используемых для измерения ингибирования агрегации белков. Соединения проявляют отличную специфичность, например, как показано в BASST анализе, а также в BATYM и ВАРА анализах. Эти соединения, таким образом, являются полезными для клинического ингибирования агрегации амилоидных белков и для визуализации амилоидных отложений для диагностического применения. Эти соединения будут применять в форме фармацевтических препаратов, и следующие примеры иллюстрируют типичные композиции. Пример 27. Препарат в форме таблеток. Ингредиент Количество Соединение примера 1 50 мг 35 Лактоза Кукурузный крахмал (для смеси) Кукурузный крахмал (для пасты) Стеарат магния (1%) Соединение примера 1 смешивают с лактозой и кукурузным крахмалом (для смеси) и перемешивают до однородности до порошка. Кукурузный крахмал (для пасты) суспендируют в 6 мл воды и нагревают при перемешивании до образования пасты. Эту пасту добавляют к смешанному порошку и эту смесь гранулируют. Влажные гранулы пропускают через твердое сито 8 и высушивают при 50 С. Эту смесь смазывают 1% стеарата магния и прессуют в таблетку. Эти таблетки вводят пациенту в дозировке от 1 до 4 каждые сутки для предупреждения агрегации амилоидных белков и лечения болезни Альцгеймера. Пример 28. Парентеральный раствор. В раствор 700 мл пропиленгликоля и 200 мл воды для инъекций добавляют 20,0 г соединения 9. Эту смесь перемешивают и доводят рН до 5,5 соляной кислотой. Объем доводят до 1000 мл водой для инъекций. Этот раствор стерилизуют, заполняют им ампулы на 5,0 мл, каждая из которых содержит 2,0 мл (40 мг соединения 8) и запаивают их в атмосфере азота. Этот раствор вводят путем инъекции пациенту,страдающему медуллярной карциномой щитовидной железы и нуждающемуся в лечении. Пример 29. Препарат в форме пластыря. 10 мг 2-4-[3-(3,4-дихлорфенил)пропил]фениламинобензойной кислоты смешивают с 1 мл пропиленгликоля и 2 мкг полимерного клея на основе акрила, содержащего смолистый поперечно сшивающий агент. Эту смесь наносят на непроницаемую подложку (30 см 2) и накладывают на верхнюю часть спины пациента для лечения амилоидной полиневропатии путем пролонгированного высвобождения. Изобретение, а также способ и процесс его реализации и применения теперь описаны в таких полных, ясных, сжатых и точных выражениях, чтобы дать возможность любому специалисту в области техники, к которой оно относится, получать и применять его таким же образом. Следует понимать, что в вышеизложенном описаны предпочтительные воплощения настоящего изобретения, и что можно делать в нем модификации, не отдаляясь от сущности или объема настоящего изобретения, как они изложены в формуле изобретения. Чтобы конкретно подчеркнуть и точно заявить сущность объекта изобретения, следующая формула изобретения является выводом из данного описания. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения, имеющие формулу I или их фармацевтически приемлемые соли,где Х представляет собой фенил или замещенный фенил;Y представляет собой фенил, замещенный фенил, пиридил или замещенный пиридил; где замещенный фенил и замещенный пиридил могут иметь от 1 до 4 заместителей, каждый из которых независимо выбран из -ОС 1 С 12 алкила, галогена, -C1-С 6 алкила, фенила,R1 и R2 независимо представляют собой водород или C1-С 6 алкил; и каждый n независимо равен числу от 0 до 5 включительно; или их фармацевтически приемлемые соли,где Х представляет собой фенил или замещенный фенил,причем когда Х представляет собой замещенный фенил, тогда этот замещенный фенил имеет от 1 до 4 заместителей, независимо выбранных из -OC1-С 6 алкила, галогена, C1 С 6 алкила, -СF3 или фенила;Y представляет собой фенил или замещенный фенил, причем когда Y представляет собой замещенный фенил, тогда этот замещенный фенил имеет от 1 до 4 заместителей, независимо выбранных из -СO2 Н, -NO2, -ОС 1-С 12 алкила,-CN, -СF3, -(CH2)nCO2H, -SO2NR1R2, тетразола,-(CH2)n-тетразола,имидазола,-(CH2)nимидазола, -СН=СН-тетразола или -СН=СНимидазола;R1 и R2 независимо представляют собой водород или C1-С 6 алкил; и каждый n независимо равен числу от 0 до 5 включительно. 3. Соединения по п.1 2-[2-(2,3,4-триметоксифенил)-2,3-дигидро 1 Н-изоиндол-5-иламино]бензойная кислота; 5-нитро-2-[2-(3,4,5-триметоксифенил)-2,3 дигидро-1 Н-изоиндол-5-иламино]бензойная кислота; 4-метокси-5-нитро-2-[2-(3,4,5-триметоксифенил)-2,3-дигидро-1 Н-изоиндол-5-иламино] бензойная кислота; 38 2-[2-(3-фторфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]-5-нитробензойная кислота; 2-[2-(3-метоксифенил)-2,3-дигидро-1 Низоиндол-5-иламино]-5-нитробензойная кислота; 2-[2-(3-фторфенил)-2,3-дигидро-1 Н-изоиндол-5-иламино]бензойная кислота; 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]-5-фторбензойная кислота и 2-[2-(3,4-дихлорфенил)-2,3-дигидро-1 Низоиндол-5-иламино]никотиновая кислота. 5. Соединения по п.1: 2-[2-(3,4,5-триметоксифенил)-2,3-дигидро 1 Н-изоиндол-5-иламино]бензонитрил или 2-[2-(3-метоксифенил)-2,3-дигидро-1 Низоиндол-5-иламино]бензойная кислота. 6. Фармацевтическая композиция, содержащая соединение по п.1 вместе с фармацевтически приемлемым носителем, разбавителем или эксципиентом для него. 7. Применение соединения по п.1 для изготовления лекарственного средства для лечения болезни Альцгеймера. 8. Применение соединения по п.1 для изготовления лекарственного средства для ингибирования агрегации амилоидных белков с образованием амилоидных отложений. 9. Способ визуализации амилоидных отложений, включающий в себя стадии, на которых а) пациенту вводят детектируемое количество меченого соединения по п.1; б) предоставляют достаточно времени для того, чтобы меченое соединение связалось с амилоидными отложениями; и в) детектируют меченое соединение, связанное с амилоидными отложениями.
МПК / Метки
МПК: A61K 31/4035, C07D 209/44, A61P 43/00
Метки: отложений, агрегации, амилоидных, использованием, производных, изоиндолина, белков, способ, ингибирования, визуализации
Код ссылки
<a href="https://eas.patents.su/20-4405-sposob-ingibirovaniya-agregacii-amiloidnyh-belkov-i-vizualizacii-amiloidnyh-otlozhenijj-s-ispolzovaniem-proizvodnyh-izoindolina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ ингибирования агрегации амилоидных белков и визуализации амилоидных отложений с использованием производных изоиндолина</a>












