Содержащие серу липиды для применения в качестве пищевой добавки или в качестве лекарственного средства
Номер патента: 22593
Опубликовано: 29.01.2016
Авторы: Хольмеиде Анне Кристин, Ховланд Рагнар, Брендванг Мортен
Формула / Реферат
1. Липидное соединение формулы (I)
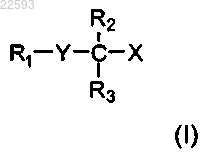
где R1 выбран из С10-С22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С10-С22 алкинильной группы, имеющей 1-6 тройных связей;
R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из атома водорода, метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -OCH2CH2OCH3 и фенильной группы, при условии, что R2 и R3 не могут быть оба атомами водорода, или
R2 и R3 могут быть соединены так, чтобы образовывать С3-С6 циклоалкил;
Y выбран из серы, сульфоксида и сульфона;
X представляет собой карбоновую кислоту или ее производное, где производное представлено в форме моноглицерида, диглицерида, триглицерида, фосфолипида, карбонового сложного эфира или карбоксамида;
или его фармацевтически приемлемая соль,
или его диастереомеры, рацематы, энантиомеры или их смеси;
при условии, что соединение формулы (I) не представляет собой 2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановую кислоту.
2. Липидное соединение по п.1, где циклоалкил выбран из циклопропила, циклобутила, циклопентила или циклогексила.
3. Липидное соединение по п.1, где R2 и R3 независимо выбраны из атома водорода, метильной группы, этильной группы, метоксигруппы или этоксигруппы.
4. Липидное соединение по п.1, где R2 и R3 независимо выбраны из атома водорода, этильной группы, метоксигруппы, этоксигруппы или фенильной группы; или R2 и R3 соединены с образованием циклобутильной группы.
5. Липидное соединение по п.1, где один из R2 и R3 представляет собой атом водорода и другой выбран из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, OCH2CF3, -OCH2CH2OCH3 и фенильной группы.
6. Липидное соединение по п.1, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, OCH2CF3, -OCH2CH2OCH3 и фенильной группы.
7. Липидное соединение по п.6, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила или н-гексила.
8. Липидное соединение по п.7, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила или изопропила.
9. Липидное соединение по п.7, где R2 и R3 представляют собой этильные группы.
10. Липидное соединение по любому из пп.1-9, где R1 означает С10-С22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации.
11. Липидное соединение по п.10, где указанное липидное соединение получено из полиненасыщенной жирной кислоты.
12. Липидное соединение по п.1, где R1 означает C14-C22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации, и имеющую первую двойную связь при третьей углерод-углеродной связи от омега (w) конца углеродной цепи.
13. Липидное соединение по п.12, где R1 означает C14-C22 алкенильную группу с 5-6 двойными связями.
14. Липидное соединение по п.1, где R1 означает С10-С22 алкинильную группу, указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей.
15. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой серу.
16. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой сульфоксид.
17. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой сульфон.
18. Липидное соединение по любому из предшествующих пунктов, где X представляет собой карбоновую кислоту или ее производное в форме моноглицерида, диглицерида, триглицерида, фосфолипида или эфира карбоновой кислоты.
19. Липидное соединение по любому из пп.1-18, где X представляет собой карбоновую кислоту или эфир карбоновой кислоты.
20. Липидное соединение по п.18 или 19, где X представляет собой карбоновую кислоту.
21. Липидное соединение по п.1, где
R2 и R3 являются одинаковыми или разными и выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -ОСН2СН2ОСН3, и фенильной группы, и
X представляет собой карбоновую кислоту.
22. Липидное соединение по п.21, где R2 и R3 представляют группы, выбранные из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила.
23. Липидное соединение по п.1, где указанная соль указанного липидного соединения содержит одновалентный катион, двухвалентный катион или поливалентный катион.
24. Липидное соединение по п.23, где одновалентный катион выбран из Li+, Na+, K+. NH4+, меглумина, трис(гидроксиметил)аминометана, диэтиламина или аргинина.
25. Липидное соединение по п.23, где двухвалентный катион выбран из Mg2+, Са2+, этилендиамина или пиперазина.
26. Соединение по п.23, где поливалентный катион представляет собой хитозан.
27. Липидное соединение по любому из предшествующих пунктов в виде смеси диастереомерных изомеров или в рацемической форме.
28. Липидное соединение по п.27 в форме диастереомера или энантиомера.
29. Липидное соединение по п.27 в форме его R-стереоизомера.
30. Липидное соединение по п.27 в форме его S-стереоизомера.
31. Липидное соединение по п.1, где указанным соединением является
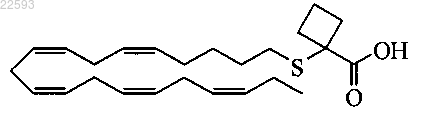
2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)циклобутанкарбоновая кислота;
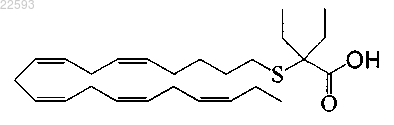
2-этил-2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановая кислота;

2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилтио)бутановая кислота;
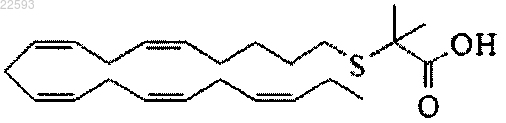
2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)-2-метилпропановая кислота;
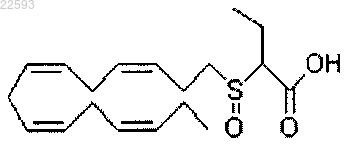
2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилсульфинил)бутановая кислота;
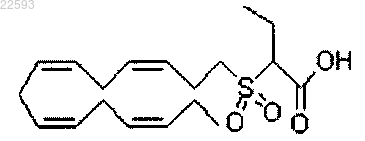
2-((3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилсульфонил)бутановая кислота;
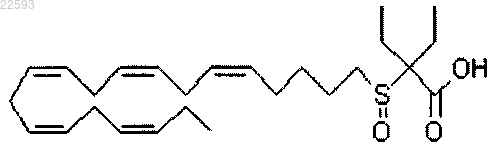
2-этил-2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилсульфинил)бутановая кислота; или
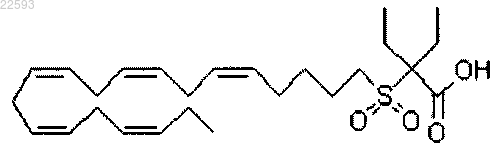
2-этил-2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилсульфонил)бутановая кислота.
32. Липидное соединение по п.31, где указанное соединение является
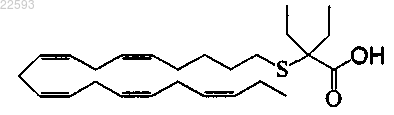
2-этил-2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислотой.
33. Липидное соединение по п.1, где X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; и
Y представляет собой серу.
34. Липидное соединение по п.1, где
R1 означает C10-C22 алкенильную группу, имеющую 3-6 прерванных метиленом двойных связей в Z-конфигурации, указанное липидное соединение получено из полиненасыщенной жирной кислоты; и
X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, карбоновый сложный эфир или карбоксамид; и
Y представляет собой серу.
35. Липидное соединение по п.1, где
R1 означает С10-С22 алкинильную группу, указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей; и
X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; и
Y представляет собой серу.
36. Липидное соединение по п.1, где
R1 выбран из С10-С22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С10-С22 алкинильной группы, имеющей 1-6 тройных связей;
X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; и
Y представляет собой сульфоксид или сульфон.
37. Липидное соединение по п.1, где X представляет собой карбоксамидную группу, которая может быть выбрана из группы, состоящей из N-метилкарбоксамида, N,N-диметилкарбоксамида, N-этилкарбоксамида и N,N-диэтилкарбоксамида.
38. Липидное соединение по п.1, где X представляет собой эфир карбоновой кислоты, выбранный из группы, состоящей из этилкарбоксилата, метилкарбоксилата, н-пропилкарбоксилата, изопропилкарбоксилата, н-бутилкарбоксилата, втор-бутилкарбоксилата и н-гексилкарбоксилата.
39. Композиция пищевой добавки, содержащая в качестве активного компонента липидное соединение по любому из пп.1-38.
40. Фармацевтическая композиция, содержащая липидное соединение по любому из пп.1-38 и фармацевтически приемлемый носитель, наполнитель или разбавитель или любое их сочетание.
41. Фармацевтическая композиция по п.40, дополнительно содержащая фармацевтически приемлемый антиоксидант.
42. Фармацевтическая композиция по п.41, где указанным антиоксидантом является токоферол.
43. Фармацевтическая композиция по любому из пп.40-42, составленная для перорального введения.
44. Фармацевтическая композиция по п.43 в форме капсулы или таблетки.
45. Применение фармацевтической композиции по любому из пп.40-44 в качестве лекарственного средства.
46. Липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по любому из пп.1-38.
47. Липидная композиция по п.46, где по меньшей мере 60 мас.% указанной липидной композиции составляет указанное липидное соединение.
48. Липидная композиция по п.47, где по меньшей мере 80 мас.% указанной липидной композиции составляет указанное липидное соединение.
49. Липидная композиция по п.46, являющаяся фармацевтической композицией.
50. Липидная композиция по любому из пп.46-49, дополнительно содержащая фармацевтически приемлемый антиоксидант.
51. Липидная композиция по п.50, где указанным антиоксидантом является токоферол.
52. Липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по п.32.
53. Применение липидной композиции по любому из пп.46-51 в качестве лекарственного средства.
54. Применение липидного соединения по любому из пп.1-38 для активации или модуляции по меньшей мере одной изоформы α, γ или δ рецептора человека, активируемого пероксисомным пролифератором (PPAR).
55. Применение по п.54, где указанное соединение является пан-агонистом или модулятором.
56. Применение липидного соединения по любому из пп.1-38 для предупреждения и/или лечения дислипидемического состояния.
57. Применение по п.56, где указанным дислипидемическим состоянием является гипертриглицеридемия (HTG).
58. Применение липидного соединения по любому из пп.1-38 для предупреждения и/или лечения повышенных уровней триглицерида, уровней LDL холестерина и/или уровней VLDL холестерина.
59. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения ожирения или состояния избыточной массы тела.
60. Применение липидного соединения по любому из пп.1-38 для снижения массы тела и/или для предотвращения увеличения массы тела.
61. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения жировой дистрофии печени.
62. Применение по п.61, где указанная жировая дистрофия печени является неалкогольной жировой дистрофией печени (NAFLD).
63. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения атеросклероза.
64. Применение липидного соединения по любому из пп.1-38 для предупреждения инфаркта миокарда.
65. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния.
66. Применение по п.65 для лечения и/или предупреждения диабета типа 2.
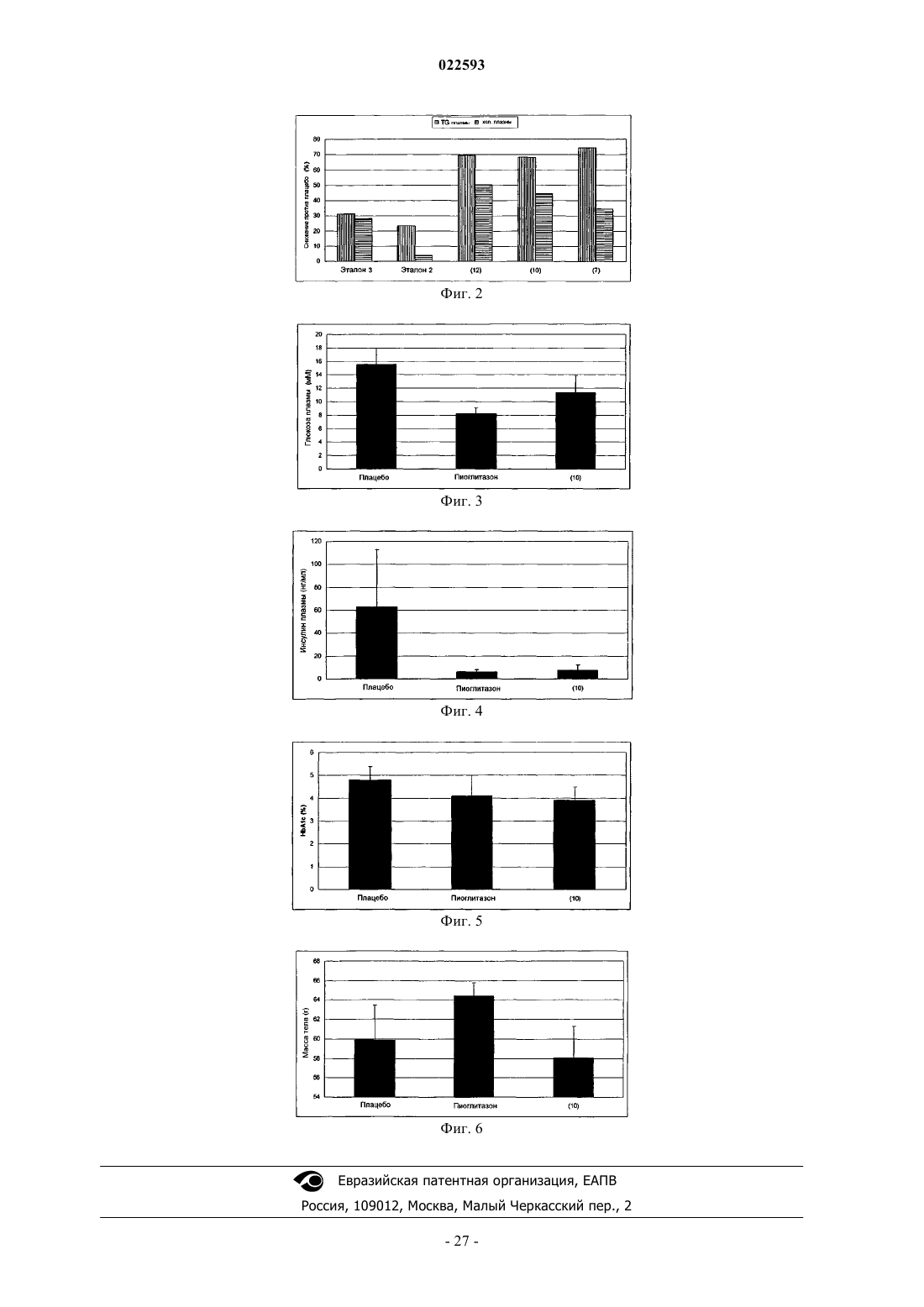
67. Применение липидного соединения по любому из пп.1-38 для снижения инсулина в плазме.
68. Применение липидного соединения по любому из пп.1-38 для снижения глюкозы в крови.
69. Применение липидного соединения по любому из пп.1-38 для снижения триглицеридов в сыворотке.
70. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения воспалительного заболевания или состояния.
71. Способ лечения состояний, имеющих отношение к активации или модуляции по меньшей мере одной изоформы α, γ или δ рецептора человека, активируемого пероксисомным пролифератором (PPAR), включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
72. Способ по п.71, где указанное соединение является пан-агонистом или модулятором PPAR.
73. Способ предупреждения и/или лечения дислипидемического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
74. Способ по п.73, где указанным дислипидемическим состоянием является гипертриглицеридемия (HTG).
75. Способ предупреждения и/или лечения повышенных уровней триглицеридов, уровней LDL холестерина и/или уровней VLDL холестерина, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
76. Способ лечения и/или предупреждения ожирения или состояния избыточной массы тела, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
77. Способ снижения массы тела и/или предотвращения увеличения массы тела, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
78. Способ лечения и/или предупреждения жировой дистрофии печени, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
79. Способ по п.76, где указанная жировая дистрофия печени является неалкогольной жировой дистрофией печени (NAFLD).
80. Способ лечения и/или предупреждения атеросклероза, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
81. Способ предупреждения инфаркта миокарда, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
82. Способ лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
83. Способ лечения и/или предупреждения диабета типа 2, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
84. Способ снижения инсулина в плазме, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
85. Способ снижения глюкозы в крови, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
86. Способ снижения триглицеридов в сыворотке, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
87. Способ лечения и/или предотвращения воспалительного заболевания или состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38.
88. Способ получения липидного соединения по любому из пп.1-38, включающий способ I
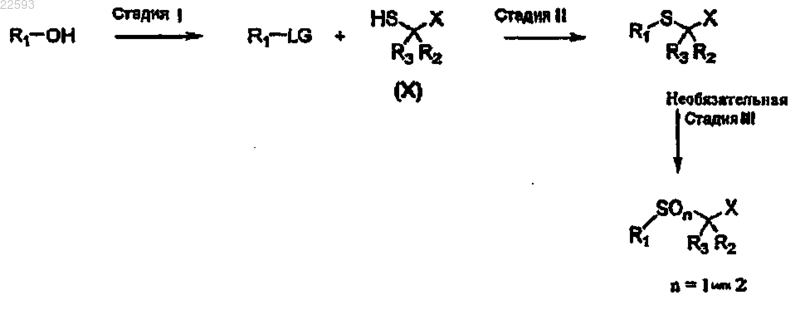
где R1, R2, R3 и X имеют значения, определенные в пп.1-38, и LG представляет собой уходящую группу, выбранную из мезилата, тозилата или галогена.
89. Способ получения липидного соединения по любому из пп.1-38, включающий способ II

где R1, R2, R3 и Х имеют значения, определенные в пп.1-38, где LG представляет собой уходящую группу, выбранную из мезилата, тозилата или галогена.
90. Способ по п.88 или 89, где сырьевой материал для получения спиртов формулы R1-OH происходит из растительного, микробного и/или животного источника.
91. Способ по п.90, где животный источник представляет собой морской рыбий жир или жир криля.
92. Способ лечения состояний, связанных с активацией или модуляцией по меньшей мере одной из изоформ α, γ или δ рецептора человека, активируемого пероксисомным пролифератором (PPAR), включающий введение млекопитающему, при необходимости этого, фармацевтически эффективного количества
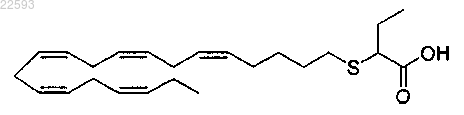
2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислоты.
93. Способ лечения и/или предупреждения заболевания или состояния, выбранного из дислипидемического состояния; повышенных уровней триглицеридов, уровней LDL холестерина и/или уровней VLDL холестерина; ожирения или состояния избыточной массы тела; жировой дистрофии печени; атеросклероза; инфаркта миокарда; периферической инсулиновой резистентности и/или диабетического состояния; и воспалительного заболевания или состояния; или
для уменьшения массы тела и/или предотвращения увеличения массы тела, инсулина в плазме, глюкозы в крови и триглицеридов в сыворотке,
включающий введение млекопитающему при необходимости этого фармацевтически эффективного количества
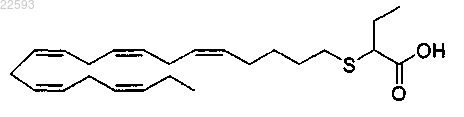
2-((5Z,8Z,11Z,142,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислоты.
94. Способ по п.93, где заболевание или состояние представляет собой неалкогольную жировую дистрофию печени (NAFLD).
95. Фармацевтическая композиция, содержащая липидное соединение

2-((5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановую кислоту и фармацевтически приемлемый носитель, наполнитель или разбавитель.
Текст
СОДЕРЖАЩИЕ СЕРУ ЛИПИДЫ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ПИЩЕВОЙ ДОБАВКИ ИЛИ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА Данное изобретение относится к липидным соединениям общей формулы (I), где R1 выбран из С 10-С 22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С 10-С 22 алкинильной группы, имеющей 1-6 тройных связей; R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из атома водорода метила, этила, н-пропила, изопропила,н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси,бензилокси, -OCH2CF3, -OCH2CH2OCH3, и фенильной группы, при условии, что R2 и R3 не могут быть оба атомами водорода, или R2 и R3 могут быть соединены так, чтобы образовывать С 3-С 6 циклоалкан; Y выбран из серы, сульфоксида и сульфона; X представляет собой карбоновую кислоту или ее производное, где производное представлено в форме моноглицерида, диглицерида, триглицерида, фосфолипида, карбонового сложного эфира или карбоксамида; или его фармацевтически приемлемой соли, или его диастереомерам,рацематам, энантиомерам или их смесям; при условии, что соединение формулы (I) не представляет собой 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутановую кислоту. Изобретение также относится к фармацевтическим композициям и липидным композициям, содержащим такие соединения, и к таким соединениям для применения в качестве лекарственных средств или для применения в терапии, в частности, для лечения заболеваний, относящихся к области сердечно-сосудистых, метаболических и воспалительных заболеваний.(71)(73) Заявитель и патентовладелец: ПРОНОВА БИОФАРМА НОРГЕ АС (NO) Область техники Данное изобретение относится к липидным соединениям общей формулы (I) где R1 выбран из С 10-С 22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С 10-С 22 алкинильной группы, имеющей 1-6 тройных связей;R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из атома водорода, метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -OCH2CH2OCH3, и фенильной группы, при условии, что R2 и R3 не могут быть, оба, атомами водорода, илиR2 и R3 могут быть соединены так, чтобы образовывать С 3-С 6 циклоалкил;X представляет собой карбоновую кислоту или ее производное, где производное представлено в форме моноглицерида, диглицерида, триглицерида, фосфолипида, карбонового сложного эфира или карбоксамида; или его фармацевтически приемлемая соль; или его диастереомеры, рацематы, энантиомеры или их смеси; при условии, что соединение формулы (I) не представляет собой 2-5Z,8Z,11Z,14Z,17Z)-эйкоза 5,8,11,14,17-пентаенилтио)бутановую кислоту. Изобретение также относится к фармацевтическим композициям и липидным композициям, содержащим такие соединения, и к таким соединениям для применения в качестве лекарственных средств или для применения в терапии, в частности для лечения заболеваний, относящихся к области сердечнососудистых, метаболических и воспалительных заболеваний. Предпосылки к созданию изобретения До настоящего времени было предпринято много исследований аналогов жирных кислот и их воздействий на разнообразные физиологические процессы, оказывающие существенное влияние на нормальное здоровье и хронические заболевания. Например, диетические полиненасыщенные жирные кислоты (PUFA), как было показано, регулируют уровни липидов в плазме, сердечно-сосудистые и иммунные функции, действие инсулина и нейронное развитие и зрительную функцию. Тетрадецилтиоуксусная кислота (ТТА) является модифицированной жирной кислотой, которая имеет несколько полезных свойств, доказуемых как in vivo, так и in vitro. ТТА имеет свойства, очень сходные со свойствами жирных кислот, основное отличие заключается в том, что она не может быть окислена путем митохондриального -окисления, но значительно усиливает окисление других жирных кислот. Несмотря на тот факт, что ТТА не способна подвергаться (окислению, она метаболизирует различными путями как нормальная насыщенная жирная кислота. ТТА влияет на окислительное состояние при различных уровнях, имея возможность изменения антиоксидантной защитной системы в дополнение к тому, что сама является антиоксидантом благодаря ее способности поглощения свободных радикалов. Добавление ТТА может предотвращать окислительную модификацию частиц липопротеина низкой плотности (LDL) в плазме и уменьшать образование пероксидов липидов. Некоторые производные полиненасыщенных жирных кислот с серой в положении 3 были получены(Flock et al., Acta Chemica Scand., 1999, 53, 436). Метил (все-Z)-3-тиа-6,9,12,15-октадекатетраеноат испытывали на крысиной модели Wistar и эффекты сравнивали с эффектами ТТА. Результаты подтверждают,что и насыщенные и ненасыщенные жирные кислоты снижали триглицериды плазмы до сходных величин (Willumsen et al., J. Lipid Mediators Cell Signalling, 1997, 17, 115). Неожиданно было обнаружено, что новые производные жирных кислот, представленные общей формулой (I), имеют более высокие степени сродства к рецепторам PPAR и PPARпо сравнению с ТТА и (все-Z)-3-тиа-6,9,12,15-октадекатетраеновой кислотой. Производные жирных кислот, представленные общей формулой (I), также снижали уровни триглицеридов, холестерина и свободных жирных кислот в дизлипидемической мышиной модели в более значительной степени, чем ТТА и (все-Z)-3-тиа-6,9,12,15-октадекатетраеновая кислота. Сущность изобретения Изобретение относится к липидному соединению формулы (I) где R1 выбран из C10-C22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С 10-С 22 алкинильной группы, имеющей 1-6 тройных связей;R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из атома водорода метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -OCH2CH2OCH3, и фенильной группы, при условии, что R2 и R3 не могут быть, оба, атомами водорода, илиR2 и R3 могут быть соединены так, чтобы образовывать С 3-С 6 циклоалкан;X представляет собой карбоновую кислоту или ее производное, где производное представлено в форме моноглицерида, диглицерида, триглицерида, фосфолипида, карбонового сложного эфира или карбоксамида; или его фармацевтически приемлемой соли; или его диастереомерам, рацематам, энантиомерам или их смесям; при условии, что соединение формулы (I) не представляет собой 2-5Z,8Z,11Z,14Z,17Z)-эйкоза 5,8,11, 14, 17-пентаенилтио)бутановую кислоту. В предпочтительном варианте циклоалкан выбран из циклопропана, циклобутана, циклопентана или циклогексана. При этом R2 и R3 независимо друг от друга могут быть выбраны из атома водорода,метильной группы, этильной группы, метоксигруппы, или этоксигруппы. В другом предпочтительном варианте R2 и R3 независимо выбраны из атома водорода, этильной группы, метоксигруппы, этоксигруппы или фенильной группы; или R2 и R3 соединены с образованием циклобутановой группы. В другом предпочтительном варианте один из R2 и R3 представляет собой атом водорода и другой выбран из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, вторбутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси,OCH2CF3, -OCH2CH2OCH3, и фенильной группы. В другом предпочтительном варианте R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, вторбутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси,OCH2CF3, -ОСН 2 СН 2 ОСН 3, и фенильной группы. При этом наиболее предпочтительно, когда R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила, изопропила, нбутила, втор-бутила или н-гексила. Ещ более предпочтительно, когда R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила или изопропила, либо R2 и R3 представляют собой этильные группы. В наиболее предпочтительном варианте R1 означает С 10-С 22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации. Причем ещ более предпочтительно когда липидное соединение получено из полиненасыщенной жирной кислоты. В другом предпочтительном варианте R1 означает C14-C22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации, и имеющую первую двойную связь при третьей углерод-углеродной связи от омега (со) конца углеродной цепи. При этом наиболее предпочтительно, когдаR1 означает С 14-С 22 алкенильную группу с 5-6 двойными связями. В ещ одном другом предпочтительном варианте R1 означает С 10-С 22 алкинильную группу, и указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей. В одном из частных вариантов воплощения настоящего изобретения Y представляет собой серу либо сульфоксид или сульфон. В другом частном варианте воплощения настоящего изобретения X представляет собой карбоновую кислоту или ее производное в форме моноглицерида, диглицерида, триглицерида, фосфолипида или эфира карбоновой кислоты. Причем наиболее предпочтительно, когда X представляет собой карбоновую кислоту или эфир карбоновой кислоты. Ещ более предпочтительно, когда X представляет собой карбоновую кислоту. В ещ одном другом предпочтительном варианте R2 и R3 являются одинаковыми или разными и выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, вторбутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси,-OCH2CF3, -ОСН 2 СН 2 ОСН 3 и фенильной группы, и X представляет собой карбоновую кислоту. Причем наиболее предпочтительно, когда R2 и R3 представляют группы, выбранные из метила, этила, н-пропила,изопропила, н-бутила, втор-бутила, н-гексила. В другом предпочтительном варианте соль липидного соединения содержит одновалентный катион,двухвалентный катион или поливалентный катион. Причем одновалентный катион может быть выбран из Li+, Na+, K+, NH4+, меглумина, трис(гидроксиметил)аминометана, диэтиламина или аргинина. Двухвалентный катион может быть выбран из Mg2+, Са 2+, этилендиамина или пиперазина. В предпочтительном аспекте липидное соединение может быть в виде смеси диастереомерных изомеров или в рацемической форме. Причем наиболее предпочтительно, когда липидное соединение находится в форме диастереомера или энантиомера либо в форме его R-стереоизомера или в форме его S-2 022593 стереоизомера. В другом предпочтительном варианте липидное соединение может представлять собой одно из следующих соединений: 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилсульфонил)бутановая кислота. В еще одном предпочтительном варианте липидное соединение представляет 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислотой. В ещ одном другом предпочтительном варианте липидного соединенияX представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой серу. В другом предпочтительно варианте R1 означает С 10-С 22 алкенильную группу, имеющую 3-6 прерванных метиленом двойных связей в Z-конфигурации, причем указанное липидное соединение получено из полиненасыщенной жирной кислоты; иX представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, карбоновый сложный эфир или карбоксамид; иY представляет собой серу. В другом предпочтительном варианте липидного соединения R1 означает С 10-С 22 алкинильную группу, указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей; иX представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой серу. В другом предпочтительном варианте липидного соединения R1 выбран из С 10-С 22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С 10-С 22 алкинильной группы, имеющей 1-6 тройных связей;X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой сульфоксид или сульфон. В другом предпочтительном варианте липидного соединения X представляет собой карбоксамидную группу, которая может быть выбрана из группы, состоящей из N-метилкарбоксамида, N,Nдиметилкарбоксамида, N-этилкарбоксамида и N,N-диэтилкарбоксамида. В ещ одном предпочтительном варианте липидного соединения X представляет собой эфир карбоновой кислоты, выбранный из группы, состоящей из этилкарбоксилата, метилкарбоксилата, нпропилкарбоксилата, изопропилкарбоксилата, н-бутилкарбоксилата, втор-бутилкарбоксилата и нгексилкарбоксилата. Другим аспектом настоящего изобретения является композиция пищевой добавки, содержащая в качестве активного компонента липидное соединение по настоящему изобретению. Ещ одним другим аспектом настоящего изобретения является фармацевтическая композиция, содержащая липидное соединение по настоящему изобретению и фармацевтически приемлемый носитель,наполнитель или разбавитель или любое их сочетание. В предпочтительном варианте фармацевтическая композиция дополнительно содержащит фармацевтически приемлемый антиоксидант, который может представлять собой токоферол. В предпочтительном варианте фармацевтическая композиция может быть составлена для перорального введения, например, в форме капсулы или таблетки. Ещ одним другим аспектом настоящего изобретения является применение фармацевтической композиции по настоящему изобретению в качестве лекарственного средства. Ещ одним другим аспектом настоящего изобретения является липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по настоящему изобретению,предпочтительно в количестве по меньшей мере 60 мас.% на общую массу липидной композиции, ещ более предпочтительно в количестве по меньшей мере 80 мас.% на общую массу липидной композиции. Липидная композиция по настоящему изобретению может представлять собой фармацевтическую композицию, которая может дополнительно содержать фармацевтически приемлемый антиоксидант,например, такой как токоферол. Ещ одним аспектом настоящего изобретения является липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по настоящему изобретению. Ещ одним другим аспектом настоящего изобретения является применение липидной композиции по настоящему изобретению в качестве лекарственного средства. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для активации или модуляции по меньшей мере одной изоформы ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR). Предпочтительно указанное липидное соединение является пан-агонистом или модулятором. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для предупреждения и/или лечения дислипидемического состояния, которое может представлять собой гипертриглицеридемия (HTG). Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для предупреждения и/или лечения повышенных уровней триглицерида,уровней LDL холестерина и/или уровней VLDL холестерина. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для лечения и/или предупреждения ожирения или состояния избыточной массы тела. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретерию для снижения массы тела и/или для предотвращения увеличения массы тела. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для лечения и/или предупреждения жировой дистрофии печени, где указанная жировая дистрофия печени может представлять собой неалкогольную жировую дистрофию печени(NAFLD). Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для лечения и/или предупреждения атеросклероза. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для предупреждения инфаркта миокарда. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния, в частности, для лечения и/или предупреждения диабета типа 2. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для снижения инсулина в плазме. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для снижения глюкозы в крови. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для снижения триглицеридов в сыворотке. Ещ одним другим аспектом настоящего изобретения является применение липидного соединения по настоящему изобретению для лечения и/или предупреждения воспалительного заболевания или состояния. Ещ одним аспектом настоящего изобретения является способ лечения состояний, имеющих отношение к активации или модуляции по меньшей мере одной изоформы ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR), включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Предпочтительно указанное липидное соединение является пан-агонистом или модулятором PPAR. Ещ одним аспектом настоящего изобретения является способ предупреждения и/или лечения дислипидемического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. В частности,указанным дислипидемическим состоянием является гипертриглицеридемия (HTG). Ещ одним аспектом настоящего изобретения является способ предупреждения и/или лечения повышенных уровней триглицеридов, уровней LDL холестерина и/или уровней VLDL холестерина, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения ожирения или состояния избыточной массы тела, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ снижения массы тела и/или предотвращения увеличения массы тела, включающий введение млекопитающему, нуждающемуся в этом,фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения жировой дистрофии печени, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Причем указанная жировая дистрофия печени может представлять собой неалкогольную жировую дистрофию печени(NAFLD). Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения атеросклероза, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ предупреждения инфаркта миокарда,включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения диабета типа 2, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ снижения инсулина в плазме, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ снижения глюкозы в крови, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ снижения триглицеридов в сыворотке, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ лечения и/или предотвращения воспалительного заболевания или состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по настоящему изобретению. Ещ одним аспектом настоящего изобретения является способ получения липидного соединения по настоящему изобретению, включающий: где Rl, R2, R3, и Х имеют определенные выше значения и LG представляет собой уходящую группу,выбранную из мезилата, тозилата или галогена. Ещ одним аспектом настоящего изобретения является способ получения липидного соединения по настоящему изобретению, включающий Способ II где R1; R2, R3, и X имеют определенные выше значения и где LG представляет собой уходящую группу, такую как мезилат, тозилат или галоген. В предпочтительном варианте сырьевой материал, для получения спиртов формулы R1-OH может происходить из растительного, микробного и/или животного источника, причем животный источник может представлять собой морской рыбий жир или жир криля. Ещ одним аспектом настоящего изобретения является способ лечения состояний, связанных с активацией или модуляцией по меньшей мере одной из изоформ ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR), включающий введение млекопитающему, при необходимости этого, фармацевтически эффективного количества 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутановой кислоты. Ещ одним аспектом настоящего изобретения является способ лечения и/или предупреждения заболевания или состояния выбранного из дислипидемического состояния; повышенных уровней триглицеридов, уровней LDL холестерина и/или уровней VLDL холестерина; ожирения или состояния избыточной массы тела; жировой дистрофии печени; атеросклероза; инфаркта миокарда; периферической инсулиновой резистентности и/или диабетического состояния; и воспалительного заболевания или состояния; или для уменьшения массы тела и/или предотвращения увеличения массы тела; инсулина в плазме; глюкозы в крови и триглицеридов в сыворотке,включающий введение млекопитающему при необходимости этого, фармацевтически эффективного количества 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутановой кислоты. В предпочтительном варианте заболевание или состояние представляет собой неалкогольную жировую дистрофию печени (NAFLD). Ещ одним аспектом настоящего изобретения является фармацевтическая композиция, содержащая липидное соединение Авторы данного изобретения обнаружили, что соединения формулы (I), которые представлены выше, имеют удивительно хорошую фармацевтическую активность. Используемый в настоящем описании термин "липидное соединение" относится к аналогам жирных кислот, полученным из, например, насыщенных жирных кислот, мононенасыщенных жирных кислот,полиненасыщенных жирных кислот и липидов, содержащих 1-6 тройных связей."Фармацевтически активное количество" относится к количеству, которое будет приводить к желательным фармакологическим и/или терапевтическим эффектам, т.е. количеству комбинированного продукта, которое является эффективным для достижения его предполагаемой цели. Так как потребности отдельных пациентов могут быть разными, определение оптимальных диапазонов эффективных количеств комбинированного продукта находится в компетенции специалиста. Как правило, режим дозирования для лечения состояния комбинированным продуктом по данному изобретению выбирают в соответствии с различными факторами, включая тип, возраст, массу, пол, диету и медицинское состояние пациента. Под "фармацевтической композицией" подразумевается липидное соединение по изобретению в любой форме, подходящей для применения в медицинских целях."Лечение" включает любое терапевтическое применение, которое может быть полезно человеку или не являющемуся человеком млекопитающему. И лечение людей, и ветеринарное лечение находятся в сфере действия данного изобретения. Лечение может быть предпринято в отношении существующего состояния, или оно может быть профилактическим. Номенклатура и терминология Жирные кислоты являются углеводородами с прямой цепью, имеющими карбоксильную (СООН) группу на одном концеи (обычно) метильную группу на другомконце. В химии нумерация атомов углерода начинается с -конца. Атом углерода а относится к первому атому углерода после атома углерода, который присоединен к функциональной группе, и второй атом углерода является -атомом углерода. Используемое в настоящем описании выражение "прерванные метиленом двойные связи" относится к случаю, когда группа метилена расположена так, что разделяет двойные связи в углеродной цепи липидного соединения. Подробное описание изобретения Неожиданно было обнаружено, что следующие липидные соединения, указанные в категориях А-Е,являются особенно предпочтительными. Категория А: получено из насыщенных жирных кислот,R1 представляет собой С 10-С 22 алкил,X представляет собой карбоновую кислоту или ее производное, карбоновый сложный эфир или карбоксамид. Пример i.R1 = С 14, Y = S Категория В: получено из мононенасыщенных жирных кислот,R1 представляет собой C10-C22 алкенил, имеющий 1 двойную связь,X представляет собой карбоновую кислоту или ее производное, карбоновый сложный эфир или карбоксамид. Пример ii. Категория С: получено из полиненасыщенных жирных кислот,R1 представляет собой С 10-С 22 алкенил, имеющий 2-6 двойных связей,X представляет собой карбоновую кислоту или ее производное, карбоновый сложный эфир или карбоксамид. Пример iv.R1 = С 20 с 5 прерванными метиленом двойными связями в Z-конфигурации, Y = SR1 = С 22 с 6 прерванными метиленом двойными связями в Z-конфигурации, Y = SR1 = C18 с 3 прерванными метиленом двойными связями в Z-конфигурации, Y = SR1 = С 15 с 4 прерванными метиленом двойными связями в Z-конфигурации, Y = SR1 = C15 с 3 прерванными метиленом двойными связями в Z-конфигурации и 1 двойной связью в Еконфигурации, Y = SR1 = C18 с 5 прерванными метиленом двойными связями в Z-конфигурации, У = SR1 = C18 с 4 прерванными метиленом двойными связями в Z-конфигурации и 1 двойной связью в Еконфигурации, Y = S Категория D: получено из липидов, содержащих 1-6 тройных связей,R1 представляет собой С 10-С 22 алкинил,X представляет собой карбоновую кислоту или ее производное, карбоновый сложный эфир или карбоксамид. Пример xi.R1 выбран из С 10-С 22 алкила, С 10-С 22 алкенила, имеющего 1-6 двойных связей, и С 10-С 22 алкинила,имеющего 1-6 тройных связей,X представляет собой карбоновую кислоту или ее производное, карбоновый сложный эфир или карбоксамид,Y представляет собой сульфоксид или сульфон. Пример xii.R1 = C15 с 4 прерванными метиленом двойными связями в Z-конфигурации, Y = SOR1 = С 15 с 4 прерванными метиленом двойными связями в Z-конфигурации, Y = SO2 Конкретными примерами предпочтительных липидных соединений по изобретению являются:(Z)-2-этил-2-(октадец-9-енилтио)бутановая кислота (6),R1 = C18H35, R2 = R3 = этил, Y = S и X = СООН. Категория С: производные полиненасыщенных жирных кислот: 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилсульфонил)бутановая кислота (29),R1 = С 20 Н 31, R2 = R3 = этил, Y = SO2 и X = СООН. Соединения категорий А-Е выше, где R2 и R3 разные, способны существовать в стереоизомерных формах, т.е. все оптические изомеры соединений и их смеси охвачены. Следовательно, указанные соединения могут быть представлены как диастереомеры, рацематы и энантиомеры. Основные способы синтеза описанных здесь соединений Соединения общей формулы (I) могут быть получены путем следующих общих процедур: Способ I. Спирты, описанные в способе I и II, могут быть получены непосредственно из карбоновых сложных эфиров, например, встречающихся в природе жирных кислот, например альфа-линоленовой кислоты,конъюгированной линолевой кислоты, ейкозапентаеновой кислоты (ЕРА) и т.д., путем восстановления восстановителем, таким как смешанный гидрид лития и алюминия или гидрид диизобутилалюминия, при-10 до 0 С. Спирты также могут быть получены путем деградации полиненасыщенных жирных кислот ЕРА и DHA, как описано Holmeide et al. (J. Chem. Soc, Perkin Trans. 1, 2000, 2271). В этом случае можно начать с очищенной ЕРА или DHA, но можно также начинать с рыбьего жира, содержащего ЕРА и DHA в смеси. Соединения формулы (X) и (XI) коммерчески доступны, или они известны в литературе, или их получают, следуя стандартным процессам, известным в области техники. Уходящей группой (LG), присутствующей в соединениях формулы (XI), может быть, например, мезилат, тозилат или подходящий галоген, такой как бром. При использовании способа I полученные спирты могут быть превращены при использовании взаимного преобразования функциональных групп способами привычными для специалистов в этой области (стадия I) в соединения, где концевая гидроксигруппа преобразована в подходящую уходящую группу(LG). Подходящие уходящие группы включают бром, мезилат и тозилат. Эти соединения могут быть подвергнуты дополнительно взаимодействию (стадия II) в реакции замещения с подходяще замещенными тиолпроизводными уксусной кислоты (X) в присутствии основания. При использовании способа II спирты могут быть превращены в соответствующие тиолы (стадияIV) способами, привычными для специалистов в этой области. Тиолы затем могут быть дополнительно подвергнуты взаимодействию (стадия V) в реакции замещения с соединениями формулы (XI), в присутствии основания в подходящей системе растворителей. Соответствующие сульфоксиды и сульфоны (Y = SO или SO2) могут быть получены окислением простых тиоэфиров (Y = S) подходящим окислителем (стадия III). Примерами окислителей являются мхлорпербензойная кислота (МСРВА), пероксид водорода (Н 2 О 2) и оксон (пероксимоносульфат калия). При использовании 1 эквивалента или менее окислителя главным продуктом будет сульфоксид. При использовании избытка окислителя, главным продуктом будет сульфон. Если используемыми производными кислот являются карбоновые сложные эфиры, может быть проведен гидролиз, чтобы получить свободные жирные кислоты. Этерифицирующая группа, такая как метильная или этильная группа, может быть удалена, например, щелочным гидролизом с использованием основания, такого как гидроксид щелочного металла, например LiOH, NaOH или KOH, или с использованием органического основания, например Et3N, вместе с неорганической солью, например LiCl, в подходящей системе растворителей. Трет-бутильная группа может быть удалена, например, обработкой кислотой, например органической кислотой, такой как трифторуксусная кислота или муравьиная кислота, в подходящей системе растворителей. Арилметильная группа, такая как бензильная группа, может быть удалена, например, гидрогенизацией над катализатором, таким как палладий-на-углероде, в подходящей системе растворителей. Получение соединений формулы I по способу I или II может иметь результатом смеси стереоизомеров. Если необходимо, эти изомеры могут быть разделены посредством хиральных разделяющих агентов и/или хиральной колоночной хроматографией способами, известными специалистам в этой области техники. Способ III. Соединения формулы (I), где X представляет собой карбоновую кислоту, и в форме фосфолипида могут быть получены следующими процессами: Ацилирование sn-глицеро-3-фосфохолина (GPC) активированной жирной кислотой, такой как имидазолиды жирной кислоты, является стандартной процедурой в синтезе фосфатидилхолина. Его обычно проводят в присутствии аниона DMSO с DMSO в качестве растворителя (Hermetter; Chemistry and Physics of lipids, 1981, 28, 111). Sn-глицеро-3-фосфохолин, как аддукт кадмия(II), также может быть подвергнут взаимодействию с активированной имидазолидом жирной кислотой в присутствии DBU (1,8- 12022593 диазабицикло[5.4.0]ундец-7-ен), чтобы получить фосфатидилхолин соответствующей жирной кислоты(международная заявка номер PCT/GB2003/002582). Ферментативное трансфосфатидилирование может приводить к преобразованию фосфатидилхолина в фосфатидилэтаноламин (Wang et al., J. Am. Chem. Soc,1993, 115, 10487). Фосфолипиды также могут быть получены ферментативной этерификацией и переэтерификацией фосфолипидов или ферментативным трансфосфатидилированием фосфолипидов. (Hosokawa, J. Am. OilChem. Soc. 1995, 1287, Lilja-Hallberg, Biocatalysis, 1994, 195). Способ IV. Соединения формулы (I), где X представляет собой карбоновую кислоту в форме триглицерида, могут быть получены путем следующего процесса. Избыток жирной кислоты может быть связан с глицерином с использованием диметиламинопиридина (DMAP) и 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата (HBTU). Способ V. Соединения формулы (I), где X представляет собой карбоновую кислоту в форме диглицерида, могут быть получены при взаимодействии жирной кислоты (2 эквивалента) с глицерином (1 эквивалент) в присутствии 1,3-дициклогексилкарбодиимида (DCC) и 4-диметиламинопиридина (DMAP). Способ VI. Соединения формулы (I), где X представляет собой карбоновую кислоту, и в форме моноглицерида могут быть получены путем следующих процессов. Ацилирование 1,2-O-изопропилиден-sn-глицерина жирной кислотой с применением DCC и DMAP в хлороформе дает монодиеноилглицерин. Удаление защитной группы изопропилидена может быть осуществлено кислотной обработкой защищенного глицерина (HCl, уксусная кислота и т.д.) (О'Brian, J.Orq. Chem., 1996, 5914). Существуют различные способы синтеза для получения моноглицеридов с жирной кислотой в положении 2. Один способ предусматривает этерификацию жирной кислоты глициридным спиртом в присутствии 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида (EDC) и 4-диметиламинопиридина (DMAP), чтобы получить глицидилпроизводное. Обработку глицидилпроизводного трифторуксусным ангидридом (TFAA) проводят перед переэтерификацией моноглицерида (Parkkari et al., Bioorg. Med. Дополнительные способы получения моно-, ди- и триглицеридов производных жирных кислот описаны в международной патентной заявке PCT/FR 02/02831. Возможно также применение ферментативных процессов (реакций липазы) для превращения жирной кислоты в моно-, ди-, триглицериды. 1,3-региоспецифическая липаза из грибов Mucor miehei может быть использована для получения триглицеридов или диглицеридов из полиненасыщенных жирных кислот и глицерина. Другая липаза, нерегиоспецифическая дрожжевая липаза из Candida antartica является высоко эффективной в образовании триглицеридов из полиненасыщенных жирных кислот (Haraldsson,Pharmazie, 2000, 3). Получение, характеристика и биологическое испытание специфических производных жирных кислот формулы (I) Изобретение теперь будет дополнительно описано на следующих неограничительных примерах, в которых могут быть использованы стандартные технические приемы, известные специалистам-химикам,и технические приемы, аналогичные описанным в указанных примерах. Если не обусловлено иное,выпаривания проводили путем ротационного испарения в вакууме; все реакции проводили при комнатной температуре, обычно в диапазоне 18-25 С, с растворителями сорта для HPLC в безводных условиях; колоночную хроматографию осуществляли флэш-процедурой на силикагеле 40-63 мкм (Merck) или путем Armen Spotflash, используя предварительно набитые силикагелем колонки "MiniVarioFlash", "SuperVarioFlash", "SuperVarioPrep" или "EasyVarioPrep" (Merck); выходы даны только для пояснения и не являются обязательно максимально достижимыми; величины сдвига при ядерном магнитном резонансе (NMR) были записаны с помощью прибораBruker Avance DPX 200 или 300 и мультиплетности пиков обозначены следующим образом: s - синглет; dAgilent 1100 series на колонке Eclipse XDB-C18 2,1x150 мм с градиентным элюированием. В качестве элюента использовали градиент 5-95% ацетонитрила в буферах, содержащих 0,01% трифторуксусную кислоту или 0,005% формиат натрия. Масс-спектр регистрировали масс-спектрометром G 1956 А (электроспрей, 3000 В) в режиме переключения положительной и отрицательной ионизации. Получение промежуточных соединений Пример 1. Получение S-(3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилэтантиоата Трифенилфосфин (PPh3) (41,7 г, 159 ммоль) растворяли в сухом тетрагидрофуране (THF) (250 мл) при 0 С в инертной атмосфере и добавляли диизопропилазодикарбоксилат (DIAD) (30,8 мл, 159 ммоль). Смесь перемешивали при 0 С в течение 40 мин и затем добавляли по каплям раствор (все-Z)-3,6,9,12 пентадекатетраенола (17,5 г, 7 9,4 ммоль) и тиоуксусной кислоты (11,4 мл, 159 ммоль) в сухом THF (150 мл). Полученную мутную смесь перемешивали при 0 С в течение 40 мин, затем при температуре окружающей среды в течение 2 ч. Добавляли гептан (300 мл), смесь перемешивали в течение 10 мин и осажденное белое твердое вещество удаляли фильтрованием. Эту процедуру повторяли дважды и наконец остаток после концентрирования перемешивали в гептане (100 мл) в течение 16 ч. Фильтрование и очистка остатка флэш-хроматографией (1% EtOAc в гептане) давали 13,7 г (62% выход) указанного в заголовке соединения в виде масла. 1LiAlH4 (2,05 г, 54,1 ммоль) суспендировали в сухом диэтиловом простом эфире (100 мл) при 0 С в инертной атмосфере. К этой суспензии добавляли по каплям раствор S-(3Z,6Z,9Z,12Z)-пентадека 3,6,9,12-тетраенилэтантиоата (13,7 г, 49,2 ммоль) в сухом диэтиловом простом эфире (50 мл) и полученную серую смесь перемешивали при 0 С в течение десяти минут и затем при температуре окружающей среды в течение 30 мин. Смесь охлаждали приблизительно до 5 С, добавляли 1 М HCl до рН 2 и фильтровали через короткую набивку целита. Набивку промывали водой и диэтиловым простым эфиром, фазы разделяли и водную фазу экстрагировали дважды диэтиловым простым эфиром (100 мл каждый раз). Объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении, получая 7,8 г (67% выход) указанного в заголовке соединения в виде масла. 1 Н-ЯМР (200 МГц, CDCl3):0,96 (т, 3 Н), 2,06 (м, 2 Н), 2,39 (м, 2 Н), 2,51 (м, 2 Н), 2,81 (м, 6 Н), 5,285,54 (м, 8 Н); MS (ESI): 235 [М-Н]-. Пример 3. Получение S-(5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилэтантиоата Трифенилфосфин (21,0 г, 80 ммоль) растворяли в сухом THF (170 мл) при 0 С в инертной атмосфере и добавляли DIAD (15,8 мл, 80 ммоль) по каплям. Через 40 мин при 0 С белую суспензию добавляли по каплям к раствору (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаен-1-ола (11,5 г, 40 ммоль) и тиоуксусной кислоты (5,7 мл, 80 ммоль) в сухом THF (50 мл) в течение 15 минут. Полученную мутную смесь перемешивали при 0 С в течение 30 мин, затем при температуре окружающей среды в течение 1,5 ч. Добавляли гептан (200 мл), смесь перемешивали в течение 10 мин и осажденное белое твердое вещество удаляли фильтрованием и промывали гептаном (150 мл). Остаток концентрировали, чтобы удалить почти весь THF и перемешивали при температуре окружающей среды в течение 18 ч. Смесь фильтровали, концентрировали и добавляли гептан (200 мл). Полученную смесь перемешивали в течение 2 ч, фильтровали и выпаривали. Остаток очищали флэш-хроматографией на силикагеле, используя EtOAc:гептан (2:98),затем EtOAc:гептан (4:96) и наконец EtOAc:гептан (5:95). Концентрирование соответствующих фракций давало 11,0 г (79% выход) указанного в заголовке соединения в виде масла. 1S-(5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилэтантиоат (7,00 г, 20,2 ммоль) растворяли в МеОН (100 мл) при перемешивании в течение 10 мин, пока не растворялись капельки масла, перед добавлением безводного карбоната калия, K2CO3 (2,79 г, 20,2 ммоль) одной порцией. Смесь перемешивали в течение 1 ч и 20 мин при температуре окружающей среды и гасили добавлением 1 М HCl (50 мл) и воды (150 мл). К белой мутной смеси добавляли Et2O (250 мл) и фазы разделяли. Водную фазу экстрагировали Et2O (2250 мл). Объединенные органические фазы промывали насыщенным раствором соли (250 мл) и сушили (MgSO4). Фильтрование и выпаривание давали указанное в заголовке соединение в виде масла (5,99 г, 97% выход), которое использовали без дополнительной очистки. 1 Н-ЯМР (300 МГц, CDCl3):0,96 (т, 3 Н, J=7,5 Гц), 1,31 (т, 1 Н, J=7,8 Гц), 1,44 (м, 2 Н), 1,61 (м, 2 Н),2,06 (м, 4 Н), 2,51 (м, 2 Н), 2,77-2,85 (м, 8 Н), 5,28-5,41 (м, 10 Н); MS (Cl (СН 4: 345 [М+С 3 Н 5]+, 333(5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаен-1-ола (1,15 г, 4,0 ммоль) в CH2Cl2 (40 мл), выдерживаемому при 0 С в атмосфере азота. Смесь перемешивали при 0 С в течение одного часа и выливали в воду со льдом (100 г) и водную фазу экстрагировали Et2O (50 мл). Объединенные органические экстракты дополняли 0,5 М H2SO4 (35 мл), органическую фазу промывали NaHCO3 (насыщенного водного) (25 мл),потом сушили (Mg2SO4, 10 г). Фильтрование и концентрирование в вакууме давали 1,2 4 г сырого масла. Очистка на колонке Armen SVP D2 6, набитой 30 г 15-40 мкм диоксида кремния Merck при потоке 20 мл/мин, УФ 210 нм и сбор 15 мл фракции осуществляли с применением градиентного элюирования: Смесь 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутановой кислоты (3,0 г, 7,9 ммоль) в сухом дихлорметане (40 мл), удерживаемую при 0 С в атмосфере азота, дополняли DMAP (1,0 г, 9,5 ммоль) и 1/3-дициклогексилкарбодиимидом (DCC) (1,8 г, 8,7 ммоль). Полученную смесь перемешивали при 0 С в течение 20 мин, добавляли (4S,5R)-4-метил-5-фенил-2-оксазолидинон (1,7 г, 9,5 ммоль) и полученную мутную смесь перемешивали при температуре окружающей среды в течение 24 ч. Смесь фильтровали и концентрировали при пониженном давлении, получая сырой продукт, содержащий желательный продукт в виде смеси двух диастереомеров. Остаток очищали флэш-хроматографией на силикагеле в аппарате Armen Spotflash, используя 2% этилацетат в гептане в качестве элюента. Два диастереомера разделяли и соответствующие фракции концентрировали. (4S,5R)-3-R)-2-5Z,8Z,HZ,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутаноил)-4-метил-5-фенилоксазолидин-2-он элюировался первым и был получен в количестве 0,95 г (47% выход) в виде масла. 1,47 г (67% выход) (4S,5R)-3-S)-25Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутаноил)-4-метил-5-фенилоксазолидин-2-она был получен в виде масла. Получение целевых молекул Пример 7. Получение этил 2-3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилтио)бутаноата (30) Раствор (3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраен-1-тиола (9,80 г, 41,5 ммоль) в сухом диметилформамиде (DMF) (70 мл) при 0 С в инертной атмосфере дополняли NaH (60% в минеральном масле,1,82 г, 45,6 ммоль) и перемешивали при этой температуре в течение десяти минут. Этилбромбутират(6,39 мл, 43,5 ммоль) добавляли и смесь перемешивали при температуре окружающей среды в течение 30 мин. Смесь распределяли между насыщенным NH4Cl (150 мл) и гептаном (150 мл). Водный слой экстрагировали дважды гептаном (100 мл каждый) и объединенный органический экстракт промывали водой(100 мл) и насыщенным раствором соли (100 мл). Органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали флэш-хроматографией на силикагеле (гептан:EtOAc 99:1, затем 95:5). Концентрирование соответствующих фракций давало 14,1 г (97% выход) указанного в заголовке соединения в виде масла. 1 Этил 2-3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилтио)бутаноат (2,7 г, 7,7 ммоль) растворяли в сухом CHCl3 (40 мл) и раствор охлаждали до -20 С в инертной атмосфере. мета-Хлорпероксибензойную кислоту (mCPBA) (77%, 4,0 г, 18 ммоль), растворенную в сухом CHCl3 (10 мл), добавляли по каплям и полученный раствор перемешивали при -20 С в течение 30 мин, давали возможность медленно достичь температуры окружающей среды и затем перемешивали в течение ночи. Растворители выпаривали в вакууме, остаток дополняли гептаном (30 мл) и полученный белый осадок удаляли фильтрованием. Фильтрат концентрировали в вакууме и остаток дополняли гептаном (10 мл). Полученный белый осадок снова удаляли фильтрованием. Фильтрат концентрировали в вакууме и остаток очищали флэшхроматографией на силикагеле (гептан:EtOAc 4:1). Концентрирование соответствующих фракций давало 0,37 г (13% выход) указанного в заголовке соединения в виде масла. 1 Н ЯМР (300 МГц, CDCl3):0,96 (т, 3 Н), 1,03 (т, 3 Н), 1,31 (т, 3 Н), 2,02-2,15 (м, 4 Н), 2,62 (м, 2 Н),2,82 (м, 6 Н), 3,05 (м, 1 Н), 3,20 (м, 1 Н), 3,70 (дд, J=10,3 Гц, J=4,7 Гц, 1 Н), 4,28 (кв., 2 Н), 5,26-5,41 (м, 7 Н),5,46-5,52 (м, 1 Н); MS (электрораспыление): 405,2 [M+Na]+. Пример 9. Получение 2-3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилтио)бутановой кислоты (7) Этил 2-3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилтио)бутаноат (14,1 г, 40,2 ммоль) растворяли в этаноле (200 мл) и добавляли раствор LiOHH2O (13,5 г, 322 ммоль) в воде (50 мл). Полученный мутный раствор перемешивали при 70 С в инертной атмосфере в течение 90 мин, охлаждали, добавляли воду(100 мл) и 3 М HCl до рН 2. Смесь экстрагировали три раза гептаном (100 мл каждый). Объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении,получая 11,8 г (91% выход) указанного в заголовке соединения в виде масла. 1 Н-ЯМР (200 МГц, CDCl3):0,91-1,06 (2 т, J=7,2 Гц, J=7,5 Гц, 6 Н), 1,60-1,80 (м, 1 Н), 1,80-1,95 (м,1 Н), 2,05 (р, J=7,2 Гц, 2 Н), 2,35 (м, 2 Н), 2,60-2,75 (м, 2 Н), 2,75-2,90 (м, 6 Н), 3,14 (т, J=7,1 Гц, 1 Н), 5,315,47 (м, 8 Н); MS (ESI): 321 [М-Н]-. Пример 10. Получение 2-3Z,6Z,9Z,12Z)-пентадека-3,6,9,12-тетраенилсульфинил)бутановой кислоты (24) 2-3Z,6Z,9Z,12Z)-Пентадека-3,6,9,12-тетраенилтио)бутановую кислоту (0,20 г, 0,62 ммоль) растворяли в сухом CHCl3 (10 мл) и раствор охлаждали до -20 С в инертной атмосфере. mCPBA (77%, 0,15 г,0,68 ммоль), растворенную в сухом CHCl3 (2 мл), добавляли по каплям и полученный раствор перемешивали при -20 С в течение 35 мин. Растворители выпаривали в вакууме, остаток дополняли гептаном (10 мл) и полученный белый осадок удаляли фильтрованием. Фильтрат концентрировали в вакууме и остаток дополняли гептаном (10 мл). Полученный белый осадок снова удаляли фильтрованием. Фильтрат концентрировали в вакууме и остаток очищали флэш-хроматографией на силикагеле (гептан:EtOAc +/l% HCOOH 4:1-1:1). Концентрирование соответствующих фракций давало 100 мг (48% выход) указан- 16022593 Этил 2-3Z,6Z,9Z,12Z)-пентадека-3,6, 9,12-тетраенилсульфонил)бутаноат (370 мг, 0,97 ммоль) растворяли в этаноле (10 мл) и добавляли раствор LiOH в Н 2 О (1 М, 3,9 мл, 3,9 ммоль). Полученную смесь перемешивали при 60 С в течение трех часов, охлаждали, добавляли 0,1 М HCl до рН 2 и экстрагировали дважды диэтиловым простым эфиром (15 мл каждый). Объединенный органический слой промывали насыщенным раствором соли (15 мл), сушили, фильтровали, концентрировали в вакууме и очищали флэш-хроматографией на силикагеле (гептан:EtOAc w/5% HCOOH 4:1). Концентрирование соответствующих фракций давало 250 мг (73% выход) указанного в заголовке соединения в виде масла. 1 Н ЯМР (300 МГц, CDCl3):0,96 (т, 3 Н), 1,09 (т, 3 Н), 2,02-2,25 (м, 4 Н), 2,65 (м, 2 Н), 2,82 (м, 6 Н),3,10 (м, 1 Н), 3,20 (м, 1 Н). Пример 12. Получение этил 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)пропаноатаNaH (60% в минеральном масле, 44 мг, 1,10 ммоль) в сухом DMF (10 мл), поддерживаемому при 0 С в инертной атмосфере. Через десять минут добавляли этилбромпропионат (136 мкл, 1,05 ммоль) и смесь перемешивали в течение 1,5 ч при 0 С. К реакционной смеси добавляли насыщенный водный NH4Cl (20 мл) и гептан (50 мл). Фазы разделяли и водную фазу экстрагировали гептаном (225 мл). Объединенные органические фазы промывали насыщенным раствором соли (25 мл), сушили (MgSO4), фильтровали и выпаривали, получая 376 мг указанного в заголовке соединения в виде сырого масла. Очистка флэшхроматографией на силикагеле с использованием градиентного элюирования (вначале чистый гептан и постепенное повышение до гептан:EtOAc 95:5) давала 318 мг (79% выход) указанного в заголовке соединения в виде масла. 1DMF (10 мл) при 0 С в инертной атмосфере добавляли NaH (60% в минеральном масле, 44 мг, 1,1 ммоль). Через пятнадцать минут добавляли этилбромбутират (154 мкл, 1,05 ммоль). Смесь перемешивали в течение 1 ч при 0 С. Добавляли насыщенный водный NH4Cl (20 мл), воду (20 мл) и гептан (50 мл). Фазы разделяли и водную фазу экстрагировали гептаном (225 мл). Объединенные органические фазы промывали водой (25 мл) и насыщенным раствором соли (25 мл), сушили (MgSO4), фильтровали и выпаривали, получая 379 мг указанного в заголовке соединения в виде сырого масла. Очистка флэшхроматографией на силикагеле с использованием градиентного элюирования (вначале чистый гептан и постепенное повышение до гептан:EtOAc 95:5) давала 345 мг (82% выход) указанного в заголовке соединения в виде масла. 1 Этил 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутаноат (209 мг, 0,50 ммоль) растворяли в этаноле (2,5 мл) и добавляли к раствору LiOHH2O (168 мг, 4,0 ммоль) в воде (2,5 мл). Полученный мутный раствор перемешивали при 70 С в инертной атмосфере в течение 2 ч, охлаждали и добавляли воду (10 мл) и 1 М HCl (5 мл) до рН 1-2. Смесь экстрагировали гептаном (220 мл) и диэтило- 17022593 вым простым эфиром (20 мл). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая 154 мг указанного в заголовке соединения в виде сырого масла. Очистка флэш-хроматографией на силикагеле с использованием градиентного элюирования (вначале чистым гептаном и с постепенным повышением до гептан:EtOAc (с 5% НОАс) 80:20), давала 151 мг (77% выход) указанного в заголовке соединения в виде масла. 1 Пероксид водорода (30% в воде, 0,71 мл, 6,91 ммоль) и моногидрат гидроксида лития (0,15 г, 3,46 ммоль) добавляли к раствору (4S,5R)-3-S)-2-5Z,8Z,HZ,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутаноил)-4-метил-5-фенилоксазолидин-2-она (0,95 г, 1,73 ммоль) в тетрагидрофуране (12 мл) и воде (4 мл), поддерживаемому при 0 С в атмосфере азота. Реакционную смесь перемешивали при 0 С в течение 30 мин. 10% Na2SO3 (водный) (30 мл) добавляли, рН доводили до 25 М раствором HCl и смесь экстрагировали дважды гептаном (30 мл). Объединенный органический экстракт сушили (Na2SO4), фильтровали и концентрировали. Остаток подвергали флэш-хроматографии на силикагеле, используя возрастающе полярные смеси гептана и этилацетата (98:81:1) в качестве элюента. Концентрирование соответствующих фракций давало 0,15 г (17% выход) указанного в заголовке продукта в виде масла. 1 Н-ЯМР (300 МГц, CDCl3):1,00 (т, 3 Н), 1,07 (т, 3 Н), 1,46 (м, 2 Н), 1,60-1,75 (м, 3 Н), 1,85 (м, 1 Н),2,10 (м, 4 Н), 2,66 (м, 2 Н), 2,80-2,90 (м, 8 Н), 3,21 (т, 1 Н), 5,35-5,45 (м, 10 Н); Пероксид водорода (30% в воде, 1,04 мл, 10,2 ммоль) и моногидрат гидроксида лития (0,21 г, 5,09 ммоль) добавляли к раствору (4S,5R)-3-R)-2- 5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио) бутаноил)-4-метил-5-фенилоксазолидин-2-она (1,40 г, 2,55 ммоль) в тетрагидрофуране (15 мл) и воде (5 мл), поддерживаемому при 0 С в атмосфере азота. Реакционную смесь перемешивали при 0 С в течение 45 мин. Добавляли 10% Na2SO3 (водный) (35 мл), рН доводили до 25 М раствором HCl и смесь экстрагировали дважды гептаном (35 мл). Объединенный органический экстракт сушили (Na2SO4), фильтровали и концентрировали. Остаток подвергали флэш-хроматографии на силикагеле, используя возрастающе полярные смеси гептана и этилацетата (98:81:1) в качестве элюента. Концентрирование соответствующих фракций давало 0,17 г (22% выход) указанного в заголовке продукта в виде масла. 1DMF (10 мл) при 0 С в инертной атмосфере добавляли NaH (60% в минеральном масле, 44 мг, 1,1 ммоль). Через пятнадцать минут добавляли этил 2-бром-2-метилбутират (154 мкл, 1,05 ммоль) и смесь перемешивали в течение 1,5 ч при 0 С. Реакционную смесь гасили добавлением насыщенного водногоNH4Cl (20 мл). Добавляли воду (20 мл) и гептан (50 мл) и фазы разделяли. Водную фазу экстрагировали гептаном (225 мл). Объединенные органические фазы промывали водой (25 мл) и насыщенным раствором соли (225 мл), сушили (MgSO4), фильтровали и выпаривали, получая 377 мг указанного в заголовке соединения в виде сырого масла. Очистка флэш-хроматографией на силикагеле с применением изократического элюирования (гептан:EtOAc 98:2) давала 307 мг (77% выход) указанного в заголовке соединения в виде масла. 1 Н-ЯМР (300 МГц, CDCl3):0,95 (т, 3 Н), 1,28 (т, 3 Н), 1,42 (м, 2 Н), 1,48 (с, 6 Н), 1,54 (м, 2 Н), 2,06 (м,4 Н), 2,58 (м, 2 Н), 2,71-2,85 (м, 8 Н), 4,15 (м, 2 Н), 5,22-5,48 (м, 10 Н); MS (Cl(CH4: 459 [М+С 3 Н 5]+, 447 Этил 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)-2-метилпропаноат (209 мг, 0,50 ммоль) растворяли в этаноле (2,5 мл) и добавляли к раствору LiOHH2O (168 мг, 4,0 ммоль) в воде (2,5 мл). Полученный мутный раствор перемешивали при 70 С в инертной атмосфере в течение 2 ч, охлаждали и добавляли воду (10 мл) и 1 М HCl (5 мл) до рН=1-2. Смесь экстрагировали три раза гептаном (320 мл). Объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали при пониженном давлении, получая 101 мг указанного в заголовке соединения в виде сырого масла. Очистка флэш-хроматографией на силикагеле с применением градиентного элюирования (начиная с чистого гептана и постепенно повышая до гептан:EtOAc (с 5% НОАс) 80:20) давала 78 мг (40%) указанного в заголовке соединения в виде масла. 1DMF (10 мл) при 0 С в инертной атмосфере добавляли NaH (60% в минеральном масле, 44 мг, 1,1 ммоль). Через 15 мин добавляли этил 2-бромциклобутанкарбоксилат (170 мкл, 1,05 ммоль) и смесь перемешивали в течение 1,5 ч при 0 С. Реакцию гасили добавлением насыщенного водного NH4Cl (20 мл). Добавляли гептан (50 мл) и фазы разделяли. Водную фазу экстрагировали гептаном (225 мл). Объединенные органические фазы промывали водой (25 мл) и насыщенным раствором соли (25 мл), сушили(MgSO4), фильтровали и выпаривали, получая 409 мг указанного в заголовке соединения в виде сырого масла. Очистка флэш-хроматографией на силикагеле с применением изократического элюирования (гептангацетон 98:2) давала 243 мг (56% выход) указанного в заголовке соединения в виде масла. 1 Н-ЯМР (300 МГц, CDCl3):0,95 (т, 3 Н), 1,27 (т, 3 Н), 1,42 (д, 3 Н), 1,54 (м, 2 Н), 1,84 (м, 1 Н), 1,962,23 (м, 7 Н), 2,51 (м, 2 Н), 2,60 (м, 2 Н), 2,73-2,90 (м, 8 Н), 4,18 (м, 2 Н), 5,23-5,43 (м, 10 Н); MS (Cl(CH4: 471 [М+С 3 Н 5]+, 459 [М+С 2 Н 5]+, 431 [М+Н]+, 385 [M-OEt]+, 357 [M-CO2Et]+, 303 [R-C]+. Пример 20. Получение 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислоты (12)NaOEt (21 мас.%, в EtOH, 0,37 мл, 0,98 ммоль) добавляли по каплям к раствору 2-меркапто-2 этилмасляной кислоты (0,08 г, 0,49 ммоль) в сухом EtOH (7 мл), поддерживаемому при 0 С в инертной атмосфере. Полученную смесь перемешивали при 0 С в течение 30 мин, потом раствор (5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилметансульфоната (0,15 г, 0,41 ммоль) добавляли в сухом EtOH (3 мл) по каплям. Полученную мутную смесь перемешивали при температуре окружающей среды в течение 24 ч, выливали в NH4Cl (насыщенный) (водный) (15 мл), добавляли 3 М HCl до рН 2, потом экстрагировали дважды EtOAc (220 мл). Объединенные органические экстракты промывали насыщенным раствором соли (10 мл), сушили (MgSO4), фильтровали и выпаривали в вакууме. Остаток очищали флэшхроматографией на силикагеле с градиентом 10-25% этилацетата в гептане в качестве элюента. Концентрирование соответствующих фракций давало 0,12 г (70% выход) указанного в заголовке соединения в виде масла. 1DMF (10 мл) при 0 С в инертной атмосфере добавляли NaH (60% в минеральном масле, 44 мг, 1,1 ммоль). Через пятнадцать минут добавляли этил 2-бром-2-фенилацетат (255 мг, 1,05 ммоль) и смесь перемешивали в течение 1,5 ч при 0 С. Реакционную смесь гасили добавлением насыщенного водногоNH4Cl (25 мл). Добавляли гептан (50 мл) и фазы разделяли. Водную фазу экстрагировали гептаном (225 мл). Объединенные органические фазы промывали водой (25 мл) и насыщенным раствором соли (25 мл),- 19022593 сушили (MgSO4), фильтровали и выпаривали, получая 453 мг указанного в заголовке соединения в виде сырого масла. Очистка флэш-хроматографией на силикагеле с использованием изократического элюирования (гептан:EtOAc 98:2) давала 177 мг (38% выход) указанного в заголовке соединения в виде масла. 1H-ЯМР (300 МГц, CDCl3):0,95 (т, 3 Н), 1,24 (т, 3 Н), 1,41 (м, 2 Н), 1,56 (м, 2 Н), 2,05 (м, 2 Н), 2,51 (м,2 Н), 2,60 (м, 2 Н), 2,67-2,92 (м, 8 Н), 4,17 (м, 2 Н), 4,53 (с, 1 Н), 5,21-5,46 (м, 10 Н), 7,27-7,35 (м, 3 Н), 7,437,46 (м, 2 Н); MS (Cl(CH4: 507 [М+С 3 Н 5]+, 495 [М+С 2 Н 5]+, 467 [М+Н]+, 421 [M-OEt]+, 393 [М-CO2Et]+,303 [R-C]'+. Биологическое испытание Пример 22. Оценка активации PPAR in vitro. Анализ проводили in vitro на трех стабильных линиях клеток-репортеров, PPAR, PPAR илиPPAR, экспрессирующих соответственно химерный белок, содержащий связывающий лиганд домен(LBD) PPAR человека, PPAR человека или PPAR человека, присоединенный к ДНК связывающему домену (DBD) дрожжевого трансактиватора GAL4. Ген-репортер люциферазы (Luc) перемещается пентамером распознающей GAL4 последовательности вперед -глобинового промотора. Применение химерных рецепторов GAL4-PPAR, GAL4-PPAR5 иGAL4-PPAR дает возможность исключения фоновой активности от эндогенных рецепторов и количественной оценки относительной активности от трех подтипов PPAR с тем же самым геном-репортером. Два незамещенных эталонных вещества, эталон 1 и 2, и пять испытуемых соединений (7), (10), (11),(24) и (25) испытывали в концентрации 10 мкМ. Структурные формулы испытанных веществ показаны ниже:PPAR селективность веществ определяли путем сравнения с известными образцами лекарственных средств (1 мкМ GW7 647 для PPAR, 1 мкМ L-165041 для PPAR и 1 мкМ BRL49653 для PPAR), установленной 100% активности. Результаты представлены на фиг. 1. Пример 23. Оценка активации PPAR in vitro (данные отклика на концентрацию). Анализ проводили in vitro, используя образцы для анализа млекопитающее-один-гибрид (М 1 Н), содержащие составные структуры GAL4-ДНК связывающий домен-PPAR-LBD в сочетании с составной структурой-репортером на основе люциферазы Photinus pyralis, несущей 5CAL4-сайты, в подвергнутых временной трансфекции клетках HEK293. Соединение (12) и положительный контроль (GW7647) испытывали при различных концентрациях. Результаты представлены в табл. 1. Таблица 1 Пример 24. Оценка воздействия на липидный метаболизм in vivo на дизлипидемической модели(трансгенные мыши APOE3Leiden). Эта животная модель признана показательной для состояния человека относительно уровней липопротеина в плазме, профилей липопротеина, его способности к реагированию на гиполипидемические лекарственные средства (такие как статины, фибраты и т.п.) и питание. Кроме того, в зависимости от уровня холестерина в плазме у мышей APOE3Leiden развиваются атеросклеротические поражения аорты, сходные с теми, которые обнаружены у людей, что касается клеточной композиции и морфологических и иммуногистохимических характеристик. Самок мышей APOE3Leiden выдерживали на полусинтетической диете вестерн-типа (WTD, 15% какао-масла, 40% сахарозы и 0,25% холестерина, все мас./мас.). При такой диете уровень холестерина в плазме достигал умеренно повышенных уровней около 12-15 ммоль/л. Через 4 недели подготовительного периода мышей распределяли на группы из 10 мышей каждая, подобранных по холестерину в плазме,триглицеридам и массе тела (t=0). Испытуемые вещества вводили перорально как примесь к диете вестерн-типа. Чтобы облегчить смешивание соединений, подсолнечное масло добавляли к общему объему масла 10 мл/кг диеты. Через три недели обработки (t=3 недели) мышей подвергали голоданию в течение ночи (о/n) и отбирали пробы крови, чтобы измерить кетоновые тела в плазме и свободные жирные кислоты. При t=0 и 4 неделям пробы крови отбирали после 4-часового периода голодания, чтобы измерить холестерин и триглицериды плазмы. Два незамещенных эталонных вещества, эталон 3 и 2, и три испытуемые соединения (7), (10) и (12) дозировали при 0,3 ммоль/кг массы тела/сутки. Структурные формулы испытанных веществ показаны ниже: Результаты показаны на фиг. 2. Пример 25. Оценка воздействий на глюкозный метаболизм на модели диабета типа II (самцы мышей ob/ob). Мыши ob/ob могут быть использованы в качестве модели диабета типа II. Мыши являются гомозиготными для жировой спонтанной мутации (мыши ob/ob могут достигать трехкратной нормальной массы тела контролей дикого типа), мыши ob/ob проявляют подобный диабету типа II синдром гипергликемии,непереносимости глюкозы, повышенного инсулина плазмы, бесплодия, ухудшенного заживления ран и повышенного продуцирования гормона как гипофизом, так и надпочечными железами. Самцов мышей ob/ob выдерживали на нормальной низкожировой диете несколько недель для акклиматизации. После периода акклиматизации мышей распределяли на три группы из 10 мышей каждая,подобранных по массе тела, глюкозе и инсулину плазмы (t=0). Все соединения вводили перорально как примесь к диете AM II. Чтобы облегчить смешивание соединений, подсолнечное масло добавляли к общему объему масла 10 мл/кг диеты. При t=0, 2 и 4 недели измеряли массу тела и потребление пищи. При t=0, 2 и 4 недели пробы крови отбирали после 4-часового периода голодания, чтобы измерить HbA1c цельной крови и глюкозу, инсулин, холестерин и триглицериды плазмы. Пиоглитазон использовали в качестве эталона (15 мг/кг массы тела/сутки). Соединение (10) давали в дозе 0,6 ммоль/кг массы тела/сутки. Результаты (t=4) показаны на фиг. 3-6. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Липидное соединение формулы (I) где R1 выбран из С 10-С 22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей в Z-конфигурации, и С 10-С 22 алкинильной группы, имеющей 1-6 тройных связей;R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из атома водорода, метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -OCH2CH2OCH3 и фенильной группы, при условии, что R2 и R3 не могут быть оба атомами водорода, илиR2 и R3 могут быть соединены так, чтобы образовывать С 3-С 6 циклоалкил;X представляет собой карбоновую кислоту или ее производное, где производное представлено в форме моноглицерида, диглицерида, триглицерида, фосфолипида, карбонового сложного эфира или карбоксамида; или его фармацевтически приемлемая соль,или его диастереомеры, рацематы, энантиомеры или их смеси; при условии, что соединение формулы (I) не представляет собой 2-5Z,8Z,11Z,14Z,17Z)-эйкоза 5,8,11,14,17-пентаенилтио)бутановую кислоту. 2. Липидное соединение по п.1, где циклоалкил выбран из циклопропила, циклобутила, циклопентила или циклогексила. 3. Липидное соединение по п.1, где R2 и R3 независимо выбраны из атома водорода, метильной группы, этильной группы, метоксигруппы или этоксигруппы. 4. Липидное соединение по п.1, где R2 и R3 независимо выбраны из атома водорода, этильной группы, метоксигруппы, этоксигруппы или фенильной группы; или R2 и R3 соединены с образованием циклобутильной группы. 5. Липидное соединение по п.1, где один из R2 и R3 представляет собой атом водорода и другой выбран из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, вторбутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси,OCH2CF3, -OCH2CH2OCH3 и фенильной группы. 6. Липидное соединение по п.1, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, вторбутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси,OCH2CF3, -OCH2CH2OCH3 и фенильной группы. 7. Липидное соединение по п.6, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила или н-гексила. 8. Липидное соединение по п.7, где R2 и R3 являются одинаковыми или разными и могут быть выбраны из метила, этила, н-пропила или изопропила. 9. Липидное соединение по п.7, где R2 и R3 представляют собой этильные группы. 10. Липидное соединение по любому из пп.1-9, где R1 означает С 10-С 22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации. 11. Липидное соединение по п.10, где указанное липидное соединение получено из полиненасыщенной жирной кислоты. 12. Липидное соединение по п.1, где R1 означает C14-C22 алкенильную группу с 3-6 прерванными метиленом двойными связями в Z-конфигурации, и имеющую первую двойную связь при третьей углерод-углеродной связи от омегаконца углеродной цепи. 13. Липидное соединение по п.12, где R1 означает C14-C22 алкенильную группу с 5-6 двойными связями. 14. Липидное соединение по п.1, где R1 означает С 10-С 22 алкинильную группу, указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей. 15. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой серу. 16. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой сульфоксид. 17. Липидное соединение по любому из предшествующих пунктов, где Y представляет собой сульфон. 18. Липидное соединение по любому из предшествующих пунктов, где X представляет собой карбоновую кислоту или ее производное в форме моноглицерида, диглицерида, триглицерида, фосфолипида или эфира карбоновой кислоты. 19. Липидное соединение по любому из пп.1-18, где X представляет собой карбоновую кислоту или эфир карбоновой кислоты. 20. Липидное соединение по п.18 или 19, где X представляет собой карбоновую кислоту. 21. Липидное соединение по п.1, гдеR2 и R3 являются одинаковыми или разными и выбраны из группы заместителей, состоящей из метила, этила, н-пропила, изопропила, н-бутила, втор-бутила, н-гексила, метокси, этокси, пропокси, изопропокси, втор-бутокси, фенокси, бензилокси, -OCH2CF3, -ОСН 2 СН 2 ОСН 3, и фенильной группы, иX представляет собой карбоновую кислоту. 22. Липидное соединение по п.21, где R2 и R3 представляют группы, выбранные из метила, этила, нпропила, изопропила, н-бутила, втор-бутила, н-гексила. 23. Липидное соединение по п.1, где указанная соль указанного липидного соединения содержит одновалентный катион, двухвалентный катион или поливалентный катион. 24. Липидное соединение по п.23, где одновалентный катион выбран из Li+, Na+, K+. NH4+, меглумина, трис(гидроксиметил)аминометана, диэтиламина или аргинина. 25. Липидное соединение по п.23, где двухвалентный катион выбран из Mg2+, Са 2+, этилендиамина или пиперазина. 26. Соединение по п.23, где поливалентный катион представляет собой хитозан. 27. Липидное соединение по любому из предшествующих пунктов в виде смеси диастереомерных изомеров или в рацемической форме. 28. Липидное соединение по п.27 в форме диастереомера или энантиомера. 29. Липидное соединение по п.27 в форме его R-стереоизомера. 30. Липидное соединение по п.27 в форме его S-стереоизомера. 31. Липидное соединение по п.1, где указанным соединением является 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилсульфонил)бутановая кислота. 32. Липидное соединение по п.31, где указанное соединение является 2-этил-2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислотой. 33. Липидное соединение по п.1, где X представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой серу. 34. Липидное соединение по п.1, гдеR1 означает C10-C22 алкенильную группу, имеющую 3-6 прерванных метиленом двойных связей в Zконфигурации, указанное липидное соединение получено из полиненасыщенной жирной кислоты; иX представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, карбоновый сложный эфир или карбоксамид; иY представляет собой серу. 35. Липидное соединение по п.1, гдеR1 означает С 10-С 22 алкинильную группу, указанное липидное соединение получено из липидов, содержащих 1-6 тройных связей; иX представляет собой карбоновую кислоту или ее производное, где производное представляет собой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой серу. 36. Липидное соединение по п.1, гдеR1 выбран из С 10-С 22 алкенильной группы, имеющей 3-6 прерванных метиленом двойных связей вX представляет собой карбоновую кислоту или ее производное, где производное представляет со- 23022593 бой моноглицерид, диглицерид, триглицерид, фосфолипид, эфир карбоновой кислоты или карбоксамид; иY представляет собой сульфоксид или сульфон. 37. Липидное соединение по п.1, где X представляет собой карбоксамидную группу, которая может быть выбрана из группы, состоящей из N-метилкарбоксамида, N,N-диметилкарбоксамида, N-этилкарбоксамида и N,N-диэтилкарбоксамида. 38. Липидное соединение по п.1, где X представляет собой эфир карбоновой кислоты, выбранный из группы, состоящей из этилкарбоксилата, метилкарбоксилата, н-пропилкарбоксилата, изопропилкарбоксилата, н-бутилкарбоксилата, втор-бутилкарбоксилата и н-гексилкарбоксилата. 39. Композиция пищевой добавки, содержащая в качестве активного компонента липидное соединение по любому из пп.1-38. 40. Фармацевтическая композиция, содержащая липидное соединение по любому из пп.1-38 и фармацевтически приемлемый носитель, наполнитель или разбавитель или любое их сочетание. 41. Фармацевтическая композиция по п.40, дополнительно содержащая фармацевтически приемлемый антиоксидант. 42. Фармацевтическая композиция по п.41, где указанным антиоксидантом является токоферол. 43. Фармацевтическая композиция по любому из пп.40-42, составленная для перорального введения. 44. Фармацевтическая композиция по п.43 в форме капсулы или таблетки. 45. Применение фармацевтической композиции по любому из пп.40-44 в качестве лекарственного средства. 46. Липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по любому из пп.1-38. 47. Липидная композиция по п.46, где по меньшей мере 60 мас.% указанной липидной композиции составляет указанное липидное соединение. 48. Липидная композиция по п.47, где по меньшей мере 80 мас.% указанной липидной композиции составляет указанное липидное соединение. 49. Липидная композиция по п.46, являющаяся фармацевтической композицией. 50. Липидная композиция по любому из пп.46-49, дополнительно содержащая фармацевтически приемлемый антиоксидант. 51. Липидная композиция по п.50, где указанным антиоксидантом является токоферол. 52. Липидная композиция, предназначенная для применения в медицине, содержащая липидное соединение по п.32. 53. Применение липидной композиции по любому из пп.46-51 в качестве лекарственного средства. 54. Применение липидного соединения по любому из пп.1-38 для активации или модуляции по меньшей мере одной изоформы ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR). 55. Применение по п.54, где указанное соединение является пан-агонистом или модулятором. 56. Применение липидного соединения по любому из пп.1-38 для предупреждения и/или лечения дислипидемического состояния. 57. Применение по п.56, где указанным дислипидемическим состоянием является гипертриглицеридемия (HTG). 58. Применение липидного соединения по любому из пп.1-38 для предупреждения и/или лечения повышенных уровней триглицерида, уровней LDL холестерина и/или уровней VLDL холестерина. 59. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения ожирения или состояния избыточной массы тела. 60. Применение липидного соединения по любому из пп.1-38 для снижения массы тела и/или для предотвращения увеличения массы тела. 61. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения жировой дистрофии печени. 62. Применение по п.61, где указанная жировая дистрофия печени является неалкогольной жировой дистрофией печени (NAFLD). 63. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения атеросклероза. 64. Применение липидного соединения по любому из пп.1-38 для предупреждения инфаркта миокарда. 65. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния. 66. Применение по п.65 для лечения и/или предупреждения диабета типа 2. 67. Применение липидного соединения по любому из пп.1-38 для снижения инсулина в плазме. 68. Применение липидного соединения по любому из пп.1-38 для снижения глюкозы в крови. 69. Применение липидного соединения по любому из пп.1-38 для снижения триглицеридов в сыво- 24022593 ротке. 70. Применение липидного соединения по любому из пп.1-38 для лечения и/или предупреждения воспалительного заболевания или состояния. 71. Способ лечения состояний, имеющих отношение к активации или модуляции по меньшей мере одной изоформы ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR),включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 72. Способ по п.71, где указанное соединение является пан-агонистом или модулятором PPAR. 73. Способ предупреждения и/или лечения дислипидемического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 74. Способ по п.73, где указанным дислипидемическим состоянием является гипертриглицеридемия(HTG). 75. Способ предупреждения и/или лечения повышенных уровней триглицеридов, уровней LDL холестерина и/или уровней VLDL холестерина, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 76. Способ лечения и/или предупреждения ожирения или состояния избыточной массы тела, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 77. Способ снижения массы тела и/или предотвращения увеличения массы тела, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 78. Способ лечения и/или предупреждения жировой дистрофии печени, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 79. Способ по п.76, где указанная жировая дистрофия печени является неалкогольной жировой дистрофией печени (NAFLD). 80. Способ лечения и/или предупреждения атеросклероза, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 81. Способ предупреждения инфаркта миокарда, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 82. Способ лечения и/или предупреждения периферической инсулиновой резистентности и/или диабетического состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 83. Способ лечения и/или предупреждения диабета типа 2, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 84. Способ снижения инсулина в плазме, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 85. Способ снижения глюкозы в крови, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 86. Способ снижения триглицеридов в сыворотке, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 87. Способ лечения и/или предотвращения воспалительного заболевания или состояния, включающий введение млекопитающему, нуждающемуся в этом, фармацевтически эффективного количества липидного соединения по любому из пп.1-38. 88. Способ получения липидного соединения по любому из пп.1-38, включающий способ I где R1, R2, R3 и X имеют значения, определенные в пп.1-38, и LG представляет собой уходящую группу, выбранную из мезилата, тозилата или галогена. 89. Способ получения липидного соединения по любому из пп.1-38, включающий способ II где R1, R2, R3 и Х имеют значения, определенные в пп.1-38, где LG представляет собой уходящую группу, выбранную из мезилата, тозилата или галогена. 90. Способ по п.88 или 89, где сырьевой материал для получения спиртов формулы R1-OH происходит из растительного, микробного и/или животного источника. 91. Способ по п.90, где животный источник представляет собой морской рыбий жир или жир криля. 92. Способ лечения состояний, связанных с активацией или модуляцией по меньшей мере одной из изоформ ,илирецептора человека, активируемого пероксисомным пролифератором (PPAR), включающий введение млекопитающему при необходимости этого фармацевтически эффективного количества 2-5Z,8Z,11Z,14Z,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислоты. 93. Способ лечения и/или предупреждения заболевания или состояния, выбранного из дислипидемического состояния; повышенных уровней триглицеридов, уровней LDL холестерина и/или уровнейVLDL холестерина; ожирения или состояния избыточной массы тела; жировой дистрофии печени; атеросклероза; инфаркта миокарда; периферической инсулиновой резистентности и/или диабетического состояния; и воспалительного заболевания или состояния; или для уменьшения массы тела и/или предотвращения увеличения массы тела, инсулина в плазме,глюкозы в крови и триглицеридов в сыворотке,включающий введение млекопитающему при необходимости этого фармацевтически эффективного количества 2-5Z,8Z,11Z,142,17Z)-эйкоза-5,8,11,14,17-пентаенилтио)бутановой кислоты. 94. Способ по п.93, где заболевание или состояние представляет собой неалкогольную жировую дистрофию печени (NAFLD). 95. Фармацевтическая композиция, содержащая липидное соединение
МПК / Метки
МПК: C07C 317/06, A23L 1/29, C07C 321/18, C07C 321/22, A61P 3/04, A61K 31/22, C07C 321/14, C07C 317/12, C07C 317/04, A61P 9/10, A61K 31/10
Метки: средства, липиды, пищевой, лекарственного, содержащие, применения, серу, добавки, качестве
Код ссылки
<a href="https://eas.patents.su/28-22593-soderzhashhie-seru-lipidy-dlya-primeneniya-v-kachestve-pishhevojj-dobavki-ili-v-kachestve-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Содержащие серу липиды для применения в качестве пищевой добавки или в качестве лекарственного средства</a>
Предыдущий патент: Усовершенствования центробежных насосов
Следующий патент: Пестицидные смеси
Случайный патент: Комбинированный пресс-фильтр