Синтетические тритерпеноиды и их применение в лечении заболеваний
Номер патента: 22166
Опубликовано: 30.11.2015
Авторы: Спон Майкл, Крал Роберт М., Хандэ Тадаши, Либи Карэн, Гриббл Гордон В., Мэйэр Колин Джей
Формула / Реферат
1. Способ лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, при котором указанному субъекту вводят фармацевтически эффективное количество соединения, имеющего следующее строение:
2. Способ по п.1, отличающийся тем, что субъект страдает RKD.
3. Способ по п.2, отличающийся тем, что RKD представляет собой диабетическую нефропатию (ДН).
4. Способ по п.1, отличающийся тем, что субъект страдает инсулиновой резистентностью.
5. Способ по п.1, отличающийся тем, что субъект страдает диабетом.
6. Способ по п.1, отличающийся тем, что субъект страдает эндотелиальной дисфункцией.
7. Способ по п.1, отличающийся тем, что субъект страдает жировой инфильтрацией печени.
8. Способ по любому из пп.1-7, отличающийся тем, что дополнительно определяют субъекта, нуждающегося в лечении любой из указанных болезней, дисфункций, резистентностей или расстройств.
9. Способ по любому из пп.1-7, отличающийся тем, что в семейном анамнезе субъекта или у него самого встречалась любая из перечисленных болезней, дисфункций, резистентностей или расстройств.
10. Способ по любому из пп.1-7, отличающийся тем, что субъект имеет симптомы любой из перечисленных болезней, дисфункций, резистентностей или расстройств.
11. Способ улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, при котором указанному субъекту вводят фармацевтически эффективное количество соединения, имеющего следующее строение:
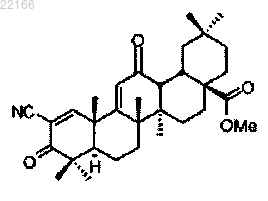
12. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят местно.
13. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят системно.
14. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят перорально, внутрижировым введением, внутриартериально, внутрисуставно, внутричерепно, внутрикожно, внутрь повреждения, внутримышечно, внутриназально, в глаза, в перикардий, внутрибрюшинно, внутриплеврально, внутрипростатно, внутриректально, подоболочечно, внутритрахеально, внутриопухолево, внутрипуповинно, внутривагинально, внутривенно, внутрипузырчато, внутристекловидно, липосомно, местно, на слизистую, перорально, парентерально, ректально, подконъюктивально, подкожно, подъязычно, наружно, трансбуккально, чрескожно, вагинально, в кремах, в липидных составах, через катетер, орошением, непрерывной инфузией, вливанием, ингаляцией, инъекцией, местной доставкой, локальной перфузией, непосредственным омыванием клеток-мишеней либо сочетанием указанного.
15. Способ по п.14, отличающийся тем, что соединение вводят внутривенно, внутриартериально или перорально.
16. Способ по п.15, отличающийся тем, что соединение вводят перорально.
17. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество представляет собой дневную дозу от около 0,1 до около 500 мг соединения.
18. Способ по п.17, отличающийся тем, что дневная доза составляет от около 1 до около 300 мг соединения.
19. Способ по п.18, отличающийся тем, что дневная доза составляет от около 10 до около 200 мг соединения.
20. Способ по п.19, отличающийся тем, что дневная доза составляет около 25 мг соединения.
21. Способ по п.19, отличающийся тем, что дневная доза составляет около 75 мг соединения.
22. Способ по п.19, отличающийся тем, что дневная доза составляет около 150 мг соединения.
23. Способ по п.17, отличающийся тем, что дневная доза составляет от около 0,1 до около 30 мг соединения.
24. Способ по п.23, отличающийся тем, что дневная доза составляет от около 0,5 до около 20 мг соединения.
25. Способ по п.24, отличающийся тем, что дневная доза составляет от около 1 до около 15 мг соединения.
26. Способ по п.25, отличающийся тем, что дневная доза составляет от около 1 до около 10 мг соединения.
27. Способ по п.26, отличающийся тем, что дневная доза составляет от около 1 до около 5 мг соединения.
28. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество представляет собой дневную дозу 0,01-25 мг состава на 1 кг массы тела.
29. Способ по п.28, отличающийся тем, что дневная доза составляет 0,05-20 мг состава на 1 кг массы тела.
30. Способ по п.29, отличающийся тем, что дневная доза составляет 0,1-10 мг состава на 1 кг массы тела.
31. Способ по п.30, отличающийся тем, что дневная доза составляет 0,1-5 мг состава на 1 кг массы тела.
32. Способ по п.31, отличающийся тем, что дневная доза составляет 0,1-2,5 мг состава на 1 кг массы тела.
33. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество вводят в виде разовой дозы в день.
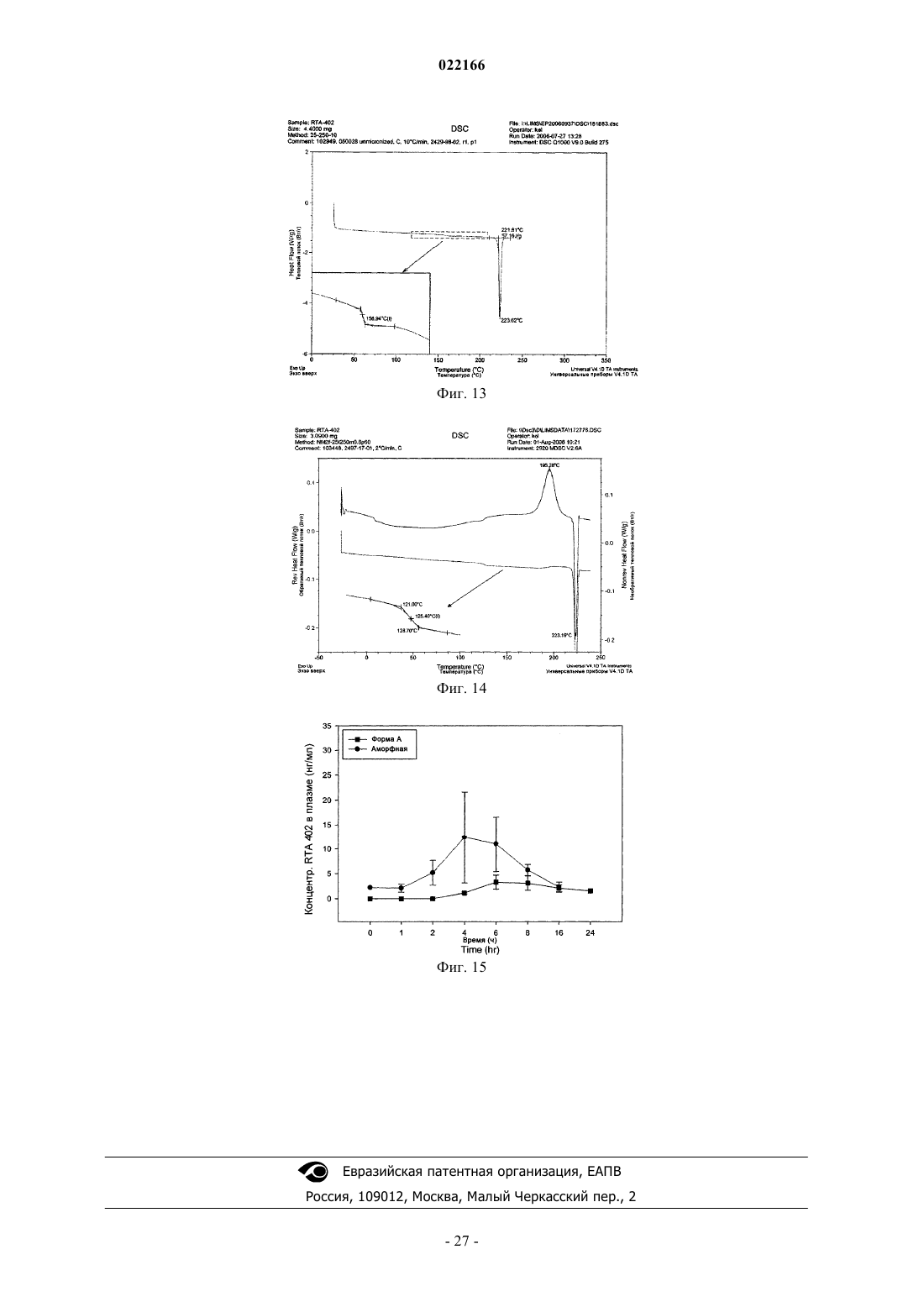
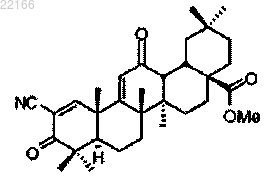
34. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество вводят двумя или более дозами в день.
35. Способ по любому из пп.1-11, отличающийся тем, что субъектом является примат.
36. Способ по п.35, отличающийся тем, что приматом является человек.
37. Способ по любому из пп.1 или 11, отличающийся тем, что субъектом является корова, лошадь, собака, кошка, свинья, мышь, крыса или морская свинка.
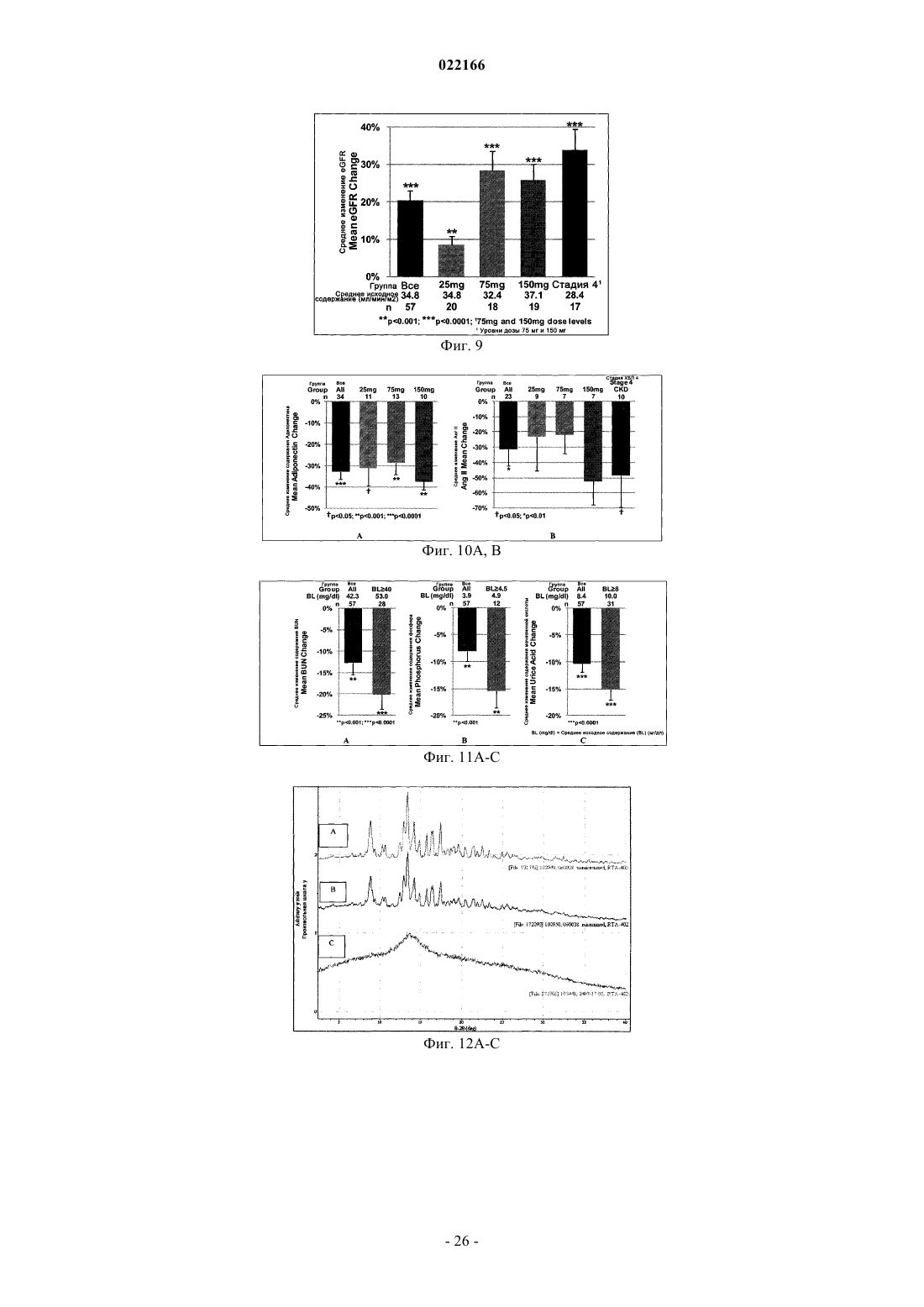
38. Способ по пп.1-37, отличающийся тем, что по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является кристаллической формой с картиной порошковой рентгенодифракции (CuKα), имеющей значащие максимумы дифракции при около 8,8, 12,9, 13,4, 14,2 и 17,4°2θ.
39. Способ по п.38, отличающийся тем, что картина порошковой рентгенодифракции (CuKα) в основном такая, как показано на фиг. 12А или 12В.
40. Способ по п.37, отличающийся тем, что по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является аморфной формой с картиной порошковой рентгенодифракции (CuKα), имеющей галопик приблизительно при 13,5°2θ, в основном как показано на фиг. 12С, а также имеет Tg.
41. Способ по п.40, отличающийся тем, что величина Tg находится в пределах от около 120 до около 135°С.
42. Способ по п.41, отличающийся тем, что величина Tg находится в пределах от около 125 до около 130°С.
43. Применение соединения, имеющего строение
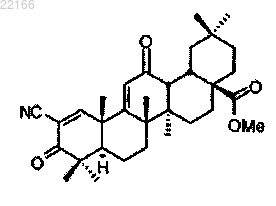
для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта.
44. Применение по п.43, отличающееся тем, что субъектом является примат, в частности человек, корова, лошадь, собака, кошка, свинья, мышь, крыса или морская свинка.
45. Фармацевтическая композиция для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, содержащая терапевтически эффективное количество соединения, имеющего следующее строение:
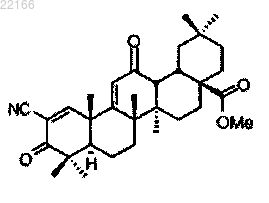
и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом.
46. Фармацевтическая композиция для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, содержащая терапевтически эффективное количество соединения, имеющего следующее строение:
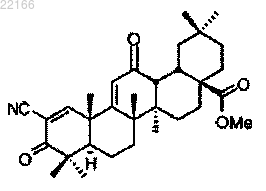
и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом.
47. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что соединение приготовляют в виде твердой или мягкой капсулы, таблетки, сиропа, суспензии, твердой дисперсии, облатки или эликсира.
48. Фармацевтическая композиция по п.47, отличающаяся тем, что соединение приготовляют в виде твердой дисперсии.
49. Фармацевтическая композиция по п.47, отличающаяся тем, что мягкая капсула выполнена в виде желатиновой капсулы.
50. Фармацевтическая композиция по п.49, отличающаяся тем, что дополнительно используют защитную оболочку.
51. Фармацевтическая композиция по п.49, отличающаяся тем, что дополнительно используют средство, задерживающее рассасывание.
52. Фармацевтическая композиция по п.47, отличающаяся тем, что дополнительно используют средство, улучшающее растворимость или диспергируемость.
53. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что соединение диспергируют в липосомах, эмульсии масло-в-воде или эмульсии вода-в-масле.
54. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что эксципиент является синтетическим органическим полимером.
55. Фармацевтическая композиция по п.54, отличающаяся тем, что эксципиент выбран из группы, содержащей гидроксипропилметилцеллюлозу, поли[1-(2-оксо-1-пирролидинил)]этилен или их сополимер и сополимер метакриловой кислоты и метилметакрилата.
56. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является гидроксипропилметилцеллюлозы фталат.
57. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является ПВП/ВА.
58. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является сополимер метакриловой кислоты и этилакрилата (1:1).
59. Фармацевтическая композиция по п.54, отличающаяся тем, что эксципиентом является коповидон.
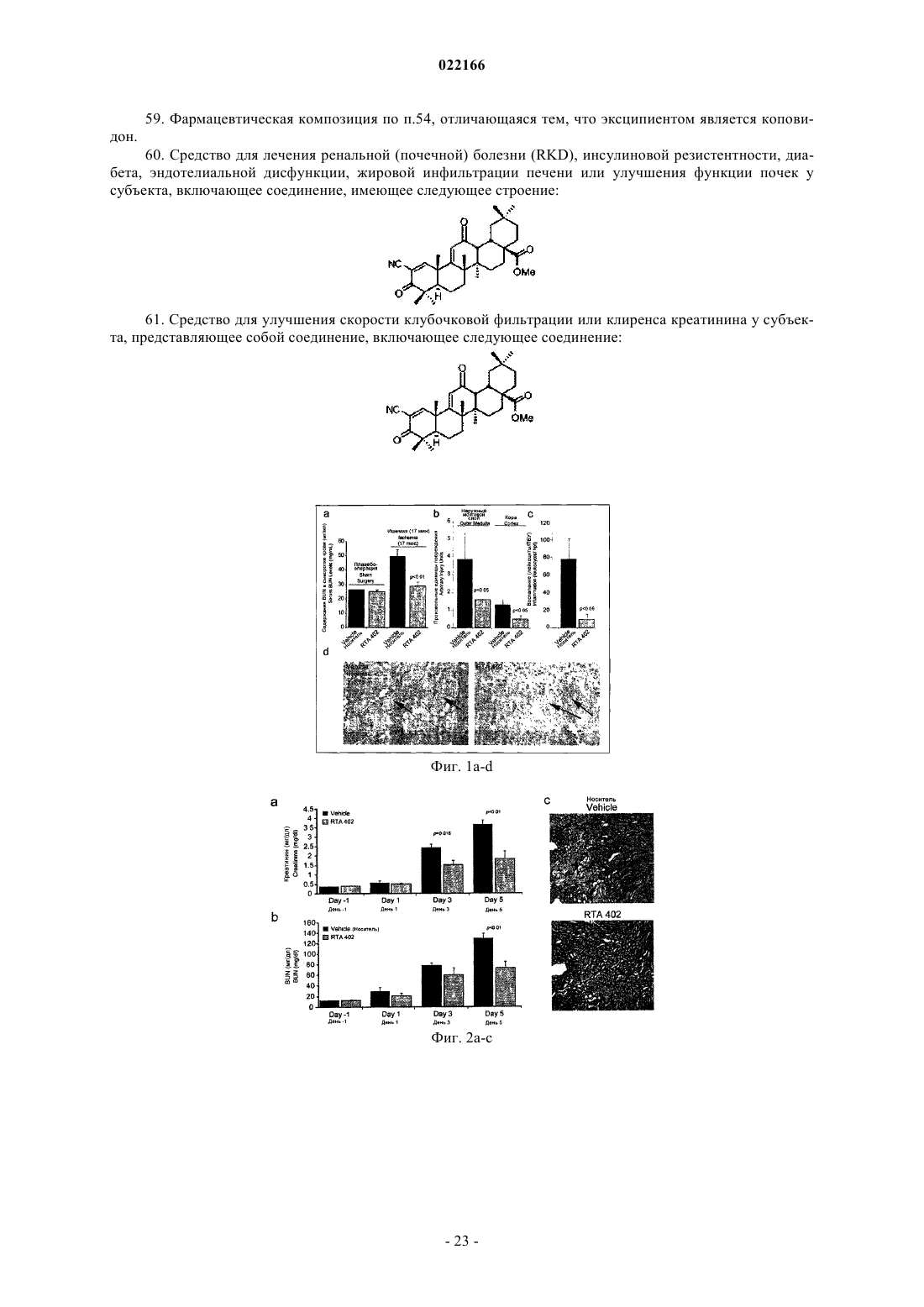
60. Средство для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, включающее соединение, имеющее следующее строение:
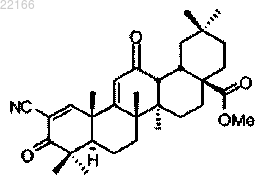
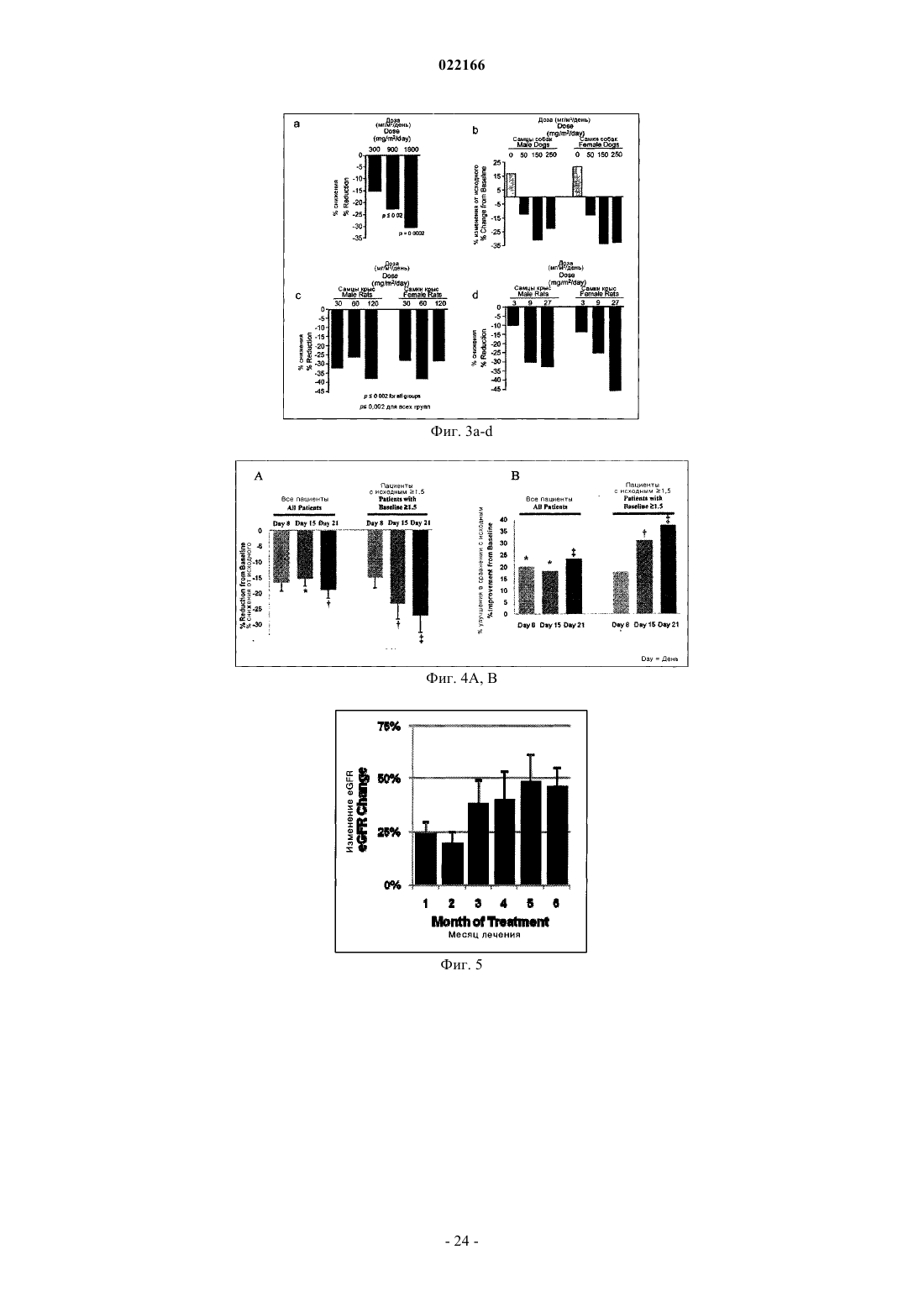
61. Средство для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, представляющее собой соединение, включающее следующее соединение:
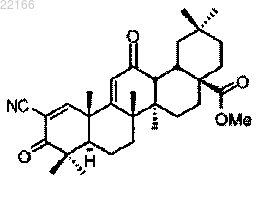
Текст
Изобретение относится к способам лечения и предупреждения ренальной/почечной болезни,инсулиновой резистентности/диабета, жировой инфильтрации печени и/или эндотелиальной дисфункции/сердечно-сосудистого заболевания с применением синтетических тритерпеноидов,возможно, в сочетании с дополнительным лечением или профилактикой. Спон Майкл, Либи Карэн, Гриббл Гордон В., Хандэ Тадаши, Крал Роберт М., Мэйэр Колин Джей (US) Медведев В.Н., Павловский А.Н. (RU)(71)(73) Заявитель и патентовладелец: РИТЭ ФАМЭСУТИКЛС, ИНК.; ТРАСТИС ОФ ДАТМФ КАЛИДЖ Область изобретения Настоящее изобретение в целом относится к биологии и медицине. В частности, оно относится к веществам и способам для лечения и/или предупреждения ренальных (почечных) заболеваний, инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени и сердечнососудистых заболеваний (ССЗ). Описание известного уровня техники Почечная недостаточность, приводящая к недостаточному выведению отходов метаболизма из крови и к ненормальному содержанию электролитов в крови, представляет собой серьезную проблему для медицины во всем мире, в особенности в развитых странах. Диабет и гипертония входят в число наиболее существенных причин хронической почечной недостаточности, известной также как хроническая болезнь почек (ХБП), при этом она также связана с иными заболеваниями, такими как волчанка или системное сердечно-сосудистое заболевание. При таких заболеваниях часто имеет место дисфункция сосудистого эндотелия, которая считается основным фактором, способствующим развитию хронической болезни почек. Острая почечная недостаточность может возникать вследствие воздействия некоторых лекарственных препаратов (например, ацетаминофена) или токсических химикатов либо в результате ишемического и реперфузионного повреждения в связи с шоком или хирургическими операциями, такими как трансплантация, при этом в конечном счете она может перейти в ХБП. У многих пациентов ХБП проходит до конечной стадии почечной болезни (КСПБ), когда пациенту требуется произвести пересадку почки или проводить регулярный диализ для продления жизни. Обе эти процедуры весьма инвазивны и связаны с серьезными побочными явлениями и с проблемами качества жизни. Хотя имеются эффективные методы лечения некоторых осложнений почечной недостаточности, таких как гиперпаратиреоз и гиперфосфатемия, ни один из существующих методов лечения не показал способности останавливать или обращать вспять прогрессирование почечной недостаточности. Таким образом, средства, которые смогли бы улучшать нарушенную работу почек, представляли бы собой существенный прогресс в лечении почечной недостаточности. Тритерпеноиды, которые являются продуктами биосинтеза растений, получаемыми в ходе циклизации сквалена, используют в лечебных целях во многих странах Азии, при этом известно, что некоторые из них, такие как урсоловая и олеаноловая кислоты, являются противовоспалительными и противораковыми веществами (Huang et al., 1994; Nishino et al., 1988). Однако биологическая активность этих встречающихся в природе молекул сравнительно невелика, вследствие чего были сделаны попытки синтеза новых аналогов с целью повышения эффективности (Honda et al., 1997; Honda et al., 1998). Непрекращающаяся работа, направленная на совершенствование противовоспалительного и антипролиферативного действия аналогов олеанолевой и урсоловой кислот, привела к открытию 2-циано-3,12-диоксоолеан 1,9(11)-диен-28-овой кислоты (CDDO) и связанных с ней соединений (Honda et al., 1997, 1998, 1999,2000 а, 2000b, 2002; Suh et al., 1998; 1999; 2003; Place et al., 2003; Liby et al., 2005). Были выделены несколько эффективных производных олеанолевой кислоты, в том числе метиловый эфир 2-циано-3,12 диоксоолеан-1,9(11)-диен-28-овой кислоты (CDDO-Me; RTA402). RTA402 подавляет индуцирование нескольких важных воспалительных медиаторов, таких как iNOS, COX-2, TNF и IFN в активированных макрофагах. Известно также, что RTA402 активирует сигнальный путь Keapl/Nrf2/ARE, что приводит к продуцированию нескольких противовоспалительных и противоокислительных белков, таких как гемоксигеназа-1 (НО-1). Благодаря этим свойствам RTA402 становится кандидатом для лечения неопластических и пролиферативных заболеваний, таких как рак. Способность этого соединения и связанных с ним молекул лечить и/или предотвращать заболевания почек и сердечно-сосудистые заболевания остается неиспытанной. Существо изобретения Настоящее изобретение направлено на создание нового способа лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, при котором указанному субъекту вводят фармацевтически эффективное количество соединения, имеющего следующее строение: В одном из вариантов способа субъект страдает RKD, где RKD может представлять собой диабетическую нефропатию (ДН). В одном из вариантов способа субъект страдает инсулиновой резистентностью. В одном из вариантов способа субъект страдает диабетом. В одном из вариантов способа субъект страдает эндотелиальной дисфункцией. В одном из вариантов способа субъект страдает жировой инфильтрацией печени. В одном из вариантов способа дополнительно определяют субъекта, нуждающегося в лечении лю-1 022166 бой из указанных болезней, дисфункций, резистентностей или расстройств. В одном из вариантов способа в семейном анамнезе субъекта или у него самого встречалась любая из перечисленных болезней, дисфункций, резистентностей или расстройств. В одном из вариантов способа субъект имеет симптомы любой из перечисленных болезней, дисфункций, резистентностей или расстройств. В еще одном аспекте настоящее изобретение направлено на создание нового способа улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, при котором указанному субъекта вводят фармацевтически эффективное количество соединения, имеющего следующее строение: В одном из вариантов способа соединение вводят местно, в другом - системно. Согласно другим вариантам способа соединение вводят перорально, внутрижировым введением,внутриартериально, внутрисуставно, внутричерепно, внутрикожно, внутрь повреждения, внутримышечно, внутриназально, в глаза, в перикардий, внутрибрюшинно, внутриплеврально, внутрипростатно, внутриректально, подоболочечно, внутритрахеально, внутриопухолево, внутрипуповинно, внутривагинально,внутривенно, внутрипузырчато, внутристекловидно, липосомно, местно, на слизистую, перорально, парентерально, ректально, подконъюктивально, подкожно, подъязычно, наружно, трансбуккально, чрескожно, вагинально, в кремах, в липидных составах, через катетер, орошением, непрерывной инфузией,вливанием, ингаляцией, инъекцией, местной доставкой, локальной перфузией, непосредственным омыванием клеток-мишеней либо сочетанием указанного. В одном из вариантов способа фармацевтически эффективное количество представляет собой дневную дозу от около 0,1 до около 500 мг соединения. В одном из вариантов способа дневная доза составляет от около 1 до около 300 мг соединения. В одном из вариантов способа дневная доза составляет от около 10 до около 200 мг соединения. В одном из вариантов способа дневная доза составляет около 25 мг соединения. В одном из вариантов способа дневная доза составляет около 75 мг соединения. В одном из вариантов способа дневная доза составляет около 150 мг соединения. В одном из вариантов способа дневная доза составляет от около 0,1 до около 30 мг соединения,предпочтительно от около 0,5 до около 20 мг соединения, еще более предпочтительно от около 1 до около 15 мг соединения, еще более предпочтительно от около 1 до около 10 мг соединения и наиболее предпочтительно от около 1 до около 5 мг соединения. В одном из вариантов способа фармацевтически эффективное количество представляет собой дневную дозу 0,01-25 мг состава на 1 кг массы тела. Предпочтительно дневная доза составляет 0,05-20 мг состава на 1 кг массы тела, более предпочтительно дневная доза составляет 0,1-10 мг состава на 1 кг массы тела, еще более предпочтительно дневная доза составляет 0,1-5 мг состава на 1 кг массы тела и наиболее предпочтительно дневная доза составляет 0,1-2,5 мг состава на 1 кг массы тела. В одном из вариантов способа фармацевтически эффективное количество вводят в виде разовой дозы в день. В одном из вариантов способа фармацевтически эффективное количество вводят двумя или более дозами в день. В одном из вариантов способа субъектом является примат, где приматом может быть человек. В одном из вариантов способа субъектом является корова, лошадь, собака, кошка, свинья, мышь,крыса или морская свинка. В одном из вариантов способа по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является кристаллической формой с картиной порошковой рентгенодифракции (CuK), имеющей значащие максимумы дифракции при около 8,8, 12,9, 13,4, 14,2 и 17,4 2. В одном из вариантов способа картина порошковой рентгенодифракции (CuK) в основном такая,как показано на фиг. 12 А или 12 В. В одном из вариантов способа по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является аморфной формой с картиной порошковой рентгенодифракции (CuK), имеющей гало пик приблизительно при 13,5 2, в основном как показано на фиг. 12 С, а также имеет Tg. В одном из вариантов способа величина Tg находится в пределах от около 120 до около 135 С. В одном из вариантов способа величина Tg находится в пределах от около 125 до около 130 С. Еще одним аспектом настоящего изобретения является применение соединения, имеющего строение: для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта. В одном из вариантов субъектом является примат, в частности человек, корова, лошадь, собака,кошка, свинья, мышь, крыса или морская свинка. Еще одним аспектом настоящего изобретения является фармацевтическая композиция для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъета, содержащая терапевтически эффективное количество соединения, имеющего следующее строение: и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом. Еще одним другим аспектом настоящего изобретения яавляется фармацевтическая композиция для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, содержащая терапевтически эффективное количество соединения, имеющего следующее строение: и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом. В одном из вариантов фармацевтической композиции соединение приготовляют в виде твердой или мягкой капсулы, таблетки, сиропа, суспензии, твердой дисперсии, облатки или эликсира. Предпочтительно соединение приготовляют в виде твердой дисперсии. Предпочтительно мягкая капсула выполнена в виде желатиновой капсулы. В одном из вариантов фармацевтической композиции дополнительно используют защитную оболочку. В одном из вариантов фармацевтической композиции дополнительно используют средство, задерживающее рассасывание. В одном из вариантов фармацевтической композиции дополнительно используют средство, улучшающее растворимость или диспергируемость. В одном из вариантов фармацевтической композиции соединение диспергируют в липосомах, масле, эмульсии масло-в-воде или эмульсии вода-в-масле. В одном из вариантов фармацевтической композиции эксципиент является синтетическим органическим полимером. В одном из вариантов фармацевтической композиции эксципиент выбран из группы, содержащей гидроксипропилметилцеллюлозу, поли[1-(2-оксо-1-пирролидинил)]этилен или их сополимер и сополимер метакриловой кислоты и метилметакрилата. В одном из вариантов фармацевтической композиции эксципиентом является гидроксипропилметилцеллюлозафталат. В одном из вариантов фармацевтической композиции эксципиентом является ПВП/ВА. В одном из вариантов фармацевтической композиции эксципиентом является сополимер метакриловой кислоты и этилакрилата (1:1). В одном из вариантов фармацевтической композиции эксципиентом является коповидон. Еще одним аспектом настоящего изобретения является средство для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, включающее соединение, имеющее следующее Еще одним другим аспектом настоящего изобретения является средство для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, представляющее собой соединение,включающее следующее соединение: Краткое описание чертежей Приведенные ниже чертежи входят в состав данного описания изобретения и приведены для дополнительной иллюстрации определенных аспектов настоящего изобретения. Изобретение можно лучше понять, обращаясь к одному или нескольким из этих чертежей, наряду с представленным ниже подробным описанием конкретных вариантов осуществления. Фиг. 1a-d - RTA 402 уменьшает повреждение почек в результате ишемии и реперфузии. Мышам ежедневно перорально желудочным зондом вводили RTA 402 в дозе 2 мг/кг или только наполнитель(кунжутное масло), начиная со дня 2. В день 0 для индуцирования ишемии и реперфузии левую почечную артерию пережимали на 17 мин, а затем снимали зажим. Фиг. 1 а - в день 1 брали кровь у животных с пережимом артерии и у контрольных животных, перенесших плацебо-операцию без пережима почечной артерии. В качестве показателя ренального повреждения измеряли содержание азота в крови и моче(BUN). Фиг. 1b-d - срезы почек мышей, проходивших лечение RTA402 или наполнителем, обследовали на предмет гистологического повреждения (фиг. 1b1d) и воспаления (фиг. 1 с). Фиг. 1d - черные стрелки(группа, проходившая лечение наполнителем) показывают два из многих сильно поврежденных канальцев во внешнем мозговом слое; красные стрелки (группа, проходившая лечение RTA 402) показывают два из многих неповрежденных канальцев во внешнем мозговом слое. Фиг. 2 а-с - RTA402 уменьшает ренальную токсичность, индуцированную цисплатином. Крысам ежедневно вводили перорально через желудочный зонд RTA 402 в дозе 10 мг/кг или просто наполнитель(кунжутное масло), начиная со дня -1. В день 0 крысам вводили внутривенно цисплатин в дозе 6 мг/кг. В указанные дни брали кровь и измеряли содержание креатинина (фиг. 2 а) и содержание азота в крови и моче (BUN) (фиг. 2b) в качестве показателей ренального повреждения. Наблюдалось статистически значимое различие между группами, проходившими лечение наполнителем и RTA 402, в день 3 (по креатинину) и в день 5 (по креатинину и BUN) (фиг. 2 с) У животных, проходивших лечение RTA 402, наблюдали меньше повреждений проксимальных канальцев в сравнении с проходившими лечение наполнителем животньми. Фиг. 3 а-d - RTA 402 уменьшает содержание креатинина в сыворотке крови у обезьян, собак и крыс(фиг. 3 а). Обезьянам cynomolgus ежедневно вводили перорально RTA402 в указанных дозах раз в день в течение 28 дней. Показано процентное понижение содержания креатинина в сыворотке крови в день 28 у обезьян, проходивших лечение RTA402, относительно проходивших лечение наполнителем контрольных обезьян (фиг. 3b). Собакам бигль ежедневно вводили перорально RTA 402 в указанных дозах в течение трех месяцев. Контрольным животным давали наполнитель (кунжутное масло). Показано процентное изменение содержания креатинина в сыворотке крови через три месяца в сравнении с исходным (фиг. 3 с). Крысам Sprague-Dawley перорально вводили раз в день RTA 402 в указанных дозах в течение одного месяца. Показано процентное снижение содержания креатинина в сыворотке крови по окончании исследования у проходивших лечение RTA 402 крыс в сравнении с проходившими лечение наполнителем контрольными крысами (фиг. 3d). Крысам Sprague-Dawley перорально вводили раз в день аморфную форму RTA 402 в указанной дозе в течение трех месяцев. Показано процентное снижение содержания креатинина в сыворотке крови по окончании исследования у проходивших лечение RTA402 крыс в сравнении с проходившими лечение наполнителем контрольными крысами (примечание: на фиг. 3 А, 3 С и 3D"% снижения", отложенный по вертикальной оси, показывает изменение в процентах. Например, показание -15 по этой оси указывает на снижение содержания креатинина в сыворотке крови на 15%). Фиг. 4 А, В - RTA 402 снижает содержание креатинина в сыворотке крови и повышает расчетную скорость клубочной фильтрации (eGFR) у больных раком людей. Фиг. 4 А - измеряли содержание креатинина в сыворотке крови у проходивших лечение RTA 402 пациентов в ходе клинического испытания фазы I лечения рака. Пациентам давали перорально ежедневно RTA402 в течение 21 дня в дозах от 5 до 1300 мг/день. Показано процентное снижение содержания креатинина в сыворотке крови в сравнении с исходным по указанным дням исследования. Наблюдали существенное снижение содержания креатинина в сыворотке крови в дни 15 и 21. Фиг. 4 В - расчетную скорость клубочковой фильтрации (eGFR) вычисляли для пациентов по фиг. 4 А. В обеих группах наблюдали значащие улучшения eGFR. Все пациенты: n=24; контрольные пациенты 1.5: n=5. На фиг. 4 А и 4 Возначает p0,04; означает р=0,01, а означает p0,01. Примечание: на фиг. 4 А "% снижения от исходного", отложенный по вертикальной оси, показывает изменение в процентах. Например, показание -15 по этой оси указывает на снижение содержания креатинина в сыворотке крови на 15%. Фиг. 5 - RTA 402 повышает GFR у больных раком людей. Расчетную скорость клубочковой фильтрации (eGFR) измеряли у проходивших лечение RTA 402 пациентов в ходе многомесячного клинического испытания лечения рака. В расчет вошли все пациенты (n=11), получавшие препарат в течение шести месяцев. Сведения о дозировках для этих пациентов приведены ниже в примере 5. Фиг. 6 - действие RTA 402 коррелирует с тяжестью. Снижение содержания гемоглобина A1c представлено в виде дробного показателя в сравнении с начальным уровнем. В группах с более высоким начальным уровнем, например со средним начальным уровнем 7,0% A1c или 7,6% А 1 с, наблюдали более заметное снижение. Группа всех включенных больных (ITT) охватывает всех пациентов (n=53), в том числе тех, которые начинают лечение с нормальной величиной A1c. Фиг. 7 - действие RTA 402 зависит от дозы. Представлено снижение гемоглобина A1c в сравнении с величиной исходного уровня. Гистограмма показывает средние результаты для всех пациентов с исходными величинами A1c7,0%, когорт с индивидуальными дозами из группы с исходными величинамиA1c7,0%, а также для пациентов с болезнью почек на стадии 4 (GFR 15-29 мл/мин), где n - число пациентов в каждой группе. Фиг. 8 - RTA 402 снижает количество циркулирующих эндотелиальных клеток (ЦЭК) и iNOSположительных ЦЭК. Представлено изменение среднего числа ЦЭК в клетках/мл для всех включенных больных (ITT) и групп с повышенным исходным уровнем до и после 28-дневного лечения RTA. Снижение в группе всех включенных больных составляло приблизительно 20%, а снижение в группе с повышенным исходным уровнем ( 5 ЦЭК/мл) составляло приблизительно 33%. Доля iNOS-положительных ЦЭК понизилась приблизительно на 29%. Фиг. 9 - дозозависимое обратимое повышение GFR за 28 дней. Лечение RTA 402 повышает GFR в зависимости от дозы. Включены все пригодные к оценке пациенты. Отмечено улучшение 30% у всех пациентов с болезнью почек в стадии 4. Фиг. 10 А, В - снижение содержания маркеров тяжести и исхода диабетической нефропатии. Отмечено улучшение по адипонектину (фиг. 10 А) и ангиотензину II (фиг. 10 В), содержание которых повышено у пациентов, страдающих диабетической нефропатией (ДН), и которые коррелируют с тяжестью болезни почек. Адипонектин является предвестником смертности от всех причин и конечной стадии болезни почек у пациентов с ДН. Включены все имеющиеся данные. Фиг. 11 А-С - RTA 402 значимо снижает содержание растворенных уремических веществ. Графики представляют средние изменения содержания BUN (фиг. 11 А), фосфора (фиг. 11 В) и мочевой кислоты(фиг. 11 С) у всех пациентов и у пациентов с повышенным исходным уровнем конкретного растворенного вещества. Фиг. 12 А-С - спектры порошковой рентгенодифракции (XRPD) форм А и В RTA 402. Фиг. 12 А показывает немелкодисперсную форму А; фиг. 12 В показывает мелкодисперсную форму А; фиг. 12 С показывает форму В. Фиг. 13 - кривая дифракционной сканирующей калориметрии с модулированной температурой(MDSC) для формы A RTA402. Показанный в развернутом виде участок кривой соответствует температуре стеклования (Tg). Фиг. 14 - кривая дифракционной сканирующей калориметрии с модулированной температурой(MDSC) для формы В RTA402. Показанный в развернутом виде участок кривой соответствует температуре стеклования (Tg). Фиг. 15 - повышенная биодоступность формы В (аморфной) у обезьян cynomolgus. Эта иллюстрация показывает репрезентативное воспроизведение зоны под кривой для формы А и формы В после перорального введения 4,1 мг/кг обезьянам cynomolgus. Каждая точка данных представляет среднюю концентрацию CDDO-Me в плазме крови у 8 животных. Столбики погрешности представляют стандартное отклонение в популяции выборки. Описание примеров осуществления В данном изобретении термин "IC50" относится к ингибирующей дозе, составляющей 50% максимального полученного ответа. Применительно к изобретению термин "пациент" или "подопытный" относится к живым организмам млекопитающих, таким как человек, обезьяна, корова, овца, коза, собака, кошка, мышь, крыса, морская свинка или их трансгенные виды. В некоторых вариантах осуществления пациентом или подопытным является примат. Среди прочего примерами подопытных-людей являются взрослые, дети и подростки, младенцы и плоды."Фармацевтически приемлемый" означает "пригодный для приготовления фармацевтической композиции, которая в целом безопасна, не токсична либо не является биологически или в ином смысле нежелательной и включает все, что допустимо для применения в ветеринарии и в фармацевтике для человека.""Предупреждение" включает (1) подавление возникновения заболевания у подопытного или пациента, который может иметь риск и/или может быть предрасположен к заболеванию, но еще не имеет и не демонстрирует любую или всю патологию или симптоматику заболевания, и/или (2) замедление возникновения патологии или симптоматики заболевания у подопытного или пациента, который может иметь риск и/или может быть предрасположен к заболеванию, но еще не имеет и не демонстрирует любую или всю патологию или симптоматику заболевания."Терапевтически эффективное количество" или "фармацевтически эффективное количество" означает, что это количество при введении подопытному или пациенту для лечения болезни будет достаточным для такого лечения болезни."Лечение" включает (1) подавление заболевания у подопытного или пациента, имеющего или демонстрирующего патологию или симптоматику заболевания (например, прекращение дальнейшего развития патологии и/или симптоматики); (2) улучшение хода болезни у подопытного или пациента, имеющего или демонстрирующего патологию или симптоматику заболевания (например, обращение вспять патологии и/или симптоматики); и/или (3) достижение любого измеряемого ослабления болезни у подопытного или пациента, имеющего или демонстрирующего патологию или симптоматику заболевания. В рамках данного изобретения термин "водорастворимый" означает, что соединение растворяется в воде, по меньшей мере, в концентрации 0,010 моль/л или считается растворимым по литературным источникам. Прочие употребляемые сокращения: DMSO - диметилсульфоксид (ДМСО); NO - оксид азота;iNOS - индуцируемая синтаза оксида азота; СОХ-2 - циклооксигеназа-2; NGF - нейротрофический ростовой фактор (НРФ); IBMX - изобутилметилксантин (ИБМК); FBS - эмбриональная коровья сыворотка крови; GPDH - глицерол 3-фосфатдегидрогеназа (ГФДГ); RXR - ретиноидный X рецептор; TGF- трансформирующий ростовой фактор- (ТРФ-бета); IFN или IFN- - гамма-интерферон; LPS - бактериальный эндотоксический липополисахарид; TNF или TNF-, - некротический опухолевый фактор-;IL-1 - интерлейкин-1; GAPDH, глицеральдегид-3-фосфатдегидрогеназа (ГА-3-ФДГ); МТВЕ - метилтрет-бутиловый эфир (МТБЭ); МТТ - 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиум бромид; ТСА - трихлоруксусная кислота (ТХУК); НО-1 - индуцируемая гем-оксигеназа. Приведенные выше определения заменяют любое противоречивое определение, включенное в данное изобретение путем отсылки. Синтетические тритерпеноиды. Тритерпеноиды - продукты биосинтеза растений циклизацией сквалена - применяют в лечебных целях во многих странах Азии, при этом известно, что некоторые из них, такие как урсоловая и олеаноловая кислоты, являются противовоспалительными и противораковыми веществами (Huang et al., 1994;Nishino et al., 1988). Однако биологическая активность этих встречающихся в природе молекул сравнительно невелика, вследствие чего были предприняты попытки синтеза новых аналогов для повышения эффективности этих веществ (Honda et al., 1997; Honda et al., 1998). В результате последующих исследований был выделен ряд синтетических соединений с повышенной активностью в сравнении с встречающимися в природе тритерпеноидами.RTA 402 (бардоксолон метил) - одно из соединений для применения в предлагаемых способах - является антиоксидантным модулятором воспаления (AIM) в клинической разработке воспалительных и связанных с раком показаний, который подавляет иммуноопосредованное воспаление путем восстановления восстановительно-окислительного гомеостаза в воспаленных тканях. Он индуцирует цитопротекторный транскрипционный фактор Nrf2 и подавляет деятельность факторов транскрипции ускорения окисления NF-В и STAT3. RTA 402 показал in vivo существенное для одного средства противовоспалительное действие на некоторых моделях воспаления у животных, таких как воспалительное ренальное повреждение в модели с цисплатином и острое ренальное повреждение в модели ишемии и реперфузии. Помимо этого, у пациентов наблюдали значащие снижения содержания креатинина в сыворотке крови при лечении RTA 402. Согласно одному аспекту изобретения предлагаемое соединение можно использовать для лечения подопытного, страдающего почечной болезнью или заболеванием, вызванным повышенными уровнями оксидативного стресса в одной или нескольких тканях. Оксидативный стресс может сопровождаться либо острым, либо хроническим воспалением. Оксидативный стресс может быть вызван острым воздействием внешнего фактора, такого как ионизирующее облучение или средство цитотоксической химиотерапии (например, доксорубицина), травмой или иным острым повреждением ткани, ишемическим и реперфузионным повреждением, плохим кровообращением или анемией, локальной или системной гипоксией или гипероксией либо иными ненормальными физиологическими состояниями, такими как гипергликемия или гипогликемия. Соответственно при патологиях с одним лишь оксидативным стрессом или с осложнением в виде воспаления лечение может включать прием терапевтически эффективного количества предлагаемого соединения, такого как описанное в данном описании изобретения. Лечение может проводиться либо заблаговременно до прогнозируемого состояния оксидативного стресса (т.е. до пересадки органа или проведения терапии ракового пациента) либо его можно проводить терапевтически в случаях установленного оксидативного стресса и воспаления. Предлагаемое соединение можно получать методами, описанными Honda et al. (1998), Honda et al.(2000b), Honda et al. (2002), Yates et al. (2007), а также в патентах США 6326507 и 6974801, которые включены в данное изобретение путем отсылки. Соединения, такие как те, которые показаны выше в таблице, структурно подобны RTA402 и во многих случаях имеют подобные биологические свойства, указанные выше. В дополнительных примерах, приведенных в табл. 1, для нескольких из этих соединений сведены результаты in vitro при предва-7 022166 рительной обработке макрофагов RAW264.7 ДМСО или лекарственными препаратами при различных концентрациях (нМ) в течение 2 ч с последующей обработкой 20 нг/мл IFN в течение 24 ч. Концентрацию NO в средах определяли с помощью системы реагентов Griess; жизнеспособность клеток определяли реагентом WST-1. NQO1 CD представляет концентрацию, необходимую для двукратного повышения экспрессии NQO1 - регулируемого Nrf2 фермента антиоксиданта в клетках гепатоаденомы мышейHepa1clc7 (Dinkova-Kostova et al., 2005). Все эти результаты на порядок выше по активности, чем, например, для исходной молекулы олеаноловой кислоты. Это частично объясняется тем, что индуцирование путей антиоксиданта вследствие активации Nrf2 обеспечивает важные защитные воздействия против оксидативного стресса и воспаления, вследствие чего связанные с RTA 402 соединения могут также давать значительные выгоды, аналогичные тем, которые представлены в данном изобретении в отношенииRTA402, при этом такие родственные соединения могут, благодаря этому, использоваться для лечения и/или предупреждения заболеваний, таких как ренальная (почечная) болезнь (RKD), инсулиновая резистентность, диабет, эндотелиальная дисфункция, жировая инфильтрация печени, сердечно-сосудистые заболевания (ССЗ) и связанные с ними расстройства. Таблица 1 Подавление продуцирования NO, индуцированного IFN Полиморфные формы CDDO-Me. В предлагаемых способах можно использовать полиморфные формы соединений, например формы А и В CDDO-Me. Форма В характеризуется биодоступностью, которая на удивление выше, чем у формы А (фиг. 15). В частности, биодоступность формы В была выше, чем у формы A CDDO-Me у обезьян, которые получали эквивалентные дозы двух форм перорально в виде желатиновых капсул (заявка на патент США 12/191176 от 13 августа 2008 г.). Форма A CDDO-Me (RTA402) несольватированная (не водная), при этом ее можно считать характерной кристаллической структурой с пространственной группой Р 43 212 ( 96) с размерами элементарной ячейки а=14,2 , b=14,2 и с=81,6 , имеющей также характерную структуру упаковки с тремя молекулами, упакованными по спирали вдоль кристаллографической оси b. В некоторых вариантах форму А можно также охарактеризовать картиной порошковой рентгенодифракции (XRPD) (CuK), имеющей значащие максимумы дифракции около 8,8, 12,9, 13,4, 14,2 и 17,4 2. В некоторых случаях картина порошковой рентгенодифракции для формы А в основном такая, как показано на фиг. 12 А или 12 В. В отличие от формы А форма В CDDO-Me - однофазная, но не имеет такого выраженного кристаллического строения. Образцы формы В не показывают дальних корреляций молекул, т.е. приблизительно около 20 . Кроме того, тепловой анализ образцов формы В показывает, что температура стеклования(Tg) находится в пределах от около 120 до около 130 С (фиг. 14). В отличие от этого, неупорядоченный нанокристаллический материал не имеет Tg, а вместо этого имеет только точку плавления (Tm), выше которой кристаллическая структура переходит в жидкое состояние. Форма В характеризуется спектром порошковой рентгенодифракции (фиг. 12 С), отличающимся от формы А (фиг. 12 А или 12 В). Не обладая выраженным кристаллическим строением, форма В также не имеет и таких выделяющихся пиков порошковой рентгенодифракции, как те, которые характеризуют форму А, и вместо этого характеризуется общим "гало" картины порошковой рентгенодифракции. В частности, некристаллическая форма В подпадает под категорию рентгеноаморфных твердых веществ, так как ее картина порошковой рентгенодифракции имеет три или меньше первичных гало дифракции. В этой категории форма является "стекловидным" материалом. Форму А и форму В CDDO-Me легко получают из различных растворов соединения. Например,форму В можно получать быстрым испарением или медленным испарением в МТБЭ, ТГФ, толуоле или этилацетате. Форму А можно получать несколькими способами, в том числе быстрым испарением, медленным испарением или медленным охлаждением раствора CDDO-Me в этаноле или метаноле. Препараты CDDO-Me в ацетоне могут давать либо форму А при быстром испарении, либо форму В при медленном испарении. Можно использовать сочетание различных средств определения для различения формы А и формы В CDDO-Me между собой и от других форм CDDO-Me. Примерами подходящих для этого методик яв-8 022166 ляются твердотельный ядерно-магнитный резонанс (ЯМР), порошковая рентгенодифракция (сравним фиг. 12 А и В с 12 С), рентгенокристаллография, дифференциальная сканирующая калориметрия (DSC)(сравним фиг. 13 с 14), динамическая паровая сорбция/десорбция (DVS), анализ по методу Карла Фишера (КФ), дифференциальная сканирующая калориметрия с модулируемой температурой, преобразование Фурье - ИК спектроскопия (FT-IR) и Рамановская спектроскопия. В частности, анализ данных порошковой рентгенодифракции и дифференциальной сканирующей калориметрии позволяет различать форму А,форму В и гемибензольные формы CDDO-Me (заявка на патент США 12/191176 от 13 августа 2008 г.). Дополнительные сведения по поводу полиморфных форм CDDO-Me приведены в предварительной заявке на патент США 60/955939 от 15 августа 2007 г. и в соответствующей непредварительной заявке на патент США 12/191176 от 13 августа 2008 г., при этом обе заявки целиком включены в данное изобретение путем отсылки. Применение тритерпеноидов для лечения хронической болезни почек, инсулиновой резистентности/диабета и эндотелиальной дисфункции/сердечно-сосудистых заболеваний. Предлагаемое соединение и способы можно применять для лечения различных видов ренальной(почечной) болезни, в том числе при острых и хронических заболеваниях. В целом способ заключается во введении подопытным фармацевтически эффективных количеств предлагаемого соединения. Воспаление вносит существенный вклад в патологию хронической болезни почек (ХБП). Существует также сильная механистическая связь между оксидативным стрессом и ренальной дисфункцией. Сигнальный путь NF-В играет важную роль в прогрессировании ХБП, так как NF-В регулирует транскрипцию МСР-1 - хемокина, ответственного за пополнение моноцитов/макрофагов, приводя к воспалительному ответу, который в конечном счете повреждает почку (Wardle, 2001). Путь Keapl/Nrf2/ARE регулирует транскрипцию нескольких генов, кодирующих ферменты антиоксидантов, в том числе гемоксигеназу-1 (НО-1). Удаление гена Nrf2 у самок мышей приводит к развитию подобного волчанке гломерулярного нефрита (Yoh et al., 2001; Ma et al., 2006). Кроме того, в нескольких исследованиях было показано, что экспрессия НО-1 индуцируется в ответ на ренальное повреждение и воспаление и что фермент и его продукты - билирубин и окись углерода - играют в почке защитную роль (Nath et al., 2006). Клубочек и окружающая его Боуменова капсула являются основным функциональным элементом почки. Скорость клубочковой фильтрации (СКФ) является стандартной мерой работы почки. Для измерения СКФ обычно используют клиренс креатинина. В то же время, содержание креатинина в сыворотке крови обычно используют в качестве косвенной меры клиренса креатинина. Например, обычно считается, что чрезмерное содержание креатинина в сыворотке крови указывает на недостаточную функцию почек, а снижение содержания креатинина в сыворотке крови со временем считается показателем улучшения функции почек. Нормальные уровни содержания креатинина в крови составляют приблизительно от 0,6 до 1,2 мг на 1 дл у взрослых мужчин и от 0,5 до 1,1 мг на 1 дл у взрослых женщин. Острое почечное повреждение (ОПП) может произойти в результате ишемии и реперфузии, лечения некоторыми фармакологическими средствами, такими как цисплатин и рапамицин, а также в результате внутривенного введения радиоконтрастных средств, используемых в медицинской визуализации. Как и при ХБП, воспаление и оксидативный стресс способствуют патологии ОПП. Молекулярные механизмы, лежащие в основе радиоконтрастной нефропатии (RCN), не до конца понятны, однако, вероятно,сочетание событий, включая длительную вазоконстрикцию, ухудшенную авторегуляцию почек и непосредственную токсичность контрастного вещества, в целом способствует почечной недостаточности(Tumlin et al., 2006). Вазоконстрикция приводит к уменьшению потока крови в почках и вызывает ишемию и реперфузию, а также продуцирование реакционноспособных видов кислорода. В этих условиях сильно индуцируется НО-1, при этом было показано, что она предотвращает ишемическое и реперфузионное повреждение в нескольких различных органах, в том числе в почке (Nath et al., 2006). В частности,показано, что индуцирование НО-1 является защитным в модели радиоконтрастной нефропатии у крысRCN (Goodman et al., 2007). Реперфузия также индуцирует воспалительный ответ, частично активированием подачи сигналов NF-В (Nichols, 2004). Было предложено использовать NF-В в качестве показателя в составе терапевтической стратегии во избежание повреждения органов (Zingarelli et al., 2003). Не привязываясь к теории, эффективность предлагаемых соединений, например RTA 402, большей частью обеспечивается введением ,-ненасыщенных карбонильных групп. По результатам проб in vitro большая часть активности соединений может ликвидироваться введением дитиотреитола (ДТТ), Nацетилцистеина (NAC) или глютатиона (GSH), а также содержащих тиол компонентов, взаимодействующих с ,-ненасыщенными карбонильными группами (Wang et al., 2000; Ikeda et al., 2003; 2004;Shishodia et al., 2006). Биохимические пробы позволили установить, что RTA402 непосредственно взаимодействует с критическим остатком цистеина (С 179) на IKK (см. ниже) и ингибирует его активность(Shishodia et al., 2006; Ahmad et al., 2006). IKK регулирует активирование NF-В по "классическому" пути, включающему вызванную фосфорилированием деградацию IВ, что приводит к выделению димеров NF-В в ядро. В макрофагах этот путь отвечает за продуцирование многих провоспалительных молекул в ответ на TNF и другие провоспалительные стимулы.RTA402 также ингибирует сигнальный путь JAK/STAT на многих уровнях. Белки JAK набираются в трансмембранные рецепторы (например, IL-6R) после активирования лигандов, таких как интерфероны и интерлейкины. Белки JAK затем фосфорилируют внутриклеточную часть рецептора, вызывающего пополнение факторов транскрипции STAT. Белки STAT далее фосфорилируются белками JAK, образуют димеры и перемещаются в ядро, где они активируют транскрипцию нескольких генов, участвующих в воспалении. RTA402 ингибирует фосфорилирование основного и индуцированного посредством IL-6STAT3 и образование димеров и непосредственно связывается с остатками цистеина в STAT3 (С 259) в домене киназы JAK1 (С 1077). Биохимические пробы также установили, что тритерпеноиды непосредственно взаимодействуют с критическими остатками цистеина на Keapl (Dinkova-Kostova et al., 2005).Keapl - это привязанный актином белок, который в нормальных условиях удерживает фактор транскрипции Nrf2 заключенным в цитоплазму (KobayashiYamamoto, 2005). Оксидативный стресс приводит к окислению регулирующих остатков цистеина на Keapl и вызывает освобождение Nrf2. Далее Nrf2 перемещается в ядро и связывается с элементами антиоксидантного ответа (ARE), приводя к активированию транскрипции многих антиоксидативных и противовоспалительных генов. Другой мишенью путиKeapl/Nrf2/ARE является гем-оксигеназа 1 (НО-1). НО-1 расщепляет гем на билирубин и окись углерода и выполняет многие антиоксидантные и противовоспалительные функции (MainesGibbs, 2005). Недавно было показано, что НО-1 сильно индуцируется тритерпеноидами (Liby et al., 2005), в том числеRTA402. Показано также, что RTA402 и многие структурные аналоги эффективно индуцируют экспрессию других белков фазы 2 (Yates et al., 2007).RTA 402 является эффективным ингибитором активирования NF-В. Помимо этого, RTA 402 активирует путь Keapl/Nrf2/ARE и индуцирует экспрессию НО-1. Как будет показано ниже, RTA 402 продемонстрировал активность на двух моделях ОПП у животных. Далее, наблюдали пониженное содержание креатинина в сыворотке крови и улучшение клубочковой фильтрации у большинства пациентов-людей,которых лечили препаратом RTA 402 (см. примеры ниже). Наблюдали значащие улучшения в фазе II исследования на пациентах с диабетической нефропатией. Результаты показывают, что препарат RTA 402 можно использовать для улучшения функции почек у пациентов с диабетической нефропатией путем подавления воспаления почек и улучшения клубочковой фильтрации. Как указано выше, и диабет, и сильная гипертония представляют собой основные факторы риска развития хронической болезни почек и в конечном счете почечной недостаточности. Оба эти состояния вместе с показателями системного сердечно-сосудистого заболевания, такого как гиперлипидемия, часто присутствуют у пациента одновременно, в особенности если пациент страдает клиническим ожирением. Хотя факторы сведения этих состояний вместе не до конца понятны, дисфункция сосудистого эндотелия считается существенным патологическим фактором в системном сердечно-сосудистом заболевании,хронической болезни почек и диабете (см., например, Zoccali, 2006). Указывалось, что острый или хронический оксидативный стресс виновен в развитии эндотелиальной дисфункции и тесно связан с хроническими воспалительными процессами. Поэтому средство, способное снимать оксидативный стресс и связанное с ним воспаление сосудистого эндотелия, может ослаблять дисфункцию и восстанавливать эндотелиальный гомеостаз. Не привязываясь к теории, предлагаемые соединения, стимулируя регулируемые посредством Nrf2 эндогенные антиоксидантные механизмы, показали совершенно необычную способность улучшать параметры, связанные с функцией почек (например, содержание креатинина в сыворотке крови и расчетную скорость клубочковой фильтрации), регулированием процессов гликемии и инсулиновой резистентностью (например, гемоглобин A1c), а также с системным сердечно-сосудистым заболеванием (например, циркулирующие эндотелиальные клетки) у пациентов с ненормальными клиническими значениями этих параметров. В настоящее время для таких пациентов обычно требуется комбинированное лечение для улучшения показателей регулирования процессов гликемии и течения сердечно-сосудистого заболевания, в том числе применение ингибиторов ферментов конвертирования ангиотензина или блокаторов рецепторов ангиотензина II для ослабления гипертонии и замедления прогрессирования хронической болезни почек. Достигая одновременных и клинически значимых улучшений всех этих параметров, в особенности показателей функции почек, предлагаемые соединения представляют собой существенное достижение в сравнении с существующими методами лечения. В некоторых аспектах предлагаемые соединения можно использовать для лечения сочетаний указанных выше заболеваний в виде отдельного лечения либо в сочетании с меньшим количеством других используемых в настоящее время методов лечения. Эти факты также показывают, что введение препарата RTA 402 можно использовать для защиты пациентов от повреждения почек, например, при воздействии радиоконтрастных средств, как это имеет место при радиоконтрастной нефропатии (RCN), а также в иных случаях. В одном из аспектов предлагаемые соединения можно использовать для лечения острых ишемических и реперфузионных повреждений и/или вызванных химиотерапией острых повреждений почек. Например, представленные ниже в примерах 2 и 3 результаты показывают, что RTA402 выполняет защитную функцию в моделях острых повреждений почек у животных, вызванных ишемией и реперфузией или химиотерапией. Креатинин в сыворотке крови измеряли на нескольких моделях у животных, которых лечили препаратом RTA402. Наблюдали значащие снижения содержания креатинина в сыворотке крови в сравнении с исходным содержанием или с содержанием у контрольных животных у обезьян cynomolgus, собак бигль и крыс Sprague-Dawley (фиг. 3A-D). Этот результат также наблюдали на крысах при применении двух форм препарата RTA 402 (кристаллической и аморфной). Препарат RTA402 снижает содержание креатинина в сыворотке крови пациентов. Например, наблюдали улучшение у пациентов, больных раком, при лечении RTA 402. У людей нефротоксичность является пределом дозировки от побочных явлений при лечении цисплатином. Считалось, что повреждение проксимальных канальцев под действием цисплатина происходило посредством усиления воспаления, оксидативного стресса и апоптоза (Yao et al., 2007). Содержание креатинина в сыворотке крови также измеряли у пациентов с хронической болезнью почек (ХБП), включенных в открытое клиническое испытание фазы II по изучению препарата RTA 402 (пример 6). Это испытание было спланировано с учетом многих критериев эффективности в категориях инсулиновой резистентности, эндотелиальной дисфункции/ССЗ и ХБП, включая измерения содержания гемоглобина A1c (A1c), что является широко принятым критерием эффективности регулирования процессов гликемии в фазе 3.A1c является малой составляющей гемоглобина, с которой связывается глюкоза. A1c также называют гликолизированным или гликолизированным гемоглобином. A1c можно отделять от другого гемоглобина по заряду и размеру от других составляющих гемоглобина А в крови посредством высокоточной жидкостной хроматографии (HPLC). Так как на A1c не влияют краткосрочные колебания содержания глюкозы в крови, например, в связи с приемом пищи, кровь можно брать для анализа на A1c независимо от момента потребления пищи. У здоровых пациентов-недиабетиков содержание A1c ниже 7% общего гемоглобина. Нормальные пределы 4-5,9%. При плохо поддающемся лечению диабете оно может составлять 8,0% и выше. Показано, что осложнения диабета можно задерживать или предотвращать, удерживая содержание A1c ближе к 7%. Недавно утвержденные к применению средства обычно снижают содержание A1c на 0,4-0,80 в течение шести месяцев лечения, при этом улучшение на 28-й день обычно невелико. В приведенной ниже таблице показано снижение содержания гемоглобина A1c за шесть месяцев двумя утвержденными к применению средствами: ситаглиптином и прамлинтид ацетатом (Aschner et al., 2006; Goldstein et al.,2007; Pullman et al., 2006). В сравнении с этим RTA402 снижает A1c за 28 дней у невосприимчивых диабетиков, помимо стандартного лечения. Лечение показало снижение у всех включенных больных на 0,34 (n=21) и снижение по сравнению с повышенным исходным уровнем (исходный уровень 7,0) на 0,50 (n=16). Эти результаты более подробно рассмотрены ниже в разделе примеров; см. также фиг. 6 и 7. В другом аспекте предлагаемые соединения можно также использовать для повышения чувствительности к инсулину и/или улучшения регулирования процессов гликемии. Например, результаты тестов с гиперинсулинемической нормогликемической фиксацией в исследовании, рассмотренном в примере 6, показали, что лечение препаратом RTA402 улучшало регулирование гликемических процессов. Тест с гиперинсулинемической нормогликемической фиксацией является стандартной методикой исследования и количественного определения чувствительности к инсулину. При этом измеряют количество глюкозы, необходимое для компенсации повышенного содержания инсулина, без провоцирования гипогликемии (DeFronzo et al., 1979). Типичный порядок работы заключается в следующем. Инсулин вводят инфузией через периферическую вену с расходом 10-120 мЕд на 1 м 2 в 1 мин. Для компенсации инфузии инсулина вводят инфузией 20% глюкозу для поддержания содержания сахара в крови на уровне от 5 до 5,5 ммоль/л. Этот расход инфузии глюкозы определяют контролем содержания сахара в крови каждые 5-10 мин. Обычно полезнее вводить инсулин малыми дозами для получения ответа печени, в то время как введение инсулина большими дозами полезно при оценке периферийного действия инсулина (например,на мускулы и жир). Результаты обычно оценивают следующим образом. Расход инфузии глюкозы за последние 30 мин теста определяет чувствительность к инсулину. Если требуются высокие уровни (7,5 мг/мин или выше),пациент чувствителен к инсулину. Очень низкие уровни (4,0 мг/мин и ниже) показывают, что организм имеет резистентность к воздействию инсулина. Уровни от 4,0 до 7,5 мг/мин могут быть недостоверными,- 11022166 при этом можно предполагать "ухудшение переносимости глюкозы" как ранний признак инсулиновой резистентности. Предлагаемые способы можно использовать для улучшения функции почек. Как показано в примере 6, лечение препаратом RTA 402 улучшало шесть показателей функции и состояния почек, в том числе содержание креатинина в сыворотке крови на основании eGFR, клиренс креатинина, BUN, Цистатин С,Адипонектин и Ангиотензин II. Установлено, что RTA 402 повышает GFR в зависимости от дозы при высокой степени ответа (86%; n=22). Как показано также на фиг. 9, улучшение GFR за 28 дней было обратимым после отмены препарата. В некоторых вариантах предлагаемые способы лечения приводят к улучшению содержания Адипонектина и/или Ангиотензина II. Адипонектин и Ангиотензин II обычно повышенные у пациентов с ДН и коррелируют с тяжестью болезни почек. Адипонектин (также известный как Acrp30, арМ 1) представляет собой гормон, который, как известно, модулирует ряд процессов метаболизма, в том числе регулирование глюкозы и катаболизм жирных кислот. Адипонектин выделяется адипозной тканью в кровоток и по сравнению с другими гормонами присутствует в больших количествах в плазме. Содержание этого гормона обратно коррелирует с процентом жира в организме взрослых, в то время как такая связь у младенцев и детей менее ясна. Этот гормон играет определенную роль в подавлении метаболических расстройств,которые могут приводить к диабету типа II, ожирению, атеросклерозу и неалкогольной жировой инфильтрации печени (NAFLD). Адипонектин можно использовать для прогнозирования смертности от всех причин и болезни почек в конечной стадии у пациентов с ДН. Предлагаемое соединение и способы можно использовать для лечения различных аспектов сердечно-сосудистого заболевания (ССЗ). Установлено, что предлагаемые способы лечения снижают содержание циркулирующих эндотелиальных клеток (ЦЭК) у людей. ЦЭК являются маркерами эндотелиальной дисфункции и повреждений сосудов. Эндотелиальная дисфункция представляет собой системный воспалительный процесс, связанный с сердечно-сосудистыми повреждениями и повреждением целевого органа. Повышенное содержание ЦЭК обычно коррелирует с развитием, прогрессированием и смертью от ССЗ. Оно также коррелирует с хронической болезнью почек и пониженной GFR. Исторически нормальное содержание 5 клеток/мл. Типичные признаки эндотелиальной дисфункции включают неспособность артерий и артериол расширяться в полной мере в ответ на соответствующий раздражитель. При этом возникает обнаружимое различие между подопытными с эндотелиальной дисфункцией и нормальными подопытными со здоровым эндотелием. Такое различие можно тестировать различными методиками, в том числе ионтофорезом ацетилхолина, внутриартериальным введением различных вазоактивных средств, локальным нагреванием кожи или временных артериальных окклюзий путем накачивания манжеты для измерения давления до высоких давлений. Тестирование можно также проводить в самих коронарных артериях. Считается, что эти методики стимулируют эндотелий на освобождение оксида азота (NO) и, возможно,некоторых других веществ, которые диффундируют в охватывающую гладкую сосудистую мышцу, приводя к вазодилатации. Например, согласно результатам исследования фазы II (пример 6) у пациентов, которых лечили препаратом RTA402 в течение 28 дней, наблюдалось снижение содержания маркеров сердечнососудистого воспаления в виде снижения количества циркулирующих эндотелиальных клеток. Уменьшение содержания ЦЭК в группе всех включенных больных (n=20) составляло 27%; снижение в группе с повышенным исходным содержанием (n=14) составляло 40% (р=0,02), при этом у девяти из этих пациентов были нормальные содержания ЦЭК после лечения. Эти результаты согласуются с обратимостью эндотелиальной дисфункции. Установлено, что предлагаемые способы лечения снижают содержание матричной металлопептидазы 9 (ММР-9), растворимых молекул адгезии и некротического опухолевого фактора (TNF) у большинства пациентов. Их высокие содержания обычно коррелируют с плохими сердечно-сосудистыми исходами. Фармацевтическая рецептура и пути введения. Введение предлагаемого соединения пациенту следует общим протоколам введения фармацевтических препаратов с учетом токсичности препарата, если она имеется. Циклы лечения при необходимости повторяются. Предлагаемое соединение можно вводить различными способами, например перорально или путем инъекции (например, подкожно, внутривенно, внутрибрюшинно и т.п.). В зависимости от пути введения активные соединения могут иметь покрытие материалом, защищающим соединение от воздействия кислот и иных природных факторов, способных деактивировать соединение. Их также можно вводить непрерывной перфузией/инфузией больному или в зону раны. Конкретные примеры рецептур, в том числе полимерной дисперсии CDDO-Me, которая показала улучшенную биодоступность при пероральном введении, приведены в заявке на патент США 12/191176 от 13 августа 2008 г., которая целиком включена в данное изобретение путем отсылки. Специалистам в данной области понятно, что можно использовать другие способы приготовления предлагаемых дисперсий с равноценными свойствами и полезностью (см.Repka et al., 2002, а также приведенную здесь литературу). Такие альтернативные способы среди прочего включают испарение растворителя, экструдирование, например экструдирование из горячего расплава, и другие методики. Для введения соединения способами, помимо парентерального, может потребоваться нанесение покрытия на соединение или его введение с материалом, предотвращающим деактивацию. Например, лечебное соединение можно вводить пациенту в соответствующем носителе, например в липосомах или в разбавителе. Фармацевтически приемлемые растворители включают физиологический раствор и водные буферные растворы. Липосомы включают CGF в виде эмульсии масло-в-воде, а также обычные липосомы (Strejan et al., 1984). Лечебное соединение можно также вводить парентерально, внутрибрюшинно, внутриспинально или внутрицеребрально. Дисперсии можно готовить, например, в глицероле, жидких полиэтиленгликолях, их смесях и в маслах. В обычных условиях хранения и применения эти препараты могут содержать консервант во избежание роста микроорганизмов. Фармацевтические композиции, пригодные для инъекций, включают стерильные водные растворы(если они водорастворимые) или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсий для инъекций непосредственно перед употреблением. Во всех случаях композиция должна быть стерильной и жидкой в той степени, в какой обеспечивается легкость прохождения через шприц. Она должна быть устойчивой в условиях производства и хранения и должна быть законсервирована для предотвращения заражающего воздействия микроорганизмов, таких как бактерии и грибки. Носителем может быть раствор или дисперсионная среда, содержащие, например, воду, этанол, полиол (такой как глицерол, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и растительные масла. Надлежащая текучесть может поддерживаться, например, применением покрытия, такого как лецитин, обеспечением необходимого размера частиц в случае применения дисперсии и использованием поверхностно-активных веществ. Недопущение воздействия микроорганизмов можно обеспечивать различными антибактериальными и противогрибковыми препаратами, например парабеном, хлорбутанолом, фенолом, аскорбиновой кислотой, тимерозалом и т.п. Во многих случаях предпочтительно включать в композицию изотонические средства, например сахара, хлорид натрия или многоатомные спирты,такие как маннитол и сорбитол. Продленное рассасывание композиции для инъекций может быть обеспечено включением в нее средства замедления рассасывания, например моностеарата алюминия или желатина. Стерильные растворы для инъекций можно приготовлять введением требуемого количества лечебного соединения в соответствующий растворитель с одним из приведенных выше ингредиентов или с их сочетанием по потребности с последующей стерилизацией. Обычно дисперсии приготовляют введением лечебного соединения в стерильный носитель, содержащий основную дисперсионную среду и требуемые ингредиенты из числа описанных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительным способом приготовления является вакуумная сушка и лиофилизация, в результате чего получается порошок активного ингредиента (т.е. лечебного соединения) с добавлением любого требуемого дополнительного ингредиента из заранее стерильно отфильтрованного раствора ингредиента. Лечебное соединение можно вводить перорально, например с инертным разбавителем или с усвояемым съедобным носителем. Лечебное соединение и другие ингредиенты могут быть также заключены в твердую или мягкую желатиновую капсулу, спрессованы в таблетки или введены непосредственно в пищу подопытного. Для лечебного перорального введения лечебное соединение можно вводить в эксципиенты и использовать в виде заглатываемых таблеток, буккальных таблеток, таблеток для рассасывания, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Процентное содержание лечебного соединения в композициях и препаратах, естественно, может меняться. Количество лечебного соединения в таких терапевтически полезных композициях такое, при котором получается подходящая дозировка. Особенно полезно приготовлять композиции для парентерального введения в отдельных дозах,обеспечивающих простоту введения и равномерность дозы. Отдельные дозы в данном понимании представляют собой физически раздельные порции, пригодные в качестве единичных доз для проходящих лечение подопытных, при этом каждая доза содержит определенное количество лечебного соединения,рассчитанное на получение желаемого результата лечения, вместе с требуемым фармацевтическим носителем. Технические требования к предлагаемым дозированным формам диктуются и непосредственно определяются (а) уникальными характеристиками лечебного соединения и достигаемым частным результатом лечения и (b) ограничениями технологии компаундирования такого лечебного соединения для лечения выбранного заболевания пациента. Лечебное соединение можно также вводить наружно на кожу, в глаза или слизистую оболочку. Можно также вводить лечебное соединение в случае желательности доставки в легкие ингаляцией сухого порошка или аэрозольного состава. Фактическая величина дозы предлагаемого соединения или композиции, содержащей предлагаемое соединение, вводимой подопытному, может определяться физическими и физиологическими факторами,такими как возраст, пол, масса тела, тяжесть заболевания, вид болезни, от которой лечат, ранее прове- 13022166 денные или текущие терапевтические вмешательства, идиопатия подопытного и пути введения. Эти факторы может определять квалифицированный специалист. Практикующий медик, отвечающий за введение, обычно определяет концентрацию активного ингредиента(ов) в композиции и соответствующую дозу(ы) для отдельного подопытного. Дозу отдельный врач может корректировать в случае каких-либо осложнений. В некоторых вариантах фармацевтически эффективным количеством является дневная доза от около 0,1 до около 500 мг соединения. В некоторых случаях дневная доза составляет от около 1 до около 300 мг соединения. В некоторых случаях дневная доза составляет от около 10 до около 200 мг соединения. В некоторых случаях дневная доза составляет около 25 мг соединения. В других случаях дневная доза составляет около 75 мг соединения. В каких-то случаях дневная доза составляет около 150 мг соединения. В других случаях дневная доза составляет от около 0,1 до около 30 мг соединения. В некоторых случаях дневная доза составляет от около 0,5 до около 20 мг соединения. В некоторых случаях дневная доза составляет от около 1 до около 15 мг соединения. В некоторых случаях дневная доза составляет 1 до около 10 мг соединения. В некоторых случаях дневная доза составляет от около 1 до около 5 мг соединения. В некоторых вариантах фармацевтически эффективным количеством является дневная доза 0,01-25 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,05-20 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,1-10 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,1-5 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,1-2,5 мг состава на 1 кг массы тела. В некоторых вариантах фармацевтически эффективным количеством является дневная доза 0,11000 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,15-20 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,20-10 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,40-3 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,50-9 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,60-8 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,70-7 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,80-6 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет 0,90-5 мг состава на 1 кг массы тела. В некоторых случаях дневная доза составляет от около 1 мг до около 5 мг состава на 1 кг массы тела. Эффективное количество обычно находится в пределах от около 0,001 до около 1000 мг/кг, от около 0,01 до около 750 мг/кг, от около 0,1 до около 500 мг/кг, от около 0,2 до около 250 мг/кг, от около 0,3 до около 150 мг/кг, от около 0,3 до около 100 мг/кг, от около 0,4 до около 75 мг/кг, от около 0,5 до около 50 мг/кг, от около 0,6 до около 30 мг/кг, от около 0,7 до около 25 мг/кг, от около 0,8 до около 15 мг/кг, от около 0,9 до около 10 мг/кг, от около 1 до около 5 мг/кг, от около 100 до около 500 мг/кг, от около 1,0 до около 250 мг/кг или от около 10,0 до около 150 мг/кг с введением ежедневно одной или нескольких доз в течение одного или нескольких дней (в зависимости от курса, способа введения и рассмотренных выше факторов). Другие подходящие пределы дозировок включают 1-10000, 100-10000, 500-10000 и 500-1000 мг в день. В некоторых частных вариантах осуществления количество составляет менее 10000 мг в день в пределах, например, от 750 до 9000 мг в день. Эффективное количество может быть менее 1, менее 500, менее 250, менее 100, менее 50, менее 25,менее 10 или менее 5 мг/кг/день. Оно также может быть в пределах от 1 до 200 мг/кг/день. Например,при лечении пациентов-диабетиков единичная доза может быть представлена количеством, снижающим содержание глюкозы в крови по меньшей мере на 40% в сравнении с не проходящим лечение подопытным. В другом варианте осуществления единичная доза представляет собой количество, снижающее содержание глюкозы в пределах 10% содержания глюкозы у подопытного-недиабетика. В других чисто иллюстративных примерах доза также может составлять от около 1, около 5, около 10, около 50, около 100, около 200, около 350, около 500 мкг на 1 кг массы тела, около 1, около 5, около 10, около 50 , около 100, около 200, около 350, около 500 до около 1000 мг на 1 кг массы тела и более на одно введение, при этом возможны и иные производные от приведенных выше переделов. Среди прочего примерами производных пределов из приведенных выше являются пределы от около 1 до около 5 мг на 1 кг массы тела, пределы от около 5 до около 100 мг на 1 кг массы тела, от около 5 до около 500 мг на 1 кг массы тела и т.п. с введением на основании приведенных выше величин. В некоторых вариантах осуществления предлагаемая фармацевтическая композиция может содержать, например, по меньшей мере около 0,1% предлагаемого соединения. В других вариантах осуществления предлагаемое соединение может составлять, например, от около 2 до около 75% массы единичной дозы или от около 25 до около 60%, а также может находиться в любых производных от указанных пределах. Предполагаются разовые или многократные дозы препаратов. Желаемые интервалы времени для доставки многократных доз могут определяться специалистом в данной области на основании не более чем стандартного эксперимента. Например, подопытным можно вводить две дозы ежедневно с интервалами приблизительно 12 ч. В некоторых вариантах препарат вводят один раз в день. Препарат(ы) можно вводить по стандартной схеме. В данном случае стандартная схема основана на определенном назначенном периоде времени. Стандартная схема может охватывать периоды времени одинаковой или разной протяженности, но при этом схема должна быть определенной. Например, стандартная схема может состоять во введении два раза в день, каждый день, один раз в два дня, один раз в три дня, раз в четыре дня, раз в пять дней, раз в шесть дней, раз в неделю, раз в месяц или раз в установленное число дней или недель в промежутке между указанными пределами. Вместо этого, определенная стандартная схема может состоять во введении два раза в день в первую неделю с последующим введением ежедневно в течение нескольких месяцев и т.п. В других вариантах осуществления предлагается принимать препарат(ы) перорально при времени приема, которое зависит или не зависит от приема пищи. Так, например, препарат можно принимать каждое утро и/или каждый вечер независимо от того, ел ли или будет есть подопытный. Чисто иллюстративные конкретные рецептуры включают полимерные дисперсии CDDO-Me (см. заявку на патент США 12/191176 от 13 августа 2008 г., включенную в данное изобретение путем отсылки). Некоторые приведенные в этой публикации рецептуры показывали более высокую биодоступность, чем рецептуры либо с мелкодисперсной формой А, либо с нанокристаллической формой А. Кроме того, рецептуры, основанные на полимерной дисперсии, показали еще более удивительное улучшение биодоступности при пероральном введении в сравнении с рецептурами на основе мелкодисперсной формы В. Например, рецептуры с сополимером метакриловой кислоты, тип С и НРМС-Р (гидроксипропилметилцеллюлозы фталат) показали наибольшую биодоступность у подопытных обезьян. Примеры Приведенные ниже примеры даны для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам в данной области должно быть понятно, что приведенные в следующих примерах методики представляют собой методики, открытые изобретателем для успешного применения при практическом осуществлении изобретения, вследствие чего их следует рассматривать в качестве предпочтительных способов осуществления изобретения. В то же время, специалисты в данной области должны в свете данного описания понимать, что в описанные конкретные варианты осуществления могут быть внесены многочисленные изменения, при этом все равно будет получен подобный или аналогичный эффект, не выходя за пределы существа и объема изобретения. Пример 1. Материалы и методы. Химикаты. Тритерпеноиды были синтезированы, как ранее описано в публикациях Honda et al.(1998), Honda et al. (2000b), Honda et al. (2002) и Yates et al. (2007), которые включены в данное изобретение путем отсылки. Пример 2. Результаты для ишемии и реперфузии у мыши. На модели ишемической острой почечной недостаточности у мыши пережимали почечную артерию приблизительно на 20 мин. По прошествии этого времени зажим удаляли и производили реперфузию почки кровью. Ишемия и реперфузия приводят к повреждению почки и снижению функции почек, что можно оценить по содержанию азота в крови и моче (BUN), которое повышается после повреждения почек. Как показано на фиг. 1a-d, хирургически вызванные ишемия и реперфузия повышали уровеньBUN приблизительно в два раза. В то же время, у животных, которых лечили пероральным введением 2 мг/кг препарата RTA 402 один раз в день, начиная за два дня до хирургической процедуры, величиныBUN были значимо снижены (р 0,01) в сравнении с животными, которым давали наполнитель, и были аналогичны величинам у животных, на которых были выполнены плацебо-операции (фиг. 1 а-с). Гистологические показатели повреждения почек и воспаления также значимо улучшались при лечении препаратом RTA 402 (фиг. 1d). Эти данные показывают, что препарат RTA 402 обеспечивает защиту от повреждения ткани, вызванного ишемией и реперфузией. Пример 3. Результаты для острого повреждения почек у крыс, вызванного химиотерапией. На другой модели острого повреждения почек крысам вводили внутривенно противоопухолевый препарат цисплатин. У людей нефротоксичность является побочным дозоограничивающим явлением при лечении цисплатином. Повреждение проксимальных канальцев, вызываемое цисплатином, как считается,происходит путем усиленного воспаления, оксидативного стресса и апоптоза (Yao et al., 2007). У крыс,пролеченных разовой дозой цисплатина в размере 6 мг/кг, развивалась почечная недостаточность по показаниям содержания креатинина в крови и BUN. Лечение пероральным введением 10 мг/кг препаратаRTA 402 через желудочный зонд с началом за один день до лечения цисплатином и в дальнейшем ежедневно значимо снижало содержание креатинина в крови и BUN (фиг. 2 а-b). Гистологическая оценка почек показала улучшение с точки зрения размера повреждения проксимальных канальцев у животных,которых лечили препаратом RTA 402, в сравнении с животными, которым давали наполнитель (фиг. 2 с). Пример 4. Снижение содержания креатинина у нескольких видов. Содержание креатинина в сыворотке крови измеряли у нескольких видов животных, которых лечили препаратом RTA402 в ходе токсикологических исследований. Значимые снижения содержания креатинина в сыворотке крови в сравнении с исходными величинами или величинами у контрольных животных наблюдали у обезьян cynomolgus, собак бигль и крыс Sprague-Dawley (фиг. 3 а-d). Это действие наблюдали у крыс при лечении кристаллической и аморфной формами препарата RTA 402. Пример 5. Пониженное содержание креатинина в сыворотке крови и повышенная eGFR у раковых пациентов. Измеряли также содержание креатинина в сыворотке крови у раковых пациентов, включенных в клиническое испытание фазы I препарата RTA 402. Этим пациентам давали препарат RTA402 один раз в день в дозах от 5 до 1300 мг/день в течение 21 дня каждые 28 дней. Наблюдали снижение содержания креатинина в сыворотке крови более чем на 15% уже через восемь дней после начала лечения, которое сохранялось до самого конца цикла (фиг. 4 А). Это снижение сохранялось у пациентов, прошедших шесть или более циклов лечения препаратом RTA 402. Подгруппа пациентов с существовавшим повреждением почек (исходное содержание креатинина по меньшей мере 1,5 мг/дл) также показала значимое снижение содержания креатинина в сыворотке крови после лечения препаратом RTA 402. У этих пациентов содержание креатинина в сыворотке крови понижалось прогрессивно в течение цикла так, что содержание в день 21 было приблизительно на 25% ниже в сравнении с исходными величинами (фиг. 4 А). Эти результаты сведены в приведенную ниже таблицу. Расчетная скорость клубочковой фильтрации (eGFR) значимо улучшалась у пациентов, которых лечили препаратом RTA 402 (фиг. 4 В). На фиг. 5 показаны результаты после по меньшей мере шести месяцев лечения препаратом RTA 402 у одиннадцати раковых пациентов, где видно, что eGFR улучшалась приблизительно непрерывно. Некоторые из этих пациентов были включены в исследование фазы I, а другие были включены в исследование препарата RTA 402 (в сочетании с гемцитабином) на пациентах с раком поджелудочной железы. Результаты сведены в приведенную ниже табл. 2. Таблица 2eGFR у пациентов, получивших 6 циклов лечения препаратом RTA 402 Пример 6. Исследование фазы 2 на пациентах с диабетической нефропатией. Содержание креатинина в сыворотке крови также измеряли у пациентов с хронической болезнью почек (ХБП), включенных в открытое клиническое испытание препарата RTA 402 фазы II. Эти пациенты получали препарат RTA 402 один раз в день тремя разными дозами в размере 25, 75 и 150 мг в течение 28 дней. Исследование было спланировано с несколькими критериями эффективности в категориях инсулиновой резистентности, эндотелиальной дисфункции/ССЗ и ХБП, которые сведены в следующую таблицу: Основным показателем исхода в этом исследовании является определение эффекта лечения препаратом RTA 402, вводимым перорально тремя разными дозами, на скорость клубочковой фильтрации (по оценке по формуле MDRD) у пациентов с диабетической нефропатией. Дополнительные показатели исхода включают (1) оценку безопасности и переносимости перорального препарата RTA 402, вводимого перорально в трех разных дозах, в данной популяции пациентов; (2) оценку действия препарата RTA 402, вводимого перорально тремя разными дозировками, на содержание креатинина в сыворотке крови, клиренс креатинина и отношение альбумина в моче к креатинину у пациентов с диабетической нефропатией; (3) оценку действия препарата RTA402, вводимого перорально тремя разными дозировками, на гемоглобин A1c у всех пациентов, включенных в исследование, и на ответ на инсулин по тесту гиперинсулемической нормогликемической фиксации у пациентов только одного центра исследований; (4) оценку действия препарата RTA 402 в трех разных дозах на ряд маркеров воспаления, повреждения почек, оксидативного стресса и дисфункции эндотелиальных клеток. Все пациенты популяции, отобранной для данного исследования, имели диабет типа 2 с ХБП. Большинство были диагностированы с плохим регулированием процессов гликемии в течение двух десятилетий. ХБП установлена на основании повышенного содержания креатинина в сыворотке крови (SCr). Большинство пациентов были диагностированы с сердечно-сосудистым заболеванием (ССЗ), и большинство получали стандартное лечение от диабета, ХБП и ССЗ (например, инсулин, ACEI/ARB, бетаблокатор, диуретик и статин). Исходные демографические характеристики пациентов приведены ниже Были приняты следующие критерии включения пациентов: (1) диагноз - диабет типа II; (2) содержание креатинина в сыворотке крови у женщин 1,3-3,0 мг/дл (115-265 мкмоль/л) включительно и у мужчин 1,5-3,0 мг/дл (133-265 мкмоль/л) включительно; (3) пациенты согласны на применение эффективной контрацепции; (4) пациент должен иметь негативный тест мочи на беременность в течение 72 ч до приема первой дозы медикамента; (5) пациент желает и способен сотрудничать по всем аспектам протокола и способен эффективно общаться; (6) пациент желает и способен предоставить письменное согласие на участие в данном клиническом исследовании. Были приняты следующие критерии исключения пациентов: (1) пациенты с диабетом типа I (инсулинозависимые с началом болезни в юности); (2) пациенты с известной недиабетической болезнью почек(допустим нефросклероз, наложенный на диабетическую нефропатию) или с почечным аллотрансплан- 17022166 татом; (3) пациенты со следующими сердечно-сосудистыми заболеваниями: неустойчивая стенокардия в течение 3 месяцев до начала исследования; инфаркт миокарда, операция по шунтированию коронарных артерий либо чрескожная транслюминальная коронарная ангиопластика/стент в течение 3 месяцев до начала исследования; преходящее ишемическое нарушение мозгового кровообращения в течение 3 месяцев до начала исследования; инсульт в течение 3 месяцев до начала исследования; обтурирование сердечного клапана или гипертрофическая кардиомиопатия; атриовентрикулярная блокада второй или третьей степени, не вылечиваемая успешно ритмоводителем; (4) пациенты, нуждающиеся в хронической(более двух недель) иммуносупрессивной терапии, в том числе в кортикостероидах (исключая вдыхаемые или назальные стероиды) в течение 3 месяцев до начала исследования; (5) пациенты с признаками дисфункции печени, включая общий билирубин 1,5 мг/дл ( 26 мкмоль/л) или трансаминазы печени(аспартат аминотрансфераза [AST] или аланин трансфераза [ALT])1,5-кратного верхнего предела нормы; (6) если пациент - женщина, беременна, кормит или планирует беременность; (7) пациенты с любыми одновременно имеющимися клиническими заболеваниями, которые по мнению исследователя могли бы потенциально представлять риск для здоровья пациента при участии в исследовании либо могли бы повлиять на исход исследования; (8) пациенты, имеющие известную повышенную чувствительность к любому компоненту исследуемого лекарственного препарата; (9) пациенты, имеющие известную аллергию к иоду; (10) пациенты, подвергнувшиеся диагностической процедуре или вмешательству, требующих применения контрастного вещества, в течение 30 дней до начала исследования; (11) пациенты с изменением или корректировкой дозы любого из следующих медикаментов: ингибиторы ангиотензинконвертирующего фермента (АСЕ), блокаторы ангиотензина II, нестероидные противовоспалительные препараты (NSAID) или ингибиторы СОХ-2 в течение 3 месяцев; других противогипертонических и других противодиабетических медикаментов в течение 6 недель до начала исследования; (12) пациенты, в прошлом злоупотреблявшие наркотиками и алкоголем или имеющие положительные результаты анализа на любые средства злоупотребления (положительный анализ мочи и/или дыхательного теста на алкоголь); (13) пациенты, принимавшие участие в другом клиническом исследовании с целью исследования разрабатываемого или продаваемого продукта в течение 30 дней до начала исследования или могущие одновременно участвовать в таком исследовании; (14) пациенты, не способные общаться или сотрудничать с исследователем из-за языковых трудностей, недостаточного умственного развития или нарушенной мозговой функции. На конец сентября 2008 г. в это исследование были включены 32 из 60 пациентов. Все пациенты,кроме одного, принимали инсулин и стандартные прописи пероральных противогипергликемических препаратов. При лечении препаратом RTA402 наблюдали снижение процентного содержания гемоглобина A1c за 28 дней у невосприимчивых диабетиков сверх стандартного лечения. Лечение показало, что снижение у всех включенных больных составляло приблизительно 0,25 (n=56) при снижении у больных с повышенным исходным уровнем (исходный уровень 7,0) в размере 0,50 (n=35). Процентное снижение содержания гемоглобина A1c в зависимости от тяжести по исходному уровню представлено на фиг. 6, а дозозависимое снижение представлено на фиг. 7. Пациенты с высоким развитием болезни почек (стадия 4) (GFR от 15-29 мл/мин) показали среднее процентное снижение содержания A1c в размере приблизительно 0,77. Все снижения были статистически значимыми. Результаты теста гиперинсулемической нормогликемической фиксации показали, что лечение в течение 28 дней также улучшало регулирование гликемических процессов и чувствительность к инсулину у пациентов при измерении по скорости вывода глюкозы (GDR). У пациентов наблюдалось улучшение показателя GDR после лечения в течение 28 дней, при этом пациенты с повышенной тяжестью состояния(GDR4) показали статистически значимое улучшение (р 0,02). Тест гиперинсулемической нормогликемической фиксации проводили на исходном уровне (день -1) и в конце исследования в день 28. Этот тест измеряет расход инфузии глюкозы (GINF), необходимый для компенсации повышенного содержания инсулина, не вызывая гипогликемию, при этом результат используют для получения показателяGDR. Вкратце можно заметить, что тест гиперинсулемической нормогликемической фиксации занимает около 2 ч. Инсулин вводят через периферическую вену с расходом 10-120 мЕд на м 2 в 1 мин. Для компенсации инфузии инсулина вливают 20% глюкозу для поддержания содержания сахара в крови на уровне от 5 до 5,5 ммоль/л. Этот расход инфузии глюкозы определяют, контролируя содержание сахара в крови каждые 10-15 мин. Расход инфузии глюкозы за последние 30 мин теста используют для определения скорости метаболизма глюкозы (М) в мг/кг/мин. Тест гиперинсулемической нормогликемической фиксации проводят по следующему протоколу. 1. Подопытный голодает 8-10 ч до проведения теста. 2. Утром перед проведением теста измеряют основные показатели жизнедеятельности и вес. 3. Запускают ретроградную линию в одной руке, используя пробоотборный катетер размером 11/4" калибра 18-20. 4. Готовят внутривенную трубку с двумя трехходовыми кранами и J-образным удлинителем. Нако- 18022166 нечник трубки вставляют в литровый пакет, содержащий 0,9% NaCl, для проведения цикла открытой вены (цикл открытой вены проводят с расходом 10 см 3/ч) до начала процедуры. 5) Накладывают согревающую подушку в наволочке, отделяющей согревающую подушку от руки подопытного (позволяет отбирать шунтируемую артериальную кровь при венозной катетеризации). 6. Контролируют температуру (приблизительно 150F/65 С), создаваемую согревающей подушкой,до и во время фиксации для поддержания артериализации. 7. Запускают другую линию, противоположную отборной стороне, в дистальном предплечье посредством катетера размером 11/4" калибра 18-20 для линии инфузии; готовят внутривенную трубку с двумя трехходовыми кранами. 8. Подвешивают пакет емкостью 500 мл с 20% декстрозой и прикрепляют к штуцеру на стороне инфузии. 9. Готовят инфузию инсулина:a) удаляют 53 см 3 физраствора (50 см 3 перелива) из пакета емкостью 500 см 3 с 0,9% NaCl и выливают;b) отбирают 8 см 3 крови от подопытного по стерильной методике и вводят в пробирку для отделения сыворотки крови;c) центрифугируют пробирку для отделения сыворотки крови. Отбирают 2 см 3 сыворотки и вводят в пакет емкостью 500 см 3 с 0,9% NaCl;e) присоединяют внутривенную трубку с двойным вентилируемым наконечником в пакет с 0,9%f) включают насос Baxter; 10. Контролируют время и отбирают все исходные пробы крови (величины исходного содержания глюкозы натощак получают до начала подачи инсулина). 11. Выполняют расчет расхода инфузии инсулина для начальной дозы и инфузии 60 мЕд/м 2 инсулина. Этот фоновый инсулин должен подавлять эндогенное продуцирование глюкозы печени. Худым подопытным проводят подавление подачей 40 мЕд/м 2; страдающим ожирением и инсулинрезистентным подопытным требуется вводить 80 мЕд/м 2. Количества 60 мЕд/м должно хватить для подавления предложенной исследуемой популяции с индексом массы тела BMI 27-40 кг/м 2. Может потребоваться коррекция предлагаемой инфузии 60 мЕд/м 2 инсулина в случае изменения индекса массы тела. 12. Отирают пробы 0,5 мл каждые 5 мин, при этом используют показания анализатора глюкозы в крови YSI для определения и корректировки расхода инфузии глюкозы (мг/кг/мин). Любые дополнительные требуемые протоколом лабораторные анализы потребуют отбора дополнительного объема крови. Фиксация продолжается 120 мин, что считается достаточным временем для определения чувствительности к инсулину. 13. Наклеивают этикетку и сохраняют все распечатки прибора YSI для документального оформления. 14. Расходы инфузии за последние 30 мин нормогликемической фиксации корректируют посредством пространственной корреляции. Их используют для определения скорости метаболизма глюкозы (М мг/кг/мин), представляющей чувствительность подопытного к инсулину. Как показано на фиг. 8, препарат RTA402 снижает содержание циркулирующих эндотелиальных клеток (ЦЭК). ЦЭК, выражаемое в клетках/мл, показано для всех включенных больных (ITT) и групп с повышенным исходным уровнем как до, так и после лечения препаратом RTA в течение 28 дней. Снижение для группы всех включенных составляло приблизительно 20%, а снижение для группы с повышенным исходным уровнем (5 ЦЭК/мл) составляло приблизительно 33%. Доля iNOS-положительных ЦЭК снижалась приблизительно на 29%. Нормализация величин содержания ЦЭК ( 5 клеток/мл) наблюдалась у 11 из 19 пациентов с повышенным исходным уровнем. ЦЭК выделяли из цельной крови посредством CD 146 Ab (антитело к антигену CD146, имеющему экспрессию на эндотелиальных клетках и лейкоцитах). После выделения ЦЭК использовали конъюгированный с FITC (флуросцеин изоцианат) CD 105 Ab (специфическое антитело для эндотелиальных клеток) для определения ЦЭК с помощью системы CellSearch. Флуоресцентный конъюгат CD45 Ab вводили для подкрашивания лейкоцитов, после чего их отбрасывали. Общий обзор этой методики приведен в публикации Blann et al., (2005), которая включена в данное изобретение путем отсылки. Образцы ЦЭК также оценивали на наличие iNOS путем окрашивания иммунной меткой. При лечении препаратом RTA 402 содержание iNOS-положительных ЦЭК снижалось приблизительно на 29%, указывая при этом на то,что препарат RTA 402 уменьшает воспаление эндотелиальных клеток. Показано, что препарат RTA 402 значимо улучшает восемь показателей функции и состояния почек, в том числе содержание креатинина в сыворотке крови, основанное на величине eGFR (фиг. 9), клиренс креатинина, BUN (фиг. 11 А), содержание фосфора в сыворотке крови (фиг. 11 В), мочевой кислоты в сыворотке крови (фиг. 11 С), Цистатина С, Адипонектина (фиг. 10 А) и Ангиотензина II (фиг. 10 В). Адипонектин является предвестником смертности от любых причин и конечной стадии болезни почек у пациентов с диабетическим нефритом (ДН). Адипонектин и Ангиотензин II, содержание которых повышено у пациентов с ДН, коррелируют с тяжестью болезни почек (фиг. 10 А-В). Воздействие на содержание BUN, фосфора и мочевой кислоты показано на фиг. 11 А-С. Пациенты после лечения повышенными дозами (75 или 150 мг) препарата RTA 402 имели умеренное повышение содержания протеинмочевины (приблизительно 20-25%). Это согласуется с исследованиями, показывающими, что улучшение GFR коррелирует с повышением протеинмочевины. Например,в длительном клиническом исследовании более 25000 пациентов лечение рамиприлом (ингибитором АСЕ) замедляло степень понижения eGFR более эффективно, чем телмисартан (блокатор рецепторов ангиотензина) или сочетание рамиприла с телмисартаном (Mann et al., 2008). Наоборот, повышение содержания протеинмочевины было больше в группе, получавшей рамиприл, чем в двух других группах. Основные результаты по почкам также были лучше с терапией одним из лекарств по сравнению с комбинированной терапией, хотя содержание протеинмочевины повышалось меньше всего в группе комбинированной терапии. Другие исследования показали, что лекарственные препараты, снижающие GFR,такие как ингибиторы АСЕ, также снижают содержание протеинмочевины (Lozano et al., 2001; Sengul etal., 2006). Другие исследования показали, что лекарственные препараты, которые резко повышают GFR,такие как определенные блокаторы кальциевых каналов, повышают содержание протеинмочевины до 60% в ходе краткосрочного дозирования (Agodoa et al., 2001; Viberti et al., 2002). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта,при котором указанному субъекту вводят фармацевтически эффективное количество соединения, имеющего следующее строение: 2. Способ по п.1, отличающийся тем, что субъект страдает RKD. 3. Способ по п.2, отличающийся тем, что RKD представляет собой диабетическую нефропатию(ДН). 4. Способ по п.1, отличающийся тем, что субъект страдает инсулиновой резистентностью. 5. Способ по п.1, отличающийся тем, что субъект страдает диабетом. 6. Способ по п.1, отличающийся тем, что субъект страдает эндотелиальной дисфункцией. 7. Способ по п.1, отличающийся тем, что субъект страдает жировой инфильтрацией печени. 8. Способ по любому из пп.1-7, отличающийся тем, что дополнительно определяют субъекта, нуждающегося в лечении любой из указанных болезней, дисфункций, резистентностей или расстройств. 9. Способ по любому из пп.1-7, отличающийся тем, что в семейном анамнезе субъекта или у него самого встречалась любая из перечисленных болезней, дисфункций, резистентностей или расстройств. 10. Способ по любому из пп.1-7, отличающийся тем, что субъект имеет симптомы любой из перечисленных болезней, дисфункций, резистентностей или расстройств. 11. Способ улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, при котором указанному субъекту вводят фармацевтически эффективное количество соединения, имеющего следующее строение: 12. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят местно. 13. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят системно. 14. Способ по любому из пп.1-11, отличающийся тем, что соединение вводят перорально, внутрижировым введением, внутриартериально, внутрисуставно, внутричерепно, внутрикожно, внутрь повреждения, внутримышечно, внутриназально, в глаза, в перикардий, внутрибрюшинно, внутриплеврально,внутрипростатно, внутриректально, подоболочечно, внутритрахеально, внутриопухолево, внутрипуповинно, внутривагинально, внутривенно, внутрипузырчато, внутристекловидно, липосомно, местно, на слизистую, перорально, парентерально, ректально, подконъюктивально, подкожно, подъязычно, наружно, трансбуккально, чрескожно, вагинально, в кремах, в липидных составах, через катетер, орошением,непрерывной инфузией, вливанием, ингаляцией, инъекцией, местной доставкой, локальной перфузией,- 20022166 непосредственным омыванием клеток-мишеней либо сочетанием указанного. 15. Способ по п.14, отличающийся тем, что соединение вводят внутривенно, внутриартериально или перорально. 16. Способ по п.15, отличающийся тем, что соединение вводят перорально. 17. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество представляет собой дневную дозу от около 0,1 до около 500 мг соединения. 18. Способ по п.17, отличающийся тем, что дневная доза составляет от около 1 до около 300 мг соединения. 19. Способ по п.18, отличающийся тем, что дневная доза составляет от около 10 до около 200 мг соединения. 20. Способ по п.19, отличающийся тем, что дневная доза составляет около 25 мг соединения. 21. Способ по п.19, отличающийся тем, что дневная доза составляет около 75 мг соединения. 22. Способ по п.19, отличающийся тем, что дневная доза составляет около 150 мг соединения. 23. Способ по п.17, отличающийся тем, что дневная доза составляет от около 0,1 до около 30 мг соединения. 24. Способ по п.23, отличающийся тем, что дневная доза составляет от около 0,5 до около 20 мг соединения. 25. Способ по п.24, отличающийся тем, что дневная доза составляет от около 1 до около 15 мг соединения. 26. Способ по п.25, отличающийся тем, что дневная доза составляет от около 1 до около 10 мг соединения. 27. Способ по п.26, отличающийся тем, что дневная доза составляет от около 1 до около 5 мг соединения. 28. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество представляет собой дневную дозу 0,01-25 мг состава на 1 кг массы тела. 29. Способ по п.28, отличающийся тем, что дневная доза составляет 0,05-20 мг состава на 1 кг массы тела. 30. Способ по п.29, отличающийся тем, что дневная доза составляет 0,1-10 мг состава на 1 кг массы тела. 31. Способ по п.30, отличающийся тем, что дневная доза составляет 0,1-5 мг состава на 1 кг массы тела. 32. Способ по п.31, отличающийся тем, что дневная доза составляет 0,1-2,5 мг состава на 1 кг массы тела. 33. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество вводят в виде разовой дозы в день. 34. Способ по любому из пп.1-11, отличающийся тем, что фармацевтически эффективное количество вводят двумя или более дозами в день. 35. Способ по любому из пп.1-11, отличающийся тем, что субъектом является примат. 36. Способ по п.35, отличающийся тем, что приматом является человек. 37. Способ по любому из пп.1 или 11, отличающийся тем, что субъектом является корова, лошадь,собака, кошка, свинья, мышь, крыса или морская свинка. 38. Способ по пп.1-37, отличающийся тем, что по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является кристаллической формой с картиной порошковой рентгенодифракции (CuK), имеющей значащие максимумы дифракции при около 8,8, 12,9,13,4, 14,2 и 17,4 2. 39. Способ по п.38, отличающийся тем, что картина порошковой рентгенодифракции (CuK) в основном такая, как показано на фиг. 12 А или 12 В. 40. Способ по п.37, отличающийся тем, что по меньшей мере часть соединения присутствует в полиморфной форме, при этом полиморфная форма является аморфной формой с картиной порошковой рентгенодифракции (CuK), имеющей галопик приблизительно при 13,5 2, в основном как показано на фиг. 12 С, а также имеет Tg. 41. Способ по п.40, отличающийся тем, что величина Tg находится в пределах от около 120 до около 135 С. 42. Способ по п.41, отличающийся тем, что величина Tg находится в пределах от около 125 до около 130 С. 43. Применение соединения, имеющего строение для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта. 44. Применение по п.43, отличающееся тем, что субъектом является примат, в частности человек,корова, лошадь, собака, кошка, свинья, мышь, крыса или морская свинка. 45. Фармацевтическая композиция для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, содержащая терапевтически эффективное количество соединения, имеющего следующее строение: и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом. 46. Фармацевтическая композиция для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, содержащая терапевтически эффективное количество соединения, имеющего следующее строение: и эксципиент, являющийся (А) углеводом, производным углевода или полимером углевода; (В) синтетическим органическим полимером; (С) солью органической кислоты; (D) белком, полипептидом или пептидом или (Е) высокомолекулярным полисахаридом. 47. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что соединение приготовляют в виде твердой или мягкой капсулы, таблетки, сиропа, суспензии, твердой дисперсии, облатки или эликсира. 48. Фармацевтическая композиция по п.47, отличающаяся тем, что соединение приготовляют в виде твердой дисперсии. 49. Фармацевтическая композиция по п.47, отличающаяся тем, что мягкая капсула выполнена в виде желатиновой капсулы. 50. Фармацевтическая композиция по п.49, отличающаяся тем, что дополнительно используют защитную оболочку. 51. Фармацевтическая композиция по п.49, отличающаяся тем, что дополнительно используют средство, задерживающее рассасывание. 52. Фармацевтическая композиция по п.47, отличающаяся тем, что дополнительно используют средство, улучшающее растворимость или диспергируемость. 53. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что соединение диспергируют в липосомах, эмульсии масло-в-воде или эмульсии вода-в-масле. 54. Фармацевтическая композиция по п.45 или 46, отличающаяся тем, что эксципиент является синтетическим органическим полимером. 55. Фармацевтическая композиция по п.54, отличающаяся тем, что эксципиент выбран из группы,содержащей гидроксипропилметилцеллюлозу, поли[1-(2-оксо-1-пирролидинил)]этилен или их сополимер и сополимер метакриловой кислоты и метилметакрилата. 56. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является гидроксипропилметилцеллюлозы фталат. 57. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является ПВП/ВА. 58. Фармацевтическая композиция по п.55, отличающаяся тем, что эксципиентом является сополимер метакриловой кислоты и этилакрилата (1:1). 59. Фармацевтическая композиция по п.54, отличающаяся тем, что эксципиентом является коповидон. 60. Средство для лечения ренальной (почечной) болезни (RKD), инсулиновой резистентности, диабета, эндотелиальной дисфункции, жировой инфильтрации печени или улучшения функции почек у субъекта, включающее соединение, имеющее следующее строение: 61. Средство для улучшения скорости клубочковой фильтрации или клиренса креатинина у субъекта, представляющее собой соединение, включающее следующее соединение:
МПК / Метки
МПК: A61K 31/275, A61P 3/00, A61K 31/4164, A61P 9/00
Метки: применение, заболеваний, лечении, тритерпеноиды, синтетические
Код ссылки
<a href="https://eas.patents.su/28-22166-sinteticheskie-triterpenoidy-i-ih-primenenie-v-lechenii-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Синтетические тритерпеноиды и их применение в лечении заболеваний</a>
Предыдущий патент: Производное 1,2,3,4-тетрагидрохинолина, подходящее для лечения диабета
Следующий патент: Наконечник рабочего валка машины для разработки грунта
Случайный патент: Дозатор